展品99.2

投資者介紹2023年1月

前瞻性陳述本演示文稿包含涉及重大風險和不確定因素的前瞻性陳述。根據1995年《私人證券訴訟改革法》對前瞻性陳述的定義,前瞻性陳述是指非歷史事實的陳述,涉及大量風險和不確定因素。本文中的“可能”、“將”、“應該”、“可能”、“將”、“預期”、“計劃”、“預期”、“相信”、“估計”、“項目”、“預測”、“打算”、“潛在”、“繼續”、
和類似的表述(以及涉及未來事件、條件或情況的其他詞語或表述)可能是前瞻性表述。本演示文稿中的前瞻性陳述基於公司當前的預期和信念,涉及已知和未知的風險、不確定因素和其他因素,這些因素可能會導致公司的實際結果、業績和成就以及某些事件的時間與任何前瞻性陳述中討論、預測、預期或表明的結果、業績、成就或時間大不相同。此類風險、不確定性和其他因素包括但不限於以下因素:美國、歐洲或日本以外的Arikayce或公司在美國、歐洲、日本或其他市場的候選產品未能獲得或延遲獲得監管批准,包括每個市場和每種用途對Lamira®霧化系統和其他產品候選設備的單獨監管批准;未能成功將公司唯一批准的產品Arikayce在美國商業化。, 歐洲或日本(分別為阿米卡星脂質體吸入劑、590毫克脂質體霧化器分散體和阿米卡星吸入藥物製品),或維持美國、歐洲或日本對Arikayce的批准;災難或其他事件造成的商業或經濟中斷,包括自然災害或公共衞生危機;新冠肺炎大流行的影響和減少其對公司業務、員工(包括關鍵人員、患者、合作伙伴和供應商)的傳播的努力;在正在進行的和未來的臨牀研究(包括Aspen研究)中,Brensocatib對患者沒有被證明有效或安全的風險;在正在進行的和未來的臨牀研究中,TPIP被證明對患者沒有有效或安全的風險;
醫生、患者、第三方付款人和醫療保健社區中的其他人對Arikayce的市場接受程度的不確定性;公司無法獲得美國食品和藥物管理局對Arikayce的完全批准,包括公司無法成功或及時完成驗證患者報告結果工具的研究和完全批准Arikayce所需的確認性上市後臨牀試驗的風險;公司無法, Pari或公司其他第三方製造商未遵守與Arikayce或Lamira®霧化器系統相關的法規要求;公司無法從政府或第三方付款人處獲得Arikayce的足夠補償或Arikayce的可接受價格;與Arikayce或公司的候選產品相關的意外安全或療效問題;公司對Arikayce、Brensocatib、TPIP或公司其他候選產品的潛在市場規模的估計不準確,或公司用來確定醫生、患者吸收預期比率、預期治療持續時間或預期患者依從率或停用率的數據不準確;與我們由Pharmakon Advisors,LP管理的某些基金擔保的優先貸款以及我們與OrbiMed Royalty&Credit Opportunities IV,LP進行的特許權使用費融資相關的風險和不確定性,以及預期的好處, 包括我們遵守優先擔保貸款和特許權使用費融資協議中的約定的能力,以及根據這些協議對我們
運營的限制的感知影響;公司無法創建有效的直銷和營銷基礎設施,或與提供此類基礎設施的第三方合作,以便在未來分銷Arikayce或任何經批准的公司候選產品;未能獲得監管部門的批准,無法將Arikayce的適應症擴大到更廣泛的患者羣體;公司的競爭對手可能獲得與公司為特定適應症開發的產品基本相同的產品的孤立藥物獨家經營權的風險;未能成功預測新基因療法產品的開發、監管批准和商業化的時間和成本
;未能成功進行Arikayce、Brensocatib、TPIP和公司其他候選產品的未來臨牀試驗,原因是公司在進行臨牀前開發活動和監管批准所需的臨牀試驗方面的經驗有限,以及可能無法招募或留住足夠的患者來進行和完成試驗或生成監管批准所需的數據等;公司的臨牀研究可能會被推遲或在藥物開發期間發現嚴重的副作用;公司所依賴的第三方未能生產足夠數量的Arikayce或公司用於商業或臨牀需求的候選產品,無法進行公司的臨牀試驗, 或遵守影響公司業務或與公司的協議的公司協議或法律法規;公司無法吸引和留住關鍵人員或有效管理公司的增長;公司無法成功整合其最近的收購併適當管理管理層投入整合活動的時間和注意力;公司收購的技術、產品和候選產品在商業上不成功的風險;本公司無法適應其競爭激烈且不斷變化的環境;本公司無法維持其重要客户的風險;政府醫療改革大幅增加本公司的成本並損害其財務狀況的風險;本公司無法充分
保護其知識產權或阻止披露其商業祕密和其他專有信息,以及與此類事項相關的訴訟或其他訴訟程序的費用;與Arikayce或公司的候選產品相關的協議對公司施加的限制或其他義務,包括與Pari和阿斯利康AB的許可協議,以及公司未能履行此類協議規定的義務;
公司正在或可能成為其中一方的訴訟造成的成本和潛在的聲譽損害, 包括產品責任索賠;公司運營在發生網絡安全攻擊或問題時受到重大中斷的風險;與公司企業資源規劃系統升級相關的業務中斷或費用;公司有限的國際運營經驗;適用於公司業務的法律法規的變化,包括任何定價改革,以及未能遵守此類法律法規;本公司的經營虧損歷史,以及本公司可能永遠無法實現或維持盈利的可能性;影響本公司經營業績和財務狀況的商譽減值費用;無力償還本公司現有的債務以及與本公司獲得未來資本的能力有關的不確定性;以及延遲執行經相關監管機構批准的額外第三方製造設施的計劃,以及與該等計劃相關的意外支出。公司可能無法實際實現公司的前瞻性陳述所表明的結果、計劃、意圖或預期,因為從本質上講,前瞻性陳述涉及風險和不確定性,因為它們與事件有關,
取決於未來可能發生或可能不發生的情況。有關可能影響公司業務的風險和不確定因素的更多信息,請參閲公司截至12月31日的年度報告10-K表中第1A項“風險因素”中討論的因素, 2021年和任何後續公司向美國證券交易委員會(美國證券交易委員會)提交的文件。本公司告誡讀者不要過度依賴任何此類
前瞻性陳述,這些陳述僅在本演示文稿發表之日發表。除法律和美國證券交易委員會規則特別要求外,本公司不承擔任何義務公開更新或修訂任何此類陳述,以反映任何此類陳述可能基於的預期或事件、條件或情況的任何變化,或可能影響實際結果與前瞻性陳述中陳述的結果大相徑庭的可能性
。

通過利用為經歷重大健康問題的小患者羣體提供的改變生活的療法組合產生的收入
打造可持續發展的生物技術公司-5年願景

未來18個月將是該公司…歷史上最具變革性的一年現金>10億美元用於支持近期拐點商業引擎有望在2022年實現30%的收入增長預計2023年收入將達到2.85億至3億美元到期PIPELIN我們每個計劃的臨牀數據在2023-2024年期間
這是您希望在Insmed建立地位的一年。4.
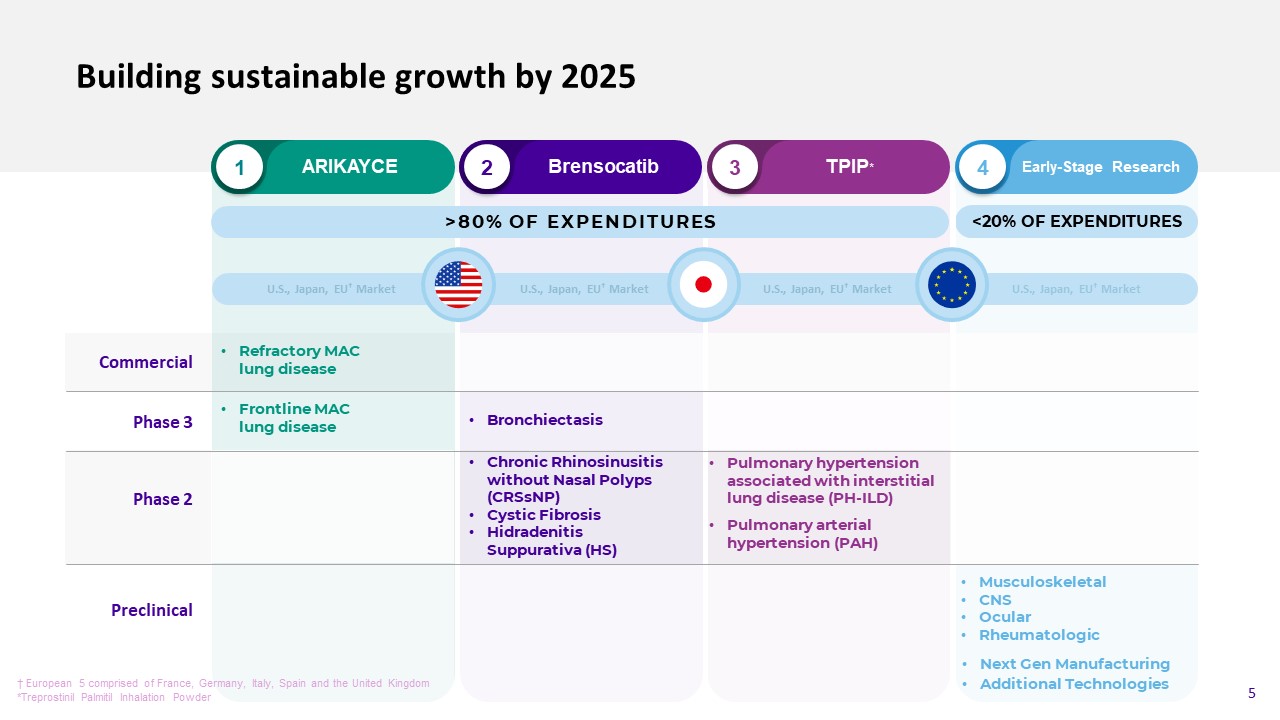
到2025年建立可持續增長商業1 2 3 4 Arikayce Brensocatib TPIP*早期研究難治性MAC肺病前線MAClung疾病下一代製造額外技術階段3支出的80%無鼻息肉(CRSsNP)化膿性囊性纖維症(HS)美國、日本、歐盟†市場†歐洲5包括法國、德國、意大利、西班牙和英國*Treprostinil Palmil吸入粉5
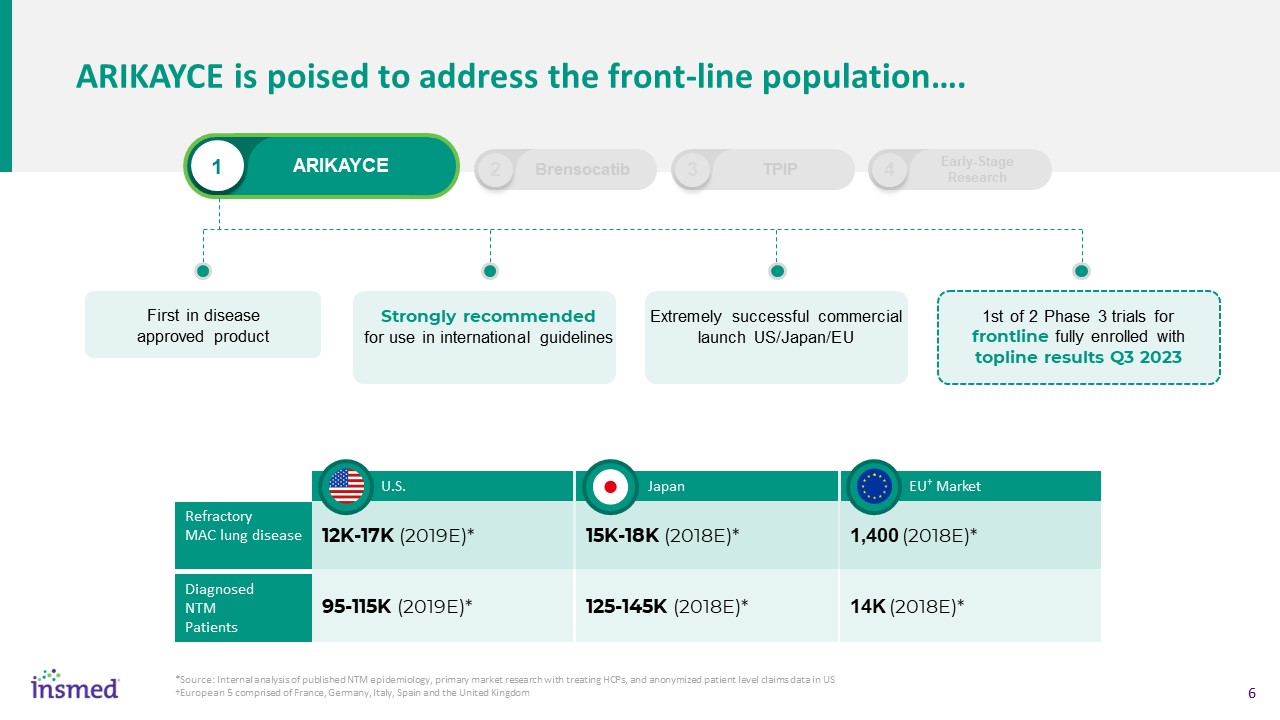
1 Arikayce Arikayce準備向一線人口…發表講話。首個疾病批准產品強烈推薦用於國際指南非常成功的商業啟動美國/日本/歐盟第一個完全納入TOPLINE的2期3期試驗結果Q3 2023 12K-17K(2019E)*95-115K(2019E)*美國難治性肺病診斷NTMPatients 15K-18K(2018E)*125-145K(2018E)*日本1,400(2018E)*14K(2018E)*歐盟†市場2 Brensocatib 3 TPIP 4早期-Stage Research*來源:
已發表的NTM流行病學內部分析,治療HCP的主要市場研究,以及由法國、德國、意大利、西班牙和英國組成的美國†歐洲5國的匿名患者水平索賠數據
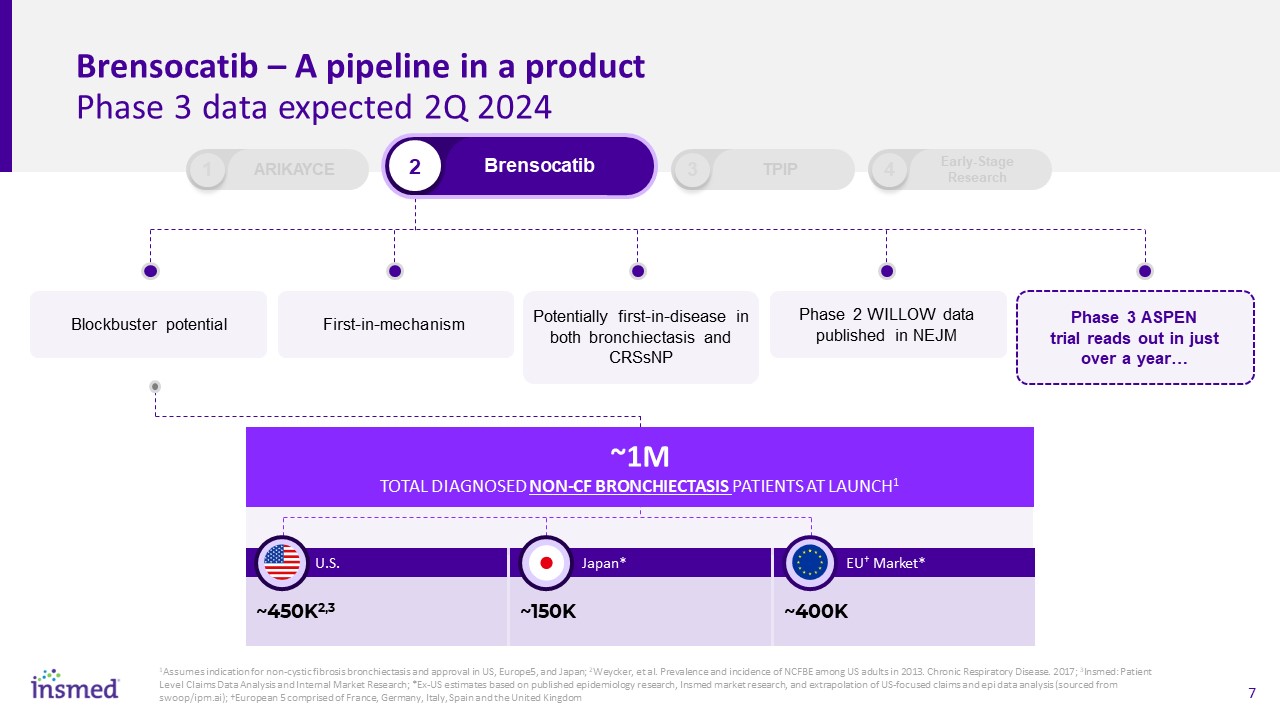
Brensocatib-產品第三階段的流水線數據預計2024年第二季度
Blockbuster Potential 2 Brensocatib 1 Arikayce 3 TPIP 4早期機制研究第一機制潛在的CRSsNP第二階段疾病在支氣管擴張症和CRSsNP第二階段數據發表在《新英格蘭醫學雜誌》第三階段Aspen試驗
在一年多一點的時間裏…1美國、歐洲和日本對非囊性纖維性支氣管擴張症的適應症和批准;2Weycker等人。2013年美國成年人中NCFBE的患病率和發病率。慢性呼吸系統疾病:2017年;3調查:患者水平索賠數據分析和內部市場研究;*基於已發表的流行病學研究、深入的市場研究以及以美國為重點的索賠和EPI數據分析的外推的美國估計;†歐洲5由法國、德國、意大利、西班牙和英國組成†~450K2,3美國~150K日本*~400K歐盟†市場*~LAUNCH1診斷的總共100萬名非CF型支氣管擴張症患者
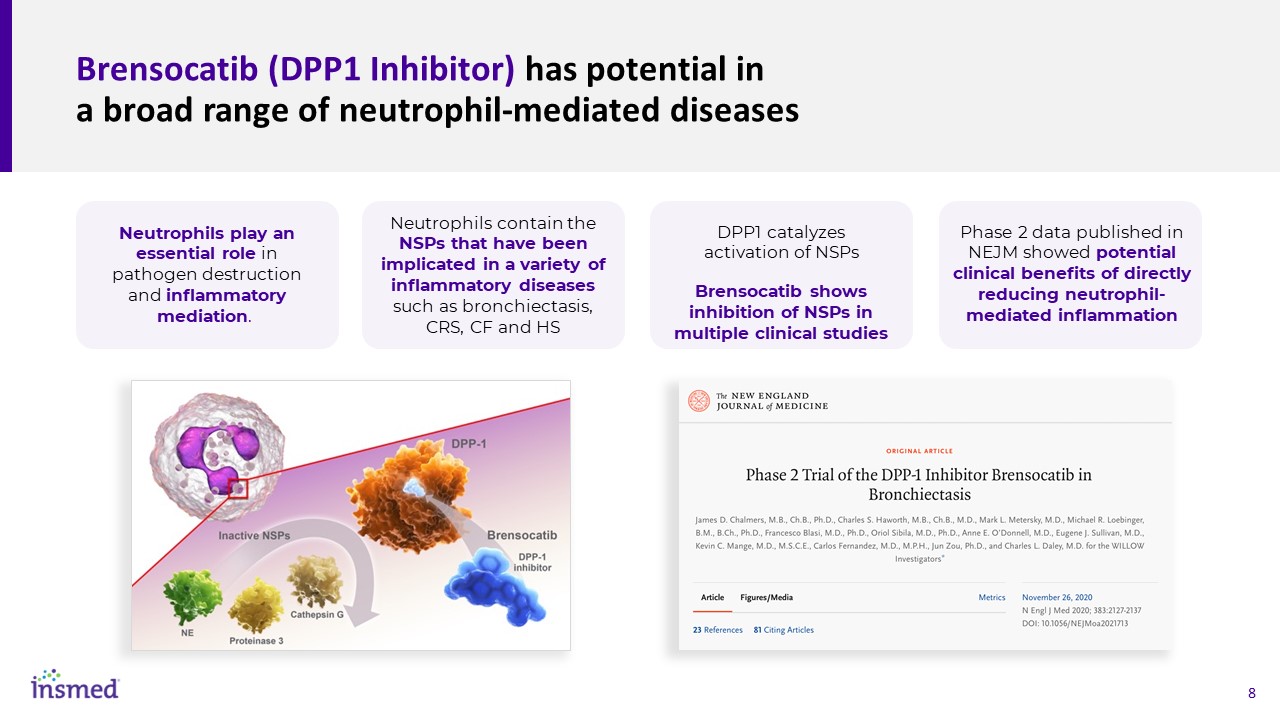
Brensocatib(DPP1抑制劑)在廣泛的中性粒細胞介導的疾病中具有潛在的作用中性粒細胞在病原體破壞和炎症調節中發揮着重要作用。中性粒細胞含有與多種炎症性疾病有關的NSP,如支氣管擴張、CRS、CF和HS DPP1催化NSP的激活。Brensocatib在多項臨牀研究中顯示對NSP的抑制作用發表在《新英格蘭醫學雜誌》上的第二階段數據顯示,直接減輕中性粒細胞介導的炎症具有潛在的臨牀益處
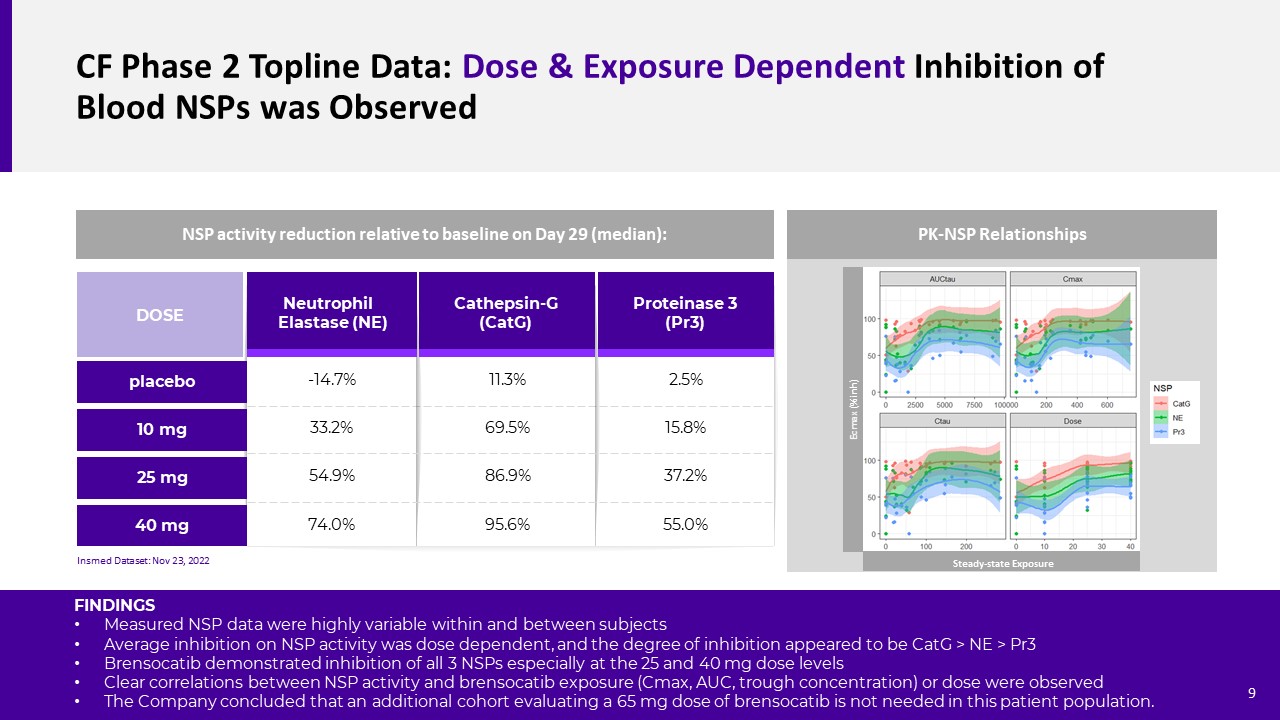
Cf第二階段拓撲線數據:觀察到血液中NSP受到劑量和暴露的抑制
組織蛋白酶-G(CATG)蛋白3(PR3)中性粒細胞彈性蛋白酶(NE)10 mg 25 mg劑量40 mg安慰劑-14.7%33.2%54.9%74.0%11.3%69.5%86.9%95.6%2.5%15.8%37.2%55.0%NSP活性相對降低
至第29天的基線(中位數):輸入數據集:11月23日,2022年PK-NSP關係研究結果在受試者內部和受試者之間測量的NSP數據高度可變,對NSP活性的平均抑制程度似乎是CATG>NE>PR3。Brensocatib顯示對所有3種NSP的抑制,特別是在25和40 mg劑量水平上。觀察到NSP活性與Brensocatib暴露(Cmax、AUC、谷濃度)或劑量之間存在明顯的相關性。該公司的結論是,在該患者羣體中不需要額外評估65 mg劑量的Brensocatib。Ecmax(%inh)穩態暴露9
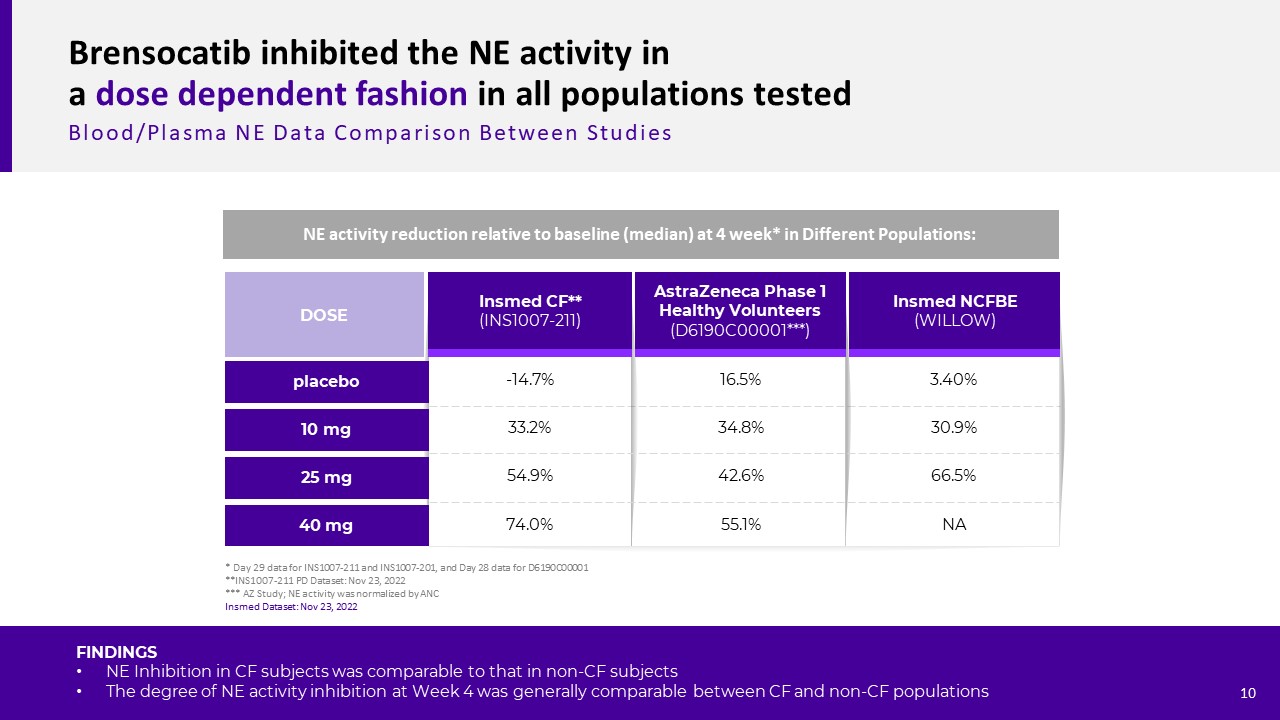
Brensocatib以劑量依賴的方式抑制所有受試人羣的NE活性血液/血漿NE數據阿斯利康1期健康志願者(D6190C00001*)注射NCFBE(Willow)CFF**(INS1007-211)10 mg 25 mg劑量40 mg安慰劑-14.7%33.2%54.9%74.0%16.5%34.8%42.6%55.1%3.40%30.9%66.5%NA不同人羣在4周*的NE活性較基線(中位數)下降:*INS1007-211和INS1007-201的第29天數據,D6190C00001**INS1007-211 PD數據集的第
28天數據:2022年11月23日*AZ研究;NE活性通過ANC歸一化。結果發現,慢性肺心病患者和非慢性肺心病患者的NE抑制程度相當。第4周的NE活性抑制程度在慢性肺心病和非慢性肺病人羣中大致相似。10輸入數據集:2022年11月23日
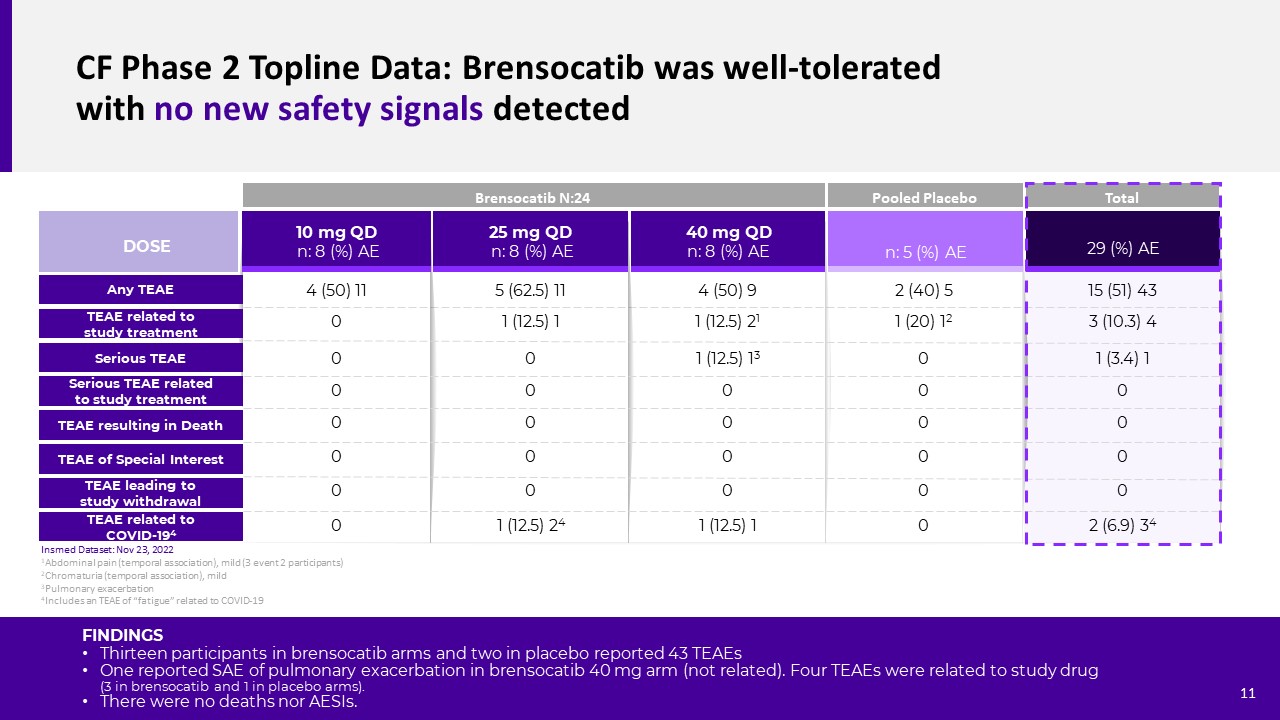
Cf第二階段TOPLINE數據:Brensocatib耐受性良好,沒有新的安全信號檢測到
結果13名Brensocatib組和2名安慰劑組參與者報告了43個TEAE,一個報告了Brensocatib 40 mg組肺惡化的SAE(無關)。有4例TEAEs與研究藥物有關(3例服用brensocatib,1例服用安慰劑)。沒有死亡病例,也沒有AESIs病例。25 mg QD n:8(%)AE 40 mg QD n:8(%)AE 10 mg QD n:8(%)AE TEAE與研究相關治療嚴重TEAE劑量嚴重TEAE與研究相關
治療任何TEAE n:5(%)AE 4(50)9 1(12.5)21 1(12.5)13 0 Brensocatib N:24與COVID-194 TEAE相關的混合安慰劑TEAE總TEAE與COVID-194 TEAE相關死亡00 1(12.51 TEAE導致研究退出5(62.5)11 1(12.5)1 00 00 01(12.5)24 4(50)11 00 00 00 2(40)51(20)12 00 00 00 15(51)43 3(10.3)4 1(3.4)1 00 00 2(6.9)34 1腹痛(暫時性聯想),
輕度(3個事件2參與者)2色尿(時間關聯),3輕度3肺惡化4包括與新冠肺炎11相關的TEAE“疲勞”INSMED數據集:2022年11月23日

通過MOA治療的潛在潛在市場是:巨大的CRSsNP~400K4,5,6,7可尋址患者WW(嚴重人羣)沒有批准的治療方法~7000萬CRSsNP1患者,但許多患者對皮質類固醇和/或內窺鏡鼻竇手術(ESS)囊性纖維化~70K8,9 WW診斷患者沒有批准的針對中性粒細胞介導性炎症的抗炎治療,中性粒細胞介導的炎症是惡化和疾病進展的關鍵驅動力HS~100K中到重度患者,對於需要多種治療和/或手術來管理疾病的患者來説,目前的11種方法是沉重的負擔多達670萬名患者超出了啟動的重點沒有批准的治療方法約170萬名未診斷的患者/誤診為COPD或哮喘1、2+~230萬至500萬未診斷的BE患者/合併COPD2、31潛在的未診斷或誤診(COPD、哮喘)是根據醫學專家驅動的見解估計的美國患者
使用先進的分析/統計方法應用於患者級別的索賠數據;2EX-US基於已發表的流行病學研究、Insmed市場研究以及對以美國為重點的索賠和EPI數據分析的推斷(來自swoop/ipm.ai);3潛在的未診斷或(患有COPD)BE患者基於對16項EPI研究的內部薈萃分析得出的美國BE患者,這些研究着眼於COPD患者的BE患病率;4Cho et。無鼻息肉的慢性鼻竇炎J變態反應性Clin免疫實踐。2016;4(4):575-582。DOI:10.1016/j.jaip.2016.04.015;5 Benjamin et.無鼻息肉的慢性鼻竇炎患者的臨牀特點學術環境中的J變態反應CLIN免疫練習卷7, 第3號,2019年3月;6患者級別索賠數據分析僅美國(科莫多健康),患者病史中沒有Dx代碼的積極管理的CRS患者的比例;外推到歐洲和日本5和日本;7僅美國患者級別索賠數據分析(科莫多健康),患有ESS的積極管理的CRSsNP患者的比例;推斷到歐洲和日本;8CF基金會,https://www.cff.org/intro-cf/about-cystic-fibrosis;9囊性纖維化
雜誌,https://www.cysticfibrosisjournal.com/action/showFullTableHTML?isHtml=true&tableId=t0015&pii=S1569-1993%2816%2930655-5;10Phan等人,化膿性汗腺炎的全球流行和地理變異-系統回顧和薈萃分析生物醫學皮膚學(2020)4:2;11 Puri,Ajay:化膿性汗腺炎高管洞察,2019年11月*化膿性汗腺炎
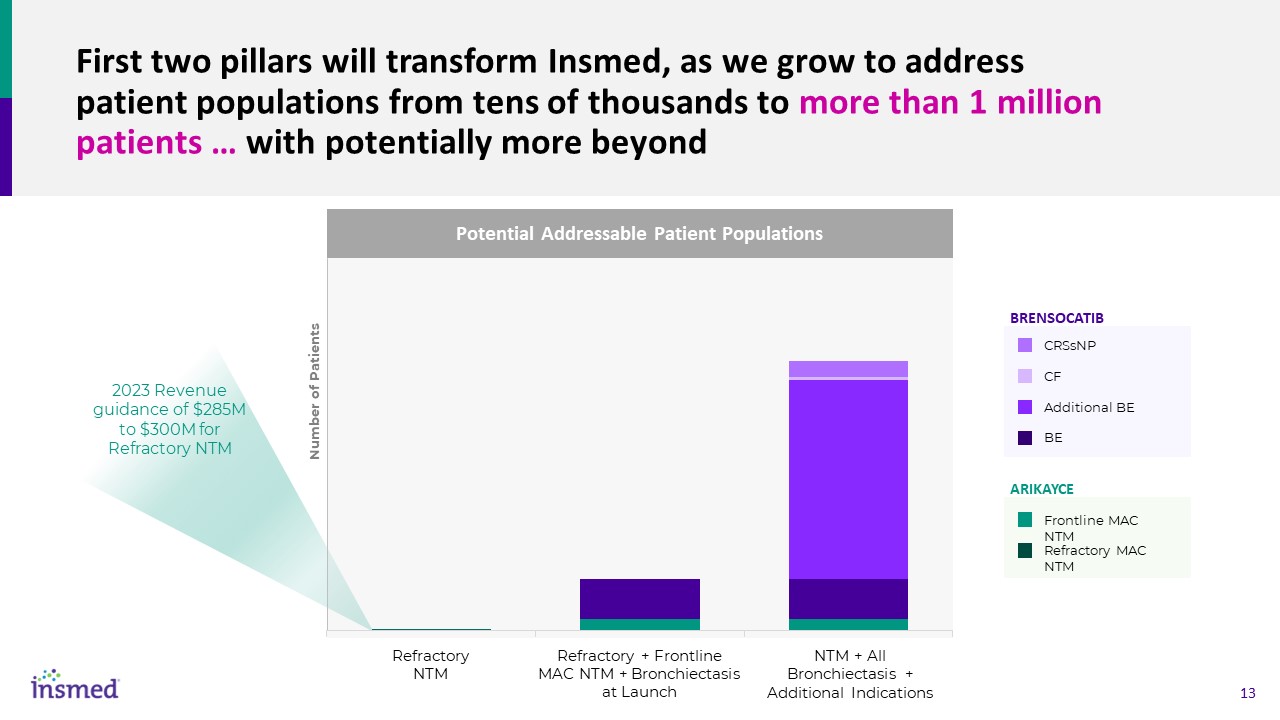
前兩個支柱將改變Insmed,因為我們將滿足患者
羣體從數萬到100多萬患者…的需求除了潛在可尋址的患者羣體外,可能還有更多難治性NTM+所有支擴+其他適應症難治性+前線MAC NTM
+推出時支擴BRENSOCATIB Arikayce CRSNP CF附加BE前線MAC NTM難治性MAC NTM 2023收入指導2.85億至3億美元用於難治性NTM患者數量
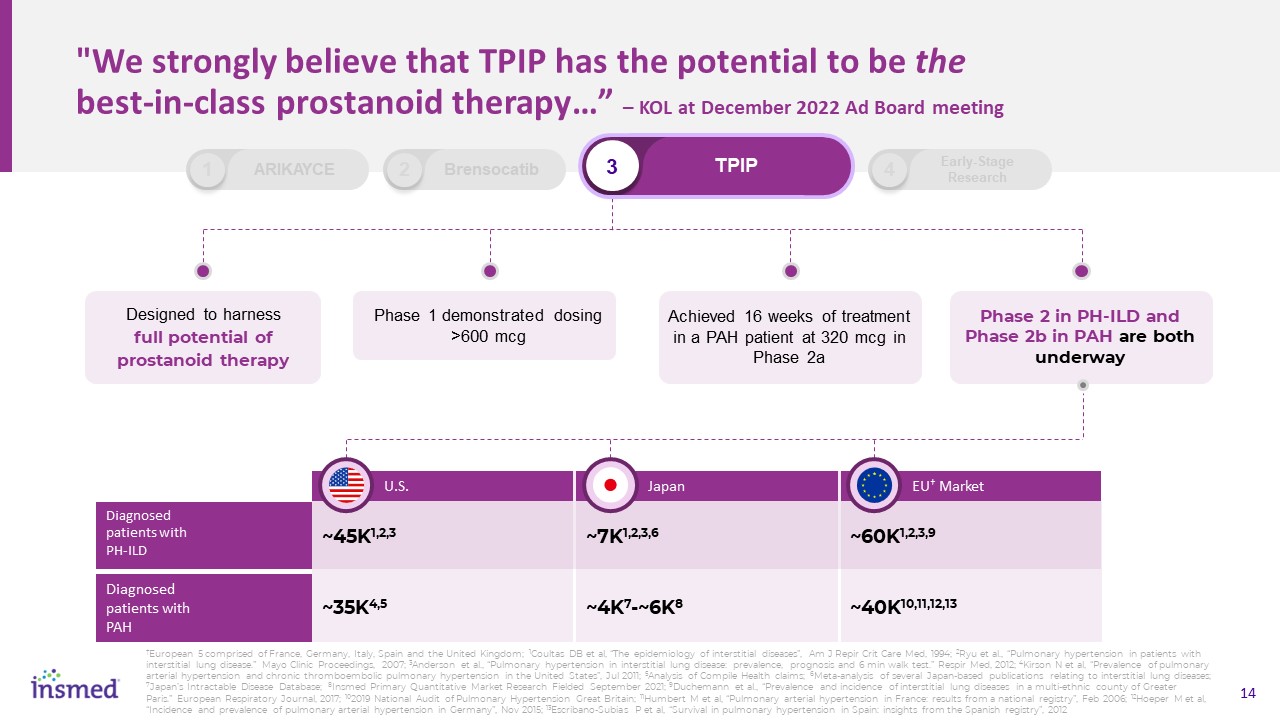
“我們堅信,TIP有可能成為同類最佳的前列腺素治療…。”-KOL在2022年12月的廣告委員會會議上充分利用前列腺素治療的全部潛力第一階段展示了劑量>600微克在一名PAH患者中實現了16周的治療,劑量為320微克,在PH-ILD的2a階段和PAH的2b階段都在進行中。美國診斷的PH-ILD患者患有PAH~7K1,2,3,6~4K7-~6K8日本~45K1,2,3,9~40K10,11,12,13個歐盟†
市場2個Brensocatib 3個TPIP 1個Arikayce 4個早期研究†歐洲5個國家包括法國、德國、意大利、西班牙和英國;1 Coultas DB等人,“間質性疾病的流行病學”,Am J Repir Crit Care Med,
1994;2Ryu等人,“間質性肺病患者的肺動脈高壓”。梅奧臨牀論文集,2007;3Anderson等人,“間質性肺疾病中的肺動脈高壓:患病率、預後和6分鐘步行試驗
。Respir Med,2012;4 Kirson N等人,“美國的肺動脈高壓和慢性血栓栓塞性肺動脈高壓的流行率”,2011年7月;5對彙編的健康聲明的分析;6關於間質性肺病的幾種日本出版物的薈萃分析;7日本的頑固性疾病數據庫;8引入的初級定量市場研究,2021年9月;9 Duchemann等人,“大巴黎一個多民族縣間質性肺疾病的患病率和發病率”。《歐洲呼吸雜誌》,2017年;《102019英國國家肺動脈高壓審計》;11 Humbert M等人,《法國的肺動脈高壓:來自國家登記的結果》, 2006年2月;12Hoeper M等人,“德國的肺動脈高壓的發生率和流行率”,2015年11月;13Escribano-Subias P等人,“在西班牙的肺動脈高壓中的生存:來自西班牙註冊機構的見解”,2012年

我們設計了TPIP,以化學方式實現前列腺素的連續給藥,並證明瞭其益處…霧化給藥比靜脈給藥有更大的血管擴張作用。在最高劑量下,霧化吸入藥物使肺血管阻力和肺動脈壓恢復到基線水平…。正在進行的第二階段試驗旨在驗證這一潛在益處15吸入前列腺素比全身給藥更有效綿羊持續急性肺性高血壓模型
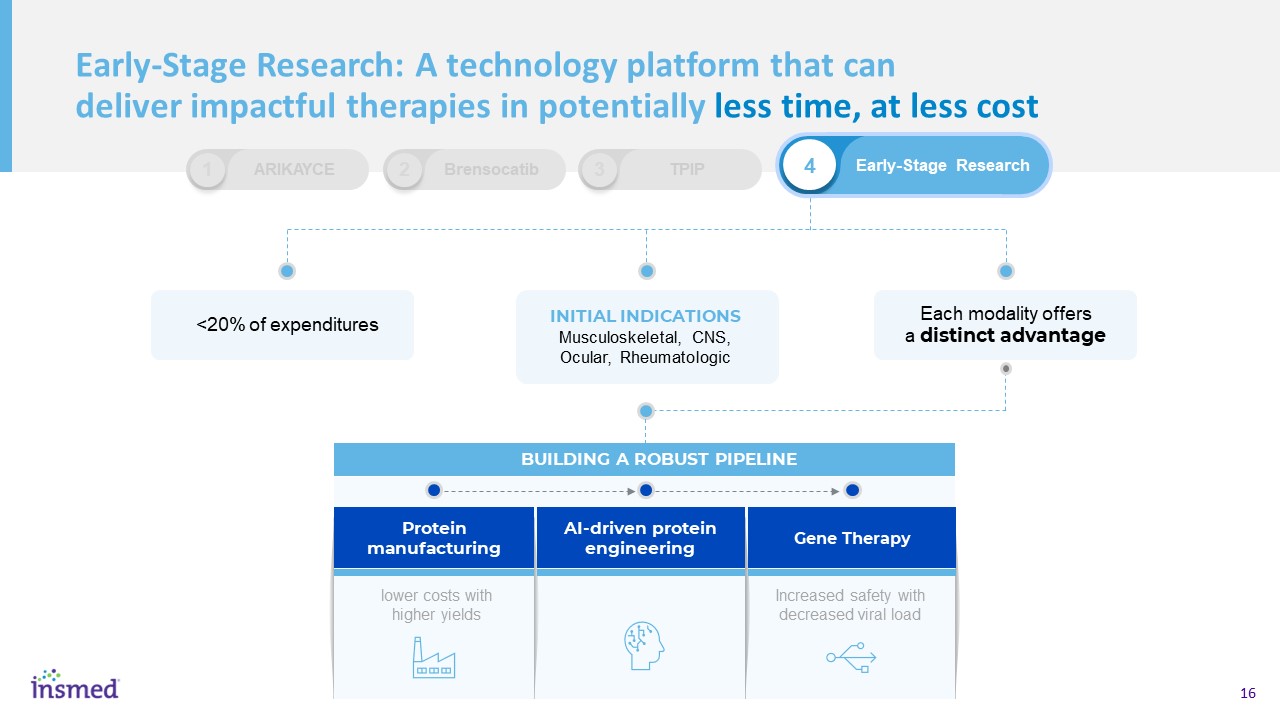

我們的三個不同的研究引擎預計將在2025年年底之前產生≥6 IND/第一階段研究化學、配方和交付基因治療,新型蛋白質製造人工智能驅動的蛋白質工程治療靶點定位團隊規模領導風濕學免疫學改進的病毒衣殼下一代DPP1抑制劑肌肉骨骼-1H23(IND)CNS-晚期‘23/早期’24(IND)新澤西州新澤西州加利福尼亞州N~40 N~15 N~35卡爾·格里斯沃爾德生物製品和NH站點負責人克里斯·貝利-凱洛格計算生物學Walter·珀金斯首席科學官布萊恩·卡斯帕

未來18個月的重要數據讀數1H
2023 1 2 3 Arikayce Brensocatib TPIP 2H 2023 1H 2024肌肉骨骼臨牀前數據(2Q)CNS臨牀前數據(2Q)囊性纖維化PK/PD數據(1Q)TOPLINE結果(3Q)中期劑量滴定安全性和耐受性水平PH-ILD TOPLINE結果肌肉骨骼臨牀數據Aspen TOPLINE結果(2Q)4早期研究

我們的戰略體現了我們對患者的承諾--提供改變生活的療法,並迅速、創造性地工作,提供有意義的結果--改變生活的創新發生在突破性科學和協作文化的交匯處,在科學2022年生物醫學僱主排行榜上排名第一(連續兩年
)全球700多名員工19
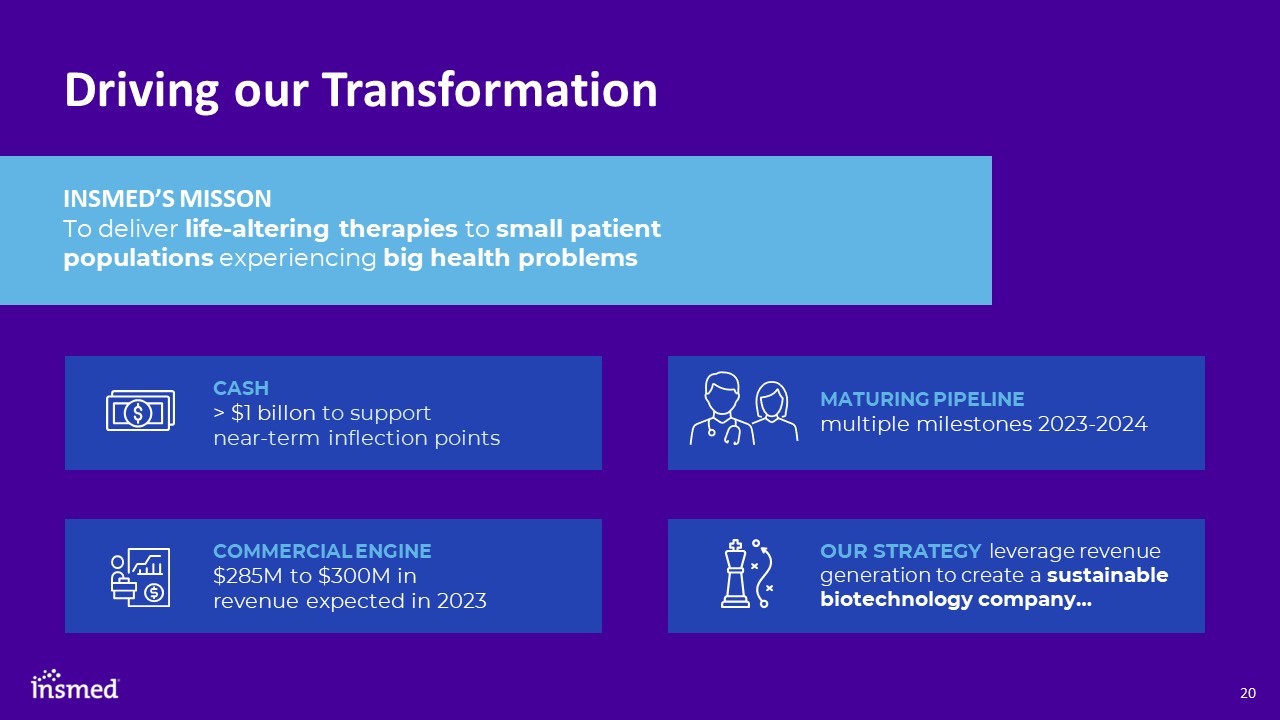
推動我們的轉型Insmed的失敗為經歷重大健康問題的小患者羣體提供改變生活的療法
正在醖釀中的多個里程碑2023-2024我們的戰略利用創收來創建可持續的生物技術公司…現金>10億美元,用於支持近期拐點商業引擎,預計2023年收入將達到2.85億至3億美元