
ARV-471:2期VERITAC試驗結果聖安東尼奧乳腺癌研討會,2022年12月8日

安全港和前瞻性陳述2本陳述包含符合1995年“私人證券訴訟改革法”定義的前瞻性陳述,涉及重大風險和不確定性,包括有關ARV-471成為一種同類最佳雌激素受體靶向療法的可能性的陳述,以及我們的ARV-471預期未來試驗的時間,包括任何組合研究。“預期”、“相信”、“估計”、“預期”、“打算”、“可能”、“可能”、“計劃”、“預測”、“項目”、“目標”、“潛在”、“將”、“可能”、“可能”、“應該”、“繼續”以及類似的表述旨在識別前瞻性表述,儘管並不是所有前瞻性表述都包含這些識別詞語。我們可能無法實際實現我們的前瞻性聲明中披露的計劃、意圖或預期,您不應過度依賴我們的前瞻性聲明。由於各種風險和不確定性因素,實際結果或事件可能與我們在前瞻性聲明中披露的計劃、意圖和預期存在實質性差異,這些風險和不確定性包括但不限於:我們和輝瑞能否在預期的時間表內成功進行ARV-471臨牀開發並獲得臨牀試驗結果,或者根本不能;以及其他重要因素,這些因素可能會導致我們的實際結果與前瞻性聲明中所述的結果大不相同,這些內容在提交給美國證券交易委員會的季度和年度報告中的“風險因素”部分進行了討論。本演示文稿中包含的前瞻性陳述反映了截至本演示文稿發表之日我們對未來事件的當前看法, 除適用法律要求外,我們不承擔更新任何前瞻性陳述的義務。這些前瞻性陳述不應被視為代表我們在本陳述之日之後的任何日期的觀點。Arvinas的名稱和標誌是我們的商標。我們還擁有PROTAC®的服務商標和註冊美國商標。本演示文稿中出現的商標、商號和服務標誌均為其各自所有者的財產。我們省略了適用於本演示文稿中命名的商標的®和™名稱。本演示文稿還包含獨立各方和我們關於市場規模的估計和其他統計數據,以及關於我們行業的其他數據。這些數據涉及許多假設和限制,提醒您不要過度重視這些數據和估計。此外,對我們未來表現的預測、假設和估計,以及我們經營的市場的未來表現,必然受到高度不確定性和風險的影響。本演示文稿僅面向投資者羣體。這並不是為了推廣本文提到的產品或以其他方式影響醫療保健處方決策。交叉試驗比較不是基於面對面的研究,也不能進行直接比較。

3簡介
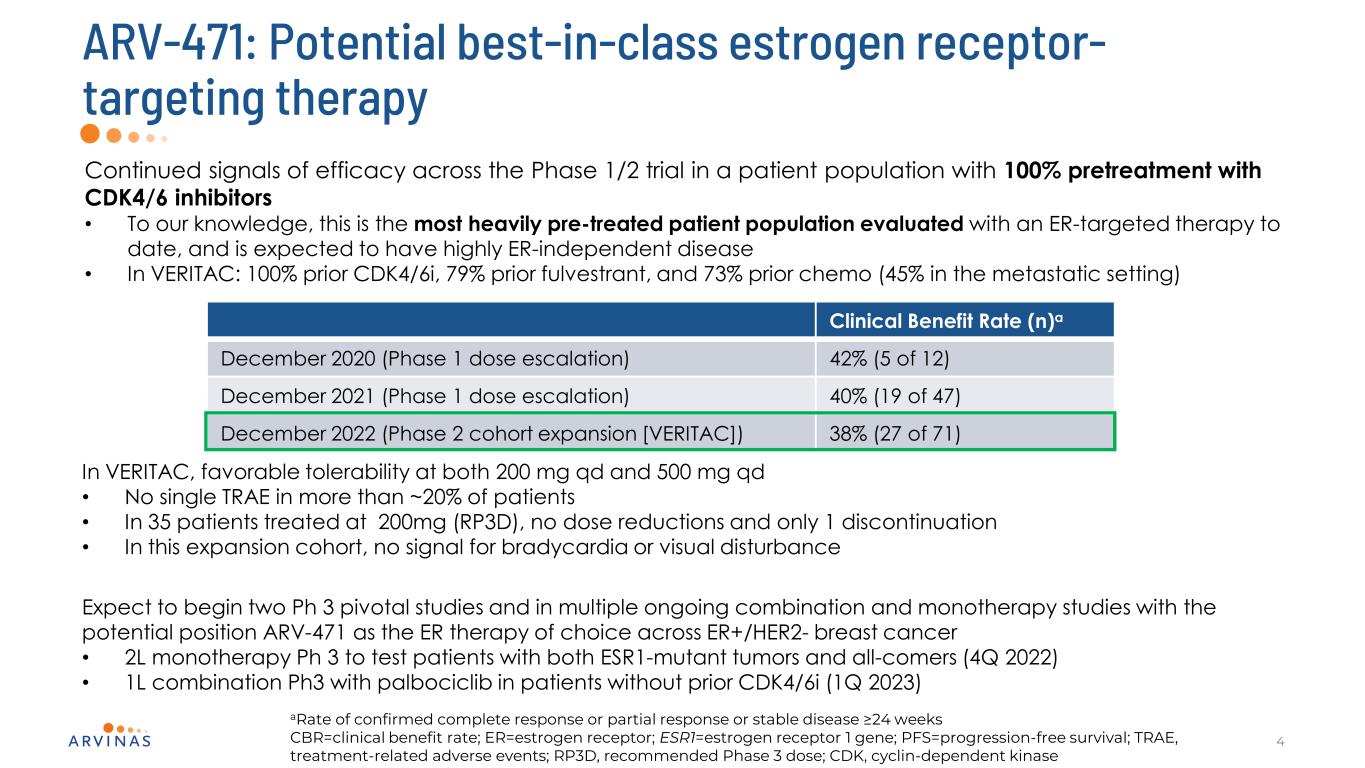
ARV-471:潛在的同類最佳雌激素受體靶向治療4在1/2期試驗中持續有效的信號,在使用CDK4/6抑制劑100%預治療的患者羣體中·據我們所知,這是迄今為止接受ER靶向治療評估的最嚴重的預治療患者羣體,預計將有高度ER非依賴性疾病·在VERITAC:100%之前的CDK4/6i,79%的之前的fulvestrant,臨牀受益率(N)2020年12月(第一階段劑量增加)42%(5/12)2021年12月(第一階段劑量增加)40%(47/19)2022年12月(第二階段隊列擴大)[VERITAC])VERITAC中38%(27/71),對200 mg/d和500 mg/d都有良好的耐受性·在超過20%的患者中沒有單一TRAE·在這個擴大隊列中,在200 mg(RP3D)治療的35例患者中,沒有劑量減少和僅1例停藥,沒有心動過緩或視覺障礙的信號預計將開始兩項Ph3關鍵研究和多項正在進行的聯合和單一治療研究,潛在的位置是ARV471作為ER+/HER2-乳腺癌的ER治療的選擇·2L單一治療Ph3用於測試同時患有ESR1突變腫瘤和所有患者的患者(2022年4月)·1L與Palbociclib的聯合Ph3在沒有CDK4/6i(2023年1月)的患者中確認完全應答或部分應答或穩定疾病的比率≥24周CBR=臨牀受益率;ER=雌激素受體;ESR1=雌激素受體1基因;PFS=無進展生存期;TRAE,與治療相關的不良事件;RP3D,推薦的3期劑量;CDK,細胞週期蛋白依賴性激酶

ARV-471:有可能成為ER+/HER2-乳腺癌治療的內分泌骨幹選擇5潛在的未來美國ER+/HER2-乳腺癌治療範例與ARV-471佐劑(手術後)乳腺癌(~160K)*轉移性乳腺癌(~50K*)第二/第三線內分泌主幹芳香酶抑制物(AI)Fulvestrant或伊西美坦附加療法CDK4/6和其他靶向抑制劑mTOR抑制劑或PIK3抑制劑Fulvestrant*來自SEER數據庫的美國人口每年事件CDK:細胞週期蛋白依賴性激酶,PI3K:磷酸肌醇3-激酶;MTOR:雷帕黴素的哺乳動物靶點ARV-471擴展潛力未來狀態:ARV-471被設計為一種口服、高效的ER降解劑,近期具有良好的安全性

有SERDS或ARV471的研究包括一系列先前的治療方法在關鍵研究中,VERITAC擁有大多數先前的治療方法Paloma-31期3研究Palbociclib+fulvestrant與安慰劑+fulvestrant(N=521)0 0 34%‡acelERA2階段2研究巨型消毒劑與SOC†(N=303)42%*19%*32%SERENA-23雙親誘導劑與Fulvestrant(N=2 4 0)50%0 19%Ameera-32期†(N=2 90)79*,‡10%*,‡11%VERONICA4聯合富維斯特與富維斯特的‡11%‡VERONICA4期研究(N=103)100%0 EMERALD5 ELEACESTANT VS SOC†(N=477)100%30%22%VERITAC2期擴展隊列的抗逆轉錄病毒-471(N=71)100%79%45%1Lancet Onol 2016。2022年ESMO。3 2022年聖安東尼奧乳腺癌研討會。4臨牀癌症研究2022年.5J臨牀癌症2022年。*高級/轉移設置。†醫生對氟維斯特或芳香酶抑制劑的選擇;他莫昔芬在AMEERA-3中也是允許的。SOC=標準護理‡公佈的數據,手動計算總人口6預期耐藥性預期療效

7 ARV-471:VERITAC第二階段詳細結果
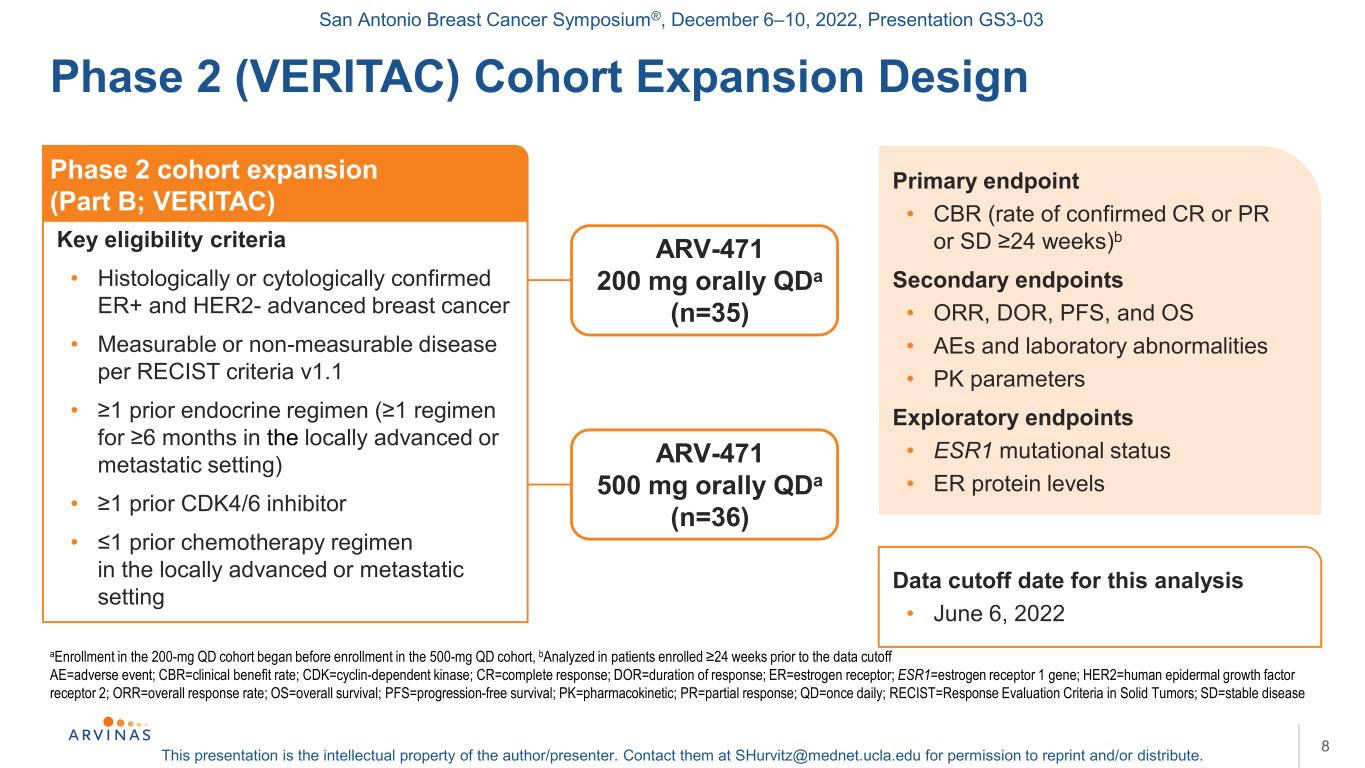
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。8a200mgQD隊列中的登記在納入500mgQD隊列之前開始,b在數據截止前24周入選≥的患者中進行分析:AE=不良事件;CBR=臨牀受益率;CDK=細胞週期依賴性激酶;CR=完全應答;DOR=應答持續時間;ER=雌激素受體;ESR1=雌激素受體1基因;HER2=人類表皮生長因子受體2;ORR=總應答率;OS=總存活率;PFS=無進展存活率;PK=藥代動力學;PR=部分應答;QD=每日一次;RECIST=實體腫瘤的療效評價標準;SD=穩定期疾病2期(VERAC)隊列擴大設計2期隊列擴大(B部分;VERITAC)關鍵資格標準·組織學或細胞學證實的ER+和HER2-晚期乳腺癌·根據RECIST標準可測量或不可測量的疾病v1.1·≥1之前的內分泌方案(在局部晚期或轉移的情況下,≥1方案為期6個月)·≥1之前的CDK4/6抑制劑·≥1之前的化療方案在局部晚期或轉移的情況下的主要終點·CBR(確診CR或PR或SD≥24周的比率)b次要終點·ORR、DOR、PFS、和OS·AEs和實驗室異常·PK參數探索終點·ESR1突變狀態·ER蛋白水平ARV-471 200 mg口服QDA(n=35)ARV-471 500 mg口服QDA(n=36)本次分析的數據截止日期·2022年6月6日
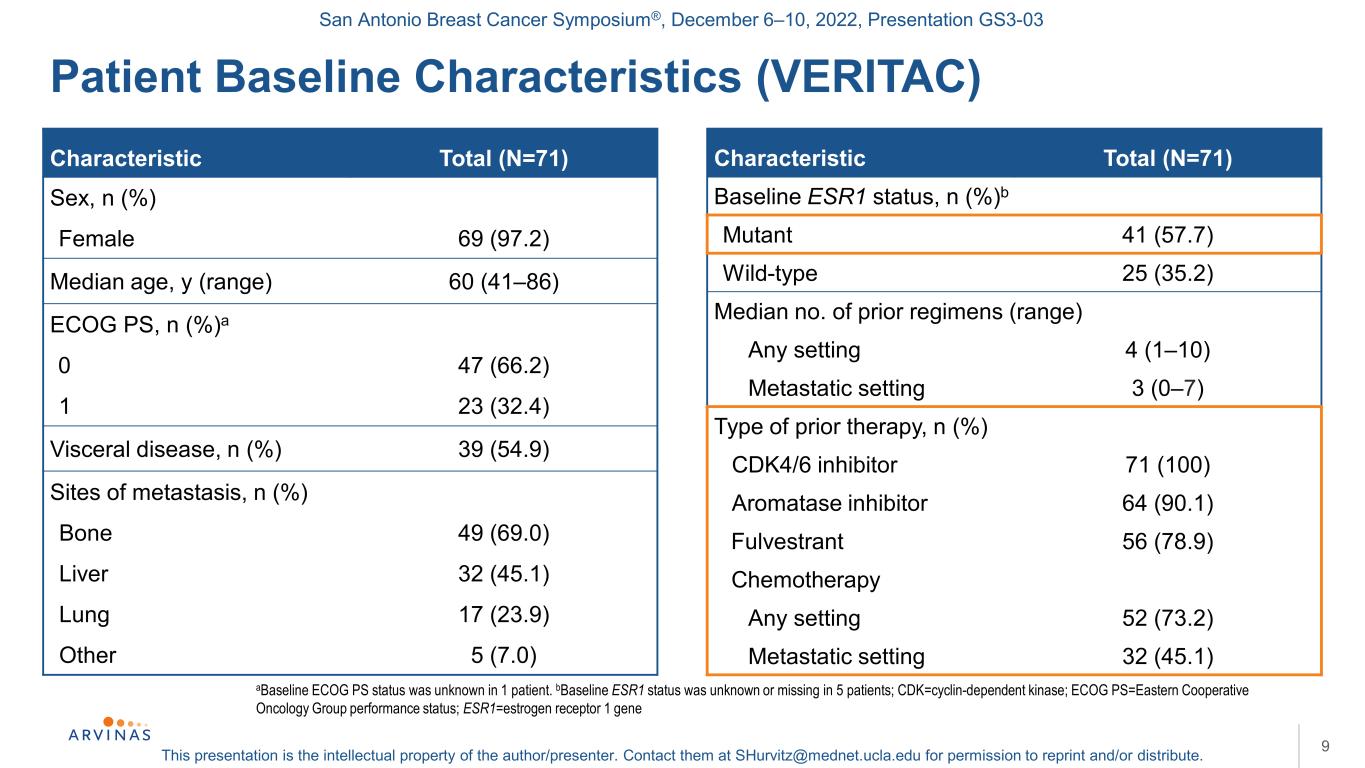
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。患者基線特徵(VERITAC)9a基線ECOG PS狀態未知1例.B基線ESR1狀態未知或缺失5例;CDK=細胞週期蛋白依賴激酶;ECOG PS=東部合作腫瘤組表現狀態;ESR1=雌激素受體1基因特徵總數(N=71)性別,n(%)女性69(97.2)中位年齡,y(範圍)60(41-86)ECOG PS,n(%)a 0 47(66.2)1 23(32.4)內臟疾病,n(%)39(54.9)轉移部位,n(%)骨49(69.0)肝32(45.1)肺17(23.9)其他5(7.0)特徵總(N=71)基線ESR1狀態,N(%)b突變體41(57.7)野生型25(35.2)中位數之前的方案(範圍)任何情況4(1-10)轉移情況3(0-7)既往治療類型n(%)CDK4/6抑制物71(100)芳香化酶抑制物64(90.1)Fulvestrant 56(78.9)化療任何情況52(73.2)轉移情況32(45.1)
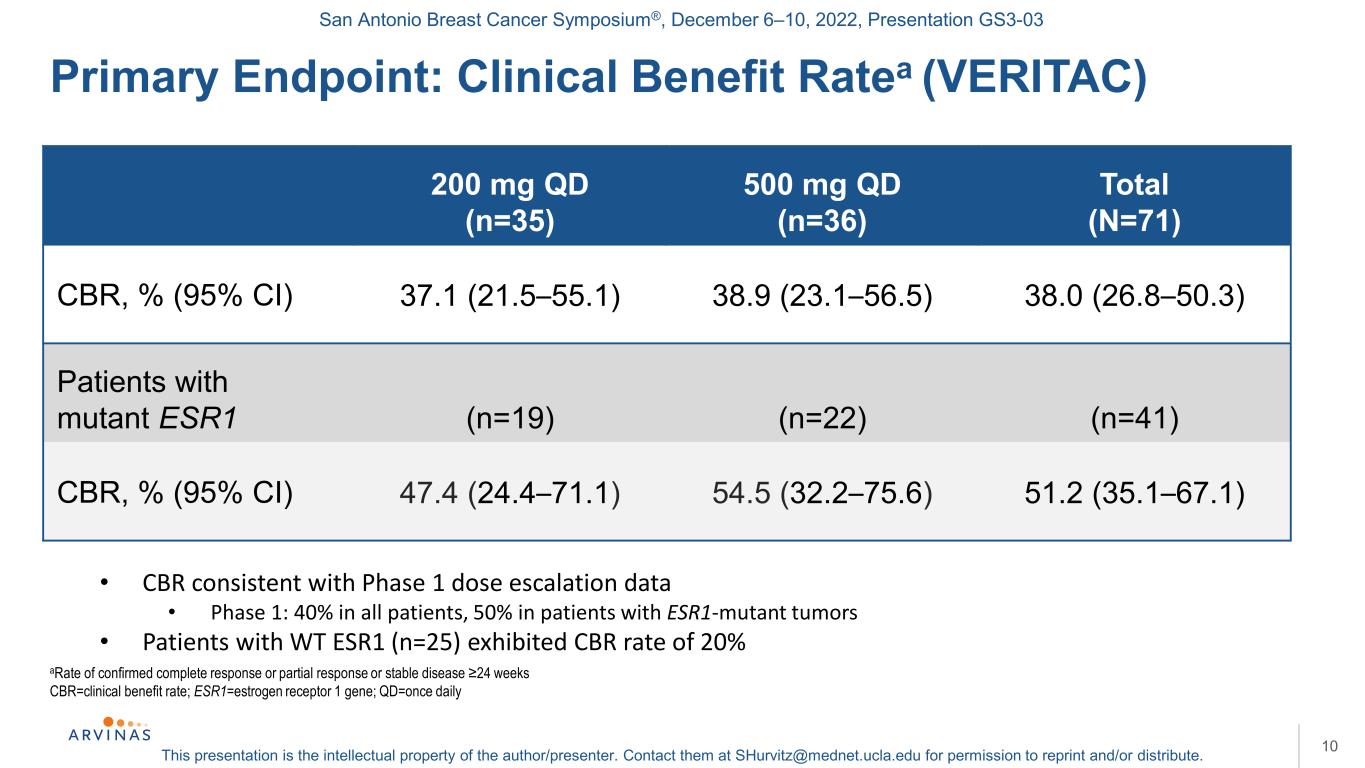
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。10確診完全緩解或部分緩解或病情穩定的比率≥24周CBR=臨牀受益率;Qd=每日一次:臨牀受益率(VERITAC)200 mg qd(n=35)500 mg qd(n=36)總CBR(N=71)CBR,%(95%CI)37.1(21.5-55.1)38.9(23.1-56.5)38.0(26.8-50.3)突變ESR1患者(n=19)(n=22)(n=41)CBR,%(95%CI)47.4(24.4-71.1)54.5(32.2-75.6)51.2(35.1-67.1)·CBR與第一階段劑量遞增數據一致·第一階段:所有患者40%,ESR1突變腫瘤患者50%·WT ESR1患者(n=25)CBR率為20%
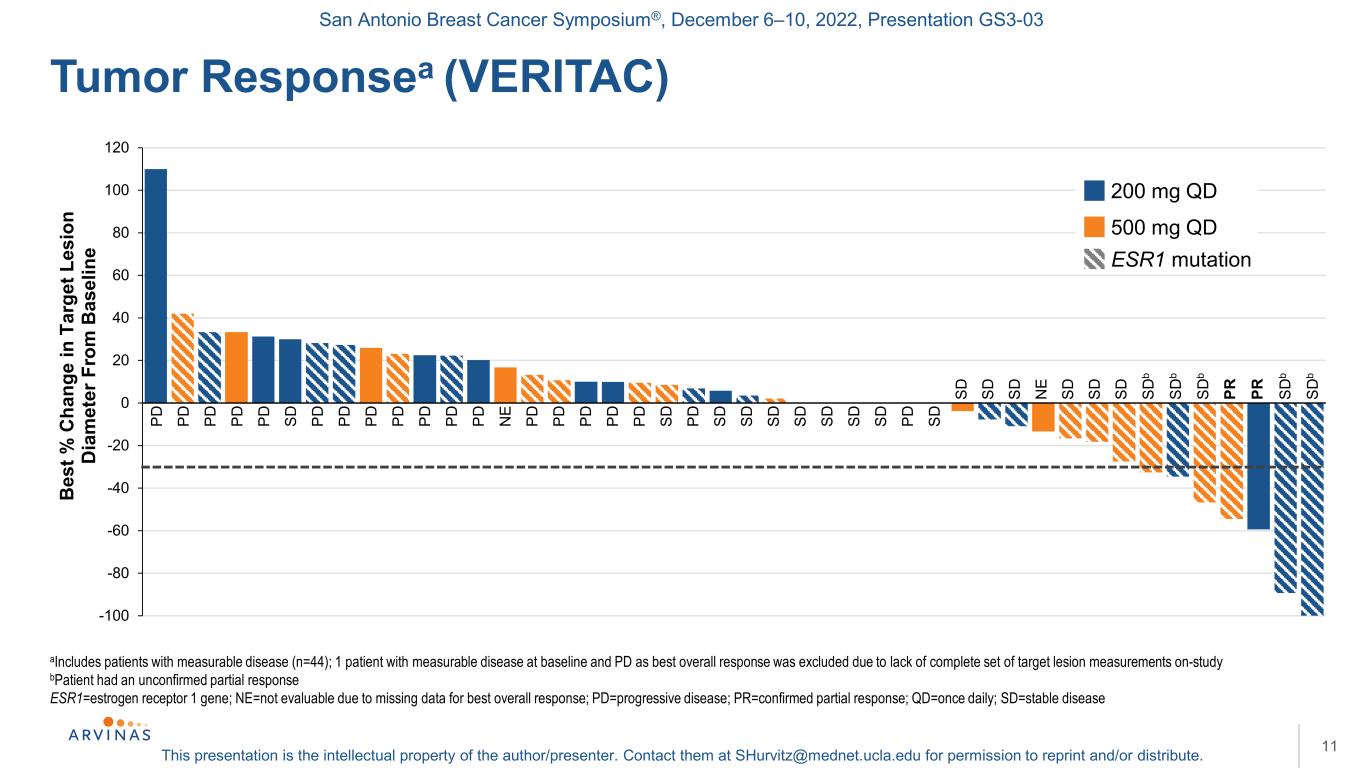
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。11a包括可測量疾病的患者(n=44);1名在基線可測量疾病和PD為最佳總體反應的患者因缺乏一套完整的靶點病變測量而被排除在研究中-研究b患者有未確認的部分反應ESR1=雌激素受體1基因;NE=由於缺少最佳總體反應的數據而不可評估;PD=進展性疾病;PR=確認的部分反應;QD=每天一次;SD=穩定型疾病腫瘤反應(VERITAC)-100-80-60-40-20 20 40 60 80 100 120 BES%C HANGE在E 200 mg QD 500 mg QD PD PD PDPD PDSD SDPD SD SDPD SD PD SD PD SD N E SD PR SD PR SD N E SD PR SD B PD SD b SD b SD b SD b ESR1突變
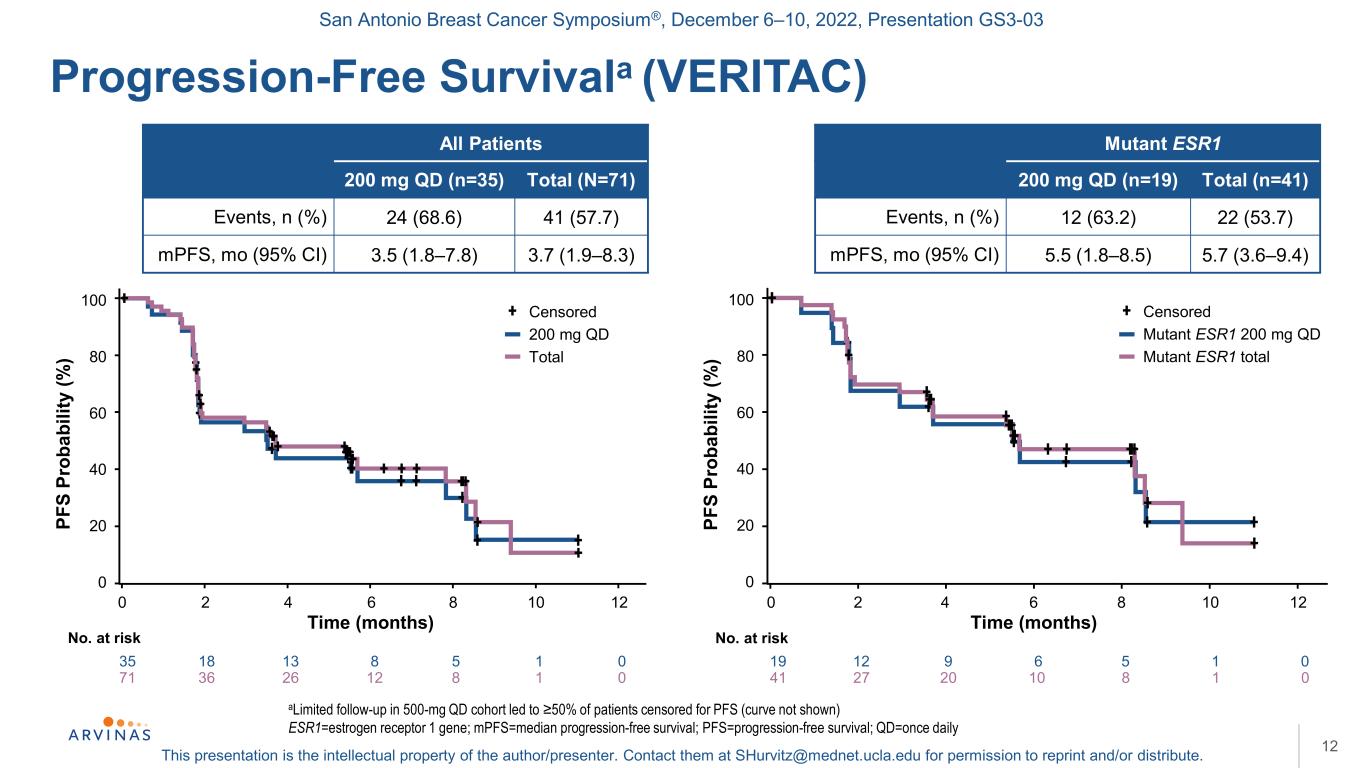
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。100 80 60 40 20 0無進展生存期(VERITAC)12在500mgQd隊列中限定的隨訪導致≥50%的患者被審查PFS(曲線未顯示)ESR1=雌激素受體1基因;MPFS=中位無進展生存期;PFS=無進展生存期;Qd=每天一次所有患者200 mg qd(n=35)總計(N=71)事件,n(%)24(68.6)41(57.7)mpFS,mo(95%CI)3.5(1.8-7.8)3.7(1.9-8.3)突變型ESR1 200 mg qd(n=19)總計(n=41)事件,n(%)12(63.2)22(53.7)mpFS,鉬(95%CI)5.5(1.8-8.5)5.7(3.6-9.4)71 36 26 12 8 1 0 100 80 60 40 0 PF S PROAB(%)0 2 4 6 8 8 10 12次(月)否風險35 18 13 8 5 10共審查200 mg qd突變體ESR1 200 mg qd突變體ESR1總Pf S pr abilty(%)0 2 4 6 8 10 12時間(月)No.面臨風險41 27 20 10 8 1 0 19 12 9 6 5 1 0
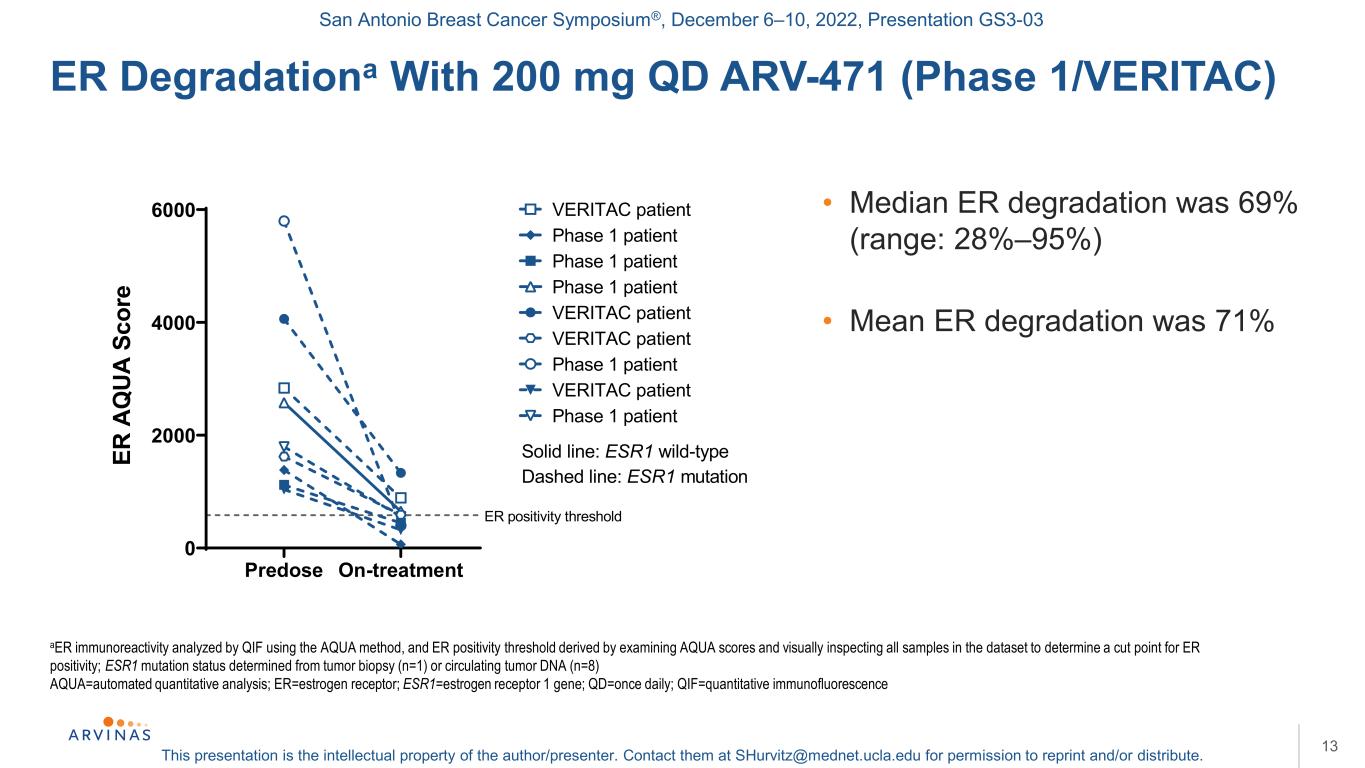
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。ER Degradationa含200 mg QD ARV-471(1期/VERITAC)13Aer免疫反應性由QIF使用Aqua方法分析,ER陽性閾值通過檢查Aqua評分和肉眼檢查數據集中的所有樣本以確定ER陽性的臨界點而得出;ESR1突變狀態通過腫瘤活檢(n=1)或循環腫瘤DNA(n=8)Aqua=自動定量分析;ER=雌激素受體;ESR1=雌激素受體1基因;QD=每天一次;QIF=定量免疫熒光·ER降解率中位數為69%(範圍:28%-95%)·治療前平均ER降解率為71%0 2000 4000 6000 ER A Q UA S COR陽性閾值VERITAC患者1期患者VERITAC患者1期VERITAC患者1期患者實線:ESR1野生型虛線:ESR1突變
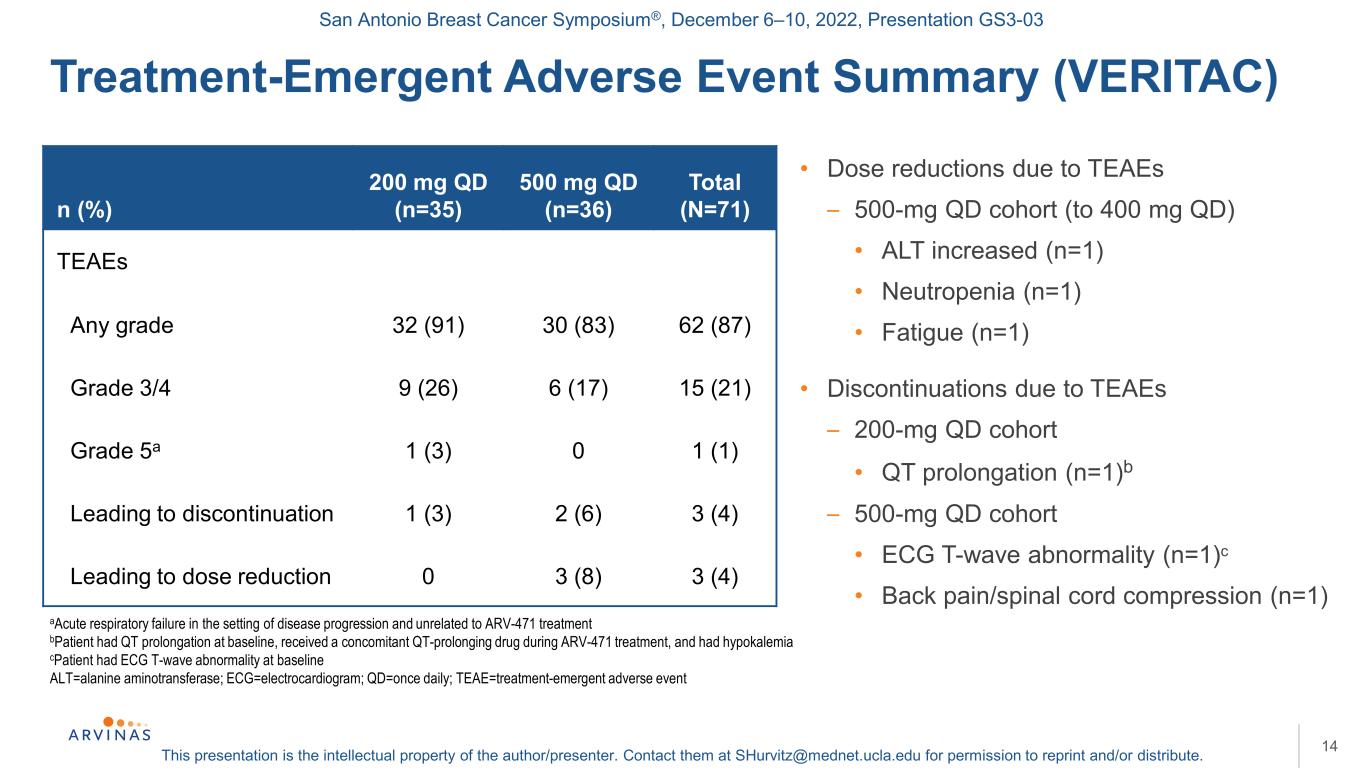
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。治療-緊急不良事件總結(VERITAC)14與ARV-471治療無關的疾病進展背景下的急性呼吸衰竭患者在基線時QT延長,在ARV-471治療期間接受伴隨的QT延長藥物,並有低鉀血癥患者在基線時有心電圖T波異常,ALT=丙氨酸氨基轉移酶;ECG=心電圖;QD=每日一次;TEAE=治療-緊急不良事件·TEAE導致的劑量減少-500 mg qd隊列(至400 mg qd)·ALT升高(n=1)·中性粒細胞減少(n=1)·疲勞(n=1)·因TEAEs中斷-200 mg qd隊列·QT延長(n=1)b-500 mg qd隊列·心電圖T波異常(n=1)c·背痛/脊髓壓迫(n=1)n(%)200 mg qd(n=35)總計500 mg qd(n=71)TEEs Any分級32(91)30(83)(87)3/4級9(26)6(17)15(21)5a級1(3)0 1(1)導致停止1(3)2(6)3(4)導致劑量減少0 3(8)3(4)
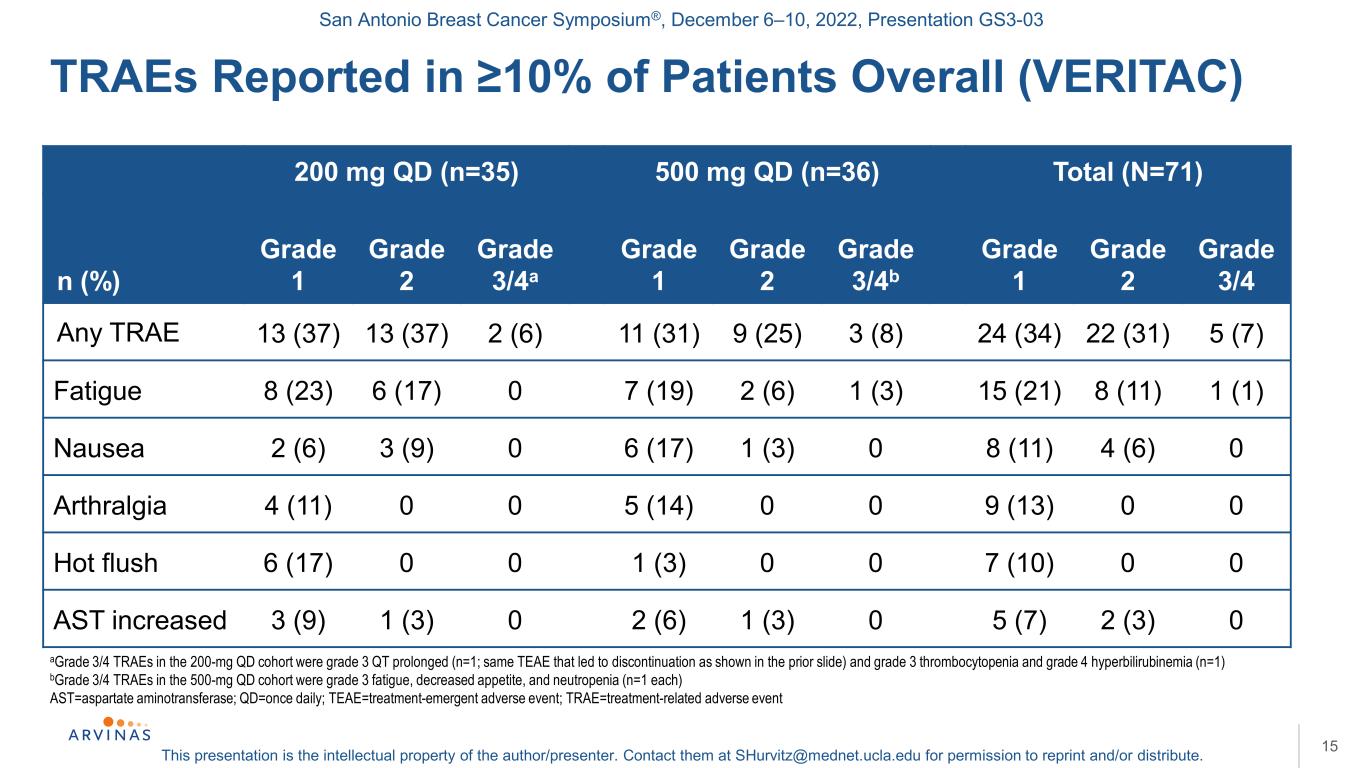
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。200 mg qd(n=35)500 mg qd(n=36)總計(N=71)n(%)1級2級3/4a級1級2級3/4b級1級3/4任何曲目13(37)13(37)2(6)11(31)9(25)3(8)24(34)22(31)5(7)疲勞8(23)6(17)07(19)2(6)1(3)15(21)8(11)1(1)噁心2(6)3(9)0 6(17)1(3)0 8(11)4(6)0關節痛4(11)0 0 5(14)0 0 9(13)0 0潮熱6(17)0 0 1(3)0 0 7(10)0 0 AST增加3(9)1(3)0 2(6)1(3)0 5(7)2(3)0 15 A級3/4 TRAE延長(n=1);B500 mg qd隊列中3/4級TRAE為3級疲乏、食慾下降和中性粒細胞減少(n=1),AST=天冬氨酸氨基轉移酶;Qd=每天1次;TEAE=治療-緊急不良事件;TRAE=治療相關不良事件≥中報告的TRAE佔患者總數的10%(VERITAC)
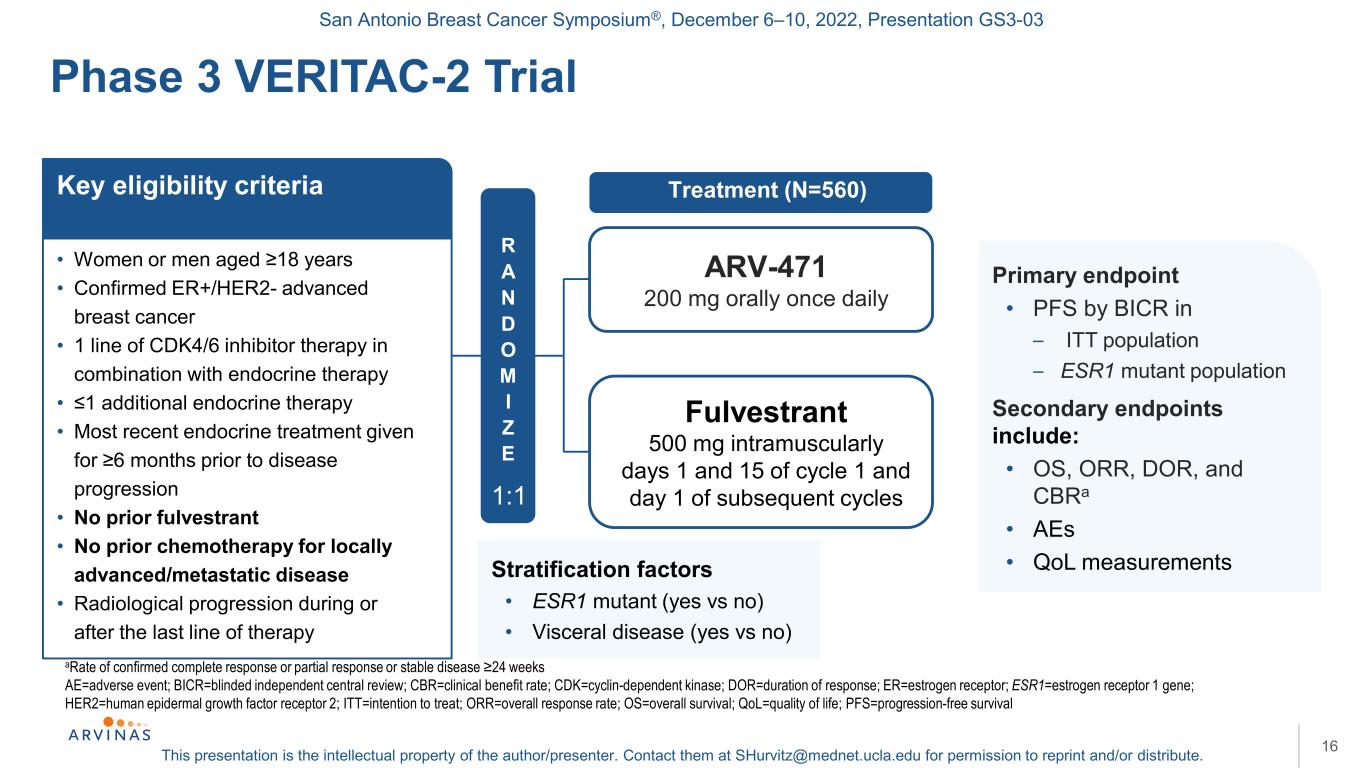
聖安東尼奧乳腺癌研討會®,2022年12月6-10日,演示文稿GS3-03本演示文稿是作者/演講者的知識產權。聯繫他們:shurvitz@mednet.ucla.edu,以獲得轉載和/或分發的許可。16確診完全緩解或部分緩解或病情穩定的比率≥24周AE=不良事件;BICR=盲法獨立中心綜述;CBR=臨牀受益率;CDK=細胞週期蛋白依賴性激酶;DOR=反應持續時間;ER=雌激素受體;ESR1=雌激素受體1基因;HER2=人表皮生長因子受體2;ITT=治療意向;ORR=總應答率;OS=總生存期;QOL=生活質量;PFS=無進展生存期3 VERITAC-2試驗·年齡18歲的女性或男性·確診的ER+/HER2-晚期乳腺癌·CDK4/6抑制劑聯合內分泌治療的1行·≤1附加內分泌治療·在疾病進展前6個月接受最近的內分泌治療·以前沒有接受過福爾維斯特·沒有接受過局部晚期/轉移性疾病的化療·最後一次治療期間或之後的放射進展-4712萬毫克,每天肌肉注射一次Fulvestrant,每天500 mg,在週期1和15天以及隨後的關鍵資格標準主要終點的第1天和第15天,以及隨後的關鍵資格標準主要終點的第1天和第15天·BICR In-ITT羣體的PFS-ESR1突變羣體次要終端包括:·OS、ORR、DOR和CBRa·AEs·QOL測量R A N D O M I Z E 1:1分層因素·ESR1突變(是與否)·內臟疾病(是與否)治療(N=560)
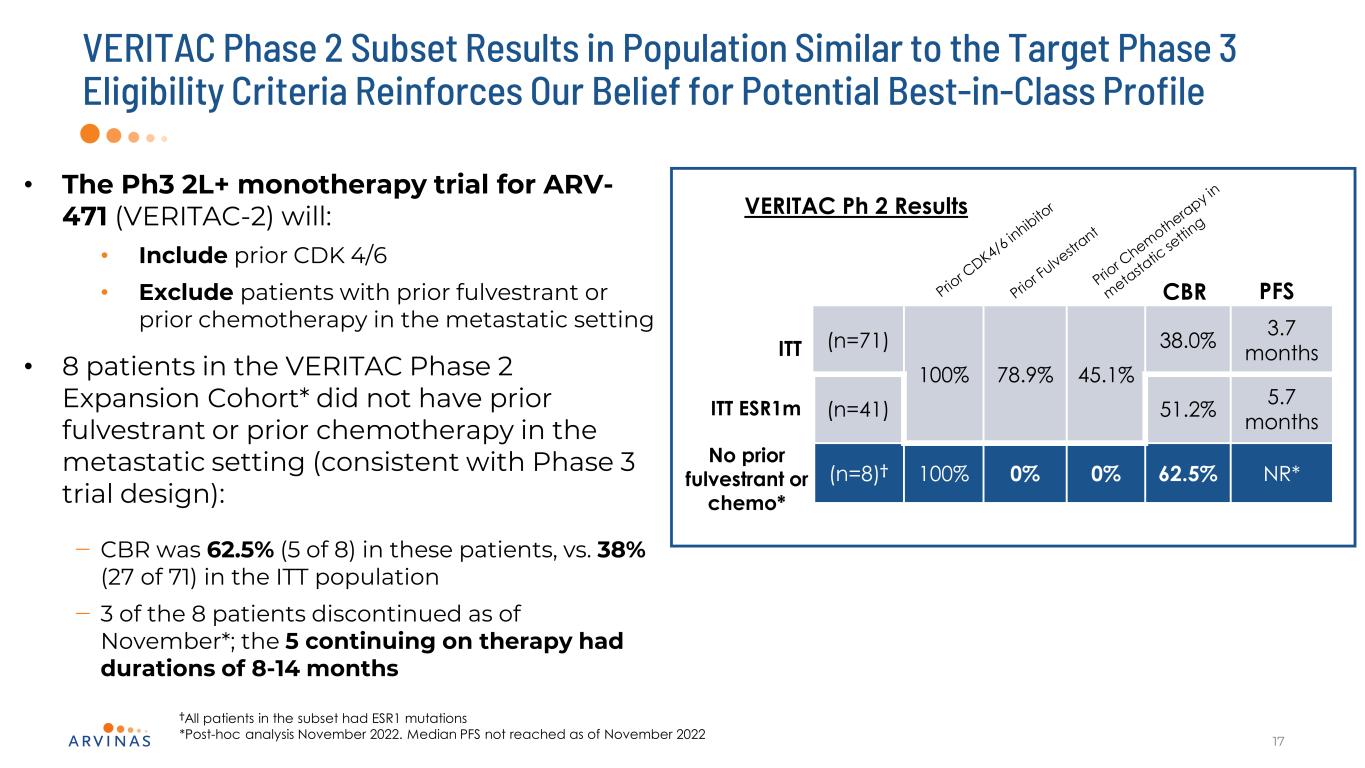
VERITAC 2期子集在人羣中的結果與目標3期資格標準相似,這加強了我們對潛在的同類最佳配置文件的信念17·針對ARV-471的Ph3 2L+單一療法試驗(VERITAC-2)將:·包括先前的CDK 4/6·排除在轉移環境中曾接受過全反式或先前化療的患者·VERITAC第2期擴展隊列中的8名患者*在轉移環境中沒有以前的全反式或先前的化療(與第3期試驗設計一致):-CBR在這些患者中為62.5%(5/8),ITT人羣中38%(27/71)--截至11月,8名患者中有3名停止了治療*;繼續治療的5名患者的持續時間為8-14個月,†亞組中的所有患者都有ESR1突變*2022年11月的事後分析。截至2022年11月未達到的中位數PFS ITT(n=71)100%78.9%45.1%38.0%3.7個月(n=41)51.2%5.7個月(n=8)†100%0%0%62.5%NR*VERITAC Ph2結果CBR PFS無之前的富爾維酮或化療*ITT ESR1M

18個結論

持續的療效和良好的耐受性使ARV-471走上了兩項關鍵研究的道路,這兩項研究很快將開始19·良好的耐受性,分別為200 mg qd和500 mg qd·200 mg第3階段劑量,無劑量減少和一次停藥·ARV-471的耐受性非常適合於在疾病連續過程中開發·啟動Ph3試驗·在治療經驗較少的患者中採用單一療法2L Ph3(2022年第四季度)·旨在解決ESR1mut和All-comers中的作用的試驗·Palbo聯合1L Ph3在ER依賴腫瘤患者中的應用(2023年第一季度)·與其他聯合療法和早期乳腺癌一起啟動的更廣泛的開發·ARV-471在嚴重耐藥患者中顯示出強大的CBR和MPFS·在這一難以治療的人羣中的活性表明了PROTAC技術的耐受性的潛力。其安全性和有效性尚未確定:確診完全緩解或部分緩解或病情穩定的比率≥24周CBR=臨牀受益率;ER=雌激素受體;ESR1=雌激素受體1基因;PFS=無進展生存期

VERITAC數據證實,ARV471有可能成為一種同類中最好的ER靶向療法20cc 2020:階段1 PoC 2021:階段1讀出2022:階段2讀出2022:計劃啟動TACTIVE-U,TACTIVE-E 2022:計劃在日本患者中啟動TACTIVE-N 2022:在日本患者中啟動第一階段驗證的PROTAC蛋白質降解器持續療效信號和良好的耐受性特徵支持推進到日本的第三階段註冊研究第一階段試驗,以實現具有多靶向治療的全球路徑組合試驗-按計劃增加更多藥物,以建立ARV-471作為骨幹治療的潛力,旨在評估早期乳腺癌的安全性和臨牀活性(例如,新佐劑)下一個里程碑:第3階段註冊研究(1L)證實了ARV-471作為轉移性乳腺癌2022年潛在治療方法的評估:VERITAC-2 Ph3試驗(2L+單一療法)第一個地點的劑量患者已經啟動

謝謝你21歲