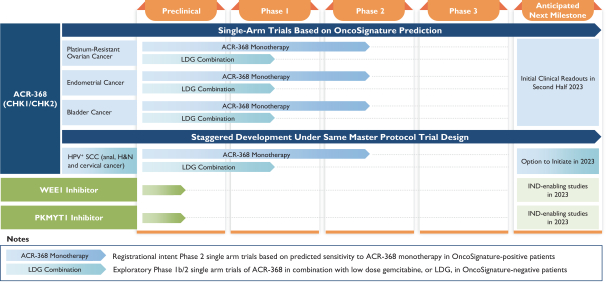
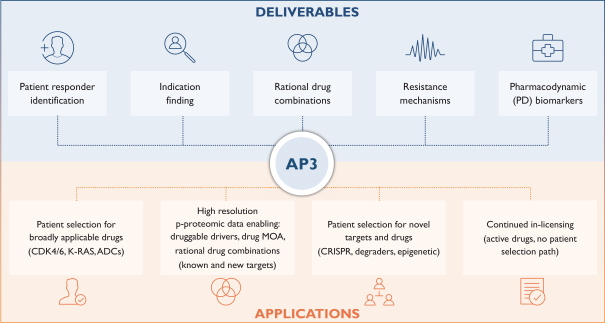
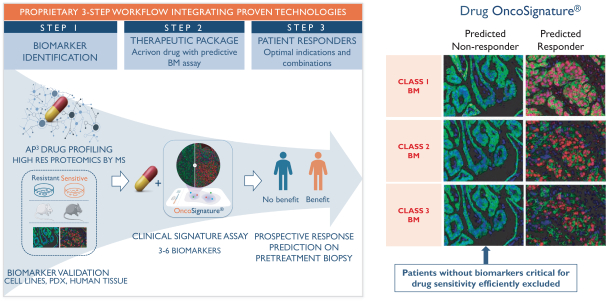
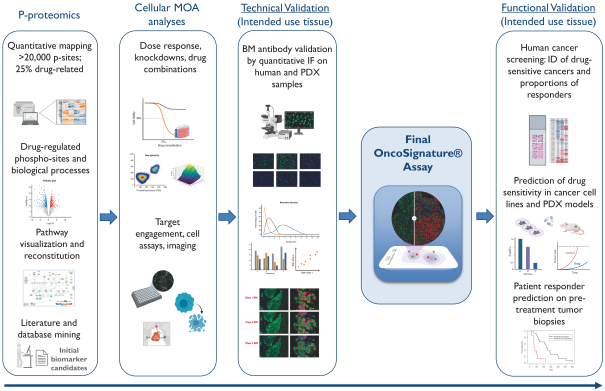
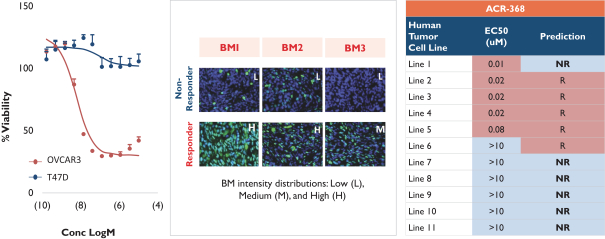
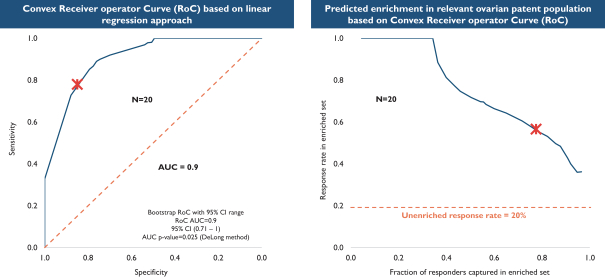
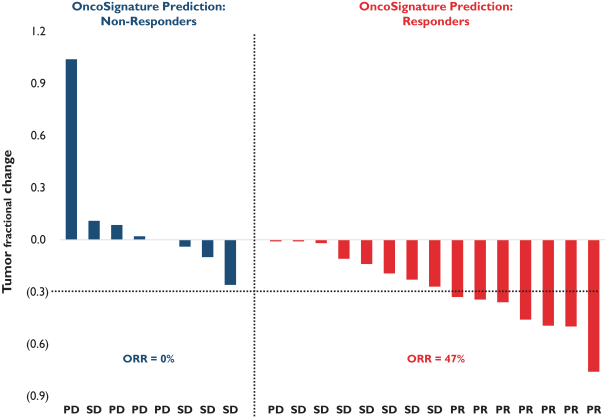
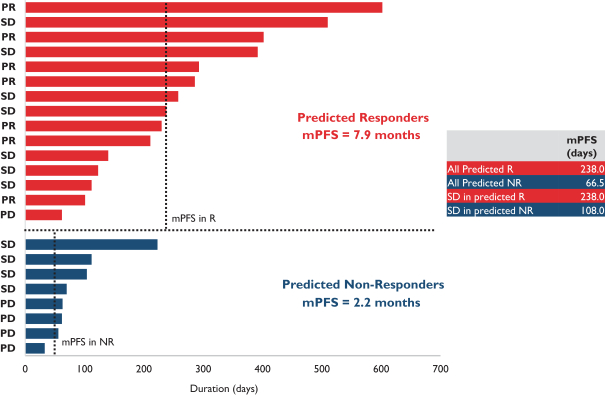
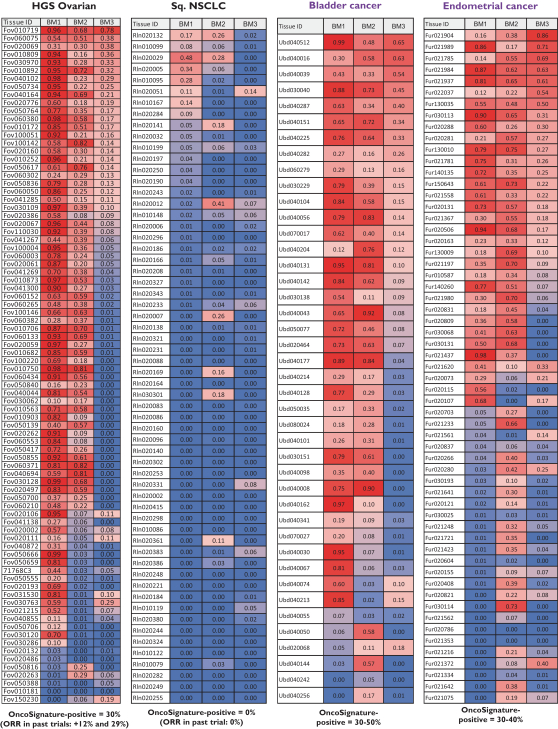
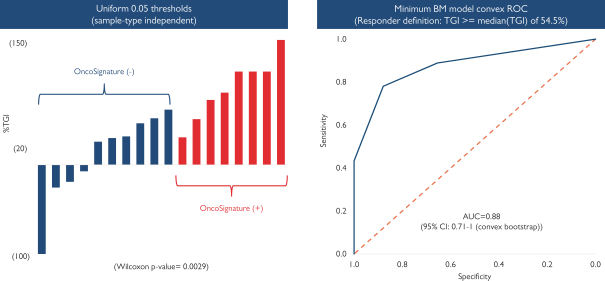
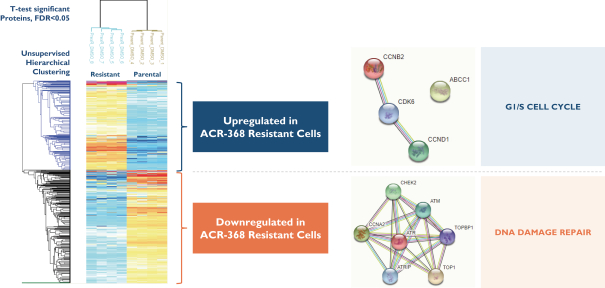
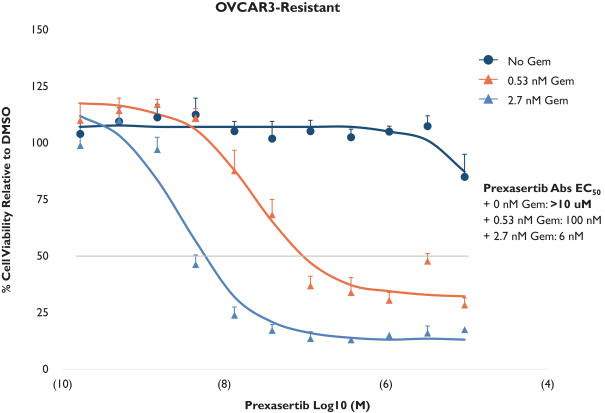
依據第424(B)(4)條提交
註冊號碼333-267911及333-268365
7,550,000 Shares

普通股
我們將發行7,550,000股普通股。這是我們的首次公開募股,目前我們的普通股還不存在公開市場。我們普通股的首次公開募股價格為每股12.50美元。我們的普通股 已獲準在納斯達克全球市場上市,代碼為ACRV。
我們是聯邦證券法定義的新興成長型公司和較小的報告公司,因此,本招股説明書和未來備案文件的上市公司報告要求將降低。見 一節,標題為招股説明書摘要和作為一家新興成長型公司和一家較小的報告公司的影響。投資我們的普通股涉及風險。請參見第13頁開始的標題為風險因素的部分。
美國證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券,也沒有確定本招股説明書是否屬實或完整。任何相反的陳述都是刑事犯罪。
| 每股 |
總計 |
|||||||
| 首次公開募股價格 |
$12.50 | $94,375,000 | ||||||
| 承保折扣和佣金 (1) |
$0.875 | $6,606,250 | ||||||
| 扣除費用前的收益,付給我們 |
$11.625 | $87,768,750 | ||||||
| (1) | 有關承銷商總薪酬的更多信息,請參閲承保 。 |
我們已授予承銷商為期30天的選擇權,最多可額外購買1,132,500股我們的普通股。
承銷商預計於2022年11月17日左右在紐約交割普通股。
持股5%或以上的Chione Limited已同意以每股12.50美元的首次公開募股價格以私募方式購買400,000股普通股 ,與本次首次公開募股同步完成。同時定向增發將與本次發行同時結束,並以完成此次發行為條件和條件。本次發行的結束並不以同時進行的私募結束為條件。承銷商擔任與同時定向增發有關的配售代理,並將獲得相當於定向增發股份總購買價7.0%或350,000美元的配售代理費。
| 傑富瑞 | 考恩 | 派珀·桑德勒 |
招股説明書日期:2022年11月14日