目錄表
非卧牀的2型和3型SMA(據估計,這代表了美國和歐洲目前流行的SMA患者的大部分)。Apitegromab在我們的第二階段黃玉概念驗證臨牀試驗中用於治療2型和3型SMA患者。黃玉臨牀試驗2期12個月的正面結果最初於2021年4月宣佈,並於2021年6月在Cure SMA虛擬會議上公佈。
2022年6月,在Cure SMA研究和臨牀護理會議上,我們公佈了託帕茲公司的apitegromab的24個月療效和安全性擴展數據。數據對於接受SMN治療的2型和3型SMA的非門診患者,支持使用apitegromab持續和持續的改善。
託帕茲評估了廣泛年齡範圍(2-21歲)的2型和3型SMA患者的apitegromab。所有35名非門診患者(隊列2和3)和23名門診患者中的12名(隊列1)正在接受努西那森維持治療。非活動人羣的主要療效終點是擴展的Hammersmith功能運動量表(“HFMSE”)較基線的平均變化。其他終點包括修訂的上肢模塊(“RULM”)較基線的平均變化,這是一項專門為SMA患者的上肢功能設計的評估。HFMSE是評估SMA患者粗大運動功能的有效工具,而RULM是通過評估與用手和手臂執行各種日常活動的能力相對應的任務來評估上肢運動能力。
在這項為期24個月的評估中,進行了一項觀察病例分析,它彙集了所有非門診患者(隊列2和3),並基於給定時間點的可用數據。該分析人羣包括接受低劑量(2 mg/kg)或大劑量(20 mg/kg)apitegromab的患者(包括隊列3中第二年從2 mg/kg改為20 mg/kg的患者),不排除任何因新冠肺炎研究網站准入限制而未能達到預期apitegromab劑量的患者。
接受有效HFMSE評估的非卧牀患者(年齡範圍為2至21歲)在24個月後HFMSE評分有顯著、持續的增加,而RULM評分在24個月時繼續增加。非門診患者與基線結果的平均變化顯示:
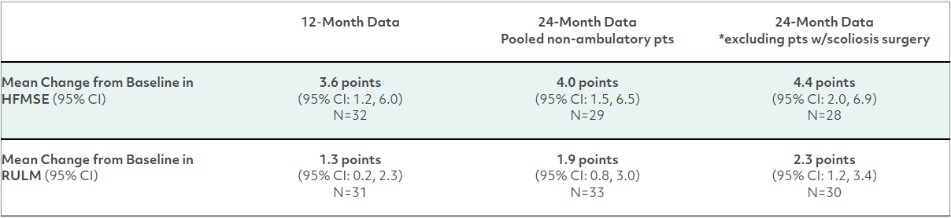
*非活動組中的三名患者在第二年接受了脊柱側彎手術,據報道,這在此後相當長的一段時間內對HFMSE評分產生了負面影響。這項分析排除了這些患者的術後數據。
根據HFMSE評分和藥效學數據(通過血清潛在的肌肉生長抑素濃度來衡量靶點參與),在服用apitegromab的24個月中繼續觀察到劑量反應,有跡象表明,隨着最初接受低劑量治療的非門診患者轉向高劑量治療,HFMSE可能會進一步增加。
3型SMA的24個月非卧牀患者(隊列1)的數據表明,接受20 mg/kg的apitegromab和Nusinesen的患者的修訂Hammersmith Scale(“RHS”)評分是穩定的。24個月時,平均RHS較基線的變化,阿替格羅布和努辛那森組(n=10)為-0.7分(95%CI:-3.1,1.7),單用組(n=11)為-2.8分(95%CI:-8.4,2.8)。隊列1中的一組個體(n=21)RHS有所改善,42.9%(9/21)和23.8%(5/21)的患者≥1點和≥3點RHS在24個月時較基線分別增加。
20