

臨牀階段神經病學公司專注於神經元興奮性障礙公司報告|2022年11月14日

前瞻性陳述本演示文稿包含涉及重大風險和不確定性的前瞻性陳述。本陳述中除有關歷史事實的陳述外,包括有關我們未來財務狀況、經營結果、業務戰略和計劃以及未來經營的管理目標的陳述,以及有關行業趨勢的陳述,均為前瞻性陳述。在某些情況下,您可以通過“預期”、“相信”、“繼續”、“可能”、“估計”、“預期”、“打算”、“可能”、“計劃”、“潛在”、“預測”、“應該”、“將會”或這些術語的否定或其他類似表述來識別前瞻性陳述。這些前瞻性陳述主要基於我們目前對未來事件和趨勢的預期和預測,我們認為這些事件和趨勢可能會影響我們的財務狀況、經營結果、業務戰略和財務需求。這些前瞻性聲明會受到大量風險、不確定性和假設的影響,其中包括但不限於以下風險:我們的產品開發活動和臨牀試驗的成功、成本和時機;我們對獲得監管批准的時間和我們的開發計劃的成本的預期;我們為公司的運營獲得資金的能力,包括完成候選產品的進一步開發和商業化所需的資金;新冠肺炎大流行對我們運營的影響;如果獲得批准,我們的候選產品的商業化;我們的候選產品的研究、開發和商業化計劃;我們開發更多候選產品的計劃;我們獲得、維護、擴展的能力, 保護和執行我們的知識產權;我們在不侵犯、挪用或以其他方式侵犯第三方知識產權的情況下運營我們業務的能力;我們吸引具有開發、監管和商業化專業知識的合作者的能力;我們與第三方就候選產品商業化達成的未來協議;我們候選產品市場的規模和增長潛力,以及我們為這些市場提供服務的能力;我們候選產品被市場接受的速度和程度;美國和外國的監管發展;監管申請、審查和批准過程以及我們遵守適用的法律和監管要求的情況;我們與第三方供應商和製造商簽訂合同的能力及其充分表現的能力;已經或可能獲得的競爭產品的成功;以及我們吸引和留住關鍵科學或管理人員的能力。這些風險並非包羅萬象。新的風險因素不時出現,我們的管理層無法預測所有風險因素,我們也無法評估所有因素對我們業務的影響,或任何因素或因素組合可能導致實際結果與任何前瞻性陳述中包含或暗示的結果大不相同的程度。有關埃利姆面臨的風險和不確定因素的更多信息,載於埃利姆截至2022年9月30日的季度10-Q表格季度報告中的“風險因素”標題下,該報告可在美國證券交易委員會網站www.sec.gov上查閲。, 在隨後的其他報告和文件中,埃利姆將不時向美國證券交易委員會提交報告。你不應該依賴前瞻性陳述作為對未來事件的預測。儘管我們認為前瞻性陳述中反映的預期是合理的,但我們不能保證未來的結果、活動水平、業績或成就。除法律另有規定外,我們沒有義務在本演示文稿發表之日後以任何理由公開更新任何前瞻性陳述。本演示文稿中包含的某些信息涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及公司自己的內部估計和研究。雖然我們相信這些第三方消息來源在本演示文稿發表之日是可靠的,但我們尚未對從第三方消息來源獲得的任何信息的充分性、公平性、準確性或完整性進行獨立核實,也不作任何陳述。此外,本演示文稿中包含的所有市場數據都涉及一些假設和限制,不能保證這些假設的準確性或可靠性。此外,對我們未來表現的預測、假設和估計,以及我們經營的市場的未來表現,必然受到高度不確定性和風險的影響。這些因素和其他因素可能導致結果與獨立各方和我們所作估計中的結果大相徑庭。最後,雖然我們相信我們自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。此外,“我們相信”的聲明和類似的聲明反映了我們對相關主題的信念和意見。這些陳述是基於截至本演示文稿發表之日我們掌握的信息。, 雖然我們認為這些信息構成了此類聲明的合理基礎,但此類信息可能是有限或不完整的,我們的聲明不應被解讀為表明我們已對所有可能獲得的相關信息進行了詳盡的調查或審查。這些陳述本質上是不確定的,告誡投資者不要過度依賴這些陳述。

經驗豐富的管理團隊基於臨牀驗證的作用機制的臨牀和臨牀前流水線抑鬱症和癲癇的兩個差異化計劃,在慢性疼痛反思神經系統疾病的治療中有擴展機會*現金、現金等價物和短期和長期有價證券截至2022年9月30日為1.296億美元~1.3億美元*進入2025年的現金跑道使臨牀數據讀出和臨牀前資產進入臨牀

首席開發官Mark Versavel,M.D.,Ph.D.首席開發官Robert Azelby,MBA首席運營官兼首席財務官James Bucher,J.D.執行副總裁兼總法律顧問在神經科學研究、臨牀開發和商業化方面擁有深厚的專業知識Lyrica,Neurontin,Trobalt,Vyepti,Vixotrigine,Nimotop,Aptiom,Lunesta,Geodon在大型製藥和小型生物技術方面的領導經驗:Amgen,GSK,Novartis,Biogen,Bayer,Pfizer Small:Alder,Juno,Converging,Cavion,Exelix在公共/私人融資和企業發展方面擁有高度熟練的技能,成功退出:Alder,Conversion,Juno,免疫醫學,Cascadian,Cavion 4
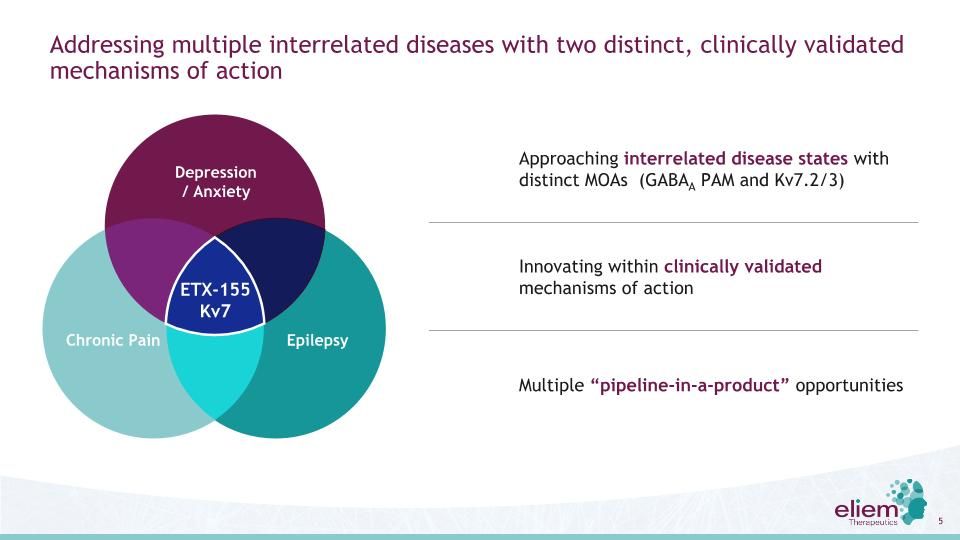
通過兩種不同的、經臨牀驗證的作用機制應對多種相互關聯的疾病利用不同的MOA(GABAA PAM和Kv7.2/3)接近相互關聯的疾病狀態在經臨牀驗證的作用機制內進行創新多個“產品中的管道”機會慢性疼痛癲癇抑鬱/焦慮ETX-155 KV7
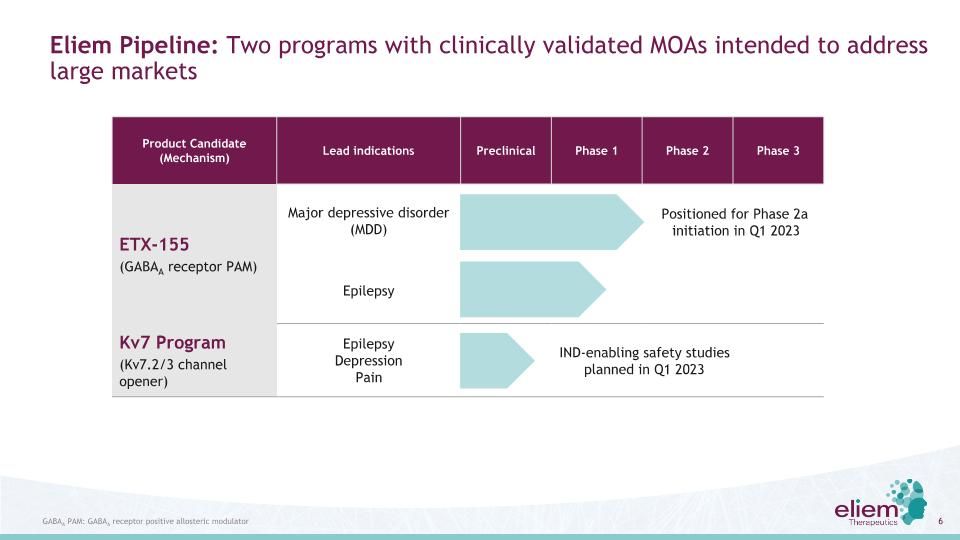
候選產品(機制)領先適應症臨牀前階段1階段2階段3 ETX-155(GABAA受體PAM)嚴重抑鬱障礙(MDD)癲癇KV7計劃(Kv7.2/3通道開放劑)癲癇抑鬱疼痛Eliem管道:兩個具有臨牀驗證的MOA的計劃旨在滿足大市場GABAA PAM:GABAA受體陽性變構調節劑Ind-Enabling安全性研究計劃於2023年第1季度進行,2a階段將於2023年第1季度啟動

ETX-155概念驗證階段2a重大抑鬱障礙(MDD)試驗定於2023年第一季度啟動
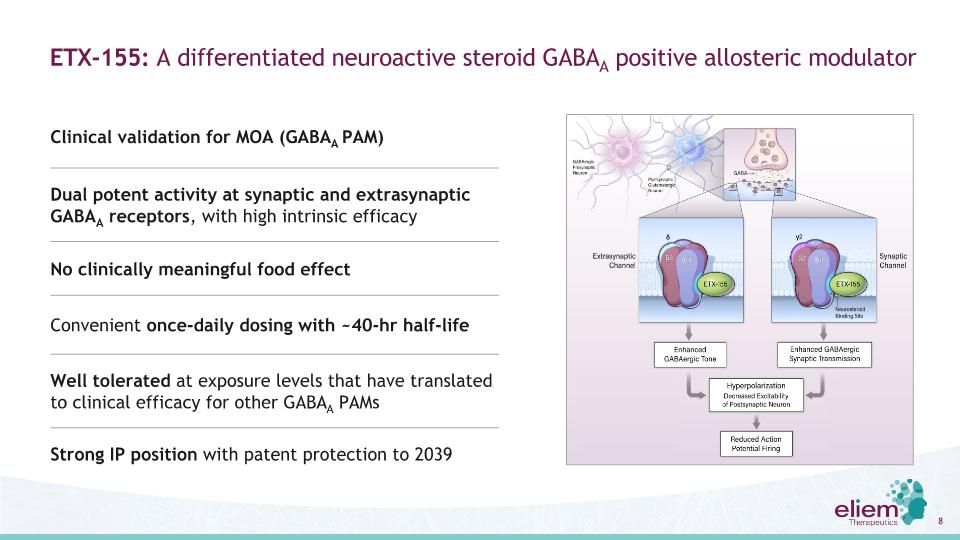
ETX-155:一種分化的神經活性類固醇GABAA陽性變構調節劑,在突觸和突觸外的GABAA受體上具有雙重潛在活性,具有高的內在效力,在暴露水平下耐受性良好,已轉化為對其他GABAA PAM的臨牀療效沒有臨牀意義的食物效應方便的每日一次,約40小時半衰期強IP位置,專利保護2039年MOA的臨牀驗證(GABAA PAM)
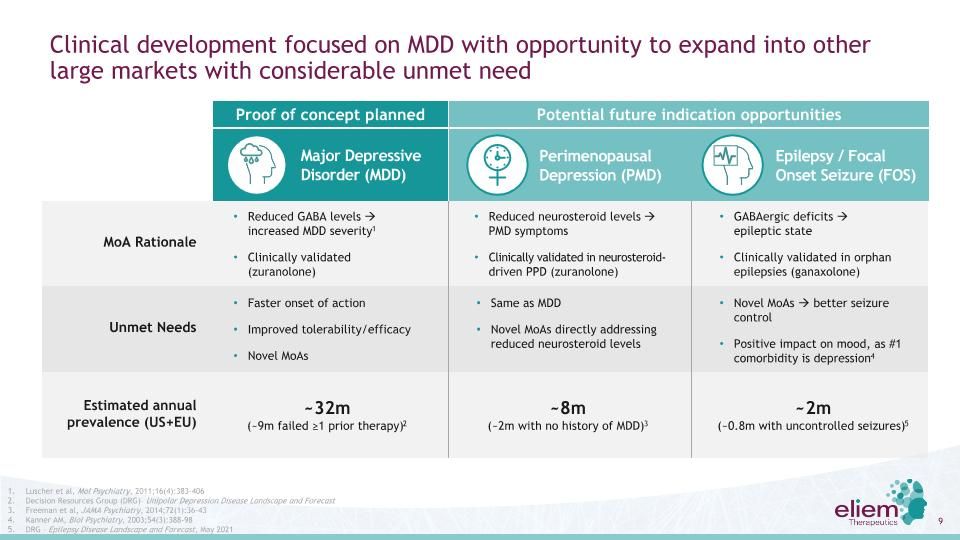
臨牀開發專注於抑鬱症,並有機會擴展到其他有大量未滿足需求的大型市場圍絕經期抑鬱症估計年患病率(美國和歐盟)MOA基本原理未滿足的需求降低GABA水平增加MDD嚴重度1臨牀驗證(祖蘭諾酮)更快的起效改善耐受性/有效性新型MOA與MDD相同新型MOAS直接解決神經類固醇水平降低的PMD症狀臨牀驗證神經類固醇驅動的產後抑鬱(祖拉諾龍)~32M(~9M失敗的≥1先前治療)2~8M(~2M無MDD病史)3 GABA氣缺陷癲癇狀態臨牀驗證孤兒(甘納洛酮)新型對情緒、癲癇控制的積極影響由於共病排名第一的是抑鬱4~2m(~0.8m伴有失控癲癇)5癲癇/癲癇發作(FOS)嚴重抑鬱障礙(MDD)Luscher等人,Mol精神病學,2011年;16(4):383-406決策資源小組(DRG)-單相抑鬱疾病前景和預測弗里曼等人,《美國醫學會精神病學》,2014;72(1):36-43 Kanner AM,生物精神病學,2003;54(3):388-98 DRG-癲癇疾病前景和預測,2021年5月概念驗證計劃潛在的未來適應症機會

公司分子GABAAR效力藥代動力學半衰期臨牀驗證(陽性隨機對照試驗)突觸外食物效應半衰期MDD PPD癲癇ETX-155否~40小時---祖蘭諾龍(SAGE-217)是14-18小時-ZTALMY®(加納鬆龍)是2-3小時--資料來源:祖拉諾龍:霍夫曼等,臨牀藥代動力學,2020年;59(1):111-120;霍夫曼等,ASCP 2018,海報#782;Boella et al,J Med Chem,2017;60(18)7810-7819;第三階段瀑布數據發佈:GanaxoloneHulihan等人,美國癲癇學會2020年年會,Poster*Evening Qd劑量for ETX-155,Zuranolone;TID劑量for ganaxolone ETX-155 Differential:類似於臨牀驗證的GABAA PAM的雙重GABAAR效力,具有不同的藥代動力學
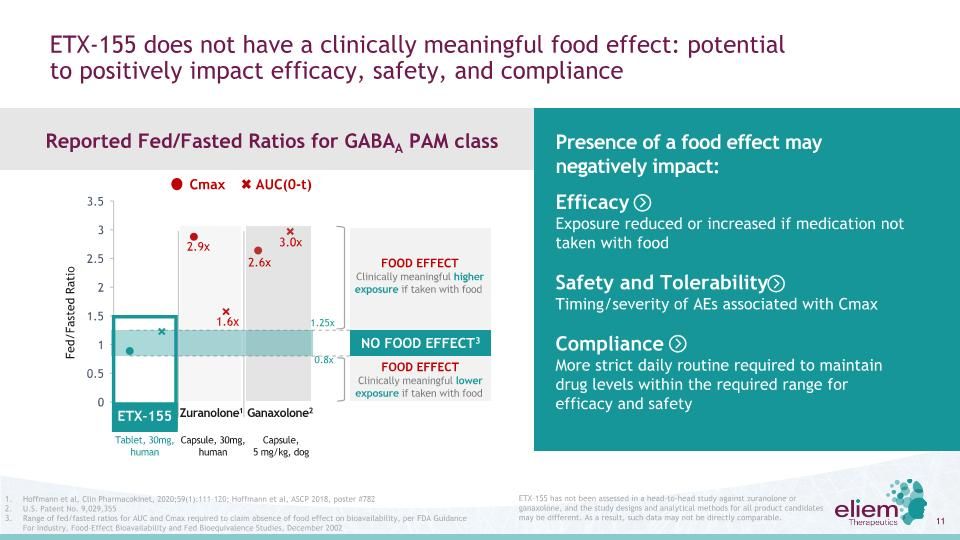
ETX-155沒有臨牀上有意義的食品效應:ETX-155對有效性、安全性和遵從性的潛在影響尚未在與祖蘭諾酮或甘納鬆龍進行的面對面研究中進行評估,所有候選產品的研究設計和分析方法可能是不同的。因此,這樣的數據可能無法直接進行比較。食品效應的存在可能會產生負面影響:有效性如果不按照食品安全和耐受性時機/嚴重程度服藥,暴露減少或增加與Cmax遵從性相關的不良反應需要更嚴格的日常程序,以將藥物濃度維持在有效性和安全性所需的範圍內1,Zuranolone 1 Ganaxolone 2無食品EFFECT3 ETX-155 AUC(0-t)Cmax食品效應臨牀有意義的高暴露如果與食品一起服用,臨牀有意義的暴露1.25x0.8x1.6x2.9x2.6x3.0x進食/空腹比片劑,30 mg,人體膠囊,30 mg,人體膠囊,5 mg/公斤,人體膠囊Dog報告了GABAA PAM類別Hoffmann等人的FED/FAST比率,Clin Pharmaco kinet,2020;59(1):111-120;Hoffmann等人,ASCP 2018,Poster#782,美國專利號9,029,355根據FDA工業、食品效應生物利用度和FED生物等效性研究指南,要求AUC和Cmax的進食/禁食比率範圍,2002年12月
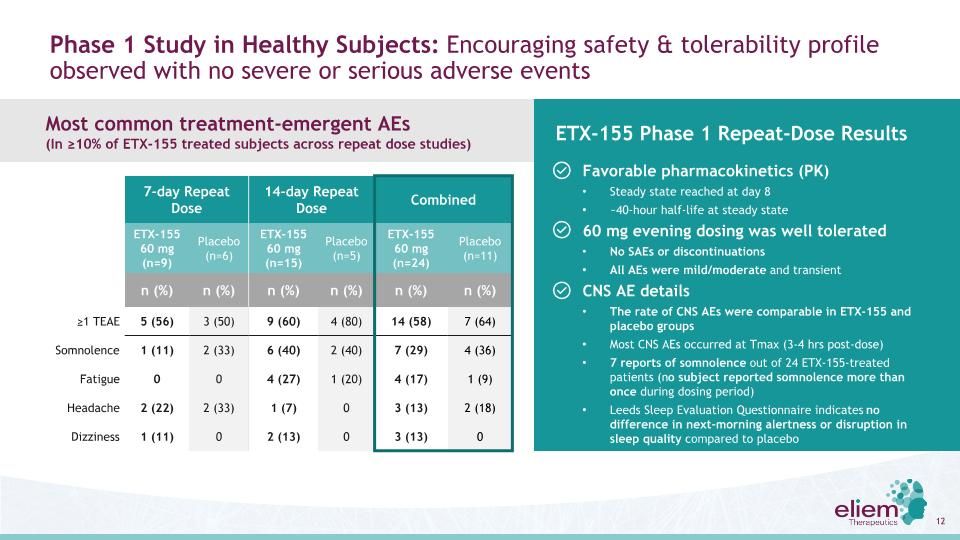
健康受試者的第1階段研究:觀察到令人鼓舞的安全性和耐受性,沒有嚴重或嚴重的不良事件ETX-155第1階段重複給藥結果有利的藥代動力學(PK)在第8天~40小時穩定半衰期穩定在穩態60 mg晚間給藥耐受性良好無SAE或停藥所有AEs均為輕/中度和一過性CNS AEs發生率ETX-155組與安慰劑組相似大多數CNS AEs發生在Tmax(服藥後3-4小時)在24名接受ETX-155治療的患者中有7例嗜睡報告(無報道超過嗜睡)利茲睡眠評估問卷顯示,與安慰劑7天重複劑量14天重複劑量聯合服用etx-155 60 mg(n=9)安慰劑(n=6)etx-155 60 mg(n=15)安慰劑(n=5)etx-155 60 mg(n=24)安慰劑(n=11)n(%)≥1TEAE 5(56)3(50)9(60)4(80)14(58)相比,第二天早上的警覺性或睡眠質量中斷沒有差別7(64)嗜睡1(11)2(33)6(40)2(40)7(29)4(36)疲勞0 04(27)1(20)4(17)1(9)頭痛2(22)2(33)1(7)03(13)2(18)頭暈1(11)02(13)03(13)0最常見的緊急治療不良反應(在重複劑量研究中,≥為10%)

對ETX-155藥代動力學曲線的分析證實,不同批次獲得的60 mg可比暴露,使2a期MDD試驗的路徑向前推進最初的第一階段研究PSE研究結果(4月22日)廣泛調查SAD(5-200 mg,n=6個活動/隊列)MAD 7天(60 mg AM和PM,n=9個活動/隊列)MAD 14天(60 mg PM,n=15個活動/隊列)耐受性良好,特別是PM劑量鼓勵PK曲線中等CV%~30%的半衰期~40小時的穩定狀態在第8天中等Acc。在臨牀前療效範圍內的~2無食物效應暴露的比率允許選擇2期臨牀劑量60 mg單劑135 mg N=3名光敏性癲癇患者在此模型中的活動評估由於~50%的暴露低於預期而不確定實現計劃的2a期MDD試驗促使在進行MDD試驗之前進行調查以瞭解潛在的根本原因在所有批次的原料藥和DP上進行CMC調查無發現狗PK比較所有批次的臨牀前暴露可比的5批健康受試者的暴露以確認PK特徵在具有變異性的批次中,基於原始的第一階段數據,將所有批次的暴露與總體PK模型進行適度比較,60毫克的暴露符合重複劑量隊列中評估75毫克的模型,以基於有利的暴露和相對於75毫克劑量的AE分佈來確定相對於為2a階段選擇的60毫克60毫克劑量的任何優勢
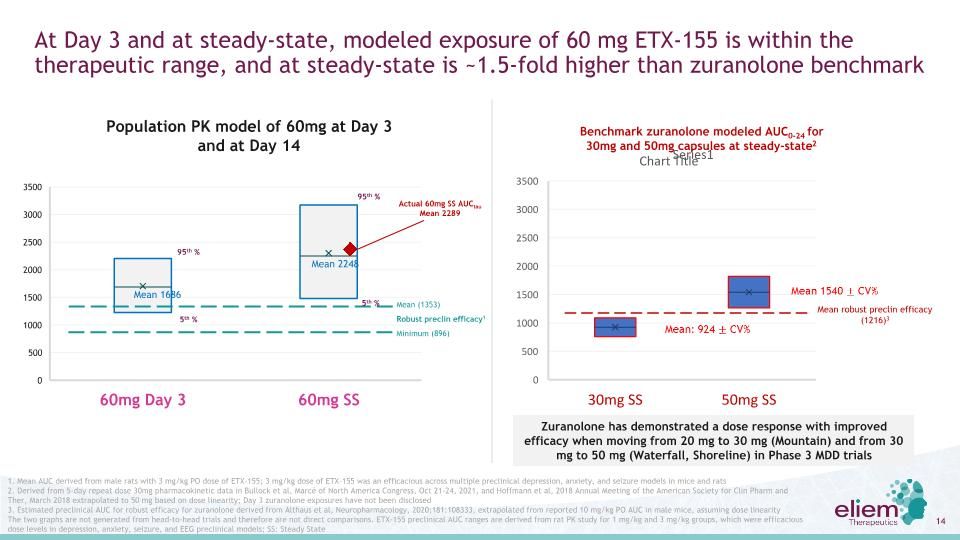
羣體PK模型在第3天60 mg,第3天第14天,穩態時,60 mg ETX-155的模型暴露在治療範圍內,穩態時比Zuranolone基準平均值2248平均值1686(1353)穩健的前排有效值高~1.5倍。1最小(896)實際60 mg SS AUCtau平均值2289 5%95%5%95%1.平均AUC來自雄性大鼠,3 mg/kg PO劑量ETX-155;3 mg/kg劑量的ETX-155對小鼠和大鼠的多種臨牀前抑鬱、焦慮和癲癇模型是有效的2.根據2021年10月21-24日北美國會的Bullock等人和Hoffmann等人的5天重複劑量30 mg藥代動力學數據,根據劑量線性將2018年3月美國臨牀藥物學會年會外推到50 mg;第3天zuranolone暴露尚未披露3.根據Althaus等人的神經藥理學,2020年的Zuranolone強大療效的臨牀前AUC估計;181:108333,從已報道的雄性小鼠的10 mg/kg PO AUC推斷,假設劑量線性這兩個曲線圖不是從正面試驗產生的,因此不是直接比較。ETX-155臨牀前AUC範圍來自對1 mg/kg和3 mg/kg組的大鼠PK研究,這是抑鬱症、焦慮、癲癇和EEG臨牀前模型的有效劑量水平;SS:穩態基準Zuranolone模擬AUC0-24為30 mg和50 mg膠囊在穩態2平均154CV%平均:924%平均穩健的Preclin療效(1216)3 Zuranolone在第三階段MDD試驗中顯示出從20 mg到30 mg(Mountain)和從30 mg到50 mg(瀑布和海岸)的劑量效應
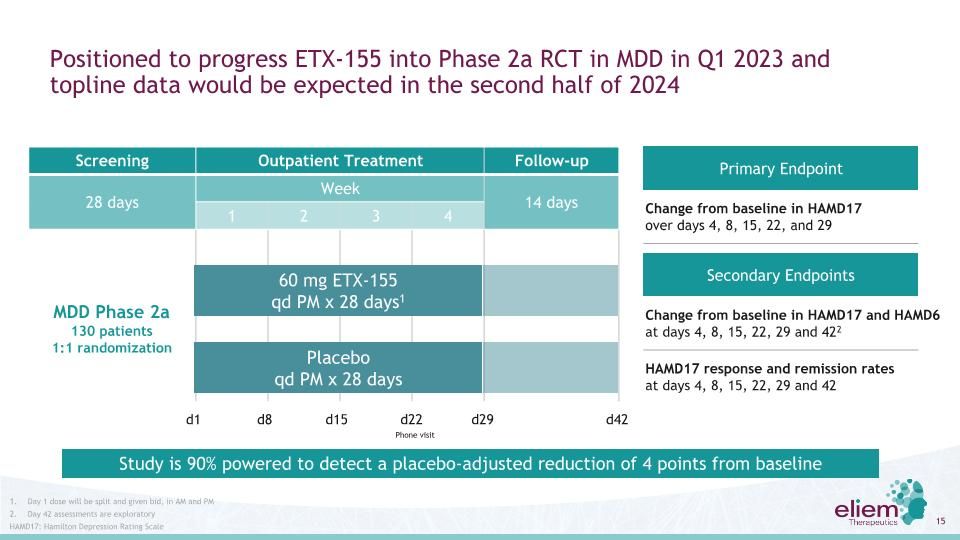
預計ETX-155將在2023年第一季度進入MDD的2a階段RCT,預計2024年下半年將獲得TOPLINE數據篩查門診治療隨訪28天每週14天1 2 3 4 60 mg ETX-155 QD PM x 28天MDD 2a階段130名患者1:1隨機化d1 d8 D15 D22 d29 D42 HAMD17的主要終點與基線在4、8、15、22和29天HAMD17和HAMD6的基線在4、8、15、22、29和422天HAMD17的反應和緩解率在4、8、15、22和29天的HAMD17和HAMD6的基線變化29天和42天的第一天劑量將分開並給予BID,在AM和PM的第42天評估是探索性的HAMD17:漢密爾頓抑鬱評定量表研究有90%的力量來檢測安慰劑調整後比基線電話訪問減少4分

ETX-155減少2a期安慰劑變異性和安慰劑反應的策略:ETX-155比率1:1(50%得到安慰劑)大型、動力充足的研究在一個地理位置選擇有經驗的地點(美國)最大限度地減少評估和訪問次數研究人員、研究人員和受試者關於HCP提供的臨牀研究和護理之間的差異的視頻教育,納入/排除標準密切監測研究藥物依從性(AiCure APP)和eDiary獨立SAFER流程:MGH臨牀醫生面談以確認HAMD-17臨牀評估和試驗資格每次就診時使用的安慰劑對照提醒腳本不包括在篩查和基線評估之間HAMD-17評分發生重大變化(增加/減少)的患者如果目前正在服用抗抑鬱藥物,受試者必須在基線評估之前至少4周處於穩定劑量

ETX-155市場機遇

美國三分之一(700萬)接受≥治療的患者機會在二線及以上二線(失敗的1個ADT級別)診斷和藥物治療的MDD患者三線+MDD(失敗的ADT級別)210萬460萬250萬美國流行病學,2030年估計2100-210億美元二線+品牌的總機會來源:DRG單相抑鬱疾病前景和預測,2021年假設WAC為6,000美元,治療/年6個月MDD藥物銷售高峯年Lexapro SSRI$3.0B 2011年Effexor SNRI$2.7B 2008 Zoloft SSRI$2.6B Cymta SSRI$2.4B 2001年
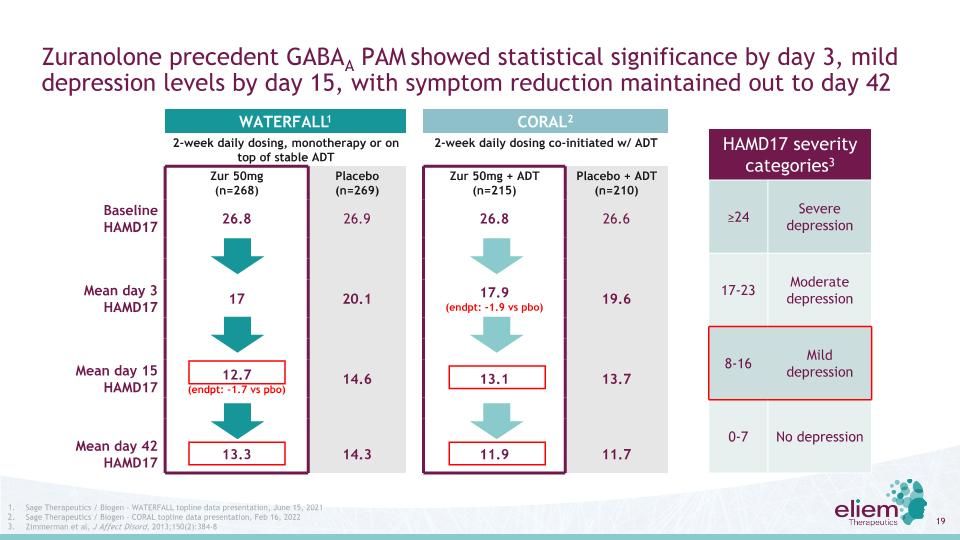
Zuranolone先例GABAA PAM在第3天顯示有統計學意義,第15天顯示輕度抑鬱水平,症狀緩解持續到第42天WATERFAL1 CORAL2每日服藥2周,單一治療或在穩定的ADT基礎上每日服用ADT 2周聯合開始服用Zur 50 mg(n=268)安慰劑(n=269)Zur 50 mg+ADT(n=215)安慰劑+ADT(n=210)基線HAMD17 26.8 26.9 26.8 26.6平均第3天HAMD17 17 20.1 17.9(結束:-1.9 vs PBO)19.6平均15天HAMD17 12.7(結束:-1.7 vs PBO)14.6 13.1 13.7平均42天HAMD17 13.3 14.3 11.9 11.7 HAMD17嚴重程度類別3≥24重度抑鬱17-23中度抑鬱8-16輕度抑鬱0-7無抑鬱聖人治療/生物遺傳瀑布背線數據,2021年6月15日Sage治療/生物遺傳-珊瑚背線數據展示,2022年2月16日,Zimmerman等人,J Effect Disord,2013;150(2):384-8

Zuranolone的先例表明,相對於現有ADT,GABAA PAM的潛在優勢在“直接面向患者”的商業市場中將具有吸引力。潛在的差異點“治療抑鬱發作”:Zuranolone使用為期兩週的方案,80%的患者在一年中只需要4周的治療。起效迅速:Zuranolone在第3天達到活動,沒有滴定,這應該使患者在兩週內知道產品是否有效:嗜睡/疲勞,但沒有體重增加,性功能障礙,在Zuranolone試驗中觀察到的停藥或停藥增強了依從性:兩週的療程應顯著改善依從性,短的治療持續時間與快速起效相結合使劑量與抑鬱發作背景一致SSRI的治療持續時間未定義-許多服用SSRI多年/生命的SSRI的患者可能需要6至8周才能起作用,如果他們有效的話;不包括滴定期的副作用,包括體重增加,性功能障礙,戒斷症狀不滿意市場對新的MDD患者的治療~5.5個月,依從率在16周為51%,在第331周為21%1。Sawada等,BMC精神病學,2009;9(38)。

ETX-155:被開發為一種潛在的臨牀分化口服神經活性類固醇提高療效在耐受性良好的劑量下觀察到的AUC增加了有臨牀意義的食物效應顯着延長了半衰期ETX-155機會提高了健康受試者的耐受性CNS AE率與安慰劑相似在睡眠質量和第二天警覺性方面與安慰劑沒有差異在重複給藥研究中沒有報道超過一天的嗜睡改善耐受性評估更長的給藥方案(即28天)陳述不是基於頭對頭試驗的數據,也不是安全性或有效性的直接比較

KV7開幕式預選對象確定計劃於2023年第一季度進行的啟用IND的安全研究

Kv7.2/3計劃:為多個神經元興奮性指徵開發一種差異化的Kv7.2/3開放劑,為兩名預選對象啟動IND使能研究;IND-Enabling安全性研究將於2023年第一季度開始Eliem KV7計劃目標KV7機會計劃狀態通過改善耐受性和安全性維持療效新的化學空間中的多個候選鉛和備份改善代謝穩定性在Kv7.2/3、選擇性VS Kv7.1/4和活躍在MES大鼠模型中*人類基因驗證在疼痛和癲癇(替加賓、氟平汀、XEN1101)中的強大臨牀驗證疼痛和癲癇(瑞加賓、氟平汀、XEN1101)明確的臨牀療效代謝/安全責任與現有分子基礎IP檔案*MES:最大電休克發作,一種臨牀前模型,其療效已被歷史證明對反覆發作的人類高度可傳遞
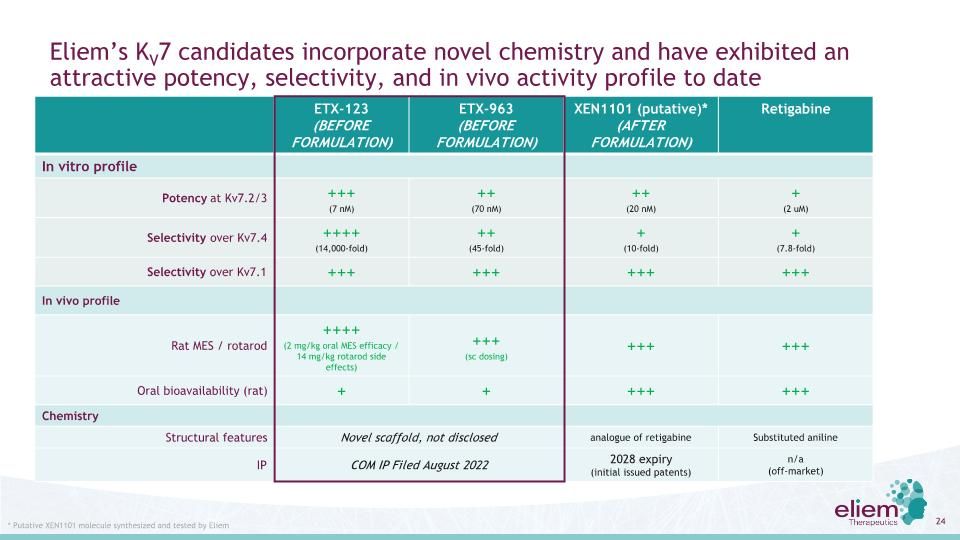
埃利姆的KV7候選者結合了新的化學物質,並展示了誘人的效力、選擇性到目前為止,由Eliem ETX-123(配方前)ETX-963(配方前)XEN1101(配方前)XEN1101(配方後)合成並測試了*可能的XEN1101分子體外活性譜Kv7.2/3+(7 Nm)++(70 Nm)++(20 Nm)+(2 Nm)對Kv7.4+(14,000倍)+(45倍)+(10-倍)+(7.8倍)對Kv7.1+的體外活性譜2 mg/kg口服MES療效/14 mg/kg羅非羅德副作用)+++(sc劑量)+++口服生物利用度(大鼠)+++化學結構特徵新型支架,2022年8月提交的未披露的雷替加賓取代苯胺類IP COM IP到期(最初頒發的專利)不適用(非市場)
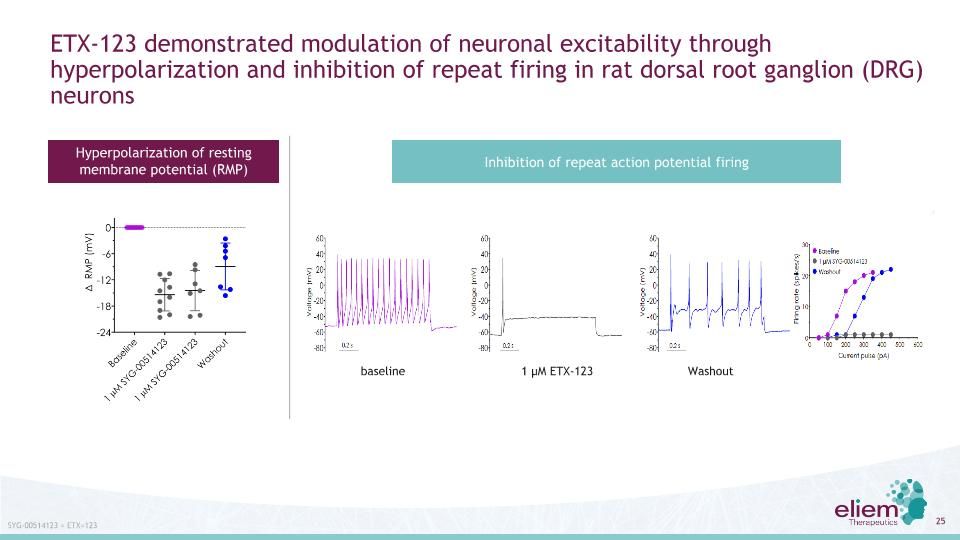
Etx-123通過超極化和抑制大鼠背根神經節神經元的重複放電來調節神經元的興奮性靜息膜電位的超極化抑制重複動作電位的激發syg-00514123=etx=123基線1μ

ETX-123證明,在大鼠MES模型中抑制強直性驚厥的劑量與在旋轉棒模型中引起副作用的劑量之間存在7倍的分離ETX-123(毫克/公斤口服)瑞格他濱POS對照(毫克/公斤口服)ETX-123迄今證明瞭良好的體內療效/耐受性;額外的口服處方優化和IND使能研究正在進行中的大鼠最大電休克發作(MES)模型在大鼠旋轉棒模型中耐受性良好*V 0.5 2 8 14.50%的動物0 25 50 75 100*p

經驗豐富的管理團隊基於臨牀驗證的作用機制在抑鬱症和癲癇方面有兩個差異化的計劃,在慢性疼痛反思神經系統疾病的治療方面有擴展機會約1.3億美元*進入2025年的現金跑道使臨牀數據讀出和臨牀前資產進入臨牀的進展*現金、現金等價物以及截至2022年9月30日的1.296億美元的短期和長期有價證券

欲瞭解更多信息,請登錄:www.eliemtx.com InvestorRelations@eliemtx.com

備份

全面的根本原因調查沒有發現任何CMC差異或與任何批次或片劑大小活動暴露的問題進行結果CMC調查原料藥和DP批次的粒度分佈、掃描電子顯微鏡、調製差示掃描量熱法、粉末X射線衍射、Zeta電位、溶出度、晶體材料的存在、輥壓、壓縮文件審查在3個不同批次之間沒有發現差異,在執行批次記錄或臨牀試驗文檔中沒有記錄偏差沒有質量事件或製造或劑量錯誤的證據臨牀前暴露比較(狗PK)6個隊列n=6只狗,比較所有藥品批次之間的暴露(2020,2021年和2022年)和片劑大小任何批次和片劑大小之間的暴露沒有差異被測試的臨牀暴露比較(HV PK)完成了5個單劑量隊列(n=19-24,總共42人蔘與幾個隊列)60 mg(4個隊列)和75 mg(一個隊列)計劃重複劑量隊列,75 mg,11月的數據(n≤18)在所有批次和片劑大小之間60毫克的暴露沒有差異單一劑量變異性仍然是適度的總體PK模型比較所有批次和片劑大小的暴露量與使用原始第一階段數據建立的PopPK模型的數學分析從正在進行的HV研究中獲得的60毫克暴露數據與POP PK模型相比在數學分析上沒有差異
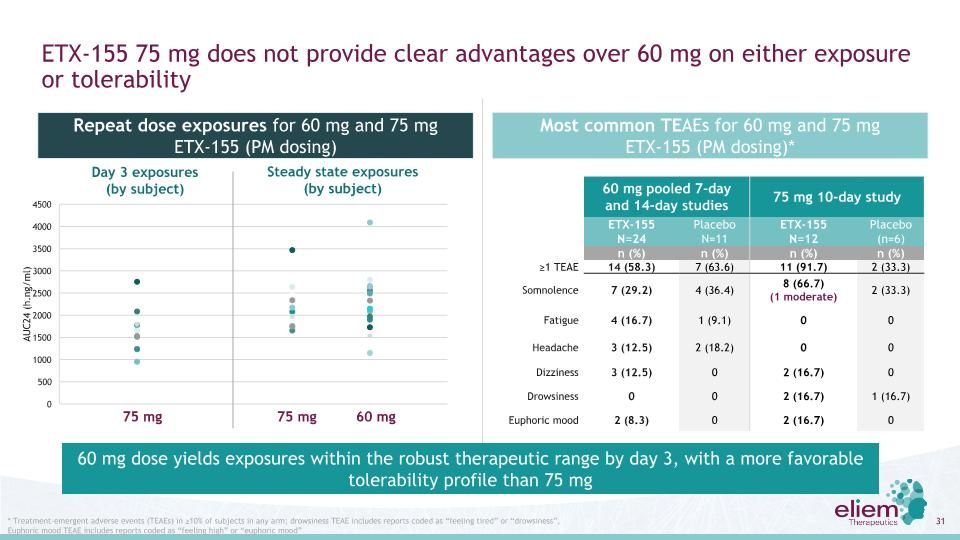
ETX-155 75毫克在暴露或耐受性方面沒有提供超過60毫克的明顯優勢60毫克7天和14天聯合研究75毫克10天研究ETX-155 N=24安慰劑N=11 ETX-155 N=12安慰劑(n=6)n(%)≥1 TEAE 14(58.3)7(63.6)11(91.7)2(33.3)嗜睡7(29.2)4(36.4)8(66.7)(1中等)2(33.3)疲勞4(16.7)1(9.1)00頭痛3(12.5)2(18.2)0 0頭暈3(12.5)02(16.7)0嗜睡0 02(16.7)1(16.7)欣快情緒2(8.3)0.2(16.7)0.75 mg 75 mg 60 mg第三天暴露(按受試者)穩定暴露(按對象)重複劑量暴露60毫克和75毫克ETX-155(PM劑量)最常見的TEAE為60Mg和75 mg ETX-155(PM劑量)**治療-≥中10%的受試者出現緊急不良事件(TEAE);昏昏欲睡TEAE包括編碼為“感覺疲倦”或“昏昏欲睡”的報告,愉悦情緒TEAE包括編碼為“感覺高漲”或“愉悦情緒”的報告60毫克劑量在第3天時暴露在強健的治療範圍內,其耐受性比75毫克更有利
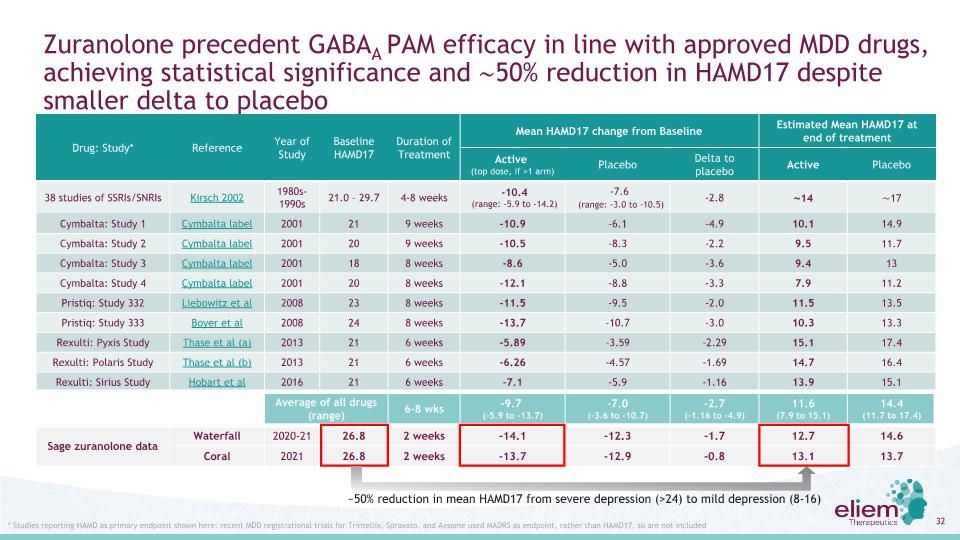
Zuranolone先例GABAA PAM的療效與批准的MDD藥物一致,實現了統計學意義,HAMD17降低了約50%,儘管與安慰劑藥物的差值較小:研究*參考年份研究基線HAMD17治療持續時間平均HAMD17與治療結束時基線估計平均HAMD17的變化(最大劑量,If>1 ARM)安慰劑Delta到安慰劑活性安慰劑38項SSRIs/SNRIs Kirsch研究2002 1980-1990 21.0-29.7 4-8周-10.4(範圍:-5.9至-14.2)-7.6(範圍:-3.0至-10.5)-2.8~14~17 Cymbalta:研究1 Cymbalta Label 2001 21 9周-10.9-6.1-4.9 10.1 14.9 Cymbalta:研究2 Cymbalta Label 2001 20 9 Week-10.5-8.3-2.2 9.5 11.7 Cymbalta:研究3 Cymbalta Label 2001 18 8周-8.6-5.0-3.6 9.4 13 Cymbalta Label 2001 20 8 Week-12.1-8.8-3.3 7.9 11.2 Pristiq:研究332 Liebowitz et al 2008 23 8 Week-11.5-9.5-2.0 11.5 13.5 Pristiq:Study 333 Boyer et al 2008 24 8 Week-13.7-10.7-3.0 10.3 13.3Rexulti:北極星研究Thase等人(A)2013年21 6周-5.89-3.59-2.29 15.1 17.4 Rexulti:北極星研究Thase等人(B)2013年21 6周-6.26-4.57-1.69 14.7 16.4 Rexulti:天狼星研究Hobart等人2016年21 6周-7.1-5.9-1.16 13.9 15.1所有藥物(範圍)平均6-8周-9.7(-5.9至-13.7)-7.0(-3.6至-10.7)-2.7(-1.16至-4.9)11.6(7.9至15.1)14.4(11.7至17.4)Sage Zuranolone數據瀑布2020-21 26.8 2周-14.1-12.3-1.7 12.7 14.6珊瑚2021 26.8 2周-13.7-12.9-0.8 13.113.7*此處顯示的報告HAMD為主要終點的研究;最近針對Trintellix、Spravato和Axome的MDD註冊試驗使用MADRS而不是HAMD17作為終點,因此不包括平均HAMD17從重度抑鬱症(>24)到輕度抑鬱症(8-16)減少約50%。

Zuranolone的海岸線研究證明瞭持久的效果,平均患者一年只需要~2個療程(~4周)~50毫克應答者中的80%*在一年內只需要1到2個療程來源:SAGE治療*只有初始治療期第15天的應答者(≥將HAMD17總分從基線下降50%)可以繼續在海岸線研究中重新治療~30毫克應答者中的70%*在第一次再治療的中位時間:249天到第一次再治療的中位時間:135天