| 納斯達克:mrns @MarinusPharma 圖片來源:凱利團隊攝影 瑞安(中) 患有CDKL5缺乏症 2022年第三季度 企業和財務動態 2022年11月 |
| ©2022年馬裏納斯製藥公司。保留所有權利i 如果本演示文稿中包含的陳述不是關於Marinus的歷史事實的描述,則它們是前瞻性陳述,反映了根據19年《私人證券訴訟改革法》的安全港條款作出的當前信念和對管理層的期望。“可能”、“將”、“預期”、“預期”、 “估計”、“打算”、“相信”等詞語以及類似的表述(以及其他涉及未來事件、ndi或情況的詞語或表述)旨在識別前瞻性表述。本演示文稿中包含的前瞻性陳述的示例包括:對我們2022年的預期收入和運營費用進行評估的聲明;我們對ZTALMY®的商業化計劃、加納鬆龍的臨牀開發計劃以及預期的時間;我們的預期和潛在的融資計劃;我們臨牀試驗中的預期劑量;臨牀開發時間表和里程碑;我們臨牀試驗中開始和完成的預期時間;預期的試驗設計、目標患者羣體和臨牀試驗的終點;解釋使用Ganaxolone的科學依據;VAI的時間選擇和數據發佈;Ganaxolone的潛在安全性和有效性以及治療潛力;ZTALMY將為患者和醫生提供的潛在益處的時機和預期 , 我們對ZTALMY One計劃的期望;對監管溝通和提交的時間和期望;對我們與BARDA協議的期望;對我們與獵户座 C 合作的期望 ;對我們候選產品的潛在市場機會的期望,包括口服加納鬆龍;潛在的商業聯盟;以及我們對COVID - 19大流行對我們業務和臨牀發展計劃影響的預期。本演示文稿中的前瞻性陳述涉及重大風險和不確定性,可能會導致我們的臨牀開發計劃、未來結果、績效或成就與前瞻性陳述中明示或暗示的內容大不相同。此類風險和不確定因素包括:與我們提供ZTALMY商業供應的能力、患者和醫生對ZTALMY的接受程度、我們為ZTA LMY獲得足夠的市場準入的能力有關的不確定性和延遲;我們在規定的時間範圍內遵守FDA對額外市場研究報告的要求的能力;監管申報的時間,包括向EMA提交Ganaxolone MAA的時間;包括FDA和EMA在內的監管當局可能不批准或可能推遲批准我們的候選產品;與設計、登記、完成有關的不確定性和延遲, 和 臨牀試驗的結果;意想不到的成本和費用;早期臨牀試驗可能不代表l 的臨牀試驗的結果;臨牀試驗結果可能不支持監管批准或在指定適應症上的進一步開發,或者根本不支持;FDA或EMA的行動或建議可能影響臨牀試驗的設計、 啟動、時間安排、繼續和/或進展 或導致需要額外的臨牀試驗;我們獲得和保持監管機構對我們的產品的批准的能力可以 直接;我們獲得、維護、保護和捍衞我們候選產品的知識產權的能力;第三方專利對我們或我們的合作伙伴將加納鬆龍商業化的能力的潛在負面影響;我們候選產品的製造和供應中的延遲、中斷或故障;我們候選產品的市場規模和增長潛力,以及我們為這些市場提供服務的能力;我們的 現金和現金等價物可能不足以支持我們的運營計劃長達預期;我們對費用、未來收入、資本需求以及額外資金的可用性和需求的預期和估計;我們獲得額外資金的能力 以支持我們的商業和臨牀開發計劃; Orion Corporation違反我們的合作協議或根據其t erm 終止協議的可能性;COVID - 19大流行對我們業務的影響, 醫學界, 監管機構和全球經濟;以及針對我們所針對的情況的替代產品或治療的可用性或潛在可用性,這些情況可能會影響我們候選產品的可用性或商業潛力。Marinus不承擔更新或修訂任何前瞻性聲明的義務。有關 可能導致實際結果與這些前瞻性陳述中所表達的結果不同的風險和不確定性的進一步描述,以及與我們業務相關的總體風險,請參閲我們提交給美國證券交易委員會的文件。您可以通過訪問SE C w EB站點www.sec.gov上的Edga免費訪問這些文檔。 安全港聲明 2 |
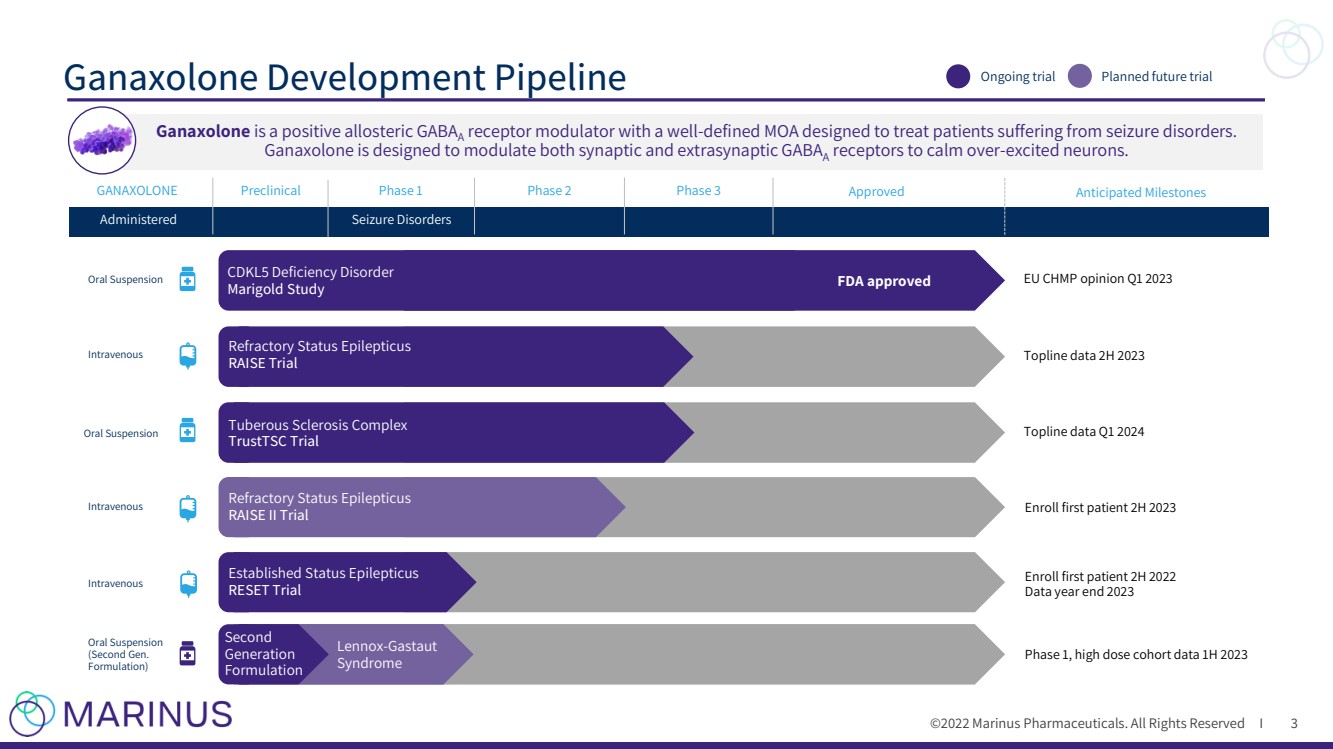
| ©2022年馬裏納斯製藥公司。保留所有權利i Ganaxolone開發管道 3 PDUFA日期2022年3月 MAA備案驗證Q4 2021 Ph3患者登記2022年第1季度 Topline Data 1H 2024 Ganaxolone 階段1 階段2 階段3 批准 口服Suspension Intravenous Intravenous Intravenous Oral暫停 (第二次Gen. Formulation) Administered Seizure疾病 口腔暫停 CDKL5缺乏症 萬壽菊研究 FDA批准 TOPLINE DATA 2H 2023 招收首位患者2023年2月 招收首位患者2022年2H 數據年終2023年 階段1,高劑量隊列數據1H 2023 TOPLINE DATA Q1 2024 正在進行的試驗 計劃中的未來trial Preclinical Lennox - Gastaut Syndrome Anticipated里程碑 歐盟CHMP意見Q1 2023 難治性癲癇狀態 RAISE試驗 結節硬化症複合體 TRUSTTSC試驗 已確定的癲癇狀態 重置Trial Second Generation Formulation Refractory狀態癲癇 RAISE II試驗 加納鬆龍 是一種正變構GABA 受體 調節劑,具有定義良好的MOA,用於治療癲癇患者。 Ganaxolone 旨在調節兩個突觸and extrasynaptic GABA A receptors,使 - 興奮的神經元平靜下來。 |
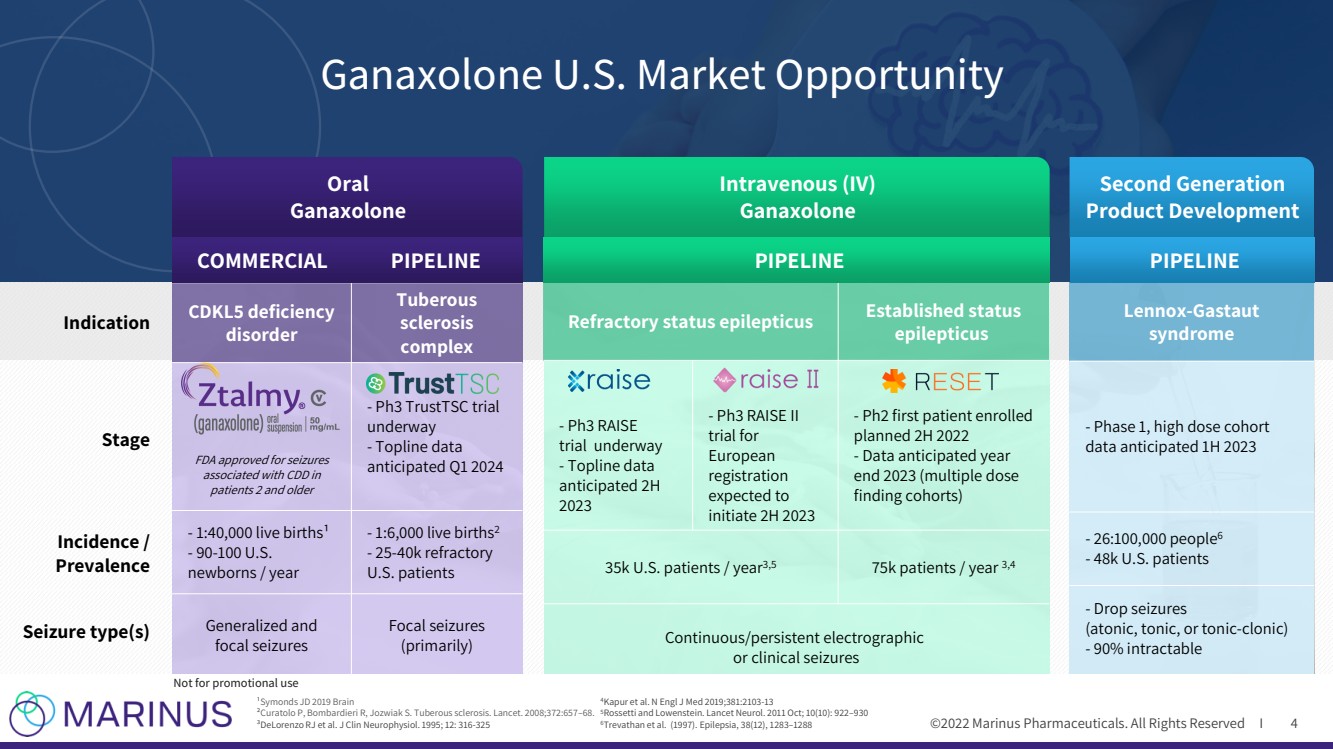
| ©2022年馬裏納斯製藥公司。保留所有權利:Symonds JD 2019 Brain(Symonds JD 2019 Brain)、Bombardieri(Br)R、Jozwiak(Br)S結節性硬化症。柳葉刀。2008;372:657 - 68.J Clin 神經生理素 。1995;12:316 - 325 4 Kapur 等人。N 工程師 J Med 2019;381:2103 - 13 5 Rossetti和Lowenstein。柳葉刀神經。2011年10月;10(10):922 - 930 6 Trevathan等人。(1997)。癲癇 ,38(12),1283年 - 1288 Ganaxolone 美國市場Opportunity Oral Ganaxolone Intravenous(IV) Ganaxolone 第二代產品開發 產品開發階段 發病率/患病率 癲癇類型 適應症 CDKL5 deficiency disorder Tuberous sclerosis complex FDA獲準用於2歲及以上患者與疾病相關的癲癇發作 Br}- Ph3 TrustTSC trial underway - Topline Data 預計2024年第1季度 - 1:40,1000活產 - 90 - 100美國 新生兒/年 - 1:6,000活產 2 - 25 - 40k難治性 美國患者 泛化和 局灶性癲癇發作 局灶性癲癇發作 難治性癲癇持續狀態 確診狀態 癲癇 - Ph3 Raise 試驗正在進行中 - Topline Data 預期2H 2023 - Ph3 Raise II 試驗}歐洲 登記 預計2023年下半年開始 - 計劃2022年下半年首次登記的PH2患者 - 預計2023年底的數據(多劑量 尋找隊列) 35k美國患者/年 3,5 75K患者/年 3,4 連續/持續腦電檢查 或臨牀seizures Lennox - Gastaut syndrome - Phase 1, 高劑量隊列 數據 預計2023年第一季度 - 26:100, 000人 6 - 48k美國患者 - 減少癲癇發作 (無張力、強直性或強直性 - 克隆 ) - 90%intractable COMMERCIAL PIPELINE PIPELINE PIPELINE Not用於促銷用途 |
| ZTALMY ® (Ganaxolone)口服混懸液簡歷 萬壽菊臨牀數據和商業發佈 不用於促銷用途 |
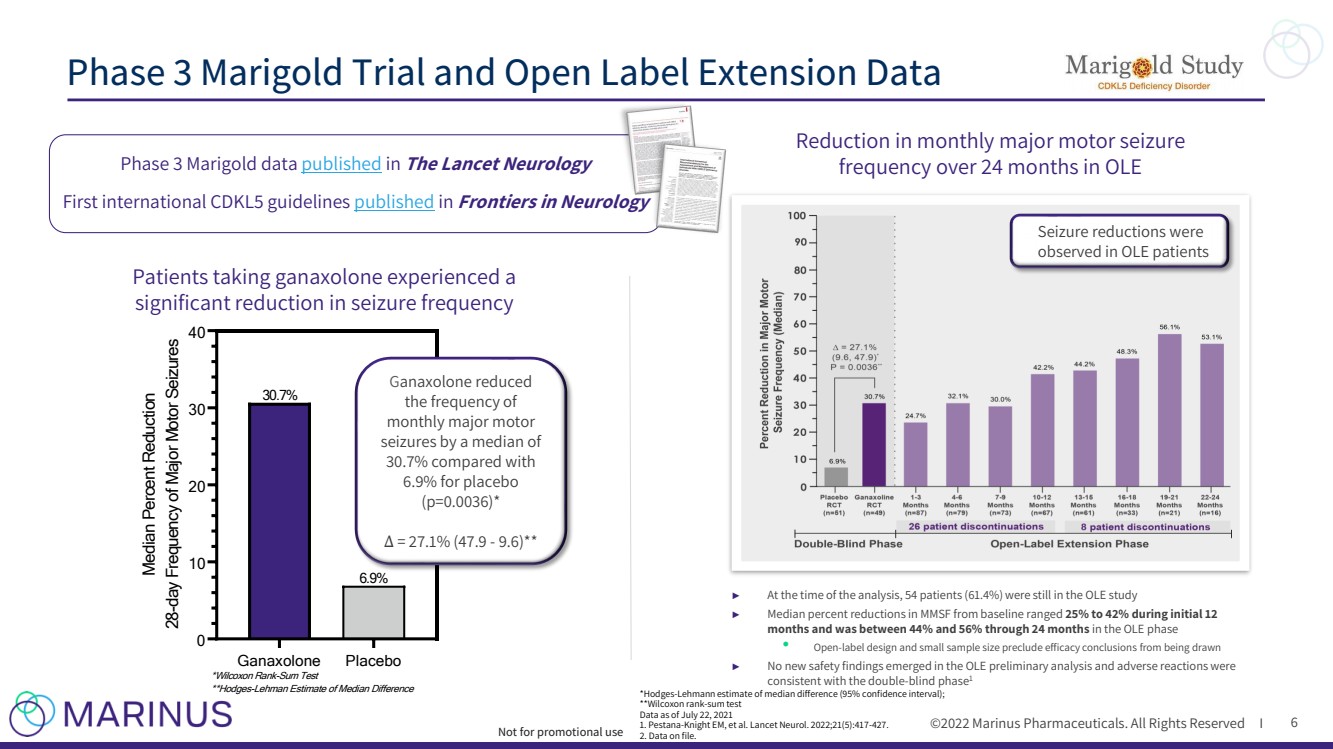
| ©2022年馬裏納斯製藥公司。所有權利保留I 6 Ganaxolone Placebo 0 10 20 30 40 Median減少百分比 28天主要運動性癲癇發作頻率 30.7% 6.9% *Wilcoxon秩和檢驗 **霍奇斯-萊曼估計中位數差異 服用加納鬆龍的患者癲癇發作頻率顯著減少 G 阿納索龍減少了頻率 每月主要運動性癲癇發作 的中位數為30.7%,而安慰劑組為6.9%(p=0.0036)*(47.9 - 9.6)* * *Hodges - Lehmann估計的中位數差值(95%可信區間)為27.1%Δ ; **Wilcoxon排名 - SUM測試 截至2021年7月22日的數據 1.Pestana - Knight EM等人。柳葉刀神經。2022年;21(5):417 - 427. 2.存檔數據。 在分析時,OLE ►中每月主要運動發作的頻率在24個月內減少了 54名患者(61.4%)仍在OLE研究中 ► 最初12個月中,MMSF較基線下降的中位數百分比為25%至42%,OLE階段為44%至56% · 開放 - 標籤設計和小樣本量排除了得出療效結論的可能性 ► 在OLE初步分析中未發現新的安全發現,不良反應與雙重試驗一致 - 盲期 在OLE患者中觀察到癲癇發作減少 3期萬壽菊數據 在 《柳葉刀神經病學》中發表了 首個國際CDKL5指南 在 神經病學前沿 3期 萬壽菊試驗和開放標籤擴展數據 不用於推廣用途 |
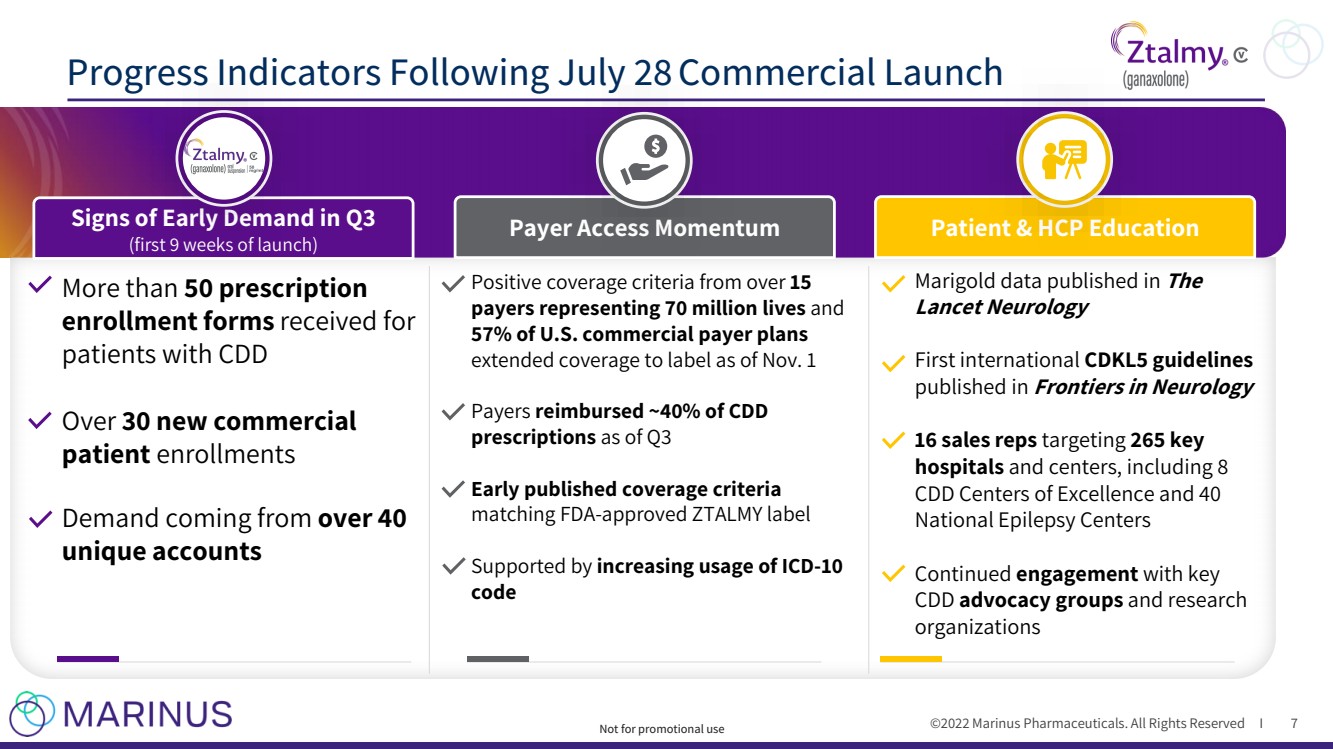
| ©2022年馬裏納斯製藥公司。保留所有權利i 7月28日商業發佈後的進度指標 7 超過 50張處方 CDD患者 收到了 30多個新的commercial patient enrollments Demand,來自 40 個獨立帳户 超過 15 支付者代表着7000萬人的生命 和 57%的積極覆蓋標準。商業支付者計劃 自11月1日起將承保範圍擴大至標籤 支付者 截至第三季度 已報銷約40%的CDD 處方 早期發佈的承保標準 與FDA - 批准的ZTALMY標籤 得到了 不斷增加的ICD - 10 code Marigold data published in The Lancet Neurology First International CDKL5的支持指南 在 神經病學前沿 中發佈了16個銷售代表 針對 265家重點醫院和中心,包括8個CDD卓越中心和40個 國家癲癇中心 繼續與主要的CDD倡導團體和研究機構進行 接觸 CDD 和研究機構 第三季度出現早期需求的跡象 (啟動9周) 支付者訪問勢頭 患者和HCP教育 不用於促銷用途 |
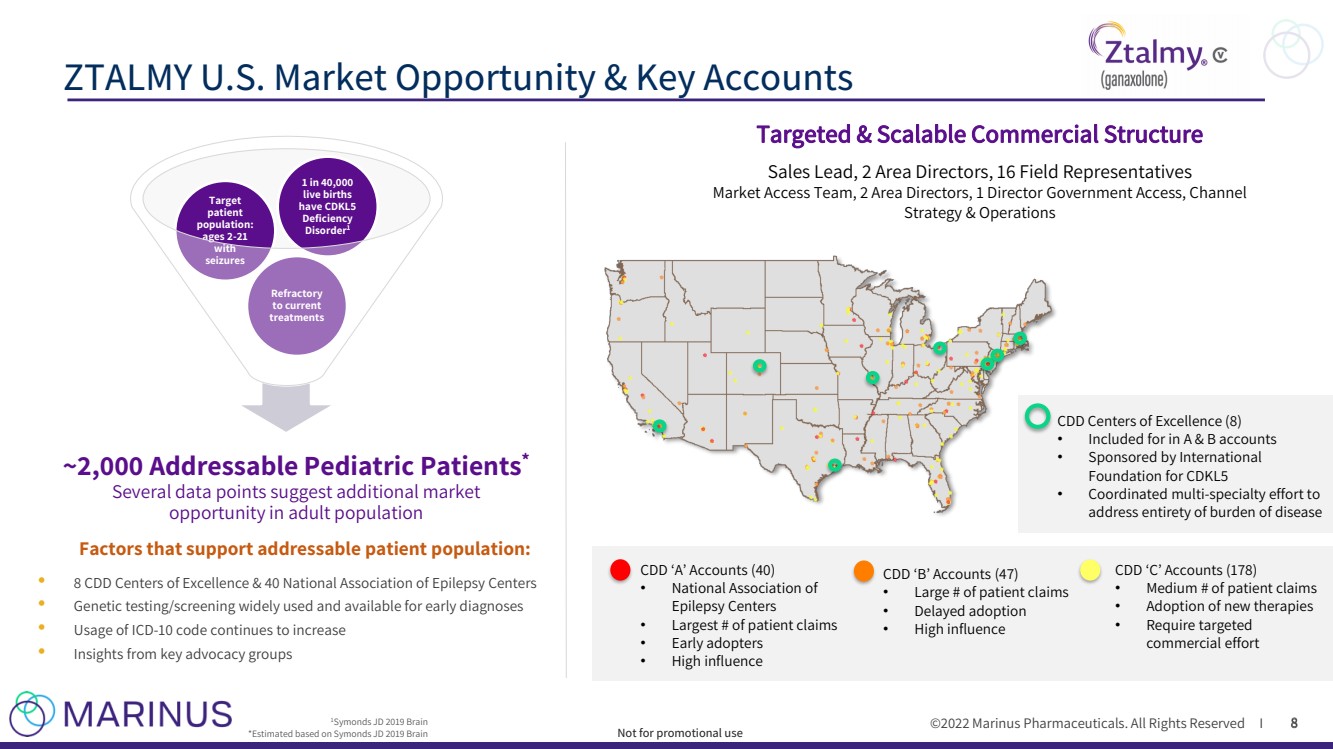
| ©2022年馬裏納斯製藥公司。保留所有權利I ZTALMY美國市場機會和主要客户 8 ~2,000名可尋址的兒科患者 * 幾個數據點表明成人人口中存在額外的市場機會 1 Symonds JD 2019 Brain *基於 Symonds JD 2019 Brain · 8個CDD卓越中心和40個全國癲癇協會 · 廣泛使用並可用於早期診斷的基因測試/篩查 10個代碼繼續增加 · 來自主要倡導團體的見解 難治性 到current treatments Target patient population: ages 2 - 21 在40,000個 活產中有1個癲癇發作 活產 具有支持可尋址患者羣體的CDKL5 Deficiency Disorder 1 Factors: 8 cdd‘A‘帳户(40) · 全國癲癇中心協會 · 最大數量的患者索賠 · 早期採用者 · 高影響力 CDD’B‘帳户(47) · 大量患者索賠 · 延遲採用 · 高影響力 CDD’C‘帳户(178) · 中等數量的患者索賠 Br}採用新療法需要有針對性的 商業努力 CDD卓越中心(8) · 納入A&B帳户 · 由國際CDKL5基金會贊助的 CDKL5 · 協調多項 - 專業工作,以 解決疾病負擔的整體問題 銷售 領導, 2名區域總監、16名現場代表 市場準入團隊、2名區域總監、1名董事政府通路、渠道 戰略與運營 目標明確且可擴展的商業結構 不用於促銷用途 |
| 罕見的Epilepsies Oral Ganaxolone Pipeline |
| 結節性硬化症複合體 “許多患有結節性硬化症的人繼續經歷無法控制的癲癇發作,儘管使用了多種抗癲癇藥物的雞尾酒。因為總是需要新的選擇, TSC社區歡迎對新的癲癇治療方法的臨牀評估“ - 結節性硬化症聯盟首席執行官總裁卡麗·路德·羅斯貝克 |
| ©2022年馬裏納斯製藥公司。保留所有權利I 11 結節硬化症(TSC) 1 DiMichele等人,J.NeuroSurg精神病學,2003 *先前兩種抗癲癇藥物失敗,持續、頻繁發作。 導致TSC1和/或TSC2基因缺陷或突變 症狀 · 良性腫瘤、癲癇發作、認知障礙、行為障礙,皮膚abnormalities INCIDENCE PREVALENCE • 1:6,000 live分娩 · ~25K -美國40K難治性need MECHANISTIC RATIONALE • Potential neurosteroid deficiency 1 • Pathophysiology患者。* 治療 儘管有治療方法,但持續得不到滿足的內科TSC可能涉及GABA能功能障礙 |
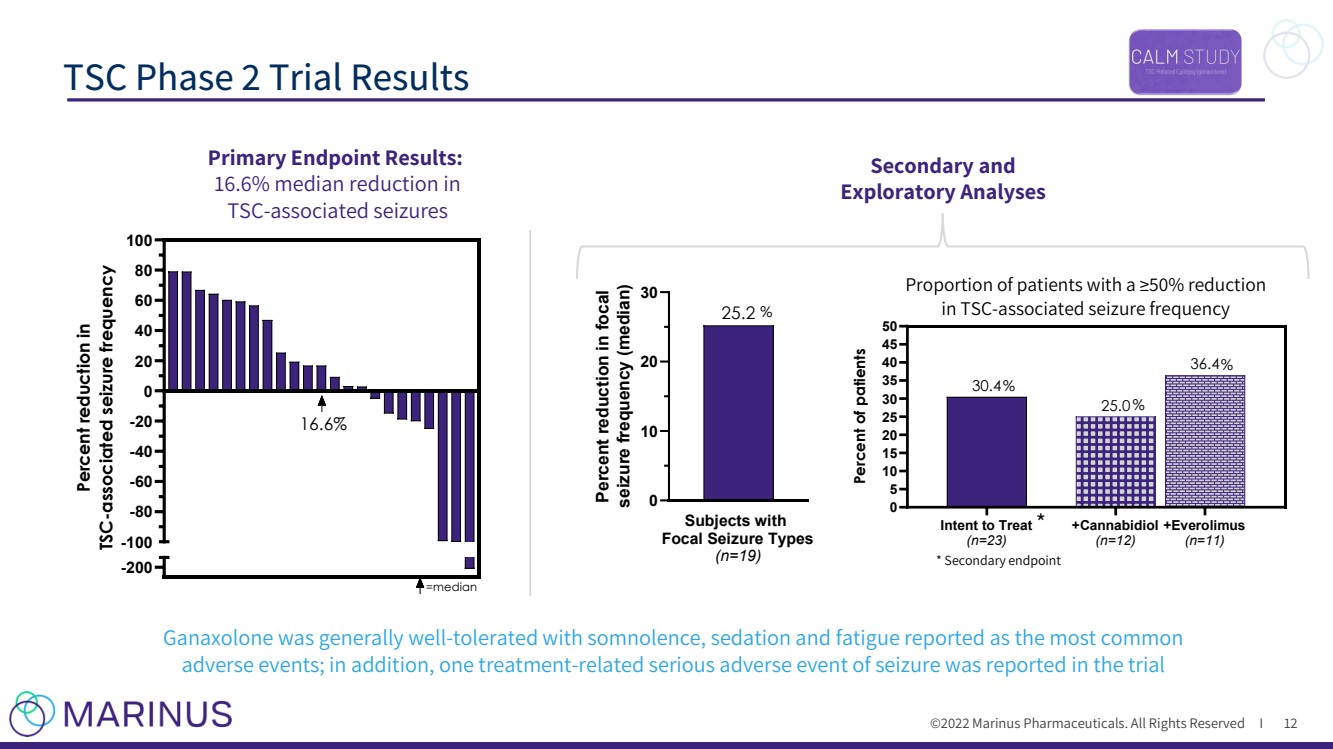
| ©2022年馬裏納斯製藥公司。保留所有權利I TSC第二階段試驗Results 12 * -200 -100 -80 -60 -40 -20 0 20 40 60 80 100 Percent降低了與TSC相關的癲癇發作頻率 =中位數 16.6% 二級和 探索性分析 主要終點結果:{br TSC - 相關癲癇發作的中位數減少16.6%通常耐受性良好 - 嗜睡,鎮靜和疲勞被報告為最常見的不良事件;此外,在試驗中報告了一種治療 - 與癲癇嚴重不良事件有關的試驗 *次要終點 患者的Tsc減少了50%的比例 - 相關的癲癇發作頻率 意向Treat (n=23) +Cannabidiol (n=12) +Everolimus (n=11) 0 5 10 15 20 25 30 35 患者的40 45 50 36.4 25.0 30.4 Percent % 局灶性癲癇患者的Types (n=19) 0 10 20 30 25.2 Percent減少 局灶性癲癇發作頻率(中位數) % |
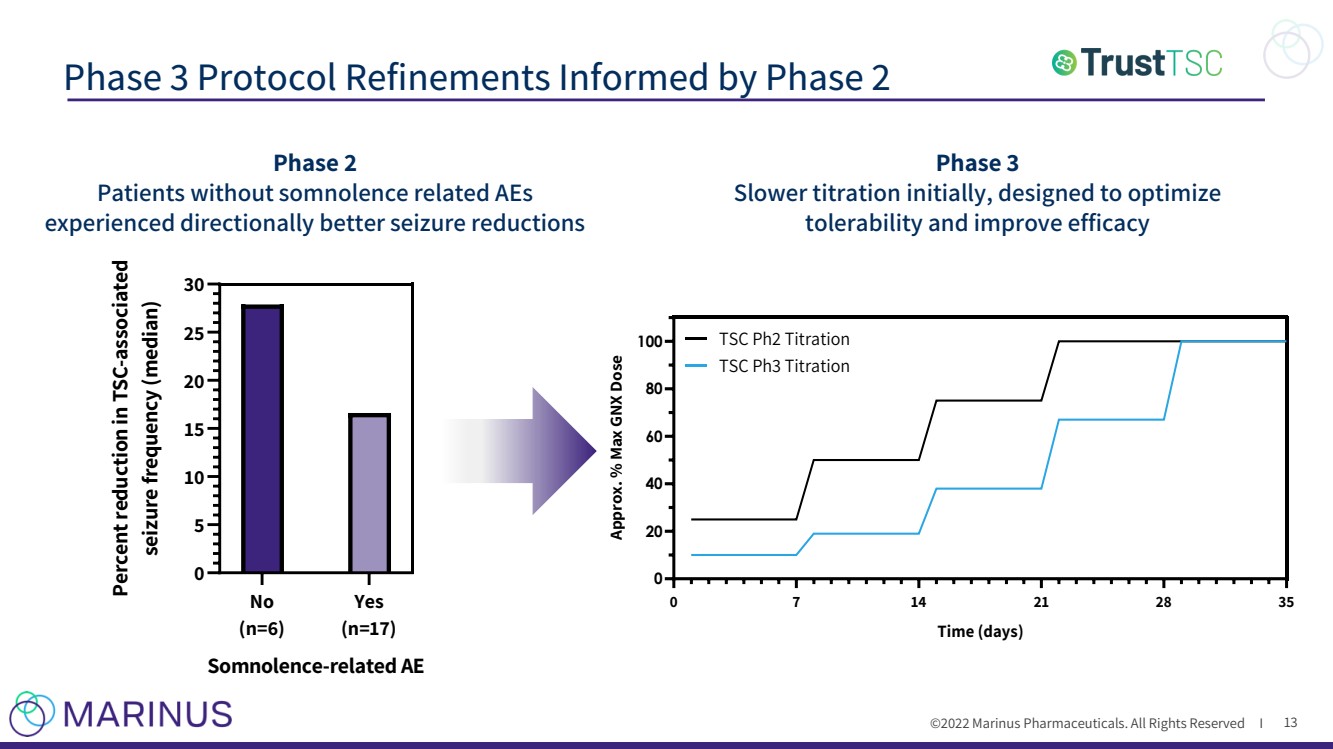
| ©2022年馬裏納斯製藥公司。保留所有權利i 階段3協議改進通知階段2 13 階段3 初始滴定速度較慢,旨在優化 容忍度並提高efficacy 0 7 14 21 28 35 0 20 40 60 80 100 Time(天數) 接近。%最大GNX劑量 TSC Ph2滴定 TSC Ph3 Titration No (n=6) Yes (n=17) 0 5 10 15 20 25 30 Somnolence-related AE 與TSC相關的發作頻率減少百分比(中位數) 第二階段 沒有嗜睡相關AEs的患者 癲癇發作明顯減少 |
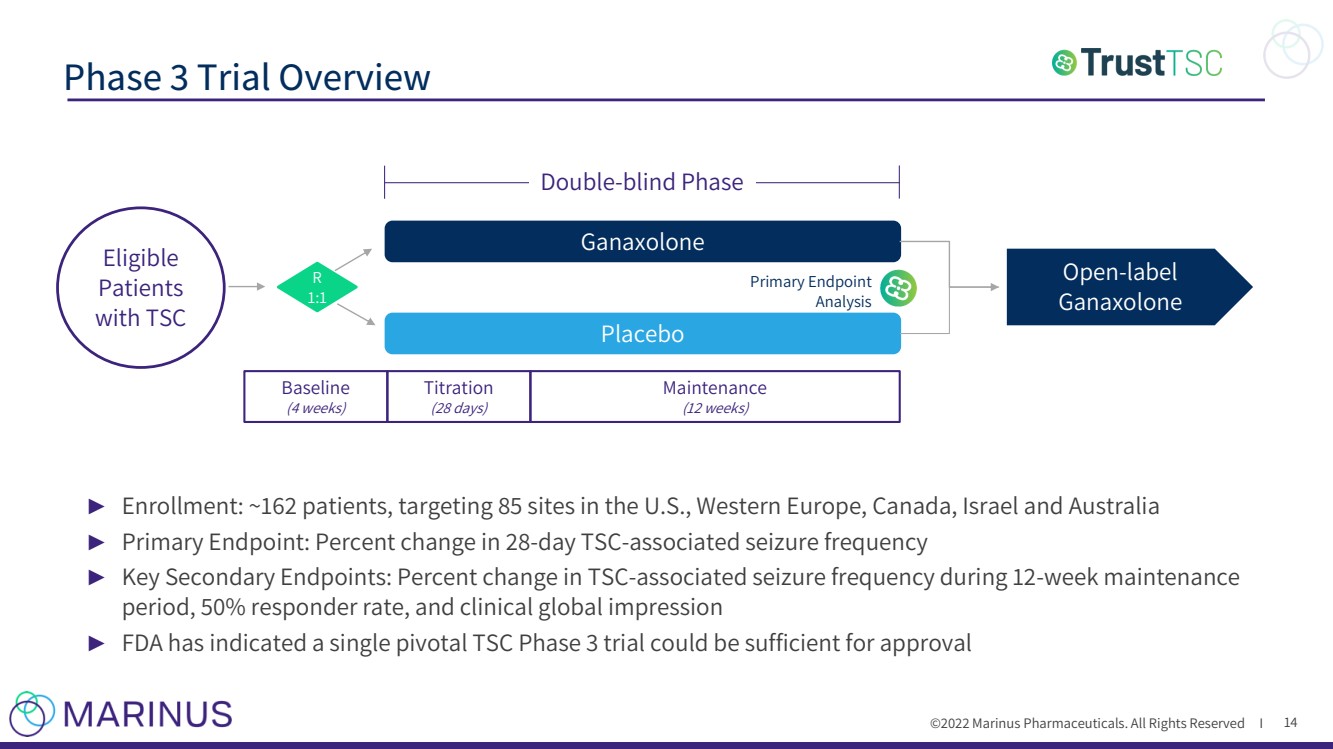
| ©2022年馬裏納斯製藥公司。保留所有權利i 第三階段試驗概述 14 ► 登記:約162名患者,目標是美國、西歐、加拿大、以色列和澳大利亞的85個地點 ► 主要終點:28天內的百分比變化 - 天► 相關癲癇發作頻率 TSC - 主要次級端點:12個 - 周維護期間相關癲癇發作頻率的百分比變化 - 周維護 期間,和臨牀全球印象 食品和藥物管理局表示,一次關鍵的approval Ganaxolone Placebo Baseline (4 3期試驗可能足以滿足Endpoint Analysis Open - label Ganaxolone Double - blind周的需求) 滴定 (28天) 維護 (12周) 符合條件的 患有TSC的患者 R 1:1 初級►期 |
| 第二代產品開發 產品開發 |
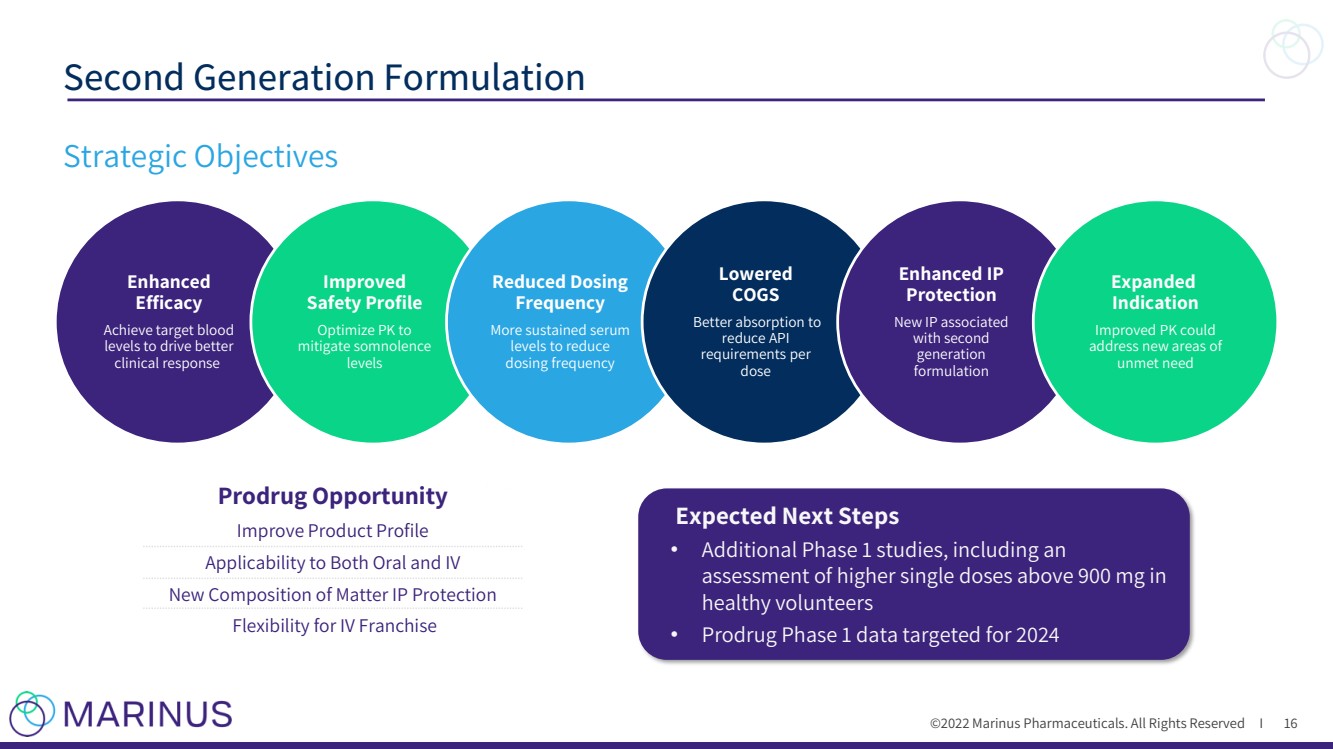
| ©2022年馬裏納斯製藥公司。版權所有I 第二代配方 16 戰略目標 增強了 功效 達到目標血液水平以推動更好的 臨牀反應 改進了 安全配置文件 將PK優化為 緩解嗜睡 級別 減少了服藥 頻率 更持久的血清水平以減少 服藥頻率 降低了 COGS 更好地吸收到了 降低了API 要求根據 劑量 增強的IP 保護 與second generation formulation Expanded Indication Improved PK關聯的新IP可以 解決 未滿足需求的新領域 預計下一步 · 其他階段1研究,包括對 健康志願者的單次劑量超過900毫克的更高劑量進行評估 · 針對2024年的前藥第一階段數據 前藥機會 改進產品概況 口服和靜脈注射的適用性 新的物質成分IP保護 靜脈注射特許經營的靈活性 |
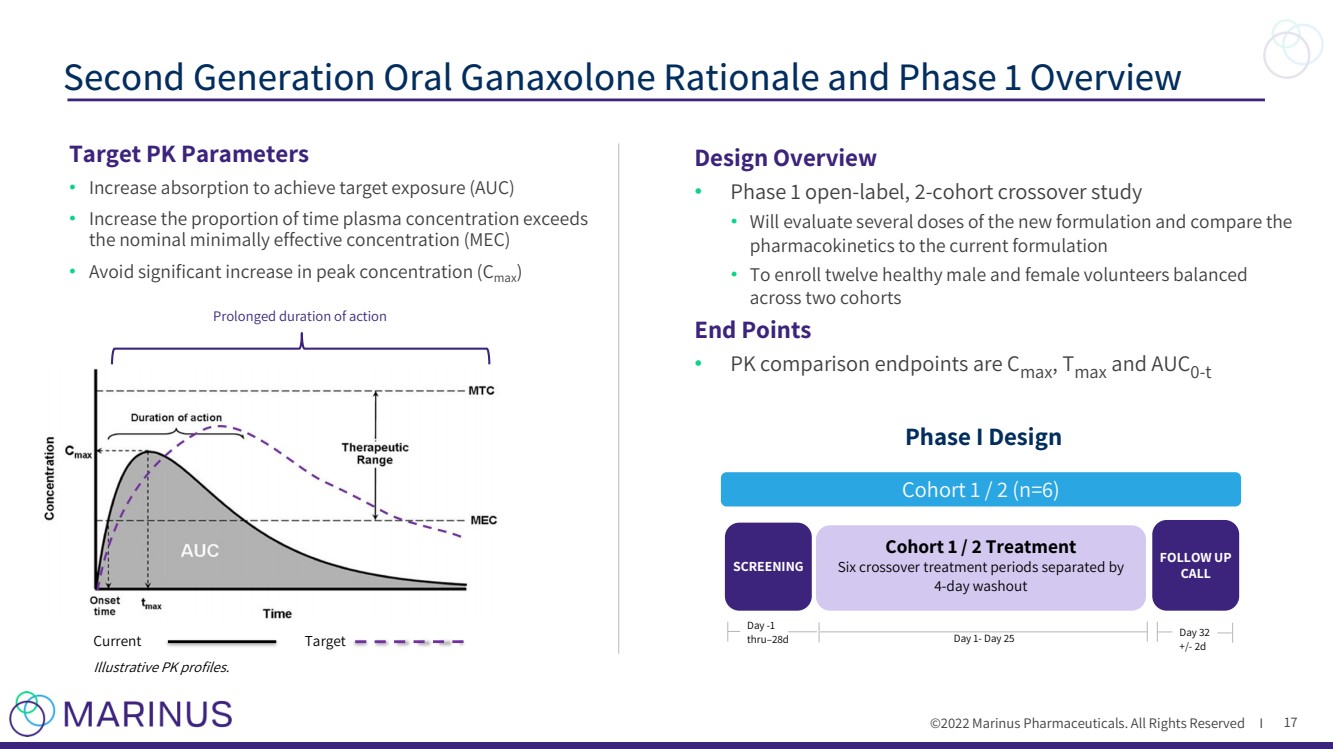
| ©2022年馬裏納斯製藥公司。保留所有權利I 第二代口服 加那索隆 原理和第一階段概述 17 隊列1/2治療 六個交叉治療週期以 4 - 天washout SCREENING Day - 1 thru – 28d Day 1 - 第25天 跟進 致電 第32天 +/{Br}- 2d 隊列1/2(n=6) 第一階段設計 設計概述 · 第一階段打開 - 標籤,2 - 隊列交叉研究 · 將評估新配方的幾種劑量,並將 藥代動力學與當前配方進行比較,以招募12名健康的男性和女性志願者,在兩個隊列中平衡 終點 · PK比較終點為C max , T max 和Auc 0 - t 目標PK參數 · 增加吸收以實現目標暴露(Auc) · 增加血漿濃度超過標稱最低有效濃度(MEC)的時間比例 · 避免峯值濃度( C max ) Current Target Illustrative PK曲線顯著增加。 延長了作用時間 |
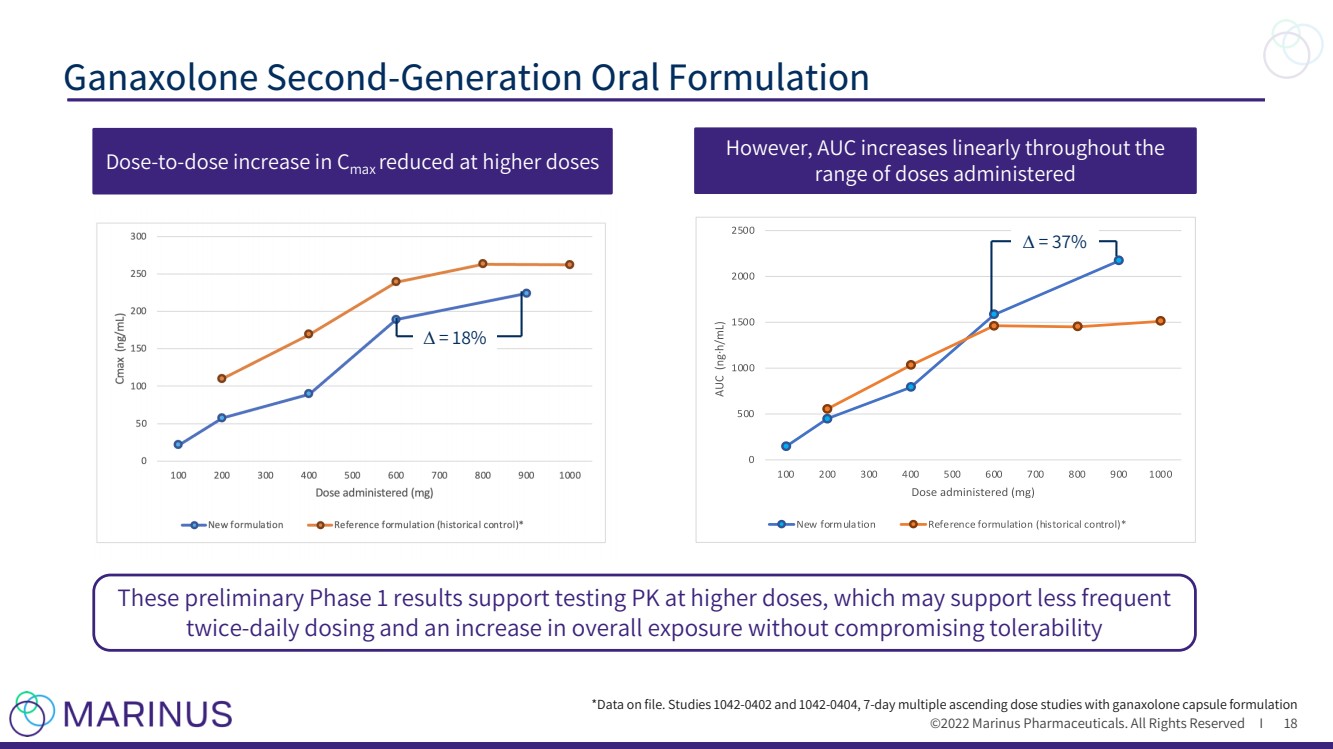
| ©2022年馬裏納斯製藥公司。保留所有權利 加納索隆 第二代口服制劑 18 然而,AUC在 劑量範圍內呈線性增加 *記錄數據。研究1042 - 0402和1042 -0404,7 - 膠囊製劑的多次遞增劑量研究 這些初步的第一階段結果支持在較高劑量下測試PK,這可能支持較低頻率的 兩次每日劑量 - 在不影響耐受性的情況下增加總暴露劑量 劑量 - 劑量增加在較高劑量下減少的 C 最大劑量 ∆ =18% ∆ =37% |
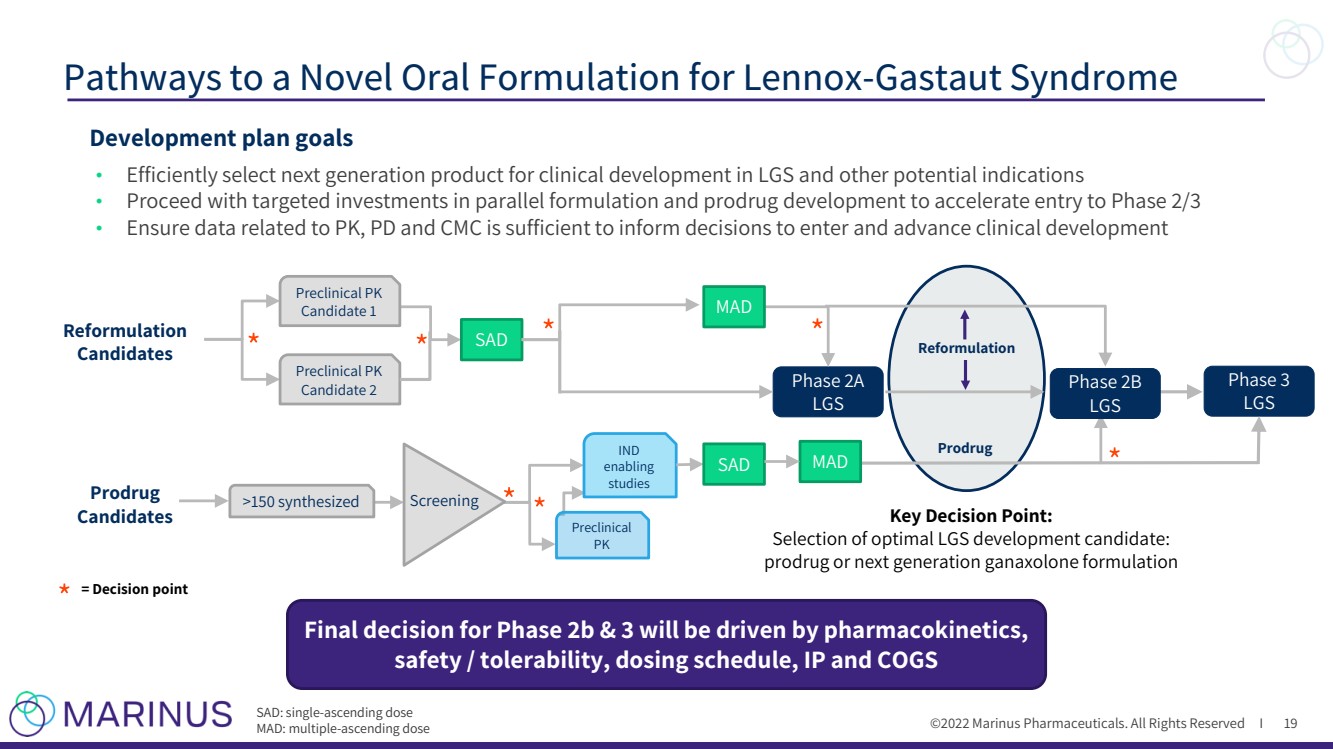
| ©2022年馬裏納斯製藥公司。保留所有權利i 開發計劃目標 · 有效地選擇下一代產品用於LGS和其他潛在適應症的臨牀開發 · 繼續在平行配方和前藥開發方面進行有針對性的投資,以加快進入2/3階段 · 確保與PK相關的數據,PD和CMC足以為進入和推進臨牀開發的決策提供信息 為Lennox - Gastaut 綜合徵 階段 LGS 關鍵決策點: 選擇最佳LGS開發候選藥物: 2b和3階段的前藥或下一個generation ganaxolone formulation Reformulation Candidates Final決定將取決於藥代動力學、安全性/耐受性、給藥時間表、IP和COGS 臨牀前PK 候選人1 臨牀前PK 候選人2 前藥 候選人 >150 synthesized Screening IND enabling studies Preclinical PK SAD MAD Phase 3 lgs 階段2B lgs =決策點 sad:單一 - 遞增劑量 MAD:多個 - 遞增dose Reformulation Prodrug 19 MAD |
| 急性癲癇 靜脈注射甘納鬆龍管道 |
| 癲癇持續狀態 |
| ©2022年馬裏納斯製藥公司。保留所有權利I 癲癇持續狀態(SE):定義和流行病學 癲癇持續狀態是美國第二常見的神經急症 每年1 15萬例 2 1.麻醉和重症監護醫學,2018年2月2日,癲癇持續狀態的管理最新進展 DeLorenzo RJ Pellock JM Towne AR Boggs JG.癲癇持續狀態的流行病學。J Clin 神經生理素 。1995年;12:316 - 325 背景 持續或接近持續發作 - 持續發作 病因包括腦瘤、中風、腦炎、藥物中毒或酒精戒斷的異質患者羣體 在不到一半的SE病例中存在癲癇 癲癇持續狀態可導致永久性神經元 損害並導致高發病率和死亡率 隨着病情的進展 變得更難治療 |
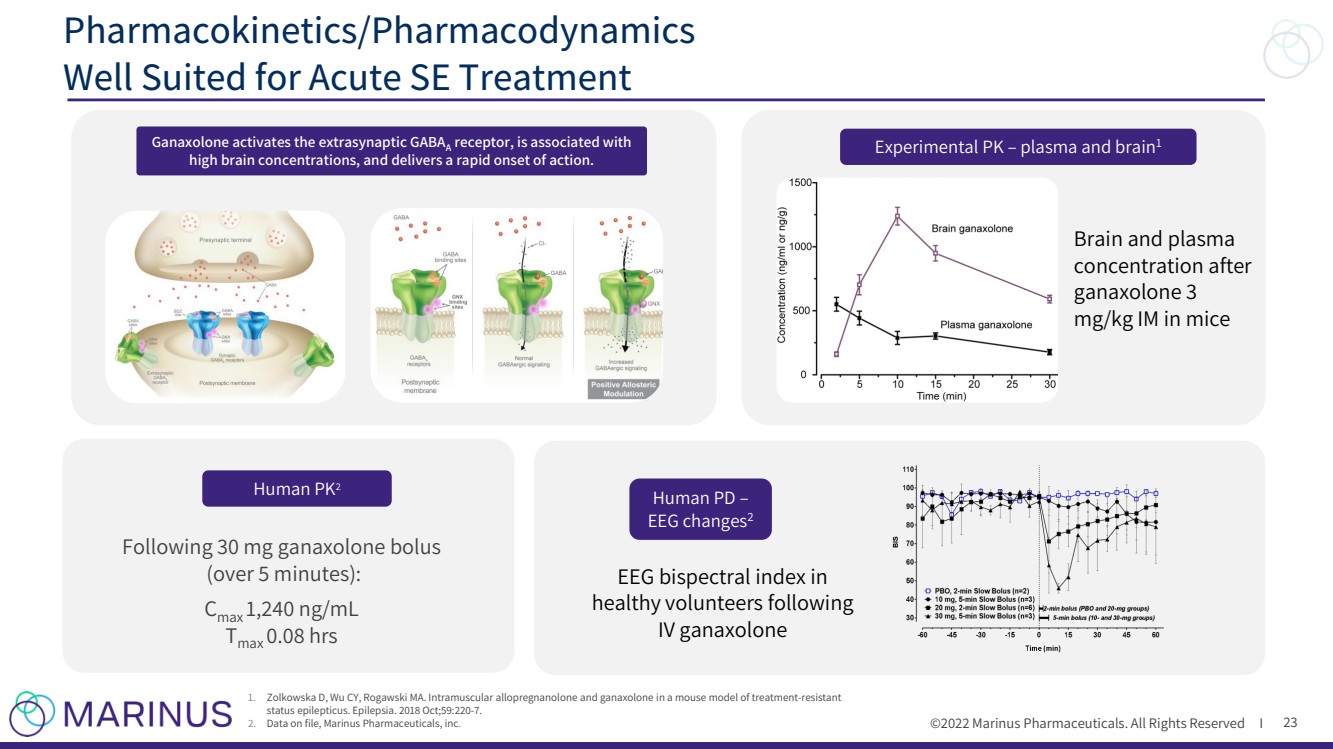
| ©2022年馬裏納斯製藥公司。版權所有適用於急性SE治療的I 23 Pharmacokinetics/Pharmacodynamics Well 實驗pk - 小鼠血漿和腦 腦組織和血漿 肌注加納索龍 3 mg/kg後 人PD - 腦電變化 2 腦電 腦電雙譜指標 健康志願者following IV ganaxolone 1. Zolkowska D,Wu Cy,羅高斯基,馬薩諸塞州。在難治性癲癇持續狀態小鼠模型中肌肉注射別孕酮和加納鬆龍。癲癇。2018年10月;59:220 - 7. 2. 文件中的數據,Marinus PharmPharmticals,Inc. 。 人PK 2 跟隨30 mg 甘納索隆 團注 (超過5分鐘): C max 1,240 ng/mL T max 0.08 hrs Ganaxolone activates the extrasynaptic GABA A receptor,與大腦高度集中有關,並能迅速起效。 |
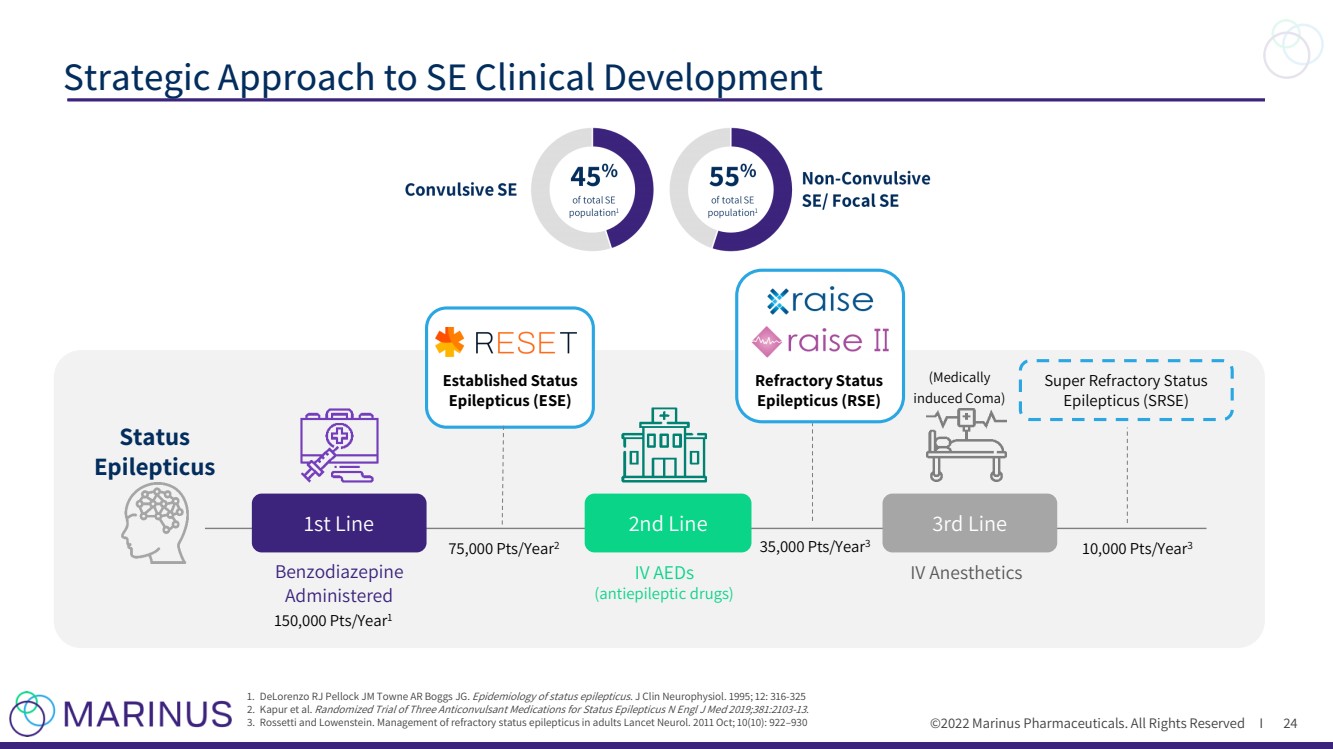
| ©2022年馬裏納斯製藥公司。版權所有i SE臨牀開發的戰略方法 24 1.DeLorenzo RJ Pellock JM Towne AR Boggs Jg. 癲癇持續狀態的流行病學。1995年;12:316 - 325 2. Kapur等人對三種抗癲癇藥物的隨機試驗N Engl J Med 2019;381:2103 - 13. 3. Rossetti和Lowenstein成人難治性癲癇持續狀態的治療。2011年10月;10(10):922 – 930 Benzodiazepine Administered (Medically induced昏迷) 已建立狀態 癲癇(癲癇) 靜脈注射抗癲癇藥 靜脈麻醉藥 超級難治狀態 癲癇(癲癇) 難治狀態 癲癇(癲癇) 一線 狀態 癲癇 三線 二線 15萬pts/年 1 75,000磅/年 2 35,000磅/年 3 10,000磅/年 3 |
| ©2022年馬裏納斯製藥公司。保留所有權利I 治療週期 負荷劑量 維持 縮減 25 2期難治性癲癇持續狀態試驗(RSE)設計 · 抽搐或非抽搐SE的診斷 · 至少一次靜脈注射失敗,但未進展到3次(Br)RD 靜脈注射麻醉藥 推注加持續輸液 2 - 4天輸液 18 - 小時逐漸減少 篩查 治療後 - 治療後 - 向上 24小時 周2,3、4 SE患者 隊列 新療法的ganaxolone/day N Low 500mg/day 5 Medium 650mg/day 4 High 713mg/day 8 Goals劑量 當前治療的侷限性 終點 · 快速停止發作 · 維持癲癇控制 · 防止病情惡化為靜脈注射麻醉藥{br)· 第一行 苯二氮卓類藥物在45%~50%無效;受心血管和呼吸系統副作用的限制 · 二線在50%以上的已建立的SE中無效,對難治性SE的反應進一步降低:發病率高,死亡率~35%;增加了 住院時間和護理費用 · 初級: %的患者在接受加納鬆龍治療後24小時內沒有要求升級靜脈注射麻醉劑 次要: 額外的療效、安全性和耐受性 男性8名,女性9名 平均年齡:57歲(範圍:23 - 88) 17名患者入選 |
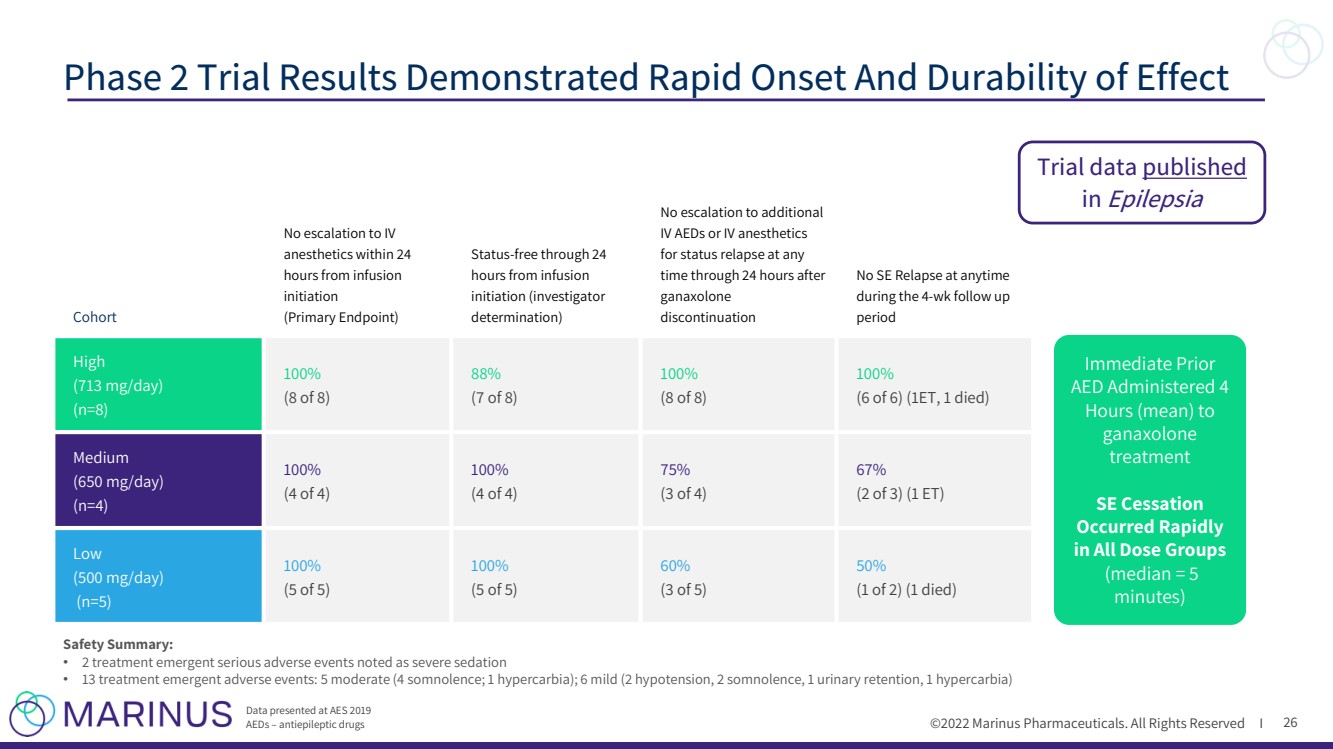
| ©2022年馬裏納斯製藥公司。保留所有權利i 26 第二階段試驗結果顯示效果起效迅速且持久 在AES 2019上提交的數據 AEDS - 抗癲癇藥物 隊列 注射後24小時內麻醉藥沒有升級到IV 麻醉藥 開始 (主要終點) 狀態 - 從注射開始到24小時內沒有升級到額外的 靜注AEDs或靜脈麻醉藥 在停藥後24小時內的任何時間內狀態復發的AEDs或IV麻醉藥 在4個 - 周的隨訪 期間 任何時間無SE復發 高 (713毫克/天) (n=8) 100% (8個) 88% (7個,共8個) 100% (8個,共8個) 100% (6個,共6個)1人死亡) 中等 (650毫克/天) (n=4) 100% (4人中的4人) 100% (4人中的4人) 75% (3人,共4人) 67%(2人,共3人)(1人ET) 低 (500毫克/天) (n=5) 100% (5人,共5人) 100% (第5次) 60% (第3次,共5次) 50% (第1次,共2次)(1例死亡) 立即使用加納鬆龍治療 次至 次治療 次(平均)至 次治療 次在所有劑量組中均迅速停止 次(中位數為5次) 安全摘要: · 2次治療緊急嚴重不良事件,記錄為嚴重鎮靜 · 治療突發不良事件13例:中度5例(嗜睡4例;1例高碳酸血癥);6例輕度(2例低血壓、2例嗜睡、1例小便、1例高碳酸血癥) 試驗數據 發表在 癲癇 上 |
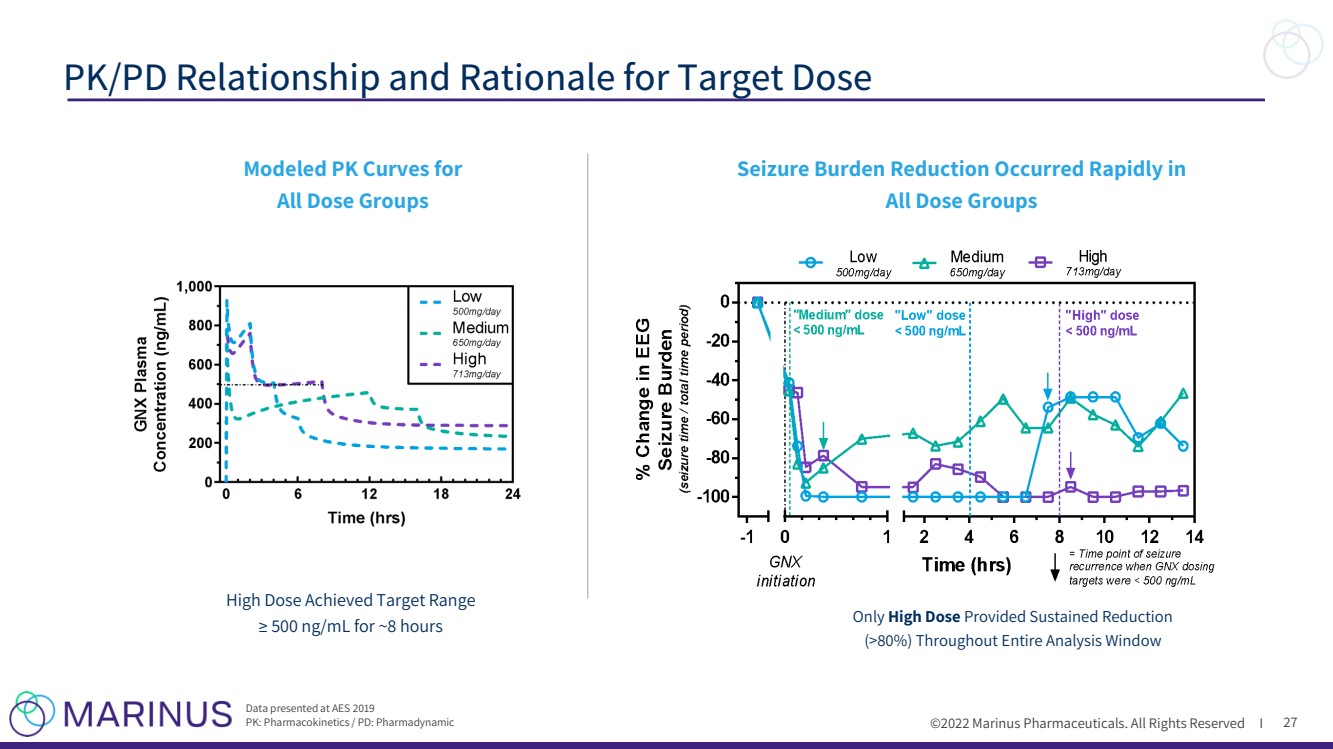
| ©2022年馬裏納斯製藥公司。保留所有權利I 27 目標劑量的PK/PD關係和原理 為 所有劑量組建立了PK曲線模型 高劑量達到目標範圍 ≥500 ng/mL,持續8小時 只有高劑量 在整個分析窗口內持續減少 (>80%) 在AES2019上公佈的數據 PK:藥代動力學/PD:藥效學 所有劑量組迅速出現癲癇負擔減輕 |
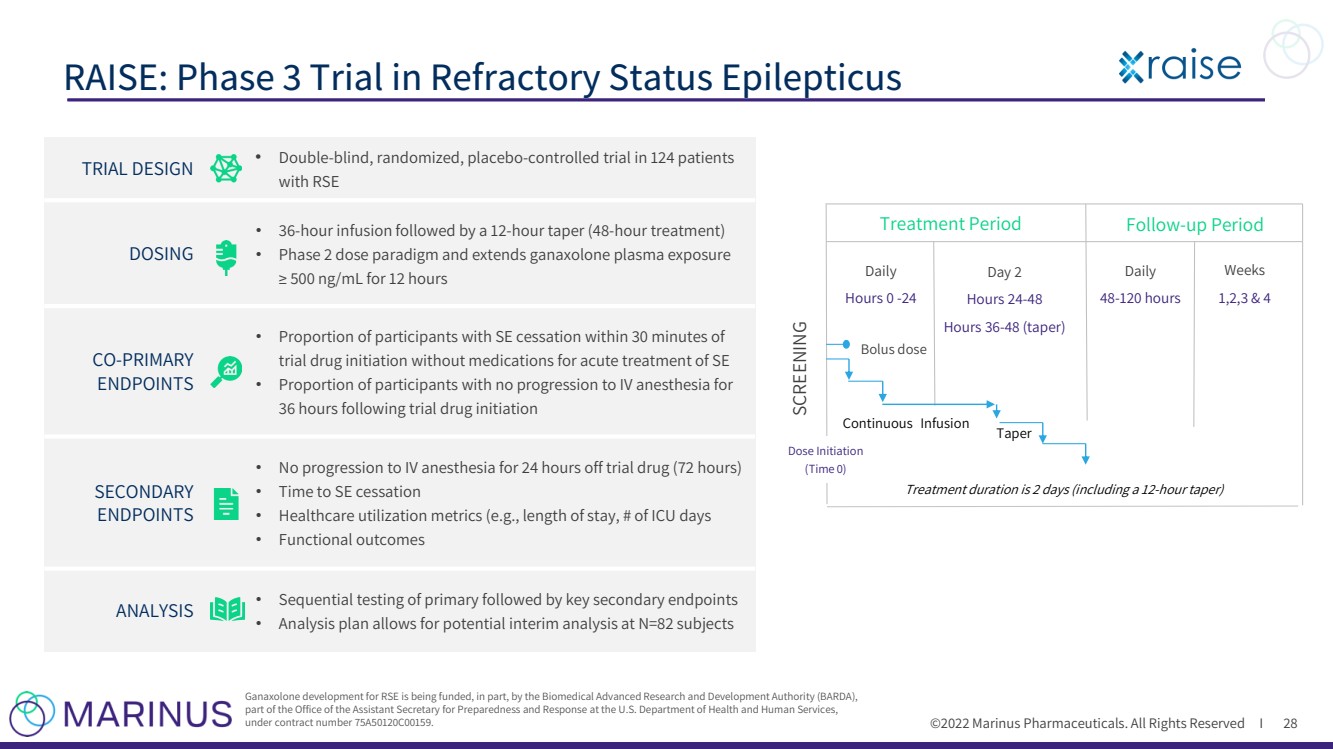
| ©2022年馬裏納斯製藥公司。保留所有權利i RAISE:難治性癲癇持續狀態的第三階段試驗 28 生物醫學高級研究和發展局(BARDA ), 美國衞生與公眾服務部負責準備和反應的助理國務卿辦公室的一部分, 合同編號75A50120C00159。 試驗設計 · 雙 - 盲目、隨機、 安慰劑-對照試驗,對124名患者進行了試驗,其中RSE 劑量為 · 36 - 小時輸液,然後12 - 小時逐漸減少(48 - 小時治療) · 第二階段劑量範例,並延長加納索龍血漿暴露時間 12 hours CO - PRIMARY ENDPOINTS • Proportion停止SE的參與者的≥500 ng/mL在試驗藥物initiation SECONDARY ENDPOINTS • No進展至靜脈麻醉後36小時內未進展到靜脈麻醉的參與者的比例(在停止試驗藥物24小時後) · 停止試驗藥物(72小時) · 停止SE的時間 · 醫療利用指標(例如,住院時間,ICU天數 · 功能結果 分析 分析 主要和關鍵次要終點的順序測試 分析計劃允許對N=82名受試者進行潛在的中期分析 篩查 開始劑量 (時間0) 治療期 後續 - 續行期 周 1,2,3和4 每天 48 - 120小時 第2天 小時24 - 48 小時36 - 48(縮減) 每天 小時0 - 24 團購dose Continuous Infusion Taper Treatment持續時間為2天(包括12 - 小時縮減) |
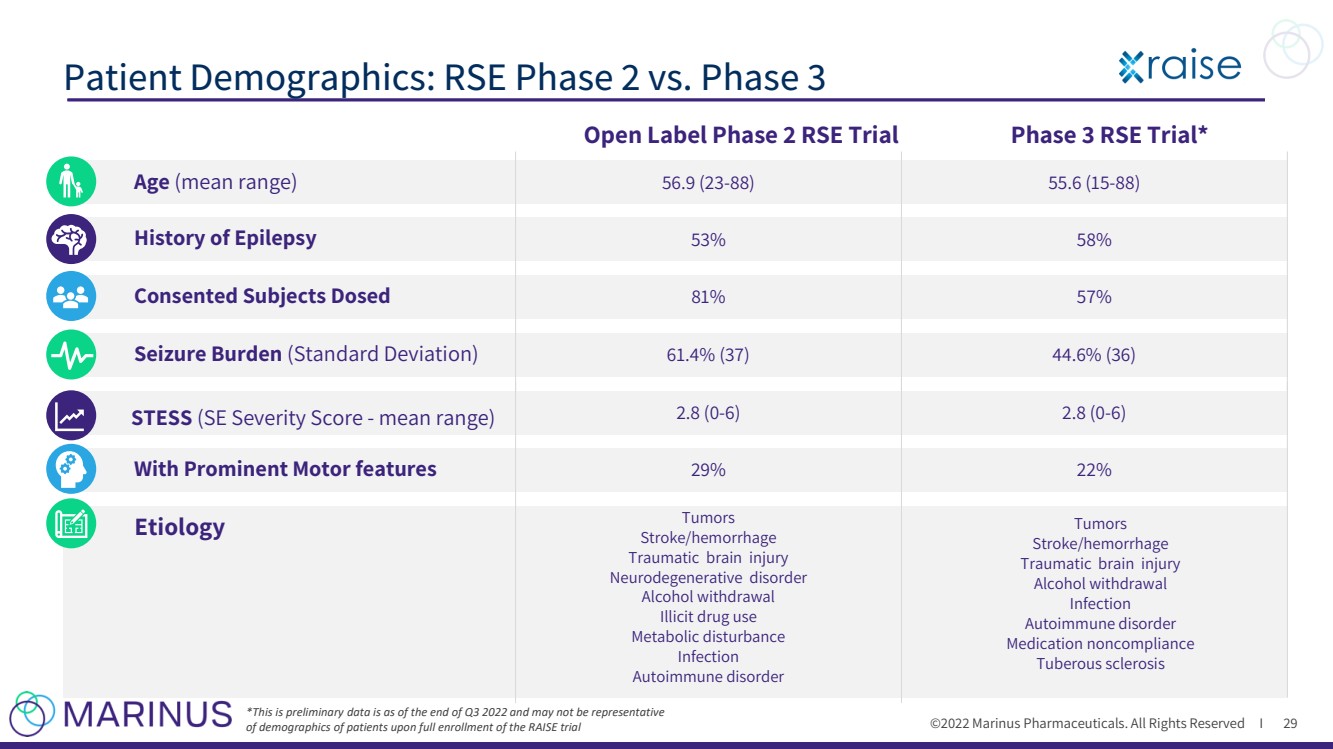
| ©2022年馬裏納斯製藥公司。保留所有權利i 患者人口統計數據:RSE第二階段與第三階段 29 * 這是截至2022年第三季度末的初步數據,可能不能代表RAISE試驗完全登記後患者的人口統計數據 Ag e (平均範圍) 同意的受試者接受劑量 癲癇病史 負擔 (標準差) 56.9(23 - 88) 55.6(15 - 88) 53% 58% 81% 57% 61.4%(37) 44.6%(36) 應力 (SE嚴重程度評分 - 平均範圍) 具有突出電機特徵的病因 2.8(0 - 6) 2.8(0 - 6) 29% 22% Tumors Stroke/hemorrhage Traumatic腦損傷 神經退行性疾病 酒精戒斷 非法藥物使用 代謝障礙 感染 自身免疫性disorder Tumors Stroke/hemorrhage Traumatic腦損傷 酒精戒斷 感染 自身免疫性疾病 用藥不依從 結節性硬化症 開放標籤第二階段隨機對照試驗 第三階段隨機對照試驗* |
| ©2022年馬裏納斯製藥公司。保留所有權利i RAISE方案修訂以加速登記 原方案 修訂方案 如果SE不保證在接下來的24小時內進行麻醉 患者將被排除在外 如果研究藥物 (加納鬆龍或安慰劑)不能控制SE 在 足夠的劑量和持續時間下使用靜脈麻醉誘導麻醉 靜脈麻醉(任何劑量/任何適應症)少於18 小時*{br苯二氮卓類藥物和兩種或兩種以上第二種或兩種以上IV型抗癲癇藥物 至少兩種或兩種以上治療,或者: 1. 苯二氮卓類藥物+ > 1靜脈注射AED 2. > 2靜脈注射AEDs 研究前30 - 分鐘 至少6分鐘癲癇發作活動(20%癲癇負擔) 研究藥物開始1小時內任意30分鐘內至少6分鐘癲癇發作活動 Ceribell 只允許進行快速腦電檢查 Ceribell 允許快速腦電檢查獲得研究資格並確定腦電停止(1 st co - 主要終點) |
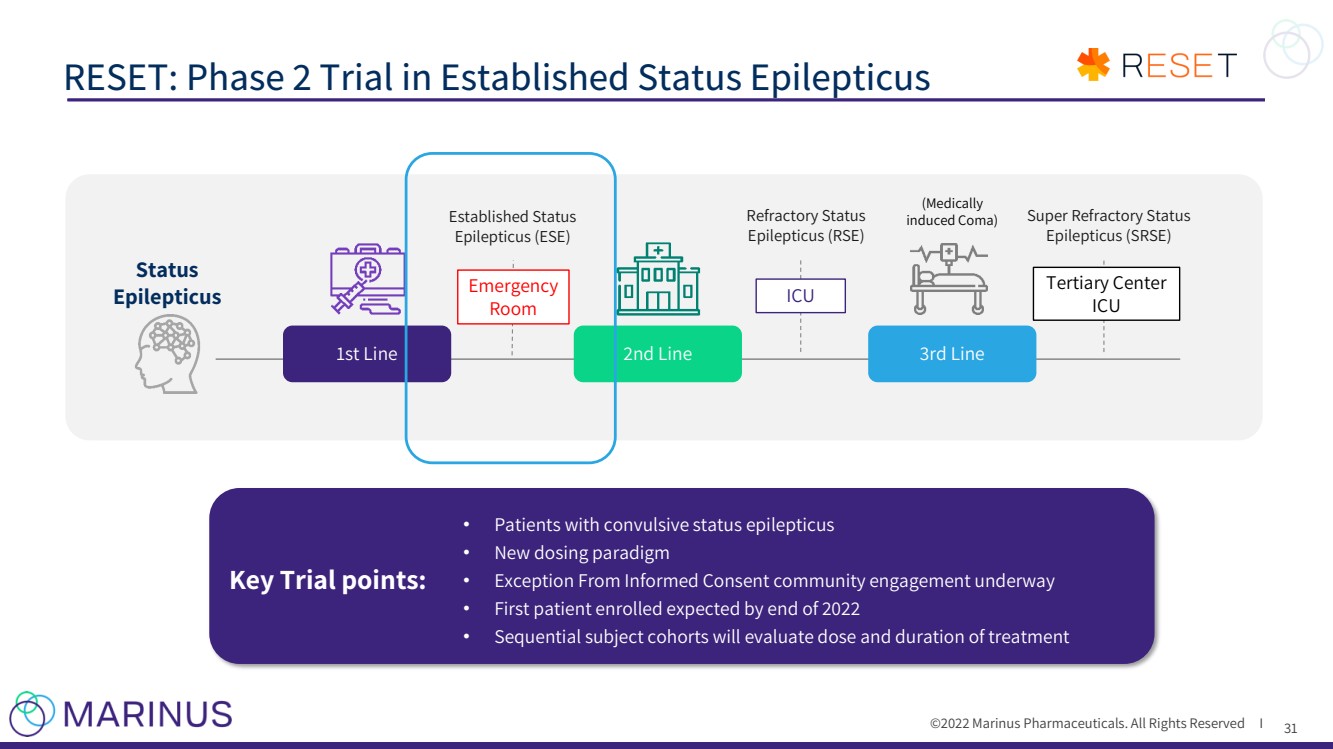
| ©2022年馬裏納斯製藥公司。保留所有權利I 重置:已確定的癲癇持續狀態的第二階段試驗 31 1 Kapur等人。 針對癲癇持續狀態的三種抗驚厥藥物的隨機試驗 N Engl J Med 2019;381:2103 - 13. 關鍵試驗點: · 癲癇持續狀態患者 · 新的給藥模式 · FDA已表示與總體研究設計保持一致 · 正在進行的知情同意社區參與計劃例外 · 計劃於2022年下半年開始 苯二氮卓類藥物 靜脈注射AEDs (抗癲癇藥物) 靜脈麻醉藥 (醫學上 導致昏迷) Br}已建立狀態 癲癇(癲癇) 超級難治狀態 癲癇(癲癇) 難治狀態 癲癇(癲癇) 一線 二線 第三Line Status Epilepticus ICU Tertiary中心 ICU 急診 房間 關鍵試驗點: 癲癇痙攣狀態患者 · 新給藥模式 · 知情同意例外社區參與正在進行中 · 預計在2022年底之前登記的第一位患者 · 後續受試者隊列將評估治療劑量和療程 |
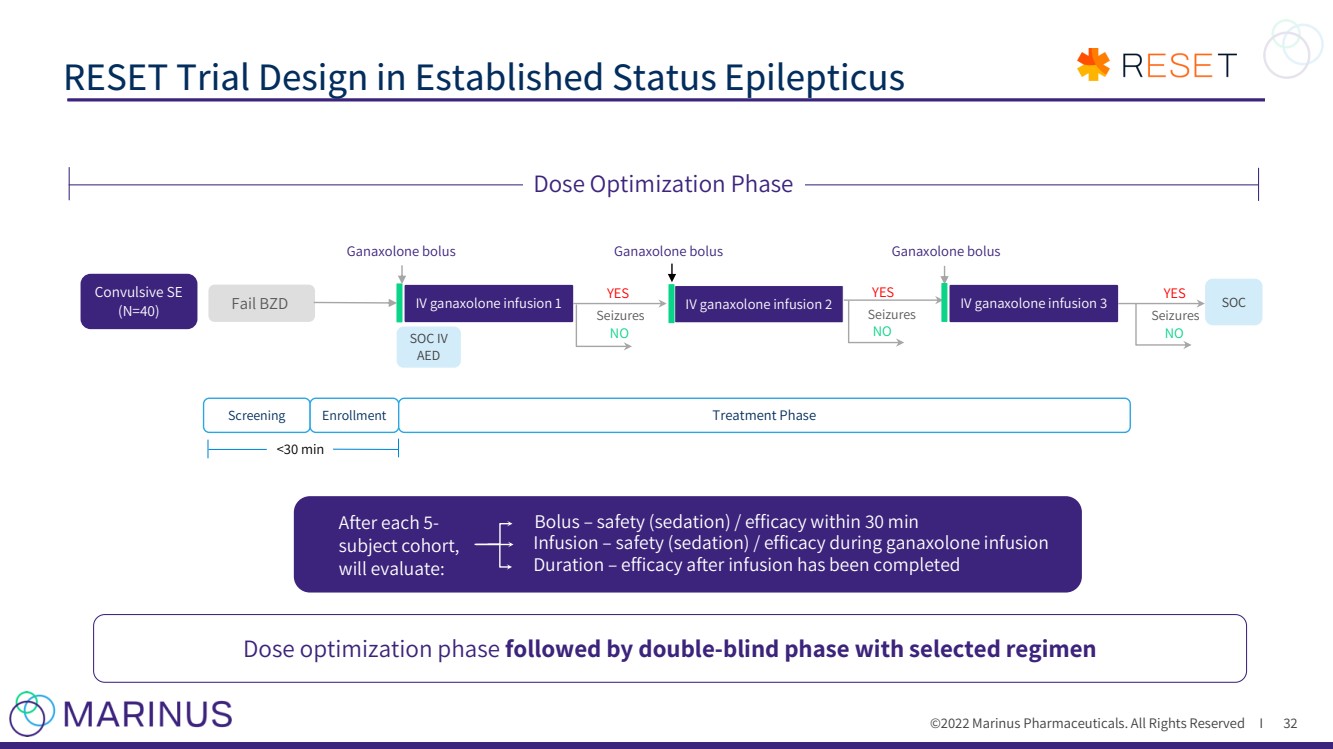
| ©2022年馬裏納斯製藥公司。保留所有權利I 已建立的癲癇狀態下的重置試驗設計 32 篩查 |
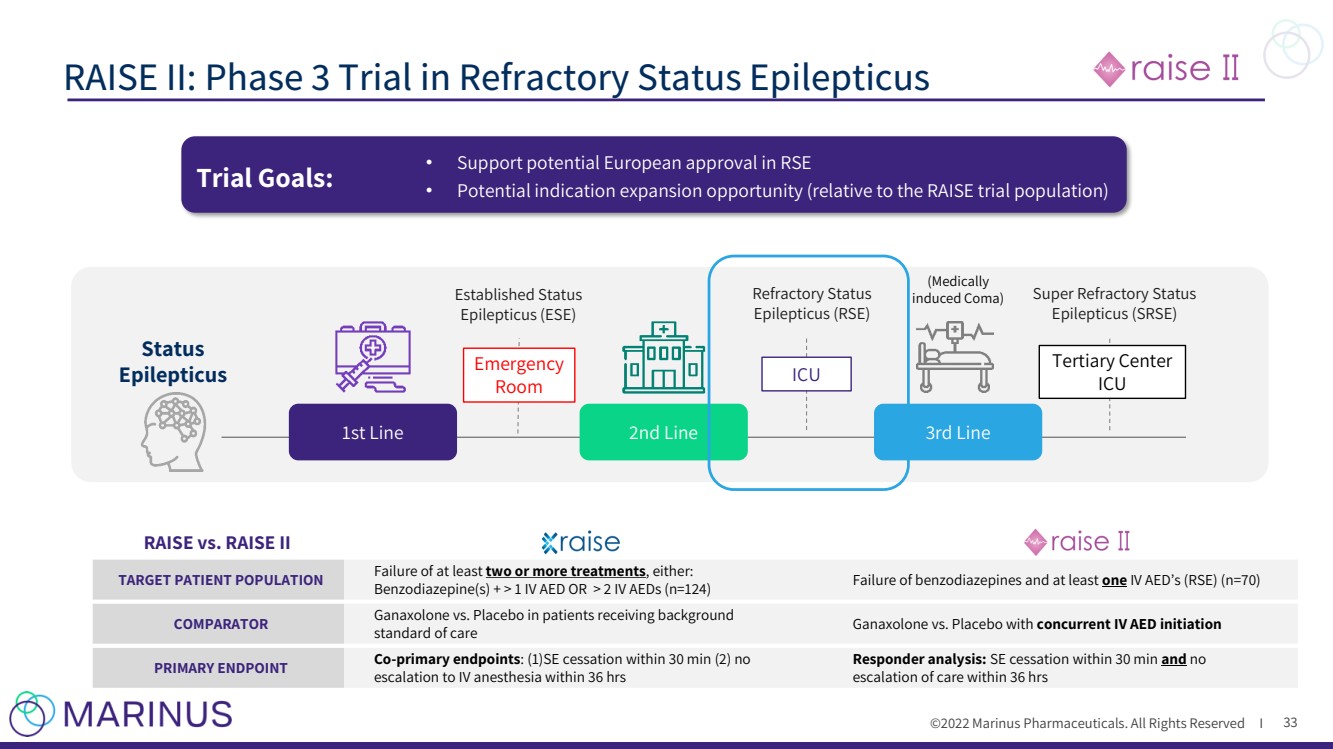
| ©2022 Marinus製藥公司。保留所有權利I RAISE II:難治性癲癇持續狀態第三階段試驗 33 1 Kapur 等人。 三種抗癲癇藥物的隨機試驗N Engl J Med 2019;381:2103 - 13. Benzodiazepine Administered IV AEDs (抗癲癇藥) 靜脈麻醉藥 (藥物誘導昏迷) 已建立狀態 癲癇(癲癇) 超級難治狀態 癲癇(SRSE) 難治狀態 癲癇(Rse) 一線 三線 狀態 癲癇 二線 重症監護室 三級中心 ICU 急診 房間 RAISE與RAIST II 目標患者人羣 至少兩次或兩次以上治療失敗 ,在接受背景治療的患者中, 苯二氮卓類藥物+>1個靜脈注射AED或>2個靜脈注射AED(n=124) 苯二氮卓類藥物和至少一個 靜脈注射AED(RSE)(n=70) 比較 加納索隆 與安慰劑對照 同時靜脈注射AED 主要終點 Co - 主要終點:(1)在接受背景治療的患者中 標準護理 與安慰劑 同時靜脈注射AED 主要終點 Co - 主要終點 :(1)停止SE內30分鐘(2)內無 麻醉在36小時內升級到靜脈麻醉 應答者分析: SE在30分鐘內停止 和 在36小時內沒有 護理升級 試驗目標: · 支持潛在的歐洲批准RSE · 潛在的適應症擴展機會(相對於RAISE試驗人羣) |
| 建設面向未來的商業基礎設施 IV發佈 |
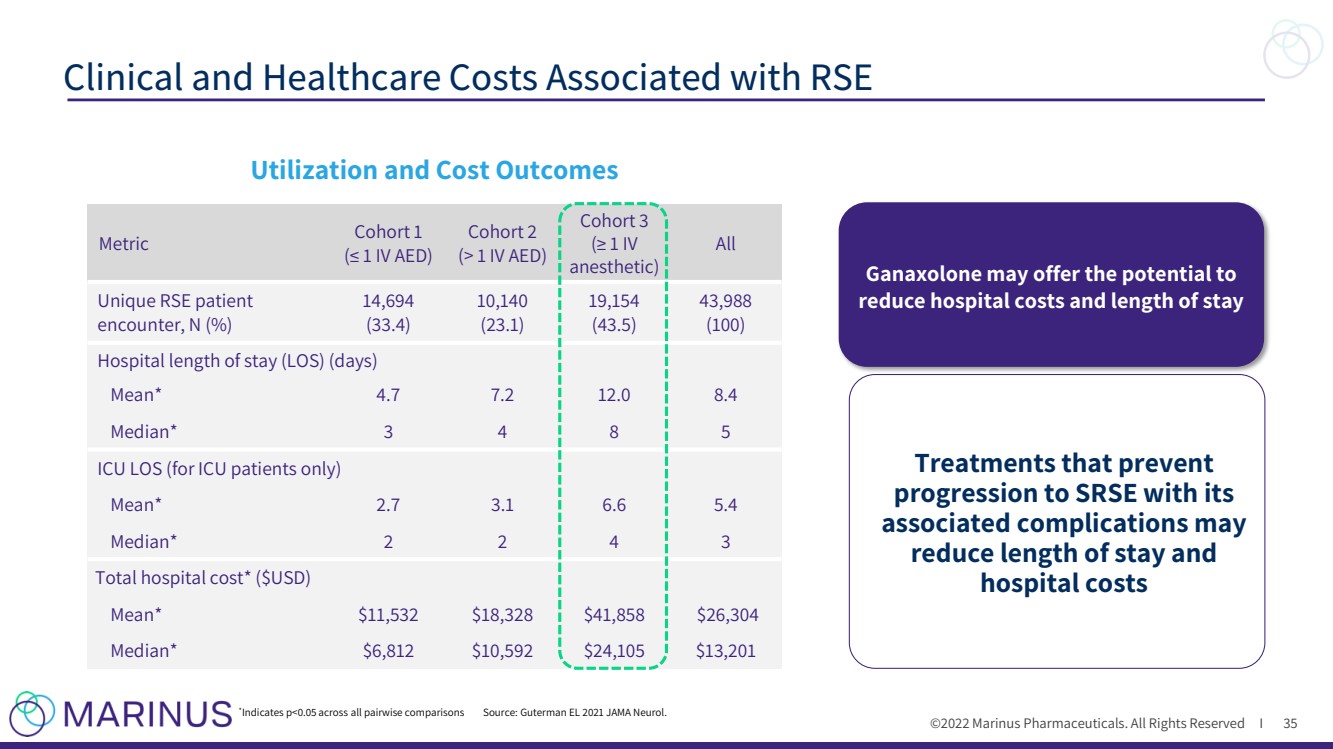
| ©2022年馬裏納斯製藥公司。保留所有權利i 與RSE相關的臨牀和醫療成本 35 使用率和成本結果 指標 隊列1 (≤1 IV AED) 隊列2 (>1 IV AED) 隊列3 (≥1 IV 麻醉) 所有獨特的RSE患者 遇到,N(%) 14,694 (33.4) 10,140 (23.1) 19,154 (43.5) 43,988 (100) Hospital Long of Stay(LOS)(days) Mean* 4.7 7.2 12.0 8.4 Median* 3 4 8 5 ICU LOS(對於重症監護室患者,only) Mean* 2.7 3.1 6.6 5.4 Median* 2 2 4 3 Total醫院費用*($USD) Mean* $11,532 $18,328 $41,858 $26,304 Median* $6,812 $10,592 $24,105 $13,201 * Indicates p |
| ©2022年馬裏納斯製藥公司。保留所有權利i 差異化市場準入戰略以確保IV 甘納鬆龍配方 36 (DRG)的成功,診斷 - 相關團體報銷 定價和報銷 · 美國/歐盟定價研究啟動並正在進行中 確定新技術添加 - 支付(NTAP)時間 · 評估DRGs和其他醫院支付系統 交付和患者訪問 符合分銷路徑 · 制定RSE計劃並評估ESE擴張的影響 價值主張和 醫療經濟 Br}消息 · 評估當前的治療方案 · 評估疾病負擔和醫院影響以擴大和包括成本避免指標 考慮醫院網絡對付款人團隊的影響 考慮到醫院網絡對付款人團隊的影響 正在對潛在的醫院目標細分進行持續評估 |
| 財務動態 |
| ©2022 Marinus Pharmaceuticals. All Rights Reserved I Financial Overview: Q3 2022 38 Analyst Coverage*: Cantor Fitzgerald: Charles C. Duncan, Ph.D. Cowen: Joseph Thome, Ph.D. H.C. Wainwright & Co: Douglas Tsao Jefferies: Andrew Tsai JMP Securities: Jason N. Butler, Ph.D. Ladenburg Thalmann : Michael Higgins SVB Securities: Marc Goodman Oppenheimer: Jay Olson RW Baird: Brian Skorney Truist : Joon Lee, M.D., Ph.D. *Note: Opinions, estimates, and forecasts of the individual analysts regarding Marinus do not represent opinions, estimates, and forecasts of Marinus. The listing above does not imply endorsement or concurrent with their information, conclusions, or recommendations. 1 Fully dilutive total includes impact of convertible preferred stock and outstanding stock options and RSU’s Investor Relations – Nasdaq: MRNS 2022 Guidance • BARDA Revenues • FY 2022 projected to be between $7 - $10 million • Operating Expenses • FY 2022 GAAP operating expenses (SG&A and R&D) of between $150 - $155 million • Total includes approximately $15 million of non - cash stock - based compensation Financial Summary (at September 30 , 2022 ): • $ 168.2 million in cash and cash equivalents • $ 75 million in debt • 37.2 million shares outstanding; 44.6 million shares outstanding on a fully dilutive basis 1 $32.5 million in gross proceeds received in October 2022 from completed revenue interest financing agreement |
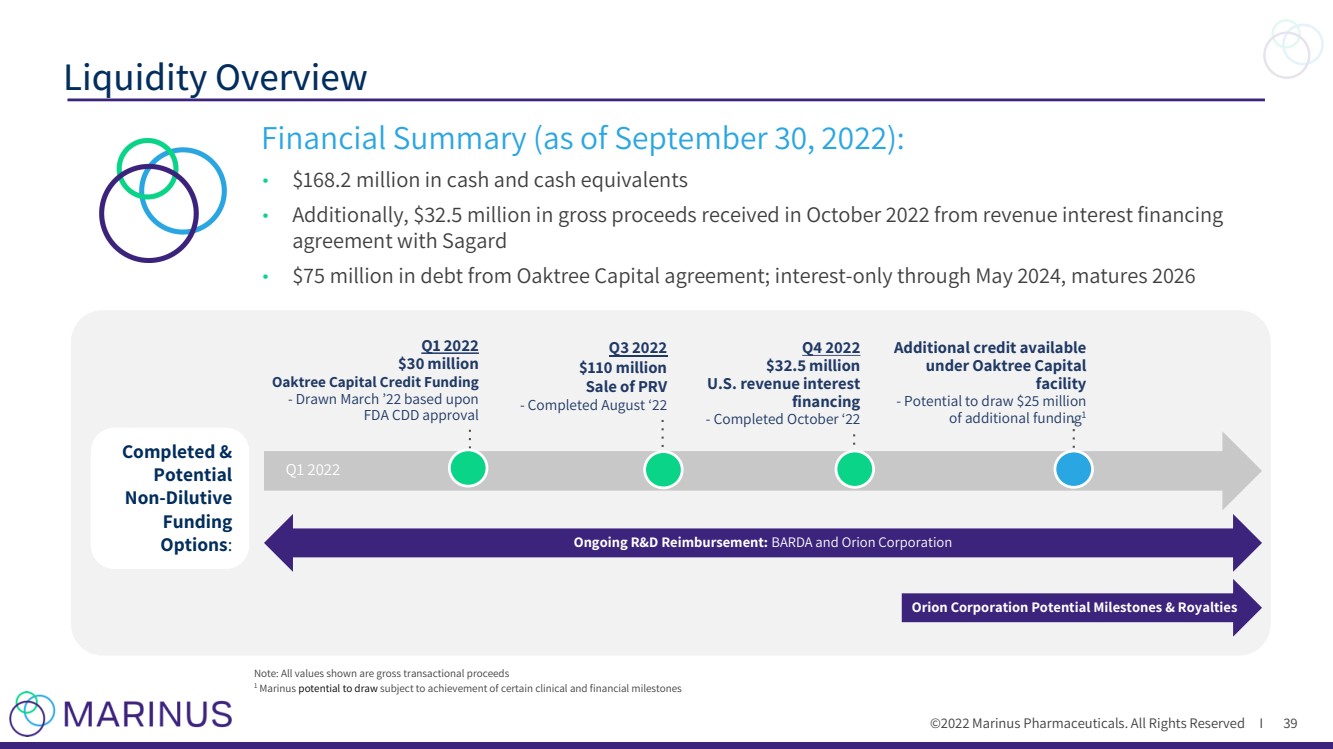
| ©2022 Marinus Pharmaceuticals. All Rights Reserved I Liquidity Overview 39 Note: All values shown ar e gross transactional proceeds 1 Marinus potential to draw subject to achievement of certain clinical and financial milestones Financial Summary (as of September 30 , 2022) : • $168.2 million in cash and cash equivalents • Additionally, $32.5 million in gross proceeds received in October 2022 from revenue interest financing agreement with Sagard • $ 75 million in debt from Oaktree Capital agreement; interest - only through May 2024, matures 2026 Completed & Potential Non - Dilutive Funding Options : FDA Approval March 2022 Q1 2022 $30 million Oaktree Capital Credit Funding - Drawn March ’22 based upon FDA CDD approval Q3 2022 $110 million Sale of PRV - Completed August ‘22 Q4 2022 $32.5 million U.S. revenue interest financing - Completed October ‘22 Ongoing R&D Reimbursement: BARDA and Orion Corporation Q1 2022 Additional credit available under Oaktree Capital facility - Potential to draw $25 million of additional funding 1 Orion Corporation Potential Milestones & Royalties |
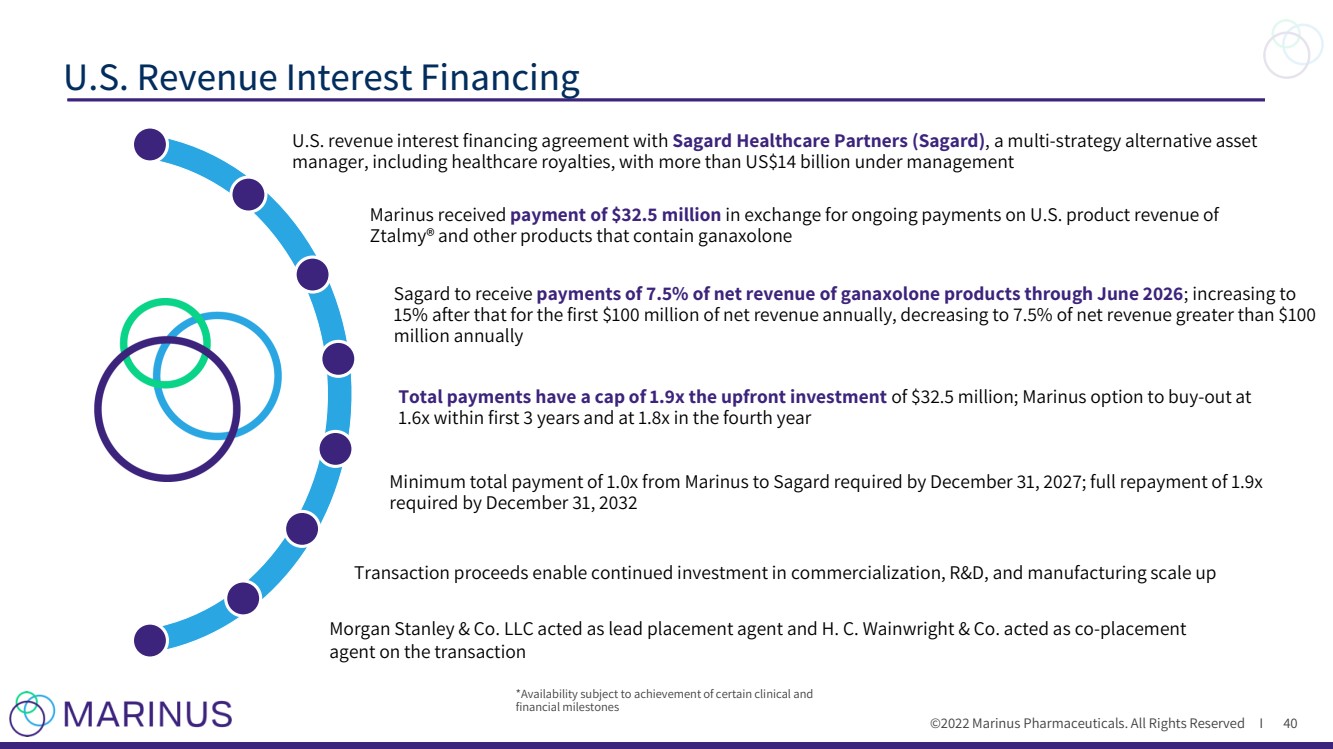
| ©2022 Marinus Pharmaceuticals. All Rights Reserved I U.S. Revenue Interest Financing 40 U. S. revenue interest financing agreement with Sagard Healthcare Partners ( Sagard ) , a multi - strategy alternative asset manager, including healthcare royalties, with more than US$14 billion under management Marinus received payment of $32.5 million in exchange for ongoing payments on U.S. product revenue of Ztalmy ® and other products that contain ganaxolone Sagard to receive payments of 7.5% of net revenue of ganaxolone products through June 2026 ; increasing to 15% after that for the first $100 million of net revenue annually, decreasing to 7.5% of net revenue greater than $100 million annually Total payments have a cap of 1.9x the upfront investment of $32.5 million; Marinus option to buy - out at 1.6x within first 3 years and at 1.8x in the fourth year Transaction proceeds enable continued investment in commercialization, R&D, and manufacturing scale up *Availability subject to achievement of certain clinical and financial milestones Morgan Stanley & Co. LLC acted as lead placement agent and H. C. Wainwright & Co. acted as co - placement agent on the transaction Minimum total payment of 1.0x from Marinus to Sagard required by December 31, 2027; full repayment of 1.9x required by December 31, 2032 |
| Intellectual Property |
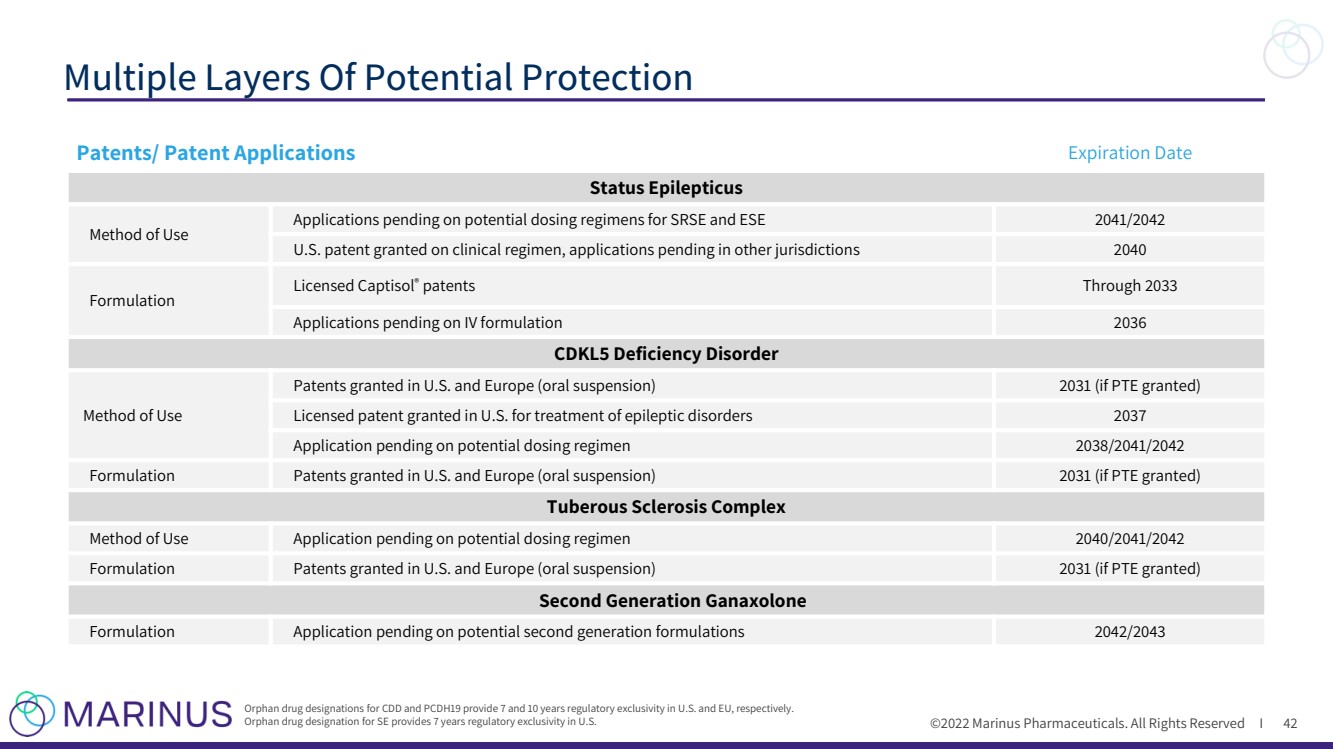
| ©2022 Marinus Pharmaceuticals. All Rights Reserved I Multiple Layers Of Potential Protection 42 Orphan drug designations for CDD and PCDH19 provide 7 and 10 years regulatory exclusivity in U.S. and EU, respectively. Orphan drug designation for SE provides 7 years regulatory exclusivity in U.S. Patents/ Patent Applications Expiration Date Status Epilepticus Method of Use Applications pending on potential dosing regimens for SRSE and ESE 2041/2042 U.S. patent granted on clinical regimen, applications pending in other jurisdictions 2040 Formulation Licensed Captisol ® patents Through 2033 Applications pending on IV formulation 2036 CDKL5 Deficiency Disorder Method of Use Patents granted in U.S. and Europe (oral suspension) 2031 (if PTE granted) Licensed patent granted in U.S. for treatment of epileptic disorders 2037 Application pending on potential dosing regimen 2038/2041/2042 Formulation Patents granted in U.S. and Europe (oral suspension) 2031 (if PTE granted) Tuberous Sclerosis Complex Method of Use Application pending on potential dosing regimen 2040/2041/2042 Formulation Patents granted in U.S. and Europe (oral suspension) 2031 (if PTE granted) Second Generation Ganaxolone Formulation Application pending on potential second generation formulations 2042/2043 |