
2022年9月12日臨牀和企業最新情況

2前瞻性陳述本演示文稿中的某些陳述屬於1995年《私人證券訴訟改革法》所指的前瞻性陳述。這些陳述可以通過使用“預期”、“相信”、“預測”、“估計”和“打算”或其他與我們的預期、戰略、計劃或意圖有關的類似術語或表達來識別。這些前瞻性陳述是基於我們目前的預期,實際結果可能大不相同。有許多因素可能導致實際事件與這些前瞻性陳述所表明的情況大不相同。這些因素包括但不限於:我們對額外資金的需求;我們持續經營的能力;臨牀試驗涉及一個漫長而昂貴的過程,結果不確定,早期研究和試驗的結果可能不能預測未來的試驗結果;我們的臨牀試驗可能會因為意外的副作用或其他安全風險而暫停或停止,這些風險可能會阻止我們的候選產品獲得批准;我們的臨牀試驗可能會在啟動或登記方面遇到影響試驗讀數的成本和時間的延遲;前瞻性表述包括與業務中斷相關的風險,包括新冠肺炎冠狀病毒的爆發可能會嚴重損害我們的財務狀況並增加我們的成本開支;政府或第三方付款人償付的不確定性;對關鍵人員的依賴;營銷和銷售經驗有限;激烈的競爭;專利保護和訴訟的不確定性;對第三方的依賴;監管風險;以及因未能獲得FDA的許可或批准以及不遵守FDA的監管而帶來的風險。不能保證我們的任何技術或產品都會被利用或被證明是商業上的成功。另外, 不能保證未來的臨牀試驗會完成或成功,也不能保證任何精準藥物療法的任何適應症都會獲得監管部門的批准,或者被證明是商業上的成功。投資者應閲讀我們截至2021年12月31日的10-K表格中列出的風險因素,以及提交給美國證券交易委員會的其他定期報告。雖然這裏提出的因素清單被認為具有代表性,但任何此類清單都不應被視為所有潛在風險和不確定因素的完整陳述。未列入清單的因素可能會對實現前瞻性陳述構成更多的重大障礙。本文中包含的前瞻性陳述是截至本文發佈之日作出的,我們不承擔公開更新此類陳述以反映後續事件或情況的任何義務。
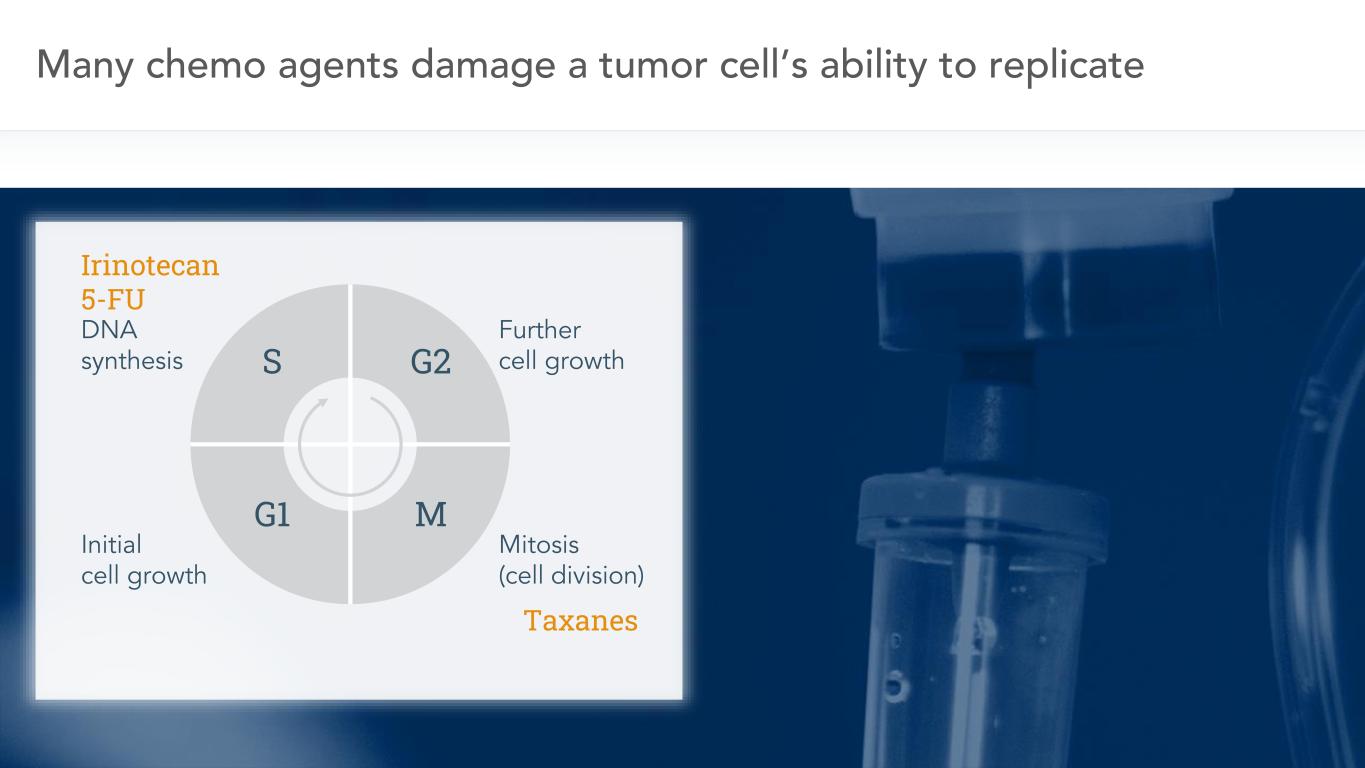
3許多化療藥物破壞腫瘤細胞複製DNA合成的能力初始細胞生長進一步細胞生長有絲分裂(細胞分裂)

4種癌症之所以茁壯成長,是因為它們優先考慮DNA複製和細胞分裂
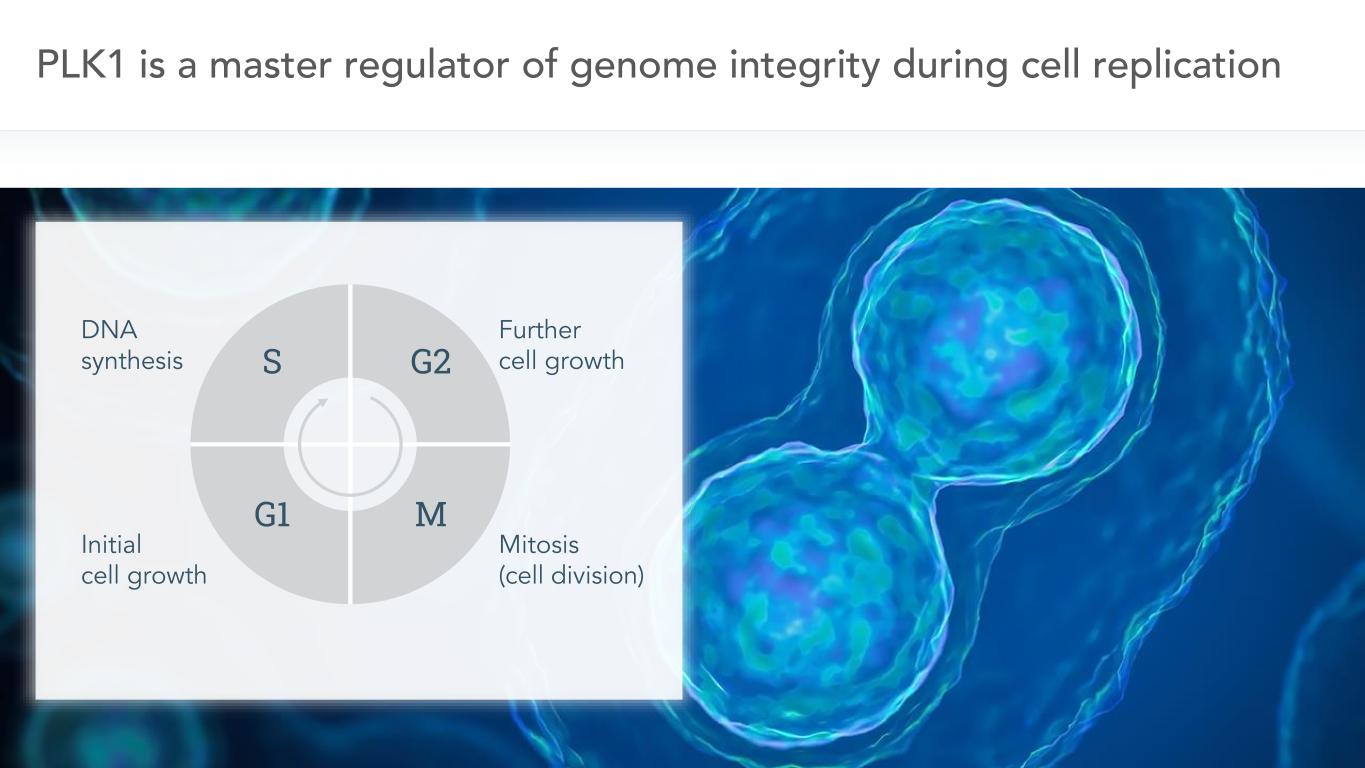
5 PLK1是細胞複製過程中基因組完整性的主要調節者DNA合成初始細胞生長進一步細胞生長有絲分裂(細胞分裂)S G2 G1 M
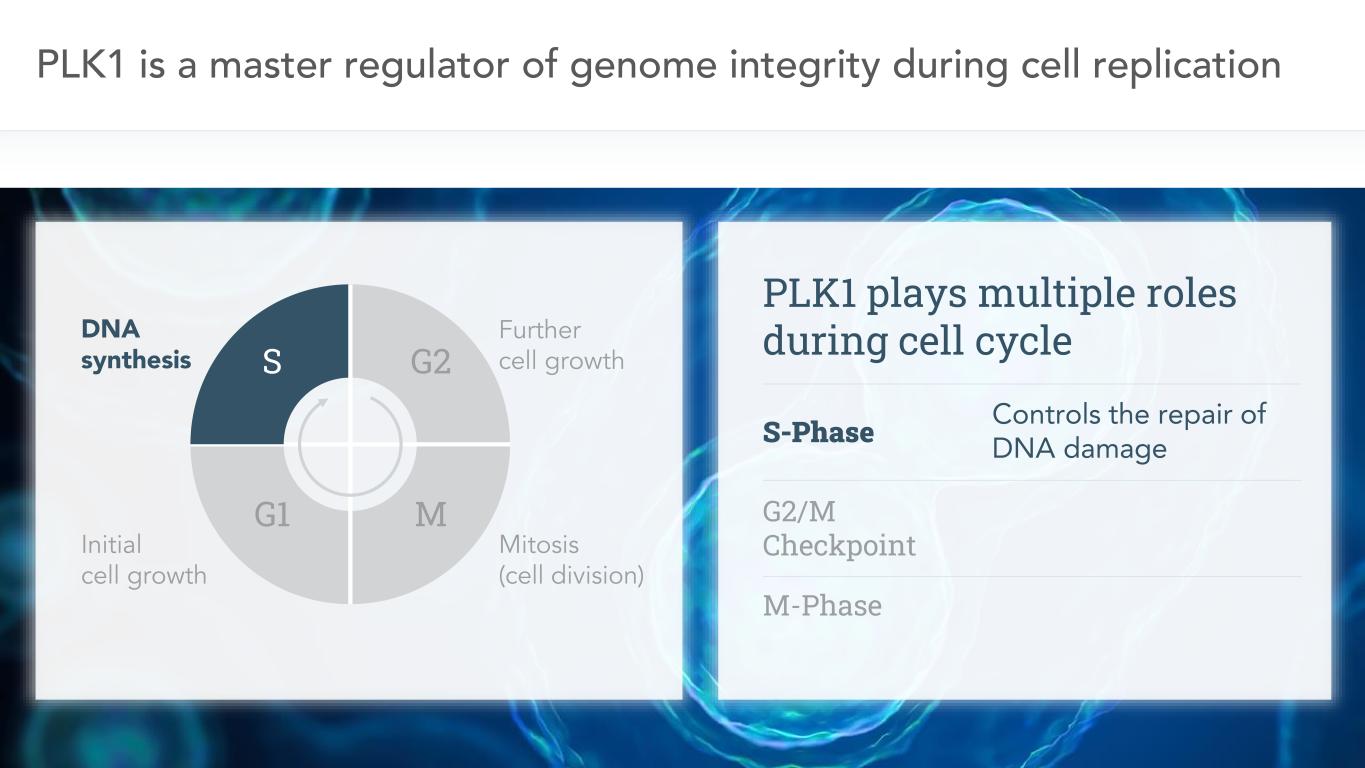
6 PLK1是細胞複製、DNA合成、初始細胞生長、細胞進一步生長、有絲分裂(細胞分裂)過程中基因組完整性的主要調節者。G2、G1、M、S、PLK1在細胞週期中發揮多重作用,S期控制DNA損傷的修復,G2/M期檢查點M期
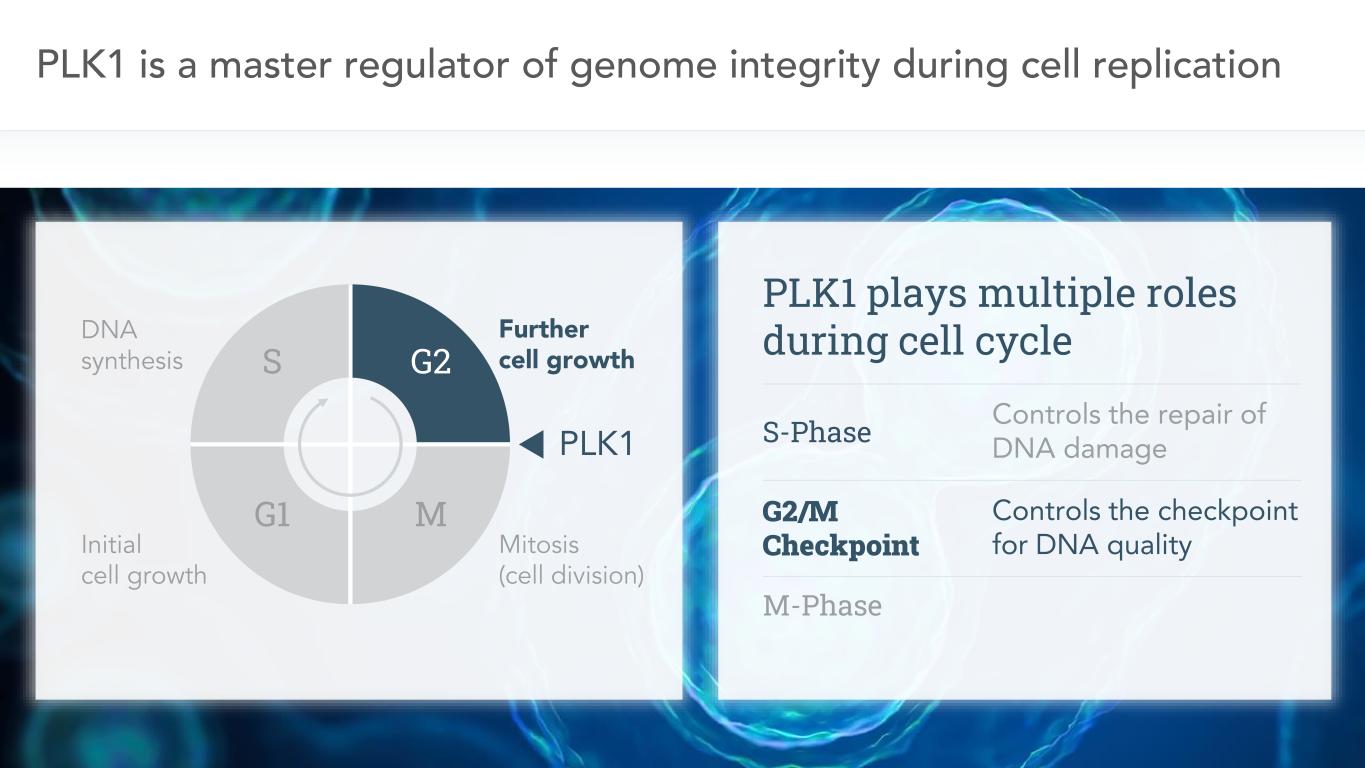
7 PLK1是細胞複製、DNA合成、初始細胞生長、細胞進一步生長、有絲分裂(細胞分裂)過程中基因組完整性的主要調節者。在細胞週期中,PLK1發揮多重作用,控制DNA損傷的修復;G2/M檢查點控制DNA質量的檢查點;M期

8、PLK1是細胞複製、DNA合成、細胞初始生長、細胞進一步生長、有絲分裂(細胞分裂)過程中基因組完整性的主要調節者。G2、G1、S、M、PLK1在細胞週期中發揮多重作用,控制DNA損傷的修復,G2/M檢查點控制DNA質量的檢查點,M期控制染色體的分離
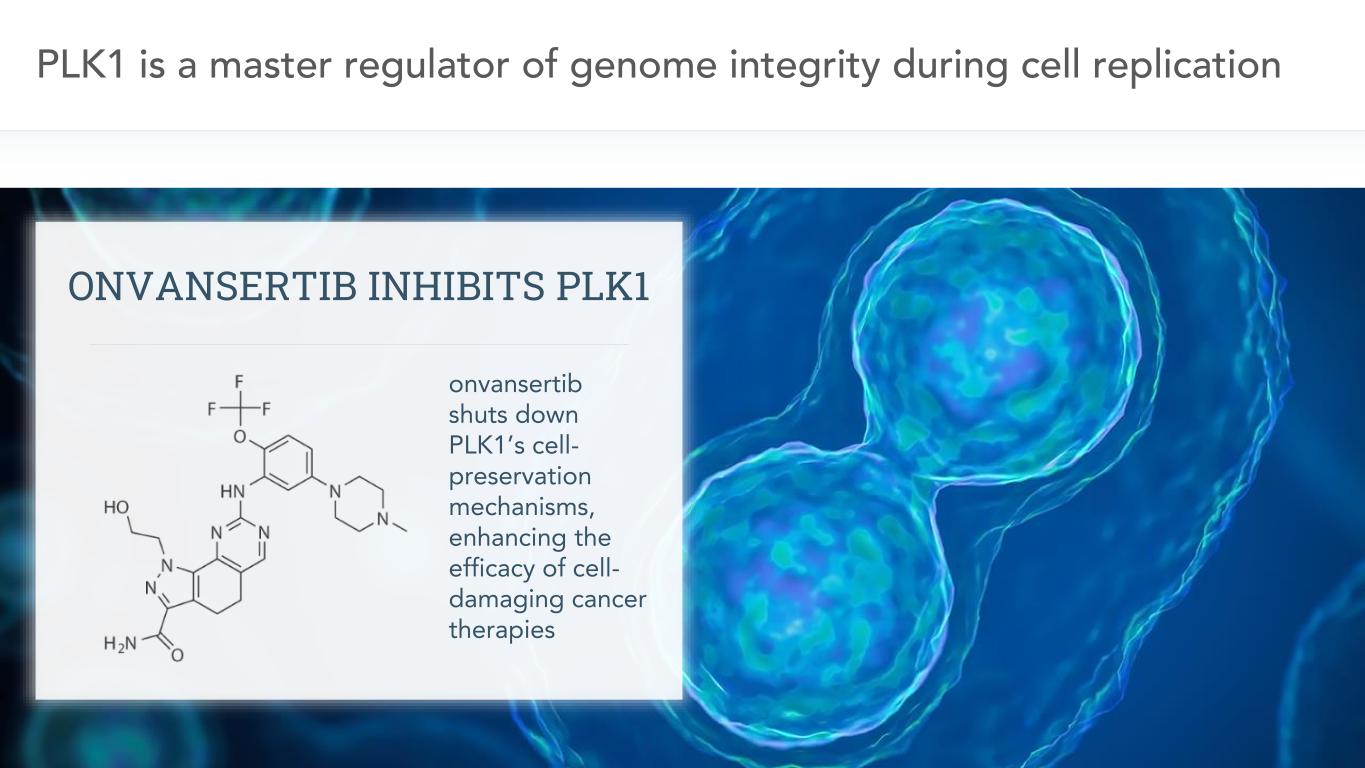
9在細胞複製過程中,PLK1是基因組完整性的主要調節者,Vansertib關閉PLK1的細胞保存機制,增強細胞破壞性癌症治療的療效

10 Onvansertib定位卡迪夫腫瘤學有效靶向PLK1·小分子·口服給藥·24小時半衰酶IC50(微米)PLK1 0.002 PLK2>10.000 PLK3>10.000 CK2 0.400 Flt3 0.400 CDK1/CycB>10.000 42其他激酶和>10.000微孔板>10.000對於PLK1特異性

11兩個目標推動我們的近期臨牀開發計劃1通過隨機試驗驗證先前的mCRC數據2展示附加適應症的臨牀POC 2022 2023 2024第一季度第二季度第三季度第四季度的目標
12今天我們將看到我們在哪裏,我們將在哪裏加速我們的mCRC計劃額外的onvansertib計劃初步試驗:階段1b/2下一次試驗

13今天,我們將看到我們所處的位置,以及我們將向何處去加速我們的mCRC計劃額外的治療胰腺癌(MPDAC)三陰性乳腺癌(TNBC)小細胞肺癌(SCLC)前列腺癌(MCRPC)

14初步試驗:1b/2階段下一次試驗加速我們的mCRC計劃額外的onvansertib計劃
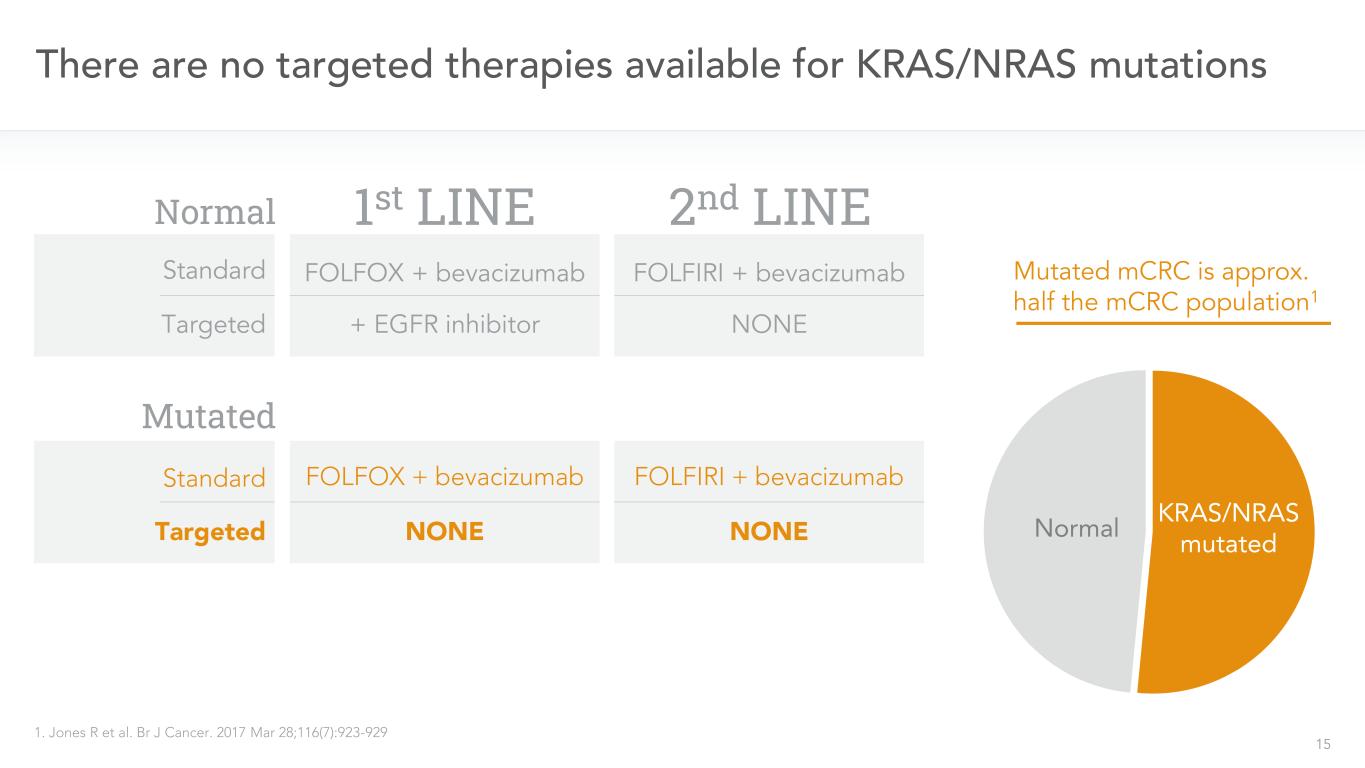
15沒有針對KRAS/NRAS突變的靶向治療1.Jones R等人。BR J癌症。2017年3月28日;116(7):923-929一線二線靶向FOLFIRI+貝伐珠單抗FOLFOX+貝伐珠單抗FOLFOX+貝伐珠單抗+EGFR抑制劑KRAS/NRAS突變正常無標準靶向FOLFOX+貝伐珠單抗FOLFIRI+貝伐珠單抗無突變mCRC約為一半的mCRC人口1

16二線mCRC患者的預後很差*Bennouna等人,《柳葉刀》2013;14:29-37;Giessen等,《腫瘤學報》,2015,54:187-193;Cremolini等,《柳葉刀》2020,21:497-507;Antoniotti等,《通信柳葉刀》,2020年6月。MCRC:轉移性結直腸癌二線FOLFIRI+貝伐單抗無既往ORR 5%11.4%13%2006-2008 2000-2013 2015-2017*一線正常突變標準靶向FOLFOX+貝伐單抗+EGFR抑制劑標準靶向非FOLFOX+貝伐單抗FOLFIRI+貝伐單抗
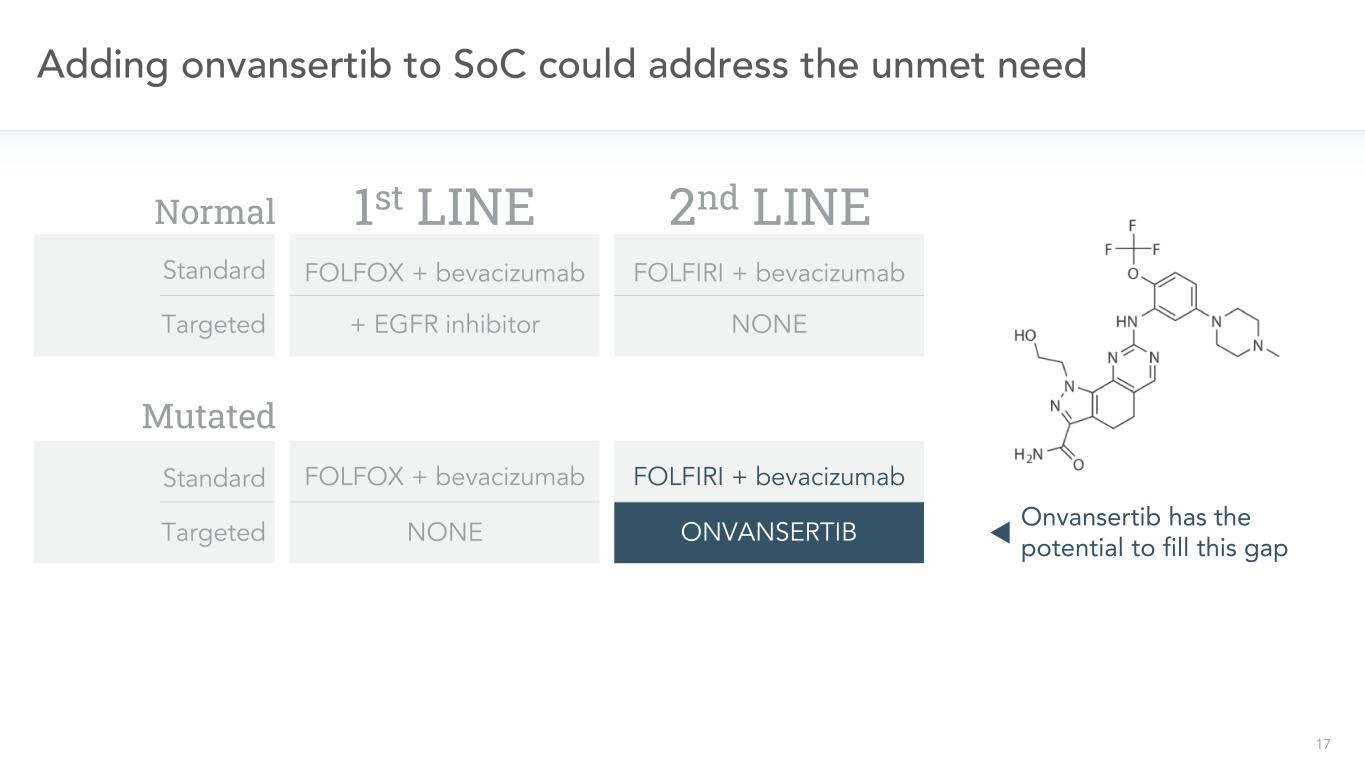
17在SoC中加入onvansertib可以解決未滿足的需求二線FOLFIRI+貝伐單抗非FOLFIRI+貝伐單抗一線靶向FOLFOX+貝伐單抗+EGFR抑制劑標準靶向FOLFOX+貝伐單抗Onvansertib具有填補這一空白的潛力
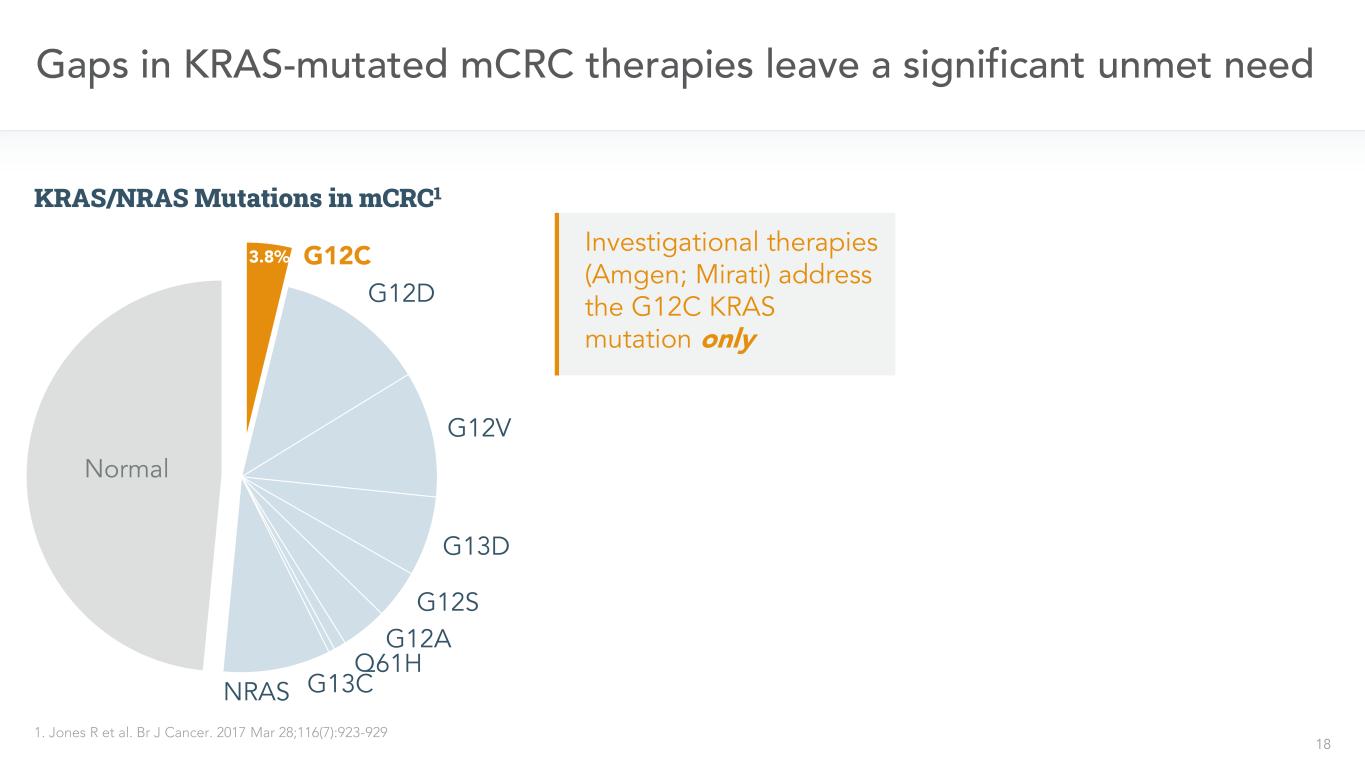
18 G12C G12D G12V G13D G12S G12A Q61H G13CNRAS KRAS突變mCRC治療中的正常缺口留下了一個顯著的未得到滿足的需求1。BR J癌症。2017年3月28日;116(7):923-929 3.8%研究療法(安進;米拉蒂)僅針對mCRC1中的G12C KRAS突變和KRAS/NRAS突變
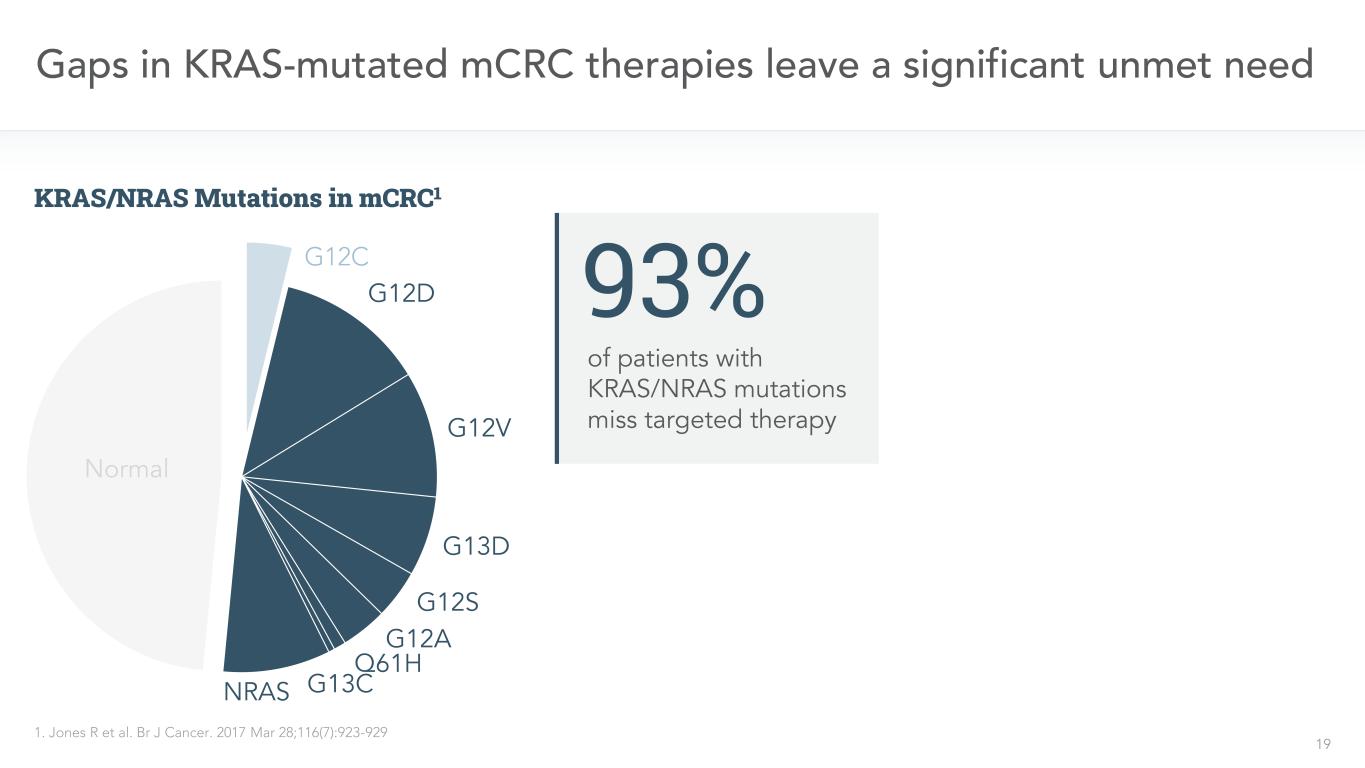
KRAS突變的mCRC治療中的19個缺口留下了一個重大的未得到滿足的需求1。BR J癌症。2017年3月28日;116(7):923-929例KRAS/NRAS突變患者未達到預期靶向治療93%G12C G12D G12V G13D G12S G12A Q61H G13CNRAS正常mCRC1中的KRAS/NRAS突變
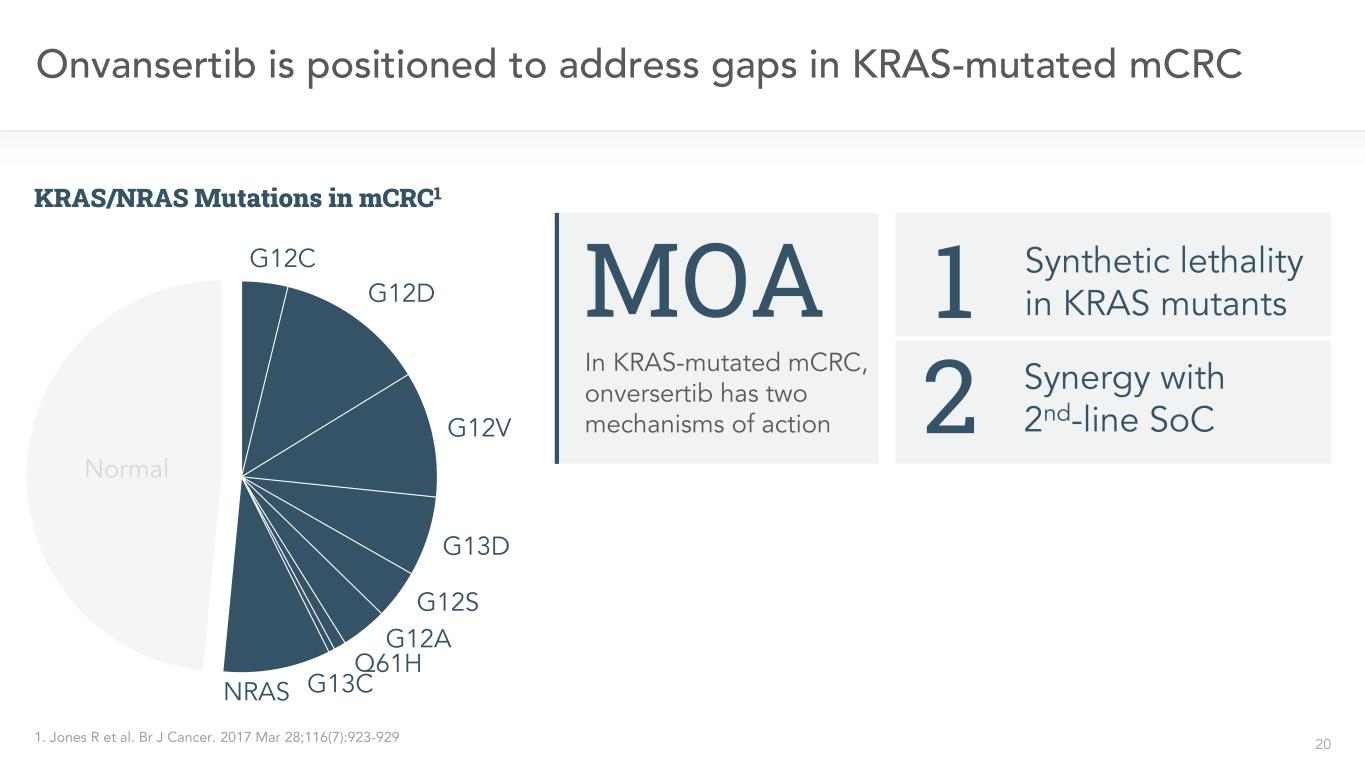
20 Onvansertib定位於解決KRAS突變的mCRC中KRAS突變的mCRC MOA的空白,onversertib有兩種作用機制1。BR J癌症。2017年3月28日;116(7):923-929與二線SOC2的協同作用KRAS突變體1G12C G12D G12V G13D G12A Q61H G13CNRAS正常的KRAS/NRAS突變
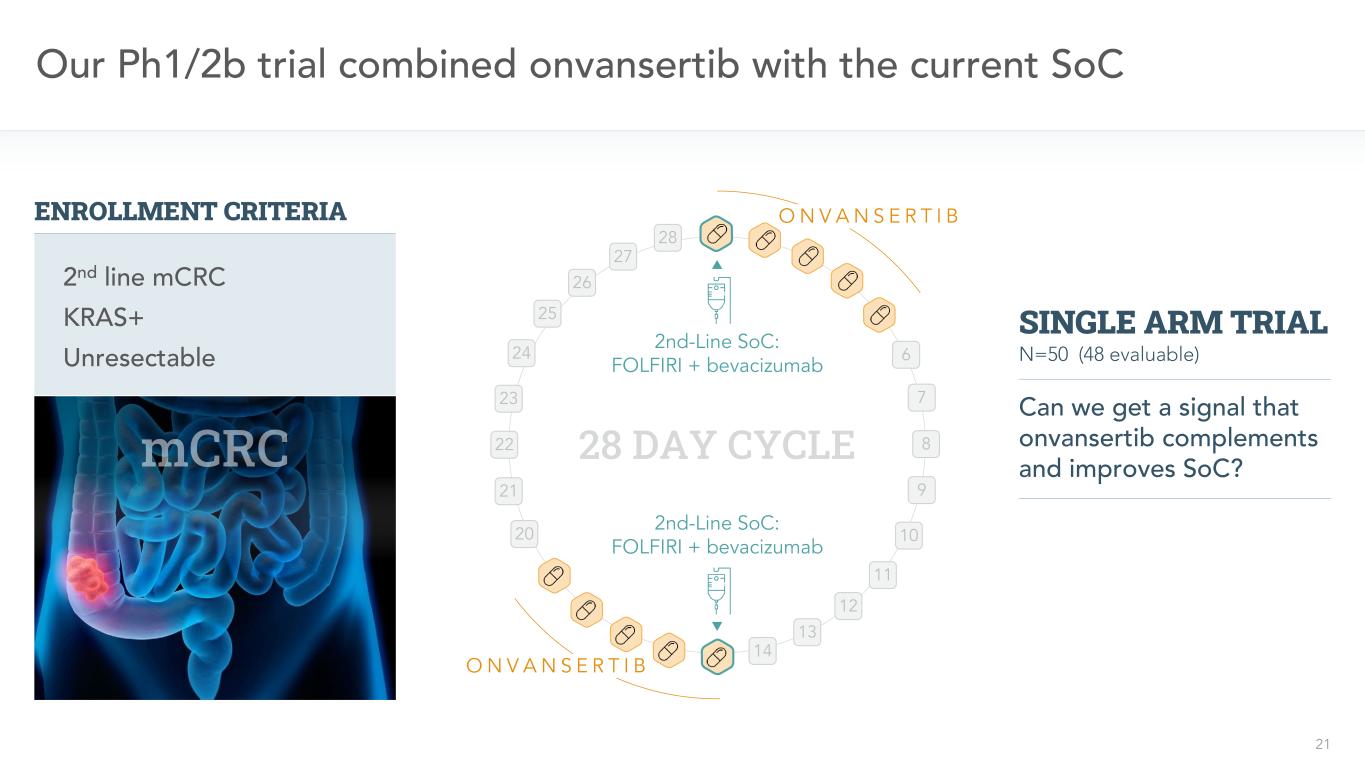
21二線SoC:FOLFIRI+貝伐單抗二線SoC:FOLFIRI+貝伐單抗28天週期我們的PH1/2b試驗將onvansertib與當前的SoC 6 7 8 9 10 11 12 13 14 20 21 22 23 24 25 26 27 28 O N V A N S E R T I B O N V A N S E R T I B KRAS+不可切除的二線mCRC註冊標準N=50(48可評估)我們能得到onvansertib補充和改進SoC的信號嗎?單臂試驗

22二線SoC:FOLFIRI+貝伐單抗二線SoC:FOLFIRI+貝伐單抗28天週期6 7 8 9 10 11 12 13 14 20 21 22 23 24 25 26 26 27 28 O N V A N S R T I B O N V A N S E R T I B KRAS+不可切除的二線mCRC登記標準N=50(48可評估)我們能得到一個信號,表明onvansertib補充和改善了SoC嗎?單臂試驗我們的PH1/2b試驗評估了安全性、有效性和應答生物標記物療效終點主要:接受≥1週期治療的患者的RECIST V1.1的客觀應答率(ORR)1次級:無進展生存期(PFS)和應答持續時間(DOR)2探索性:KRAS突變負擔的減少和對治療的應答3 22
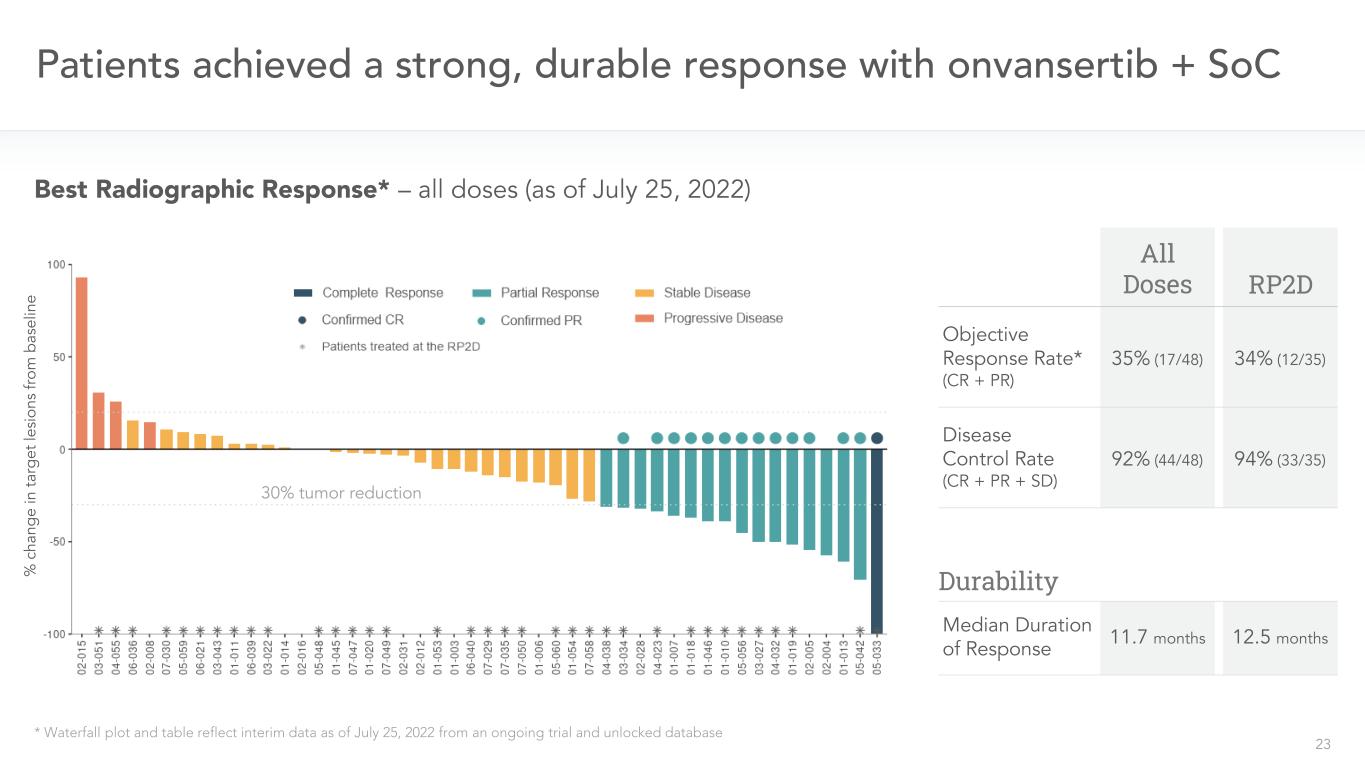
23名患者使用onvansertib+SoC*瀑布圖和表格反映了截至2022年7月25日正在進行的試驗的中期數據和解鎖的數據庫最佳放射反應*-所有劑量(截至7月25日,2022年)所有劑量的RP2D目標緩解率*(CR+PR)34%(12/35)35%(17/48)疾病控制率(CR+PR+SD)92%(44/48)中位緩解期12.5個月11.7個月94%(33/35)腫瘤減少耐受性30%
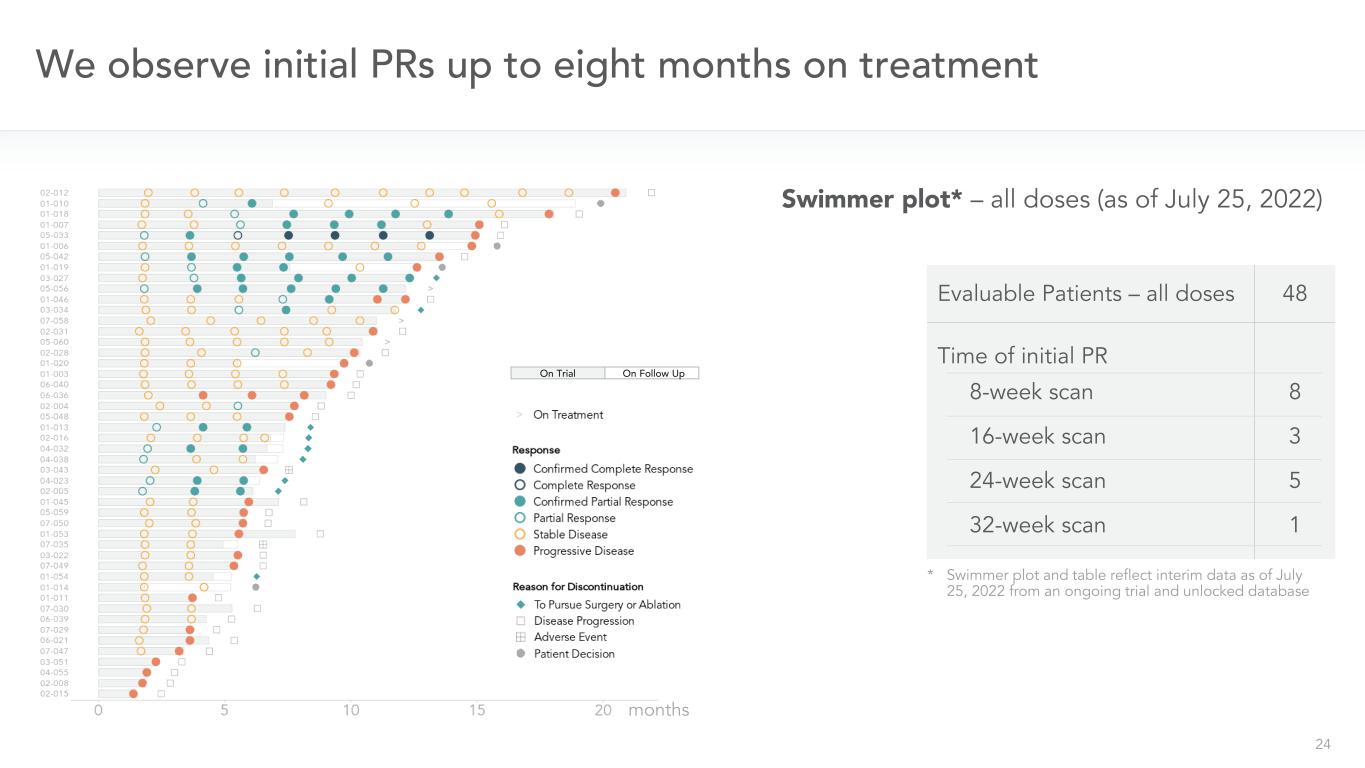
24我們在治療中觀察初始PR長達8個月*游泳者曲線圖和表格反映了截至2022年7月25日的中期數據,來自正在進行的試驗和未鎖定的數據庫可評估患者-所有劑量48次初始PR 8周掃描16周掃描24周掃描32周掃描8 3 5 1游泳者曲線圖*-所有劑量(截至2022年7月25日)在隨訪月中試驗
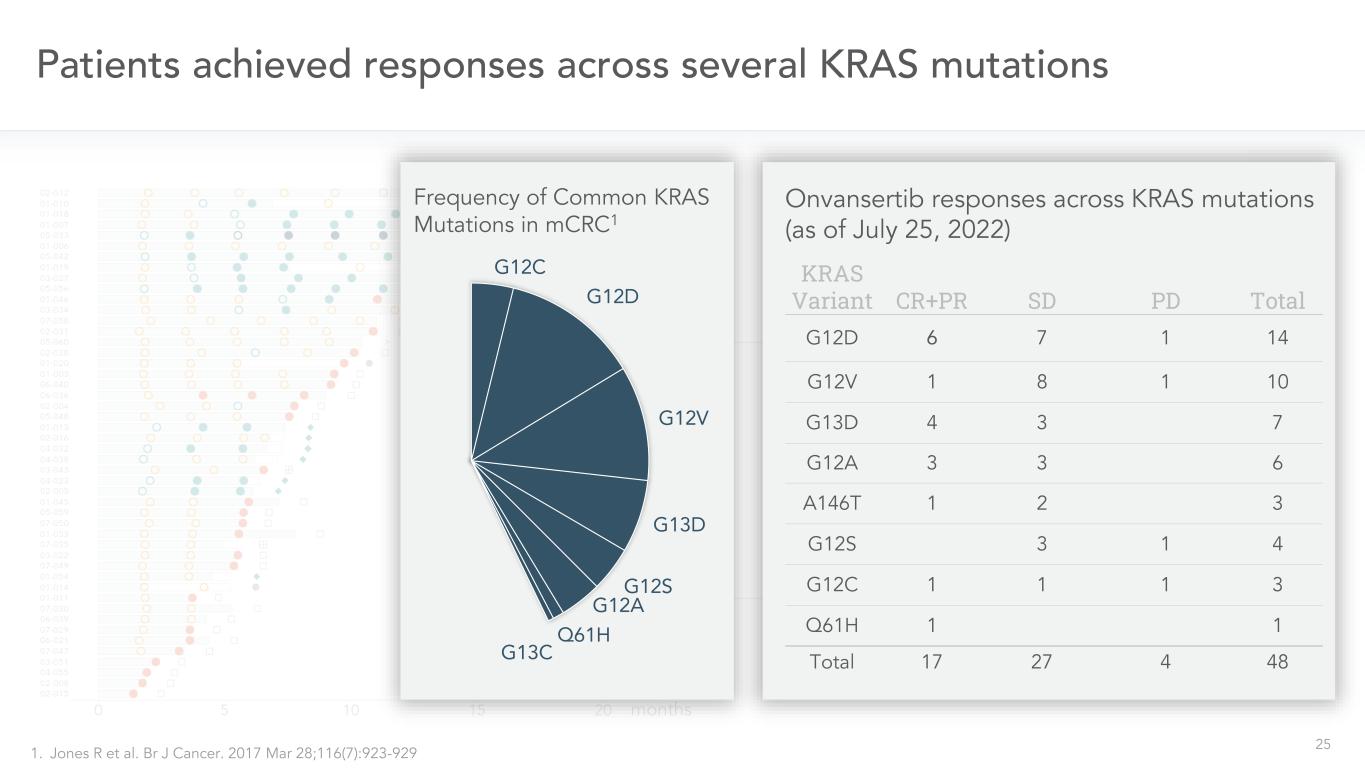
25名患者在幾個可評估的KRAS突變患者中實現了應答-所有劑量48次初始PR 8周掃描16周掃描24周掃描32周掃描8 3 5 1游泳圖*-所有劑量(截至2022年7月25日)月KRAS變體CR+PR SD PD Total G12D 6 7 1 14 G12V 1 8 1 10 G13D 4 3 7 G12A 3 3 6 A146T 1 2 3 G12S 3 1 4 G12C 1 1 1 3 Q61H1總計17 27 4 48 Onvansertib在KRAS突變中的反應(截至2022年7月25日)mCRC1.R Jones等人的常見KRAS突變頻率BR J癌症。2017年3月28日;116(7):923-929 G12C G12D G12V G13D G12S G12A Q61H G13C
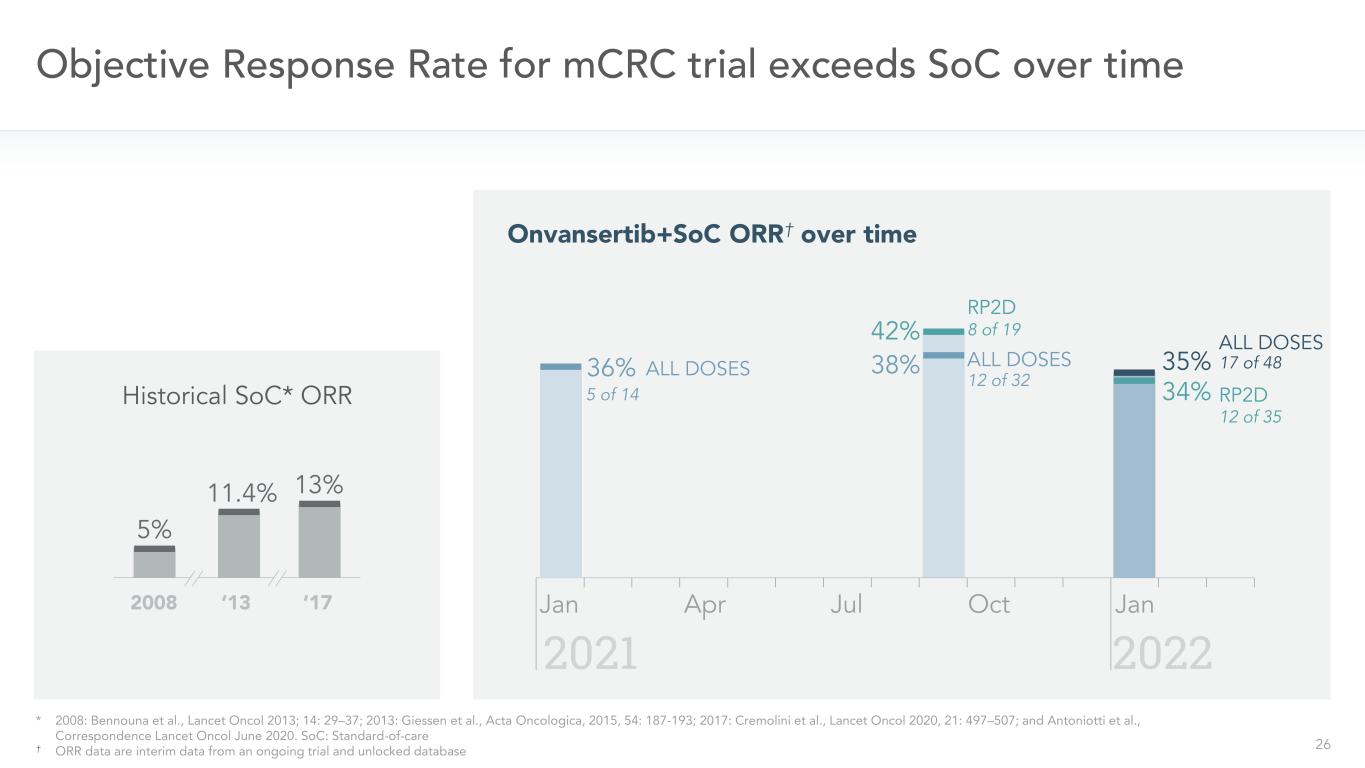
26 2008年‘13’17年mCRC試驗的客觀應答率超過SOC 42%RP2D Onvansertib+SOC ORR†隨時間推移38%所有劑量歷史SOC*ORR 8/19 5%11.4%13%20222021 1/35 17/4836%1/14劑量*2008年:本努納等,《柳葉刀》2013年;14:29-37;2013年:吉森等,腫瘤學報,2015年,54:187-193;2017年:克里莫里尼等,《柳葉刀》,2020年,21:497-507;和Antoniotti等人,《通信柳葉刀》,2020年6月。SOC:標準護理†ORR數據是來自正在進行的試驗和解鎖數據庫的臨時數據

27隨着時間的推移,mCRC試驗的無進展生存期超過了SOC*2008年:Bennouna等人,《柳葉刀》2013;14:29-37;2013:Giessen等,《腫瘤學報》,2015,54:187-193;2017:Cremolini等,《柳葉刀》2020,21:497-507;Antoniotti等,《通信柳葉刀》2020年6月。SOC:標準護理†MPFS是來自正在進行的試驗和解鎖數據庫的臨時數據。無進展生存期†-所有劑量(截至2022年7月25日)9.3歷史SOC*MPFS(Mo)2008 2013 5.7 2017 4.5 5.6 0.00 0.25 0.50 0.75 1.00 Pr ob abtity of S ur vi va l 0 5 10 15 20個月中位PFS:
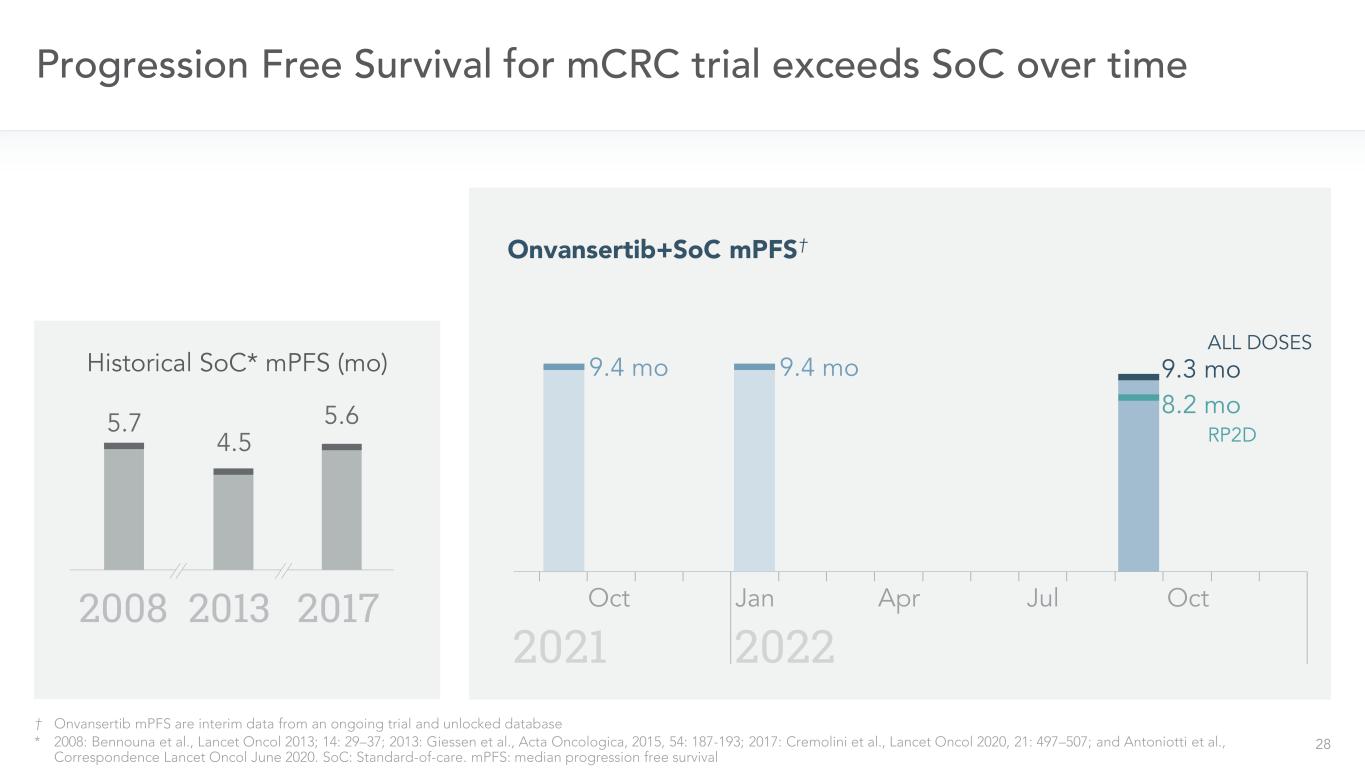
28†Onvansertib MPF是來自正在進行的試驗和解鎖數據庫的臨時數據*2008年:本努納等人,《柳葉刀》2013年;14:29-37;2013年:吉森等人,《腫瘤學報》,2015,54:187-193;2017年:克里莫里尼等,《柳葉刀》2020,21:497-507;以及Antoniotti等,《通信柳葉刀》2020年6月。SOC:護理標準。MPFS:†9.4mo 20222021 10月9.4mo 4月10月9.3mo歷史SOC*MPFS(Mo)20082013年20175.55.6RP2D 8.2mo所有劑量

29 Onvansertib與FOLFIRI-BEV聯合使用耐受性良好*截至2022年7月25日的臨時數據來自正在進行的試驗和解鎖的數據庫。N:患者數量(總數N=50);顯示的事件發生在≥中的患者佔10%;數字表示經歷該事件的患者數量(不管因果關係如何);每個患者只計算一次,且僅針對給定事件的最高級別。−:治療突發不良事件†肌肉骨骼疼痛、感染和出血彙集在一起沒有重大/意想不到的毒副作用等級TEAE*1 2 3 4所有中性粒細胞減少症1 13 15 6 35疲乏15 15 3 0 33噁心24 7 2 0 33腹瀉15 7 2 0 24腹痛13 7 1 0 21粘膜炎11 6 2 0 19脱髮17 2 0 19血小板減少10 4 1 0 15高血壓2 8 5 0 15·在所有TEAE中,僅11%(84/788)為G3/G4·7患者共發生11個G4不良事件:TEAEs中性粒細胞減少(n=7);白細胞減少(n=2);中性粒細胞減少(n=1);高磷血癥(n=1)·停用5-FU+使用生長因子改善了中性粒細胞減少的嚴重程度*1 2 3 4全部貧血9 4 1 0 14嘔吐9 3 1 0 13肌肉骨骼疼痛†11 1 0 12感染†3 4 4 0 11出血†8 0 1 09頭痛7 0 07神經病5 2 0 7 GERD 7 0 0 7 ALT增加4 0 0 5

30試驗的患者人口統計數據反映了二線mCRC人口*數據是截至2022年7月25日的臨時數據,來自正在進行的試驗和解鎖的數據庫,適用於前50名受試者。患者數量(N)1b期,劑量水平0 Onvansertib 12 mg/m2階段1b,劑量水平+1 Onvansertib 15 mg/m2階段1b,劑量水平+2 Onvansertib 18 mg/m2階段2 RP2D Onvansertib 15 mg/m2總患者治療6 6 32 50目前正在治療0 03總患者N=50中位數[量程]或n(%)年齡(年)61[35-83]性別男性28(56%)女性22(44%)ECOG 0.33(66%)1 17(34%)原發灶結腸癌27(54%)直腸18(36%)其他5(10%)總患者N=50中位數n(%)肝轉移13(26%)肝臟和其他27(54%)僅肝臟10(20%)轉移器官數目116(32%)≥234(68%)接受貝伐單抗治療5是35(70%)否15(30%)登記人數*
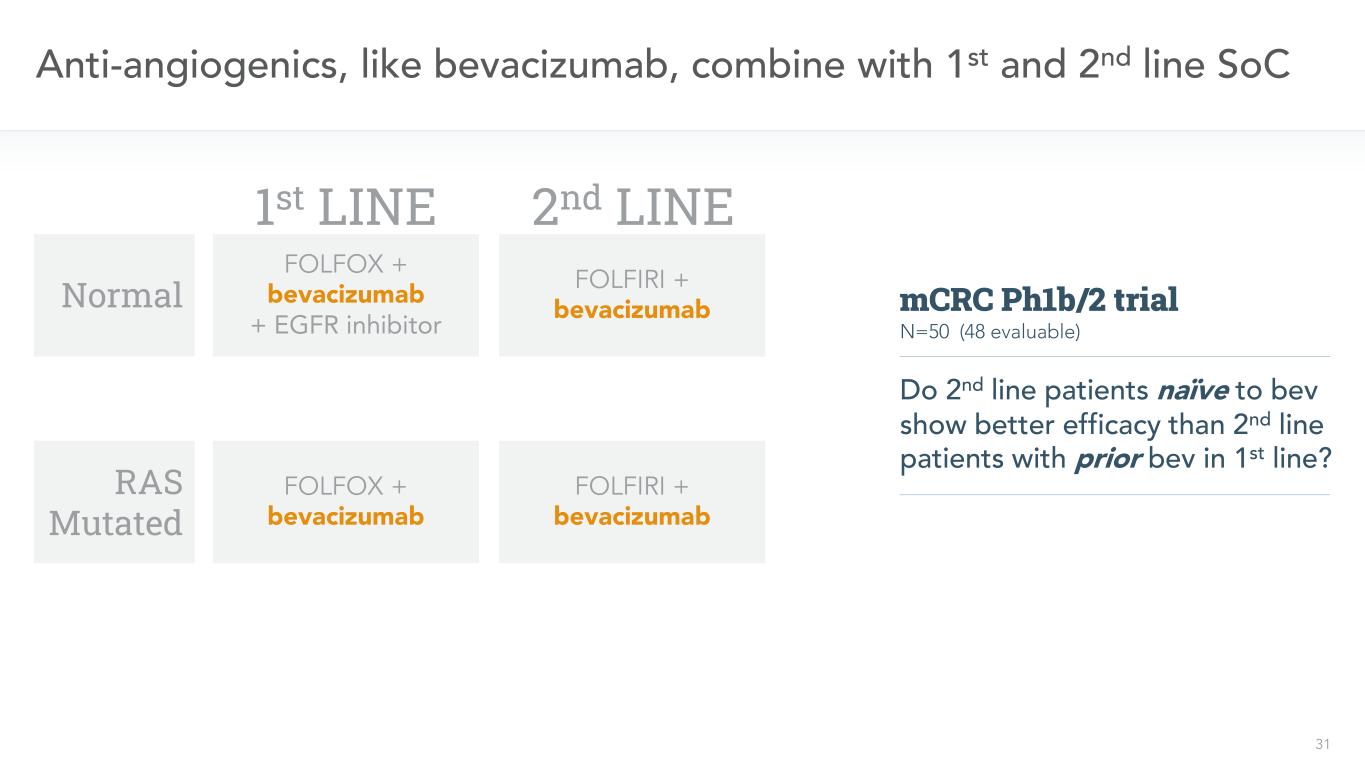
31種抗血管生成藥物,如貝伐單抗,聯合一線和二線SoC正常RAS突變一線FOLFOX+貝伐單抗+EGFR抑制劑FOLFOX+貝伐單抗二線FOLFIRI+貝伐單抗FOLFIRI+貝伐單抗N=50(48可評估)單純至BEV的二線患者是否比一線接受BEV治療的二線患者顯示出更好的療效?MCRC PH1b/2試驗
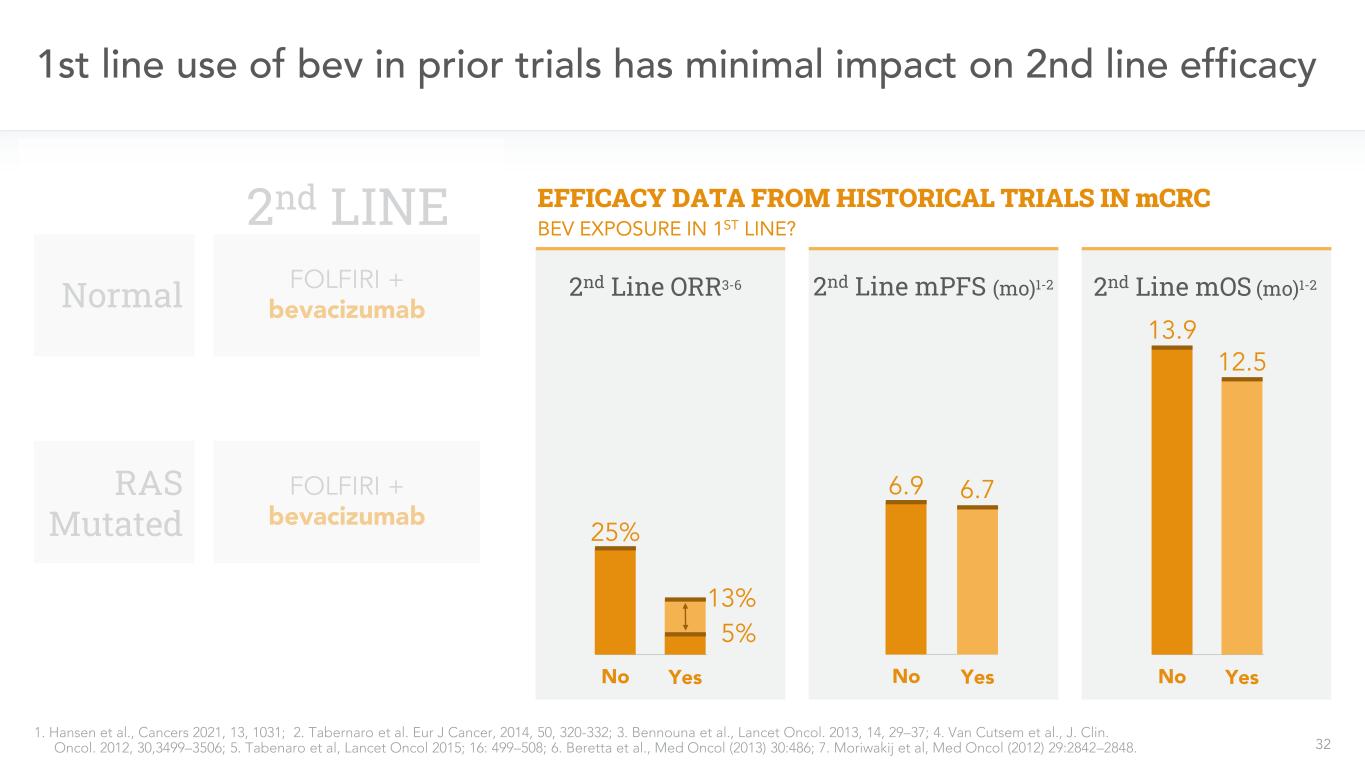
32在先前的試驗中,一線使用Bev對二線療效的影響很小1.Hansen等人,癌症2021,13,1031;2.Tabernaro等人。歐洲癌症雜誌,2014,50,320-332;3.本努納等人,《柳葉刀》。2013,14,29-37;4.Van Cutsem等人,J.Clin。奧科爾。2012,30,3499-3506;5.Tabenaro等,《柳葉刀》2015;16:499-508;6.Beretta等,Med Onol(2013)30:486;7.Moriwakij等,Med Onol(2012)29:2842-2848。MCRC第二線MOS(Mo)1-2 13.9 12.5歷史試驗中正常RAS突變的療效數據1-2 13.9 12.5否是第二線MPFS(Mo)1-2 6.9 6.7否是第二線FOLFIRI+貝伐單抗FOLFIRI+貝伐單抗第二線ORR3-6 25%13%否是第一線5%Bev暴露?
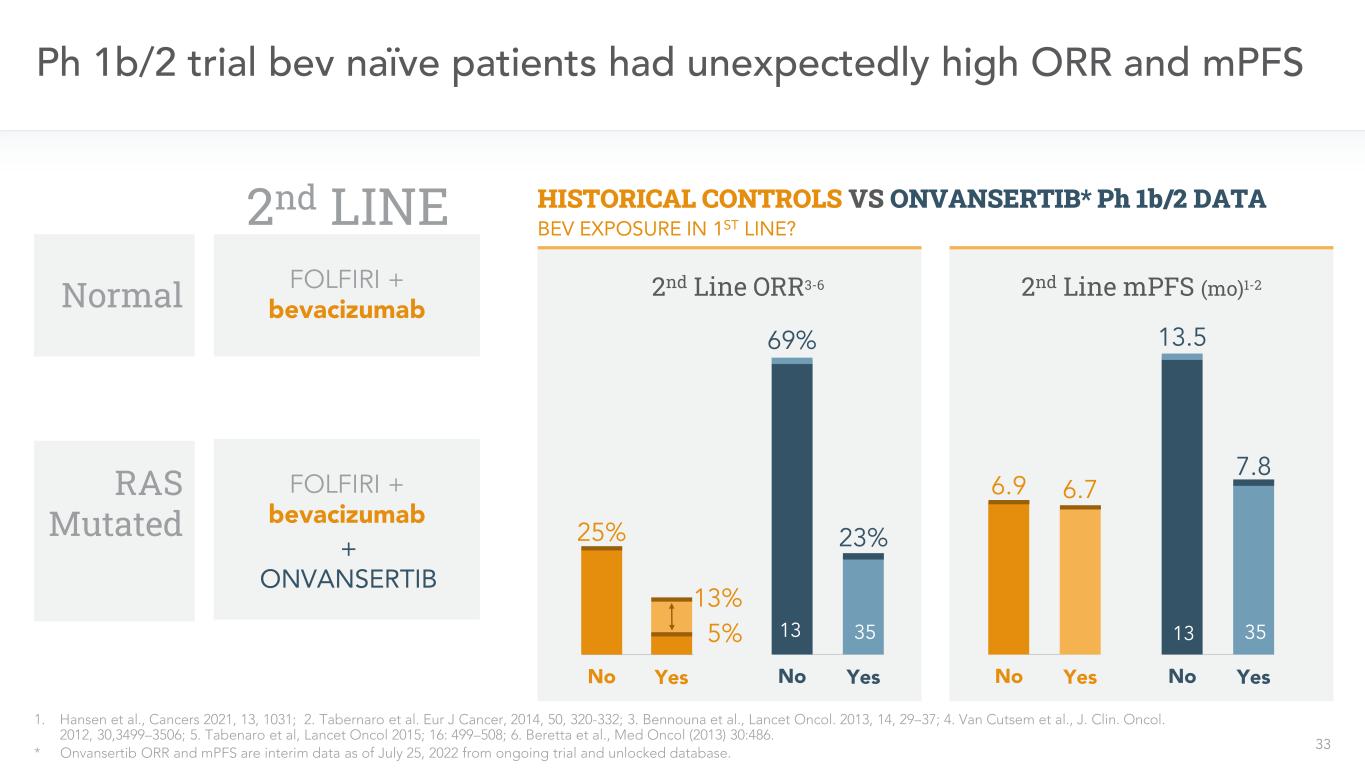
33名Ph 1b/2試驗的天真患者有出人意料的高ORR和MPFS 1.Hansen等人,癌症2021,13,1031;2.Tabernaro等人。歐洲癌症雜誌,2014,50,320-332;3.本努納等人,《柳葉刀》。2013,14,29-37;4.Van Cutsem等人,J.Clin。奧科爾。2012,30,3499-3506;5.Tabenaro等人,《柳葉刀》2015;16:499-508;6.Beretta等,Med Onol(2013)30:486。*Onvansertib ORR和MPFS是截至2022年7月25日的臨時數據,來自正在進行的試驗和解鎖的數據庫。正常歷史對照與ONVANSERTIB*Ph1b/2數據第二行MPFS(Mo)1-2 6.9 6.7否是第二行FOLFIRI+貝伐單抗第二行ORR3-6 25%13%否是5%13.5 7.8否是69%23%否是13 FOLFIRI+貝伐單抗+ONVANSERTIB Bev暴露在第一行?RAS突變35 3513
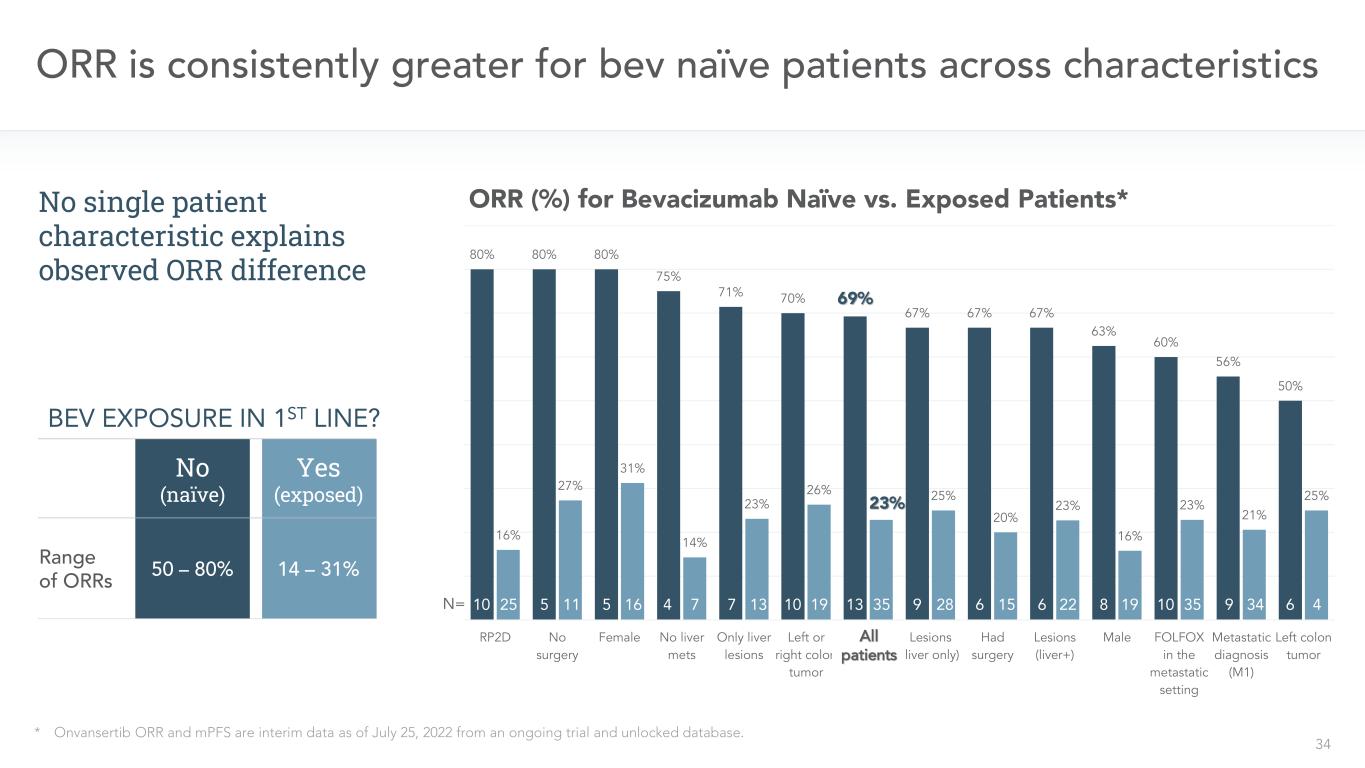
34 80%80%80%75%71%70%69%67%67%67%63%60%56%50%16%27%31%14%23%26%23%23%25%20%23%16%23%21%25%RP2D無手術女性無肝臟病變左或右結腸癌所有患者(僅肝臟)有手術病變(肝臟+)男性FOLFOX在轉移環境中轉移診斷(M1)左半結腸癌N=ORR跨特徵*Onvansertib ORR和MPFS是截至2022年7月25日的中期數據,來自正在進行的試驗和解鎖的數據庫。10 25 5 11 5 16 4 7 7 13 10 19 13 35 9 28 6 15 6 22 8 19 10 35 9 34 64貝伐單抗與暴露患者的ORR(%)*否(幼稚)是(暴露)ORR範圍14-31%50-80%沒有單一患者特徵解釋觀察到的ORR差異l p-ts Bev在一線?

35潛在的onvansertib beacizumab協同作用是一個新的機會*Onvansertib ORR和MPFS是截至2022年7月25日的中期數據,來自正在進行的試驗和解鎖的數據庫。10 5 11 5 16 4 7 7 13 10 19 13 35 9 28 6 15 6 22 8 19 10 35 9 34 6 4否(幼稚)是(暴露)所有患者23%或R69%或R我們應該如何迴應這一觀察結果?操作機會A。這是統計異常(小數n)嗎?這是由於ONV/BEV的協同效應?假設1.在下一次mCRC試驗的隨機化範圍內對先前的Bev暴露進行分層2.在臨牀前研究中探索明顯的onv/Bev協同作用3.分析Ph1b/2患者的基線ctDNA在Bev幼稚與Bev暴露的基因組變化進行一線探索性mCRC試驗onvansertib+FOLFIRI+Bev RP2D 80%或R16%ORR Bev暴露在一線?

36早期KRAS MAF ctDNA下降與放射學反應的相關性KRAS MAF是截至2022年7月25日的中期數據,來自正在進行的試驗和解鎖的數據庫。K RA S M A F-96-73-63的0-50-100 CR+PR SD PD%C HA在基線(週期1天,給藥前)和治療(週期2的第1天,給藥前)用滴狀數字聚合酶鏈式反應(DdPCR)測量KRAS MAF。1例PR和2例SD患者基線時未檢測到KRAS MAF。預測反應生物標記物·48名可評估患者中有45名評估了KRAS MAF的變化·87.5%(14/16)的CR/PR患者在第一個週期後KRAS MAF下降了90%·32%(8/25)的SD患者和4名PD患者(n=4)在一個28天的治療週期(截至2022年7月25日的平均值±SD)後沒有這樣的下降%KRAS突變等位基因頻率(MAF)*下降。平均分-90

37 KRAS MAF的早期變化預測臨牀反應Onvansertib ORR和MPFS是截至2022年7月25日的臨時數據,來自正在進行的試驗和解鎖的數據庫。或(%)9%2在23個KRAS非響應者中64%14在22個KRAS響應者中14 12.6個月MPFS(Mo)6.0個KRAS響應者KRAS非響應者P=0.0190.00 0.25 0.50 0.75 1.00 KRAS非響應者0 5 10 15 20個月KRAS響應者KRAS非響應者12.66.0

38初步試驗:1b/2階段下一次試驗加速我們的mCRC計劃額外的onvansertib計劃
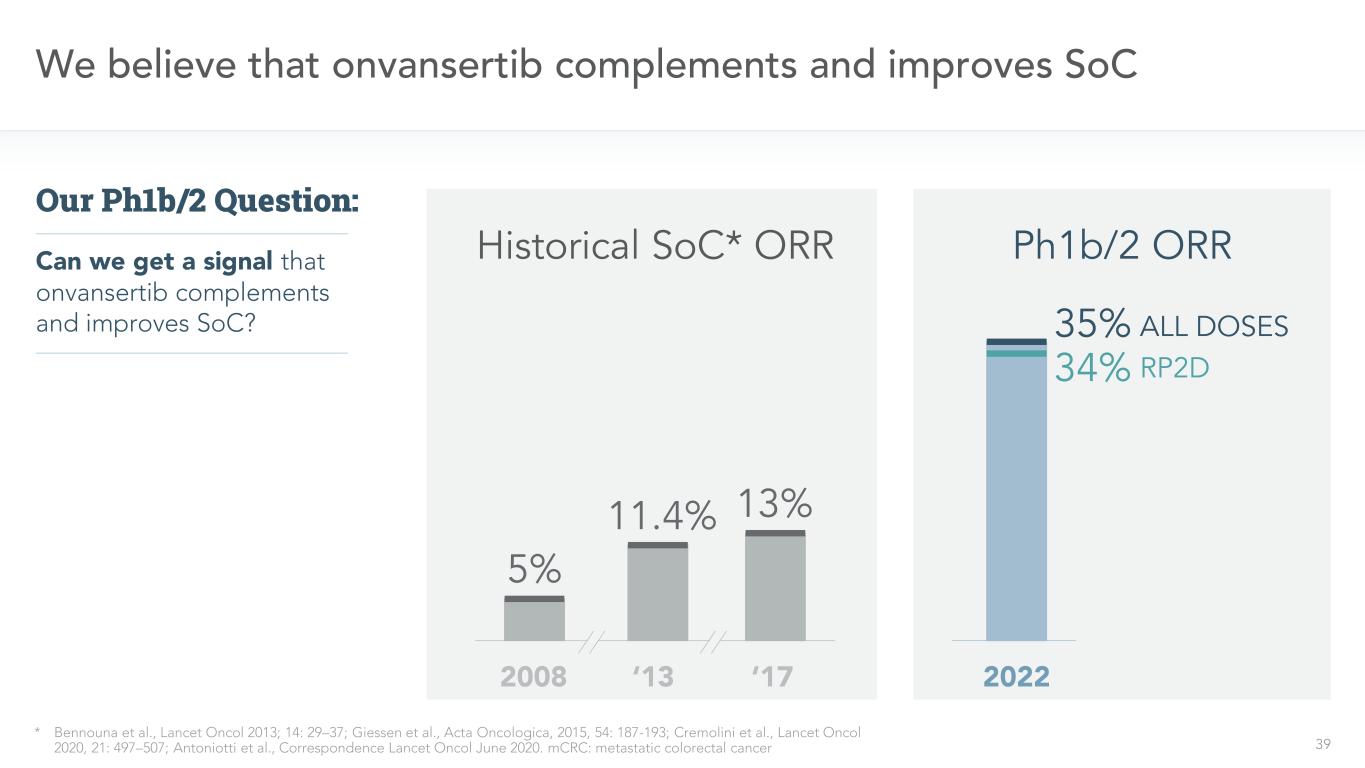
39我們認為onvansertib補充和改進了SoC*Bennouna等人,《柳葉刀》2013;14:29-37;Giessen等,《腫瘤學報》,2015,54:187-193;Cremolini等,《柳葉刀》2020,21:497-507;Antoniotti等,《通信柳葉刀》2020年6月。MCRC:轉移性結直腸癌我們能得到onvansertib補充和改善SoC的信號嗎?我們的PH1b/2問題:2008‘13’17歷史SoC*ORR 5%11.4%13%35%RP2D34%所有劑量2022 PH1b/2 ORR

40我們帶着四個明確的目標進行下一次試驗,展示onvansertib對SoC的貢獻確認最佳給藥位置以可能的加速審批機會以資本效率運營
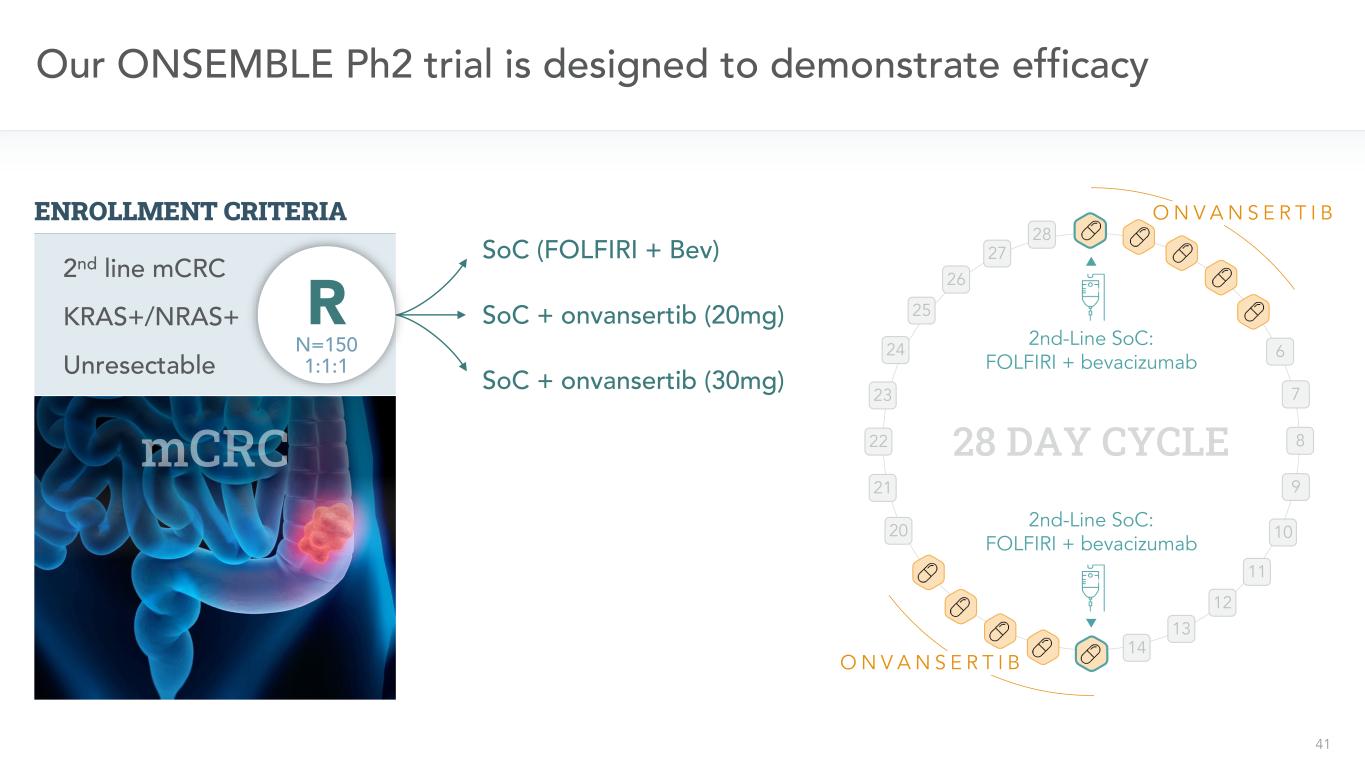
41二線SoC:FOLFIRI+貝伐單抗二線SOC:FOLFIRI+貝伐單抗28天週期我們的唯一PH2試驗旨在展示SOC(FOLFIRI+BEV)SoC+onvansertib(20 Mg)SoC+onvansertib(30 Mg)6 7 8 9 10 11 12 13 14 20 21 22 23 24 25 26 27 28 O N V A N S E R T I B O N V A N S E R T I B KRAS+/NRAS+不可切除的第二線CRC mN=150 1:1:1 R登記標準

42我們的唯一PH2試驗旨在展示療效終點主要關鍵次要其他次要目標應答率:CR+PR無進展存活率疾病控制率:CR+PR+SD反應持續時間:DOR總體生存期:OS降低MAF與ORR、PFS、DCR、DOR、OS登記標準KRAS+/NRAS+不可切除二線mCRC N=150 1:1:1 R

43我們的單一PH2試驗將是統計上可靠的登記標準KRAS+/NRAS+不可切除的二線mCRC N=150 1:1:1 R·與對照組獨家隨機進行SoC·檢查兩劑onvansertib的安全性/有效性·BEV-NAIVE與BEV暴露的隨機分層·高效且經濟高效的設計STAT·檢測ORR中有意義的差異的最低功率·顯着性水平的最佳使用(每個治療組與對照組的阿爾法0.045)·為PFS彙集治療武器的能力

44我們樂觀地認為,隨機數據將創造實質性價值2022 2023 2024 Q1 Q2 Q3 Q4 mCRC隨機數據讀出機會創造價值·嚴格證明onvansertib在提高mCRC與單獨使用SoC的療效方面的作用·在mCRC中可能加速批准機會的位置·及早識別可能的應答者(MAF)·強有力的跡象表明,onvansertib在其他適應症試驗激活中具有潛力

45胰腺癌(MPDAC)前列腺癌(MCRPC)三陰性乳腺癌(TNBC)小細胞肺癌(SCLC)加速我們的mCRC計劃額外的onvansertib計劃

46我們的mPDAC PH2試驗結合了onvansertib和標準護理10 9 8 7 6二線SoC:NAL-IRI+亞葉酸鈣+5-FU 14天週期11 12 13 14 O N V A N S E R T I B未能通過一線吉西他濱/阿布拉沙尼登記標準43名患者計劃了43名患者,我們能否得到onvansertib補充和改善SoC的信號?單臂試驗
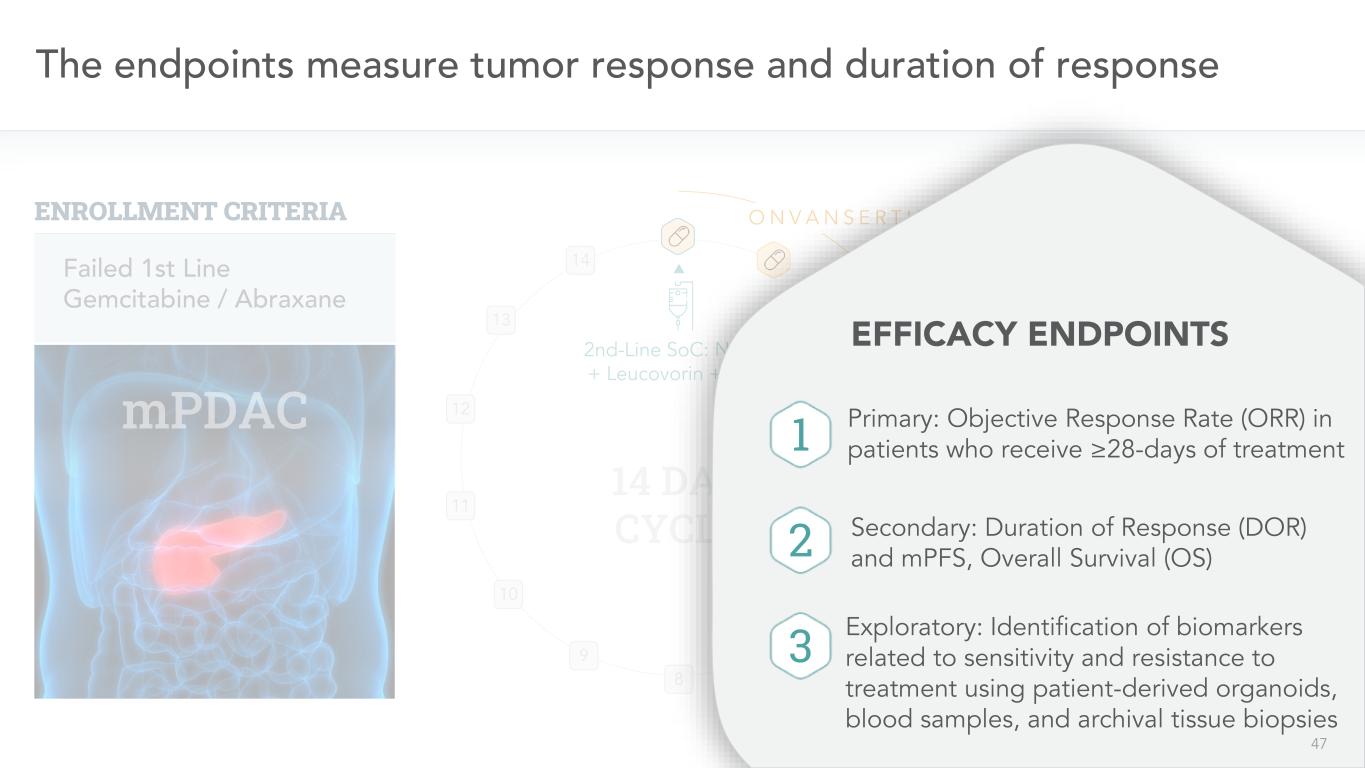
47終點測量腫瘤反應和反應持續時間10 9 8 7 6二線SoC:NAL-IRI+亞葉酸鈣+5-FU 14天週期11 12 13 14 O N V A N S E R T I B失敗一線吉西他濱/阿布拉沙坦登記標準N=6/43以下是我們試圖從這項試驗中獲得的單臂三聯FICACY終點主要:接受≥治療28天的患者的客觀應答率(ORR)次要:應答持續時間(DOR)和MPFS,總生存期(OS)探索性:識別與使用患者衍生器官、血液樣本治療的敏感性和耐藥性相關的生物標誌物檔案組織活組織檢查1 2 3 47
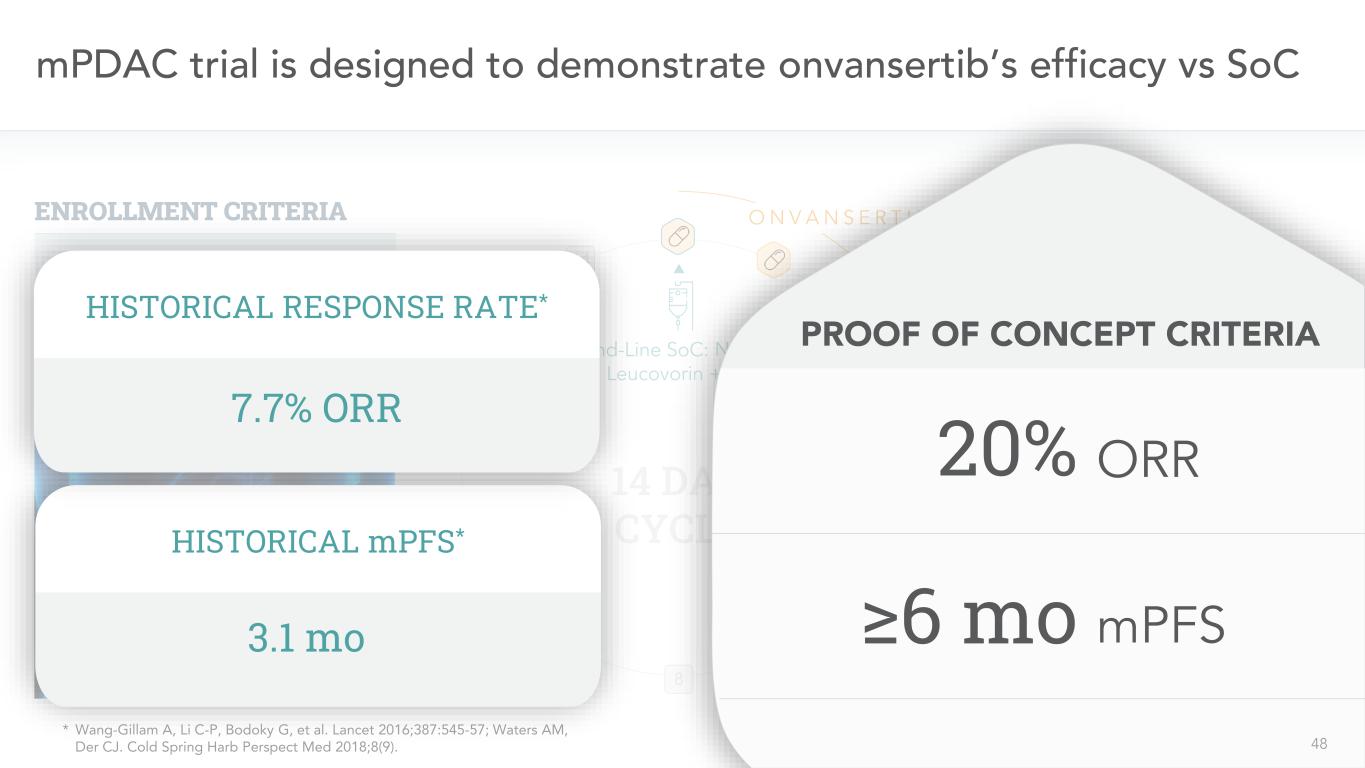
48 mPDAC試驗旨在證明onvansertib與SoC 10 8 8 7 6二線SoC的療效:NAL-IRI+亞葉酸鈣+5-FU 14天週期11 12 13 14 O N V A N S E R T I B失敗的一線吉西他濱/阿布拉沙尼登記標準N=6/43以下是我們試圖從這項試驗中獲得的單臂試驗歷史MPFS*3.1mo歷史應答率*7.7%ORR概念驗證標準20%≥6 mo ORR MPFS 48*Wang-Gillam A,理想汽車C-P,Bodoky G等。《柳葉刀》2016;387:545-57;Waters AM,Der CJ。《冷泉哈勃透視醫學》2018;8(9)。
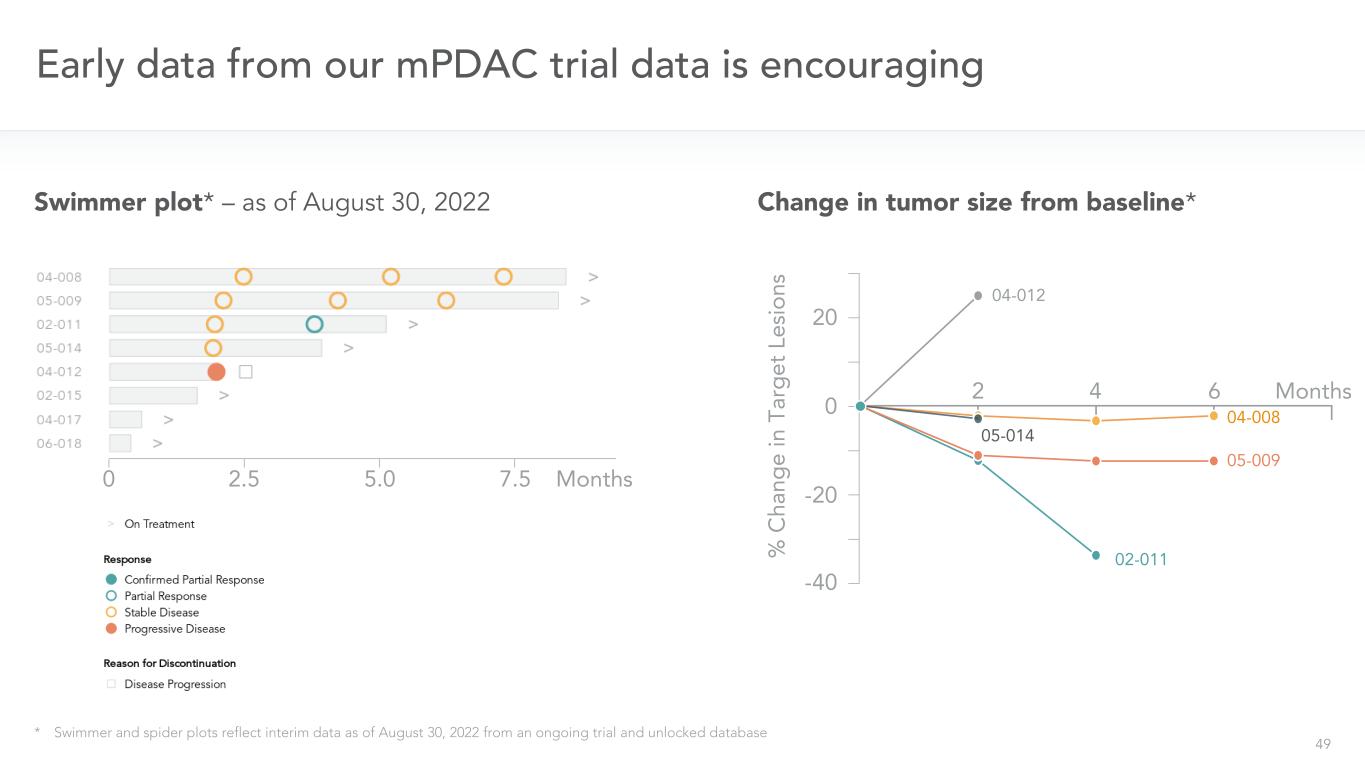
49我們的mPDAC試驗數據的早期數據令人鼓舞*游泳者和蜘蛛圖反映了截至2022年8月30日正在進行的試驗和未鎖定的數據庫游泳者圖的中期數據*-截至2022年8月30日02.5 5.0 7.5個月腫瘤大小與基線相比變化*04-008 05-009 02-012 20 0-20-40 02-011 05-009 04-008 05-014 04-012

50胰腺癌(MPDAC)前列腺癌(MCRPC)三陰性乳腺癌(TNBC)小細胞肺癌(SCLC)加速我們的mCRC計劃額外的onvansertib計劃

2022年4月51 AACR數據顯示,在表現為對阿比特龍初始耐藥的mCRPC患者中,疾病控制率隨着評估的劑量密度的增加而增加。通過增加PSA,疾病控制率隨着onvansertib劑量密度的增加而增加·實現PSA穩定的患者的疾病控制率從29%增加到45%,而放射學穩定的患者中,ctDNA分析顯示PI3K信號通路與對onvansertib/阿比特龍的敏感性相關

52我們不打算資助任何未來的mCRPC開發活動該試驗已完成登記(n=72),併產生了重要的臨牀數據:·由於onvansertib的毒性可忽略不計·疾病控制隨着劑量密度的增加而增加卡迪夫腫瘤學公司不計劃在mCRPC研究結果的前進道路上採取任何公司贊助的未來步驟

53胰腺癌(MPDAC)前列腺癌(MCRPC)三陰性乳腺癌(TNBC)小細胞肺癌(SCLC)加速我們的mCRC計劃額外的onvansertib計劃
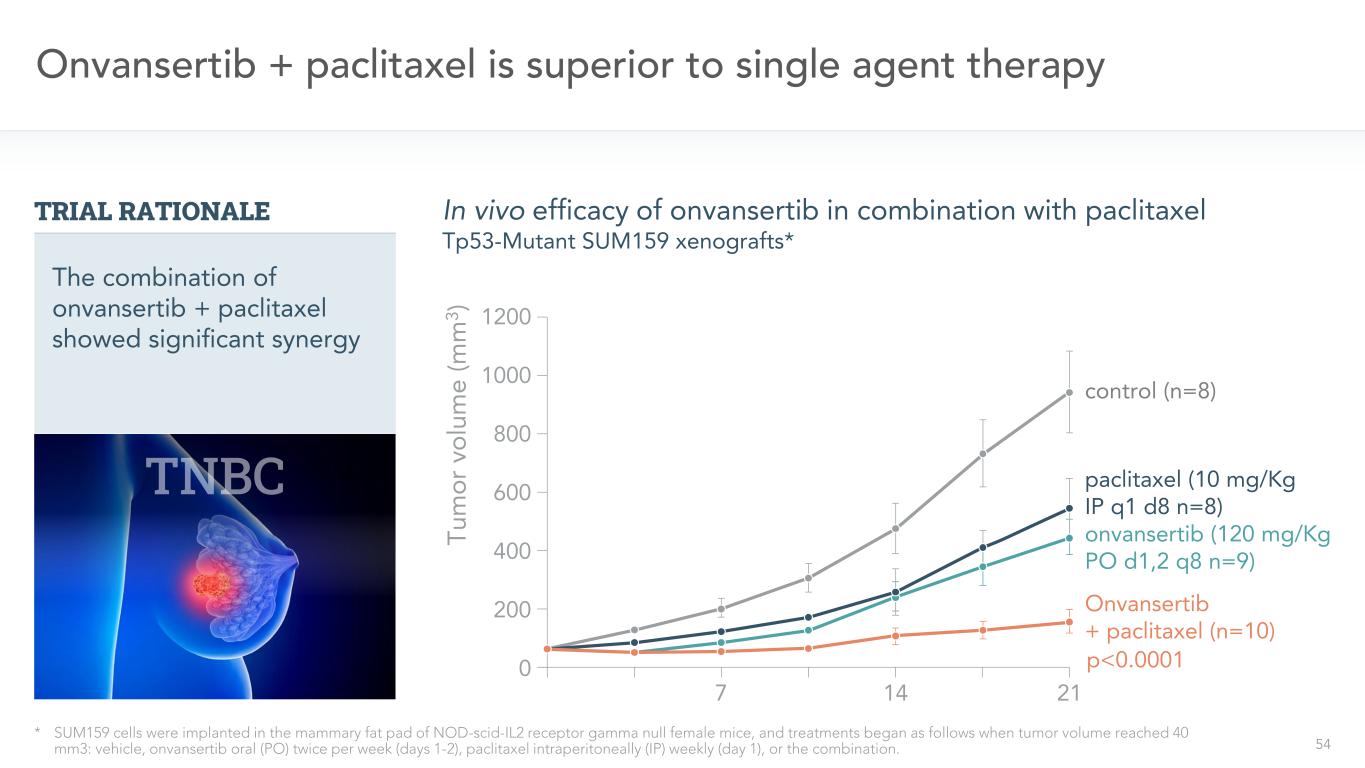
54昂凡瑟替布+紫杉醇治療優於單藥治療*將SUM159細胞接種於NOD-SCID-IL2受體γ缺陷型雌性小鼠的乳房脂肪墊內,當腫瘤體積達到40mm3時,開始治療:賦形劑、昂凡瑟替布口服(PO)每週2次(第1~2天)、紫杉醇每週腹腔注射(IP)每週(第1天)或兩者合用。對照組(n=8)紫杉醇(10 mg/kg ip q1 d8 n=8)onvansertib(12 0 mg/kg PO d1,2 q8 n=9)onvansertib+紫杉醇(n=10)onvansertib聯合紫杉醇TP53-突變株SUM159異種移植的體內療效
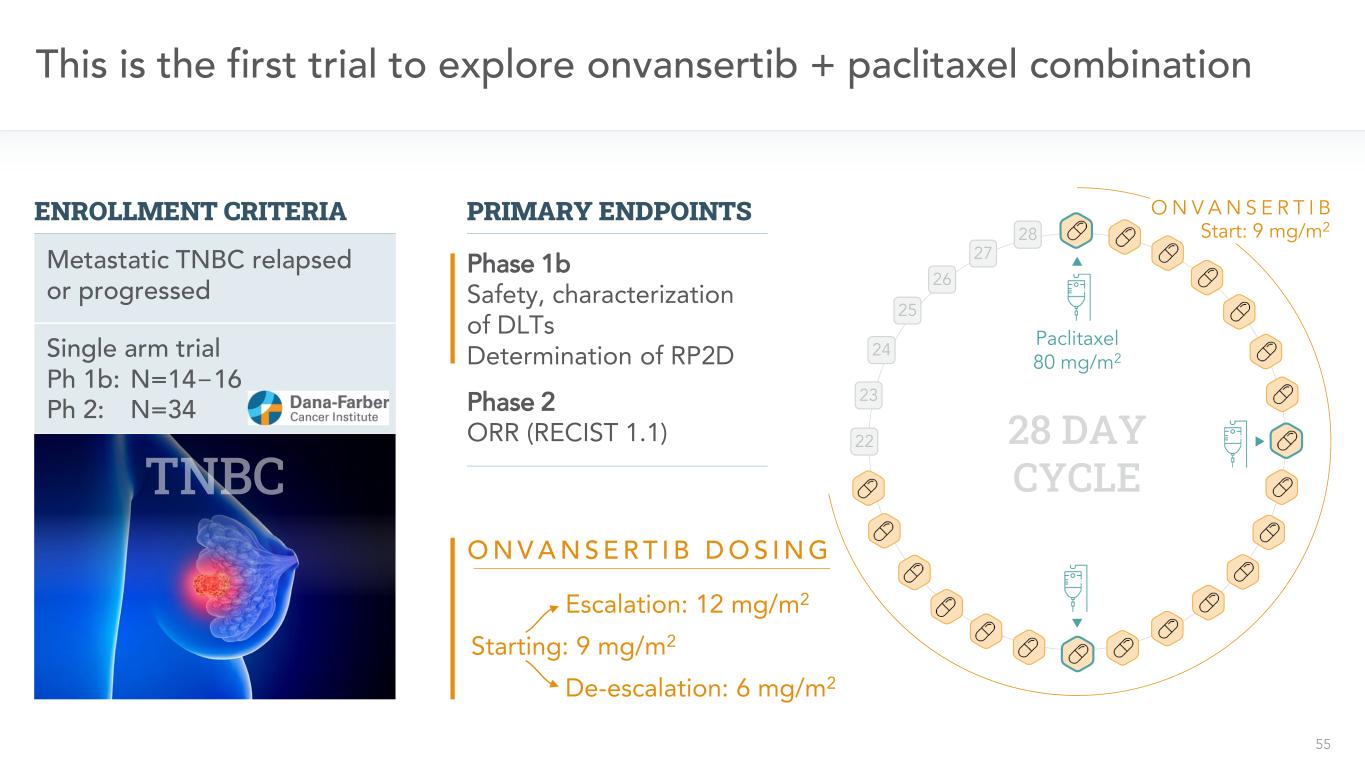
55單臂試驗Ph 1b:n=14−16 Ph 2:n=34這是第一次探索onvansertib+紫杉醇聯合轉移性臨牀試驗復發或進展的登記標準主要終點1b期安全性、DLTS測定RP2D紫杉醇80 mg/m2 28天週期22 23 24 25 26 27 28 O N V A N S R T I B O N V A N S E R T I B D O S I N G開始:9 mg/m 2升級:12 mg/m 2降級:6 mg/m 2啟動:9 mg/m 2或2期ORR(RECIST 1.1)

56這是首次探索萬色替布+紫杉醇聯合入選標準紫杉醇80 mg/m2 28天週期22 23 24 25 26 27 28 O N V A N S R T I B RP2D主要終點1b期安全性、DLTS的特徵RP2D 2期或R(RECIST 1.1)次級終點2期無進展生存(PFS)單臂試驗Ph 1b:N=14−16 Ph 2:N=34轉移性TNBC復發或進展

57胰腺癌(MPDAC)前列腺癌(MCRPC)三陰性乳腺癌(TNBC)小細胞肺癌(SCLC)加速我們的mCRC計劃額外的onvansertib計劃
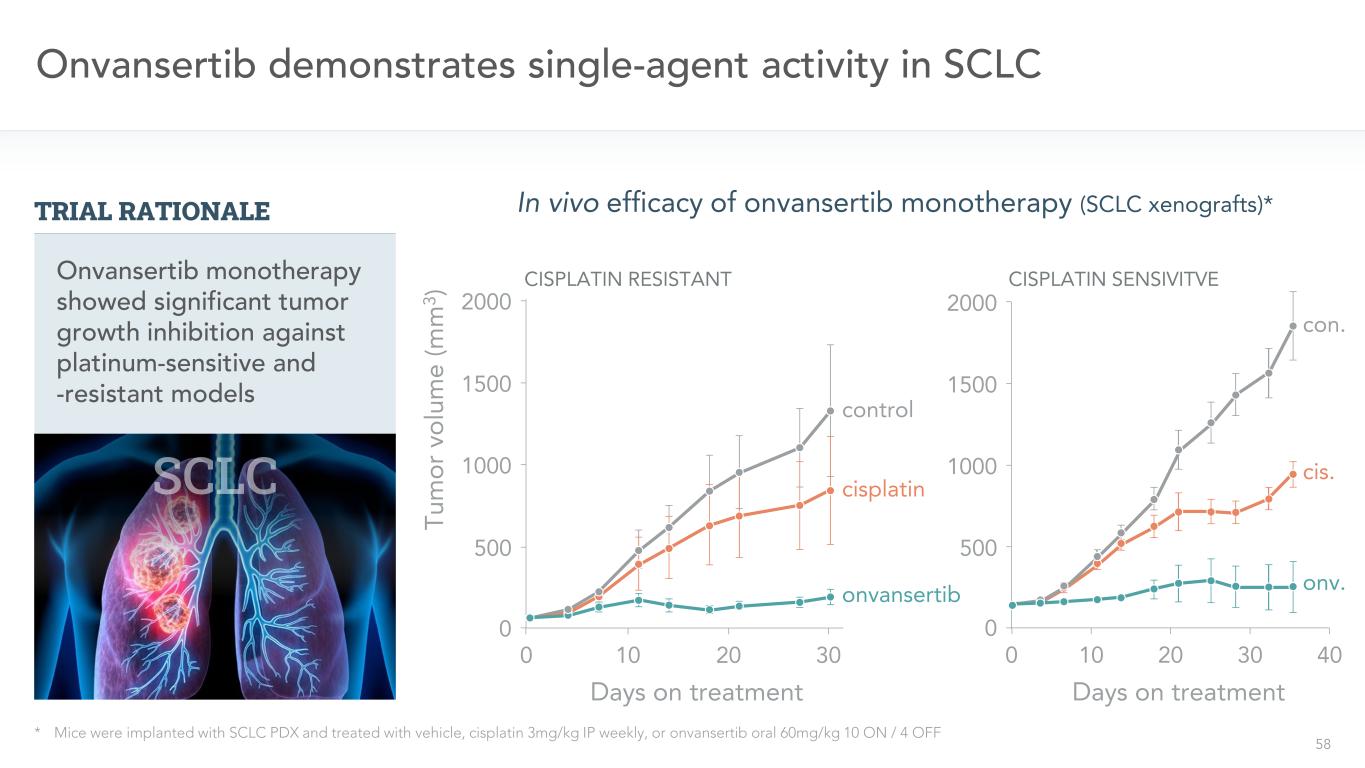
58 Onvansertib在SCLC*小鼠體內表現出單藥活性。小鼠植入SCLC PDX後,每週ip順鉑3 mg/kg,或口服Onvansertib 60 mg/kg 10 on/4 onvansertib對照2000 1500 1000 500 0Tu或Vol e(M 3)10 20 300 2000 1500 1000 500 0 10 20 30 40 Onvansertib單一治療對鉑敏感和耐藥模型顯示出顯著的腫瘤生長抑制作用。順位。科恩。Onvansertib單一治療(SCLC異種移植)的體內療效
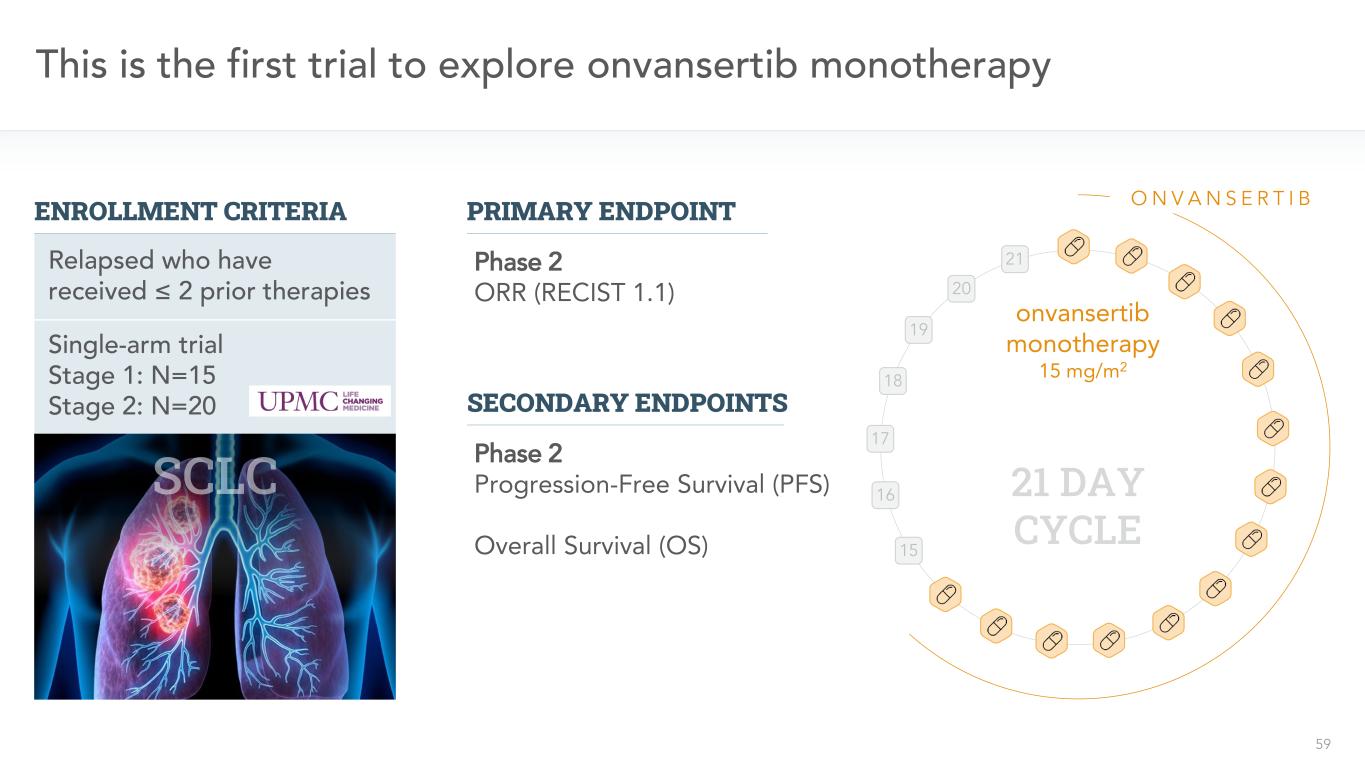
59單臂試驗階段1:N=15階段2:N=20這是第一個探索接受≤2先前治療的復發者接受Vansertib單一治療的第一個試驗15 16 17 18 19 20 21 O N V A N S R T I B 21天週期onvansertib單一治療15 mg/m2 2期或R(RECIST 1.1)主要終點次要終點2期無進展存活(PFS)總存活率(OS)

60我們正在籌備中的onvansertib臨牀前PH1/2 PH2/3 mPDAC TNBC SCLC卵巢mCRC Onivyde/5-FU紫杉醇None(單一療法)PARP抑制劑FOLFIRI/BEV Investigator發起的試驗組合:登記狀態登記評估激活mCRC FOLFIRI/BEV登記隨機單臂試驗
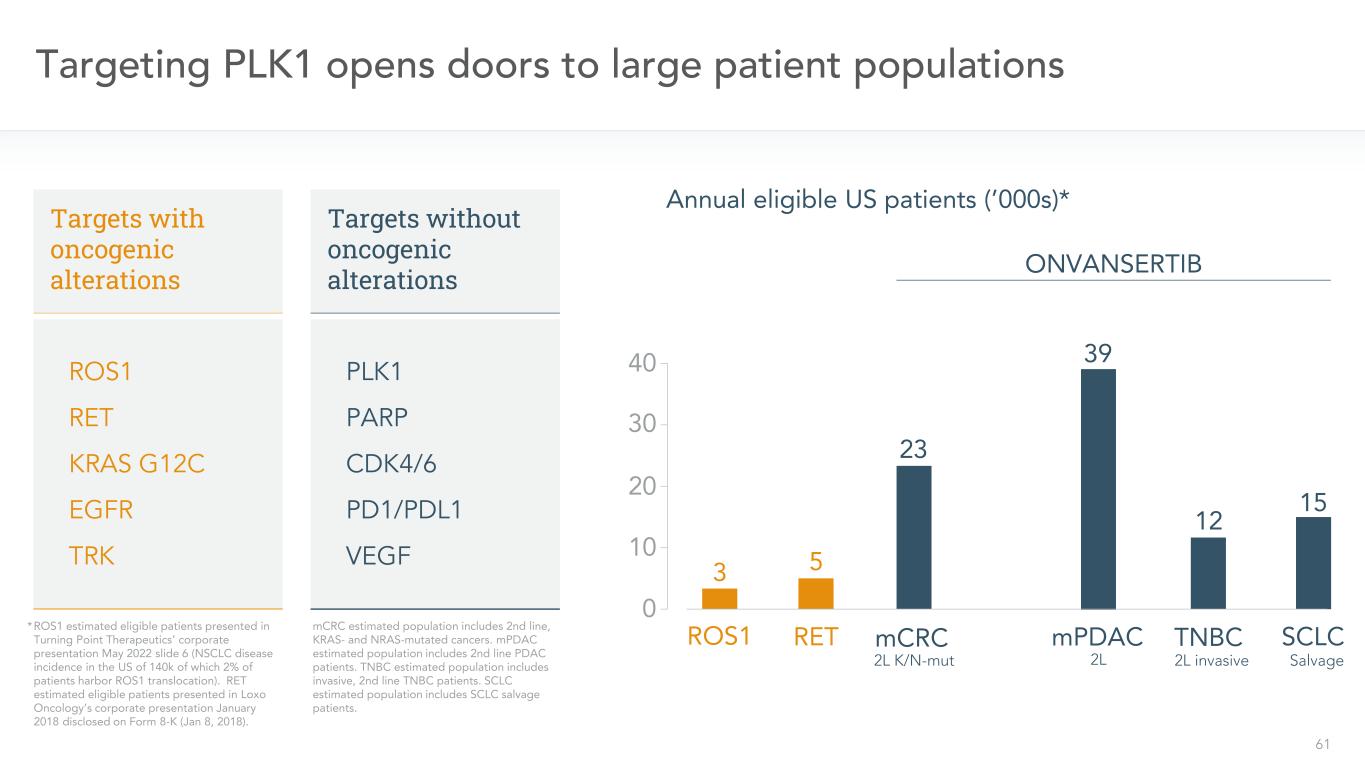
61針對PLK1為大量患者羣體打開了大門53 RETROS1年度符合條件的美國患者(2000年代)*ONVANSERTIB 15 SCLCTNBC 12 mPDAC 39 23 mCRC靶標ROS1 RET KRAS G12C EGFR TRK靶標無癌基因改變PLK1 PARP CDK4/6 PD1/PDL1 VEGF*ROS1在Turning Point Treateutics的公司演示中公佈的估計合格患者2022年5月幻燈片6(美國的NSCLC疾病發病率為140k,其中2%的患者存在ROS1易位)。RET估計符合條件的患者出現在Loxo Oncology 2018年1月在Form 8-K(2018年1月8日)上披露的公司演示文稿中。MCRC估計的人口包括二線、KRAS和NRAS突變的癌症。MPDAC估計人羣包括二線PDAC患者。TNBC估計人羣包括侵襲性、二線TNBC患者。小細胞肺癌估計人羣包括小細胞肺癌打撈患者。2L K/N-MUT 2L 2L有創搶救30 20 10 040
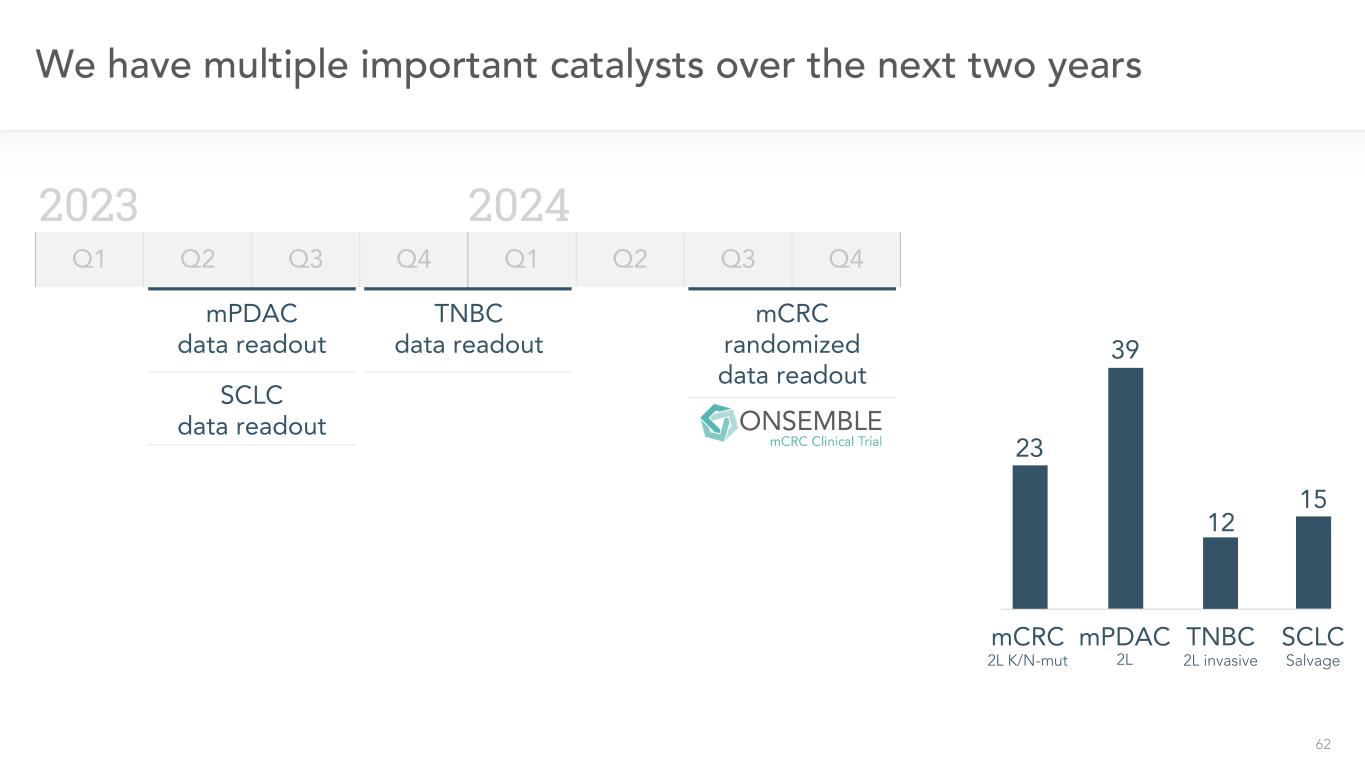
62我們在未來兩年有多個重要催化劑2023年2024年Q1 Q2 Q3 Q4 Q1 Q2 Q3 Q4 mPDAC數據讀出SCLC數據讀出TNBC數據讀出15 SCLCTNBC 12 mPDAC 39 23 mCRC mCRC隨機數據讀出2L K/N-MUT 2L有創搶救

63 2025第一季度第二季度截至2022年6月30日,我們的財務狀況穩健*以上財務信息來自我們於8/4/22年8月4日提交的10Q表格中未經審計的財務信息。2022年6月30日現金和投資*經營活動中使用的現金淨額*(截至2022年6月30日的滾動兩個季度)1690萬美元2023年第一季度第二季度第三季度第四季度第一季度第三季度第四季度第二季度隨機數據讀數mPDAC數據讀數SCLC數據讀數TNBC數據讀數

64我們的臨牀開發計劃支持我們的主要目標1通過隨機試驗驗證先前的mCRC數據2證明臨牀POC在其他適應症中的應用目標2025 Q1 Q2 2023 2024 Q1 Q2 Q3 Q4 Q1 Q2 Q3 Q4

65我們的臨牀開發計劃支持我們的主要目標階段1b/2單臂階段2隨機強ORR+DOR+PFS MAF生物標誌物機會有效設計確認劑量;分層BEV1通過隨機試驗驗證先前的mCRC數據2展示臨牀POC在其他適應症目標信號發現2025 Q1 Q2 2023 2024 Q1 Q2 Q3 Q4 Q1 Q2 Q3 Q4我們的戰略
66附錄

67隨時間推移的onvansertib mCRC PH1b/2試驗數據摘要*數據發佈包括某些後續數據,並反映正在進行的試驗和解鎖數據庫的臨時數據。ASCO GI 2021年1月KOL活動2021年9月投資者網絡直播2022年1月投資者網絡廣播2022年9月數據截止日期2020年11月2日*2021年12月3日*7月25日2022*所有劑量所有劑量RP2D可評估患者(CR+PR)36%(5)38%(12)42%(8)35%(17)34%(12)35%(17)34%(12)確診CR/PR 29%(4)31%(10)37%(7)27%(13)29%(10)29%(14)31%(11)有效時間11.7疾病控制率(CR+PR+SD)86%(12)94%(30)100%(19)92%(44)94%(33)92%(44)94%(33)