
創新系列2022年6月29日P o to:F u si o n m e e d ic a l a n im a ti on,un spla sh

本演示文稿包含經修訂的1995年《私人證券訴訟改革法》定義的前瞻性陳述,包括但不限於以下陳述:新冠肺炎疫苗初始或加強劑量的未來商業需求和醫療需求;與其他新冠肺炎疫苗的競爭或與我們其他候選產品的競爭,包括那些具有不同作用機制和不同製造和分銷限制的產品,其基礎是療效、成本、儲存和分銷的便利性、批准的使用範圍、副作用概況和免疫反應的持久性;我們的新冠肺炎疫苗以及我們的研究藥物(如果獲得批准)被市場接受的速度和程度;我們的研究和開發計劃以及我們當前和未來的臨牀前研究和臨牀試驗的啟動、時間、進展和結果,包括有關研究或試驗及相關準備工作的開始和完成的時間、試驗結果的期限和我們的研發計劃;我們獲得並保持對我們的候選產品的監管批准的時間和能力;我們與輝瑞公司合作開發和銷售新冠肺炎疫苗(包括BNT162b2的潛在增強劑量和/或具有修改的mrna序列的BNT162b2變體的潛在增強劑量);BNT162b2預防由新出現的病毒變異引起的新冠肺炎的能力;我們發現研究機會和發現和開發研究藥物的能力;我們的第三方合作者繼續進行與我們的開發候選藥物和研究藥物相關的研發活動的能力和意願;新冠肺炎大流行對我們開發計劃的影響, 這些風險包括:我們的供應鏈、合作伙伴和財務業績;不可預見的安全問題和因使用我們開發或製造的其他產品和候選產品而導致的人身傷害或死亡的索賠;我們推進瘧疾、結核病和艾滋病毒計劃的能力,包括為這些計劃選擇臨牀候選人的時間和臨牀試驗的開始,以及任何數據的讀出;世界衞生組織、歐盟委員會和其他組織支持基礎設施建設的性質和持續時間;在非洲大陸開發可持續的疫苗生產和供應解決方案,以及這些解決方案的性質和可行性;我們對研發收入、商業收入、銷售成本、研發費用、銷售和營銷費用、一般和行政費用、資本支出、所得税、流通股的估計;我們和我們的合作伙伴將我們的候選產品(包括我們的新冠肺炎疫苗)商業化和營銷的能力;我們管理開發和擴張的能力;美國和外國的法規發展;我們有效地擴大我們的生產能力和製造我們的產品,包括我們的新冠肺炎疫苗的目標生產水平和候選產品的能力;以及目前我們不知道的其他因素。在某些情況下,前瞻性陳述可以通過諸如“將”、“可能”、“應該”、“預期”、“打算”、“計劃”、“目標”、“預期”、“相信”、“估計”、“預測”、“潛在”、“繼續”或這些術語的否定或其他類似術語來識別。, 儘管並不是所有前瞻性聲明都包含這些詞語。本演示文稿中的前瞻性陳述既不是承諾,也不是保證,您不應過度依賴這些前瞻性陳述,因為它們涉及已知和未知的風險、不確定性和其他因素,其中許多因素不在BioNTech的控制範圍之內,可能導致實際結果與這些前瞻性陳述中明示或暗示的結果大不相同。你應該審查本演示文稿中“風險因素”標題下描述的截至2022年3月31日的三個月的風險和不確定因素,以及生物技術公司提交給美國證券交易委員會的後續文件中的風險和不確定因素,這些文件可在美國證券交易委員會的網站上查閲:https://www.sec.gov/.除法律另有規定外,在出現新信息、未來發展或其他情況時,BioNTech對更新或修改本演示文稿中包含的任何前瞻性陳述不承擔任何意圖或責任。這些前瞻性陳述是基於BioNTech目前的預期,僅代表截至本文發佈之日的情況。本幻燈片演示文稿包括前瞻性陳述2

COMIRATY®▼(輝瑞-生物科技新冠肺炎疫苗)已獲得歐盟委員會的有條件營銷授權,可從5歲起預防2019年人類冠狀病毒病(新冠肺炎)。該疫苗以兩劑為一系列,間隔3周接種。此外,CMA已擴大到包括18歲及以上個人在第二次接種後至少6個月的加強劑量(第三次接種)。對於免疫功能低下的人,第三次接種可能在第二次接種後至少28天給予。歐洲藥品管理局的人類藥物委員會已經完成了對COMIRATY®的嚴格評估,一致認為關於疫苗質量、安全性和有效性的足夠有力的數據現在已經可用。重要安全信息:·已報告過敏反應事件。在接種疫苗後出現過敏反應的情況下,應隨時提供適當的治療和監督。·在接種Comirnaty疫苗後觀察到非常罕見的心肌炎和心包炎病例。這些病例主要發生在接種疫苗後14天內,更多發生在第二次接種之後,更多發生在年輕男子身上。現有數據表明,接種疫苗後的心肌炎和心包炎的病程與一般的心肌炎或心包炎沒有什麼不同。·與焦慮有關的反應,包括血管迷走神經反應(暈厥)、過度換氣或與壓力有關的反應(如頭暈、心悸、心率加快、血壓改變, 刺痛感和出汗)可能與接種過程本身有關。與壓力相關的反應是暫時的,並自行解決。應建議個人將症狀提請疫苗接種提供者進行評估。重要的是要採取預防措施,避免因暈倒而受傷。·疫苗的有效性、安全性和免疫原性尚未在包括接受免疫抑制治療在內的免疫功能受損的個人身上進行評估。在免疫抑制的個體中,COMIRATY®的療效可能較低。·與任何疫苗一樣,使用COMIRATY®接種疫苗可能不會保護所有疫苗接受者。個人可能要在第二次接種疫苗後7天才能獲得完全保護。·在臨牀研究中,16歲及以上參與者的不良反應為注射部位疼痛(>80%)、疲勞(>60%)、頭痛(>50%)、肌肉疼痛和寒戰(>30%)、關節痛(>20%)、發熱和注射部位腫脹(>10%),通常為輕度或中度,並在接種疫苗後幾天內消失。較低的反應性事件發生頻率與較大的年齡相關。·COMIRATY®在5至15歲參與者中的總體安全概況與16歲及以上參與者中看到的相似。·5至11歲兒童最常見的不良反應是注射部位疼痛(>80%)、疲勞(>50%)、頭痛(>30%)、注射部位紅腫(>20%)、肌肉疼痛和寒戰(>10%)。·12至15歲的臨牀試驗參與者最常見的不良反應是注射部位疼痛(>90%)、疲勞和頭痛(>70%)、肌肉痛和寒戰(>40%), 關節痛、發熱(>20%)。·在孕婦中使用COMIRATY®的經驗有限。只有當對母親和胎兒的潛在益處超過任何潛在風險時,才應考慮在懷孕期間使用COMIRNAY®。·目前尚不清楚COMIRNatY®是否會從母乳中排泄出來。·尚未研究與其他醫藥產品的相互作用或與其他疫苗同時使用COMIRATY®的情況。·有關COMIRATY®安全性的完整信息,請始終參考EMA網站上以歐盟所有語言提供的經批准的產品特性摘要和包裝傳單。黑色等邊三角形▼表示需要額外監測以捕獲任何不良反應。這將允許快速識別新的安全信息。個人可以通過報告他們可能獲得的任何副作用來提供幫助。副作用可報告給EudraVigilance,或通過電子郵件Medinfo@biontech.de、電話+49 6131 9084 0或通過網站www.biontech.de安全信息3直接向BioNTech報告。

安全信息授權在美國使用·新冠肺炎疫苗是美國食品和藥物管理局批准的新冠肺炎疫苗,用於主動免疫,以預防由嚴重急性呼吸綜合徵冠狀病毒2(SARS-CoV-2)引起的16歲及以上個人患上2019年冠狀病毒病(新冠肺炎)。根據歐盟法案,它還被授權向6個月至4歲的個人提供3劑初級系列疫苗,向5歲及5歲以上的個人提供2劑初級系列疫苗,向已被確定有某些免疫損害的5歲及5歲以上個人提供第三劑初級系列疫苗,向已完成輝瑞-生物技術新冠肺炎疫苗或COMIRNAY®初級系列疫苗的12歲及以上個人提供單劑加強劑,向已完成不同授權新冠肺炎疫苗初級接種的18歲及以上個人提供單劑加強劑。對已接種任何授權新冠肺炎疫苗的第一劑加強劑的50歲及以上個人進行第二劑加強接種;對12歲及12歲以上被確定患有某種免疫折衷並接受了任何授權新冠肺炎疫苗的第一劑加強接種的個人進行第二次加強接種。加強劑時間表基於用於初級系列的疫苗的標籤信息。重要安全信息個人不應接種疫苗,條件是:·在上一劑疫苗後出現嚴重過敏反應·對該疫苗的任何成分有嚴重過敏反應個人應將其所有醫療狀況告知疫苗接種提供者, 包括以下情況:·有任何過敏·患有心肌炎(心肌炎)或心包炎(心臟外襯裏的炎症)·發燒·有出血性疾病或正在服用血液稀釋劑·免疫功能受損或正在服用影響免疫系統的藥物·懷孕、計劃懷孕或正在哺乳·接受了另一種新冠肺炎疫苗·曾因注射疫苗而暈倒·疫苗可能無法保護所有人。據報道,疫苗的副作用包括:·疫苗引起嚴重過敏反應的可能性很小,嚴重過敏反應通常在接種疫苗後幾分鐘至1小時內發生。出於這個原因,疫苗接種提供者可能會要求個人在接種疫苗後留在接種疫苗的地方進行監測o嚴重過敏反應的跡象可能包括呼吸困難、面部和喉嚨腫脹、心跳加快、全身嚴重皮疹、頭暈和虛弱o如果個人經歷嚴重過敏反應,他們應該撥打9-1-1或去最近的醫院·一些接種疫苗的人發生了心肌炎(心肌炎症)和心包炎(心臟外襯裏的炎症),在40歲以下的男性中比女性和年長的男性更常見。在這些人中,大多數人在接種第二劑疫苗後幾天內開始出現症狀。發生這種情況的可能性非常低。個別人士在接種疫苗後如有下列任何病徵,應立即求醫:o胸痛o呼吸急促o感覺心跳急促、撲騰, ·嚴重的過敏反應;非嚴重的過敏反應,如注射部位疼痛;疲倦;頭痛;肌肉疼痛;寒戰;關節疼痛;發燒;注射部位腫脹;注射部位發紅;噁心;感覺不適;淋巴結腫大(淋巴結病);食慾減退;腹瀉;嘔吐;手臂疼痛;以及與注射疫苗相關的暈厥·這些可能不是疫苗可能的副作用。可能會出現嚴重的、意想不到的副作用。疫苗可能的副作用仍在臨牀試驗中研究。致電疫苗接種提供商或醫療保健提供商,瞭解令人煩惱的副作用或副作用不會消失,因為其他疫苗尚未提交給FDA,因此有關接種該疫苗的數據尚未提交給FDA。考慮與其他疫苗一起接種這種疫苗的個人應該與他們的醫療保健提供者討論他們的選擇。患者應該總是向他們的醫療保健提供者尋求關於不良事件的醫療建議。鼓勵個人向美國食品和藥物管理局(FDA)和疾病控制和預防中心(CDC)報告疫苗的負面副作用。請訪問https://www.vaers.hhs.gov或致電1-800-822-7967。此外,副作用可報告給輝瑞公司,網址為www.pfizerSafetyreport。或致電1-800-438-1985。4.

Ugur議程歡迎生物技術創新方法-目標發現和表徵-多平臺創新引擎-數字和AI/ML-製造和自動化傳染病的新前沿Q&A咖啡介紹腫瘤學流水線信使核糖核酸癌症疫苗蛋白質療法將細胞療法擴展到實體腫瘤細胞因子閉幕詞問與答會議閉幕詞:F u si o o n m e e d ic a l a n im a ti on,un n spla sh

維吾爾族的歡迎
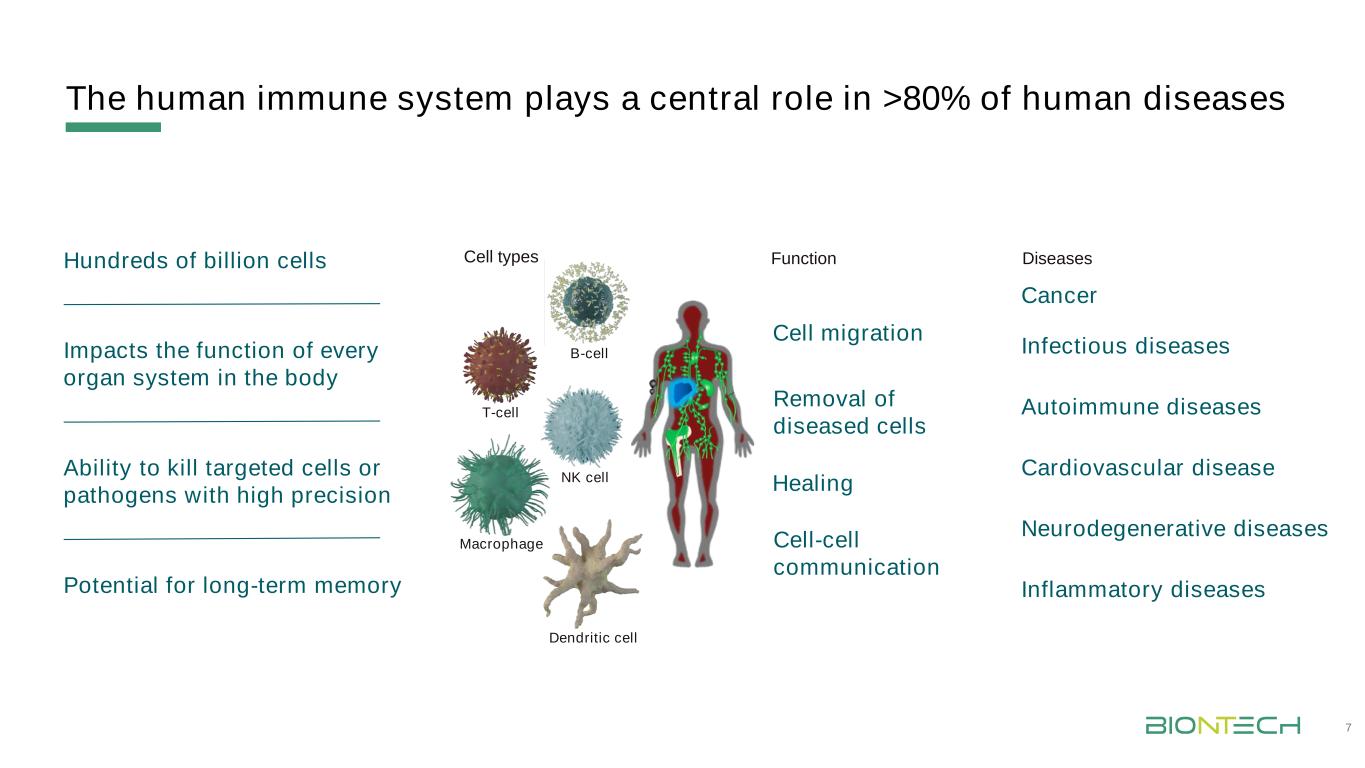
人類免疫系統在超過80%的人類疾病中發揮核心作用7.高精度殺傷靶細胞或病原體的能力千億細胞影響人體每個器官系統的功能長期記憶的潛能癌症自身免疫性疾病神經退行性疾病感染性疾病B細胞-巨噬細胞-NK細胞-T細胞類型炎症疾病樹突狀細胞遷移疾病細胞-細胞通訊疾病
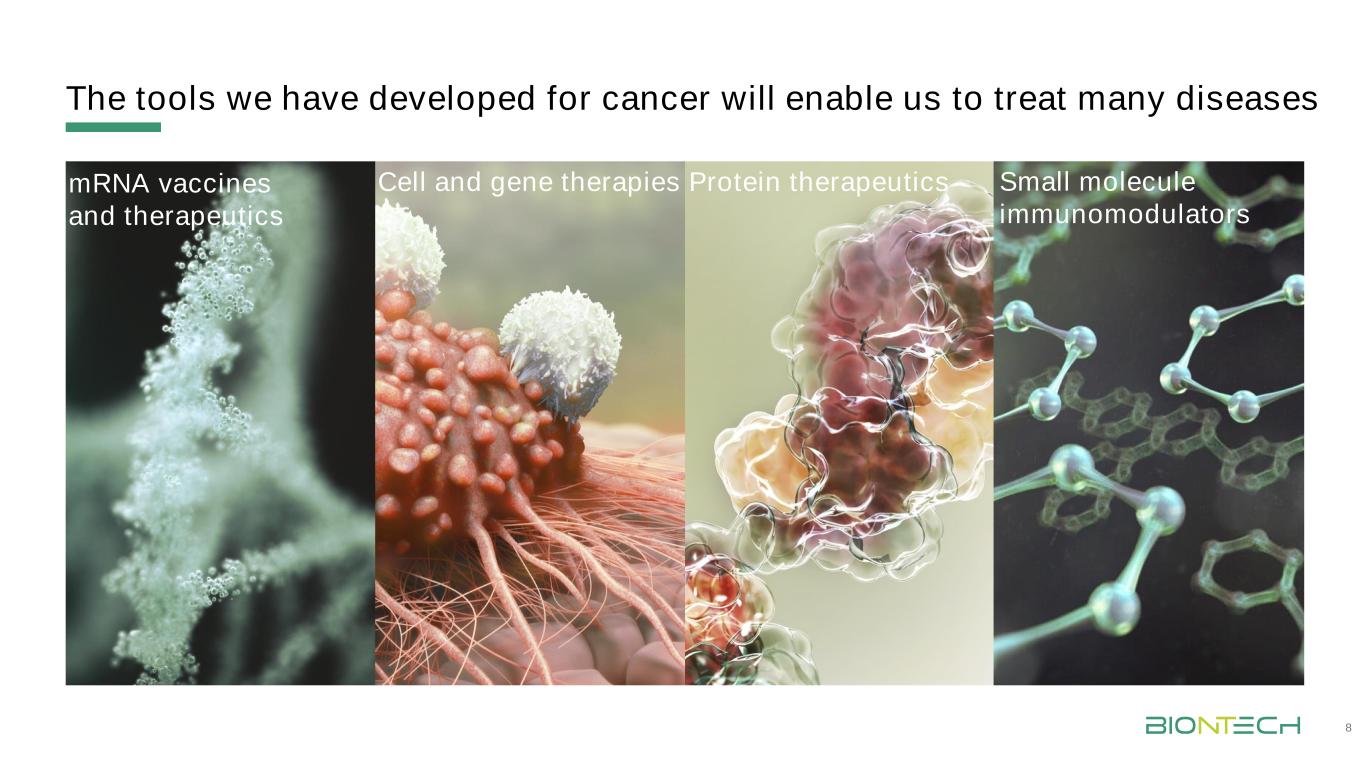
我們開發的癌症治療工具將使我們能夠治療多種疾病8mrna疫苗和療法細胞和基因療法蛋白質療法小分子免疫調節劑

將基因從VISION轉化為現實1,在全球100多個國家和地區授權或批准用於緊急用途或臨時使用,或獲得營銷授權,2022年4月;2截至2022年4月底;3至2022年底;4 Eric C.Schneider等人,美國新冠肺炎疫苗接種計劃一年:避免了多少死亡和住院?(英聯邦基金,2021年12月)。歐洲疾病預防和控制中心;5.https://www.statista.com/topics/6139/covid-19-impact-on-the-global-economy/9 BNT162b2數百萬例嚴重疾病或死亡病例可能避免了4萬億美元的全球經濟影響5~34億劑2有史以來第一次獲得批准的信使核糖核酸療法1超過10億人接種2>175個國家/地區達到約20億至中低收入國家3最快的製藥產品開發和推出

CARVac臨牀前概念驗證發表在《科學》雜誌上的強大勢頭建立在20年的創新基礎上由創始人10階段開始的mRNA疫苗研究20世紀90年代中期2008 BioNTech由Ugur Sahin,Özlem Türeci和Christoph Huber在美因茨創立,2017年發表在《自然》雜誌上的德國現成的信使核糖核酸疫苗2019年首次公開發售納斯達克計劃光速啟動的新冠肺炎疫苗獲得美國食品和藥物管理局的全面批准2個體化的信使核糖核酸疫苗降低黑色素瘤患者的轉移性複發率發表在《自然》雜誌2017年細胞療法首例人體試驗2021年雙特異性免疫調節劑首例人體試驗3 2020年核單抗首次人體試驗2022年核單抗BNT211 17臨牀方案7個臨牀方案改進新冠肺炎疫苗配方推出核細胞因子首例人體試驗變異適應新冠肺炎疫苗提交2005年首例信使核糖核酸2006年發表於血液中的個體化信使核糖核酸癌症疫苗首例人體試驗2014年納米粒信使核糖核酸疫苗首例人類試驗2016年發表於《自然》雜誌2015上的輔助性胰腺數據在ASCO年會上發表的MS疫苗臨牀前概念驗證發表在《科學》IVAC試驗中,延長了RNA-Lipoplex治療2016 MS的無復發生存臨牀前概念驗證,多發性硬化症。1項與基因泰克的iNeST合作;2項與輝瑞的全球聯合開發聯合商業協議;3項與Genmab的GEN1046合作。
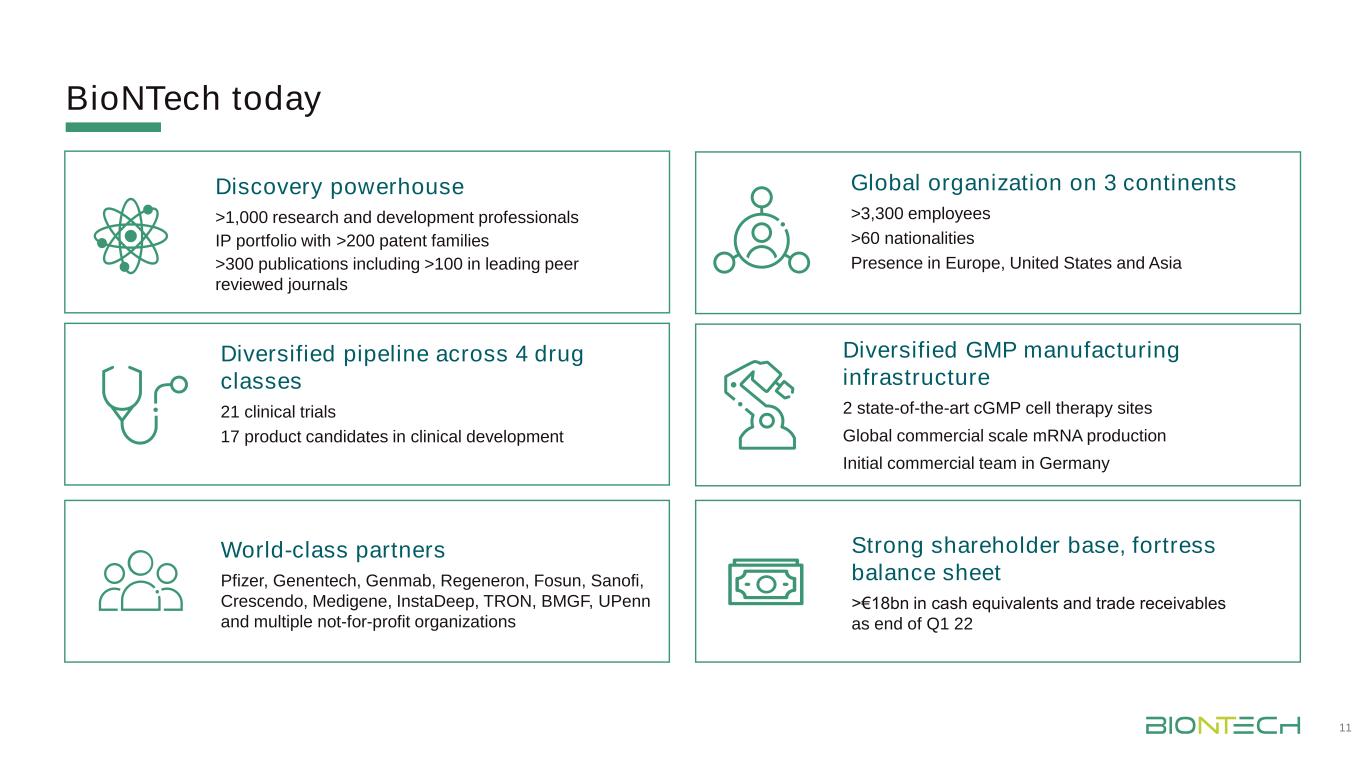
BioNTech今天擁有超過1,000名研究和開發專業人員的IP投資組合,擁有超過200個專利家族>300篇出版物,包括超過100種領先的同行評審期刊21項臨牀試驗多元化流水線跨4個藥物類別21項臨牀試驗17個臨牀開發候選產品多元化GMP製造基礎設施2個最先進的cGMP細胞治療網站全球商業規模基因生產最初的商業團隊在德國擁有世界級合作伙伴輝瑞、基因泰克、Genmab、Regeneron、復星國際、賽諾菲、Cresendo、Medigene、InstaDeep、Tron、BMGF、UPenn和多個非營利組織強大的股東基礎,堡壘資產負債表>截至第一季度末的180億歐元現金等價物和應收賬款22全球組織在3大洲>3,300名員工>60個國家在歐洲、美國和亞洲的業務
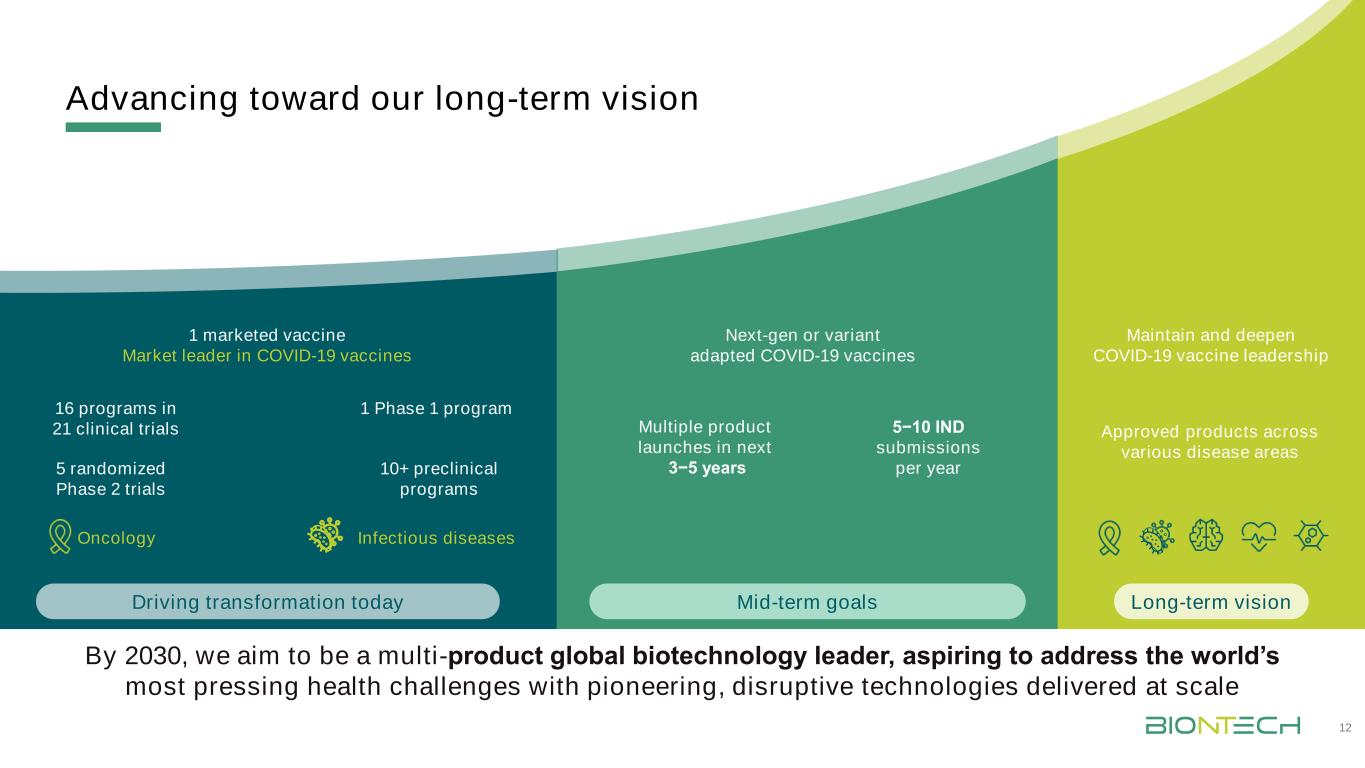
邁向我們的長期願景12腫瘤學感染性疾病5隨機第二階段試驗1上市疫苗市場新冠肺炎疫苗10+臨牀前計劃1階段1計劃21項臨牀試驗中的16項計劃保持並深化新冠肺炎疫苗的領導地位未來3−5年到2030年,我們的目標是成為多產品全球生物技術的領先者,渴望通過大規模交付開創性、顛覆性技術來應對世界上最緊迫的健康挑戰中期目標推動轉型今天長期願景5−10指數每年提交新一代或變種改裝新冠肺炎疫苗批准的跨不同疾病領域的產品

創新的生物技術方法{P o o to:V 2 o s k,u n s p la s h
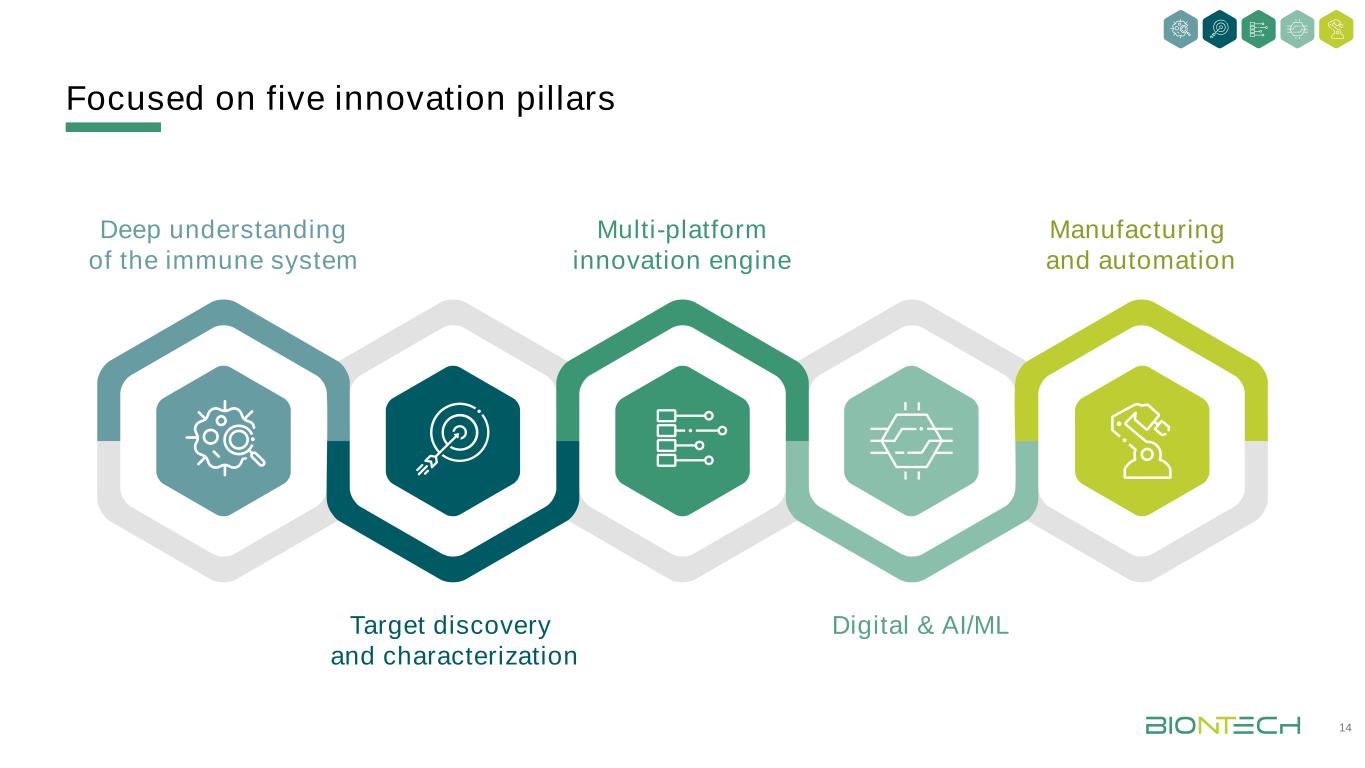
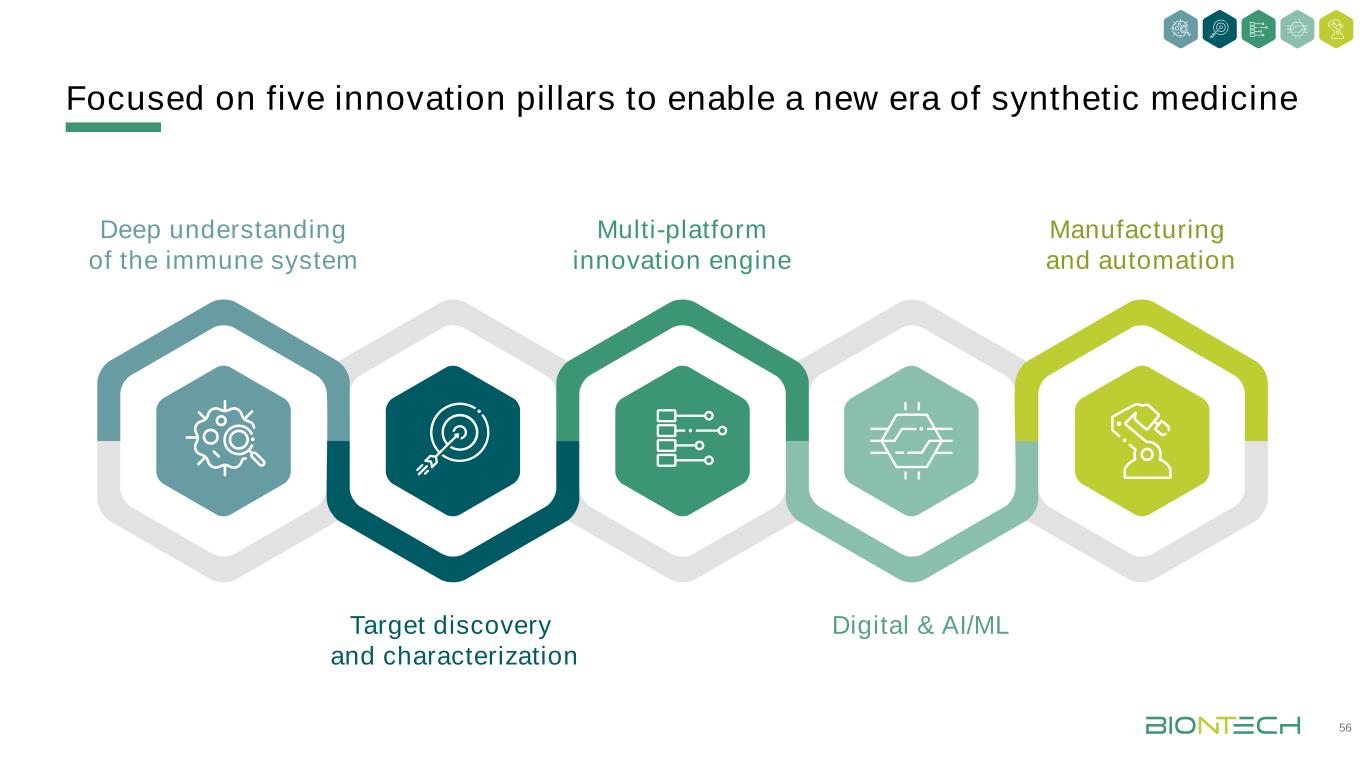
聚焦五大創新支柱深入理解免疫系統多平臺創新引擎製造與自動化目標發現與表徵數字化與AI/ML 14

蛋白質翻譯基因轉錄mRNA--本質上參與所有生物過程免疫系統--全身控制生理和病理機制免疫系統15

T細胞腫瘤細胞Treg 4-1BB PD-1 PD-L1 TCRMHC促炎細胞因子幼稚T細胞APC CD40瞭解和利用免疫學機制16 mRNA編碼的癌症疫苗2共享抗原個性化抗原CAR、TCR和非工程細胞療法3 44 2下一代免疫調節劑4 mRNA編碼的傳染病疫苗1 B細胞1mRNA編碼的效應分子5免疫系統抗體細胞因子共享抗原個性化雙激動劑CPI+激動劑抗體55 32健康細胞病原體
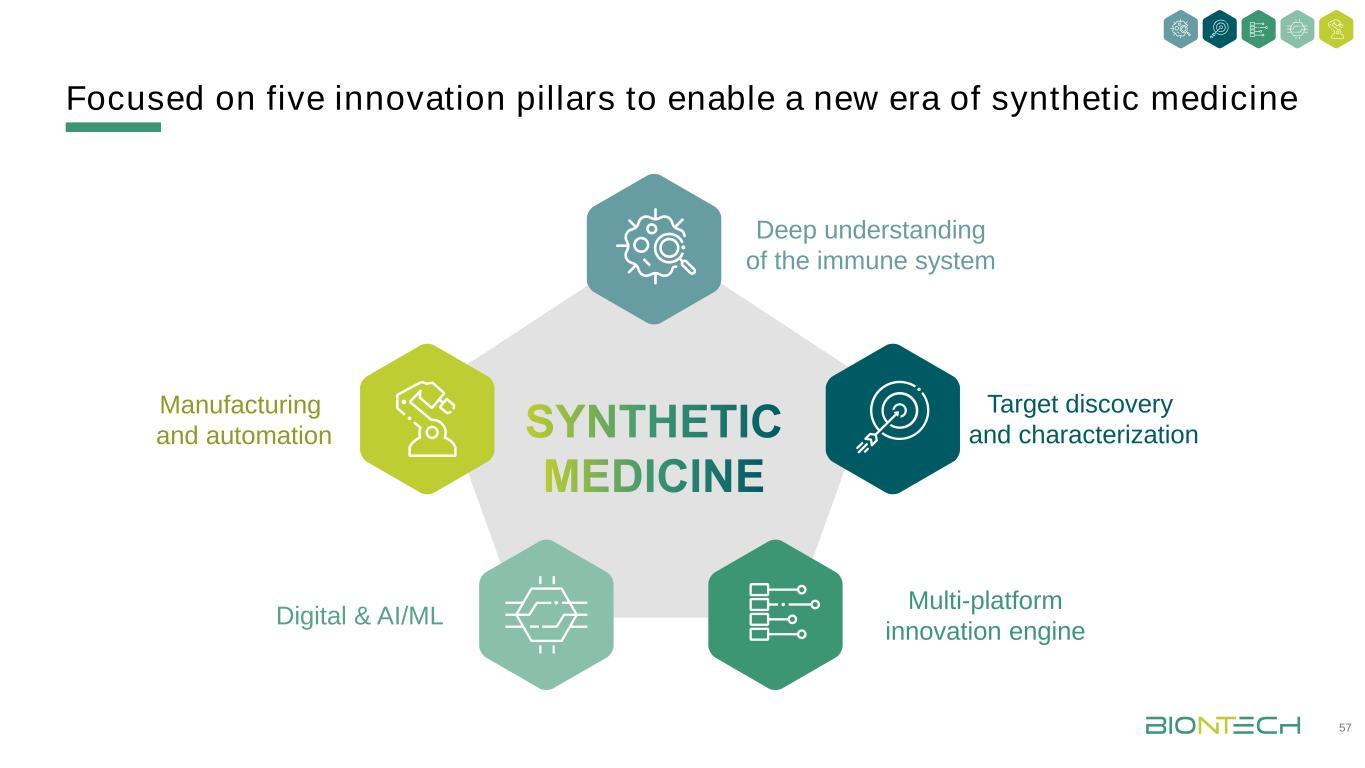
聚焦五大創新支柱深入理解免疫系統多平臺創新引擎製造與自動化目標發現與表徵數字化&AI/ML 17目標發現
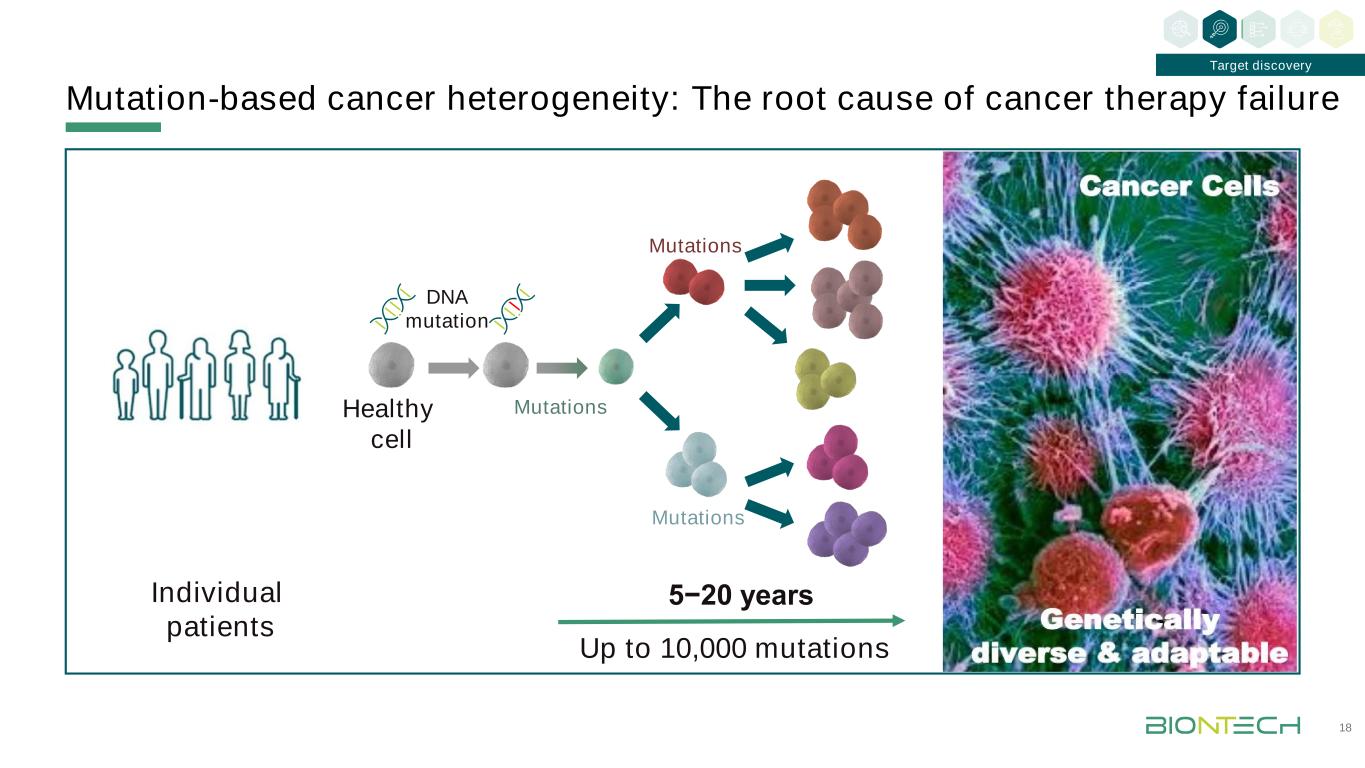
基於突變的癌症異質性:癌症治療失敗的根本原因18目標發現多達10,000個突變5−20年個別患者健康細胞dna突變
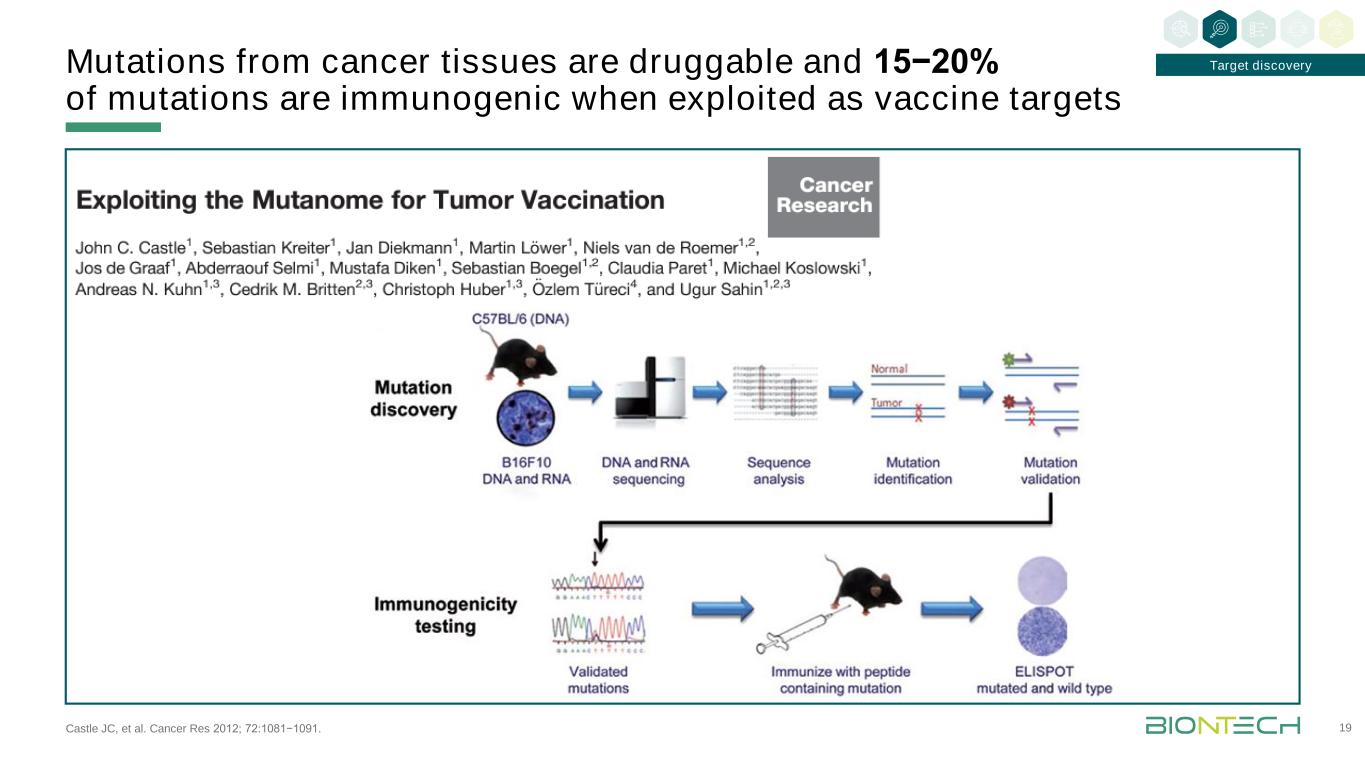
Castle JC等人。癌症資源2012;72:1081−1091。來自癌症組織的突變是可用藥的,15−20%的突變被用作疫苗靶點時是免疫原性的19靶點發現
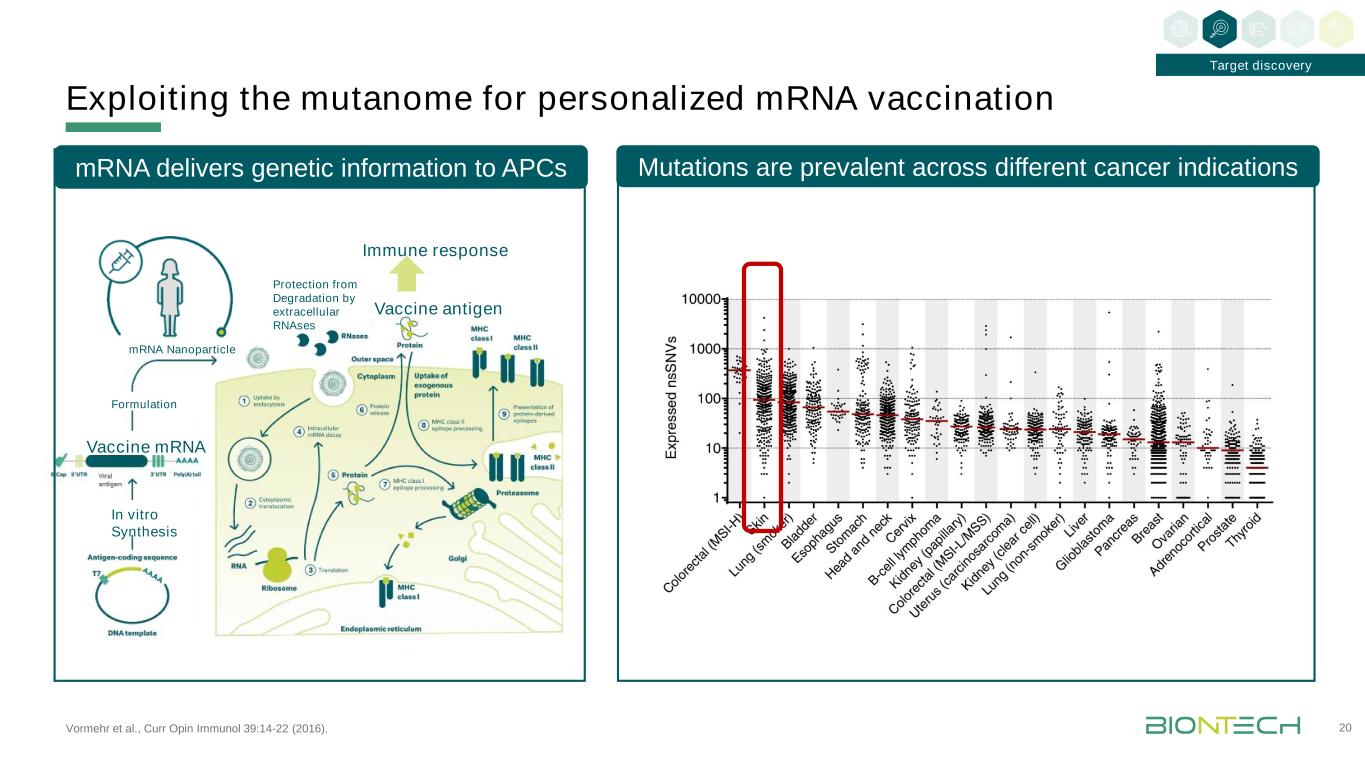
Vormehr等人,Curr Opin免疫學39:14-22(2016)。利用突變組進行個性化信使核糖核酸疫苗20靶點發現疫苗抗原疫苗體外合成免疫反應制劑信使核糖核酸酶降解信使核糖核酸酶信使基因信息傳遞給APC突變在不同的癌症適應症中普遍存在

獲取患者組織和血液樣本21個靶點的發現
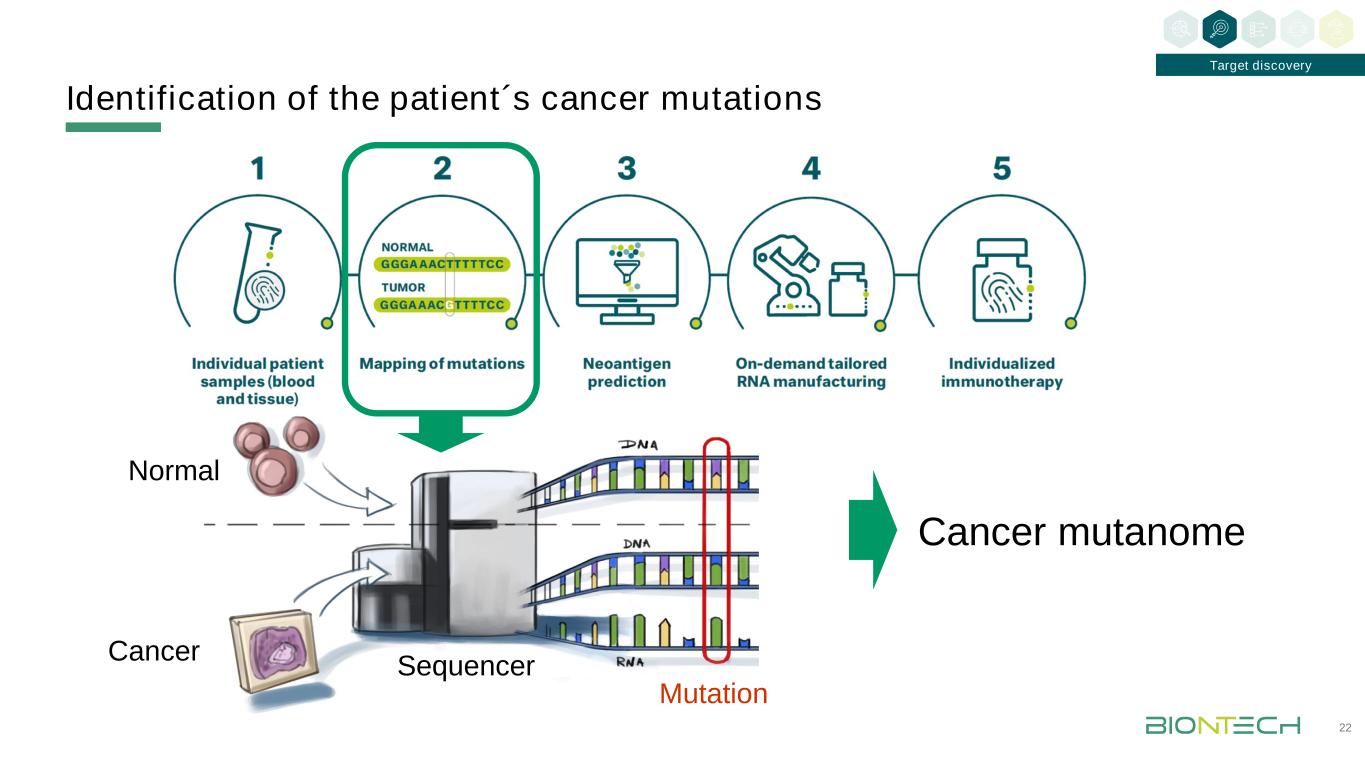
患者癌基因突變的鑑定22靶點發現癌突變組正常癌基因序列突變

KREITER et.艾爾自然2015年計算機預測突變23目標發現計算機預測突變列表由專家評審關鍵基因Mut Chrom Score#001 PIK3CA R115L 3 0,2#002 IMPA2 R202P 18 0,3#003 KRAS G12D 12 0,45#...…驗證………#267 KIF21B P188 S 1 3,45
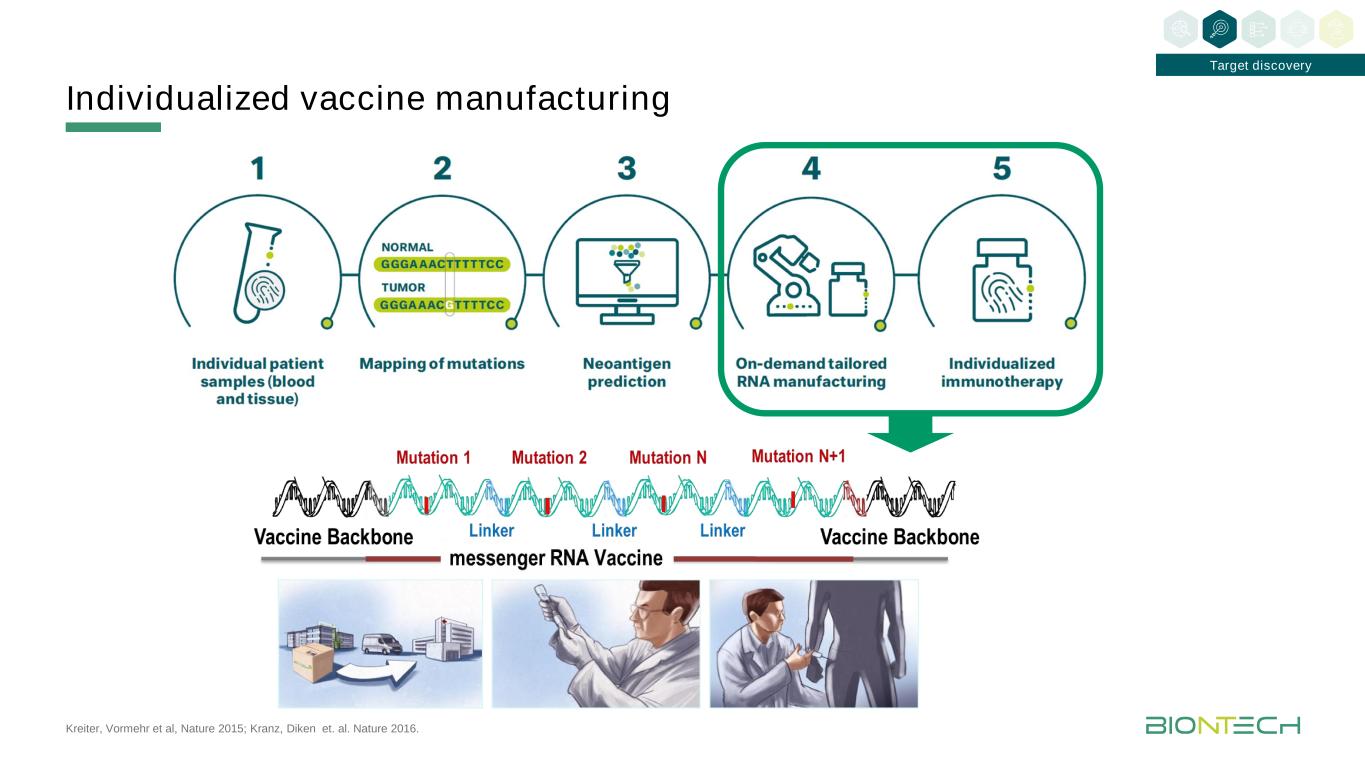
KREITER,Vormehr等人,《自然》2015;Kranz,Diken等人。艾爾《自然》2016。個性化疫苗生產目標的發現
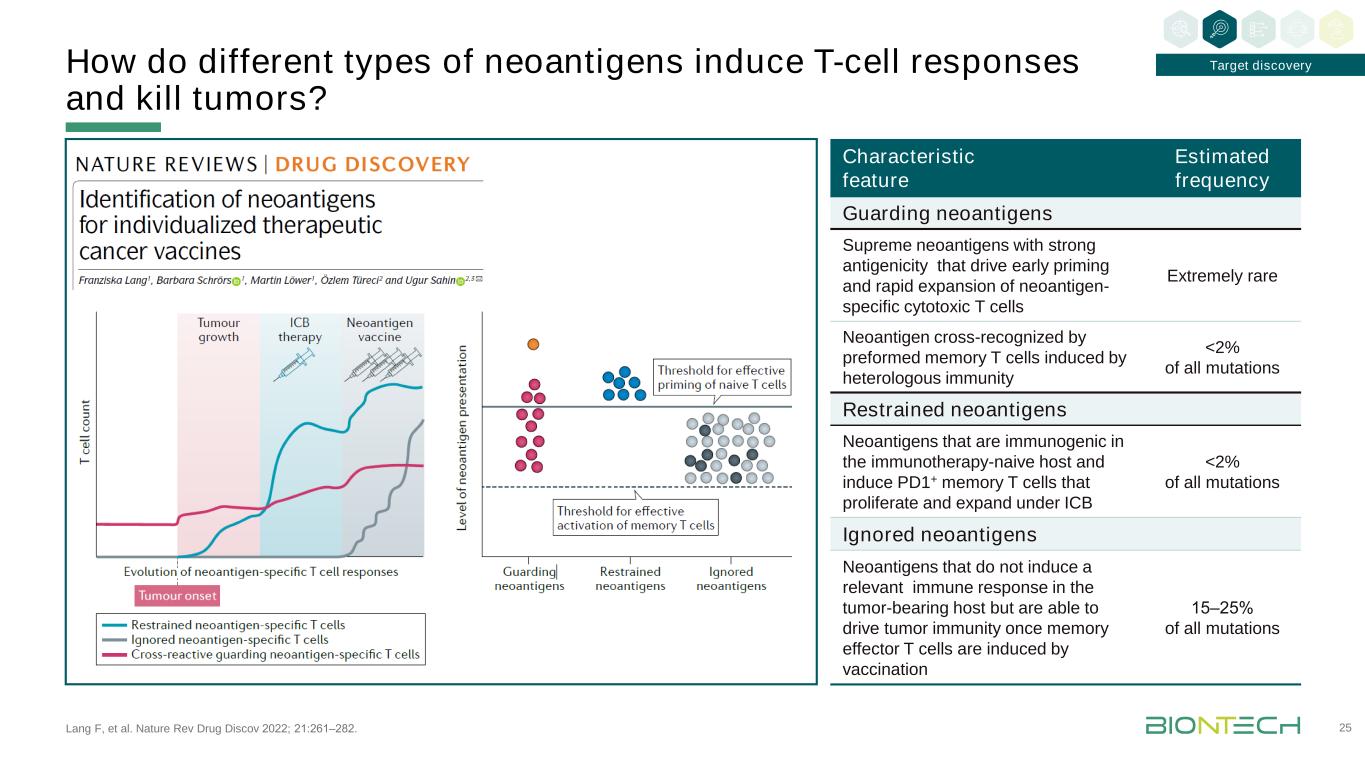
Lang F等人的研究成果。《自然回顧藥物發現》2022;21:261-282。不同類型的新抗原如何誘導T細胞反應和殺傷腫瘤?25個特徵特徵守衞新抗原的頻率最高的新抗原具有很強的抗原性,促使新抗原特異性細胞毒T細胞的早期啟動和快速擴增異種免疫誘導的預形成記憶T細胞交叉識別的極其罕見的新抗原
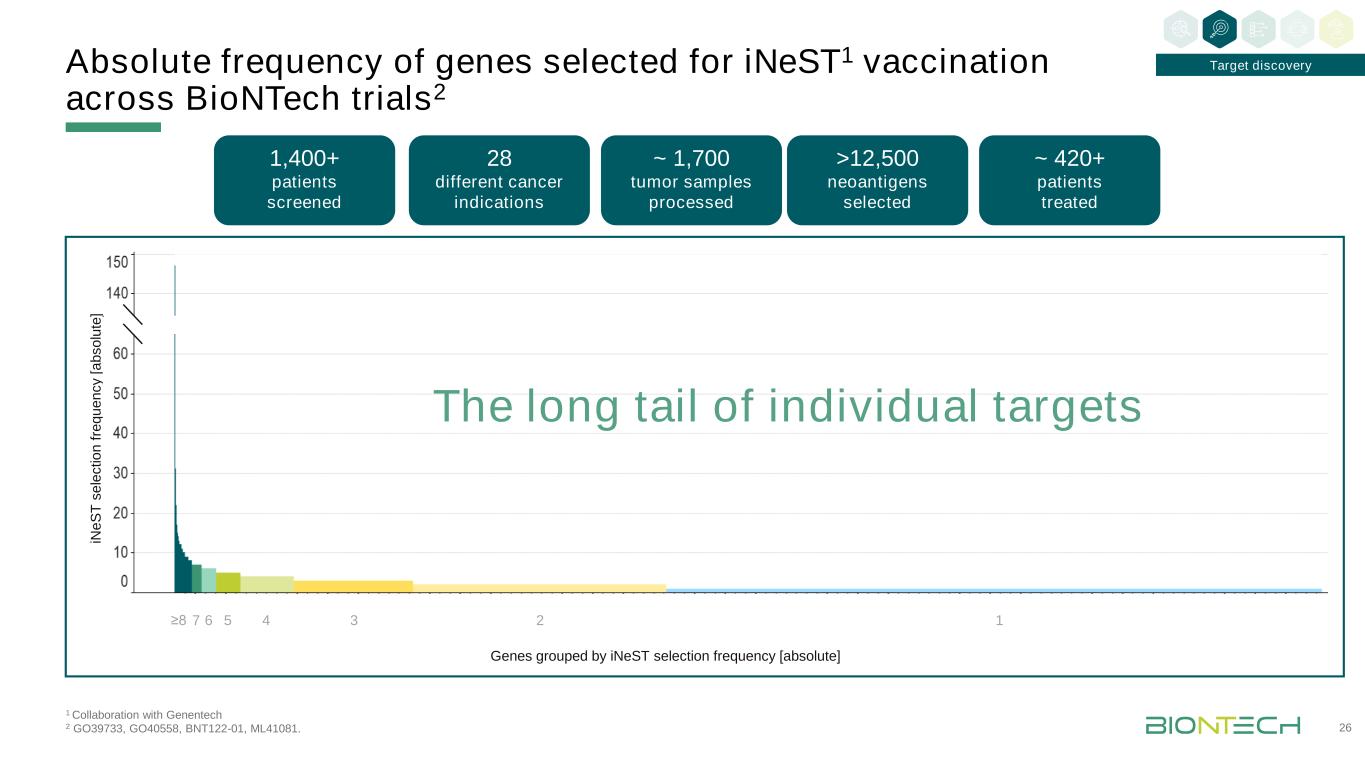
在E S T s e le c ti o n Fr e Q u e n c y中[一個b s o lu te]≥8 7 6 5 4 3 2 1 1與基因泰克2 GO39733、GO40558、BNT122-01、ML41081協作。在BioNTech試驗中選擇用於iNeST1疫苗接種的基因的絕對頻率2 26目標發現1,400+患者篩選~420+接受治療的患者約1,700個腫瘤樣本處理>12,500個新抗原選擇28個不同的癌症適應症基因按iNeST選擇頻率分組[絕對的]個別目標的長尾
聚焦五大創新支柱深入理解免疫系統多平臺創新引擎製造與自動化目標發現與表徵數字化AI/ML 27多平臺引擎
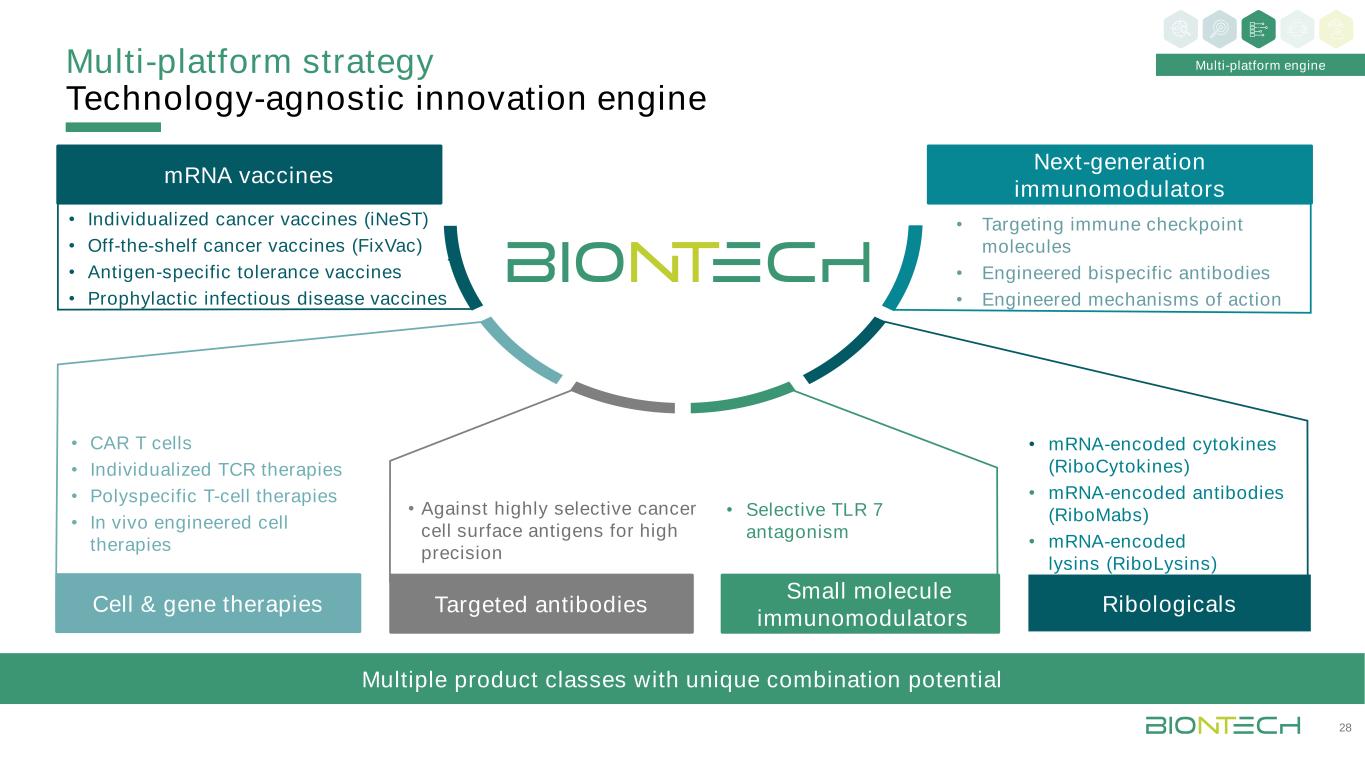
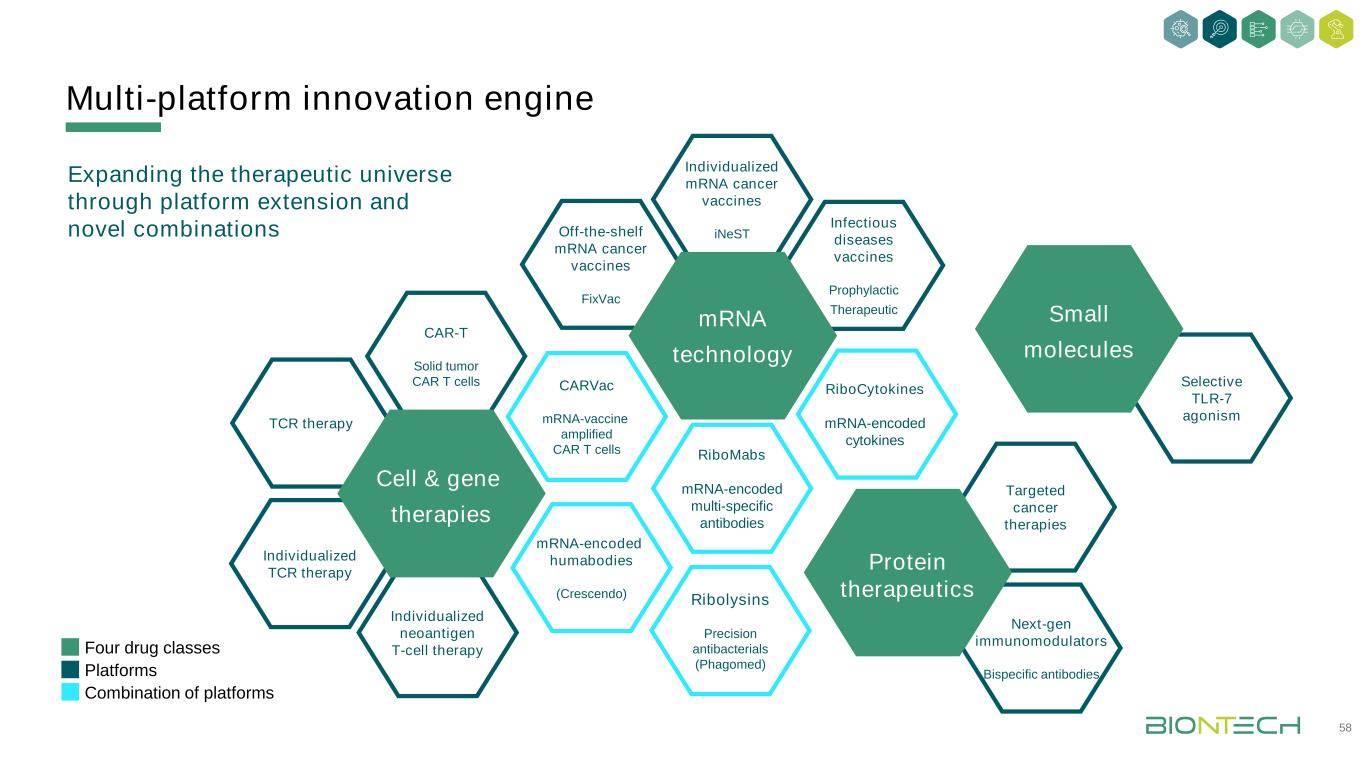
多平臺戰略技術-不可知創新引擎多平臺引擎28 mRNA疫苗靶向抗體小分子免疫調節劑·靶向免疫檢查點分子·工程雙特異性抗體·作用機制細胞和基因療法下一代免疫調節劑Ribologics·針對高選擇性癌細胞表面抗原的高精確度·選擇性TLR7拮抗劑·CAR T細胞·個體化TCR療法·多特異性T細胞療法·體內工程細胞療法·個體化癌症疫苗(INeST)·現成癌症疫苗(FixVac)·抗原特異性耐受性疫苗·預防性傳染病疫苗·mRNA編碼的細胞因子(核細胞因子·信使核糖核酸編碼抗體(RiboMabs)·信使核糖核酸編碼賴氨酸(RiboLysins)具有獨特結合潛力的多種產品類別

信使核糖核酸技術基於深厚的免疫學專業知識構建的廣泛信使信使核糖核酸工具包29多種信使核糖核酸遞送配方靈活的遞送途徑局部、腫瘤內、組織特異性或全身脂複合物(LPX)脂質納米粒(LNP)多複合體骨架優化的尿苷信使信使核糖核酸(URNA)+十多年的信使核糖核酸研究使效價提高>10,000倍並改善持久性骨架優化的核苷修飾信使核糖核酸(ModRNA)自擴增信使核糖核酸(SARNA)多平臺引擎反式放大信使信使(TARNA)
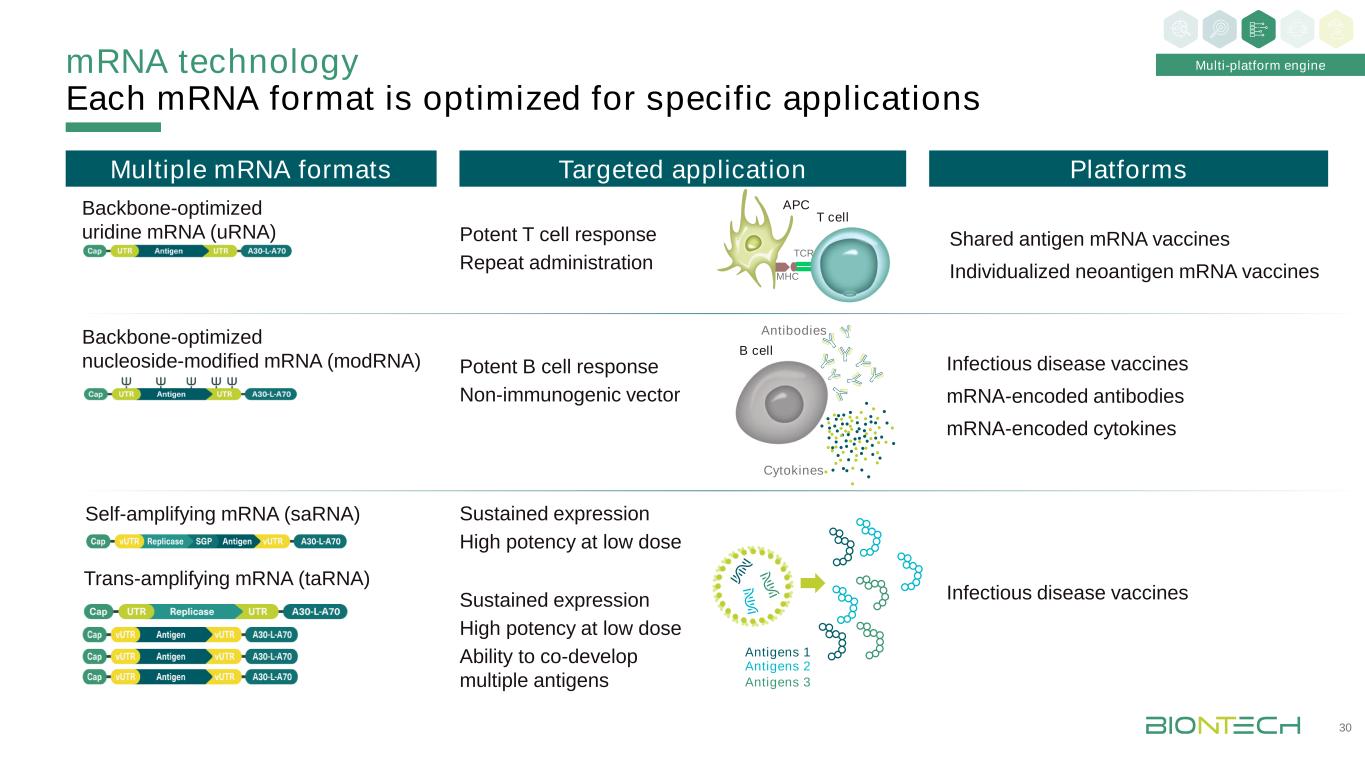
T細胞TCR MHC APC信使核糖核酸技術每種信使信使針對特定應用而優化多種信使信使骨架優化尿苷信使核糖核酸骨架優化核苷修飾信使核糖核酸靶嚮應用有效T細胞應答重複給藥共享抗原信使核糖核酸疫苗個性化新抗原信使核糖核酸疫苗平臺有效B細胞應答非免疫原性載體持續表達低劑量高效持續表達高效協同開發多種抗原B細胞因子抗體感染性疾病疫苗抗原1抗原2抗原3多平臺引擎傳染病疫苗信使核糖核酸編碼抗體信使核糖核酸反式擴增信使核糖核酸自擴增信使核糖核酸30
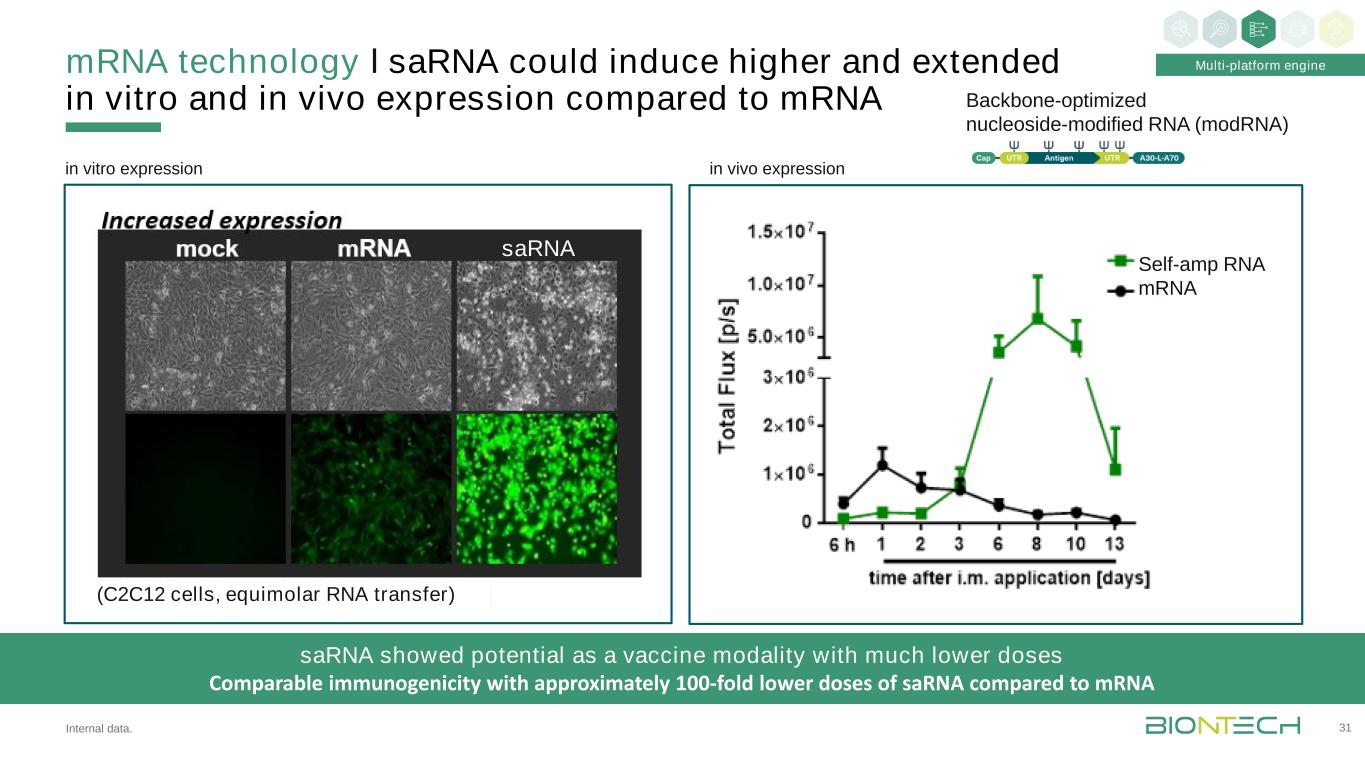
與І內部數據相比,信使核糖核酸技術可以在體外和體內誘導更高和更長時間的表達。31體外表達骨架優化的核苷修飾RNA(ModRNA)多平臺引擎Sarna顯示出作為疫苗的潛力,其劑量與免疫原性相當,與信使核糖核酸(C2C12細胞,等摩爾RNA轉移)相比,其免疫原性約低100倍
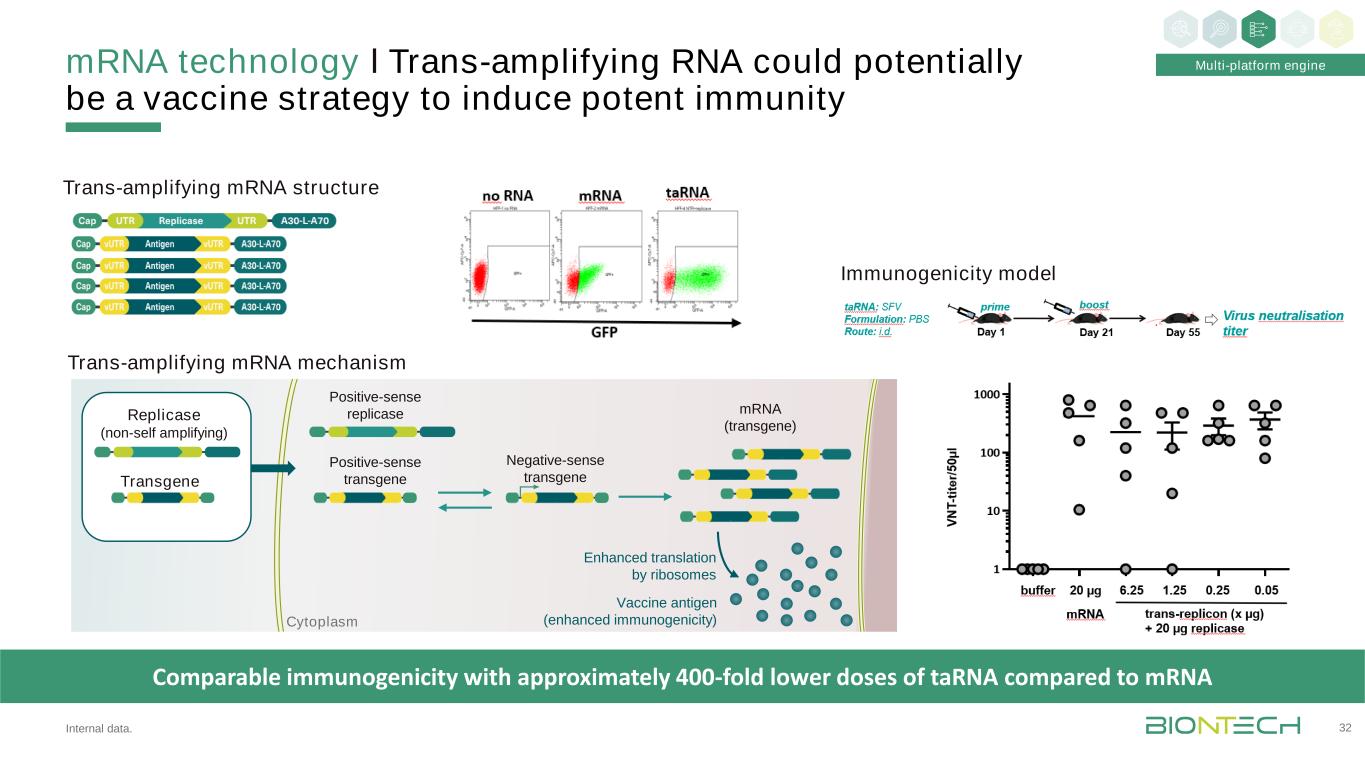
核糖核酸技術І反式擴增核糖核酸可能是一種潛在的疫苗策略,以誘導強大的免疫力32多平臺引擎內部數據。轉基因複製酶(非自擴增)正義複製酶正義轉基因反義轉基因(轉基因)疫苗抗原(增強免疫原性)增強核糖體的翻譯胞漿免疫原性與TARNA的劑量相比低約400倍反式擴增的結構免疫原性模型反式擴增的機制
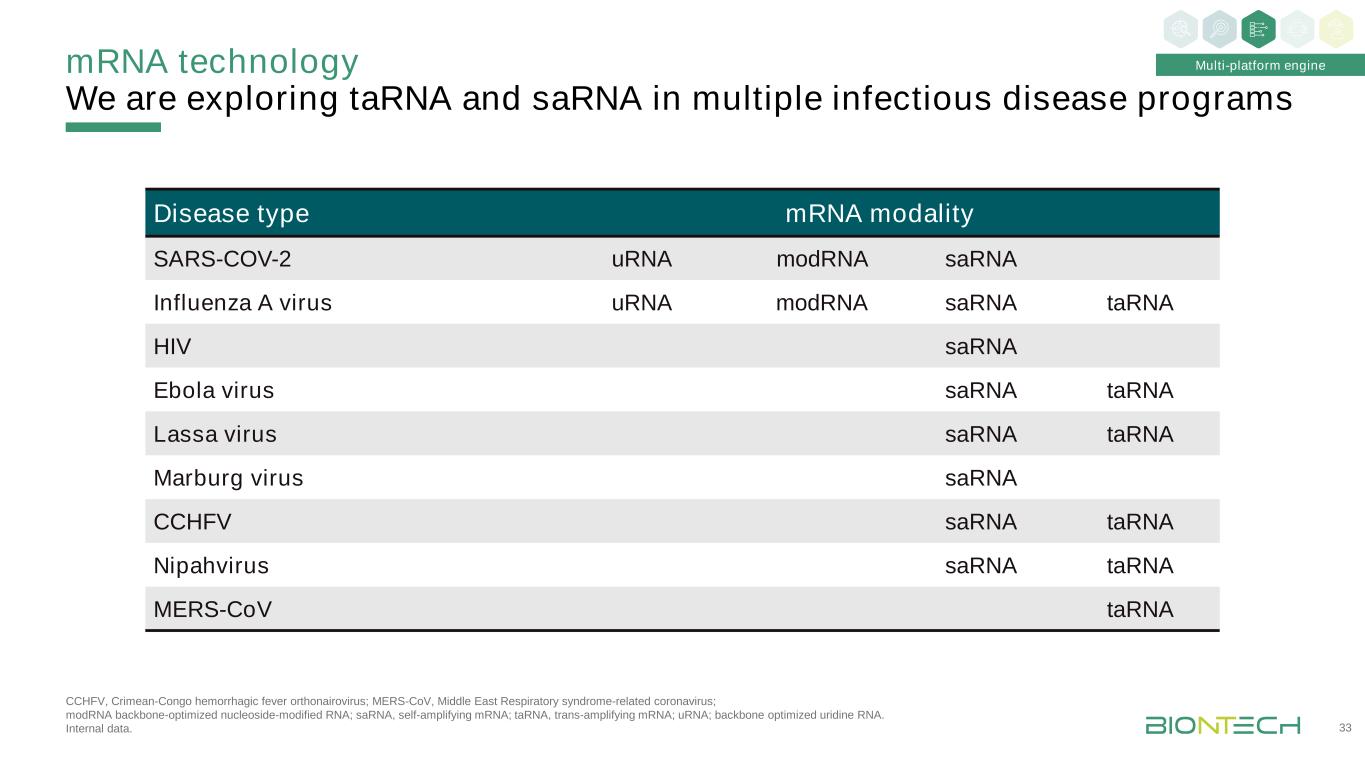
我們正在探索TARNA和SARNA在多種傳染病項目中的應用:CCHFV,克里米亞-剛果出血熱原核病毒;MERS-CoV,中東呼吸綜合徵相關冠狀病毒;modRNA骨架優化的核苷修飾的RNA;SARNA,自我擴增的RNA;TARNA,反式放大的RNA;URNA;骨架優化的尿苷RNA。內部數據。33疾病類型mRNA模式SARS-COV-2 urna modRNA Sarna流感A病毒urna modRNA Sarna Tarna HIV Sarna埃博拉病毒Sarna Tarna Lassa病毒Sarna Tarna Marburg病毒Sarna CCHFV Sarna Tarna NipahVirus Sarna Tarna MERS-CoV Tarna多平臺引擎
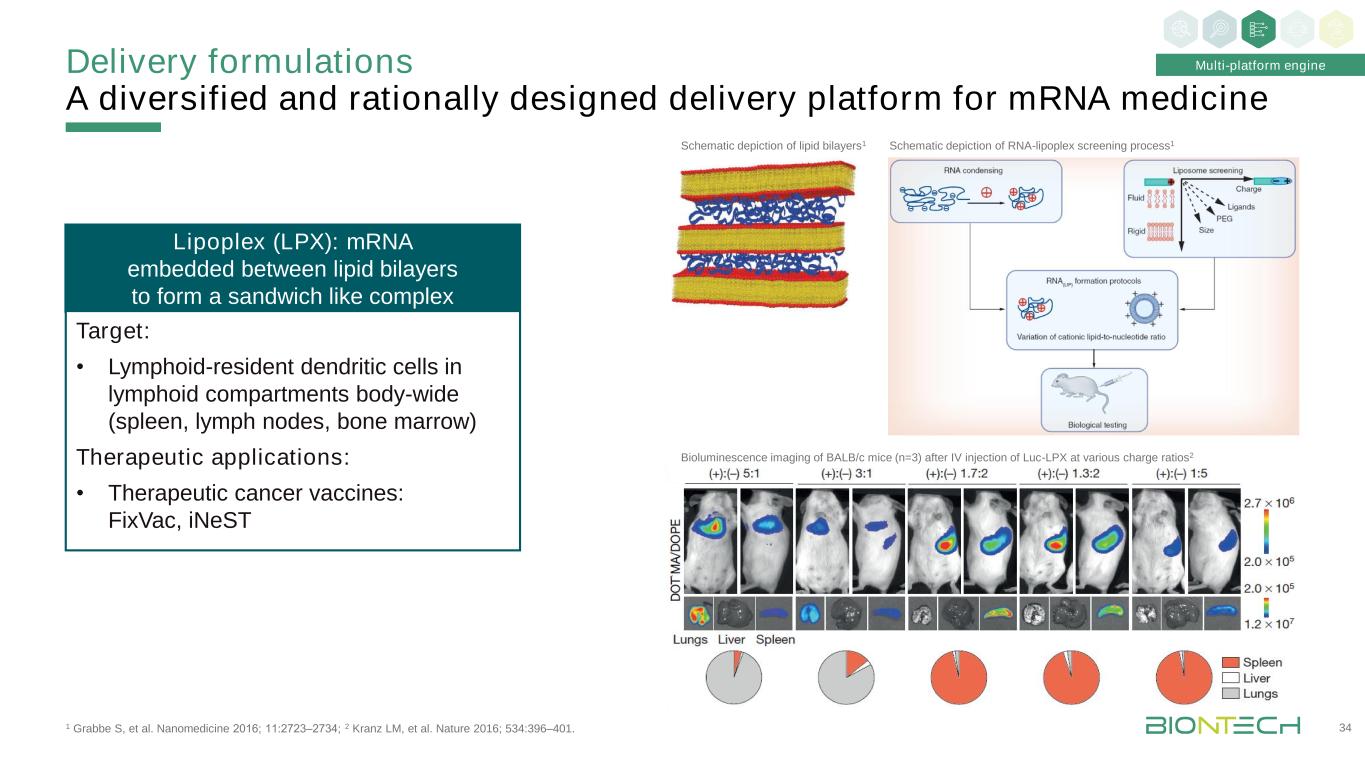
1 Grabbe S等人。Nanomedicine 2016;11:2723-2734;2 Kranz LM,等人。《自然》2016;534:396-401。給藥配方多樣化且設計合理的信使核糖核酸藥物遞送平臺34多平臺引擎核糖核酸-脂複合體篩選過程示意圖1不同充電比靜脈注射Luc-LPX後BALB/c小鼠的生物發光成像(n=3)2脂雙層(LPX)示意圖:嵌入在脂雙層之間以形成夾心狀複合體的信使核糖核酸靶點:·淋巴滯留於全身淋巴間隔(脾、淋巴結、骨髓)的樹突狀細胞治療應用:治療癌症疫苗:FixVac,iNeST
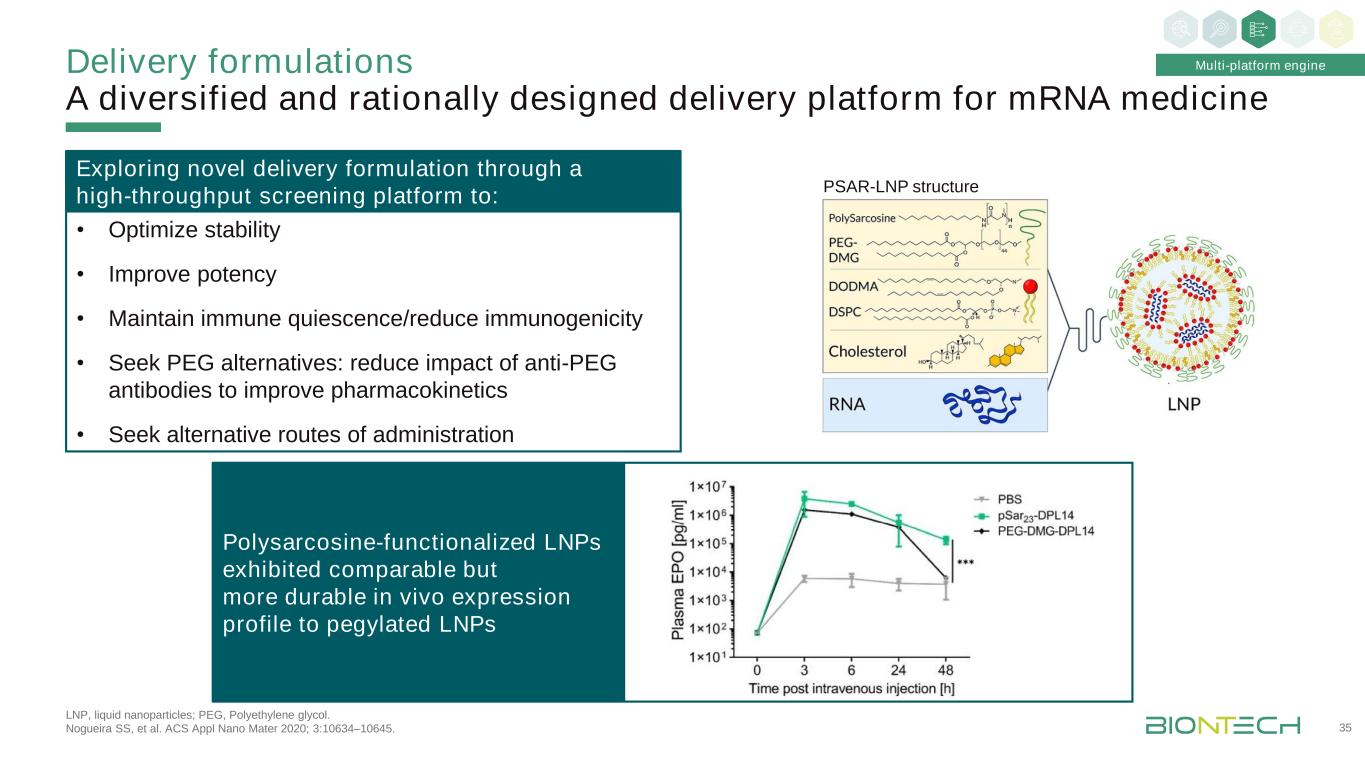
·優化穩定性·提高效力·保持免疫靜止/降低免疫原性·尋求聚乙二醇類替代品:減少抗聚乙二醇類抗體的影響以改善藥代動力學·尋求替代給藥途徑:LNP,液體納米粒;聚乙二醇類。Nogueira SS等人。美國應用納米材料2020年;3:10634-10645。遞送配方用於信使核糖核酸藥物的多樣化和合理設計的遞送平臺35多平臺引擎通過高通量篩選平臺探索新的遞送配方以:Psar-LNP結構多肌氨酸功能化的LNPs顯示出與聚乙二醇化的LNPs相似但更持久的體內表達譜
聚焦五大創新支柱深入理解免疫系統多平臺創新引擎製造與自動化目標發現與表徵Digital&AI/ML 36 Digital&AI/ML

BioNTech的AI&ML應用37新抗原預測新冠肺炎變異監測和預測數字化&AI/ML 1 2
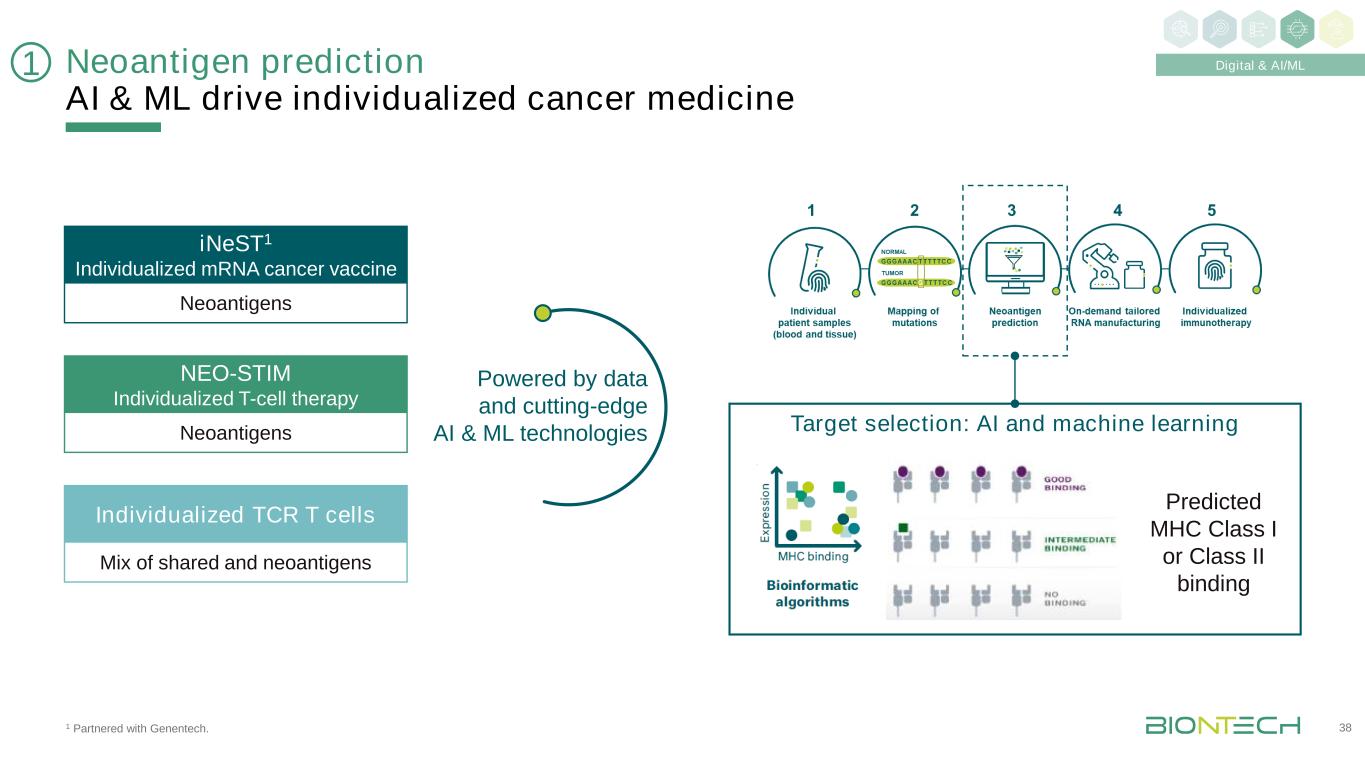
1與基因泰克合作。新抗原預測AI&ML驅動個體化癌症藥物38 1新抗原iNeST1個體化信使核糖核酸癌症疫苗新抗原NEO-STIM個體化T細胞療法共享和新抗原的混合個體化TCR T細胞由數據和尖端AI&ML技術驅動目標選擇:AI和機器學習預測MHC I類或II類結合數字和AI/ML

1 TüreciÖ,et al.NAT Bimed Eng 2018;2:566-569;2 Sahin U.AACR 2022年會;口頭陳述;3 McGranahan N等人。Science 2016;351:1463-1469;4 Gejman RS等人。ELife 2018;7:e41090;5段F等人。J Exp Med 2014;211:2231-2248;6 Balachandran副總裁等人。《自然》2017;551:512-516;7亞達夫·M等人。《自然》2014;515:572-576;8 Kreiter S等人。《自然》2015;520:692-696;9 Abelin JG等人。豁免權2017;46:315-326。新抗原預測我們如何識別、預測和表徵新抗原?39細胞毒性T細胞對癌症相關突變的識別1參考?與免疫原性相關的生物學與腫瘤細胞識別相關的生物學·突變的類型(SNV、Indel、Fusion.)2·突變的克隆性(克隆、亞克隆)3、4·突變位置(錨定、非錨定、TCR可及性)5-7·突變的轉錄本表達水平8、9·與外來抗原的相似性/缺乏自相似性2·多肽/人類白細胞抗原結合強度(親和力、失重率)2數字和AI/ML1
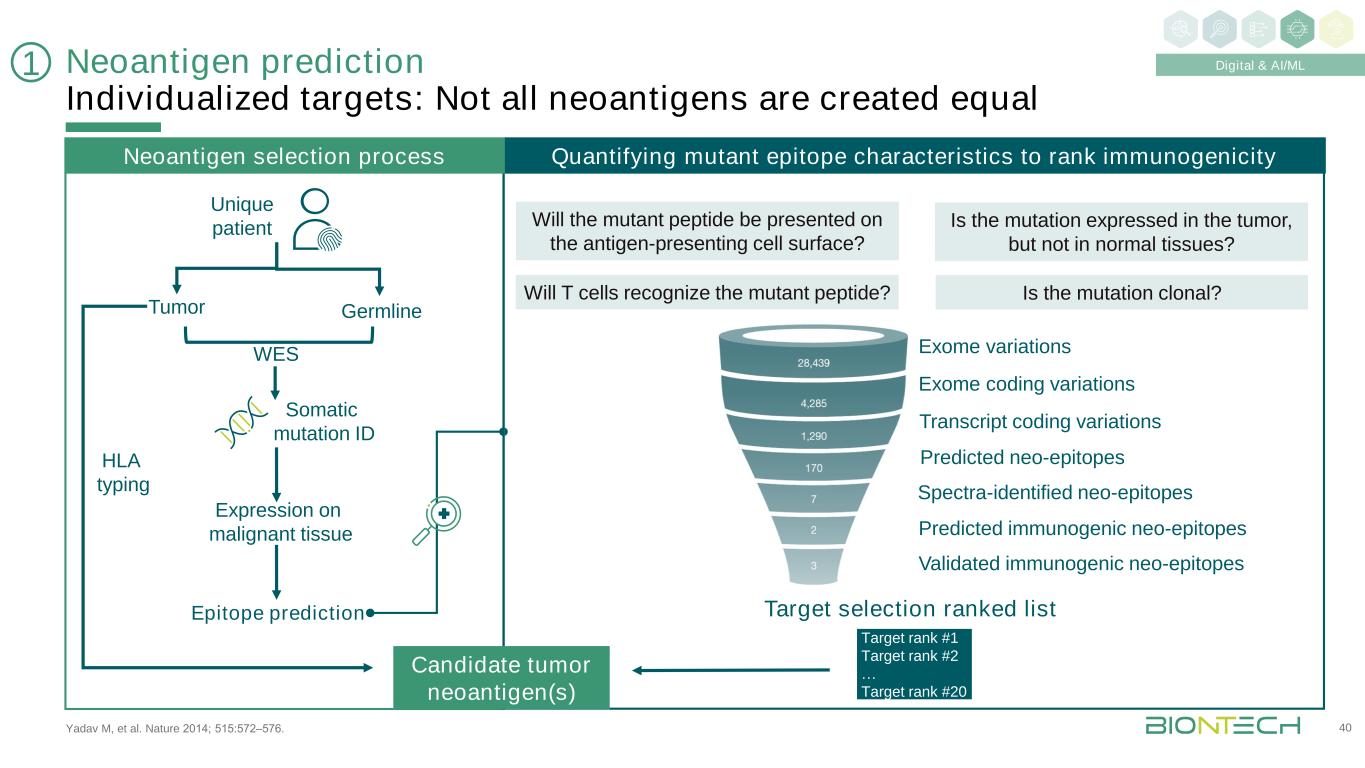
Yadav M等人。《自然》2014;515:572-576。新抗原預測個體化靶點:並非所有新抗原都是等同的40個外顯子變異外顯子編碼變異轉錄本編碼變異預測新表位光譜鑑定新表位預測免疫原性新表位驗證免疫原性新表位T細胞會識別突變的多肽嗎?突變是否在腫瘤中表達,而在正常組織中不表達?突變的多肽會出現在抗原提呈細胞表面嗎?突變是克隆的嗎?目標排名#1目標排名#2…靶點排名#20獨特的患者腫瘤胚系WES體細胞突變ID在惡性組織上的表達表位預測人類白細胞抗原分型量化突變表位特徵排名免疫原性新抗原選擇過程排名候選腫瘤新抗原1數字和AI/ML
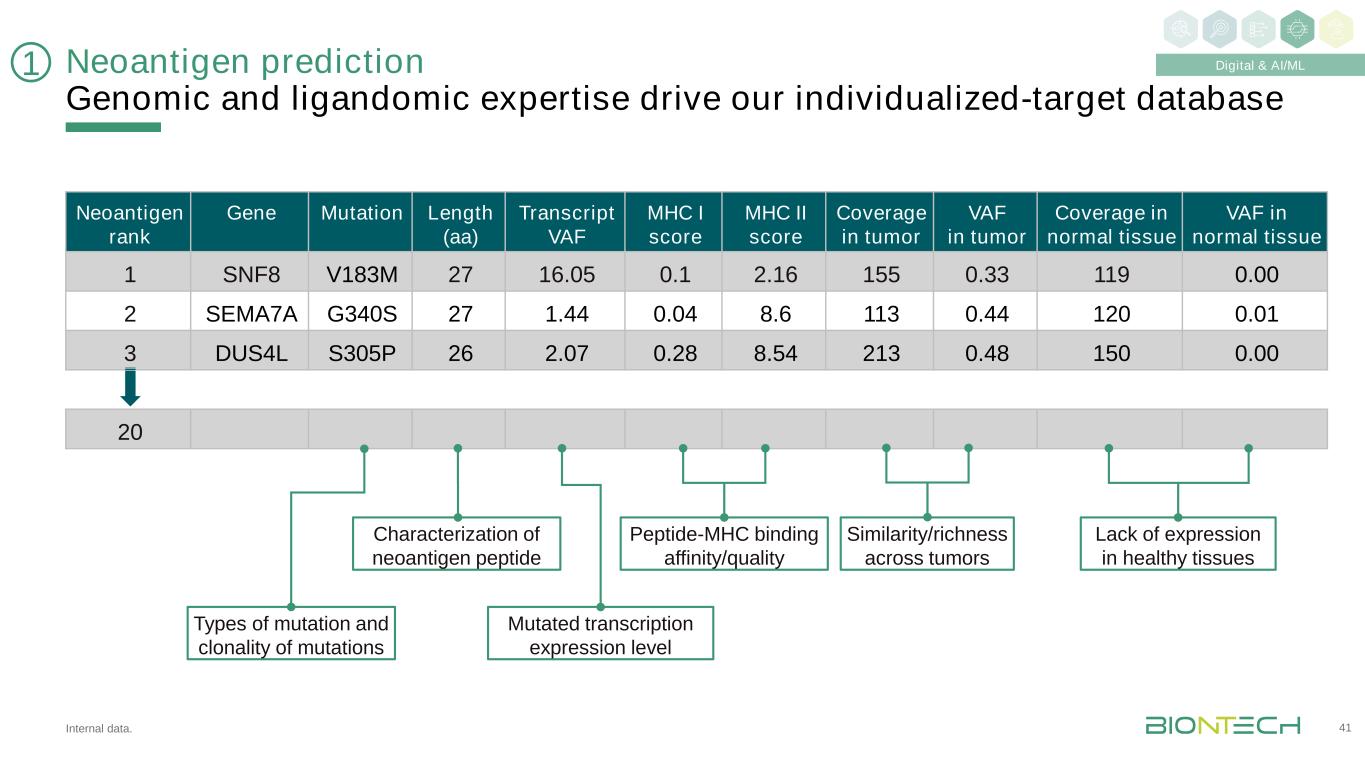
內部數據。新抗原預測基因組和配子學專業知識推動我們的個性化靶標數據庫41新抗原等級基因突變長度(AA)轉錄本VAF MHC I評分MHC II評分腫瘤VAF覆蓋正常組織1 SNF8 V183M 27 16.05 0.1 2.16 155 0.33 119 0.00 2 SEMA7A G340S 27 1.0.04 8.6 113 0.44 120 0.01 3 DUS4L S305P 26 2.07 0.28 8.54 213 0.48 150 0.00 20種突變和克隆性突變轉錄表達水平表徵新抗原肽-MHC的結合親和力/質量相似性/豐富度跨腫瘤缺乏在健康組織中表達1數字和AI/ML
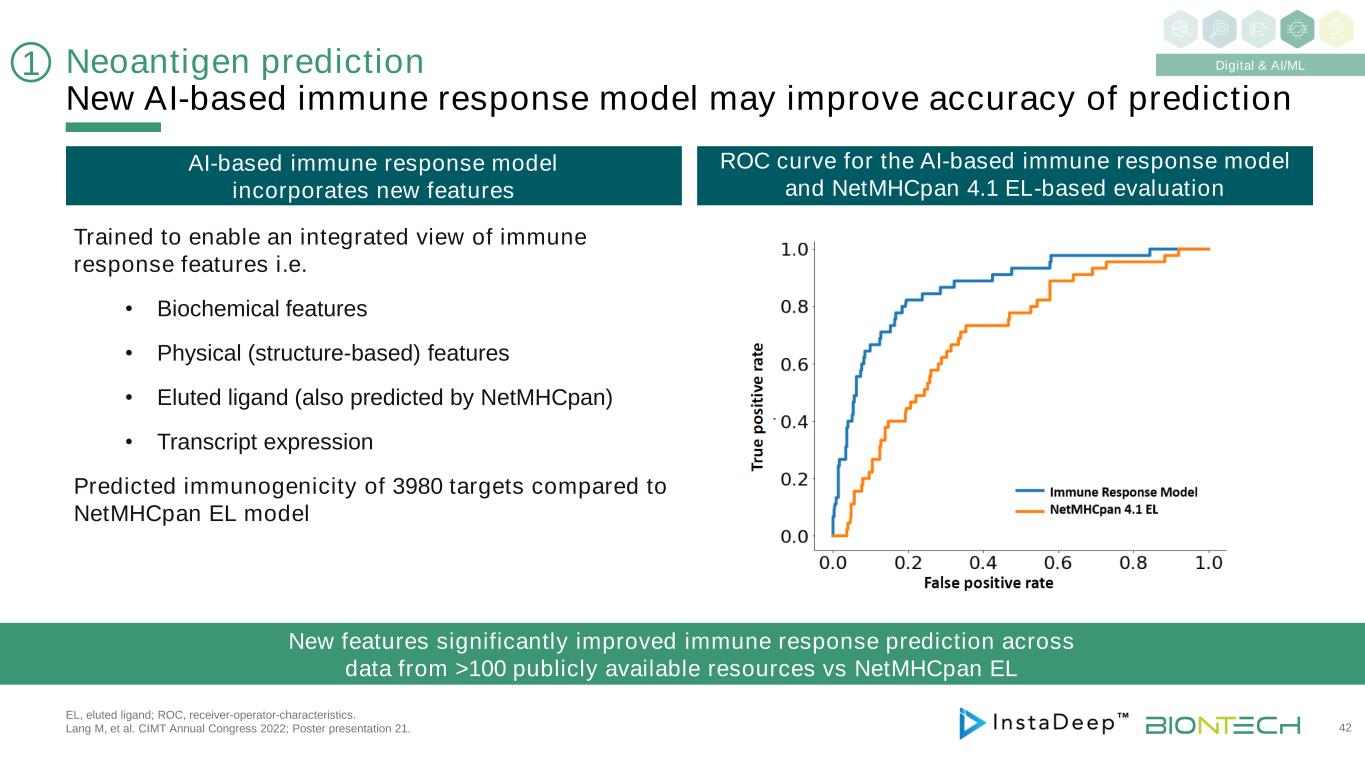
新抗原預測新的基於AI的免疫反應模型可能提高預測EL的準確性;洗脱的配體;ROC,接受者-操作者-特性。Lang M等人的研究成果。CIMT 2022年年會;海報展示21。42 1經過數字和AI/ML培訓,以實現免疫反應特徵的集成視圖,即·生化特徵·物理(基於結構)特徵·洗脱配體(也由NetMHCpanEL預測)·與NetMHCpanEL模型相比,轉錄表達預測3980個目標的免疫原性新功能顯著改進了對來自100多個公開資源的數據的免疫反應預測VS NetMHCpanEL基於AI的免疫反應模型納入了新功能ROC曲線用於基於AI的免疫反應模型和NetMHCpan4.1基於EL的評估

新冠肺炎變異的監測和預測在檢測到新變異的時間上減少了~2個月1人工智能合作的BioNTech和InstaDeep。緊急警報系統。Bguir K,et al.BioRxiv 2021年;DOI:10.1101/2021.12.24.474095。43高危SARS-CoV-2變種的早期計算檢測1支持新冠肺炎疫苗的快速適應以對抗新的威脅,在響應時間上節省數月2表位改變分數通過抗體檢測和中和ACE2結合蛋白免疫逃逸分數感染性分數感染性分數Pareto分數嵌入空間語義變化距離野生型對數語言模型增長速度元數據(序列+實驗數據)預測概率的似然和(序列+實驗數據)結構建模機器學習建模EWS分數Spike Protein ACE2SARS-CoV-2病毒按世界衞生組織名稱標記隨時間變化的變異案例累計(以對數標度表示)數字AI/ML
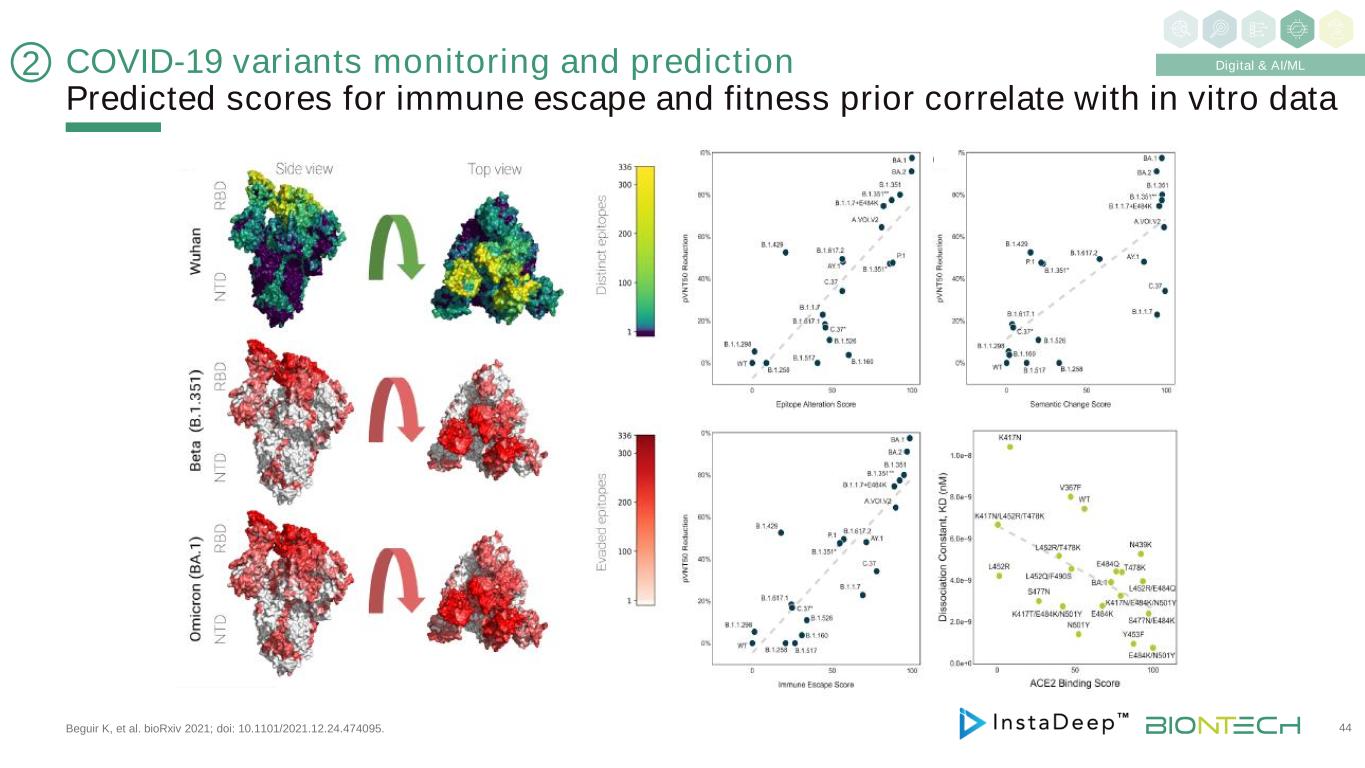
新冠肺炎變異監測和預測的免疫逃逸和健康先驗預測分數與體外數據相關,Bguir K等人。BioRxiv 2021年;DOI:10.1101/2021.12.24.474095。44 2數字和AI/ML
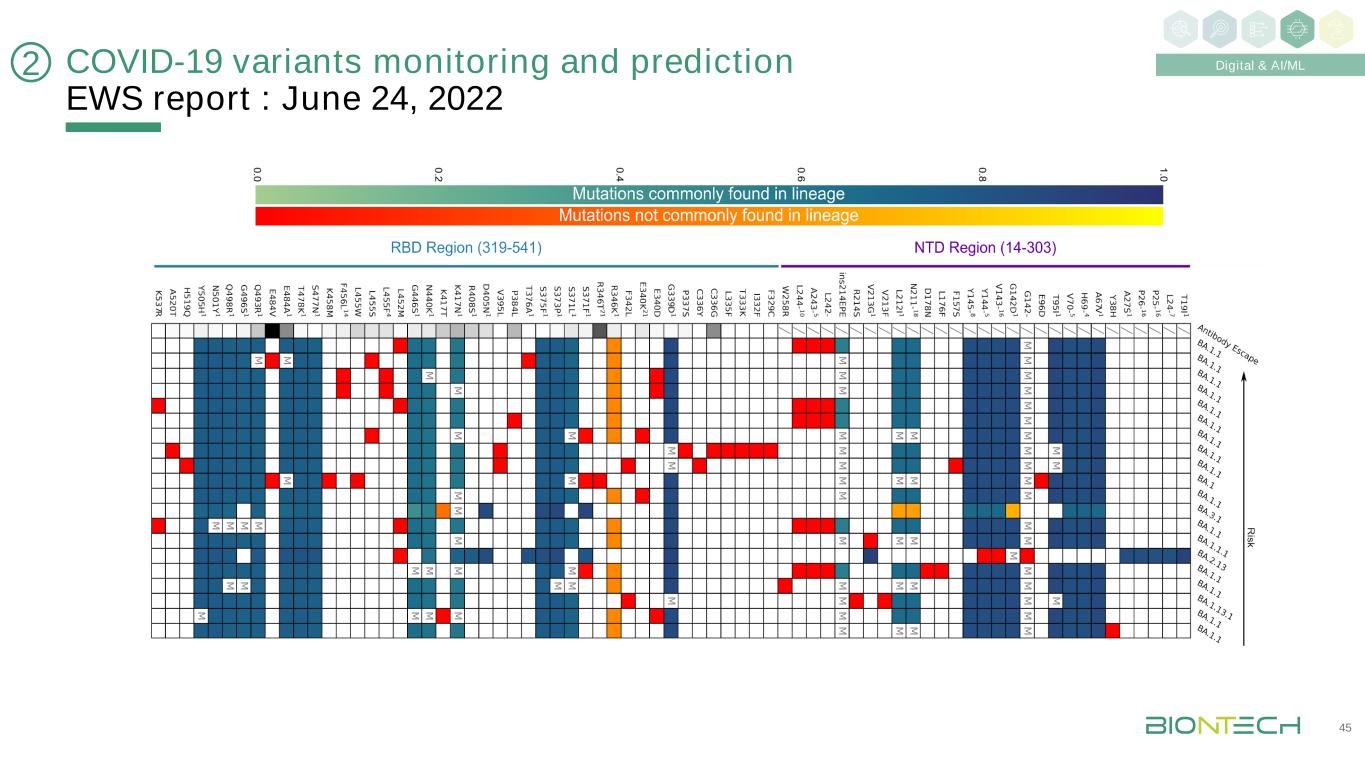
新冠肺炎變異監測和預測預警報告:2022年6月24日45數字化&人工智能/ML2
聚焦五大創新支柱深入理解免疫系統多平臺創新引擎製造與自動化目標發現與表徵數字化與AI/ML 46製造與自動化

製造業和自動化
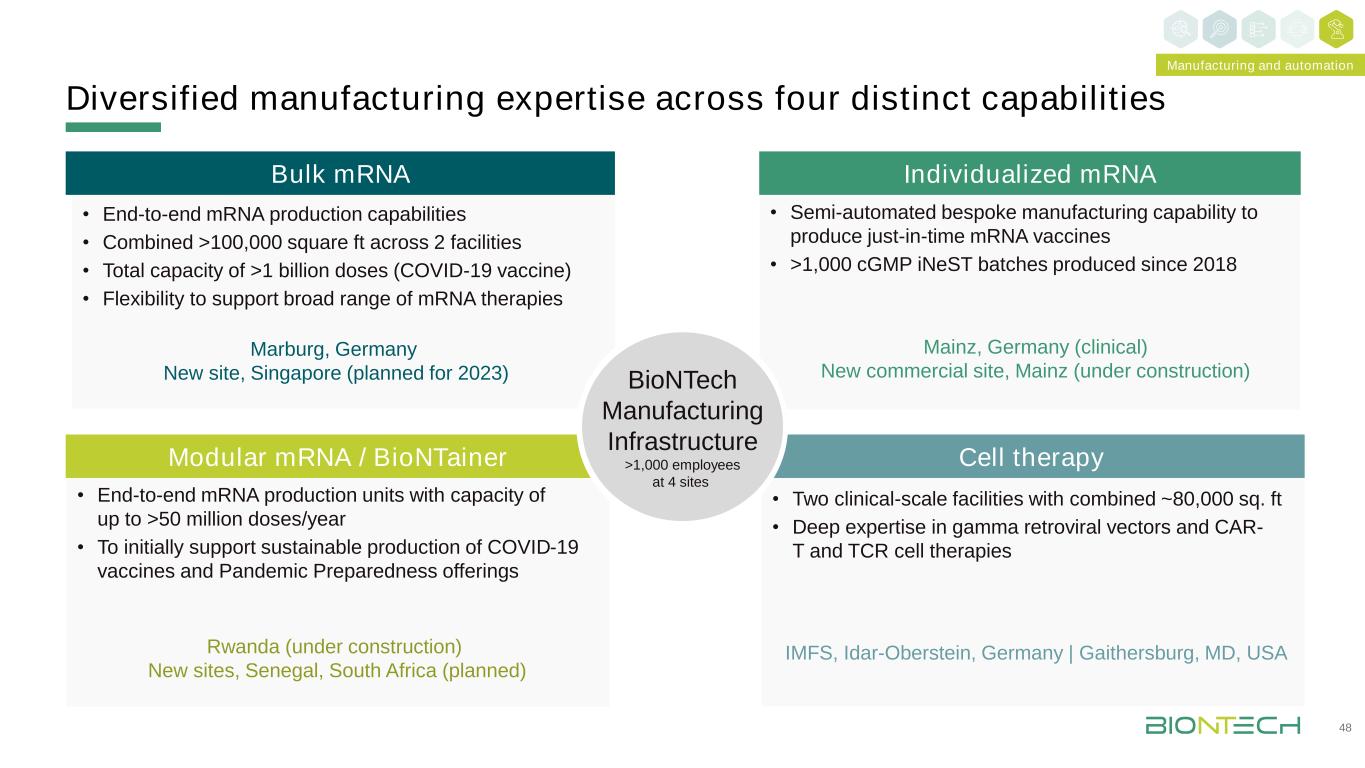
四個不同能力的多樣化製造專業技能48·端到端信使核糖核酸生產能力·2個設施合計超過100,000平方英尺·總產能>10億劑(新冠肺炎疫苗)·靈活地支持各種信使核糖核酸療法大宗信使信使能·半自動定製製造能力,以生產即時信使核糖核酸疫苗·>1,000 cGMP iNeST自2018年以來生產的批次個體化信使核糖核酸·端到端信使核糖核酸生產能力高達>5,000萬劑/年·最初支持新冠肺炎疫苗和大流行防範產品的可持續生產模塊化信使核糖核酸/BioNTainer·兩個臨牀規模的設施,合併約80,000平方英尺。《金融時報》·伽瑪逆轉錄病毒載體和CAR-T及TCR細胞療法的深厚專業知識德國馬爾堡細胞療法,新加坡(計劃2023年)德國美因茨(臨牀)新商業網站,美因茨(在建)盧旺達(在建)新網站,塞內加爾,南非(計劃)IMF,德國|蓋瑟斯堡,馬裏蘭州,美國製造和自動化BioNTech製造基礎設施在4個網站超過1,000名員工
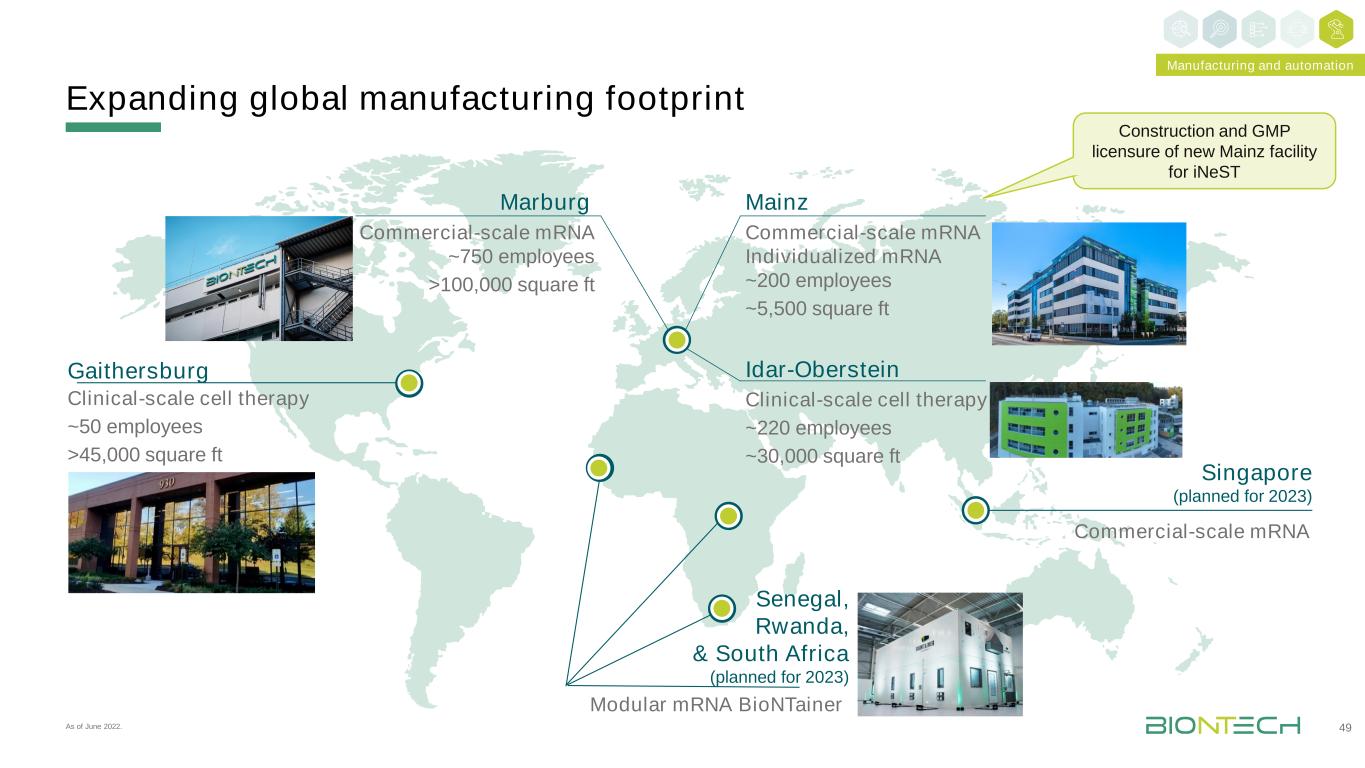
擴大全球製造規模49蓋瑟斯堡臨牀規模細胞療法~50名員工>45,000平方英尺模塊化mRNA生物信息網塞內加爾、盧旺達和南非(計劃於2023年)新加坡(計劃2023年)商業規模mRNA Idar-Oberstein MainzMarburg商業規模mRNA個性化mRNA~200名員工~5,500平方英尺臨牀規模細胞療法~220名員工~30,000平方英尺商業規模mRNA~750名員工>100,000平方英尺建造和GMP許可證截至2022年6月,為iNeST製造和自動化提供新的Mainz工廠

擴大信使核糖核酸生產通過數字化和自動化實現50批次的規模和能力擴展2022年年度臨牀患者批次能力1,000>10,000計劃能力2020年末馬爾堡大宗信使核糖核酸批次規模350克1.4公斤2020年初製造和自動化1克2011年10

擴大基因批次:Marburg 51 BioNTainer開發中心於2020年以不到1億歐元的價格從諾華公司收購>2021年第二季度以來生產的15億劑新冠肺炎疫苗>100,000平方英尺和8套改裝生產套件,在收購、製造和自動化後6個月內生產基因疫苗
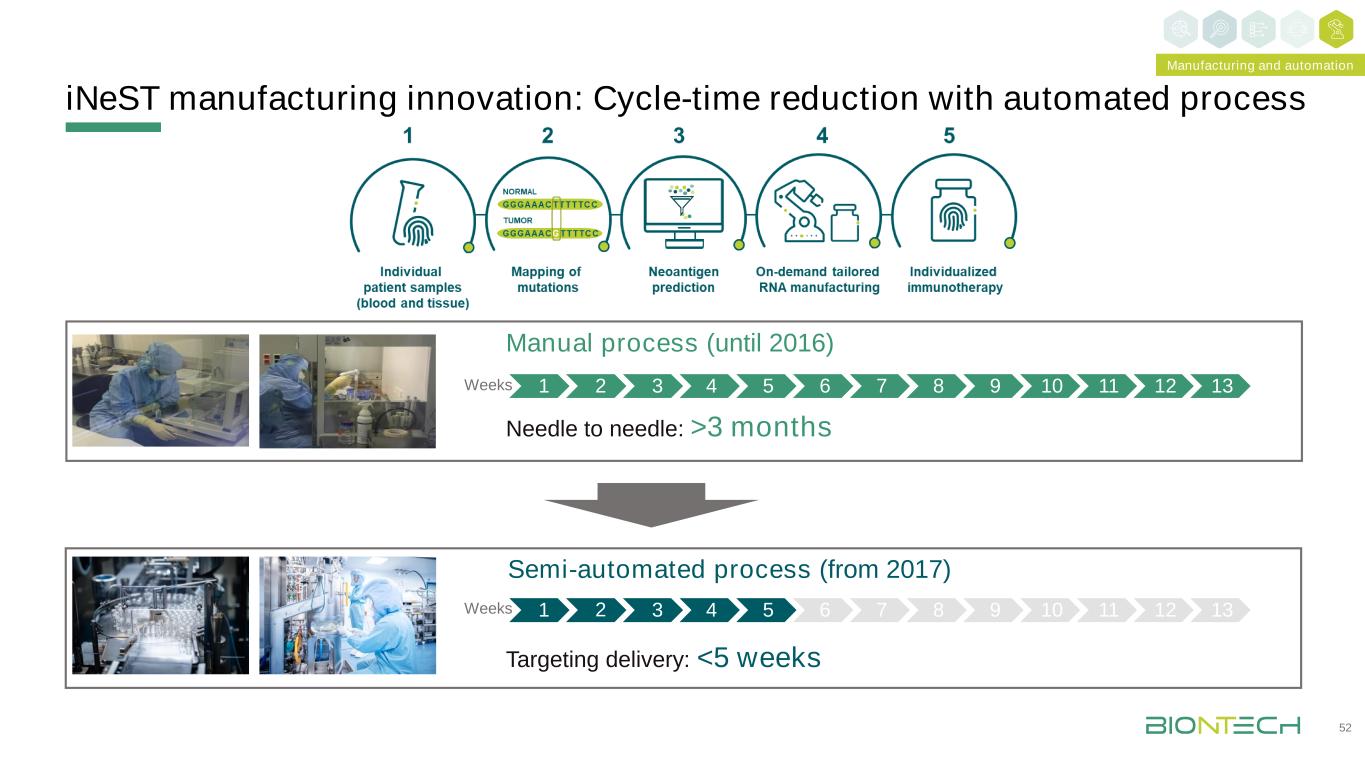
1 2 3 4 5 6 7 8 9 10 11 12 13目標交付:3個月手動流程(至2016年)半自動流程(自2017年起)周製造和自動化

我們正在投資全球cGMP細胞治療基礎設施53個IMF,德國伊達爾-奧伯斯坦(全資擁有)全天候運營模式減少步驟和時間複雜性提高效率自動化方法的優勢製造過程的重複性釋放產能更快的週轉時間每個患者先進的計劃算法需要網站BioNTech,蓋瑟斯堡,馬裏蘭州,美國(長期租賃)製造和自動化的新圖片

BIONTainer:本地化和可持續的信使核糖核酸生產的平臺54挑戰建立信使核糖核酸的GMP生產的解決方案是複雜的,需要克服多個層面的挑戰交鑰匙方案,包括模塊化生產單元、符合GMP的設置和人員培訓製造和自動化

BioNTainers:2022年的下一步是什麼55在盧旺達的第一個BioNTainer製造工廠破土動工55第一個BioNTainer預計將發貨(YE 2022)監管框架符合國際和當地標準評估全球BioNTainer的其他用例和產品最終確定非洲聯盟製造和自動化新設施的規劃和初始資產
聚焦五大創新支柱使合成醫學進入新時代對免疫系統的深刻理解多平臺創新引擎製造和自動化目標發現和表徵數字化&AI/ML 56
聚焦五大創新支柱推動合成醫學進入新時代對免疫系統的深入理解多平臺創新引擎製造和自動化目標發現和表徵數字化&AI/ML 57
多平臺創新引擎58 TCR治療CAR-T實體瘤CAR-T細胞感染性疾病疫苗預防治療現成的信使核糖核酸癌症疫苗FixVac RiboMabs信使核糖核酸編碼的多特異性抗體癌症疫苗iNeST核細胞因子信使核糖核酸編碼的細胞因子CARVac信使核糖核酸疫苗擴增的CAR-T細胞核糖核酸精確抗菌藥物(已合成)四種藥物平臺結合平臺個體化新抗原T細胞療法信使核糖核酸編碼的體液(新藥)個體化的TCR細胞和基因療法下一代免疫調節劑雙特異性抗體靶向癌症治療TLR-7選擇性激動劑小分子通過擴展平臺和新組合擴大治療宇宙

傳染病的新前沿傳染病的新前沿

在新冠肺炎疫苗領導地位的基礎上應對全球挑戰60推進信使核糖核酸疫苗、核糖核酸疫苗、核糖核酸疫苗和核糖核酸疫苗的廣泛工具包下一代新冠肺炎疫苗的多樣化流水線提供針對高需求傳染病的突破有能力精確地解決多樣化和難以靶向的病原體新疫苗的推出和臨牀試驗預計將於2022年下半年開始
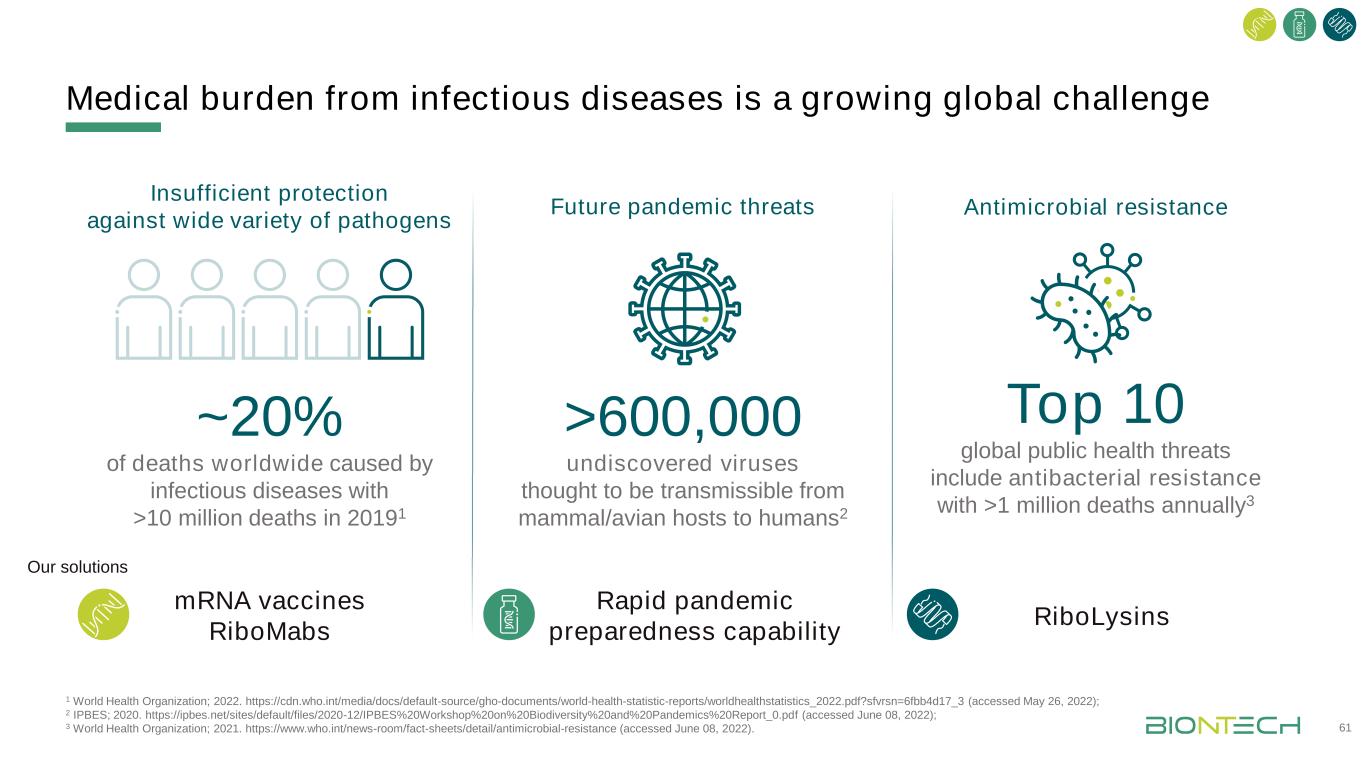
傳染病造成的醫療負擔是一個日益嚴重的全球性挑戰,1世界衞生組織,2022年。Https://cdn.who.int/media/docs/default-source/gho-documents/world-health-statistic-reports/worldhealthstatistics_2022.pdf?sfvrsn=6fbb4d17_3(2022年5月26日訪問);2個IPBES;2020年。Https://ipbes.net/sites/default/files/2020-12/IPBES%20Workshop%20on%20Biodiversity%20and%20Pandemics%20Report_0.pdf(2022年6月8日訪問);3世界衞生組織;2021年。Https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance(2022年6月8日訪問)。全球61%~20%的人死於傳染病20191全球10大公共衞生威脅包括抗菌素抗藥性每年有100多萬人死亡3未來大流行威脅對多種病原體的保護不足抗菌素抗藥性>600,000種被認為可從哺乳動物/禽類宿主傳染給人類的未發現病毒2核糖核酸疫苗RiboMabs快速大流行預防能力RiboLysins我們的解決方案

新冠肺炎疫苗驗證了我們的信使核糖核酸技術,併為未來信使信使核糖核酸產品62信使核糖核酸的ID 10個月開發時間劑量截至202234億10億接種者安全數據庫鋪平了道路

BioNTech和輝瑞在傳染病領域的全球mRNA合作計劃FIH,這是人類首例。63新冠肺炎公司:計劃於2022年下半年推出全球領先的特許經營變異適應疫苗計劃2022年下半年推出單劑四價mna疫苗第一階段數據更新預計2022年帶狀皰疹疫苗潛在的一流基於信使核糖核酸的帶狀皰疹疫苗具有重磅炸彈潛力FIH第一階段試驗2H 2022mRNAfor ID建立在傳染病疫苗快速臨牀開發和成功全球商業化的記錄+

截至2022年3月,1被批准為預防新冠肺炎的2劑系列疫苗,適用於16歲及以上的個人;2 2劑系列的緊急使用許可,適用於5-15歲的個人;3劑系列的緊急使用許可,適用於6個月至4歲的兒童;2該疫苗被指定為主動免疫,以預防5歲及以上的個人預防SARS-CoV-2病毒引起的新冠肺炎。為下一階段新冠肺炎大流行做好準備64個關鍵驅動者大流行準備。FDA批准用於兒科的EUA(6個月至175個國家和地區
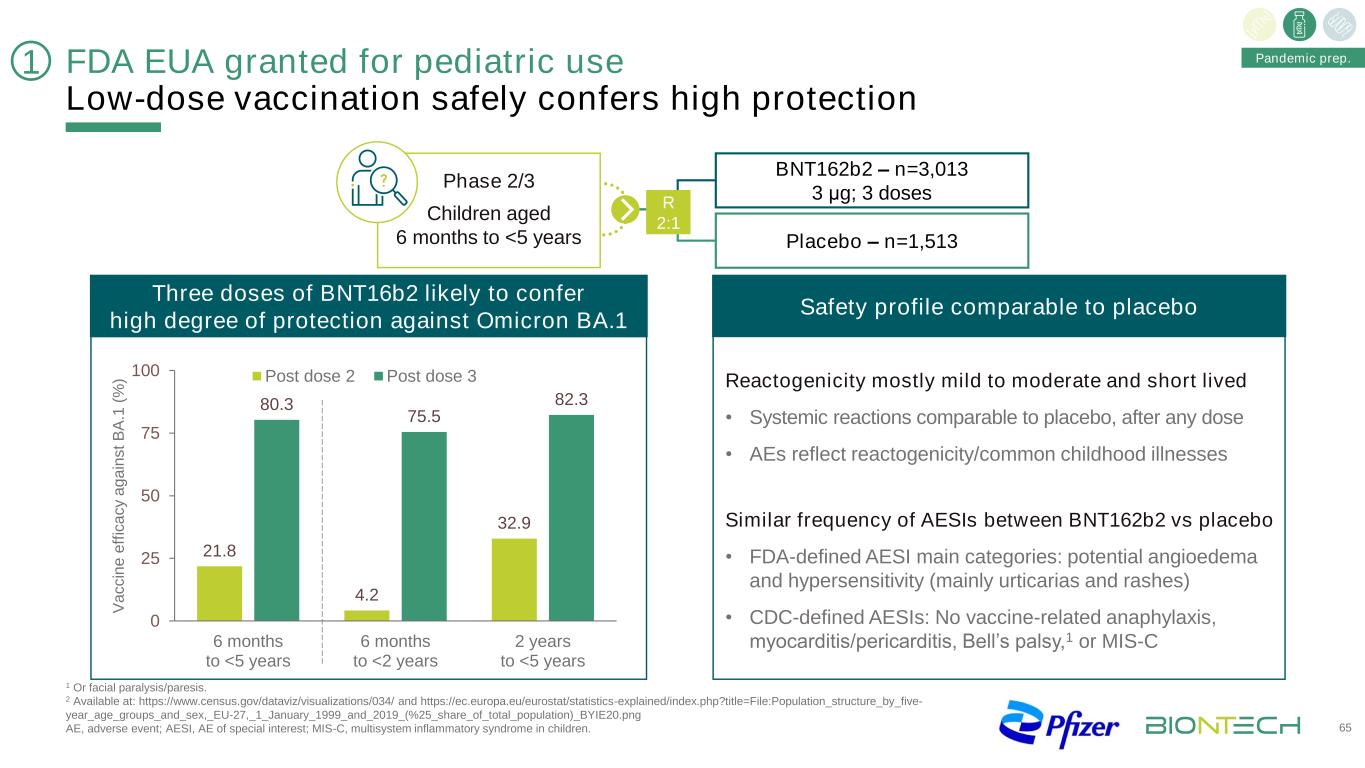
FDA批准用於兒童的EUA低劑量疫苗安全地提供高保護65三劑BNT16b2可能對奧密克戎BA.1 21.8 4.2 32.9 80.3 75.5 82.3 0 25 50 75 100 6個月提供高度保護
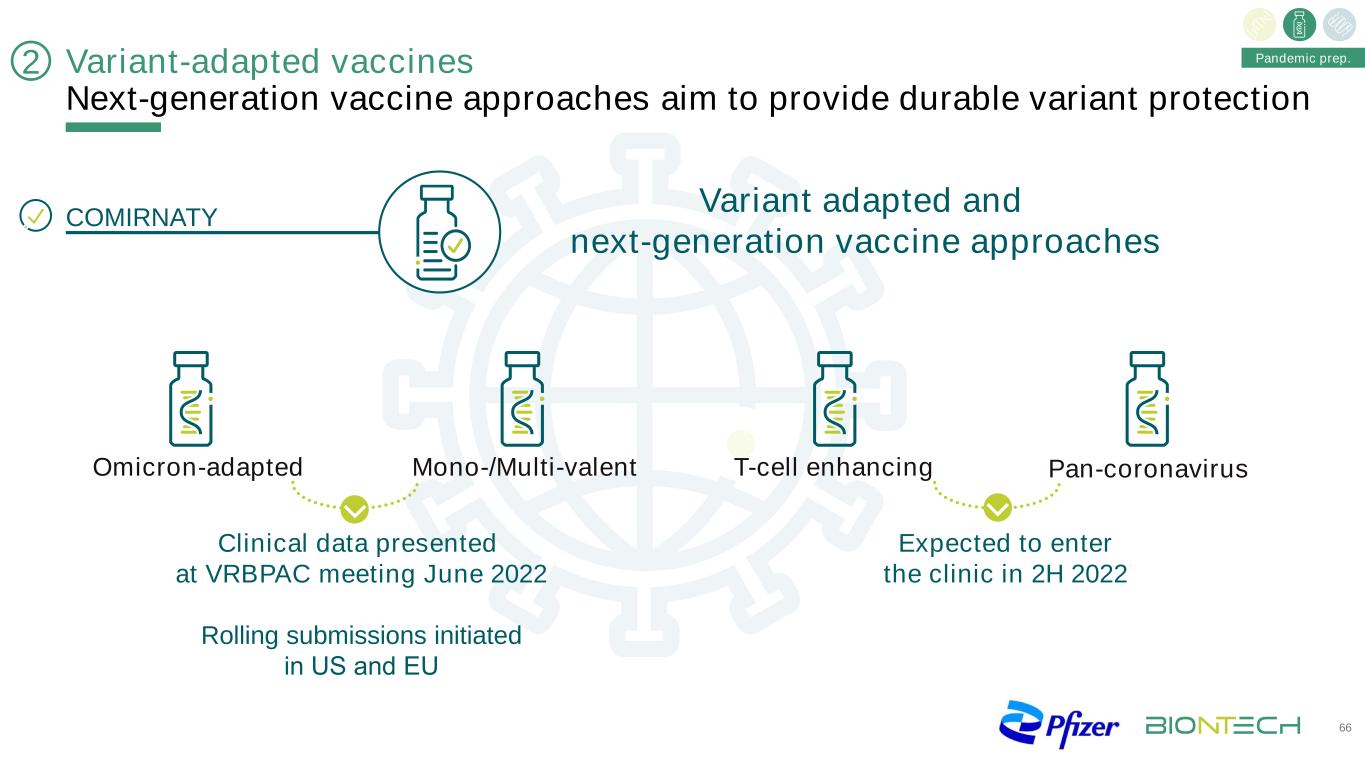
變異適應疫苗下一代疫苗方法旨在提供持久的變異保護66奧密克戎適應的單價/多價T細胞增強型泛冠狀病毒變異適應和下一代疫苗方法在VRBPAC會議上提交的臨牀數據2022年6月在美國和歐盟發起的滾動提交預計將在2022年下半年大流行準備進入臨牀2
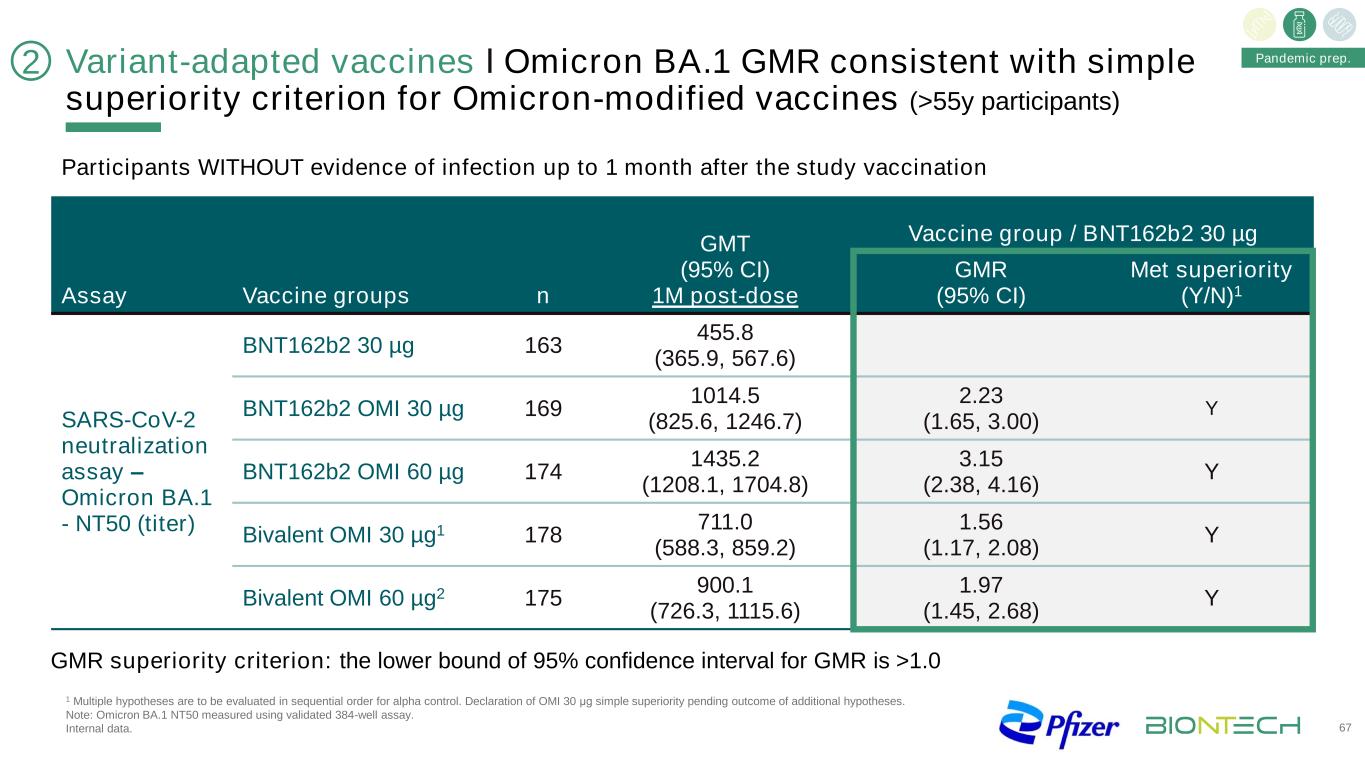
GMR優勢標準:GMR的95%可信區間下限為>1.0變異適應疫苗І奧密克戎BA.1 GMR與奧密克戎修飾疫苗(>55y參與者)67大流行準備的簡單優勢標準一致。在研究接種後1個月內無感染證據的參與者GMT(95%CI)1M劑量後疫苗組/BNT162b2 30微克檢測疫苗組n GMR(95%CI)蛋氨酸優勢(Y/N)1 SARS-CoV-2中和試驗-奧密克戎BA1-NT50(效價)BNT162b2 30微克163 455.8(365.9,567.6)BNT162b2 OMI 30微克169 1014.5(825.6,1246.7)2.23(1.65,3.00)Y BNT162b2 OMI 60微克174 1435.2(1208.1,1704.8)3.15(2.38,4.16)Y雙價OMI 30微米G1178 711.0(588.3,859.2)1.56(1.17,2.08)Y雙價OMI 60微米G2 175 900.1(726.3,1115.6)1.97(1.45,2.68)Y21多重假設將按順序進行阿爾法對照評估。宣佈OMI 30μg簡單優勢有待額外假設的結果。注:奧密克戎BA.1 NT50採用驗證的384孔試紙條測定。內部數據。
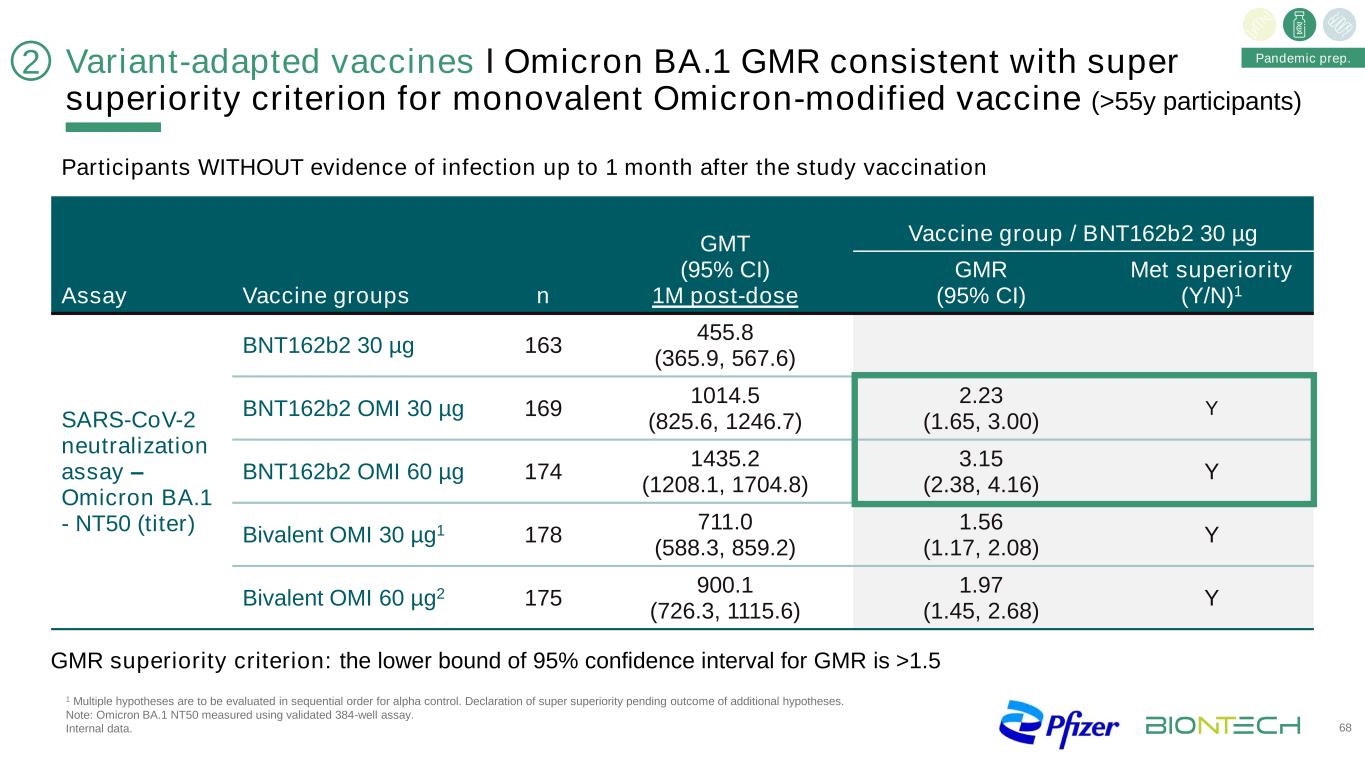
變種適應疫苗І奧密克戎BA.1 GMR符合單價奧密克戎修飾疫苗的超級優勢標準(>55y參與者)68大流行準備。在研究接種後1個月內無感染證據的參與者GMT(95%CI)1M劑量後疫苗組/BNT162b2 30微克檢測疫苗組n GMR(95%CI)蛋氨酸優勢(Y/N)1 SARS-CoV-2中和試驗-奧密克戎BA1-NT50(效價)BNT162b2 30微克163 455.8(365.9,567.6)BNT162b2 OMI 30微克169 1014.5(825.6,1246.7)2.23(1.65,3.00)Y BNT162b2 OMI 60微克174 1435.2(1208.1,1704.8)3.15(2.38,4.16)Y二價OMI30µG1178 711.0(588.3,859.2)1.56(1.17,2.08)Y二價OMI60µG2175 900.1(726.3,1115.6)1.97(1.45,2.68)Y巨磁電阻優勢標準:巨磁電阻的95%可信區間下限>1.521阿爾法對照的多重假設將按順序進行評估。宣佈超級優勢,等待額外假設的結果。注:奧密克戎BA.1 NT50採用驗證的384孔試紙條測定。內部數據。
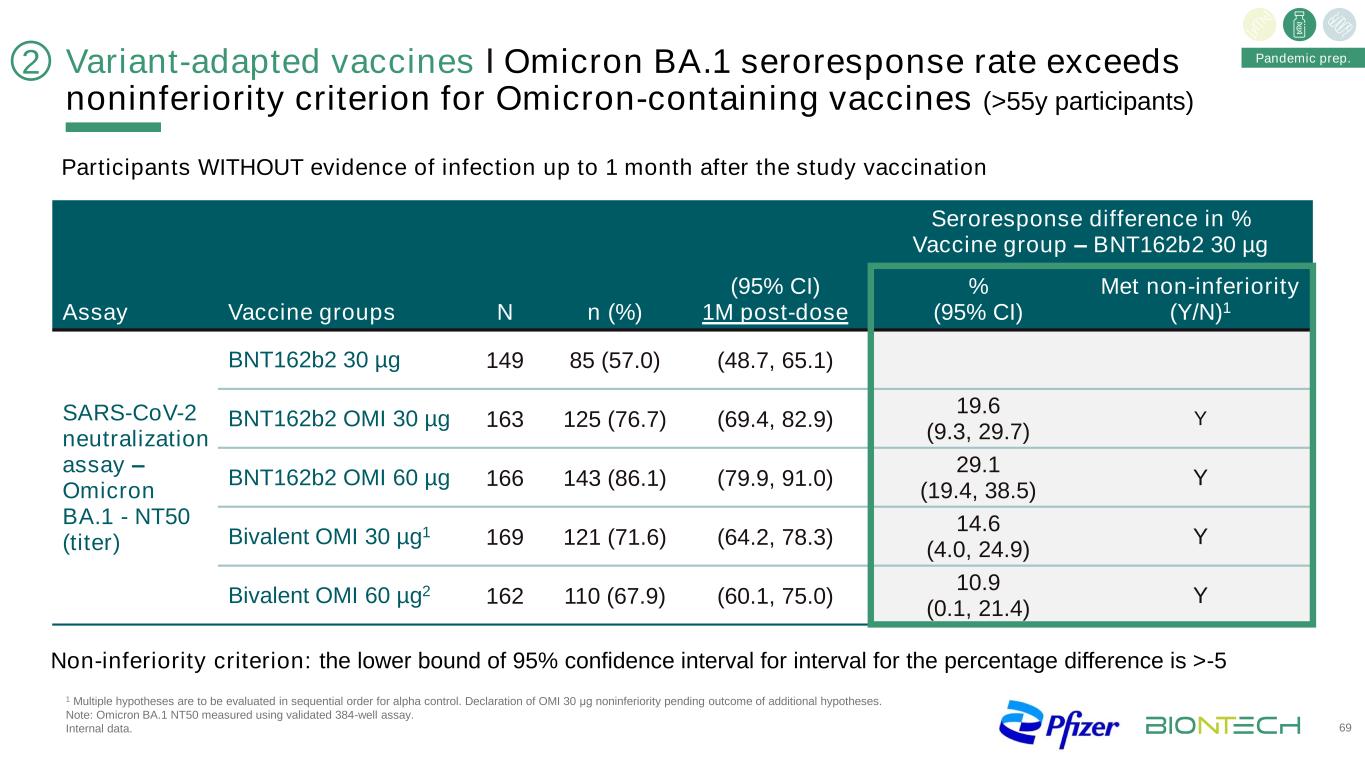
變種適應疫苗І奧密克戎BA1血清響應率超過含奧密克戎疫苗(>55歲參與者)的非劣質標準69大流行準備。研究接種後1個月內無感染證據的參與者%疫苗組1M劑量後血清反應差異-BNT162b2 30微克%(95%CI)滿足非劣勢(Y/N)1檢測疫苗組N SARS-CoV-2中和試驗-奧密克戎BA1-NT50(滴度)BNT162b2 30微克149 85(57.0)(48.7,65.1)BNT162b2 OMI 30微克163 125(76.7)(69.4,82.9)19.6(9.3,29.7)Y BNT162b2 OMI 60微克166 143(86.1)(79.9,91.0)29.1(19.4,38.5)Y二價OMI 30微米G1 169 121(71.6)(64.2,78.3)14.6(4.0,24.9)Y二價OMI 60微米G2 110(67.9)(60.1,75.0)10.9(0.1,21.4)Y非劣性標準:百分比差異區間的95%可信區間下限>-5 2 1多個假設應按順序進行阿爾法對照評估。宣佈OMI 30μg非劣勢,等待額外假設的結果。注:奧密克戎BA.1 NT50採用驗證的384孔試紙條測定。內部數據。
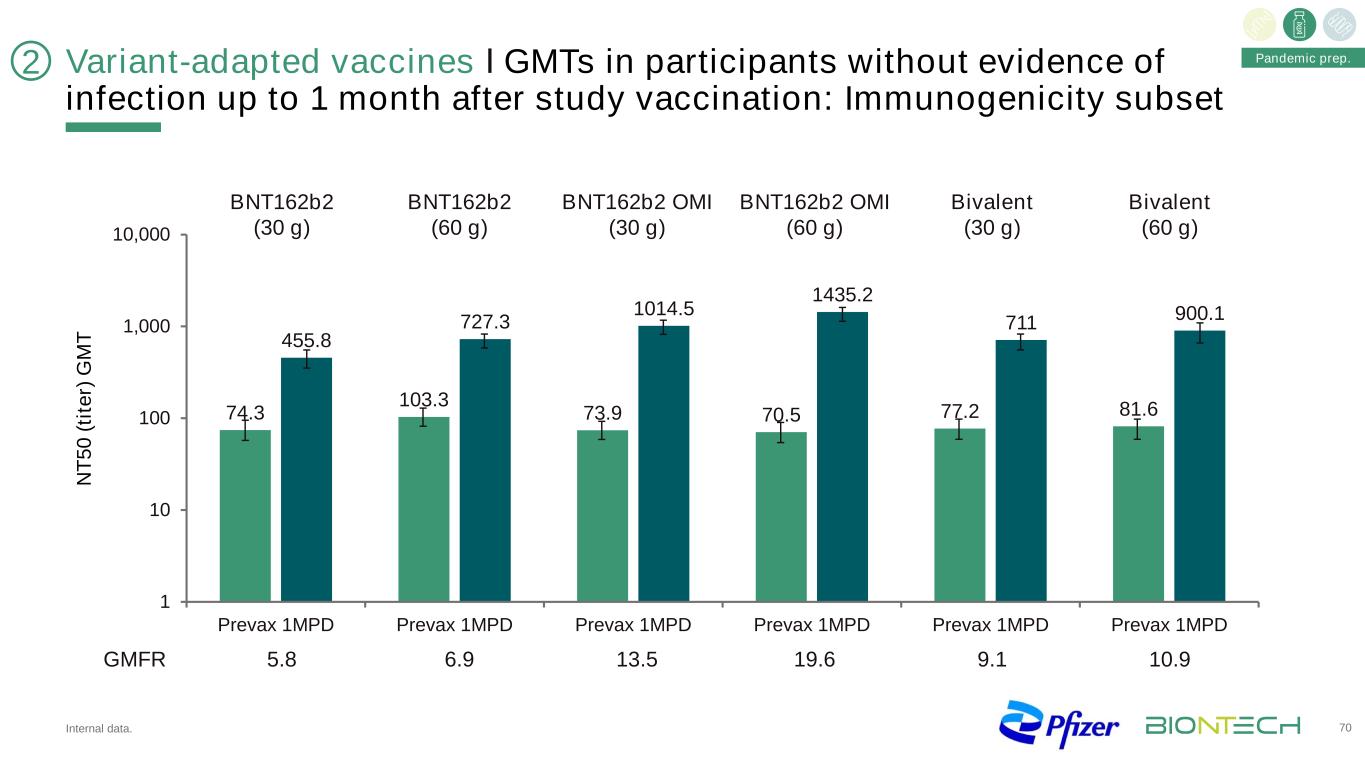
變種適應疫苗在研究接種後1個月內無感染證據的參與者中的ІGMT:免疫原性亞集N T 50(Tite R)G M T大流行準備。BNT162b2(30克)BNT162b2(60克)BNT162b2 OMI(30克)BNT162b2 OMI(60克)二價(30克)二價(60克)149 163 163 169 163 169 166 169 178 162 175 5.8 6.9 13.6 9.1 10.9GMFR 74.3 103.3 73.9 70.5 77.2 81.6 727.3 1014.5 1435.2 711 900.1 1 10 10 100 1,000 Prevax 1MPD 70 2內部數據。

變種適應疫苗І變種疫苗的反應性概況總體上類似於原型BNT162b2疫苗大流行準備。年齡18−55歲的參與者·單價奧密克戎修飾疫苗(30微克)顯示出與原型疫苗(30微克)相似的局部反應和全身事件特徵·年齡>55歲的參與者(30微克)顯示出與原型疫苗相似的局部反應和全身事件特徵·60微克劑量水平:與30微克71 2內部數據相比,輕度至中度注射部位疼痛、疲勞和肌肉疼痛更常見。

變種適應疫苗奧密克戎含修飾變種疫苗摘要72大流行準備。奧密克戎疫苗的中和反應符合監管標準:·GMR簡單優勢,血清反應非劣勢(單價和雙價疫苗)·GMR(單價疫苗)“超級”優勢變異疫苗的反應性圖譜與原型BNT162b2疫苗內部數據總體相似。2.
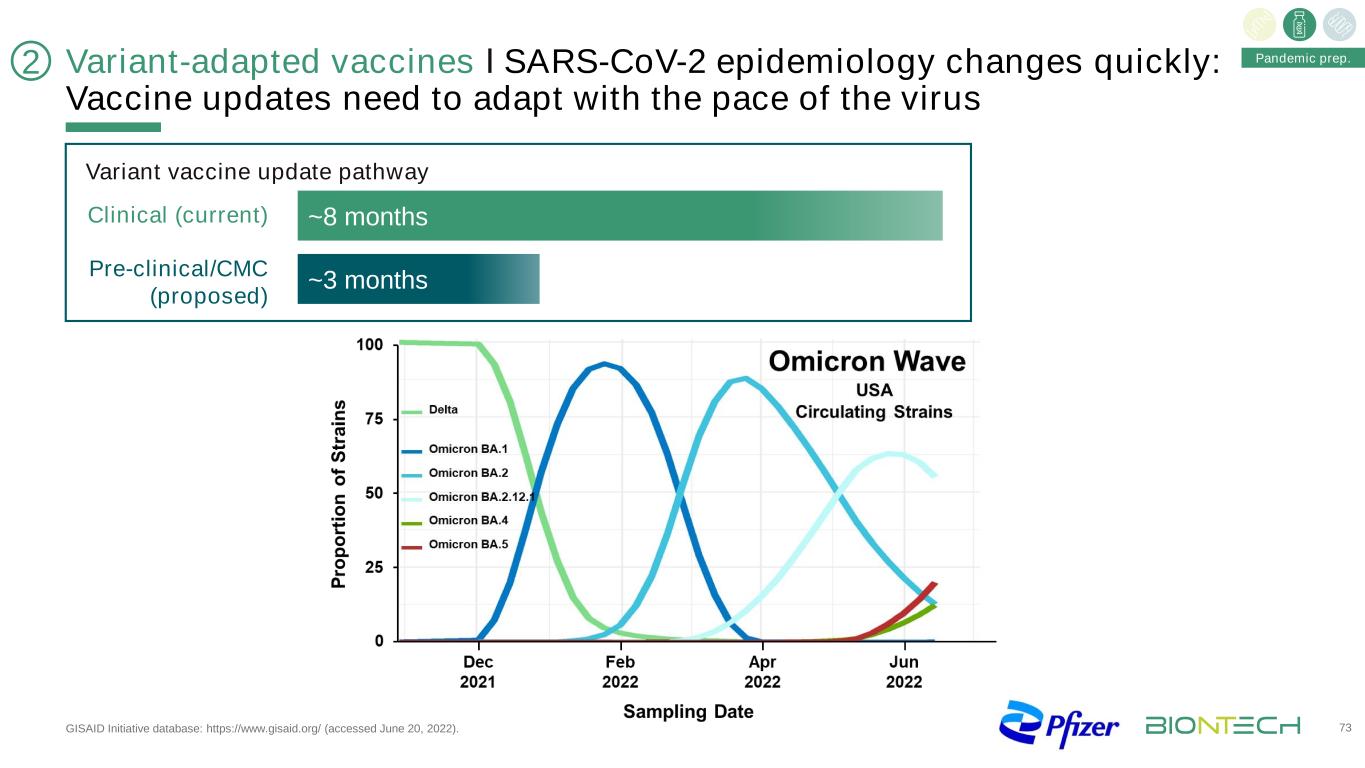
變種適應疫苗ІSARS-CoV-2流行病學變化迅速:疫苗更新需要適應病毒大流行準備的步伐。GISAID倡議數據庫:https://www.gisaid.org/(2022年6月20日訪問)。~8個月~3個月臨牀前(當前)臨牀前/CMC(建議)變異疫苗更新途徑73 2
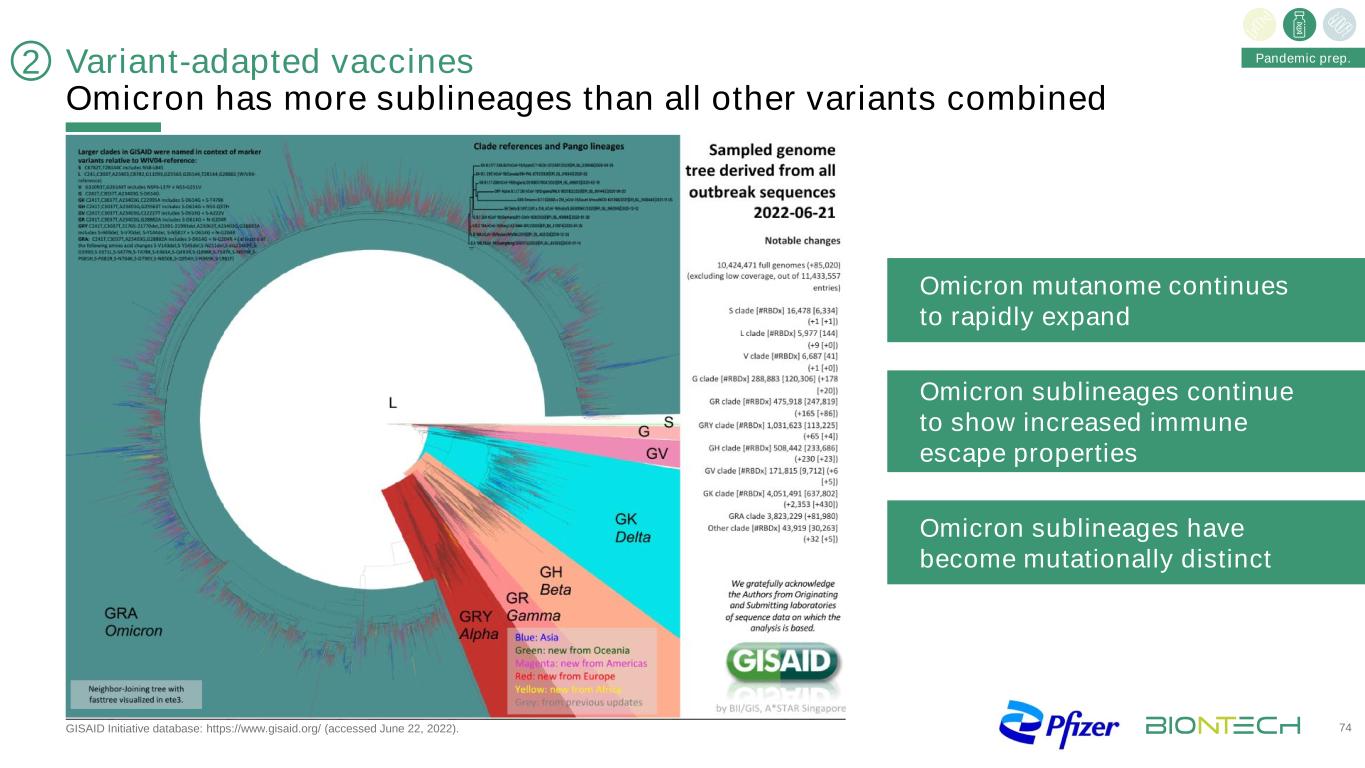
變種適應疫苗奧密克戎的亞系比所有其他變種的總和更多,GISAID倡議數據庫:https://www.gisaid.org/(2022年6月22日訪問)。74奧密克戎突變組繼續迅速擴大奧密克戎亞系繼續表現出增強的免疫逃逸特性奧密克戎亞系已成為突變明顯的大流行準備2
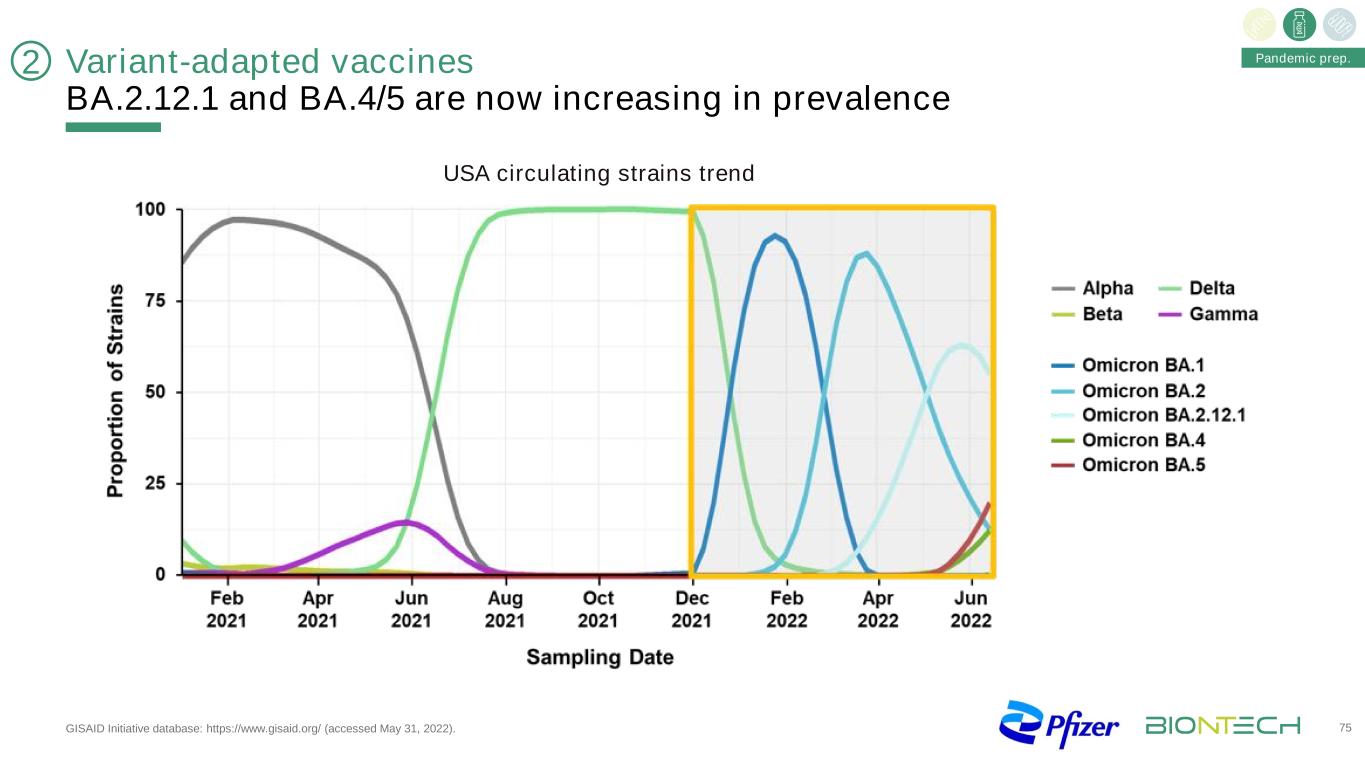
變種適應疫苗BA.2.12.1和BA.4/5現在在GISAID倡議數據庫中的流行率正在增加:https://www.gisaid.org/(2022年5月31日訪問)。75大流行準備2美國流行毒株趨勢
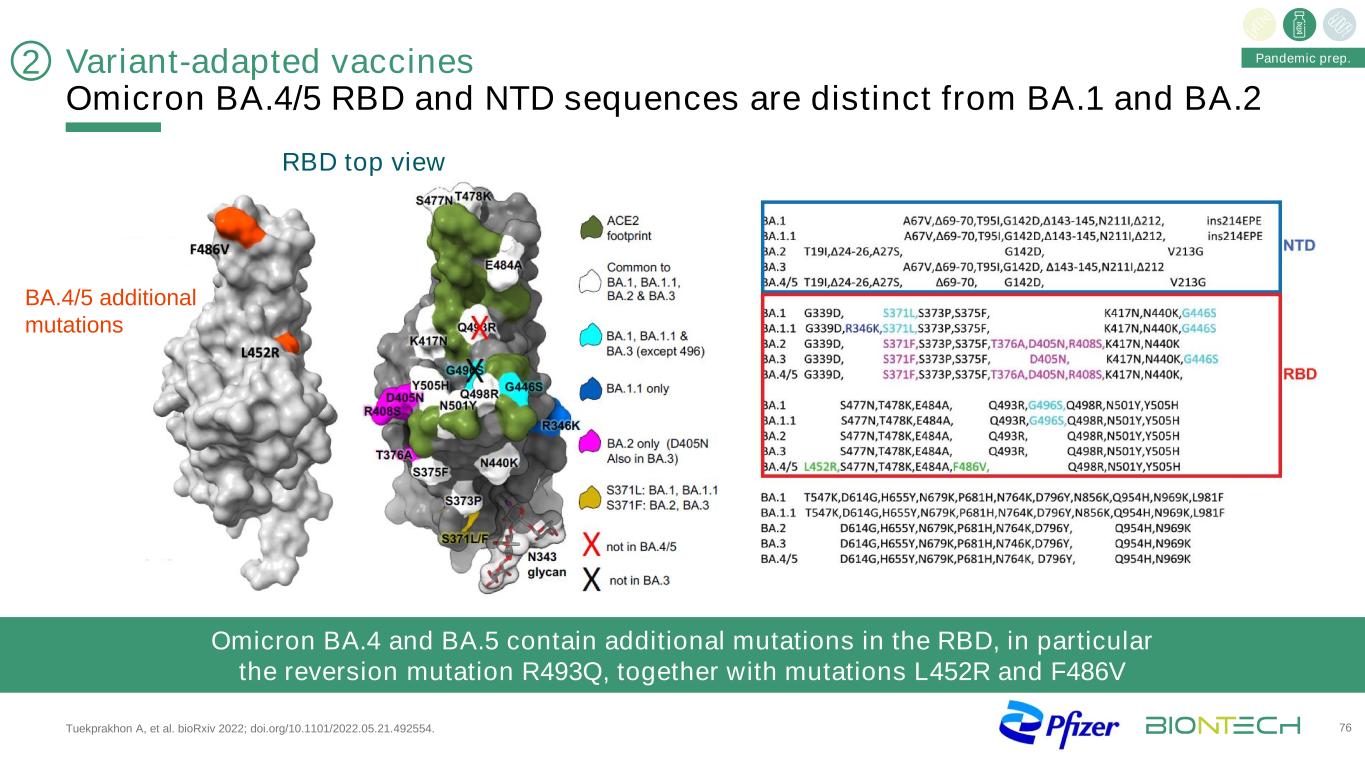
變種適應疫苗奧密克戎BA.4/5RBD和NTD序列不同於BA.1和BA2,TuekPrakhon A等人。BioRxiv 2022;doi.org/10.1101/2022.05.21.492554。76奧密克戎BA.4和BA.5含有額外的RBD突變,特別是回覆突變R493Q,以及不屬於BA.4/5大流行的突變L452R和F486V。2 BA.4/5其他突變RBD頂視圖
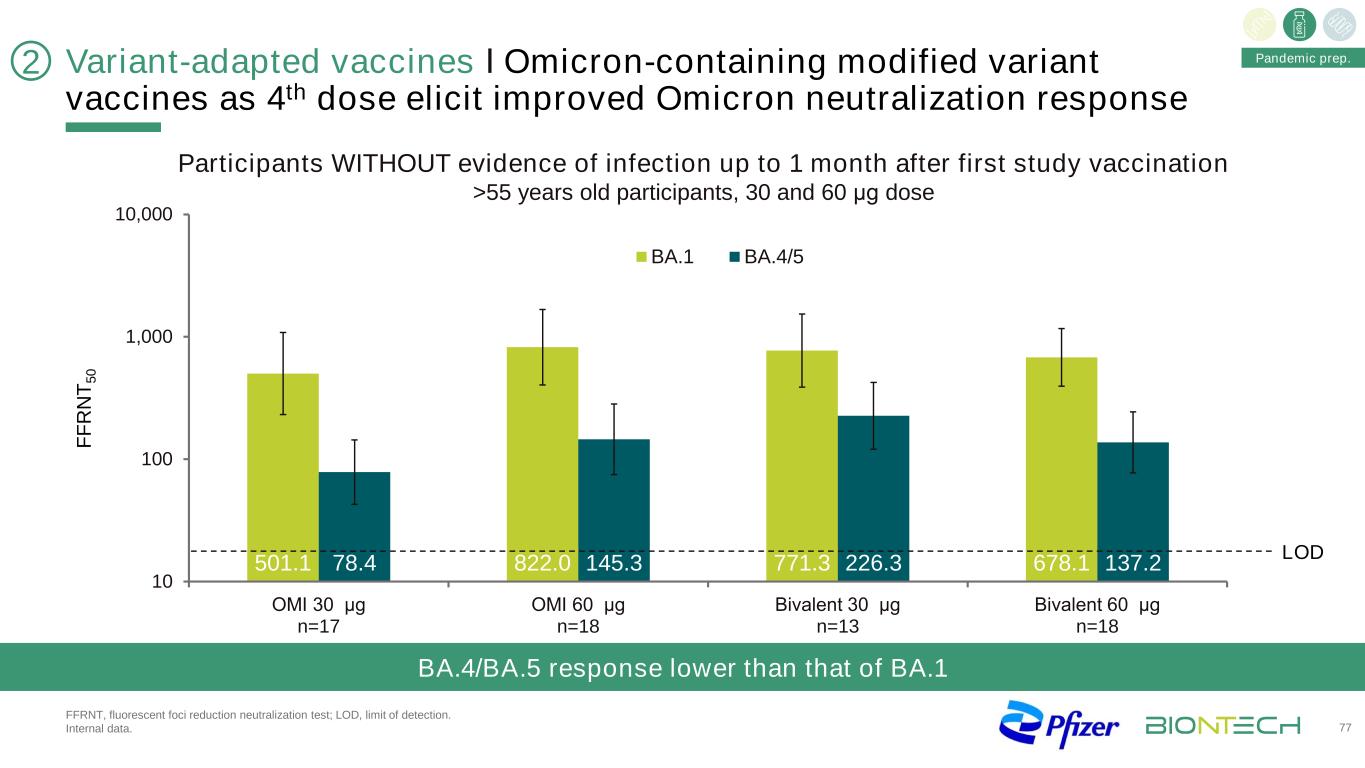
F F R N T 5 0 501.1 822.0 771.3 678.178.4 145.3 226.3 137.2 10 100 1,000 10,000 OMI 30μg n=17 OMI 60μg n=18二價30μg n=13二價60μg n=18 BA 1.1 BA.4/5 LOD變異疫苗І奧密克戎第4劑含修飾變異疫苗可誘導增強的奧密克戎中和反應,熒光灶減少中和試驗;檢出限。內部數據。BA.4/BA.5的反應低於BA.1大流行準備。首次研究後1個月內無感染證據的參與者>55歲的參與者,30和60μg劑量77 2
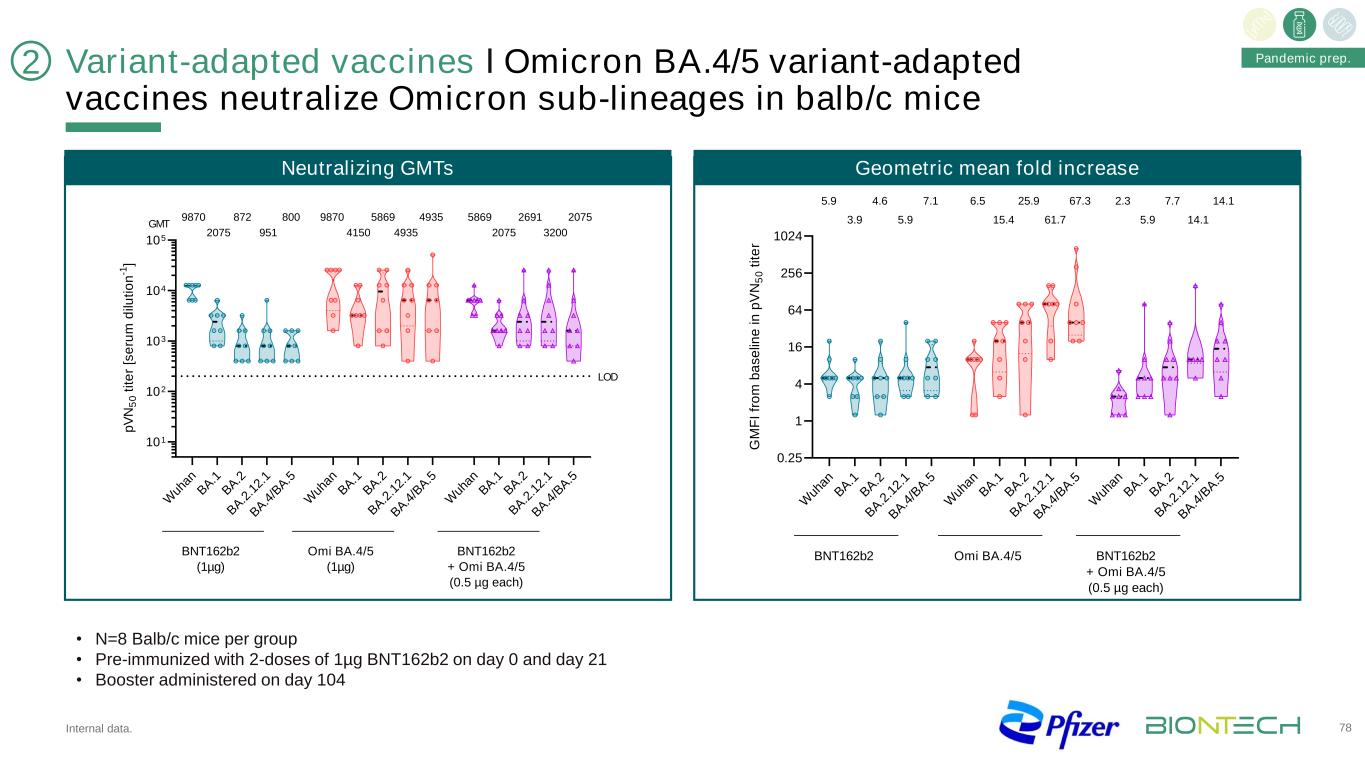
變種適應疫苗І奧密克戎BA.4/5變種適應疫苗中和BALB/c小鼠奧密克戎亞系內部數據。78·N=每組8只Balb/c小鼠·第0天和第21天用1微克BNT162b2預免疫·第104天接種BA.1 BA.2 BA.2 2.1 BA4/BA.5WUANBA.1 BA.2 BA.2 1.2 1BA4/BA.5WUAAN BA.1 BA.2 2.1BA.1 BA.2 BA.2 2.1BA.4/BA.50.25 1 4 16 64 256 1024 G M F i fr o m b a s e lin e i n p V N 5 0 t it e r 5.9 3.9 4.6 5.9 7.1 6.5 15.4 25.9 61.7 67.3 2.3 5.9 7.7 14.1 14.1 BNT162b2 Omi BA.4/5 BNT162b2+Omi BA.4/5(各0.5微克)W Uh an B A.1 B A.2 B A.2 2.1 BA.4/B A.5 W an B A.1 B A.2 B A.2 1 B A.1 B A.4/B A.5 W an B A.1 B A.2 B A.2 2.1 B A.4/B A.5 101 102 103 104 p V N 5 0 t it e r[S e ru m d ilu ti on n-1] BNT162b2 (1µg) Omi BA.4/5 (1µg) BNT162b2 + Omi BA.4/5 (0.5 µg each) 9870 2075 872 951 800 9870 4150 5869 4935 4935 5869 2075 2691 3200 2075 GMT LOD Neutralizing GMTs Geometric mean fold increase 2 Pandemic prep.
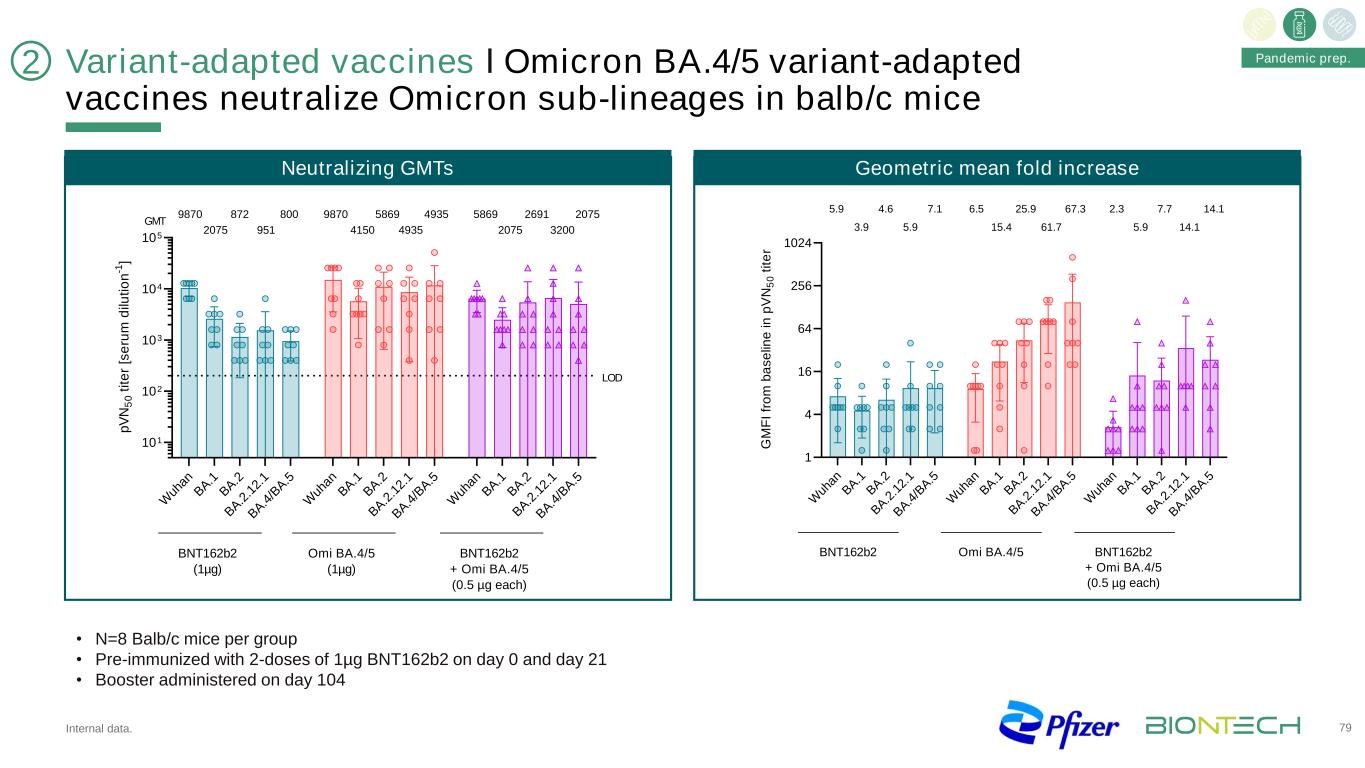
變種適應疫苗І奧密克戎BA.4/5變種適應疫苗中和BALB/c小鼠奧密克戎亞系內部數據。79·N=每組8只Balb/c小鼠·第0天和第21天兩劑1微克BNT162b2預先免疫·第104天免疫,中和GMT幾何平均倍數增加W Un An B A.1 B A.2 B A.2 2.1 B A.4/B A.5W Un An B A.1 B A.2 B A.2 2.1 B A.4/B A.5 W Uh An B A.1 B A.2 B A.2 2.1 B A 4/B A.5 101 102 103 104 105 p V N 50 t it e r[S e ru m d ilu ti on n-1] BNT162b2 (1µg) Omi BA.4/5 (1µg) BNT162b2 + Omi BA.4/5 (0.5 µg each) 9870 2075 872 951 800 9870 4150 5869 4935 4935 5869 2075 2691 3200 2075 GMT LOD W uh an B A .1 B A .2 B A .2 .1 2. 1 B A .4 /B A .5 W uh an B A .1 B A .2 B A .2 .1 2. 1 B A .4 /B A .5 W uh an B A .1 B A .2 B A .2 .1 2. 1 B A .4 /B A .5 1 4 16 64 256 1024 G M F I fr o m b a s e lin e i n p V N 5 0 t it e r 5.9 3.9 4.6 5.9 7.1 6.5 15.4 25.9 61.7 67.3 2.3 5.9 7.7 14.1 14.1 BNT162b2 Omi BA.4/5 BNT162b2 + Omi BA.4/5 (0.5 µg each) 2 Pandemic prep.

變異適應疫苗І奧密克戎BA 4/5變異適應疫苗增加奧密克戎亞系/武漢參考Balb/c小鼠內部數據中pVN50滴度比率。80 W Un B A.1 B A.2 B A.2 2.1 B A.4/B A.5 0.1 1 R a ti o o f v a ri a n t/W u h a n r e F.p V N 50 t it e r BNT162b2 Omi BA.4/5幾何平均比率O m I B A.1 O m I B A.2 O m I B A 2.1 2.1 O m I B A.4/B A.5 0.21 0.090.10 0.08 0.42 0.59 0.50 0.35 0.46 0.55 0.35b2+Omi BA.4/5交叉中和分析·N=每組8只Balb/c小鼠·在第0天和第21天用2劑1微克BNT162b2預先免疫·在第104天大流行準備時加強免疫。

變種適應疫苗科學驅動的準備戰略81大流行準備2正在與監管機構討論,以確定最合適的途徑,以利用當前的經驗,並確保未來可以提供變種適應疫苗,以及時應對新出現的變種/亞系·多個其他變種適應疫苗的豐富臨牀經驗-一致的安全性和免疫原性特徵·穩健的製造過程-只需最少的改變即可為新的變種/亞系引入更新的抗原序列·截至目前,COMIRNAY的安全性特徵良好-廣泛的上市後暴露和密切的監測-在兒科人羣中沒有發現新的重要安全問題以及加強計劃

大流行防備未來大流行防備的綜合、多方面模型82應對準備現場測試實驗室測試風險預測(人工智能驅動)用於部署大流行準備的製造規劃。我們的目標:實現我們疫苗在全球範圍內的端到端製造和交付,同時確保未來五年的生產質量3:儲備和保持製造能力,每年生產至少8000萬劑基於mRNA的疫苗,以應對2022年4月與德國聯邦衞生部簽訂的大流行預防合同

瘧疾、結核病和艾滋病毒仍然是流行的艾滋病毒,人類免疫缺陷病毒;世衞組織,世界衞生組織。世界衞生組織概況介紹。Https://www.who.int/news-room/fact-sheets(2022年6月9日訪問)。2020年世界衞生組織非洲區域83~2.29億例病例2020年世界衞生組織非洲區域60.1萬例死亡(80%為兒童
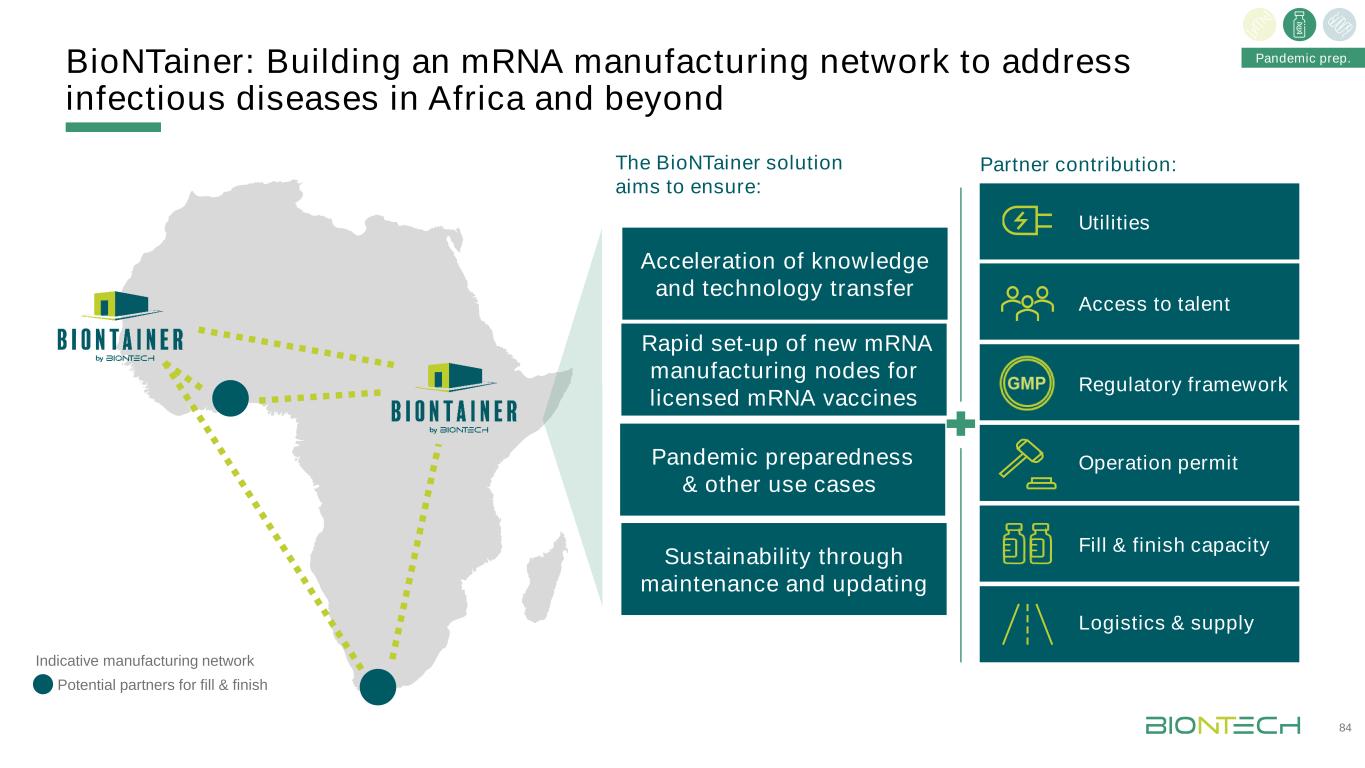
BioNTainer:建立一個信使核糖核酸製造網絡,以應對非洲及84年以後的傳染病。BioNTainer解決方案旨在確保:合作伙伴貢獻:指示性的製造網絡潛在的合作伙伴填補和完成大流行預防和其他使用案例的可持續性通過維護和更新,加速知識和技術轉讓快速建立新的信使製造節點,以獲得許可的信使核糖核酸疫苗運作許可物流和供應公用事業獲得人才填補和完成能力監管框架大流行準備。

迫切需要下一代精密抗菌劑1抗菌素耐藥性協作者。《柳葉刀》2022;399:629-655;2 O‘Neill J.Wellcome Collection。2014年歸屬;可在:https://wellcomecollection.org/works/rdpck35v(2022年6月6日訪問)上查閲。85抗菌藥可防止多達1,000萬人死於抗菌素耐藥性20501通過有效的抗菌劑保護現代醫學1,2改善1.5億慢性和嚴重細菌感染患者的護理標準1
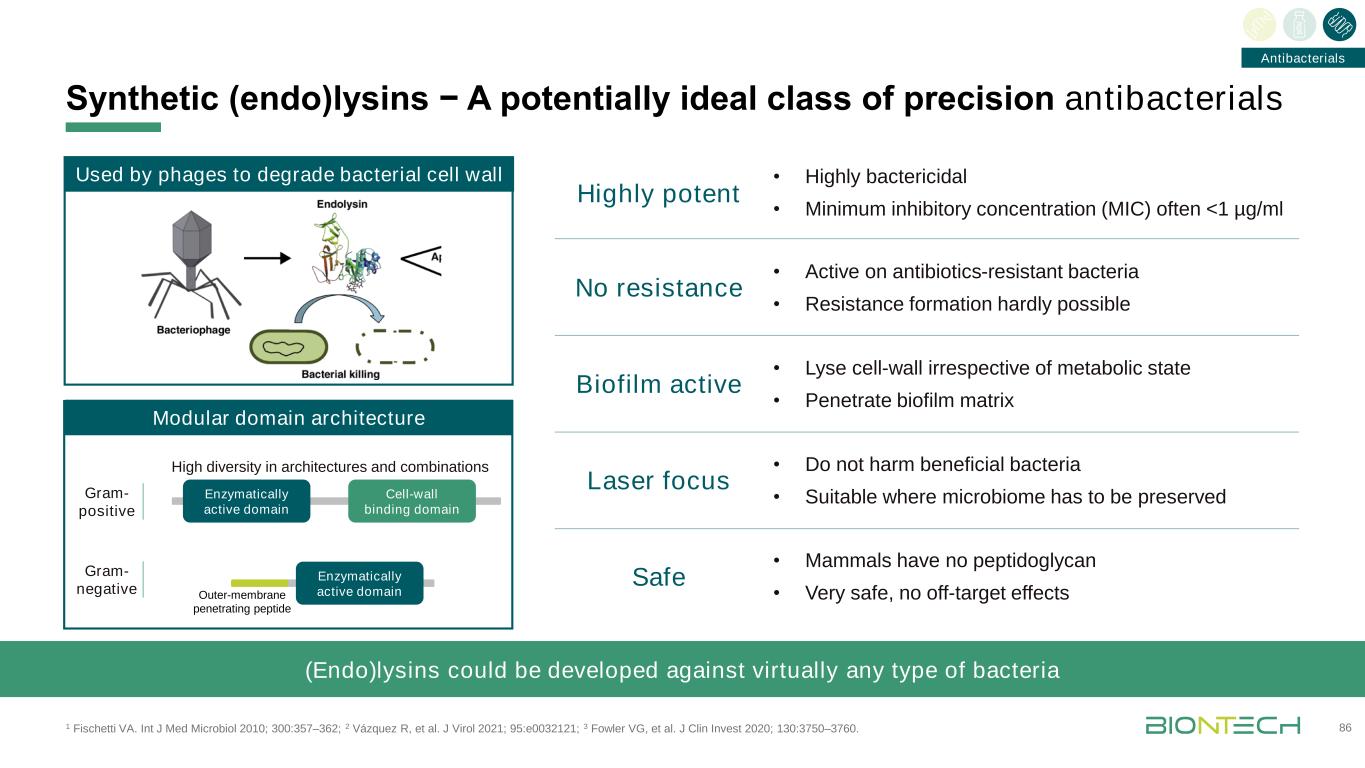
合成(內切)賴氨酸−一類潛在的理想的精密抗菌藥1費舍蒂VA。INT J Med Microbiol 2010;300:357-362;2 Vázquez R,等人。J Virol 2021;95:e0032121;3 Fowler VG,et al.J Clin Invest 2020;130:3750-3760。86模塊結構域結構酶活性結構域細胞壁結合結構域酶活性結構域噬菌體用於降解細菌細胞壁(Endo)的外膜穿透肽結構和組合的高度多樣性可針對幾乎任何類型的細菌開發生物膜活性激光焦點無耐藥性安全·對抗生素耐藥細菌有活性·幾乎不可能形成耐藥性·不受代謝狀態影響的細胞壁·穿透生物膜基質·不損害有益細菌·適用於微生物組必須保存的地方·哺乳動物無肽多糖·非常安全,無脱靶效應高度有效·高度殺菌·最低抑菌濃度(MIC)經常
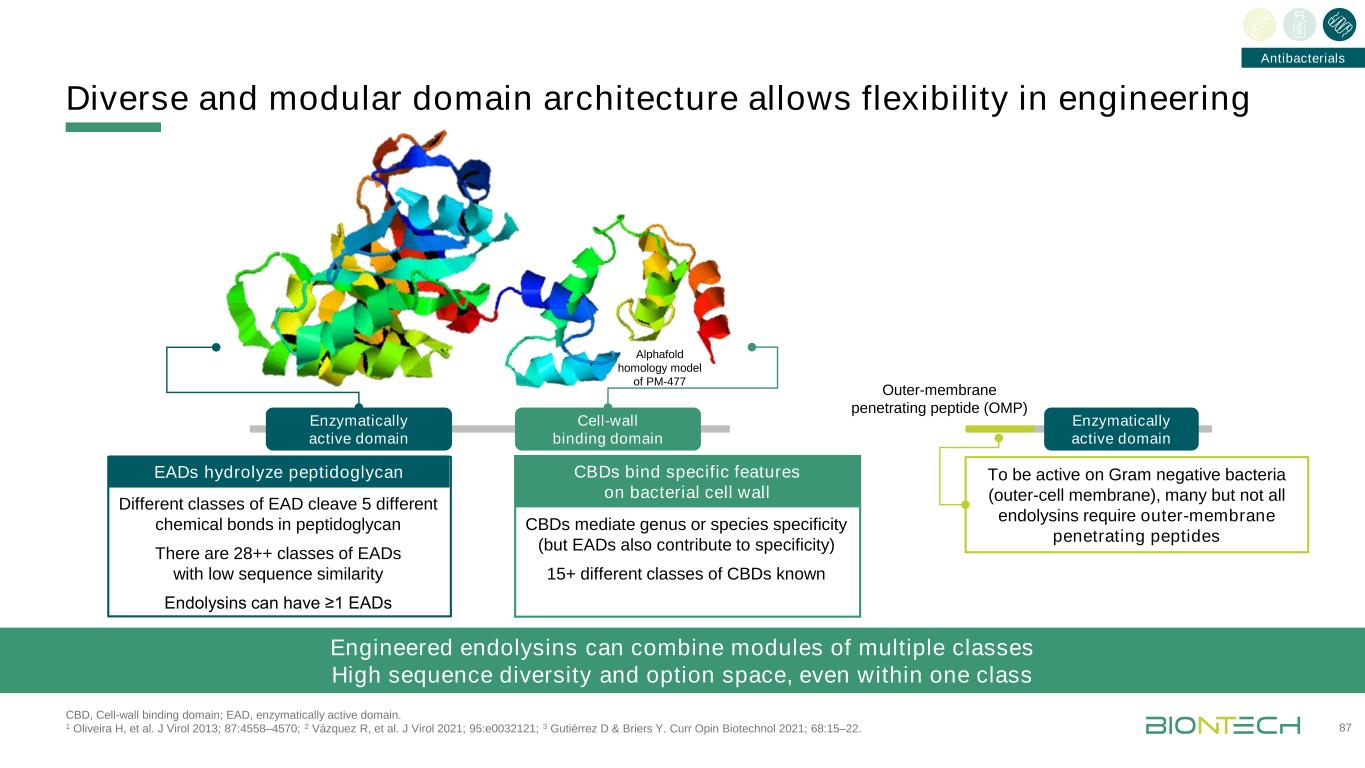
CBD介導屬或種的特異性(但EADS也有助於特異性)15+不同類別的CBD已知的多樣化和模塊化的結構域結構允許靈活地設計87個酶活性區域細胞壁結合區域酶活性區域外膜穿透肽(OMP)對革蘭氏陰性細菌(外細胞膜),許多但不是所有的內毒素需要外膜穿透肽的Alphaold同源模型的PM-477 CBD,細胞壁結合區域;EAD,酶活性區域。1 Oliveira H,et al.J Virol 2013;87:4558-4570;2 Vázquez R,et al.J Virol 2021;95:e0032121;3 Gutiérrez D&Briers Y.Curr Opin Biotechnol 2021;68:15-22。抗菌工程內毒素可以結合多種類型的模塊,具有高度的序列多樣性和選擇空間,即使在同一類EAD中,不同類型的EAD也能切割5個不同的化學鍵。有28++類的EAD具有低序列相似性的EAD,內毒素可以具有≥1 EADS CBD結合細菌細胞壁的特異性
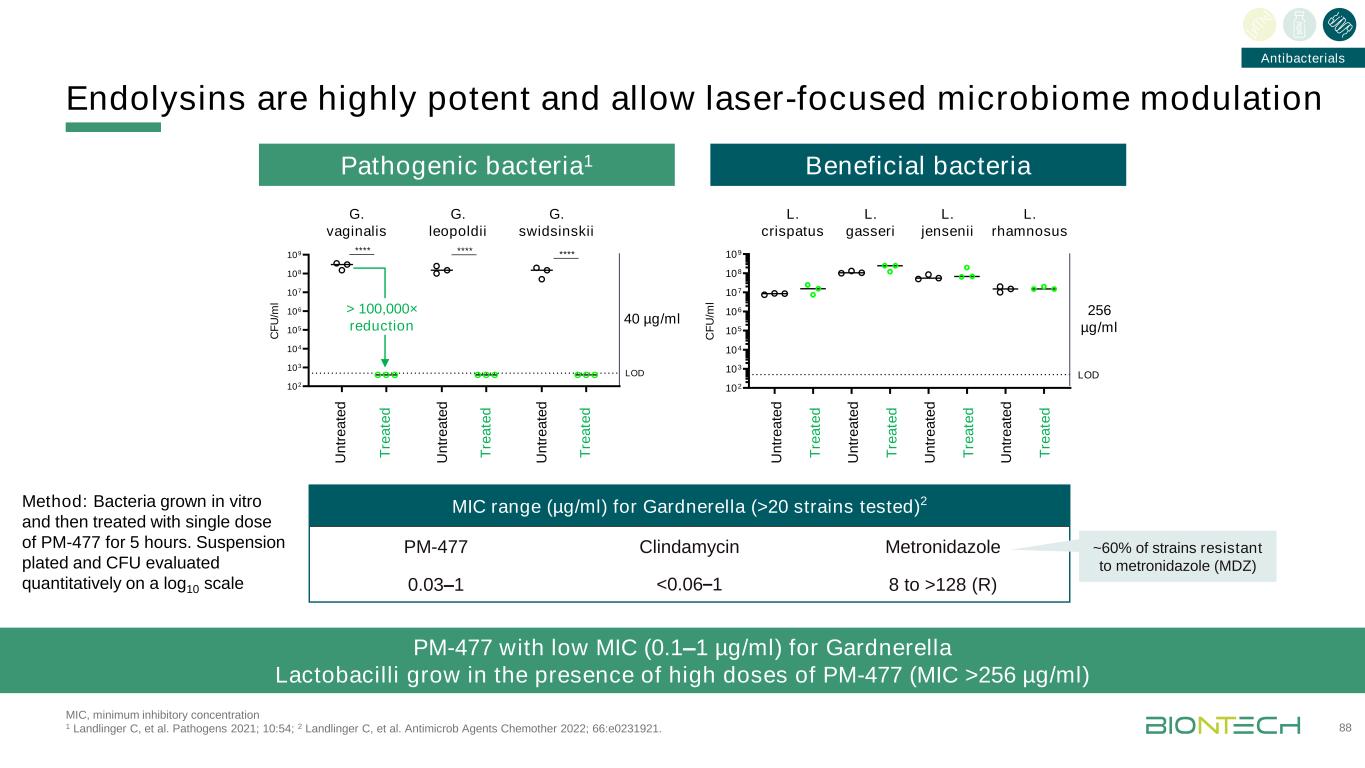
內毒素是高效的,允許激光聚焦微生物羣調節對加德納氏菌(>20株測試)的MIC範圍(>20株)2 PM-477克林黴素甲硝唑0.03-1 128(R)方法:細菌在體外生長,然後用單劑量PM-477處理5小時。懸液平板和CFU對60%的甲硝唑(MDZ)耐藥菌株進行了對數10分的定量檢測。致病菌102 103 104 105 106 107 108 109 C F U/m l LOD>100,000×還原MIC>100,000×還原MIC,最低抑菌濃度1 Landlinger C等。病原體2021;10:54;2 Landlinger C等人。抗菌劑化學試劑2022;66:E0231921。對加德納乳桿菌具有低MIC(0.1-1微克/毫升)的抗菌劑PM-477在高劑量PM-477(最低抑菌濃度>256微克/毫升)下生長

擴大傳染病領域的機會:4項首例人類信使核糖核酸疫苗試驗預計於2022年啟動1項全球聯合開發聯合商業協議;2項授權輝瑞公司的全球權利;3項與賓夕法尼亞大學的合作;4項與比爾和梅林達·蓋茨基金會的合作。BioNTech擁有全球發行權,但BMGF擁有發行權的發展中國家除外。89平臺產品候選(目標)下一個里程碑基因疫苗BNT162b21新冠肺炎2022年數據更新Omicron1新冠肺炎2022年數據更新BNT16122022年新冠肺炎數據更新BNT1612 2022年流感數據更新2帶狀皰疹首例人體試驗將於2022年下半年開始BNT163(預防性)3單純皰疹病毒2首例人體試驗將於2022年下半年開始3單純皰疹病毒2例人類首例人體試驗將於2022年下半年開始3單純皰疹病毒2BNT1644結核病首例人體試驗將於2022年下半年開始BNT165瘧疾首個人體試驗將於2022年下半年開始

90 Q & A

休息時間到了!

腫瘤學管道
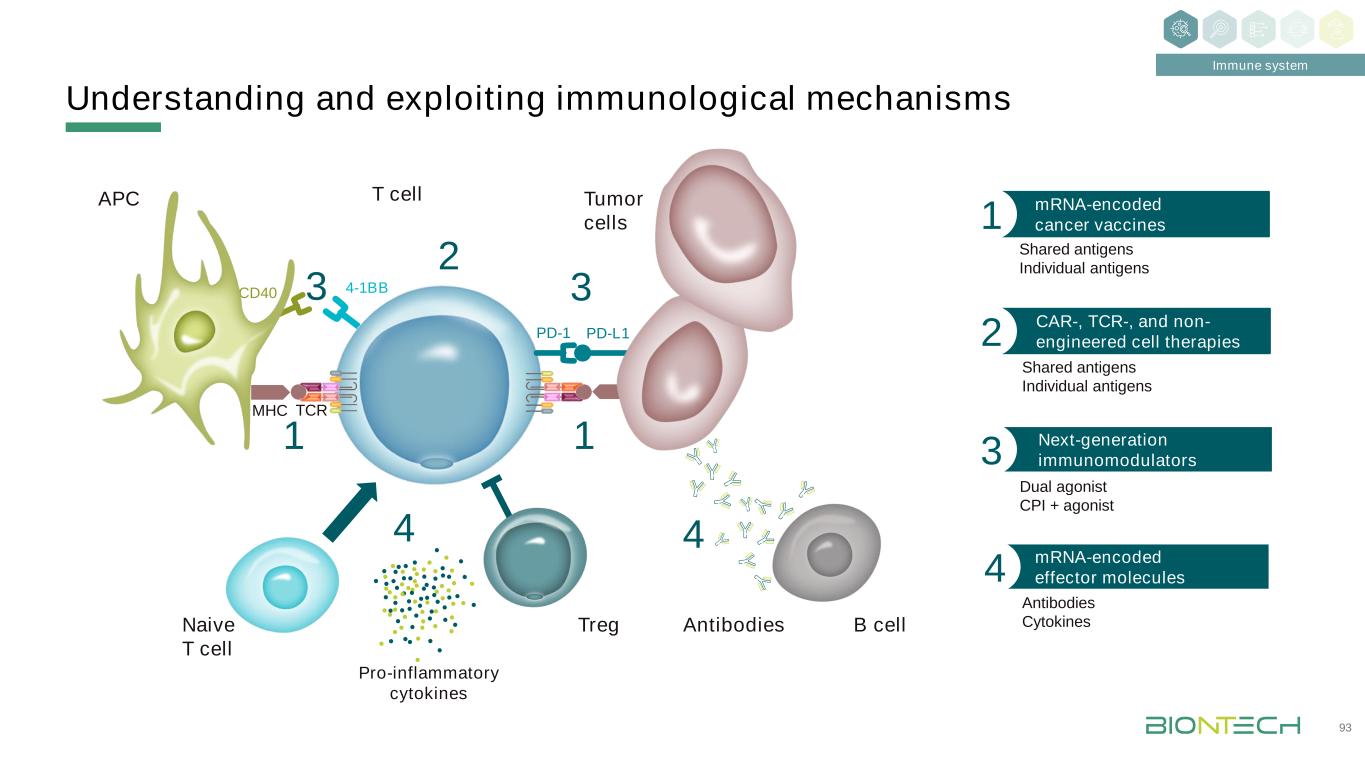
瞭解和探索免疫機制免疫系統93 T細胞腫瘤細胞Treg 4-1BB PD-1 PD-L1 TCRMHC促炎細胞因子幼稚T細胞APC CD40 mRNA編碼的癌症疫苗1共享抗原單個抗原CAR、TCR和非工程細胞療法2 33 1下一代免疫調節劑3B細胞mRNA編碼的效應分子4抗體細胞因子共享抗原雙重激動劑CPI+激動劑抗體44 21

SMIM,小分子免疫調節劑。1名研究人員發起的第1階段試驗;2名與Genentech合作;3名與賽諾菲合作;4名與Genmab合作。腫瘤學流水線:2022年重大進展和擴展94藥物類別平臺候選產品適應症(目標)臨牀前1期2期3期里程碑mRNA修復Vac BNT111晚期和R/R黑色素瘤FPD 2021年6月BNT112前列腺癌BNT113 HPV16+頭頸癌FPD,2021年7月BNT1151卵巢癌BNT116 NSCLC開始1/2期iNeST Autogene cevumeran(BNT122)2 1L黑色素瘤數據H2 2022輔助直腸癌FPD,2021年12月實體瘤輔助胰腺導管腺癌1後續試驗腔內免疫治療SAR441000(BNT131)3實體腫瘤(IL-12c,IL15-sushi,GM-CSF,GM-CSF)幹擾素α)RiboMabs BNT141多實體腫瘤(CLDN18.2)FPD 1月2022年1月BNT142多實體腫瘤(CD3×CLDN6)啟動1/2期核細胞因子BNT151多實體腫瘤(優化的IL-2)BNT152,BNT153多實體腫瘤(IL-7,IL-2)細胞治療CAR T細胞+CARVac BNT211多實體腫瘤(CLDN6)Ph 2計劃2023年BNT212胰腺、其他腫瘤(CLDN18.2)基於新抗原的T細胞BNT221(neo-PTC-01)多實體腫瘤TCR工程化T細胞將被選為所有抗體下一個檢查點免疫調節器(BNT311腫瘤)4轉移非小細胞肺癌(PD-L1×4-1BB)FPD,FPD2021年12月多實體瘤(PD-L1×4-1BB)GEN1042(BNT312)4多實體瘤(CD40×4-1BB)靶向腫瘤抗體BNT321(MVT-5873)胰腺癌(Slea)SMIM Toll樣受體結合BNT411實體瘤(TLR7)
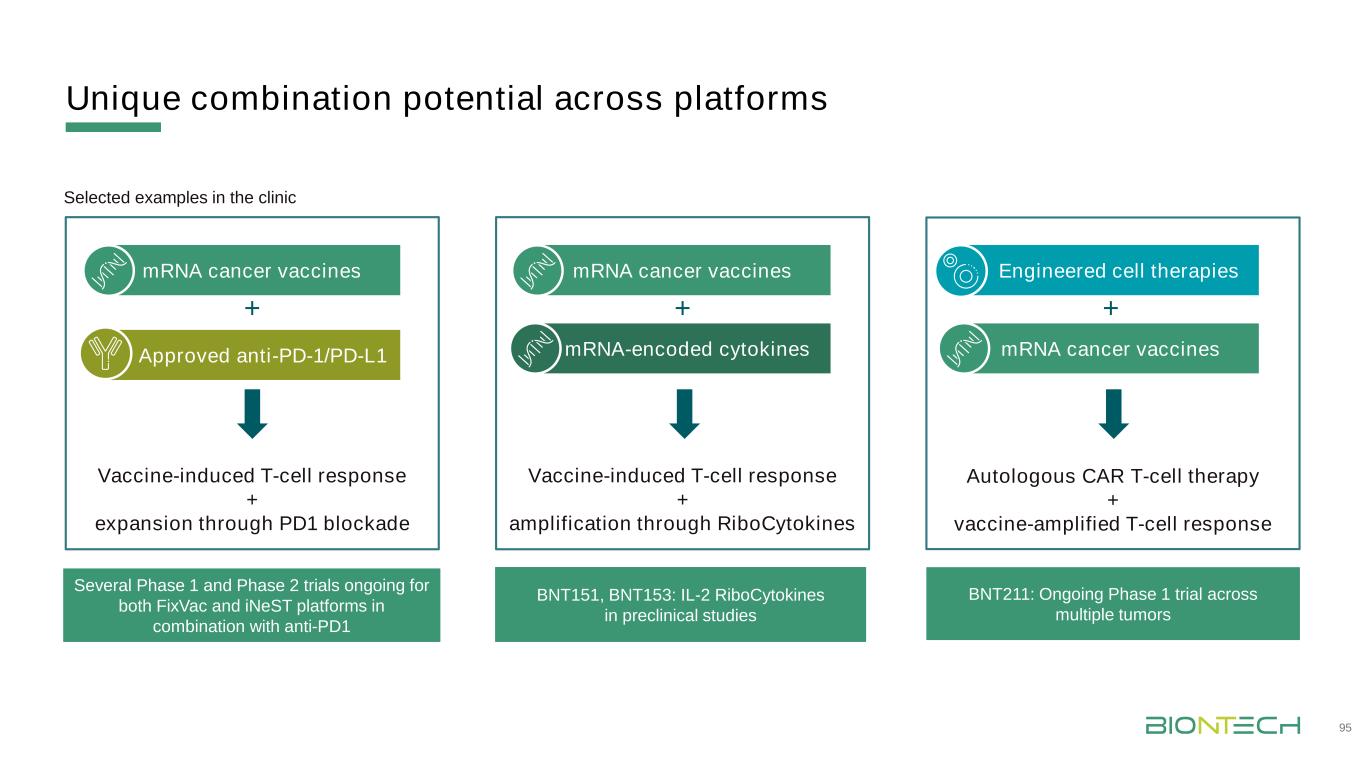
跨平臺的獨特組合潛力95疫苗誘導T細胞反應+通過PD1阻斷自體T細胞療法+疫苗放大的T細胞反應疫苗誘導T細胞反應+通過核細胞因子擴增批准的抗PD-1/PD-L1 mRNA癌症疫苗+mRNA編碼的細胞因子+工程細胞療法mRNA癌症疫苗+臨牀上正在進行的FixVac和iNeST平臺與抗PD1 BNT151、BNT153:IL-2核細胞因子聯合臨牀前研究的幾個第一階段和第二階段試驗精選實例

核糖核酸腫瘤疫苗
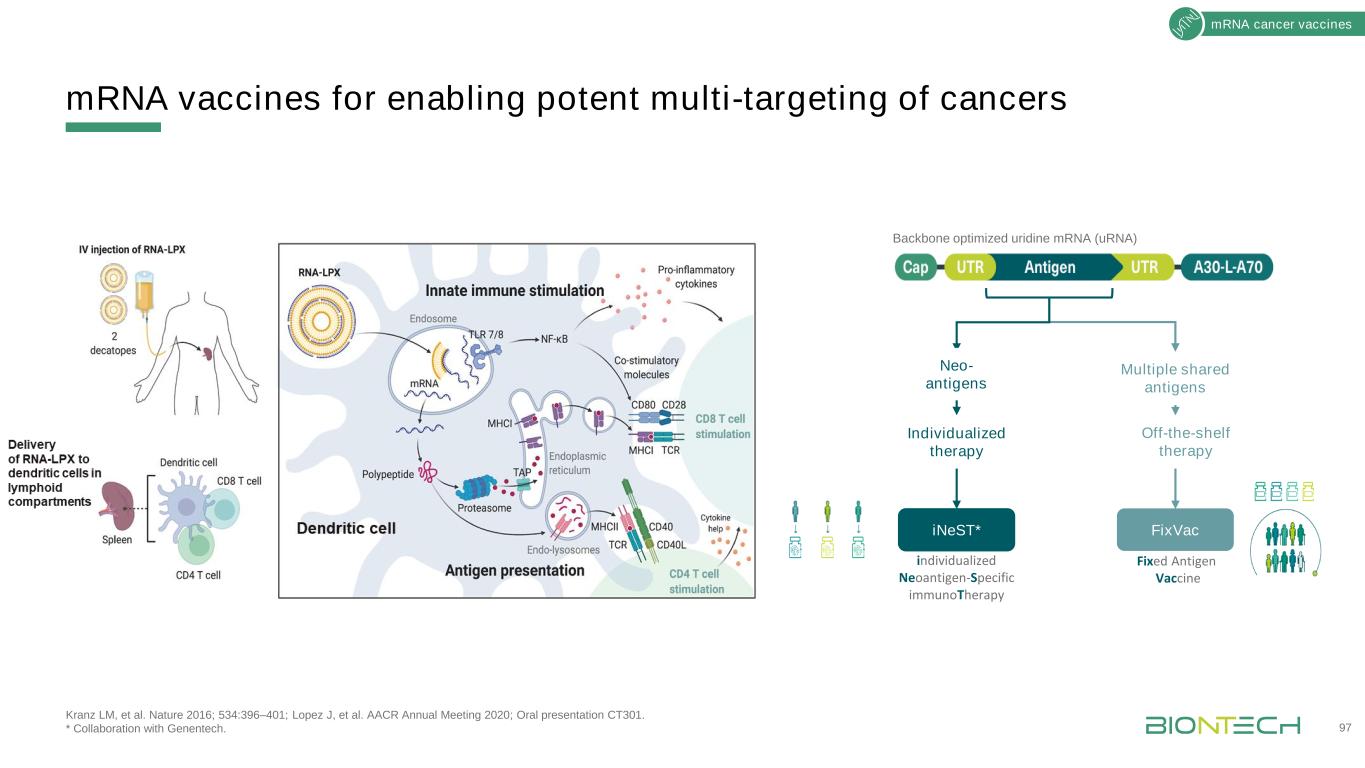
實現癌症有效多靶向的信使RNA疫苗97信使RNA癌症疫苗多種共享抗原個體化治療現成治療iNeST*FixVac固定抗原疫苗個體化新抗原特異性免疫治療主幹優化尿苷信使核糖核酸新抗原Kranz LM等。《自然》2016;534:396-401;洛佩茲等人。AACR 2020年年會;口頭報告CT301。*與基因泰克合作。
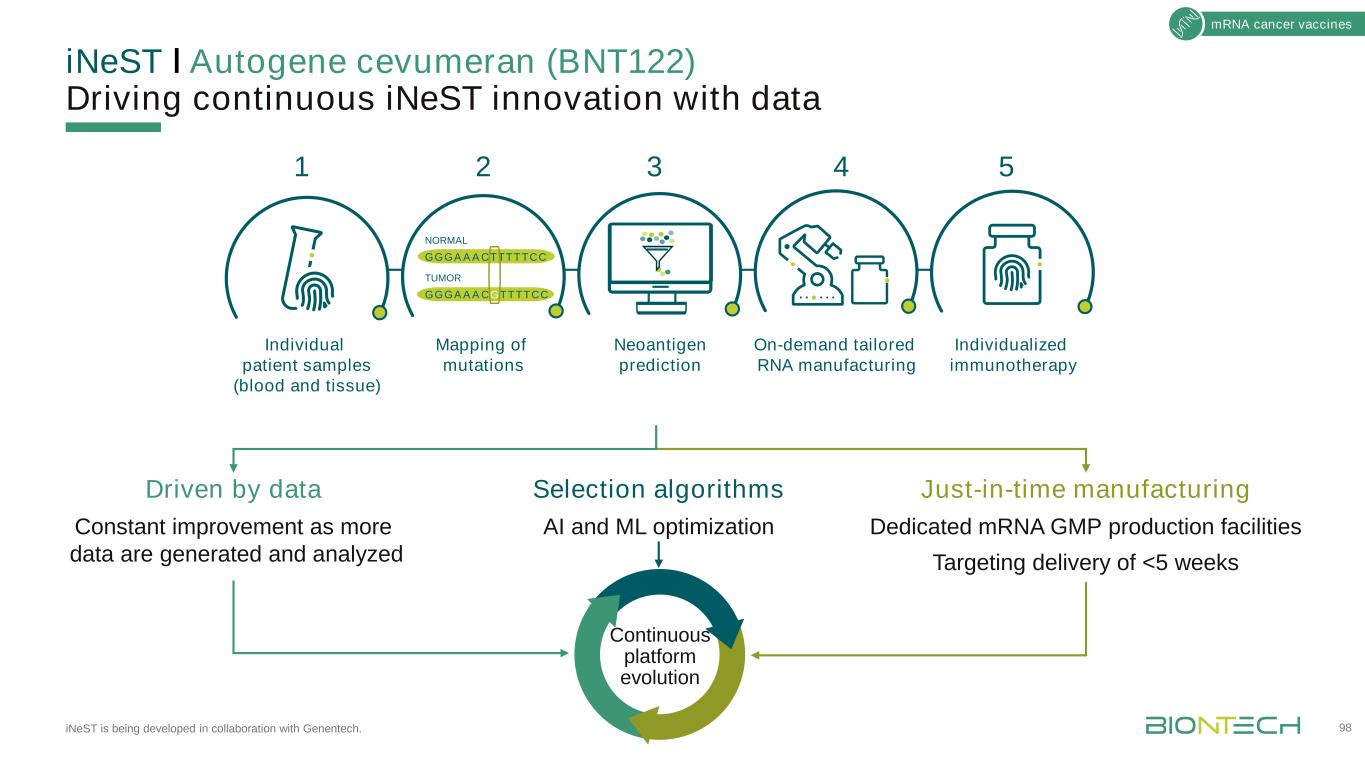
InestǀAutogene cevumeran(BNT122)正在與基因泰克合作開發,以數據驅動inest的持續創新。98種信使核糖核酸癌症疫苗及時生產專用信使核糖核酸生產設施,目標是交付

INeSTǀAutogene Cevumeran(BNT122)1期作為單一療法,與檢查點抑制劑阿替唑單抗CPI聯合治療;PR,部分緩解;PD,進展性疾病;SD,穩定期疾病。1.Sahin U,et al.自然2017;547:222-226;BNT121是BNT122的前身,也是iNeST與基因泰克合作的前身。2.洛佩茲·J等人。AACR 2020年年會;口頭報告CT301;3.Braiteh F等人。AACR 2020年年會;海報演示CT169;4.與基因泰克合作。MRNA型癌症疫苗·在經過大量預治療、PD-L1低的患者中進行的一期試驗的數據涉及多種腫瘤類型·證明瞭作為單一療法和聯合療法(多個患者每個新表位T細胞反應率>5%),能夠誘導顯著的效應和記憶表型T細胞反應·與治療相關的不良事件主要是短暫的全身反應,表現為低級別CRS,IRR或流感樣症狀·臨牀活動的初始信號作為單一藥物觀察,聯合Atezo BNT122在CPI敏感和CPI不敏感的腫瘤類型中誘導CD8+T細胞BNT122在腫瘤中誘導CD8+T細胞浸潤BNT122在>10個適應症99中使用/不使用Tecentriq的安全性和可行性評價
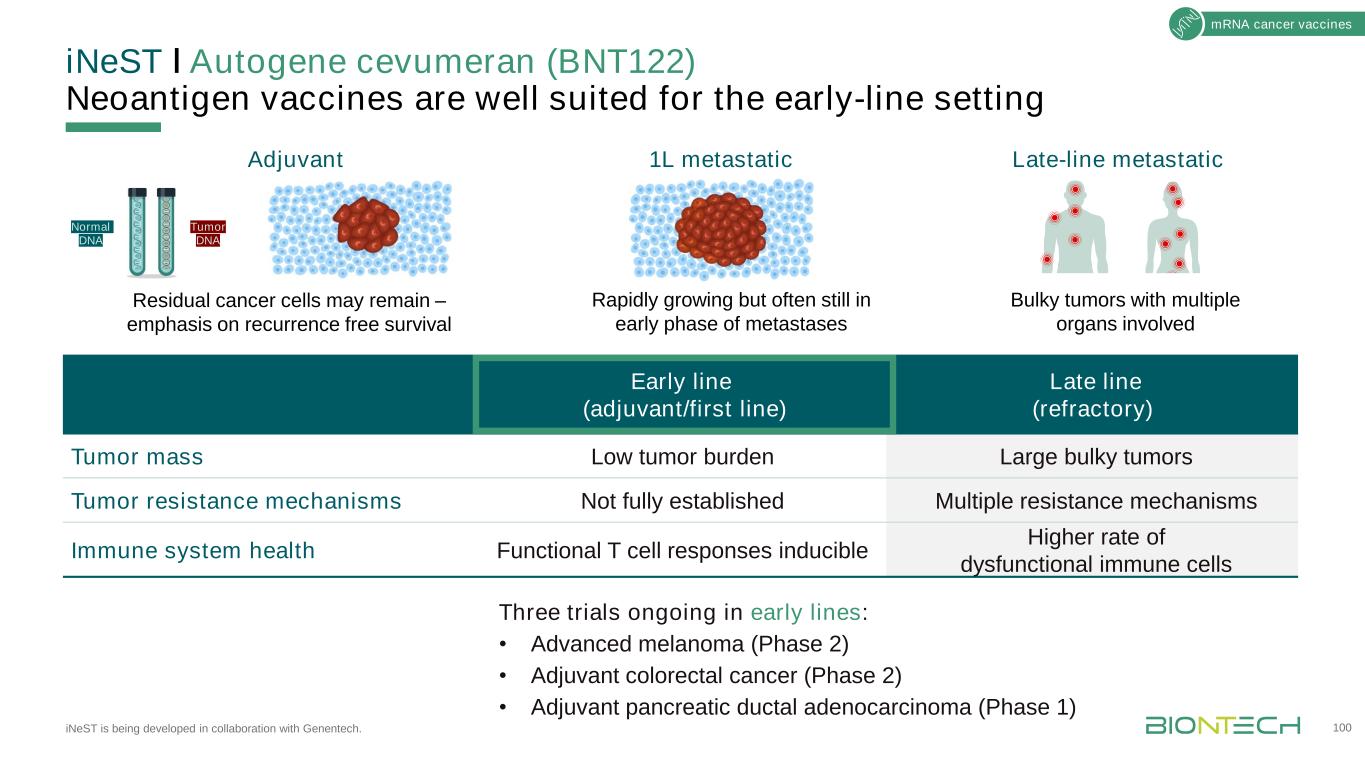
INeSTǀAutogene Cevumeran(BNT122)新抗原疫苗非常適合與基因泰克合作開發的早期產品線。100mRNA腫瘤疫苗早期(佐劑/一線)晚期(難治)腫瘤質量低腫瘤負擔大體積腫瘤耐藥機制未完全建立多重耐藥機制免疫系統健康功能T細胞反應誘導更高的免疫細胞功能障礙免疫細胞比率早期正在進行的三項試驗:·晚期黑色素瘤(2期)·佐劑性結直腸癌(2期)·佐劑胰腺導管腺癌(1期)晚期轉移1L轉移佐劑正常DNA腫瘤DNA殘留癌細胞可能保持--強調無復發生存迅速增長,但往往仍處於轉移的早期階段多器官受累的大腫瘤
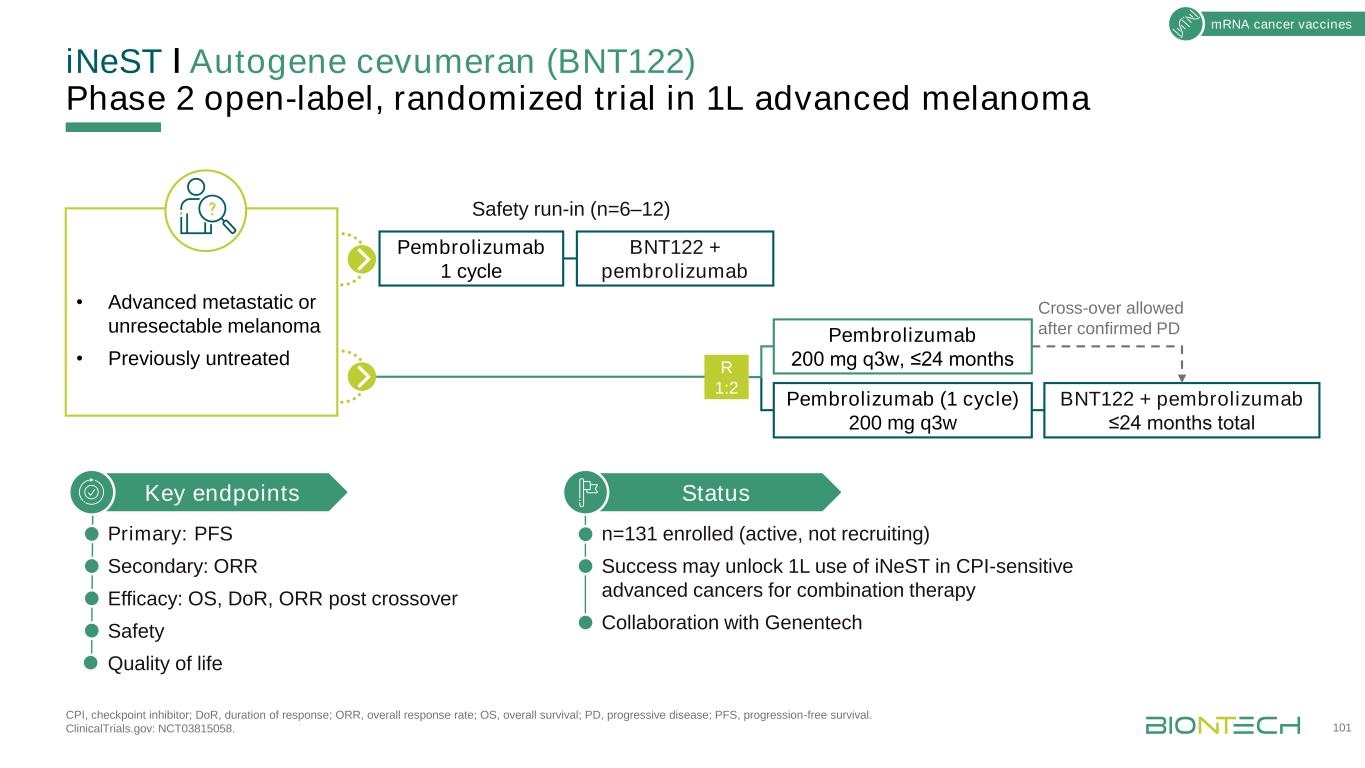
INeSTǀAutogene Cevumeran(BNT122)2期開放隨機試驗治療1L晚期黑色素瘤CPI,檢查點抑制劑;DOR,反應持續時間;ORR,總應答率;OS,總存活率;PD,進展性疾病;PFS,無進展存活率。臨牀試驗網站:NCT03815058。101mRNA癌症疫苗·晚期轉移性或無法切除的黑色素瘤·以前未治療的狀態n=131入選(正在進行,未招募)成功可能開啟inest在CPI敏感的晚期癌症中的1L使用,用於與基因泰克關鍵終點的聯合治療合作主要:PFS次級:或R療效:OS,DOR,ORR交叉後安全生活質量BNT122+Pembrolizumab≤24個月總計Pembrolizumab 200 mg q3w,≤24個月在確認PD BNT122+Pembrolizumab 1安全週期磨合後允許交叉使用
二期(高危)/三期結直腸癌信使核糖核酸疫苗輔助治療的高度醫療需求結直腸癌;ctDNA,循環腫瘤DNA;OS,總存活率;SOC,護理標準,1世衞組織癌症情況説明書。2018年;2個SEER數據庫;3個Fan G等人。PLOS One 2017;12:E0171991;4 Loupakis F,等人。JCO Precis Oncol2021;5:PO.21.00101;5 Reinert T,et al.《美國醫學會腫瘤學》,2019;5:1124−1131。102二期(高危)和三期結直腸癌接受輔助化療所有患者手術50%手術治癒CT掃描無殘留病變在手術基礎上化療20%手術+化療殘留病30%手術+化療殘留病50%僅手術治癒·結直腸癌是世界上第二致命的癌症1,5年OS在區域疾病中為71%2.原發腫瘤切除後的SOC在II期(高危)和III期CRC在原發腫瘤切除和輔助化療後仍需密切關注等待·ctDNA是微小殘留病的標誌,因此可以識別疾病復發的高風險患者3,42期(高危)和3期結直腸癌輔助化療後,無病生存期為6個月5對II期(高危)/III期結直腸癌的輔助治療有很高的醫療需求

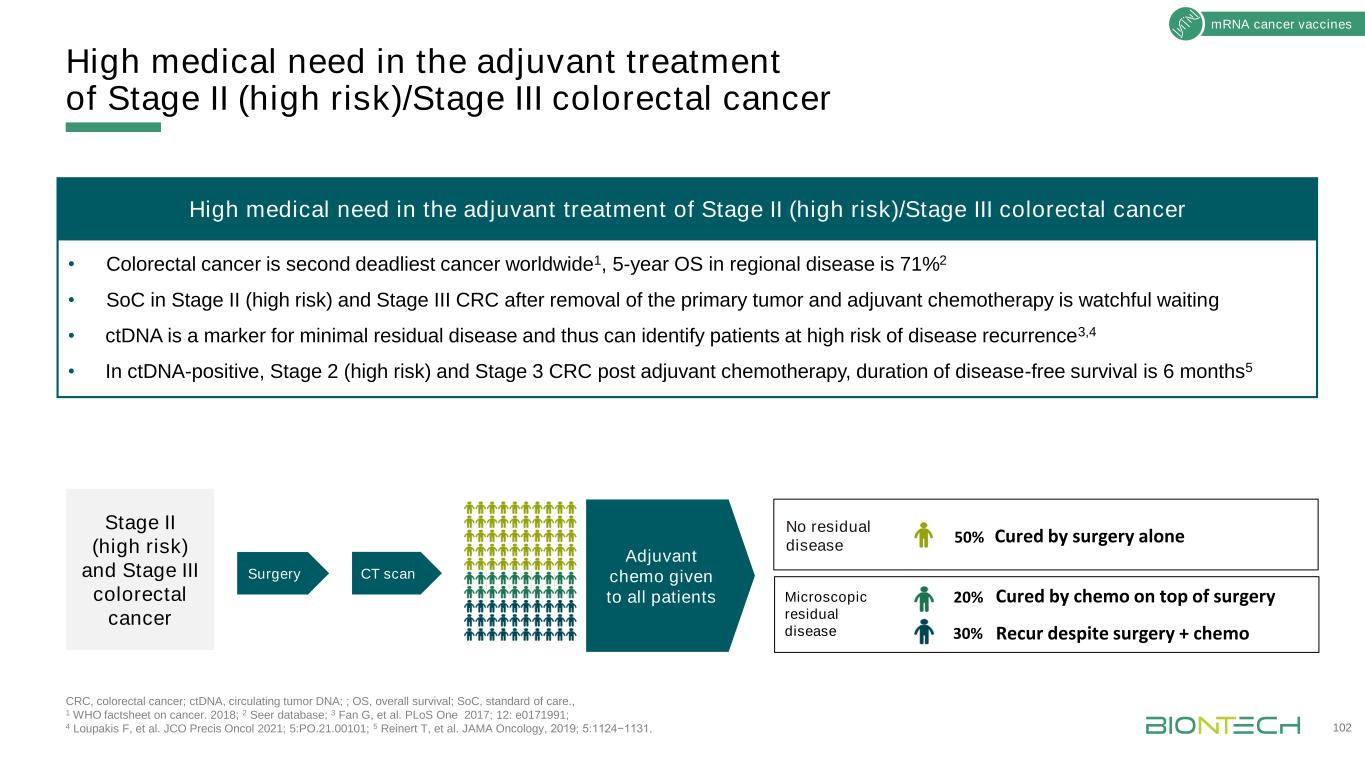
INeSTǀAutogene Cevumeran(BNT122)2期隨機試驗與觀察等待治療在輔助結直腸癌、結直腸癌;ctDNA,循環腫瘤dna;OS,總存活率;Q1/2/6周,每1/2/6周;R,隨機化;RFS,無復發生存期;SOC,護理標準;ttf,治療失敗時間;ttr,反應時間。臨牀試驗網站:NCT04486378。103 mRNA癌症疫苗狀態第一名患者接種(隨機隊列):2021年12月與基因泰克關鍵終點合作主要:無病生存(DFS)療效:RFS、TTR、TTF、OS在ctDNA狀態BNT122 15劑:6×q1w、2×q2w、7×q6w觀察觀察等待接受手術切除的II期(高危)或III期CRC篩查1 ctDNA狀態(手術後)篩查3最終合格(ctDNA陽性)篩查2新抗原選擇用於疫苗生產12-24周iNeST製造≤20新表位R1:1探索性:BNT122篩查復發疾病3(n≤20)n=166生物標誌物:BNT122與ctDNA狀態無關(n=15)
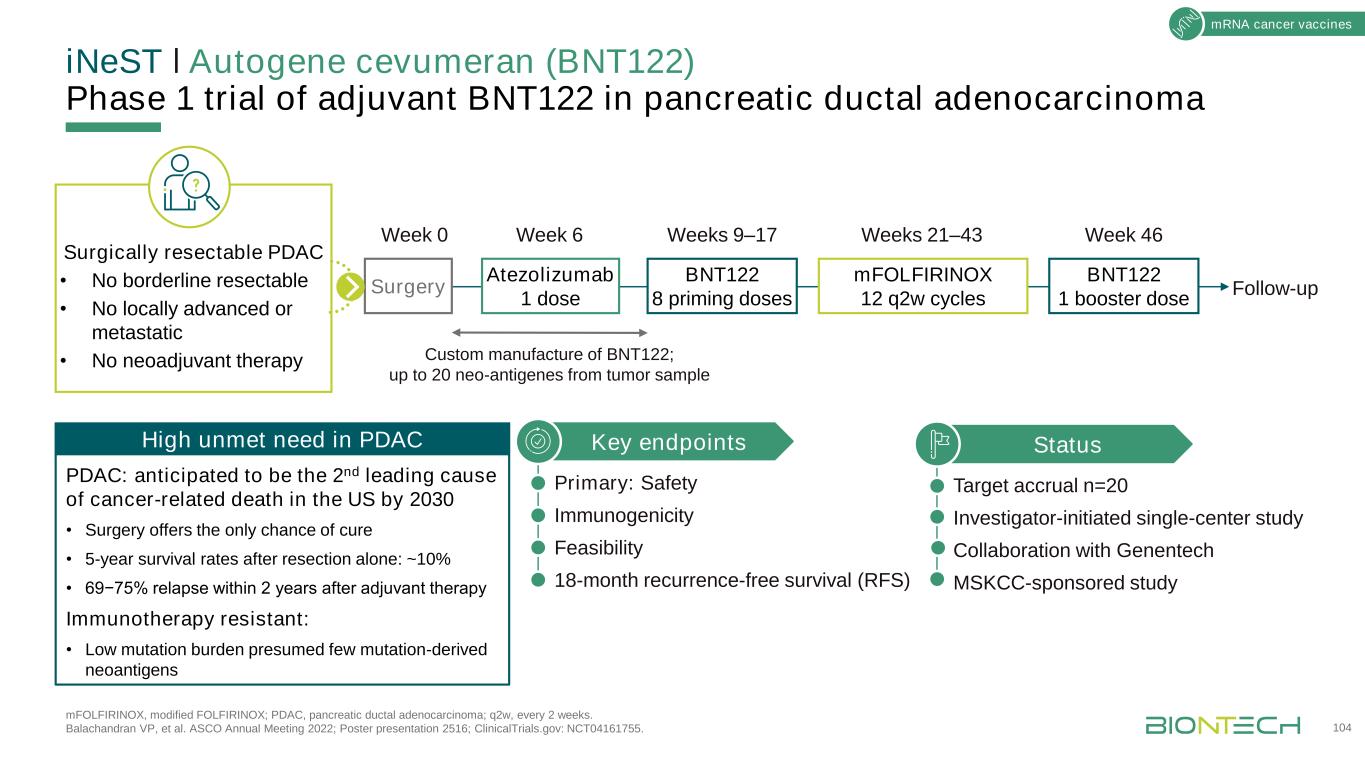
INeSTǀ自身基因Cevumeran(BNT122)佐劑治療胰腺導管腺癌的1期試驗:改良FOLFIRINOX;PDAC,胰腺導管腺癌;Q2W,每2週一次。Balachandran副總裁等人。ASCO 2022年會;海報展示2516;ClinicalTrials.gov:NCT04161755。104狀態目標應計n=20研究人員發起的單中心研究與基因技術公司MSKCC贊助的研究關鍵終點主要:安全免疫原性可行性18個月無復發生存期pDAC:預計到2030年將成為美國癌症相關死亡的第二大原因·手術提供治癒的唯一機會·單獨切除後5年存活率:~10%·69−75%在輔助治療後2年內復發免疫治療耐藥:·低突變負擔假定很少突變衍生的腫瘤抗原在可手術切除的pDAC中高度未滿足的需求·無手術切除·無局部切除·無局部切除晚期或轉移性·無新輔助治療BNT122 8預充劑Atezolizumab 1劑BNT122 1加強劑mFOLFIRINOX 12個Q2W週期手術周0周6周9~17周21~43周46次隨訪定製BNT122;從腫瘤樣本中提取多達20個新的抗癌基因
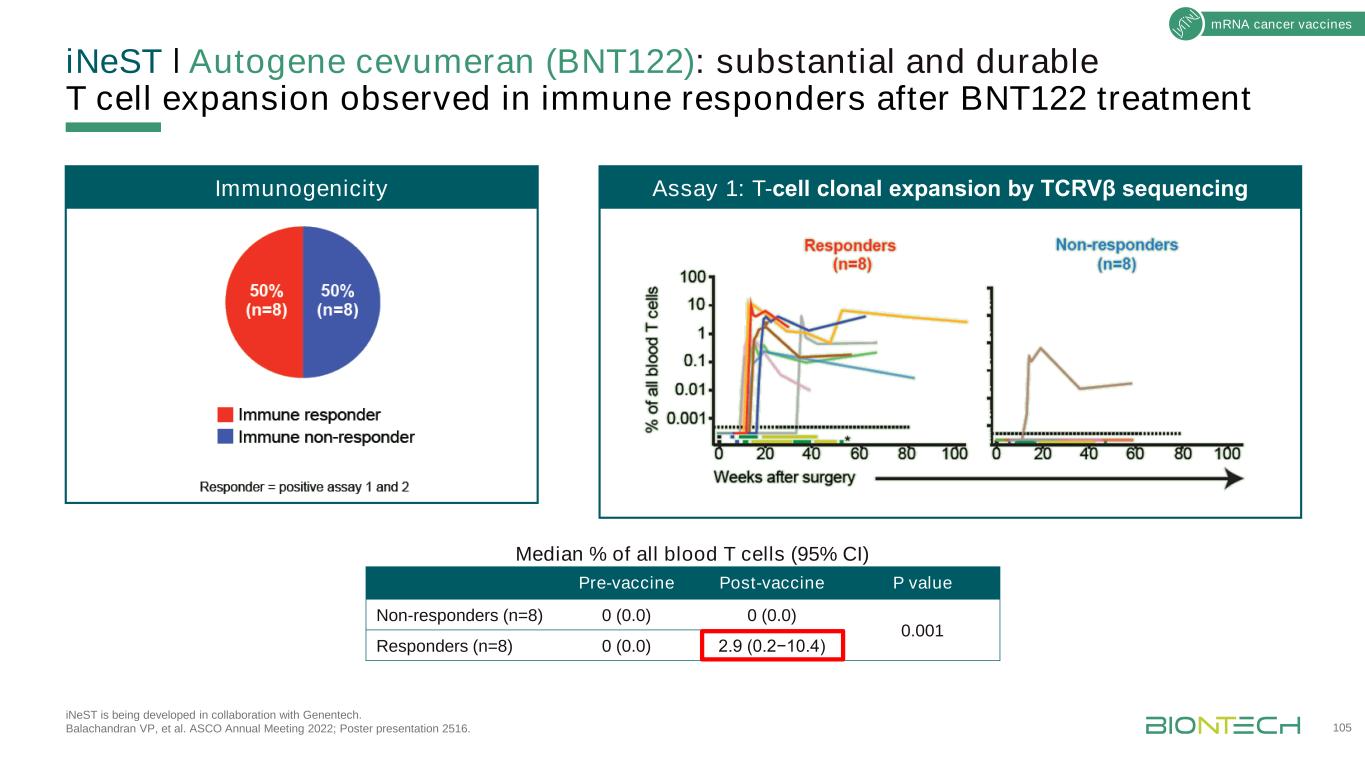
INeSTǀ自體基因Cevumeran(BNT122):在BNT122治療後免疫應答者中觀察到大量和持久的T細胞增殖iNeST正在與基因技術公司合作開發。Balachandran副總裁等人。2022年ASCO年會;海報展示2516。免疫原性檢測1:T細胞克隆性擴增疫苗接種前P值無應答者(n=8)0(0)0(0)0.001應答者(n=8)0(0)2.9(0.2−10.4)T細胞佔全血T細胞的中位數%(95%CI)

由ELISPOT在免疫應答器中證實的inestǀ自體基因cevumeran(BNT122)功能T細胞正在與基因技術公司合作開發。Balachandran副總裁等人。2022年ASCO年會;海報展示2516。用幹擾素γELISPOT檢測106mRNAs腫瘤疫苗對自身基因Cevumeran新抗原的2:T細胞特異性
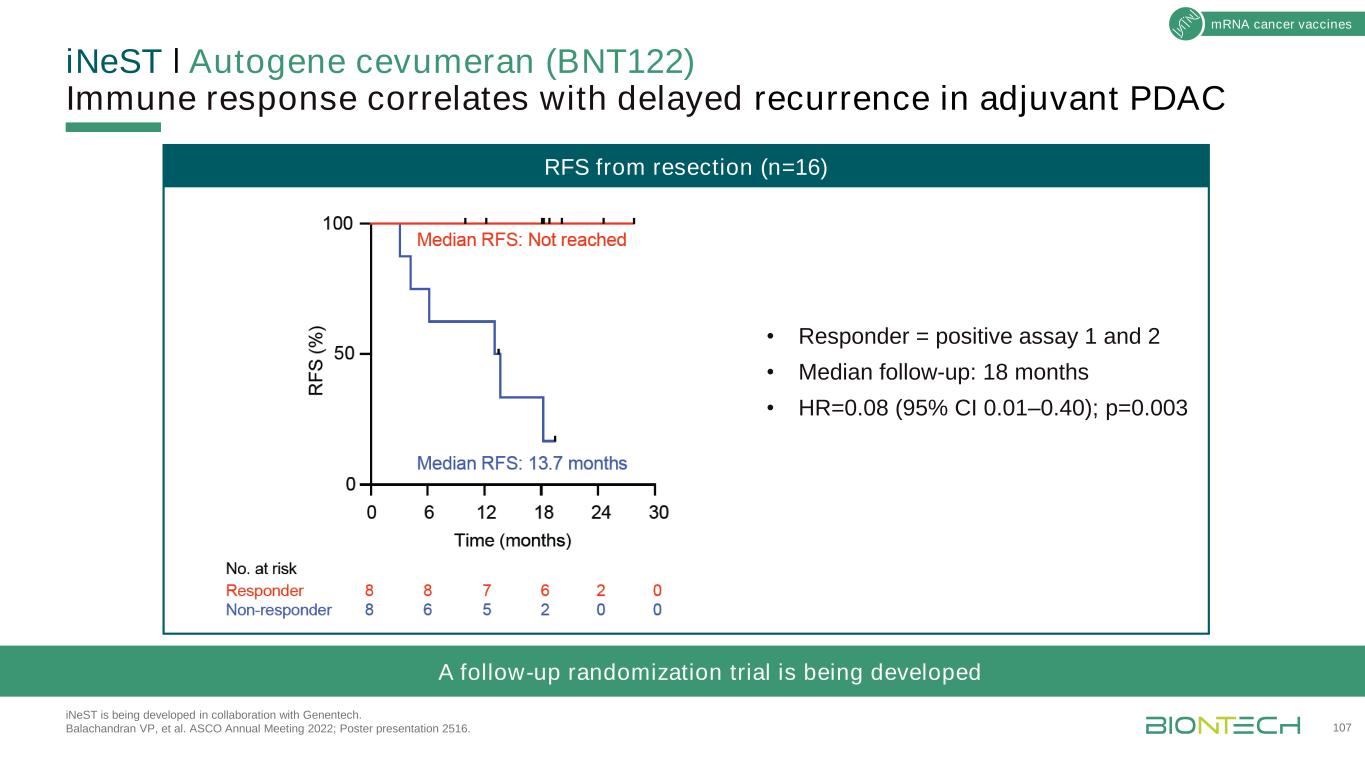
ǀ自身基因Cevumeran(BNT122)免疫反應與佐劑PDAC延遲復發相關iNeST正在與基因泰克合作開發。Balachandran副總裁等人。2022年ASCO年會;海報展示2516。107mR NA腫瘤疫苗切除後RFS(n=16)·應答者=陽性試驗1和2·中位隨訪期:18個月·HR=0.08(95%可信區間0.01-0.40);p=0.003正在進行隨機化隨訪試驗

FixVac利用共享的腫瘤相關抗原治療癌症:HNSCC,頭頸部鱗狀細胞癌;HPV,人乳頭瘤病毒;NSCLC,非小細胞肺癌。108信使核糖核酸疫苗共有抗原的疫苗骨架Lipoplex=針對共有腫瘤相關抗原的固定疫苗組合RNA-LPX配方(IV)固定Vac骨架優化的尿苷mRNA(URNA)針對每個適應症量身定做的多抗原方法+AAAA Poly(A)尾部抗原CASSETTE5‘BNT111編碼4個腫瘤相關抗原,覆蓋90%以上的皮膚黑色素瘤患者HPV16+HNSCC HPV-E6 HPV-E7 BNT113編碼2個癌蛋白,僅在前列腺癌前和惡性組織中表達BNT112編碼5個前列腺癌相關抗原NSCLC BNT116編碼6個不同的NSCLC腫瘤相關抗原

解決晚期黑色素瘤CPI失效所需的治療選擇CPI,檢查點抑制劑;DOR,反應持續時間;MPFS,中位無進展生存期;ORR,總應答率;R/R,難治/耐藥;世衞組織,世界衞生組織。1可在:https://www.melanomauk.org.uk/2020-melanoma-skin-cancer-report;2全球癌症觀測站-2018年《今日癌症》的數據;3全球癌症觀測站-《明天的癌症》預測的2025年數據;4拉金等人。N Engl J Med 2019;381:1535−1546;5可從https://seer.cancer.gov/statfacts/html/melan.html獲得(2021年8月6日訪問。109信使核糖核酸癌症疫苗改善護理標準的重要機會每年病例增加近50%,超過287,0001,2世衞組織預測,到2025年,死亡人數將增加20%3 20%50%的發病率死亡患者對CPI治療無效或復發,使他們的治療選擇有限4CPI R/R患者~55%黑色素瘤仍然是最致命的皮膚癌1,2·5年轉移性黑色素瘤的生存率仍然只有29.8%5·CPI的一線免疫治療最大限度地誘導持久的反應。45CPI50%的患者−時間相對較短·CPI抵抗/難治性患者對CPI無反應或CPI後復發的患者預後特別差,根據危險因素,生存期短至6個月·晚期CPI R/R黑色素瘤是高醫療需求人羣,預後極差
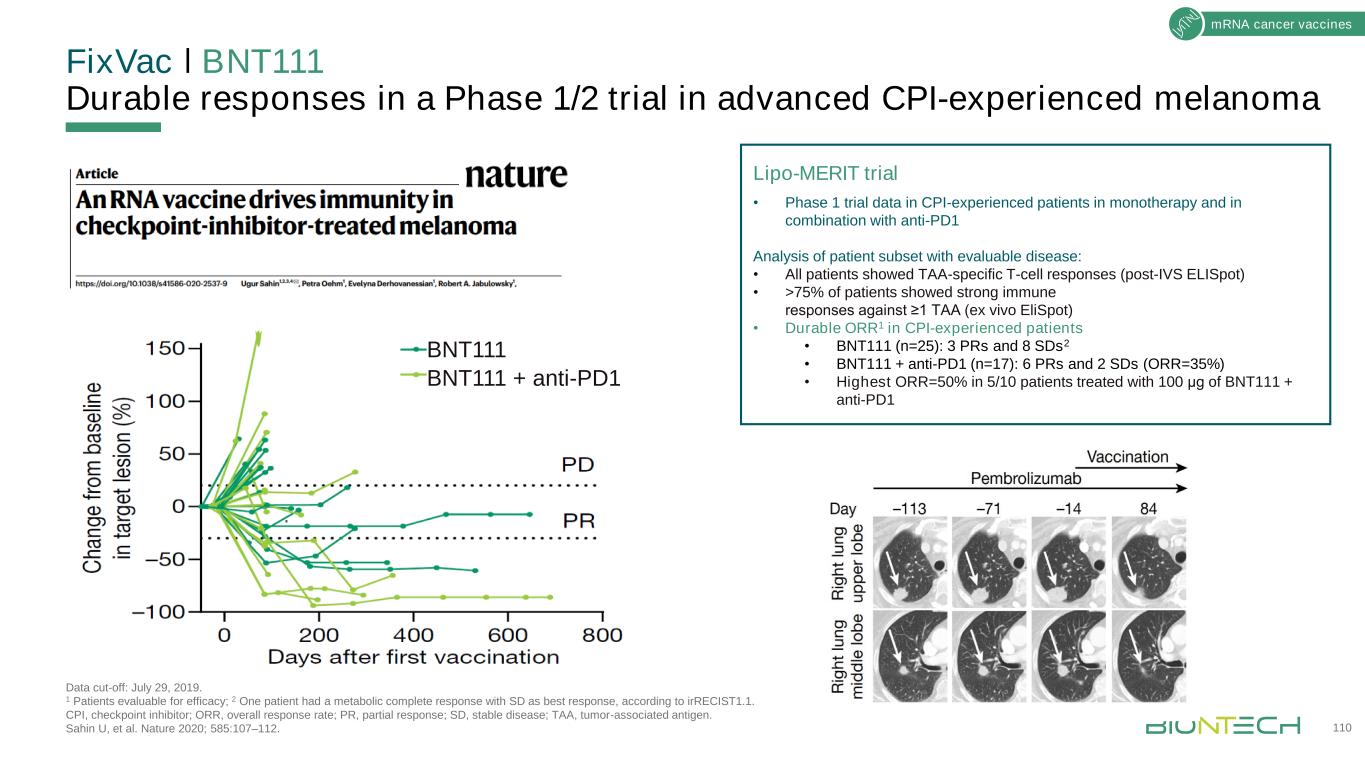
修復VacǀBNT111在晚期消費物價指數經歷的黑色素瘤數據截斷的1/2階段試驗中的持久反應:2019年7月29日。1例可評價療效;2根據irRECIST1.1標準,1例患者代謝完全緩解,SD為最佳反應。CPI,檢查點抑制物;ORR,總緩解率;PR,部分緩解率;SD,病情穩定;TAA,腫瘤相關抗原。Sahin U,et al.《自然》2020;585:107-112。110mRNA型癌症疫苗BNT111 BNT111+抗-PD1Lipo優點試驗·在有CPI經驗的患者中進行單藥治療和聯合抗PD1分析的第一階段試驗數據:·所有患者都顯示出TAA特異性T細胞應答(體外ELISPOT後)·>75%的患者對≥1 TAA(體外ELISPOT)有強烈的免疫應答·有CPI經驗的患者的持久ORR1·BNT111(n=25):3個PR和8個SD 2·BNT111+抗-PD1(n=17):6個PR和2個SD(ORR=35%)·100μg BNT111+抗PD1治療的5/10患者ORR=50%
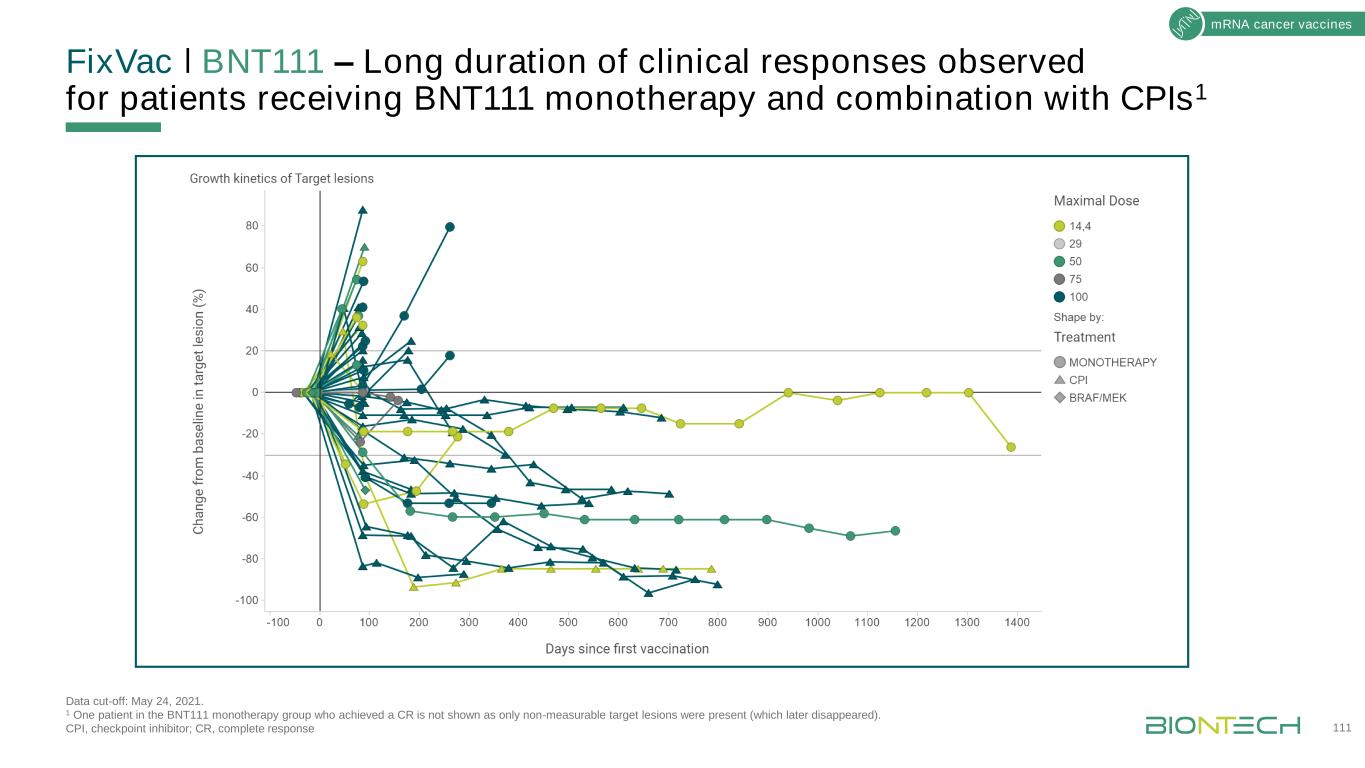
修復VacǀBNT111-接受BNT111單一治療和聯合CPIS1數據截止的患者觀察到的長時間臨牀反應:2021年5月24日。1在BNT111單一治療組中,有1例患者達到CR,但未顯示為僅存在不可測量的靶區(後來消失)。CPI,檢查點抑制因子;CR,完全應答111mRNA癌症疫苗

修復VacǀBNT111-接受BNT111單一治療或與PD-1抑制劑1,2聯合治療的患者觀察到腫瘤縮小1,2數據截止日期:2021年5月24日。1 1例患者靶區病變較基線減少83.2%,但出現新的靶區病變,總體療效最佳。患者B4-31有幾個新的病變,儘管目標病變減少;2在BNT111單一治療組中有一名患者實現了CR,但沒有顯示,因為只有不可測量的目標病變存在(後來消失)。CPI,檢查點抑制物;irRECIST,實體瘤免疫相關反應評估標準;SD,穩定期疾病。112種信使核糖核酸腫瘤疫苗最佳總體應答*PR°SD/IRSD

修復VacǀBNT111強大的免疫原性和有望的臨牀活性在第一階段Lipo-優點數據截止日期:2021年5月24日。ED,疾病證據;IVS,體外刺激;NED,無疾病證據;NR,未達到;TAA;腫瘤相關抗原。Loquai C等人。SITC 2021年年會;海報展示549。113個mRNA癌症疫苗在ED和NED患者之間顯示出類似的CD4+和CD8+T細胞反應,在試驗納入體外ELISpot(ED,n=22;NED,n=28)後,在沒有疾病證據的患者中初步無病生存(ED,n=9;NED,n=6)體外反應ED:64%(n=14)NED:68%(n=19)T細胞對≥-1TAA的反應在所有患者中觀察到·在NED患者中:34.8月中位DFS(95%CI:7.0NR),中位隨訪期40.7個月(95%CI:35.3-42.7)
FixVacǀBNT111第2期隨機試驗±cymplimab在患有抗PD1-R/R黑色素瘤DCR的患者中,疾病控制率;DOR,反應持續時間;ORR,總應答率;OS,總生存期;PFS,無進展生存期;R/R,復發/難治;Ttr,反應時間。臨牀試驗網站:NCT04526899。114種信使核糖核酸癌症疫苗·無法切除的III或IV期黑色素瘤·復發/對抗PD1狀態難治性首例患者用藥:2021年6月n=180個全球試驗(澳大利亞、德國、意大利、波蘭、西班牙、英國、美國)與Regeneron關鍵終點合作主要:聯合ARM:ORR療效:ORR、DOR、DCR、TTR、PFS、OS安全性,包括免疫相關的AEs生活質量BNT111長達24個月-n=45 Cymplimab長達24個月-n=90 R2:1:1疾病進展後BNT111+cymplimab成功措施ORR=30%美國快速通道指定和Orphan藥物指定
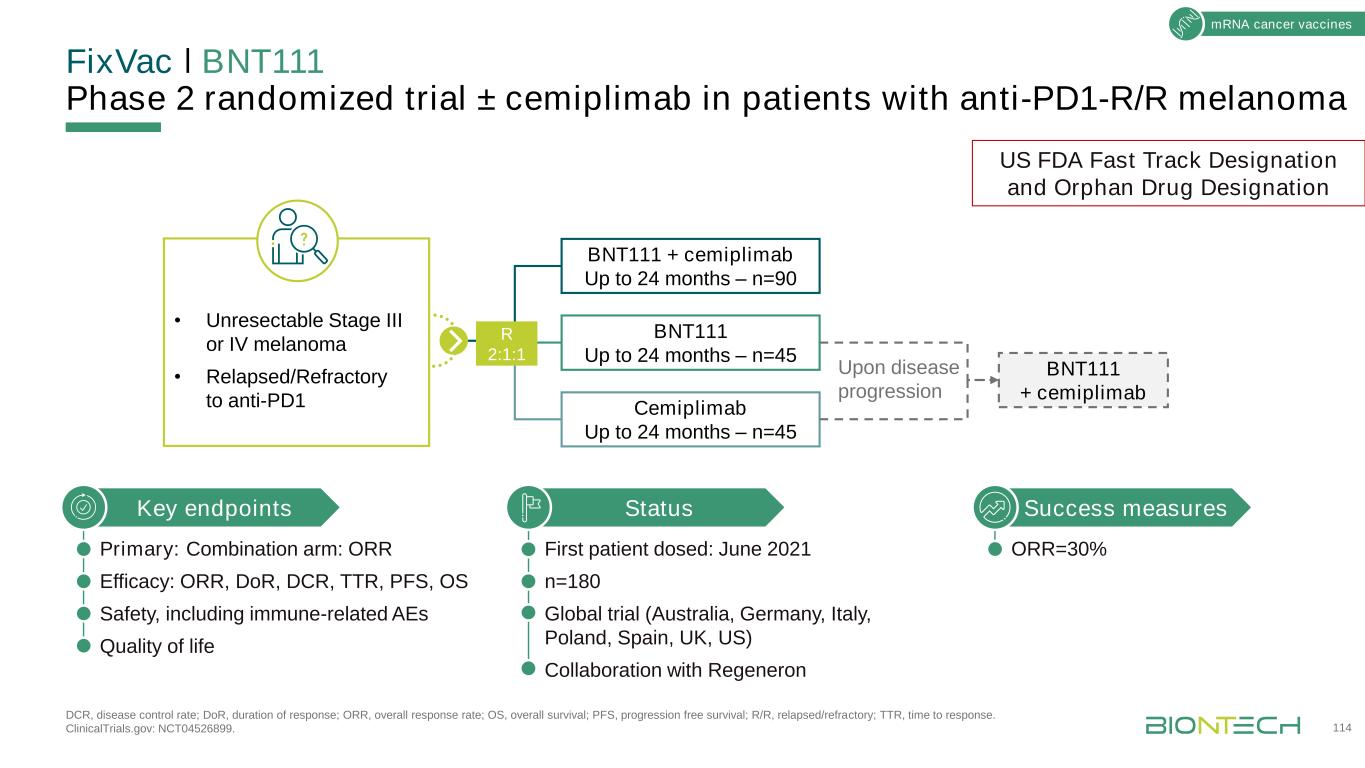
FPD,首例用藥;HNSCC,頭頸部鱗狀細胞癌;NSCLC,非小細胞肺癌;PDAC,胰腺導管腺癌;R/R,復發/難治。1 BNT122,與基因技術公司合作;2研究人員發起的研究。近期里程碑115mRNA癌症疫苗平臺產品候選適應症(靶點)下一個里程碑iNeST新抗原mRNA疫苗Autogene cevumeran(BNT122)+培溴利珠單抗1L黑色素瘤2期完全招募;數據更新H2 2022自體基因cevumeran(BNT122)1佐劑結直腸癌2期正在進行(FPD,2021年12月)自體基因cevumeran(BNT122)±阿替唑珠單抗實體瘤1期完全招募自體基因cevumeran(BNT122)±阿替唑藍1,2佐劑PDAC後續隨機試驗正在開發中FixVac固定組合信使核糖核酸疫苗BNT111±抗PD1晚期黑色素瘤1期正在進行BNT111±cymplimab R/R黑色素瘤2期正在進行(FPD,2021年6月)-美國FDA快速跟蹤指定和孤兒藥物指定BNT112±cplimab正在進行的第二部分BNT113+pembrozumab PVH16+頭頸部癌症和具有登記潛力的頭頸部癌症2期(FPD,2021年7月)BNT111±cempplimab R/R黑色素瘤2期正在進行(FPD,2021年6月)-美國FDA快速跟蹤指定和孤兒藥物指定BNT112正在進行的cplimab前列腺癌登記第二部分BNT113+pembrozumab PVH16+頸部癌症2期正在進行(FPD,2021年7月)

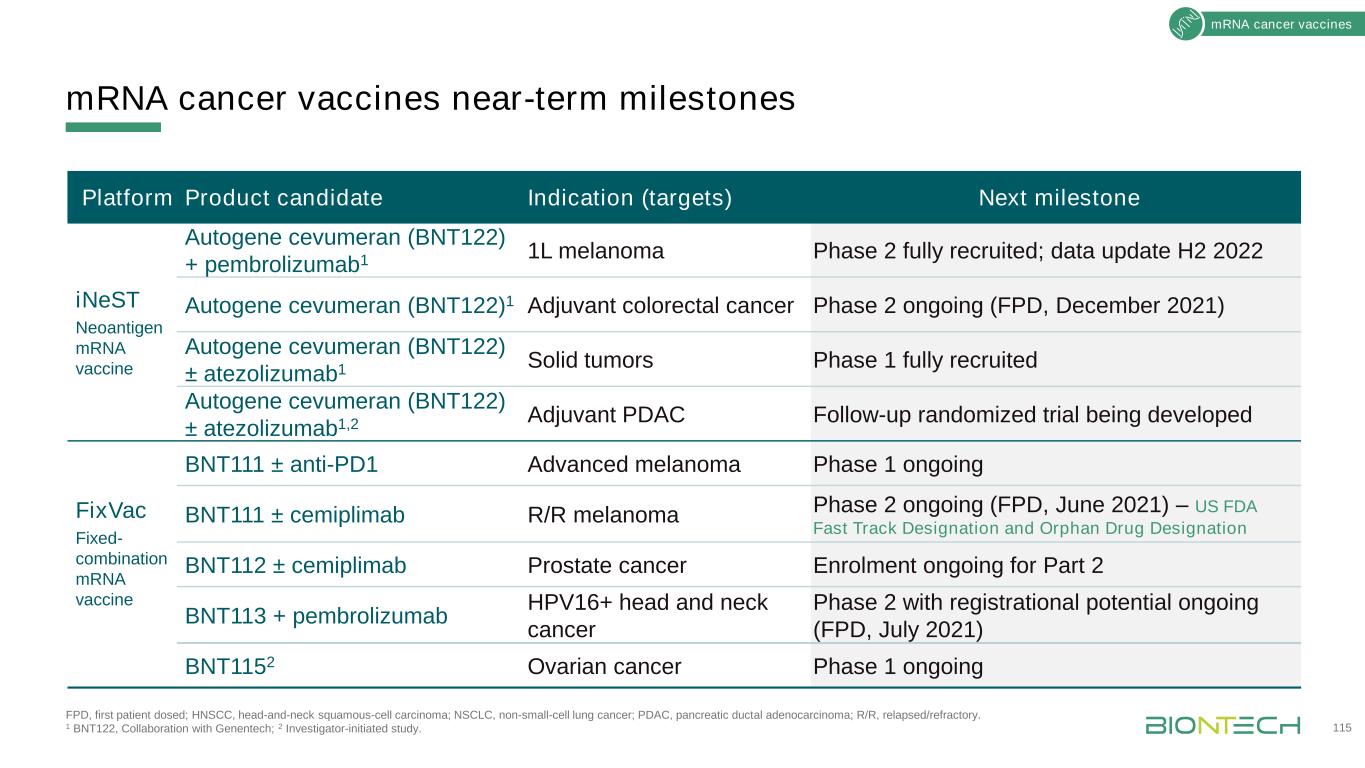
蛋白質療法
BNT311結合了檢查點封鎖和條件T細胞共刺激*BNT311(Gen1046)是與Genmab基於50/50分享成本和利潤的合作伙伴關係。1 Muik A等人。癌症Discov 2022;12:1248−1345。117蛋白質療法以PD-L1結合為條件的雙靶向4-1BB共刺激條件增強T細胞和NK細胞功能的新機制(BNT311)·針對兩個臨牀前驗證靶點的條件性雙特異性分子:·PD-L1:表達在腫瘤細胞上的受體-配體,以抑制PD1陽性細胞的增殖,並參與免疫逃避·4-1BB:表達在T細胞和NK細胞上的共刺激腫瘤壞死因子。激活4-1BB途徑可促進T細胞增殖、增強T細胞效應功能並阻止T細胞死亡BNT311結合親和力:KD PD-L1:0.16nmol/L,4-1BB:0.15nmol/L
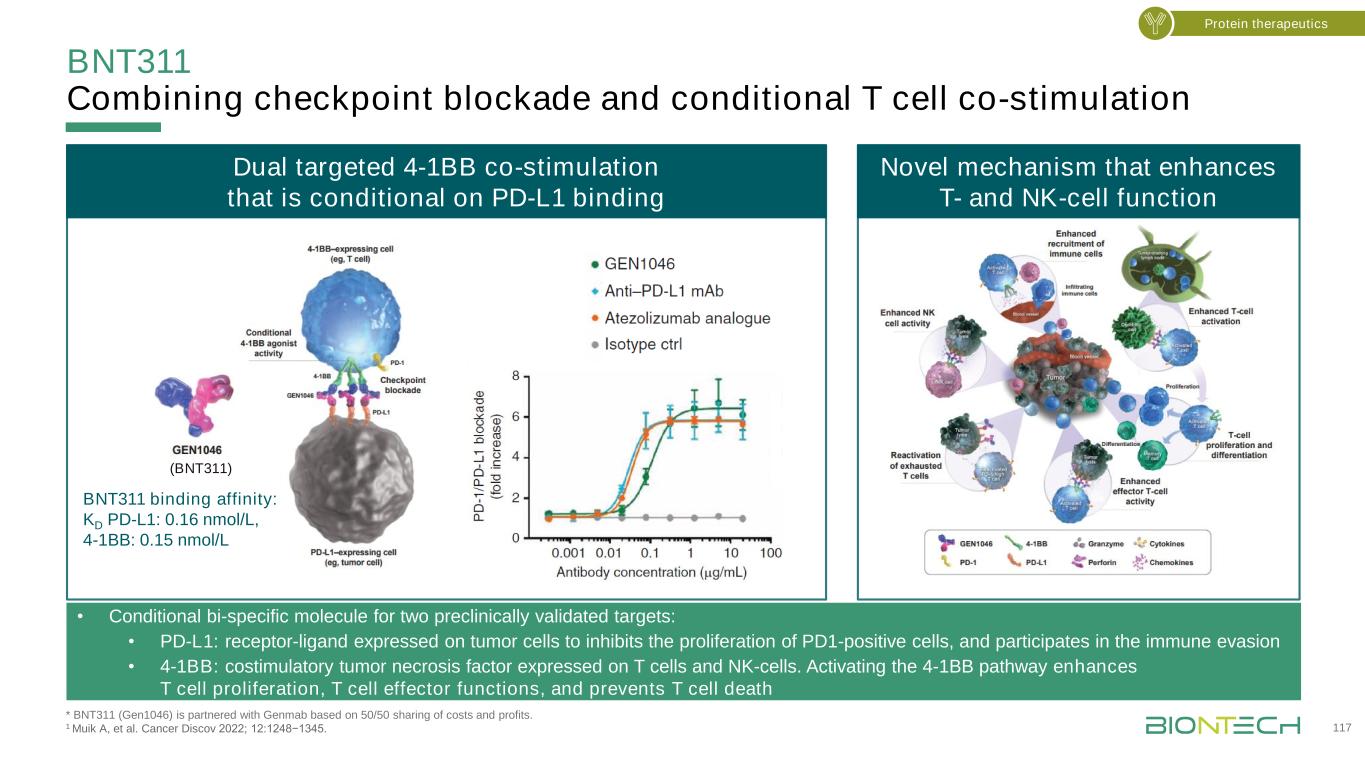
BNT311是人類首個經過嚴格預處理的晚期實體腫瘤的1/2期試驗*BNT311(Gen1046)與Genmab基於50/50分享成本和利潤的基礎上進行合作。CC,宮頸癌;EC,子宮內膜癌;HNSCC,頭頸部鱗狀細胞癌;MTD,最大耐受劑量;NSCLC,非小細胞肺癌,PD,進展性疾病;RP2D,推薦2期劑量;TNBC,三陰性乳腺癌;UC,尿路上皮癌。NCT03917381。與Genmab關鍵終點合作招募11個擴展隊列主要:MTD、RP2D安全性、藥代動力學、免疫原性藥效學和潛在預測生物標記物抗腫瘤活性(RECIST v1.1)蛋白質治療劑量遞增(N=61)BNT311/GEN1046*IV直至PD或不可接受毒性·轉移性或無法切除的實體腫瘤·不適合標準治療劑量擴展的患者(≤40/隊列)·PD-(L)1-抑制劑預治療隊列·CervicalC·EndometrialC·HNSCC擴展劑量100 mg Q3W 1期2a·NSCLC·TNBC·Urethelic
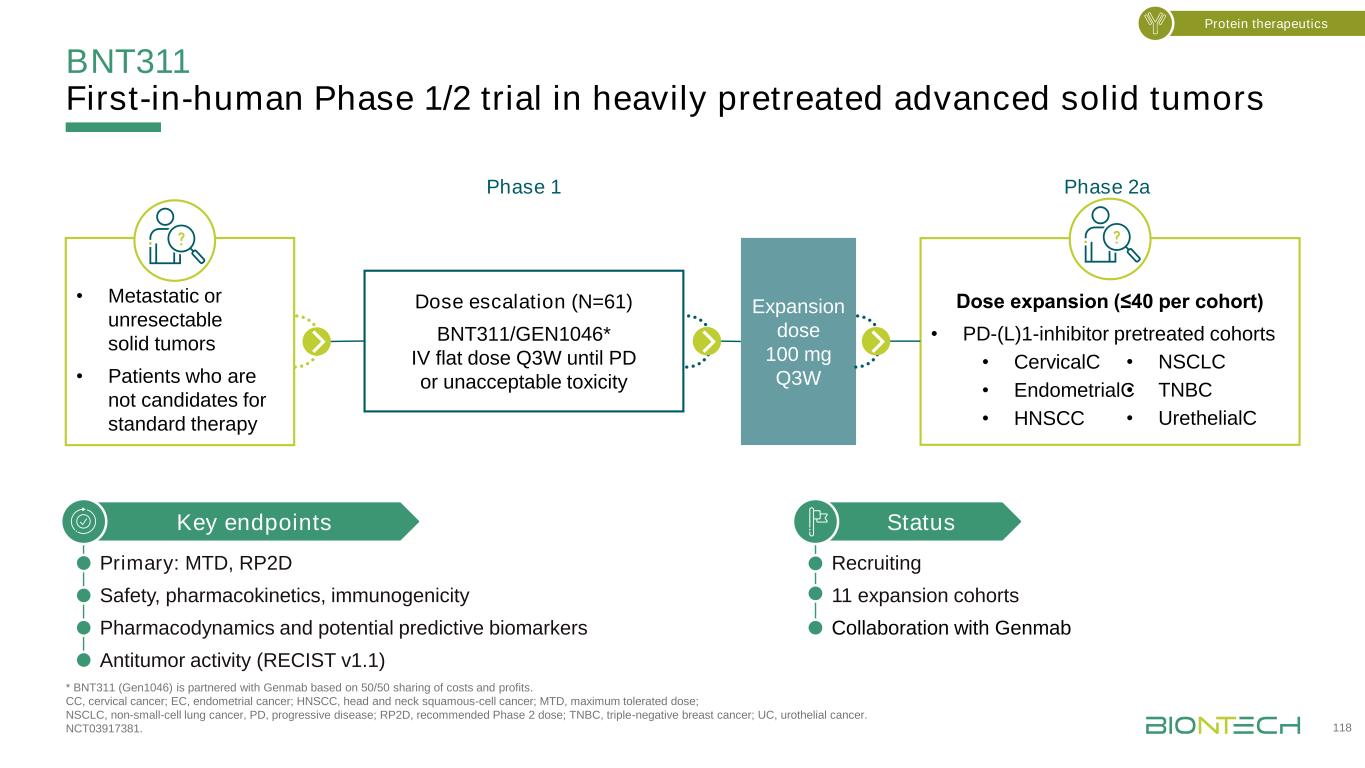
BNT311:劑量升級的初步結果顯示,大多數AE的安全狀況可控,數據截止日期為1級或2級:2020年8月31日。DLT,劑量限制毒性;MTD,最大耐受量;TEAE,治療緊急不良事件;TRAE,治療相關不良事件。Garralda E,et al.SITC 2020年年會;海報展示412。蛋白療法·治療相關轉氨酶升高26.2%(≥3級:9.8%),用糖皮質激素治療後降低·無治療相關膽紅素升高或4級轉氨酶升高·6例DLT:4級發熱中性粒細胞減少2例,3級腎炎1例,3級ALT升高1例,3級AST/ALT升高1例,3級轉氨酶升高1例·6例患者均痊癒無後遺症·≥未達TEAE,劑量遞增隊列中10%的患者發生≥。N(%)≥3級,n(%)任何TRAE 43(70.5)17(2 7.9)TRAE在≥患者中佔10%,由於優先項ALT升高,穀草轉氨酶升高增加甲減疲勞14(2 3.0)13(2 1.3)11(18.0)8(13.1)5(8.2)2(3.3)1(1.6)1(1.6)
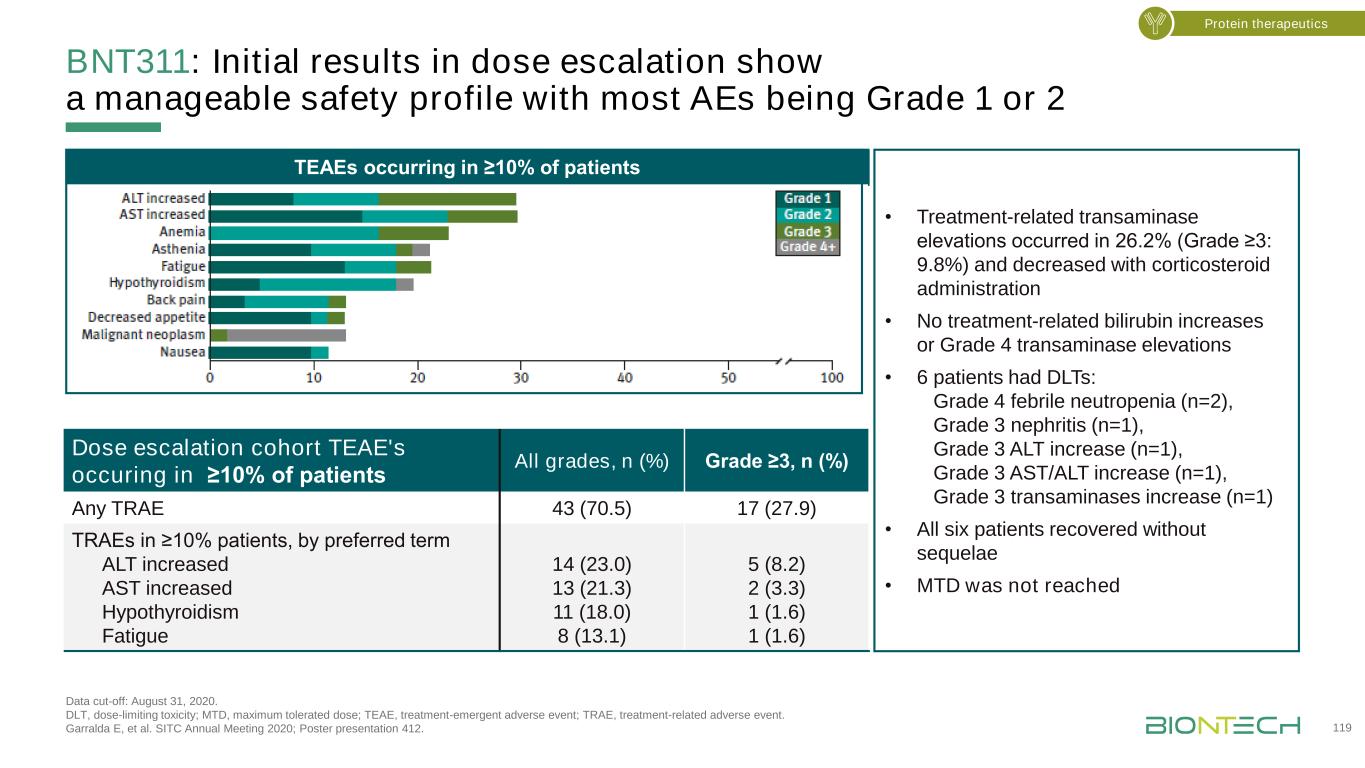
BNT311抗腫瘤活性(第一階段劑量升級部分)數據截止日期:2020年9月29日。沒有對5名患者進行基線後掃描。未達到每個RECIST v1.1的最短響應持續時間(5周)。B-PR在隨後的掃描中沒有得到確認。NE,不可評估;NSCLC,非小細胞肺癌;PD,進展性疾病;PD-(L)1,程序性死亡(配體)1;PR,部分反應;SD,穩定疾病;SOD,直徑總和;UPR,未證實部分反應。65.6%(40/61)的患者在3個月的中位隨訪期內實現了▪病的控制,▪4早期部分反應在TNBC(1例),卵巢癌(1例),和CPI治療前NSCLC(2)腫瘤大小變化最好的患者結直腸癌NSCLC卵巢癌胰腺癌其他癌症之前PD-(L)1 75 50 25-25-50-75劑量水平PD SD NEA SD PD SD PD SD NEA PR uPRbuPRSD 1 4 0 m g 4 0 m g 1 2 0 m g 5 0 m g2 5 m g 2 5 m g 8 0 m g 1 4 0 m g 2 0 0 m g 2 0 0 m g 8 0 m g 2 0 0 m g 1 4 0 m g 4 0 m g 4 0 m g 1 4 0 m g 1 4 0 m g 8 0 m g 1 4 0 m g 8 0 m g 8 0 0 m g 2 0 0 m g 8 0 m g 4 0 0 m g 5 0 m g 4 0 0 m g 8 0 m g 2 5 m g 1 4 0 m g 1 0 0 m g 1 0 m g 2 0 m gG 1 2 0 0 m g 8 0 0 m g 1 0 0 m g 1 2 0 m g 8 0 m g 1 2 0 m g 4 0 0 m g 4 0 0 m g 8 0 m g 5 0 m g 5 0 m g 8 0 m g 2 0 0 m g 4 0 0 m g 8 0 0 m g 5 0 m g 5 0 m g 4 0 0 m g 8 0 0 m g 8 0 0 m g 2 0 m g 8 0 m g 2 0 m g 1 0 0 m g
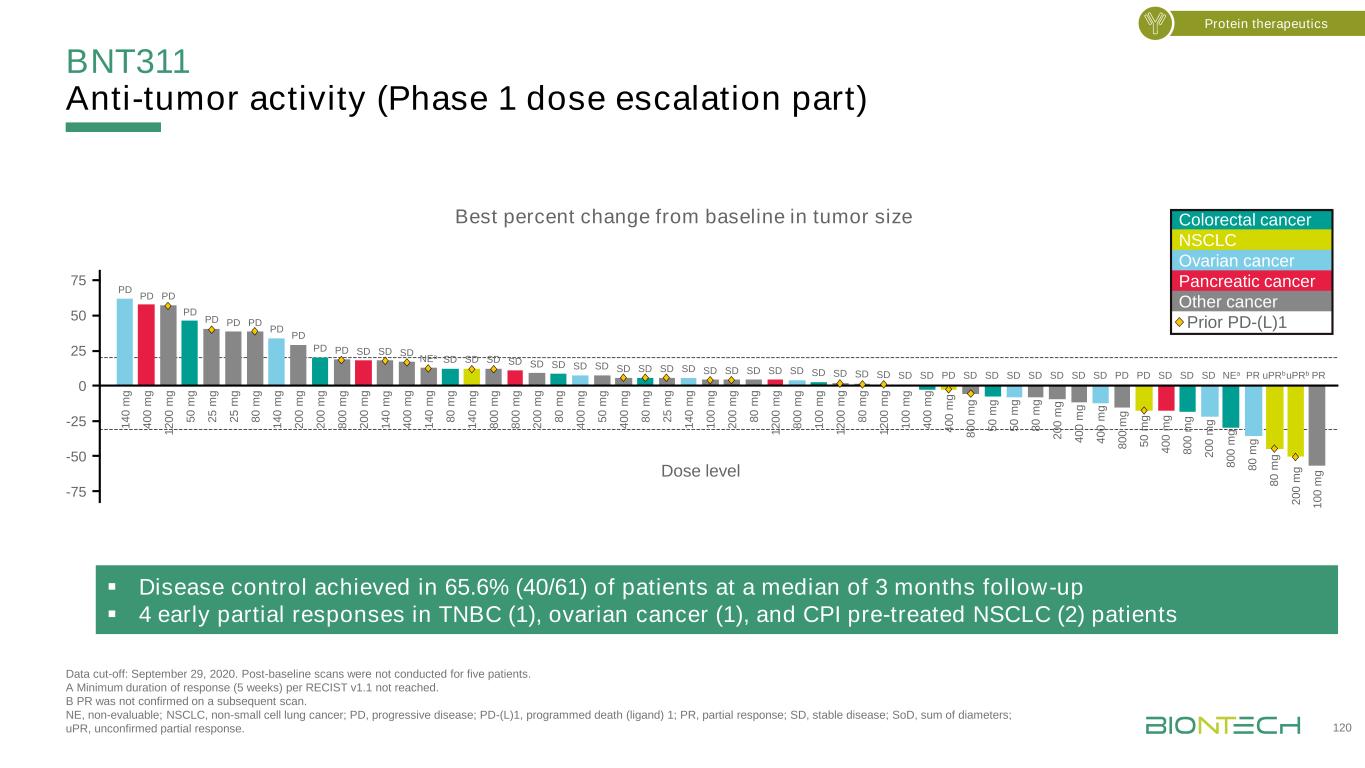
BNT311 CPI患者的臨牀活動-復發/難治性NSCLC數據截止日期:2020年10月12日。*PR未經隨後的掃描確認。所有患者都接受了≥-1基線後腫瘤評估(每6周進行一次),因此可以進行臨牀受益評估;12名患者中有6名仍在接受治療。NA,不可用,NE,不可評估;PD,進展性疾病;PR,部分反應;SD,穩定期;SOD,直徑總和;UPR,未證實的部分反應。Garralda E,et al.SITC 2020年年會;海報展示412。121例蛋白質療法·NSCLC擴展隊列中的12名可評估患者,其中2名經歷PR;1名UPR;4名SD靶病變較基線有PD(L)-1(n=12)的NSCLC患者(n=12)*有PD(L)-1(n=12)的NSCLC患者腫瘤大小較基線有最佳變化
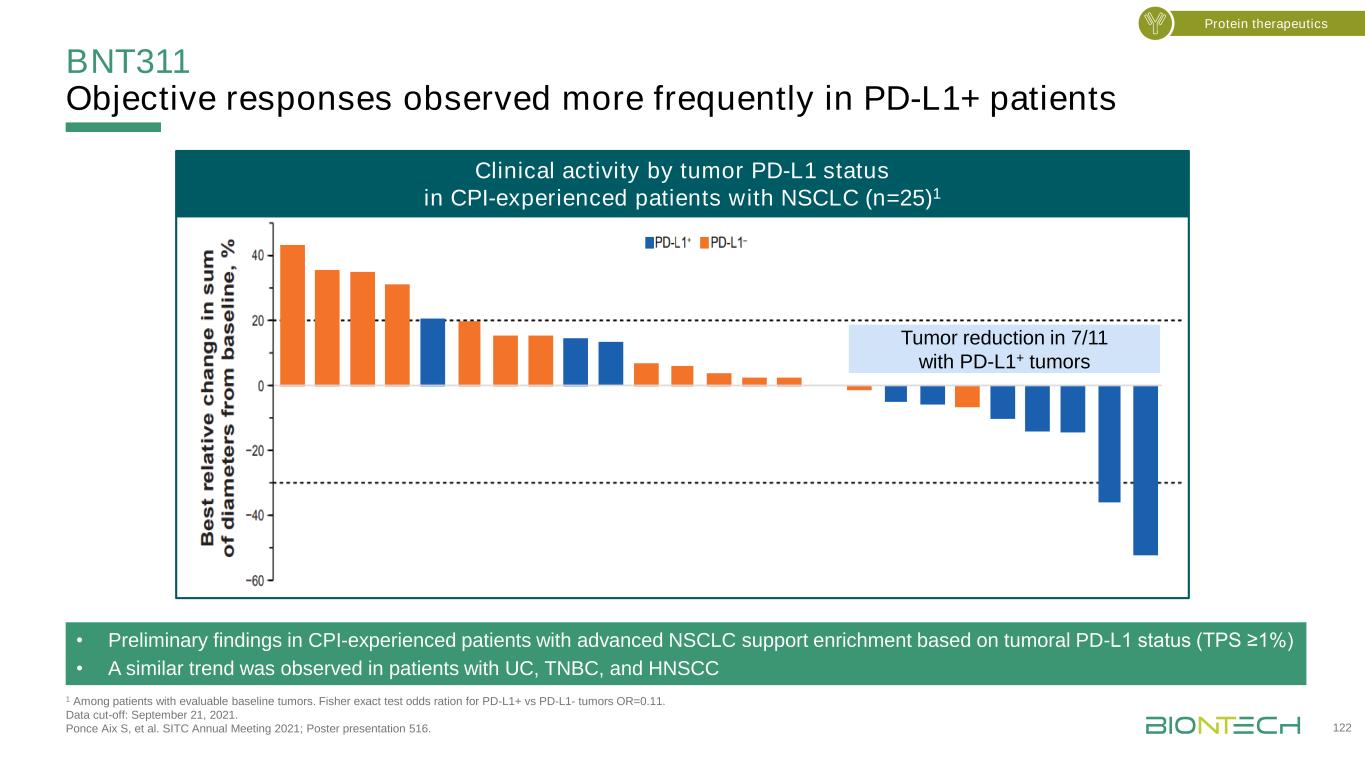
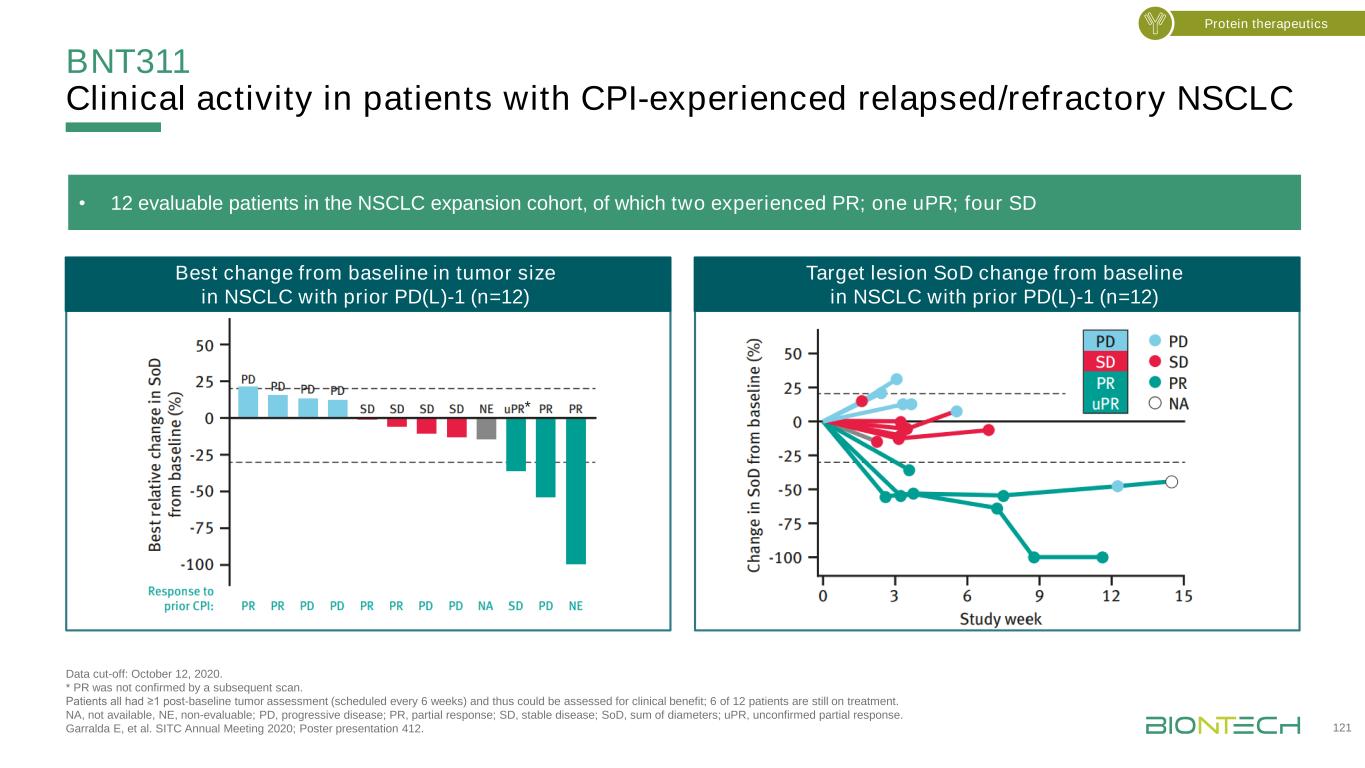
BNT311在PD-L1+患者中觀察到更頻繁的客觀反應1在可評估的基線腫瘤患者中。Pd-L1+與Pd-L1-腫瘤的Fisher確切檢驗優勢比OR=0.11。數據截止日:2021年9月21日。龐塞·艾克斯·S等人SITC 2021年年會;海報展示516。有CPI經歷的非小細胞肺癌患者中腫瘤PD-L1狀態的臨牀活性(n=25)1·有CPI經歷的非小細胞肺癌患者中基於腫瘤PD-L1狀態的晚期非小細胞肺癌支持增加的初步結果(Tps≥1%)·在UC、TNBC和HNSCC患者中觀察到類似的趨勢,7/11例PD-L1+腫瘤患者腫瘤減少

PD-L1×4-1BB雙特異性與PD-1拮抗劑聯合應用可提高臨牀前模型的活性1當
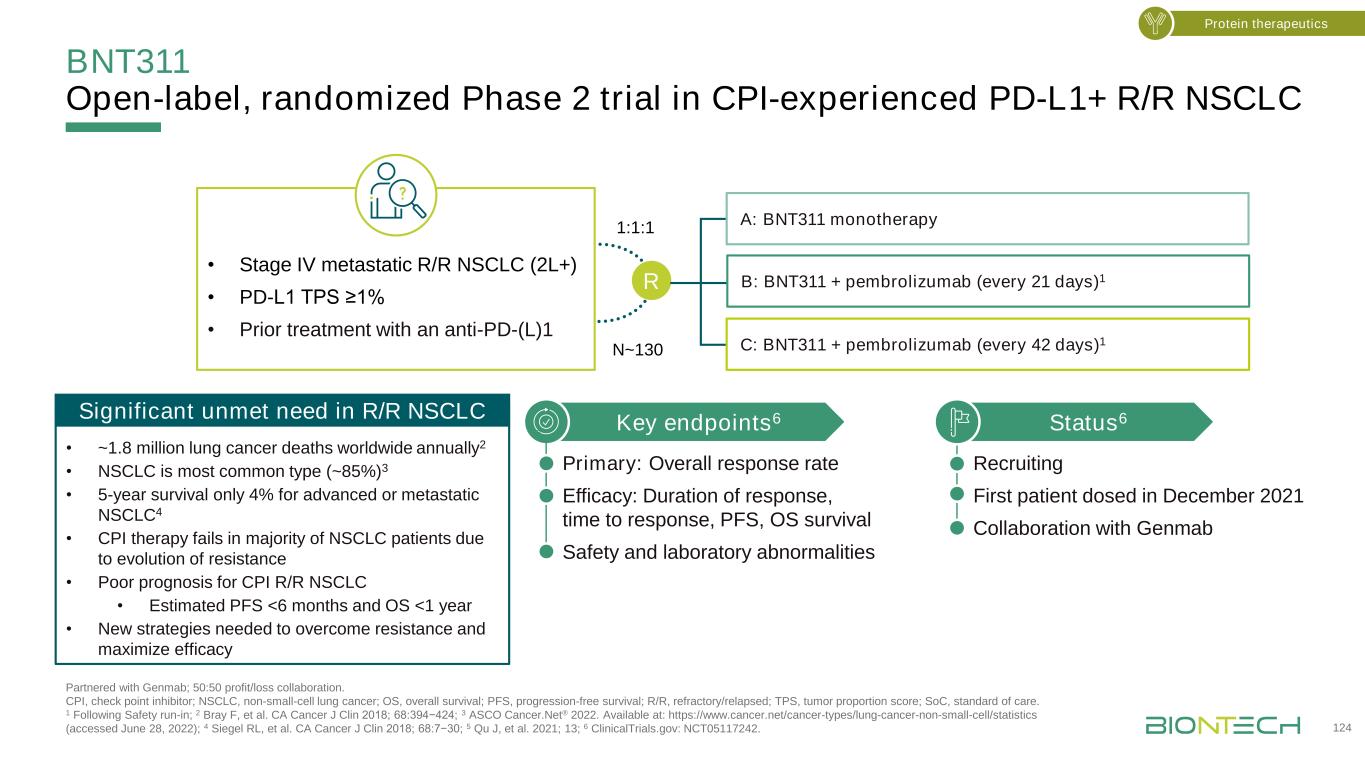
BNT311在CPI經驗豐富的PD-L1+R/R非小細胞肺癌與Genmab合作的開放標籤隨機第二階段試驗;50:50盈虧協作。CPI,檢查點抑制物;NSCLC,非小細胞肺癌;OS,總生存期;PFS,無進展生存期;R/R,難治/復發;TPS,腫瘤比例評分;SOC,護理標準。1遵循安全磨合;2 Bray F等人。《美國癌症雜誌》2018年;68:394ASCO424;3ASCO Cancer.net−2022年。可從以下網站獲得:https://www.cancer.net/cancer-types/lung-cancer-non-small-cell/statistics(2022年6月28日訪問);4Siegel RL等人。《加州癌症雜誌》2018年;68:7−30;5 QUJ等人。2021;13;6 ClinicalTrials.gov:NCT05117242。蛋白質療法·IV期轉移性R/R非小細胞肺癌(2L+)·PD-L1 TPS≥1%·接受抗PD-(L)1狀態治療6招募2021年12月給藥的第一名患者與Genmab關鍵終點合作6主要:總應答率療效:反應持續時間、反應時間、PFS、OS生存安全性和實驗室異常N~130 R 1:1:1 A:BNT311單一療法B:BNT311+培溴珠單抗(每21天)1 C:BNT311+培溴珠單抗(每42天)全球每年1~180萬肺癌死亡2·非小細胞肺癌是最常見的類型(~85%)3·5年生存率晚期或轉移性非小細胞肺癌僅4%·CPI治療在大多數非小細胞肺癌患者中由於耐藥性的演變而失敗·CPI R/R非小細胞肺癌預後不良·估計PFS

BNT312雙特異性抗體旨在增強T細胞和APC突觸BNT312(Gen1042)與Genmab基於50/50分享成本和利潤的合作;1 Muik A等。J免疫其他癌症2022;0:e004322。DOI:10.1136/JITC2021-004322。125蛋白質治療藥物惰性FC、雙條件、雙CD40×4-1BB激動劑有條件CD40-刺激APC和有條件4-1BB介導的T細胞刺激·兩個臨牀前驗證靶點的“雙條件”“雙激動劑”分子:·CD40:主要表達於APC的刺激受體。CD40的參與導致APC·4-1BB的激活和成熟:表達在T細胞和NK細胞上的共刺激腫瘤壞死因子。激活4-1BB途徑可促進T細胞增殖、增強T細胞效應功能並防止T細胞死亡·惰性Fc可避免不需要的免疫細胞交聯(BNT312)BNT311結合親和力:KD CD40 1.0nmol/L,4-1BB:0.17nmol/L
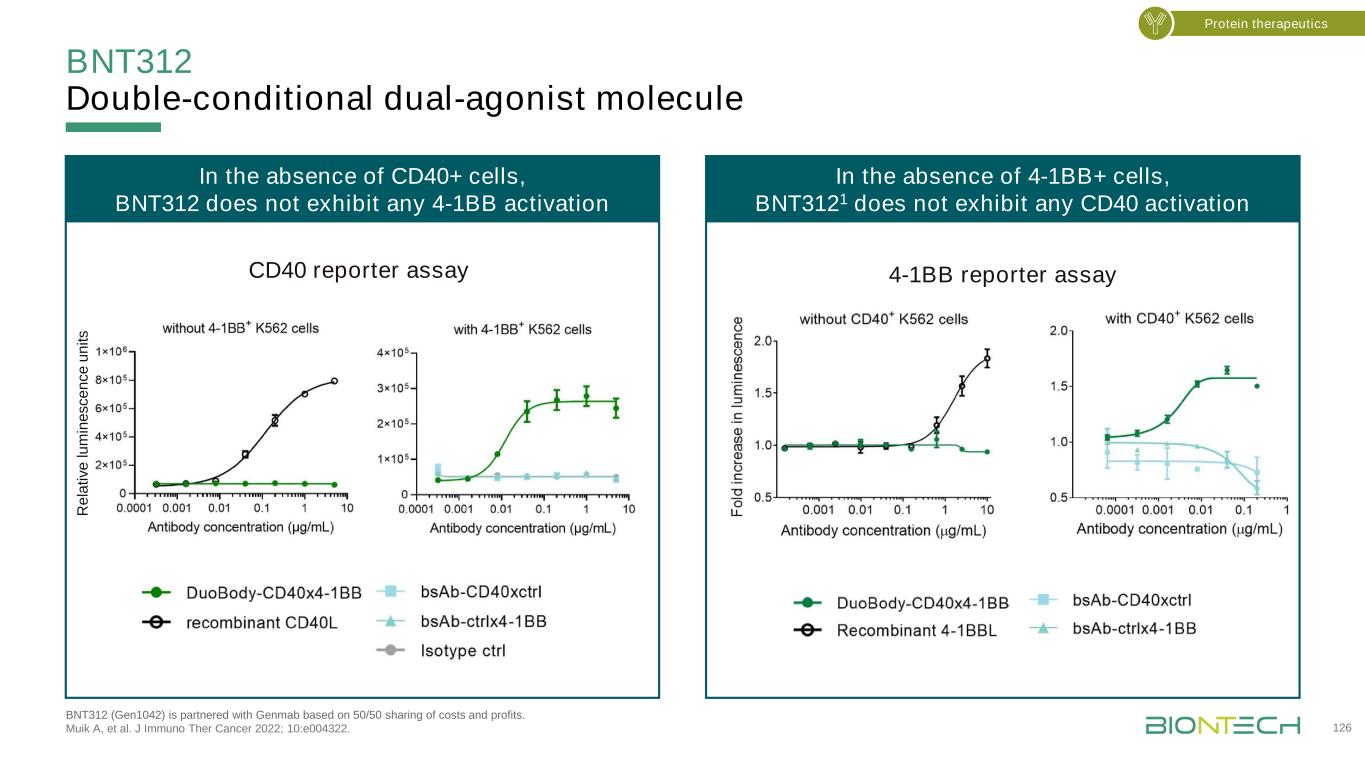
BNT312雙條件雙激動劑分子BNT312(Gen1042)與Genmab合作,成本和利潤各佔一半。Muik A等人的研究成果。J免疫治療癌症2022;10:e004322。126蛋白質療法在沒有CD40+細胞的情況下,BNT312在沒有4-1BB+細胞的情況下不表現出任何4-1BB激活,BNT3121不表現出任何CD40激活CD40報告實驗4-1BB報告實驗
BNT312增強了IDC的T細胞和APC 127單Z平面之間的交聯,在Alexa Fluor 647-偶聯的DuoBody-CD40.4-1BB(洋紅)和LFA-1(綠色)抗體的存在下,IDC與預激活的CD8+T細胞共培養,在x和y軸上,同一圖像的z堆疊與相對放大。在DuoBody-CD40.4-1BB或對照抗體存在的情況下,用Hoechst(藍色)共培養的代表性熒光圖像對細胞核進行反染。白虛線=DC和T細胞之間的界面加強的交聯蛋白療法BNT312(Gen1042)與Genmab基於50/50的成本和利潤分擔而建立合作伙伴關係。Muik A等人的研究成果。J免疫治療癌症2022;10:e004322。
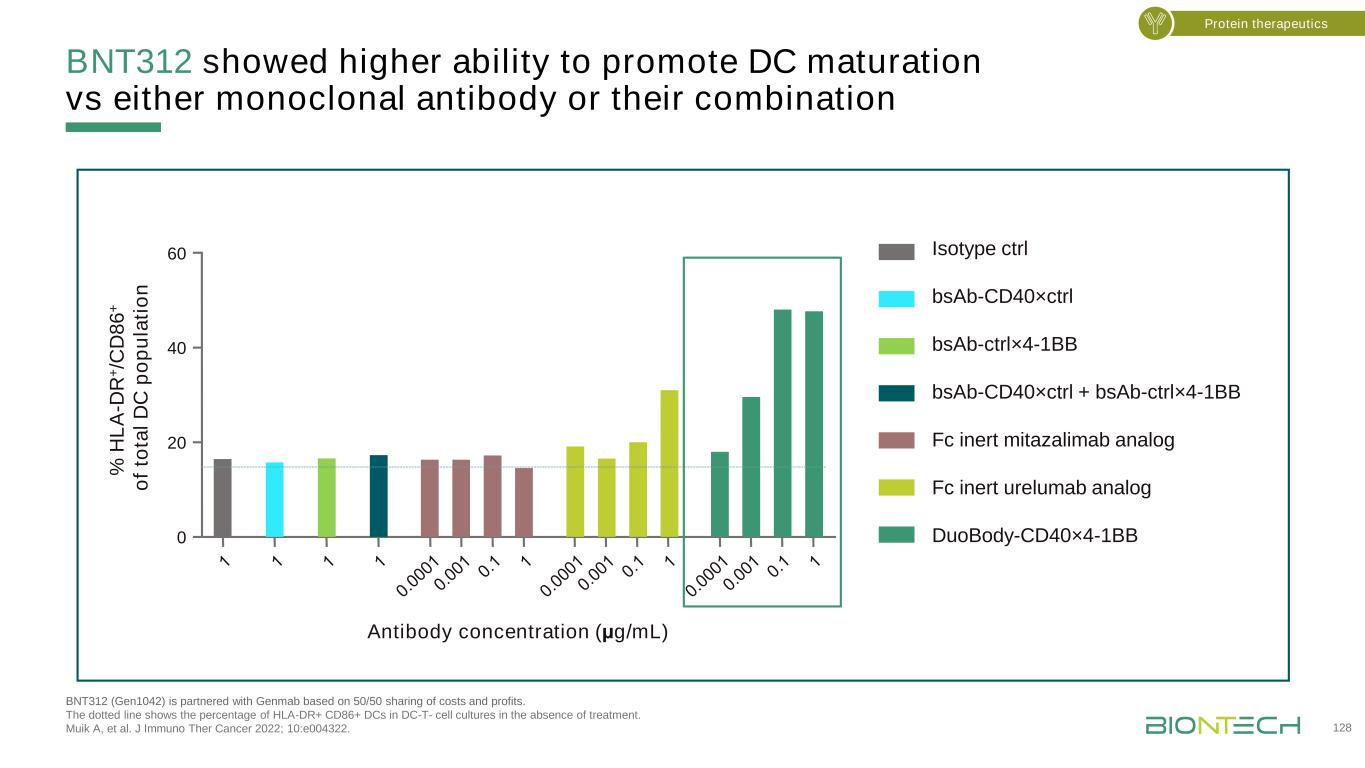
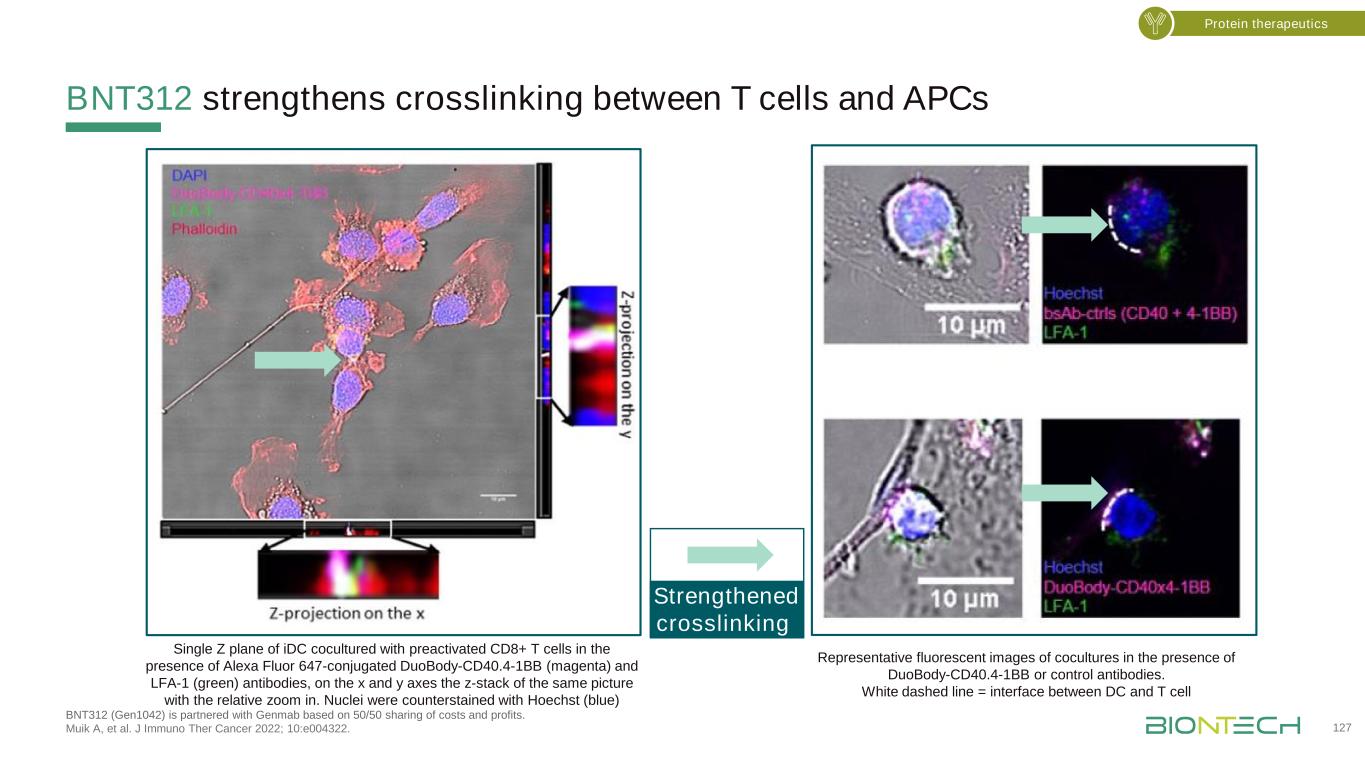
BNT312具有更強的促進DC成熟的能力,BNT312(Gen1042)與Genmab的結合體BNT312(Gen1042)與Genmab按50/50的成本和利潤分攤。虛線顯示未經治療的DC-T細胞培養中人類白細胞抗原DR+CD86+DC的百分比。Muik A等人的研究成果。J免疫治療癌症2022;10:e004322。12 8 0 20 40 60抗體濃度(μg/m L)%H LA-D R+/CD D 8 6+抗Ta l D C p o p u la ti n同型ctrl bsAb-CD40×ctrl bsAb-ctrl×4-1BB bsAb-CD40×ctrl+bsAb-ctrl×4-1BB Fc惰性米他那利單抗類似物Fc惰性urelumab類似物雙抗體-CD40×4-1BB蛋白治療
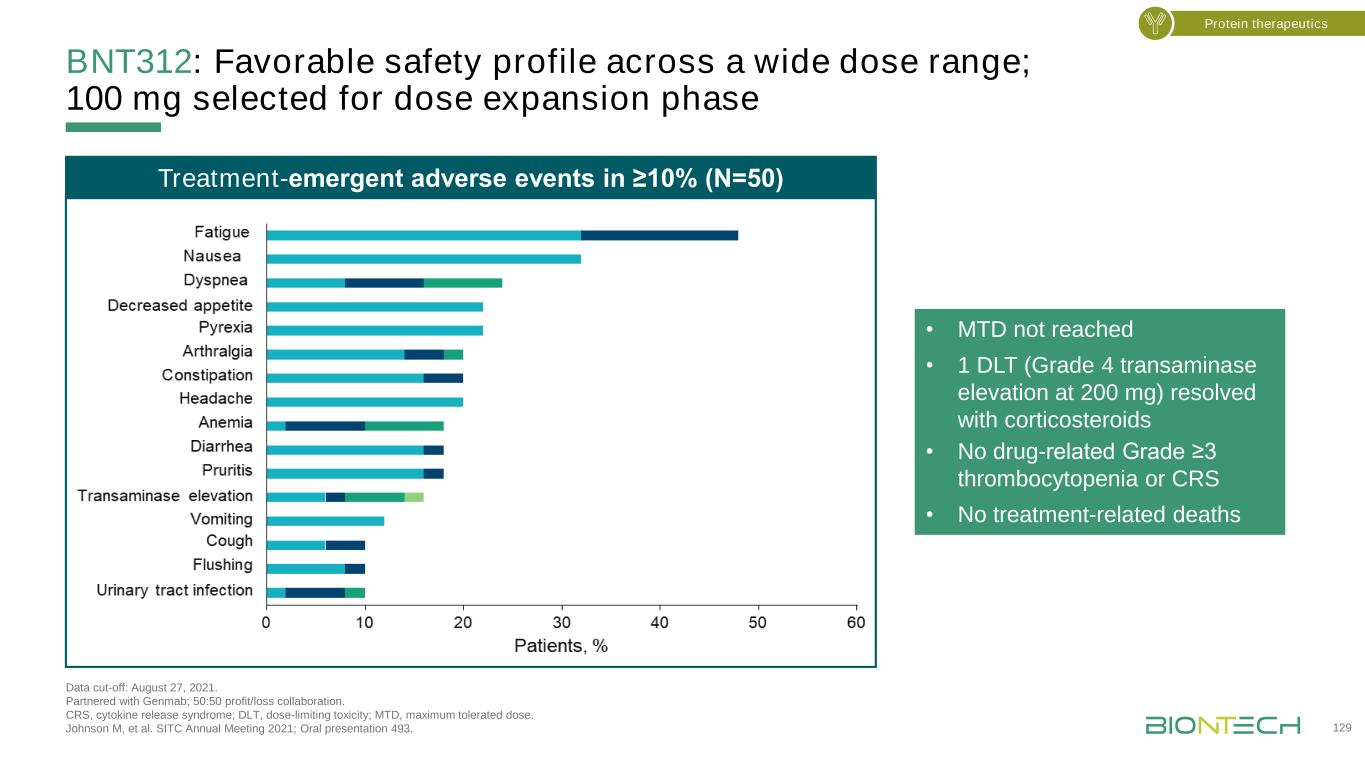
BNT312:在廣泛的劑量範圍內具有良好的安全性;選擇100毫克作為劑量擴展階段數據截止日期:2021年8月27日。與Genmab合作;50:50盈虧協作。CRS,細胞因子釋放綜合徵;DLT,劑量限制性毒性;MTD,最大耐受量。Johnson M,et al.SITC 2021年年會;口頭陳述493。蛋白質療法·MTD未達到·1DLT(4級轉氨酶升高200毫克)可用皮質類固醇解決·沒有藥物相關的≥3級血小板減少症或CRS·沒有治療相關的死亡-≥10%的緊急不良事件(N=50)
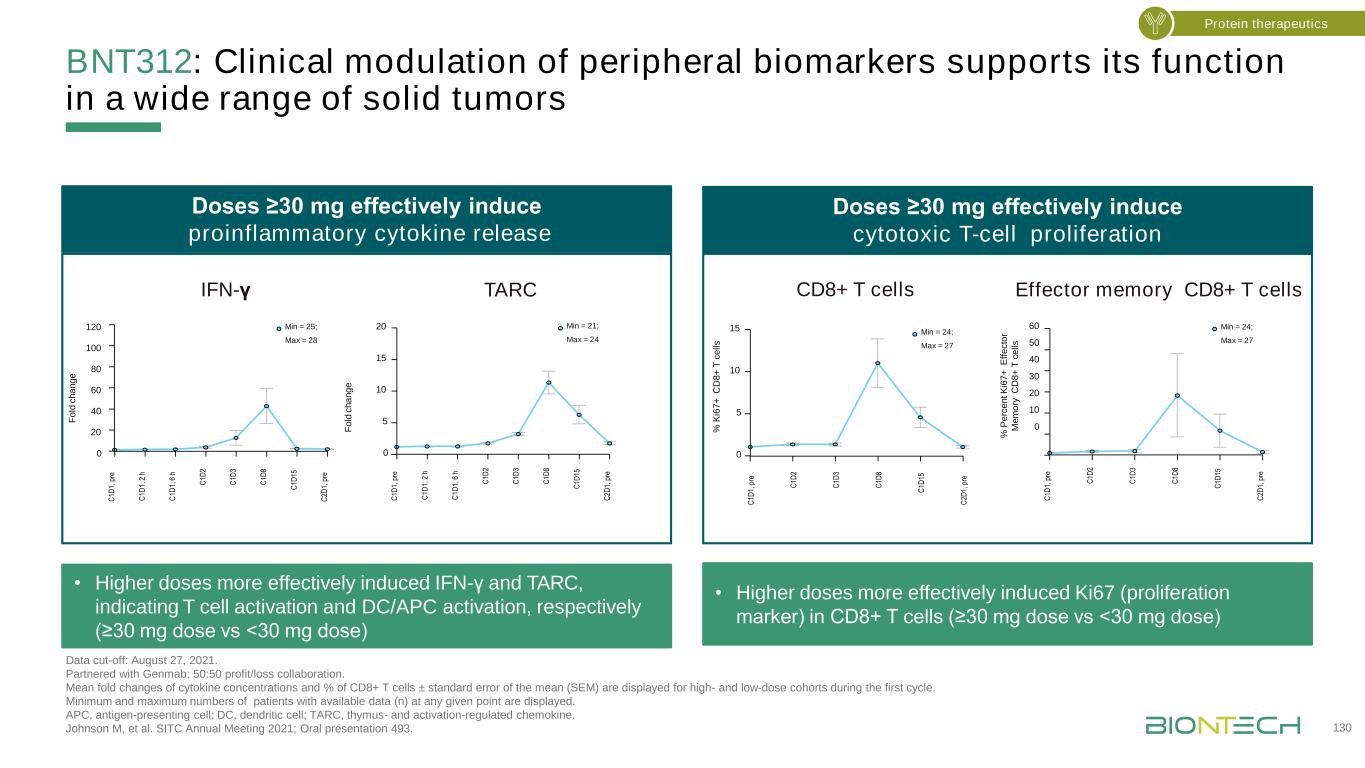
BNT312:外周生物標記物的臨牀調節支持其在廣泛實體腫瘤中的功能數據截止日期:2021年8月27日。與Genmab合作;50:50盈虧協作。在第一個週期中,高劑量和低劑量隊列的細胞因子濃度和CD8+T細胞百分比±平均標準差(SEM)的平均倍數變化。顯示在任何給定點具有可用數據(N)的最小和最大患者數。APC,抗原提呈細胞;DC,樹突狀細胞;TARC,胸腺和激活調節的趨化因子。Johnson M,et al.SITC 2021年年會;口頭陳述493。1 3 0蛋白質療法12 0 0 80 6 0 40 2 0 0 Min=2 5;Max=2 8C1D1,Pr e C1D1,2 h C1D1,6h C1D2C1D3C1D8C1D15C2D1,Pr e Fo ld ch an g e 60 5 0 40 30 2 0 10 0 C1D1,Pr e C1D2 C1D3C1D8C1D15C2D1,Pr鄂敏=2 4;MAX=2 7 0 5 10 15 2 0 C1D 1,Pr e C 1D 1,2 h C 1 D 1,6 h C 1D 2 C 1D 3 C 1D 8 C 1D 15 C 2 D 1,Pr鄂敏=2 1,M ax=2 4 F o d c h a n g e 0 5 10 15 Min=2 4;MAX=27C1D1C1D3C1D8C1D15C2D1,Pre%KI67+CD8+Tcell s劑量≥30 mg可有效誘導促炎細胞因子的釋放·高劑量更有效地誘導幹擾素-≥和γ,分別表明T細胞激活和DC/APC激活(Pre%KI6 7+CD8+T cEll s劑量vs.
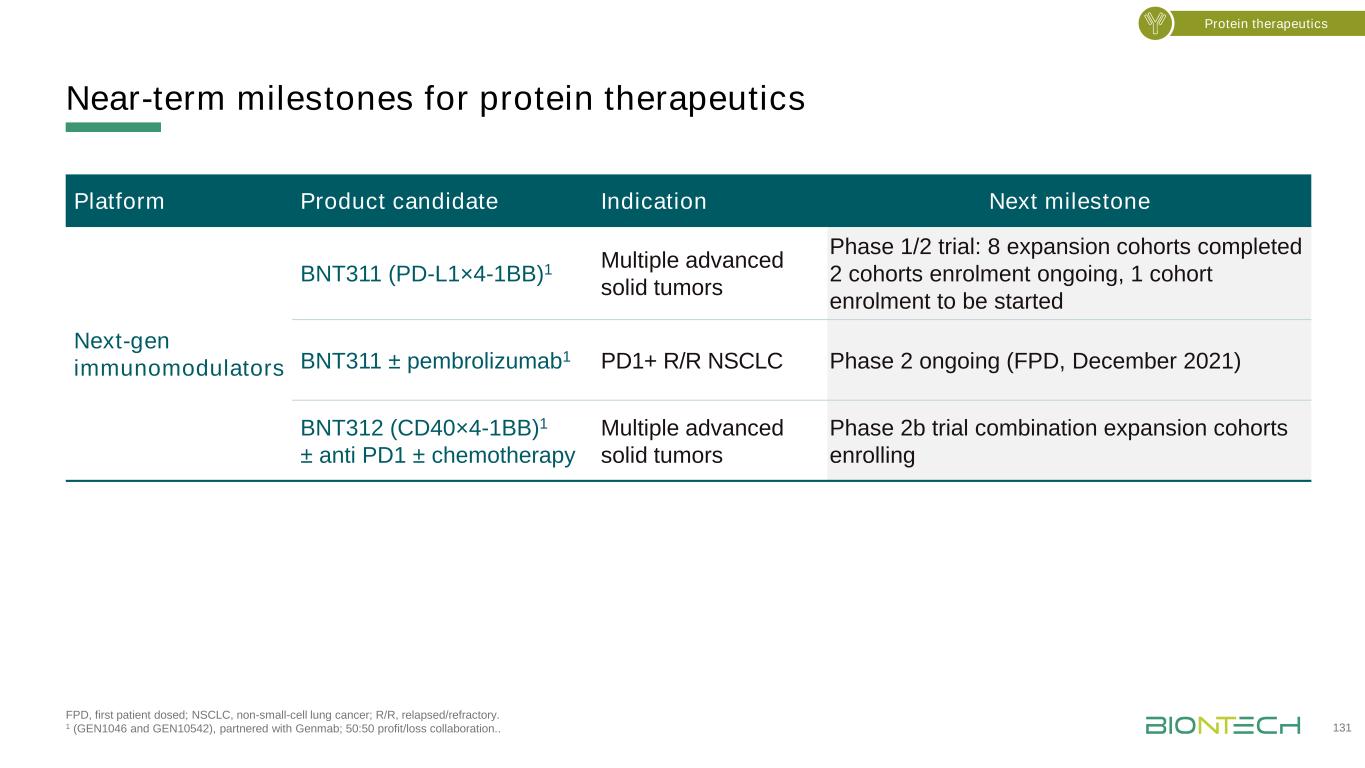
FPD,首次給藥;非小細胞肺癌,非小細胞肺癌;R/R,復發/難治。1(GEN1046和GEN10542),與Genmab合作;50:50盈虧協作。蛋白質療法近期里程碑131蛋白質療法平臺候選產品適應症下一個里程碑下一代免疫調節劑BNT311(PD-L1×4-1BB)1多種晚期實體瘤1/2期試驗:8個擴展隊列已完成2個隊列招募正在進行,1個隊列招募將開始BNT311±Pembrolizumab1 PD1+R/R NSCLC第2期正在進行(FPD,2021年12月)BNT312(CD40×4-1BB)1±抗PD1±化療多個晚期實體腫瘤2b期聯合試驗擴展隊列正在招募
將細胞治療擴展到實體瘤

開發3個自體細胞治療平臺並解決新靶點,Reinhard K等人。科學2020;367:446-453133新嵌合抗原受體(CAR)1 T細胞受體(TCR)CARVac·針對細胞外靶點的自體工程細胞療法+rna-LPX疫苗·針對新抗原的個性化體外T細胞療法·針對細胞內外靶點的工程細胞療法·正在開發的個性化TCR-T領先計劃:BNT211針對CLDN6的CARVac計劃:BNT221跨多實體腫瘤計劃:KRAS,PRAME TCRs細胞治療αCLDN6 scFCD8鉸鏈4-1BB CD3ζαβεδεγ

·針對癌症特異性癌-胚胎抗原CLDN6的第二代CAR·CLDN6在具有高醫療需求的多種實體癌症中表達·CAR T BNT211的體內擴展、持久性和有效性:評估針對CLDN6、CLADIN 6的下一代CAR T與CARVac在實體瘤CLDN6、CLADIN 6中的1/2試驗;E15,胚胎第15天;E1,細胞外環;P0,出生時。萊因哈德·K等人。科學2020;367:446-453。134CAR-T細胞治療+CARVac RNA疫苗體內擴增CAR T細胞αCLDN6scFvCD8鉸鏈4-1BB CD3ζ在tr a c e ll u la r E x tr a c e ll u la r E x tr a c e ll u la r r細胞治療多種癌症中未見表達的Claudin-6在多種癌症中表達的第二階段試驗計劃於2023年在睾丸癌卵巢癌中命名為EMA Prime
BNT211 16名接受大量預治療的患者在試驗數據截止日期:2022年3月10日。CLDN6,Claudin 6;Dl,劑量水平。Haanen J,et al.AACR 2022年年會;口頭報告CT002。135名患者特徵單一治療DL1(n=3)聯合DL1(n=3)單一治療DL2(n=6)聯合DL2(n=4)總計(n=16)中位年齡、年齡(範圍)33(25-68)41(27-56)56(35-66)44(23-61)46(23-68)性別(男/女)癌症類型n/n 2/1 3/03/3 2/2 10/6N睾丸卵巢子宮內膜輸卵管肉瘤胃1 1 0 0 1 0 3 0 0 0 2 1 1 1 0 1 2 2 0 0 0 8 4 1 11 1中位CLDN6 II/III+細胞百分比(範圍)60(60-80)90(90-95)82.5(50-90)95(75-100)85(50-100)治療前中位數(範圍)4(3-5)4(3-4)5(2-7)5(3-7)4(2-7)
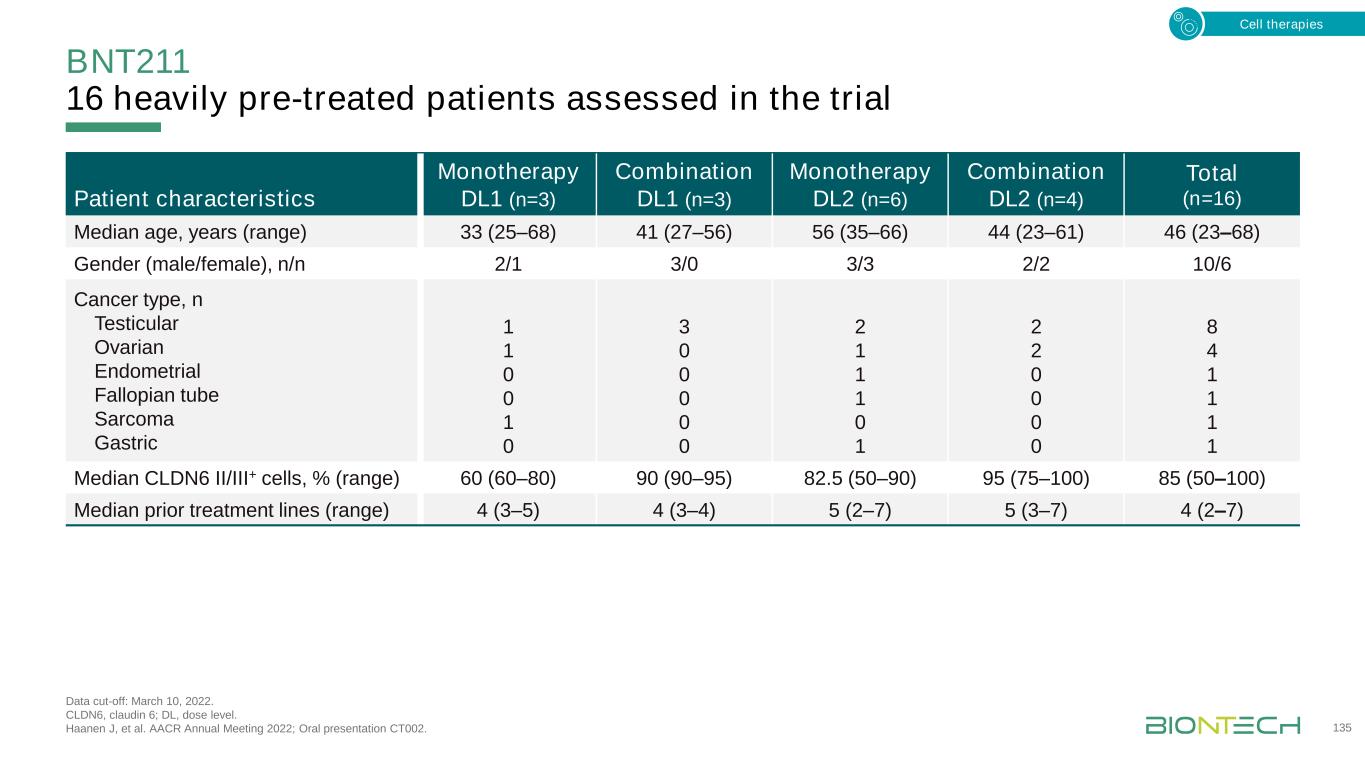
BNT211在評估數據截止的劑量水平上耐受性良好:2022年3月10日。不良事件;CAR,嵌合抗原受體;CARVac,CAR T細胞放大RNA疫苗;CRS,細胞因子釋放綜合徵;DL,劑量水平;DLT,劑量限制性毒性;HLH,噬血細胞淋巴組織細胞增多症;ICANS,免疫效應細胞相關神經毒性綜合徵;SAE,嚴重AE。Haanen J,et al.AACR 2022年年會;口頭報告CT002。136次單一治療DL1(n=3)聯合DL1(n=3)單一治療DL2(n=6)聯合DL2(n=4)總(n=16)隨訪天數(範圍)284(111-348)38(29-156)157(99-241)93(52-127)127(2-348)次CARVac注射中位數,n(範圍)N/A 2(1-6)N/A 4(3-5)N/A安全性,N單一治療DL1(n=3)聯合DL1(n=3)單一治療DL2(n=6)聯合DL2(n=4)總計(n=16)DLTS 0 0 1 12 2例≥3 AE3 3 3 5 4 15 AEs 3懷疑與BNT211 4 8 11 2 2 45例CRS 0 1 4 3 8例ICAN 0 1 0 1死亡疾病進展SAE 1 0 2 0 2 0 0 0 5 0·2 DLT觀察:淋巴清除後全血細胞減少延長(單一治療DL2)和HLH(聯合DL2,開始CARVAC前)·所有CRS均為1或2級;據報道,70%的DL2患者可通過使用tocilizumab(如果需要)細胞療法進行治療
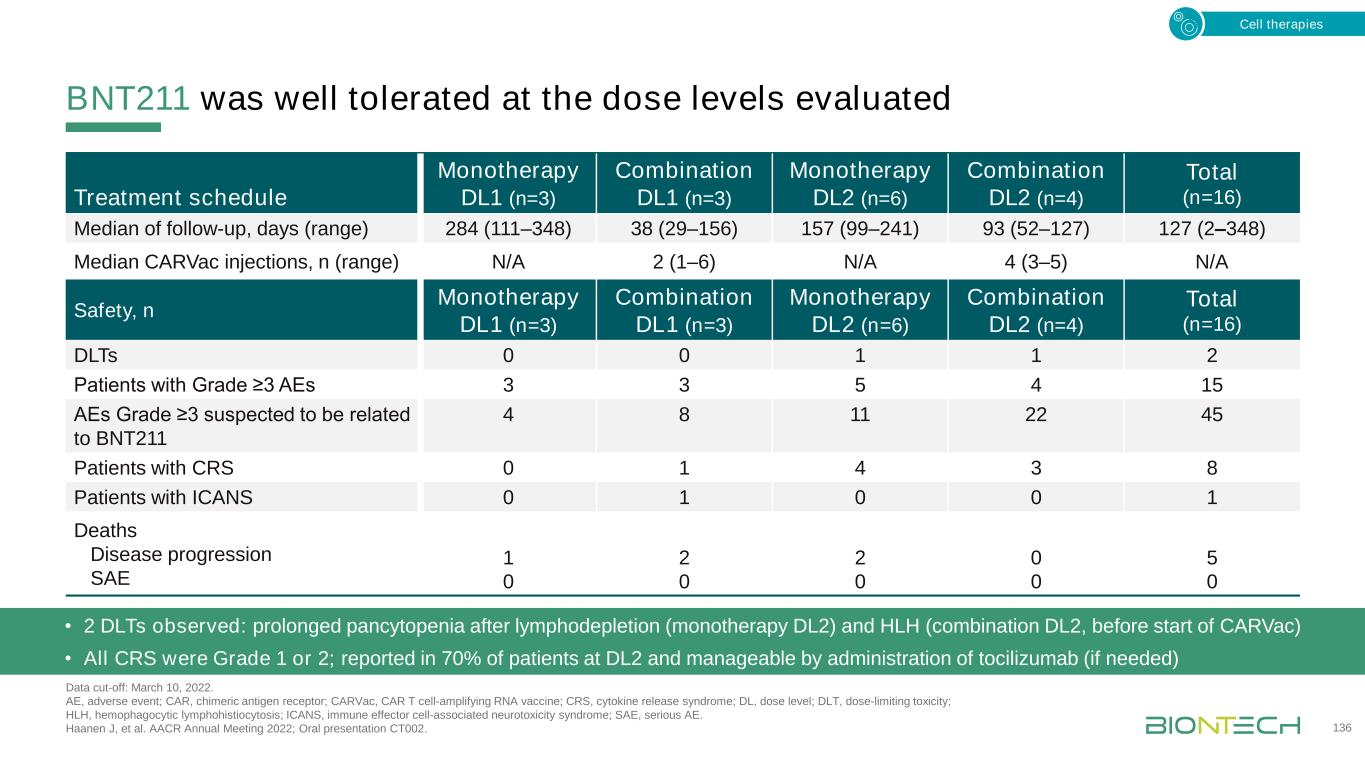
BNT211,ORR 43%,DCR 86%(PR 6例,SD+5例,SD 1例),截止時間:2022年3月10日;首次評估,輸注後6周。ACT,過繼細胞轉移;CR,完全緩解;DCR,疾病控制率;EoT,試驗結束(由於PD);PD,進展性疾病;PR,部分反應;SD(+),穩定疾病(目標皮損縮小)。Haanen J,et al.AACR 2022年年會;口頭報告CT002。137ACT 6周12周18周24周PR SD+PD CR PAT#1 PAT#2 PAT#3 30周36周PAT#1 Mono DL1 Combo DL1 Mono DL2 42周48周EoT Mono→組合PAT#1 PAT#2 PAT#3 PAT#4 PAT#5 PAT#2 Combo DL2 SD PAT#6 PAT#5 PAT#6修復PAT#3 PAT#4其他不包括不可評估的PAT#1(50%淋巴清除)在DL2睾丸癌(n=5,包括減少LD):最佳總體應答率̶80%,DCR100%(1個CR,3個PR,1個SD+)細胞療法
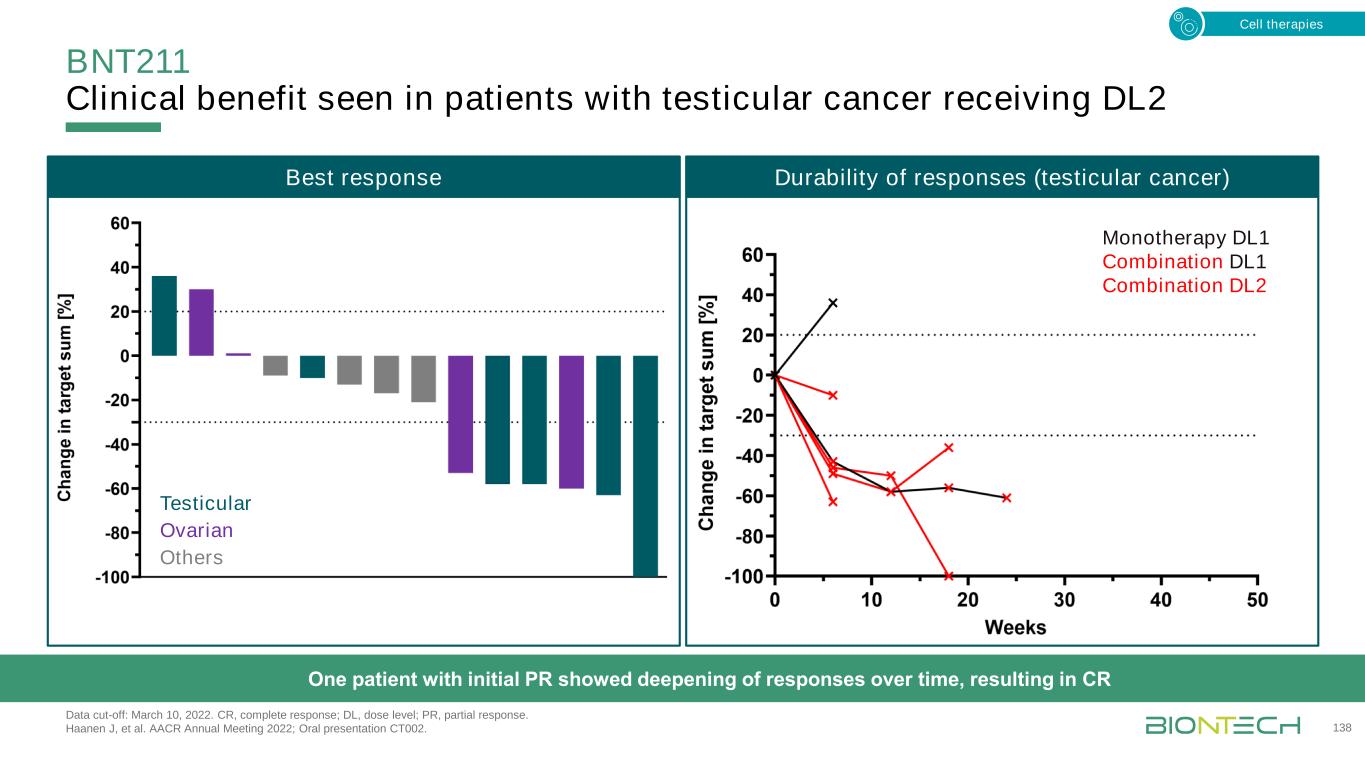
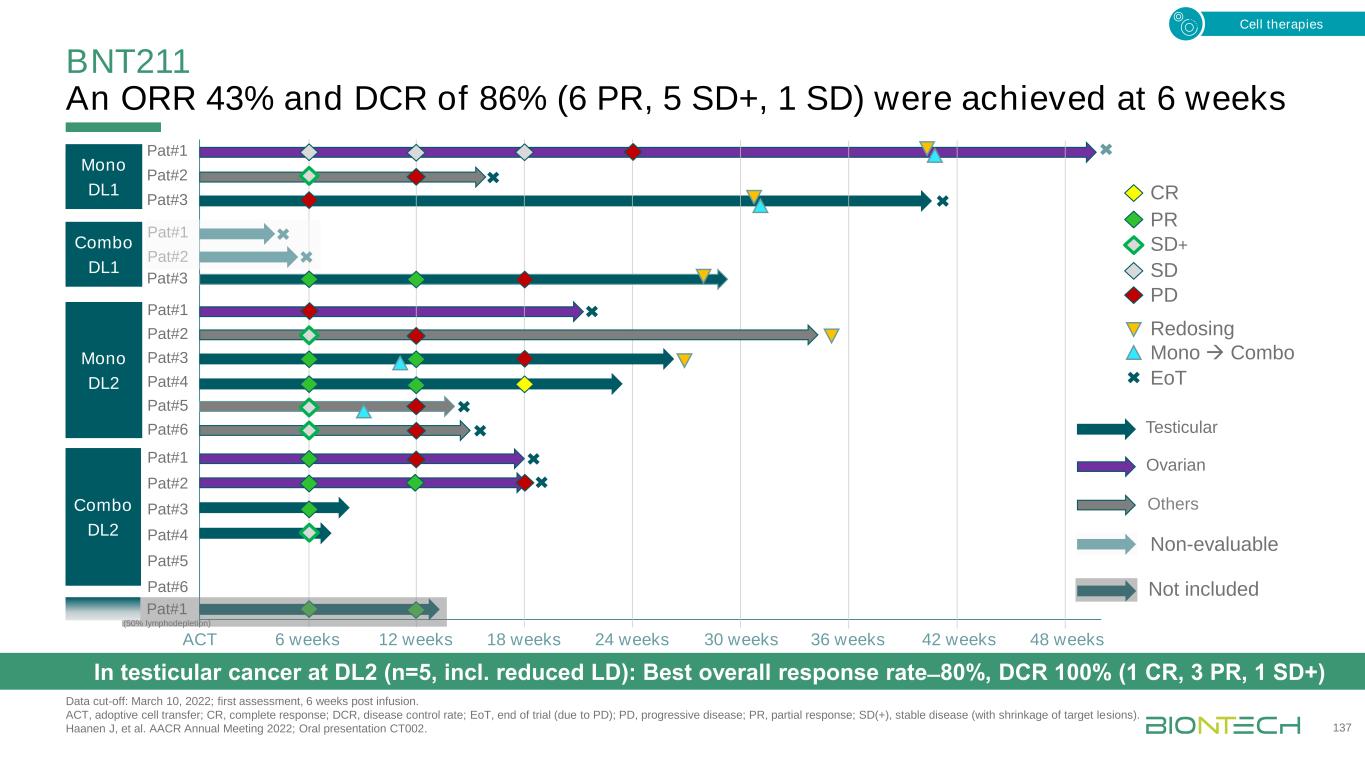
接受DL2數據截止的睾丸癌患者的BNT211臨牀益處:2022年3月10日。CR,完全反應;DL,劑量水平;PR,部分反應。Haanen J,et al.AACR 2022年年會;口頭報告CT002。138個睾丸卵巢其他一個初次PR的患者隨着時間的推移表現出反應的加深,導致CR單一療法DL1聯合DL1聯合DL2細胞治療反應的最佳反應持久性(睾丸癌)

兩名睾丸癌患者的BNT211反應數據截止日期:2022年3月10日。甲胎蛋白;CAR,嵌合抗原受體;CARVac,CAR T細胞擴增RNA疫苗;CLDN6,claudin 6;CR,完全應答;d,天;DL,劑量水平。Haanen J,et al.AACR 2022年年會;口頭報告CT002。139 12周後掃描患者1 61歲男性確診2008(DL2:1×108)患者2 56歲男性確診2020(DL1:1×107+CARVac)輸注後6周基線12周後·未發現新病變·腫瘤標誌物(AFP)處於正常水平·正在進行CR·在初步應答後,發現新病變·治療中活檢顯示CLDN6陽性·再次接受d197細胞治療
BNT221:NEO-STIM是一種個體化的新抗原靶向策略,解決了腫瘤浸潤性淋巴細胞療法的侷限性1,Velez D等人。SITC 2021年年會,海報展示201;2 Lenkala D,等人。SITC 2020年年會,海報展示153。140針對每個患者的多種腫瘤新藥1 BNT221 BNT221+自體腫瘤**如果Nγ+d/或r C D 1 0 7a+(o f C D 8+p M H C+)15 10 5 0細胞因子反應·多靶點:降低抗原逃逸的風險·T細胞從外周血中誘導而不使用基因工程或病毒載體:降低毒性·跨實體腫瘤廣泛的臨牀機會BNT221細胞專門識別自體腫瘤2細胞療法
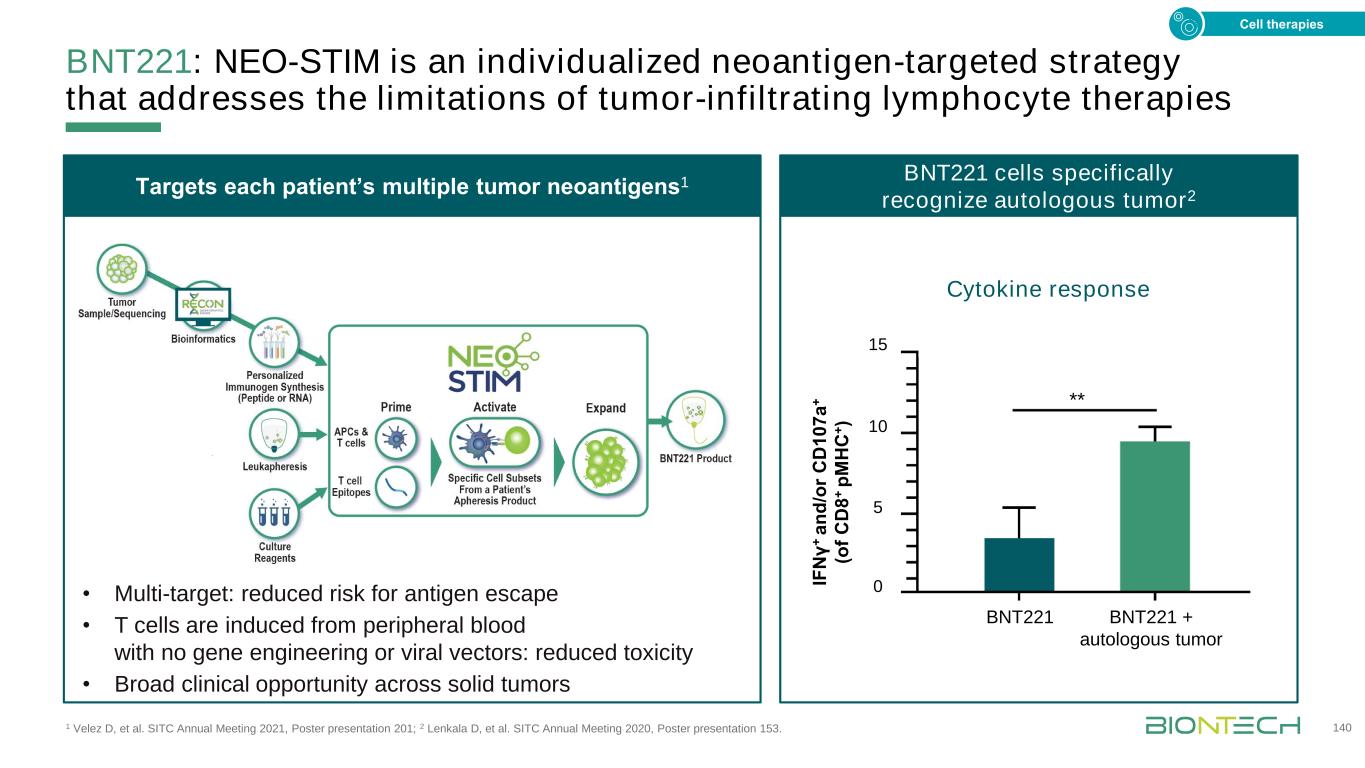
BNT221在PD-1難治性轉移性黑色素瘤患者中的1期試驗,Velez D等人。SITC 2021年年會,海報展示201;ClinicalTrials.gov:NCT04625205。141 A組劑量遞增(3×3)·無法切除或轉移性黑色素瘤·抗PD-1進展·接受抗CTLA-4狀態招募多達20名患者將在劑量擴展B組關鍵臨牀活動(ORR,反應持久性)免疫監測細胞存活·不可切除或轉移性黑色素瘤·穩定或無症狀進展抗PD-1±抗CTLA-4隊列B劑量擴展選定劑量細胞療法
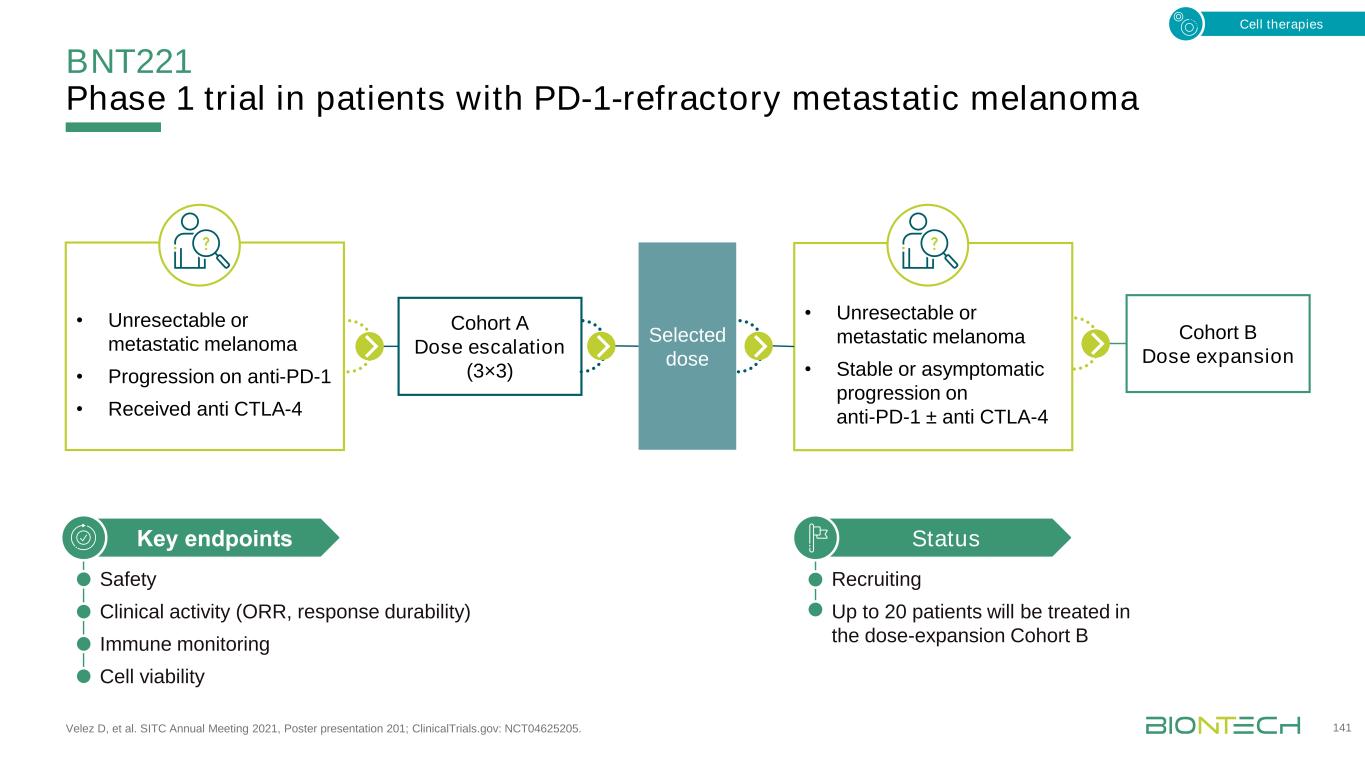
TCR發現平臺,用於腫瘤和患者特定的治療TCR,T細胞受體。142種細胞療法·技術迭代·與其他資產(例如核細胞因子)的結合·收購:PRAME-TCR和PD1-41BB Switch(Medigene,2022年2月)·TCR倉庫:多個TCR,針對一個或多個抗原·類庫方法,增加新的靶點和HL A等位基因·與Medigene研發合作·按需識別新表位,及時製造定製的T細胞·收購:新抗原TCR平臺(Kite,2021年7月)在實體瘤廣泛覆蓋患者的個性化治療中建立TCR平臺

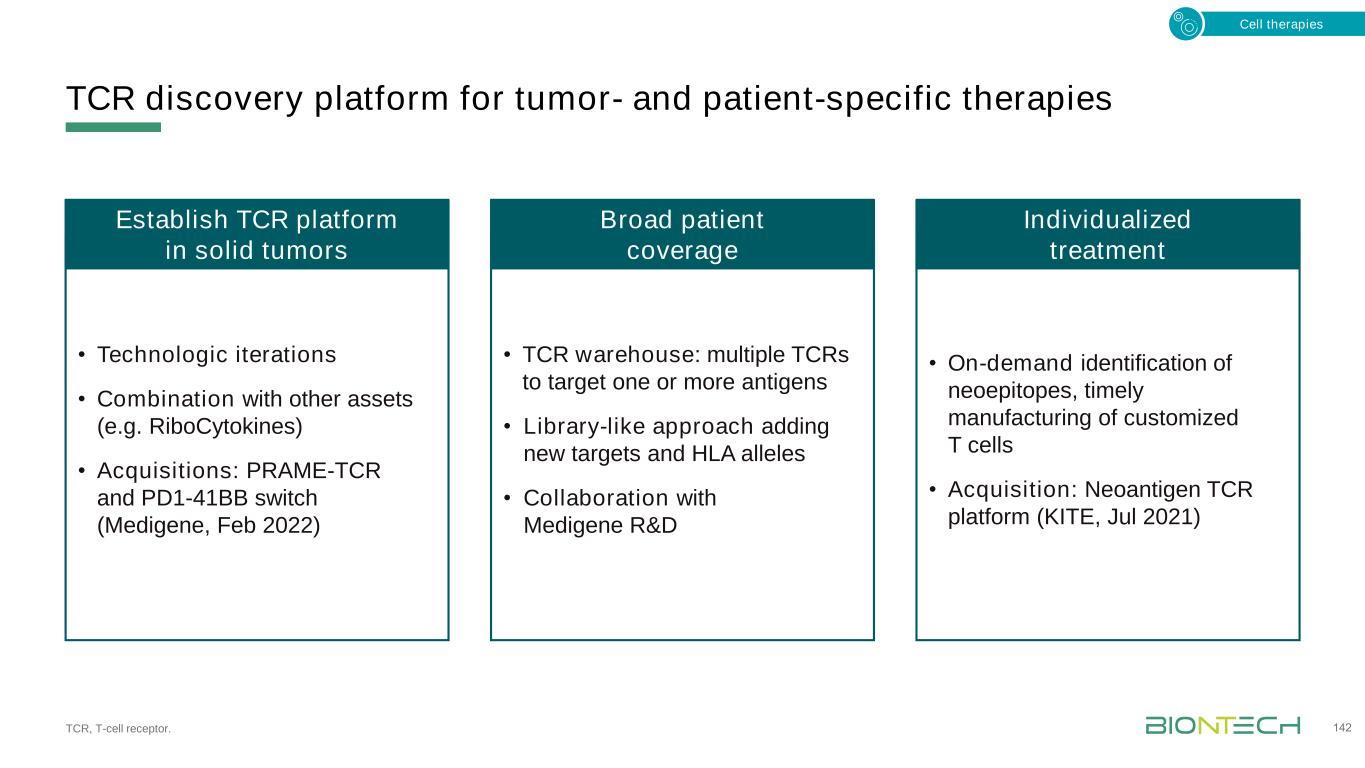
核細胞因子
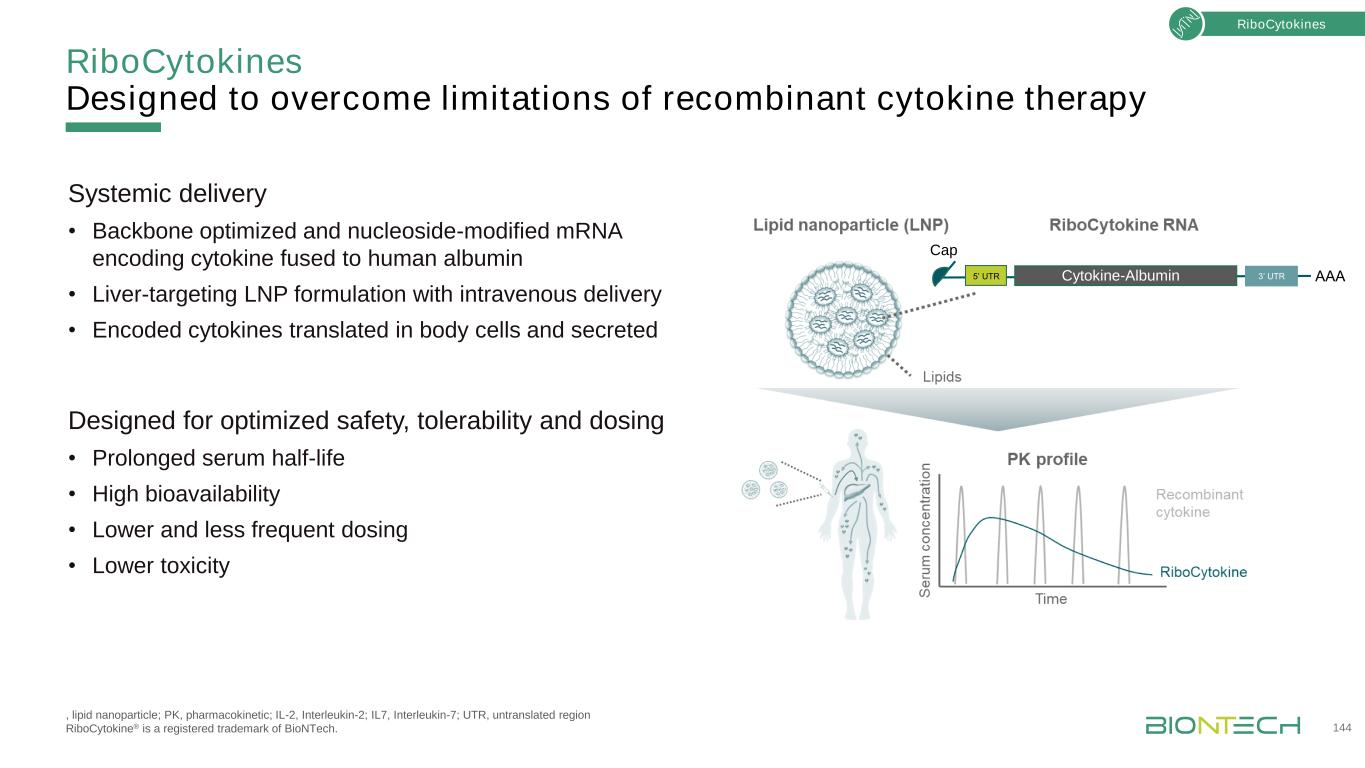
為克服重組細胞因子治療的侷限性而設計的核細胞因子,脂質納米粒;PK,藥代動力學;IL-2,白介素2;白介素7;非翻譯區核細胞因子®是BioNtech的註冊商標。144種核細胞因子系統遞送·骨架優化和核苷修飾的編碼細胞因子的mRNA與人白蛋白融合·肝靶向靜脈遞送LNP製劑·編碼的細胞因子在體內細胞中轉譯並分泌,以優化安全性、耐受性和劑量·延長血清半衰期·高生物利用度·更低和更少的給藥頻率·較低的毒性5‘UTR3’UTRAAA帽細胞因子-白蛋白

BNT151刺激CD8+和NK細胞,而不廣泛觸發Treg細胞Vormehr M等人。SITC 2019年年會;海報展示626。·與IL-2Rα的結合減弱·旨在刺激低表達或不表達IL-2Rα的幼稚和效應性T細胞(CD25low/neg),而不廣泛觸發免疫抑制調節性T細胞·增加與IL-2Rβ核細胞因子IL-2RαIL-2RβIL-2Rγ的結合
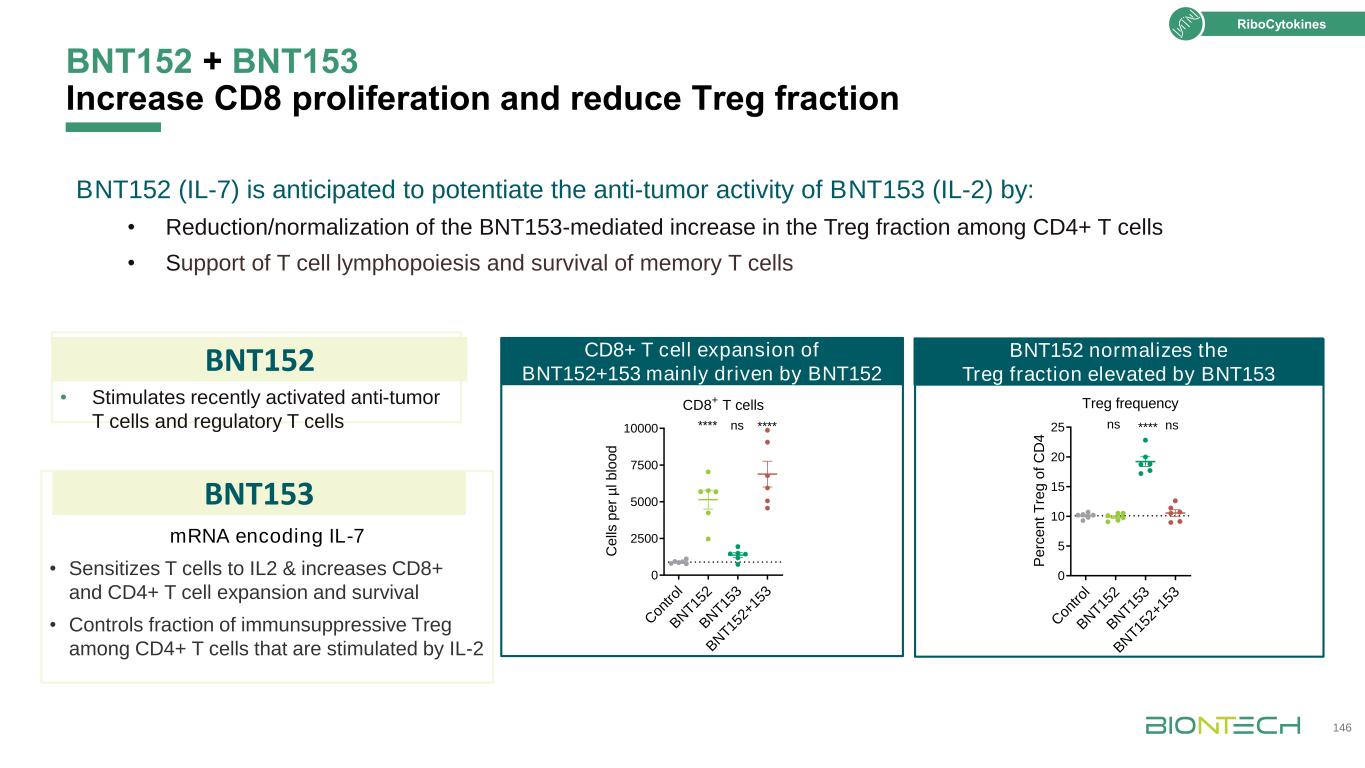
·刺激最近激活的抗腫瘤T細胞和編碼IL-7的調節性T細胞mRNA·增強T細胞對IL-2的敏感性,增加CD8+和CD4+T細胞的擴增和存活·控制IL-2刺激的CD4+T細胞中免疫抑制Treg的部分BNT152+BNT153促進CD8增殖和減少Treg部分146 BNT152 BNT153(IL-7)有望通過以下方式增強BNT153(IL-2)的抗腫瘤活性:·降低/正常化BNT153介導的CD4+T細胞中Treg比例的增加·支持T細胞的生成和記憶T細胞的存活在tro l B N T15 2 B N T15 2+15 3 B N T15 2 B N T15 3 B N T15 2+15 3 B N T15 2+15 3 0 5 10 15 20 20 25*nsCD8+T細胞C在tro l B N T15 2 B N T15 2 B N T15 3 B N T15 2+15 3 0 2 500 5000 7500 10000 ns上

BNT152+BNT153結合基因疫苗Kranz LM等人。SITC 2019年年會;海報展示620。147 BNT152聯合RNA疫苗在CT26模型中增強BNT153的治療抗腫瘤活性BNT152+BNT153在第二次治療後7天優先擴增疫苗誘導的CD8+T細胞1 10 10 100 1,000 10,000 10,000 CD8+T細胞,Cd 8+T細胞非E7特異性E7特異性*vac:BNT153:mIL7:IRR++E7+-E7-+E7+核細胞因子
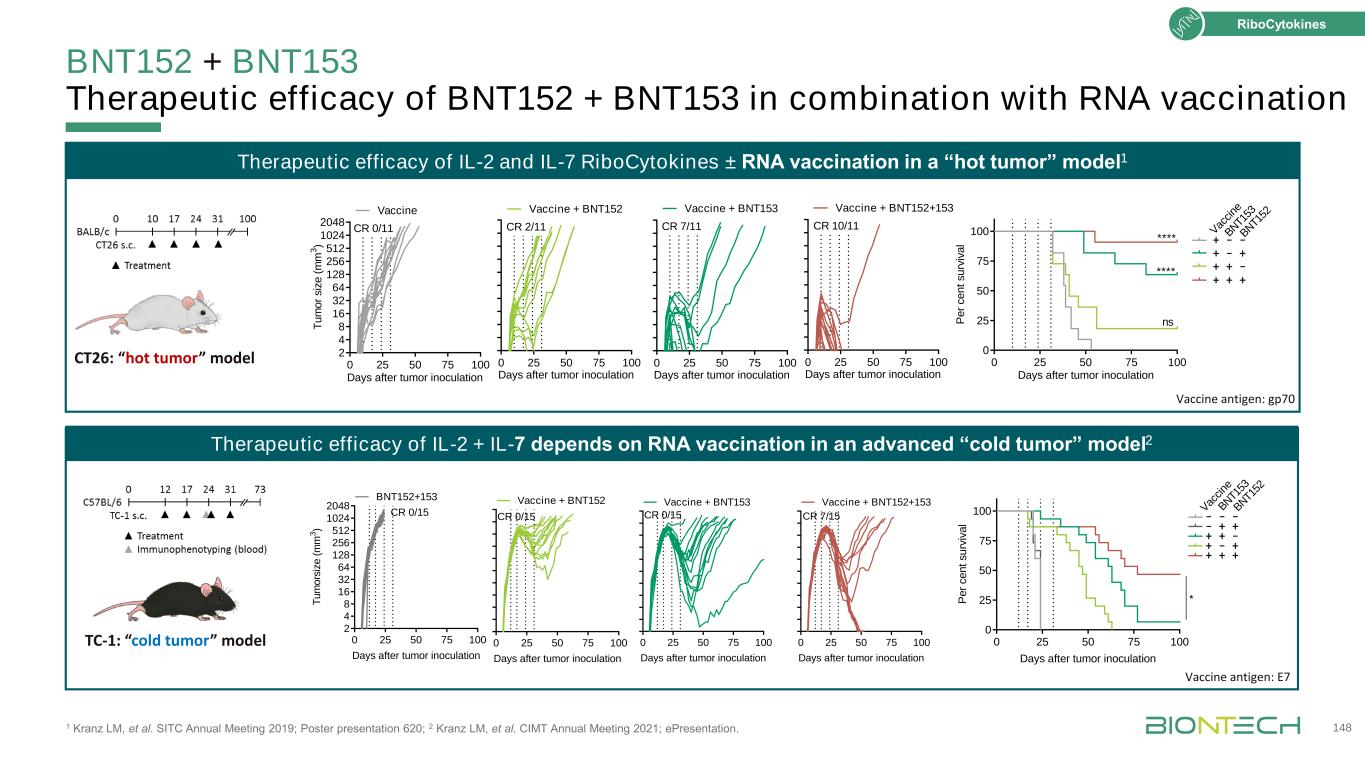
BNT152+BNT153聯合RNA疫苗1 Kranz LM等的治療效果SITC 2019年年會;海報展示620;2 Kranz LM,等人。CIMT 2021年年會;電子演示。腫瘤接種後148 0 25 50 75 75 100 0 25 50 75 U RV iv a l V ac ne---+++-+++*BN T1 53 BN T1 52 0 25 50 75 100 2 4 8 16 32 64 128 256 512 1024 2048腫瘤接種後CR0/11 0 25 50 75 75 100天腫瘤接種CR 7/11疫苗+BNT153 0 25 50 75 75 100天接種疫苗+BNT152接種疫苗+BNT152接種疫苗100天+BNT152+153 CR 10/11 TC-1:冷瘤模型0 25 50 75 100 2 4 8 16 32 64 128 256 512 1024 2048天(立方米)CR0/15 BNT152+153 0 25 50 75 100天CR0/15疫苗+BNT152 0 25 50 75 100天+BNT152 0 25 50 75 100天CR 7/15疫苗+BNT152+153腫瘤接種後0 25 50 75 100 0 25 50 75 rv iv a l*ns*Vac ci ne BN T1 53 BN T1 52+-+++CT26:“熱腫瘤”模型疫苗抗原:gp70疫苗抗原:E7 IL-2+IL-7的療效取決於晚期“冷腫瘤”模型中的RNA接種2 IL-2和IL-7核細胞因子±RNA疫苗在“熱腫瘤”模型1中的治療效果
BNT151聯合T細胞疫苗的治療活性1 Kranz LM等。SITC 2019年年會;海報展示620;2 Kranz LM,等人。CIMT 2021年年會;電子演示。腫瘤接種後149天,核細胞因子TRP1疫苗+hIL2 TRP1疫苗+對照+hIL2對照+BNT151 0 25 50 75 0 250 500 750 1000 1250 1500 1750天。*對照TRP1疫苗+BNT151 0 10 20 30 40 TRP1特異性CD8+T細胞接種天數:hIL2:BNT151:+---+++-++*nsB16F10 S.C.腫瘤疫苗靶點:腫瘤疫苗靶點:TRP1(含CD8 T細胞表位的分化抗原)C57BL/6 0 10 20 30 40 CD8+與Treg的比值CD8+與T細胞的比例疫苗:hIL2:BNT151:+---+++-+-+*ns0 20 40 60 80 2 4 8 16 32 64 128 256 512 1024 2048天后T(M 3)gp70疫苗0/11 CR 0 20 40腫瘤接種後60 80天7/11 CR gp70疫苗+hIL 2 0 20 40 60 80天gp70疫苗+BNT151 11/11 CR 0 20 40 60 80 2 4 8 16 32 64 128 256 512 1024 2048(立方米)gp70疫苗0/11 CR 0 20 40 6 6 8天7/11 CR gp70疫苗+hIL 2 0 20 40 60 60 80天gp70疫苗+BNT151 11/11 CR 0 20 40 60 2 4 8 32 64 128 256 512Gp70疫苗接種後1024 2048d或s(M M 3)gp70疫苗接種後0/11 CR 0 20 40 60 8 d 7/11 CR gp70疫苗+hIL 2 0 20 40 60 80 d週期gp70疫苗+BNT151 11/11 CR疫苗單獨疫苗+hIL-2疫苗+BNT151 Vormehr M,等人的研究。SITC 2019年年會;海報展示626。BNT151對RNA-LPX疫苗治療效果的實質性提高
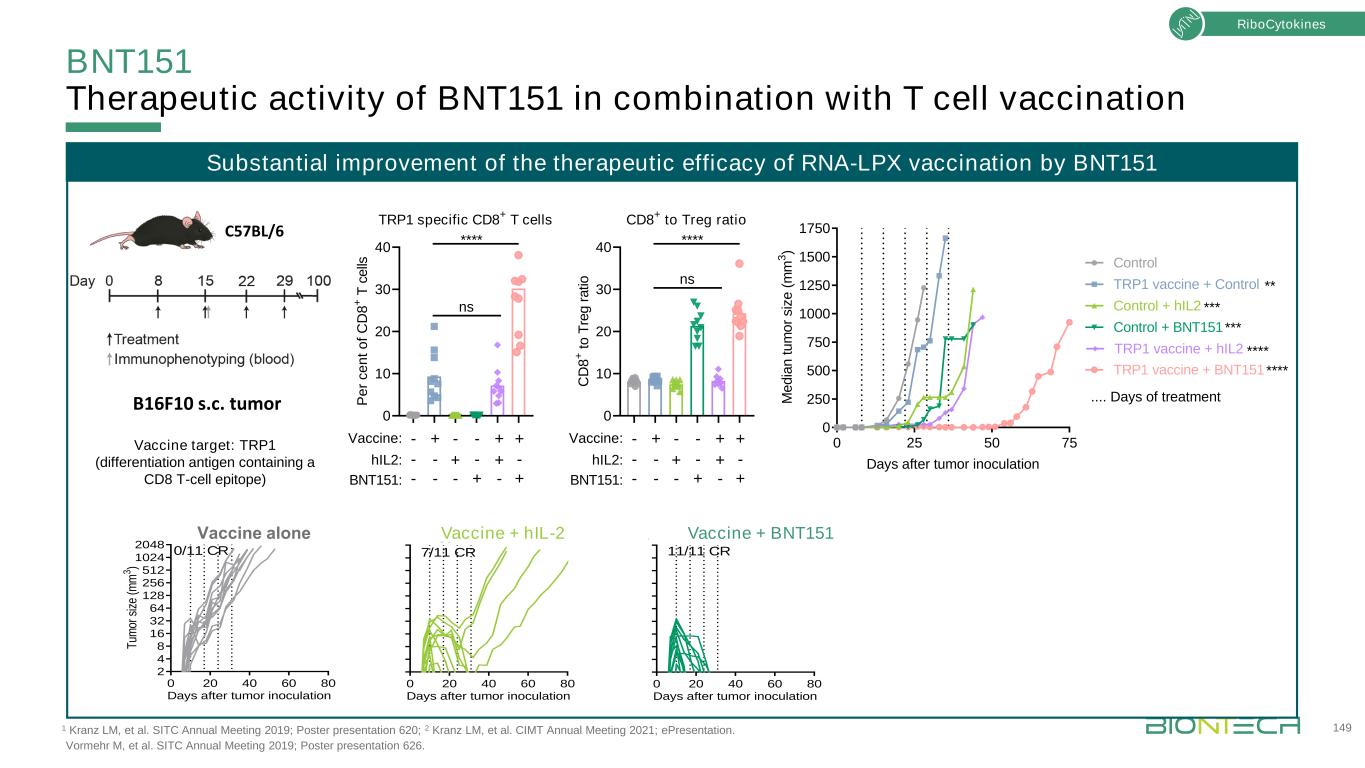
與CLDN6-LPX治療組相比,BNT151治療組的CAR T細胞在體內的初始擴增作用與CLDN6-LPX治療組相似。CLDN6-LPX+BNT151治療組在治療後第3/4天達到CAR T細胞擴增高峯,隨後在第7天進入收縮階段。BNT151介導非腫瘤小鼠CAR T細胞的體內擴增CLDN6-CAR-LPX或BNT151處理的CLDN6-CAR-BBZ-LUC-GFP陽性T細胞CLDN6-CLDN6-LPX BNT151 C6-LPX+BNT151 Ctr-LPX+Ctrl-LNP CLDN6-LPX BNT151 C6-LPX+BNT151 Ctr-LPX+ctrl-LNP第1天(基線)1°治療-第1天第4天第9天2°治療-第7天2×106 2×107分離的脾細胞用於體外細胞毒性分析108 10 0 5天后#C R T=o T ta l fl s s第1天(基線)1°治療-第1天第4天第9天2°治療-第7天2×106 2×107分離的脾細胞用於體外細胞毒性分析[ p /s ]Car T劑量治療2×106+CLDN6-LPX 2×106+BNT151 2×106+CLDN6-LPX+BNT151 2×107+ctrl-LPX+crt1-LNP治療時間點分析核細胞因子
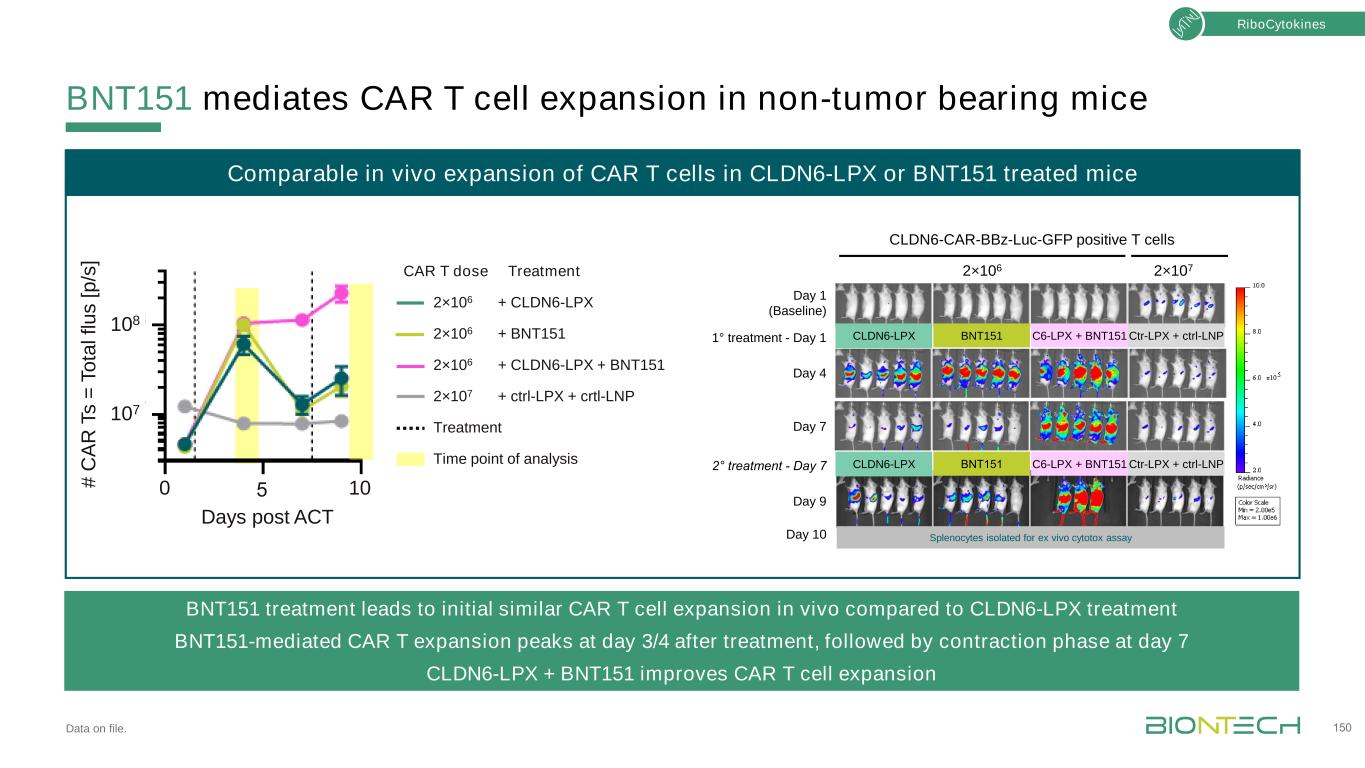
結合疫苗和BNT151的體內長期擴增和抗腫瘤活性的CAR T細胞。151次重複治療1°2°3°治療4°5°0 20 40 60 80 80 100 0.1 10 100天后NSG小鼠體內核細胞因子CAR T細胞的擴增和存留CLDN6-LPX BNT151 CLDN6-LPX+BNT151 Ctrl-LPX+Ctrl-LNP在OV90荷瘤NSG小鼠體內的體外抗腫瘤活性[ m m 3 ]CLDN6 Car-T+CLDN6-LPX CLDN6 Car-T+BNT151 CLDN6 Car-T+CLDN6-LPX+BNT151 CLDN6 Car-T+ctrl-LPX+ctrl-LNP NTD-T+CLDN6-LPX NTD-T+BNT151 Car-T-LPX 151 6-LPX+BNT151 Trl-LNP NTD+CLDN6-LPX+BNT151·Car特異性刺激持續時間>90天·BNT151重複刺激(CAR)T細胞。CLDN6-LPX聯合BNT151在刺激初始擴增和持久性方面具有優勢·CLDN6-LPX、BNT151在異種移植模型中擴增亞治療性CAR T細胞併產生治療活性
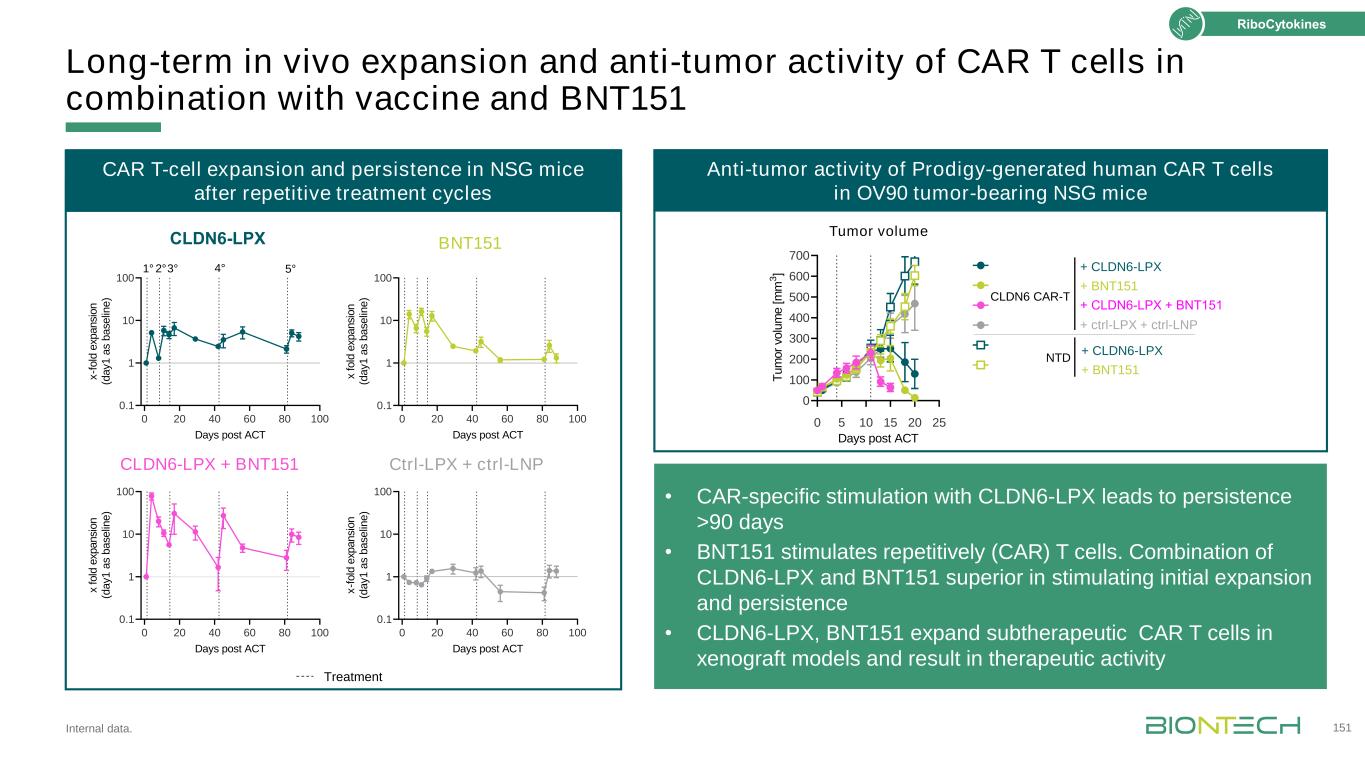
BNT152+BNT153 BNT151、BNT152+BNT153兩期1/2期FIH試驗:信使核糖核酸編碼的細胞因子在實體瘤FIH、人類首例、肝細胞癌、HNSCC、頭頸部鱗狀細胞癌;MAD,最大給藥劑量;MTD,最大耐受劑量;NSCLC,非小細胞肺癌;OBD,最佳生物劑量;RCC,腎細胞癌;RP2D,推薦2期劑量;SOC,護理標準;TNBC,三陰性乳腺癌。臨牀試驗.gov:NCT04455620。152 BNT151單一治療劑量遞增·多發性實體腫瘤第2部分狀態劑量遞增正在進行的患者總數:26個關鍵終點安全性和耐受性抗腫瘤活性BNT151聯合治療HNSCC、肝癌、腎癌、非小細胞肺癌、TNBC核細胞因子MTD或MAD OBD和/或MTD·轉移性不可切除實體腫瘤A組:BNT153組:BNT152聯合治療第1部分MTD/RP2D單藥劑量遞增

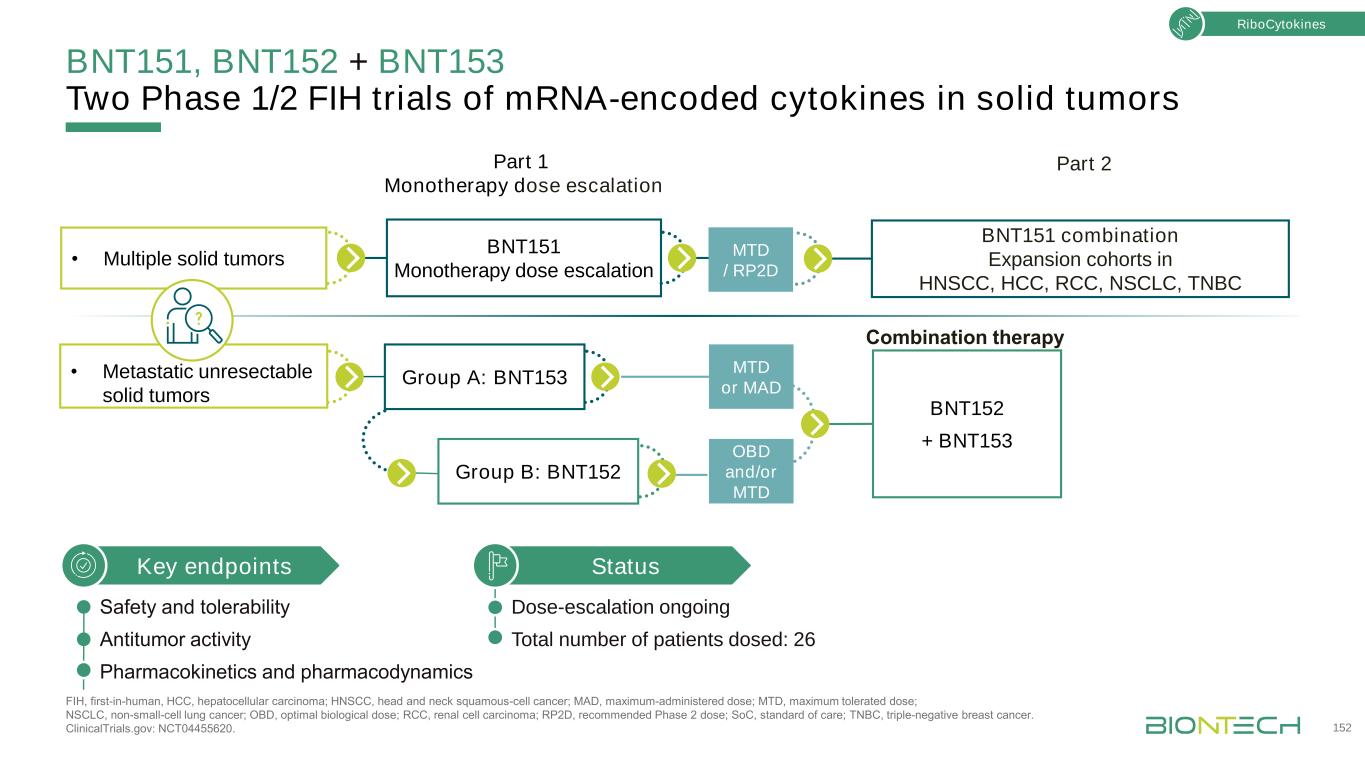
結束語
邁向我們的長期願景15腫瘤學感染性疾病5隨機第二階段試驗1上市疫苗市場新冠肺炎疫苗10+臨牀前計劃1階段1計劃21項臨牀試驗中的16項計劃保持並深化新冠肺炎疫苗的領導地位未來3−5年到2030年,我們的目標是成為多產品全球生物技術的領先者,渴望通過大規模交付開創性、顛覆性技術來應對世界上最緊迫的健康挑戰中期目標推動轉型今天長期願景5−10每年提交的新一代或變種改裝新冠肺炎疫苗批准的跨不同疾病領域的產品

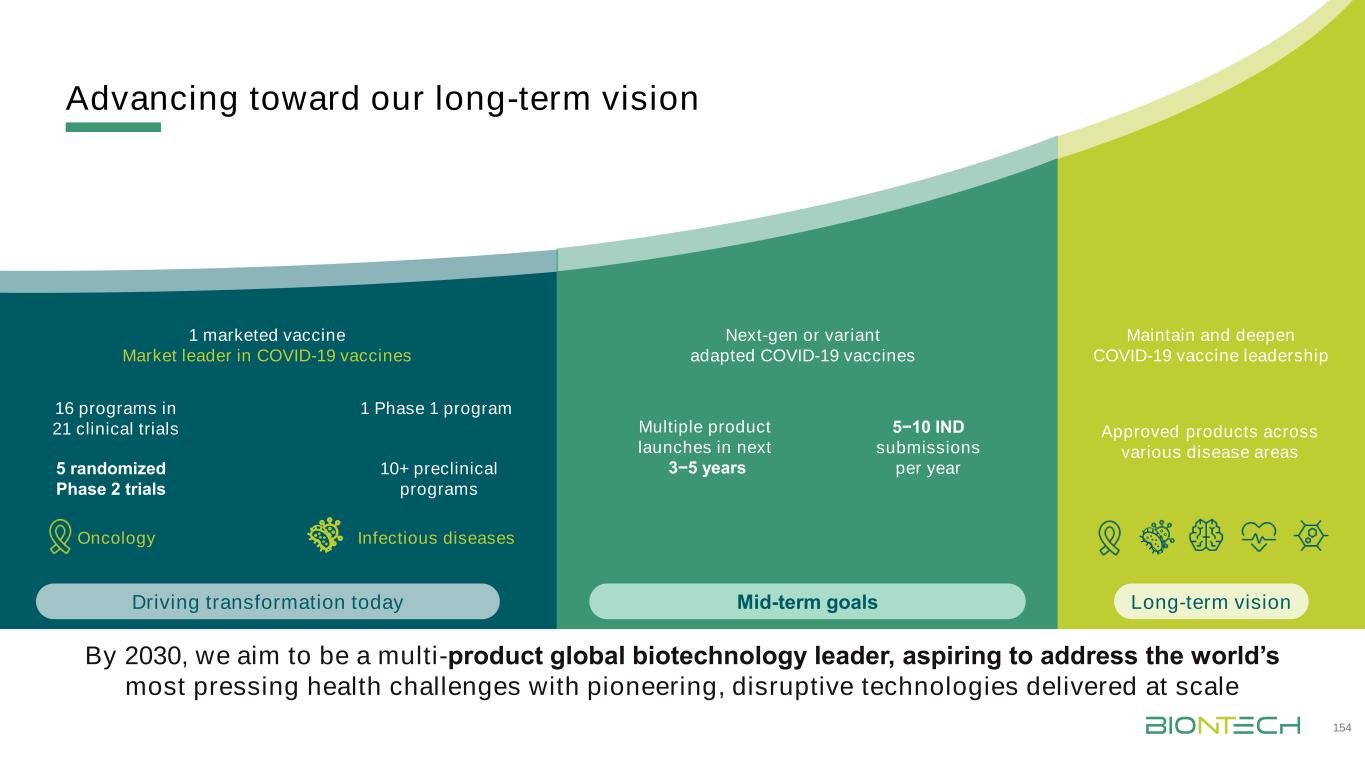
15 5 Q & A

