加利福尼亞州雷德伍德城,2022年5月12日-Adverum BioTechnologies,Inc.(納斯達克:ADVM),一家針對眼科和罕見疾病的未得到滿足的醫療需求的臨牀階段基因治療公司,今天公佈了截至2022年3月31日的第一季度財務業績。
Adverum生物技術公司總裁兼首席執行官Laurent Fischer醫學博士説:“我們仍在按計劃在2022年第三季度為我們計劃的ADVM-022第二階段試驗中的第一名患者服用濕性老年性黃斑變性藥物。我們對在我們要求與美國食品和藥物管理局舉行C型會議後收到的反饋感到高興,我們對我們正在推進的ADVM-022臨牀開發計劃充滿信心。我們期待着在2×10^11 Vg/眼劑量和新的更低的6×10^10 Vg/眼劑量下評估ADVM-022,並加強預防性類固醇療法,包括局部類固醇以及局部和全身類固醇的組合。“
·美國食品和藥物管理局(FDA)授予ADVM-062(AAV.7M8-L-OPTIN)孤兒藥物稱號,這是一種正在開發的新型基因治療產品候選產品,可能成為治療藍色錐體單色(BCM)的單一玻璃體內給藥。
·Adverum對其領導團隊進行了關鍵的補充,包括擔任首席開發官的製藥公司Star Seyedkazemi和擔任首席醫療官的醫學博士理查德·貝克曼。此外,醫學博士Rabia Gurses Ozden和M.B.A.Soo J.Hong被任命為董事會成員。
·4月6日,Adverum宣佈已通過一次C型會議收到FDA的書面反饋,該反饋涉及Adverum計劃用於濕性老年性黃斑變性(濕性AMD)的ADVM-022第二階段試驗。Adverum要求FDA在提交第二階段試驗的研究新藥(IND)修正案之前與監管機構保持一致。
·在視覺和眼科研究協會(ARVO)2022年年會上,Adverum介紹了ADVM-022在濕性AMD的光學試驗中的額外療效和安全性數據。在所有接受2×10^11Vg/眼(2E11)劑量的參與者中,平均年化抗血管內皮生長因子(anti-VEGF)注射率降低了81%。中和抗體(NAB)滴度的參與者
預計2022年的里程碑
·2022年第二季度-在美國基因與細胞治療學會(ASGCT)2022年年會上,介紹支持人類相當於6×10^10 VG/眼(6E10)劑量的ADVM-022的非人靈長類動物afLibercept蛋白質水平數據。
·2022年第二季度--在ASGCT 2022年年會上介紹來自良好實驗室實踐毒理學研究的活體非人類靈長類數據,支持ADVM-062的臨牀前概念驗證。
·2022年年中-完成IND修訂程序,以啟動ADVM-022在濕性AMD中的第二階段試驗
·2022年第三季度-計劃在濕性AMD中使用ADVM-022第二階段試驗的第一名患者
截至2022年3月31日的三個月的財務業績
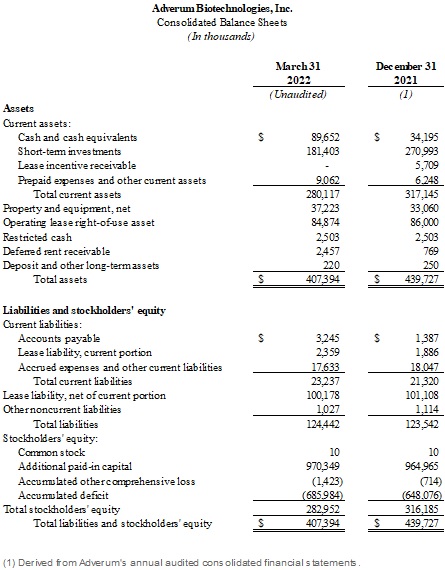
截至2022年3月31日,現金、現金等價物和短期投資為2.711億美元,而截至2021年12月31日,現金、現金等價物和短期投資為3.052億美元。Adverum預計,2022年3月31日的現金狀況將為2024年之前的運營提供資金。
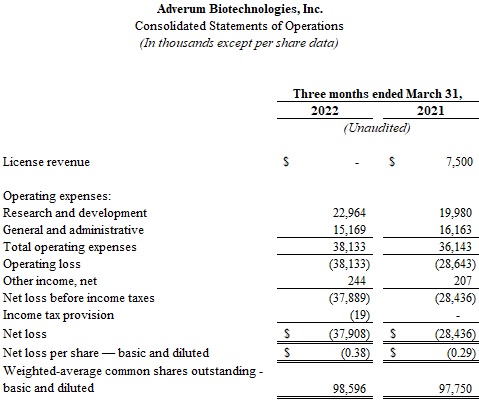
·截至2022年3月31日的三個月,研發支出為2300萬美元,而2021年同期為2000萬美元。研發開支增加主要是由於人員相關成本上升、於2021年第二季開始的新租約的分配租金及設施開支,以及與臨牀試驗相關的開支被較低的材料生產成本及生物分析開支部分抵銷。2022年第一季度,包括在研發費用中的股票薪酬支出為190萬美元。
·截至2022年3月31日的三個月,一般和行政費用為1520萬美元,而2021年同期為1620萬美元。一般和行政費用減少的主要原因是與人員有關的費用和專業服務費用減少,但因税收和保險增加以及2021年第二季度開始的新租約分配租金和設施費用增加而部分抵消。2022年第一季度,包括在一般和行政費用中的基於股票的薪酬支出為340萬美元。
·截至2022年3月31日的三個月,淨虧損為3790萬美元,或每股基本及攤薄虧損0.38美元,而2021年同期為2840萬美元,或每股基本及攤薄虧損0.29美元。
關於濕性老年性黃斑變性
濕性AMD,也被稱為新生血管性AMD或NAMD,是AMD的一種高級形式,大約10%的AMD患者受到影響。濕性AMD是65歲以上患者失明的主要原因,全世界約有2000萬人患有這種疾病。隨着人口老齡化,濕性AMD新病例的發病率預計將在全球範圍內顯著增長。預計到2040年,AMD將影響全球2.88億人,其中濕性AMD約佔這些病例的10%。
關於ADVM-022在濕性AMD中的光學試驗
ADVM-022是Adverum正在開發的治療濕性AMD的臨牀期基因療法候選產品。ADVM-022利用特性載體衣殼AAV.7m8,在專有表達盒的控制下攜帶afLibercept編碼序列。與其他需要手術才能在視網膜(視網膜下途徑)下實施基因治療的眼科基因療法不同,ADVM-022具有在辦公室作為一次性IVT注射的優勢,旨在提供長期療效,減輕頻繁注射抗血管內皮生長因子的負擔,優化患者依從性,並改善濕性AMD患者的視力結果。
OPTION試驗是一項多中心、開放標籤、劑量範圍、安全性和有效性的ADVM-022試驗,用於對抗血管內皮生長因子治療有反應的濕性AMD患者。OPTEM的患者治療經驗豐富,以前需要頻繁注射抗血管內皮生長因子來管理他們的濕性AMD並維持功能性視力。
關於藍錐體單色性
BCM是一種X連鎖隱性遺傳性疾病,由L或M視蛋白基因突變引起,可表現為視力喪失、光敏、近視和嬰兒眼球震顫,可持續到成年。因此,患有BCM的人在日常生活的重要方面有視覺障礙,如面部識別、學習、閲讀和日光視覺。目前,全世界大約每100,000名男性中就有1至9人患有BCM,而且BCM尚無治癒方法。
關於ADVM-062基因治療
ADVM-062(AAV.7m8-L-opsin)是一種新的候選基因治療產品,正在開發中,通過單次靜脈注射將OPN1LW基因的功能性拷貝輸送到患有藍錐單色染色體(BCM)的患者的中心凹錐體。ADVM-062利用Adverum的適當載體衣殼AAV.7m8。2022年1月,FDA授予ADVM-062孤兒藥物稱號。
關於Adverum生物技術公司
Adverum生物技術公司(納斯達克代碼:ADVM)是一家臨牀階段的基因治療公司,目標是治療嚴重的眼科和罕見疾病,滿足未得到滿足的醫療需求。Adverum正在評估其新的基因治療候選藥物ADVM-022,作為一次性玻璃體內注射,用於治療新生血管或濕性老年性黃斑變性患者。欲瞭解更多信息,請訪問www.Adverum.com。
前瞻性陳述
本新聞稿中包含的有關未來可能發生的事件或結果的陳述屬於“1995年私人證券訴訟改革法”所指的“前瞻性陳述”。這些陳述包括但不限於:Adverum預計2022年3月31日的現金狀況將為2024年之前的運營提供資金;有關Adverum計劃啟動ADVM-022在濕性AMD中的第二階段試驗的陳述,劑量為2×10^11 Vg/眼和新的更低的6 X 10^10 Vg/眼劑量;標題為“預期的2022個里程碑”的陳述。由於各種風險和不確定性,實際結果可能與此類前瞻性陳述中預期的結果大不相同,包括
這些風險和不確定性包括但不限於:Adverum的新技術使其難以預測臨牀試驗的開始和完成時間;監管的不確定性;早期臨牀試驗的結果並不總是能預測未來臨牀試驗和結果;以及使用ADVM-022可能導致未來併發症或副作用的可能性。Adverum面臨的其他風險和不確定因素在Adverum提交給美國證券交易委員會(美國證券交易委員會)的文件和報告中以“風險因素”為標題闡述,包括Adverum於2022年3月29日提交給美國證券交易委員會的截至2021年12月31日的Form 10-K年度報告。本新聞稿中包含的所有前瞻性陳述僅在發表之日發表。Adverum沒有義務更新這些聲明,以反映在聲明發表之日之後發生的事件或存在的情況。
問詢
阿南德·雷迪
副總裁,公司戰略和對外事務及接洽負責人
Adverum生物技術公司
T: 650-649-1358
投資者
勞倫斯·瓦茨
吉爾馬丁集團
T: 619-916-7620
電子郵件:laurence@gilmartinir.com
媒體
梅根·塔隆
企業傳播部助理董事
Adverum生物技術公司
T: 650-649-1006
電子郵箱:mtalon@adverticum.com