新聞稿

受第一季度銷售額增加和利潤率提高的推動,賽諾菲繼續實現強勁的業務每股收益(1)增長
巴黎,2022年4月28日
在Dupixent® 和CHC的推動下,按恆定匯率計算,2022年第一季度銷售額增長8.6%
•在Dupixent®(16.14億歐元,增長45.7%)的推動下,專業護理增長了17.8%
•疫苗上漲6.8%,這反映了PPH特許經營的強勁以及旅行疫苗的逐步恢復
•受Rezurock® 的推動,普通藥品的核心資產增長了4.7%,GBU的整體銷售額基本穩定(-0.7%)
•在咳嗽和感冒和疼痛護理類別的推動下,CHC繼續保持強勁的增長勢頭(+17.0%)
受銷售額增加和利潤率提高的推動,2022年第一季度業務每股收益(1)按恆定匯率增長16.1%
•BOI利潤率達到31.7%,增長1.0個百分點,反映了投資研發時毛利率的提高
•業務每股收益(1)為1.94歐元,按報告計算增長20.5%,按CER計算增長16.1%,這也得益於有效税率的提高
•國際財務報告準則每股收益為1.61歐元(增長28.8%)
企業社會責任戰略的進展
•賽諾菲在改善藥品供應方面繼續取得進展;發行與可持續發展相關的債券併發布其全球准入和定價政策
• 賽諾菲正在與來自領先腫瘤學機構的專家合作,以實現其在兒童癌症方面的企業社會責任抱負
研發轉型的關鍵里程碑和監管成果
•Efanesoctocog alfa 達到了 A 型血友病的 3 期主要終點,表現出優於先前的因子預防
•Dupixent® 在歐盟獲準用於治療6至11歲兒童的嚴重哮喘;在美國,針對兒童(6個月至5歲)的特應性皮炎和12歲及以上的嗜酸性食管炎患者,獲得了優先審評
•Nirsevimab EMA的監管申請在所有嬰兒的呼吸道合胞病毒保護加速評估下被接受
•美國食品藥品管理局批准的Enjaymo™,這是第一種用於冷凝素病(CAD)患者的治療方法
•Xenpozyme® 在日本獲得批准,是第一種也是唯一獲批的用於治療酸性鞘磷脂酶缺乏症(ASMD)的療法
•賽諾菲和葛蘭素史克為其在歐洲的第一代 COVID-19 疫苗申請了有條件的監管授權,其數據支持將其用作通用增強劑,旨在增強所有目前批准的 COVID-19 疫苗平臺
2022年財務展望
•賽諾菲預計,除非出現不可預見的重大不利事件,否則按CER計算,2022年業務每股收益(1)將增長兩位數(2)的低水平。按2022年4月的平均匯率計算,貨幣對2022年企業每股收益的積極影響估計在+4%至+5%之間
賽諾菲首席執行官保羅·哈德森評論説:
“得益於Dupixent® 持續的出色表現、CHC業務的兩位數增長以及第一季度利潤率的提高,我們在2022年有了一個良好的開端。在研發方面,我們增加了投資,為我們快速發展的產品線提供燃料,在此期間,通過Seagen、IGM、Exscientia和黑石集團等BD合作,進一步加強了這一投資。正如我們在三月份的投資者活動上所強調的那樣,我們將繼續專注於在免疫學領域取得行業領導地位的道路,正在開發一系列新療法,包括Dupixent® 用於治療瘙癢結節和嗜酸性食管炎等疾病的其他適應症,這些適應症最近已提交監管部門批准。此外,我們對efanesoctogog alfa的積極關鍵試驗結果感到特別興奮。efanesoctogog alfa有可能為甲型血友病患者帶來革命性的治療方法,計劃於年中提交。同樣在本季度,我們繼續在戰略優先事項上表現良好,決定通過特別股息進行擬議的EUROAPI股票上市和分拆業務。基於強勁的第一季度,儘管商業環境充滿挑戰,但我們有望實現2022年的財務指導。”
| | | | | | | | | | | | | | |
| Q1 2022 | 改變 | 改變
在 CER | | | |
| 國際財務報告準則報告的淨銷售額 | €9,674m | +12.6% | +8.6% | | | |
| 報告的《國際財務報告準則》淨收益 | €2,009m | +28.3% | _ | | | |
| 國際財務報告準則每股收益報告 | €1.61 | +28.8% | _ | | | |
自由現金流 (3) | €1,707m | -11.3% | _ | | | |
| 企業營業收入 | €3,065m | +16.2% | +12.2% | | | |
業務淨收益 (1) | €2,424m | +20.2% | +16.0% | | | |
企業每股收益 (1) | €1.94 | +20.5% | +16.1% | | | |
除非另有説明,否則淨銷售額的變化以固定匯率(CER)表示(定義見附錄7)
(1)為了促進對運營業績的理解,賽諾菲對企業淨損益表發表了評論。企業淨收入是非公認會計準則財務指標(定義見附錄7)。附錄3中提供了2022年第一季度的合併損益表,附錄4列出了報告的國際財務報告準則淨收益與企業淨收益的對賬;(2)2021年業務每股收益為6.56歐元;(3)自由現金流是非公認會計準則財務指標(定義見附錄7)。
2022年第一季度賽諾菲銷售額
----------------------------
除非另有説明,否則本新聞稿中所有銷售額的百分比變化均在CER1中列出
----------------------------
2022年第一季度,賽諾菲的銷售額為96.74億歐元,據報告增長12.6%。匯率變動產生了4.0個百分點的積極影響,這主要歸因於美元。在CER,公司的銷售額增長了8.6%。
全球業務部門
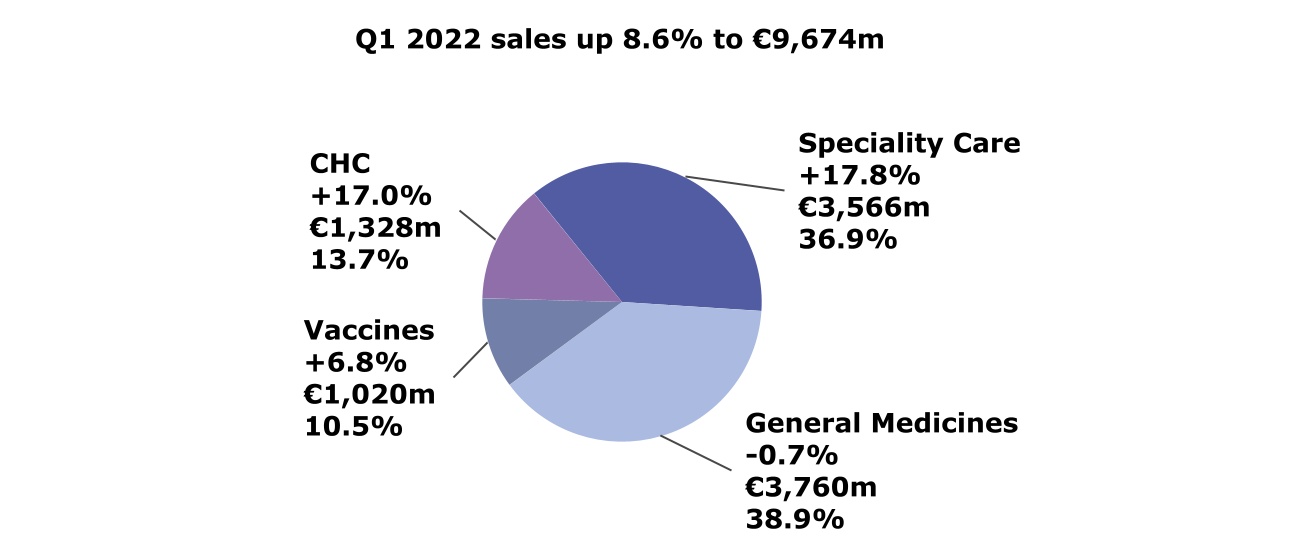
按全球業務部門劃分的2022年第一季度淨銷售額(按CER變動;百萬歐元;佔總銷售額的百分比)
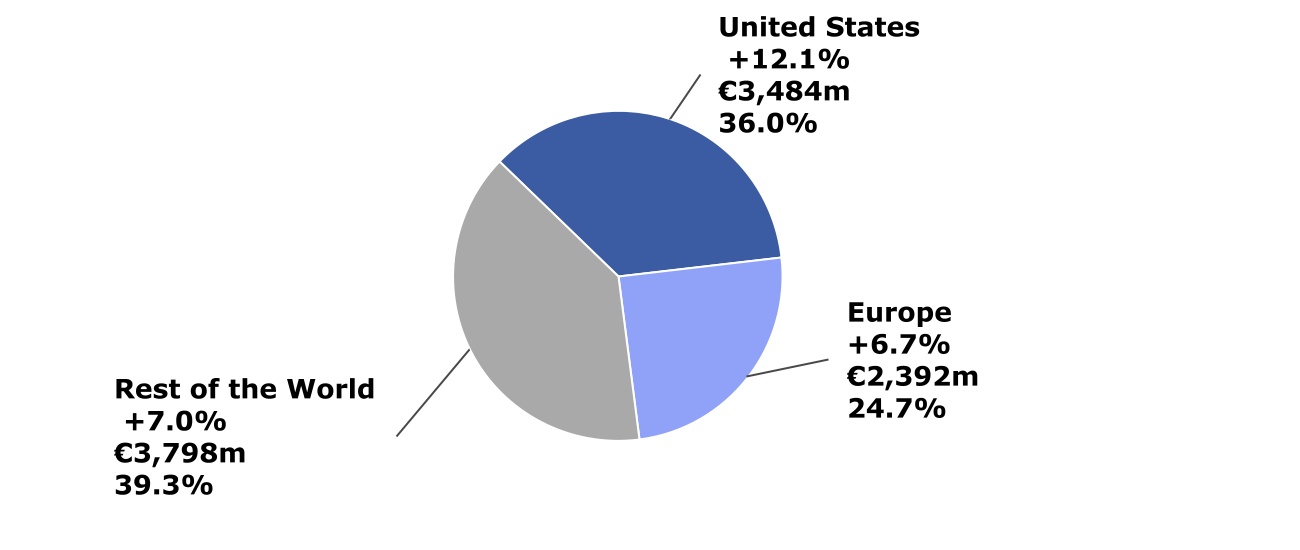
按地理區域劃分的2022年第一季度淨銷售額(按CER變動;百萬歐元;佔總銷售額的百分比)
2022年第一季度營業收入
第一季度業務營業收入(BOI)增長了16.2%,達到30.65億歐元。在CER,投資回報率增長了12.2%。投資回報率與淨銷售額的比率增長了1.0個百分點至31.7%(按恆定匯率計算為31.7%)。
1 財務指標的定義見附錄7。
藥品
2022年第一季度藥品銷售額增長了7.5%,達到73.26億歐元,這主要是由專業護理產品組合(增長17.8%)以及Dupixent® 的持續強勁表現所推動,而普通藥品的銷售額下降了0.7%。
專業護理
Dupixent
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
Total Dupixent® | 1,614 | | +45.7 | % | | |
第一季度,Dupixent®(與Regeneron合作)的銷售額增長了45.7%,達到16.14億歐元。在美國,Dupixent® 銷售額為11.76億歐元(增長38.1%),這得益於成人、青少年和6至11歲兒童對AD的持續強勁需求,以及哮喘和慢性鼻竇炎伴鼻息肉(crsWNP)的持續普及。Dupixent® 處方總量(TRx)增長了43%(同比),新品牌處方(NBRx)增長了32%。在歐洲,第一季度Dupixent® 的銷售額增長了53.3%,達到2.11億歐元,這反映了AD的持續增長以及年輕人羣在AD、哮喘和CrsWNP領域的更多推出。
神經病學和免疫學
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在CER | | |
Aubagio® | 491 | | -6.6 | % | | |
Lemtrada® | 25 | | — | % | | |
Kevzara® | 95 | | +61.4 | % | | |
全神經病學和免疫學 | 611 | | +0.3 | % | | |
第一季度,神經病學和免疫學的銷售額增長了0.3%,達到6.11億歐元,這反映了Kevzara® 的強勁銷售額,但Aubagio® 銷售額的下降部分抵消了這一增長。
Aubagio® 第一季度的銷售額下降了6.6%,至4.91億歐元,這是由於競爭壓力和價格導致美國銷售額下降。歐洲的銷售保持穩定。
第一季度Kevzara®(與Regeneron合作)的銷售額增長了61.4%,達到9500萬歐元,這要歸因於與 COVID-19 相關的全球對IL-6受體阻滯劑的需求增加以及託珠單抗暫時短缺。
罕見病
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
Myozyme®/Lumizyme® | 235 | | -3.0 | % | | |
Nexviazyme® | 30 | | ns | | |
Fabrazyme® | 220 | | +2.4 | % | | |
Cerezyme® | 165 | | -6.7 | % | | |
Aldurazyme® | 69 | | +3.0 | % | | |
Cerdelga® | 67 | | +3.2 | % | | |
| 其他罕見病 | 18 | | -14.3 | % | | |
| 總罕見病 | 804 | | +1.9 | % | | |
在第一季度,在龐培特許經營權的推動下,罕見病銷售額增長了1.9%,達到8.04億歐元,但部分被世界其他地區不利的購買模式所抵消,主要是Gaucher和Fabrazyme特許經營權。與去年同期相比,基礎患者接受治療的基礎增長了約6%。
Pompe特許經營權(Myozyme/Lumizyme® + Nexviazyme®)第一季度的銷售額增長了8.9%,達到2.65億歐元,這主要是由於新增患者累積和Nexviazyme® 的增加。Myozyme® /Lumizyme® 的銷售額下降了3.0%,至2.35億歐元,這主要反映了向Nexviazyme® 的轉換
Nexviazyme®(於2021年8月在美國推出,2021年11月在日本推出)在第一季度的美國銷售額為3000萬歐元(其中2600萬歐元在美國上市)。
高徹特許經營權(Cerezyme® + Cerdelga®)的第一季度銷售額下降了4.2%(至2.32億歐元)。在此期間,Cerezyme® 的銷售額下降了6.7%,至1.65億歐元,這主要是由於不利的購買模式導致世界其他地區的銷售額下降。同時,Cerdelga® 的銷售額增長了3.2%,這得益於歐洲和美國的轉換和新患者累積。
第一季度Fabrazyme® 銷售額增長了2.4%,達到2.2億歐元,這主要是由歐洲和美國推動的。在世界其他地區,儘管購買模式不利,但Fabrazyme® 的銷售額保持穩定。
腫瘤學
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
Jevtana® | 98 | | -25.4 | % | | |
Sarclisa® | 65 | | +85.3 | % | | |
Fasturtec® | 40 | | +8.6 | % | | |
Libtayo® | 41 | | +53.8 | % | | |
| 全腫瘤學 | 244 | | +6.8 | % | | |
2022年第一季度腫瘤學的銷售額增長了6.8%(至2.44億歐元),這得益於Sarclisa® 的推出,這足以抵消歐洲Jevtana® 仿製藥競爭的影響。
繼2021年3月底一些歐洲市場進入仿製藥競爭(下降75.6%)之後,Jevtana® 第一季度的銷售額下降了25.4%,至9800萬歐元。在美國,銷售額增長了8.6%,其中Jevtana® 目前受四項橙皮書列出的專利保護:7,241,907項、8,927,592項、10,583,110美元和10,716,777美元。賽諾菲在美國特拉華特區地方法院根據Hatch-Waxman對聲稱擁有'110專利、'777專利和'592專利的仿製藥申請人提起了專利侵權訴訟。賽諾菲已與一些被告達成和解協議,針對其餘被告的訴訟仍在進行中。計劃從2023年1月開始對Apotex和Sandoz進行為期3天的審判,其餘被告同意在地方法院作出有利於被告的裁決之前或審後簡報會結束四個月後,不推出任何仿製卡巴齊他賽產品。Jevtana® 還獲得了與CARD臨牀研究相關的監管數據獨家授權,該研究將於2023年12月到期。
第一季度Sarclisa® 銷售額為6,500萬歐元(2021年第一季度為3,400萬歐元),這主要是由美國(2500萬歐元)、歐洲(2,200萬歐元)和日本的業績推動的。
罕見血液病
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
Eloctate® | 138 | | -3.0 | % | | |
Alprolix® | 108 | | +2.0 | % | | |
Cablivi® | 46 | | +15.8 | % | | |
| 總罕見血液病 | 293 | | +1.8 | % | | |
第一季度,罕見血液病的特許經營銷售額增長了1.8%(2.93億歐元),這反映了Cablivi® 和Alprolix® 的增長被對Sobi的Eloctate® /Alprolix® 工業銷售額(記錄在世界其他地區)的下降部分抵消。
Eloctate® 第一季度的銷售額為1.38億歐元,下降了3.0%,這反映了美國(下降1.9%)和世界其他地區的銷售額下降。
受美國銷售額(增長8.9%)的推動,Alprolix® 第一季度銷售額增長了2.0%,達到1.08億歐元,但世界其他地區銷售額的下降部分抵消了這一增長。
受歐洲上市(增長46.7%至2300萬歐元)的推動,Cablivi® 第一季度的銷售額增長了15.8%,達到4600萬歐元。在美國,該產品的銷售額下降了4.5%,至2200萬歐元,這是由於 COVID-19 環境影響了醫院層面的治療啟動。
普通藥物
第一季度通用藥品銷售額下降0.7%,至37.6億歐元,不包括精簡投資組合,銷售額保持穩定。
核心資產
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
Lovenox® | 377 | | -8.2 | % | | |
Toujeo® | 274 | | +6.3 | % | | |
Plavix® | 261 | | 0.0 | % | | |
Multaq® | 87 | | +13.9 | % | | |
胸腺球蛋白® | 97 | | +13.8 | % | | |
Mozobil® | 58 | | +5.8 | % | | |
Praluent® | 69 | | +21.4 | % | | |
Soliqua® | 53 | | +15.9 | % | | |
Rezurock® | 41 | | 不是 | | |
| 其他 | 277 | | +1.9 | % | | |
| 核心資產總額 | 1,594 | | +4.7 | % | | |
第一季度,核心資產銷售額增長了4.7%,達到15.94億歐元,這得益於Toujeo®、Praluent®、Multaq®、Thymoglobulin® 和Rezurock®(自2021年11月9日起合併),但部分被Lovenox® 銷售額下降所抵消。第一季度,所有地區的核心資產銷售額均有所增長。
Lovenox® 第一季度銷售額下降了8.2%,至3.77億歐元,這主要反映了世界其他地區的銷售額下降(下降11.9%),這是由於受益於強勁的COVID相關需求(世衞組織指南建議在住院的 COVID-19 患者中使用低分子量肝素),2021年第一季度的比較基數較高。此外,生物仿製藥的競爭和供應限制影響了性能。
由於歐洲和世界其他地區的增長,第一季度Toujeo® 銷售額增長了6.3%,達到2.74億歐元,但部分被美國銷售額下降所抵消。
在中國,胰島素的批量採購(VBP)預計將於2022年5月實施。2021年11月,賽諾菲參與了基礎胰島素類似物的VBP招標,並憑藉Lantus® /Toujeo® 成為A組的競標中標者之一。賽諾菲預計,到2022年,其glargine(Toujeo® /Lantus®)在中國的銷售額將下降約30%,這要歸因於高產量和低得多的價格。在中國,2021 年,Toujeo® /Lantus® 的銷售額為 4.59 億歐元。
Plavix® 第一季度銷售額穩定至2.61億歐元,世界其他地區的銷售額增加(增長1.4%)抵消了歐洲銷售額的下降。由於2021年第一季度的比較基數較高,Plavix® 在中國的銷售額下降了3.4%,至1.23億歐元。
Multaq® 第一季度銷售額增長了13.9%,達到8700萬歐元,反映了美國的強勁銷售增長。
Rezurock® 是最近獲得美國食品藥品管理局批准的首款慢性移植物抗宿主病(cgVHD)治療藥物,其銷售額截至2021年11月9日(通過收購Kadmon)進行了合併,第一季度創造了4,100萬歐元的收入。Rezurock® 的表現反映了處方機構數量的迅速擴大,以及已失敗多種全身療法的 cGvHD 患者被壓抑的需求。
Praluent® 第一季度的銷售額為6900萬歐元,增長了21.4%,這得益於歐洲的表現。在世界其他地區,銷售額增長了6.7%。在中國,Praluent® 於2022年初被列入NDRL名單。
受新產品發佈和Solimix業績的支持,Soliqua® 第一季度銷售額增長了15.9%,達到5300萬歐元,這得益於世界其他地區(增長54.5%)。
非核心資產
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
Lantus® * | 671 | | -1.5 | % | | |
Aprovel® /Avapro® | 125 | | +17.8 | % | | |
| 其他非核心資產 | 1,187 | | -7.4 | % | | |
| 非核心資產總額 | 1,983 | | -4.2 | % | | |
第一季度,非核心資產銷售額下降了4.2%,至19.83億歐元,這反映了投資組合的精簡(-1.4ppt)、Lantus® 銷售額下降以及中國VBP第五波對Eloxatin® 和Taxotere® 銷售的影響。
Lantus® 銷售額為6.71億歐元,第一季度下降1.5%,這是由於歐洲銷售額下降,這反映了生物仿製藥的競爭和持續的Toujeo® 開關。
第一季度Aprovel® /Avapro® 的銷售額增長了17.8%,達到1.25億歐元,這要歸因於供應的部分改善,也與2021年第一季度的低基數相比。
製藥業務營業收入
在第一季度,藥品的業務營業收入(BOI)增長了12.6%,達到28.31億歐元(按恆定匯率增長8.8%)。投資回報率與淨銷售額的比率增長了0.3個百分點至38.6%(按CER計算為38.8%),反映了毛利率的提高。
疫苗
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
脊髓灰質炎/百日咳/Hib 疫苗 (包括 Hexaxim®/Hexyon®、Pentacel®、Pentaxim® 和 Imovax®) | 613 | | +10.3 | % | | |
腦膜炎疫苗 (包括 Menactra®、MenquadFi®) | 112 | | -16.4 | % | | |
加強疫苗(包括 Adacel®) | 109 | | +4.0 | % | | |
| 旅行和流行疫苗 | 98 | | +61.0 | % | | |
流感疫苗 (包括 Fluzone® HD/ Efluelda®、Fluzone®、Flublok®、Vaxigrip®) | 66 | | -18.2 | % | | |
| 其他疫苗 | 22 | | +11.1 | % | | |
| 疫苗總數 | 1,020 | | +6.8 | % | | |
.
第一季度疫苗銷售額增長6.8%,達到10.2億歐元,這得益於脊髓灰質炎/百日咳/Hib疫苗銷售額的兩位數增長以及旅行疫苗的部分恢復。
第一季度,脊髓灰質炎/百日咳/乙型流感嗜血桿菌(PPH)疫苗的銷售額增長了10.3%,達到6.13億歐元。在世界其他地區,PPH的銷售額增長了23.1%,這要歸因於Pentaxim® 與去年的低基數相比的強勁表現以及脊髓灰質炎招標交付的有利時機。在美國,PPH的銷售受到庫存波動和Vaxelis® 銷售額逐步增長的影響。提醒一下,Vaxelis® 的市場銷售不合並,利潤由賽諾菲和默沙東平均分配。
第一季度腦膜炎銷售額下降了16.4%,至1.12億歐元,這是由於拉丁美洲的銷售額下降反映了公開招標的價格競爭。
受世界其他地區的推動,加強疫苗銷售額在第一季度增長了4.0%,達到1.09億歐元。
第一季度旅行和地方疫苗銷售額增長了61.0%,達到9800萬歐元,這反映了歐洲和美國旅行疫苗的部分復甦,以及世界其他地區流行疫苗的銷售增加。
由於2021年第一季度的需求異常高,第一季度流感疫苗的銷售額下降了18.2%,達到6600萬歐元。
疫苗業務營業收入
與去年同期相比,第一季度的業務營業收入(BOI)下降了20.2%(按CER計算下降24.8%),至2.96億歐元。這反映了與Translate Bio和mRNA卓越中心相關的研發費用增加,以及第一三共在2021年第一季度記錄的付款。投資回報率與淨銷售額的比率為29.0%(2021年第一季度為40.5%,不包括第一三共的付款,為27.5%)。
消費者醫療保健
| | | | | | | | | | |
| 淨銷售額(百萬歐元) | Q1 2022 | 改變 在 CER | | |
| 過敏 | 226 | | +11.3 | % | | |
| 咳嗽和感冒 | 121 | | +118.2 | % | | |
| 疼痛護理 | 314 | | +22.5 | % | | |
| 消化健康 | 325 | | +13.8 | % | | |
| 身心健康 | 154 | | +14.9% | | |
| 個人護理 | 130 | | -2.4 | % | | |
| 非核心 /其他 | 58 | | -16.2 | % | | |
| 全面的消費者醫療保健 | 1,328 | | +17.0 | % | | |
在第一季度,消費者醫療保健(CHC)的銷售額增長了17.0%,達到13.28億歐元,這得益於歐洲和世界其他地區的增長。這一表現主要是由對咳嗽和感冒產品的強勁需求以及止痛護理和消化健康類別的表現所推動的。這種全球表現包括3%的積極價格影響。非核心產品的撤資對第一季度增長的影響為-0.6個百分點。
在美國,第一季度CHC銷售額增長了2.1%,達到3.1億歐元,這主要是由於供應限制導致的過敏類別的兩位數增長,部分抵消了個人護理和非核心資產銷售的下降。
在歐洲,第一季度CHC銷售額增長了21.0%,達到4.06億歐元,這主要反映了咳嗽和感冒以及止痛護理類別的強勁增長。
在世界其他地區,受所有類別增長的支持,第一季度CHC銷售額增長了22.8%,達到6.12億歐元。
CHC 業務營業收入
在第一季度,CHC的業務營業收入(BOI)增長了51.3%(按恆定匯率計算增長48.0%),達到5.96億歐元。投資回報率與淨銷售額的比率比上年增長了9.5個百分點至44.9%,這反映了強勁的營收增長以及與剝離非戰略資產相關的資本收益。
按地理區域劃分的公司銷售額
| | | | | | | | | | |
| 賽諾菲銷售額(百萬歐元) | Q1 2022 | 改變
在 CER | | |
| 美國 | 3,484 | +12.1 | % | | |
| 歐洲 | 2,392 | +6.7 | % | | |
| 世界其他地區 | 3,798 | +7.0 | % | | |
| 其中中國 | 901 | +13.4 | % | | |
| 其中日本 | 433 | +1.6 | % | | |
| 其中巴西 | 260 | -9.3 | % | | |
其中俄羅斯 | 185 | +34.4% | | |
| 賽諾菲總銷售額 | 9,674 | +8.6 | % | | |
受Dupixent® 強勁表現的支持,美國第一季度的銷售額增長了12.1%,達到34.84億歐元。
歐洲第一季度的銷售額增長了6.7%,達到23.92億歐元,這主要是由Dupixent® 的業績以及CHC的強勁增長所推動的。
在世界其他地區,第一季度的銷售額增長了7.0%,達到37.98億歐元,這反映了Dupixent®、CHC和疫苗的業績,這在很大程度上抵消了普通藥品銷售額的下降。在中國的銷售額增長了13.4%,達到9.01億歐元,這主要是由於Dupixent®、疫苗和CHC的增長。在日本,受Dupixent® 和Sarclisa® 的推動,第一季度銷售額增長了1.6%,達到4.33億歐元,這足以抵消普通藥品銷售額的下降。在俄羅斯,由於咳嗽、感冒和流感相關銷售的強勁,疫苗銷售的增加以及藥房和患者層面的空前庫存銷售在第一季度增長了34.4%。3月,賽諾菲決定停止任何與其在俄羅斯供應基本和改變生活的藥物和疫苗無關的新支出。這包括所有廣告和促銷支出。
2022年第一季度末的研發最新情況
監管更新
•歐洲藥品管理局人用藥品委員會(CHMP)已通過一項積極意見,建議延長Dupixent®(dupilumab)在歐盟的批准期限,包括對患有嚴重哮喘的6至11歲患有2型炎症的兒童進行額外維持治療,其特徵是血液嗜酸性粒細胞升高和/或分數呼出的一氧化氮(FeNO)升高,兩種維持療法的控制不力。
•美國食品藥品監督管理局(FDA)已接受Dupixent® 的補充生物製劑許可申請(sBLa)進行優先審查,該申請是針對患有中度至重度特應性皮炎的6個月至5歲的兒童,其病情無法通過局部處方療法得到充分控制或不建議使用這些療法。美國食品和藥物管理局關於這種研究用途的決定的目標行動日期是2022年6月9日。Dupixent® 仍然是該適應症中唯一獲準用於6歲及以上患者的生物藥物。
•美國食品和藥物管理局已接受Dupixent® 每週300毫克的補充生物製劑許可申請(sBLA)進行優先審查,該申請用於治療12歲及以上患有嗜酸性食管炎(EoE)的成人和青少年,嗜酸性食管炎(EoE)是一種損害食道和吞嚥能力的慢性進行性2型炎性疾病。
•美國食品藥品管理局已批准Enjaymo™(sutimlimab-jome),這是第一種也是唯一獲得批准的減少冷凝集素病(CAD)成人溶血導致的紅細胞輸血需求的治療方法。冠心病是一種慢性罕見的血液病,影響着美國約5,000人的生活。賽諾菲估計,每年約有3,200名患者接受藥物治療,Enjaymo在未來幾年可能達到約25%的市場份額。
•日本厚生勞動省(MHLW)已批准Xenpozyme®(olipudase alfa)的上市許可,用於治療出現酸性鞘磷脂酶缺乏症(ASMD)非中樞神經系統表現的成人和兒童患者。Xenpozyme® 是目前唯一獲批的ASMD治療藥物,也是賽諾菲首款獲得SAKIGAKE或先鋒稱號批准的療法,這是日本政府的監管快速通道,旨在促進創新型新醫療產品的研究和開發,以解決未滿足的緊急醫療需求。
•EMA已根據加速評估程序接受了nirsevimab的上市許可申請(MAA)。賽諾菲和阿斯利康正在開發第一種在研的長效抗體,旨在保護所有嬰兒在呼吸道合胞病毒(RSV)季節免受醫學介入的下呼吸道感染(LRTI)的侵害。《新英格蘭醫學雜誌》(NEJM)公佈了MELODY試驗的詳細三期結果。在這項研究中,隨着在足月或晚期早產兒出生的健康嬰兒進入他們的第一個呼吸道合胞病毒季節,與安慰劑相比,由呼吸道合胞病毒引起的細支氣管炎(例如細支氣管炎或肺炎)的發病率降低了74.5%。
•EMA已開始評估賽諾菲-葛蘭素史克第一代重組 COVID-19 疫苗的有條件上市許可申請,該疫苗是主要疫苗和旨在促進所有目前批准的 COVID-19 疫苗平臺的增強疫苗。對 VAT02 COVID-19 加強試驗的最終分析證實,在疫苗平臺上普遍能夠將中和抗體增強18至30倍。VAT08 初級系列試驗在血清陰性人羣中接種兩劑賽諾菲-葛蘭素史克疫苗,顯示出對重度 COVID-19 疾病和住院的療效為 100%,對中度或重度 COVID-19 疾病的療效為 75%,對任何有症狀的 COVID-19 疾病的療效為 57.9%,符合當今以關注變種為主的環境中的預期疫苗有效性。當賽諾菲-葛蘭素史克疫苗用作兩劑初級疫苗時,與增強劑量相比,中和抗體增加了84至153倍。
•賽諾菲和Regeneron宣佈自願取消Libtayo®(cemiplimab-rwlc)的sBLA,作為晚期宮頸癌患者的二線治療藥物。該決定是在兩家公司和美國食品藥品管理局無法就某些上市後研究達成一致之後做出的。與美國以外監管機構的討論仍在進行中。
投資組合更新
第 3 階段:
•賽諾菲和索比宣佈了評估每週一次的重組 efanesoctog alfa(BIVV001)的安全性、有效性和藥代動力學的關鍵性 XTEND-1 研究的積極結果
VIII因子療法,適用於先前接受過治療的年齡在12歲以上的嚴重血友病A患者。該研究符合主要和次要終點,顯示在52周內預防重度A型血友病患者的出血具有臨牀意義,中位年化出血率(ABR)為0,平均ABR為0.71,並且根據患者內部比較,優於先前的預防因子VIII替代療法。賽諾菲計劃在2022年中期在美國提交數據。歐盟的提交將遵循正在進行的Xtend-Kids兒科研究的數據,該研究預計將於2023年提交。
•第二項試驗(PRIME)評估了Dupixent® 用於治療未受控制的結節性瘙癢(PN)的成年人,達到了其主要和關鍵的次要終點,顯示與安慰劑相比,在本研究環境中,與安慰劑相比,它在24周時顯著減少了瘙癢和皮膚損傷。數據證實了先前報告的3期 PRIME2 試驗的陽性結果。
•評估皮下Dupixent® 治療不明來源慢性瘙癢(CPUO)的成年參與者的療效和安全性的LIBERTY-CPUO-CHIC研究已經啟動,並招募了第一位參與者。
•根據預先指定的中期分析,評估奧馬珠單抗難治的慢性自發性蕁麻疹(CSU)患者的CUPIXENT® 的B研究因無效而停止。儘管在減少瘙癢和蕁麻疹方面觀察到積極的數字趨勢,但中期分析的結果並未顯示出主要終點的統計學意義。LIBERTY-CUPID關鍵計劃於2020年啟動,其戰略加速了直接進入第三階段。先前報告的3期試驗(研究A)評估了另一組生物學天真的患者,在24周時達到了其主要和所有關鍵次要終點,結果表明,與單獨使用抗組胺藥相比,在標準護理抗組胺藥中添加Dupixent可顯著減少瘙癢和蕁麻疹。賽諾菲和Regeneron仍然致力於為科羅拉多州立大學抗組胺藥不受控制的患者推廣Dupixent,正在評估後續措施,包括與監管機構的討論。
•該臨牀試驗評估了Amcenestrant與他莫昔芬對因治療相關毒性(AMEERA-6)而停止輔助芳香酶抑制劑(AI)治療的HR+早期乳腺癌患者的療效和安全性,招募了第一位參與者。
第 2 階段:
•三項評估rilzabrutinib的研究已經啟動並招收了第一批參與者:一項針對中度至重度哮喘成人的隨機、雙盲、安慰劑對照研究、一項在科羅拉多州立大學進行的隨機、雙盲、安慰劑對照研究,以及一項針對温熱性自身免疫性溶血性貧血(WaiHA)成人的開放標籤研究。
•這項評估SAR444245 與其他抗癌療法聯合治療成人晚期或轉移性胃腸道癌的臨牀益處的非隨機和開放標籤研究已經啟動,並對第一位參與者進行了治療。
•根據一項獨立中心審查的評估,這項關鍵的 AMEERA-3 臨牀試驗評估了經過研究優化的口服選擇性雌激素受體降解劑(SERD)作為單一療法,與醫生選擇的內分泌治療相比,對服用激素療法或之後進展的局部晚期或轉移性 ER+/HER2-乳腺癌患者的單一療法,未達到改善無進展存活率的主要終點。
第 1 階段:
•評估4種正在研究的HSV 2疫苗對由HSV 2(HSV15)引起的複發性生殖器皰疹的成年人的安全性和有效性的研究已經停止。
鑑於烏克蘭戰爭和烏克蘭人民的苦難,賽諾菲調整了在該地區的臨牀試驗實施情況。該公司決定停止為俄羅斯和白俄羅斯正在進行的臨牀試驗招募任何新的患者,儘管它將繼續治療已經入組的患者。在烏克蘭,賽諾菲正在盡其所能為目前參加賽諾菲贊助的臨牀試驗的患者提供支持和供應,包括將他們轉移到烏克蘭境內或鄰國。由於預計可能會丟失數據,該公司目前正在激活新的臨牀站點,並在未受戰爭影響的地區,擴大患者註冊人數。這可能會導致其多發性硬化症和慢性阻塞性肺病關鍵試驗的初步完成日期發生變化,先前公佈的提交時間表保持不變。
收購和重大合作
•賽諾菲和黑石集團宣佈了一項戰略風險分擔合作,根據該合作,由黑石生命科學管理的基金將出資高達3億歐元,用於加速皮下製劑的全球關鍵研究和臨牀開發計劃,以及
抗CD38抗體Sarclisa® 的交付預計將於2022年下半年開始,用於治療多發性骨髓瘤(MM)患者。
•賽諾菲宣佈了研究合作和許可協議,將利用其利用實際患者樣本的端到端人工智能驅動平臺,與Exscientia合作開發多達15種跨腫瘤學和免疫學的新型小分子候選藥物。兩家公司自2016年以來一直在合作,賽諾菲在2019年批准了Exscientia的新型雙特異性小分子候選藥物,該候選藥物能夠靶向炎症和免疫學中的兩個不同靶標。
•賽諾菲宣佈完成對Amunix Pharmicals, Inc.的收購,增加了前景光明的T細胞參與劑和細胞因子療法產品線。此次收購還為他們提供了pro-XTEN、XPAT和XPAC技術的機會,以提供下一代條件激活的生物製劑。該技術平臺與賽諾菲現有的研發平臺高度互補,支持賽諾菲努力加快和擴大其對腫瘤患者創新藥物的貢獻,目前約有20種分子正在開發中。
•賽諾菲和西根宣佈了一項獨家合作協議,旨在設計、開發和商業化針對最多三個癌症靶標的抗體藥物偶聯物(ADC)。此次合作將利用賽諾菲專有的單克隆抗體技術和西根的專有ADC技術。
•賽諾菲和IGM Biosciences宣佈簽署一項全球獨家合作協議,以創造、開發、製造和商業化針對三個腫瘤靶標和三個免疫學/炎症靶標的IgM抗體激動劑。
截至2022年3月31日的研發渠道更新可在賽諾菲的網站上查閲:
https://www.sanofi.com/en/science-and-innovation/research-and-development
企業社會責任戰略的實施進展情況
賽諾菲在改善藥品供應方面繼續取得進展
與賽諾菲的准入承諾相關的可持續發展相關債券
賽諾菲致力於將可持續發展納入其 “Play to Win” 業務戰略及其投資和融資戰略。在發行首批與可持續發展相關的信貸循環融資機制一年多之後,賽諾菲成功地對首張以藥品供應指數為指數的可持續發展掛鈎債券進行了定價。名義金額為6.5億歐元的票據,與賽諾菲承諾通過其全球健康非營利部門改善中低收入國家獲得基本藥物的機會有關。該交易表明了賽諾菲對社會的承諾,即確保全球弱勢羣體獲得醫療保健。
賽諾菲的准入和定價原則
賽諾菲在與醫療保健系統合作方面有着悠久的歷史,以使有需要的患者能夠獲得和負擔得起的治療。賽諾菲理解並對患者可負擔藥品的價格感到擔憂,賽諾菲鼓勵各國提高醫療支出的價值。但是,該公司堅信,製藥行業只是醫療保健系統中可以而且應該為這一目標做出貢獻的眾多利益相關者之一。鑑於人們對醫療成本上漲的擔憂與日俱增,賽諾菲制定了一種定價方法,該方法反映了其對廣泛擴大患者獲得藥品和疫苗的機會,同時保持對研發的可持續投資的承諾。它提出的准入和定價原則建立在兩大支柱之上:
—在新藥或疫苗推出時定價和准入的明確理由
—將可負擔性標準納入新產品的定價考慮因素
當公司設定新藥的價格時,它遵循嚴格的結構化流程,其中包括與外部利益相關者的磋商,並考慮以下因素:
—價值的整體評估(臨牀、社會和福祉以及經濟價值)
—發佈時類似治療方法的可用性或預期情況
—市場負擔新藥的能力
—發佈時藥物或疫苗特有的獨特因素
賽諾菲在其全球網站上披露了有關其全球准入和定價原則的更多信息,特別是在賽諾菲美國網站上披露了有關其美國定價政策的更多信息。
建立合作伙伴關係以支持賽諾菲對兒科癌症的承諾
對於兒童癌症旗艦項目,賽諾菲的目標是與各行各業的合作伙伴合作,以提高兒科研究的知識。
在研究領域,賽諾菲現在是兒科臨牀前概念驗證平臺(ITCC-P4)的合作伙伴之一,該平臺旨在實現對新型分子靶向化合物進行最先進的前期臨牀前測試。賽諾菲最近參與了由美國國立衞生研究院基金會(FNIH)牽頭的兒科腫瘤學相關靶點合作,以審查和確定目標的優先順序。
在創新臨牀試驗的開發方面,賽諾菲很榮幸能與醫學博士安德森癌症中心、古斯塔夫·魯西研究所、費城兒童醫院、達納-法伯癌症研究所、紀念斯隆·凱特琳癌症中心的專家密切合作。所有這些努力都以患者需求為中心,賽諾菲對兒童癌症倡導團體的支持,包括抗擊兒童癌症聯盟(CAC2)和Imagine for Margo就突顯了這一點。
ESG 控制面板
2020年,隨着賽諾菲重申其企業社會責任雄心,公司審查並更新了其舉措組合。下圖顯示的數字突顯了賽諾菲企業社會責任戰略實施的持續進展。
實惠的訪問權限
賽諾菲全球健康是公司內部於2021年4月成立的非營利機構,旨在為40個最低收入國家的患者提供涵蓋廣泛治療領域的30種賽諾菲藥物。除了提供的產品外,賽諾菲全球健康還將專注於綜合計劃,確保長期為患者提供最佳的護理管理。
賽諾菲還致力於幫助1,000名無法獲得治療的罕見疾病患者,並將每年捐贈100,000瓶藥物用於治療。這種情況還在繼續
賽諾菲30年來一直致力於為患有罕見疾病(例如法布里病、高歇病或龐貝病)的患者提供服務,這些疾病的治療機會通常有限。
關於准入的第三項舉措是為所有新產品制定全球准入計劃,在推出後的兩年內在選定的相關市場上市。
| | | | | | | | |
儀錶板提供實惠的訪問權限 | | |
賽諾菲全球健康 |
| 2021 財年 | Q1 2022 |
瘧疾 | •9,276,504 名患者接受了治療 •23 個國家
| •1,024,170 名患者接受了治療 •8 個國家 |
肺結核 | •146,356 名患者接受了治療 •28 個國家
| •35,094 名患者接受了治療 •11 個國家 |
NCD | •40,439 名患者接受了治療 •16 個國家
| •46,300 名患者接受了治療 •12 個國家 |
捐贈小瓶 |
| 2021 財年 | Q1 2022 |
# 接受治療的患者 | 1,083 | 998 |
#Vials 捐贈了 | 109,677 | 22,682 |
全球訪問計劃 |
| 2021 財年 | Q1 2022 |
訪問計劃數量 | 試點階段正在進行中 |
為弱勢社區創新
賽諾菲繼續努力抗擊脊髓灰質炎和昏睡病,這是其解決全球健康問題的兩項傳統計劃。
賽諾菲從一開始就參與了對抗脊髓灰質炎的鬥爭,並將繼續在脊髓灰質炎疫苗的交付中發揮關鍵作用。該公司還承諾與世衞組織合作,到2030年消除昏睡病。
賽諾菲研發目標的一部分是開發創新藥物,以消除兒童癌症死亡。
| | | | | | | | |
弱勢社區儀錶板 |
根除脊髓灰質炎 |
| 2021 財年 | Q1 2022 |
# 已提供的 IPV 劑量 | 為全球疫苗免疫聯盟國家向聯合國兒童基金會提供了5,050萬劑IPV疫苗
| 為全球疫苗免疫聯盟國家向聯合國兒童基金會提供了1600萬劑IPV疫苗
|
消除昏睡病
|
| 2020 財年 | 2021 財年 |
# 接受測試的患者 | 160 萬 | 2022年第二季度可用的數據 |
# 接受治療的患者 | 663 |
開發針對兒童癌症的創新藥物 |
| 2021 財年 | Q1 2022 |
已識別的資產數量 | 確定了 2 項資產;臨牀前研究已開始 | 臨牀研究方案准備的 2 項資產中的 1 項 |
保護地球
為了更好地保護資源,賽諾菲計劃在2027年之前拆除疫苗的所有塑料吸塑包裝。此外,該公司承諾到2025年對所有新產品進行生態設計。為了到2030年將其温室氣體排放量減少55%,賽諾菲的所有基地都將使用100%的可再生能源電力,該公司已設定了到2030年實現其車隊碳中和的目標。
| | | | | | | | | | | |
星球儀錶板 |
無水泡疫苗 |
| 2021 財年 | Q1 2022 |
% 無泡疫苗 | 生產的無泡疫苗有 29%
| 數據每年更新一次 |
生態設計 |
| 2021 財年 | Q1 2022 |
生命週期分析 (LCA) 的數量 | 進行了4次LCA
| 4 個 LCA 已完成,1 個正在進行中 生態設計數字解決方案項目啟動 |
範圍 1 和 2 排放 |
| Q4 2021 | Q1 2022 |
與 2019 年相比,温室氣體減少 | -25% | -26% |
可再生電力
|
| Q4 2021 | Q1 2022 |
來自可再生能源的電力消耗百分比 | 50% | 61% |
環保車隊 |
| Q4 2021 | Q1 2022 |
環保車隊佔總車隊的百分比 | 26.2% 生態艦隊 | 28.7% 的生態艦隊 |
建設包容性工作場所
作為一家跨國公司,賽諾菲致力於確保其領導者反映其所服務的社區和患者。公司致力於繼續培育一個所有員工都有平等機會在公司內部擔任責任職位的組織。賽諾菲的目標是到2025年讓40%的女性擔任高級管理職位,50%的女性擔任高級領導職位。賽諾菲將繼續參與其經營所在社區的社會和經濟活動。最後,賽諾菲正在將其對社會的承諾嵌入其領導者的職業發展道路中,以增強其決策的社會影響力。
| | | | | | | | | | | | | | |
包容性工作場所的儀錶板 |
| Q4 2021 | Q1 2022 |
多元化的高級領導層 |
女性百分比 | 34.2% 的高層管理人員 40.1% 的高級領導人 | 35.1% 的高層管理人員 40.4% 的高級領導人
|
在我們開展業務的所有社區中加強社會和經濟參與 |
| 2021 財年 | Q1 2022 |
# 志願者 | 4,975 名志願者 | 下一次更新將在 2022 年第二季度 |
# 小時 | 26,906 小時 |
從領袖到公民 |
| Q4 2021 | Q1 2022 |
關鍵績效指標 | 計劃於2022年推出 |
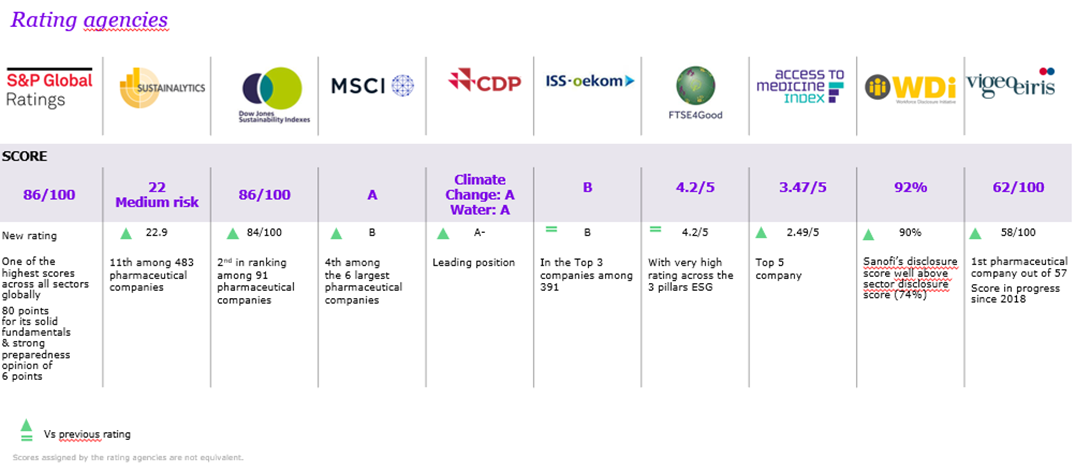
ESG 評級
在標準普爾全球評級(S&P)進行的ESG評估(環境、社會、治理)中,賽諾菲被公認為最致力於可持續發展的公司之一。
ESG評估給賽諾菲打出了86分(滿分100分),是全球所有行業中得分最高的分數之一。賽諾菲的ESG概況因其穩健的基本面而獲得80分,另外還因其出色的風險和機遇意識以及預測和適應各種長期可能的幹擾的能力而獲得了6分的強有力的準備意見。
賽諾菲的社交概況在社區類別中被評為 “領先”,這凸顯了其最近在2021年成立的全球衞生部門,該部門旨在為40個最低收入國家的患者提供涵蓋廣泛治療領域的30種賽諾菲藥物。該報告還指出,賽諾菲致力於消滅脊髓灰質炎、昏睡病和瘧疾等傳染病。
賽諾菲因其對藥品供應的承諾而著稱,特別是在弱勢社區。該研究認識到 “所有地區的醫療保健挑戰和不平等日益加劇”,並確定成立一個致力於為最貧窮國家提供基本藥物的非營利機構是賽諾菲的主要差異化因素之一。
近幾個月來,賽諾菲社會影響力戰略的持續實施使該公司在大多數ESG排名中的排名或等級出現了一系列積極的更新。
Covid 更新
賽諾菲和葛蘭素史克在歐洲申請了其第一代 COVID-19 疫苗的監管授權,其數據支持將其用作通用增強劑,旨在促進所有目前批准的 COVID-19 疫苗平臺。此外,兩家公司正在開發下一代加強疫苗,旨在為從原始菌株到 Omicron BA.2 的所有相關變種提供廣泛的保護。數據(VAT02 隊列2)預計將在2022年第二季度公佈。
2022年第一季度財務業績
企業淨收入2
2022年第一季度,賽諾菲創造了96.74億歐元的淨銷售額,增長了12.6%(按恆定匯率計算增長8.6%)。
第一季度其他收入增長了28.5%(按恆定匯率增長23.7%),至3.79億歐元,其中包括VaxServe對非賽諾菲產品的銷售貢獻2.86億歐元(按恆定匯率增長16.7%)。
第一季度毛利增長了15.7%(按恆定匯率計算增長11.1%),達到71.75億歐元。與2021年第一季度相比,毛利率增長了2.0個百分點至74.2%,這反映了藥品毛利率的強勁提高(從75.2%提高到77.9%),這得益於專業護理權重增加、工業事務效率提高和特許權使用費支出減少的有利影響。疫苗毛利率從62.0%略微下降至61.6%。CHC毛利率為67.3%,下降0.7個百分點。
第一季度研發(R&D)支出增長了17.5%(按CER計算增長14.0%),達到14.89億歐元,這反映了優先資產開發的增加以及最近的收購。
第一季度銷售一般和管理費用(SG&A)增長了8.4%,至23.79億歐元。在CER,銷售和收購支出增長了4.3%,這反映了對專業護理增長驅動因素的商業投資增加,但持續的精簡舉措部分抵消了這些投資。在第一季度,銷售和收購佔銷售額的比率與去年同期相比下降了0.9個百分點至24.6%。
第一季度的運營支出為38.68億歐元,按CER計算增長了11.8%和7.8%。
第一季度扣除支出後的其他當前營業收入為-2.65億歐元,而2021年第一季度為-1.01億歐元。扣除支出後的其他當前營業收入包括4.77億歐元的支出(2021年第一季度的支出為2.79億歐元),相當於單克隆抗體聯盟Regeneron的利潤份額,Regeneron對開發成本的報銷以及Regeneron產生的商業化相關費用的報銷。在第一季度,該項目還包括與普通藥品和CHC投資組合精簡相關的2.32億歐元淨資本收益,而2021年同期為5,600萬歐元。
員工利潤份額為3000萬歐元,而2021年第一季度為900萬歐元,其中包括與Vaxelis® 相關的美國利潤份額。
第一季度業務營業收入2(BOI)增長了16.2%,達到30.65億歐元。在CER,投資回報率增長了12.2%。投資回報率與淨銷售額的比率增長了1.0個百分點至31.7%,這主要反映了毛利率的提高。
淨財務支出為7,800萬歐元,而2021年同期為8400萬歐元。
第一季度的有效税率為19.0%,去年同期為21.0%。賽諾菲預計,到2022年,其有效税率將達到19%左右。
第一季度業務淨收入2增長了20.2%,至24.24億歐元,按恆定匯率計算增長了16.0%。與2021年第一季度相比,企業淨收入與淨銷售額的比率增長了1.6個百分點至25.1%。
2022年第一季度,每股業務收益2(每股收益)為1.94歐元,按報告計算增長20.5%(按恆定匯率增長16.1%)。平均已發行股票數量為12.492億股,而2021年第一季度為12.493億股。
報告的《國際財務報告準則》淨收益與企業淨收益的對賬(見附錄4)
2022年第一季度,國際財務報告準則的淨收入為20.09億歐元。不包括在業務淨收入中的主要項目是:
•4.49億歐元的攤銷費用涉及被收購公司的無形資產(主要是Genzyme:1.45億歐元,Bioverativ:8,800萬歐元,勃林格殷格翰CHC業務:4,800萬歐元,Ablynx:4200萬歐元,Kadmon:3700萬歐元)以及收購的無形資產(許可證/產品:2400萬歐元)。這些項目對公司沒有現金影響。
•無形資產減值500萬歐元。
•與精簡計劃相關的重組成本和類似項目為1.75億歐元。
附錄 7 中的 2 定義
•由上述項目產生的2.32億歐元的税收影響,主要包括無形資產攤銷和減值產生的9,600萬歐元的遞延税款以及與重組成本和類似項目相關的4600萬歐元(見附錄4)。
資本分配
2022年第一季度,扣除營運資金(-4.68億歐元)和資本支出(-3.56億歐元)的淨變動,重組、收購和處置前的自由現金流下降了15.5%,至19.98億歐元。在收購3(-2.77億歐元)、出售收益3(+3.47億歐元)以及與重組和類似項目相關的付款(-3.61億歐元)後,自由現金流4下降了11.3%,至17.07億歐元。收購Amunix(-8.03億歐元)後,淨負債從2021年12月31日的99.83億歐元減少到2022年3月31日的94.32億歐元(扣除87.28億歐元的現金和現金等價物)。
3 每筆交易不超過5億歐元(包括與交易相關的所有付款)。
4 非公認會計準則財務指標(定義見附錄7)。
前瞻性陳述
本新聞稿包含經修訂的1995年《私人證券訴訟改革法》中定義的前瞻性陳述。前瞻性陳述是不是歷史事實的陳述。這些陳述包括預測和估計及其基本假設,有關未來財務業績、事件、運營、服務、產品開發和潛力的計劃、目標、意圖和預期的陳述,以及有關未來業績的陳述。前瞻性陳述通常由 “期望”、“預期”、“相信”、“打算”、“估計”、“計劃” 和類似表述來識別。儘管賽諾菲管理層認為此類前瞻性陳述中反映的預期是合理的,但提醒投資者,前瞻性信息和陳述存在各種風險和不確定性,其中許多風險和不確定性難以預測,通常超出賽諾菲的控制範圍,這可能導致實際業績和發展與前瞻性信息和陳述所表達、暗示或預測的業績和發展存在重大差異。除其他外,這些風險和不確定性包括研發固有的不確定性、未來的臨牀數據和分析,包括上市後的分析、監管機構(例如FDA或EMA)關於是否及何時批准任何此類候選產品可能申請的任何藥物、設備或生物學應用的決定,以及他們關於標籤和其他可能影響此類候選產品可用性或商業潛力的事項的決定,候選產品如果獲得批准的事實可能不會在商業上取得成功、替代療法的未來批准和商業成功、賽諾菲從外部增長機會中受益、完成關聯交易和/或獲得監管許可的能力、與知識產權和任何相關的未決或未來訴訟相關的風險以及此類訴訟的最終結果、匯率和現行利率的趨勢、動盪的經濟和市場狀況、成本控制舉措及其後續變化,以及 COVID-19 將產生的影響關係到我們、我們的客户、供應商、供應商和其他業務夥伴,以及其中任何一個的財務狀況,以及我們的員工和整個全球經濟的狀況。COVID-19 對上述任何內容的任何實質性影響也可能對我們產生不利影響。這種情況正在迅速變化,可能會產生我們目前尚未意識到的額外影響,並可能加劇先前確定的其他風險。風險和不確定性還包括賽諾菲在向美國證券交易委員會和AMF提交的公開文件中討論或確定的不確定性,包括賽諾菲截至2021年12月31日止年度的20-F表年度報告中 “風險因素” 和 “關於前瞻性陳述的警示性聲明” 中列出的不確定性。除適用法律的要求外,賽諾菲不承擔任何更新或修改任何前瞻性信息或陳述的義務。
附錄
| | | | | |
附錄 1: | 2022年第一季度按GBU、特許經營、地理區域和產品劃分的銷售額 |
附錄二: | 2022年第一季度企業淨損益表 |
附錄 3: | 2022年第一季度合併損益表 |
附錄 4: | 報告的《國際財務報告準則》淨收益與企業淨收入的對賬 |
附錄 5: | 淨負債的變化 |
| |
| |
附錄 6: | 貨幣敏感度 |
附錄 7: | 非公認會計準則財務指標的定義 |
媒體關係
Sandrine Guendoul | + 33 6 25 25 09 14 25 | sandrine.guendoul@sanofi.com
尼古拉斯·奧布里斯特 | + 33 6 77 21 27 55 | nicolas.obrist@sanofi.com
Victor Rouault | + 33 6 70 93 71 40 | victor.rouault@sanofi.com
Sally Bain | + 1 617 834 6026 | sally.bain@sanofi.com
投資者關係
Eva Schaefer-Jansen | + 33 7 86 80 56 39 | eva.schaefer-jansen@sanofi.com
Arnaud Delépine | + 33 6 73 69 36 93 | arnaud.delepine@sanofi.com
Corentine Driancourt | + 33 6 40 56 92 | corentine.driancourt@sanofi.com
Felix Lauscher | + 1 908 612 7239 | felix.lauscher@sanofi.com
普里亞·南杜裏 | +1 617 764 6418 | priya.nanduri@sanofi.com
Nathalie Pham | + 33 7 85 93 30 17 | nathalie.pham@sanofi.com
附錄1:按GBU、特許經營、地理區域和產品劃分的2022年第一季度淨銷售額
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年第一季度(百萬歐元) | 總銷售額 | % CER | % 已報告 | | 美國 | % CER | | 歐洲 | % CER | | 世界其他地區 | % CER |
| Dupixent | 1,614 | +45.7 | % | +54.2 | % | | 1,176 | +38.1 | % | | 211 | +53.3 | % | | 227 | +88.0 | % |
| 奧巴吉奧 | 491 | -6.6 | % | -1.8 | % | | 329 | -9.7 | % | | 132 | 0.0 | % | | 30 | 0.0 | % |
| 萊姆特拉達 | 25 | 0.0 | % | +4.2 | % | | 11 | 0.0 | % | | 6 | +20.0 | % | | 8 | -11.1 | % |
| Kevzara | 95 | +61.4 | % | +66.7 | % | | 50 | +88.0 | % | | 28 | +33.3 | % | | 17 | +54.5 | % |
| 神經病學和免疫學 | 611 | +0.3 | % | +5.2 | % | | 390 | -2.9 | % | | 166 | +5.1 | % | | 55 | +10.2 | % |
| Cerezyme | 165 | -6.7 | % | -7.3 | % | | 45 | +5.0 | % | | 60 | -4.8 | % | | 60 | -14.7 | % |
| Cerdelga | 67 | +3.2 | % | +8.1 | % | | 36 | +3.1 | % | | 27 | +3.8 | % | | 4 | 0.0 | % |
| Myozyme | 235 | -3.0 | % | 0.0 | % | | 82 | -13.6 | % | | 103 | +4.1 | % | | 50 | +2.0 | % |
| Nexviazyme | 30 | 0.0 | % | 0.0 | % | | 26 | 0.0 | % | | 1 | 0.0 | % | | 3 | 0.0 | % |
| Fabrazyme | 220 | +2.4 | % | +5.8 | % | | 105 | +4.3 | % | | 58 | +1.8 | % | | 57 | 0.0 | % |
| Aldurazyme | 69 | +3.0 | % | +4.5 | % | | 13 | 0.0 | % | | 24 | 0.0 | % | | 32 | +6.5 | % |
| 罕見病 | 804 | +1.9 | % | +4.4 | % | | 307 | +7.2 | % | | 274 | +1.9 | % | | 223 | -3.8 | % |
| 傑夫塔納 | 98 | -25.4 | % | -22.2 | % | | 68 | +8.6 | % | | 11 | -75.6 | % | | 19 | -13.0 | % |
| Fasturtec | 40 | +8.6 | % | +14.3 | % | | 24 | +9.5 | % | | 12 | +9.1 | % | | 4 | 0.0 | % |
| Libtayo | 41 | +53.8 | % | +57.7 | % | | — | 0.0 | % | | 34 | +50.0 | % | | 7 | +75.0 | % |
| Sarclisa | 65 | +85.3 | % | +91.2 | % | | 25 | +100.0 | % | | 22 | +69.2 | % | | 18 | +88.9 | % |
| 腫瘤學 | 244 | +6.8 | % | +10.4 | % | | 117 | +20.9 | % | | 79 | -14.3 | % | | 48 | +23.1 | % |
| Alprolix | 108 | +2.0 | % | +8.0 | % | | 92 | +8.9 | % | | — | 0.0 | % | | 16 | -23.8 | % |
| Eloctate | 138 | -3.0 | % | +3.0 | % | | 108 | -1.9 | % | | — | 0.0 | % | | 30 | -6.5 | % |
| Cablivi | 46 | +15.8 | % | +21.1 | % | | 22 | -4.5 | % | | 23 | +46.7 | % | | 1 | 0.0 | % |
| 罕見血液病 | 293 | +1.8 | % | +7.7 | % | | 223 | +2.5 | % | | 23 | +46.7 | % | | 47 | -13.2 | % |
| 專業護理 | 3,566 | +17.8 | % | +23.3 | % | | 2,213 | +19.3 | % | | 753 | +12.0 | % | | 600 | +20.4 | % |
| | | | | | | | | | | | |
| 洛文諾克斯 | 377 | -8.2 | % | -6.0 | % | | 5 | -61.5 | % | | 185 | -0.5 | % | | 187 | -11.9 | % |
| Toujeo | 274 | +6.3 | % | +8.3 | % | | 58 | -12.9 | % | | 104 | +9.6 | % | | 112 | +15.5 | % |
| Plavix | 261 | 0.0 | % | +4.0 | % | | 3 | 0.0 | % | | 26 | -10.3 | % | | 232 | +1.4 | % |
| Multaq | 87 | +13.9 | % | +20.8 | % | | 78 | +17.7 | % | | 5 | -16.7 | % | | 4 | 0.0 | % |
| 胸腺球蛋白 | 97 | +13.8 | % | +21.3 | % | | 56 | +13.0 | % | | 8 | 0.0 | % | | 33 | +19.2 | % |
| Mozobil | 58 | +5.8 | % | +11.5 | % | | 31 | +3.6 | % | | 15 | +7.1 | % | | 12 | +10.0 | % |
| Praluent | 69 | +21.4 | % | +23.2 | % | | — | -100.0 | % | | 53 | +44.4 | % | | 16 | +6.7 | % |
| soliqua/iglarLixi | 53 | +15.9 | % | +20.5 | % | | 30 | +3.8 | % | | 8 | 0.0 | % | | 15 | +54.5 | % |
| Rezurock | 41 | 0.0 | % | 0.0 | % | | 41 | 0.0 | % | | — | 0.0 | % | | — | 0.0 | % |
| 其他核心資產 | 277 | +1.9 | % | +4.5 | % | | 39 | -37.5 | % | | 95 | +10.6 | % | | 143 | +13.7 | % |
| 核心資產 | 1,594 | +4.7 | % | +8.1 | % | | 341 | +5.0 | % | | 499 | +6.5 | % | | 754 | +3.4 | % |
| 蘭圖斯 | 671 | -1.5 | % | +2.9 | % | | 208 | +0.5 | % | | 112 | -11.2 | % | | 351 | +0.9 | % |
| Aprovel | 125 | +17.8 | % | +23.8 | % | | 1 | -50.0 | % | | 21 | -8.7 | % | | 103 | +27.6 | % |
| 其他非核心資產 | 1,187 | -7.4 | % | -5.6 | % | | 95 | -2.2 | % | | 300 | -8.8 | % | | 792 | -7.4 | % |
| 非核心資產 | 1,983 | -4.2 | % | -1.3 | % | | 304 | -0.7 | % | | 433 | -9.4 | % | | 1,246 | -3.1 | % |
| 工業銷售 | 183 | -4.3 | % | -2.7 | % | | 10 | -18.2 | % | | 168 | +5.8 | % | | 5 | -71.4 | % |
| 普通藥物 | 3,760 | -0.7 | % | +2.4 | % | | 655 | +1.8 | % | | 1,100 | -0.5 | % | | 2,005 | -1.5 | % |
| | | | | | | | | | | | |
| 藥品 | 7,326 | +7.5 | % | +11.6 | % | | 2,868 | +14.8 | % | | 1,853 | +4.2 | % | | 2,605 | +2.9 | % |
| | | | | | | | | | | | |
| 脊髓灰質炎/百日咳/乙型流感嗜血桿菌 | 613 | +10.3 | % | +15.0 | % | | 125 | -14.1 | % | | 78 | 0.0 | % | | 410 | +23.1 | % |
| 加強疫苗 | 109 | +4.0 | % | +9.0 | % | | 53 | +2.1 | % | | 31 | -8.8 | % | | 25 | +33.3 | % |
| 腦膜炎 | 112 | -16.4 | % | -12.5 | % | | 76 | -6.6 | % | | 2 | 0.0 | % | | 34 | -34.6 | % |
| 流感疫苗 | 66 | -18.2 | % | -14.3 | % | | 12 | 0.0 | % | | 4 | -55.6 | % | | 50 | -29.4 | % |
| 旅行和流行疫苗 | 98 | +61.0 | % | +66.1 | % | | 23 | +57.1 | % | | 17 | +240.0 | % | | 58 | +40.0 | % |
| 疫苗 | 1,020 | +6.8 | % | +11.5 | % | | 306 | -0.4 | % | | 133 | +4.7 | % | | 581 | +11.3 | % |
| | | | | | | | | | | | |
| 過敏 | 226 | +11.3 | % | +15.9 | % | | 131 | +15.1 | % | | 17 | -5.6 | % | | 78 | +9.9 | % |
| 咳嗽和感冒 | 121 | +118.2 | % | +120.0 | % | | — | 0.0 | % | | 66 | +164.0 | % | | 55 | +80.0 | % |
| 疼痛護理 | 314 | +22.5 | % | +24.1 | % | | 46 | +7.5 | % | | 151 | +23.8 | % | | 117 | +27.5 | % |
| 消化健康 | 325 | +13.8 | % | +14.8 | % | | 29 | +8.0 | % | | 112 | +5.7 | % | | 184 | +20.3 | % |
| 身體健康 | 88 | +7.4 | % | +8.6 | % | | — | 0.0 | % | | 6 | -25.0 | % | | 82 | +11.0 | % |
| 心理健康 | 66 | +26.4 | % | +24.5 | % | | 12 | 0.0 | % | | 34 | +17.2 | % | | 20 | +69.2 | % |
| 個人護理 | 130 | -2.4 | % | +4.0 | % | | 96 | -7.3 | % | | 1 | 0.0 | % | | 33 | +14.3 | % |
| 非核心 /其他 | 58 | -16.2 | % | -14.7 | % | | (4) | -160.0 | % | | 19 | -30.8 | % | | 43 | +13.5 | % |
| 消費者醫療保健 | 1,328 | +17.0 | % | +19.3 | % | | 310 | +2.1 | % | | 406 | +21.0 | % | | 612 | +22.8 | % |
| | | | | | | | | | | | |
| 公司 | 9,674 | +8.6 | % | +12.6 | % | | 3,484 | +12.1 | % | | 2,392 | +6.7 | % | | 3,798 | +7.0 | % |
附錄 2:企業淨損益表
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022 年第一季度 | 藥品 | 疫苗 | 消費者醫療保健 | 其他 (1) | 道達爾集團 |
| 百萬歐元 | Q1 2022 | Q1 2021(2) | 改變 | Q1 2022 | Q1 2021(2) | 改變 | Q1 2022 | Q1 2021(2) | 改變 | Q1 2022 | Q1 2021(2) | 改變 | Q1 2022 | Q1 2021(2) | 改變 |
| 淨銷售額 | 7,326 | 6,563 | 11.6% | 1,020 | 915 | 11.5% | 1,328 | 1,113 | 19.3% | — | — | —% | 9,674 | 8,591 | 12.6% |
| 其他收入 | 75 | 50 | 50.0% | 289 | 231 | 25.1% | 14 | 14 | —% | 1 | — | —% | 379 | 295 | 28.5% |
| 銷售成本 | (1,695) | (1,679) | 1.0% | (681) | (579) | 17.6% | (448) | (370) | 21.1% | (54) | (56) | -3.6% | (2,878) | (2,684) | 7.2% |
| 佔淨銷售額的百分比 | (23.1)% | (25.6)% | | (66.8)% | (63.3)% | | (33.7)% | (33.2)% | | | | | (29.7)% | (31.2)% | |
| 毛利 | 5,706 | 4,934 | 15.6% | 628 | 567 | 10.8% | 894 | 757 | 18.1% | (53) | (56) | -5.4% | 7,175 | 6,202 | 15.7% |
| 佔淨銷售額的百分比 | 77.9% | 75.2% | | 61.6% | 62.0% | | 67.3% | 68.0% | | | | | 74.2% | 72.2% | |
| 研究和開發費用 | (1,165) | (979) | 19.0% | (185) | (145) | 27.6% | (36) | (28) | 28.6% | (103) | (115) | -10.4% | (1,489) | (1,267) | 17.5% |
| 佔淨銷售額的百分比 | (15.9)% | (14.9)% | | (18.1)% | (15.8)% | | (2.7)% | (2.5)% | | | | | (15.4)% | (14.7)% | |
| 銷售和一般費用 | (1,308) | (1,188) | 10.1% | (170) | (170) | —% | (382) | (344) | 11.0% | (519) | (492) | 5.5% | (2,379) | (2,194) | 8.4% |
| 佔淨銷售額的百分比 | (17.9)% | (18.1)% | | (16.7)% | (18.6)% | | (28.8)% | (30.9)% | | | | | (24.6)% | (25.5)% | |
| 其他當期營業收入/支出 | (411) | (252) | | 7 | 120 | | 122 | 10 | | 17 | 21 | | (265) | (101) | |
| 聯營公司*和合資企業的利潤/虧損份額 | 14 | 7 | | 16 | (1) | | — | 3 | | — | — | | 30 | 9 | |
| 歸屬於非控股權益的淨收益 | (5) | (8) | | — | — | | (2) | (4) | | — | — | | (7) | (12) | |
| 企業營業收入 | 2,831 | 2,514 | 12.6% | 296 | 371 | -20.2% | 596 | 394 | 51.3% | (658) | (642) | 2.5% | 3,065 | 2,637 | 16.2% |
| 佔淨銷售額的百分比 | 38.6% | 38.3% | | 29.0% | 40.5% | | 44.9% | 35.4% | | | | | 31.7% | 30.7% | |
| | | | | | | | | | | | | | | |
| | | | 財務收入和支出 | (78) | (84) | |
| | | | 所得税支出 | | | | | (563) | (537) | |
| | | | 税率** | | | | | 19.0% | 21.0% | |
| | | | 業務淨收入 | | | | | 2,424 | 2,016 | 20.2% |
| | | | 佔淨銷售額的百分比 | | | | | 25.1% | 23.5% | |
| | | | | | | | | | | |
| | | | 企業收益/股份(單位:歐元)*** | 1.94 | 1.61 | 20.5% |
* 扣除税款。
** 根據税前業務收入、關聯公司和非控股權益確定。
*** 基於2022年第一季度平均流通股數12.492億股和2021年第一季度12.493億股。
(1) 其他包括全球支持職能(財務、人力資源、信息解決方案與技術、賽諾菲商業服務等)的費用。
(2) 包括2021年4月IFRIC最終議程決定對服務期福利分配的影響。
附錄 3:合併損益表
| | | | | | | | | | |
| 百萬歐元 | Q1 2022 | Q1 2021 (1) | | |
| 淨銷售額 | 9,674 | | 8,591 | | | |
| 其他收入 | 379 | | 295 | | | |
| 銷售成本 | (2,880) | | (2,684) | | | |
| 毛利 | 7,173 | | 6,202 | | | |
| 研究和開發費用 | (1,489) | | (1,267) | | | |
| 銷售和一般費用 | (2,379) | | (2,194) | | | |
| 其他營業收入 | 390 | | 267 | | | |
| 其他運營費用 | (655) | | (368) | | | |
| 無形資產的攤銷 | (449) | | (389) | | | |
無形資產減值 | (5) | | (2) | | | |
| 或有對價的公允價值重新計量 | 4 | | (36) | | | |
| 重組成本和類似項目 | (175) | | (156) | | | |
其他得失和訴訟 | (18) | | — | | | |
| | | | |
| 營業收入 | 2,397 | | 2,057 | | | |
| 財務費用 | (88) | | (98) | | | |
| 財務收入 | 10 | | 14 | | | |
| 税前收入、聯營企業和合資企業 | 2,319 | | 1,973 | | | |
| 所得税支出 | (332) | | (404) | | | |
| 聯營企業和合資企業的利潤/(虧損)份額 | 30 | | 9 | | | |
| | | | |
| | | | |
| 淨收入 | 2,017 | | 1,578 | | | |
| 歸屬於非控股權益的淨收益 | 8 | | 12 | | | |
| 歸屬於賽諾菲股東的淨收益 | 2,009 | | 1,566 | | | |
| 平均已發行股票數量(百萬) | 1,249.2 | | 1,249.3 | | | |
| | | | |
| 國際財務報告準則每股收益(單位:歐元) | 1.61 | | 1.25 | | | |
(1) 包括2021年4月IFRIC最終議程決定對服務期福利分配的影響
附錄4:歸屬於賽諾菲股東的淨收益與業務淨收益的對賬
| | | | | | | | | | |
| 百萬歐元 | Q1 2022 | Q1 2021 (1) | | |
| 歸屬於賽諾菲股東的淨收益 | 2,009 | | 1,566 | | | |
無形資產攤銷 (2) | 449 | | 389 | | | |
無形資產減值 | 5 | | 2 | | | |
| 或有對價的公允價值重新計量 | (4) | | 36 | | | |
| 收購對庫存的影響所產生的費用 | 3 | | — | | | |
| 重組成本和類似項目 | 175 | | 156 | | | |
其他得失和訴訟 | 18 | | — | | | |
| | | | |
| 上面列出的項目的税收影響: | (232) | | (133) | | | |
| 無形資產的攤銷和減值 | (96) | | (89) | | | |
| 或有對價的公允價值重新計量 | (7) | | (1) | | | |
| | | | |
| 重組成本和類似項目 | (46) | | (42) | | | |
| | | | |
| 其他税收影響 | (83) | | (1) | | | |
| 歸屬於非控股權益的上述項目份額 | 1 | | — | | | |
| | | | |
| | | | |
| | | | |
| 業務淨收入 | 2,424 | | 2,016 | | | |
國際財務報告準則每股收益 (3)(以歐元計) | 1.61 | | 1.25 | | | |
(1) 包括2021年4月IFRIC最終議程決定對服務期福利分配的影響。
(2)其中與作為業務合併一部分的無形資產重新評估所產生的攤銷費用有關:2022年第一季度為4.25億歐元,2021年第一季度為3.69億歐元。
(3) 基於2022年第一季度平均流通股數12.492億股和2021年第一季度12.493億股。
附錄5:淨負債的變化
| | | | | | | | | | | |
| 百萬歐元 | Q1 2022 | Q1 2021 | (1) |
| 業務淨收入 | 2,424 | | 2,016 | | |
| 不動產、廠房、設備和軟件的折舊、攤銷和減值 | 361 | | 347 | | |
| 其他物品 | 37 | | (43) | | |
| 運營現金流 | 2,822 | | 2,320 | | |
| 營運資金的變化 | (468) | | 422 | | |
| 購置不動產、廠房和設備及軟件 | (356) | | (378) | | |
| 重組、收購和處置前的自由現金流 | 1,998 | | 2,364 | | |
收購無形資產、投資和其他長期金融資產 (2) | (277) | | (277) | | |
| 已支付的重組費用和類似項目 | (361) | | (244) | | |
處置不動產、廠房和設備、無形資產和其他非流動資產扣除税款後的收益 (2) | 347 | | 82 | | |
| 自由現金流 | 1,707 | | 1,925 | | |
收購合併企業投資,包括 假定債務 (3) | (823) | | (21) | | |
| | | |
| | | |
| | | |
| 賽諾菲股票的發行 | 13 | | 11 | | |
| 收購庫存股 | (360) | | (140) | | |
| | | |
| 其他物品 | 14 | | 192 | | |
| 淨負債的變化 | 551 | | 1,967 | | |
| 期初 | 9,983 | | 8,790 | | |
| 結清淨債務 | 9,432 | | 6,823 | | |
(1) 包括2021年4月IFRIC最終議程決定對服務期福利分配的影響。
(2) 自由現金流包括每筆交易上限不超過5億歐元的投資和撤資(包括與交易相關的所有付款)。
(3) 包括每筆交易上限超過5億歐元的交易(包括與交易相關的所有付款)。
附錄 6:貨幣敏感度
2022年企業每股收益貨幣敏感度
| | | | | | | | |
| 貨幣 | 變體 | 企業每股收益靈敏度 |
| 美元 | +0.05 美元/歐元 | -歐元 0.14 |
| 日元 | +5 日元/歐元 | -0.02 歐元 |
| 中國元 | +0.2 人民幣/歐元 | -0.02 歐元 |
| 巴西雷亞爾 | +0.4 巴西雷亞爾/歐元 | -歐元 0.01 |
| 俄羅斯盧布 | +10 盧布/歐元 | -0.02 歐元 |
2022年第一季度銷售額的貨幣敞口
| | | | | |
| 貨幣 | Q1 2022 |
| 我們 $ | 37.0 | % |
| 歐元 € | 21.0 | % |
| 中國元 | 8.8 | % |
| 日元 | 4.4 | % |
| 巴西雷亞爾 | 2.5 | % |
| 俄羅斯盧布 | 1.8 | % |
| 匈牙利福林 | 1.7 | % |
| 加拿大元 | 1.4 | % |
| 澳大利亞元 $ | 1.4 | % |
| 英鎊 | 1.4 | % |
| 其他 | 18.6 | % |
貨幣平均匯率
| | | | | | | | | | | | | | |
| Q1 2021 | Q1 2022 | 改變 | | | |
| €/$ | 1.21 | | 1.12 | | -6.9 | % | | | |
| 歐元/日元 | 127.69 | | 130.47 | | +2.2 | % | | | |
| 歐元/元 | 7.81 | | 7.14 | | -8.6 | % | | | |
| 歐元/雷亞爾 | 6.59 | | 5.88 | | -10.8 | % | | | |
| 歐元/盧布 | 89.72 | | 97.95 | | +9.2 | % | | | |
附錄7:非公認會計準則財務指標的定義
按固定匯率 (CER) 計算的公司銷售額
當我們提到 “按固定匯率”(CER)計算的淨銷售額變化時,這意味着我們排除了匯率變動的影響。
我們通過使用前一時期的匯率重新計算相關時期的淨銷售額來消除匯率的影響。
2022年第一季度按固定匯率計算的淨銷售額與公司銷售額的對賬
| | | | | | |
| 百萬歐元 | Q1 2022 | |
| 淨銷售額 | 9,674 | | |
| 匯率的影響 | 341 | | |
| 按固定匯率計算的公司銷售額 | 9,333 | | |
業務淨收入
賽諾菲發佈了一項重要的非公認會計準則指標。業務淨收益定義為歸屬於賽諾菲股東的淨收益,不包括:
•攤銷無形資產,
•無形資產減值,
•重新計量與業務合併或處置相關的或有對價的公允價值,
•與收購相關的其他影響(包括收購對關聯公司和合資企業的影響),
•重組成本和類似項目(1),
•其他損益(包括處置非流動資產的損益(1)),
•與訴訟相關的費用或條款 (1),
•2020年5月29日完成交易產生的Regeneron投資收益(該金額不包括與目前按公允價值調整40萬股保留股票相關的收益),
•與上述項目相關的税收影響以及重大税收糾紛的影響,
•由於2020年5月29日出售了Regeneron的全部股權投資(賽諾菲保留的40萬股股票除外),權益法對Regeneron投資(不包括業務淨收益)的影響,
•歸屬於與上述項目相關的非控股權益的淨收益。
(1) 在合併財務報表附註B.19和B.20中列報的重組成本和類似項目以及處置損益和訴訟損益。
自由現金流
自由現金流是一項非公認會計準則財務指標,由我們的管理層審查,我們認為它為衡量公司運營產生的淨現金提供了有用的信息,可用於戰略投資1(扣除撤資1)、債務償還和股東資本回報。自由現金流由經摺舊、攤銷和減值調整後的企業淨收入、扣除股息後的關聯公司和合資企業的損益份額、處置損益、包括養老金和其他離職後福利在內的準備金的淨變動、遞延税、基於股份的支出和其他非現金項目等準備金的淨變動來確定。它包括扣除處置收益2後的營運資金、資本支出和其他資產收購的淨變動2,以及與重組和類似項目相關的付款。自由現金流不是國際財務報告準則定義的,它不能替代國際財務報告準則經營活動中總淨現金流量的衡量標準。
1 交易金額超過每筆交易5億歐元的上限(包括與交易相關的所有付款)。
2 每筆交易的上限不超過5億歐元(包括與交易相關的所有付款)。