

世界需要更好的疫苗。 我們正在努力創造它們。企業概覽|2022年4月展覽99.1

本演示文稿中包含的有關非歷史事實事項的前瞻性陳述為前瞻性陳述。前瞻性陳述基於公司目前的信念和預期,包括但不限於:公司推進其臨牀前和臨牀計劃的目標、公司取得里程碑成就的時間、公司的現金餘額以及公司VLP技術的潛力。由於公司業務固有的風險和不確定性,實際結果可能與本演示文稿中闡述的不同,包括但不限於:公司開發工作的早期階段;公司新的和未經證實的技術以及與公司新候選藥物的開發及其作為泛呼吸道疫苗的潛在用途相關的不確定性;臨牀試驗和臨牀前研究的開始、登記和完成的潛在延遲;公司在製造、研究以及臨牀前和臨牀試驗方面對第三方的依賴;公司候選產品的意外副作用或免疫原性或效力不足,可能限制其作為單價疫苗或組合疫苗或泛呼吸道疫苗的開發、監管批准和/或商業化;臨牀前研究或早期臨牀試驗的結果不一定能預測未來結果;公司的IVX-411藥物產品調查可能產生不確定的結果;即使調查確定了導致IVX-411中期免疫原性數據低於預期的根本原因或促成因素, 該公司可能無法解決所有歧義;可能已影響IVX-411-01臨牀試驗中的臨時免疫原性數據的任何錯誤或其他未知因素也可能影響安全性數據;對IVX-411中期結果的調查可能影響該公司正在進行的IVX-121試驗的結果;限制該公司候選疫苗的商業價值的相互競爭的 方法;美國和其他國家的監管動態;該公司獲得和維護其候選產品的知識產權保護並根據知識產權許可證維護其權利的能力;公司用目前的現金、現金等價物和投資為其運營計劃提供資金的能力;公司在新冠肺炎疫情期間保持不中斷業務運營的能力,包括與臨牀試驗、製造和供應鏈有關的能力;以及公司之前提交給美國證券交易委員會(美國證券交易委員會)的文件中描述的其他風險,包括公司在截至2021年12月31日的10-K表格年度報告和後續提交給美國證券交易委員會的任何文件中的“風險因素”標題。告誡您不要過度依賴這些前瞻性陳述, 這些前瞻性陳述僅在本文發佈之日起發表,公司不承擔更新此類陳述以反映此後發生的事件或存在的情況的義務。本警示聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的,所有前瞻性陳述均受此警示聲明的完整限制。
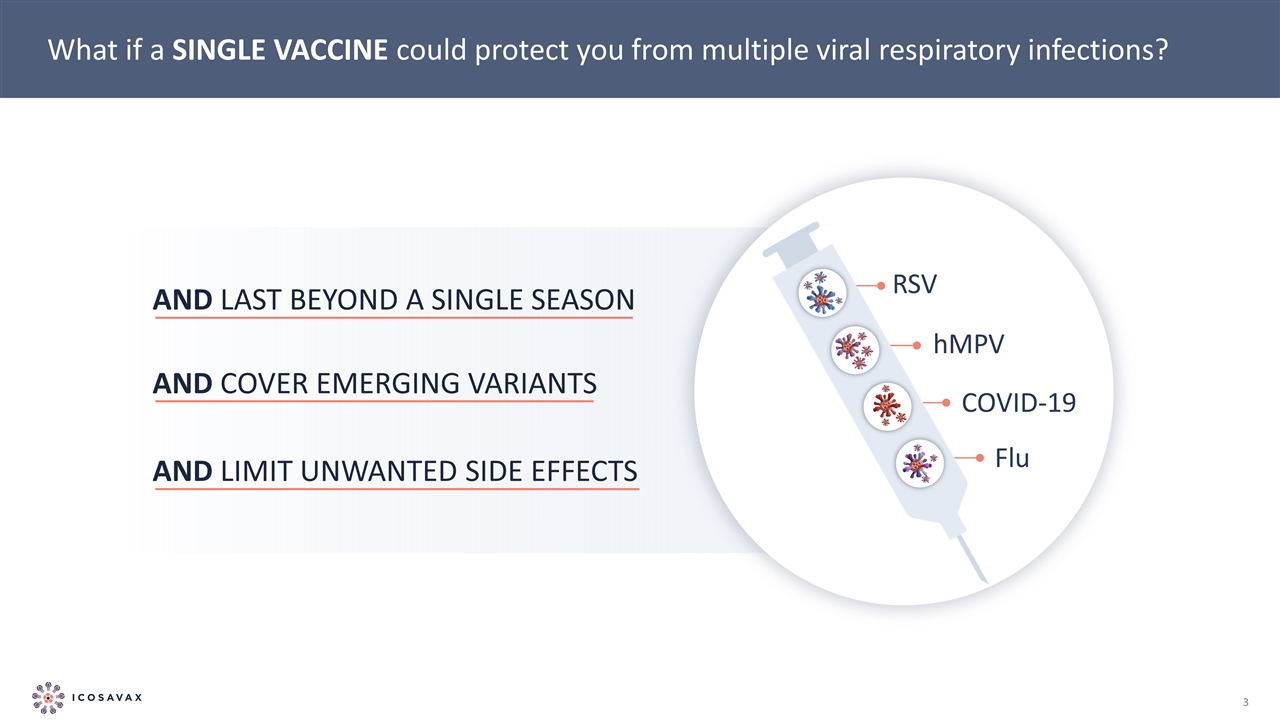
如果一種疫苗就能保護你免受多種病毒性呼吸道感染,那會怎樣?並持續超過一季,涵蓋新出現的變種,並限制不良副作用
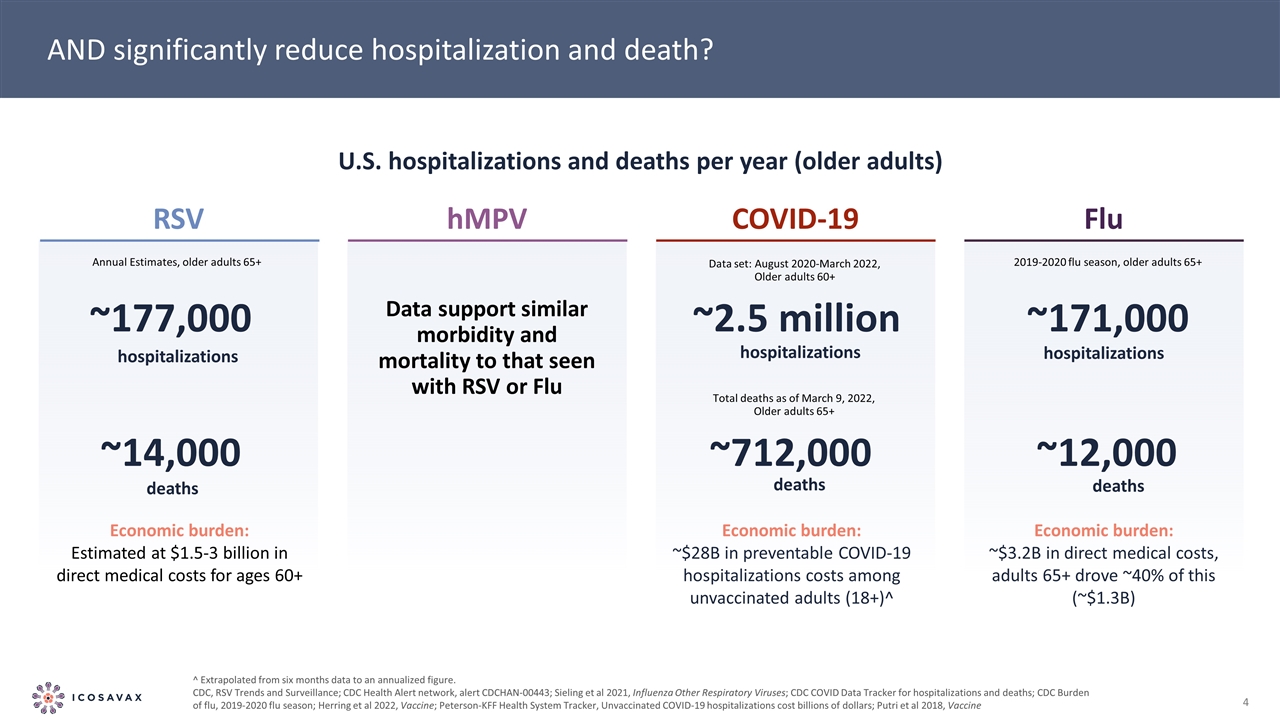
並顯著減少住院和死亡?美國每年住院和死亡人數(老年人)?從六個月的數據外推到年化數字。疾控中心,呼吸道合胞病毒趨勢和監測;疾控中心健康警報網絡,警報CDCHAN-00443;西靈等人2021年,流感其他呼吸道病毒;疾控中心住院和死亡數據跟蹤;疾控中心流感負擔,2019年至2020年流感季節;Herring等人,2022年疫苗;彼得森-KFF2021年衞生系統跟蹤,未接種疫苗的新冠肺炎住院費用 數十億美元;Putri等人2018年,疫苗RSV hMPV新冠肺炎流感住院~177,000例死亡~14,000例經濟負擔:60歲以上直接醫療費用估計為15-30億美元+年度估計,65歲以上老年人的數據支持與RSV或流感住院相似的發病率和死亡率約250萬例死亡~712,000例經濟負擔:~280億美元未接種疫苗的成年人中可預防的新冠肺炎住院費用(18+)住院~171,000例死亡~12,000例 經濟負擔:~3.2億美元直接醫療費用,成人65+驅動本流感季節的~40%(約13億美元)2019年8月-2022年3月截至2022年3月9日,老年人60+總死亡人數,老年人65+
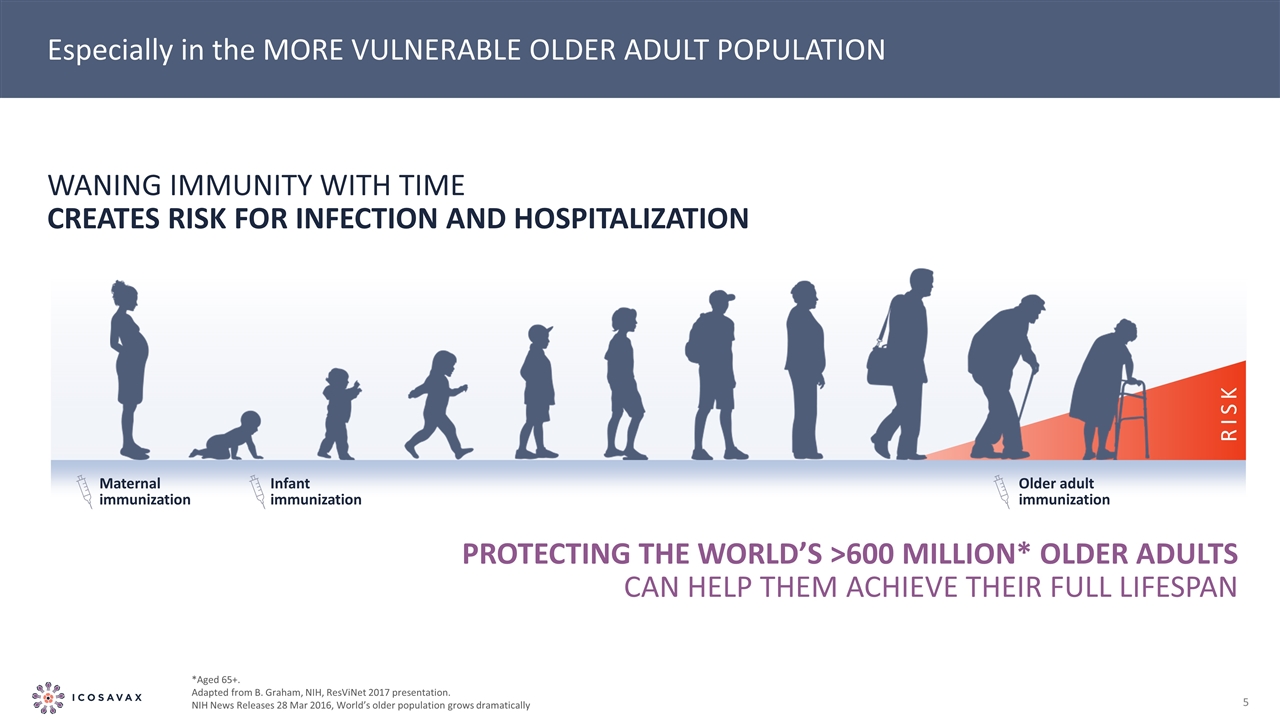
尤其是在更易受傷害的老年人羣中 母嬰免疫嬰兒免疫老年人免疫隨着時間的推移免疫力減弱會造成感染和住院的風險保護世界上超過6億*的老年人可以幫助他們實現他們65歲以上的完整壽命。改編自B.Graham,NIH,ResViNet 2017演示文稿。NIH新聞發佈2016年3月28日,世界老年人口急劇增長

我們的目標就是做到這一點--通過蓋茨基金會和華盛頓大學蛋白質設計研究所合作產生的一種專注於病毒樣顆粒(VLP)的新方法,ICosavax出現了一個願景: 創造世界上最好的疫苗我們的疫苗故意設計為模擬病毒的結構,以增強免疫反應

VLP可能提供這些 一個或多個潛在益處與現有模式相比,我們相信我們的VLP技術有潛力改進:覆蓋面廣、耐久性可對抗老年人的免疫衰老 針對相關病毒株和變異的保護程度更高;對變種的定製更少抗體持久性更長,需要更少的助劑耐受性/反應性製造配合性副作用發生率更低,可接受性更高生產效率和可擴展性高,具有工藝效率、存儲靈活性和穩定性將多個VLP結合到一個疫苗中的能力

HPV-16(與HPV-18類似的結果)Yr 10年5個VLP有多個潛在好處(續)技術類型摺疊變化YA NTS/Hcs*療效(%)原始毒株*VLP†SK Bioscience~6待定巴伐利亞北歐~12待定可溶性蛋白/膠束~4 96mRNA3-4 94-95 Ad載體~1 62-90潛在更高的反應強度(COVID)潛在更持久(HPV示例)*不是正面分析。研究結果來自第三方進行的單獨研究,僅供參考。資料來源:Gobeil等人,2021年,MedRxiv預印本;Covax彙編已發表的疫苗數據;Schwarz等人,2019年,Hum Vaccines免疫其他;公司新聞稿。潛在更廣泛的覆蓋面Cervarx HPV VLP疫苗在針對HPV 16和18型的HPV疫苗Cervarx的關鍵3期試驗的4年隨訪中,該疫苗對另外4種未在疫苗中表達的致癌HPV類型顯示出強大的交叉保護效力。候選諾如病毒VLP疫苗HIL-214是GI.1和GII的二價VLP 。Ph2b試驗的特別分析顯示疫苗對GII.2有效,GII.2是疫苗3劑中不存在的一種基因,可誘導針對HPV-16、18、31、在10-14年內首次接種疫苗後至少10年內為45人。青春期女孩Cervarx 10年免疫反應100,000,000,100,100 10 1 GMT(95%CI)M0 M2 M7 M12-16 M18 M24 M36 M48 M60 M72 M84 M96 M108 M120高原水平自然感染水平評估VLP方法的臨牀研究顯示,與人類恢復期血清(HCS)對照組相比,VLP方法的變化最大,這是一種與疫苗保護相關的措施,迄今為止對有效性進行了評估。†使用IVX-411的初始Ph1結果與HCS免疫應答相當或低於HCS免疫應答,調查正在進行中。
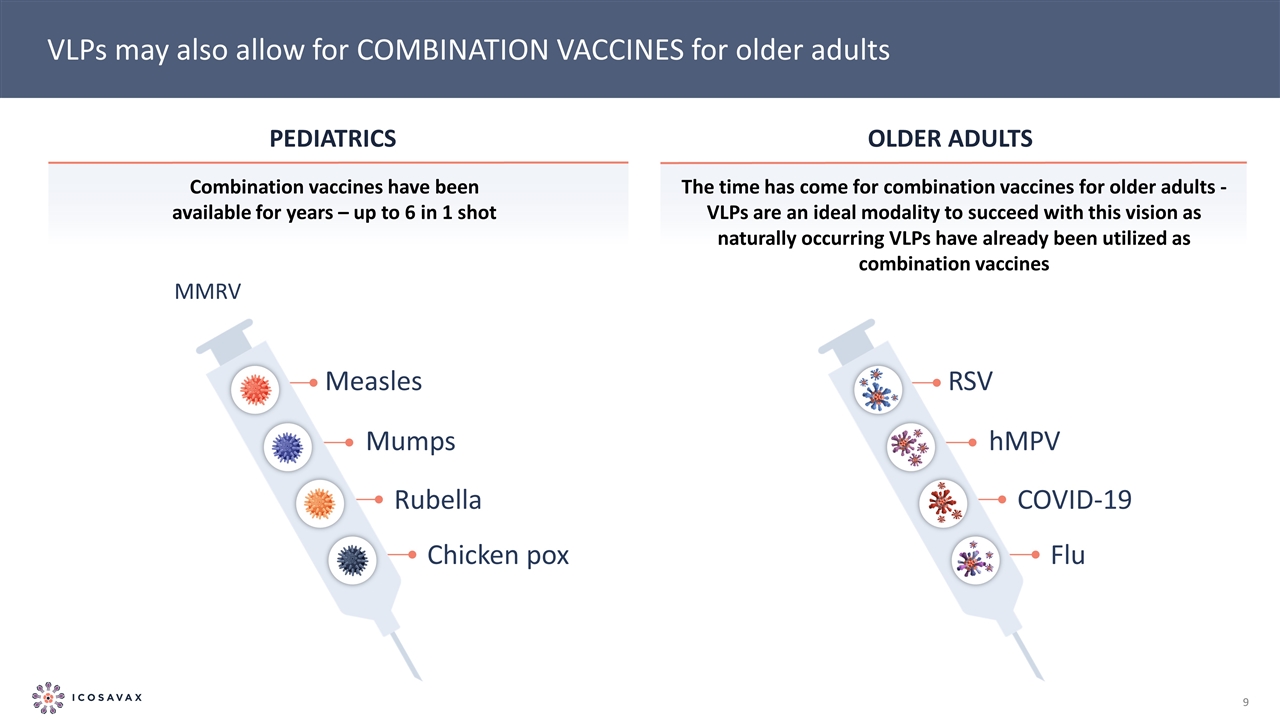
呼吸道合胞病毒hMPV新冠肺炎流感兒科聯合疫苗已經上市多年-老年人1針中就有6針針對老年人的聯合疫苗時機已經到來-VLP是實現這一願景的理想方式,因為自然發生的VLP已經被用作聯合疫苗 MMRV麻疹腮腺炎風疹水痘VLP也可能允許為老年人接種聯合疫苗
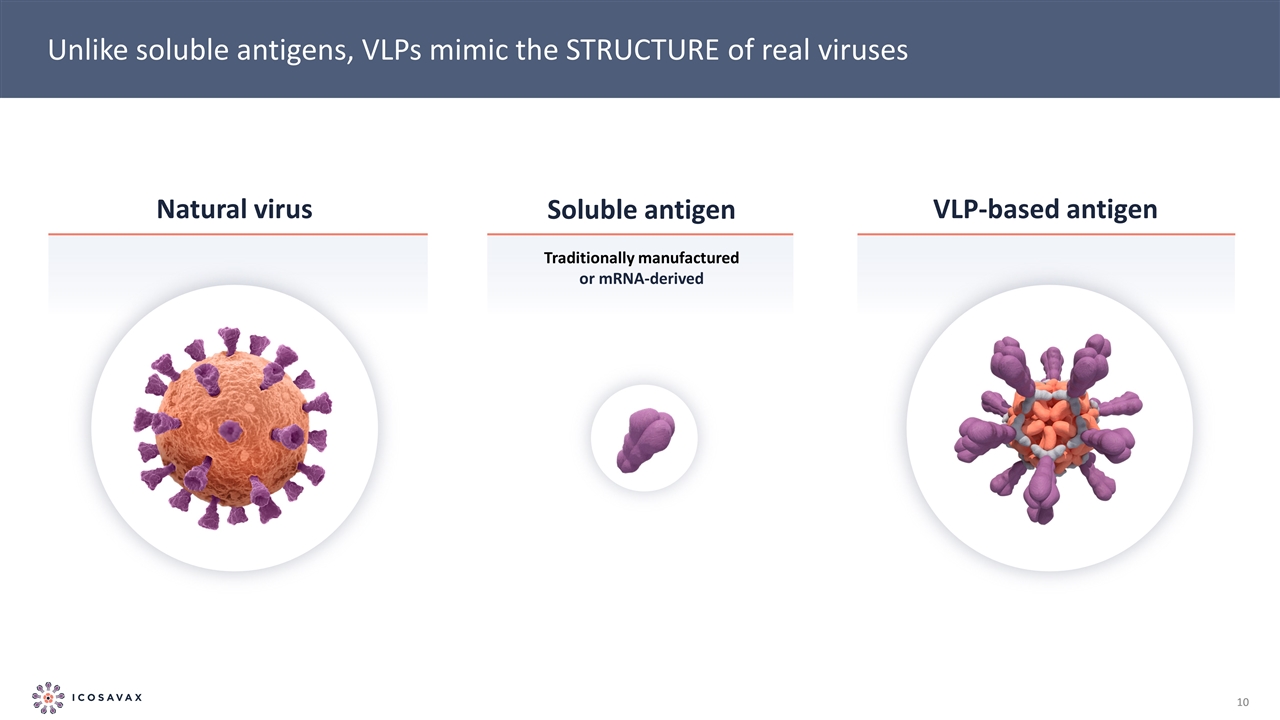
與可溶性抗原不同,VLP模擬真實病毒的結構天然病毒可溶性抗原基於VLP的抗原傳統上製造或由信使核糖核酸衍生
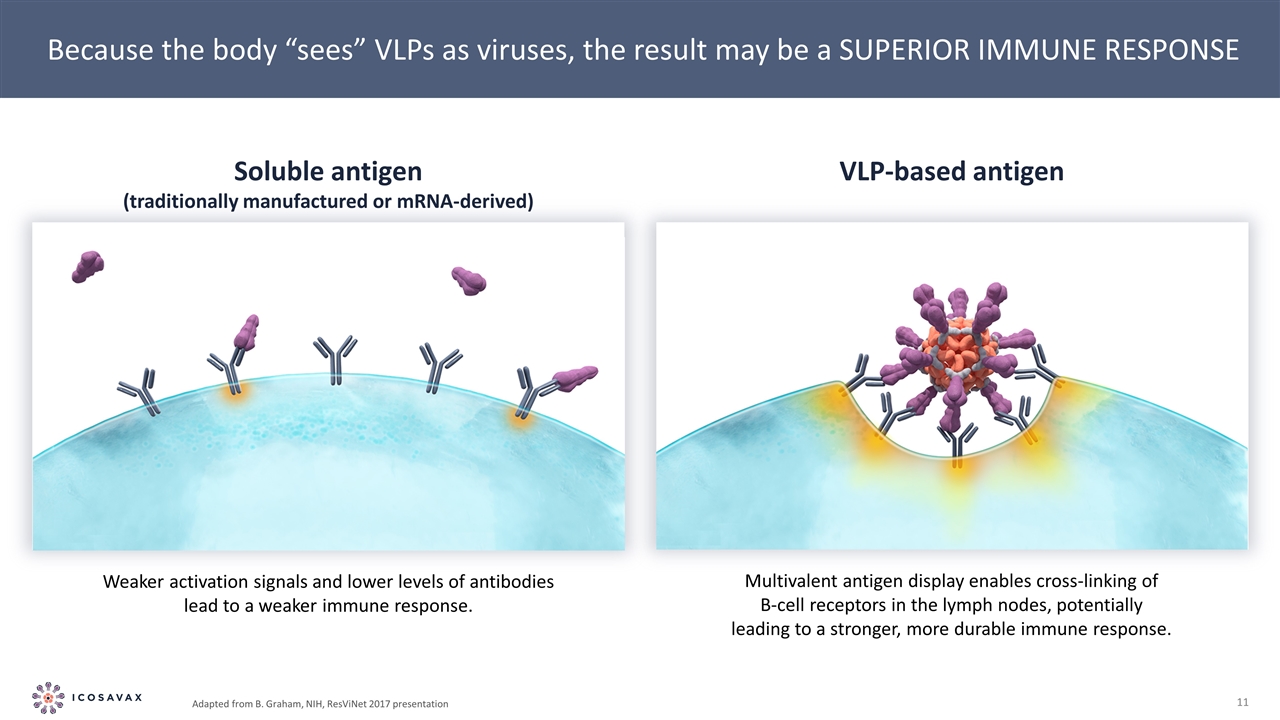
由於人體將VLP視為病毒,其結果可能是免疫反應更強,激活信號較弱,抗體水平較低導致免疫反應較弱。多價抗原展示可使淋巴結中的B細胞受體發生交叉連接, 潛在地導致更強、更持久的免疫反應。可溶性抗原(傳統制造或信使核糖核酸衍生)基於VLP的抗原,改編自B.Graham,NIH,ResViNet 2017演示文稿

多種機制可能支持預期的對VLP的強勁免疫反應內化VLP VLP改善APC對抗原的攝取和提呈高效地運送到淋巴結增強細胞串擾B細胞受體激活的CD4+T細胞初始B細胞交聯型受體激活的B細胞短壽命漿細胞長壽命漿細胞記憶B細胞強健的抗體反應持久的抗體反應召回抗體反應先天適應的抗體反應潛力: 改編自戈麥斯等人2017年,疫苗

VLP已被證明是安全和有效的疫苗;目前在臨牀上的兩個ICosavax候選自然發生VLP用於已在市場上上市並已建立多年的疫苗中;2018年;Rappuoli和Serruto 2019;Sherwood等人2020;Gara等人 2015;Path單劑HPV疫苗評估聯盟,2019年關於VLP第一個VLP疫苗許可用於人類乙肝病毒(乙肝)人類乳頭瘤病毒(HPV)疫苗的第1期出版物:Cerarix和Gardasil 1973 1981年戊型肝炎疫苗 (在中國獲得許可)2011 2007 2022臨牀上使用的兩個ICosavax VLP疫苗候選疫苗

我們的VLP是通過專有的兩組分精密設計系統IVX-121 IVX-241 Flu IVX-411 hMPV RSV SARS-CoV-2 Flu三聚體蛋白與靶抗原正確摺疊以顯示中和表位而組裝成VLP新抗原 設計功能使我們能夠為未來的威脅做好準備VLP組分B(通用)可用於多個候選疫苗的自組裝當A組分和B組分組合二十面體對稱性和顆粒大小模仿病毒特性以潛在地增強免疫原性VLP可以在每個VLP中有一個靶點或單個VLP上有多個不同的抗原(抗原特異性)
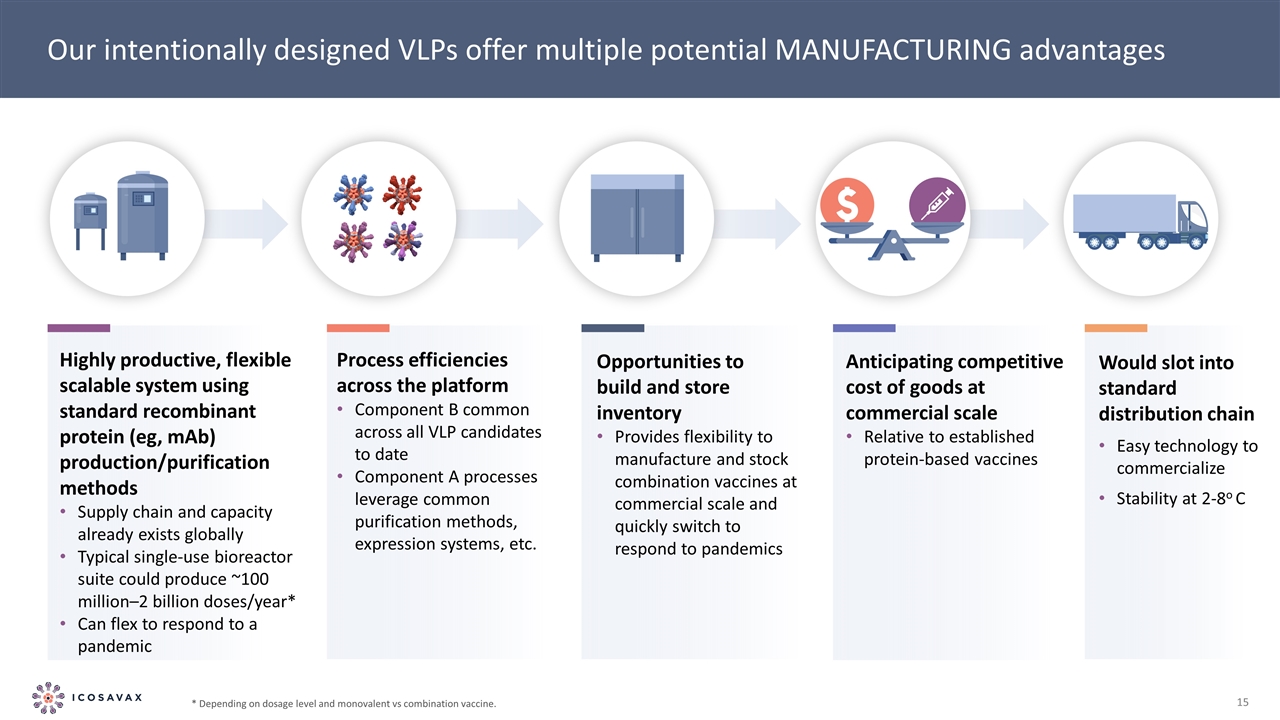
C高效、靈活的可擴展系統使用標準重組蛋白(例如,單抗)生產/純化方法供應鏈和產能已在全球範圍內存在典型的一次性生物反應器套件每年可生產約1億-20億劑*我們特意設計的VLP提供多種潛在的製造優勢將插入標準分銷鏈輕鬆技術將穩定在2-8℃的整個平臺上的過程效率商業化B組分迄今在所有VLP候選者中通用利用常見的純化方法、表達系統、建立和儲存庫存的機會為商業規模生產和儲存組合疫苗提供了靈活性,並根據劑量水平和單價與組合疫苗的不同迅速切換到對流行病的反應。預測商品在商業規模上相對於已建立的蛋白質疫苗的競爭成本

我們正在尋求尚未滿足的主要需求 我們的VLP技術細菌病毒挑戰接種(100株)批准的疫苗存在~50億美元的銷售額批准的疫苗存在~80億美元的銷售額沒有批准的疫苗呼吸系統疫苗是一個新興市場:目前還沒有批准的RSV或hMPV疫苗,而且有機會改善對流感疫苗的保護RSV/hMPV預計將被ACIP等決策者推薦針對RSV的疫苗,特別是在老年人中,這可能會推動RSV的快速覆蓋和接受,並實現更快的增長,以達到銷售峯值分析師預計到2030年RSV疫苗市場將達到約100億美元的峯值;我們相信人類MPV疫苗將類似新冠肺炎2021年Covid疫苗銷售額約600億美元多個行業消息來源估計,100億美元/年的機會將持續在流行階段(例如:2025年)IQVIA、Global Data、股票分析師流感儘管它們在商業上取得了成功,但現有疫苗歷來效力低於平均水平(過去10年中約15%-50%)Jain S et al 2017,臨牀胸科醫學;GBD 2015 LRI合作者;柳葉刀感染Dis 2017;Walsh等2008,Arch內科醫學;世界衞生組織;SVB Leerink 2021年5月在成人社區獲得性肺炎住院患者中檢測到前5名病原體(Epic 研究;新冠肺炎之前)
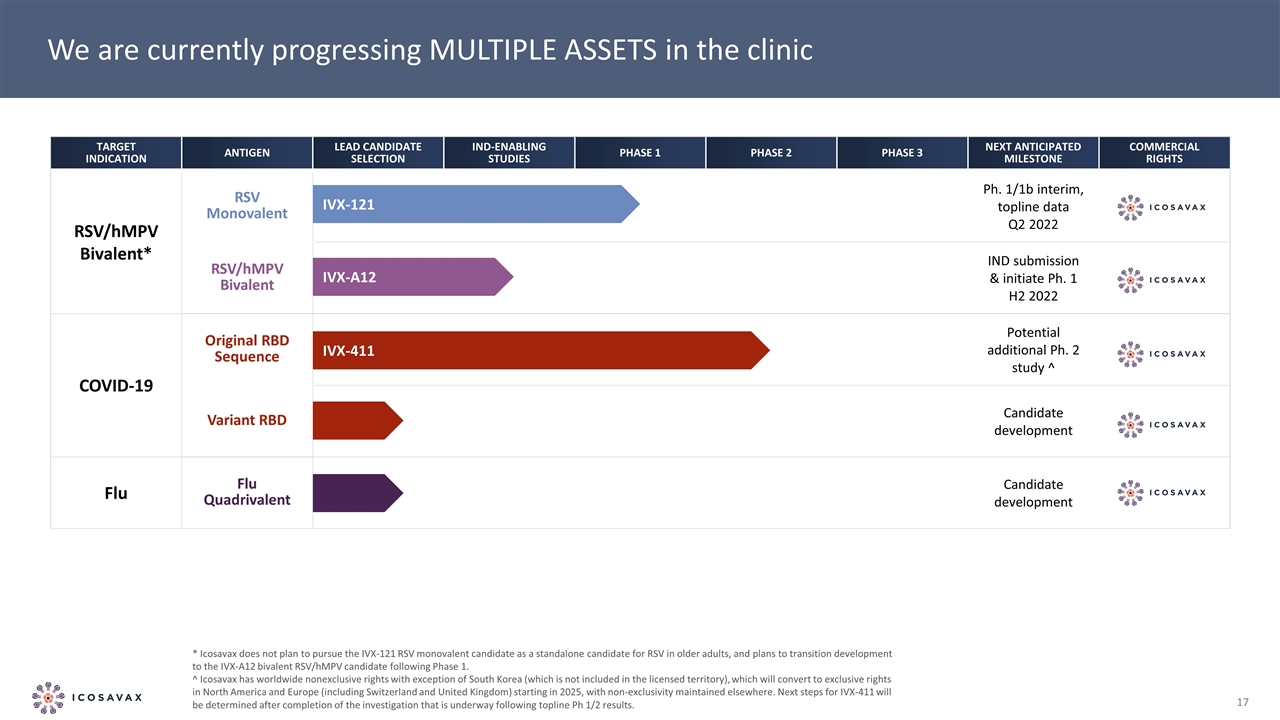
我們目前正在進行臨牀中的多種資產*ICosavax不打算在老年人中將IVX-121 RSV單價候選藥物作為RSV的獨立候選藥物,並計劃在第1階段之後過渡到IVX-A12二價RSV/hMPV候選藥物的開發。^ICosavax擁有全球非獨家權利,但韓國(不包括在許可區域內)將從2025年開始在北美和歐洲(包括瑞士和英國)轉換為獨家權利,並在其他地方保持非獨家權利。IVX-411的下一步將在完成TOPLINE PH1/2結果後正在進行的調查後確定。靶標抗原先導候選選擇啟用IND 研究階段1階段2階段3下一個預期里程碑RSV/hMPV二價*RSV單價Ph.1/1b中期,背線數據Q2 2022 RSV/hMPV二價IND提交和啟動Ph.1 H2 2022新冠肺炎原始RBD序列 潛在額外博士2研究^變異RBD候選開發流感四價候選開發IVX-411 IVX-A12 IVX-121

RSV/hMPV二價候選疫苗 (IVX-A12)機密

我們的第一個候選組合疫苗-IVX-A12-針對8%因肺炎住院的美國成年人中發現的RSV和hMPV,其中病原體檢測到16%的ICU入院可能性,5%的死亡症狀:咳嗽,疲勞,呼吸困難,充血,喘息, 在11%的因肺炎住院的美國成年人中發現發熱RSV,其中病原體檢測到17%的ICU入院可能性,4%的死亡症狀:咳嗽,喘息,呼吸困難,充血,疲勞hMPV臨牀先例使用針對相關病原體(例如,人乳頭瘤病毒,諾如病毒)在VLP IVX-121 RSV IVX-241 hMPV+RSV和hMPV上展示的利用預輸注穩定的F抗原的Icoavax與肺炎病毒科有關,並有重疊的季節性循環,這兩種病毒都很常見,再感染率很高,兩者的目標都是靶向F蛋白(負責病毒細胞進入),Jain等人2015年;Widmer等人2012年;Walsh等人2008年;T shi等人2019 RSV hMPV IVX-A12候選RSV/hMPV雙價疫苗候選疫苗
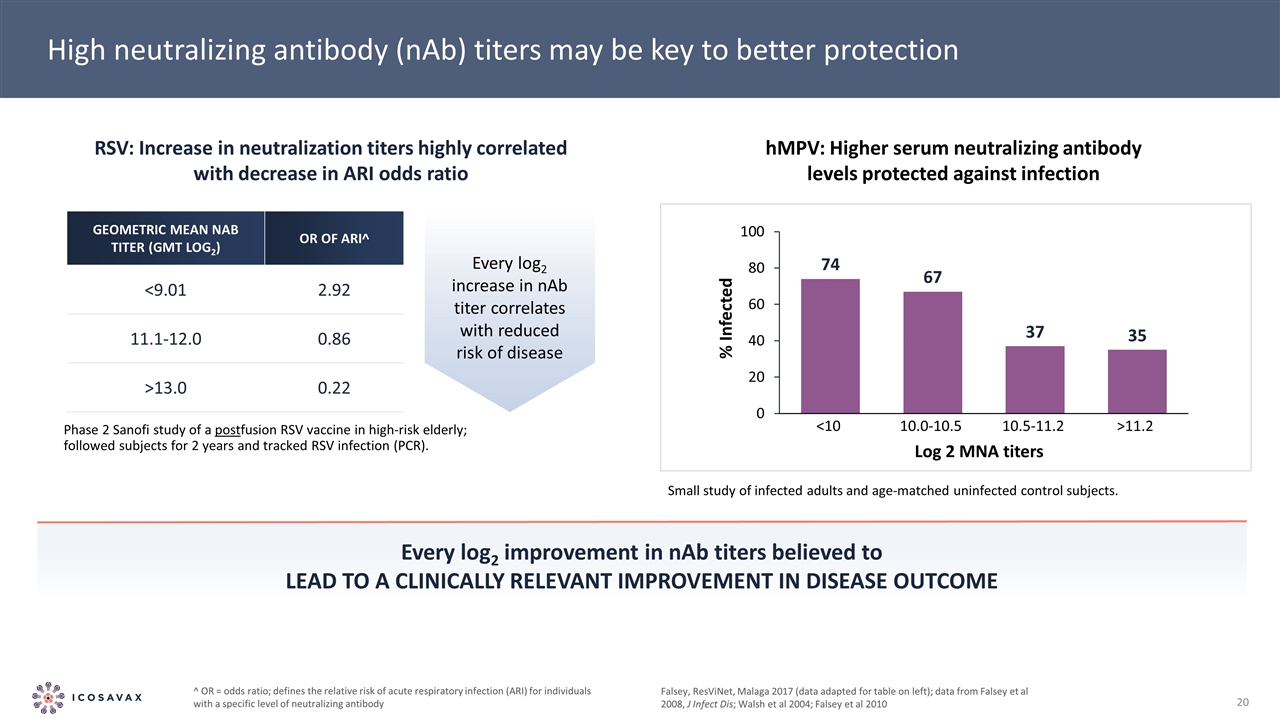
NAB滴度的每一次log2改善被認為會導致疾病結局的臨牀相關改善Falsey,ResViNet,Malaga 2017(數據適用於左側表格);來自Falsey等人2008,J Infect Dis;Walsh等人2004;Falsey等人2010年高中和抗體(NAB) 滴度的數據可能是更好地保護高危老年人融合後RSV疫苗的第二階段賽諾菲研究的關鍵;跟蹤受試者2年並跟蹤RSV感染(PCR)。RSV:中和滴度的增加與ARI優勢比的下降高度相關:hMPV:較高的血清中和抗體水平可防止感染。感染成人和年齡匹配的未感染對照受試者的小型研究。幾何平均NAB滴度(GMT Log2)OR為ARI^13.0 0.22^OR=優勢比;定義具有特定水平中和抗體的個人患急性呼吸道感染(ARI)的相對風險NAB滴度每增加log2與疾病風險降低相關感染Log 2 MNA滴度
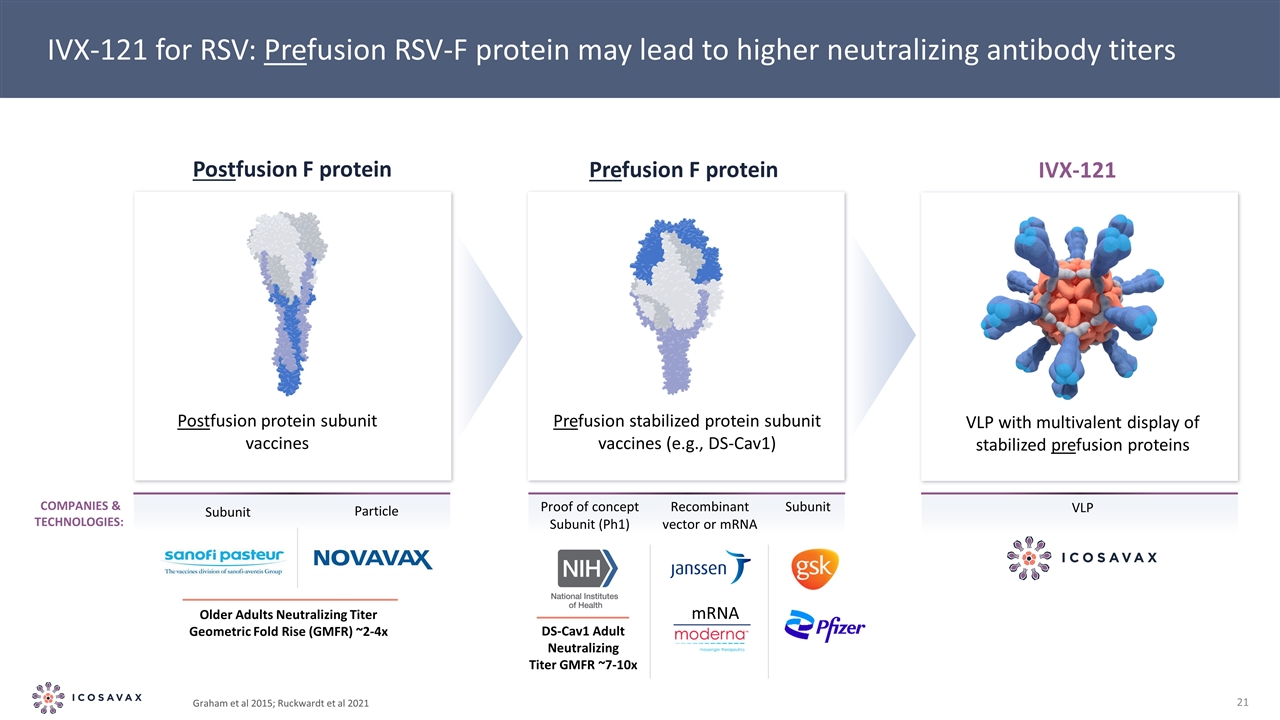
Graham et al 2015;Ruckwardt et al 2021 IVX-121 for RSV:融合RSV-F蛋白可導致更高的中和抗體滴度概念亞單位(PH1)亞單位重組載體或信使核糖核酸VLP公司與技術:信使DS-Cav1成人中和滴度GMFR~7-10x融合後蛋白亞單位疫苗融合穩定蛋白亞單位疫苗(如DS-Cav1)VLP具有多價顯示穩定的預融合蛋白融合後F蛋白融合蛋白IVX-121亞單位老年顆粒 中和滴度幾何摺疊上升(GMFR)~2-4x
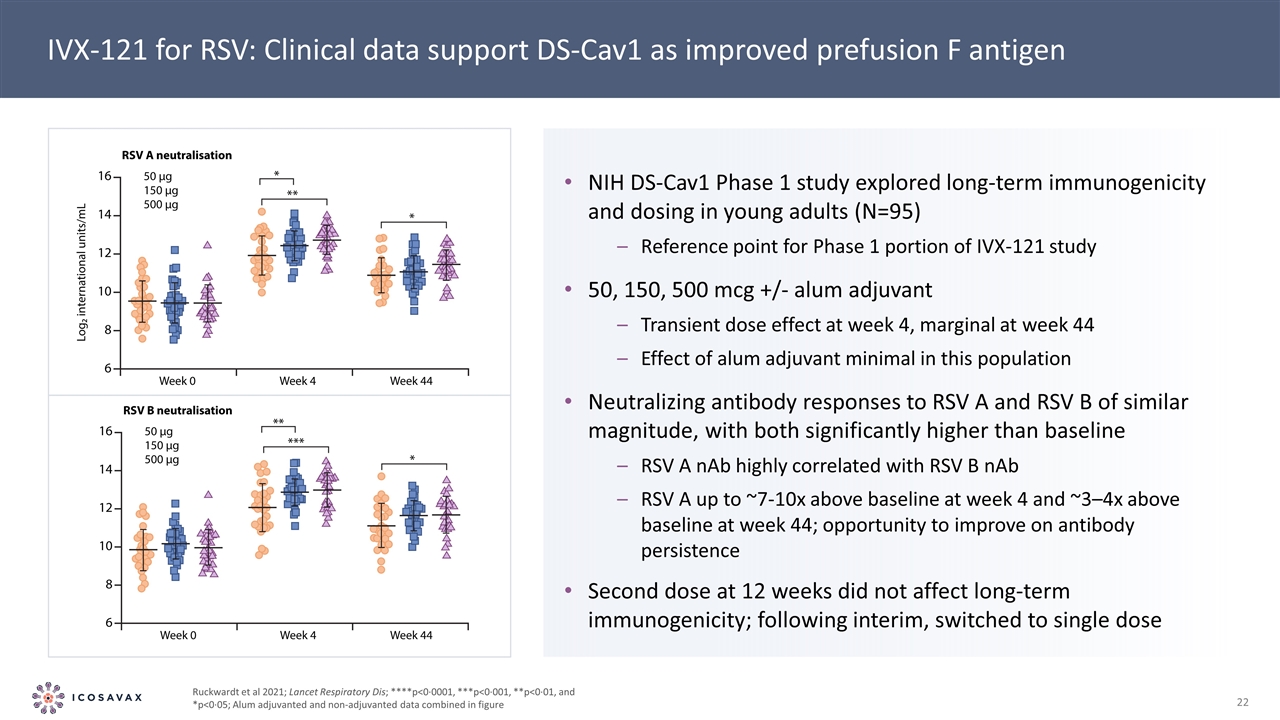
IVX-121用於RSV:臨牀數據支持DS-Cav1作為改進的預輸F抗原NIH DS-Cav1第一階段研究探索了年輕人(N=95)的長期免疫原性和劑量IVX-121研究第一階段的參考點50,150,500微克/-明礬佐劑瞬時劑量在第4周影響,在第44周邊緣該人羣中明礬佐劑最小的影響對RSV A和RSV B的中和抗體反應,兩者均顯着高於基線水平,且與RSV B NAB高度相關。RSV A在第4周達到基線的7-10倍,在44周達到基線的3-4倍;在12周進行第二次接種以改善抗體持久性的機會並不影響長期免疫原性;在過渡之後,改用單劑 Ruckwardt et al 2021;《柳葉刀》呼吸系統疾病;*p
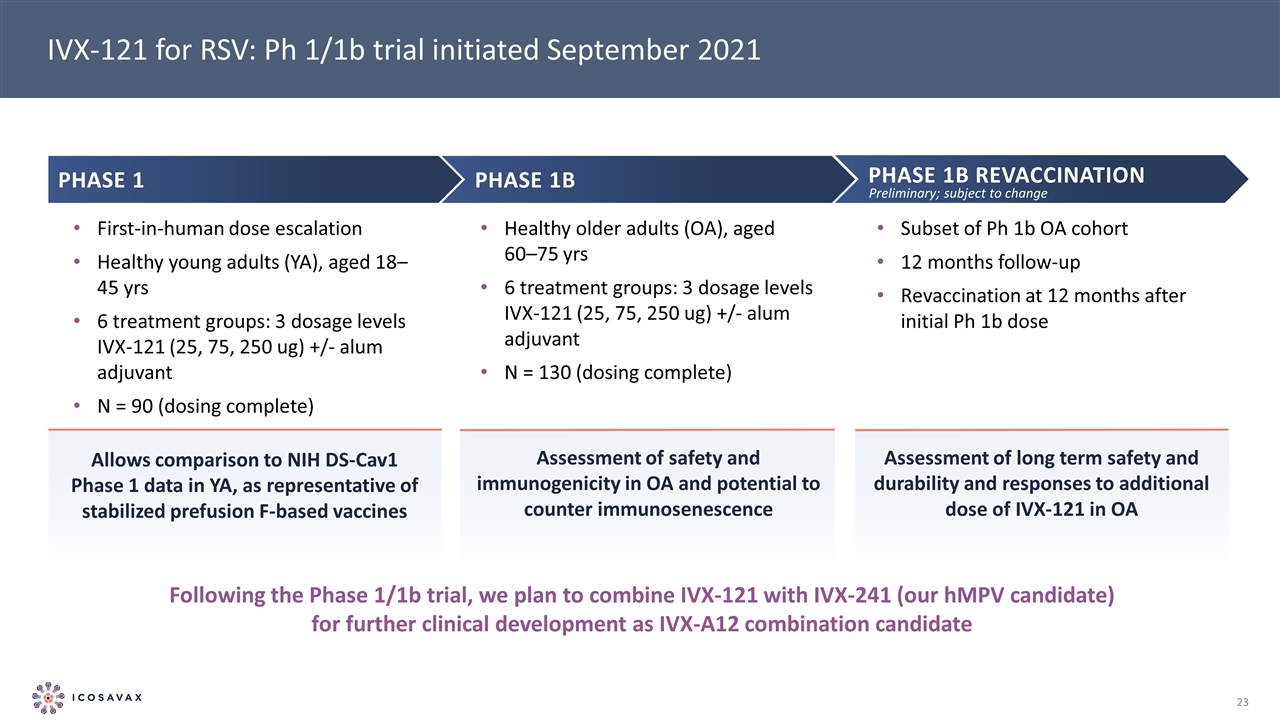
IVX-121用於RSV:ph1/1b試驗 2021年9月啟動Ph1b階段1b複種OA羣隨訪12個月在初始Ph1b劑量後12個月繼1/1b階段試驗後,我們計劃將IVX-121與IVX-241(我們的hMPV候選藥物)聯合用於 進一步的臨牀開發,作為IVX-A12組合候選第一階段人類劑量遞增健康青年(YA),年齡18-45歲6個治療組:3個劑量水平IVX-121(25,75,250微克)+/-明礬佐劑N=90(完全劑量)1b期健康老年人(OA),年齡60-75歲6個治療組:3個劑量水平IVX-121(25,75,250微克)+/-明礬佐劑N=130(完全劑量)允許與YA的NIH DS-Cav1階段數據進行比較,作為穩定的基於F的疫苗在OA中的安全性和免疫原性評估的代表性,以及對抗免疫衰老的可能性評估長期安全性和持久性的評估以及初步增加劑量IVX-121的反應;受 更改的影響

ICosavax獨家授權了用於hMPV的融合到IVX-241中的融合穩定的F抗原的權利(除了可以授予的一個mRNA許可證)IVX-241:融合穩定的F hMPV/A抗原選擇類似於RSV,關鍵的hMPV F蛋白靶點在融合到細胞膜後經歷構象變化融合F蛋白在小鼠模型中被證明與融合後F抗原融合前F蛋白相比具有~6倍的中和抗體效價與融合後F抗原融合後F蛋白戰鬥等人,2016,MAS等人2016,公共科學圖書館病原體;戰鬥等人,2017;謝家華等人,2022,NAT Commun

二價(RSV/hMPV)製劑的安全性和免疫原性健康的年輕人和老年人恆定RSV劑量水平+多劑量hMPV劑量水平+/-佐劑第2A期持續時間第1期2a IVX-A12 Ph1和2試驗計劃評估安全性和 免疫互不幹擾這些研究將幫助我們優化我們的二價製劑,並告知臨牀終點將用於潛在的POC 2b期療效研究初步研究設計;可能會更改。安全性和免疫學:VLP之間不幹擾;劑量和配方選擇健康老年人多種RSV和hMPV二價比率長期安全性和免疫原性持續時間(多年)健康老年人

ICosavax是唯一一家從事RSV和hMPV研究的具有VLP模式的公司 臨牀前1期2期3 VLP亞單位/可溶性抗原重組載體GSK融合RSV-F+ASO1輝瑞融合RSV-F+明礬Janssen腺病毒+可溶性RSV-F巴伐利亞北歐MVA RSV-F[br}Moderna:RSV+Covid+老年流感病毒/HMPV管線候選RSV-hMPV單價RSV-hMPV預融合RSV-F+alum RSV-F=RSV(融合抗原)賽諾菲:RSV賽諾菲: RSV+hMPV Moderna:RSV+Covid+老年流感病毒和/或MPV管道候選RSV
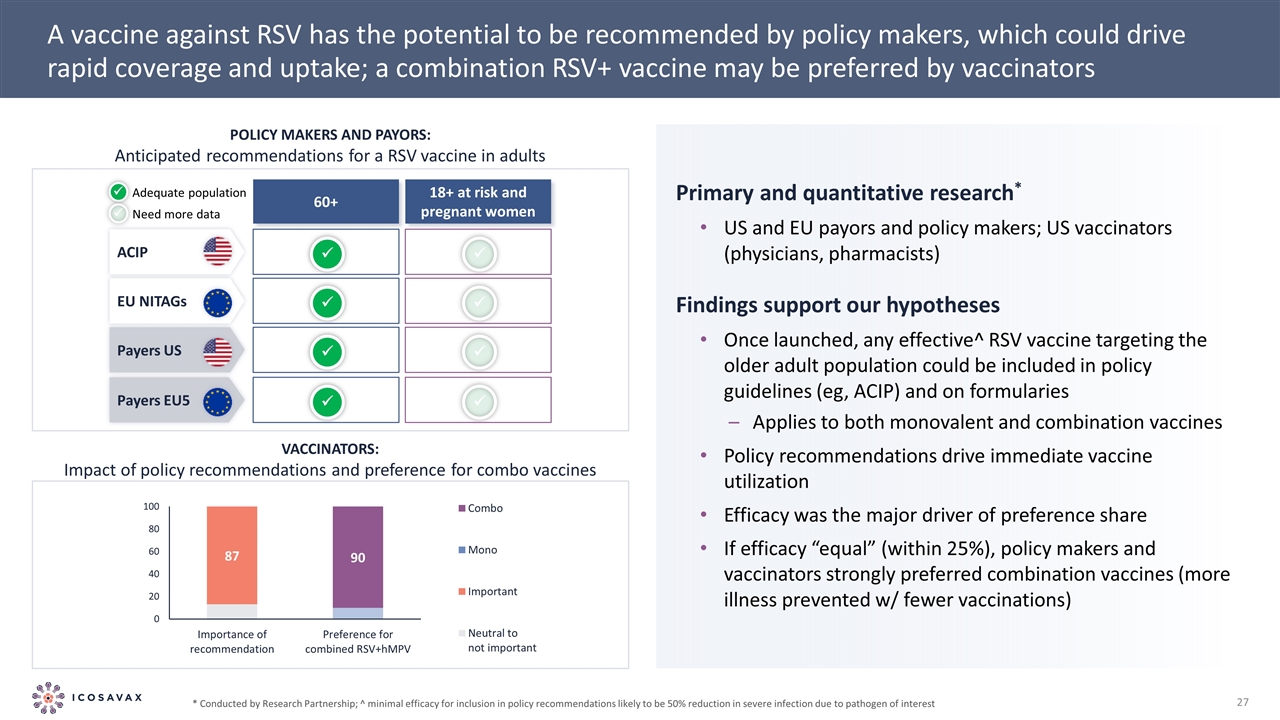
針對RSV的疫苗有可能被政策制定者推薦,這可能會推動快速覆蓋和採用;聯合RSV+疫苗可能是疫苗接種者政策制定者和支付者的首選:針對18歲以上高危成年人和60+ü孕婦的RSV疫苗的預期建議足夠的人口需要更多數據ACIP EU NITAGs支付者美國支付者EU5üüü初級和定量研究*美國和歐盟支付者和政策制定者;美國疫苗接種員 (醫生、藥劑師)的研究結果支持我們的假設一旦推出,任何針對老年人口的有效RSV疫苗都可以包括在政策指南(例如,ACIP)和適用於單價和組合疫苗的配方中 政策建議驅動立即使用疫苗的效力是偏好份額的主要驅動因素如果療效“相等”(在25%以內),政策制定者和疫苗接種者強烈傾向於組合疫苗(預防更多疾病,但接種更少)*由Research Partnership進行;^政策建議中包含的最低療效可能是將感興趣的病原體引起的嚴重感染減少50%:政策建議的影響 和對聯合疫苗的偏好

新冠肺炎候選疫苗(IVX-411)
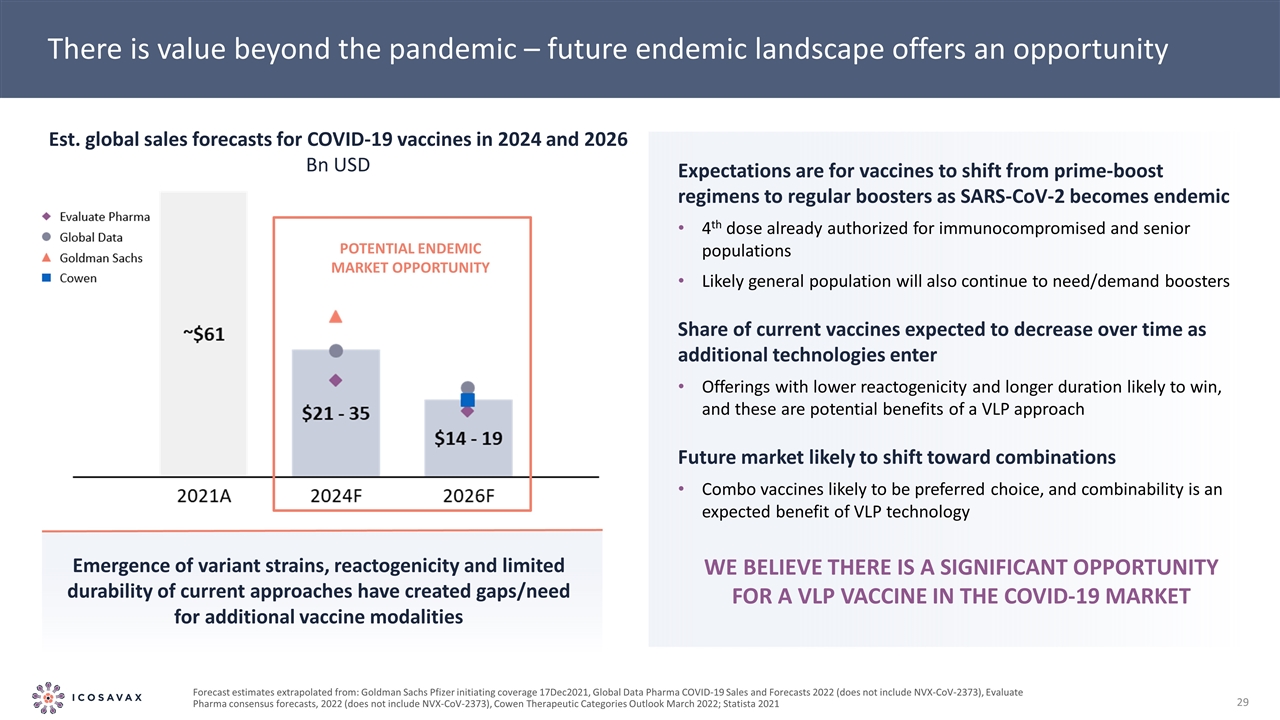
潛在的流行市場機會 大流行之外還有價值-未來的流行格局提供了出現變異毒株的機會,反應性和當前方法有限的持久性造成了對額外疫苗形式的缺口/需要 預期是隨着SARS-CoV-2成為針對免疫受損人羣的第四劑地方性疫苗而成為地方性疫苗,可能普通人羣也將繼續需要/需求加強劑在當前疫苗中的份額預計將隨着時間的推移而減少,因為更多的技術進入反應性較低且可能獲勝的持續時間更長的產品,這些是VLP方法的潛在好處未來市場可能轉向組合組合疫苗可能是首選,而可組合性是VLP技術的預期好處。2024年和2026年新冠肺炎疫苗的全球銷售預測美元預測是從:高盛 輝瑞公司啟動覆蓋範圍2021年12月17日,全球數據製藥公司新冠肺炎銷售和預測2022年(不包括NVX-CoV-2373),評估製藥公司的共識預測,2022年(不包括NVX-CoV-2373),考恩治療類別展望2022年3月; Statista 2021我們相信新冠肺炎市場上VLP疫苗存在巨大的機會
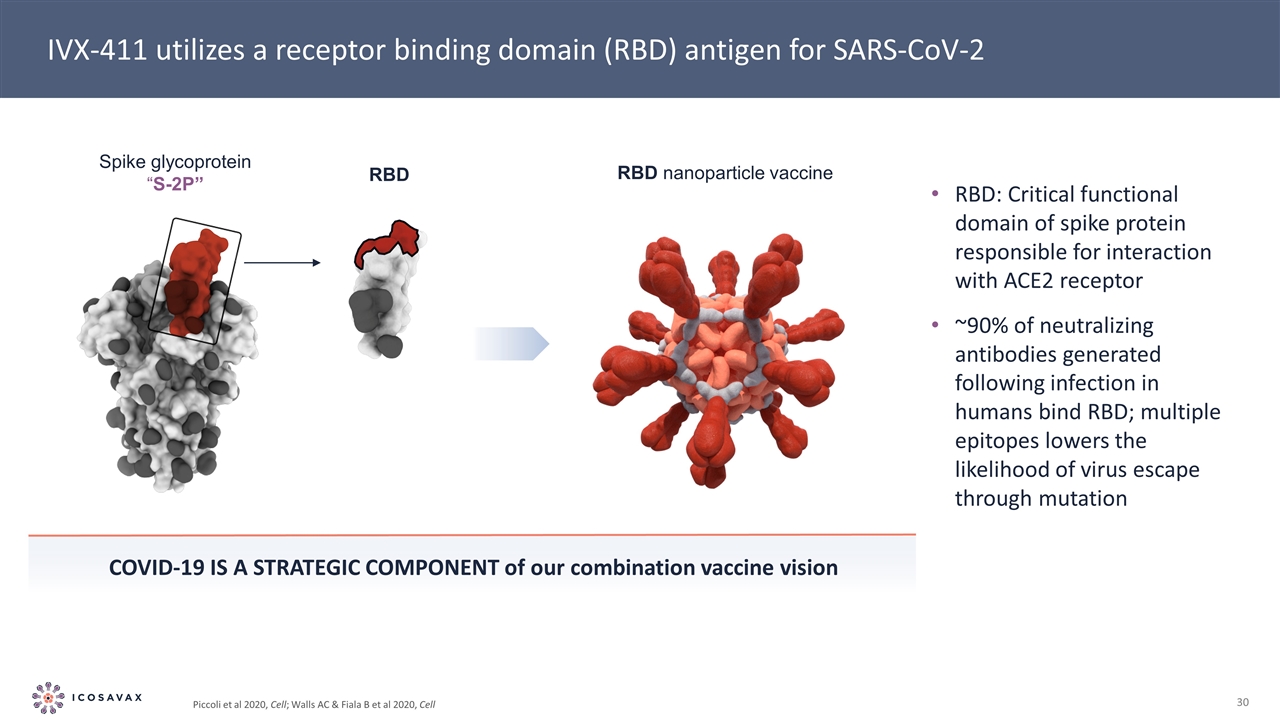
S-2P“S-2P”RBD RBD納米顆粒疫苗IVX-411利用SARS-CoV-2畢赤酵母的受體結合域(RBD)抗原,細胞;WALS AC&Fiala B等2020,細胞RBD:負責與ACE2受體相互作用的SPEK蛋白的關鍵功能域在人類感染後產生的~90%的中和抗體與RBD結合;多表位降低病毒通過突變逃逸的可能性新冠肺炎是我們聯合疫苗願景的戰略組成部分

研究達到了主要的安全性和免疫原性目標:初始環境中的第1階段(n=84)。2劑,間隔28天:5,25,125ug IVX-411劑量水平+/-佐劑2期強化設置(n=84)。1劑,在基本方案完成後3-6個月:5、25、125ug IVX-411+/-佐劑IVX-411一般安全且耐受性良好觀察到的不良事件(AEs)頻率與安慰劑的輕度至中度反應性相當,沒有嚴重或劑量限制。在初次接種和加強接種中未顯示相關的嚴重不良反應或具有特殊免疫原性的不良反應:初次接種中野生型(WT)的NAB和IgG抗體滴度相當於或低於人恢復期血清(HCS)水平,高於安慰劑水平 。佐劑組的高血清轉換率助推器:在mRNA3/4和腺病毒(1/4)初次接種後,WT變種的異源增強作用最高可達基線的5倍:在初級和加強免疫接種上下文中,所有受關注的變種(貝塔、德爾塔、奧密克戎)都出現了免疫反應從IVX-411期1/2 TOPLINE數據讀出的關鍵結論基於現有的臨牀前數據和VLP技術對RBD-VLP的預期免疫原性與預期的RBD-VLP基於現有的臨牀前數據和VLP技術 平臺正在進行低效性的根本原因調查,包括抗原穩定性和特性以及體內效力
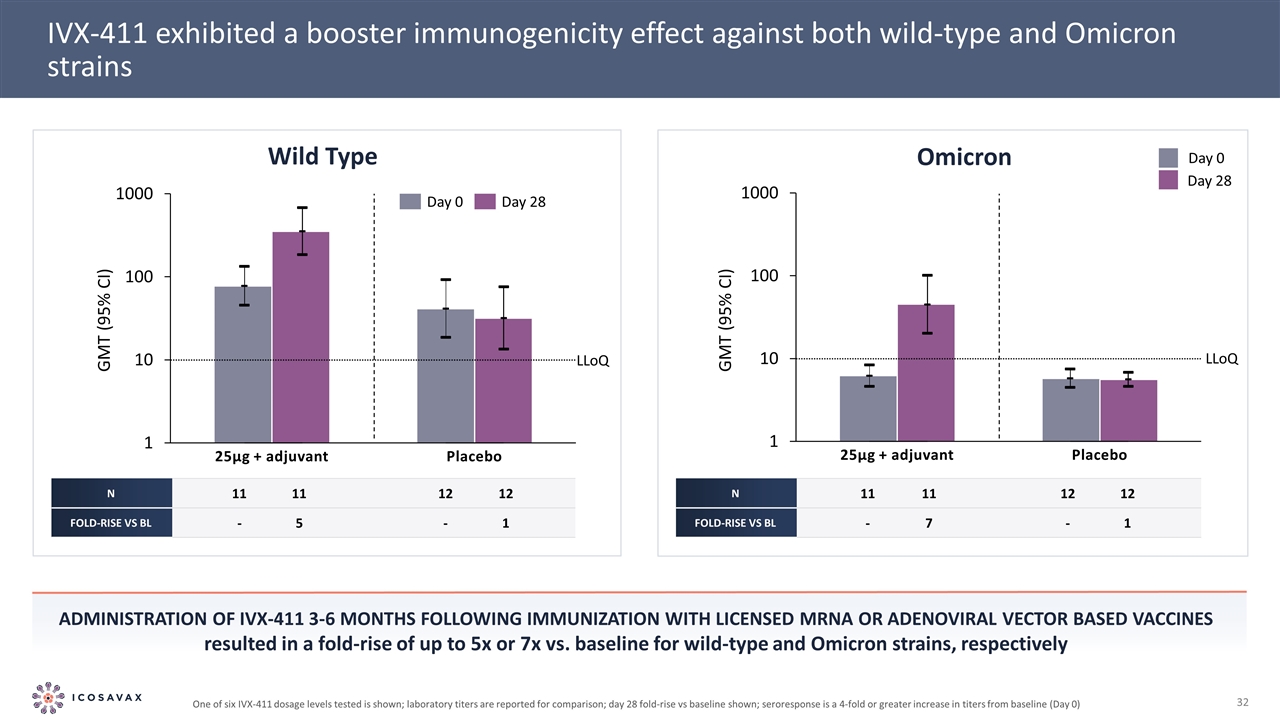
25微克+佐劑IVX-411顯示出對野生型和奧密克戎毒株的增強免疫原性作用。在獲得許可的基因和腺病毒載體疫苗免疫3-6個月後,野生型和奧密克戎毒株的免疫原性分別比基線增加了5倍或7倍,分別是25微克+佐劑N 11 11 12倍比BL-5-1 N 11 11 12倍比BL-7-1奧密克戎野生型GMT(95%CI)GMT(95%CI)LLOQ LLOQ ;報告實驗室滴度以供比較;第28天比基線上升4倍;血清反應是滴度比基線(第0天)增加4倍或更多
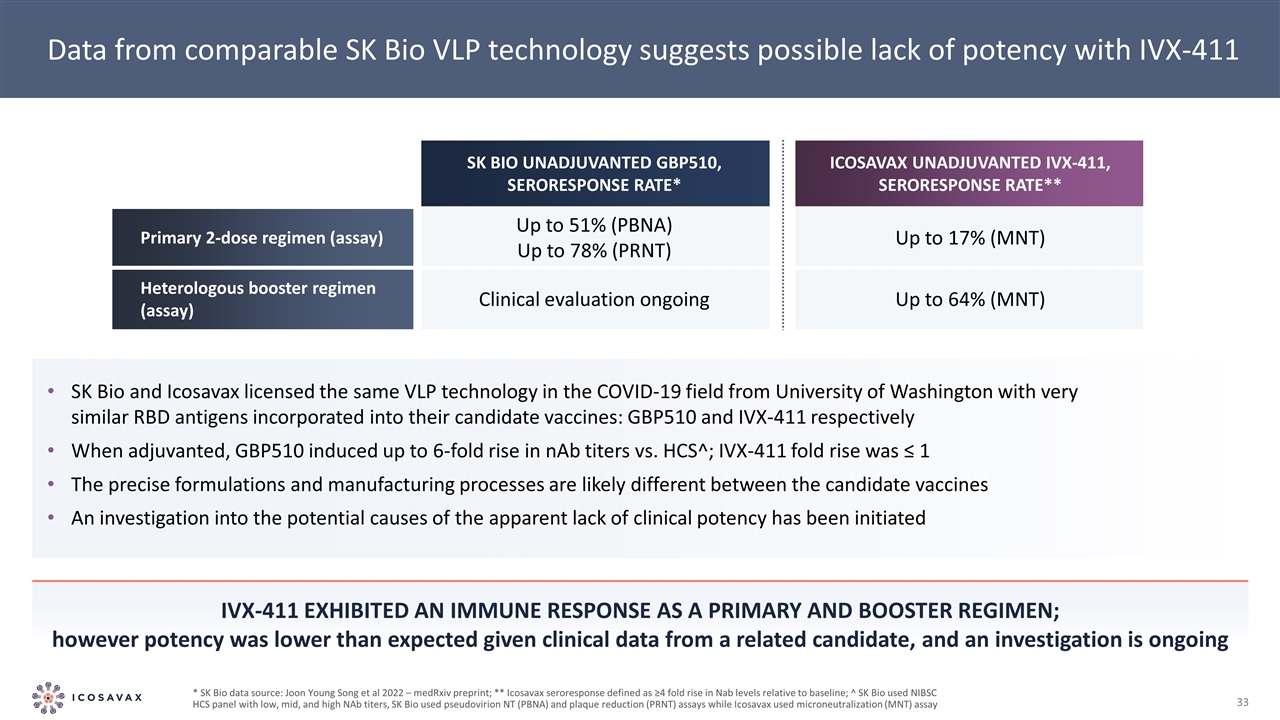
來自可比SK Bio VLP技術的數據表明,IVX-411SK Bio和ICosavax在新冠肺炎領域使用華盛頓大學授權的相同VLP技術,候選疫苗中加入了非常相似的RBD抗原:分別是GBP510和IVX-411,當加入佐劑時,GBP510誘導的NAB效價比HCS^增加了6倍;IVX-411的效價上升了6倍≤1候選疫苗的精確配方和製造工藝可能不同已經啟動了對明顯缺乏臨牀效力的潛在原因的調查IVX-411作為主要和加強方案顯示了免疫反應;然而,考慮到相關候選人的臨牀數據,效價低於預期,而且 調查正在進行中*SK Bio數據來源:Joon Young Song等人2022年-MedRxiv預印本;**Icoavax血清反應定義為≥水平相對於基線上升4倍;SK Bio使用低、中、高NAB滴度的NIBSC HCS面板,SK Bio使用偽病毒NT(PBNA)和空斑減少(PRNT)檢測,而ICosavax使用微量中和(MNT)檢測SK Bio未加佐劑GBP510,血清應答率*ICosavax無佐劑IVX-411,血清應答率**一次2劑 方案(檢測)高達51%(PBNA)至78%(PRNT)至17%(MNT)異種強化方案(檢測)正在進行臨牀評估

流感計劃
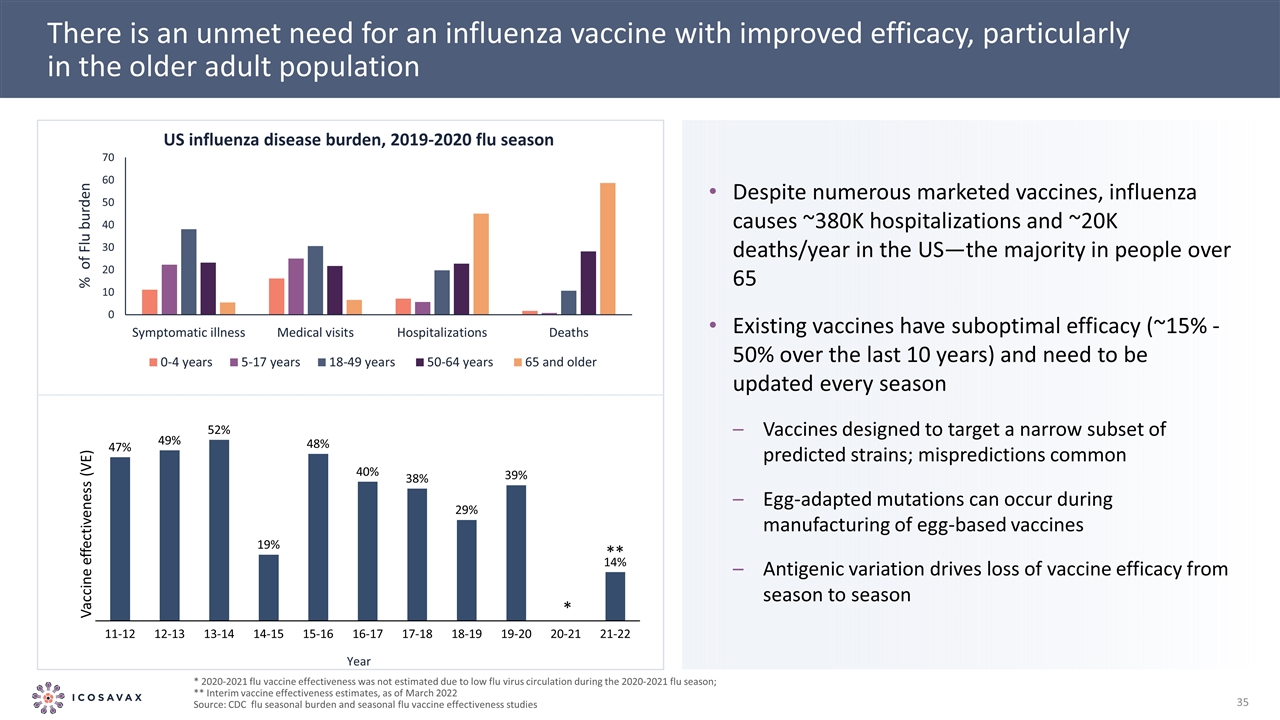
對提高效力的流感疫苗的需求尚未得到滿足,特別是在老年人口中*由於2020-2021年流感季節流感病毒傳播量較低,因此沒有估計2020-2021年流感疫苗的有效性;**臨時疫苗有效性 估計,截至2022年3月來源:CDC流感季節性負擔和季節性流感疫苗有效性研究儘管美國市場上有許多疫苗,流感每年導致約38萬人住院和約20000人死亡-現有疫苗的大多數在 65歲以上的人中效果不佳(過去10年中約15%-50%),需要每季度更新針對少數預測毒株的疫苗;在生產雞蛋疫苗期間,常見的雞蛋適應突變可能會發生 抗原變異導致疫苗效力從一個季節到另一個季節的喪失佔流感負擔年度的百分比**
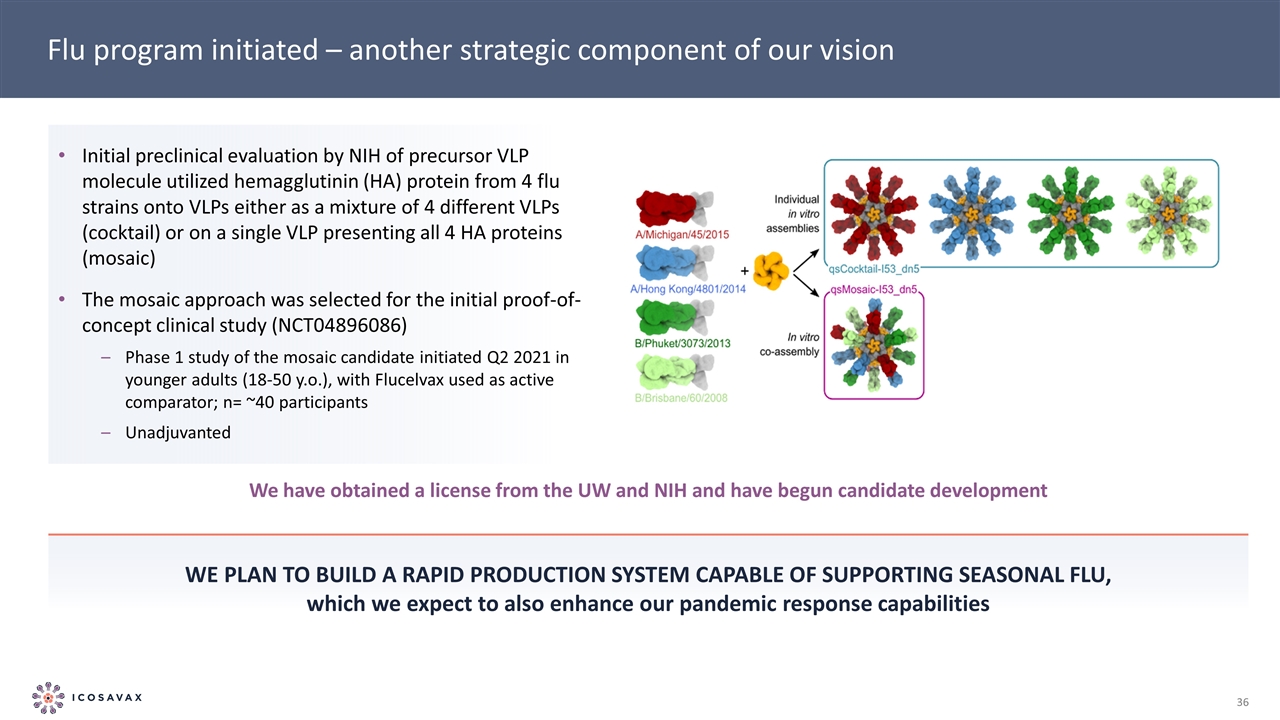
流感計劃啟動-我們願景的另一個戰略組成部分我們計劃建立一個能夠支持季節性流感的快速生產系統,我們預計這也將增強我們的大流行應對能力NIH對來自4個流感毒株的前體VLP 分子利用來自4個不同VLP的血凝素(HA)蛋白進行初步臨牀前評估,作為4個不同VLP的混合物(雞尾酒)或在單個VLP上呈現所有4個HA蛋白(馬賽克)馬賽克方法被選擇用於初步概念驗證 臨牀研究(NCT04896086)階段1研究馬賽克候選在2021年第二季度在年輕人(18-50歲)中啟動,以FLucelvax為主動比較器;N=~40名參與者未經調整我們已從華盛頓大學和美國國立衞生研究院獲得許可,並已開始候選開發
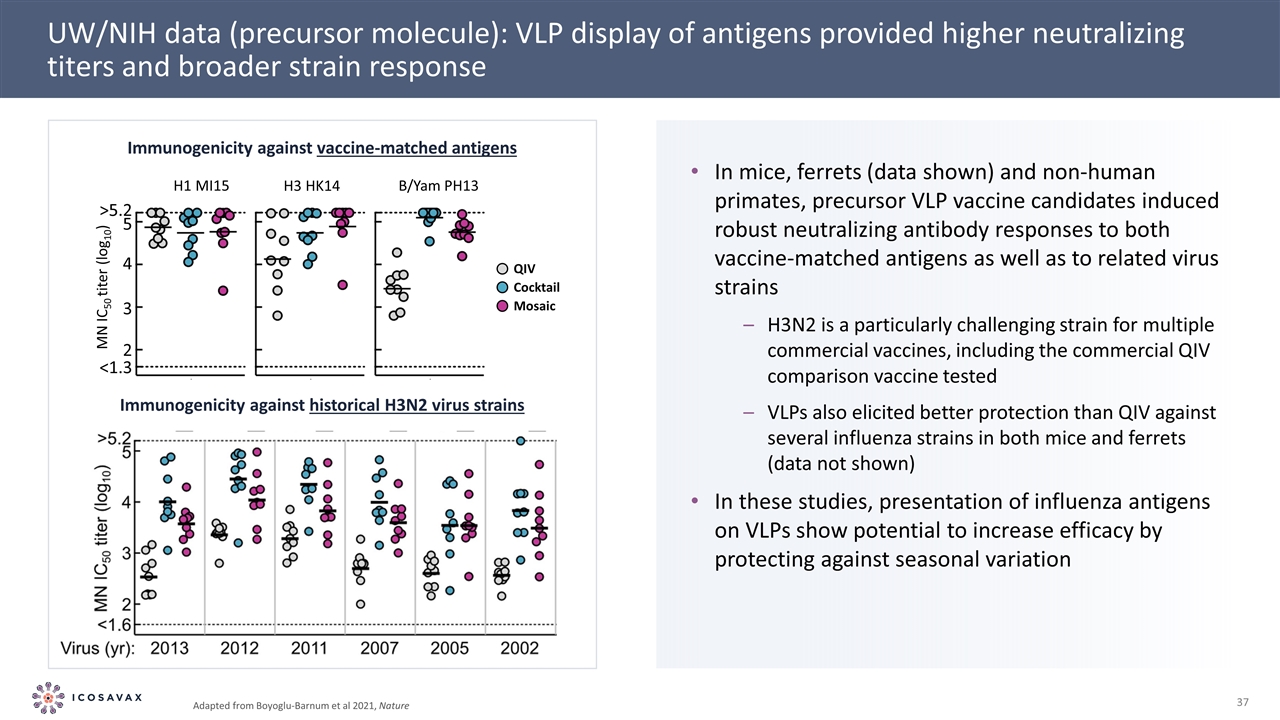
UW/NIH數據(前體分子):抗原的VLP展示提供了更高的中和滴度和更廣泛的針對疫苗匹配抗原的毒株反應免疫原性對來自Boyylu-Barnum等人的歷史H3N2病毒株的免疫原性,自然在小鼠,雪貂(數據顯示)和非人類靈長類動物,前體VLP候選疫苗對疫苗匹配抗原和相關病毒株都能誘導強大的中和抗體反應H3N2對多種商業疫苗特別具有挑戰性,包括商業QIV比較疫苗測試的VLP對小鼠和雪貂的幾種流感病毒株(數據未顯示)也具有更好的保護作用。將流感抗原呈現在VLP上可防止雞尾酒QIV馬賽克H3 HK14 H1 MI15 B/YAM Ph13 5.2 MN IC50滴度(Log10)的季節性變化,從而顯示出提高療效的潛力

總結:為什麼選擇Icoavax?

執行團隊執行團隊亞當·辛普森首席執行官Doug Holtzman博士公共衞生碩士首席科學官Niranjan Kanesa-thasan醫學博士MTMH首席醫療官Tom Russo首席財務官Cassia Cearley博士首席商務官Elizabeth Bekiroğlu General律師查爾斯·理查森博士技術運營領導科學諮詢委員會高級副總裁尼爾·金博士(主席)聯合創始人大衞·貝克博士聯合創始人拉爾夫·克萊門斯醫學博士巴尼·格雷厄姆醫學博士克里斯蒂安·曼德爾,醫學博士Jean-Paul Prieels,博士Robin Robinson,博士董事會Terry Gold Adams Street Peter Kolchinsky,Ph.D.Ra Capital海蒂·昆茨,前加州Mark McDade藍盾公司執行副總裁兼首席財務官(主席)啟明風險投資合夥人John Shiver,博士,IMG Biosciences;前賽諾菲·巴斯德,默克,美國國立衞生研究院亞當·辛普森首席執行官安·維尼曼,聯合國兒童基金會前執行董事

開發以VLP為基礎的疫苗和 組合物,設想為老年人提供泛呼吸道疫苗專門設計的模仿病毒結構以增強免疫反應的獨特方式有多種潛在好處--並在未滿足需求的主要領域提供多個 製造優勢和有吸引力的商業機會 RSV候選疫苗IVX-121目前處於第1/1b階段,背線數據將於22年第2季度公佈;首個RSV/hMPV組合候選疫苗IVX-A12 計劃今年晚些時候進入第一階段;COVID候選疫苗IVX-411已完成第1/2階段;下一步將在調查後確定。臨牀前開發中的新流感計劃繼續擴大能力, 包括新的研究團隊,帶來最先進的抗原設計,優化製造速度等。在領先的醫療保健投資者的支持下,在蛋白質設計和疫苗開發方面擁有豐富專業知識的經驗豐富的團隊,以及傑出的科學顧問委員會的主要亮點
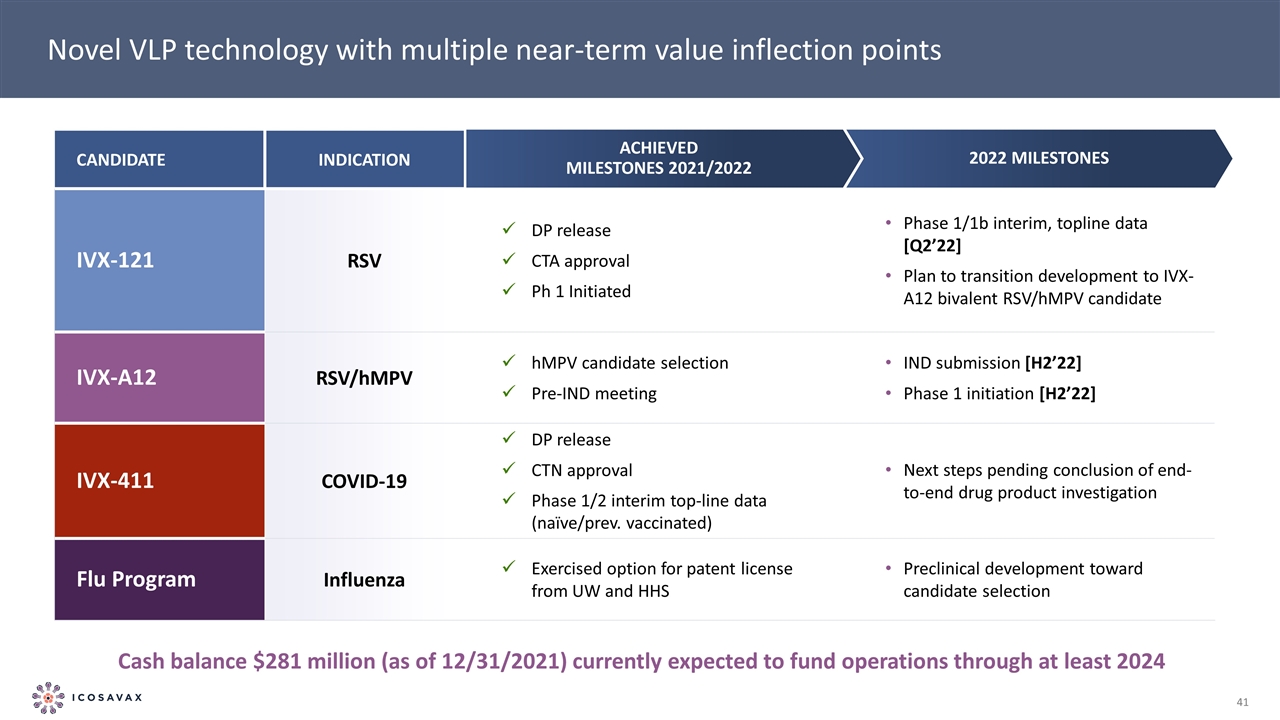
具有多個近期價值拐點的新型VLP技術候選指示IVX-121 RSV DP發佈CTA批准Ph1啟動階段1/1b中期、背線數據[Q2’22]計劃過渡到IVX-A12二價RSV/hMPV候選IVX-A12 RSV/hMPV hMPV 候選人選擇IND會議前IND提交[H2’22]第一階段啟動[H2’22]IVX-411新冠肺炎DP發佈CTN批准階段1/2臨時頂線數據(天真/之前疫苗接種)下一步等待端到端藥物的結論 產品調查流感計劃流感行使UW和HHS臨牀前開發候選選擇專利許可證2021/2022里程碑2022里程碑現金餘額2.81億美元(截至2021/31/2021)目前 預計至少到2024年為運營提供資金