
勇於創新2022年4月納斯達克:OCGN

前瞻性陳述2本陳述包含1995年《私人證券訴訟改革法》所指的前瞻性陳述,這些陳述會受到風險和不確定性的影響。在某些情況下,我們可能會使用“預測”、“相信”、“潛在”、“建議”、“繼續”、“估計”、“預期”、“預期”、“計劃”、“打算”、“可能”、“將”、“應該”或其他表達未來事件或結果不確定性的詞語來識別這些前瞻性陳述。此類前瞻性陳述包括對現有數據的定性評估、潛在益處、對臨牀試驗的預期以及臨牀試驗讀數和監管提交的預期時間。這些信息涉及風險和不確定因素,可能導致實際結果與此類陳述所表達或暗示的結果大相徑庭。風險和不確定性包括但不限於研發中固有的不確定性,包括滿足預期臨牀終點的能力、臨牀試驗的開始和/或完成日期、監管提交日期、監管批准日期和/或啟動日期,包括由於持續的新冠肺炎大流行的影響而無法滿足這些日期的風險,以及與初步和中期數據相關的風險,包括不利的新臨牀試驗數據和對現有臨牀試驗數據的進一步分析;體外研究結果不會在人體臨牀試驗中重複的風險;在科學界,臨牀試驗數據受到不同解釋和評估的風險,包括在同行審查/發表過程中, 是否以及何時將來自Bharat Biotech的臨牀試驗的數據發表在科學期刊出版物上,如果是,何時以及進行何種修改;由印度Bharat Biotech進行的COVAXIN™的臨牀前和臨牀研究的數據和結果是否將被美國食品和藥物管理局(“FDA”)接受,或者是否足以支持我們的研究性新藥申請(“IND”)或計劃的生物製品許可證申請(“BLA”)(視情況而定);我們是否以及何時能夠解決我們的COVAXIN™的2/3期免疫橋聯和拓寬臨牀試驗的臨牀擱置;我們可能需要進行的任何其他試驗或研究的規模、範圍、時間和結果,以支持COVAXIN™的臨牀試驗,包括我們的2/3期免疫橋接和拓寬臨牀試驗和計劃的安全橋接臨牀試驗;我們可能被要求提交的任何額外的化學、製造和對照信息;COVAXIN™的BLA是否以及何時將提交給FDA;美國食品和藥物管理局是否以及何時批准新藥提交申請,加拿大衞生部是否批准新藥提交申請,以及我們向加拿大衞生部提供的額外信息是否足以支持加拿大衞生部批准COVAXIN™及其相關的任何延遲;根據我們與巴拉特生物技術公司的協議,我們是否有能力在墨西哥為18歲以上的成年人成功地將COVAXIN™商業化;我們是否以及何時將獲得用於2至18歲兒童的COVAXIN™在墨西哥的緊急使用授權批准;授權或批准將取決於多種因素, 包括確定候選疫苗的益處是否大於其已知風險,以及候選疫苗的效力以及如果獲得批准或獲得批准是否會在商業上成功;與新冠肺炎大流行有關的事態發展是否會影響美國、加拿大、墨西哥或其他司法管轄區可用於疫苗的監管途徑;製造能力、生產能力和供應限制,包括是否能在我們預計的時間段內生產或供應足夠劑量的科瓦欣™;美國、加拿大或墨西哥對科瓦欣™的市場需求;美國食品和藥物管理局、加拿大衞生部或聯邦衞生防護委員會在墨西哥針對影響標籤、製造工藝、安全性和/或其他可能影響™在美國、加拿大或墨西哥的供應或商業潛力的事項的衞生風險作出的決定,包括其他公司的產品或療法的開發。這些以及其他風險和不確定性在我們提交給美國證券交易委員會(“美國證券交易委員會”)的定期報告中有更全面的描述,包括我們在提交給美國證券交易委員會的季度和年度報告中題為“風險因素”的章節中描述的風險因素。我們在本演示文稿中所作的任何前瞻性陳述僅限於本演示文稿發佈之日。除法律另有規定外,我們沒有義務在本陳述之日之後,因新信息、未來事件或其他原因而更新陳述中包含的前瞻性陳述。。

我們來到這裏是為了通過歐庫根的勇敢創新3使命產生影響,我們正在為醫療挑戰開發新的解決方案,有目的和靈活地進行醫療創新,為面臨疾病的人提供新的選擇。願景我們正在培育一個沒有人在疾病面前感到絕望的未來。從遺傳疾病到新的疾病,我們的專業知識和堅韌正在為人們和全球社區創造選擇。首創針對幾種遺傳形式視力障礙的突破性修飾基因療法創新一種新的生物療法用於治療可能導致數百萬人失明的眼病共同開發一種新冠肺炎疫苗

4管道概述資產/項目指示狀態疫苗COVAXIN™(BBV152)墨西哥成人用全病毒滅活疫苗新冠肺炎·EUA;正在審查的2-18歲兒童EUA*·美國2/3期臨牀試驗*(暫停劑量/臨牀擱置)·加拿大衞生部正在審查的NDS*修飾基因治療平臺OCU400*AAV-hNR2E3基因突變與視網膜變性相關**NR2E3突變1/2 Rho突變1/2 CEP290突變將提交PDE6B突變將提交OCU410 AAV-hRORA乾性年齡相關性黃斑變性(乾性AMD)**臨牀前新生物OCU200轉鐵蛋白-腫瘤糖尿病黃斑水腫臨牀前糖尿病視網膜黃斑變性(Wet AMD)臨牀前*基於印度巴拉特生物技術贊助的臨牀試驗**在美國沒有批准的療法https://www.aao.org/eye-health/diseases/retinitis-pigmentosa-treatment|https://www.aao.org/eye-health/diseases/amd-treatment*孤兒藥物指定;歐共體指定廣泛的孤兒藥品用於治療視網膜色素變性(RP)和Leber先天性黑色素(LCA)

5柯薩欣™(BBV152)是巴拉特生物技術公司批准用於美國和加拿大市場的全病毒滅活新冠肺炎候選疫苗

產品簡介6 COVAXIN™(BBV152):全病毒滅活SARS-CoV-2抗原和佐劑:6ug/shd+阿爾蓋爾-™(TLR7/8激動劑)劑量水平和方案為每0.5毫升混懸液6 ug;2劑:第0天和第28天每瓶10劑預計貨架壽命2℃-8℃儲存條件下穩定6個月兩年建議適應症預防由SARS-CoV-2引起的新冠肺炎目標人羣:2-18歲及以上兒童

7為什麼選擇科瓦欣™?旨在增強我們在北美的新冠肺炎疫苗庫·成人和兒童階段2/3數據表明,針對多種病毒蛋白產生體液和細胞反應·數據支持疫苗誘導Th1反應(細胞免疫),這對持久保護至關重要·數據表明,成人和兒童人羣中有很強的安全性·用於生產脊髓灰質炎的技術平臺,流感和狂犬病疫苗使用VERO細胞平臺已知的安全性·第三階段數據建議可預防新冠肺炎引起的住院·增強劑量提供針對奧密克戎和Delta變種的強大中和抗體反應,專為廣譜免疫反應設計結果顯示可預防嚴重新冠肺炎病·10劑瓶裝,可在2°-8°C下儲存和運輸,保質期2年,室温下6個月穩定性運輸和儲存輕鬆圖片僅供説明用途

8為什麼選擇™(BBV152)?第三階段臨牀試驗亮點77.8%93.4%65.2%總體療效與重症療效對比B.1.617.2(Delta)嚴重不良事件安慰劑ARM不良事件COVAXIN™ARM 12.4%

柯薩欣™發展的9條途徑國家技術研究:05258669免疫橋聯和拓寬(OCU-002)助推器和安全性*建議的中期分析BLA提交窗口*擬提交的協議OCU-002A階段2/3,觀察者盲法,免疫橋接,和拓寬完整的嚴重急性呼吸綜合徵冠狀病毒滅活疫苗(BBV152)在健康成人中的研究類型幹預(臨牀試驗)估計登記400參與者分配隨機分配幹預模型平行分配幹預模型描述1:1隨機比主要目的預防模型描述

10修飾劑基因治療平臺突破性技術旨在應對許多罕見疾病以及影響數百萬人的複雜疾病

11我們的焦點:核激素受體基因(NHR)*參考:https://pubmed.ncbi.nlm.nih.gov/28556246/|https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5409218/https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4339951/|https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0183526 NHR是視網膜發育和功能的調節器,作為視網膜分子重置關鍵轉錄因子和相關基因網絡的“主基因”--視網膜穩態基因修飾物的概念,包括它對臨牀表型的影響,在其他疾病領域是眾所周知的,如囊性纖維化和脊肌萎縮症

12我們的願景:修飾性基因治療與傳統基因增強正常基因X基因增強:將非功能基因的功能版本轉移到靶細胞中。修飾基因治療:旨在引入一種功能基因來改變許多基因、基因網絡的表達,並調節視網膜的基本生物學過程。一次針對一種單個基因突變的傳統方法調控途徑專注於一種疾病的特定產品更長時間來收回開發成本針對核激素基因(NHR)的新方法,傳統基因療法OCU400 NR2E3突變相關視網膜疾病視紫紅質突變相關視網膜疾病CEP290突變相關視網膜疾病PDE6B突變相關視網膜疾病廣譜治療RP One疾病基因X基因X基因X細胞基因M細胞功能正常的基因以外的其他基因修飾基因X基因M細胞功能正常的細胞我們計劃使用相同的基因修飾物產品來治療多種疾病。單元格

13我們的原則證明:Neena Haider博士的實驗室研究在《自然》雜誌上發表了在哈佛醫學院開發的5種獨特的RP技術小鼠模型上顯示的基因治療有效性結果,表明修飾性基因治療在疾病早期和晚期獲得廣譜治療益處的效力表明,有證據表明在疾病的早期和晚期進行視力挽救https://www.nature.com/articles/s41434-020-0134-z是治療發展的重要里程碑;證明瞭在由不同突變引起的變性動物模型中引發的原理保護的證據可能代表第一種廣譜治療並在疾病開始後提供救援
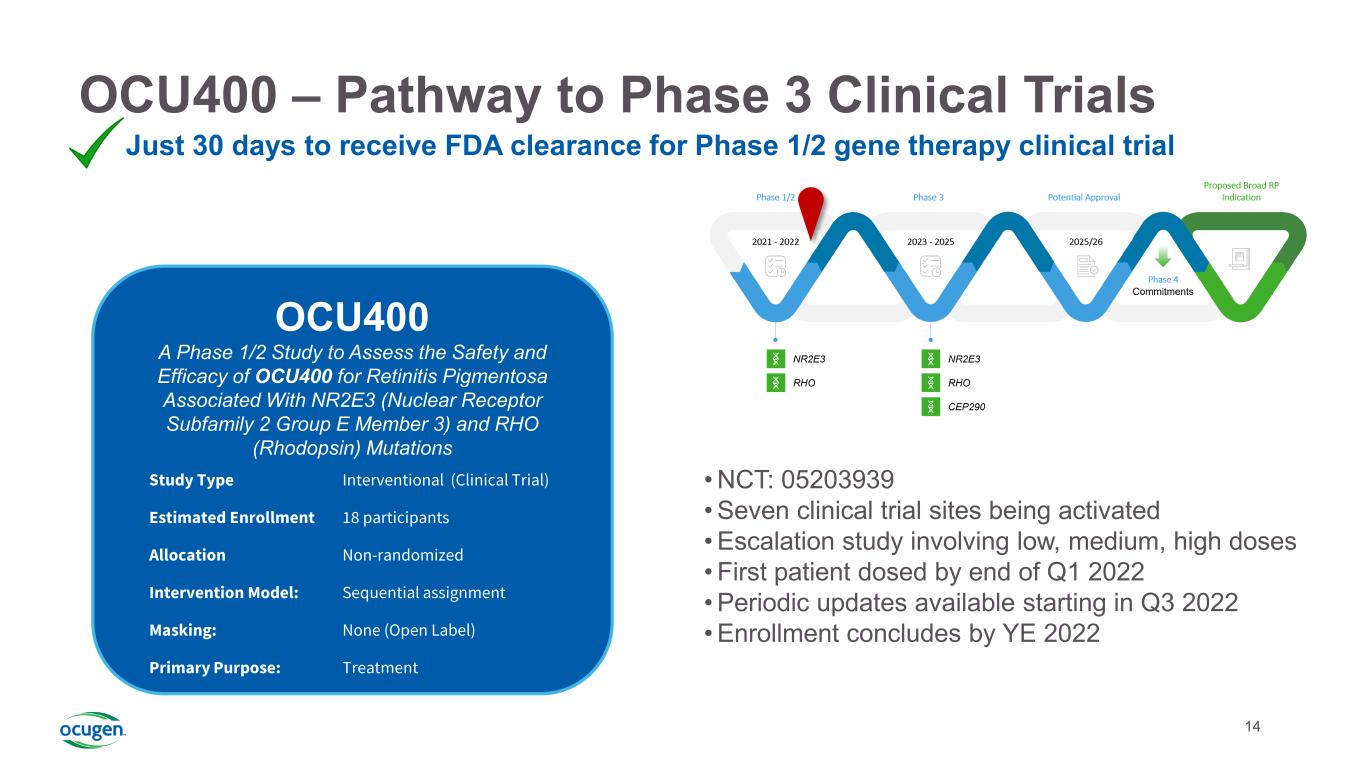
14 OCU400-3期臨牀試驗之路僅30天即可獲得FDA批准進行1/2期基因治療臨牀試驗·NCT:05203939·7個臨牀試驗站點正在激活·涉及低、中、高劑量·第一個患者在2022年第一季度末給藥·2022年第三季度開始定期更新·2022年第三季度結束登記OCU400評估OCU400治療與NR2E3(核受體亞家族2組E成員3)和Rho(視紫紅質)突變相關的視網膜色素變性的安全性和有效性的1/2階段研究類型介入(臨牀試驗)估計登記18參與者分配非隨機幹預模型:序貫分配掩蔽:無(開放標籤)主要目的:治療

15在研究OCU400用於治療由NR2E3和RHO基因突變引起的視網膜色素變性的1/2期臨牀試驗中,第一名患者在CanSinoBio成功完成了商業規模(200L)的生產,以支持臨牀研究擴大與CanSinoBio的製造協議,包括支持OCU410 Ocugen計劃2022年在墨西哥將™商業化的活動摘要,隨着Ocugen領域的擴大,現已覆蓋整個北美,該公司正在與美國食品和藥物管理局合作,解決世界衞生組織對BBIL製造設施的檢查所產生的問題,以便繼續進行OCU-002臨牀試驗加拿大衞生部繼續進行COVAXIN™(BBV152)OCU400/410

16經驗豐富的領導力Shankar Musunuri,博士,MBA董事長、首席執行官兼聯合創始人Zara Gaudioso,SHRM-CP AVP,人力資源,辦公廳主任Nirdosh Jagota,法規事務,合規和安全高級副總裁Jessica Creso,註冊會計師首席會計官&高級副總裁,財務Bruce Forrest,MD代理首席醫療官J.P.Gabriel SVP,技術運營Huma Qamar,MD,公共衞生碩士,CMI AVP,臨牀開發Mike Shine高級副總裁,商業Arun Upadhyay,博士高級副總裁,研發

2022年4月納斯達克:OCGN謝謝!