
附錄 99.1

1 © 2022 NOVAVAX。版權所有。NOVAVAX 研究 N AnoFLU 疫苗和 COVID-19 的最新情況——流感聯合疫苗開發 2022 年 4 月 20 日 | NOVAVAX

安全港聲明 2 © 2022 NOVAVAX。版權所有。某些信息,特別是與Novavax的未來、其運營計劃和前景、合作伙伴關係、NVX-CoV 2373的持續發展有關的信息,包括Novavax計劃在2022年第二季度啟動兒科研究,NanoFlu,其COVID-季節性流感研究候選疫苗,COVID-nanoFlu組合疫苗,包括Novavax啟動COVID-nanoFlu組合疫苗的2期臨牀試驗的計劃,Omicron-特異性疫苗和其他 Novavax 候選疫苗產品,得出結果的時間來自臨牀試驗,Novavax和NVX-CoV 2373在解決疫苗獲取、控制疫情和保護人羣方面的潛在影響,包括加強劑量的NVX-CoV 2373以提供針對COVID-19(包括變體)的保護,以及NVX-CoV 2373的有效性、安全性和預期用途,包括Novavax' 計劃用監管部門同意的兒科數據和兒科調查計劃來補充全球監管文件當局、NVX-CoV 2373的全球市場機遇、我們的全球供應鏈準備就緒以及NVX-CoV 2373在全球範圍內的未來上市,以及NVX-CoV 2373的商業化和預期交付以及即將到來的關鍵里程碑構成了前瞻性聲明。前瞻性陳述通常可能包含諸如 “相信”、“可能”、“將”、“可能”、“可能”、“估計”、“繼續”、“正在進行”、“考慮”、“預期”、“打算”、“尋求”、“表明”、“計劃”、“項目”、“期望”、“應該”、“將”、“目標” 或 “假設” 或 “假設” 或此類單詞或其他具有相似含義的單詞的變體。Novavax警告説,這些前瞻性陳述受許多假設、風險和不確定性的影響,這些假設、風險和不確定性會隨着時間的推移而發生變化,並可能導致實際業績與前瞻性陳述中討論的結果存在重大差異。這些風險和不確定性包括但不限於單獨或與合作伙伴一起滿足各種安全性、有效性和產品特性要求,包括滿足相關監管機構所需的與工藝認證和檢測驗證相關的要求;難以獲得稀缺的原材料和供應;資源限制,包括製造能力,包括人力資本和製造能力,影響Novavax走上計劃監管途徑的能力;應對挑戰與多個商業、政府和其他實體達成的協議下的合同要求;以及向美國證券交易委員會提交的截至2021年12月31日的Novavax截至2021年12月31日年度報告的 “風險因素” 和 “管理層對財務狀況和經營業績的討論和分析” 部分確定的其他風險因素,可在www.sec.gov和www.novavax.com上查閲。前瞻性陳述基於當前的預期和假設以及當前可用的數據,既不是對未來事件或業績的預測,也不是對未來事件或業績的保證。當前的結果可能無法預測未來的結果。你不應過分依賴前瞻性陳述,這些陳述僅代表截至本文發佈之日。除非適用法律要求,否則公司不承諾在任何前瞻性陳述發表後對其進行更新或修改,無論是由於新信息、未來事件還是其他原因。Novavax TM(及所有相關徽標)是 Novavax, Inc. 的商標。Matrix-M TM 是 Novavax AB 的商標。

概述 nanoFLU (qNiV) 疫苗項目開發 COVID-流感組合 (CIC) 疫苗開發 3 © 2022 NOVAVAX。版權所有。

N anoFLU * (q NIV) 疫苗開發 4 © 2022 NOVAVAX。版權所有。* nanoFLU 鑑定了 Novavax 生產的重組血凝素 (HA) 蛋白納米顆粒候選流感疫苗。該候選研究對象是在2019-2020年流感季節進行的一項對照3期試驗中評估的。

特徵針對疫苗類型卵子——適應性變化抗原漂移免疫衰老抗體 T-細胞標準滅活 1,2,3,4,5 高劑量滅活 1,3,4,5 x MF-59 輔助型 4,5,6,7 x x?細胞-衍生的失活 5,8?重組 2,3,4 x x x nanoFlu (qniV) 9,10 [重組 + 佐劑]x x x x 目前獲得許可的流感疫苗的特徵 5 © 2022 NOVAVAX。版權所有。1.Diaz-Granados 2015;2.Dunkle,2017;3.Zost,2017;4.2019 年 Cowling;5.2019 年 Izurieta;6.Frey 2014;7.Mannino 2012;8.Gouma 2020;9.Shinde 2018;10.Shinde 2020 nanoFLU(qNiV)已被證明可以誘導廣泛的交叉反應性抗體和強效的多功能 CD4+ T 細胞反應,並避免卵子適應性抗原變化。這些只是產品特性,尚未進行頭對頭研究,並不意味着臨牀療效。
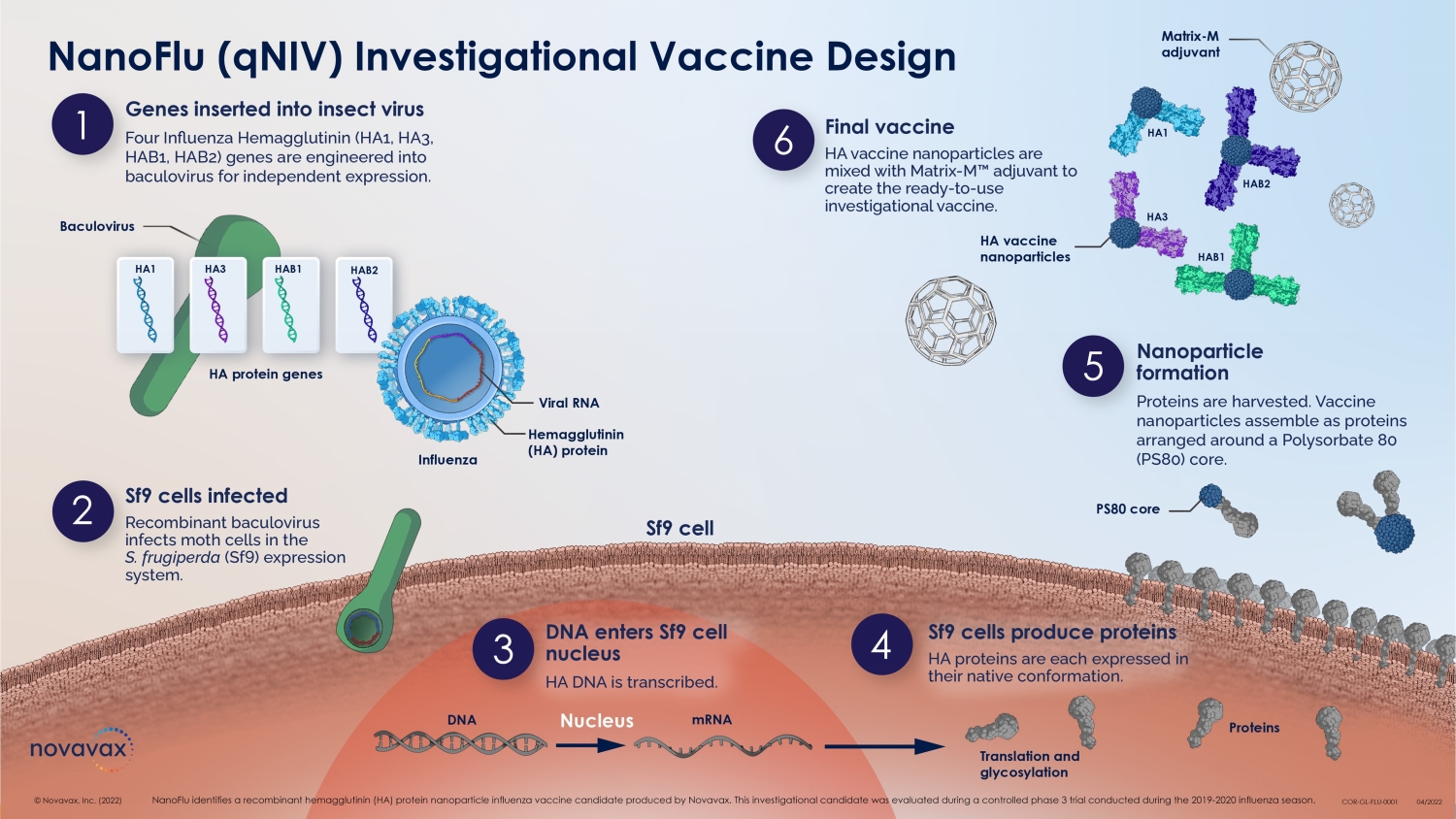
6 © 2022 NOVAVAX。版權所有。
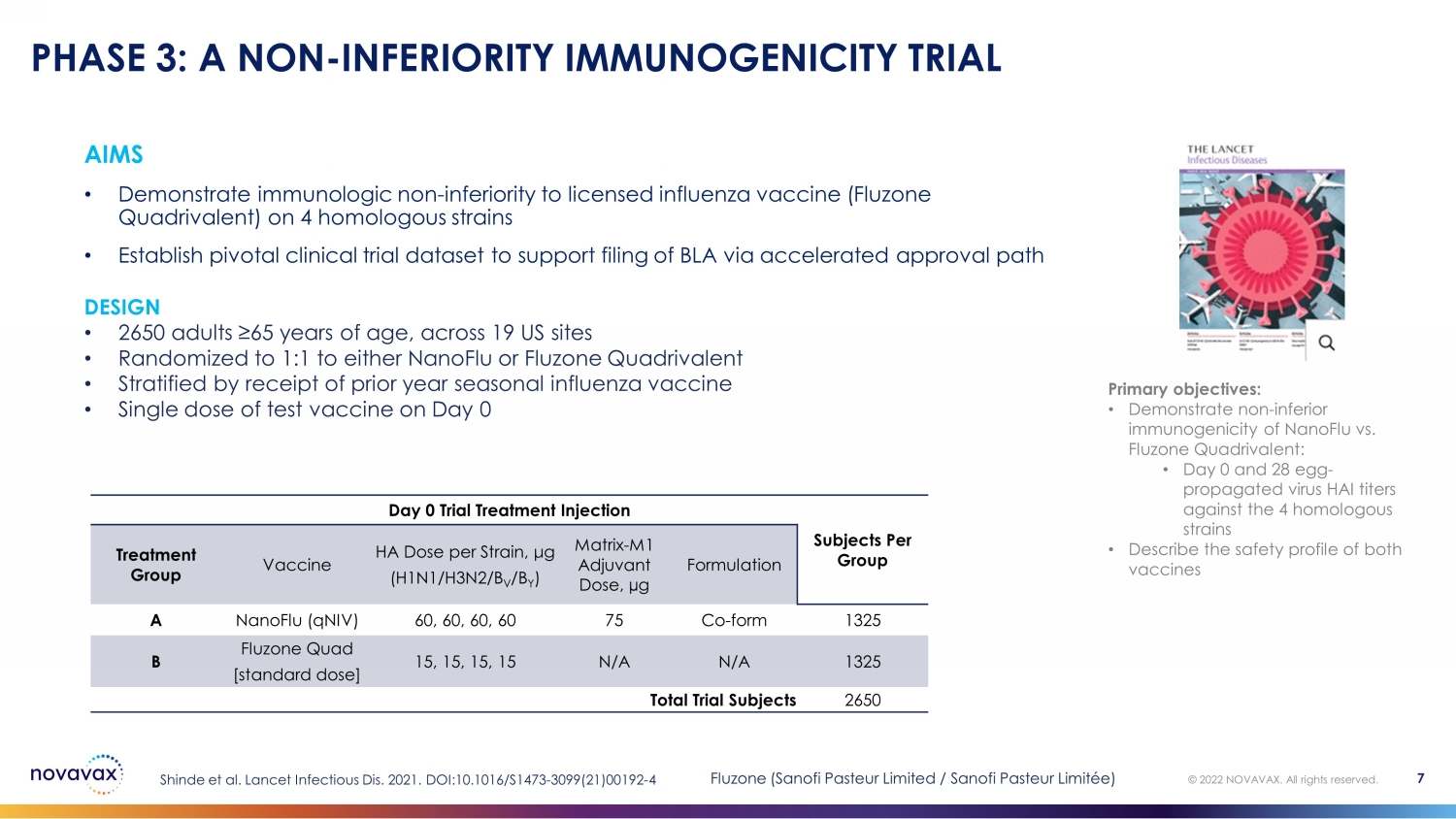
目標 • 在 4 種同源菌株上證明免疫學上不遜於獲得許可的流感疫苗(Fluzone Quadrivalent)• 建立關鍵臨牀試驗數據集以支持通過加速批准途徑申報 BLA 第 3 階段:非劣質免疫原性試驗主要目標:• 證明 nanoFlu 與 Fluzone 四價疫苗的免疫原性不差:• 第 0 天和第 28 天——卵子傳播的病毒 HAI 滴度對比 4 同源菌株 • 描述兩種疫苗的安全性(第 0 天試驗治療每組治療的注射受試者)每種菌株的分組疫苗 HA 劑量,μg (H1N1/H3N2/B V /B Y) 矩陣-M1 輔助劑量,µg 配方 A nanoFlu (qniV) 60、60、60、60 75 Co-form 1325 B Fluzone Quad [標準劑量]15、15、15、15 N/A N/A 1325 總試驗受試者 2650 Shinde 等人2021 年《柳葉刀》傳染病。DOI: 10.1016/S1473-3099 (21) 00192-4 © 2022 NOVAVAX。版權所有。7 DESIGN • 美國 19 個地點的 2650 名年齡在 65 歲以上的成年人 • NanoFlu 或 Fluzone Quadrivalent 隨機分配至 1:1 • 按去年接種的季節性流感疫苗進行分層 • 第 0 天 Fluzone 的單劑測試疫苗(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司)

• 所有使用卵子適應性 HAI 抗體反應評估的同源菌株均達到主要免疫原性終點 • 非自卑性符合 GMT 比率和血清轉化差異成功標準 • nanoFlu:與 4 種同源菌株的 Fluzone 四價抗體相比 Fluzone 四價抗體反應高 24 — 66% • nanoFlu:野生型 HAI 抗體反應高出 34 — 46% 2 漂移菌株 • 野生型微中和抗體反應已證實野生型 HAI 抗體反應第 3 階段摘要:已達到主要終點Shinde 等人。2021 年《柳葉刀》編號。DOI:10.1016/S1473-3099 (21) 00192-4 © 2022 NOVAVAX。版權所有。8
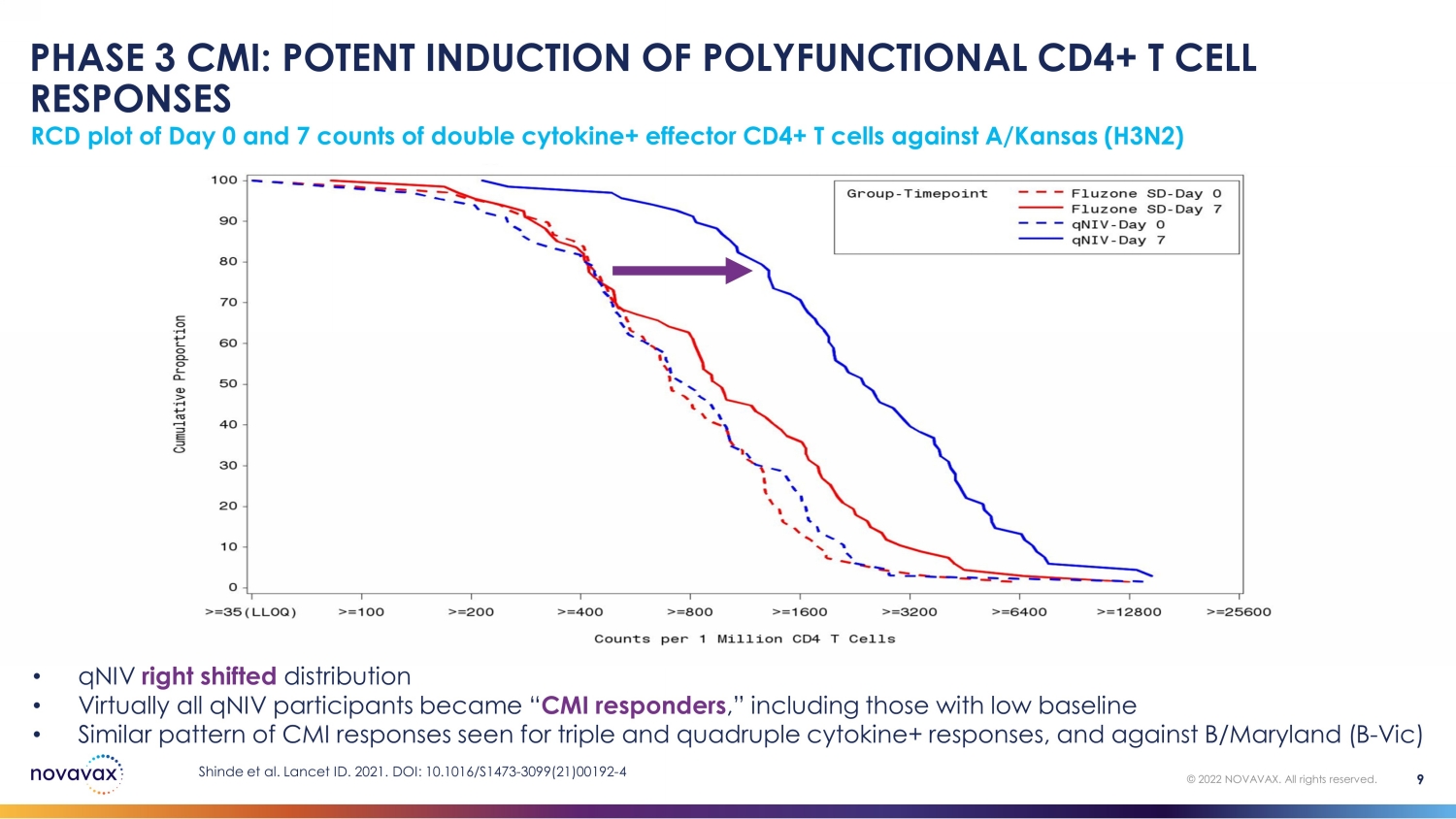
第 3 階段 CMI:強效誘導多功能 CD4+ T 細胞反應 0 天 RCD 曲線圖和 7 個針對 A/Kansas (H3N2) 的雙cytokine+ 效應 CD4+ T 細胞計數 9 © 2022 NOVAVAX。版權所有。• qniV 右移分佈 • 幾乎所有 qniV 參與者都成了 “CMI 反應者”,包括基線較低的參與者 • 三重和四倍細胞因子+反應以及針對 B/Maryland (B-Vic) Shinde 等人的 CMI 反應模式類似。2021 年《柳葉刀》編號。DOI:10.1016/S1473-3099 (21) 00192-4
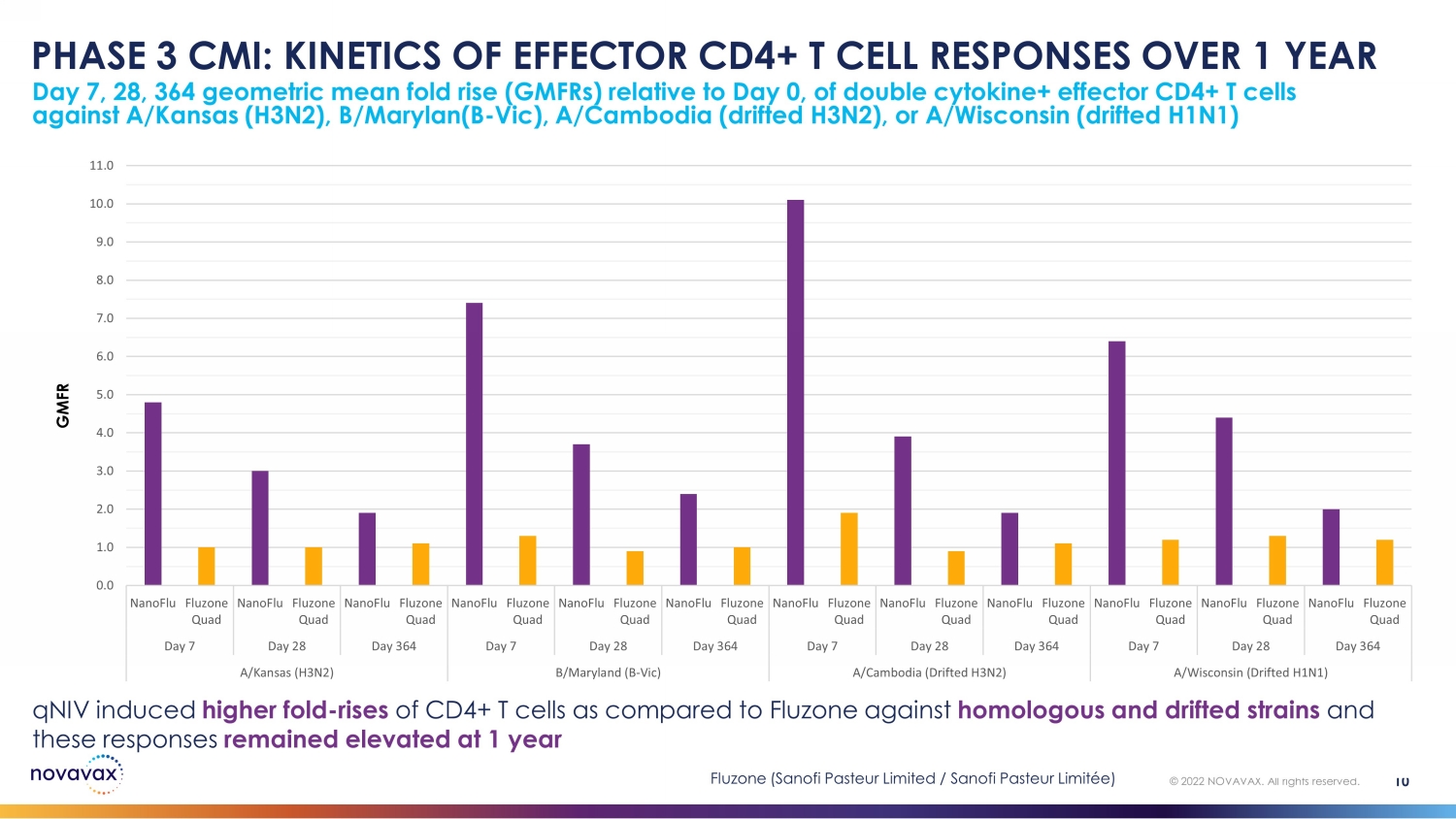
相對於第0天,雙細胞因子+效應CD4+ T細胞對抗A/Kansas(H3N2)、B/ Marylan(B-Vic)、A/Cambodia(漂移的H3N2)或/威斯康星(漂移的H3N1)的第7、28、364天的幾何平均倍數上升(gmFRs)10 © 2022 NOVAVAX。版權所有。PHASE 3 CMI:1 年內效應 CD4+ T 細胞反應的動力學 GMFR 0.0 1.0 2.0 3.0 4.0 6.0 7.0 8.0 9.0 10.0 nanoFlu Fluzone Quad nanoFLU Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone Quad nanoFlu Fluzone QuaFluzone Quad nanoFLU Fluzone Quad nanoFlu Quad Day 7 Day 28 Day 364 Day 28 Day 28 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 day 364 Day 364摺疊——與Fluzone相比,CD4+ T細胞在同源和漂移菌株上升,這些反應在1年 Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司)

第 3 階段:總結和結論已達到主要終點:• 已證明免疫學上不遜於 Fluzone Quad(卵適應性 HAI 抗體反應)與 Fluzone Quadrivalent 相比,野生型 HAI 抗體反應更高:• 第 28 天 gmT 對同源菌株的反應提高了 24 — 66% • 第 28 天 gmT 對抗多種漂移 A/H3N2 菌株的野生型 HAI 抗體反應得到證實野生型 HAI 抗體反應,包括對漂移菌株的反應,多功能 CD4+ T 細胞的強效誘導反應,一年後仍然存在 • 幾乎所有 nanoFLU 受試者都成了 “CMI 反應者”,值得注意的是,包括基線低的 CMI 11 © 2022 NOVAVAX 的受試者。版權所有。Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司)

COVID-流感組合(CIC)疫苗開發 12 © 2022 NOVAVAX。版權所有。

接種 COVID-CoV-2 疫苗的理由未來可能需要反覆接種 SARS-COV-2 疫苗的復發增強劑持續出現逃避自然/疫苗免疫的變異體持續的SARS-CoV-2傳播,可能呈季節性反覆發作模式在疫苗接種或感染後的4至12個月內中和抗體反應減弱儘管在2020年和2021年COV-19疫情期間流感傳播很少,但仍需要每年接種季節性流感疫苗,流感可能傳播隨着社會的重新開放,將在2022年及以後反彈。公共衞生部門迫切需要開發更有效的季節性流感疫苗 © 2022 NOVAVAX。版權所有。13 用一種潛在的疫苗解決方案解決兩個主要的公共衞生問題聯合疫苗的開發預計未來需要在冬季傳播季節之前每年同時接種SARS-CoV-2和流感病毒
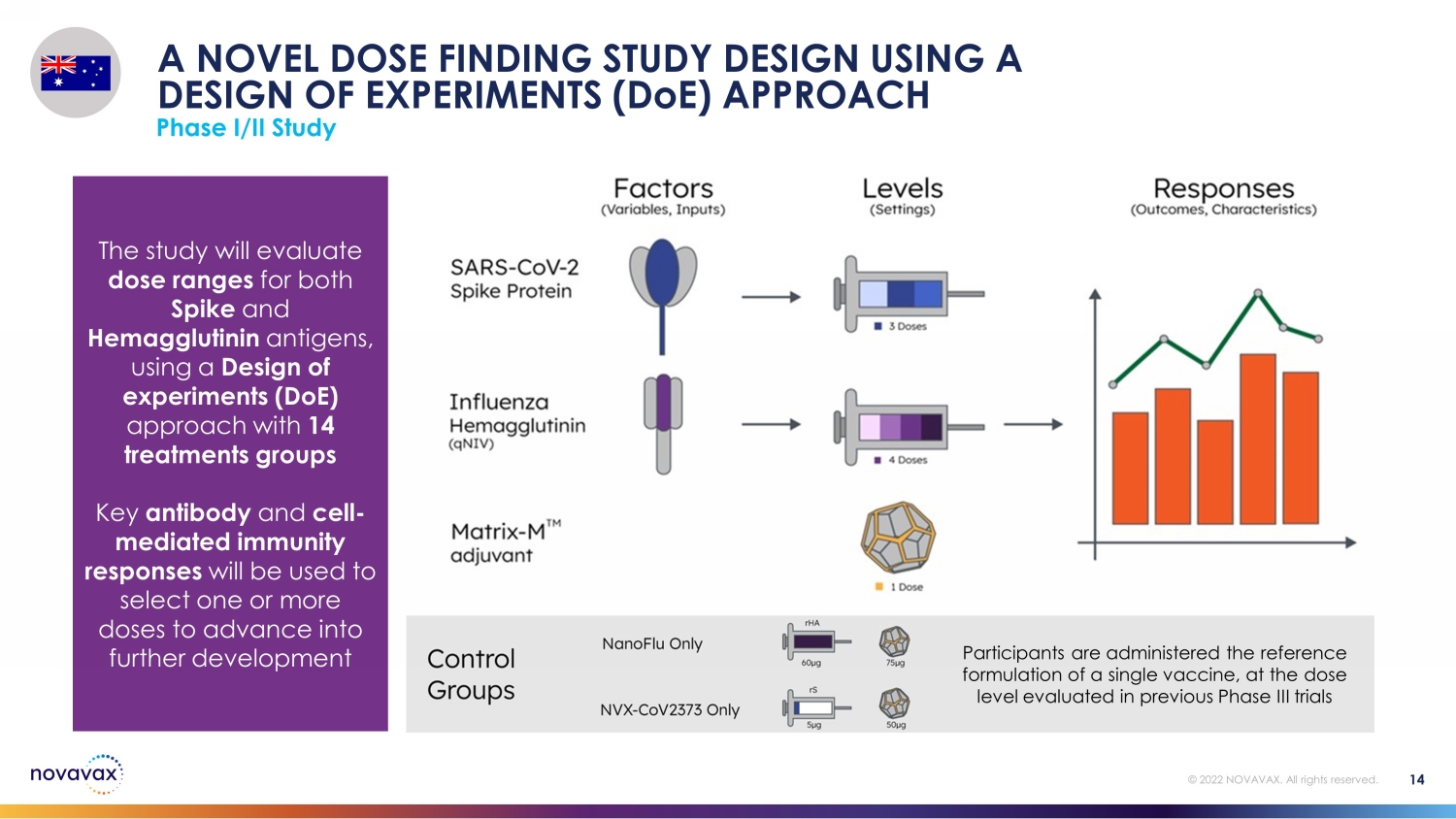
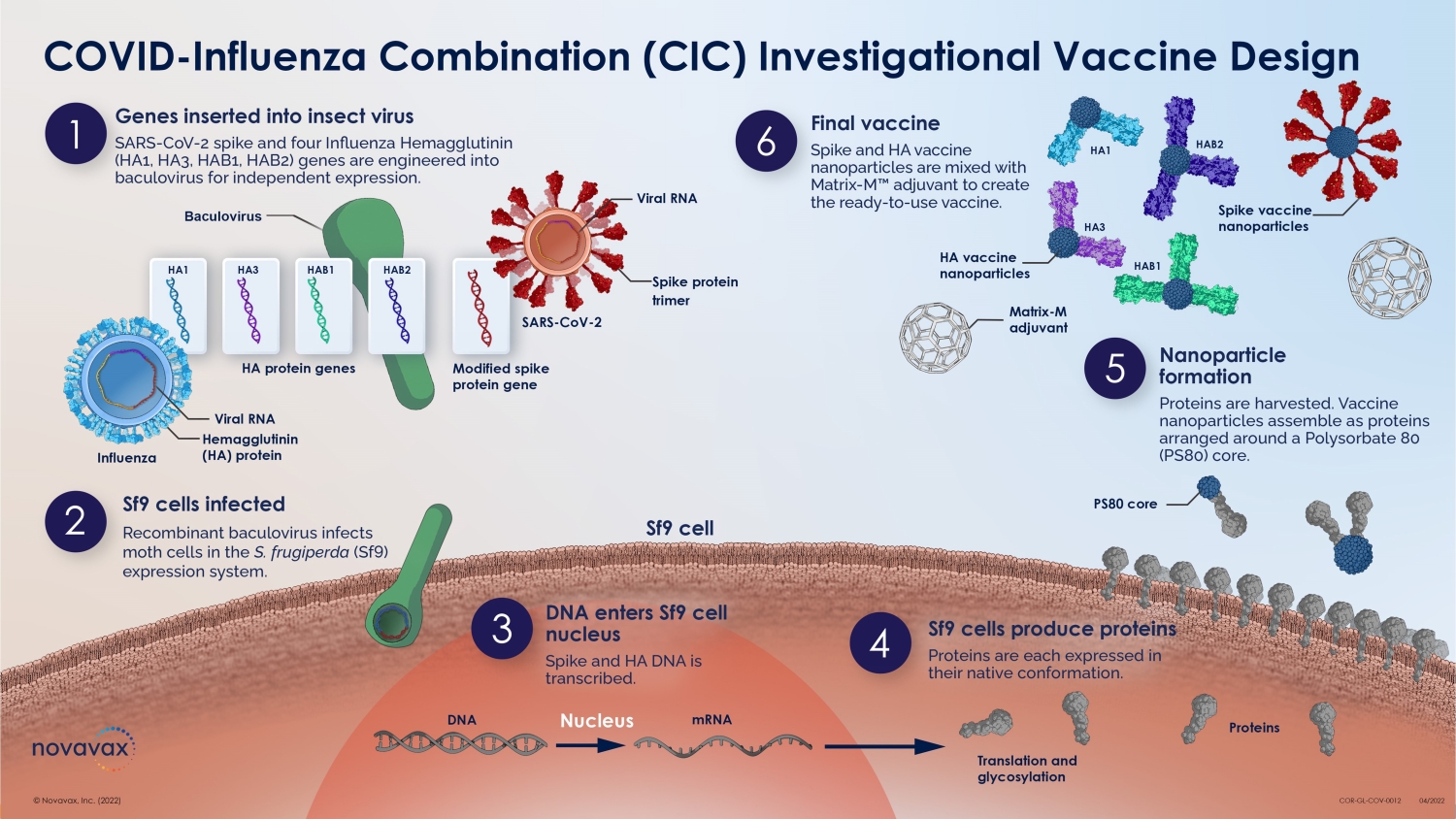
該研究將採用實驗設計(DoE)方法,評估Spike和Hemagglutinin抗原的劑量範圍,包括14個治療組。關鍵抗體和細胞介導的免疫反應將用於選擇一個或多個劑量進行進一步開發。參與者接受單一疫苗的參考配方,其劑量水平與先前III期試驗中評估的劑量水平相同。使用實驗設計(DoE)方法進行I/II期研究 © 2022 NOVAVAX。版權所有。14
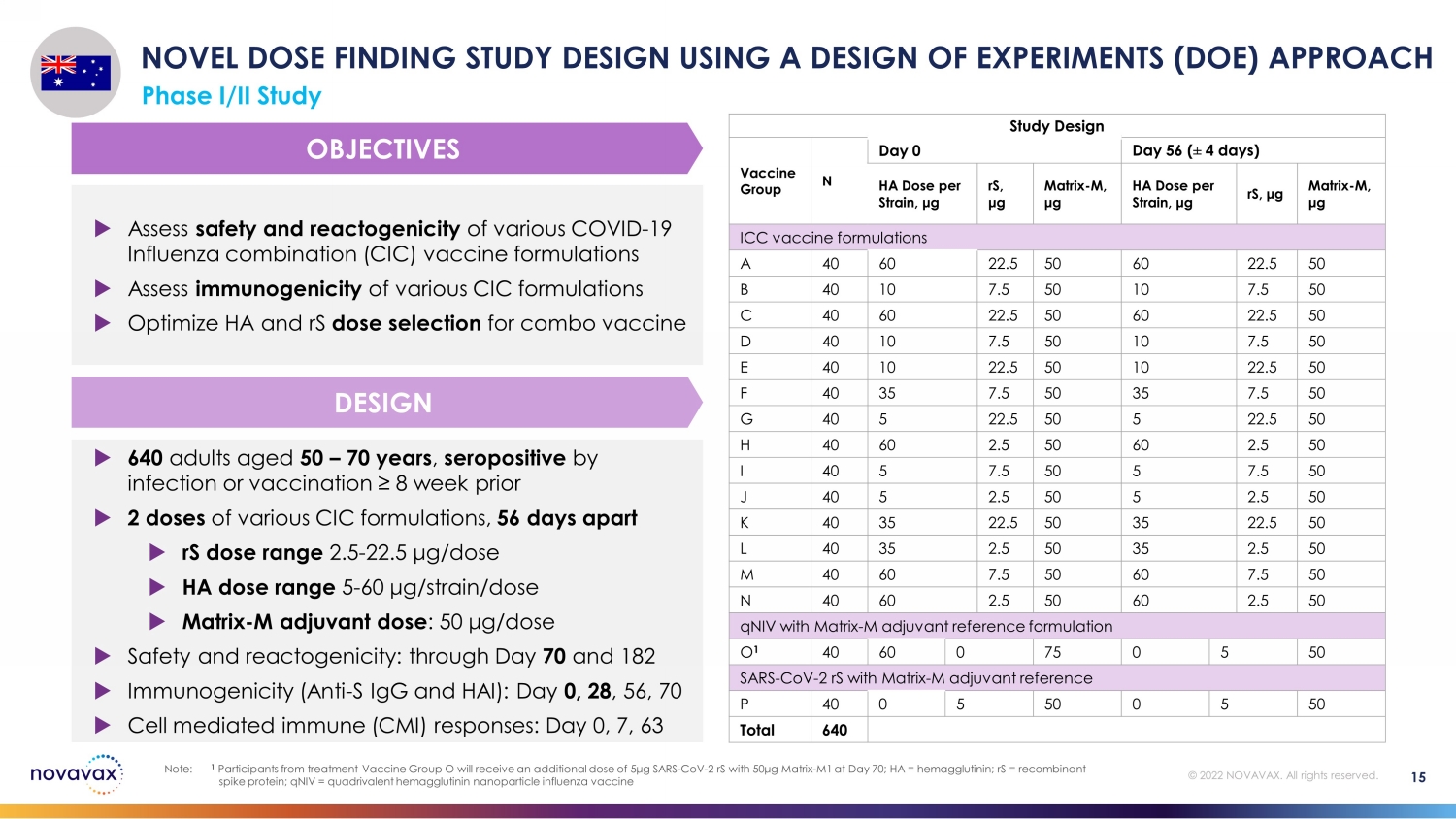
640 名 50 — 70 歲的成年人,感染或疫苗接種呈血清陽性 ≥ 8 周前 2 劑各種 CIC 製劑,相隔 56 天 rS 劑量範圍 2.5-22.5 μg /劑量 HA 劑量範圍 5-60 μg /張力/劑量 matrix-M 輔助劑量:50 μg/劑量安全性和反應原性:直到第 70 天和 182 天免疫原性(抗 S IgG 和 HAI):第 0 天、28 天 56、70 細胞介導免疫 (CMI) 反應:第 0、7、63 天評估各種 COVID-19 流感組合 (CIC) 疫苗製劑的安全性和反應原性評估各種 CIC 配方的免疫原性優化組合疫苗的 HA 和 rS 劑量選擇使用實驗設計 (DOE) 方法進行新劑量尋找研究設計使用實驗設計 I/II 期研究設計疫苗組 N 天 0 天 56(4 天)HA 每株劑量,μ g rS,μg matrix-M,μg matrix-M,μg ICC 疫苗配方 A 40 60 22.5 50 B 40 7.5 50 50 50 C 40 60 22.5 50 60 22.5 50 D 40 10 7.5 50 10 7.5 50 E 40 22.5 50 10 22.5 50 F 40 35 7.5 50 G 40 5 22.5 50 50 5 22.5 50 H 40 2.5 50 60 2.5 50 I 40 7.5 50 5 7.5 50 J 40 5 2.5 50 50 J 40 5 2.5 50 K 40 5 2.535 22.5 50 35 22.5 50 L 40 2.5 50 2.5 50 50 50 50 60 7.5 50 7.5 50 N 40 60 2.5 50 60 2.5 50 qNiV 帶有 Matrix-M 輔助參考配方 O 1 40 60 0 75 5 50 sars-CoV-2 rs with matrix-M 輔助參考製劑 P 40 0 5 5 50 total 640 設計目標 15 注意:1 來自治療疫苗組 O 的參與者將獲得額外劑量 5μg SARS-CoV-2 rs with 50μg Matrix-70 天 M1;HA = 血凝素;rS = 重組刺突蛋白;qniV = 四價血凝素納米顆粒流感疫苗 © 2022 NOVAVAX。版權所有。

16 個 CIC 疫苗第 1/2 期試驗的初步結果 © 2022 NOVAVAX。版權所有。

基線特徵、反應原性和安全性結果 17 © 2022 NOVAVAX。版權所有。治療組在基線水平上相當 • 中位年齡 59 歲 • 62% 男性/38% 女性 • 100% 曾接種過原發系列 EUA COV-19 疫苗;中位數在 0 天前 10.7 周 • 約 0.2% 以前曾感染過嚴重急性呼吸道綜合徵——CoV-2 CIC 製劑耐受性良好:• 反應原性與獨立參比 rS(NVX-CoV2373)和 HA(qniV)相當 • 最常見的徵集局部 AE 為疼痛和壓痛 • 最常見的全身 AE 為疲勞、頭痛、全身乏力、肌肉疼痛;發燒很少見 • 通常為 0、1 級或者 2。3 級稀有。不是 4 級。• 徵集的局部和全身 AE 在 rS 劑量水平上沒有顯著差異 • 通過增加 HA 劑量水平略高徵集的局部 AE • 劑量 1 和劑量 2 之間的反應原性相當 70 天之前的安全性:• CIC 製劑顯示未經請求的 AE 與獨立的參考 rS 和 HA 製劑的發生率相當 • 嚴重的 AE(SAE)很少見;沒有一個被評估為相關性接種疫苗 • 沒有關於特別關注的不良事件(AESI)的報告
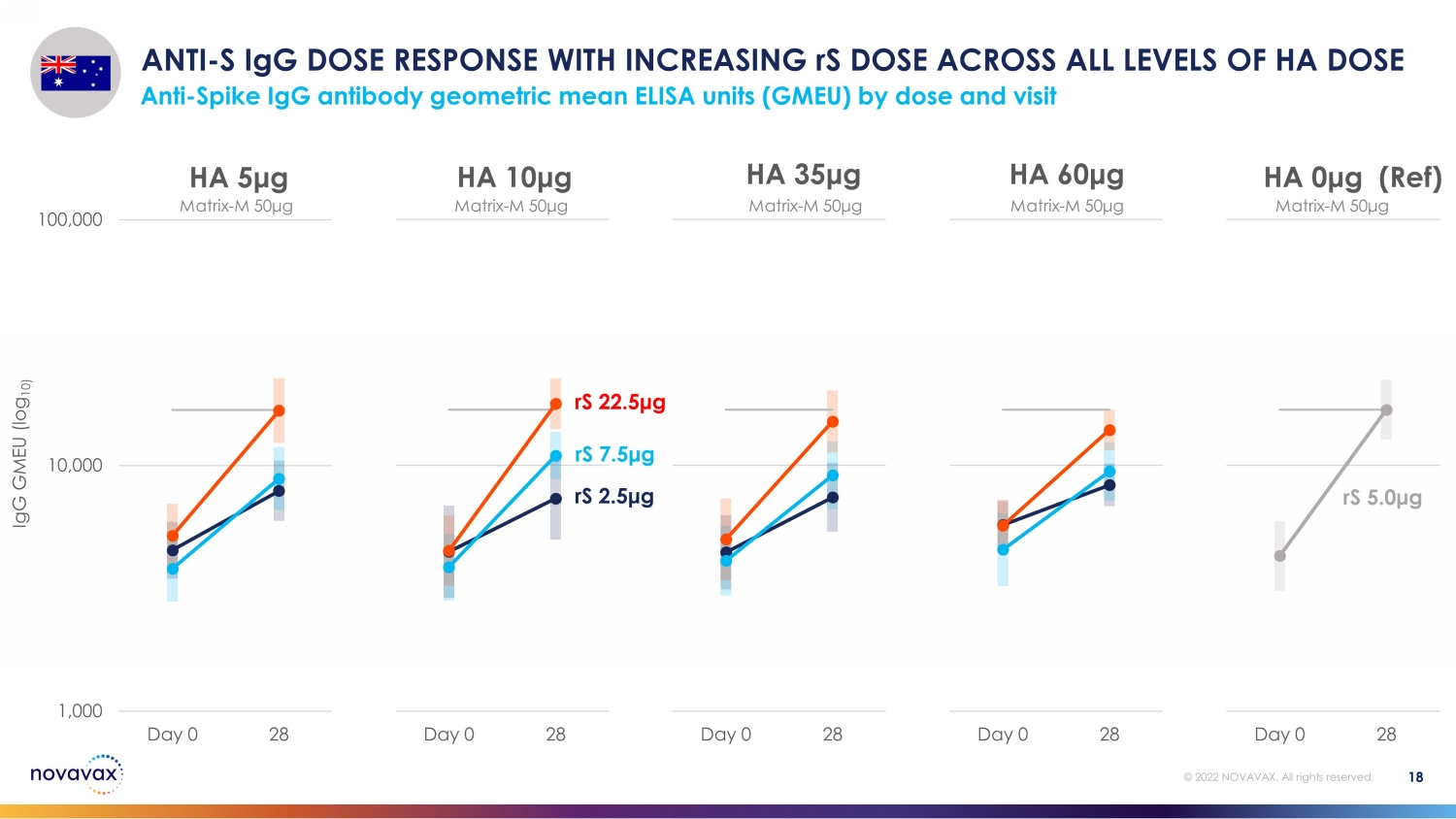
18 © 2022 NOVAVAX。版權所有。1,000 10,000 100,000 天 0 28 HA 0 μg(參考)1,000 10,000 10,000 天 0 28 HA 60 μg 100,000 Day 0 28 HA 10 μg 100,000 Day 0 28 HA 5 μg rS 2.5 μg rS 7.5 μg rS 5.0 g anti-S igG day 0 28 HA 10 μg rS 5.0 g anti-S igG day 0 28 HA 10 μg rS 5.0 g anti-S igG day 0 28 HA 10 μg rS 7.5 μg rS 5.0 g anti-S igG 劑量響應隨着 rS 增加所有等級 HA 劑量 anti-Sp按劑量和訪問量劃分的 g 抗體幾何平均值 ELISA 單位 (GMEU) matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg igG GMEU (log 10)
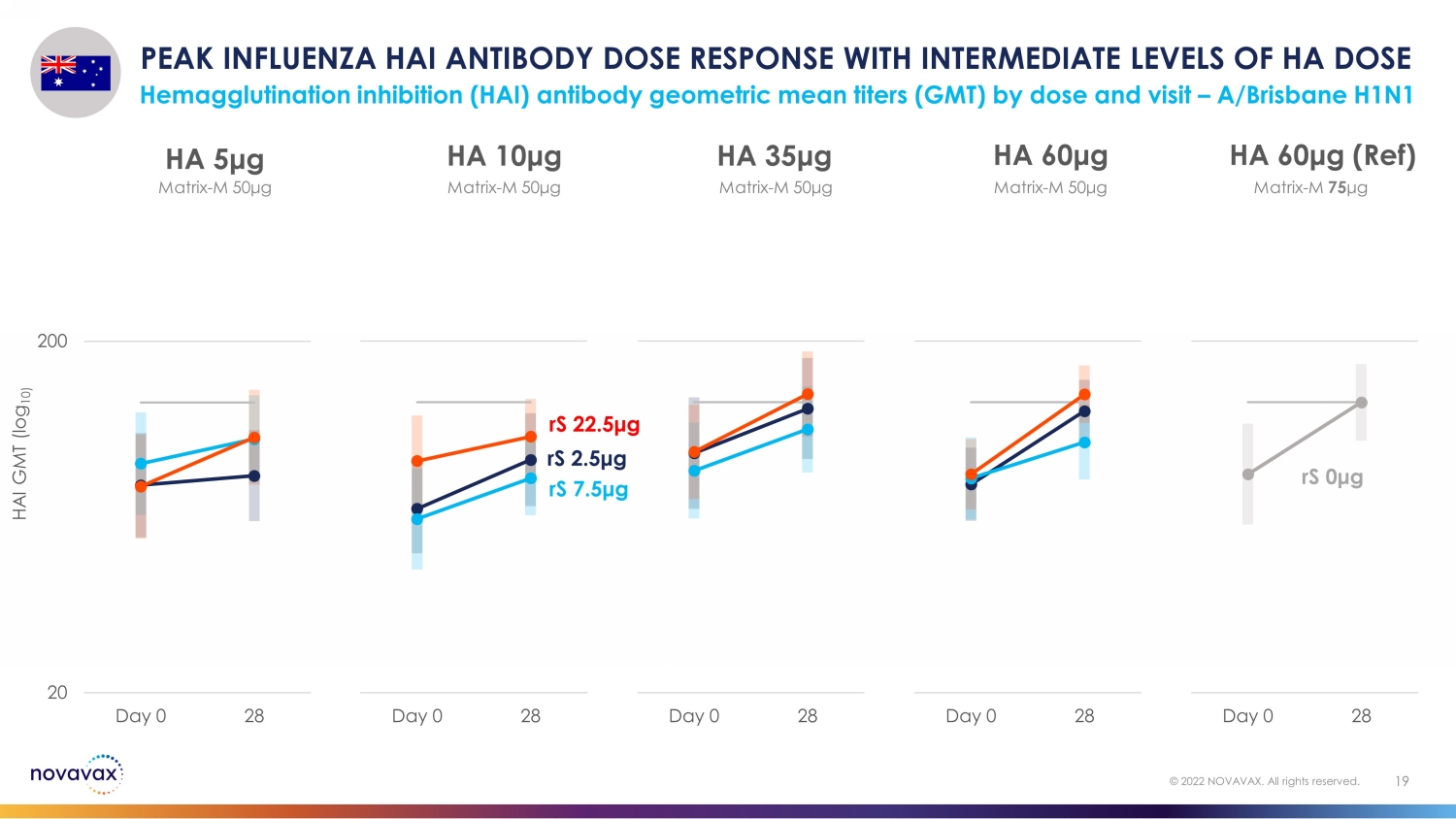
按劑量和訪問量劃分,HA 劑量血凝抑制 (HAI) 抗體幾何平均滴度 (GMT) 處於中等水平,HA 劑量血凝抑制 (HAI) 的峯值 HAI 抗體劑量反應 — A/Brisbane H1N1 19 © 2022 NOVAVAX。版權所有。20 200 Day 0 28 HA 60 μg(參考資料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩陣-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)
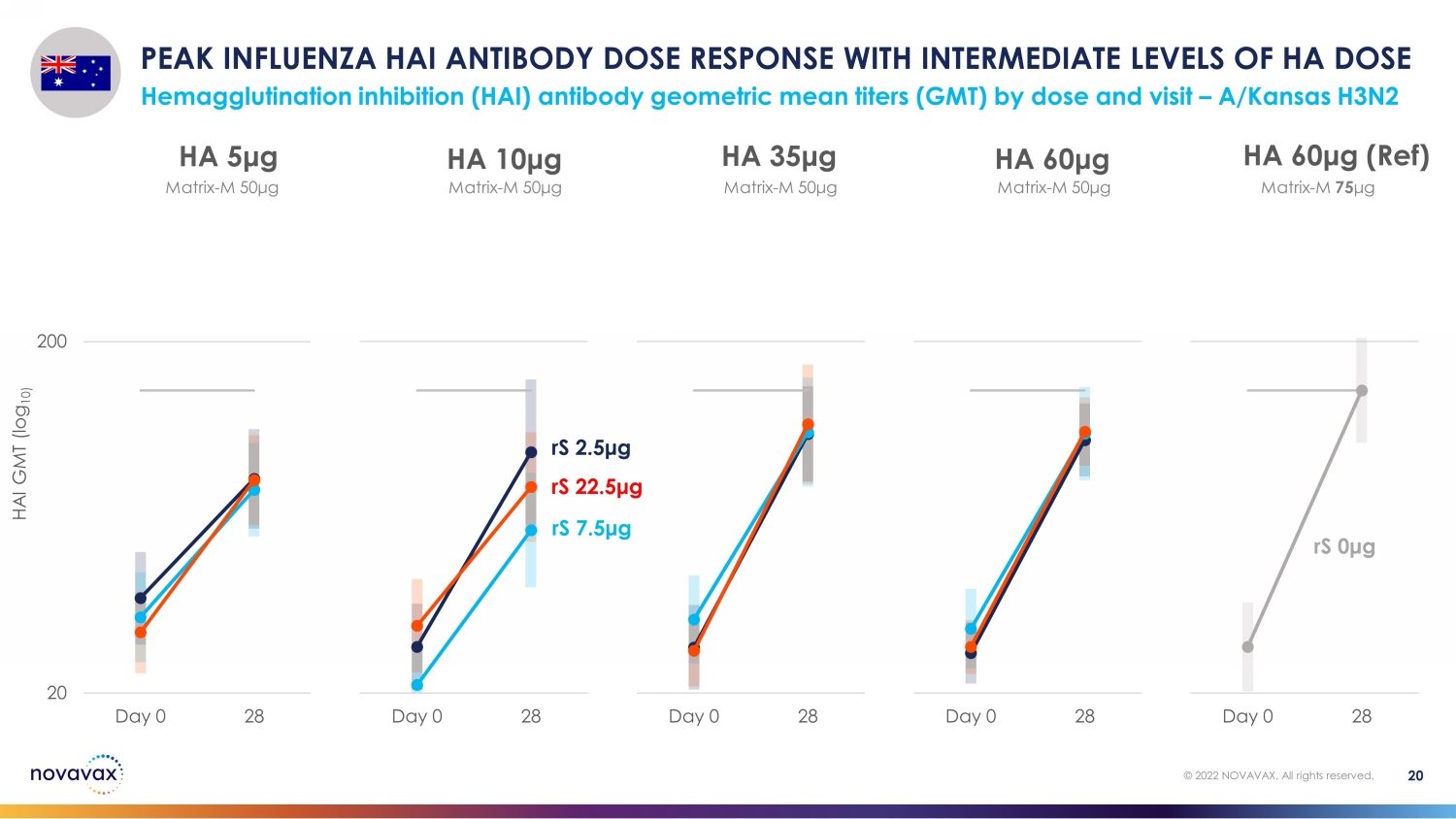
按劑量和訪問量劃分,HA 劑量血凝抑制 (HAI) 抗體幾何平均滴度 (GMT) 處於中等水平,HA 劑量血凝抑制 (HAI) 的峯值 HAI 抗體劑量反應 — A/Kansas H3N2 20 © 2022 NOVAVAX。版權所有。20 200 Day 0 28 HA 60 μg(參考資料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩陣-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)
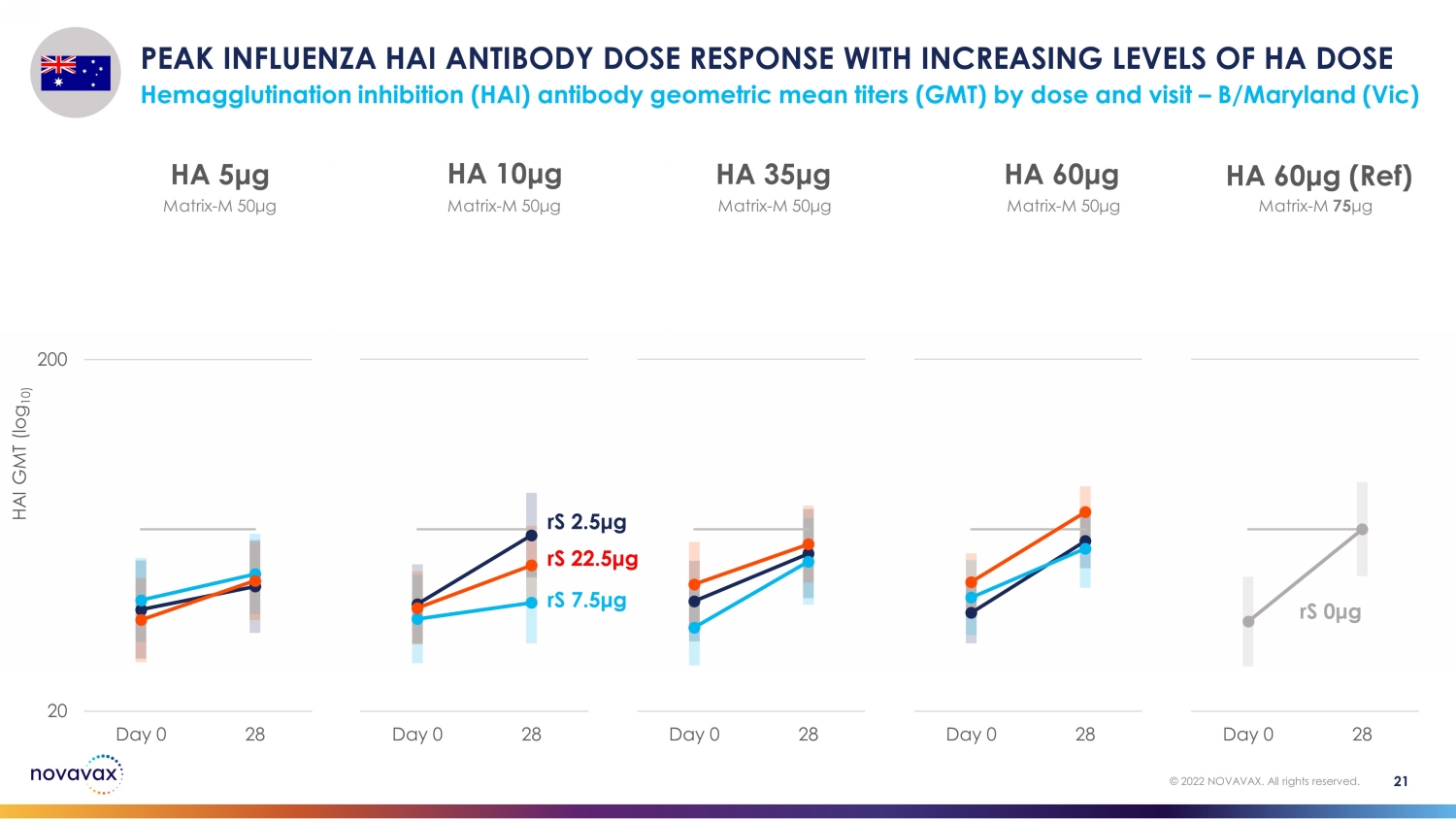
隨着 HA 劑量血凝抑制 (HAI) 抗體幾何平均滴度 (GMT) 的劑量和訪問量增加,HA 抗體劑量反應達到峯值 — B/Maryland (Vic) 21 © 2022 NOVAVAX。版權所有。20 200 Day 0 28 HA 60 μg(參考資料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩陣-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)

按劑量和訪問量劃分,HA 劑量血凝抑制 (HAI) 抗體幾何平均滴度 (GMT) 處於中等水平,HA 劑量血凝抑制 (HAI) 達到峯值 HAI 抗體劑量反應 — b/Phukei (Yam) 22 © 2022 NOVAVAX。版權所有。20 200 Day 0 28 HA 60 μg(參考資料)20 200 天 0 28 HA 60 μg 20 Day 0 28 HA 35 μg 20 200 天 0 28 HA 10 μg 20 200 天 0 HA 5 μg rS 2.5 μg rS 7.5 μg rS rS 0 μg 矩陣-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg matrix-M 50 μg M 75 μg HAI GMT (log 10)
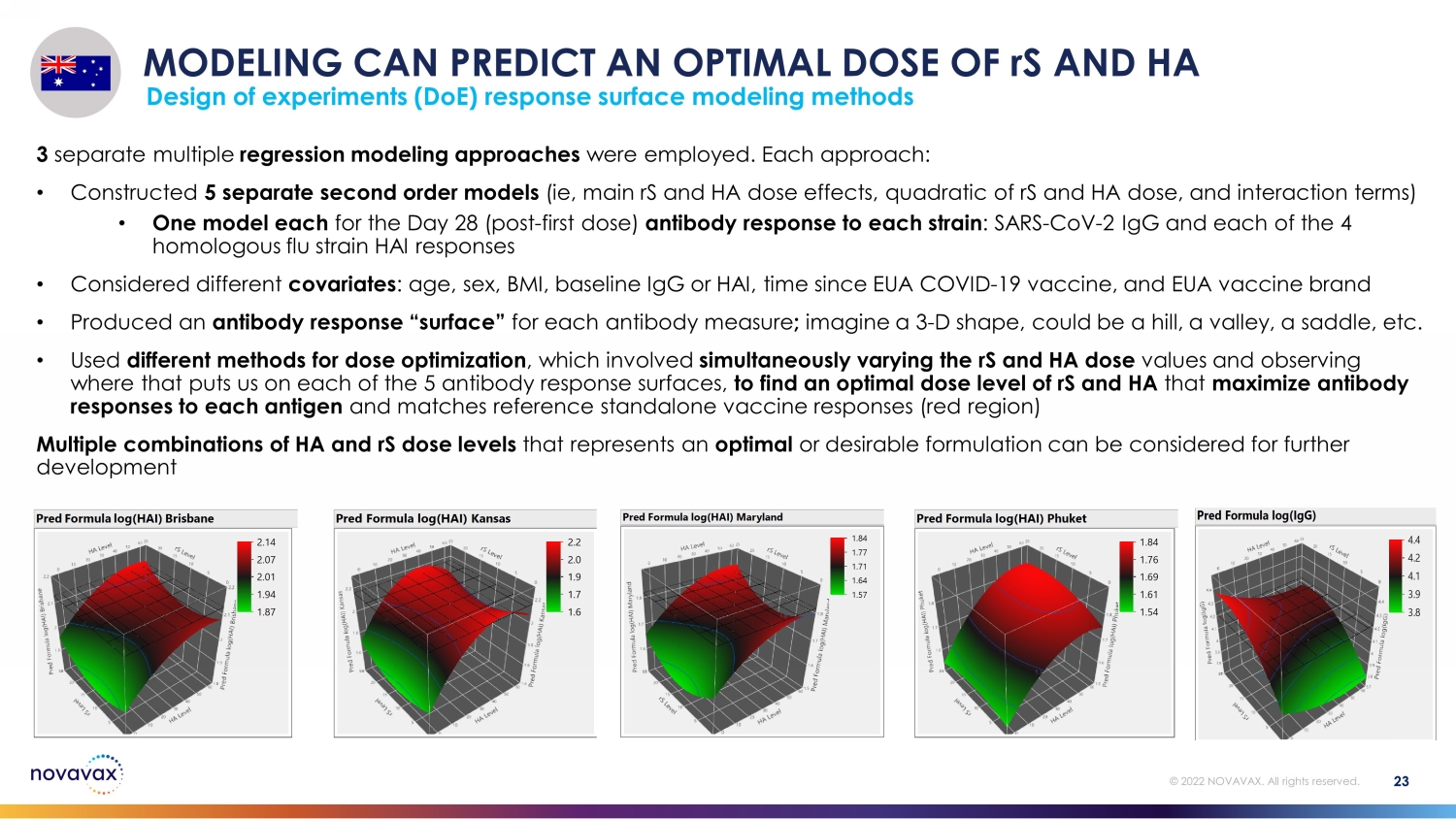
建模可以預測 rS 和 HA 的最佳劑量實驗設計 (DoE) 響應表面建模方法 23 © 2022 NOVAVAX。版權所有。採用了 3 種不同的多元迴歸建模方法。每種方法:• 構建 5 個獨立的二階模型(即主要 rS 和 HA 劑量效應、rS 和 HA 劑量的二次方以及相互作用項)• 每種菌株的第 28 天(第一劑後)抗體反應各一個模型:SARS-CoV-2 IgG 和 4 種同源流感菌株 HAI 反應 • 考慮了不同的協變量:年齡、性別、體重指數、基線 IgG 或 HAI,此後的時間 EUA COVID-19 疫苗和 EUA 疫苗品牌 • 為每項抗體測量生成了抗體反應 “表面”;想象一個 3-D 形狀,可能是山丘、山谷、鞍座,等等 • 使用不同的方法進行劑量優化,包括同時改變 rS 和 HA 劑量值,觀察這會使我們在 5 個抗體反應表面上的位置,以找出最佳 rS 和 HA 劑量水平,以最大限度地提高對每種抗原的抗體反應並匹配參考獨立疫苗反應(紅色區域)可以考慮將代表最佳或理想配方的 HA 和 rS 劑量水平的多種組合用於進一步開發 Pred Formula log (HAI) Brisbane 1.87 94 2.01 2.07 2.14 Response Grid 滑塊2.12678 Pred Formula log (HAI) 堪薩斯州 1.6 1.7 1.9 2.0 2.2 Response Grid Slider 2.16167 Pred Formula log (HAI) 馬裏蘭 1.57 1.64 Pred Formula log (HAI)
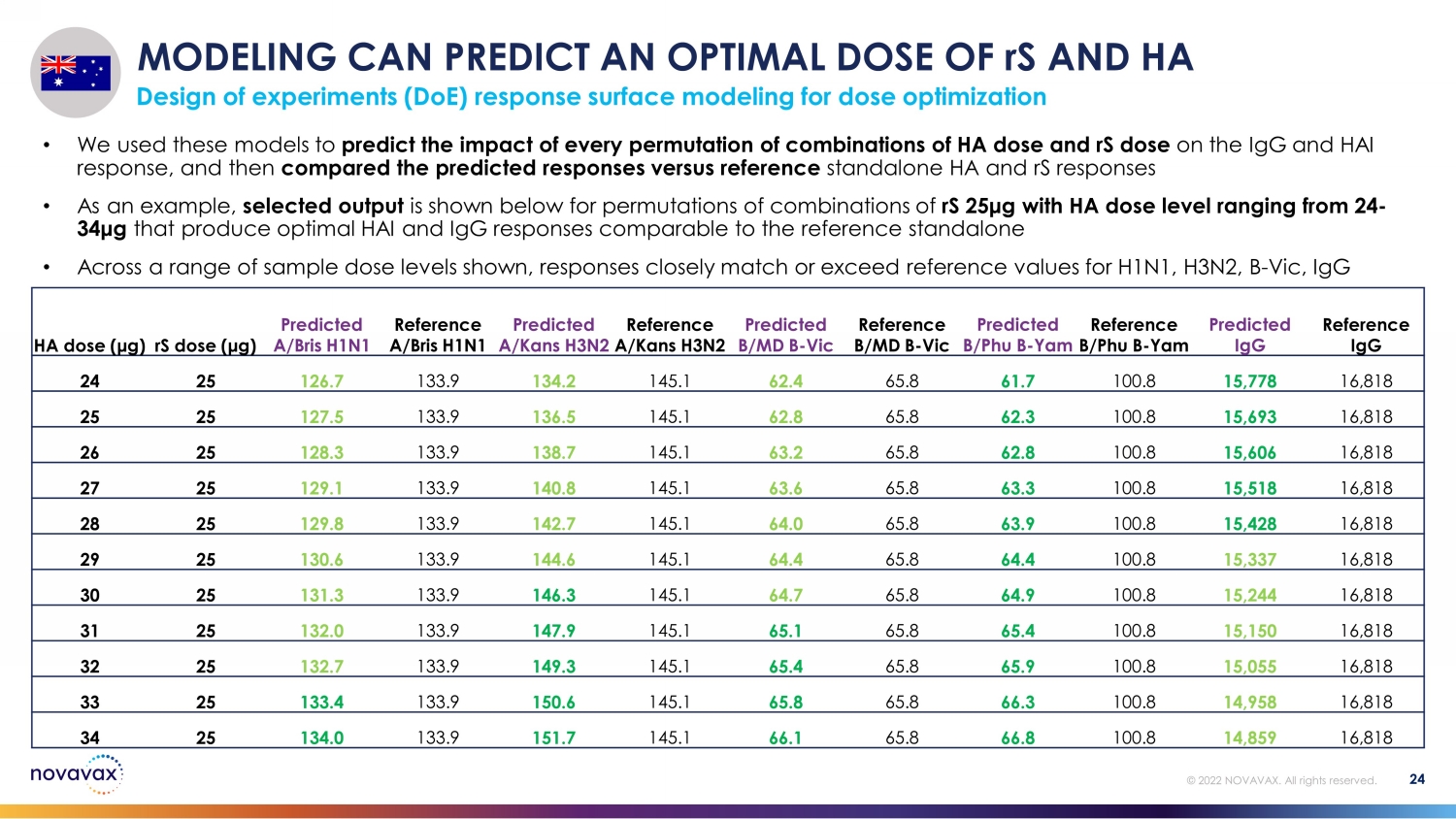
建模可以預測 rS 和 HA 的最佳劑量用於劑量優化的實驗設計 (DoE) 響應表面建模 24 © 2022 NOVAVAX。版權所有。• 我們使用這些模型預測 HA 劑量和 rS 劑量組合的每一次排列對 IgG 和 HAI 反應的影響,然後將預測的反應與參考獨立的 HA 和 rS 反應進行比較 • 舉例來説,下面顯示了 rS 25 μg 和 HA 劑量水平在 24-34 μg 之間的組合排列的選定輸出,可產生與參考獨立劑量相當的最佳 HAI 和 IgG 反應 • 在一系列範圍內顯示樣本劑量水平,反應接近或超過 H1N1 的參考值,H3N2,B-Vic,IgG HA 劑量 (μ g) rS 劑量 (μ g) 預測 A/bris H1N1 參考文獻 A/bris H1N1 預測 a/kans H3N2 預測 b/MD B-Vic reference b/Phu B-Yam reference b/ph B-Yam 預測的 IgG 24 25 126.7 133.9 134.2 145.1 2.4 65.8 61.7 100.8 15778 16,818 25 25 127.5 133.9 136.5 145.1 62.8 62.8 100.8 100.8 15,693 16,818 26 25 128.3 138.7 145.1 62.8 100.8 15,606 16,818 27 25 129.1 133.9 140.8 63.3 100.8 28 25 129.8 133.9 100.8 16,818 28 25 129.8 133.9 143.9 100.8 145.1 64.0 65.8 63.9 100。8 15,428 16,818 29 25 130.6 133.9 144.6 145.1 64.4 65.4 64.4 100.8 15,337 16,818 30 25 131.3 133.9 146.3 145.1 64.9 100.8 15,244 16,818 31 25 133.9 145.1 65.1 65.8 100.8 16,818 32 25 132.7 133.9 133.9 145.1 133.9 145.1 143.9 1415.8 16,818 32 25 132.7 133.9 133.9 145.1 133.9 145.1 143.9 1415.8 16,818 100.9 100.8 15,055 16,818 33 25 133.9 153.9 150.6 145.1 65.8 65.8 66.3 100.8 14958 16,818 34 25 133.9 151.7 145.1 66.1 66.8 100.8 14859 16,818

使用建模來預測 rS 和 HA 的最佳劑量用於劑量優化的實驗設計 (DoE) 響應表面建模 25 © 2022 NOVAVAX。版權所有。在最佳劑量組合方面,三種不同的建模方法大致趨同於一組相似的結果,從而提高了總體解釋和結論的可靠性:• 作為組合配方的 rS 和 HA 抗原相互之間存在適度幹擾,但是,劑量調整可以克服幹擾 • 更高的 rS 劑量水平(>20 μg)可以克服 HA 劑量的幹擾,並且可以匹配(獨立)參考的 rS 疫苗反應水平 • HA 的中等劑量水平(每個菌株 24-40 μg)可以克服以下幹擾rS 劑量,可以匹配 H3N2、H1N1、B-Vic 菌株的(獨立)參考 HA 反應;但是 B-Yam 菌株的劑量略低

初步調查結果和後續步驟 26 © 2022 NOVAVAX。版權所有。• 第一項證明COVID-流感聯合疫苗可行、耐受性良好、免疫原性的研究,這些數據值得繼續開發 • 一種基於美國能源部建模的新型劑量查找/優化方法是一種強大的工具,可以:• 對反應表面的免疫反應進行粒度分離,以及 • 精細調整的劑量選擇 • 各種 CIC 配方可能誘發與獨立的 qniV 和 COVID-19 疫苗相似的抗體反應(適用於 H1N1、H3N2、B-Vic 和 rS)•CIC 所需的 rS 劑量比獨立的 rS 劑量高 • CIC 所需的 HA 劑量比獨立的 HA 劑量低 • 與獨立 rS 和 HA 成分的總和相比,CIC 配方中的總抗原含量最多可降低 50% ——可能會節省劑量

初步調查結果和後續步驟 27 © 2022 NOVAVAX。版權所有。• 本研究評估了含有 50μg Matrix-M 佐劑的 CIC 製劑,該配方低於之前在獨立 qNiV 中使用的 75μg Matrix-M。• CIC 中更高 75μg 的 Matrix-M 輔助劑劑量可能會進一步增強抗體反應,進一步節省劑量。將在未來的試驗中進行評估。• 預計將有更多關於微中性抗體和CMI反應的免疫原性數據,以及抗體反應的第二劑量和耐久性• 該研究的數據將為計劃中的2期劑量確認研究提供信息,該研究將:• 確認組合疫苗劑量/配方 • 評估較低劑量的獨立qniV

28 © 2022 NOVAVAX。版權所有。謝謝貢獻者 VIVEK SHINDE、WAYNE WOO、SHARON LIU、SUSAN NEAL、JOYCE PLESTED、TIM VINCENT、MINGZHUB ZHU、SHANE CLONEY-CLARK、IKSUNG CHO、LOU FRIES、FILIP DUBOVSKY、GRE

29 © 2022 NOVAVAX。版權所有。備份
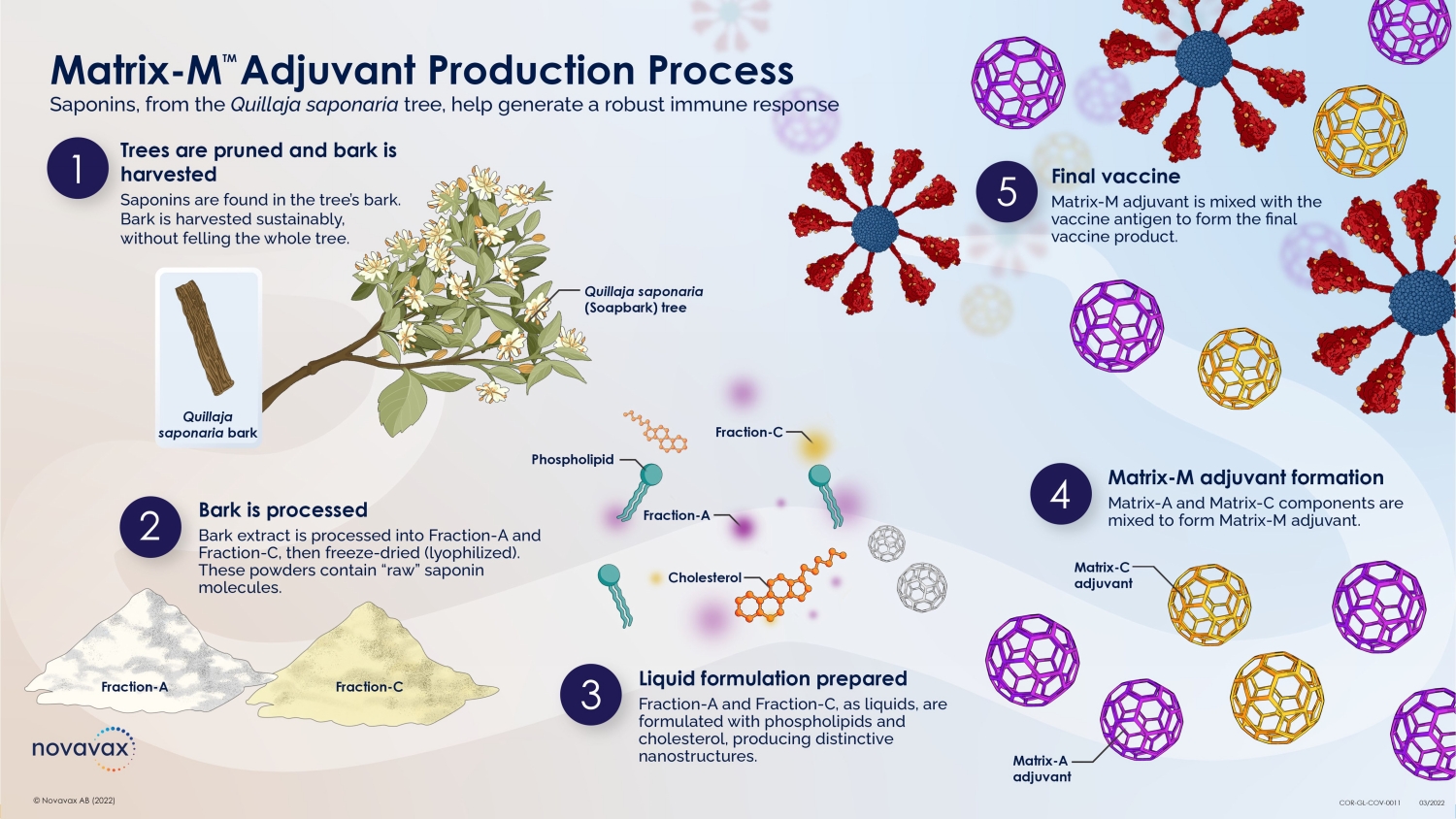
nanoFLU 疫苗 Hemagglutinin 納米顆粒抗原和 Matrix-M 佐劑 30 © 2022 NOVAVAX。版權所有。重組血凝素 (HA) 納米顆粒 • 在桿狀病毒/Sf9 昆蟲細胞系統中產生 • 表現為重組、全長、野生型、未裂解的 HA0,可組裝成同型三聚體 • 純化的同型三聚體形成 20-40 nm 的高階納米顆粒結構,含有 PS-80 • 採用快速、高產量、高純度工藝製造 Matrix-M 佐劑 • 從 Quillaja saponaria Molina 的樹皮中以皂苷形式提取的純化餾分 • 由膽固醇和磷脂配製而成,形成籠狀顆粒 •其作用機制包括:• 增強向引流淋巴結的抗原輸送 • 增強引流淋巴結中活化 T 細胞、B 細胞和 APC 羣體 • 誘導功能性和廣泛交叉反應性抗體(例如流感)• 增強抗體反應的峯值和耐久性(例如呼吸道合胞病毒、流感、SARS-CoV-2)• 誘導多功能 T 細胞,包括 CD4+(例如埃博拉、流感)、SARS-CoV-2)和 CD8+(例如埃博拉、SARS-CoV-2)• 在新抗原背景下保存抗原:大流行性流感、埃博拉和嚴重急性呼吸道綜合徵-CoV-2 抗原
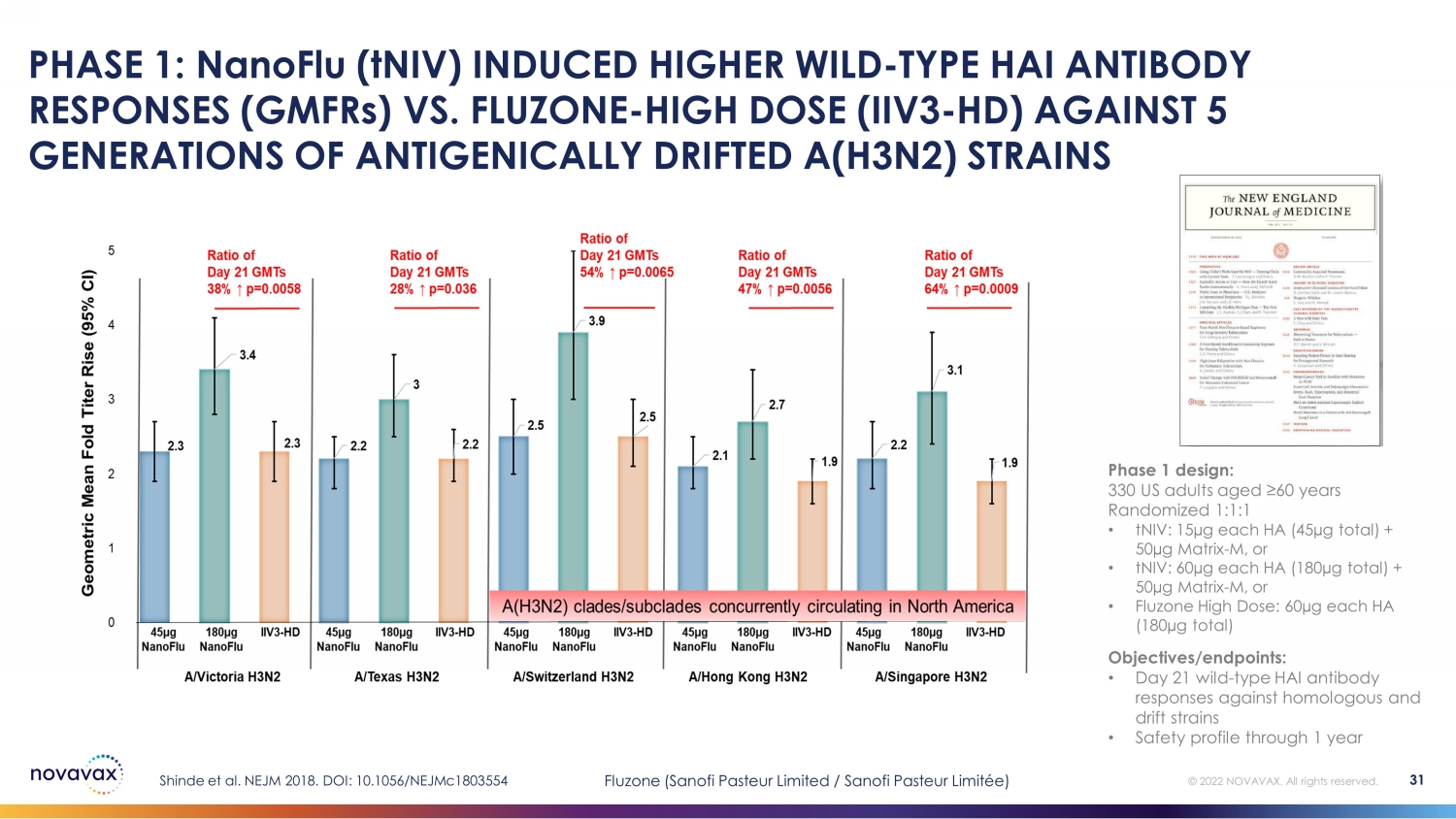
第 1 階段:與 nanoFLU (tniV) 相比,NanoFLU (tniV) 誘導的野生 HAI 型抗體反應 (gmFRS) 更高FLUZONE——對抗五代抗原漂移 A 型 (H3N2) 菌株的高劑量(IIV3-HD)Shinde 等人。NEJM 2018。DOI:10.1056/nejmc1803554 第 1 階段設計:330 名年齡在 60 歲以上的美國成年人隨機分配 1:1:1 • tniV:每個 HA 15µg(總計 45µg)+ 50µg Matrix-M,或 • Fluzone 高劑量:每個 HA 60µg(共 180 微克)目標/終點:• 第 21 天野生——針對同源和漂移菌株的 HAI 型抗體的反應 • 1 年 31 年的安全概況 © 2022 NOVAVAX。版權所有。Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司)

• 演示 “輔助效應” • 與未輔助配方相比,Matrix-M 輔助劑可顯著增強免疫反應 • 與 Fluzone HD 相比,對同源 A/H3N2 和漂移 A/H3N2 菌株的野生型 HAI 抗體反應更高 • 與 Flublok 相比,對同源和漂移菌株的野生型 HAI 抗體反應相似 • 多功能 CD4+ T 細胞的強效誘導反應,均高於 Fluzone HD 和 Flublok • 耐受性良好,安全狀況可接受第 2 階段:摘要 © 2022 NOVAVAX。版權所有。第 2 階段設計:1375 名年齡在 65 歲以上的成年人隨機分為 7 組中的一組 • nanoFlu:牀邊混合 • nanoFlu:共同配製 • nanoFlu:增加輔助劑量(75µg Matrix-M)• nanoFlu:增加 B 抗原劑量 • nanoFlu:僅限抗原(無矩陣)• Fluzone HD • Flublok 目標/終點:• 主要:演示 “輔助效應” • 第 28 天野生——針對同源菌株和漂移菌株的 HAI 型抗體反應 • 1 年的安全概況 • 探索性:CD4+ T 細胞反應 Shinde 等人2020 年臨牀感染疾病。DOI:10.1093/ ciaa1673 32 Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司);Flublok(蛋白科學公司)

nanoFLU 疫苗 Hemagglutinin 納米顆粒抗原和 Matrix-M 佐劑 34 © 2022 NOVAVAX。版權所有。重組血凝素 (HA) 納米顆粒 • 在桿狀病毒/Sf9 昆蟲細胞系統中產生 • 表現為重組、全長、野生型、未裂解的 HA0,可組裝成同型三聚體 • 純化的同型三聚體形成 20-40 nm 的高階納米顆粒結構,含有 PS-80 • 採用快速、高產量、高純度工藝製造 Matrix-M 佐劑 • 從 Quillaja saponaria Molina 的樹皮中以皂苷形式提取的純化餾分 • 由膽固醇和磷脂配製而成,形成籠狀顆粒 •其作用機制包括:• 增強向引流淋巴結的抗原輸送 • 增強引流淋巴結中活化 T 細胞、B 細胞和 APC 羣體 • 誘導功能性和廣泛交叉反應性抗體(例如流感)• 增強抗體反應的峯值和耐久性(例如呼吸道合胞病毒、流感、SARS-CoV-2)• 誘導多功能 T 細胞,包括 CD4+(例如埃博拉、流感)、SARS-CoV-2)和 CD8+(例如埃博拉、SARS-CoV-2)• 在新抗原背景下保存抗原:大流行性流感、埃博拉和嚴重急性呼吸道綜合徵-CoV-2 抗原
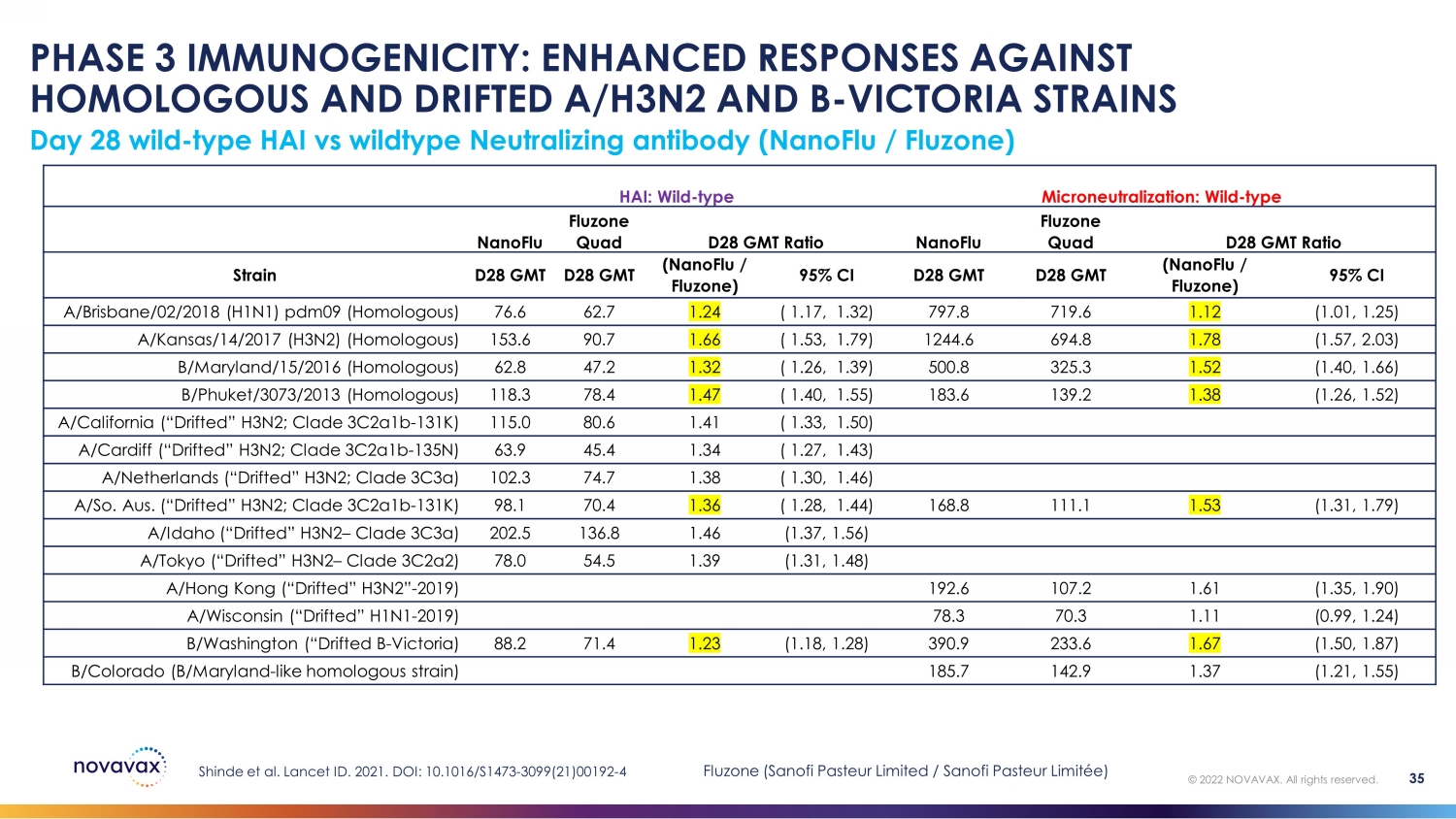
第 28 天野生——HAI 型與野生型中和抗體(nanoFLU /Fluzone)第 3 階段免疫原性:增強對同源和漂移 A/H3N2 和 B 的反應——維多利亞菌株 Shinde 等人。2021 年《柳葉刀》編號。DOI:10.1016/S1473-3099 (21) 00192-4 HAI:野生型微中和化:野生型 nanoFlu Fluzone Quad D28 GMT 比例 nanoFlu Quad D28 GMT 菌株 D28 GMT (nanoFlu /Fluzone) 95% CI D28 GMT (nanoFlu /Fluzone) 95% CI A/Brisbane/02/2018 (HofLU /Fluzone) 1N1) pdm09(同源)76.6 62.7 1.24 (1.17, 1.32) 797.8 719.6 1.12 (1.01, 1.25) A/Kansas/14/2017 (H3N2) (同源) 153.6 90.7 1.66 (1.53, 1.79) 1244.6 694.8 1.78 (1.57, 2.03) b/Maryland/15/2016 (同源) 62.8 47.2 1.32 (1.26, 1.39) 500.8 325.3 1.52 (1.40, 1.66) B/Phuket/3073/2013 (同源)118.3 78.4 1.47(1.40,1.55)183.6 139.2 1.38(1.26,1.52)A/California(“Drifted” H3N2;Clade 3c2a1b-131K)115.0 80.6 1.41(1.33,1.50)A/Cardift(“漂移” H3N2;Clade 3c2a1b-135N)63.9 45.4 1.34 (1.27,1.43) A/荷蘭(“漂移” H3N2;Clade 3c3a)102.3 74.7 1.38(1.30,1.46)A/So.澳大利亞。(“漂移” H3N2;Clade 3c2a1b-131K)98.1 70.4 1.36(1.28,1.44)168.8 111.1 1.53(1.31,1.79)A/愛達荷州(“漂移” H3N2 — Clade 3c3a)202.5 136.8 1.46(1.37,1.56)A/Tokyo(“Drifted” H3N2 — Clade 3c2a2) 78.0 54.5 1.39 (1.31,1.48) A/香港(“Drifted” H3N2”-2019)192.6 107.2 1.61(1.35,1.90)A/威斯康星(“漂移” H1N1-2019)78.3 70.3 1.11(0.99,1.24)b/華盛頓(“Drifted B-Victoria)88.2 71.4 1.23(1.18,1.23)28) 390.9 233.6 1.67 (1.50,1.87) b/Colorado(B/Maryland——比如同源菌株)185.7 142.9 1.37 (1.21,1.55) © 2022 NOVAVAX。版權所有。35 Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司)

COVID-流感聯合疫苗開發 2021 年 6 月公佈了聯合給藥子研究的數據** 2021 年 5 月公佈了積極的臨牀前數據* 2021 年 9 月啟動 COVID-nanoFlu 聯合疫苗的 I/II 期臨牀試驗臨牀前開發臨牀概念驗證 • 英國 III 期聯合給藥子研究已證實可行 • 個體疫苗和聯合疫苗(HAI)和 ACE2 滴度相當(疫苗)倉鼠和雪貂)•維持臨牀和病毒學保護,抵禦SARS-CoV-2(倉鼠模型)的實驗挑戰 • 美國常見的抗SARS-CoV-2中和表位的誘導抗體——WA1(原始菌株)和β(B.1.351)變異體臨牀開發 • 在澳大利亞啟動並全面註冊——安全性、免疫原性和劑量發現 36 個關鍵里程碑 © 2022 NOVAVAX。版權所有。36 來源:* Massare 等人 2021;DOI:10.1101/2021.05.05.442782,** Toback 等人 2021;DOI:10.1101/2021.06.09.21258556
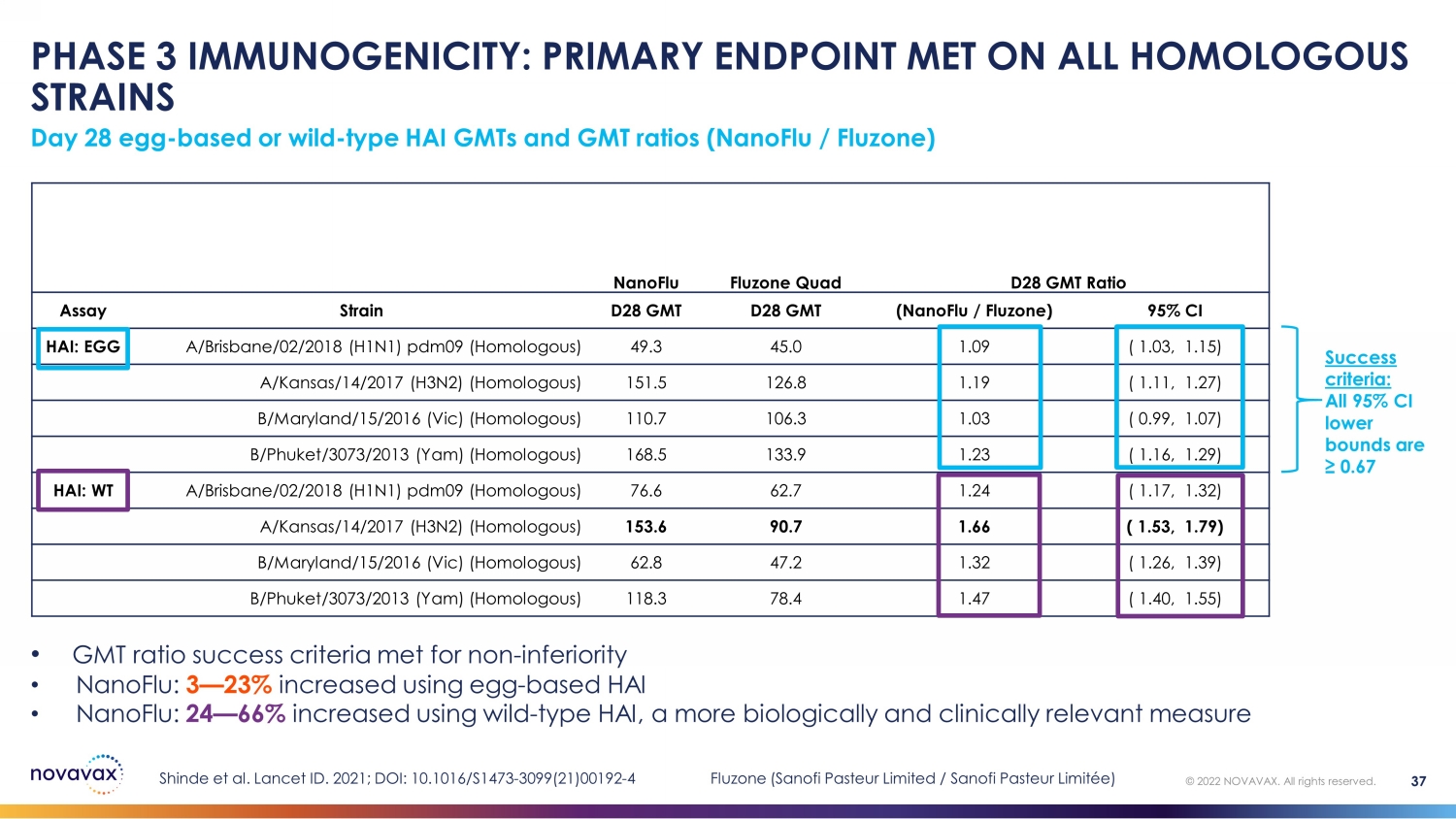
第 3 階段免疫原性:所有同源菌株均達到主要終點第 28 天蛋基型或野生型 HAI 型 GMT 和 GMT 比率(nanoFLU /Fluzone)© 2022 NOVAVAX。版權所有。37 nanoFLU Fluzone Quad D28 GMT Ratio Strain D28 GMT (nanoFlu /Fluzone) 95% CI HAI: EGG A/Brisbane/02/2018 (H1N1) pdm09 (同源) 49.3 45.0 1.09 (1.03, 1.15) a/Kansas/14/2017 (H3N2)(同源)151.5 126.8 1.19 (1.11, 1.27) b/Maryland/15/2016 (Vic)(同源)110.7 106.3 1.03 (0.99, 1.07) B/Phuket/3073/2013 (Yam) (Yam) (同源) 168.5 133.9 1.23 (1.16, 1.29) HAI: WT A/Brisbane/02/2018 (H1N1) pdm09 (0.99, 1.07) 76.6 62.7 1.24 (1.17, 1.32) A/Kansas/14/2017 (H3N2)(同源)153.6 90.7 1.66 (1.53, 1.79) b/Maryland/15/2016(Vic)(同源)62.8 47.2 1.32(1.26,1.39)B/Phuket/3073/2013(Yam)(同源)118.3 78.4 1.47(1.40,1.55)• 非自卑的格林尼治標準成功率達到 3 — 23% • nanoFlu:使用野生 HAI 增加了 24 — 66%,更具生物學和臨牀相關性的衡量標準成功標準:所有 95% 置信區間下限均為 ≥ 0.67 Shinde 等人。Lancet ID. 2021;DOI:10.1016/S1473-3099 (21) 00192-4 Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司)
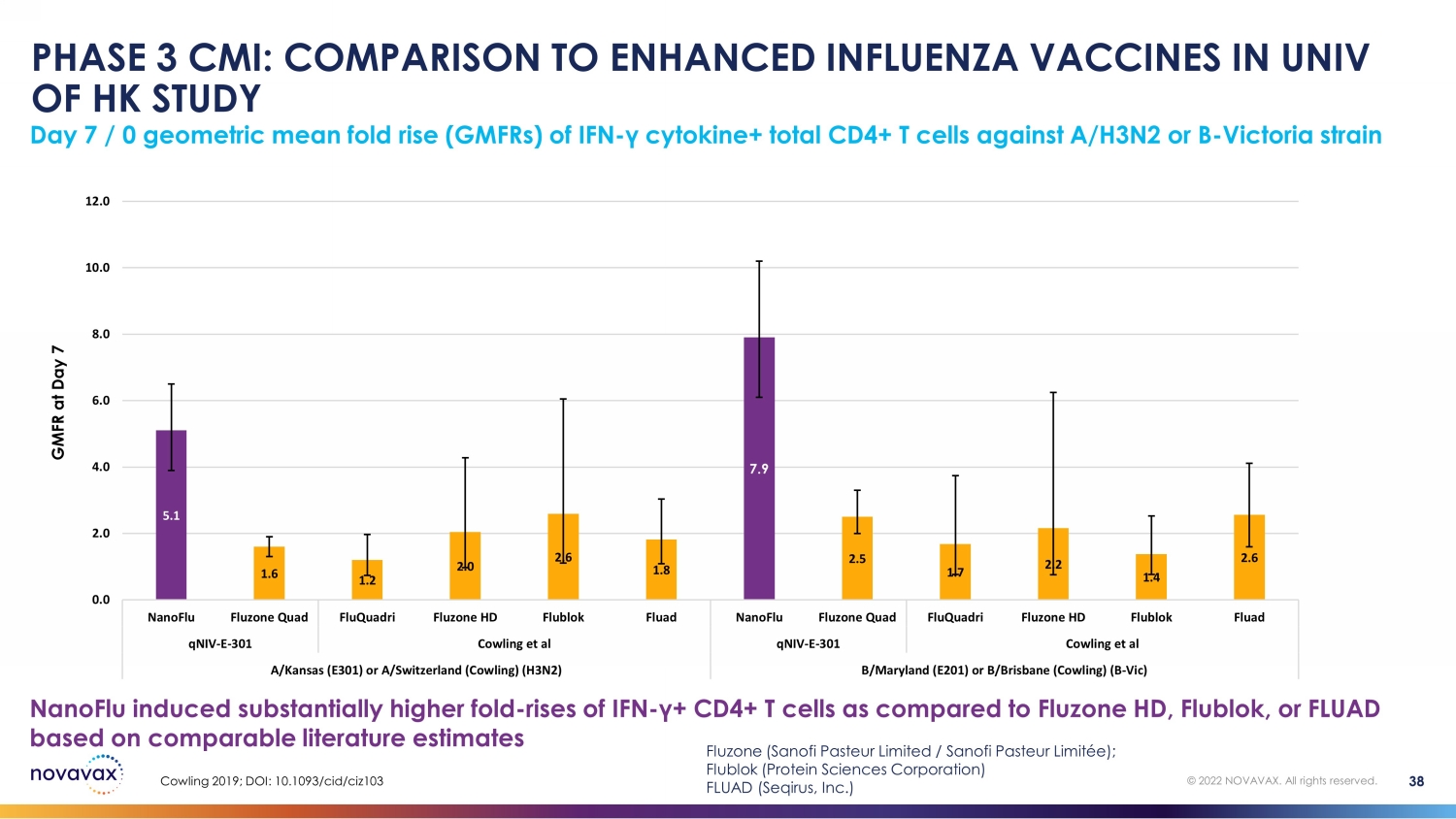
第 3 階段 CMI:與香港大學強化型流感疫苗的比較研究第 7 天/ 0 與 Fluzone HD、Flublok 或 FLUAD 相比,IFN-γ細胞因子+ 總 CD4+ T 細胞對 A/H3N2 或 B-Victoria 菌株 GMFR 的幾何平均倍數上升 (gmFRs) 根據可比文獻估計 5.1 1.6 1.2 2.0 2.6 1.8 7.9 2.7 1.7 2.2 1.4 2.6 0.0 4.0 6.0 6.0 8.0 12.0 nanoFLU Quad FluquaDri Fluzone HD Flublok Fluad fluquadRI Fluzone Quad fluquaDri Fluzone HD FluquaDri Fluzone HD301 Cowling 等人 qniv-e-301 Cowling 等人 A/Kansas (E301) 或 a/Switter (Cowling) (H3N2) B/Maryland (E201) 或 b/Brisbane (Cowling) (B-Vic) Cowling 2019;DOI:10.1093/ cid /ciz103 38 © 2022 NOVAVAX。版權所有。Fluzone(賽諾菲巴斯德有限公司/賽諾菲巴斯德有限公司);Flublok(蛋白科學公司)FLUAD(Seqirus, Inc.)
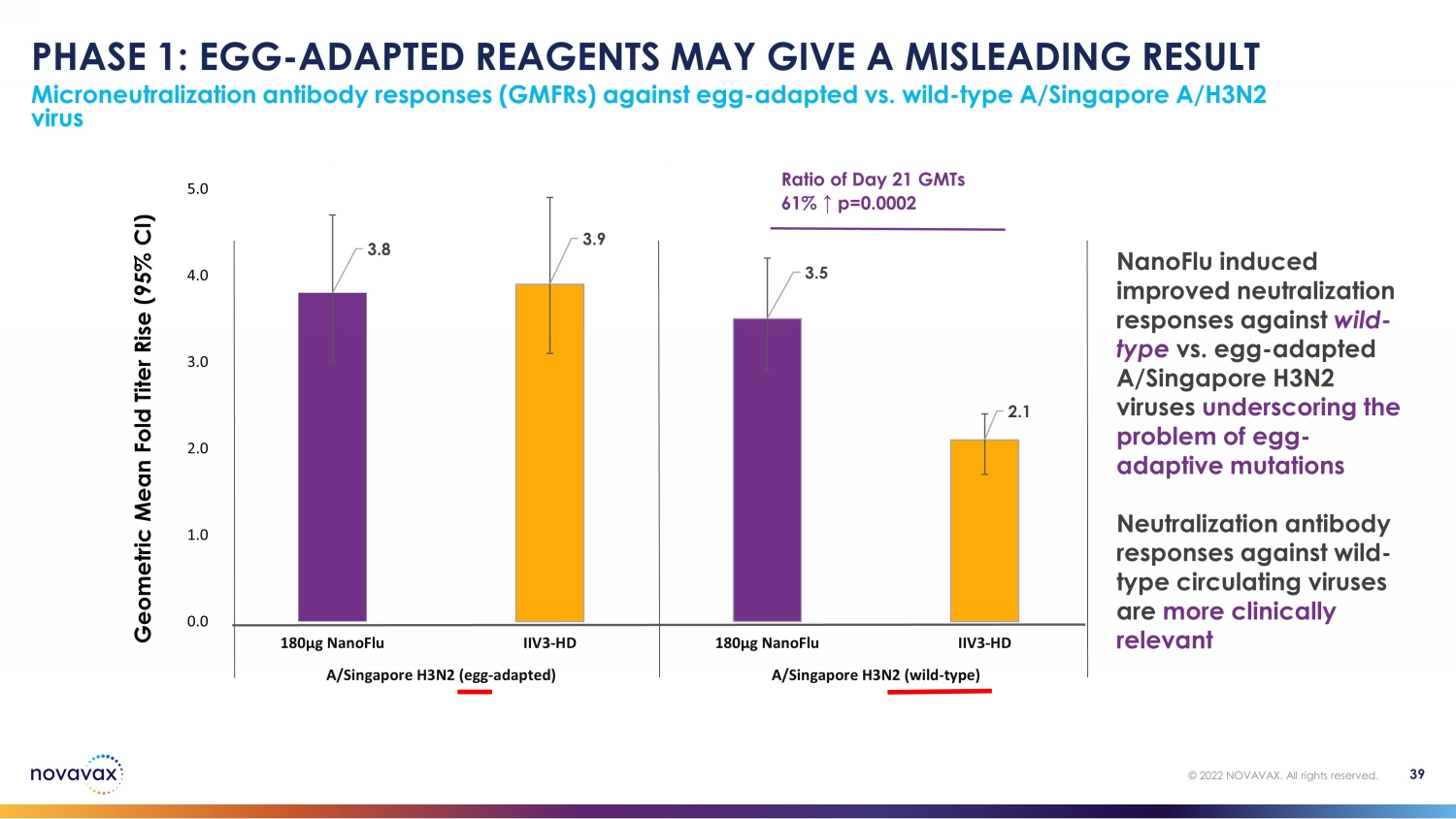
第 1 階段:雞蛋——適應性試劑可能會給出誤導性結果針對卵子的微量中和抗體反應 (gmFR) ——適應型病毒與野生型 A/新加坡A/H3N2 病毒 39 © 2022 NOVAVAX。版權所有。第 21 天比率 61% ↑ p=0.0002 3.9 3.9 3.5 2.1 0.0 2.0 2.0 2.0 3.0 4.0 4.0 180µg nanoFlu IIV3-HD 180µg nanoFlu IIV3-HD a/新加坡 H3N2(野生型)第 21 天幾何平均摺疊滴度上升(95% 置信區間)第 21 天比率 61% ↑ p=0.0002 nanoFlu 誘導的中和反應得到改善野生型與卵類適應性A/新加坡H3N2病毒強調卵子適應性突變問題針對野生型循環病毒的中和抗體反應更具臨牀意義
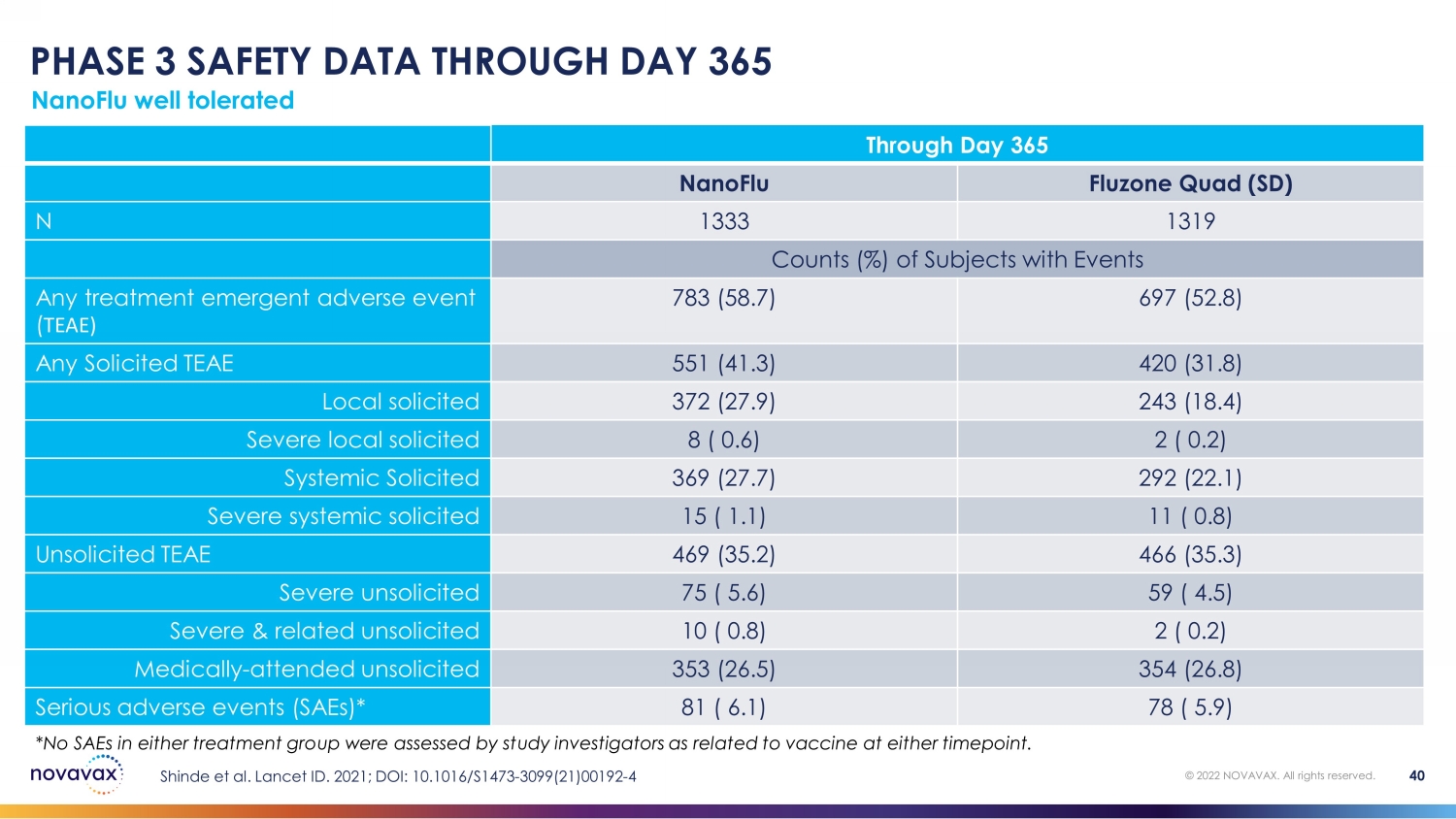
nanoFlu 耐受性良好 © 2022 NOVAVAX。版權所有。40 *研究調查人員在任一時間點均未評估出任一治療組的SAE與疫苗有關。截至第 365 天 nanoFlu Quad (SD) N 1333 1319 有事件的受試者計數 (%) 任何治療緊急不良事件 (TEAE) 783 (58.7) 697 (52.8) 任何請求的 TEAE 551 (41.3) 420 (31.8) 本地徵集 372 (27.9) 243 (18.4) 嚴重受試者 8 (0.6) 2 (0.2) 系統性請求 369 (27.7) 292 (22.1) 嚴重系統性受傷 15 (1.1) 11 (0.8) 未經請求的 TEAE 469 (35.2) 466 (35.3) 未經請求的嚴重系統性 75 (5.6) 59 (4.5) 未經請求的嚴重及相關的 10 (0.8) 2 (0.2) 醫學上——未經請求就診 353 (26.5) 354 (26.8) 嚴重不良事件 (SaeS) * 81 (6.1) 78 (5.9) Shinde 等人Lancet ID. 2021;DOI:101016/S1473-3099 (21) 00192-4 第 365 天的第 3 階段安全數據