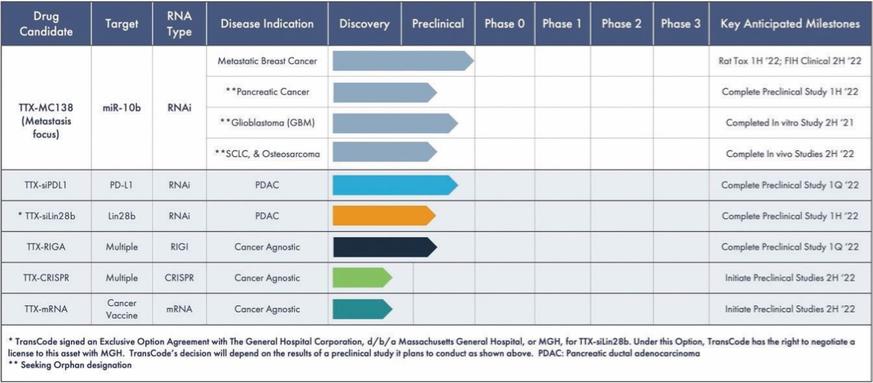
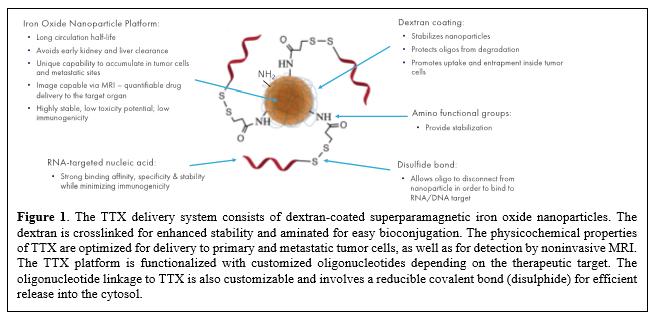
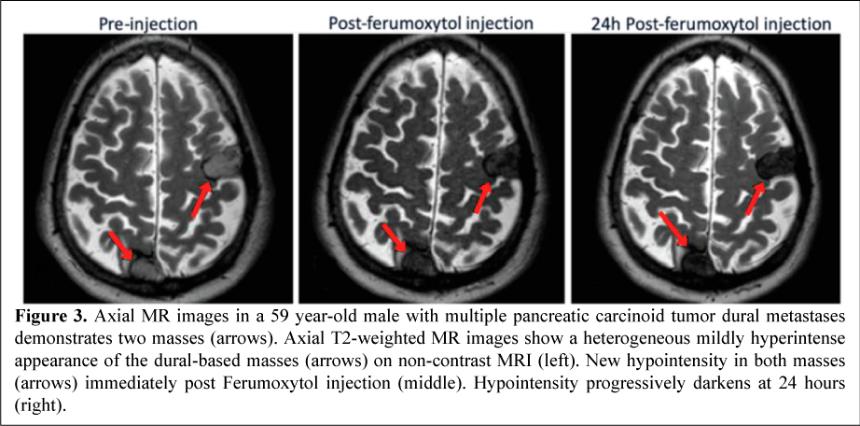
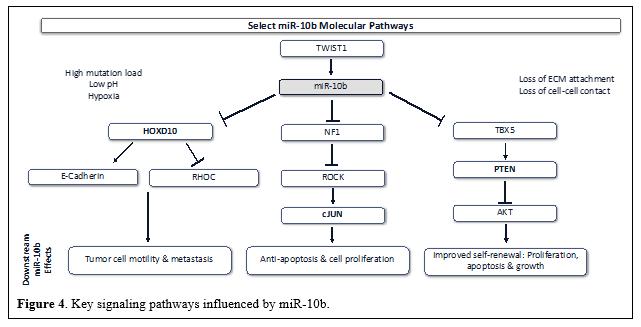
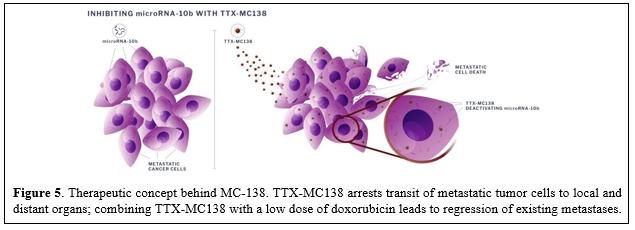
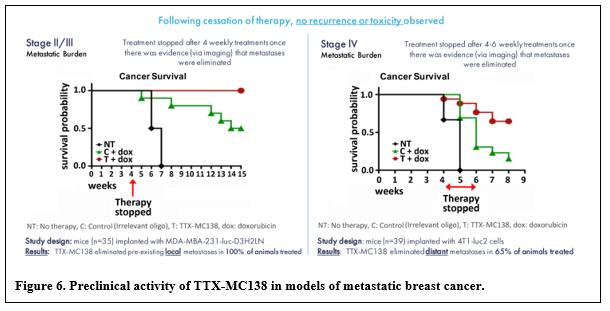
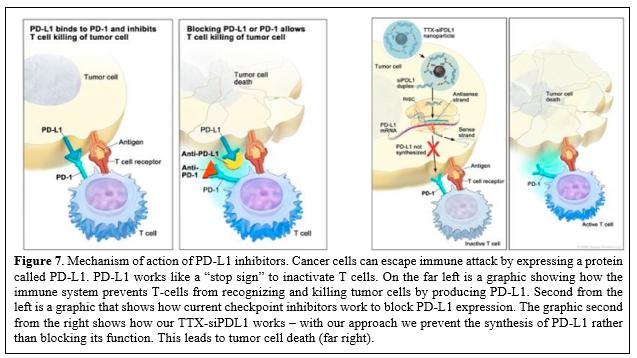
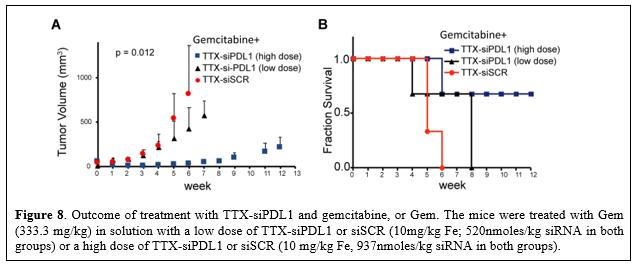
目錄
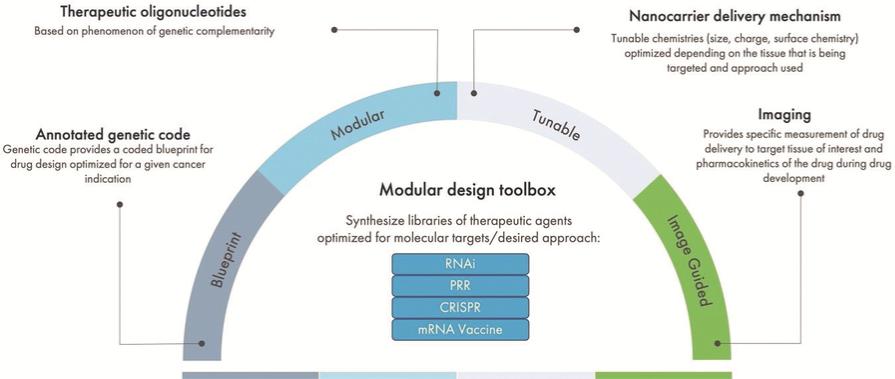
下圖總結了我們的模塊化設計方法:
我們的團隊
在代碼轉換方面,我們被驅使改變癌症作為一種治療方式和在改善患者結果方面的治療方式。我們相信RNA療法的潛在能力是為患者提供疾病完全消退而不會復發,而不是目前的規範,即給患者額外的幾個月的生存時間。我們由一支經驗豐富的敬業科學家和專家團隊領導,他們在RNA和藥物開發的基礎領域擁有數十年的經驗,包括使用反義寡核苷酸或ASO的RNA藥物開發和沉默RNA方法。我們的聯合創始人兼首席執行官邁克爾·達德利在醫療器械、診斷和治療領域擁有40多年的行政領導經驗。Zdravka Medarova博士,我們的聯合創始人兼首席技術官,是一名訓練有素的遺傳學家和癌症生物學家。她是國際公認的癌症治療非編碼RNA領域的領導者,也是Transcode技術的發明者之一。她開發了核心TTX遞送平臺,並驗證了許多治療靶點。我們的聯合創始人安娜·摩爾博士以其在靶向成像和圖像引導治療方面的開創性研究而聞名國際。我們的首席財務官Tom Fitzgerald在擔任首席財務官和投資銀行家方面取得了30多年的成就,為生命科學、技術、金融和工業領域的公司從新興增長到扭虧為盈的財富500強公司提供服務。我們的研發副總裁兼首席科學家Peter Liu博士在生物製藥行業擁有超過20年的研發、經驗和領導能力,並在化學、寡核苷酸生物化學和
13