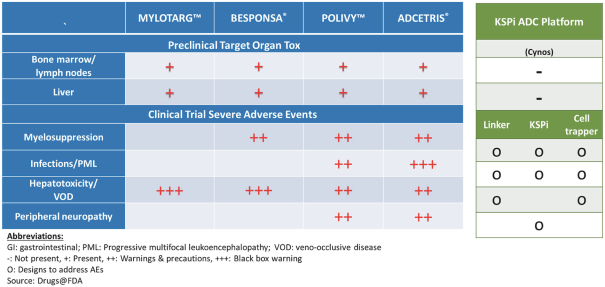
我們的戰略
我們的目標是通過臨牀開發多種產品可能還會通過加快美國的審批速度來實現。我們的近期目標是:
概念驗證
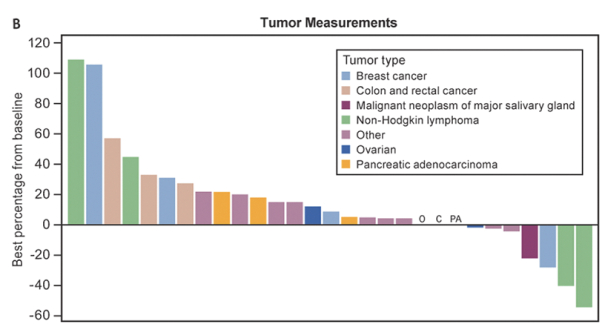
| • | 繼續我們的小分子藥物抑制劑(VIP152)的臨牀開發,作為單一療法並在第一階段與其他抗癌藥物聯合使用,包括擴大血液病患者(例如, 雙打 DLBCL;轉化濾泡性淋巴瘤;裏希特綜合徵;對任何BTK抑制劑和萬乃馨復發或無效的慢性淋巴細胞白血病;以及套細胞淋巴瘤)和實體腫瘤(例如卵巢、三陰性乳腺癌和去勢抵抗前列腺癌)概念驗證 |
| • | 在2022年底或2023年初開始與我們的SMDC(VIP236)進行臨牀試驗。 |
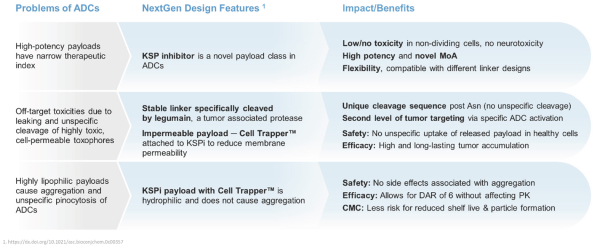
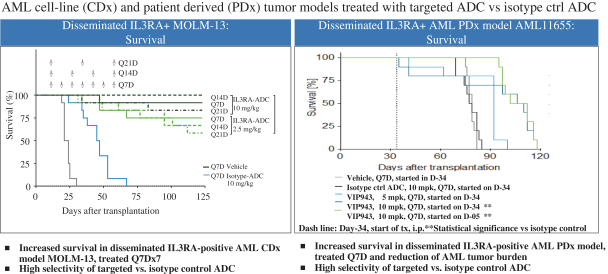
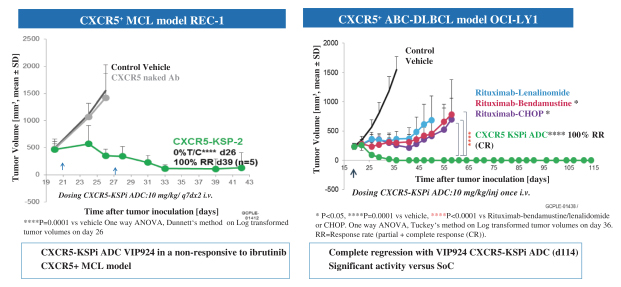
| • | 從2023年底到2024年初,開始使用我們的至少一個下一代ADC(VIP943或VIP924)進行臨牀試驗。 |
我們的產品候選渠道
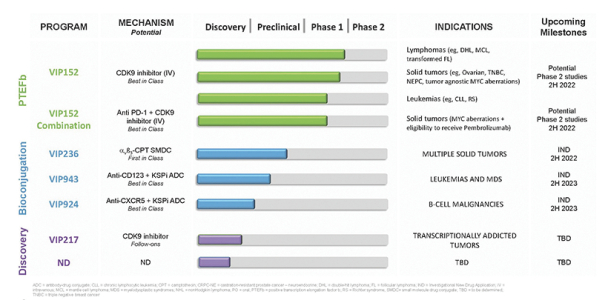
小分子藥物計劃-PTEFb
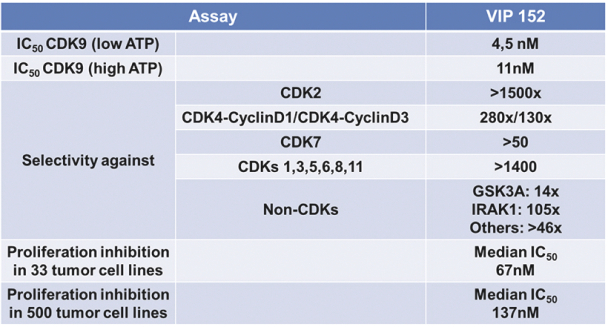
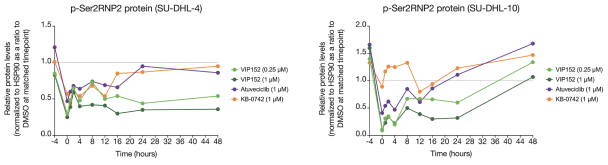
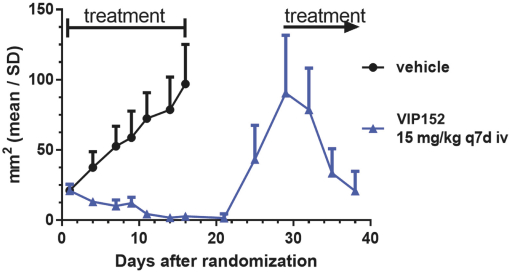
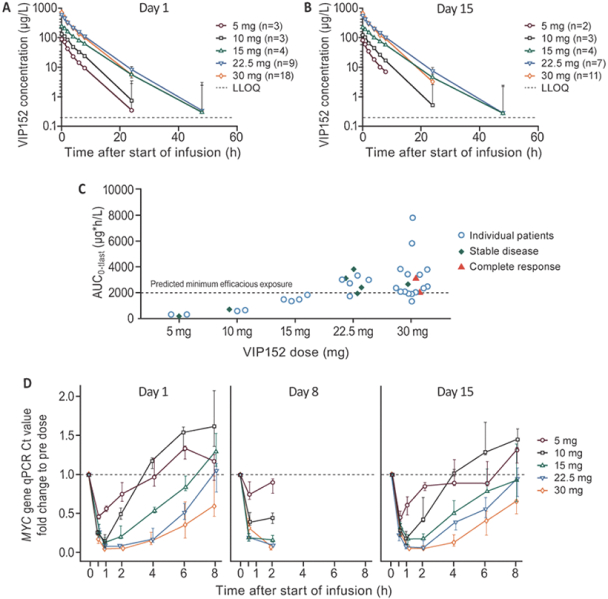
VIP152是一種高度選擇性的CDK9抑制劑,可以幹擾PTEFb的功能,旨在靜脈給藥,目前正處於晚期癌症患者的1期研究中。VIP152擁有廣泛的知識產權保護,物質組成的專有權至少持續到2033年,外加潛在的延期。
癌基因及其轉錄調控在癌症中的科學研究概況
癌基因(即驅動癌症的基因)是由正常基因的突變引起的,這些突變會導致失去正常的細胞生長控制,並導致癌症的形成。這些癌基因的表達通常需要轉錄失調(即基因被激活或調節的生物過程),並被稱為“轉錄成癮”。因此,能夠針對癌細胞中活躍的轉錄機制的藥物可能在治療癌症患者方面具有重要的實用價值。細胞週期蛋白依賴性激酶,如CDK7
8