
展品99.3

Valneva報告2021年全年業績並提供公司更新分析師演示文稿2022年3月24日

免責聲明本演示文稿不包含或構成向美國或任何司法管轄區的任何人發出購買或認購Valneva SE股票的要約,或該要約或要約對其非法的任何司法管轄區的要約。Valneva是一家歐洲公司。發佈的信息受到歐洲與美國不同的披露要求的約束。財務報表和信息可能是根據會計準則編制的,而這些準則可能無法與美國公司普遍使用的會計準則相比較。本演示文稿僅包括截至本演示文稿之日提供的摘要信息,並不自稱是全面的。本演示文稿中的任何信息純屬指示性信息,可隨時修改,恕不另行通知。Valneva不保證本演示文稿中包含的信息或觀點的完整性、準確性或正確性。Valneva或其任何附屬公司、董事、高級管理人員、顧問和員工均無義務更新此類信息,也不對因使用本演示文稿而造成的任何損失承擔任何責任。這些信息未經獨立核實,並受Valneva根據巴黎泛歐交易所和納斯達克全球精選市場上市公司適用的規則、法規和實踐要求公佈的商業、財務和其他信息的完整限定,尤其包括Valneva於2022年3月23日提交給法國金融市場管理局的全球註冊文件和提交給美國的20-F表格中描述的風險因素。S.美國證券交易委員會(美國證券交易委員會),2022年3月23日, 以及任何其他定期報告和任何其他新聞稿中的信息,這些信息可在Valneva的網站(www.Valneva)免費獲得。瓦爾內瓦。Com)和/或AMF(WWW.AMF-法國。Org)和美國證券交易委員會(WWW美國證券交易委員會。Gov)。本報告中包含的某些信息和陳述不是歷史事實,而是前瞻性陳述,包括有關收入指引、進展、時機、候選產品的研究、開發和臨牀試驗的完成結果以及對未來業績的估計的陳述。前瞻性表述(A)基於當前的信念、預期和假設,包括但不限於對當前和未來業務戰略以及Valneva運營環境的假設,涉及已知和未知的風險、不確定性和其他因素,可能導致實際結果、業績或成就與這些前瞻性表述中明示或暗示的結果、業績或成就大不相同,(B)僅在本演示文稿發佈之日發表,(C)僅供説明之用。請投資者注意,前瞻性信息和陳述不是對未來業績的保證,會受到各種風險和不確定因素的影響,其中許多風險和不確定因素很難預測,而且通常不在Valneva的控制範圍之內。2022年3月24日Valneva 2021財年分析師演示文稿2

議程2022年3月24日Valneva 2021財年分析師演示文稿3簡介業務更新財務報告2021財年新聞流問答財務展望

Valneva報告2021年全年業績並提供公司最新信息2022年3月24日Valneva 2021財年分析師演示文稿4所有臨牀計劃▪萊姆病:報告進一步的陽性第二階段結果,包括助推器反應;第三階段劑量和時間表選定的▪新冠肺炎:報告陽性第三階段結果;巴林批准的EUA;正在與歐洲藥品管理局和MHRA▪進行的審查:最終陽性第三階段結果和背線批次數據報告;青少年3期試驗啟動了強勁的2021年全年收入和現金頭寸▪總收入2021年為3.481億歐元,而2020年為1.103億歐元--增加了216%▪現金頭寸3.467億歐元(2021年12月31日)成功進行納斯達克首次公開募股、歐洲配售和後續發行

議程2022年3月24日Valneva 2021財年分析師演示文稿5簡介業務更新財務報告2021財年新聞流問答財務展望

遵循萊姆病疫苗已證實的作用機制FDA快速通道指定授予Topline從第二階段試驗1,2,3報告的結果,包括。增強反應4;選定的第三階段時間表;Topine兒科數據預計將於2022年第二季度公佈,以預防美國和歐洲的萊姆病。與輝瑞VLA15建立全球獨家合作伙伴關係:多價萊姆病候選疫苗僅萊姆病候選項目高級臨牀開發中的萊姆病計劃今天2022年3月Valneva公司演示文稿6 1 2 4 5 3 1 Valneva宣佈萊姆病候選疫苗第二階段研究的初步陽性結果。2 Valneva宣佈萊姆病候選疫苗VLA15的第二階段第二階段研究的初步結果為陽性。3 Valneva和輝瑞報告了萊姆病候選疫苗的進一步積極的第二階段數據;4 Valneva和輝瑞報告了進一步的積極的第二階段結果,包括增強反應,根據Valneva估計,全球候選萊姆病疫苗市場的年銷售額將超過10億美元。

VLA15:開發進展和展望VLA15-公司演示文稿7VLA15-221招募了625名隨機參與者,年齡在5歲至65歲之間,基於更強的免疫反應和兩劑計劃,被選為第三階段用於成人的▪三劑量啟動計劃;UB分析報告2022年2月3▪TOPLINE兒科數據預計在2022年第二季度▪VLA15-221還將調查VLA15的增強劑量,在所有劑量組的6個月劑量1 VLA15-202結果和2021年9月4▪VLA15免疫原性公佈的背線增強數據後一年實施;在初次接種系列疫苗(主要終點)一個月後在所有血清型中引發高抗體反應▪加強劑量引起強烈的記憶反應第三階段關鍵療效試驗計劃於2022年第三季度開始1▪臨牀讀數,基於一個滴答季節,預計在2023年底之前向Valneva支付2500萬美元的里程碑式付款由於試驗啟動初始提交監管批准預計在2024年下半年,假設陽性數據1 Valneva和輝瑞宣佈啟動萊姆病候選疫苗的第二階段研究。,2 Valneva和輝瑞完成了萊姆病候選疫苗第二階段試驗的招募;3 Valneva和輝瑞報告了萊姆病候選疫苗第二階段的進一步陽性數據;4 Valneva和輝瑞報告了萊姆病候選疫苗第二階段的進一步陽性結果,包括加強反應,報告的成人第二階段陽性結果;Topine兒科數據預計在2022年3月第二季度

VLA1553:單針基孔肯雅疫苗候選全球最先進基孔肯雅疫苗計劃2022年3月瓦爾內瓦-公司演示文稿8注:圖片來源:詹姆斯·加薩尼。1 Valneva宣佈其單針基孔肯雅候選疫苗的第三階段關鍵結果為陽性;2 Valneva宣佈其單針基孔肯雅候選疫苗的批次對批次一致性試驗結果為陽性;3 Valneva宣佈其單針基孔肯雅候選疫苗的青少年第三階段試驗開始;4 https://www。美國食品和藥物管理局。GOV/About-FDA/Center-藥物評價和研究中心/熱帶疾病優先審查代金券計劃;5 Valneva因其單針基孔肯雅候選疫苗獲得FDA突破稱號;6 Valneva獲得FDA基孔肯雅候選疫苗快速通道稱號;7 Valneva的基孔肯雅候選疫苗獲得EMA優質稱號;8 CHIKV LR 2006-OPY 1感染性克隆通過刪除編碼NSP 3(甲型病毒複製酶)的基因進行減毒;9 Valneva與布坦坦研究所合作針對中低收入國家的基孔肯雅病毒單針疫苗;10 VacineZAnalytics與基孔肯雅病毒全球需求分析。2020年2月。最終積極的關鍵3期結果1和TOPLINE批次到批次數據2報告;2022年1月啟動的青少年階段3試驗獲得FDA突破性療法5、Fast Track 6和EMA Prime 7稱號;有資格獲得優先審查憑單4;FDA預提交過程預計在2022年第二季度進行單針活減毒8針對基孔肯雅病毒的預防疫苗中和CEPI授予Valneva高達2,340萬美元的研發費用;與Instituto Butantan合作開發LMIC 9與現有商業和製造能力完美匹配1 2 4 5 3全球市場, 包括流行地區,估計到2032年每年將超過5億美元10 6

VLA1553:發展展望Valneva-公司介紹9 1 Valneva成功完成單針基孔肯雅候選疫苗的關鍵第三階段試驗;2 Valneva宣佈其單針基孔肯雅候選疫苗的批次對批次一致性試驗結果呈陽性;3 Valneva宣佈啟動其單針基孔肯雅候選疫苗的青少年第三階段試驗;4 https://www.fda.gov/about-fda/中心-藥物評估和研究-cder/熱帶病優先-審查-憑證計劃;食品和藥物管理局的預提交程序預計將於2022年第二季度開始首個也是唯一一個在全球範圍內報告第三階段陽性結果的計劃▪S九個月的隨訪完成-所有第三階段免疫原性和安全終點在一個月後達到98.9%的參與者在六個月後達到96.3%-良好的安全性和耐受性簡檔確認▪陽性背線對批次一致性試驗結果報告(VLA1553-302)2預計2022年第二季度▪抗體持久性後續試驗(VLA1553-303)的最終數據正在進行:VLA1553-301試驗中的多達375名志願者將接受為期5年的每年跟蹤研究▪2022年1月啟動的支持潛在標籤擴展的遲緩階段3試驗,由防疫創新聯盟資助的3個預提交過程預計將於2022年第二季度開始美國批准的第一種基孔肯雅熱疫苗的贊助商將有資格獲得2022年3月4日的優先審查券
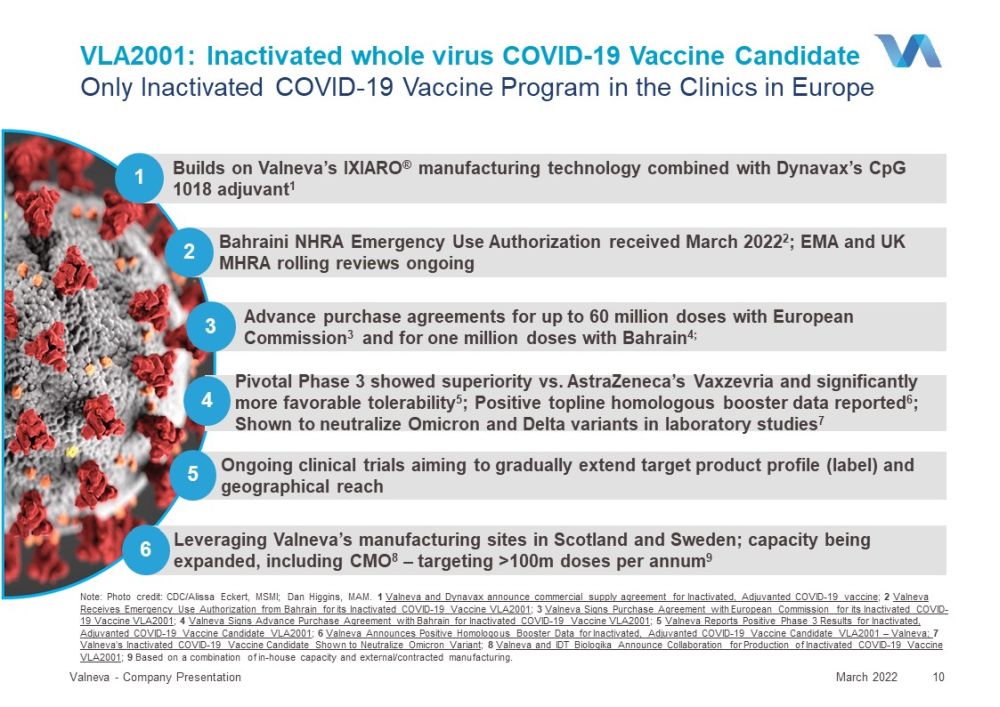
巴林NHRA緊急使用授權收到2022年3月2;EMA和英國MHRA滾動審查正在進行的2 P ivotal階段3顯示出優於阿斯利康的Vaxzevria,並且顯著更有利的耐受性5;陽性topline同源強化數據報告6;實驗室研究中顯示中和奧密克戎和達美航空的變種7 4與歐盟委員會的3和與巴林的100萬劑的預先購買協議4;3 VLA2001:新冠肺炎滅活全病毒疫苗候選疫苗只在歐洲的診所進行滅活的新冠肺炎疫苗計劃Valneva公司演示文稿10:圖片來源:CDC/Alissa Eckert,MSMI;Dan Higgins,MAM。1 Valneva公司和Dyavax公司宣佈達成了新冠肺炎滅活疫苗和佐劑疫苗的商業供應協議;2 Valneva公司從巴林獲得了其新冠肺炎滅活疫苗VLA2001的緊急使用授權;3 Valneva公司與歐盟委員會簽署了其2001年新冠肺炎滅活疫苗VLA2001的採購協議;4 Valneva公司與巴林簽署了預購協議,以獲得新冠肺炎滅活疫苗VLA2001的第三階段陽性結果;5 Valneva公司報告了新冠肺炎滅活疫苗和佐劑候選疫苗VLA2001的陽性第三階段結果;6 Valneva公司宣佈了新冠肺炎滅活、佐劑候選疫苗VLA2001-Valneva的陽性同源助推數據;7 Valneva公司的新冠肺炎滅活候選疫苗顯示出了中和奧密克戎變體的作用;8 Valneva和IDT Biologika宣佈合作生產2001年滅活新冠肺炎疫苗VLA9基於內部產能和外部/合同製造的組合。建立在Valneva的IXIARO®製造技術和Dyavax的CpG 1018佐劑1的基礎上,利用Valneva在蘇格蘭和瑞典的製造基地;產能正在擴大, 包括CMO 8-每年超過1億劑9 6項正在進行的臨牀試驗,旨在逐步擴大目標產品範圍(標籤)和地理覆蓋範圍2022年3月5日

VLA2001:關鍵階段3“CoV-比較研究”結果EMA和UK MHRA滾動審查正在進行的Valneva-Company Presentation 11免疫原性·VLA2001總體上耐受性良好:o與AZD1222相比,o 30歲及以上的參與者報告的不良事件顯著減少,包括注射部位反應和全身反應·18-29歲的參與者表現出與年齡較大年齡組相當的整體安全性·VLA2001與AZD1222相比達到了共同的主要終點,證明瞭:O在中和抗體幾何平均滴度(GMT比率=1.39,p 方面具有優勢

瓦爾內瓦-公司演示文稿12▪24.300萬劑將在2022年第二季度和第三季度供應;EC可以選擇增加首次採購,其餘部分將在2023年VLA2001交付:目前的採購協議和批准歐盟預計在2022年第二季度交付的第一批貨物1 Valneva宣佈歐盟委員會批准預購協議,預購最多6000萬劑新冠肺炎滅活疫苗VLA2001;2 Valneva與巴林簽署預購協議,預購新冠肺炎滅活疫苗VLA2001;3 Valneva從巴林獲得其滅活新冠肺炎疫苗VLA2001的緊急使用授權;4 Valneva由蘇格蘭企業授予高達2000萬GB的獎勵,以推進疫苗開發▪NHRA緊急使用授權已收到;第一批交付預計在2022年3月底3歐盟委員會:2022年至2023年供應多達6000萬劑VLA2001 1巴林:100萬劑VLA2001將於2022年至23年供應2▪贈款預計在未來三年內收到總計高達2000萬GB的贈款,從2022年3月開始▪第一筆贈款至多GB 12,500,000將支持與VLA2001製造有關的研發;第二筆高達7,500,000 GB的贈款將支持與製造Valneva的其他候選疫苗相關的研發,最高可達2000萬GB由蘇格蘭企業授予,以推進疫苗開發2022年3月4日

VLA2001:計劃中的標籤擴展正在進行和未來的臨牀研究預計將加強Valneva的產品簡介-公司介紹13初級免疫18-55年。初次免疫2-11年。目標產品簡介戰略價值開發P-OST-P和初級免疫12-17歲。助推器包括混合/匹配初級免疫接種55年+2022年3月如果需要,可能會切換到變體(VLA2101)

議程2022年3月24日Valneva 2021財年分析師演示文稿14簡介業務更新財務報告2021財年新聞流問答財務展望
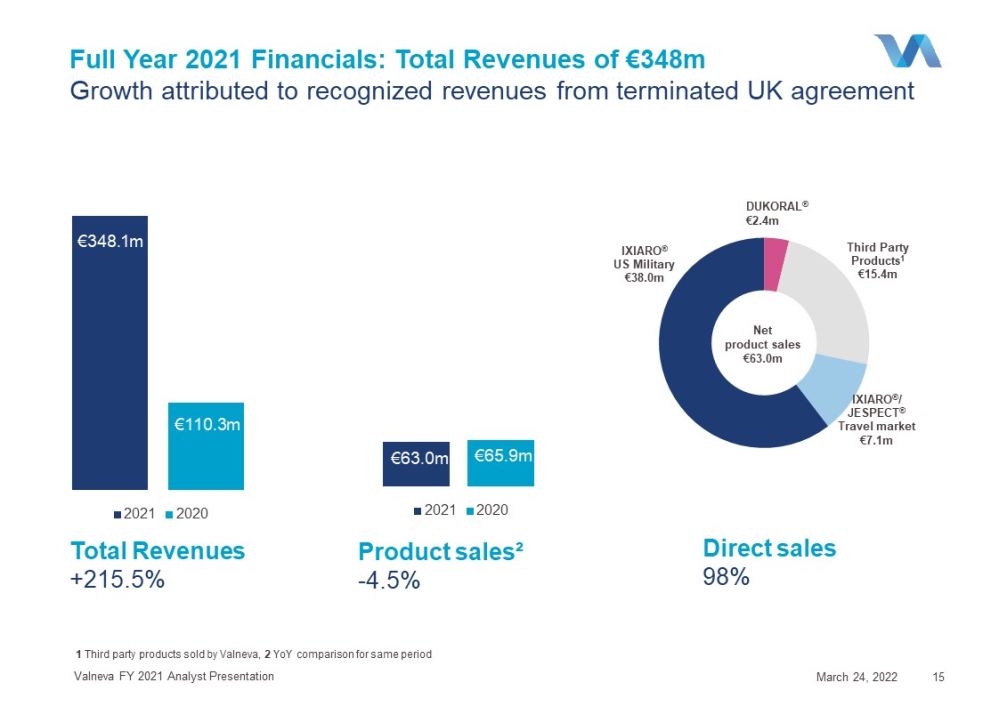
Ixiaro®美國軍用第三方產品3800萬歐元1歐元1540萬歐元IXIARO®/JESPECT®旅遊市場2021年全年710萬歐元財務:總收入增長3.48億歐元,歸因於2022年3月24日Valneva FY FY分析師演示文稿15杜科拉爾®240萬歐元直銷98%產品銷售額-4.5%Valneva銷售的第三方產品,2同期產品淨銷售額6300萬歐元杜科拉®240萬歐元總收入+215.5%歐元3.481億歐元1.103億歐元2021年2020年6300萬歐元6590萬歐元2021年
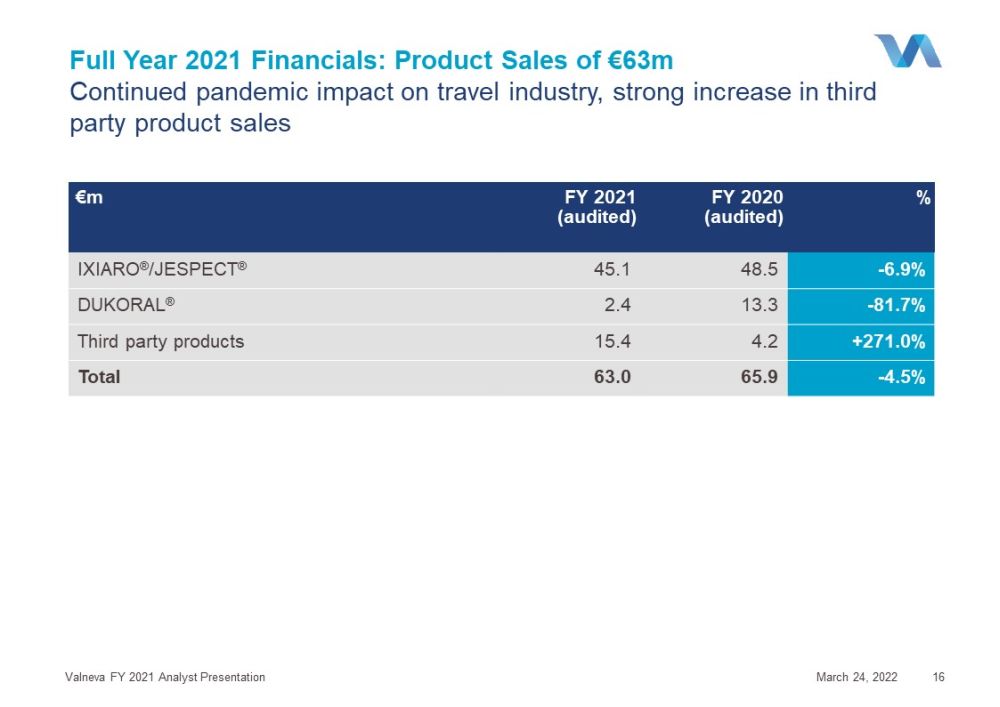
2021年全年財務:產品銷售額6300萬歐元繼續對旅遊業產生影響,第三方產品銷售額強勁增長2022年3月24日Valneva 2021財年分析師演示文稿16歐元2021財年(經審計)2020財年(經審計)%IXIARO®/JESPECT®45.1 48.5-6.9%杜科拉®2.4 13.3-81.7%第三方產品15.4 4.2+271.0%總計63.0 65.9-4.5%

2021年全年財務:EBITDA為-4710萬歐元,反映了流行病對銷售和重大研發投資的影響。2022年3月24日Valneva 2021財年分析師演示文稿17 1財年EBITDA是按不包括14歐元計算的。300萬歐元(2020年:9歐元。900萬歐元的折舊和攤銷。400萬歐元(2020年:55歐元。100萬)在《國際財務報告準則》下的綜合收益表中記錄的營業虧損。2021財年產品銷售63.0 65.9其他收入285.1 44.4收入348.1 110.3商品和服務成本(187.9)(54.3)研發費用(173.3)(84.5)營銷和分銷費用(23.6)(18.3)一般和行政費用(47.6)(27.5)其他收入/(支出),淨23.0 19.1營業虧損(61.4)(55.1)財務,聯營公司投資及所得税(12.0)(9.3)當期損益(73.4)(64.4)EBITDA 1(47.1)(45.2)

2021年全年財務:截至2021年3月24日,新冠肺炎計劃對損益新冠肺炎的影響作為單獨的部門報告,2022年Valneva 2021財年分析師演示文稿18財年1財年EBITDA不包括歐元14。300萬歐元(2020年:9歐元。900萬歐元的折舊和攤銷。400萬歐元(2020年:55歐元。100萬)在《國際財務報告準則》下的綜合收益表中記錄的營業虧損。歐元(2021年審計)2021財年集團2021財年COVID僅2021財年不包括。產品銷售63.0 63.0其他收入285.1 253.3 31.8收入348.1 253.3 94.8商品和服務成本(187.9)(122.8)(65.1)研發費用(173.3)(113.9)(59.4)營銷和分銷費用(23.6)(1.2)(22.5)一般和行政費用(47.6)(23.0)(24.6)其他收入/(支出),淨營業虧損23.0 11.5 11.4營業虧損(61.4)3.9(65.3)財務、聯營公司投資及所得税(12.0)(12.0)當期損益(73.4)3.9(77.4)EBITDA 1(47.1)11.6(58.7)
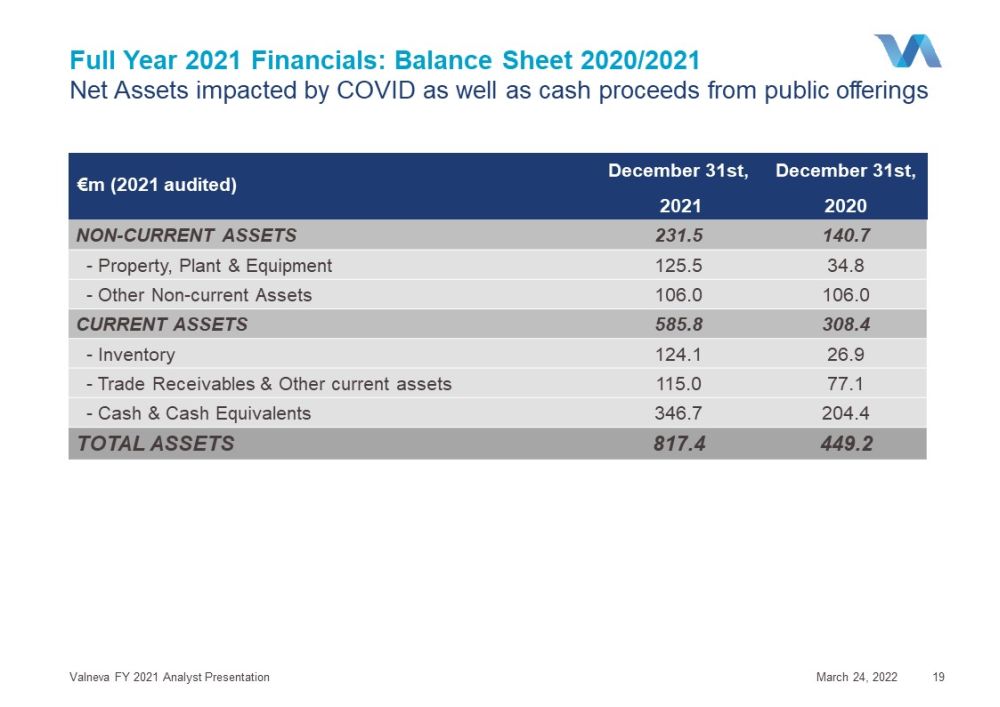
2022年12月31日非流動資產231.5 140.7-物業、廠房和設備125.5 34.8-其他非流動資產106.0 106.0流動資產585.8 308.4-存貨124.1 26.9-應收貿易賬款和其他流動資產115.0 77.1-現金和現金等價物346.7 204.4總資產817.4 449.2 2021年全年財務:資產負債表2020年/2021年受虛擬資產管理公司影響的淨資產以及公開發行的現金收益
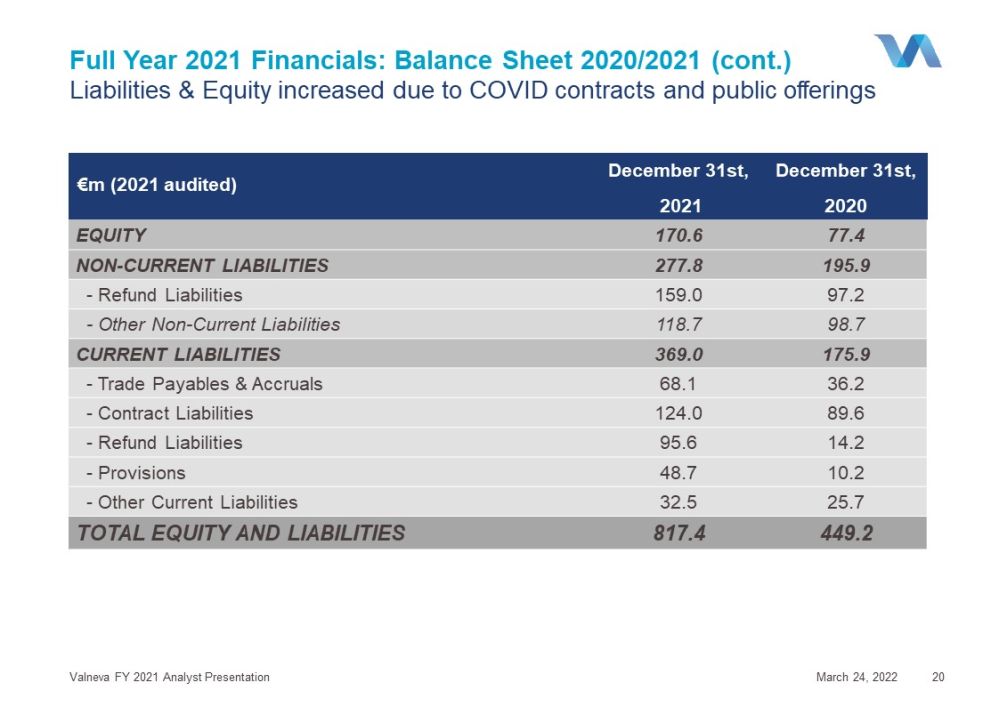
2022年3月24日Valneva 2021財年分析師演示文稿20歐元(2021年審計)2021年12月31日2020年股本170.6 77.4非流動負債277.8 195.9-退款負債159.0 97.2-其他非流動負債118.7 98.7流動負債369.0 175.9-貿易應付款和應計項目68.1 36.2-合同負債124.0 89.6-退款負債95.6 14.2-準備金48.710.2-其他流動負債32.5 25.7股本和負債總額817.4 449.2 2021年全年財務:資產負債表2020/2021年(續)由於COVID合同和公開發行,負債和股權增加

2021年全年財務:受終止的英國協議的影響2021年收到的現金總額4.2億歐元報告為2021年的其他收入2.53億歐元2021年12月剩餘2.53億歐元作為退款負債歐元1.67億歐元-特許權使用費的退款負債歐元8700萬歐元-資本支出預付款的退款負債8000萬歐元2022年3月24日Valneva 2021財年分析師演示文稿21終止的供應協議影響收入確認和資產負債表*)現金收入來自a)終止的英國新冠肺炎疫苗供應協議在合同有效期內收到的不可退還的付款,b)初步試驗協議付款;包括780萬歐元的未付款;包括歐元/英鎊外匯對收到資金的影響

議程2022年3月24日Valneva 2021財年分析師演示文稿22簡介業務更新財務報告2021財年新聞流問答財務展望

·新冠肺炎疫苗銷售收入3.5億至5億歐元有待監管部門批准和交付2001年1月1日·其他疫苗銷售收入6000萬至7000萬歐元·其他收入約2000萬歐元(來自合作、許可和服務的收入)研發投資預計在1.6億歐元至2億歐元之間·研發投資反映了管道進展

議程2022年3月24日Valneva 2021財年分析師演示文稿24簡介業務更新財務報告2021財年新聞流問答財務展望

即將到來的關鍵催化劑和2022年新聞流-公司介紹25萊姆病候選疫苗VLA15▪預計2022年第二季度▪第三階段試驗預計2022年第三季度啟動基孔肯雅候選疫苗VLA1553▪預提交過程預計將於2022年第二季度開始▪最終批量第三階段數據預計2022年第二季度新冠肺炎候選疫苗VLA2001▪可能的監管批准▪供應和進一步的供應合同▪進一步的臨牀試驗和數據預計2022年3月

謝謝你,謝謝你,丹克大頭針