
附件99.1


·本文檔可能包括PharmaCyte Biotech的聲明,這些聲明構成了“前瞻性聲明”。這類陳述的特點通常是“可能”、“相信”、“預期”或“預期”,並不反映事實。·前瞻性陳述涉及風險、不確定因素和其他因素,可能導致PharmaCyte及其子公司的實際結果、業績或成就與此類前瞻性陳述明示或暗示的結果、業績或成就大不相同。前瞻性陳述僅代表該陳述發表之日的情況。PharmaCyte不承擔、也明確拒絕任何更新任何前瞻性陳述的義務。·可能影響前瞻性陳述和PharmaCyte業務的因素,一般包括但不限於:(I)PharmaCyte在提交給證券交易委員會的定期報告(可在www.sec.gov上查閲)中提出的風險因素、警示和其他陳述,以及(Ii)PharmaCyte目前無法確定或量化但未來可能存在的其他因素。安全港聲明和免責聲明2

·本陳述不應構成出售任何證券的要約或邀請購買任何證券的要約,也不得在任何州或司法管轄區出售此類證券,在任何州或司法管轄區,在根據任何此類州或司法管轄區的證券法註冊或獲得資格之前,此類要約、招攬或出售都是非法的。安全港聲明和免責聲明(續)3

微囊化轉基因活細胞用於治療疾病·癌症:o微囊化將前體藥物從無效形式轉化為殺癌形式的轉基因活細胞o微囊化活細胞被植入腫瘤部位附近;低劑量化療前體藥物異環磷酰胺靜脈注射。微囊化活細胞起到人工肝的作用,在腫瘤部位轉化前藥。o我們相信這項技術可以產生最佳的細胞毒性效應,幾乎沒有治療相關的副作用·糖尿病:o微囊化基因工程活細胞,根據體內葡萄糖濃度產生、儲存和釋放胰島素。o微囊化活細胞植入糖尿病患者體內,作為人工胰腺,用於治療癌症和糖尿病的胰島素生產平臺技術(Insulin Production Platform Technology for Cancer and糖尿病)4。

臨牀前1期2b期3期轉化異環磷酰胺的微囊化活細胞--抗腫瘤效果和大大改善的生活質量*胰腺癌:臨牀前1期2期3期臨牀前1期2期3期根據需要為1型和胰島素依賴型2型糖尿病生產胰島素的微囊化活細胞糖尿病:臨牀前1期2期3 5微囊化活細胞轉化大麻素前體藥物-使用大麻素的抗腫瘤效果和止痛癌症:惡性腹水堆積:微囊化活細胞轉化Ifosos型糖尿病:臨牀前1期2期3期5微囊化活細胞轉化大麻素前體藥物的抗腫瘤效果和疼痛控制使用大麻素的癌症:惡性腹水堆積:微囊化活細胞轉化異環磷酰胺以PharmaCyte滿足FDA的要求為前提。深藍色陰影表示公司開發計劃的當前狀態。

Platform Technology針對實體腫瘤進行靶向化療·使用Cellin-in-a-Box®微囊化活細胞+癌症前體藥物異環磷酰胺·“正常劑量”的異環磷酰胺在治療某些癌症方面顯示出成功,但由於嚴重毒性而不能以正常劑量使用·Cellin-in-a-Box®膠囊內含有基因工程活細胞,可產生一種酶,可將異環磷酰胺轉化為其殺癌形式,被植入腫瘤附近的血液供應中·然後給予異環磷酰胺異環磷酰胺在腫瘤部位轉化。它通常在肝臟中轉化·將Cell-in-a-Box®膠囊放置在腫瘤附近,可在腫瘤部位產生最佳濃度的“殺癌”異環磷酰胺·異環磷酰胺的殺癌代謝產物半衰期短,我們認為這對體內其他器官或組織幾乎沒有附帶損害·我們認為這大大縮小了腫瘤大小,幾乎沒有治療相關副作用,提高了患者的生活質量6

Cellin-in-a-Box®膠囊獨特的封裝材料·膠囊由生物惰性材料(纖維素/棉花)製成·膠囊有用於營養和廢物轉移的孔隙·孔隙太小,免疫系統細胞無法進入或包裹活細胞離開膠囊·封裝的活細胞可以長期冷凍(5年以上),當細胞解凍後,它們可以恢復約80%的存活率·物流可管理,保質期長·其他活細胞封裝技術使用海藻酸鹽等物質所有這些都遠沒有那麼穩健和穩定。都不能被冷凍以運輸封裝的活細胞7
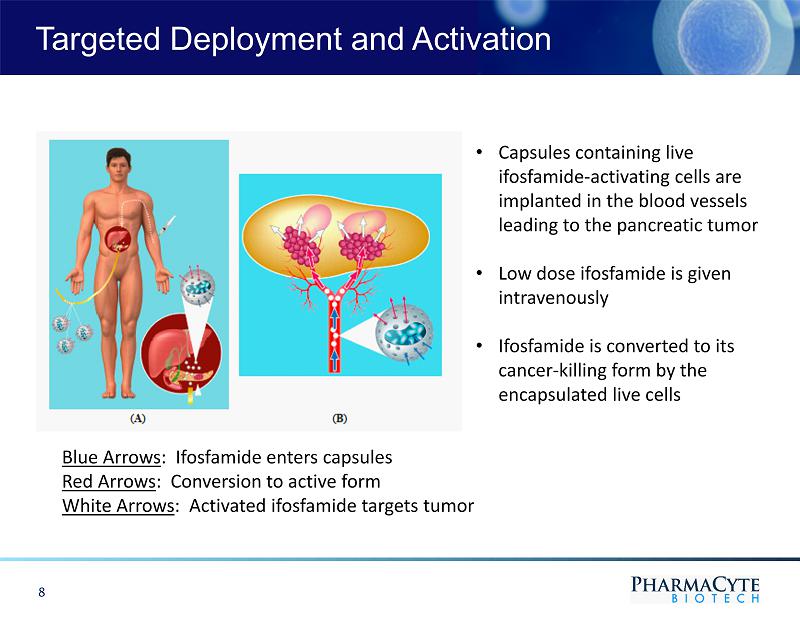
靶向部署和激活8·含有異環磷酰胺激活細胞的膠囊植入導致胰腺腫瘤的血管·靜脈注射低劑量異環磷酰胺·異環磷酰胺被包裹的活細胞轉化為殺癌形式藍色箭頭:異環磷酰胺進入膠囊紅色箭頭:轉化為活性形式白色箭頭:激活的異環磷酰胺靶向腫瘤
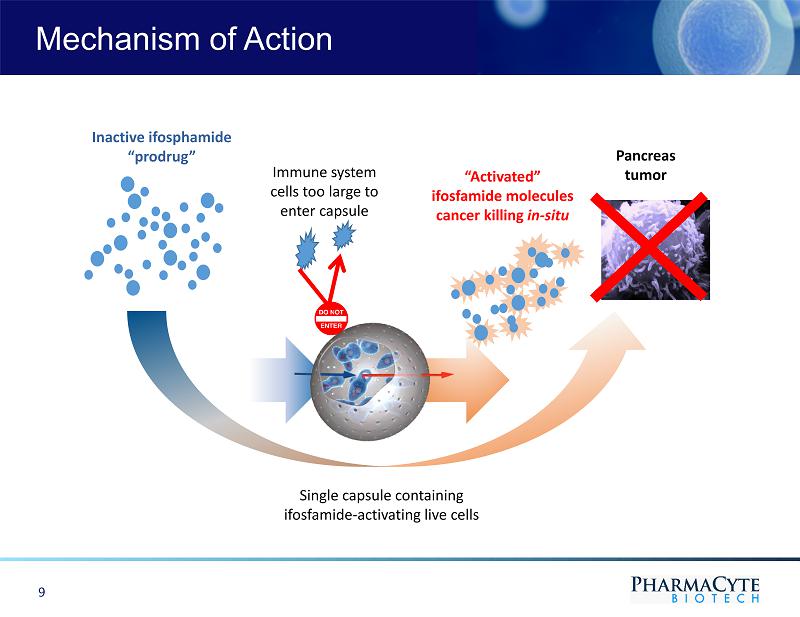
免疫系統細胞過大不能進入膠囊的作用機制含異環磷酰胺激活活細胞的單膠囊滅活異環磷酰胺前藥激活的異環磷酰胺分子對胰腺原位腫瘤的殺傷作用
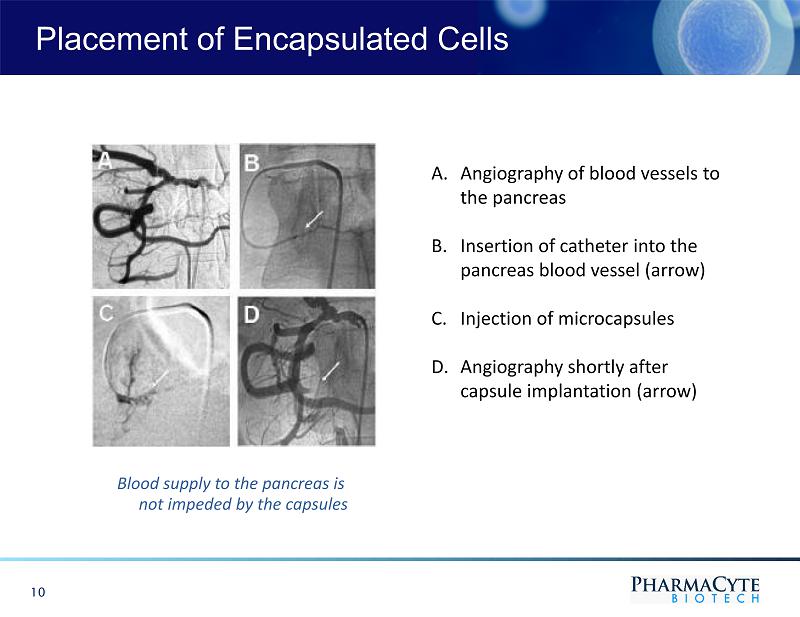
囊化細胞的放置10A.胰腺血管造影B.將導管插入胰腺血管(箭頭)C.注射微囊D.囊膜植入後不久的血管造影(箭頭)該膠囊不會阻礙胰腺的血液供應

胰腺癌計劃預後不良的侵襲性癌症·在大多數工業化國家呈上升趨勢·西方世界癌症相關死亡的第三大原因·預計2021年胰腺癌患者:美國>60,430人;48,480人死亡·約80%在確診第一年內死亡·4期胰腺癌的五年存活率約為3%·確診後10年的存活率約為2%·如果不接受治療,胰腺癌患者還有3-6個月的生命·通常在癌症晚期和無法手術之前不能確診·除非癌症晚期且無法手術,否則無法治癒只有15%是可手術的·自從1996年第一種藥物(吉西他濱)被批准用於胰腺癌以來,已經進行了大約40項關鍵的3期臨牀試驗·中位生存期和1年存活率幾乎沒有改善·吉西他濱聯合另一種化療藥物取得了最大的成功11

目前的一線療法Abraxane®+吉西他濱·2013年9月FDA批准的聯合療法·與單獨使用吉西他濱相比,中位生存期提高了1.8個月·一年存活率從使用吉西他濱的22%提高到38%·Abraxane®+吉西他濱治療的嚴重副作用FOLFIRINOX·4種藥物的組合-亞葉酸、5-氟尿嘧啶、伊立替康和奧沙利鉑·3期從未獲得市場批准·只能用於其他健康的患者·FOLFIRINOX療法的嚴重副作用12胰腺癌計劃(續)

13項胰腺癌1/2期臨牀試驗,使用兩個療程的低劑量異環磷酰胺(1998-1999)·14名患者僅接受兩個療程的異環磷酰胺治療,劑量為通常用於治療其他形式癌症的1/3(1g/m)·中位生存期:吉西他濱=5.7個月,Cat-in-a-Box®+異環磷酰胺=10個月·1年存活率:吉西他濱=18%,Cellin-in-a-a效果:吉西他濱=顯著VS-in-a-a-Box®+異環磷酰胺=無2期臨牀試驗,兩個療程的異環磷酰胺用量是異環磷酰胺的兩倍(1999-2000)·13名晚期、不能手術的胰腺癌是在單臂、多部位治療的(德國有3例[羅斯托克,柏林,慕尼黑],1在瑞士伯爾尼)研究。與1/2期試驗唯一不同的是,異環磷酰胺的劑量增加了一倍,達到2g/m2,以求獲得更好的抗腫瘤效果·將異環磷酰胺的劑量加倍並不會導致更大的抗腫瘤效果,但會導致與治療相關的副作用兩項臨牀試驗結果的總體比較·當與Cell-in-a-Box®膠囊聯合使用時,異環磷酰胺應以低劑量給予,以最大限度地發揮抗腫瘤作用並消除副作用
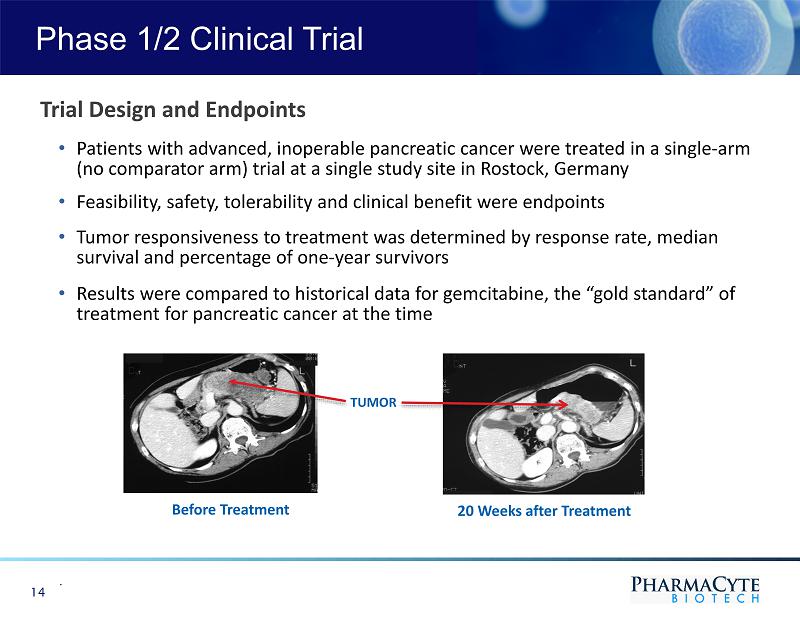
1/2期臨牀試驗。14個試驗設計和終點·晚期、不能手術的胰腺癌患者在德國羅斯托克的一個單一研究地點進行單臂(無對照手臂)試驗·可行性、安全性、耐受性和臨牀益處是終點·腫瘤對治療的反應性由應答率、中位生存期和一年存活率決定·結果與治療前20周治療胰腺癌的“金標準”吉西他濱的歷史數據進行比較

計劃中的胰腺癌臨牀試驗解決關鍵的未得到滿足的醫療需求·胰腺癌患者存在一個關鍵的未得到滿足的醫療需求,這些患者的腫瘤是局部晚期的,無法手術,但對Abraxane®+吉西他濱或FOLFIRINOX不再有效·一旦這些聯合療法不再有效,這些患者就沒有有效的治療選擇·這些患者最常用的兩種治療方法是5-氟尿嘧啶(5-FU)或卡培他濱(5-FU的前體藥物)化療+放療或單獨放療臨牀試驗表明,PharmaCyte的胰腺癌候選產品可以作為Abraxane®+吉西他濱或FOLFIRINOX的“鞏固療法”,並解決這些胰腺癌患者未得到滿足的醫療需求15

臨牀試驗設計要點·設計:試驗將是雙臂的·地點:試驗將在美國進行·目標:試驗旨在證明Cell-in-a-Box®+小劑量異環磷酰胺可以作為一種有效而安全的鞏固化療,用於治療4-6個月後對Abraxane®+吉西他濱或FOLFIRINOX無效的腫瘤患者·CRO管理:試驗將由Medpace在美國進行·CRO職責:臨牀開發計劃、計劃臨牀管理和數據庫開發·放射科醫生職責:協調植入Cell-in-a-Box®膠囊和CT掃描測量的所有抗腫瘤療效16

臨牀試驗設計(續)·開始日期:試驗預計將於2022年第三季度開始,條件是FDA及時取消臨牀暫停·資格:只有腫瘤局部晚期、無法手術和未轉移的患者才有資格入選。患者必須用Abraxane®+吉西他濱或FOLFORINOX治療4-6個月,直到他們的腫瘤對這種療法不再有反應為止·隨機:100名患者將被隨機分成兩組。50名患者將接受PharmaCyte的胰腺癌候選產品治療。另外50名患者將接受卡培他濱+體外放射治療(EBRT)或單獨接受立體定向全身放射治療(SBRT)·PharmaCyte治療組:接受PharmaCyte治療的每個患者將接受一次300 Cell-in-a-Box®膠囊植入+多個療程的低劑量異環磷酰胺,直到患者變得難治或出現不可接受的毒性水平·主要終點:從隨機到疾病進展或死亡的無進展生存率17

·次要終點:o根據從隨機化到因任何原因死亡的時間來評估總體存活率o客觀應答率根據完全緩解和部分緩解的綜合發生率來評估o從隨機狀態下不能手術轉變為可手術治療的患者的比例來評估治療後轉變為可切除疾病的比例o CA19-9生物標記物水平從篩查/基線到疼痛和疼痛治療開始的時間的變化o在接受PharmaCyte治療期間對患者的總體生活質量進行評估o將對整體安全性進行評估體檢和臨牀實驗室檢查結果18項臨牀試驗設計(續)

試驗設計腫瘤學家帶領專家開發治療胰腺癌的療法19丹尼爾·D·馮·霍夫博士曼努埃爾·伊達爾戈博士馬蒂亞斯·洛爾博士

試驗設計腫瘤學家(續)20丹尼爾·馮·霍夫博士·治療胰腺癌藥物開發的世界領先腫瘤學家·參與200多種抗癌和生物藥物的臨牀試驗·對過去20年美國批准的大多數抗癌藥物進行早期臨牀試驗·密切參與胰腺癌吉西他濱和阿布拉沙尼的臨牀開發·眾多腫瘤學期刊的編輯;癌症相關活動的多項獲獎獲得者·蘇格蘭梅奧診所醫學教授, 翻譯基因組研究所(TGen)主任醫師兼傑出教授兼翻譯藥物開發首席開發官曼努埃爾·伊達爾戈博士·國際知名的胰腺和其他癌症腫瘤學家和臨牀研究員·國際胰腺癌研究團隊的聯合創始人和主席·協助開發了30多種新型腫瘤學藥物;幾名胰腺癌患者·馬德里西班牙國家癌症研究中心前臨牀開發主管,約翰·霍普金斯大學藥物開發和胃腸腫瘤學聯合董事·羅森伯格臨牀癌症中心前臨牀董事主任,波士頓貝絲以色列女執事醫學中心血液腫瘤科主任·血液和內科腫瘤科主任/威爾康奈爾醫學和紐約長老會/威爾康奈爾醫學中心馬蒂亞斯·洛爾博士Cellin-in-a-Box®技術·PharmaCyte胰腺癌治療先前臨牀試驗的首席研究員·PharmaCyte醫學和科學顧問委員會主席·現任瑞典著名的卡羅林斯卡研究所胃腸病和肝病學教授

製造能力和試驗準備21製造能力·GMP設施成功審核,並被認為已準備好生產名為“CypCapsΡ”的臨牀試驗候選產品·成功完成兩次錯開和背靠背的臨牀試驗候選產品生產·FDA要求“釋放測試”完成並通過CypCapsΡ的測試·3、6、9、12、18個月和24個月的時間點·CypCapsΡ預計在需要試驗準備時進入美國·與美國食品和藥物管理局舉行IND前會議(2017年1月)·FDA確定了許多需要進行的測試和需要開發的數據,以支持成功提交IND·在ASCO年會上與美國/歐盟調查人員會面,完善試驗設計·曼努埃爾·伊達爾戈博士被選為臨牀試驗的首席研究員

試驗準備(續)22項試驗準備·方案和研究人員手冊,以美國食品和藥物管理局的意見為準·保留實用臨牀作為臨牀操作的董事·Medpace被選為臨牀研究總監進行試驗。MedPace是全球排名前十的CRO之一,是一家提供全方位服務的CRO,在許多治療領域擁有專業知識,專注於支持生物技術行業-特別是胰腺癌·血管造影指南編寫·藥房手冊編寫·臨牀藥品供應標籤(注射器)準備·指定藥品供應鏈和CypCapsΡ儲存供應商

IND提交給FDA·IND於2020年9月1日向FDA提交,開始局部晚期和不能手術的胰腺癌(LAPC)的2b期臨牀試驗·2020年10月1日,收到FDA已暫停IND臨牀試驗的通知·2020年10月30日,FDA致函PharmaCyte説明瞭臨牀擱置的原因,並就PharmaCyte必須做什麼才能解除臨牀擱置提供了具體指導·附錄A列出了PharmaCyte必須完成的解除臨牀擱置的項目列表·組建了一個科學和監管專家團隊來回應FDA的意見·團隊正在努力完成FDA要求PharmaCyte的項目清單。在處理這些研究和獲取FDA要求的信息的不同階段。PharmaCyte的工作總結載於附錄A研究新藥申請23

FDA批准胰腺癌治療的孤兒藥物名稱·在FDA批准後在美國提供7年的市場獨家經營權·EMA批准胰腺癌治療的孤兒藥物指定在歐盟提供10年的市場獨家經營權·有資格獲得生物製品價格競爭和創新法案·在FDA批准後在美國提供12年的市場獨家經營權。歐盟的類似法律提供市場獨佔性IP組合和IP保護戰略·在美國、澳大利亞和加拿大提交的專利申請,以保護將癌症前體藥物轉化為患者羣體的基因工程細胞·使用封裝的轉基因人類細胞治療癌症和糖尿病的獨家許可證·專利保護Melligen細胞·預計將為每個候選產品申請後續專利·封裝過程使用獨特的受專利保護的硫酸纖維素·商業祕密和技術訣竅孤兒藥物狀態和IP組合24

25惡性腹水計劃靶向化療治療惡性腹水·惡性腹水是由腹部腫瘤分泌到腹部的·含有可在整個腹部種植並形成新腫瘤的癌細胞·在腹腔內積聚導致腹部腫脹、嚴重呼吸困難和極度疼痛·必須定期切除-疼痛和昂貴·沒有可用的治療方法阻止或延緩惡性腹水的產生和積聚·轉化性藥物開發進行了7項臨牀前研究,以確定PharmaCyte的癌症療法是否可以延緩惡性腹水的產生和積聚PharmaCyte計劃在德國進行另一項臨牀前研究,以確定PharmaCyte的癌症療法是否可以延緩惡性腹水的產生和積累·如果成功,PharmaCyte計劃尋求FDA的批准,在美國進行一項第一階段研究。

生物人工胰腺治療糖尿病·PharmaCyte的糖尿病計劃包括封裝基因工程活細胞(Melligen細胞和幹細胞),根據患者的血糖水平產生胰島素,然後將膠囊植入體內,治療1型糖尿病和胰島素依賴型2型糖尿病·Cell-in-a-Box®膠囊保護細胞免受體內免疫系統的攻擊,從而發揮“生物人工胰腺”的作用,為糖尿病患者製造胰島素利用Melligen胰島素分泌細胞治療糖尿病。Melligen細胞是人類肝臟細胞,通過基因工程產生,Melligen細胞對體內葡萄糖濃度的反應儲存和釋放胰島素已經證明有能力逆轉免疫抑制的糖尿病小鼠的糖尿病狀況糖尿病計劃26

O在過去,PharmaCyte的國際糖尿病聯盟遇到了與Melligen細胞的穩定性有關的困難。PharmaCyte隨後花了兩年時間重建穩定版本的Melligen細胞·UTS與PharmaCyte達成協議,創建新的、穩定的高級版本的Melligen細胞。這項研究還在進行中·還將進行改進以增加Melligen細胞的胰島素產生和產生的胰島素的生物活性·\27糖尿病計劃(CONT‘D)糖尿病生物人工胰腺(CONT’D)

開發時間表加快·PharmaCyte成立了一個由世界知名醫生和科學家組成的國際糖尿病聯盟,專門治療糖尿病和胰腺疾病。瑞典斯德哥爾摩卡羅林斯卡研究所;德國海德堡大學;澳大利亞悉尼理工大學;奧地利維也納獸醫大學;西班牙巴塞羅那大學;德國慕尼黑路德維希-馬克西米利安大學;丹麥哥本哈根大學;和奧地利,新加坡·國際糖尿病聯盟的成員在多個研究軌道上對Melligen細胞進行了臨牀前研究,以加快臨牀試驗的時間表·國際糖尿病聯盟計劃進行進一步的研究28

29大麻計劃*大麻素的抗癌作用·大麻素的特性(THC和CBD):o抗增殖:緩慢的腫瘤生長o抗轉移:緩慢的腫瘤擴散o抗血管生成:緩慢的血管穿透o促凋亡:啟動程序性細胞死亡·體外和體內模型·大麻的抗癌作用廣泛:o肺、腦、甲狀腺、淋巴瘤、肝、皮膚、胰腺、子宮、乳腺和前列腺·51項研究綜述:“由於大麻類化合物能夠調節對細胞生長和存活至關重要的細胞信號通路,因此可能對癌症的治療有用。“*直到:(I)FDA允許我們在我們的IND中描述的LAPC中開始臨牀試驗,FDA已經對其進行了臨牀擱置;以及(Ii)我們在計劃中的LAPC第二階段b臨牀試驗中驗證了Cell-in-a-Box®封裝技術,在此之前,我們不會花費任何進一步的資源來開發該計劃。

30大麻計劃(續)*大麻衍生的大麻素“前藥”生物工程細胞系由盒中細胞®包裹,產生活化酶靶向治療“活性”大麻素靶向治療癌細胞死亡靶向大麻素化療·PharmaCyte擁有獨一無二的全球許可將Cell-in-a-Box®技術與基因工程活細胞相結合,旨在激活大麻素分子用於治療疾病及其相關症狀·初始目標膠質母細胞瘤(腦癌)-一種難以治療的癌症+=*直到:(I)FDA允許我們在IND中描述的LAPC中開始臨牀試驗,FDA已對其進行臨牀擱置;並且(Ii)我們在LAPC計劃的2b期臨牀試驗中驗證了Cell-in-a-Box®封裝技術,我們不會再花費任何資源來開發此程序。

與北科羅拉多大學的研究計劃·最初的目標是開發鑑定、分離和定量大麻成分的方法,這些成分是需要激活的前體藥物。大麻方案“這方面的重點是:o確認大麻素的抗癌活性;o開發一種能夠將失活的大麻素前體藥物轉化為其殺癌形式的細胞。北科羅拉多大學現在已經對這樣的細胞進行了基因工程·測試轉基因細胞將大麻素前體藥物轉化為活性殺癌形式的效率·基於大麻素的靶向化療將通過在腫瘤部位附近植入生物工程細胞並同時給予大麻素前體藥物31*來完成,直到:(I)FDA允許我們在IND中描述的LAPC中開始一項臨牀試驗,FDA已經對該試驗進行了臨牀擱置;以及(Ii)我們驗證了該細胞的有效性:(I)FDA允許我們在IND中描述的LAPC中開始一項臨牀試驗,FDA已經對該試驗進行了臨牀擱置;以及(Ii)我們驗證了該細胞:(I)FDA允許我們在我們的IND中描述的LAPC中開始臨牀試驗,FDA已經對該試驗進行了臨牀擱置大麻計劃(續)*

疼痛療法的發展·慢性疼痛與行動受限、阿片類藥物依賴、焦慮、抑鬱和生活質量下降有關·美國每年估計有5600億美元的直接成本、生產力損失和殘疾計劃·大麻計劃的其他目標是利用Cell-in-a-Box®平臺提供大麻類終端產品,以提供慢性疼痛緩解32*直到:(I)FDA允許我們在IND中描述的LAPC開始臨牀試驗,FDA已對其進行臨牀擱置;並且(Ii)我們在LAPC計劃的2b期臨牀試驗中驗證了Cell-in-a-Box®封裝技術,我們不會再花費任何資源來開發此程序。大麻計劃(續)*

肯尼斯·L·瓦格納,JD-首席執行官、總裁兼總法律顧問·在法律、管理、運營和商業方面擁有40多年的經驗·Brobeck,Phleger and Harrison律師事務所的高級合夥人,該律師事務所是全球頂級律師事務所之一,為Chron、Amgen、Biogen和IDEC等生物技術客户提供服務·傑拉爾德·W·克拉布特裏(Gerald W.Crabtree)職業生涯的大部分時間代表着財富100強公司,博士-首席科學官·在癌症研究和抗癌藥物開發的所有階段有50多年的經驗·特別是在抗癌藥物的臨牀前研究和臨牀試驗方面經驗豐富·領導紫杉醇-百時美施貴寶(Bristol-Myers Squibb)價值數十億美元的藥物的臨牀前開發·JoséL.Iglesias博士-胰腺癌臨牀試驗的首席醫療官·在禮來公司(Eli Lilly)、安進公司(Amgen)、阿布拉西斯公司(Abraxis)和Celgene公司擔任職務·曾擔任Celgene公司臨牀開發全球副總裁

卡洛斯·特魯希略,註冊會計師-首席財務官·在財務、會計和管理方面有36年的經驗·在過去的13年裏,他一直擔任私人持股、上市和跨國公司的首席財務官34領導團隊(續)

醫學和科學諮詢委員會馬蒂亞斯·洛爾博士(主席)·瑞典斯德哥爾摩卡羅林斯卡研究所世界知名的歐洲腫瘤學家/胃腸病學家。治療胰腺癌和糖尿病的專家·曾擔任PharmaCyte胰腺癌療法1/2期和2期臨牀試驗的首席研究員Manuel Hidalgo博士·國際知名的腫瘤學家和胰腺及其他癌症的臨牀研究員·國際胰腺癌研究團隊的聯合創始人和主席·協助開發30多種新型腫瘤學藥物·威爾·康奈爾醫學和紐約長老會醫院血液和內科腫瘤科主任/博士·Cell-in-a-Box®活細胞封裝技術的共同發明者·奧地利公司總裁兼首席執行官·成就卓著的科學家,在35種科學期刊上發表了120多篇論文

Mark L.Rabe博士·使用大麻治療疾病及其症狀的領導者·曾擔任加州最大的醫生擁有的大麻評估中心網絡的首席醫療官David A.Judd·在大島生物公司工作了30多年的細胞生物學家,在我們胰腺癌治療中使用的細胞系具有特殊的專業知識·在細胞培養基中培養難以生長的細胞和解決細胞生長問題方面有數十年的經驗36醫學和科學顧問委員會(CONT)

美國食品和藥物管理局指導解除臨牀擱置·提供更多測序數據和遺傳穩定性研究·對最終配方的候選產品以及PharmaCyte主細胞庫的細胞進行穩定性研究·評估輸送裝置(用於植入CypCapsΡ的預填充注射器和微導管)與PharmaCyte候選產品的兼容性·提供更多詳細説明PharmaCyte候選產品的製造過程·提供PharmaCyte封裝活細胞的更多釋放規格·證明可比性兩代候選產品之間具有一致的產品性能和安全性·使用最終成品膠囊但沒有活細胞進行生物兼容性評估·解決化學方面的不足,交叉引用的藥品主文件中的生產和控制信息·在大型動物(如豬)中進行額外的非臨牀研究,以評估候選產品的安全性、活性和分佈·修訂研究人員手冊,以包括針對臨牀持有而進行的臨牀前研究,並刪除數據附錄A37不支持的任何陳述

FDA要求PharmaCyte解決以下問題作為IND修正案?提供PC3/2B1質粒的分析證書,其中包括評估純度的測試,安全性和效力·對CypCapsΡ灌裝過程進行資格研究,以確保候選產品在該過程中保持無菌和穩定·提交特定批次候選產品的最新批次分析,該批次將用於未來所有候選產品的生產·提供有關Resufin(CYP2B1)效力和PrestoBlue代謝分析方法的更多詳細信息·提供幾個符合PharmaCyte血管造影程序手冊規範的常見微導管的例子·澄清“藥房手冊”中有關正確使用的語言針對CYP2B1蛋白的動物研究和在我們的試驗人羣中誘導自身免疫介導的毒性的可能性38附錄A(續)

負責FDA要求的科學和監管專家團隊PharmaCyte組建了一個科學和監管專家團隊來滿足FDA的要求。PharmaCyte正在努力完成FDA要求的項目,並取得了以下進展:·IND團隊增加了更多的監管專業知識。除了現有的專家團隊外,該公司還聘請了生物製品諮詢公司進行監管“差距分析”,並協助公司提交IND。生物製品諮詢公司是一家為生物製品、藥品和醫療器械提供全方位服務的監管和產品開發諮詢公司,擁有豐富的FDA經驗·PharmaCyte的臨牀試驗產品穩定性研究。PharmaCyte現在已經成功地完成了候選產品在-80C下冷凍3、6、9、12、18和24個月後的產品穩定性研究,包括特定時間點的容器封閉完整性測試·FDA要求的其他研究。根據食品和藥物管理局的要求,PharmaCyte已經設計並開始了各種額外的研究,包括對用於製造CypCapsΡ的MCB中的細胞進行的穩定性研究。PharmaCyte的MCB細胞已經處於3年穩定時間點。PharmaCyte公司還在整理現有信息,這些信息涉及將細胞填充到瓶子中的重複性和質量,為CypCapsΡ製造做好準備。39附錄A(續)

·細胞色素P450 2B1基因的精確序列測定。PharmaCyte公司已經使用最先進的納米孔測序技術完成了插入在9號染色體上先前確定的位置的細胞色素P450 2B1基因的精確序列的測定。納米孔測序是一種尖端的、獨特的和可擴展的技術,可以對長DNA片段進行實時分析。對序列數據的分析結果證實這些基因是完整的·進一步證實了細胞色素P450 2B1基因插入的準確序列。對擴增的HEK293細胞克隆的細胞色素P4502B1基因的整合位點進行了額外的、更詳細的分析,該克隆用於其CypCapsΡ產品,被發現是完整的。在這項新的研究中,PharmaCyte已經能夠使用更多的數據點來確認先前闡明的整合轉基因序列的結構。這些研究還為下一步的分析奠定了基礎,以確定細胞色素P4502B1基因在多輪細胞生長後在DNA水平上的遺傳穩定性。這項新的研究已經完成,將原始研究細胞庫(RCB)的細胞與MCB的細胞進行比較,分析證實細胞色素P4502B1及其周圍序列保持穩定,在DNA水平40附錄A(續)沒有檢測到變化。

·生物相容性研究。PharmaCyte已經設計並開始了8項生物相容性研究,其中6項已經成功完成。其餘兩項研究仍在進行中。這兩項研究分別是空白硫酸纖維素膠囊對小鼠的急性全身毒性試驗和豚鼠對空白硫酸纖維素膠囊的皮膚致敏試驗。為了能夠進行這些研究,奧地利製造了另外400個空膠囊注射器用於測試。正在產生的一些數據還將被用來證明與CypCapsΡ的可比性,該CypCaps DNA在早先的兩次胰腺癌臨牀試驗中成功使用,即微壓縮和腫脹測試。該項目正在開發和優化兩種可重複使用的方法,用於測試和確認CypCapsΡ候選產品的物理穩定性和完整性。這些研究需要奧地拉諾瓦公司採購新設備,並驗證並整合到奧地亞諾瓦公司的質量控制實驗室·破碎力(Break Force)和滑動測試(Glide Testing)中。該公司正在制定一項協議,以測量在用於排出膠囊時與導管相連的注射器是否仍具有符合公司已制定的規格的破裂和滑動力。本公司將根據注射器/柱塞製造商測量的斷裂和滑動力,或者根據診所常規使用的滑動力的可接受範圍41附錄A(續)制定本規範。

·CypCaps膠囊與注射器和微導管輸送系統的其他部件兼容。PharmaCyte公司已經開始了旨在證明CypCapsΡ不會受到介入放射科醫生用來將其送入患者體內的導管的任何不利影響的研究。目前正在生成兼容性數據,以證明CypCapsΡ在通過計劃中的微導管系統·CypCaps膠囊後保持質量,並在暴露於放射造影劑後保持細胞活力。PharmaCyte公司設計並啟動了一個項目,以測試CypCapsΡ與兩種常規使用的造影劑的接觸效果,介入放射科醫生用這兩種造影劑將CypCapsΡ植入患者體內。造影劑用於顯示植入CypCapsΡ·藥物主文件信息期間的血管。Audianova正在向FDA提供有關製造過程的額外詳細機密信息,包括自上一次臨牀試驗在重複性和安全性方面進行以來對候選產品進行的改進和進步的信息。然而,奧地利並沒有改變CypCapsΡ的整體物理特性。PharmaCyte在財政上支持奧地利的這項工作42附錄A(續)

·FDA要求的其他文件。該公司正在更新其IND提交文件,包括擴大其LAPC·PIG研究治療的免疫學方面的討論。最後,該公司設計了一項在豬身上的研究,以解決其CypCapsΡ的生物相容性和長期植入和分散問題。我們相信,這項動物研究將補充先前人類臨牀試驗中已有的陽性數據,這些數據表明CypCapsΡ植入人類患者是安全的43附錄A(續)

如需更多信息,請聯繫投資者關係部InvestorRelations@PharmaCyte.com謝謝投資者關係部44