附件99.1

UniQure宣佈2021年財務業績和 重點介紹公司最近的進展
~血友病最大基因療法研究的數據 B顯示18個月後持續的治療效果,與基線相比,在降低年出血率方面具有統計學優勢 FIX預防療法;2022年上半年提交的營銷申請進入正軌~
~正在進行的美國亨廷頓病I/II期臨牀試驗的前4名患者的數據顯示,AMT-130耐受性良好,沒有觀察到明顯的安全性問題 ~
~來自美國AMT-130 I/II期低劑量隊列所有患者的更多臨牀數據 ,包括mHTT和NFL生物標誌物,預計將於2022年第二季度公佈 ~
~開始招募歐洲Ib/II期AMT-130研究 前兩名患者服藥~
~2022年難治性顳葉癲癇和Fabry 項目進入IND研究~
~2021年底財務狀況強勁,現金為5.56億美元~
馬薩諸塞州列剋星敦和荷蘭阿姆斯特丹(2022年2月25日)-為有嚴重醫療需求的患者推進變革性療法的領先基因治療公司UnQure N.V.(納斯達克:QURE)今天公佈了2021年的財務業績,並重點介紹了其業務的最新進展。
“2021年,我們在所有戰略要務方面都取得了巨大進展,包括推進我們的臨牀階段計劃,擴大我們的研究渠道,並準備 提交計劃於2021年提交的營銷申請。第四紀去扎帕沃韋斯2022年上半年,“uniQure首席執行官馬特·卡普斯塔(Matt Kapusta)説。“有了HOPE-B關鍵研究的積極數據,我們期待着與我們的合作伙伴CSL Behring密切合作,為血友病B患者帶來這種可能改變生命的基因療法。”
在2022年期間,我們還密切關注 保持我們的強勁勢頭,登記兩項正在進行的亨廷頓病I/II期研究。重要的是,我們期待着 在2022年第二季度分享來自低劑量隊列中所有10名患者的更多安全性和生物標記物數據,包括突變HTT蛋白(MHTT)和神經絲輕鏈(NFL)。我們還準備將我們針對Fabry病和難治性顳葉癲癇的候選基因治療產品推進到IND毒理學研究中,我們預計今年將推出至少兩個針對肝臟和中樞神經系統的新基因治療計劃。隨着我們繼續推進和擴大我們的流水線, 我們還通過在阿姆斯特丹的第二個cGMP工廠擴大我們的製造足跡,我們預計該工廠將於2022年上線。“
近期主要成就
| • | 推進第四紀去扎帕沃維克的後期發展 (AMT-061) for the treatment of hemophilia B |
| • | 2021年12月,該公司和CSL Behring宣佈,在對重度和中度血友病B患者進行的ETRAACGENE dezparvovec的HOPE-B關鍵試驗中,獲得了主要和次要終點。與基線 因子IX(FIX)預防治療相比,服藥18個月後的年出血率(ABR)達到了非劣勢的主要終點 ,作為ABR的次要優勢終點 。 |
| • | HOPE-B試驗的數據 表明第四紀去扎帕沃韋斯輸注後6個月的平均FIX活性為正常的39.0%,18個月時為正常的36.9% 。在輸液後6個月的引導期後,所有出血的調整後年化出血率(1.51)降低了64%(p=0.0002),所有固定治療的出血量減少了77%(3.6 5%至0.83;Petranacogene dezparvovec 停止使用預防措施,每位參與者的平均未調整 年化FIX消費量總體減少了97%,從257,338.8 IU/年降至8,486.6 IU/年(從 導入期降至13-18個月)。穩定固定表達後所有出血的ABR值在18個月時評估為1.5,而導入期至少6個月的ABR值為4.19%(p=0.0002)。調查員裁決的FIX治療出血的ABR為0.83,而導入ABR為3.65(p |
| • | 公司和CSL Behring在準備營銷申請方面取得重大進展 第四紀的德扎帕沃韋克,預計將於2022年上半年由CSL Behring在美國和歐盟提交。作為這些努力的一部分, 該公司於2021年12月成功通過了其商業製造流程的認證。 |
| • | 推進AMT-130治療亨廷頓病的臨牀研究進展 |
| • | 2021年12月,在AMT-130的美國I/II期雙盲隨機研究的 低劑量隊列中,宣佈了對前4名患者的初步觀察結果。AMT-130 總體耐受性良好,沒有與AMT-130相關的嚴重不良反應。在接受AMT-130手術後,NFL如預期的那樣立即增加了 ,並在兩名接受治療的患者中恢復到基線 。在兩名未經治療的對照組患者中,NFL保持相對穩定。在一年的隨訪中,結構磁共振成像沒有顯示任何臨牀上有意義的安全性發現,無論是治療組還是對照組患者。 |
| • | 在 2022年第二季度,該公司預計將提供低劑量隊列中所有10名患者的臨牀最新信息,包括安全性、mHTT和NFL生物標誌物數據。在兩個劑量隊列中的所有患者 都解盲後,容積MRI和 功能數據預計在2023年上半年可用。 |
| • | 患者 預計將於2022年下半年開始第三個隊列的登記,以探索 使用替代立體定向導航系統來簡化AMT-130輸液 導管的放置。該隊列計劃包括多達18名隨機患者, 其中約12人將接受較高劑量的6x1013 VG。 |
| • | 2022年2月,前兩名患者參加了AMT-130的歐洲開放標籤Ib/II期 研究。這項研究將招募15名早期表現為亨廷頓病的患者,其劑量與美國研究中探索的劑量相同。與正在進行的 美國研究一起,歐洲研究旨在確定AMT-130的安全性、概念驗證和 最佳劑量,以推進到第三階段開發,或進入驗證性的 研究(如果加速註冊路徑可行)。 |
| • | In total, 59 patients are expected to be enrolled in the U.S. and European Phase 1/II trials of AMT-130. |
| • | 將我們的研究渠道推向臨牀 |
| • | 難治性顳葉癲癇(TLE)-該公司預計在2022年下半年啟動一項針對非人類靈長類動物的GLP毒理學研究 ,預計將在2023年支持IND提交 。AMT-260採用miRNA沉默技術抑制TLE患者海馬中異常表達的Kainite 受體。TLE是一個巨大的未得到滿足的臨牀需求 僅在美國和歐洲就有大約130萬人受到影響,其中約80萬患者無法通過目前批准的 抗癲癇療法充分控制急性癲癇發作。 |
| • | Fabry disease-該公司預計在2022年年中啟動AMT-191的普洛斯毒理學研究,預計將支持2023年提交IND。AMT-191是一款 一次性給予AAV5基因治療,並整合α-半乳糖苷酶A(Gla)轉基因。在臨牀前研究中,AMT-191顯示了腎臟和心臟交叉校正的潛力,並有可能進入大腦。它 還提供了重新給藥的可能性,就像一項對非人類靈長類動物的研究所顯示的那樣。 |
| • | 公司以優先分配資源和加快我們的難治性TLE和Fabry病項目進入臨牀的目標為目標,剝奪了AMT-150治療脊髓小腦性共濟失調3型的臨牀前開發 。 |
| • | 擴展我們的製造能力 |
| • | 公司最近完成了阿姆斯特丹工廠的擴建,為新的研發活動提供了額外的實驗室 ,並建造了一個專為生產500升cGMP材料而設計的潔淨室 。此擴展現在可提高產品開發的速度和敏捷性 。 |
| • | 強大的 現金狀況以推進公司的計劃 |
| • | 截至2021年12月31日,該公司的現金和現金等價物為5.563億美元。 公司預計其現金和現金等價物將足以為2025年上半年的運營提供資金 假設BLA和MAA提交以及 CSL Behring協議下的首批商業銷售里程碑實現。 |
即將舉行的投資者活動(每個活動都將以虛擬方式進行 )
| • | Cowen 42發送年度醫療保健會議,2022年3月7日至9日 |
| • | Stifel 2022 CNS Days, March 28-29, 2022 |
| • | 古根海姆 基因組藥物和罕見病日,2022年3月31日和4月1日 |
財務亮點
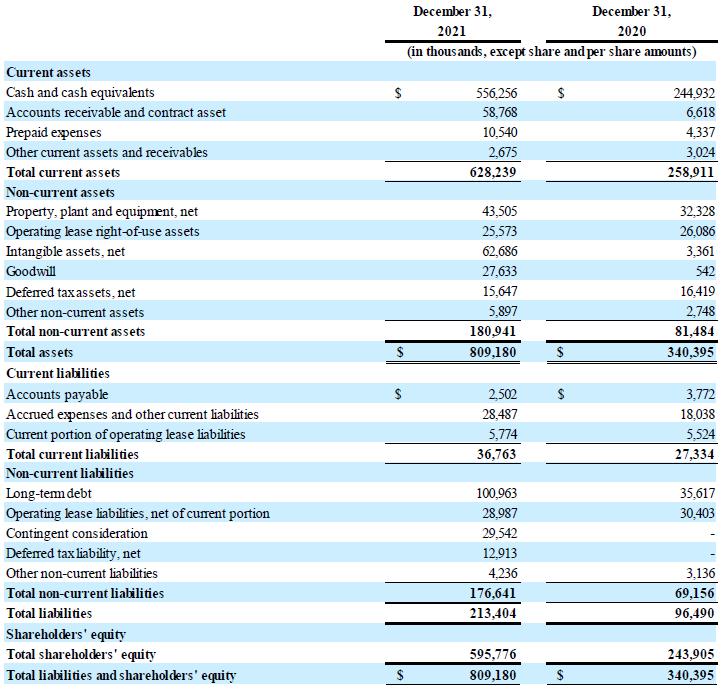
現金狀況:截至2021年12月31日,公司持有的現金和現金等價物為5.563億美元,而截至2020年12月31日的現金及現金等價物為2.449億美元。CSL Behring協議於2021年5月6日全面生效後,公司收到了4.624億美元的付款。2021年1月和 12月,本公司和Hercules修訂了債務融資協議,根據該協議,本公司於2021年1月額外提取了3500萬美元 ,並進一步提取了3000萬美元,截至2021年12月31日,該融資項下的未償還債務總額為1.0億美元 。該公司還將到期日從2023年6月延長至2025年12月。2021年3月和4月,公司 根據與SVB Leerink LLC的公開市場銷售協議,出售了921,730股普通股,總收益約為2960萬美元。 2021年7月,公司支付了與收購Corlieve相關的淨額4210萬歐元(4990萬美元)。
收入:截至2021年12月31日的年度收入為5.24億美元,而2020年同期為3750萬美元。這一增長是由於CSL Behring交易於2021年5月完成時確認的4.624億美元許可收入,以及與CSL Behring在2022年上半年提交生物製品許可申請(“BLA”) 和市場授權申請(“MAA”)後公司預計將收取的里程碑式付款相關的5500萬美元許可收入。在2020年,公司確認了 2780萬美元的非現金許可收入,截至2020年12月1日,也就是修訂後的百時美施貴寶合作和許可協議的生效日期,以及在實現四個合作目標中的一個 的研究里程碑後,於2020年12月確認的收入為440萬美元。
研發費用:截至2021年12月31日的一年,研發費用為1.435億美元,而2020年同期為1.224億美元。 變化主要涉及招聘人員以支持候選產品的開發、推進公司亨廷頓病基因治療計劃的臨牀開發 以及增加與臨牀前產品 候選產品相關的活動,以及增加與因收購Corlieve而記錄的或有對價負債相關的公允價值變化。
SG&A費用:截至2021年12月31日的一年中,銷售、一般和 管理費用為5630萬美元,而2020年同期為4260萬美元 。這一變化主要與人員招聘、基於股份的薪酬支出增加以及與CSL Behring的許可交易有關的 財務諮詢付款有關。
其他收入淨額:截至2021年12月31日的一年,其他收入淨額為1,140萬美元,而2020年同期其他收入淨額為200萬美元。 其他收入淨額的增加主要與根據美國CARE法案收到的員工留用積分收入有關, 與歐洲當局為補貼荷蘭研發工作而支付的款項有關,以及與公司與Vectory B.V.在4月份簽訂的和解協議有關的收入 。 其他收入淨額為1,140萬美元,而2020年同期其他收入淨額為200萬美元。 其他收入淨額的增加主要與根據美國CARE法案收到的員工留用積分收入有關, 與公司與Vectory B.V.在4月份達成的和解協議有關
其他非經營性項目,淨額:
其他營業外收入,截至2021年12月31日的年度淨收入為2220萬美元,而2020年同期其他營業外虧損為1600萬美元。其他營業外收入的增長主要與本期淨外幣收益有關,而與2020年同期的淨外幣虧損 相比。
淨收入:
截至2021年12月31日的年度淨收益為3.296億美元,或每股普通股基本淨收入7.17美元,每股稀釋後淨收入7.04美元,而2020年同期虧損1.25億美元,或每股普通股基本和稀釋後虧損2.81美元。
關於uniQure
UnQure正在兑現基因 療法的承諾--一種具有潛在療效的單一療法。我們正在利用我們模塊化和經驗證的技術平臺 快速推進一系列專利基因療法,用於治療血友病B、亨廷頓病、難治性顳葉癲癇、Fabry病和其他疾病。Www.uniQure.com
UnQure前瞻性陳述
本新聞稿包含前瞻性 陳述。除歷史事實陳述外,其他所有陳述均為前瞻性陳述,通常用術語 表示,如“預期”、“相信”、“可能”、“估計”、“預期”、“目標”、“打算”、“期待”、“可能”、“計劃”、“潛在”、“預測”、“項目”、“應該”、“ ”、“將會”和類似的表達方式。前瞻性陳述基於管理層的信念和假設 以及截至本新聞稿發佈之日管理層才能獲得的信息。這些前瞻性聲明包括,但不限於,我們是否會將etranacogene dezparvovec帶給患者,我們是否會分享突變的htt蛋白(Mhtt)和神經細絲輕鏈(Nfl)或來自我們的amt-130臨牀試驗中任何患者的其他安全和生物標誌物數據,在2022年第二季度, 2023年上半年或以後,我們是否能夠推進我們的Fabry病基因治療候選產品。無論我們是否會在年內啟動任何針對肝臟或中樞神經系統的新基因治療計劃,我們在阿姆斯特丹的第二個cGMP設施是否會在2022年或永遠上線,無論etranacogene dezparvovec的營銷申請 是否會在2022年上半年或永遠在美國或歐盟提交。由於許多原因,公司的實際結果可能與這些前瞻性聲明中預期的結果大不相同,包括但不限於,與持續的新冠肺炎疫情對我們公司和更廣泛的經濟和醫療體系的影響相關的風險, 我們與CSL Behring的商業化和許可協議,我們的臨牀開發活動,臨牀結果,合作安排, 監管監督, 產品商業化和知識產權索賠,以及公司定期證券申報文件(包括2022年2月25日提交的Form 10-K年度報告)中“風險因素”項下描述的風險、不確定性和其他因素 。鑑於這些風險、不確定性和其他因素,您不應過度依賴這些前瞻性陳述 ,即使未來有新信息 ,公司也不承擔更新這些前瞻性陳述的義務。
UniQure聯繫人:
| 對於投資者來説: | FOR MEDIA: | |
| 瑪麗亞·E·坎託 | 基亞拉·魯索 | Tom Malone |
| Direct: 339-970-7536 | Direct: 617-306-9137 | Direct: 339-970-7558 |
| Mobile: 617-680-9452 | Mobile: 617-306-9137 | Mobile:339-223-8541 |
| 郵箱:m.cantor@uniQure.com | 郵箱:c.russo@uniQure.com | 郵箱:t.malone@uniQure.com |
UnQure N.V.
未經審計的綜合資產負債表
UnQure N.V.
未經審計的合併經營報表