再被許可人對被許可的專利提出挑戰。此外,我們和Bioprojet有權在對方破產時終止Bioprojet許可協議。
知識產權
知識產權,包括專利、商業祕密、商標和版權,對我們的業務非常重要。我們的商業成功在一定程度上取決於我們是否有能力為我們的WAKIX產品和未來潛在的基於瀝青劑的產品,以及未來的候選產品和新發現、產品開發技術和專有技術獲得和維護專有知識產權保護。我們的商業成功在一定程度上還取決於我們在不侵犯他人財產權的情況下運營的能力,以及防止他人侵犯我們的財產權的能力。我們的政策是通過許可或提交與我們的技術、發明和改進相關的美國和外國專利和申請(這些對我們業務的發展和實施非常重要),來發展和保持對我們的專有地位的保護。
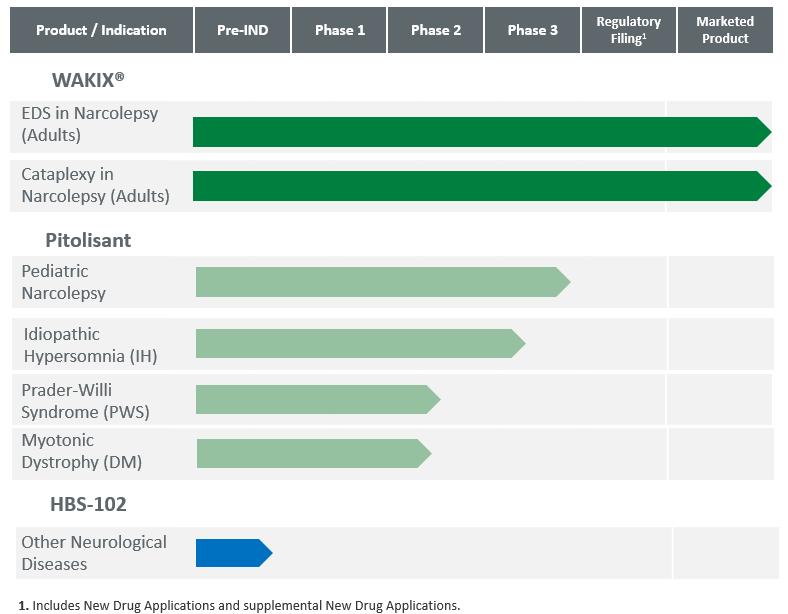
我們的WAKIX專利組合由Bioprojet獨家授權給我們的三項美國專利組成。一項美國專利No.8,207,197要求保護垂體油劑的一種多晶型,即一種特定的結晶形式,以及製備該多晶型的垂體油脂劑的方法,該方法預計將於2029年2月到期,而不考慮任何可能的專利期限延長。第二項美國專利,第8,486,947號,要求通過使用垂體後葉素治療日間過度睏倦的方法,該專利預計將於2029年9月到期,不考慮任何可能的專利期延長。隨着適用的專利期限延長,我們相信我們的產品組合中最後一個到期的瀝青劑相關專利的期限將延長到2030年2月或2030年9月,這取決於我們選擇哪一項專利來延長專利期限,如下所述。
我們的HBS-102專利組合包括三個專利系列。第一個專利系列包括美國專利No.8,637,501,該專利要求某些黑色素濃縮激素(MCH-1)受體拮抗劑作為物質的組合物,以及製造拮抗劑的方法,用於治療肥胖、焦慮和抑鬱的方法,以及製備化合物的方法,該專利預計將於2031年4月到期,而不考慮任何可能的專利期延長。第二個專利系列包括三項已獲授權的美國專利(編號8,716,308;9,296,743和9,650,378),並在澳大利亞、巴西、加拿大、中國、德國、西班牙、法國、英國、以色列、意大利、日本、韓國、墨西哥和新西蘭獲得專利。這些專利要求將某些人類MCH-1受體選擇性拮抗劑作為物質的組合物,預計將於2031年6月(‘308號專利)和2029年1月(’743和‘378號專利,以及國際專利)到期。第三個專利系列包括一項正在申請中的PCT申請(WO2021/142395),並要求提供包含三重單胺再攝取抑制劑、MCH受體1拮抗劑和二氮嗪的藥物的治療組合或配方,以及治療或預防吞噬過多、中到重度暴食障礙、神經性暴食症和肥胖管理的方法。
我們產品組合中單個專利的期限取決於獲得這些專利的國家/地區的法律期限。在美國,專利期為自提交非臨時專利申請的最早日期起20年。美國專利的期限可能有資格進行專利期限調整,這允許恢復專利期限,作為對美國專利商標局(USPTO)在專利起訴過程中發生的延遲的補償。此外,對於FDA批准的藥物的專利,1984年的“藥品價格競爭和專利期限恢復法”(“Hatch-Waxman法案”)允許專利期限在專利到期後最多延長五年。雖然專利期限延長的長度與藥物接受監管審查的時間長短有關,但專利期限延長不能將專利的剩餘期限從產品批准之日起總共延長14年,而且根據哈奇-瓦克斯曼法案,每種批准的藥物只能延長一項專利。我們已經申請了兩項涉及垂體油劑的專利(上文提到的‘197和’947項專利),其中只有一項專利可以延長專利期限(如果可以延長的話)。FDA告知美國專利商標局,WAKIX的相關監管審查期限為505天,根據該信息,我們估計專利期限延長的長度為374天。不能保證USPTO的決定將與我們的估計一致。
像我們這樣的公司的專利地位通常是不確定的,涉及複雜的法律和事實問題。美國專利法或其解釋的變化可能會削弱我們保護我們的技術或候選產品的能力,並可能影響此類知識產權的價值。特別是,我們阻止第三方製造、使用、銷售、提供銷售或進口侵犯我們知識產權的產品的能力,在一定程度上將取決於我們能否成功地執行涵蓋我們的技術、發明和改進的專利主張。我們不能保證將來可能提交的任何專利申請都會獲得專利,也不能保證將來可能授予我們的任何專利在保護我們的產品、使用方法或