
展品99.2

Natera,Inc.投資者演示2021年第四季度收益電話會議

2不得複製或進一步分發。本報告包含根據1995年“私人證券訴訟改革法案”的含義作出的前瞻性陳述。除有關歷史事實的陳述外,本演示文稿中包含的所有陳述,包括有關我們的市場機會、我們建議的產品和推出時間表、我們的報銷EME NT覆蓋範圍和產品成本、我們的商業合作伙伴和潛在收購、我們的用户體驗、我們的臨牀試驗和研究、我們的財務表現、我們的戰略、我們的主要收入和財務前景、我們的目標以及總體商業和市場狀況,都是前瞻性陳述。這些前瞻性聲明會受到已知和未知風險及不確定性的影響,可能會導致實際結果與聲明所述產生重大差異,這些風險和不確定性包括:我們在實現財務預測和目標方面面臨大量不確定性和挑戰;我們可能因新冠肺炎疫情造成的業務中斷和經濟不確定性而無法按計劃維持業務和運營;我們可能無法通過直銷或通過實驗室合作伙伴進一步增加Panorama和Horizon的使用和採用率;我們可能無法開發包括Signatera和Prosperon在內的新產品併成功將其商業化。我們自成立以來一直虧損,我們意識到在可預見的未來我們將繼續虧損;我們的季度業績可能會在不同時期波動;我們對市場機會的估計和對市場增長的預測可能被證明是不準確的;我們可能無法與競爭對手提供的現有或未來的產品或服務競爭;我們可能會進行收購。, 存款或其他戰略交易可能無法實現我們的預期利益,否則可能會擾亂我們的業務,導致我們的股東被稀釋或減少我們的財務資源;我們可能需要籌集額外的資本來支持我們的業務計劃,這可能在必要時或在有利的條件下無法獲得;我們可能無法成功地商業化我們的基於雲的分銷模式;我們的產品可能不會像預期的那樣表現;我們的臨牀研究結果,包括我們基於SNP的微缺失和非整倍體註冊(SMART)研究,可能無法説服專業協會或付款人支持我們的測試的使用,特別是在中等風險懷孕人羣或微缺失篩查中,或者可能無法在監管批准或許可所需的後續研究中複製;如果我們的任何一個主要CLIA認證的實驗室設施無法操作,我們將無法執行測試,我們的業務將受到損害;我們的一些實驗室儀器和材料依賴於有限數量的供應商,在某些情況下依賴於單一供應商,可能無法找到替代品或立即轉移到替代供應商;如果我們不能成功擴大業務規模,我們的業務可能會受到影響;Panorama和我們其他產品的營銷、銷售和使用可能導致產品責任或專業責任索賠超出我們的資源而導致的嚴重損害;我們可能無法擴大、獲得或維持Panorama、Horizon和我們的其他測試的第三方付款人覆蓋範圍和報銷,並且我們可能被要求退還已收到的報銷款項;第三方付款人可能會因政策變化、賬單複雜性或其他因素而撤回承保範圍或提供較低水平的報銷。, 例如,第三方付款人更加關注要求在進行測試之前獲得事先授權;如果F DA開始積極管理我們的測試,我們可能會產生與嘗試獲得上市前批准或批准相關的大量成本和延誤,以及與遵守上市後控制相關的成本;由於第三方聲稱侵犯知識產權或第三方侵犯我們的技術而導致的訴訟或其他訴訟,成本高昂,耗費電子費用,並可能限制我們將產品或服務商業化的能力;任何不能將我們的產品或服務商業化的訴訟或其他訴訟程序,都是昂貴的、耗費電子費用的,並可能限制我們將產品或服務商業化的能力。我們不能保證我們將能夠償還和履行我們的未償債務義務,或實現我們對未償還可轉換票據的預期。我們在我們的定期報告10-K表和10-Q表以及我們不時提交給美國證券交易委員會的其他文件中的“風險因素”和“管理層對財務狀況和經營結果的討論和分析”一節中更詳細地討論了這些和其他風險和不確定性。此外,我們的運營環境競爭激烈,變化迅速。新的風險時有出現。我們的管理層不可能預測所有風險,也不能評估所有因素對我們業務的影響,或任何因素或因素組合可能導致CTU最終結果與任何前瞻性陳述中包含的結果大不相同的程度。鑑於這些風險、不確定性和假設, 本報告中討論的前瞻性事件和情況可能不會發生,我們的實際結果可能與預期或暗示的結果大不相同。因此,你們不應該過分依賴我們的前瞻性國家。除非法律另有要求,否則我們沒有義務在本陳述發表之日之後以任何理由公開更新任何前瞻性陳述,以使這些陳述與實際結果或我們預期的變化保持一致。我們向美國證券交易委員會提交報告、委託書和其他信息。有關我們的此類報告、委託書和其他信息,請訪問http://www.sec.gov.要索取此類文件的副本,請直接聯繫我們位於納特拉公司的投資者關係部,地址:13011 McCallen Pass,Building A Suite100,Austin,TX 78753。您的電話號碼是(650)249-9090。安全港聲明

3不得複製或進一步分發。2021財年處理的測試總數為157萬個;與2020年相比增長約53%,比預告增加>5000個-2021財年第四季度處理的測試總數約為43.9萬個,總收入為6.255億美元;與2020年相比增長約60%,高於之前指導範圍的高端-2021年第四季度總收入1.73億美元里程碑式循環-日本研究顯示,Signatera Faste MRD可以預測結直腸癌SMART 22q11.2缺失研究的化療益處。這項研究發表在《美國婦產科雜誌》上:里程碑式的5年,20,000名患者參加Trifeta研究的試驗成功讀數-迄今為止最大的前瞻性、完全活檢匹配的腎臟數據集指導2022年總收入7.7億美元至7.7億美元
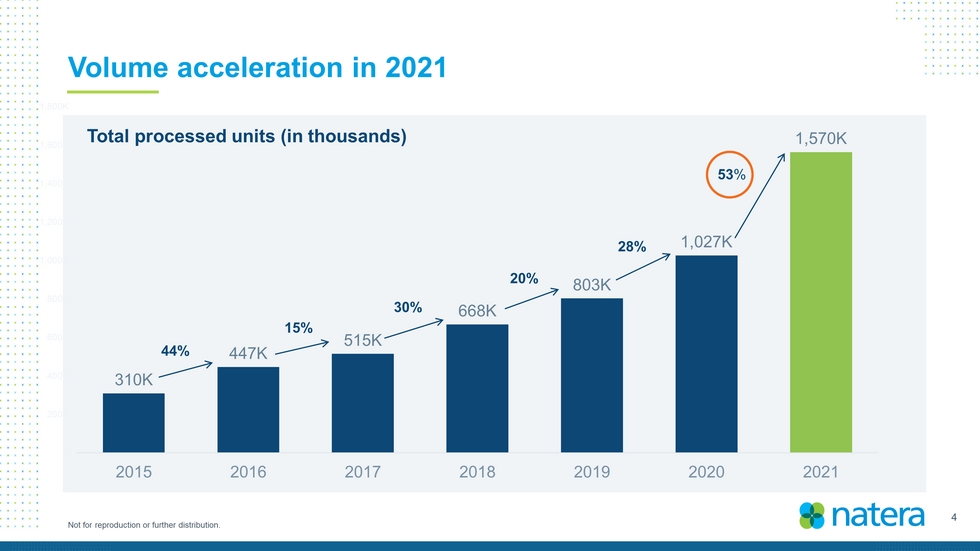
4 Not for reproduction or further distribution. Volume acceleration in 2021 310K 447K 515K 668K 803K 1,027K 1,570K K 200K 400K 600K 800K 1,000K 1,200K 1,400K 1,600K 1,800K 2015 2016 2017 2018 2019 2020 2021 53 % 28% 20% 30% 15% 44% Total processed units (in thousands)
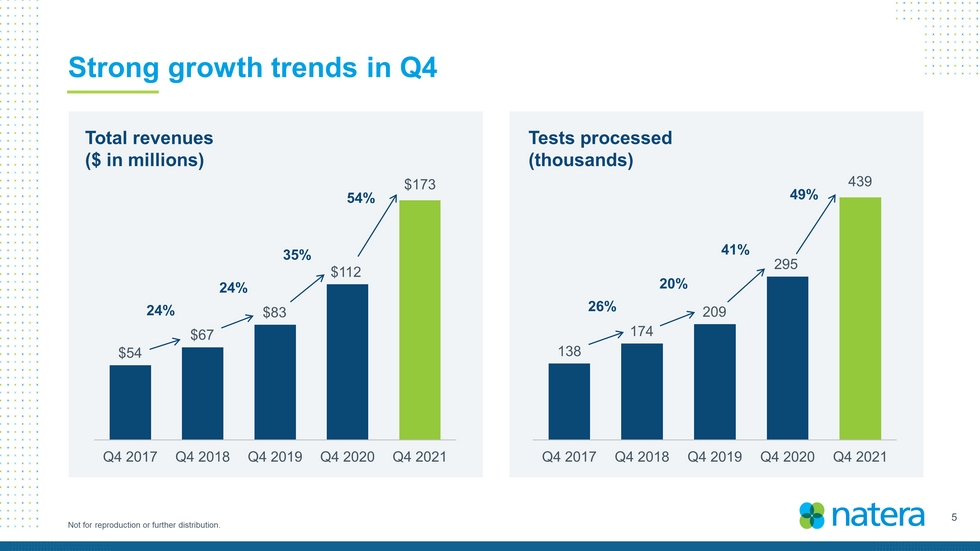
5 Not for reproduction or further distribution. Strong growth trends in Q4 Total revenues ($ in millions) Tests processed (thousands) $54 $67 $83 $112 $173 Q4 2017 Q4 2018 Q4 2019 Q4 2020 Q4 2021 138 174 209 295 439 Q4 2017 Q4 2018 Q4 2019 Q4 2020 Q4 2021 24% 24% 54% 35% 26% 20% 49% 41%
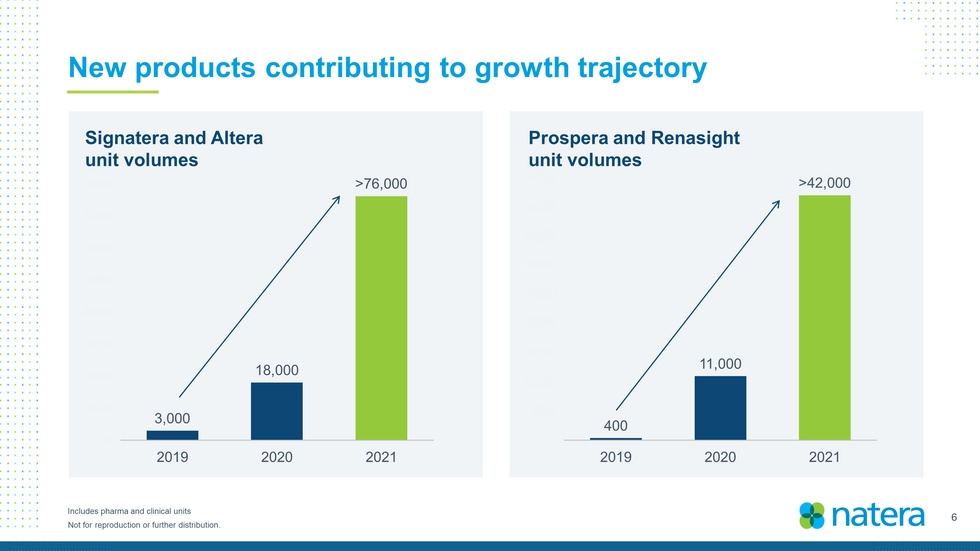
6不得複製或進一步分發。有助於增長軌跡的新產品包括製藥和臨牀部門Signatera和Altera單位數量Prospera和Renasight單位數量3,000 18,000>76,000 0 10,000 20,000 30,000 40,000 60,000 70,000 80,000 2019 2020 2021 400 11,000>42,000 0,000 10,000 15,000 20,000 25,000 30,000 35,000 40,000 45,000 2020 2021
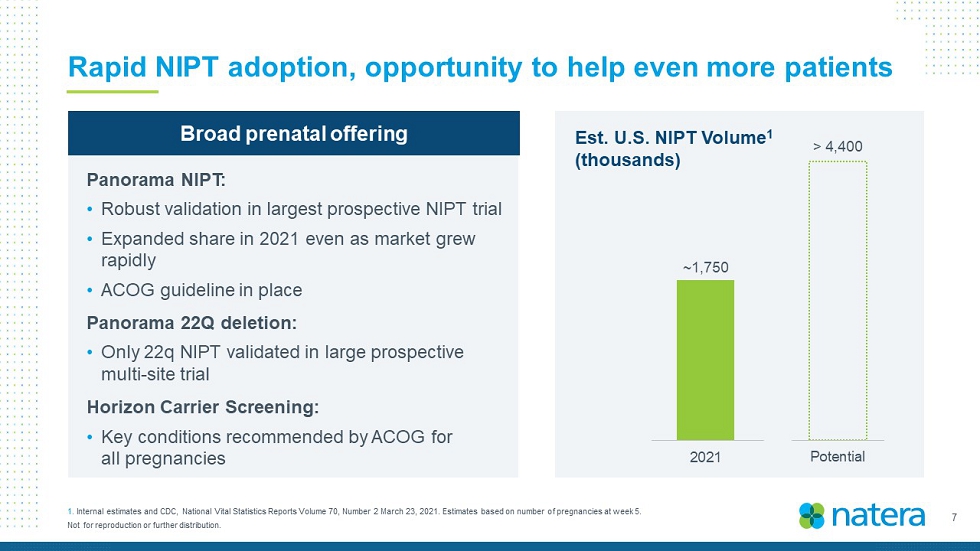
7不得複製或進一步分發。NIPT的迅速採用,幫助更多患者的機會1。《內部評估和疾病預防控制中心》,《國家生命統計報告》第70卷,第2期,2021年3月23日。根據美國東部時間第5周的懷孕次數進行估計。美國NIPT第1卷(千)~1,200~1,750 0 200 400 600 800 800 1,200 1,400 1,600 1,800 2,000 2020 2021潛力>4,400廣泛產前服務Panorama NIPT:·在最大的預期NIPT試驗中進行強有力的驗證·即使市場快速增長,2021年的份額也會擴大·ACOG指南到位Panorama 22Q刪除:·只有22q NIPT在大型前瞻性多部位試驗Horizon Carrier篩查中得到驗證:·ACOG為所有孕婦推薦的關鍵條件

8不得複製或進一步分發。發表在AJOG SMART出版物上的里程碑式SMART研究關鍵結果只有22q測試在現實世界、多地點前瞻性研究中得到了驗證:·在>18,000名患者中確認結果的穩健驗證22q結果超出預期:·高發病率1/1,524,極高的敏感性和特異性·高PPV為53%(>10倍於歷史上接受的篩查測試)22q篩查的高臨牀實用性:·是普通人羣中先天性心臟病的主要原因之一1·有助於避免產後診斷奧德賽自然綜述疾病引物中的22q11.2缺失綜合徵
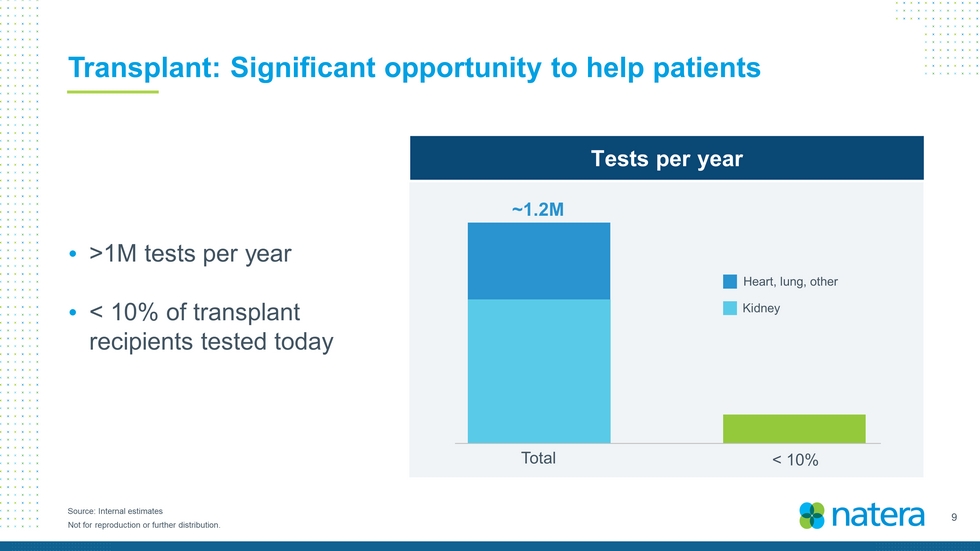
9不得複製或進一步分發。來源:內部評估移植:每年幫助患者超過100萬次檢查的重要機會

10不得複製或進一步分發。計劃於2022年上半年發表的大型臨牀研究報告1.Halloran等人。2022年提交出版的手稿。2.Kim等人。2022年提交出版的手稿。3.Rosenheck等人。提交發表的手稿,2022年Trifeta研究,1個多點驗證試驗,2個有效研究,3個·最大的前瞻性研究,完全活檢匹配,腎移植受者迄今的dd-CFDNA多位點研究1·>300個活檢匹配樣本⎻包括>100個經活檢確認的排斥反應·20+美國和國際網站·包括超過250個預期收集的活檢匹配樣本·曲線下面積(Auc):>0.84·可以消除昂貴和繁瑣的多模態測試的需要·迄今為止在肺移植受者中進行的最大規模的前瞻性研究可用於商業化的dd-CFDNA檢測·AuC0.91的排斥反應與穩定的·195個活檢匹配樣本的比較(AUC):>0.84·可以消除昂貴和繁瑣的多模態測試的需要·迄今為止在肺移植受者中進行的最大的前瞻性研究用於商業化的dd-CFDNA檢測·AuC0.91與穩定的比較·195個活檢匹配的樣本
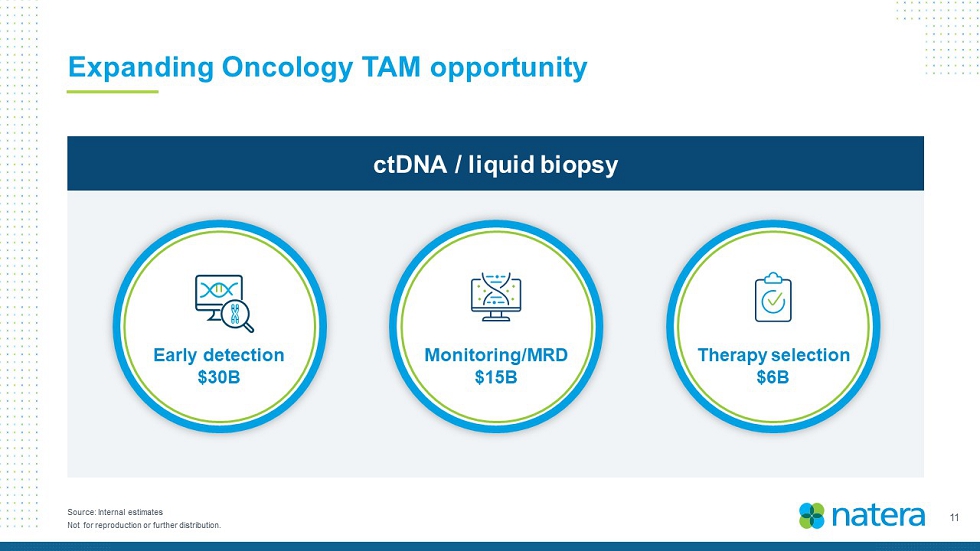
11不得複製或進一步分發。來源:內部估計擴大腫瘤學TAM機會ctDNA/液體活檢療法選擇60億美元早期檢測300億美元監測/MRD 150億美元

12不得複製或進一步分發。Signatera為效率和增長做好了準備·商業足跡為未來的增長做好了準備,目前只有10%的容量·首次測試(包括腫瘤外顯子組)的中位數時間為19天;後續測試為6天·在線門户和EMR集成,便於測試訂購和報告·直觀的經常性訂單基礎設施商業達到強大的運營尖端UX·>100項正在進行的臨牀研究·>2022年預計將發表20篇臨牀數據

13不得複製或進一步分發。Circulate-IDEA日本:最大的前瞻性MRD研究·約1,200名患者入選·~800名患者被分析·按MRD狀態分層:⎻平均~6個月⎻最大~10個月·~3,000名患者入選·~1,000名患者分析·按MRD狀態和治療狀態分層:⎻平均~12個月⎻最長2022年:ASCO-GI 2021年:ASCO,ESMO建立可能改變社會實踐指南的證據

14不得複製或進一步分發。MRD陽性患者從ACT中受益顯著,HR根據性別和表現狀態進行了調整。ACT,輔助化療;DFS,無病生存;HR,危險比;CI,保密間隔。DFS曲線用Kaplan-Meier法估計。用Cox比例風險模型計算HR和95%CI。術後4周MRD陽性高危人羣DFS數W/ACT W/O ACT 9 9 3 0 13 7 1 0 65 58 24 0 25 8 2 0 22 16 4 0 46 13 1 0高危pStage II pStage III pStage IV 100 80 60 40 20 0 DFS%0 6 12 18術後18個月100 80 60 40 20 0%0 6 12 18調整後HR=9.4 95%CI,1.1至79.1,P=0.04調整後HR=8.8 95%P
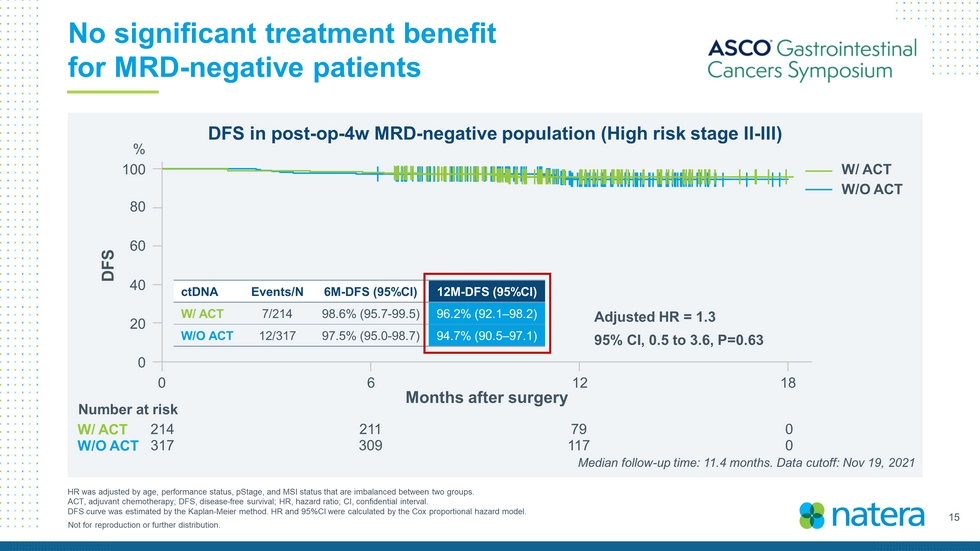
15不得複製或進一步分發。MRD陰性患者的HR在兩組之間不平衡的情況下,根據年齡、表現狀態、pStage和MSI狀態進行了調整,沒有顯著的治療益處。ACT,輔助化療;DFS,無病生存率;HR,風險比;CI,保密區間。DFS曲線用Kaplan-Meier法估計。用Cox比例風險模型計算HR和95%CI。術後4周MRD陰性人羣(高危II-III期)術後3個月的DFS 100 80 60 40 20 0 DFS 0 6 12 18 W/ACT調整後HR=1.3 95%CI,0.5至3.6,P=0.63 ctDNA Events/N 6M-DFS(95%CI)12M-DFS(95%CI)W/ACT 7/214 98.6%(95.7-99.5)96.2%(92.1-98.2)W/O ACT 12/317 97.5%(95.0-98.7)94.7%(90.5-97.1)%214 211 79 0317 309 117 0中位隨訪時間:11.4個月。數據截止時間:2021年11月19日,風險數字,無活動,無活動

16不得複製或進一步分發。傳閲日本ASCO GI 22個關鍵要點1.Kotaka等人。循環日本銀河觀察性研究中的彩色癌患者在輔助性環境下循環腫瘤DNA動態與臨牀結果的關係。ASCO GI 2022。循環日本ASCO GI 22 1·Signatera陽性術後:顯著受益於輔助化療(高危II期或III期HR 8.8-9.4)·Signatera陰性術後:未從輔助化療中獲得顯著益處(12個月DFS時絕對風險降低僅1.5%)·Signatera ctDNA清除:預測治療效果(HR 15.8清除與未清除)預測結果MRD陽性患者的12m-DFS為5(HR)術後4周MRD陽性與MRD陰性的敏感度分別為13.3%和67.6%
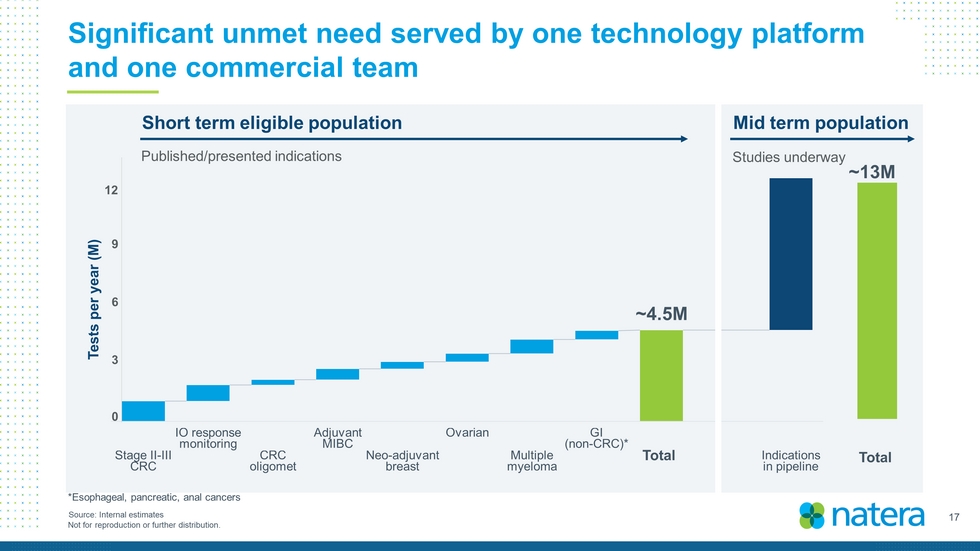
17不得複製或進一步分發。一個技術平臺和一個商業團隊滿足的重大未滿足需求約450萬~1300萬總來源:每年內部估計測試總數0 3 6 9 12短期符合條件人口中期人口公佈/提交適應症研究正在進行中*食管癌、胰腺癌、肛門癌*食管癌、胰腺癌、肛門癌*正在進行研究*食管癌、胰腺癌、肛門癌*正在進行研究*食管癌、胰腺癌、肛門癌
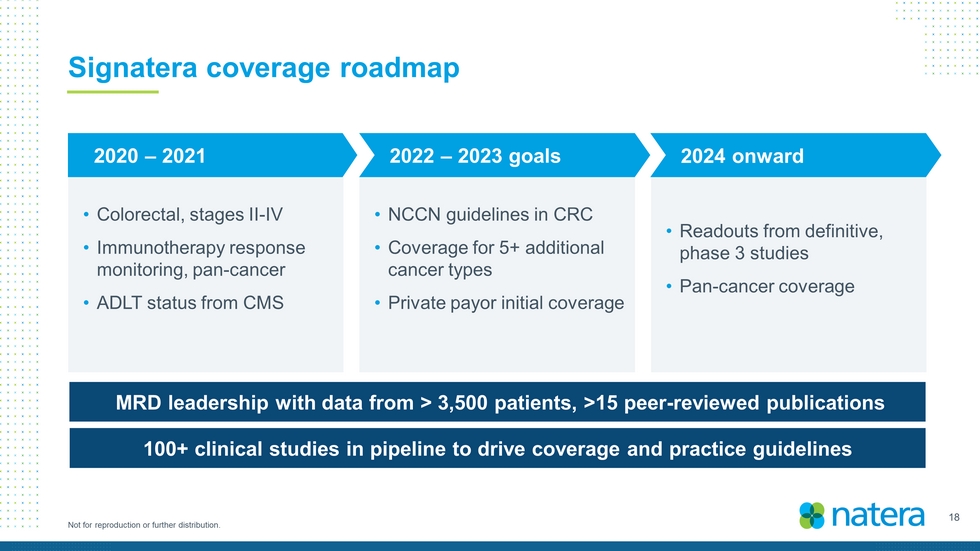
18不得複製或進一步分發。Signatera覆蓋路線圖·結直腸癌,II-IV期·免疫治療反應監測,泛癌症·CMS MRD領導層的ADLT狀態,來自>3,500名患者的數據,>15篇同行評審出版物100+正在籌備中的臨牀研究,以推動覆蓋和實踐指南·NCCN在CRC中的指南·覆蓋5種以上其他癌症類型·私人付款人初始覆蓋·明確的3期研究的讀數·泛癌覆蓋2022-2023年目標2020-2021年以後
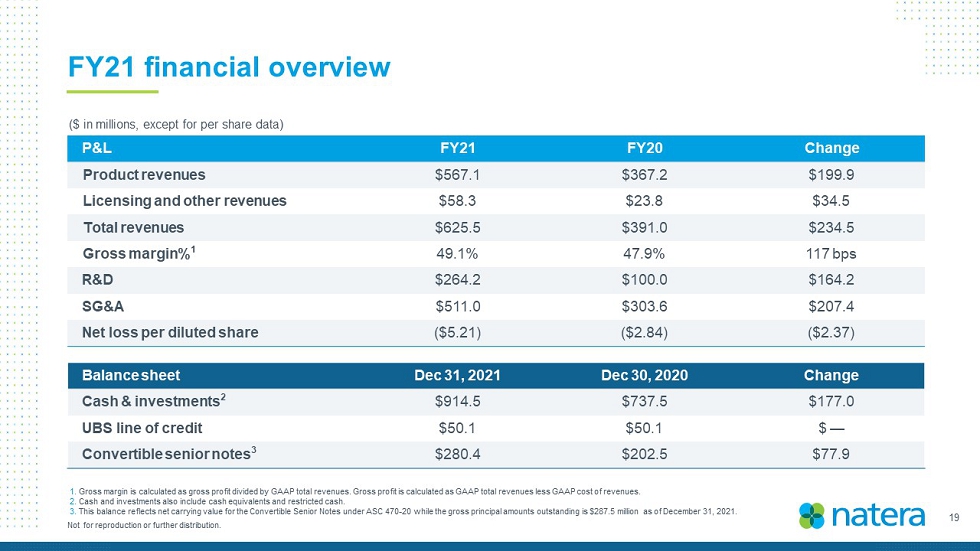
19不得複製或進一步分發。21財年財務概覽(百萬美元,每股數據除外)資產負債表2021年12月31日,12月30日,2020年變更現金和投資2$914.5$737.5$177.0瑞銀信貸額度$50.1$50.1$-可轉換優先票據3$280.4$202.5$77.9P&L 21 FY20財年變更產品收入$567.1$367.2$199.9許可和其他收入$58.3$23.8$34.5總收入$625.4$391.0$234.4毛利率%149.1%47.9%117個基點研發$264.2$100.0$164.2SG&A$511.0$303.6$207.4稀釋後每股淨虧損(5.21美元)(2.84美元)(2.37美元)1.毛利計算方法為毛利除以GAAP總收入。毛利按公認會計準則總收入減去公認會計準則收入成本計算。2.現金和投資還包括現金等價物和限制性現金。3.這一餘額反映了ASC 470-20項下的可轉換優先票據的賬面淨值,而截至2021年12月31日的未償還本金總額為2.875億美元。

20不得複製或進一步分發。2022年年度指導指南$(百萬)關鍵驅動因素收入$770-$790持續的銷量增長,保守的ASP,新產品的貢獻不斷增加毛利率%收入46%-48%保守的ASP假設,泛癌Signatera的快速增長,新患者獲得前期外顯子SG&A$560-$590腫瘤學全商業團隊,器官健康就地研發$340-$360大型臨牀試驗旨在推動腫瘤學和移植的廣泛採用現金消耗$370美元

21不得複製或進一步分發。©2020 Natera,Inc.保留所有權利。不用於複製或進一步分發。©2022 Natera,Inc.保留所有權利。不用於複製或進一步分發。