

恢復腸屏障健康企業演示文稿|2022年2月巴利(納斯達克)|palisadeBio.com

前瞻性陳述本演示文稿中非歷史事實陳述屬於前瞻性陳述。這些前瞻性陳述包括但不限於有關我們的研究和臨牀開發計劃、戰略、監管事項、市場規模和機會以及我們完成某些里程碑的能力的陳述。諸如“相信”、“預期”、“可能”、“估計”、“目標”、“目標”、“計劃”、“預期”、“打算”、“將會”、“可能”、“目標”、“潛在”等詞彙以及類似的表述旨在識別前瞻性表述,儘管並非所有前瞻性表述都一定包含這些標識性詞彙。這些前瞻性陳述是基於公司管理層的信念以及可能永遠不會實現或被證明是不正確的假設。此類陳述反映了公司對未來事件的當前看法,會受到已知和未知風險的影響,包括但不限於,有關公司的商業、監管、經濟和競爭風險、不確定因素、意外情況和假設,包括但不限於藥品開發過程中固有的風險、公司正在進行和計劃中的臨牀試驗的未來結果、公司獲得足夠資金為計劃中的臨牀試驗和其他費用提供資金的能力、行業趨勢、競爭格局的變化、新冠肺炎疫情造成的延誤或中斷。該行業和未來支出的法律和監管框架。鑑於這些風險和不確定性, 前瞻性陳述中提到的事件或情況可能不會發生。實際結果可能與預期結果不同,變化可能是實質性的。可能導致公司實際結果與當前預期不同的其他因素在公司提交給證券交易委員會的文件中進行了討論,其中包括文件中題為“風險因素”的章節。這些前瞻性陳述不應被視為預測或承諾,也不應被視為暗示、保證或保證作出此類前瞻性陳述所依據的假設是正確或詳盡的,或者就假設而言,是在本演示文稿中充分陳述的。告誡您不要過度依賴這些前瞻性陳述,這些陳述僅反映了本報告發表之日的情況。除非法律要求,否則Palisade Bio沒有義務更新本文中包含的任何前瞻性陳述,以反映預期的任何變化,即使有新的信息可用。本演示討論正在進行臨牀研究的候選產品,以及尚未獲得美國食品和藥物管理局(FDA)批准上市的候選產品。沒有關於這些候選產品的安全性或有效性的陳述。當解釋涉及不同候選產品的不同試驗結果時,應謹慎行事。試驗設計和受試者人口統計學之間存在差異,這限制了從不同試驗的比較中得出的結論。本演示文稿包括我們從行業出版物、第三方研究、調查和研究中獲得的統計數據和其他行業和市場數據。這些信息是從據信可靠的來源獲得的。, 儘管不能保證此類信息的準確性或完整性。本文中包含的商標是其所有者的財產,僅供參考。

Palisade Bio公司開發有針對性的消化酶抑制劑Palisade Bio公司開發治療消化酶泄漏引起的疾病的藥物,這些疾病會產生炎症和組織損傷科學平臺技術LB1148是一種口服液體蛋白酶抑制劑,在家中用於大手術的腸道準備,並在兩個大的適應症上顯示了積極的臨牀效果:加速術後腸功能的恢復,以及減少手術後粘連,使候選藥物進入第三階段

主藥:LB1148

主要候選藥物LB1148-手術患者商業化的潛在途徑的要點口服消化酶抑制劑已在多項外科研究中顯示出臨牀益處臨牀安全性和有效性事先批准為關鍵試驗設計和監管審查提供了先例;LB1148進入關鍵研究LB1148可以在手術前在家裏進行;非常大的手術市場(20%的市場份額可能帶來超過15億美元的收入)商業化的理想報銷方案批准巨大的商業機會

未得到滿足的需求-術後胃腸功能恢復的時間通常是出院的限制性決定因素患者通常直到排便後才出院缺乏胃腸功能恢復:引起疼痛和腹脹引起重大不適延長住院時間增加醫療成本如果我們節省一天的住院時間,我們每年將實現2000萬美元的額外利潤。大手術心血管、胃腸、腹部、婦科LB1148顯示住院時間縮短1.1至1.3天。每個住院日的平均住院費用=2400美元

未得到滿足的需求減少手術後粘連是一個普遍且潛在的嚴重問題:高達93%的腹部手術導致手術後粘連頭號原因繼發性女性不孕頭號原因腸梗阻(高達75%)第十大最常見原因緊急手術死亡80%美國每年40萬例粘連溶解手術美國每年23億美元醫療費用來源:J Chir Incerale2012年;149(2):114-126。DOI:10.1016/j.jviscSurg.2011.11.006女性不孕的原因,2020年至今,K.阿爾..。結腸切除術後粘連相關併發症對醫療服務利用的影響。克萊恩。結果結果10,761-771(2018)非粘連併發症粘連併發症差異住院時間5.2天7.2天38%再住院費用22,500美元29,800美元7,326美元/分。

術後粘連限制:僅批准用於腹部手術的產品僅批准用於開腹手術,不能用於腹腔鏡手術,這些產品的市場份額越來越大,只減少腹壁和潛在內臟之間的粘連,擾亂手術過程,延長麻醉藥的持續時間每個適應症只有一個競爭對手;競爭對手展示了FDA批准的先例腸道功能限制的恢復:住院治療僅限短期使用限制性REMS計劃黑匣子警告:心肌梗死發病率增加只能通過限制性計劃-REMS
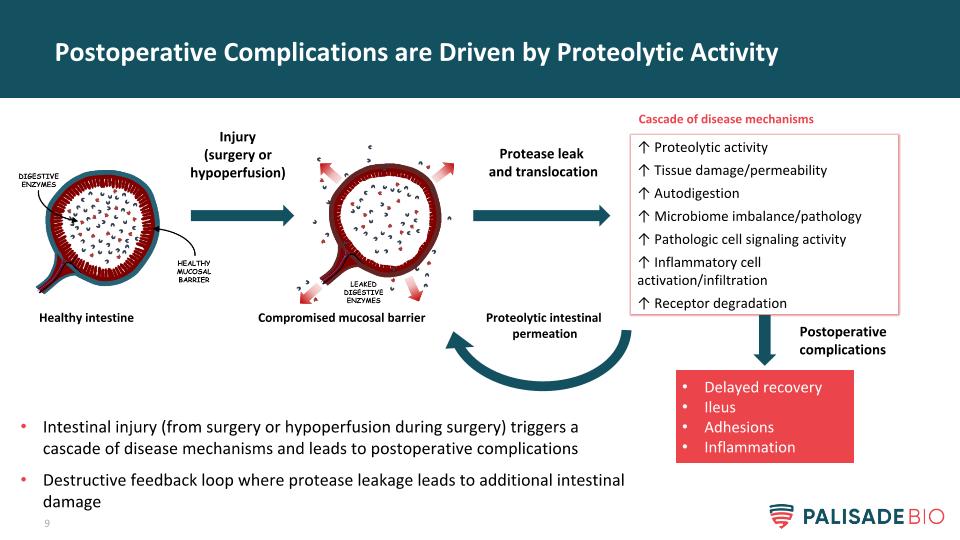
術後併發症的驅動因素是蛋白水解活性損傷(手術或低灌注)損害粘膜屏障健康腸道蛋白酶泄漏和移位↑蛋白水解活性↑組織損傷/通透性↑自體消化↑微生物羣失衡/病理↑病理細胞信號活性↑炎性細胞活化/浸潤↑受體降解延遲恢復腸梗阻粘連炎症級聯疾病機制蛋白溶解性腸滲透損傷(手術或術中低灌注)觸發一系列疾病機制並導致術後併發症破壞反饋環
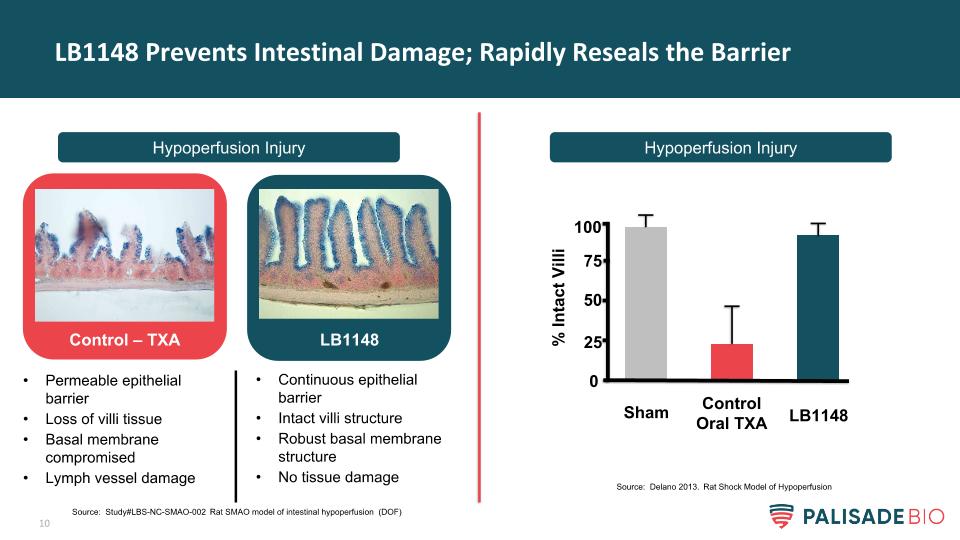
LB1148防止腸道損傷;快速修復屏障低灌注損傷對照-TXA LB1148通透性上皮屏障丟失絨毛組織基底膜受損淋巴管受損持續上皮屏障完整的絨毛結構堅固的基底膜結構無組織損傷%完好率絨毛假對照口服TXA LB1148 0 50 75 100 25來源:研究#LBS-NC-SMAO-002大鼠SMAO小腸低灌注模型(DOF)來源:Delano 2013。低灌注休克大鼠模型的建立

LB1148概述:產品中的流水線-多適應症LB1148計劃臨牀前階段1階段2階段3下一個里程碑術後腸功能恢復階段3協議許可1H 2022;研究啟動2H 2022*CV計劃跟蹤GI研究2022年3月16日手術後腹部粘連的預防SAGES數據介紹2022年3月16日第二階段登記完成2H 2022*GI外科第二階段:已完成的GI手術第二階段:正在進行的LB1148在大中華區(不包括臺灣)的商業權已被授予Newsoara心血管外科第二階段:完成美國食品和藥物管理局批准LB1148的兩個臨牀適應症的快速通道稱號:減少腹部或盆腔手術治療術後GI的粘連

加速腸功能恢復
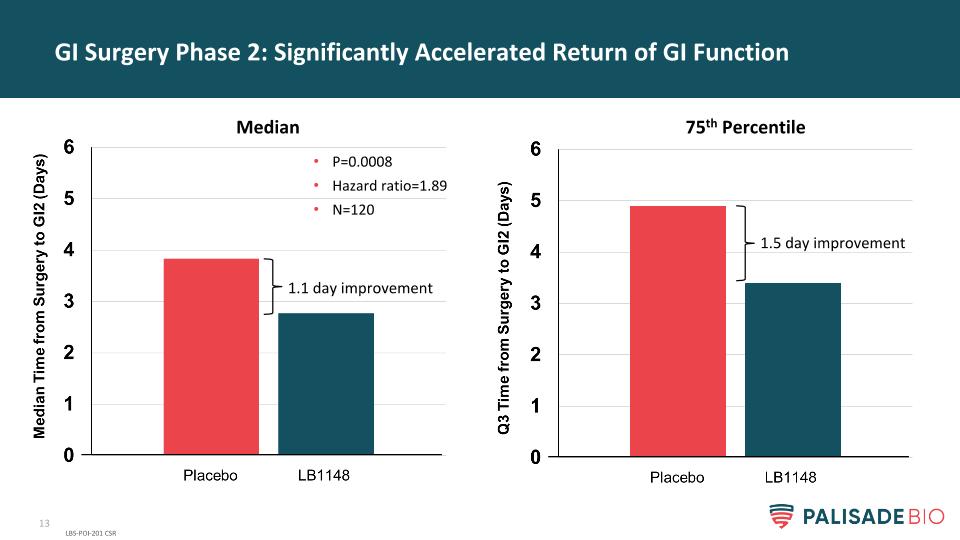
GI手術階段2:顯著加速GI功能恢復LBS-POI-201CSR P=0.0008風險比=1.89N=1201.1天改善1.5天改善中位數第75百分位數

LB1148加速胃腸道功能的恢復--在三項已完成的臨牀研究中,其臨牀療效均達到3期一致,在統計學上具有顯着性意義。在第1期胃腸道手術後,腸功能恢復的時間縮短了48%(與Enterig研究中的安慰劑相比314*)。與入院時的預期腸道功能相比,住院時間縮短了1.3天(p )

預防術後粘連
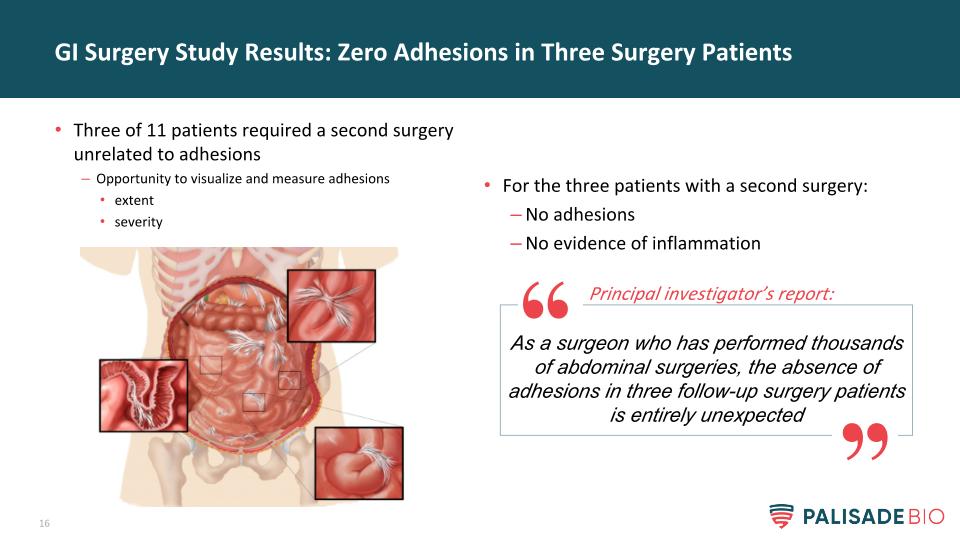
對於三名接受第二次手術的患者:沒有粘連沒有炎症證據的胃腸道手術研究結果:三名手術患者為零粘連11名患者中有三名需要進行與粘連無關的第二次手術機會觀察和測量粘連的嚴重程度作為一名做過數千次腹部手術的外科醫生,三名隨訪的手術患者沒有粘連是完全出乎意料的首席調查員的報告:

LB1148商機
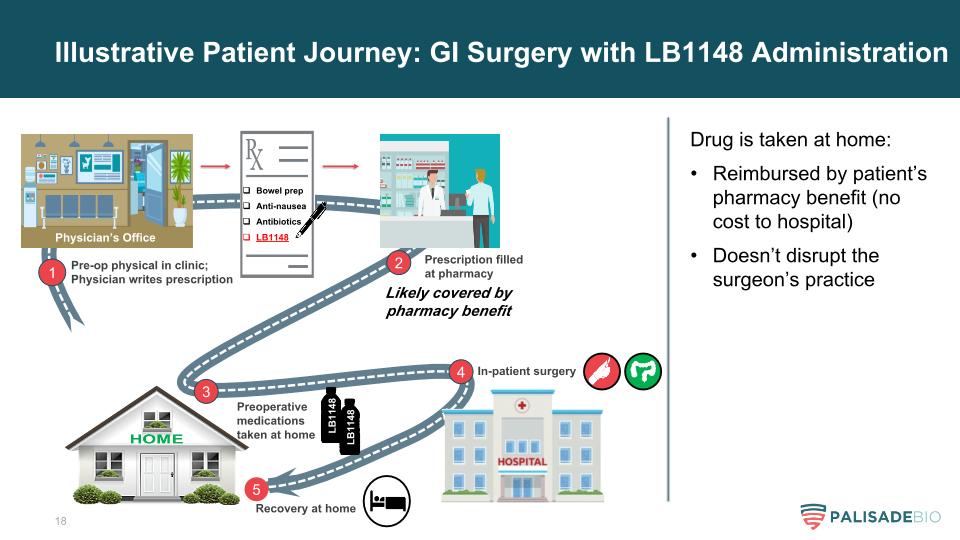
説明性患者之旅:GI手術使用LB1148管理1術前臨牀體檢;醫生寫處方腸道準備抗噁心抗生素LB1148可能由藥房福利覆蓋2處方在藥房配藥3術前藥物在家服用LB1148 4住院手術5在家康復藥物在家服用:由患者的藥房福利報銷(不支付醫院費用)不會擾亂外科醫生的執業LB1148醫生辦公室

LB1148擁有巨大的全球市場機會美國市場110萬例心內直視手術560萬例腹部手術20-40%的市場滲透率可轉化為超過20億美元的收入與中國合作:W/Newsoara EU和ROW機會潛在地與美國的權利或獨立合作美國戰略通過向5000家醫院營銷進行商業化併購-顯示粘合市場的價值巴克斯特在2020年以3.5億美元從賽諾菲手中收購了醫療器械SepraFilm,銷售額是3.5倍

加利福尼亞州卡爾斯巴德210卡爾斯巴德套房5800ARMADA DR,郵編:92008858-704-4900IR@palisadeBio.comPALI(納斯達克)www.palisadeBio.com

附錄幻燈片

由FDA批准的成分組成的新型口服制劑廣譜絲氨酸蛋白酶抑制劑(氨甲環酸)已知的安全性簡介計劃利用505(B)(2)途徑獲得批准用於減少手術粘連的快速通道指定用於減少接受心內直視手術的兒童患者術後胃腸道功能障礙為藥品頒發專利自2008年以來,沒有批准用於術後腸梗阻的新藥Enterig具有嚴格的黑盒警告、繁瑣的REMS方案和有限的使用LB1148--快速調節途徑;有限競爭

Enteregg:只有被批准用於加速胃腸道功能恢復的藥物提供了FDA批准的先例途徑,該藥物由GSK/Adolor/Cubist開發,現為默克公司所有,表明可改善術後腸功能恢復第三階段*:腸功能恢復17小時改善住院時間7小時Enterig MOA存在安全風險ENTEG MOA LB1148具有完全不同的MOA限制包括*:住院管理僅限短期使用,僅限限制性REMS計劃,針對少數醫院使用的嚴重副作用的黑匣子警告Program-REMS Enterig的FDA批准提供了監管路線圖LB1148臨牀試驗設計

LB1148計劃概述產品中的流水線-多適應症加速術後胃腸功能恢復,減少術後粘連心血管手術、胃腸手術、腹部手術

心血管外科(低灌注損傷)

CV手術完成階段2:研究設計*研究第0天是手術日。篩查期CV手術術後/出院LB1148天-42至-1天0天*隨訪1-14天30天安慰劑心血管手術需要體外循環的心內直視手術隨機、雙盲、安慰劑對照,在接受CABG和/或心臟瓣膜置換手術的受試者中,在0、1和2天隨機選擇1:1 7.5克,每日1次。研究設計120名接受擇期心臟手術的患者,單中心CRO:IQVIA,2020年公佈的數據範圍和時間表ICO:IQVIA
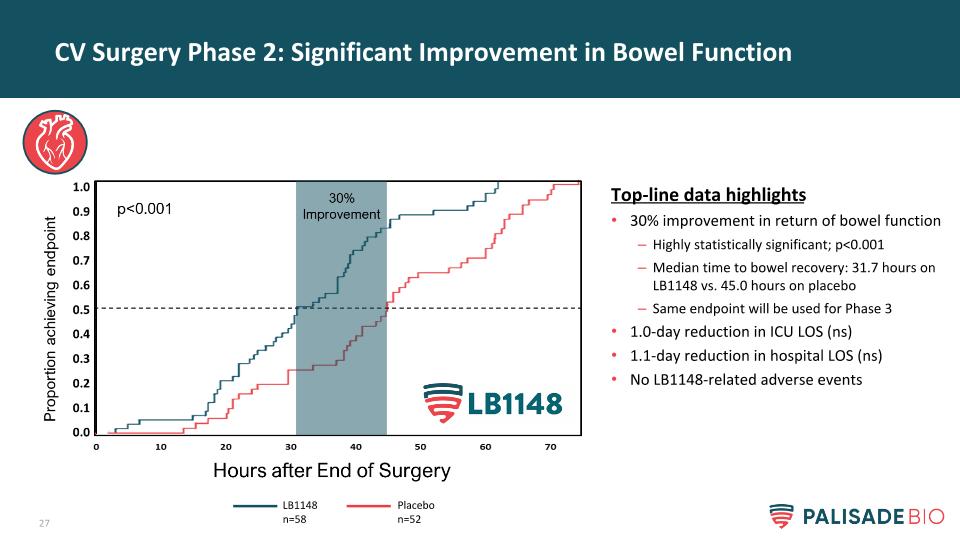
CV手術階段2:腸功能的顯著改善頂線數據突出顯示腸功能恢復30%的改善具有高度統計學意義;p

胃腸道手術:腸功能恢復(身體損傷)
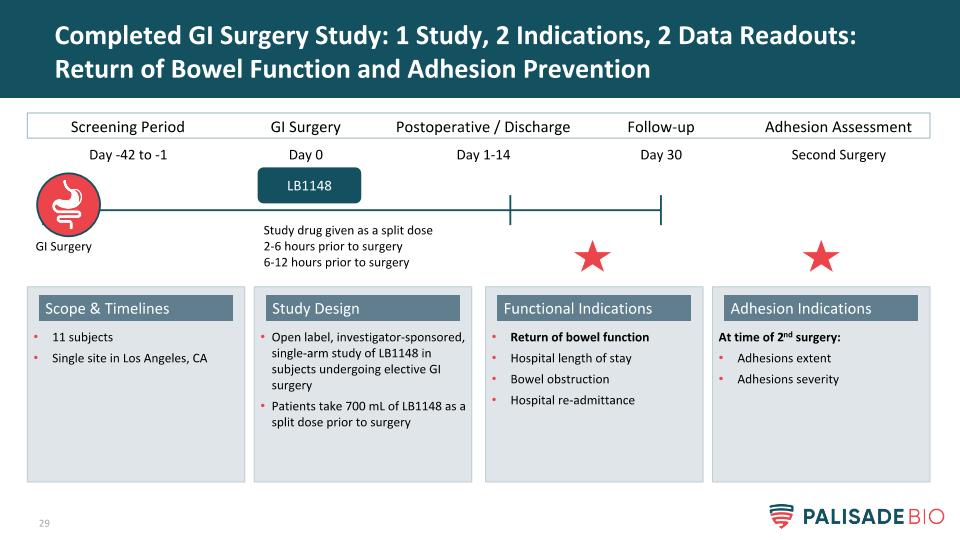
完成胃腸道手術研究:1項研究,2個適應症,2個數據讀數:腸功能恢復和粘連預防開放標籤,研究人員贊助的單臂LB1148研究在接受擇期胃腸道手術的受試者中,患者在手術前服用700毫升LB1148作為分次劑量設計11名受試者在洛杉磯的單一地點,第二次手術時的CA範圍和時間表:粘連程度粘連嚴重粘連指徵腸功能恢復住院時間腸梗阻醫院再入院功能指徵篩查期GI手術術後/出院LB1148天-42至-1天0天1-14隨訪第30天30天研究藥物在手術前2-6小時分次給藥手術前6-12小時手術前6-12小時粘連評估第二次手術GI手術
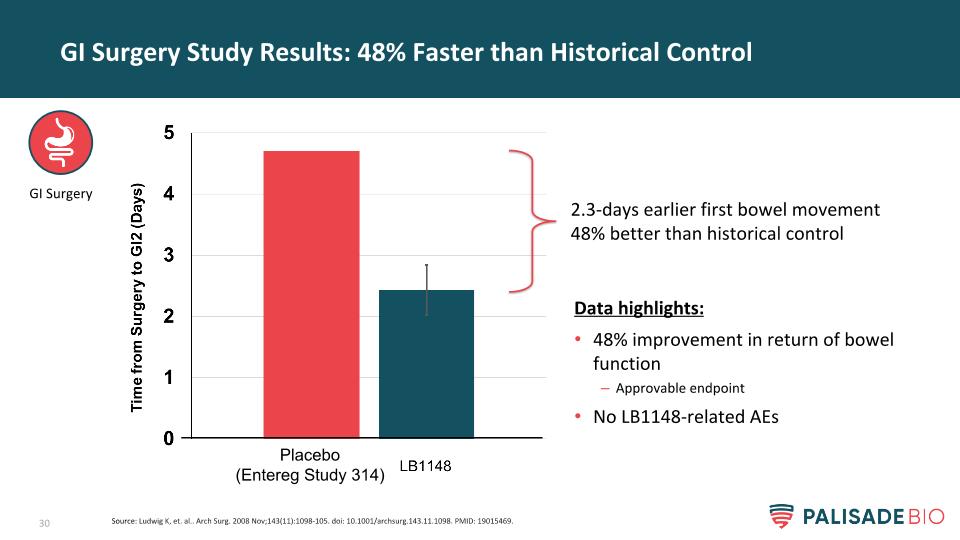
GI手術研究結果:比歷史控制數據突出48%:腸功能恢復48%可批准終點No LB1148相關AEs 2.3天第一次排便比歷史控制GI手術好48%來源:Ludwig K,et。阿爾..。“拱門外科”,2008年11月;143(11):1098-105。DOI:10.1001/archSurg.143.11.1098.19015469。安慰劑(腸道研究314)

GI外科研究結果:與預期的LOS GI手術相比,住院時間有顯著改善患者從手術到出院的實際住院時間(LOS)與從入院時的賬單代碼(GMLOS)確定的預期LOS進行了比較,LOS減少了1.3天,LOS減少了20%,p=0.03

GI手術(Profile)階段2-夥伴研究GI手術隨機、雙盲、安慰劑對照、多部位第二階段試驗評估LB1148在接受擇期腸道切除(採用剖腹手術或計劃拆除造口的微創入路)受試者的GI功能和粘連恢復情況研究設計120名患者第二次手術時在中國6個地點範圍:粘連的存在粘連對腸功能和疼痛粘連指徵的影響主要終點:恢復GI功能的時間GI2:(第一次排便)次要終點:醫院對解決POI功能指徵的損失時間篩查期GI手術時的範圍:粘連的存在對腸功能和疼痛粘連指徵的影響GI2:(第一次排便)次要終點:解決POI功能指徵的住院損失時間篩查期GI手術術前2-6小時分次給藥,術前6-10小時進行粘連評估,首次手術後最多7個月服用安慰劑

胃腸道手術第二階段:安全和耐受性良好的LB1148是耐受性良好的藥物相關不良事件LB1148=10.9%安慰劑=4.8%最常見的與藥物相關的不良反應是胃腸道疾病LB1148 4.7%安慰劑3.2%在試驗中沒有發生與藥物相關的嚴重不良事件

胃腸道手術:減少粘連(身體損傷)
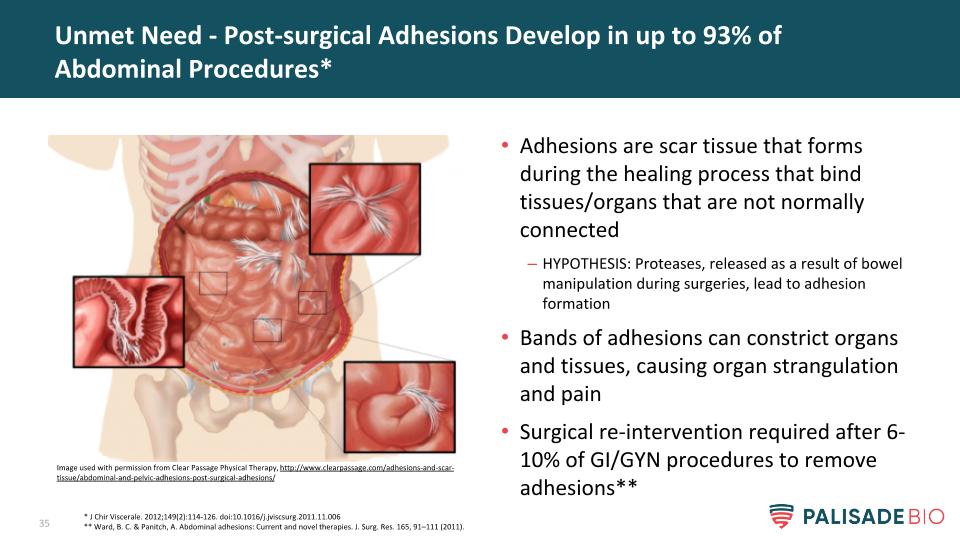
粘連是癒合過程中形成的疤痕組織,它綁定了未正常連接的組織/器官假設:手術中操作腸道時釋放的蛋白酶會導致器官和組織發生粘連,粘連的條帶會收縮器官和組織,造成器官窒息和疼痛,6-10%的GI/GYN手術後需要再次幹預以解除粘連**未得到滿足的需求-高達93%的腹部手術後會發生粘連**J Chir內臟。2012年;149(2):114-126。DOI:10.1016/j.jviscSurg.2011.11.006**Ward,B.C.&Panitch,A.腹部粘連:當前和新的治療方法。“外科學報”165,91-111(2011)。經http://www.clearpassage.com/adhesions-and-scar-tissue/abdominal-and-pelvic-adhesions-post-surgical-adhesions/透明通道理療中心許可使用的圖像
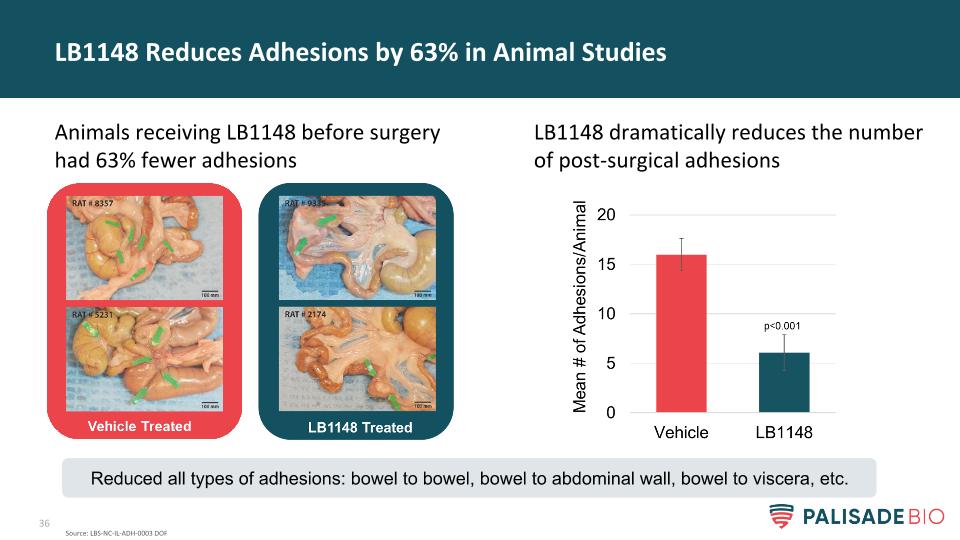
LB1148大大減少了手術後粘連的數量LB1148在動物研究中減少了63%的粘連在手術前接受LB1148的動物粘連減少了63%來源:LBS-NC-IL-ADH-0003 DOF減少了所有類型的粘連:腸與腸、腸與腹壁、腸與內臟等。

美國食品和藥物管理局批准ADEPT用於盆腔手術,粘連僅減少10%來源:ADEPT(4%二十碳糊精)包裝插入;2006年3月www.accessdata.fda.gov/cdrh_docs/pdf5/P050011B.pdf FDA批准ADEPT僅基於10%的患者獲得“成功”(定義為減少≥3個部位的粘連)

加利福尼亞州卡爾斯巴德210卡爾斯巴德套房5800ARMADA DR,郵編:92008858-704-4900IR@palisadeBio.comPALI(納斯達克)www.palisadeBio.com