

拉尼治療公司宣佈蘭尼皮爾™HC 2022年2月展會99.2

前瞻性陳述本演示文稿和隨附的口頭陳述包含前瞻性陳述。前瞻性陳述基於作出這些陳述時可獲得的信息或管理層截至那時對未來事件的善意信念和假設,受風險和不確定因素的影響,這些風險和不確定因素可能導致實際業績或結果與前瞻性陳述中表達或建議的情況大不相同。鑑於這些風險和不確定性,本陳述和隨附的口頭陳述中討論的前瞻性事件和情況可能不會發生,實際結果可能與前瞻性 陳述中預期或暗示的結果大不相同。這些風險和不確定性包括Rani治療控股公司(“Rani”、“我們”、“我們”或“我們”)未來的財務表現,包括我們對我們的收入、收入成本、運營費用、產品的市場潛力以及我們實現和保持未來盈利能力的預期、產品開發、臨牀前和臨牀前開發過程以及監管批准過程中固有的風險、商業化和獲得市場認可的風險和不確定因素、與保護和捍衞我們的專利或我們的專有權可能 不足以保護我們的候選產品的風險,我們無法在需要時以可接受的條款或根本無法獲得必要資本的風險,來自其他產品或程序的競爭,我們對第三方進行臨牀和非臨牀試驗的依賴,我們對單一來源第三方供應商生產臨牀的依賴, 這些因素包括:我們對候選產品的非臨牀和任何未來商業供應的預期;我們開發、優化和擴大製造流程的能力 ;新冠肺炎疫情的範圍和持續時間;我們對客户對候選產品需求的預期;我們拓展產品潛在市場的能力,以及不斷提高的監管要求。本演示文稿中出現的其他公司的商號、 商標和服務標誌均為其各自所有者的財產。僅為方便起見,本演示文稿中提及的商標和商號可能不帶®和 ™符號出現,但這些引用並不意味着我們不會根據適用法律最大程度地聲明我們或適用許可人對這些商標和商號的權利。 前瞻性聲明固有地受到風險和不確定性的影響,其中一些風險和不確定性是無法預測或量化的。在某些情況下,您可以通過“預期”、“ ”、“相信”、“思考”、“繼續”、“可能”、“估計”、“預期”、“打算”、“可能”、“計劃”、“潛在”、“預測”、“ ”、“項目”、“應該”、“目標”、“將”或“將”等術語或其他類似術語的負面含義來識別前瞻性陳述。您不應過度依賴任何前瞻性陳述。 前瞻性陳述不應被解讀為對未來業績或結果的保證,也不一定是對實現此類業績或結果的時間或時間的準確指示(如果有的話)。除非法律要求 ,否則Rani不承擔任何公開更新或修改任何前瞻性陳述的義務,無論這些前瞻性陳述是否因新信息而產生, 未來的發展或其他方面。本演示文稿和隨附的口頭演示文稿包含 基於獨立行業出版物或其他公開信息的統計數據、估計和預測,以及基於我們內部來源的其他信息。此信息涉及許多假設和 限制,提醒您不要過度重視此類信息。我們沒有獨立驗證行業出版物和其他公開提供的信息中包含的信息的準確性或完整性。 因此,我們不對該信息的準確性或完整性做出任何陳述,也不承諾在本演示文稿日期之後更新此類信息。
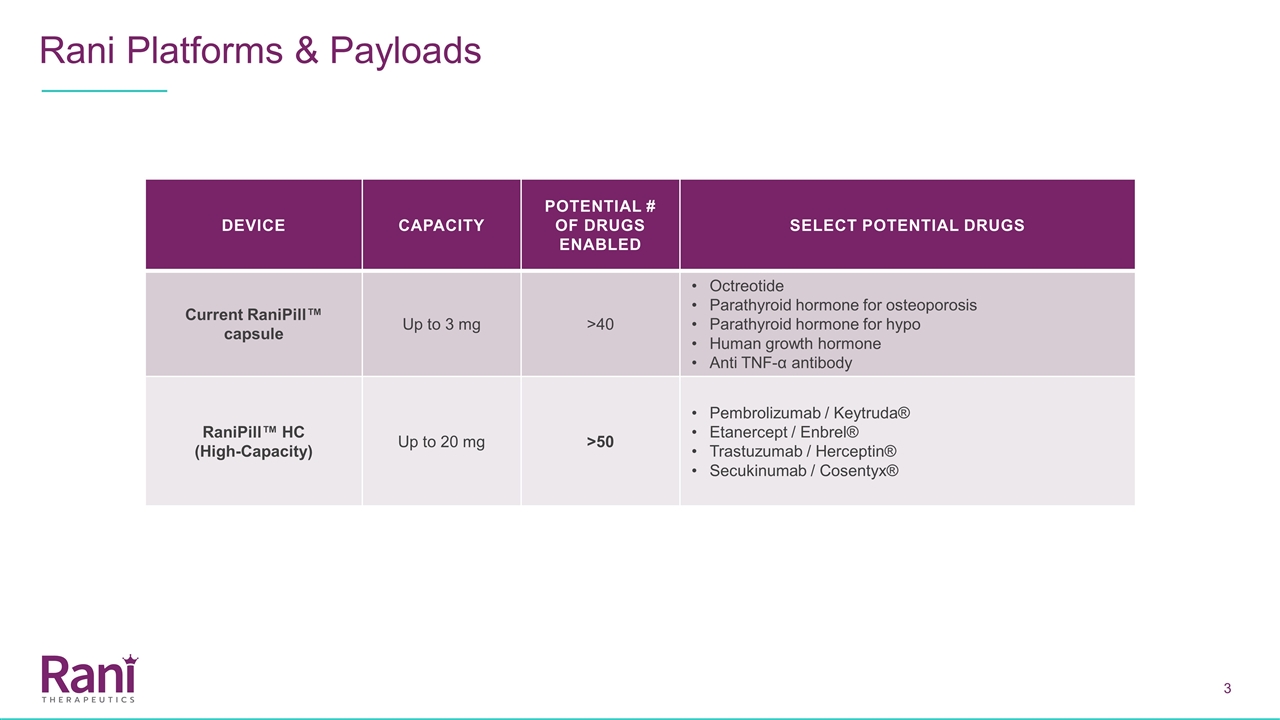
RANI平臺和有效載荷設備 容量潛力#可供選擇的潛在藥物目前蘭尼皮爾™膠囊最高3毫克>40奧曲肽甲狀旁腺激素治療骨質疏鬆症甲狀旁腺激素治療人類生長激素過低抗腫瘤壞死因子-α抗體蘭尼皮爾™ HC(高容量)最高20毫克>50培哚珠單抗/Keytruda®Etanercept/Enbrel®Trastuzumab/Herceptin®Secukinab

RANIPILL™HC高有效載荷 RANIPILL™HC將使更多種類的藥物成為可能,並可能極大地擴大我們的市場機會

蘭尼皮爾™HC研究

高有效負荷系統:研究目標 證明能夠在犬體內輸送高藥物有效負荷(高達20毫克),證實通過Ranipill™HC裝置輸送的阿達利單抗的吸收曲線與之前建立的與阿達利單抗生物相似的歷史對照一致。

Ranipill™HC-Adalimumab: 方案概要測試裝置Ranipill™HC裝置無腸溶包衣膠囊外殼或化學反應物試驗文章和劑量Adalimumab:18 mg/20 mg方案Ranipill™HC裝置通過剖腹手術直接插入空腸腔內Ranipill™氣囊由外部注射器泵充氣(驅動壓力與現有Ranipill™裝置相似)切口閉合縫合血樣採集3mL血樣和5天
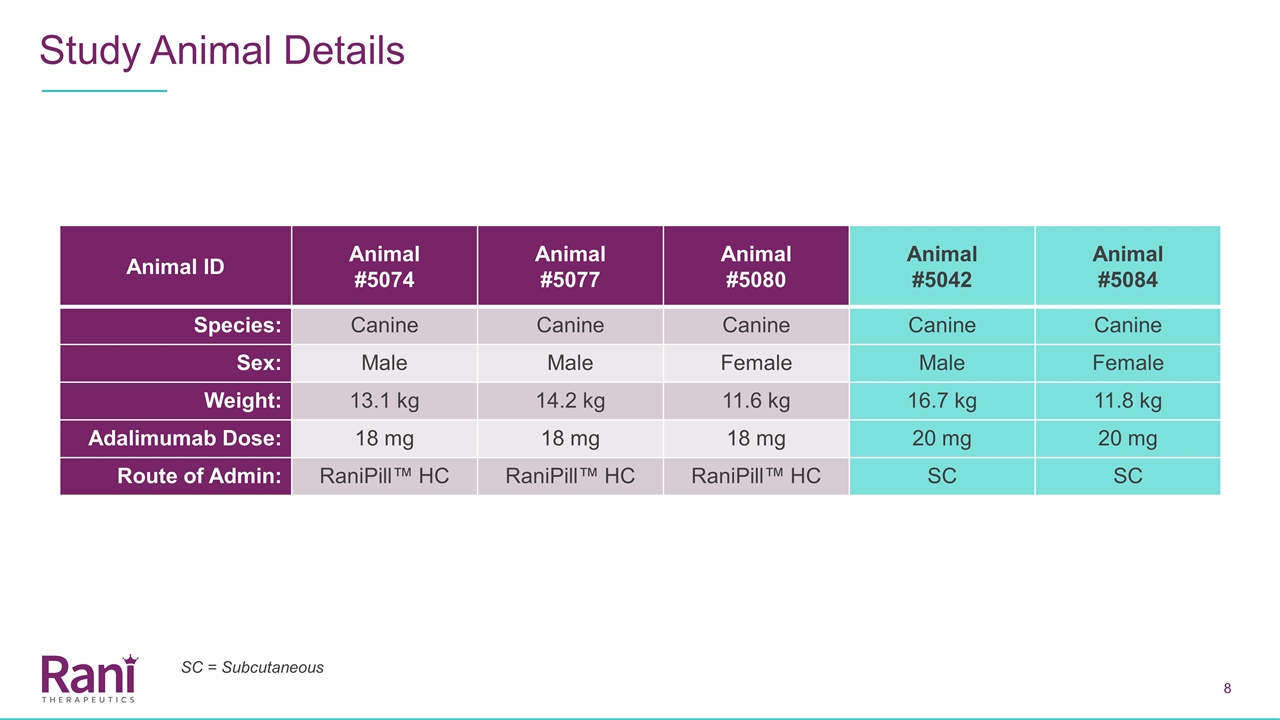
動物ID動物#5074動物#5077動物#5042動物#5084種:犬性別:雄性14.2公斤11.6公斤16.7公斤11.8公斤阿達利單抗劑量:18毫克18毫克18毫克20毫克20毫克給藥途徑:Ranipill™HC=皮下
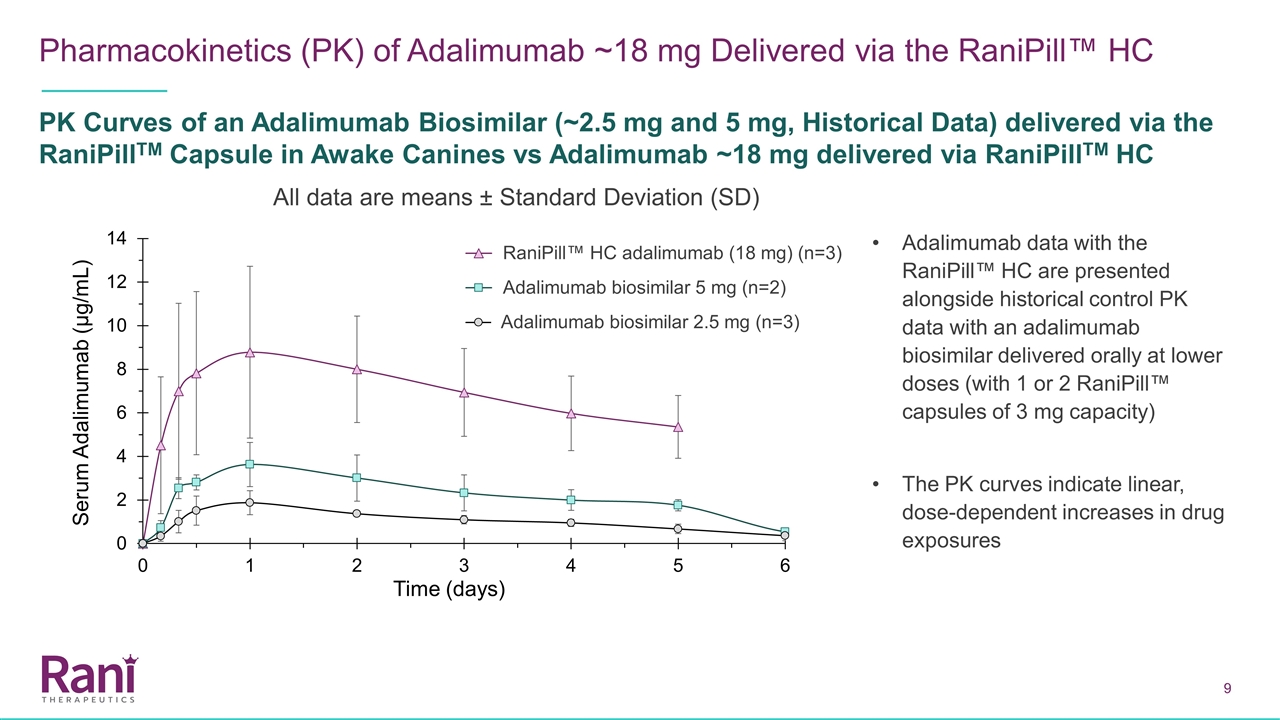
阿達利單抗~18 mg經Ranipill™™HC PK曲線(~2.5 mg和5 mg,歷史數據)在清醒犬體內的藥代動力學(PK)與Adalimumab~18 mg經RaniPill TM HC給藥比較所有數據均為均值±標準差(SD)阿達利單抗數據與歷史對照PK數據一起給出Adalimumab生物相似物5毫克(n=2)、Adalimumab生物相似物2.5 mg(n=3)、Ranipill™HC Adalimumab(18毫克)(n=3)(n=3)
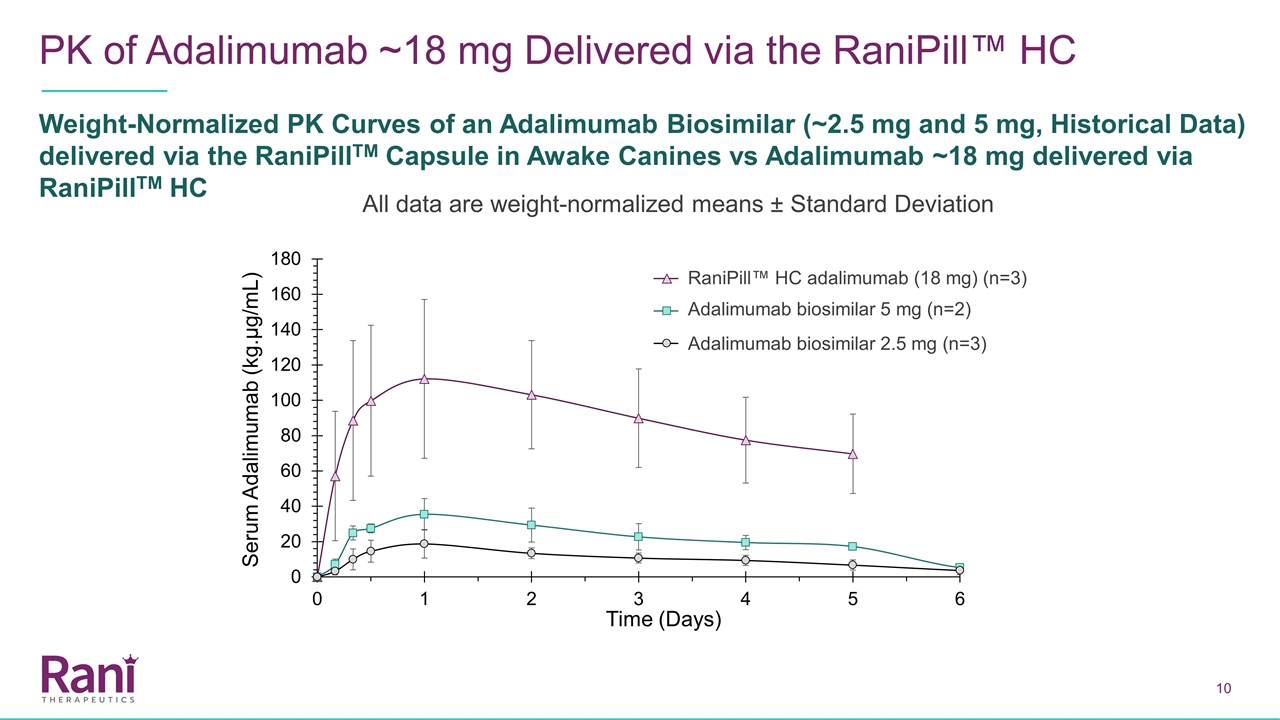
通過Ranipill™HC重量歸一化的PK曲線(約2.5mg和5 mg,歷史數據)在清醒犬體內注射阿達利單抗~18毫克與通過RanipillTM HC給藥的阿達利馬單抗~18毫克相比所有數據均為重量歸一化平均數±標準差阿達利馬單抗生物相似物5毫克(n=2)阿達利姆單抗生物相似物2.5毫克(n=2)阿達利米單抗生物相似物5毫克(n=2)阿達利米單抗生物相似物2.5毫克(n=2)阿達利米單抗生物相似物(n=2)阿達利米單抗生物相似物2.5毫克(n=2)

通過Adalimumab Biosimilar的RaniPill路徑劑量和重量歸一化PK曲線(2.5毫克和5毫克,歷史數據)與通過Ranipill™HC傳遞的Adalimumab~18 mg相比,使用RaniPill™HC設備產生的Adalimumab的PK曲線與通過3 mg Ranipill™膠囊傳遞的Adalimumab生物相似物產生的歷史PK曲線相似。請注意,由於僅收集了長達5天的數據,因此在這項初步研究中,沒有完全捕獲RaniPill™HC的消除階段 Adalimumab Biosimilar 5 mg(n
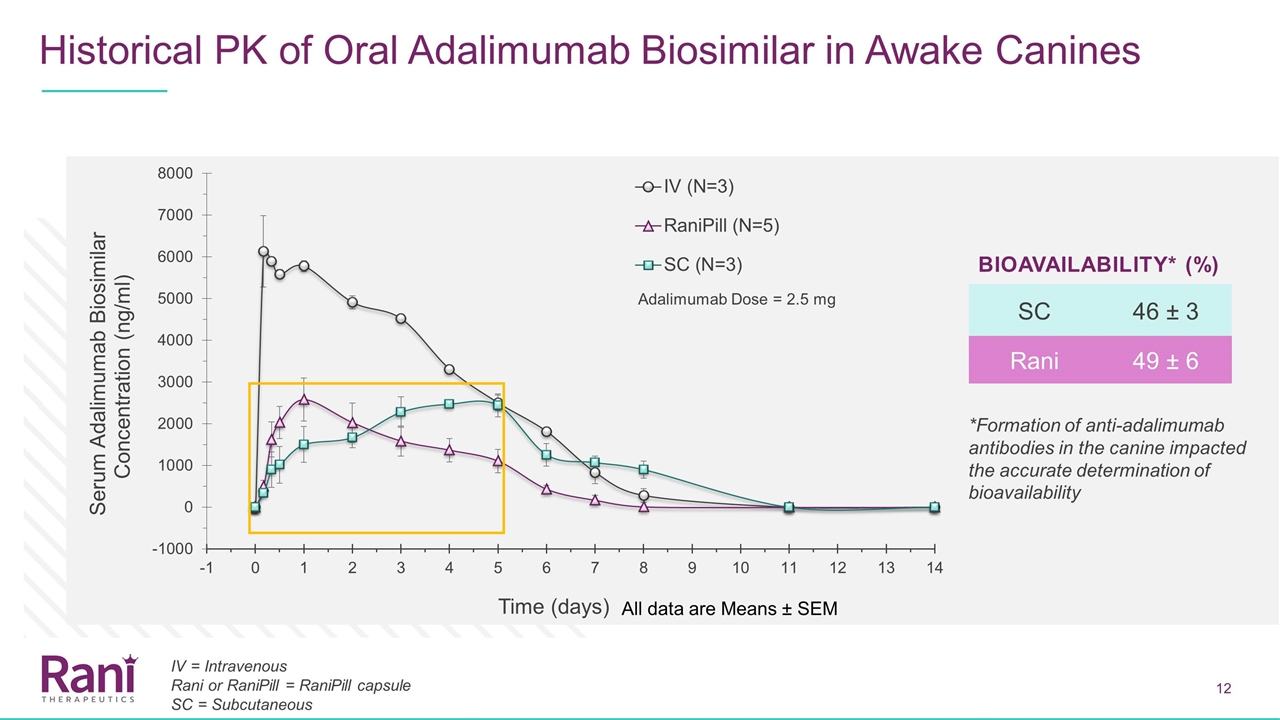
阿達利單抗在清醒犬體內的歷史PK 清醒犬的生物相似性所有數據均為平均值±SEM SC 46±3 RANI 49±6生物利用度*(%)*犬體內抗ADALIMumab抗體的形成影響了ADALIMumab劑量=2.5 mg IV =靜脈注射Rani或RaniPill=RaniPill膠囊SC=皮下注射的生物利用度的準確測定
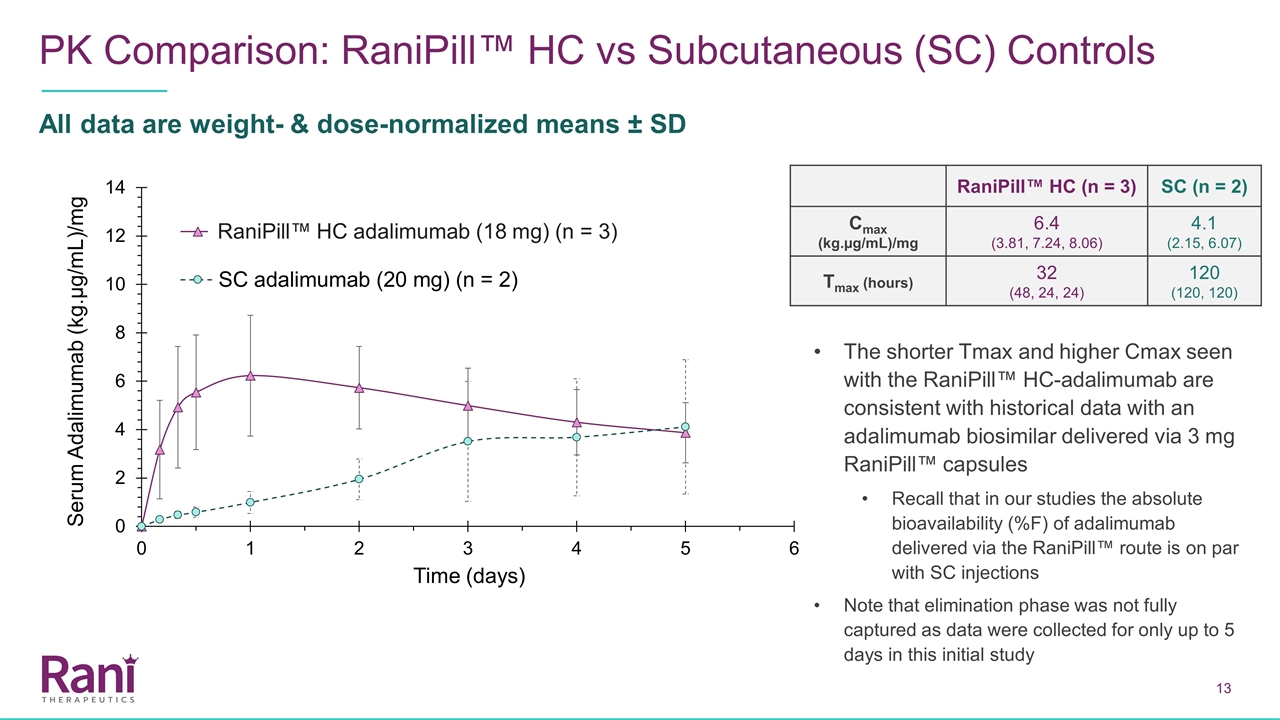
PK比較:Ranipill™HC與 皮下(SC)對照所有數據均為重量和劑量歸一化平均值±SD Ranipill™HC(n=3)SC(n=2)Cmax(kg.µg/mL)/mg 6.4(3.81,7.24,8.06)4.1(2.15,6.07)Tmax(小時)32(48,24,24)120(120,使用Ranipill™HC-Adalimumab的較短的Tmax 和較高的Cmax與通過3毫克Ranipill™膠囊傳遞的Adalimumab生物相似物的歷史數據一致記住,在我們的研究中,通過Ranipill™路線傳遞的Adalimumab 的絕對生物利用度(%F)與SC注射相同。注意,消除階段沒有完全捕獲,因為在最初的研究中僅收集了長達5天的數據Ranipill™HC adalimimab

使用Ranipill™HC裝置,我們已經證明瞭高劑量(18毫克)的阿達利單抗在犬體內的成功給藥。與歷史對照相比,使用Ranipill™HC裝置給藥18 mg的阿達利單抗的血藥濃度呈劑量比例增加(通過目前的Ranipill™膠囊給藥)。與SC相比,使用Ranipill™HC裝置的低劑量(2.5 mg和5 mg)阿達利單抗的Tmax更短。

市場調研
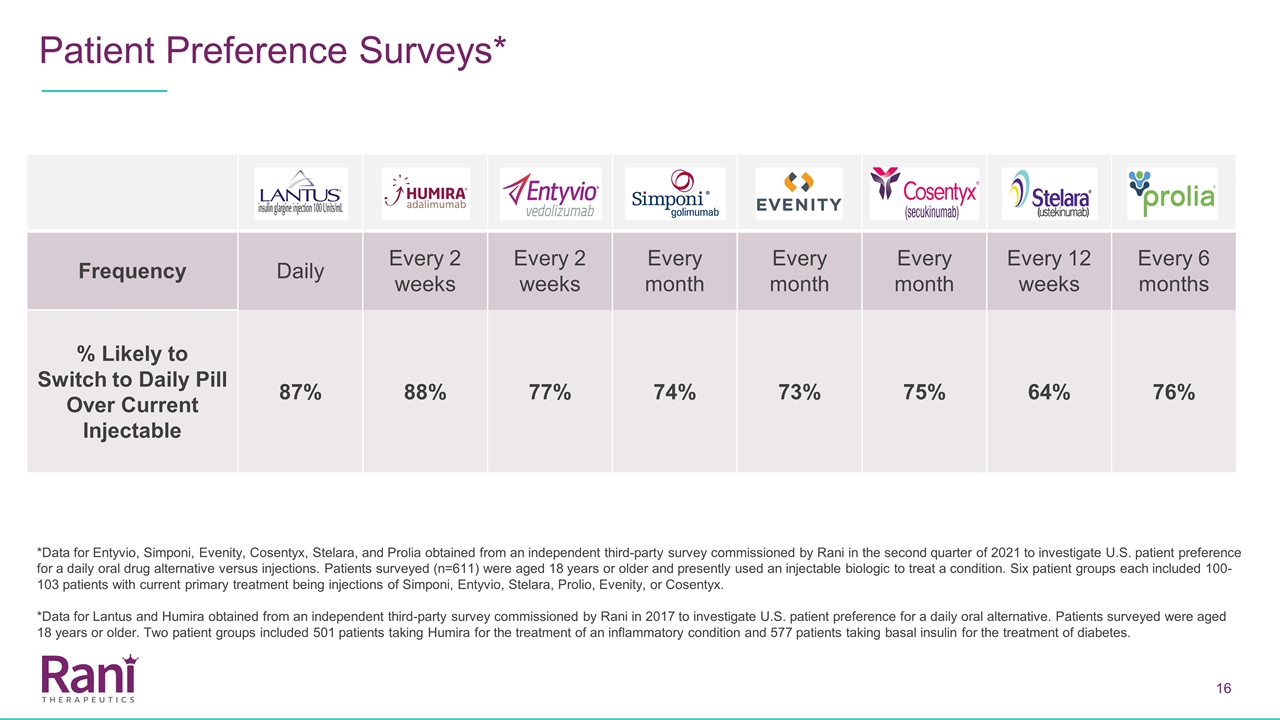
患者偏好調查* 頻率每天每2周每月每12周每6個月轉換為每日避孕藥的可能性超過當前可注射藥物87%88%77%74%73%75%64%76%*Entyvio、Simponi、Evenity、Cosentyx、 Stelara和Prolia的數據來自Rani於2021年第二季度委託進行的獨立第三方調查,以調查美國患者對每日口服藥物替代品的偏好而不是注射。接受調查的患者(n=611)年齡在18歲或以上,目前使用可注射生物製劑治療某種疾病。6個患者組各包括100-103名患者,目前的主要治療是注射Simponi、Entyvio、Stelara、Prolio、Evenity或Cosentyx。*Lantus和Humira的數據來自Rani於2017年委託進行的一項獨立第三方調查,該調查旨在調查美國患者對每日口服替代品的偏好。接受調查的患者年齡在18歲或以上。兩組患者包括501名服用Humira治療炎症性疾病的患者和577名服用基礎胰島素治療糖尿病的患者。

模擬蘭尼皮爾™吞嚥試驗概述目的:評價不同年齡患者對模擬蘭尼皮爾™膠囊的吞嚥易用性患者人羣:目前正在接受各種藥物注射的患者研究設計3組患者年齡組: 21~50歲,51~65歲,66~75歲,每組50人。試驗文章:一種灌裝馬鈴薯澱粉的模擬蘭尼皮爾™膠囊(與目前蘭尼皮爾™膠囊重量和大小相同)
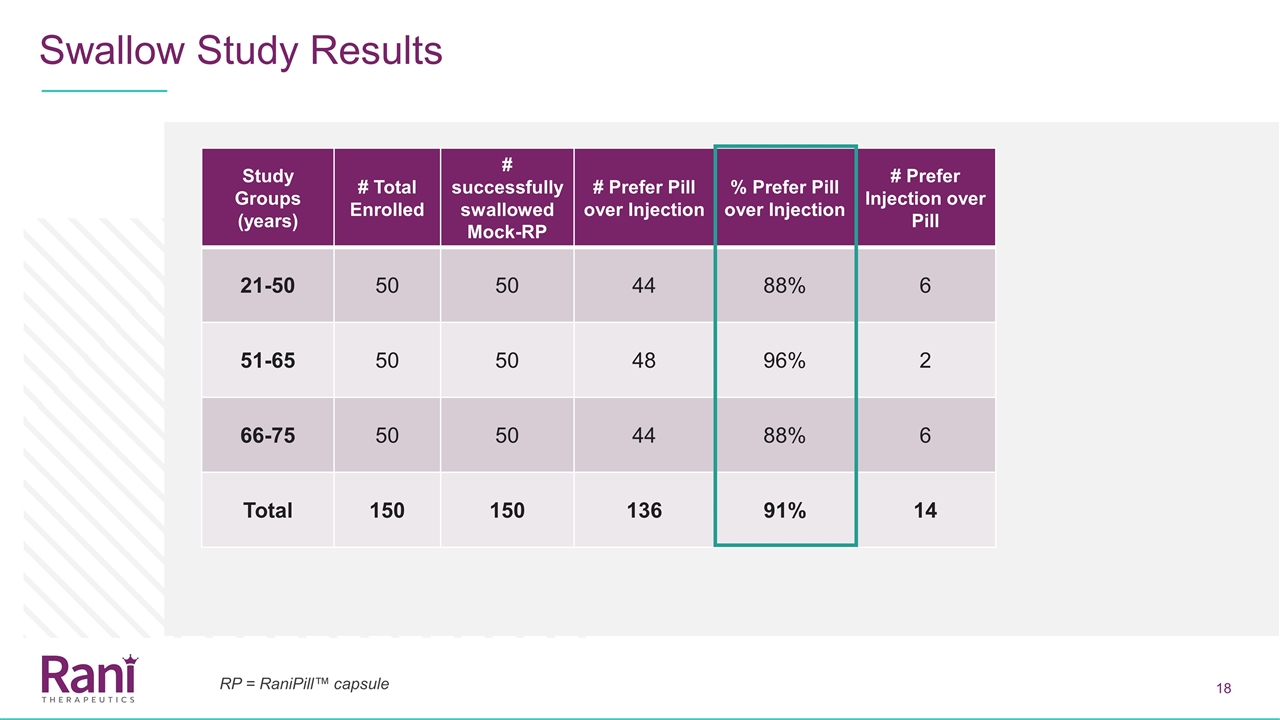
吞嚥研究結果研究組 (年)#入選總數#成功吞嚥模擬-RP#首選丸劑勝過注射劑#首選丸劑勝過注射劑#6 51-65 50 50 48 96%2 66-75 50 44 88%6總計150 150 136 91%14 RP= RaniPill™膠囊

Adalimumab:每日口服雷尼普利劑量的模擬

每日劑量Adalimumab的劑量為每2周40毫克,我們利用我們的人體內窺鏡研究數據(2.5毫克空腸內注射)推測這大約相當於每天2.5毫克的劑量,我們委託穩態模擬 來模擬每天口服一次雷尼皮爾劑量2.5毫克的藥物動力學。根據模擬,預計:血清中阿達伊單抗的治療水平可以40毫克皮下注射或兩週每日兩次口服)減少達到治療水平的時間目前正在服用阿達利瑪單抗40毫克雙週給藥方案的患者可以在最後一次SC劑量阿達利單抗之後的任何時候切換到每天的雷尼皮爾方案

Adalimumab空腸內(IJ)數據的穩態PK模擬:從皮下切換,預計目前正在接受adalimumab 40 mg雙週給藥方案的患者可以在最後一次皮下給藥 adalimumab qd=每日劑量之後的任何時間點改用每天的Ranipill™方案
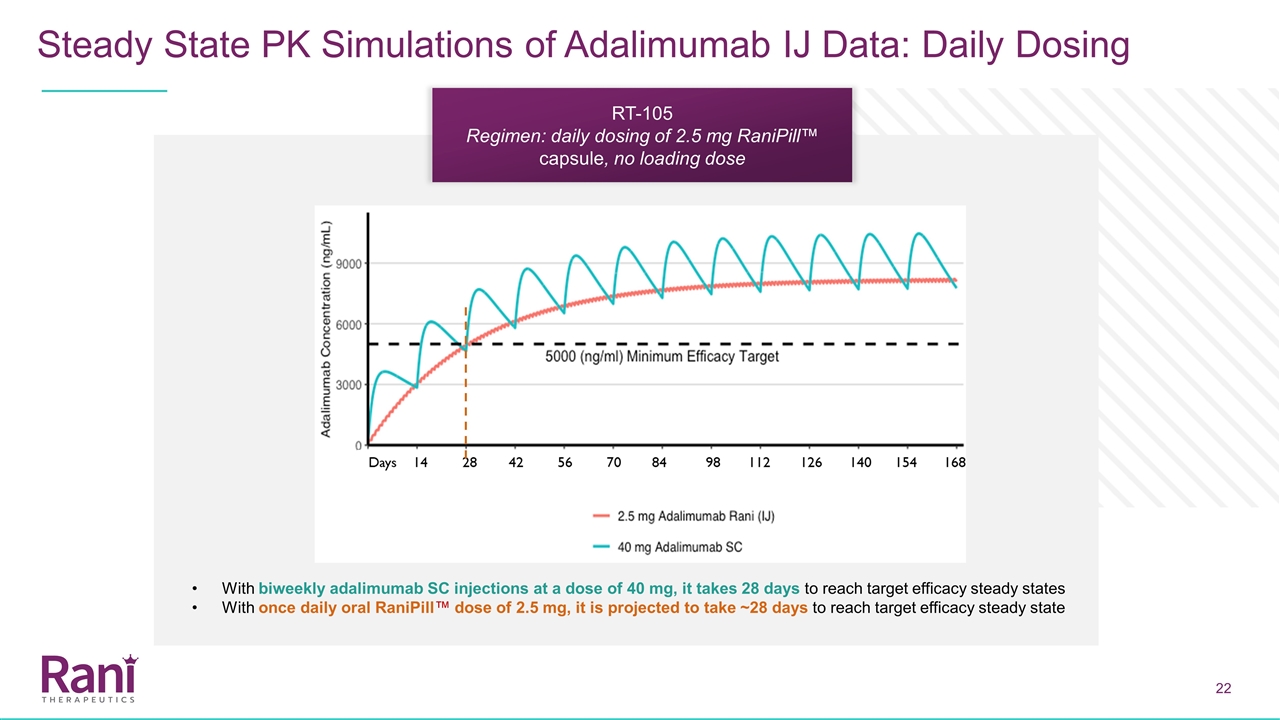
Adalimumab IJ數據的穩態PK模擬:每天給藥兩週一次,劑量為40 mg,每天口服一次雷尼皮爾™劑量為2.5 mg,需要28天才能達到目標療效穩定狀態,預計需要~28天才能達到目標療效 穩定狀態RT-10 5方案:每天給藥2.5 mg雷尼皮爾™膠囊,無負荷量
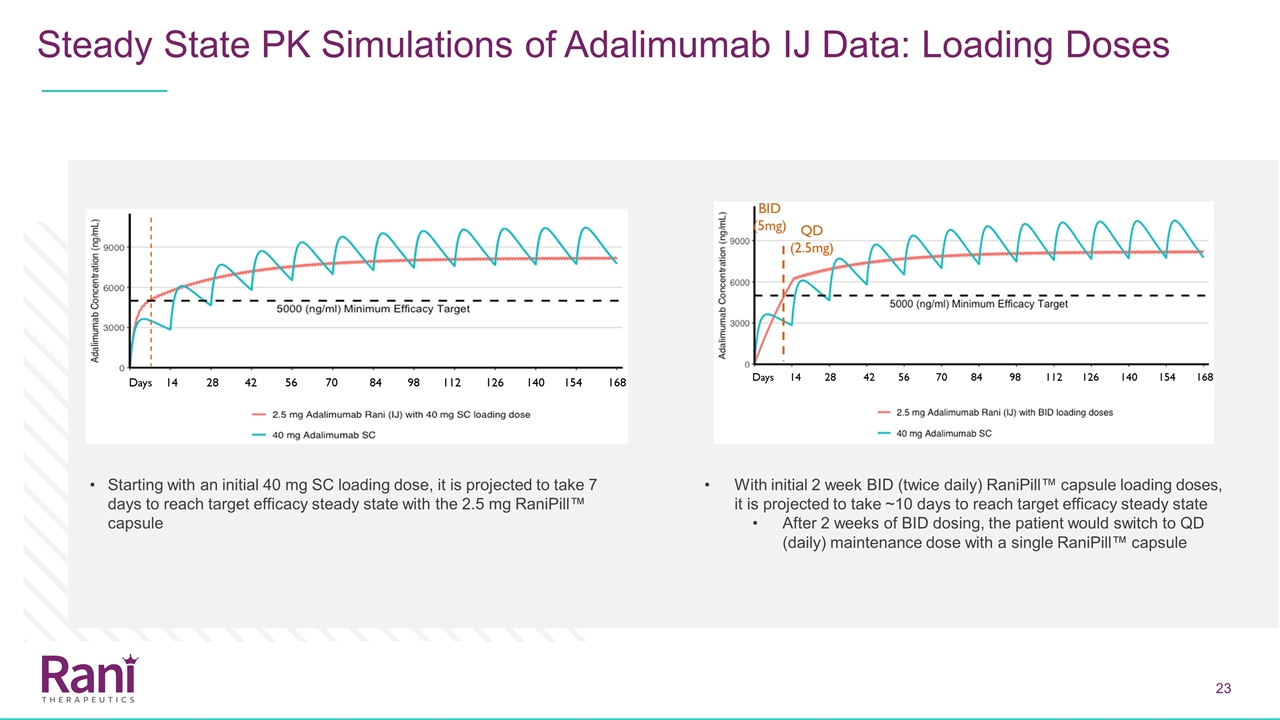
Adalimumab IJ數據的穩態PK模擬:從最初的40 mg SC負荷劑量開始,2.5mgRanipill™膠囊與初始2周Bid(每天兩次)Ranipill™膠囊的負荷劑量預計需要7天才能達到目標療效穩定狀態 預計在2周的Bid劑量後達到目標療效穩定狀態需要~10天,患者將用一粒Ranipill™膠囊切換到Qd(每日)維持量

我們的目標是成為一線生物製藥公司的適應症啟動療法口服Ranipill®生物製劑標準注射劑2型糖尿病二甲雙胍(口服)DPP-4(口服)基礎胰島素和GLP-1(注射劑)基礎胰島素和GLP-1(注射劑)骨質疏鬆 雙膦酸鹽(口服)Teriparatide(注射劑)Denosumab(注射劑)甲狀旁腺功能減退(注射)克羅恩病類固醇和5-氨基水楊酸酯(口服)腫瘤壞死因子-α,α4-整合素(注射)IL-12/23(注射)

謝謝!