
巴夫加魯胺(ARV-110):第1階段劑量升級和臨時熱切第2階段劑量擴大試驗結果2022年2月17日ASCO泌尿生殖系癌症研討會,2022年展覽99.2

本演示文稿包含 “1995年私人證券訴訟改革法案”中定義的前瞻性聲明,這些聲明涉及重大風險和不確定性,包括有關 巴伐魯胺(ARV-110)的潛在優勢和治療益處、巴伐盧胺和我們的其他候選產品的開發和監管狀況、臨牀試驗的時間和這些試驗的數據以及我們的候選產品的註冊計劃,以及我們的任何候選產品的 潛在商業化的聲明。除有關歷史事實的陳述外,本報告中包含的所有陳述,包括有關我們的戰略、未來業務、未來財務狀況、 未來收入、預計成本、前景、計劃和管理目標的陳述,均為前瞻性陳述。“預期”、“相信”、“估計”、“預期”、“打算”、“ ”、“可能”、“計劃”、“預測”、“項目”、“目標”、“潛在”、“將會”、“將會”、“可能”、“應該”、“應該”、“繼續”等類似表述旨在識別前瞻性表述,儘管並不是所有前瞻性表述都包含這些標識性詞語。我們可能無法實際實現我們的前瞻性聲明中披露的計劃、意圖或預期 ,您不應過度依賴我們的前瞻性聲明。由於各種風險和不確定性,實際結果或事件可能與我們在前瞻性 聲明中披露的計劃、意圖和預期大不相同,這些風險和不確定性包括但不限於:我們是否能夠成功地進行和完成巴伐魯胺和我們的其他候選產品的開發,包括我們 是否為我們的候選產品啟動和完成臨牀試驗, 這些風險因素可能會導致我們的實際結果與我們提交給美國證券交易委員會(SEC)的季度和年度報告中“風險因素”部分討論的前瞻性陳述中所述的 有所不同,這些因素可能會導致我們的實際結果與前瞻性陳述中所包含的 不同,這些因素都可能導致我們的實際結果與前瞻性陳述中所述的 不同。本演示文稿中包含的前瞻性陳述 反映了截至本演示文稿發佈之日我們對未來事件的當前看法,除非適用法律要求,否則我們不承擔更新任何前瞻性陳述的義務。這些前瞻性陳述不應被 視為代表公司截至本8-K表格報告日期之後的任何日期的觀點。Arvinas的名稱和徽標是我們的商標。我們還擁有PROTAC®的服務商標和註冊的美國商標 。本演示文稿中出現的商標、商號和服務標誌均為其各自所有者的財產。對於本 演示文稿中指定的商標,我們已省略了適用的®和™名稱。本演示文稿還包含獨立各方和我們對市場規模的估計和其他統計數據,以及有關我們行業的其他數據。此數據涉及許多假設和限制,請您 不要過分重視此類數據和估計。此外,對我們未來業績和我們經營的市場的未來業績的預測、假設和估計必然會受到高度的不確定性和風險 的影響。安全港和前瞻性陳述

巴夫德古拉胺1期試驗(ARV-110)已經完成,到目前為止,幾乎所有參加2期急切試驗的患者都登記了數據,顯示在所有AR患者中,AR T878X/H875Y突變與腫瘤對巴伐古魯胺46%PSA50的高反應性相關。在7名RECIST可評估患者中,有2名患者持久確認部分應答,其中2名患者PSA下降,RECIST治療有效。7名腫瘤減少的患者中,6名患者PSA下降,RECIST治療無效。無≥4級TRAE由於TRAE,RP2D的停用率或劑量減少率較低 在NHA後患者中,潛在的通過伴隨診斷方法加速上市的路徑;目標是在2022年年底之前啟動關鍵試驗巴伐魯胺的療效和可管理耐受性的強健信號支持一條潛在的途徑 加速批准AR=雄激素受體;nHA=新型激素劑;PSA=前列腺特異抗原;PSA50=最佳PSA下降≥50
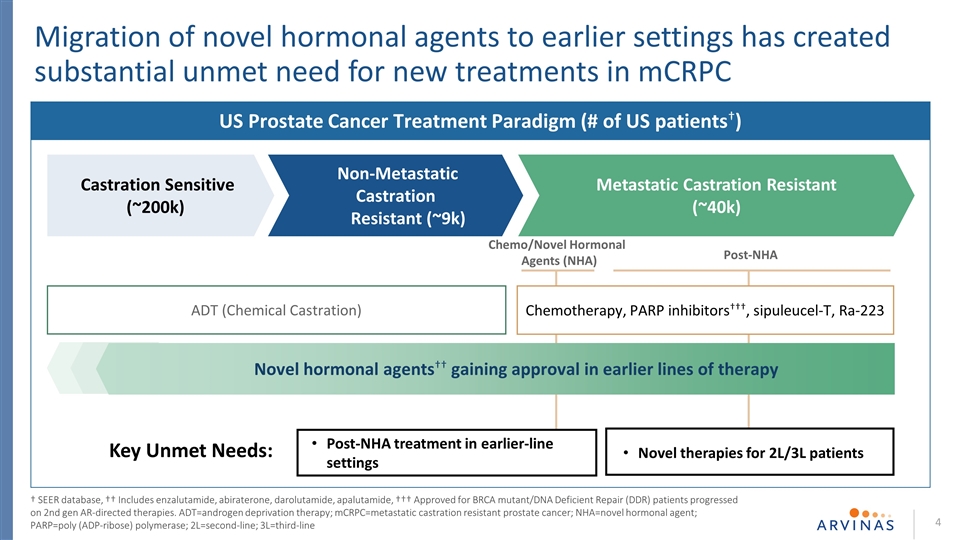
2L/3L患者的新療法 早期NHA治療後的關鍵需求尚未得到滿足:新型激素藥物向早期環境的遷移在mCRPC去勢敏感型(~200k)美國前列腺癌治療模式(# 美國患者†)轉移性去勢抵抗(~40k)非轉移性去勢抵抗(~9k)化療/新型激素劑(NHA)化療後PARPC中產生了大量未得到滿足的新療法。RA-223ADT(化學閹割)第二代AR導向療法††新型激素製劑††在早期系列療法中獲得批准†SEER數據庫中,††包括苯扎魯胺、阿比特龍、達魯他胺、阿帕魯胺、†††,被批准用於BRCA突變/脱氧核糖核酸缺陷修復(DDR)患者的第二代AR導向療法正在進行第二代AR導向療法。Adt=雄激素剝奪療法;mCRPC=抗去勢轉移性前列腺癌;nHA=新型激素劑; PARP=聚(ADP-核糖)聚合酶;2L=二線;3L=三線
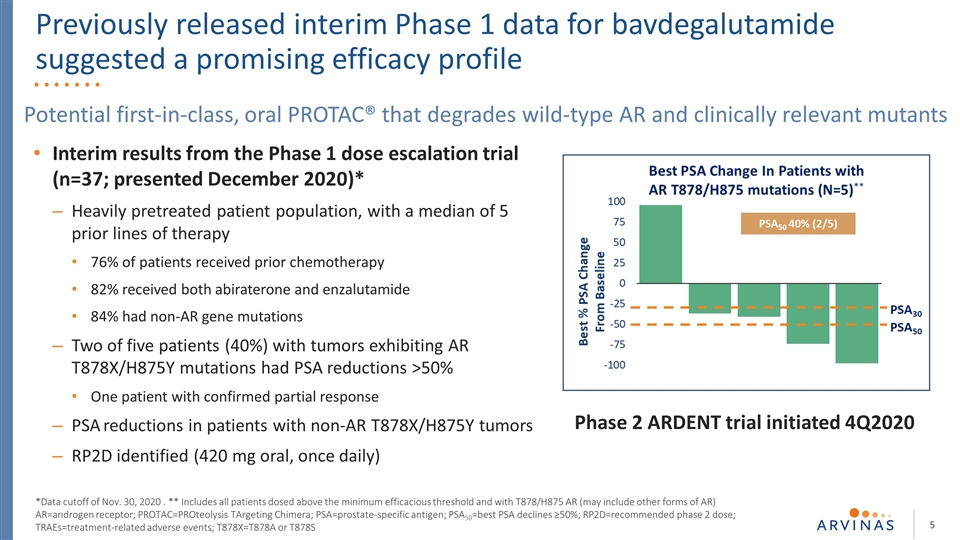
第一階段劑量升級試驗的中期結果(n=37;2020年12月公佈)*嚴重預處理的患者羣體,之前接受過5個治療路線的中位數76%接受過化療的患者82%同時接受阿比特龍和苯扎魯胺治療84%有非AR基因 突變顯示AR T878X/H875Y突變的5名腫瘤患者中有2名(40%)PSA下降>50%1名確診部分應答PSA下降的非AR T878X/H875Y腫瘤患者RP2D(420毫克口服,一旦口服PROTAC®,可降解野生型AR和臨牀相關突變體*截止日期為2020年11月30日。* 包括所有劑量超過最低有效閾值且使用T878/H875 AR(可能包括其他形式的AR)的患者AR=雄激素受體;PROTAC=針對嵌合體的蛋白水解;PSA=前列腺特異抗原;PSA50=最佳PSA下降≥50%; RP2D=推薦的第二階段劑量;TRAES=與治療相關的不良事件;T878X=T878A或T878S第二階段啟動的劇烈試驗
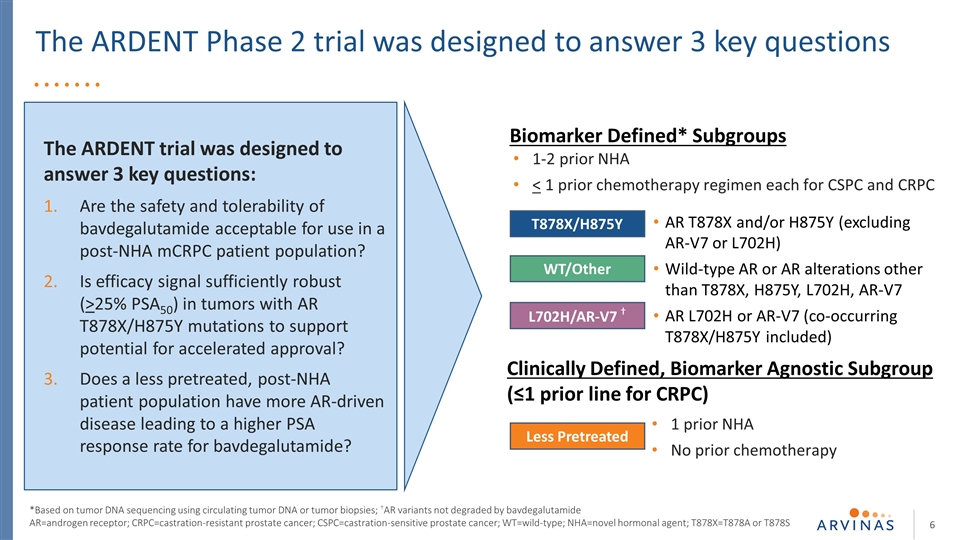
熱切2期試驗旨在回答3個關鍵問題。熱切試驗旨在回答3個關鍵問題:巴伐魯胺的安全性和耐受性是否可接受用於NHA後的mCRPC患者?在AR T878X/H875Y突變的腫瘤中,療效信號是否足夠強(>25%PSA50) 以支持加速批准的可能性?接受較少預處理的NHA患者羣體是否有更多AR驅動的疾病,從而導致巴伐地高盧胺的PSA應答率更高?NHA之前定義的生物標誌物* 亞組1-2
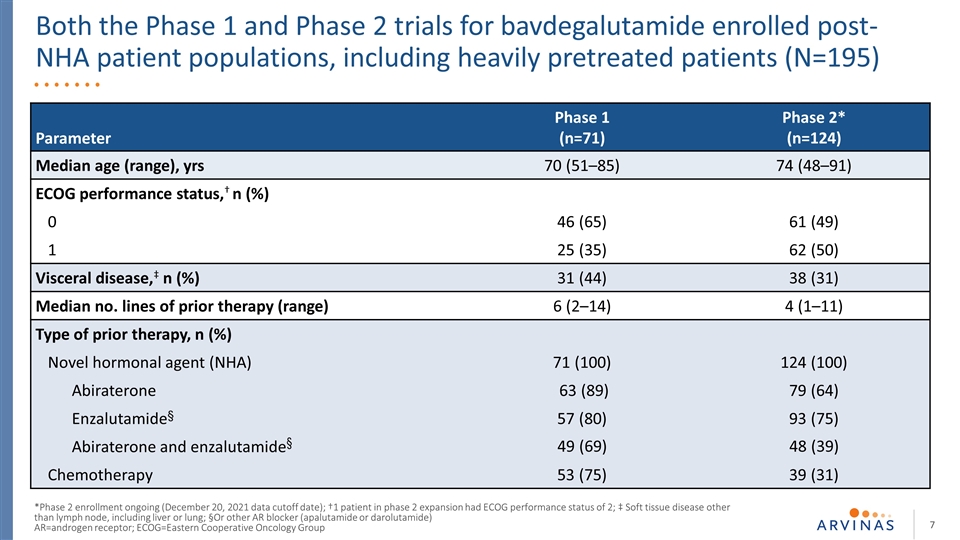
參數1(n=71)2期* (n=12 4)中位年齡(範圍),年齡70(51-85)74(48-91)腦電圖表現狀態,†n(%)0 46(65)61(49)1 25(35)62(50)內臟疾病,‡n(%)31(44)38(31)中位數NO既往治療路線(範圍)6(2-14)4 (1-11)既往治療類型,n(%)新型激素劑(NHA)71(100)124(100)阿比拉特隆63(89)79(64)恩扎魯胺§57(80)93(75)阿比拉特隆和苯扎魯胺§49(69)48(39)化療§53(75)39(31)巴伐他胺1期 和2期試驗†2期擴張期患者1例,COG評分為2分;‡軟組織疾病淋巴結以外的疾病,包括肝或肺;§或其他AR阻滯劑(阿帕魯胺或達魯他胺)AR=雄激素受體;ECOG=東部合作腫瘤組

熱切的2期試驗旨在回答3個關鍵問題:巴伐地高盧胺的安全性和耐受性是否可接受用於NHA後mCRPC患者羣體?在AR T878X/H875Y突變的腫瘤中,療效信號是否足夠強(>25%PSA50)以支持加速批准的潛力?接受較少預處理的NHA患者羣體是否有更多AR驅動的疾病,從而導致巴伐地高盧胺的PSA應答率更高?AR=雄激素受體;mCRPC=耐去勢轉移性前列腺癌 ;nHA=新型激素劑;T878X=T878A或T878S
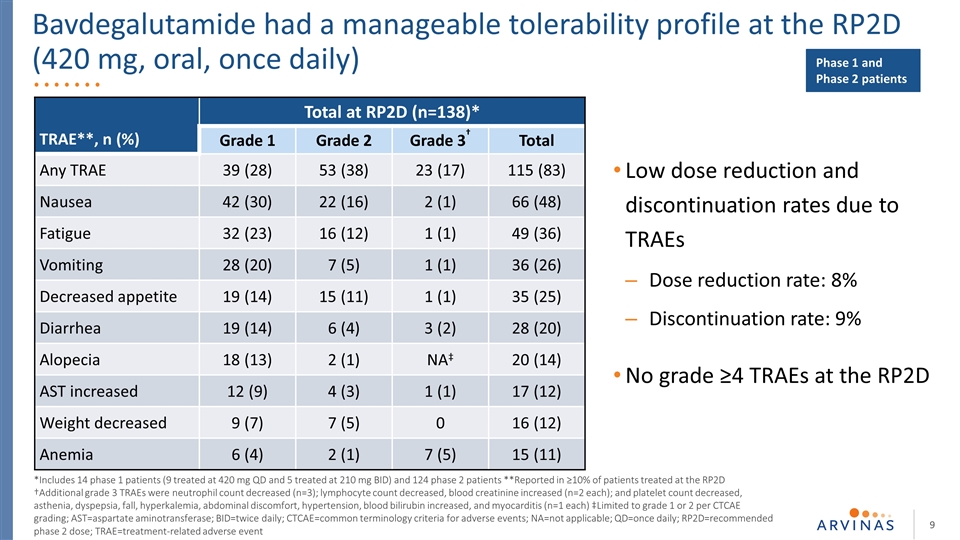
巴伐盧胺在RP2D(420毫克,口服,每天一次)的低劑量減少率和停藥率是可控的,這是由於TRAEs的劑量減少率:8%的停用率:9%無等級≥*包括14名第1期患者(9名接受420mgqd治療,5名接受210mgbid治療)和124名第2期患者**據≥報告,10%的患者接受了RP2D†額外級別的治療(9名患者接受420 mg qd治療,5名患者接受210 mg bid治療)和124名2期患者**據報道,在RP2D†附加級別接受治療的患者中,有10%的患者接受了TRAEs的治療血小板減少,虛弱,消化不良,跌倒,高鉀,腹部不適,高血壓,血膽紅素升高,心肌炎(n=1)‡限制為1級或2級,按CTCAE分級;AST=天冬氨酸轉氨酶;BID=每日兩次;CTCAE=不良事件的通用術語標準;NA=不適用;QD=每天一次;RP2D=推薦的2期劑量;TRAE=與治療相關的不良事件TRAE**,N(%)RP2D總計(n=138)*1級2級 3級†總計39(28)53(38)23(17)115(83)噁心42(30)22(16)2(1)66(48)疲勞32(23)16(12)1(1)49(36)嘔吐28(20)7(5)1(1)36(26)食慾下降19(14)15(11)1(1)35(25)腹瀉Br}(2)28(20)脱髮18(13)2(1)NA‡20(14)AST12(9)4(3)1(1)17(12)體重減少9(7)7(5)0 16(12)貧血6(4)2(1)7(5)15(11)1期和2期患者

這項熱切的2期試驗旨在回答3個關鍵問題:AR=雄激素受體;mCRPC=耐去勢轉移性前列腺癌;NHA=新型激素劑;T878X=T878A或T878S。在NHA後的mCRPC患者中使用巴伐他胺的安全性和耐受性是否可以接受 ?在AR T878X/H875Y突變的腫瘤中,療效信號是否足夠強(>25%PSA50),以支持加速批准的可能性?經過較少預處理的NHA患者羣體是否有更多AR驅動的疾病,從而導致巴伐地高盧胺的PSA應答率更高?
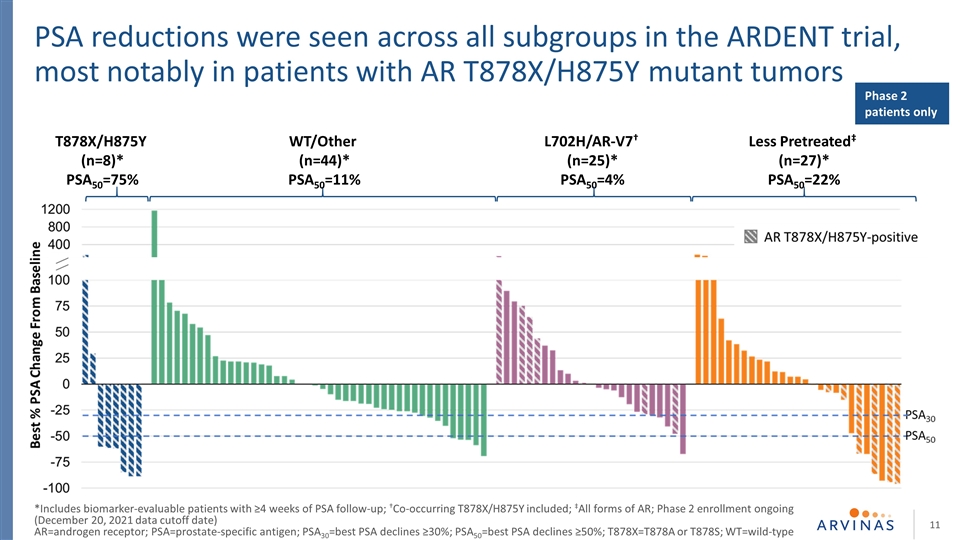
L702H/AR-V7†(n=25)*PSA50=4% T878X/H875Y(n=8)*PSA50=75%在熱切試驗的所有亞組中均可見PSA降低,尤其是在AR T878X/H875Y突變腫瘤WT/Other(n=44)患者中最明顯*PSA50=11%預處理‡(n=27)*PSA50=22%僅2期患者 PSA30=最佳PSA下降≥30%;PSA50=最佳PSA下降≥50%;T878X=T878A或T878S;WT=野生型
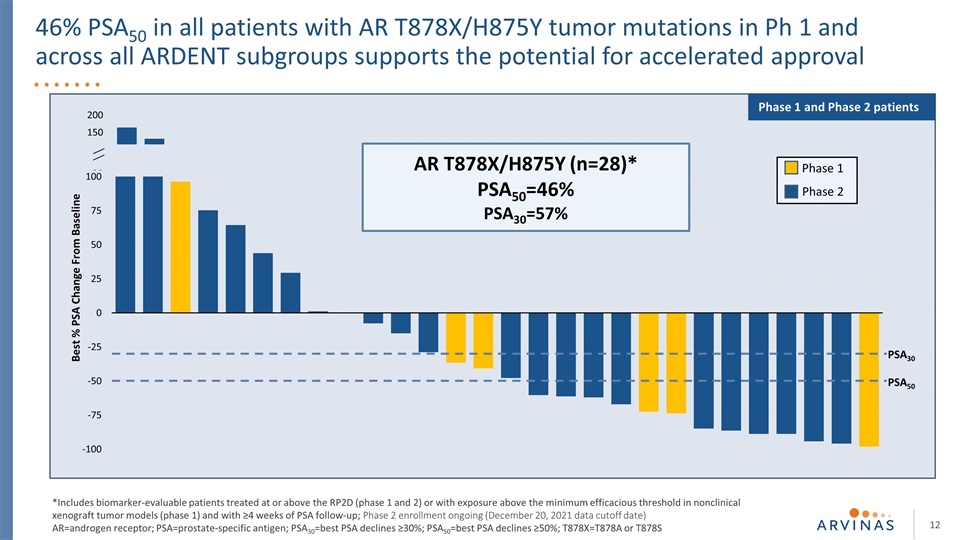
Ph 1中所有AR T878X/H875Y腫瘤突變患者的46%PSA50支持加速批准的可能性從基線PSA50 PSA30 AR T878X/H875Y(n=28)*PSA50=46%PSA30=57%*PSA50=46%PSA30=57%*包括接受RP2D或以上(1和2期)治療或暴露在最低有效閾值以上的可進行生物標記物評估的患者 PSA50=最佳PSA下降≥50%;T878X=T878A或T878S一期、二期、一期和二期患者
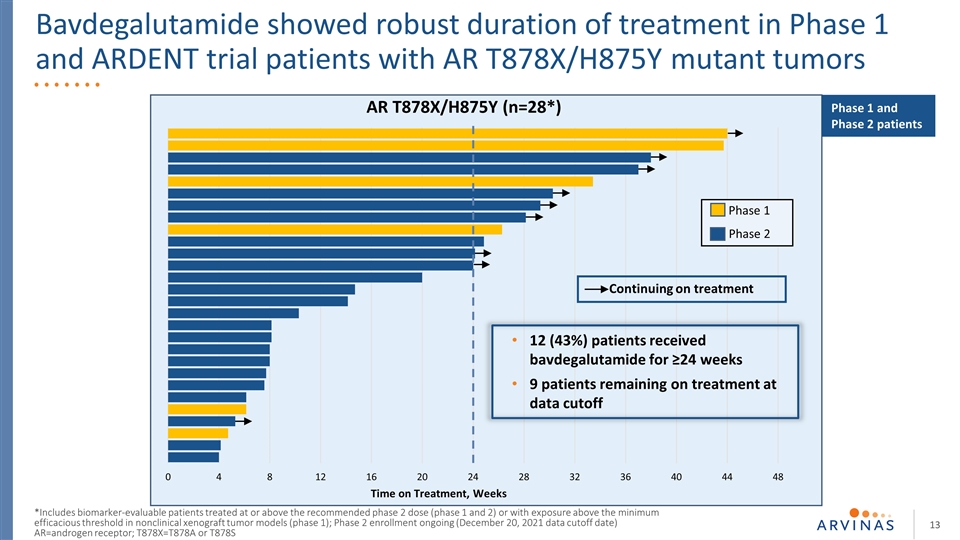
巴夫加魯胺顯示出強勁的1期治療持續時間和熱切試驗AR T878X/H875Y突變腫瘤患者持續治療時間,AR T878X/H875Y(n=28*)繼續治療12例(43%)患者接受≥治療24周9名患者在數據截止期1期和2期繼續治療 包括在推薦的2期劑量(1期和2期)或以上治療的可進行生物標記物評估的患者。T878X=T878A或T878S 1期和2期患者
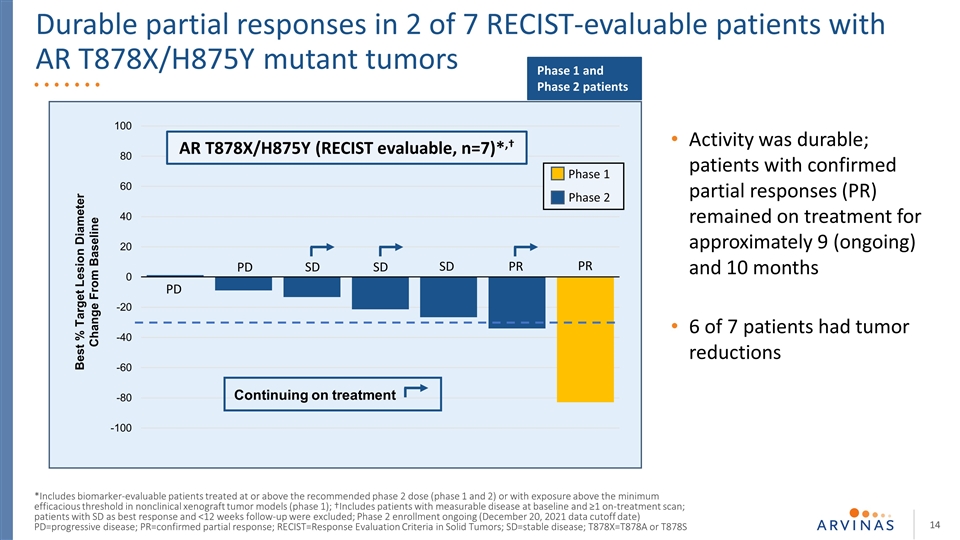
7名可接受RECIST評估的AR T878X/H875Y突變腫瘤患者中有2名出現持久的部分反應 靶區直徑較基線PD PD SD PR PR AR T878X/H875Y改變的最佳百分比(RECIST可評估,n=7)*,†繼續治療*包括在非臨牀異種腫瘤模型中接受推薦的2期劑量(1期和2期)或暴露在最低有效閾值以上的生物標誌物可評估患者
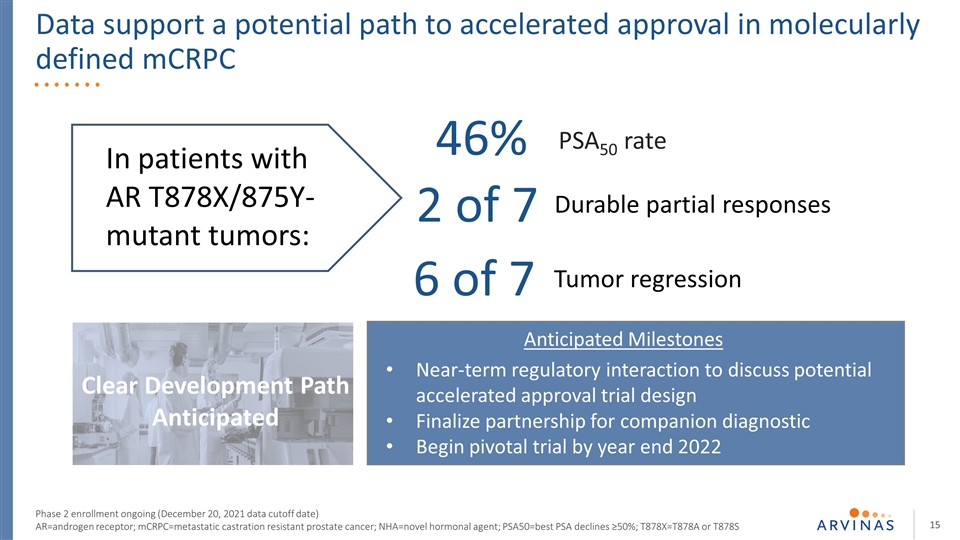
數據支持在分子定義的mCRPC第二階段登記中加速批准的潛在途徑正在進行中(2021年12月20日數據截止日期)AR=雄激素受體;mCRPC=轉移性去勢耐受前列腺癌;nHA=新型激素劑;PSA50=最佳PSA下降 ≥50%;T878X=T878A或T878S明確的發展路徑預期的近期調控相互作用,以討論可能的加速批准試驗設計最終確定夥伴關係診斷開始樞軸

巴夫加魯胺作為前列腺癌患者精確藥物的潛在機會*Ledet等人,腫瘤學家2019年;24 AR=雄激素受體;mCRPC=轉移性去勢抵抗前列腺癌;CSPC-去勢敏感型前列腺癌;NHA=新型激素劑;CTDNA=循環腫瘤DNA選擇攜帶AR T878/H875腫瘤突變的患者可提供“針對患者的正確藥物”基於血液的檢測(CTDNA)使患者識別變得容易AR T878/875代表了10%的≥患者 前列腺癌患者使用CTDNA檢測的情況越來越多,因為越來越多的新診斷(CSPC)患者接受NHAS治療,巴伐魯胺作為NHA後治療的需求和潛在機會也在增加

這項熱切的2期試驗旨在回答3個關鍵問題:AR=雄激素受體;mCRPC=耐去勢轉移性前列腺癌;NHA=新型激素劑;T878X=T878A或T878S。在NHA後的mCRPC患者中使用巴伐他胺的安全性和耐受性是否可以接受 ?在AR T878X/H875Y突變的腫瘤中,療效信號是否足夠強(>25%PSA50),以支持加速批准的可能性?經過較少預處理的NHA患者羣體是否有更多AR驅動的疾病,從而導致巴伐地高盧胺的PSA應答率更高?
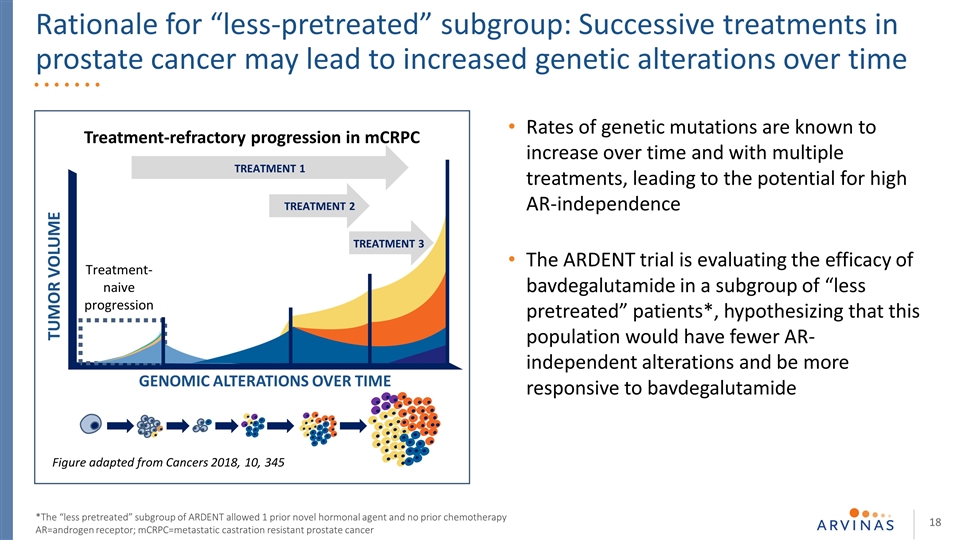
已知基因突變率隨着時間的推移和多種治療的增加而增加,導致高AR獨立性的可能性。熱切的試驗正在評估巴伐魯胺在一組“較少預處理”患者中的療效*,假設這一 人羣將具有較少的AR非依賴性改變,並且隨着時間的推移對巴伐盧胺腫瘤體積的基因組改變更敏感治療1治療2治療3從癌症改編而來的數字2018,10,345治療-mCRPC治療的難治性進展-“預處理較少”亞組的幼稚進展原理:前列腺癌的連續治療可能會導致基因改變隨着時間的推移而增加*熱情 的“預處理較少”亞組允許1種先前的新激素製劑,而不允許先前的化療AR=雄激素受體;MCRPC=耐去勢轉移性前列腺癌
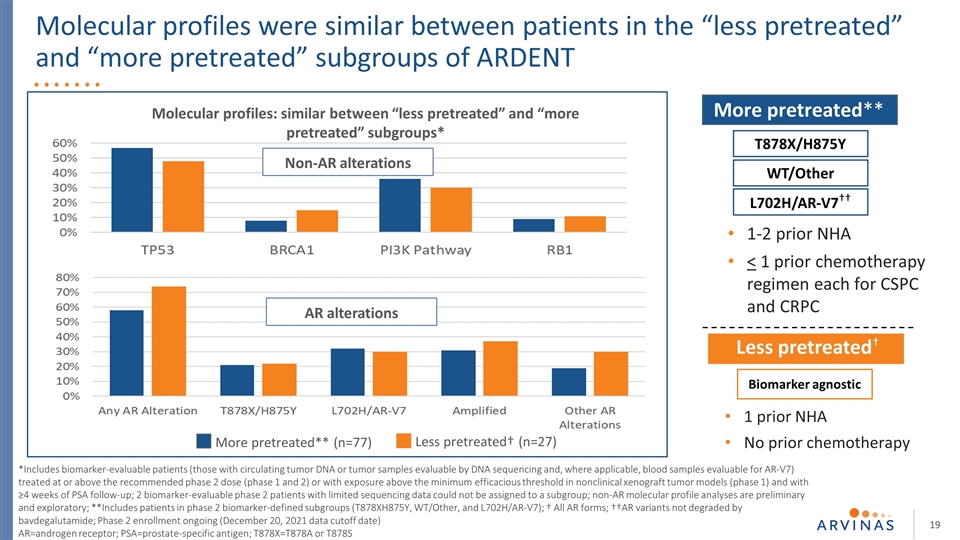
在“較少預處理”和“較多預處理”亞組的患者之間,分子圖譜相似 *包括那些生物標誌物可評估的患者(那些具有循環腫瘤dna或可通過dna測序評估的腫瘤樣本的患者,在適用的情況下, 可評估AR-V7的血液樣本),治療達到或超過推薦的第二期劑量(第1和2期),或在非臨牀異種腫瘤模型(第1期)中暴露於高於最低有效閾值的情況下,並接受≥4周的前列腺特異性抗原隨訪;2非AR分子圖譜分析是初步的和探索性的;**包括2期生物標記物定義的亞組(T878XH875Y、WT/OTHER和L702H/AR-V7)的患者;†所有AR形式;††AR變體未被巴伐德魯胺降解;2期登記正在進行(2021年12月20日數據截止日期)AR=雄激素受體;PSA=前列腺特異抗原;T878X=T878A或T878S 預處理較少**(n=77)預處理較少†(n=27)非AR改變AR改變:“預處理較少”和“預處理較多”亞組之間相似**T878X/H875Y WT/其他L702H/AR-V7††生物標記物不可知性預處理較少†1之前NHA之前無化療1-2之前NHA
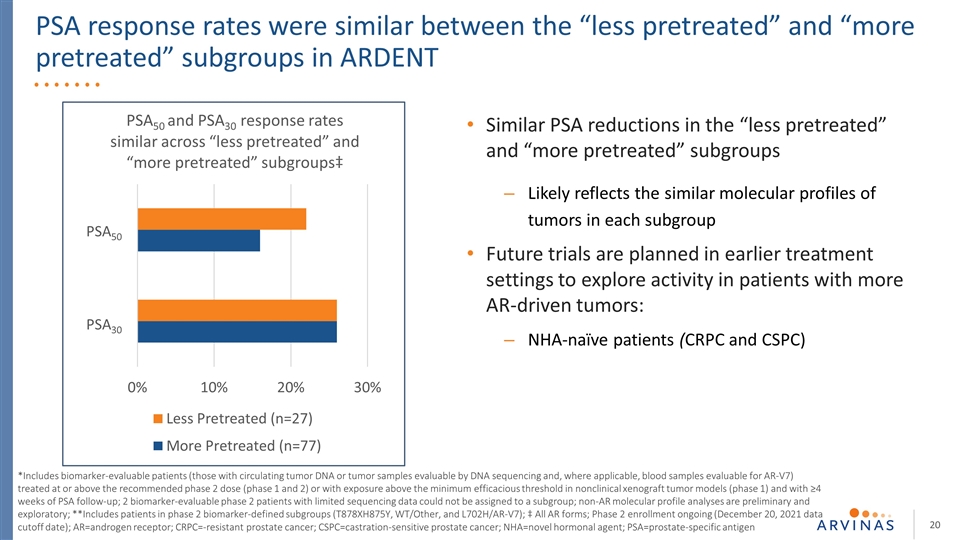
PSA應答率在“較少預處理”和“較多預處理”亞組之間相似 在熱切*包括生物標記物可評估的患者(那些循環腫瘤dna或腫瘤樣本可通過dna測序和血液樣本評估AR-V7的患者),治療達到或超過推薦的2期劑量(1期和2期),或在非臨牀異種腫瘤模型(1期)中暴露於最低有效閾值以上,並接受≥4周的PSA隨訪;2.(2)非臨牀異種移植瘤模型(第1期)中暴露於最低有效閾值以上的患者*包括接受4周PSA隨訪的生物標誌物可評估的患者(那些具有循環腫瘤dna或可通過dna測序評估的腫瘤樣本,以及可評估AR-V7的血液樣本)非AR分子圖譜分析是初步的和探索性的;**包括第2期生物標記物定義的亞組(T878XH875Y、WT/OTHER和L702H/AR-V7)的患者;‡所有AR形式;正在進行的第2期登記(2021年12月20日數據截止日期);AR=雄激素受體;CRPC=耐藥前列腺癌;CSPC=去勢敏感型前列腺癌;nHA=新型激素製劑; PSA=前列腺特異性抗原“預處理較少”和“預處理較多”亞組中類似的PSA降低可能反映了每個亞組中腫瘤的相似分子特徵未來試驗計劃在較早的 治療環境中進行,以探索更多AR驅動的腫瘤患者的活性:無症狀患者(CRPC和CSPC)PSA50 PSA30

2022年上半年:與FDA討論潛在的加速審批路徑 最終確定伴隨診斷2H 2022啟動針對患有AR T878/H875腫瘤突變圖譜的患者的關鍵試驗巴伐魯胺可能在mCRPC AR=雄激素受體;FDA=食品和藥物管理局;CSPC=閹割敏感型前列腺癌;mCRPC=轉移性閹割抵抗前列腺癌方面支持明確的精確藥物機會 ;NHA=新的激素藥物預計將在2022年達到里程碑,同時在更廣泛的患者羣體中探索 機會:CRPC和CSPC在NHA前後的單一治療或聯合治療(例如阿比特龍)潛在的加速批准途徑未滿足的需求預計將隨着NHAS的早期近期進展而增加, T878/H875陽性mCRPC的精確機會 在T878/H875陽性的mCRPC中,預計未得到滿足的需求將隨着NHAS的提早而增加。 在T878/H875陽性的mCRPC中, 精確機會

在接受1-2種先前新型激素藥物治療的mCRPC嚴重預處理患者中,臨牀活動的強勁信號 支持加速批准AR T878X/H875Y突變腫瘤患者的潛在途徑:46%的PSA50率,7名經RECIST評估的患者中有2名有持久的部分反應 ;腫瘤減少的7名患者中有6名43%的患者持續治療24周或更長時間,腫瘤患者的PSA下降和RECIST反應被認為降低了對AR治療的反應性 可管理的耐受性概況計劃在早期、更廣泛的患者羣體中探索巴伐魯胺,預計在2022年年底之前在T878/H875突變腫瘤患者中啟動一項關鍵試驗,並 探索結論mCRPC=轉移性CAC第2階段登記 正在進行(2021年12月20日數據截止日期)

附錄