目錄
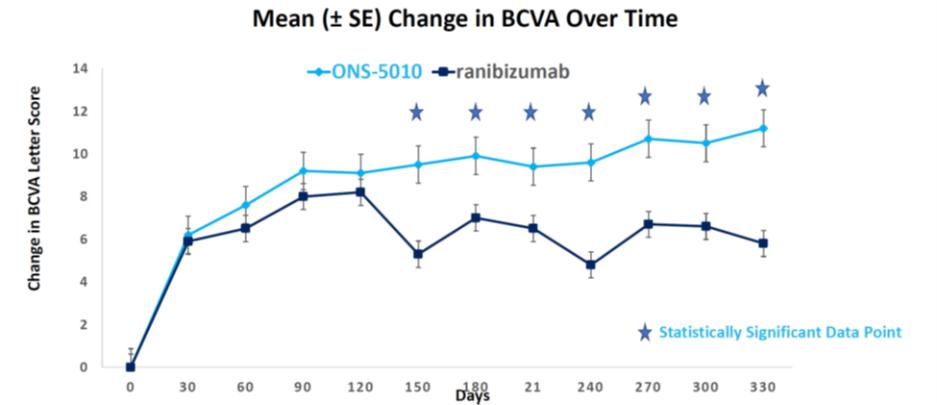
1045、美國許可的阿瓦斯丁和歐盟許可的阿瓦斯丁為Mean。時間零處的垂直線表示劑量。這些結果表明這三種產品之間有很高的相似性。
ONS-1045與阿瓦斯丁(美國和歐盟)的效力比較
市場機會
老年性黃斑變性(AMD)是一種常見的眼病,也是50歲及以上人羣失明的主要原因。濕性AMD是“晚期”AMD的一種形式,也被稱為新生血管性AMD。在濕性AMD中,異常血管在視網膜下面生長。這些血管可能會滲漏液體和血液,這可能會導致黃斑腫脹和損傷,導致視力喪失。對於濕性AMD,眼睛中會分泌異常高水平的VEGF。VEGF是一種促進新的異常血管生長的蛋白質。抗血管內皮生長因子注射療法阻止了這種生長。自從抗VEGF療法問世以來,它已經成為全球視網膜社區的標準護理治療選擇。濕性AMD是世界範圍內的一種重要疾病,據估計,2020年僅在美國、歐洲國家和日本就有超過290萬名患者被診斷為AMD(GlobalData)。儘管貝伐單抗目前沒有被FDA批准用於治療濕性AMD,但據信貝伐單抗目前至少佔美國所有濕性AMD玻璃體內注射的50%,在美國,阿瓦斯丁是通過複方藥店重新包裝的,並在標籤外開出處方。如果獲得批准,我們相信ONS-5010有可能降低與貝伐單抗標籤外重新包裝相關的風險,包括但不限於效力、安全性和無菌不良事件以及注射器相關不良事件的可變性。
DME是由一種稱為糖尿病視網膜病變的糖尿病併發症引起的。糖尿病視網膜病變是最常見的糖尿病眼病,也是美國工作年齡人羣不可逆轉失明的主要原因。糖尿病視網膜病變通常影響雙眼,由視網膜小血管持續受損引起。液體滲入視網膜可能導致周圍組織腫脹,包括黃斑。二甲基醚是糖尿病視網膜病變患者視力喪失的最常見原因。DME可以發生在糖尿病視網膜病變的任何階段,儘管它更有可能發生在疾病的後期。2020年,僅在美國、歐洲國家和日本就有大約860萬名DME患者(GlobalData)。
在BRVO中,當輸送血液和所需氧氣和營養物質的靜脈阻塞視網膜神經細胞時,就會發生視網膜靜脈阻塞。視網膜主靜脈阻塞稱為視網膜中央靜脈阻塞(CRVO),而較小靜脈阻塞稱為視網膜分支靜脈阻塞(BRVO)。根據美國眼科學會的數據,視網膜靜脈阻塞是僅次於美國眼科學會的第二大常見視網膜血管疾病
3