
ARV-471:第1階段劑量遞增 臨牀試驗結果聖安東尼奧乳腺癌研討會2021年12月10日展覽99.2

安全港和前瞻性 陳述本演示文稿包含符合1995年“私人證券訴訟改革法案”定義的前瞻性陳述,涉及重大風險和不確定性,包括有關ARV-471和我們正在開發的其他候選產品的開發和監管狀況、臨牀試驗的時間和這些試驗的數據以及我們候選產品的註冊計劃、我們候選產品的治療潛力以及我們的任何候選產品的 潛在商業化的陳述。除有關歷史事實的陳述外,本報告中包含的所有陳述,包括有關我們的戰略、未來業務、未來財務狀況、 未來收入、預計成本、前景、計劃和管理目標的陳述,均為前瞻性陳述。“預期”、“相信”、“估計”、“預期”、“打算”、“ ”、“可能”、“計劃”、“預測”、“項目”、“目標”、“潛在”、“將會”、“將會”、“可能”、“應該”、“應該”、“繼續”等類似表述旨在識別前瞻性表述,儘管並不是所有前瞻性表述都包含這些標識性詞語。我們可能無法實際實現我們的前瞻性聲明中披露的計劃、意圖或預期 ,您不應過度依賴我們的前瞻性聲明。由於各種風險和不確定性,實際結果或事件可能與我們在前瞻性 聲明中披露的計劃、意圖和預期大不相同,這些風險和不確定性包括但不限於:我們和輝瑞是否能夠成功地進行ARV-471的臨牀開發,啟動並完成我們候選產品的其他臨牀試驗 , 在我們提交給美國證券交易委員會(Securities And Exchange Commission)的季度和年度報告的“風險因素”一節中討論了我們的預期時間表、或者根本沒有收到我們的臨牀試驗結果,以及其他重要因素,這些因素中的任何一個都可能導致我們的實際結果與前瞻性陳述中所包含的結果不同,這些前瞻性陳述在我們提交給美國證券交易委員會(Securities And Exchange Commission)的季度和年度報告的“風險因素”一節中進行了討論。本演示文稿中包含的前瞻性陳述反映了截至 演示文稿發表之日我們對未來事件的當前看法,除非適用法律要求,否則我們不承擔更新任何前瞻性陳述的義務。這些前瞻性陳述不應被視為在本演示文稿日期之後的任何 日期代表我們的觀點。Arvinas的名稱和徽標是我們的商標。我們還擁有PROTAC®的服務商標和註冊美國商標。本 演示文稿中出現的商標、商號和服務標記均為其各自所有者的財產。我們省略了本演示文稿中指定的商標的®和™名稱(如果適用)。本演示文稿還包含由 獨立各方和我們做出的關於市場規模的估計和其他統計數據,以及關於我們行業的其他數據。這些數據涉及許多假設和限制,提醒您不要過度重視這些數據和估計。此外,對我們未來業績和我們經營的市場的未來業績的預測、 假設和估計必然會受到高度不確定性和風險的影響。

議程主題參與者介紹 Arvinas ARV-471臨牀數據更新Ron Peck,M.D.Chris Boshoff,M.D.,Ph.D.首席醫療官,Arvinas首席開發官,輝瑞腫瘤學首席開發官,Arvinas ARV-471總裁兼首席執行官 John G.Houston,Ph.D.總裁兼首席執行官Ron Peck,M.D.Chris Boshoff,M.D.,Ph.D.首席醫療官,Arvinas首席開發官問答
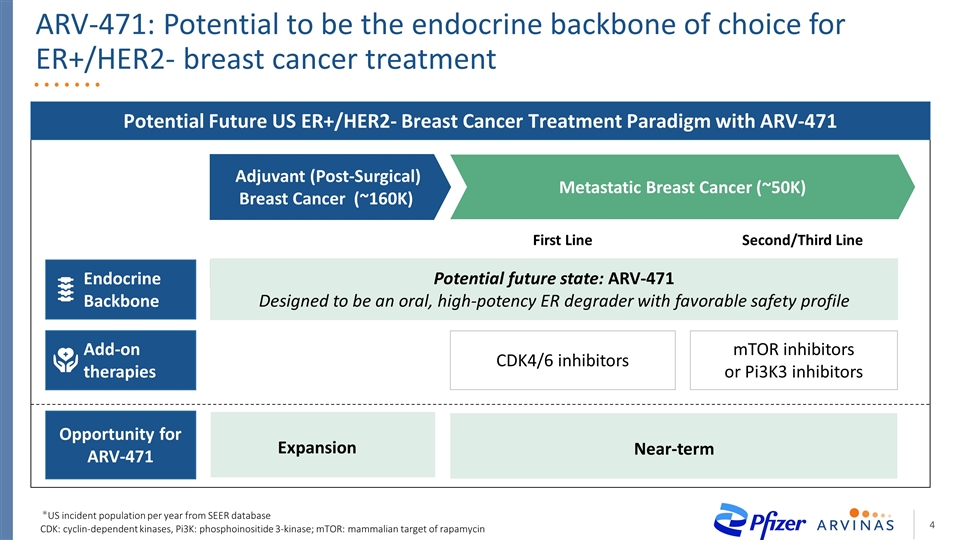
ARV-471:有可能成為ER+/HER2-乳腺癌治療潛力的內分泌骨幹 未來US ER+/HER2-乳腺癌治療範例:ARV-471佐劑(手術後)乳腺癌(~160K)轉移性乳腺癌(~50K)第二/三線一線 臨牀限制內分泌骨幹芳香化酶抑制劑MTOR:雷帕黴素潛在未來狀態的哺乳動物靶點:ARV-471被設計為一種口服、高效的ER降解劑,具有良好的安全性*來自SEER數據庫的每年美國病例數量

ARV-471:潛在的同類最佳雌激素受體靶向治療2020年12月:21名患者,臨牀受益率為42%(12名可評估患者中的5名)2021年12月:60名患者,臨牀受益率為40%(47名可評估患者中的19名)在預期患有高度ER非依賴性疾病的患者羣體中持續發出強勁的療效信號,由於CDK4/6抑制劑100%預處理對所有劑量水平都有很好的耐受性,沒有700毫克的劑量限制毒性,報告的大多數(89%)的不良反應為1/2級ER 降解率高達89%,與已發表的用FULVESTRANT和臨牀期SERDS相比,富維斯特朗和臨牀期††的降解率繼續超過已報道的降解率。在所有劑量水平上,CDK4/6抑制劑的耐受性都很好,沒有高達700毫克的劑量限制毒性,大多數(89%)報道的不良反應為1/2級。ARV-471尚未在臨牀試驗中進行研究, 用於治療FUVESTRANT和/或臨牀期SERD。CDK4/6,細胞週期蛋白依賴性激酶;SERD,選擇性雌激素受體降解物

設計“3+3”劑量與回填ARV-471口服配合食物開始劑量:30毫克口服每日最大給藥劑量:700毫克ARV-471:首次人體研究“3+3”劑量遞增研究終點: 最大耐受劑量和推薦第二階段劑量次要:安全藥代動力學藥效學:定量配對活檢組織中的ER(基線和正在治療)療效:RECIST,臨牀受益率(CBR)

在CDK4/6抑制劑治療後,約66%的乳腺癌患者具有ER非依賴性耐藥機制†先前披露的數據顯示CDK4/6抑制劑治療效果不佳,例如,富維斯特朗:中位PFS=1.9月††CBR=13.7%††1期研究中100%的患者為CDK4/6抑制劑後;潛在ER非依賴性耐藥機制的高比率第1階段納入標準ER+/HER2-CDK4/6抑制劑≥2先行內分泌治療進展期乳腺癌在任何設定中都存在多達3種先期化療方案的晚期乳腺癌,據信這是唯一一項針對所有患者需要先行CDK4/6治療的ER靶向治療試驗†WAND 2020;††Lindeman ASCO2021 結果出自Veronica試驗。CDK4/6I,細胞週期蛋白依賴性激酶4/6抑制劑。PFS,無進展生存期;TTF,治療失敗時間;CBR,臨牀受益率
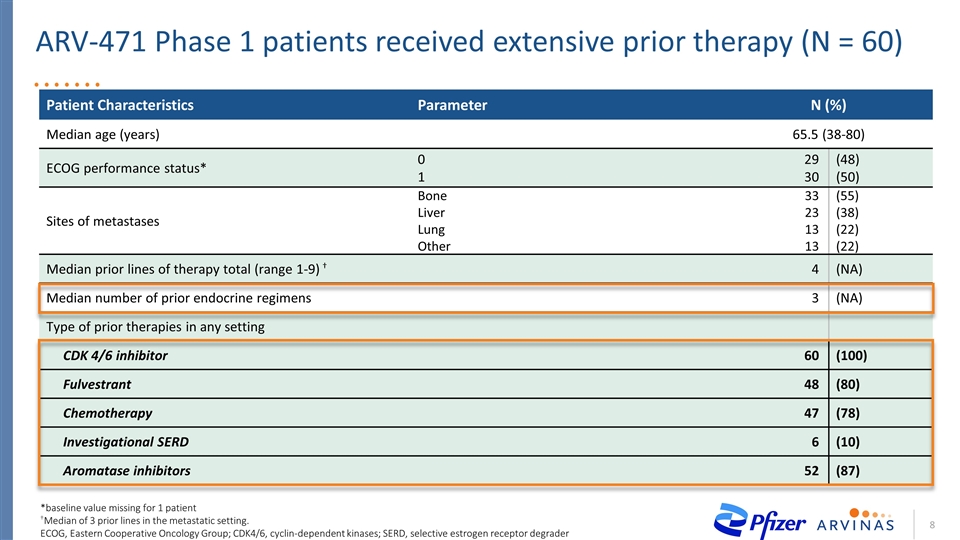
患者特徵參數N(%)中位年齡(歲)65.5(38-80)腦電圖表現狀態*0 1 29 30(48)(50)轉移部位骨、肝、肺其他33 23 13 13(55)(38)(22)(22)治療前線中位數總計(1-9)†4(NA)先前內分泌治療的中位數3(NA)6抑制劑60(10 0)Fulvestrant 48(80)化療47(78)研究SERD6(10)芳香化酶抑制劑52 (87)*1例患者†基線值缺失3個轉移病例的中位數。ECOG,東方合作腫瘤學小組;CDK4/6,細胞週期蛋白依賴性激酶;SERD,選擇性雌激素受體降解劑

ARV-471在所有劑量水平下耐受性良好 ;無劑量限制毒性和MTD未達停用率10%患者30 mg(n=3)60 mg(n=3)120 mg(n=7)180/200 mg(n=11)360 mg(n=15)500 mg(n=17)700 mg(n=4)總(N=60) Gr 1/2Gr 3 Any Trae 0 03(50%)0 6(86%))0 6(5 5%)1(9%)10(67%)1(7%)7(41%)2(12%)2(50%)0 34(57%)4(7%)噁心0 0 2(33%)0 2(2 9%)0 4(36%)0 3 (2 0%)0 4(2 4%)1(6%)1(2 5%)0 16(2 7%)1(2%)疲勞0 1(17%)0 0 0 1(0 3(2 0%)0 5(2 9%)0 2(5 0%)0 12(2 0%)0嘔吐0 0 0 2(2 9%)0 1(9%)0 2(13%)0 1(6%)0 0 0 6(10%)0 AST增加0 0 0 1(14%)0 2(18%)0 0 0 1(6%)0 2(50%)0 6(10%)0 4例患者經歷了可能與ARV-4有關的GR 3事件單次出現無症狀澱粉酶和脂肪酶升高,噁心和無症狀QTc延長,以及小手術後靜脈栓塞(br}*)
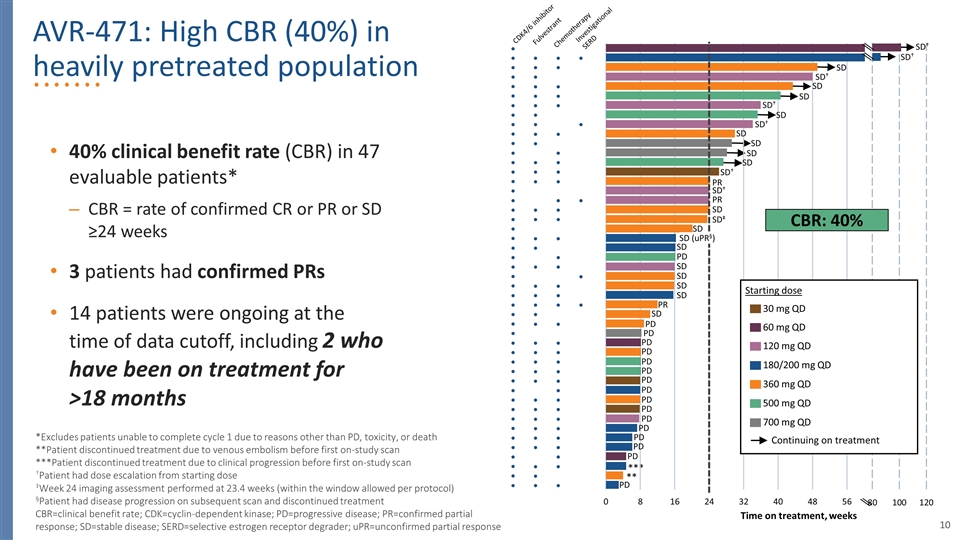
47名可評估患者的40%臨牀受益率*cbr=確診CR或PR或SD≥的比率24周3名患者已確認PR 14名患者在數據截止時仍在進行中,包括2名接受治療超過18個月的患者aVR-471:嚴重預處理人羣中的高臨牀獲益率(40%) 不包括由於PD、毒性、或死亡**患者在首次研究掃描前因靜脈栓塞而中斷治療*患者在首次研究掃描前因臨牀進展而中斷治療**†患者在23.4周(在協議允許的窗口內)進行的24周顯像評估中,劑量從開始劑量‡遞增§患者在 隨後的掃描和停止治療時病情惡化,cbr=臨牀受益率;CDK=細胞週期素依賴性激酶;PD=進展性疾病;PR=確診的部分應答;SD=穩定期疾病;SERD=選擇性雌激素受體降解劑;UPR=未確認的部分響應 研究SERD*CDK4/6抑制劑Fulvestrant化療時間, Week SD†PD SD†SD†SD SD†PR SD†SD SD‡SD PR SD PD PD SD 700 mg qd 120 mg qd 180/200 mg qd 360 mg qd 500 mg qd 30 mg qd繼續治療60 mg qd起始劑量SD(upr§)CBR:40%
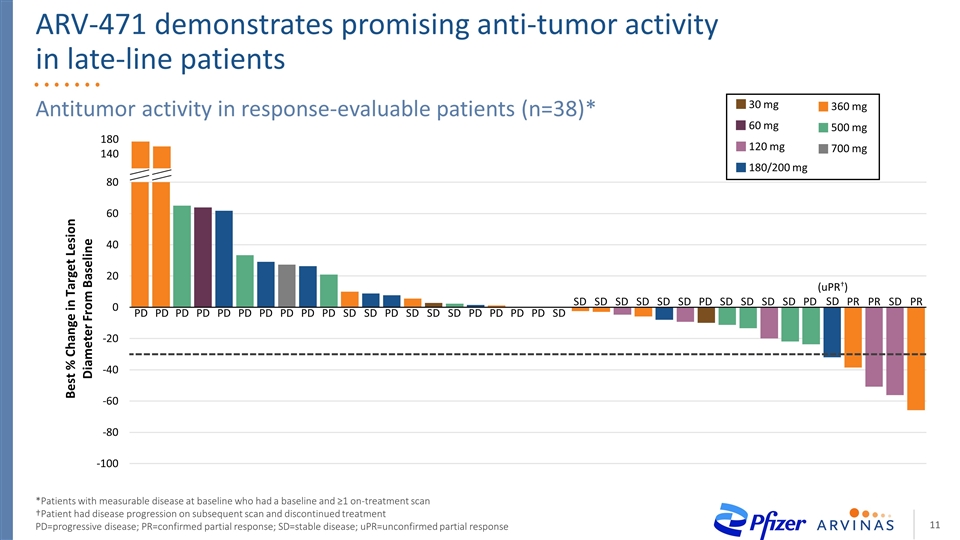
可評估應答的患者(n=38)**基線有可測量疾病且有≥1正在治療掃描的患者†患者在隨後的掃描中有疾病進展,停止治療PD=進展性疾病; PR=確認的部分應答;SD=穩定的疾病; PR=確認的部分應答;SD=穩定的疾病; PR=確認的部分應答;SD=穩定的疾病;UPR=未經證實的部分應答PD SD SD PD PR PR SD(UPR†)SD PR ARV471在晚期患者中顯示出良好的抗腫瘤活性700mg120 mg180/200mg360 mg500 mg30 mg60 mg
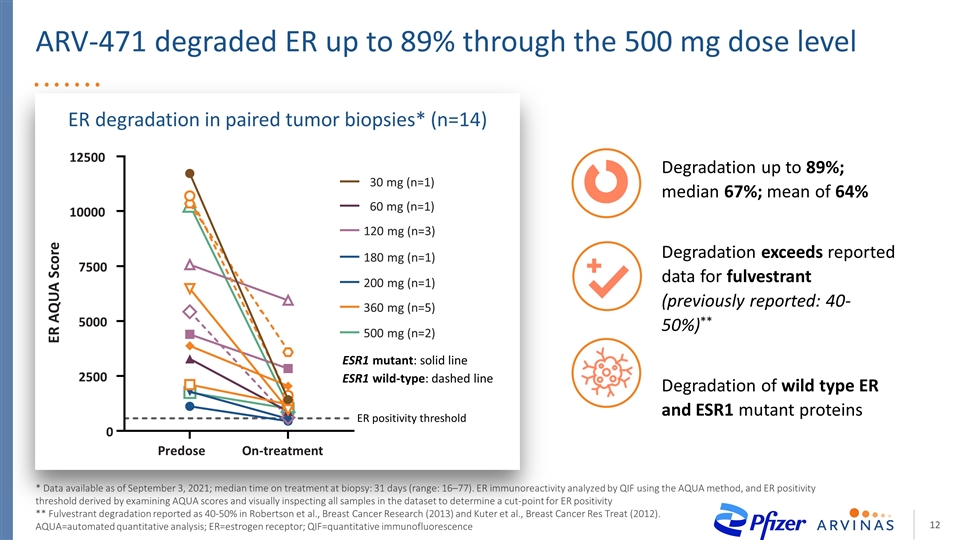
通過截至2021年9月3日可獲得的500毫克劑量水平*數據,抗逆轉錄病毒-471使ER降解率高達89% ;活組織檢查的治療時間中值:31天(範圍:16-77)。ER免疫反應性由QIF使用Aqua方法分析,ER陽性閾值是通過檢查 Aqua評分並目視檢查數據集中的所有樣本來確定ER陽性的臨界點而得出的**在Robertson等人、Breast Cancer Research(2013)和Kuter等人的“Breast Cancer res Treat”(2012年)中,Fulvestrant降解率報告為40-50%(見Robertson等人,Breast Cancer Research(2013)和Kuter等人,Breast Cancer Res Treat (2012))。AQA=自動定量分析;ER=雌激素受體;QIF=定量免疫熒光降解率高達89%;中位數67%;平均降解率64%超過已報道的弗維斯特數據(先前報道:40-50%)**野生型ER和ESR1突變蛋白的降解率ESR1突變體:實線ESR1野生型:虛線預劑量治療0 2500 5000 7500 10000 12500 ER AQA評分ER陽性閾值30毫克(n=1)180毫克(n==1)
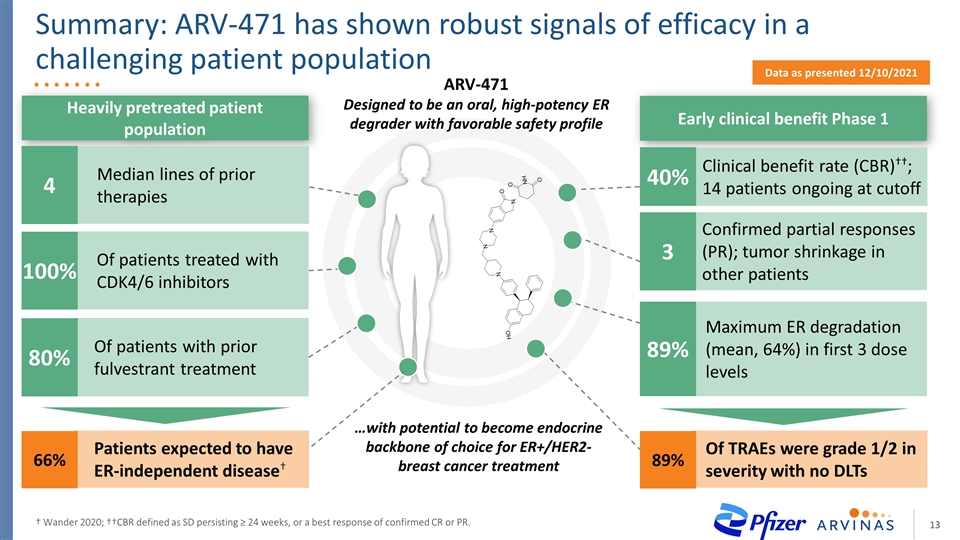
摘要:抗逆轉錄病毒471號在具有挑戰性的患者羣體†WANDER 2020中顯示出強勁的療效信號;††CBR被定義為SD持續≥24周,或確認CR或PR的最佳反應。預期患有ER非依賴性疾病†的患者 使用CDK4/6抑制劑治療的患者中80%接受CDK4/6抑制劑治療的患者100%66%接受大量預處理的患者羣體早期臨牀受益1期數據顯示,2012年12月10日公佈的ARV-471ARV-471是一種口服、高效ER降解劑,具有良好的安全性 …有可能成為ER+/HER2的內分泌骨幹-乳腺癌治療的前三個劑量水平的最大ER降解率(平均64%)89%確認的部分應答(PR);其他患者的腫瘤縮小3臨牀受益率(††);14名患者在截止時仍在進行TRAE 40%的TRAE嚴重程度為1/2級,沒有DLT 89%的先前治療的中位線4
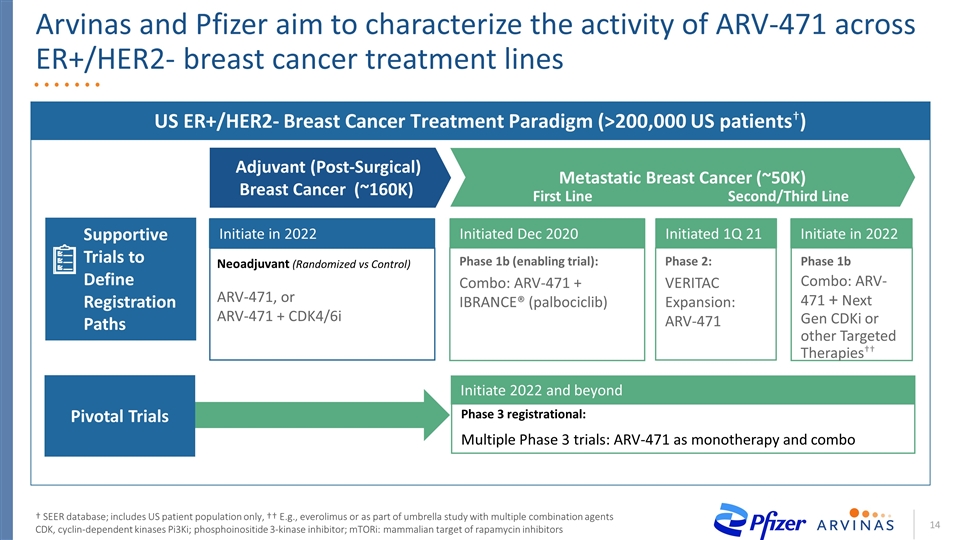
阿維納斯和輝瑞公司的目標是 表徵抗逆轉錄病毒471在ER+/hER2-乳腺癌治療系†SEER數據庫中的活性;僅包括美國患者羣體,例如††,或作為多種聯合藥物CDK、細胞週期蛋白依賴性激酶Pi3Ki、磷脂酰肌醇3-激酶抑制劑的傘形研究的一部分;MTORI:雷帕黴素抑制劑的哺乳動物靶點US ER+/HER2-乳腺癌治療範例(>200,000名美國患者†)新佐劑(隨機對照)ARV-471,或††-471+CDK4/6i 1b期(啟用試驗):COMBO:ARV-471+Ibrance®(Palbociclib)第2期:VERITAC擴展:ARV-471b期聯合:ARV-471+下一代CDKI或其他靶向療法於2022年啟動於2020年12月啟動 於2022年啟動21季度啟動(手術後)乳腺癌輔助治療(~16

1L/2L/3L有可能被批准為輔助或早期轉移性癌症的單一療法或與CDK抑制劑和其他靶向療法的計劃組合僅在美國就有大量未得到滿足的需求和機會,ER+/HER2-乳腺癌代表了每年超過200K†的可尋址患者,以及超過150億美元的市場機會比已發表的富維斯特朗和SERD數據†強大的療效信號在一個主要依賴ER的人羣中具有很好的耐受性††Fulvestrant降解在Robertson等人的《乳腺癌研究》(2013年)和庫特等人的《乳腺癌藥物治療》(2012年)中報道。

謝謝