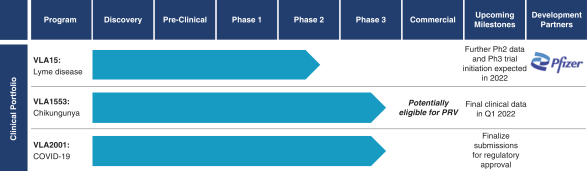
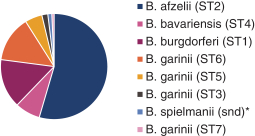
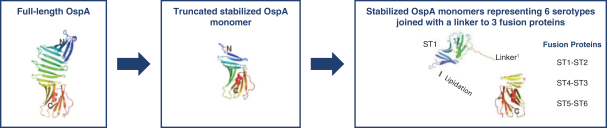
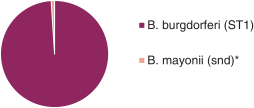依據第424(B)(4)條提交
註冊號碼333-260507
招股説明書
450萬股普通股
包括美國存托股份形式的普通股

這是Valneva SE 4,500,000股普通股的公開發行,包括:(I)在美國公開發行33,120股美國存托股份(ADS)普通股,每股代表獲得兩股普通股的權利,我們稱之為美國發行,以及(Ii)在歐洲(包括法國)同時私募4,466,880股專門向合格投資者發行的普通股,該術語在第2條中定義(我們稱之為 歐洲私募。我們將美國發售和同時進行的歐洲私募稱為全球發售。這些普通股直接發售或以美國存託憑證(ADR)的形式發售,可由美國存託憑證(ADR) 證明。
我們的美國存託憑證(ADS)在納斯達克全球精選市場(Nasdaq Global Select Market)掛牌交易,交易代碼為?VLA.我們的普通股 在巴黎泛歐交易所(Euronext Paris)掛牌交易,交易代碼為?VLA。
ADS在美國的公開發行價為每股39.416美元,相當於歐洲私募的每股普通股17美分。
2021年10月28日,我們普通股在巴黎泛歐交易所 最後一次報告的售價為每股普通股19.45美元,我們的美國存託憑證在納斯達克全球精選市場的最後一次報告售價為每ADS 45.3美元。
我們是根據美國聯邦證券法定義的新興成長型公司,因此,本招股説明書和未來備案文件的上市公司報告要求將有所降低。
投資我們的美國存託憑證和普通股是有風險的。請參閲第15頁開始的風險因素,瞭解您在購買我們的普通股或美國存託憑證之前應考慮的 因素。
根據我們股東授予的進行全球發售的授權,我們發行的美國存託憑證和普通股最初只能由(I)根據法國或 外國法律組織的自然人和法人實體購買,包括定期投資於製藥、生物技術或醫療技術部門的公司、信託或投資基金,以及(Ii)在製藥、化粧品、化工或醫療器械和/或技術領域開展大量業務的任何類型的法國或外國公司、機構或實體。
美國證券交易委員會(SEC)或美國任何州證券委員會都沒有批准或不批准這些證券,也沒有確定本招股説明書是否真實或完整。任何相反的陳述都是刑事犯罪。
| 人均 普通 分享 |
人均 廣告 |
共計 | ||||||||||
| 發行價 |
| 17.00 | $ | 39.4160 | $ | 88,686,000 | ||||||
| 承銷佣金(1) |
| 1.02 | $ | 2.3650 | $ | 5,321,160 | ||||||
| 扣除費用前的收益給Valneva SE |
| 15.98 | $ | 37.0510 | $ | 83,364,840 | ||||||
| (1) | 有關支付給 承銷商的賠償的説明,請參閲標題為?承保?的章節。 |
在承銷商出售超過4,500,000股普通股(可能是美國存託憑證形式)的範圍內, 承銷商有權在本招股説明書發佈之日起30天內,按價格向公眾購買最多675,000股美國存託憑證形式的普通股。
將在美國發行和歐洲私募中出售的普通股(包括美國存託憑證形式的普通股)總數 (包括在本招股説明書發佈之日起30天內行使承銷商購買額外美國存託憑證的選擇權後)將在兩者之間重新分配。
承銷商預計在2021年11月2日左右向買方交付美國存託憑證。
| 高盛 | 傑弗瑞 | 古根海姆證券 | Bryan,Garnier&Co. |
招股説明書日期為2021年10月28日。