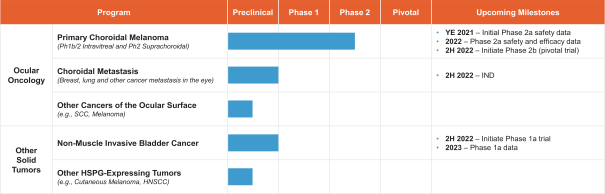
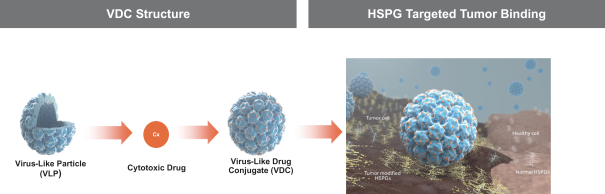
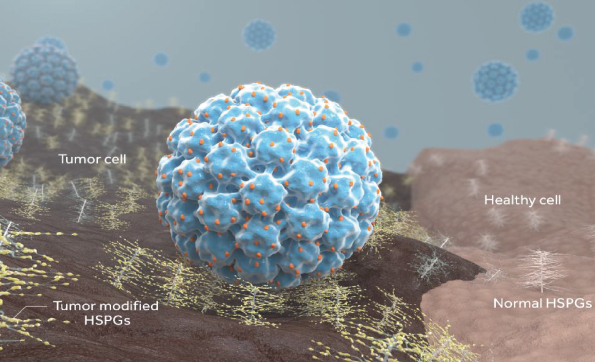
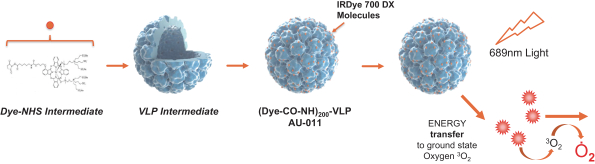
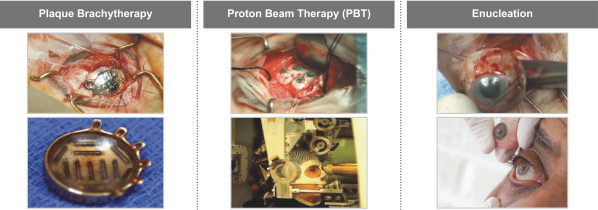
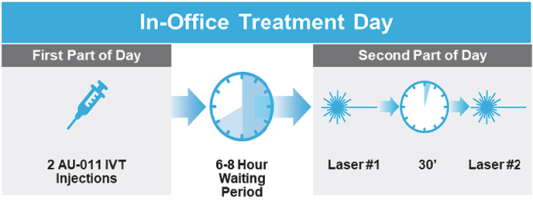
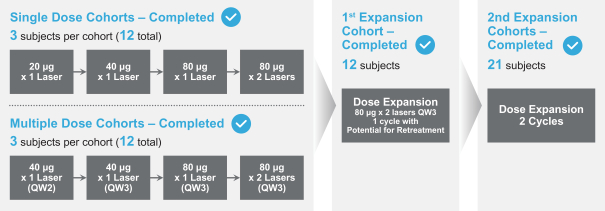
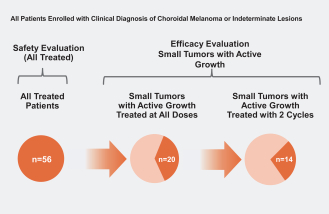
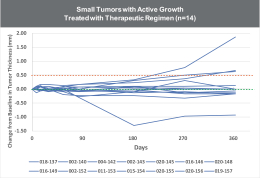
依據第424(B)(4)條提交
註冊號碼333-260156
招股説明書
540萬股

普通股
這是我們普通股的首次公開發行。我們將提供540萬股我們的普通股。在這次發行之前,我們的普通股還沒有公開市場。我們的普通股已獲準在納斯達克 全球市場上市,代碼為AURA。我們普通股的首次公開募股價格為每股14.00美元。
根據美國證券交易委員會(Securities And Exchange Commission)的適用規則,我們是一家新興的成長型公司和一家規模較小的報告公司,本招股説明書和未來備案文件的上市公司報告要求將有所降低。
我們的業務和對普通股的投資涉及重大風險。從本招股説明書第12頁開始,這些風險在標題?風險 因素下進行了描述。
美國證券交易委員會(Securities And Exchange Commission)和任何州證券委員會均未批准或 不批准本招股説明書下可能提供的證券,也沒有任何這些機構確定本招股説明書是否真實或完整。任何相反的陳述都是刑事犯罪。
| 每股 | 總計 | |||||||
| 首次公開發行(IPO)價格 |
$ | 14.00 | $ | 75,600,000 | ||||
| 承保折扣和佣金(1) |
$ | 0.98 | $ | 5,292,000 | ||||
| 扣除費用前的收益將捐給Aura Biosciences,Inc. |
$ | 13.02 | $ | 70,308,000 | ||||
| (1) | 有關支付給 承銷商的賠償的其他信息,請參閲標題為《承保風險》的章節。我們已同意向承銷商報銷與此次發行有關的某些費用。 |
我們已授予 承銷商為期30天的選擇權,以公開發行價減去承銷折扣和佣金,向我們增購最多810,000股普通股。
承銷商預計將於2021年11月2日交割普通股。
聯合簿記管理經理
| 考恩 | SVB Leerink | Evercore ISI |
銷售線索經理
BTIG
2021年10月28日