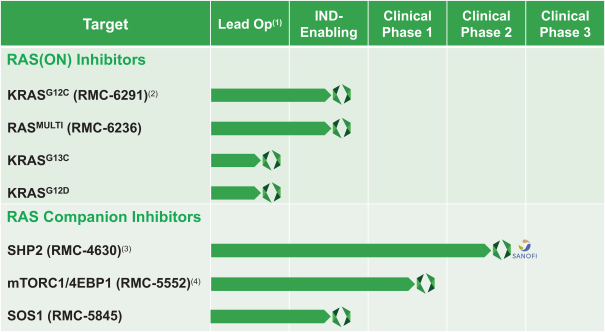
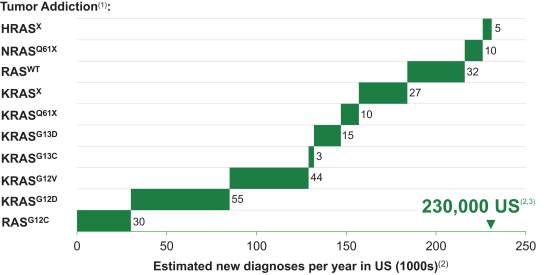
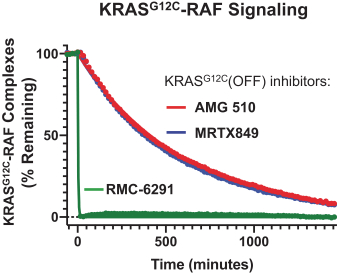
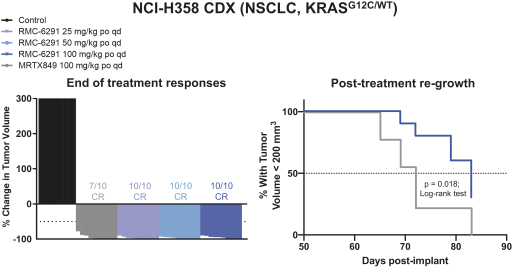
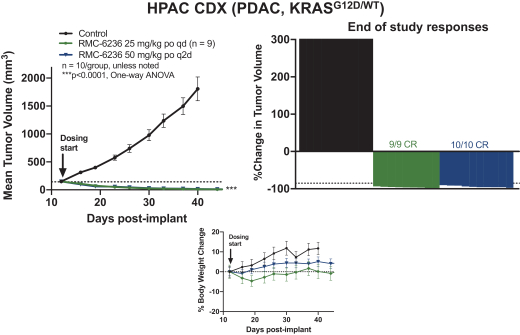
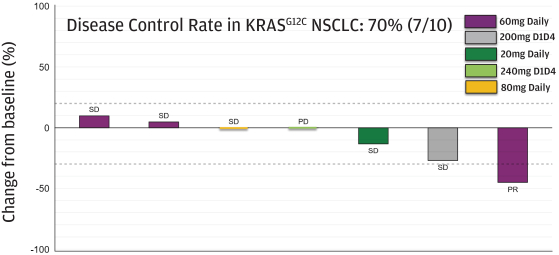
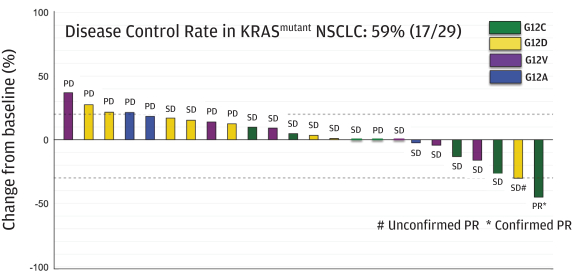
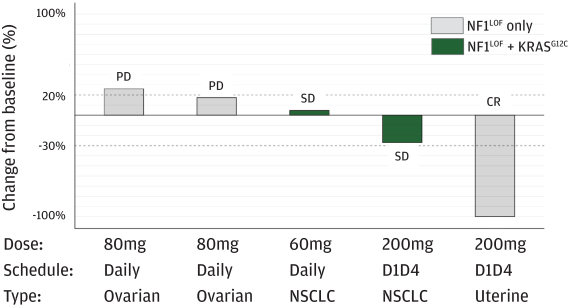
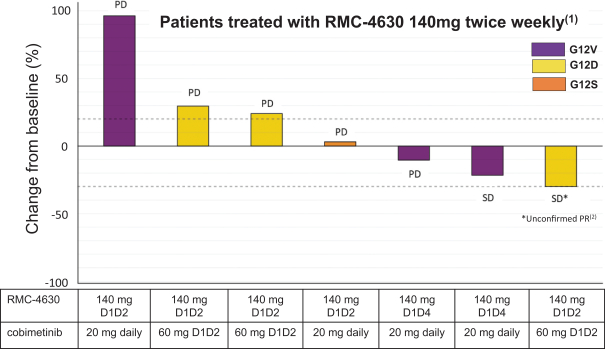
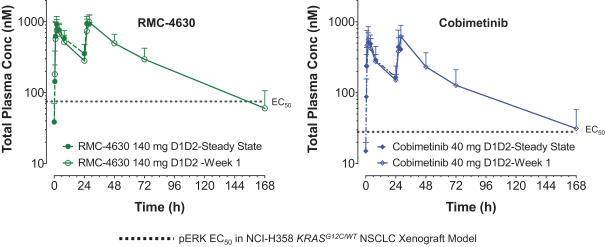
革命醫藥公司要求的保密治療。
依據第17 C.F.R.200.83條
各種歸屬明細表的規定以及證券法第144條和第701條允許的範圍。如果這些額外的普通股被出售,或者如果
察覺到它們將在公開市場上出售,我們普通股的市場價格可能會下降。
此外,持有約1,800萬股我們普通股的持有者有權根據證券法登記他們的股份。根據證券法註冊這些股票將導致股票可以自由交易,不受證券法的限制
,附屬公司購買的股票除外。這些股東的任何證券出售都可能對我們普通股的市場價格產生實質性的不利影響。
我們利用淨營業虧損結轉和某些其他税務屬性的能力受到所有權變更的限制,可能會受到
進一步的限制。
根據修訂後的1986年《國內税法》(Internal Revenue Code)第382和383條,或該法以及州法律的相應條款,如果一家公司經歷所有權變更(通常定義為在三年滾動期間其股權所有權變化超過50個百分點(按價值計算)),該公司有能力使用其變動前淨營業虧損結轉和其他變動前税收屬性以抵消其變動後收入可能是有限的。我們在過去經歷過所有權變更,未來我們可能會因為公開發行股票或其他股權變更(其中一些不在我們的控制範圍內)而經歷所有權變更。使用我們的聯邦和州淨營業虧損結轉一直受到
限制,如果我們經歷額外的所有權變更,可能會進一步受到限制。
如果我們在未來的融資中出售普通股,
股東可能會立即遭受稀釋,因此,我們的股票價格可能會下跌。
我們可能會不時以低於普通股當前交易價格的價格增發普通股
。因此,我們的股東在購買以這樣的折扣價出售的普通股的任何股份後,將立即遭受稀釋。此外,隨着
機會的出現,我們未來可能會進行融資或類似的安排,包括髮行債務證券、優先股或普通股。如果我們發行普通股或可轉換為普通股的證券,
我們的普通股股東將遭受額外的稀釋,因此,我們的股票價格可能會下跌。
如果證券分析師不繼續
發佈有關我們業務的研究或報告,或者如果他們發佈對我們股票的負面評價,我們的股票價格可能會下跌。
我們普通股的交易市場在一定程度上依賴於行業或金融分析師發佈的關於我們或我們業務的研究和報告。如果很少有
分析師發表關於我們的研究或報告,我們股票的交易價格可能會下跌。如果一位或多位跟蹤我們業務的分析師下調了他們對我們股票的估值,我們的股票價格可能會下跌。如果這些分析師中有一個或多個停止跟蹤我們的股票,我們的股票可能會在市場上失去可見性,進而可能導致我們的股價下跌。
如果我們不能對財務報告保持適當和有效的內部控制,我們編制準確和及時財務報告的能力可能會
受到損害,投資者可能會對我們的財務報告失去信心,我們普通股的交易價格可能會下跌。
根據薩班斯-奧克斯利法案(Sarbanes-Oxley)第404條,我們的管理層必須從截至2020年12月31日的財年年度報告開始,報告我們對財務報告的內部控制的有效性。當我們失去作為新興成長型公司的
地位時,我們的獨立註冊會計師事務所將被要求證明我們對財務報告的內部控制的有效性。管理管理層評估財務報告內部控制所必須滿足的標準的規則非常複雜,需要大量文檔、測試和可能的補救措施。
未來,我國的財務報告內部控制可能會存在實質性的薄弱環節。任何未能實施和維護財務報告內部控制的行為都可能嚴重阻礙我們準確地
67