目錄
下圖彙總了我們目前的候選產品和選定的研究人員贊助的概念驗證研究:
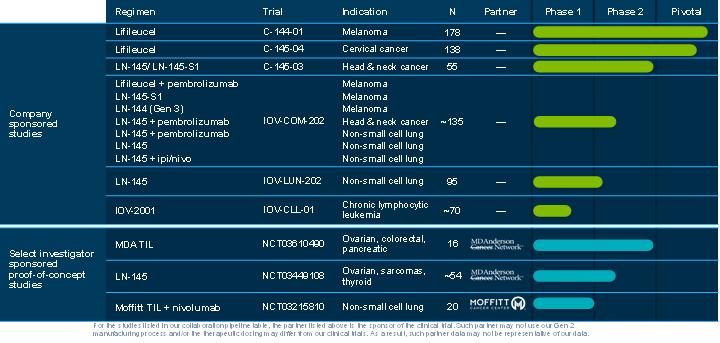
我們已經開發了名為Gen 3的第三代TIL製造流程。Gen 3的流程比Gen 2更短。我們在NSCLC的IOV-COM-202試驗的1C隊列和NSCLC的IOV-LUN-202試驗的隊列3中使用了Gen 3製造,並曾在HNSCC的C-145-03試驗中使用過它。
我們目前擁有超過25項已授予或允許的美國和國際專利,涉及與我們的第二代製造工藝相關的廣泛癌症的組合物和治療方法,包括美國專利號10,130,659,10,166,257,10,272,113,10,363,273,10,398,734,10,420,799,10,463,697,10,537,595,10,639,330,10,646,517,10,653,723,10,695,372,10,894,010,695,595,10,639,330,10,646,517,10,653,723,10,695,372,10,894,0我們預計,這些與第二代製造工藝相關的專利的有效期將延長至2038年1月,不包括任何可能的專利期延長或調整。我們擁有和授權的知識產權組合還包括與TIL、骨髓浸潤性淋巴細胞(MIL)和PBL療法有關的專利申請和專利;基於腫瘤的冷凍TIL技術;殘留TIL和消化TIL的成分、方法和過程;使用TIL療法治療多種癌症的方法;TIL、MIL和PBL療法的製造方法;共刺激分子在TIL療法和製造中的使用;穩定和短暫的轉基因TIL療法;使用免疫檢查點的方法
2020年1月,我們獲得了諾華公司的許可,可以開發和商業化一種抗體細胞因子植入蛋白,我們稱之為IOV-3001。根據協議,我們向諾華公司支付了預付款,並可能支付在IOV-3001臨牀開發的不同階段啟動患者劑量以及在美國、歐盟和日本批准一種潛在產品所涉及的里程碑。諾華公司還有權從IOV-3001的商業銷售中獲得中低個位數百分比的版税。此外,2020年1月,我們宣佈與Cellectis公司達成研究合作和全球獨家許可協議,Cellectis公司是一家臨牀階段的生物製藥公司,專注於開發基於基因編輯的同種異體嵌合抗原受體修飾T細胞的免疫療法,根據該協議,我們獲得了Cellectis公司的某些TALEN技術的許可,以便開發經過基因編輯的TIL,以創造潛在更有效的癌症療法。全球獨家許可使我們能夠使用TALEN技術處理多個基因靶點來修改TIL,用於治療幾種癌症適應症。許可證的財務條款包括我們向Cellectis支付的開發、監管和銷售里程碑付款,以及基於TALEN改性TIL產品淨銷售額的特許權使用費支付。
33