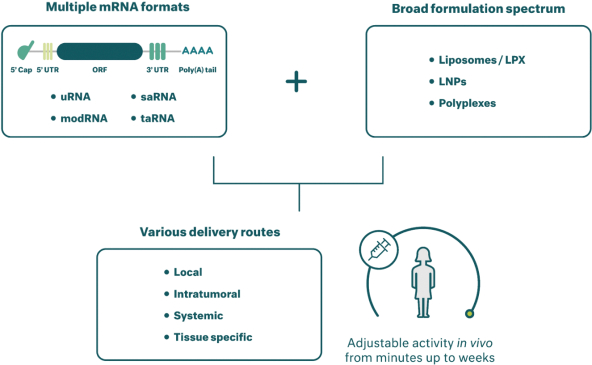
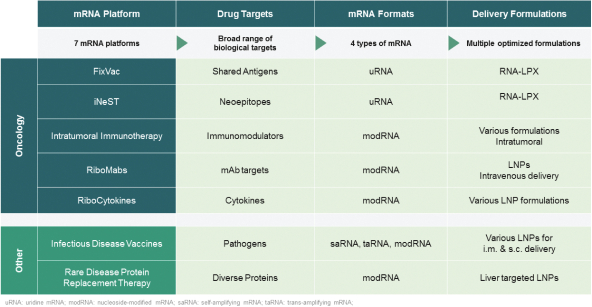
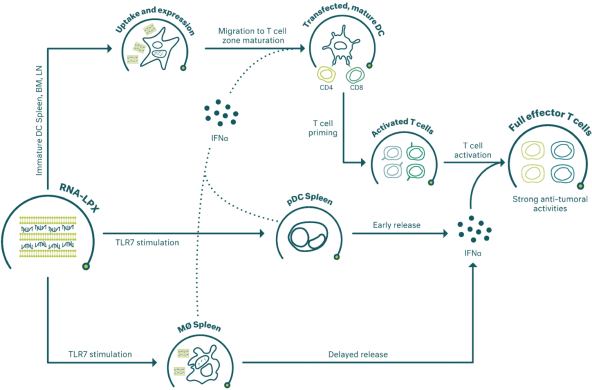
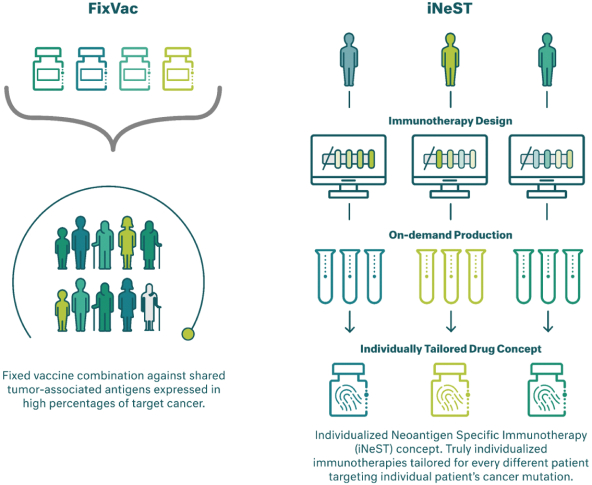
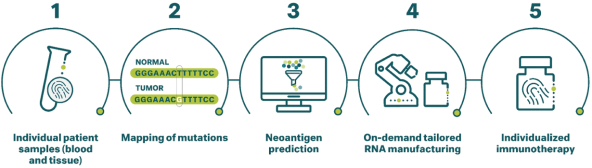
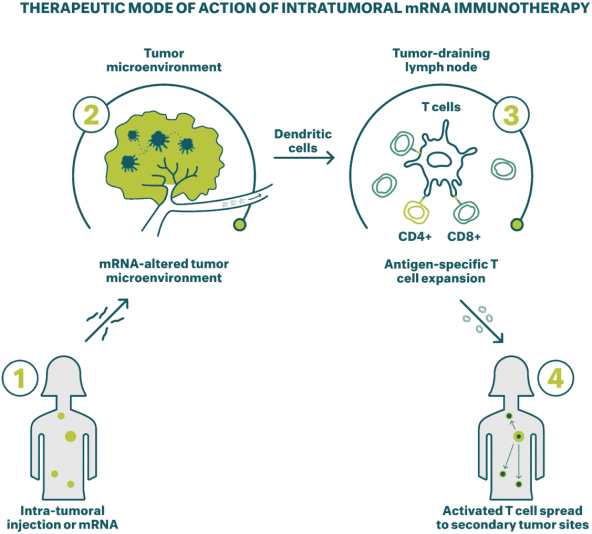
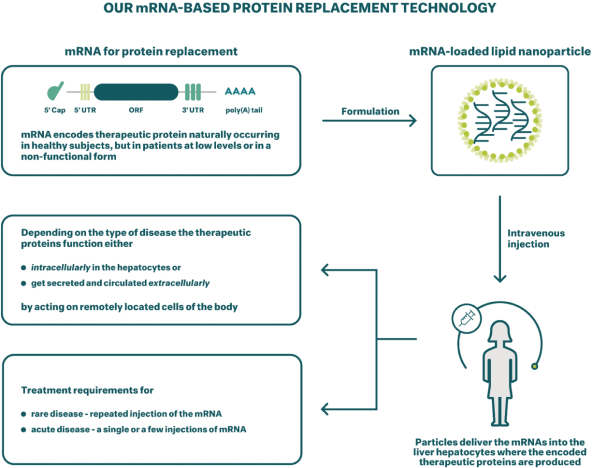
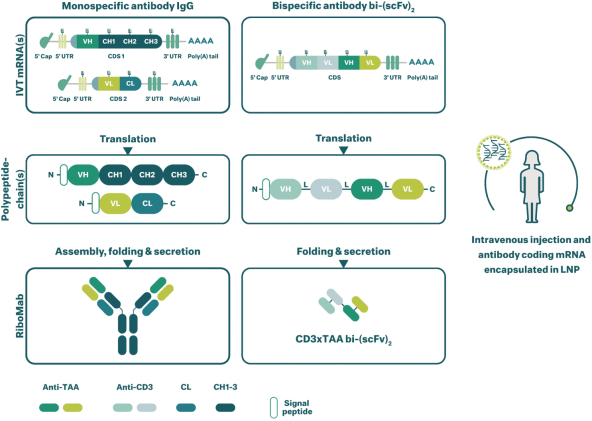
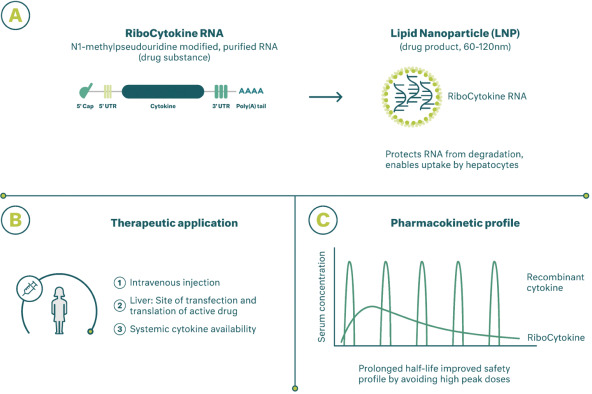
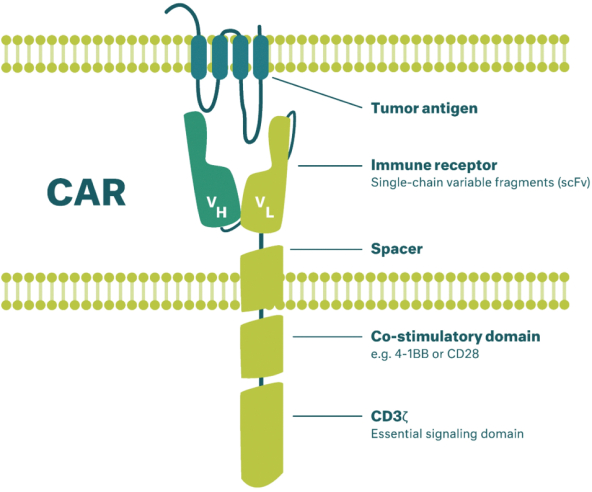
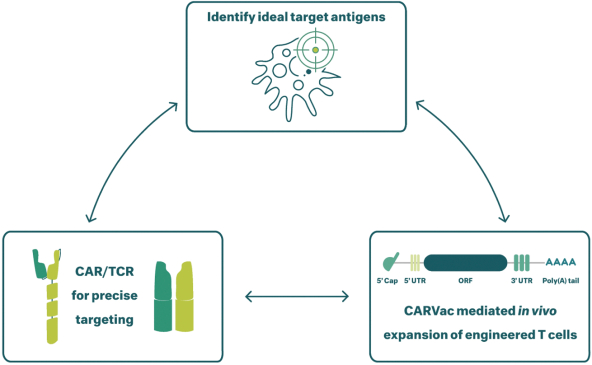
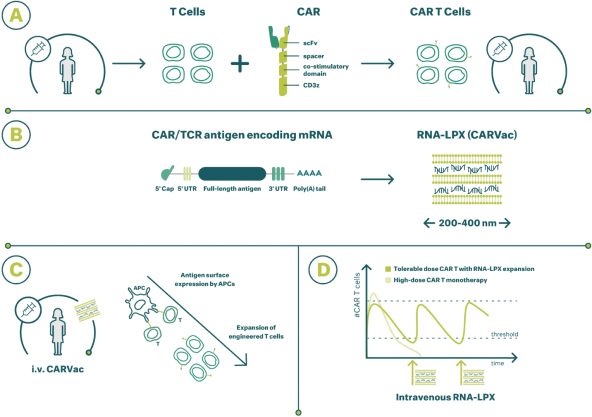
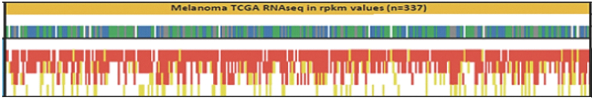
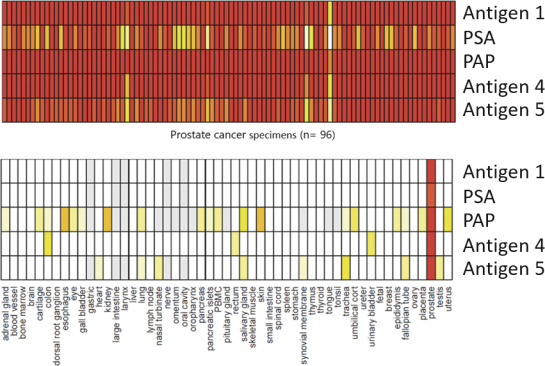
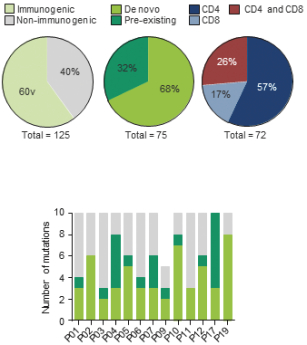
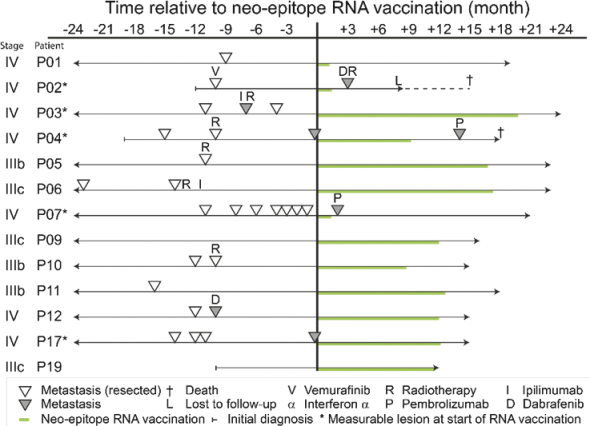
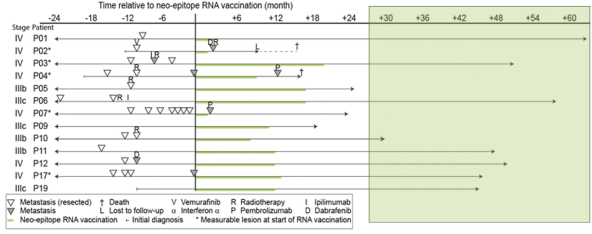
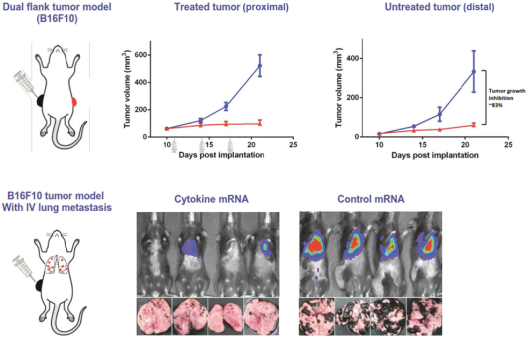
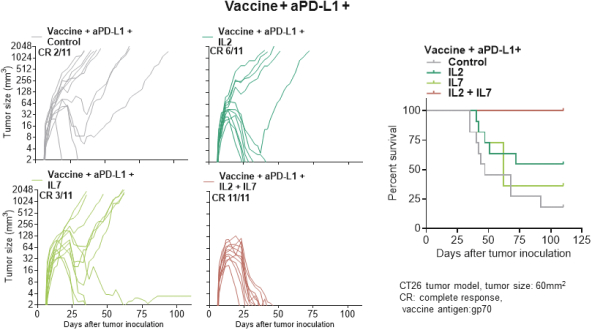
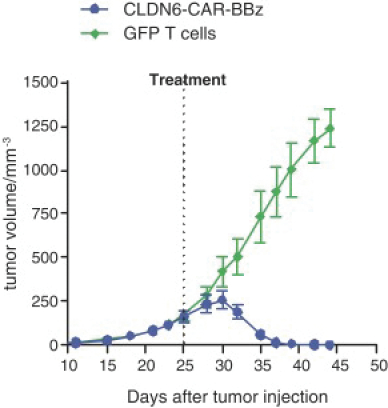
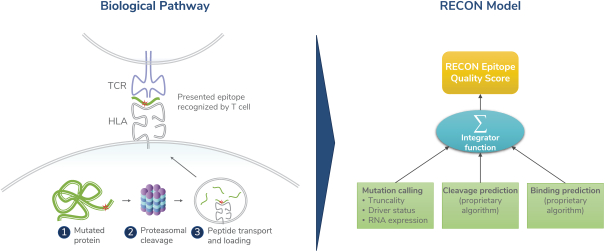
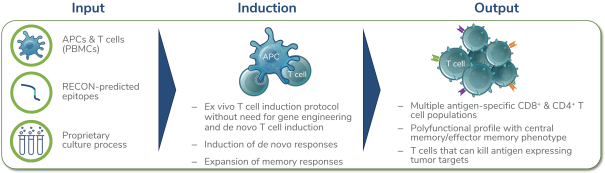
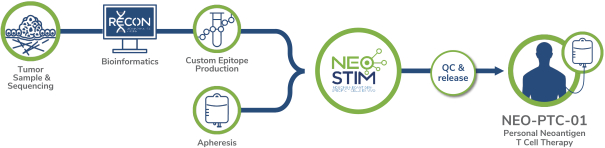
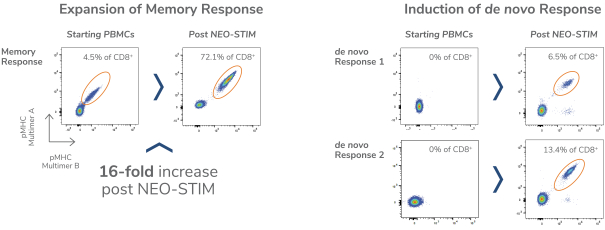
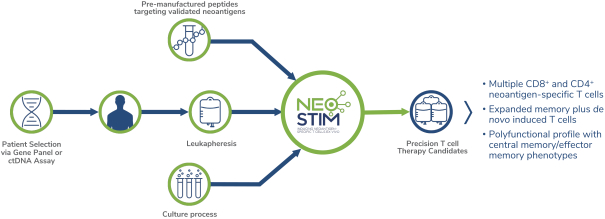
除非(除其他事項外)霓虹燈股東以有權就該事項投票的霓虹燈普通股過半數流通股持有人的贊成票批准合併提議。
霓虹燈董事會(或霓虹燈董事會)一致認為(1)根據協議所載條款及條件,合併 協議及擬進行的交易(包括合併)符合霓虹燈股東的最佳利益;(2)根據特拉華州公司法的規定,批准及宣佈合併協議及擬進行的交易;及(3)建議霓虹燈股東在霓虹燈特別大會上批准及採納合併協議。Neon 董事會一致建議Neon股東投票支持合併提案,投票支持休會提案。
你的投票很重要。無論您是否希望在線參加Neon特別會議,我們都敦促您通過以下方式儘快投票:(1)訪問您的代理卡上指定的互聯網網站;(2)撥打您的代理卡上指定的免費電話;或(3)簽署並退回所提供的郵資已付信封中隨附的代理卡,以便您的Neon普通股可以在Neon特別會議上代表並投票。如果您持有的霓虹燈普通股是以銀行、經紀人或其他受託機構的名義持有的,請按照記錄持有人提供的投票指導卡上的説明進行操作。
Neon和 BioNTech完成合並的義務取決於合併協議中規定的幾個條件的滿足或放棄。有關Neon、BioNTech和合並的更多信息包含在本委託書/招股説明書中。請仔細閲讀本 完整的委託書/招股説明書,包括本委託書/招股説明書中其他位置的風險因素。
真誠地
休·奧多德
總裁兼首席執行官
SEC或任何州證券委員會均未批准或不批准本委託書/招股説明書中描述的合併,或 與合併相關的BioNTech美國存託憑證的發行,也未考慮本委託書/招股説明書的準確性或充分性。任何相反的陳述都是刑事犯罪。
本委託書/招股説明書註明日期[●],2020年,並將於 左右首次郵寄給Neon的股東 [●], 2020.