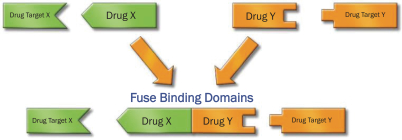
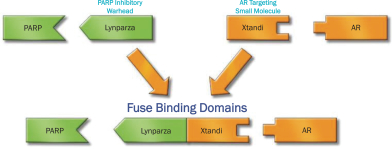
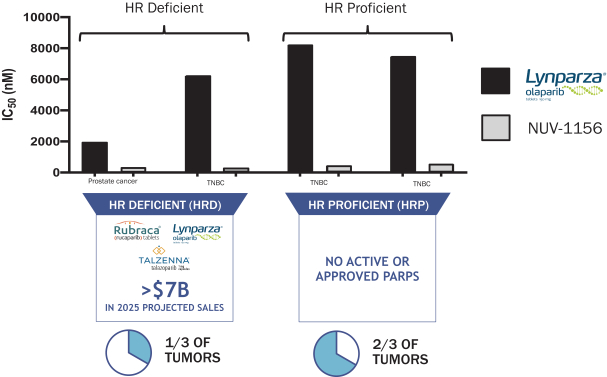
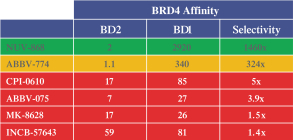
依據第424(B)(3)條提交
註冊號碼333-254176
招股説明書

最多60,936,608股A類普通股
最多5,787,472股A類普通股,可在行使認股權證時發行
最多995,833份認股權證購買A類普通股
本招股説明書涉及本公司發行總計5,787,472股我們的A類普通股,每股面值0.0001美元(該普通股),其中包括(I)最多162,500股可通過行使私募認股權證(該私募認股權證)發行的普通股,該普通股最初是以 私募方式發行給EcoR1 Panacea Holdings,LLC(該發起人為?保薦人)的(??私募認股權證),其中包括:(I)最多162,500股普通股,可通過行使私募認股權證(?私募認股權證)發行給EcoR1 Panacea Holdings,LLC(?保薦人)。(Ii)833,333股可在行使認股權證時發行的普通股(遠期認購權證,連同私募認股權證, 私募認股權證),由Panacea和發起人及其某些附屬公司根據日期為2020年6月30日的特定遠期購買協議發行(遠期購買);及(Iii)最多4,791,639股普通股,可在行使認股權證後發行(遠期購買認股權證)和(Iii)最多 4,791,639股普通股,可在行使認股權證和保薦人及其某些附屬公司之間發行(遠期購買認股權證),以及(Iii)最多 4,791,639股普通股,可在行使權證後發行我們將收到行使任何 現金認股權證的收益。
本招股説明書還涉及本 招股説明書中點名的出售證券持有人或其許可受讓人(出售證券持有人)不時提出並出售(I)最多60,936,608股普通股,其中包括(A)向保薦人和考恩投資公司發行最多487,500股普通股(私募股份) ,(B)最多2,500,000股普通股((D)根據日期為2020年10月20日的 認購協議,於2021年2月10日以私募方式發行最多45,655,000股普通股(管道股);(E)根據我們與出售 證券持有人之間於2021年2月10日達成的經修訂和重新簽署的註冊權協議,最多可增發10,929,867股普通股,授予該等持有人關於該等股份的登記權;及(F)368,408股已發行普通股根據本招股説明書,我們將不會從出售證券持有人出售普通股或認股權證中獲得任何收益。
出售證券持有人可以公開或私下 交易方式,以現行市場價格或協議價格發售、出售或分銷在此登記的全部或部分證券。我們將不會從出售普通股或認股權證的股份中獲得任何收益,除非我們在行使認股權證時收到的金額。我們將 承擔與註冊這些證券相關的所有成本、費用和費用,包括與遵守國家證券或藍天法律有關的費用。出售證券持有人將承擔因出售普通股或私募認股權證股票而產生的所有佣金和折扣。 請參閲標題為??的一節。配送計劃.
我們的普通股和公共認股權證在紐約證券交易所(NYSE?)上市,代碼分別為?NUVB和 ?NUVB.WS。2021年6月1日,我們普通股的最新報告銷售價格為每股13.60美元,我們的公共認股權證的最新報告銷售價格為每份認股權證4.40美元。
我們是一家新興成長型公司和一家較小的報告公司,符合美國聯邦證券法的定義。 請參閲招股説明書摘要和作為一家新興成長型公司和一家較小的報告公司的影響。本招股説明書符合適用於作為新興成長型公司和較小的報告公司的發行人的要求。
投資我們的證券涉及高度的風險。您應從本招股説明書的第7頁開始,並在本招股説明書的任何修訂或補充中的類似標題下,仔細查看 標題為風險因素的章節中描述的風險和不確定性。
美國證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券,或者 都沒有對本招股説明書的準確性或充分性進行評估。任何相反的陳述都是刑事犯罪。
招股説明書日期為 2021年6月2日