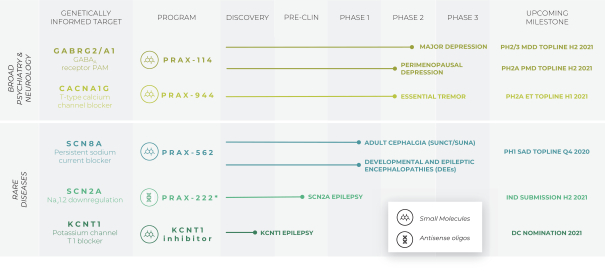
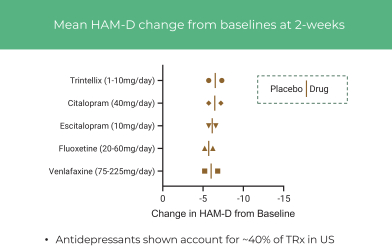
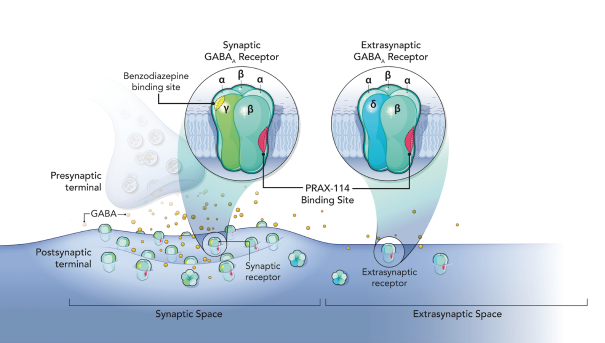
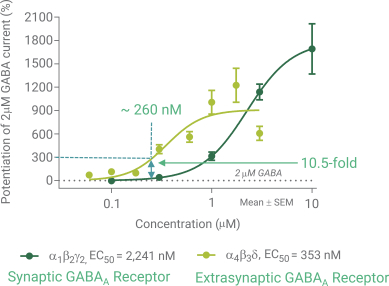
依據第424(B)(4)條提交
註冊號碼333-249074
| 招股説明書 |
1000萬股

普通股
這是我們普通股的首次公開發行。我們將提供1000萬股我們的普通股。在這次發行之前,我們的普通股還沒有公開市場。我們的普通股已獲準在納斯達克 全球精選市場掛牌上市,代碼為?PRAX。我們普通股的首次公開募股價格為每股19.00美元。
根據美國證券交易委員會(Securities And Exchange Commission)的適用規則,我們是一家新興的成長型公司,本招股説明書和未來備案文件的上市公司報告要求將有所降低。
美國證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券,也沒有對本招股説明書的準確性或充分性進行評估。任何相反的陳述都是刑事犯罪。
我們的業務和對普通股的投資涉及重大風險 。這些風險在本招股説明書第13頁開始的標題?風險因素下進行了描述。
| 每股 | 總計 | |||||||
| 公開發行價 |
$ | 19.00 | $ | 190,000,000 | ||||
| 承保折扣(1) |
$ | 1.33 | $ | 13,300,000 | ||||
| 扣除費用前的收益將捐給Praxis Precision Medicines,Inc. |
$ | 17.67 | $ | 176,700,000 | ||||
| (1) | 有關承保補償的其他 信息,請參閲本招股説明書第218頁開始的承保(利益衝突)。 |
承銷商還可以自本招股説明書發佈之日起30天內,以公開發行價減去承銷折扣向我們額外購買最多1,500,000股股票,以彌補超額配售。
承銷商預計將於2020年10月20日在紐約交割 股票。
賬簿管理經理
| 考恩 | Evercore ISI | 派珀·桑德勒 |
銷售線索經理
韋德布什PacGrow
聯席經理
黑石資本市場
2020年10月15日。