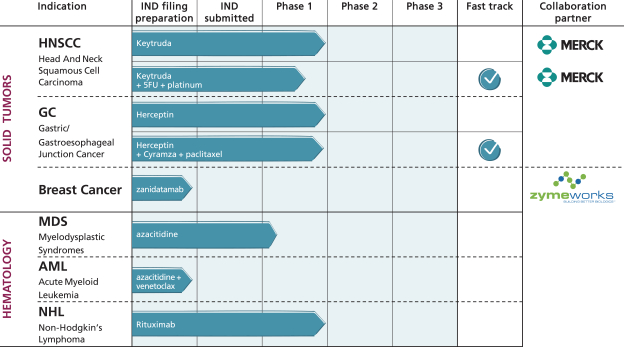
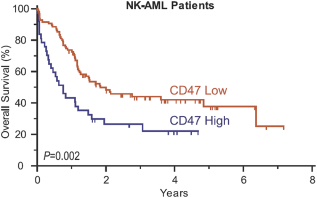
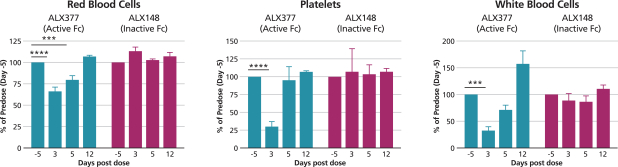
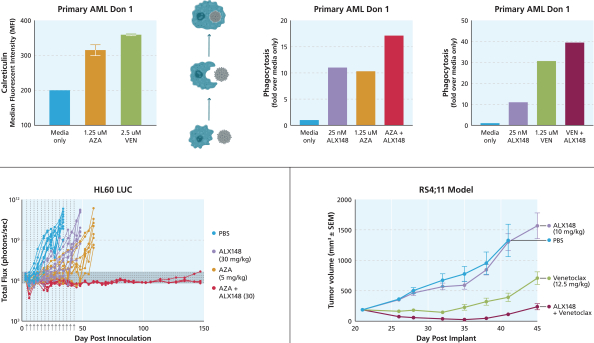
依據第424(B)(4)條提交
註冊號碼第333-251171及333-251248
招股説明書
238萬股

普通股
我們將 發售238萬股我們的普通股。
我們的普通股在納斯達克全球精選市場掛牌上市,代碼是?ALXO。 2020年12月9日,我們的普通股在納斯達克全球精選市場的最新報告售價為每股81.73美元。
我們是一家新興的成長型公司,正如聯邦證券法 所定義的那樣,因此,我們已選擇遵守本招股説明書的某些降低的報告要求,並可能選擇在未來的備案文件中這樣做。
投資我們的普通股有很高的風險。請從本 招股説明書第12頁開始閲讀風險因素。
美國證券交易委員會(Securities And Exchange Commission)和任何州證券委員會都沒有批准或不批准這些證券,也沒有確定 本招股説明書是否真實或完整。任何相反的陳述都是刑事犯罪。
| 每股 | 共計 | |||||||
| 公開發行價格 |
$ | 76.00 | $ | 180,880,000 | ||||
| 承保折扣和佣金(1) |
$ | 4.56 | $ | 10,852,800 | ||||
| 未扣除費用的ALX腫瘤學控股公司收益 |
$ | 71.44 | $ | 170,027,200 | ||||
| (1) | 有關承保人賠償的更多信息,請參閲第166頁開始的承保? |
普通股預計將在2020年12月14日左右交割。我們已授予承銷商為期30天的選擇權, 可額外購買357,000股我們的普通股。如果承銷商全面行使選擇權,我們應支付的承保折扣和佣金總額為12,480,720美元,扣除費用前給我們的總收益為 $195,531,280。
| 傑弗瑞 | 瑞士信貸(Credit Suisse) | 派珀·桑德勒 |
| 康託 | 瑞銀投資銀行 |
生活科學資本
日期為2020年12月9日的招股説明書