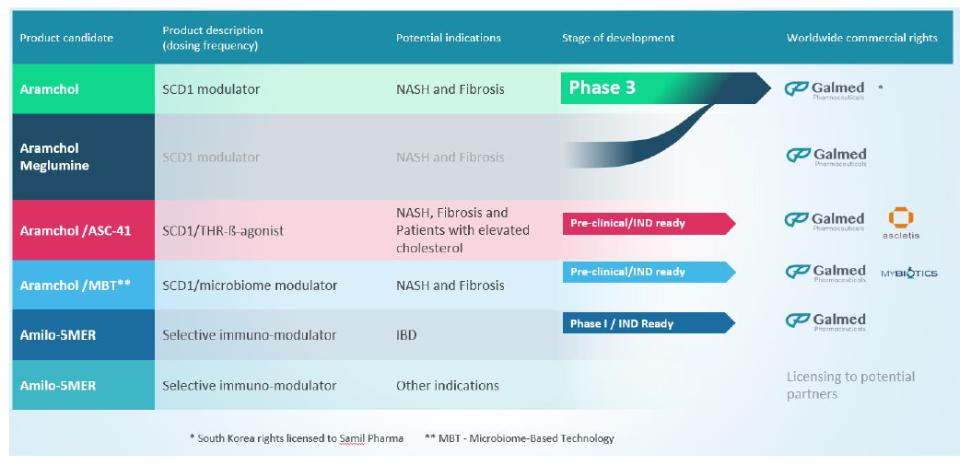
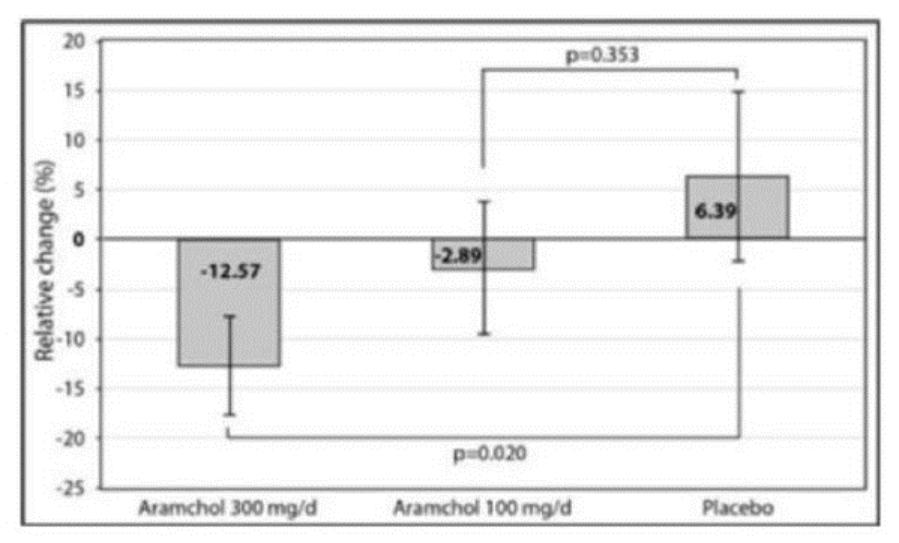
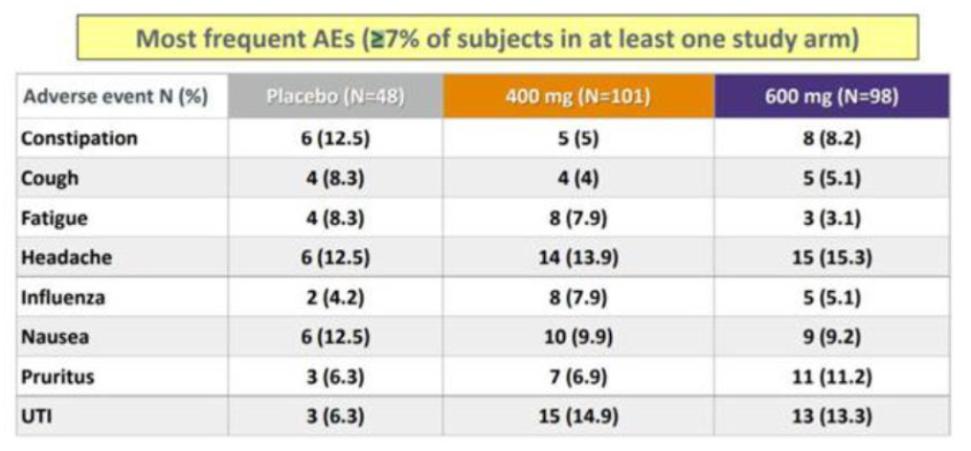
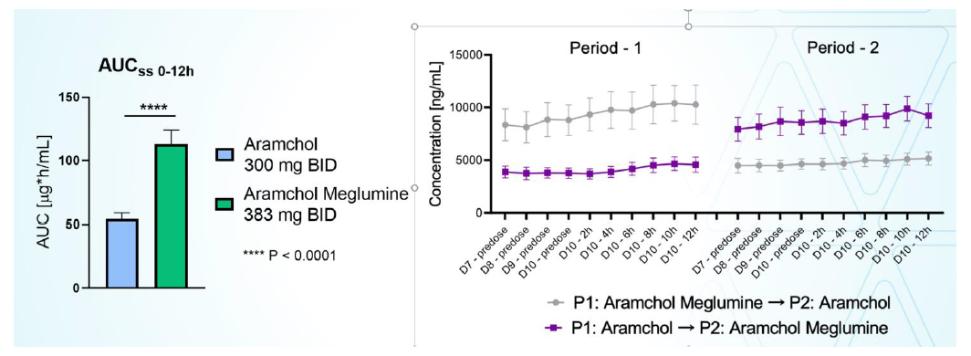
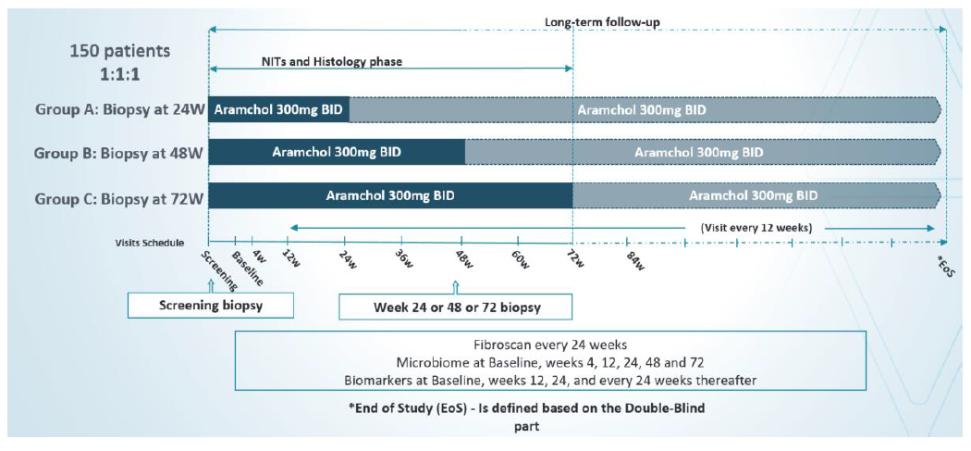
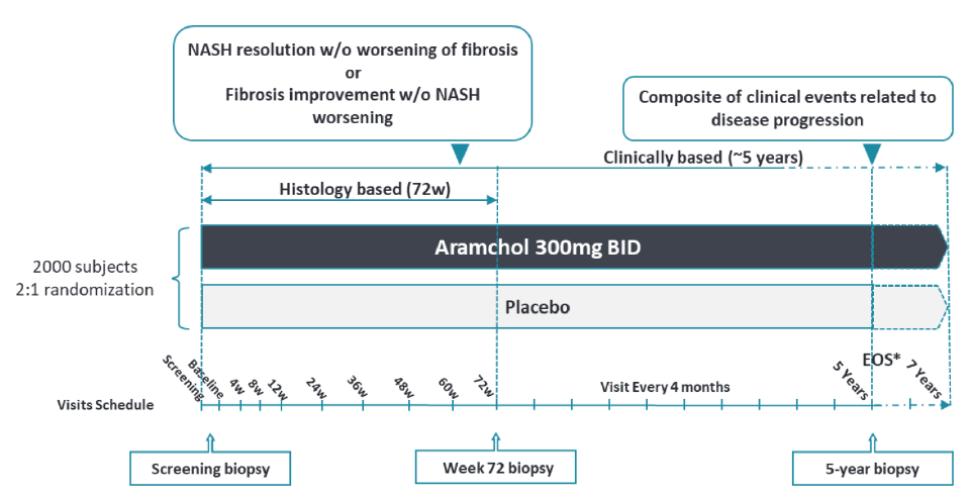
目錄
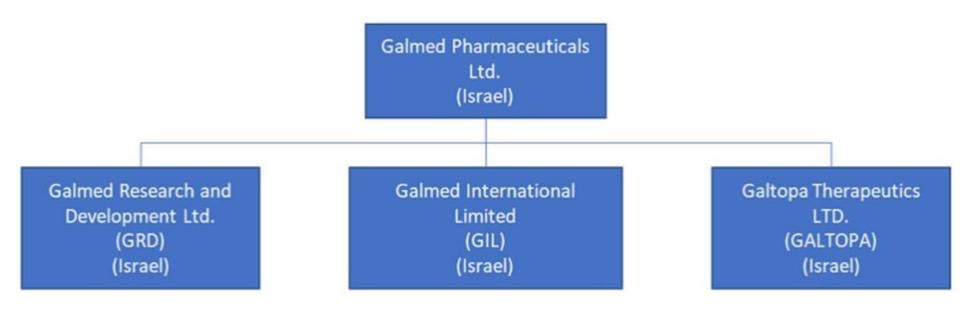
2014年2月2日,我們進行了重組,根據重組,我們所有的無形資產(包括我們的知識產權)從GIL轉移到GRD。重組是通過股份轉讓和資產轉讓完成的,使本公司成為母公司,並擁有以下公司的100%股權:(1)持有本集團所有知識產權(包括本公司的專利組合)的GRD;(2)非活躍公司GIL;以及(3)於2017年清算的GTTI。GIL持有GMR,GMR於2015年成為一家不活躍的公司,並於2019年2月被清算。這次重組是為了簡化我們的資本結構,降低我們的運營成本,提高我們的籌資能力。就在重組之前,我們的所有股東總共持有9,739股GHI普通股。與重組有關,並根據税前裁決,吾等向所有該等股東發行本公司普通股,以致於重組後,吾等全體股東合共持有7,099,731股本公司普通股,佔所有股東的比例相同,反映出本公司普通股與每股GHI普通股的比率為729股。
以下是我們的公司結構圖(GTTI清算後):
2014年3月18日,我們完成了首次公開募股(IPO),此後一直在納斯達克資本市場(Nasdaq Capital Market)掛牌上市,代碼為“GLMD”。
我們在以色列的主要執行辦事處和註冊辦事處位於以色列特拉維夫Tiomkin Street 16號,郵政編碼6578317,我們的電話號碼是+9723938448。我們的網址是http://www.galmedpharma.com.我們網站上包含的或可以通過我們網站訪問的信息既不是本年度報告的一部分,也不包含在本年度報告中。我們將我們的網站地址包括在本年度報告中,僅作為不活躍的文本參考。Puglisi&Associates,或Puglisi,是我們在美國的授權代表,負責某些有限的事務。普格利西的地址是特拉華州紐瓦克圖書館大道850號,郵編:19711。
證交會維護一個互聯網網站,其中包含以電子方式向證交會提交文件的發行人的報告、委託書和信息聲明以及其他信息,網址為http://sec.gov.我們使用我們的網站(Http://www.galmedpharma.com)作為公司信息的分發渠道。我們通過此渠道發佈的信息可能會被視為重要信息。因此,投資者除了關注我們的新聞稿、美國證券交易委員會(SEC)文件以及公開電話會議和網絡廣播外,還應該關注我們的網站。然而,我們網站的內容不是本年度報告的一部分。
57