目錄
數據截止時,9名患者的疾病控制率為89%,在8名可評估的患者中,有7名(87.5%)的靶病變減少。之前接受治療的平均次數為1.1次,89%的患者之前接受過化療。4名患者人乳頭瘤病毒(HPV)陽性,2名患者HPV陰性,3名患者HPV狀態不明。治療緊急不良事件(TEAE)的情況與潛在的晚期疾病和已知的培布羅利珠單抗、淋巴濾除和IL-2方案的不良事件情況是一致的。最常見的TEAE是寒戰、低血壓、貧血、血小板減少、發熱、疲勞和心動過速。
2019年11月,我們宣佈,我們的PBL療法的研究新藥申請(IND)IOV-2001獲得了FDA的授權,我們贊助的使用這種療法的臨牀試驗IOV-CLL-01獲準繼續進行。IOV-2001是一種非轉基因多克隆T細胞產品,從患者血液中提取50毫升,經過9天的生產過程。IOV-CLL-01是1/2期臨牀試驗,評估IOV-2001在復發或難治性慢性淋巴細胞白血病或小淋巴細胞白血病患者中的安全性和有效性。IOV-CLL-01試驗預計將招募大約70名患者。
作為我們與MD Anderson癌症中心(MDACC)合作計劃的一部分,2018年啟動了兩項第二階段試驗。這兩項試驗都是由MDACC贊助的。第一項試驗名為NCT03449108,旨在研究Iovance公司生產的LN-145,使用我們的製造工藝治療軟組織肉瘤、骨肉瘤和耐鉑卵巢癌患者。與MDACC合作的第二個試驗NCT03610490也在進行中。這項試驗正在治療對鉑耐藥的卵巢癌、胰腺癌和結直腸癌患者。這項試驗使用MDACC生產的TIL,使用urelumab,一種4-1BB激動型抗體,作為生產過程的一部分。使用此製造過程獲得的數據可能不能代表我們使用第二代製造過程的數據。
我們還與蒙特利爾大學中心(CHUM)、耶魯大學(Yale University)和莫菲特(Moffitt)合作,對其他適應症的TIL療法進行研究人員贊助的臨牀試驗。CHUM和Moffitt贊助的臨牀試驗使用或將使用由不同製造工藝製造的TIL,這可能不能代表我們使用第二代製造工藝的數據。
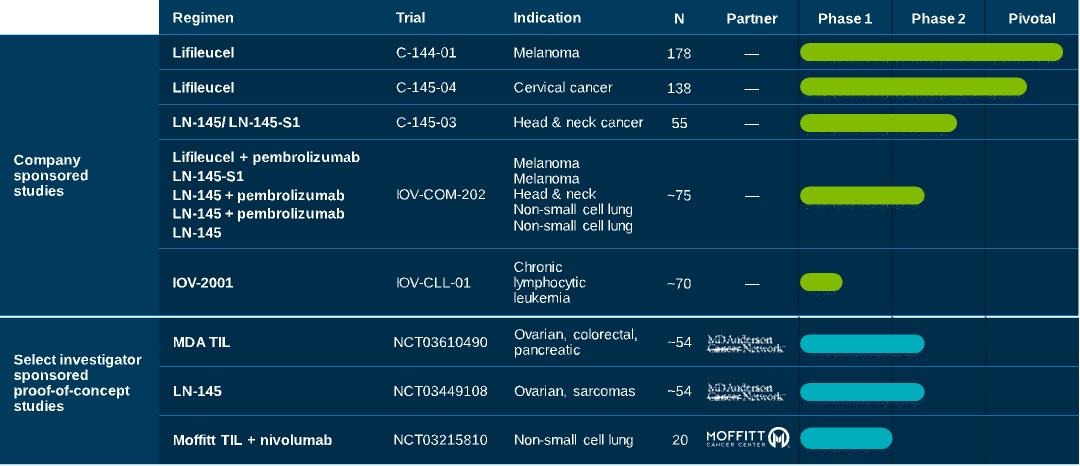
我們目前的候選產品和選定的研究人員贊助的概念驗證研究總結如下:
30