美國
證券交易委員會
華盛頓特區20549
表格20-F
(第一標記)
| ☐ |
依據1934年度證券交易所條例第12(B)或(G)條作出的註冊聲明
|
或
|
依據1934年度證券交易所第13或15(D)條提交的年報
|
截至#date0#12月31日的財政年度
或
| ☐ |
依據1934年度證券交易所條例第13或15(D)條提交的過渡報告
|
或
| ☐ |
根據1934年度證券交易所第13或15(D)條作出的空殼公司報告
|
事件發生日期需要此空殼公司報告
的過渡時期
佣金檔案編號001-38024
碧昂斯公司
(註冊人的確切名稱,一如其章程所指明者)
開曼羣島
(法團或組織的司法管轄權)
碧昂斯公司
紐約,紐約10005
(主要行政辦公室地址)
董事會主席兼首席執行官Lan Huang博士
電話:+1(646)305-#number0#
傳真:+1(646)882-4228
碧昂斯公司
自由街28號,39樓
紐約,紐約10005
(公司聯絡人姓名、電話、電郵及/或傳真號碼及地址)
根據該法第12(B)條登記或將登記的證券。
|
每一班的職稱
|
註冊的每個交易所的名稱
|
|
|
普通股,每股面值0.0001美元
|
納斯達克股票市場有限責任公司
|
根據該法第12(G)條登記或登記的證券:無
根據該法第15(D)條負有報告義務的證券:無
註明截至年度報告所述期間結束時每個發行人類別的資本或普通股的流通股數:22,530,702普通股,截至2017,012月31日
如“證券法”第405條所界定,以勾選標記標明註冊人是否為知名的有經驗的發行人。是的,☐號碼。
如果本報告是年度報告或過渡報告,請用複選標記標明註冊人是否不需要根據1934“證券交易法”第13或15(D)條提交報告。是的,☐No。
注-以上覆選框不會免除任何註冊人根據“1934證券交易法”第13或15(D)節提交報告的義務。
Indicate by check mark whether the registrant (1) has filed all reports required to be filed by Section 13 or 15(d) of the Securities Exchange Act of 1934 during the preceding 12 months (or for such shorter period that the registrant was required to file such reports), and (2) has been subject to such filing requirements for the past 90 days. Yes No ☐
請檢查註冊人是否已以電子方式提交併張貼在其公司網站上(如果有的話),説明在過去12個月內,根據條例S-T(本章第232.405節)規則第四零五條的要求提交和張貼的每一交互數據文件(或要求註冊人提交和張貼此類文件的較短期限)。是的,沒有☐
通過檢查標記表明註冊人是大型加速備案者、加速備案者還是非加速備案者。見“外匯法”第12b-2條規則中“加速備案者和大型加速申報人”的定義。(檢查一):
|
大型加速箱
|
☐
|
加速過濾器
|
☐
|
|
非加速過濾
|
☐
|
新興成長型公司
|
如果一家新興成長型公司按照美國公認會計準則編制其財務報表,請用支票標記表明註冊人是否選擇不使用延長的過渡期來遵守根據“外匯法”第13(A)條規定的任何新的或經修訂的財務會計準則†。
†指的是財務會計準則委員會在2012年月5日後發佈的對其會計準則編纂的任何更新。
通過核對標記表明登記人用於編制本年度報告所列財務報表的會計基礎:
|
美國公認會計原則
|
國際財務報告準則
國際會計準則發佈
板☐
|
其他☐
|
如果在回答上一個問題時選中了“其他”,請用複選標記標明登記人選擇遵循的財務報表項目。☐項目18☐。
如果這是年度報告,請檢查註冊人是否為空殼公司(如“交易法”規則12b-2所定義的)。是的,☐否。
目錄
第一部分
|
項目1.
|
董事、高級管理人員和顧問的身份
|
4
|
|
項目2.
|
提供統計數據和預期時間表
|
4
|
|
項目3.
|
關鍵信息
|
4
|
|
項目4.
|
有關該公司的資料
|
59
|
|
項目4A。
|
未解決的工作人員意見
|
105
|
|
項目5.
|
經營與財務回顧與展望
|
105
|
|
項目6.
|
董事、高級管理人員和僱員
|
118
|
|
項目7.
|
大股東與關聯方交易
|
128
|
|
項目8.
|
財務信息
|
132
|
|
項目9.
|
要約和上市
|
132
|
|
項目10.
|
補充資料
|
133
|
|
項目11.
|
市場風險的定性和定量披露
|
146
|
|
項目12.
|
證券的描述(股本證券除外)
|
147
|
|
第二部分
|
||
|
項目13.
|
違約、股利拖欠和拖欠
|
148
|
|
項目14.
|
對證券持有人權利的實質性修改和收益的使用
|
148
|
|
項目15.
|
管制和程序
|
149
|
|
項目16.
|
[預留]
|
150
|
|
項目16A.
|
審計委員會財務專家
|
150
|
|
項目16B.
|
道德守則
|
150
|
|
項目16C.
|
首席會計師費用及服務
|
150
|
|
項目16D.
|
豁免審計委員會的上市標準
|
151
|
|
發行人及關聯購買者購買權益證券
|
151
|
|
|
項目16F.
|
註冊會計師的變更
|
151
|
|
項目16G.
|
公司治理
|
151
|
|
項目16H.
|
礦山安全披露
|
151
|
|
第III部
|
||
|
項目17.
|
財務報表
|
152
|
|
項目18.
|
財務報表
|
152
|
|
項目19.
|
展品
|
153
|
目錄
導言
BeyondSpringInc.於2014根據開曼羣島的法律註冊為一家豁免公司。Except as the context otherwise may require, all references to “us,” “our,” “BeyondSpring,” “we,” the “Company” and similar designations refer to Dalian Wanchun Biotechnology Co., Ltd., or Wanchun Biotech, the former holding company of our U.S. subsidiary, and its consolidated subsidiaries, as a whole, prior to the completion of our internal corporate reorganization, and BeyondSpring 公司及其合併子公司,在我們公司內部重組完成後,於2015年月日結束。See Note 1 to our consolidated financial statements included elsewhere in this annual report. All references in this annual report to “$,” “U.S.$,” “U.S. dollars,” “dollars” and “USD” mean U.S. dollars, all references to “RMB” mean Renminbi, the legal currency of China, and all references to “AUD” mean Australian dollars, unless otherwise noted.本年度報告中對“中華人民共和國”或“中國”的所有提述均指中華人民共和國。
目錄
前瞻性陳述
這份關於表格20-F的年度報告包含了前瞻性的陳述,這些陳述基於我們管理層的信念和假設,以及我們管理層目前可以獲得的信息。雖然我們認為這些前瞻性報表所反映的期望是合理的,但這些報表涉及未來事件或我們未來的財務業績,涉及已知和未知的風險、不確定因素和其他因素,這些因素可能導致我們的實際結果、活動水平、業績或成就與這些前瞻性報表所表達或暗示的任何未來結果、活動水平、業績或成就大不相同。本年度報告中的前瞻性發言包括但不限於以下方面的説明:
| · |
我們在動物和臨牀試驗中的研究的開始、時間、進展和結果,以及我們的研究和發展計劃;
|
| · |
我們有能力推動我們的產品候選人進入併成功完成臨牀試驗;
|
| · |
我們依靠臨牀階段產品的成功;
|
| · |
監管申請和批准的時間或可能性;
|
| · |
我們的產品候選產品的商業化,如果獲得批准;
|
| · |
我們發展銷售和營銷能力的能力;
|
| · |
產品候選產品的定價和報銷,如獲批准;
|
| · |
實施我們的商業模式,我們的業務和技術戰略計劃;
|
| · |
我們能夠建立和維護知識產權的保護範圍,涵蓋我們的產品、候選人和技術;
|
| · |
我們在不侵犯第三方知識產權和專有技術的情況下經營業務的能力;
|
| · |
與保護知識產權、產品責任和其他索賠有關的費用;
|
| · |
美國、中國和其他司法管轄區的監管發展;
|
| · |
估算我們的開支、未來收入、資本需求和我們對額外融資的需求;
|
| · |
戰略合作協定的潛在好處和我們訂立戰略安排的能力;
|
| · |
我們維持和建立合作關係或獲得額外贈款的能力;
|
| · |
我們的產品候選人的市場接受率和程度;
|
| · |
與我們的競爭對手和我們的行業有關的發展,包括競爭療法;
|
| · |
有效管理預期增長的能力;
|
| · |
我們有能力吸引和留住合格的員工和關鍵人才;
|
2
目錄
| · |
我們對美國創業法案(BusinessStartups Act)或“就業法案”(就業法案)下的新興成長型公司的期望;
|
| · |
關於未來收入、僱用計劃、開支、資本支出、資本需求和分享業績的報表;
|
| · |
未來我國普通股的交易價格以及證券分析師的報告對這些價格的影響。
|
歷史事實陳述以外的所有陳述都是前瞻性陳述.這些前瞻性聲明是根據經修正的“1934證券交易法”第21E條或“交易法”的“安全港”規定作出的,並在1995“私人證券訴訟改革法”中作了定義。在某些情況下,你可以用“可能”、“將”、“應該”、“期望”、“打算”、“計劃”、“預期”、“相信”、“估計”、“預測”、“潛在”、“繼續”等術語來識別前瞻性陳述,或者這些術語的負面詞或其他類似術語。這些説法只是預言。你不應過分依賴前瞻性陳述,因為它們涉及已知和未知的風險、不確定性和其他因素,在某些情況下,這些因素超出了我們的控制範圍,而且可能對結果產生重大影響。可能導致實際結果與目前預期大不相同的因素包括,除其他外,列在“項目3”下的因素。關鍵信息-D.風險因素“以及本年度報告的其他部分。如果這些風險或不確定性中有一個或多個發生,或者如果我們的基本假設被證明是不正確的,那麼實際事件或結果可能與前瞻性陳述所暗示或預測的事件或結果有很大差異。沒有前瞻性聲明是未來業績的保證。您應該閲讀本年度報告和我們在本年度報告中提到的文件,並瞭解到我們未來的實際結果可能與這些前瞻性聲明所表達或暗示的任何未來結果大不相同。
本年度報告中的前瞻性發言代表了我們在本年度報告之日的看法。我們預計,隨後發生的事件和事態發展將使我們的觀點發生變化。不過,雖然我們將來可能會選擇更新這些前瞻性的聲明,但我們目前並無打算這樣做,除非是在適用的法律所規定的範圍內。因此,你不應以這些前瞻性發言作為我們在本年度報告提交之日之後的任何日期的意見的代表。
這份年度報告載有從行業出版物中獲得的市場數據和行業預測。這些數據涉及許多假設和限制,並告誡您不要過分重視這些估計。雖然我們認為這份年報所載的市場狀況、市場機會和市場規模資料大致上是可靠的,但這些資料本身是不準確的。
3
目錄
第一部分
| 項目1. |
董事、高級管理人員和顧問的身份
|
不適用。
| 項目2. |
提供統計數據和預期時間表
|
不適用。
| 項目3. |
關鍵信息
|
| A. |
選定財務數據
|
截至12月31日、2015、2016和2017年底的綜合損失數據綜合報表和截至12月31日、2016和2017的選定綜合資產負債表數據是從本年度報告其他地方所載的經審計的合併財務報表中得出的。截至2015年度12月31日的選定綜合資產負債表數據是從本年度報告未包括的經審計的合併財務報表中得出的。我們的財務報表是根據美國公認的會計原則(或美國公認會計準則)編制的。你應該閲讀這些數據,連同我們的審計綜合財務報表和本年度報告其他部分的相關説明,以及標題“第5項”下的信息。經營及財務檢討及展望。“我們的歷史成果不一定代表我們未來的結果。
|
截至12月31日的年度,
|
||||||||||||
|
2015
|
2016
|
2017
|
||||||||||
|
(單位:千美元(“美元”),
除股份及每股款額外)
|
||||||||||||
|
綜合損失數據報表:
|
||||||||||||
|
收入
|
—
|
—
|
—
|
|||||||||
|
業務費用:
|
||||||||||||
|
研究與開發(包括截至#date0#12月31日的專利費用42,259美元)
|
(6,282
|
)
|
(10,437
|
)
|
(88,928
|
)
|
||||||
|
一般和行政
|
(1,193
|
)
|
(1,931
|
)
|
(9,053
|
)
|
||||||
|
業務損失
|
(7,475
|
)
|
(12,368
|
)
|
(97,981
|
)
|
||||||
|
外匯收益(虧損),淨額
|
13
|
(195
|
)
|
555
|
||||||||
|
利息收入
|
13
|
18
|
120
|
|||||||||
|
其他收入
|
—
|
—
|
918
|
|||||||||
|
利息費用
|
(532
|
)
|
—
|
—
|
||||||||
|
財產和設備處置方面的損失
|
(27
|
)
|
—
|
—
|
||||||||
|
權益法投資淨虧損
|
(44
|
)
|
—
|
—
|
||||||||
|
所得税前淨虧損
|
(8,052
|
)
|
(12,545
|
)
|
(96,388
|
)
|
||||||
|
所得税利益
|
—
|
—
|
—
|
|||||||||
|
淨損失
|
(8,052
|
)
|
(12,545
|
)
|
(96,388
|
)
|
||||||
|
減:非控制權益造成的淨損失
|
(82
|
)
|
(535
|
)
|
(4,625
|
)
|
||||||
|
可歸因於BeyondSpring公司的淨虧損
|
(7,970
|
)
|
(12,010
|
)
|
(91,763
|
)
|
||||||
|
每股淨虧損
|
||||||||||||
|
鹼性稀釋
|
(0.53
|
)
|
(0.75
|
)
|
(4.40
|
)
|
||||||
|
加權平均股票發行基礎和稀釋
|
15,171,370
|
16,086,419
|
20,866,084
|
|||||||||
4
目錄
|
截至12月31日的年度,
|
||||||||||||
|
2015
|
2016
|
2017
|
||||||||||
|
(單位:千美元(“美元”),
除股份及每股款額外)
|
||||||||||||
|
其他綜合損失
|
||||||||||||
|
外幣折算調整收益(虧損)
|
(21
|
)
|
(64
|
)
|
(1
|
)
|
||||||
|
總綜合損失
|
(8,073
|
)
|
(12,609
|
)
|
(96,389
|
)
|
||||||
|
減:非控制利益造成的全面損失
|
(92
|
)
|
(561
|
)
|
(4,535
|
)
|
||||||
|
可歸因於BeyondSpring公司的全面損失
|
(7,981
|
)
|
(12,048
|
)
|
(91,854
|
)
|
||||||
|
綜合資產負債表數據:
|
||||||||||||
|
現金
|
10,821
|
11,687
|
27,481
|
|||||||||
|
總資產
|
10,970
|
14,908
|
32,828
|
|||||||||
|
流動負債總額
|
1,312
|
2,609
|
4,792
|
|||||||||
|
負債總額
|
1,312
|
2,609
|
4,792
|
|||||||||
|
非控制利益
|
708
|
147
|
960
|
|||||||||
|
總股本
|
9,658
|
12,299
|
28,036
|
|||||||||
| B. |
資本化和負債
|
不適用。
| C. |
提供和使用收益的理由
|
不適用。
| D. |
危險因素
|
與我們的財務狀況有關的風險和需要追加資本
我們的經營歷史有限,這可能使我們很難評估我們目前的業務和預測我們的未來業績。
萬春生物科技有限公司,原美國子公司控股公司,成立於2010。到目前為止,我們的業務重點是組織和配置我們的公司,業務規劃,籌集資金,建立我們的知識產權組合,包括保護普林布林的權利,以及進行動物研究和普林布林的臨牀試驗。Our current pipeline consists of Plinabulin for multiple indications, including the prevention of chemotherapy-induced severe neutropenia, or CIN, as a direct anticancer agent in non-small cell lung cancer, or NSCLC, when combined with docetaxel and as a direct anticancer agent in NSCLC when combined with nivolumab and a pipeline of preclinical immuno-oncology product candidates.我們還沒有證明我們有能力成功地完成大規模的關鍵臨牀試驗,獲得監管批准,製造商業規模的藥物,或者安排第三方代表我們這樣做,或者進行成功商業化所必需的銷售和營銷活動。我們還沒有獲得監管機構的批准,也沒有證明我們的任何產品候選產品都有商業化的能力。我們沒有批准的產品進行商業銷售,也沒有從產品銷售中獲得任何收入。因此,很難評估我們的業務和未來業績的前景。
5
目錄
我們致力於發現和發展創新的,分子靶向的和免疫腫瘤治療癌症的藥物。我們有限的經營歷史,特別是考慮到迅速發展的癌症治療領域,可能使我們很難評估我們目前的業務和未來業績的前景。我們短暫的歷史使我們對未來業績或生存能力的任何評估都會受到重大不確定性的影響。我們將遇到早期公司在迅速發展的領域中經常遇到的風險和困難,因為我們尋求向一家能夠支持商業活動的公司過渡。此外,作為一個新的業務,我們可能更可能遇到意外的費用,困難,複雜和延誤,由於經驗有限。如果我們不成功地解決這些風險和困難,我們的業務就會受到影響。
自成立以來,我們在每一段時間內均錄得淨虧損,並預計在可預見的將來,我們會繼續錄得淨虧損。
藥品開發具有高度的投機性,因為它需要大量的前期資本支出,而且產品候選人將無法獲得監管機構的批准或無法獲得患者、醫生和付款人的商業可行性和接受的重大風險。我們已將大部分財政資源用於研究和開發,包括我們在動物和臨牀試驗方面的研究。到目前為止,我們還沒有從產品銷售中獲得任何收入,而且我們繼續承擔着與我們正在進行的業務相關的重大開發和其他開支。因此,我們沒有盈利,並已在每一個期間發生虧損,我們成立於2010。截至#date0#12月31日,我們報告淨虧損9,640萬美元,截至12月31日,累計虧損達123.9,000美元,其中4,230萬美元可歸因於發行給NPBISPO液化信託公司(Nereus Trust)的股票。與我們於2017年月14日完成的首次公開募股(Ipo)有關,我們向Nereus信託公司發行了2,112,963股普通股,並終止了我們與Nereus製藥公司或Nereus公司之間的特許權使用費安排。見“項目5”。經營與財務回顧與展望-A.經營業績-運營結果-截至12月31日、2017和2016年底的年度比較-研究與發展。“從Nereus獲得的專利作為研究和開發費用支出,成本是根據發行的普通股每股20美元的公允價值確定的。截至12月31日、2015和2016這幾年,我們分別報告淨虧損800萬美元和1,250萬美元,截至12月31日,累計赤字為3,210萬美元。基本上,我們所有的經營損失都是由於與我們的研究和開發計劃有關的費用以及與我們的業務有關的一般和行政費用造成的。
我們預計在可預見的未來將繼續遭受損失,我們預計,隨着我們繼續開發我們的產品候選產品並尋求監管批准,這些損失還會增加,並開始將已批准的藥物商業化(如果有的話)。通常情況下,從發現一種新藥到可以用於治療病人,需要很多年的時間。我們可能會遇到意外的開支、困難、複雜情況、延誤和其他未知因素,這些因素可能會增加我們的開支,並對我們創造收入的能力造成不利影響。我們未來淨虧損的規模將在一定程度上取決於我們管理業務這些方面的能力。如果我們的任何產品在臨牀試驗中失敗,或者沒有獲得監管機構的批准,或者如果獲得批准,無法獲得市場認可,我們可能永遠不會盈利。即使我們在未來取得盈利能力,我們也可能無法在隨後的時期內維持盈利能力。我們先前的虧損和預期的未來虧損已經並將繼續對我們的股東權益和營運資本產生不利影響。
我們期望我們的研究和開發費用將繼續很大,因為我們將繼續投資於我們正在進行的和計劃中的臨牀試驗,為我們目前的產品候選人和任何未來的產品候選人,我們可能開發。此外,我們計劃在獲得監管批准之前對商業化前活動進行投資,如果我們獲得產品候選產品的監管批准,我們預計會導致銷售和營銷費用的增加。此外,我們還承擔了與作為一家上市公司經營有關的額外費用。因此,我們預計在可預見的將來,將繼續遭受重大和不斷增加的經營損失和負現金流量。這些虧損已經並將繼續對我們的股東權益、財務狀況、現金流動和週轉資本產生重大不利影響。
我們將需要獲得額外的資金來資助我們今後的業務。如果我們不能獲得這樣的資金,我們可能無法完成我們目前或未來產品候選人的開發和商業化。
我們通過發行股票、股東貸款和第三方貸款為我們的業務提供資金.Through December 31, 2017, we have raised approximately $81.4 million in equity financing, $1.0 million in third party loans, which was since converted into an equity investment, and $8.8 million in shareholder loans, of which $0.4 million has been repaid and $8.4 million was assumed by Wanchun Biotech, the former holding company of our U.S. subsidiary, on July 20, 2015 pursuant to our internal restructuring.我們的產品候選人將要求完成監管審查,重大營銷努力和大量投資,然後他們才能提供任何產品銷售收入。
6
目錄
自成立以來,我們的業務消耗了大量的現金。在截至12月31日、2015、2016和2017的年度,用於我們業務活動的淨現金分別為660萬美元、1370萬美元和2880萬美元。我們預計將繼續投入大量資金來發現新產品候選人,推進產品候選產品的臨牀開發,並將我們獲得監管批准的任何產品候選產品推出和商業化,包括建立我們自己的商業機構,以應對中國的某些市場。
我們將需要獲得額外的資金,以資助我們的未來業務,並完成我們目前或未來的產品候選人的開發和商業化。此外,我們的固定費用和其他合同承諾數額很大,預計今後還會增加。
我們未來的資金需求將取決於許多因素,包括但不限於:
| · |
我們目前、計劃和未來臨牀試驗的費用;
|
| · |
由美國食品藥品監督管理局(FDA)、中國食品藥品監督管理局(FDA)、中國食品藥品監督管理局(CFDA)、歐洲藥品管理局(EMA)和類似監管機構批准的結果、時間和成本,包括我們可能需要進行的任何額外研究;
|
| · |
我們產品候選產品商業化的成本;
|
| · |
完成商業規模外包製造活動的成本和時間;
|
| · |
我們從產品候選人那裏獲得的利潤,如果有的話,我們成功地將產品商業化;
|
| · |
提出、起訴、辯護和執行任何專利主張和其他知識產權的費用;
|
| · |
與我們可能建立的任何未來合作、許可或其他安排有關的費用;
|
| · |
任何未來收購的現金需求;
|
| · |
作為上市公司經營的成本;
|
| · |
迴應技術及市場發展所需的時間及成本;及
|
| · |
我們可能開發的產品候選人的數量和特點,以及與開發相關的費用。
|
我們可以通過公共或私人股本發行、許可協議、債務融資、合作、戰略聯盟和營銷或分銷安排來滿足未來的現金需求。
根據我們目前的經營計劃,我們預計截至12月31日為止,我們現有的現金、現金等價物和短期投資3,060萬美元,將使我們至少在提交這份表格20-F的年度報告後12個月內,能夠支付我們的運營費用和資本支出需求。我們可能會比我們預期的更快地利用我們的資本資源。此外,完成普林布林與尼沃盧馬聯合治療非小細胞肺癌的臨牀試驗,以及我們治療CIN和開發其他產品候選產品的兩期2/3臨牀試驗將需要額外的資金。因此,我們將需要更多的資金,而這些資金我們可能無法以可接受的條件獲得,或根本無法獲得。如果我們不能在必要時或在有吸引力的條件下籌集資金,我們將被迫推遲、減少或取消我們的研究和開發計劃或未來的商業化努力。當我們需要額外的資金時,我們無法獲得額外的資金,這可能會嚴重損害我們的業務。
7
目錄
籌集更多的資金可能會給我們的股東造成稀釋,限制我們的經營,或者要求我們放棄我們的技術或產品的權利。
我們可以通過股票發行、債務融資、合作、許可安排、戰略聯盟以及營銷或分銷安排等方式尋求額外資金。任何發行股票或與股票掛鈎的證券,都可能導致我們的股東被大幅稀釋.增加負債或發行某些股本證券可能導致固定付款義務增加,還可能導致某些額外的限制性公約,例如限制我們承受額外債務或發行額外股本的能力,限制我們獲得或許可知識產權的能力,以及可能對我們經營業務的能力產生不利影響的其他業務限制。此外,增發股票或發行這種證券的可能性,可能會導致我們普通股的市價下跌。如果我們達成合作或許可協議來籌集資金,我們可能被要求接受不利的條件,包括在不利條件下將我們對技術或產品候選者的權利放棄或許可給第三方,否則我們將尋求開發或商業化我們自己,或在我們能夠獲得更有利的條件時為未來的潛在安排保留潛在的可能安排。
我們目前無法從產品銷售中獲得收入,而且可能永遠不會盈利。
我們能否創造收入和盈利,取決於我們能否成功地完成我們的產品候選人的開發,並獲得我們可能開發的任何未來產品候選人的必要監管批准,因為我們目前沒有任何可供商業銷售的藥物。我們期望通過我們的產品候選人和任何未來的產品候選人的商業化而繼續遭受巨大的和不斷增加的損失。我們的產品候選人沒有一個被批准在中國、美國、歐盟或任何其他地區銷售,而且可能永遠不會得到這樣的批准。我們創造收入和實現盈利的能力取決於我們是否有能力完成我們的產品候選產品和我們開發的任何未來產品候選產品的開發,獲得必要的監管批准,並使我們的藥品生產和銷售成功。
即使我們獲得一個或多個產品候選人的監管批准和營銷授權,或任何未來商業銷售的產品候選人中的一個或多個,除非我們在以下方面取得成功,否則潛在的產品可能根本無法產生收入:
| · |
為我們的產品候選者和任何批准的產品開發可持續和可擴展的製造過程,包括與第三方建立和保持商業上可行的供應關係;
|
| · |
直接或與合作者或分銷商合作,對產品候選人進行啟動和商業化,並獲得監管批准和營銷授權;
|
| · |
爭取市場接納我們的產品候選產品作為可行的治療方案;以及
|
| · |
解決任何相互競爭的技術和市場發展。
|
此外,我們實現和保持盈利的能力取決於我們承擔的時間和開支數額。如果FDA、CFDA、EMA或其他類似的監管機構要求我們除了目前預期的研究之外,我們的開支可能會大幅增加。即使我們的產品候選產品被批准用於商業銷售,我們預計將承擔與這些藥物的商業銷售相關的重大成本。
8
目錄
即使我們能夠從銷售我們開發的任何產品中獲得收入,我們也可能無法在可持續的基礎上實現盈利。如果我們不能繼續盈利,就會降低我們公司的價值,並對我們普通股的市場價格產生不利影響,這可能會損害我們籌集資金、擴大業務或繼續運營的能力,並使您損失全部或部分投資。
與產品開發相關的風險
我們在很大程度上依賴於Plinbulin的成功,它正在為多種適應症而開發。我們開發的任何其他產品候選產品的臨牀試驗都可能不成功。如果我們不能將產品的候選產品商業化,或者在這樣做的過程中經歷了重大的延誤,我們的業務將受到實質性的損害。
我們的業務和是否有能力創造與產品銷售相關的收入,將取決於我們可能開發的任何其他產品的成功開發、監管批准和商業化。我們已經投入了很大一部分努力和財政資源,以發展我們目前的產品候選人,並期望投資於其他產品候選人。Plinbulin和任何其他潛在產品的成功取決於許多因素,包括:
| · |
動物研究和臨牀試驗的成功註冊和完成;
|
| · |
第三方安全、高效、符合協議的臨牀試驗能力;
|
| · |
從FDA、CFDA、EMA和其他類似的監管機構獲得對我們產品候選產品的監管批准;
|
| · |
通過與第三方製造商的安排建立商業製造能力;
|
| · |
如獲批准,我們的產品候選產品將開展商業銷售;
|
| · |
確保我們不侵犯、挪用或者以其他方式侵犯第三方的專利、商業祕密或者其他知識產權;
|
| · |
獲得醫生和病人對產品候選人的認可;
|
| · |
如獲批准,可從第三方付款人處獲得產品候選方的補償;
|
| · |
我們有能力與其他產品和藥品競爭;
|
| · |
在獲得監管批准後,在收到產品時,為產品候選人保持可接受的安全狀況;及
|
| · |
獲得和維護專利、商業祕密和其他知識產權保護和管理專門性。
|
我們可能無法及時或完全實現監管批准和商業化。在我們獲得批准和/或成功地使我們的產品候選產品商業化的能力方面出現重大延誤將對我們的業務造成重大損害,而且我們可能無法產生足夠的收入和現金流量來繼續我們的業務。
9
目錄
我們目前的所有臨牀試驗都涉及到Plinbulin的多種適應症,我們可能無法成功地確定或發現更多的候選產品。由於我們有限的資源和獲得資金的機會,我們必須,而且在過去已經決定,優先發展普林布林為不同的跡象。如果我們目前的產品候選產品不能成為可行的產品,我們的業務將受到不利影響.
儘管我們打算在未來探索除Plinbulin之外的其他治療機會,這是我們從Nereus那裏獲得的,並且沒有自行開發,但目前我們只確定了三種產品候選產品,不包括Plinbulin,而對這些候選產品的臨牀試驗尚未開始。開發產品候選人需要大量的技術、財政和人力資源,無論我們最終是否成功。我們的研究項目以及我們的合作者華盛頓大學和弗雷德·哈欽森癌症研究中心,或弗雷德·哈欽森中心的研究項目,最初可能在確定潛在的適應症和/或產品候選人方面顯示出希望,但由於以下幾個原因未能為臨牀開發取得成果:
| · |
所使用的研究方法可能無法成功地確定潛在的跡象和/或產品候選人;
|
| · |
經進一步研究後,可能會發現潛在的產品候選人具有有害的副作用或其他特徵,表明它們不太可能是有效的藥物;或
|
| · |
可能需要更多的人力和財政資源來為我們的產品候選人確定更多的治療機會,或者通過內部研究項目開發合適的潛在產品候選人,從而限制了我們多樣化和擴大藥物組合的能力。
|
由於我們的財政和管理資源有限,我們把重點放在研究項目和產品候選人的具體跡象。我們可能會把我們的努力和資源集中在潛在的產品候選人或其他最終被證明是不成功的潛在項目上。我們也可能放棄或推遲與其他產品候選人一起尋找機會,或為了後來證明具有更大商業潛力或更大成功可能性的其他跡象。我們的資源分配決定可能導致我們無法利用可行的商業產品或有利可圖的市場機會。
因此,我們可能永遠無法為我們的產品候選人確定更多的治療機會,或通過內部研究項目開發合適的潛在產品候選人,這可能會對我們未來的發展和前景或我們的合作產生實質性的不利影響。
如果我們在臨牀試驗中很難登記病人,我們的臨牀發展活動可能會受到延遲或其他不利影響。
根據其議定書及時完成臨牀試驗,除其他外,取決於我們是否有能力招收足夠數量的符合試驗標準的病人,並在試驗結束之前留在試驗中。由於各種原因,我們在臨牀試驗中可能難以登記和留住適當的病人,包括:
| · |
病人人數和性質;
|
| · |
臨牀協議中確定的病人資格標準;
|
| · |
對試驗的主要終點進行統計分析所需的研究人口的規模;
|
| · |
病人接近試驗地點;
|
| · |
審判設計和審判設計的變更;
|
10
目錄
| · |
我們有能力招聘具有適當能力和經驗的臨牀試驗調查員;
|
| · |
類似療法或其他新療法的臨牀試驗相互競爭,這將減少我們可以使用的病人的數量和類型;
|
| · |
臨牀醫生和病人對正在研究的產品的潛在優勢和副作用的看法,包括可能被批准用於我們正在調查的適應症的任何新藥物或治療;
|
| · |
我們獲得和維持病人同意的能力;
|
| · |
參加臨牀試驗的病人不得完成臨牀試驗;
|
| · |
獲得批准的療法,類似於我們的產品候選。
|
即使我們能夠在我們的臨牀試驗中吸收足夠數量的病人,病人登記的延遲也可能導致費用增加,或影響計劃中的臨牀試驗的時間或結果,這可能妨礙這些試驗的完成,並對我們推動產品候選產品開發的能力產生不利影響。
臨牀藥物的開發涉及到一個漫長而昂貴的過程,並且在這個過程的任何階段都可能失敗。我們在進行臨牀試驗方面的經驗有限,以前的研究和試驗的結果可能不會在今後的臨牀試驗中重現。
臨牀試驗費用昂貴,需要許多年才能完成,在臨牀試驗過程中隨時可能發生失敗。動物的研究結果和我們產品候選產品的早期臨牀試驗結果可能無法預測後期臨牀試驗的結果。我們目前正在對CIN和NSCLC中的Plinbulin進行臨牀試驗,但是我們沒有進行與Plinabin和多西紫杉醇相結合的1/2期臨牀試驗,也沒有進行101項研究。研究101由Nereus進行,在1/2期臨牀試驗基本完成後,我們從Nereus獲得了Plinbulin。在臨牀試驗的後期階段,儘管通過動物研究和初步臨牀試驗取得了進展,但候選產品可能無法顯示出所期望的安全性和有效性特徵。在某些情況下,同一產品候選產品的不同試驗之間的安全性和(或)療效結果可能存在顯著差異,原因有許多因素,包括協議規定的試驗程序的變化、患者羣體規模和類型的差異(包括遺傳差異)、患者遵守給藥方案的情況和病人的輟學率。由於更多的臨牀試驗地點和更多的國家和語言參與了這些試驗,以後的試驗結果也可能與早期的試驗不同。此外,臨牀試驗的設計可以確定其結果是否支持產品的批准,而臨牀試驗設計的缺陷可能在臨牀試驗進展良好和發生重大費用之後才會顯現。
製藥和生物技術行業的一些公司在高級臨牀試驗中遭遇重大挫折,原因是缺乏證明的療效或不良的安全狀況,儘管在早期試驗中取得了可喜的結果。潛在產品的臨牀試驗往往表明,繼續開發是不實際的或不可行的。例如,在研究101的第二階段中,所有的患者在普林布林加多西他賽手臂中的存活率都沒有明顯的改善。我們決定進行第三階段普林布林與多西他賽聯合治療晚期非小細胞肺癌的臨牀試驗(研究103)。基於先前的子集分析,在研究103中,我們將那些至少失敗了一次鉑基化療並具有可測量病變的晚期或轉移性非小細胞肺癌患者納入本試驗。以這種方式設計第三階段試驗可能會增加試驗結果可能與我們預期的不一樣的風險。如果普林布林聯合多西他賽治療晚期非小細胞肺癌的研究結果在統計學上沒有顯示出顯著的療效,且安全性可以接受,我們將無法獲得普林布林的批准。In addition, based upon a post hoc analysis of Study 101 in which Plinabulin demonstrated a benefit to patients in CIN, we met with the FDA and have initiated two Phase 2/3 trials in CIN (Study 105 and Study 106). If these trials or other trials we conduct fail to meet their primary statistical and clinical endpoints they will not support CFDA or FDA approval of Plinabulin in one or both of these indications.如果出現這種情況,我們將需要用一項或多項新的審判取代任何失敗的審判,這將需要大量額外費用,造成商業化方面的重大拖延,並對我們的業務、財務狀況、現金流量和業務結果造成重大不利影響。
11
目錄
如果我們的產品候選產品的臨牀試驗未能證明安全和有效,使FDA、CFDA、EMA或其他類似的監管機構滿意,或者不產生積極的結果,我們可能會在完成或最終無法完成我們的產品候選產品的開發和商業化過程中承擔額外的費用或經歷延誤。
在申請並獲得銷售我們的產品候選產品的監管批准之前,我們必須進行廣泛的臨牀試驗,以證明我們的產品候選產品在人體內的安全性和有效性。臨牀試驗費用昂貴,設計和實施困難,可能需要很多年才能完成,而且可能失敗。我們的一個或多個臨牀試驗的失敗可能發生在測試的任何階段,而臨牀試驗的成功中期結果並不一定能預測成功的最終結果。
我們和我們的合同研究組織,或CRO,被要求遵守良好的臨牀實踐要求,或GCPs,這是由FDA,CFDA,EMA和其他類似的監管機構對臨牀開發中的所有藥物實施的條例和指南。監管當局通過定期檢查審判發起人、主要調查人員和審判地點來執行這些全球合作伙伴制度。遵守GCPs可能是昂貴的,如果我們或我們的任何CRO未能遵守適用的GCPs,在我們的臨牀試驗中生成的臨牀數據可能被認為是不可靠的,FDA、CFDA、EMA或類似的監管機構可能要求我們在批准我們的營銷申請之前進行額外的臨牀試驗。
我們可能會在臨牀試驗期間或由於臨牀試驗而經歷許多意外事件,這些事件可能會延誤或妨礙我們獲得監管批准或將產品候選品商業化的能力,包括:
| · |
監管機構、機構評審委員會、或倫理委員會不得授權我們或我們的調查人員開始臨牀試驗或在預期的試驗地點進行臨牀試驗;
|
| · |
我們的產品候選產品的臨牀試驗可能會產生負面或非決定性的結果,我們可能會決定,或者監管機構可能要求我們進行更多的臨牀試驗或放棄藥物開發計劃;
|
| · |
我們的候選產品臨牀試驗所需的病人人數可能比我們預期的要多,註冊人數可能不夠,或者比我們預期的要慢,或者病人的輟學率可能比我們預期的要高;
|
| · |
我們的第三方承包商和調查人員可能沒有及時或根本不遵守監管要求或履行他們對我們的合同義務;
|
| · |
我們可能不得不暫停或終止對產品候選產品的臨牀試驗,原因有多種,包括缺乏臨牀反應或確定參與者面臨不可接受的健康風險;
|
| · |
監管機構、IRBs或倫理委員會可能要求我們或我們的調查人員出於各種原因暫停或終止臨牀研究,包括不遵守監管要求;
|
| · |
我們的產品候選產品臨牀試驗的成本可能比我們預期的要高;
|
| · |
我們的產品候選人或進行臨牀試驗所需的其他資料的供應或質素可能不足或不足;及
|
| · |
我們的產品候選可能會導致不良事件、不良副作用或其他意想不到的特性,導致我們、我們的調查人員或監管機構暫停或終止試驗。
|
12
目錄
如果我們被要求在我們目前所設想的範圍之外對我們的產品候選人進行額外的臨牀試驗或其他測試,如果我們無法成功地完成我們的產品候選人的臨牀試驗或其他測試,如果這些試驗或測試的結果不是陽性或只是中度陽性,或者如果它們引起了安全問題,我們可以:
| · |
延遲為我們的產品候選人獲得法規批准;
|
| · |
根本沒有獲得監管機構的批准;
|
| · |
對未達到預期範圍的跡象獲得批准;
|
| · |
經監管部門批准後,將藥品從市場上移除;
|
| · |
須符合額外的售後測試要求;
|
| · |
受藥物分銷或使用方式的限制;或
|
| · |
因使用毒品而無法獲得補償。
|
測試或批准的延遲可能會增加我們的藥物開發成本。我們不知道是否會按計劃開始任何臨牀試驗,是否需要重組,或是否會如期完成,或根本沒有。臨牀試驗可能產生陰性或非決定性的結果。此外,這些審判可能會被推遲或進行得比預期的要快。延遲完成我們的臨牀試驗將增加我們的成本,減緩我們的產品候選開發和批准過程,並危及我們開始產品銷售和創造收入的能力,而且我們可能沒有足夠的資金來完成測試和批准過程。任何這些事件都可能嚴重損害我們的業務、財務狀況和前景,導致我們的產品候選人被拒絕接受監管批准,或允許我們的競爭對手在我們之前將藥品推向市場,如果獲得批准,我們的藥品商業化的能力就會受到損害。
與我們的產品候選人獲得監管批准有關的風險
FDA、CFDA、EMA和其他類似的監管機構的監管審批過程宂長、耗時且本質上不可預測,如果我們最終無法為我們目前的產品候選人或我們可能開發的任何未來產品候選人獲得監管批准,我們的業務將受到嚴重損害。
我們不能商業化的產品候選人,除非首先獲得監管批准,以銷售每種藥物,從FDA,CFDA,EMA或類似的監管當局。在獲得對任何目標指示的產品候選產品的商業銷售的監管批准之前,我們必須在動物研究和嚴格控制的臨牀試驗中證明,關於在美國的批准,令FDA滿意的是,該產品的候選產品對於該目標指示是安全和有效的,並且製造設施、工藝和控制是足夠的。
獲得FDA、CFDA、EMA和其他類似監管機構批准所需的時間是不可預測的,但在動物研究和臨牀試驗開始後通常需要許多年,這取決於許多因素,包括監管當局的重大酌處權。此外,審批政策、法規或獲得批准所需的臨牀數據的類型和數量在監管當局之間可能有所不同,並可能在產品候選人的臨牀開發過程中發生變化。我們尚未獲得任何產品候選產品的監管批准。無論是我們現有的產品候選人,還是我們可能發現或獲得的用於未來開發的任何產品候選人,都有可能獲得監管機構的批准。即使我們在一個法域獲得監管批准,我們也可能無法在其他法域獲得批准。
13
目錄
我們的產品候選方可能無法獲得FDA、CFDA、EMA或類似監管機構的任何監管批准,原因包括:
| · |
與監管機構就臨牀試驗的設計或實施存在分歧;
|
| · |
未能證明產品候選產品是安全和有效的,或安全的,純的和有力的,其擬議的指示;
|
| · |
臨牀試驗結果不能滿足統計意義水平的批准。例如,研究101的結果沒有統計學意義;
|
| · |
未能證明候選產品的臨牀和其他好處大於其安全風險;
|
| · |
我們對動物研究或臨牀試驗數據的解釋與監管者意見不一;
|
| · |
從臨牀試驗中收集的數據不足,無法支持新藥申請、NDA或其他申請或獲得監管批准的提交和提交;
|
| · |
FDA、CFDA、EMA或可比監管當局發現與我們簽訂臨牀和商業用品合同的第三方製造商的製造工藝或設施有關的缺陷;以及
|
| · |
批准政策或規定的變化,使我們的臨牀前研究和臨牀數據不足以批准。
|
In addition, conducting our late stage clinical trials for the treatment of CIN and NSCLC for Plinabulin that include a majority of patients in China may create some regulatory risks for our NDA filings in the U.S. Our ongoing NSCLC clinical trial (Study 103) will be conducted in 554 patients with 80% of the patients in China and 20% of the patients in the U.S. and Australia.Our CIN clinical trials (Study 105 and Study 106) will be conducted in approximately 400 patients with approximately 50% of the patients in China and 50% of the patients in the U.S., Russia, Hungary and the Ukraine. If no benefit is shown in the U.S. population, if the results of our studies do not support the assessment that the Phase 2/3 study data may be pooled, or if the 登記的病人人數不反映美國的護理標準,試驗結果可能不適用於美國病人,FDA可能不批准我們的NDA。
任何FDA、CFDA、EMA或類似的監管機構都可能需要更多的信息,包括額外的臨牀前研究或臨牀數據,以支持批准,這可能會推遲或阻止批准和我們的商業化計劃,或者我們可能決定放棄開發計劃。如果我們獲得批准,監管機構可能會批准我們的任何產品候選人,因為我們要求的數量較少或更有限。例如,由於FDA認為鱗狀和非鱗狀非小細胞肺癌是不同的疾病,取決於我們對非小細胞肺癌第三階段試驗的結果,我們可能只能獲得其中一種疾病的批准。監管機構也可以根據昂貴的市場營銷後臨牀試驗的表現給予批准,或者批准帶有標籤的產品候選產品,而該標籤對該產品候選產品的成功商業化是不可取的。此外,如果我們的產品候選產品產生不良副作用或涉及其他安全問題,FDA可能要求建立風險評估減輕戰略,或REMS,或CFDA,EMA或類似的監管機構可能需要建立類似的戰略。例如,這樣一種策略可能限制我們產品候選產品的分發,需要病人或醫生的教育,或者對我們強加其他繁瑣的實施要求。
14
目錄
上述任何一種情況都會對我們產品的商業前景造成實質性的損害。
如果監管機構需要額外的時間或研究來評估產品候選產品的安全性或有效性,我們的產品候選產品可能會被大大推遲,或者不會獲得批准。
我們可能無法完成我們的產品候選人的開發,或啟動或完成任何未來的產品候選人,我們可能會按計劃開發,如果有的話。根據我們目前的運營計劃,我們預計,截至12月31日,我們現有的現金和現金等價物以及短期投資3060萬美元,將使我們至少在提交本年度報告後的12個月內,能夠滿足我們的運營費用和資本支出需求。我們可能比預期更快地利用我們的資本資源。In addition, completing the clinical trials of Plinabulin in combination with nivolumab for the treatment of NSCLC and the development of other product candidates will require additional funds. If regulatory authorities require additional time or studies to assess the safety or efficacy of our product candidates, we may not have or be able to obtain adequate funding to complete the necessary steps for approval for our product candidates or any future product candidate.
動物研究和臨牀試驗證明我們的產品的安全性和有效性是耗時和昂貴的,需要幾年或更長時間才能完成。在美國、中國、歐洲或其他市場,臨牀試驗、監管批准或拒絕監管批准申請的延誤可能是由於許多因素造成的,其中包括:
| · |
我們無法獲得進行或繼續臨牀試驗所需的足夠資金,包括由於意外費用或其他商業決定而缺乏資金;
|
| · |
未能與FDA、CFDA、EMA或其他監管機構就臨牀試驗的範圍或設計達成協議,或無法遵守這些規定;
|
| · |
臨牀擱置、對開始或繼續進行臨牀試驗的其他監管異議或條件,或在需要此類批准的國家無法獲得監管機構批准開始臨牀試驗;
|
| · |
我們無法就可接受的條件與潛在的CRO和試驗場達成協議,這些協議的條款可以經過廣泛的談判,而且在不同的CRO和試驗場之間可能會有很大的差異;
|
| · |
我們無法獲得國際研究中心或倫理委員會的批准,無法在各自的地點進行臨牀試驗;
|
| · |
我們無法在臨牀試驗中登記足夠數量的符合納入和排除標準的患者;
|
| · |
我們無法在臨牀試驗中保留足夠數量的病人;
|
| · |
我們無法按照監管要求或我們的臨牀協議進行臨牀試驗;
|
| · |
臨牀現場和調查人員偏離審判規程,不按照規定進行審判,退出或者退出審判,或者喪失參加審判資格的;
|
| · |
無法確定和維持足夠數量的試驗場所,其中許多可能已經參與其他臨牀試驗項目,包括一些可能是為了同樣的指示;
|
| · |
延遲或失敗增加新的臨牀試驗地點;
|
15
目錄
| · |
我們的第三方臨牀試驗管理人員未能履行合同義務或未達到預期的最後期限;
|
| · |
製造問題,包括製造問題或及時從第三方獲得足夠數量的產品供臨牀試驗使用;
|
| · |
治療後難以與患者保持聯繫,導致資料不完整;
|
| · |
不明確或否定的中期結果,或與先前結果不一致的結果;
|
| · |
動物臨牀試驗和支持性研究的不利或不確定的結果;
|
| · |
對動物和臨牀試驗的額外分析、報告、數據和研究,或與數據解釋有關的管理問題的管理要求;
|
| · |
來自FDA、CFDA、EMA、IRB、數據安全監測委員會或可比實體的反饋意見,或早期階段或同時在動物和臨牀試驗中進行的研究的結果,涉及我們的產品候選產品或其他藥物產品,包括可能需要修改試驗協議的產品;
|
| · |
不可接受的風險-利益簡介或意外的安全問題或不良副作用;
|
| · |
FDA、CFDA、EMA、IRB、可比實體或公司的決定,或數據安全監測委員會或可比監管實體的建議,因安全問題或任何其他原因,隨時暫停或終止臨牀試驗;以及
|
| · |
未能證明使用藥物有好處。
|
監管要求和指導也可能發生變化,我們可能需要修改提交給適用的監管機構的臨牀試驗規程以反映這些變化。修正案可能要求我們重新提交臨牀試驗規程給IRBs或倫理委員會重新檢查,這可能會增加完成臨牀試驗所需的費用或時間。
我們在CIN中的第2/3階段試驗(研究105和研究106)和我們在晚期NSCLC的第3階段試驗(研究103)的結果可能不足以支持我們的產品候選人提交或批准營銷申請。FDA、CFDA、EMA或其他監管機構可能要求我們註冊更多的研究對象或進行更多的臨牀試驗。
可能FDA、CFDA、EMA或其他監管機構可能不認為我們在CIN中的兩期2/3試驗或NSCLC的第3階段試驗的結果足以批准我們對每個適應症的Plinbulin。特別是,FDA通常需要兩個關鍵的臨牀試驗來批准一種藥物。然而,在腫瘤學領域,FDA在某些情況下只需要一次第三階段的臨牀試驗,就可以在嚴重的醫療需求未得到滿足的情況下批准一種藥物。FDA通常不認為單一的臨牀試驗足以作為一個關鍵的試驗,除非,除其他外,它是很好的控制,並顯示出對死亡率,不可逆轉的發病率,或預防疾病的潛在嚴重後果的臨牀有意義的影響,並且驗證性研究將是實際或倫理上不可能的。While we have been informed by the FDA that one Phase 2/3 trial with (i) results that are highly statistically significant, (ii) a clinically meaningful effect on survival that is consistent among relevant subgroups and (iii) an acceptable risk-benefit profile may be sufficient for approval of Plinabulin as an anticancer agent in advanced metastatic NSCLC, because the FDA generally requires two pivotal clinical trials, it may require that we conduct 在每次NDA提交之前,我們的Plinabin產品候選產品的更大或更多的臨牀試驗,或作為對每項適應症的批准的要求。It is also possible that, even if we achieve favorable results in the Phase 2/3 CIN trials or Phase 3 NSCLC trial, the FDA may require us to enroll additional subjects or conduct additional clinical trials, possibly involving a larger sample size or a different clinical study design, particularly if the FDA does not find the results from each Phase 2/3 CIN trial or Phase 3 NSCLC trial to be sufficiently persuasive to support each NDA submission.
16
目錄
如果FDA、CFDA、EMA或其他監管機構需要更多的研究,我們將在營銷審批過程中承擔更多的費用和延誤,這可能需要我們花費比我們現有的更多的資源。此外,FDA、CFDA、EMA或其他監管機構可能對成功的NDA或類似的營銷應用所需的要素有不同的意見,這可能導致我們改變我們的發展、監管和/或商業化戰略。
#date0#,中共中央、國務院辦公廳發佈了“關於深化藥品和醫療器械鑑定制度改革和創新的意見”,除其他外,規定加快對急需臨牀實踐的藥品、醫療器械的審批程序。對於(I)治療不能有效治癒的嚴重及危及生命的疾病的藥物或醫療器具,或(Ii)迫切需要改善公眾健康的藥物或醫療器具,如這些藥物或醫療器具的臨牀試驗的早期及中期指標顯示有效及潛在的臨牀價值,則可有條件地批准這些藥物及醫療器具的銷售,以及希望推廣的公司。銷售此類藥物或醫療器械時,應根據適用的要求制定風險控制計劃。根據我們與cfda的討論,我們認為Plinabin在CIN和NSCLC中的目標適應症符合這一標準。如果來自研究105第3階段的中期結果的療效數據,則為106的第2階段和第2階段的結果。研究103號的中期結果是積極的,我們計劃在2018年底或2019上半年在中國進行加速或有條件的批准。然而,我們可能無法從國家食品藥品監督管理局獲得這種有條件的或加速的批准,在這種情況下,批准途徑將比我們預期的更長,我們最終可能無法獲得批准。
我們的產品候選產品可能導致不良事件,或具有其他特性,可能會延遲或阻止其監管審批,限制已批准的標籤的商業形象,或在任何監管批准後造成重大的負面後果。
由我們的產品候選人或我們可能開發的任何未來產品候選人引起的不良不良事件可能導致我們或監管機構中斷、延遲或停止臨牀試驗,並可能導致FDA、CFDA、EMA或其他類似監管機構的更嚴格的標籤或延遲或拒絕批准。不良不良事件引起的Plinbulin可能包括,但不限於,噁心,嘔吐,疲勞,發燒,腫瘤疼痛和暫時性血壓升高。我們在任何發展階段的試驗結果都可能顯示出不良事件的嚴重程度或普遍程度,這是不可接受的。如果發生這種情況,我們的試驗可能被暫停或終止,FDA、CFDA、EMA或其他類似的監管機構可以命令我們停止進一步開發或拒絕批准我們針對任何或所有目標指標的產品候選產品。普林布林是我們目前所有三個臨牀產品候選的有效成分,影響着我們目前的所有臨牀試驗。因此,任何嚴重的影響產生的Plinbulin將導致負面的後果,我們的每一個目前的產品候選人。與藥物有關的不良事件也可能影響患者的招募或登記對象完成試驗的能力,可能導致潛在的產品責任索賠,並可能嚴重損害我們的聲譽、商業、財務狀況和商業前景。
此外,如果我們目前或未來的產品候選人中有一人或多人獲得監管機構的批准,而我們或其他人後來確認了此類藥物造成的不良副作用,則可能會產生一些潛在的重大負面後果,包括:
| · |
我們可以暫停這種藥物的銷售;
|
| · |
監管機關可以撤銷對該藥品的批准;
|
| · |
管理當局可要求在標籤上附加警告;
|
| · |
我們可能被要求為該藥物開發一種REMS,或者如果REMS已經存在,則在REMS之下納入額外的要求,或者根據類似的監管當局的要求制定類似的戰略;
|
| · |
我們可能需要進行市場後研究;
|
17
目錄
| · |
我們可能會被起訴,並就對當事人或病人造成的傷害承擔責任;以及
|
| · |
我們的名聲可能會受損。
|
這些事件中的任何一個都會阻止我們獲得或保持市場對特定產品候選產品的認可,如果獲得批准,可能會嚴重損害我們的業務、運營結果和前景。
此外,聯合治療,如我們的臨牀試驗聯合多西他賽和其他化療藥物,涉及獨特的不良事件,可能會加劇比單一療法的不良事件。這些類型的不良事件可能是由我們的產品候選人引起的,也可能導致我們或監管機構中斷、延遲或停止臨牀試驗,並可能導致更嚴格的標籤,或者導致FDA、CFDA、EMA或其他類似的監管機構延遲或拒絕批准。我們的試驗結果可能揭示出不良事件的嚴重程度或普遍程度,這是無法接受的。
即使我們為我們的產品候選人獲得監管批准,我們也將面臨持續的監管義務和持續的監管審查,這可能會導致重大的額外開支,如果我們不遵守監管要求或我們的產品候選人遇到意想不到的問題,我們可能會受到處罰。
如果我們的產品候選人或我們開發的任何未來產品候選人獲得批准,他們將受到持續的監管要求,如製造、標籤、包裝、儲存、廣告、促銷、取樣、記錄保存、進行營銷後研究以及提交安全、功效和其他市場後信息,包括美國聯邦和州的要求以及類似監管機構的要求。
藥品製造商和製造商的設施必須遵守廣泛的FDA、CFDA、EMA和類似的監管機構要求,包括在美國確保質量控制和製造程序符合當前良好的生產實踐或cGMP法規。因此,我們的合同製造商將接受持續的審查和檢查,以評估cGMP的遵守情況和在任何NDA、其他營銷應用程序中所作承諾的遵守情況,以及先前對檢查結果的反應。因此,我們和我們與之合作的其他方面必須繼續在遵守法規的所有領域,包括在生產、生產和質量控制方面,花費時間、金錢和精力。
我們為我們的產品候選人獲得的任何監管批准都可能受到藥物可能銷售的已批准的指定用途的限制,也可能受到批准條件的限制,或者包含對潛在昂貴的營銷後測試的要求,包括第四階段的臨牀試驗和監測,以監測該產品候選產品的安全性和有效性。FDA還可能需要一個REMS項目作為我們產品候選人批准的條件,這可能需要對長期的病人跟蹤、藥物指南、醫生溝通計劃或其他確保安全使用的要素,如限制分發方法、病人登記和其他風險最小化工具。此外,如果FDA、CFDA、EMA或類似的監管機構批准了我們的產品候選產品,我們將必須遵守要求,例如,提交安全和其他營銷後信息和報告、註冊以及繼續遵守GCPs和cGMP,以便我們在批准後進行任何臨牀試驗。
如果不遵守監管要求和標準,或者在藥品上市後出現問題,FDA可以頒佈同意令或撤銷批准。Later discovery of previously unknown problems with our product candidates, including adverse events of unanticipated severity or frequency, or with our third-party manufacturers or manufacturing processes, or failure to comply with regulatory requirements, may result in revisions to the approved labeling to add new safety information; imposition of post-market studies or clinical studies to assess new safety risks; or imposition of distribution restrictions or other restrictions under a REMS program.其他潛在後果包括:
| · |
限制藥品的銷售或製造,從市場上撤出產品,或自願或強制召回產品;
|
18
目錄
| · |
罰款、無名稱或警告信,或擱置臨牀試驗;
|
| · |
FDA拒絕批准我們提出的待批准申請或補充申請,或暫停或吊銷許可證批准;
|
| · |
扣押或扣留產品,或拒絕準許我們的產品候選人進出口;及
|
| · |
禁止或判處民事或刑事處罰。
|
FDA嚴格管制投放市場的產品的營銷、標籤、廣告和促銷。藥品只能根據經批准的適應症和經批准的標籤的規定進行推廣。fda、cfda、epa和其他監管機構積極執行禁止推廣標籤外用途的法律和法規,而發現不適當地推廣標籤外用途的公司可能要承擔重大責任。
FDA、CFDA、EMA和其他監管機構的政策可能會發生變化,我們無法預測美國或國外未來立法或行政行動可能產生的政府監管的可能性、性質或程度。如果我們緩慢或無法適應現有要求的變化,或採用新的要求或政策,或者如果我們不能保持遵守規章的規定,我們可能失去任何可能獲得的監管批准,也可能無法實現或維持盈利能力。
與產品候選人商業化有關的風險
如果我們不能取得所需的監管許可,或在獲得這些批准方面遇到延誤,我們將無法將產品候選產品商業化,我們的創收能力將受到重大損害。
目前,我們沒有任何產品在中國、美國、歐盟或任何其他國家獲得監管批准銷售,而且我們可能永遠沒有適銷對路的藥品。我們的業務在很大程度上取決於我們是否有能力及時完成產品候選產品的開發、獲得監管機構的批准併成功地將產品商品化。我們不能在沒有獲得FDA、CFDA、EMA和類似監管機構的每一種藥物的監管許可的情況下,將產品候選品商業化。普林布林目前在兩個臨牀發展計劃:一個在CIN和第二個作為一種抗癌治療的非小細胞肺癌的治療。普林布林已在臨牀前模型和第1/2階段的試驗研究,以探討其治療潛力結合免疫腫瘤學藥物。這些試驗和今後的試驗可能不成功,監管者可能不同意我們關於動物研究和我們迄今進行的臨牀試驗的結論。
在獲得對任何目標指示的產品候選產品的商業銷售的監管批准之前,我們必須在動物研究和嚴格控制的臨牀試驗中證明,關於在美國的批准,令FDA滿意的是,該產品的候選產品對於該目標指示是安全和有效的,並且製造設施、工藝和控制是足夠的。在美國,NDA必須包括廣泛的臨牀前研究和臨牀數據以及輔助信息,在NDA的情況下,確定產品候選產品的安全性和有效性。NDA還必須包括有關藥物的化學、製造和控制的重要信息。獲得NDA的批准是一個漫長、昂貴和不確定的過程,而且可能得不到批准。如果我們向FDA提交一份NDA,FDA決定是否接受或拒絕提交申請,我們提交的任何文件都不可能被FDA接受和審查。
美國以外的監管機構,如EMA或新興市場的監管機構,如中國,也有批准商業銷售藥品的要求,在這些地區的銷售之前,我們必須遵守這些要求。監管要求可能因國家而有很大差異,可能會推遲或阻止我們的產品候選人的引進。在一國進行的臨牀試驗可能不被其他國家的管理當局接受,而在一國獲得監管批准並不意味着在任何其他國家將獲得監管批准。批准程序因國家而異,可能涉及額外的產品測試和驗證以及額外的行政審查期。尋求非美國監管機構的批准可能需要對動物或臨牀試驗進行更多的研究,這可能是昂貴和耗時的。非美國監管機構的審批過程可能包括類似於獲得FDA批准的風險。由於所有這些原因,我們可能無法及時獲得非美國監管機構的批准。
19
目錄
具體而言,在中國,中國藥品監督管理局將國內生產的創新藥物應用分類為1類,進口藥物應用為5類。到目前為止,如果美國食品和藥物管理局(FDA)或美國食品藥品管理局(EMA)尚未批准,大多數本土公司的國產藥品申請都屬於第1類。大多數跨國製藥公司的藥品註冊申請都屬於第3類,根據中國藥監局於2016年3月發佈的“化學藥物註冊類別改革計劃”,將其重新歸類為5類。這兩個類別有不同的批准途徑。我們相信本地藥物註冊途徑,即第一類,是一條比第5類更快捷和更有效的途徑,在中國市場獲得批准。在中國進行臨牀試驗之前,公司必須獲得臨牀試驗申請批准。如果產品候選人在國家優先事項清單上,此註冊途徑具有快速審核和審批機制。進口藥物註冊途徑第5類更為複雜,而且正在演變。中國第5類註冊申請只有在獲得美國藥品監督管理局(NDA)批准並獲得美國FDA或EMA等主要藥品監管機構批准的藥品產品證書(CPP)後才能提交。由CFDA指定的第1類產品不得授予我們的任何產品候選人,可能被撤銷,或可能不會導致更快的發展或法規審查或批准過程。目前,我們的領先資產普林布林在中國被認為是第一類藥物。此外,類別1的指定不會增加我們的產品候選人獲得監管批准的可能性。
此外,中國國務院在2015年8月發佈了“關於改革醫藥產品和醫療器械審批程序的意見”,其中包含了一些可能對醫藥行業有利的政策變化:
| · |
一項加快創新藥物批准的計劃,其中包括特別審查和批准程序,重點是高度未得到滿足的醫療需求領域,包括用於治療艾滋病毒、癌症、嚴重傳染病和孤兒疾病的藥物,以及列入國家優先事項清單的藥物。
|
| · |
一項計劃,將採取一項政策,允許公司作為營銷授權持有人,並僱用合同製造機構生產藥品。
|
| · |
一項改進臨牀試驗審批的計劃,允許公司在進行其他國家臨牀試驗的同時進行臨牀試驗,並鼓勵當地臨牀試驗組織參與國際多中心臨牀試驗。
|
In November 2015, the Standing Committee of the National People’s Congress issued the Decision on Authorizing the State Council to Conduct the Pilot Program of the System of the Holders of Drug Marketing Licenses in Certain Areas and the Relevant Issues, which authorized the State Council to conduct the pilot program of the system of the holders of drug marketing licenses in Beijing, Tianjin, Hebei, Shanghai, Jiangsu, Zhejiang, 福建、山東、廣東、四川等地授權國務院對藥品註冊類別進行改革。
2015年度,國家藥品監督管理局發佈了“關於藥品註冊審批若干政策的通知”,進一步闡明瞭以下政策可能簡化和加快臨牀試驗審批程序:
| · |
對於新藥的臨牀試驗申請,將採用一次性的總括審批程序,允許同時批准新藥臨牀試驗的所有階段,而不是目前的逐階段批准程序。
|
| · |
A fast track drug registration or clinical trial approval pathway will be available for the following applications: (1) registration of innovative new drugs treating HIV, cancer, serious infectious diseases and orphan diseases; (2) registration of pediatric drugs; (3) registration of geriatric drugs and drugs treating China-prevalent diseases in elders; (4) registration of drugs sponsored by national science and technology grants; (5) registration of innovative drugs using advanced technology, using innovative 治療方法,或具有獨特的臨牀效益;(6)在中國本土生產的外國創新藥物註冊;(7)同時申請在美國或歐洲聯盟批准的新藥臨牀試驗,或同時申請在美國或歐洲聯盟申請市場授權並通過現場檢驗並在中國使用同一生產線生產的藥物進行藥物註冊;(八)臨牀急用藥品三年內臨牀試驗申請和專利期滿,臨牀急症藥品營銷授權申請一年內專利期滿。
|
20
目錄
2016年度,國家藥品監督管理局發佈了“關於優先審批解決藥品登記申請積壓問題的意見”,進一步闡明瞭可能加快某些臨牀試驗或藥物註冊審批程序的政策,這些政策可能對我們有益:
| · |
A fast track drug registration or clinical trial approval pathway will be available for the following drug registration applications with distinctive clinical benefits: (1) registration of innovative drugs not sold within or outside China; (2) registration of innovative drug transferred to be manufactured in China; (3) registration of drugs using advanced technology, using innovative treatment methods, or having distinctive treatment advantages; (4) clinical trial applications for drugs patent expiry within (5)美國或歐洲聯盟已批准的新藥臨牀試驗同時申請,或已在美國或歐洲聯盟申請市場授權並通過現場檢驗並在中國生產的藥物同時申請藥品註冊;(6)中藥(包括中藥)(七)國家重點技術項目或者國家重點發展項目資助的新藥登記。
|
| · |
一條快速的藥品註冊審批途徑將提供給藥物註冊申請,在以下疾病的預防和治療方面具有獨特的臨牀效益:艾滋病毒、肺結核、病毒性肝炎、孤兒疾病、癌症、兒童疾病和老年病。
|
2016年3月,中國藥監局發佈了“化學藥物註冊類別改革計劃”通知,其中概述了化學藥物應用的重新分類。根據新的分類,尚未在中國或境外獲得批准並將在中國生產的創新藥物仍屬於第一類,而在中國境外尋求銷售批准的藥物現在屬於第5類。
2016,國務院辦公廳發佈了“藥品營銷授權持有人制度試點項目通知”,標誌着藥品營銷授權持有人制度終於投入實施。第41號通知允許北京、天津、河北、上海、江蘇、浙江、福建、山東、廣東、四川等地的藥品研發機構和研究專業人員擔任藥品註冊申請人,並提交藥品臨牀試驗和藥品營銷申請。在第41號通知生效後新註冊的藥品,申請人在提交藥品臨牀試驗或藥品銷售申請的同時,也可以提交成為藥品營銷授權人的申請。2016年度,國家藥品監督管理局發佈了“藥品營銷授權持有人制度試點工作通知”,對41號通知規定的申請程序作了進一步的説明。2017年度,國家藥品監督管理局發佈了“藥品營銷授權持有人制度試點項目推廣事項通知”。本通知除其他外,旨在推動實施藥品銷售授權持有人制度試點計劃,明確這些持有者的權利和義務,加強藥品生產過程的質量控制制度,完善藥品製造和銷售供應鏈的責任制。
21
目錄
CFDA可能會發布關於快速臨牀試驗批准和藥物註冊途徑的詳細政策,我們預計CFDA的審查和批准過程將隨着時間的推移而改善。然而,如何以及何時改變這一批准程序仍有待於CFDA頒佈的進一步政策,目前尚不確定。
在美國和中國內外,開發、獲得監管機構批准並將產品候選產品商業化的過程是漫長、複雜和昂貴的,而且可能不會獲得批准。即使我們的產品候選人成功地獲得了監管部門的批准,任何批准都可能會大大限制批准使用的適應症,或者要求在產品標籤上包括預防措施、禁忌症或警告,或者要求昂貴和耗時的批准後臨牀研究或監督作為批准條件。在批准對我們的產品候選產品進行商業銷售後,藥品的某些變化,如製造工藝的改變和額外的標籤聲明,可能會受到FDA、CFDA和EMA以及類似監管機構的額外審查和批准。此外,我們的任何產品候選產品的監管審批可能會被撤銷。如果我們無法為我們在一個或多個管轄區的產品候選人獲得監管批准,或者任何批准都有很大的侷限性,我們的目標市場將被削弱,我們實現產品候選者充分市場潛力的能力將受到損害。此外,我們可能無法取得足夠的資金或產生足夠的收入和現金流量,以繼續發展我們的產品候選人或任何未來的產品候選人,我們可能開發。
即使我們的任何產品候選人獲得監管批准,他們可能無法達到市場接受程度的醫生,病人,第三方支付人和其他在醫學界的商業成功所必需的程度。
如果我們的任何產品候選人或任何未來的產品候選人,我們開發得到監管批准,但它可能無法獲得足夠的市場接受的醫生,病人,第三方支付人和其他在醫學界。例如,目前的癌症治療,如化療和放射治療,以及目前的中性粒細胞減少療法,在醫學界得到了很好的認可,醫生們可能會繼續依賴這些療法,而排除我們的產品候選人。此外,醫生、病人和第三方付款人可能更喜歡其他新產品而不是我們的產品。如果我們的產品候選人沒有達到足夠的接受水平,我們可能不會產生大量的產品銷售收入,我們可能無法盈利。我們的產品候選產品在市場上的接受程度,如果獲準商業銷售,將取決於多個因素,包括:
| · |
我們產品候選的臨牀適應症;
|
| · |
醫生,醫院,癌症治療中心和病人認為我們的產品候選作為一個安全和有效的治療;
|
| · |
我們的產品候選產品相對於替代療法的潛在優勢和感知優勢;
|
| · |
任何副作用的發生率和嚴重程度;
|
| · |
FDA、CFDA、EMA或其他類似監管機構的產品標識或產品插入要求;
|
| · |
FDA、CFDA、EMA或其他類似監管機構批准的標籤中包含的限制或警告;
|
| · |
市場推出的時機,我們的產品候選人以及競爭的藥物;
|
| · |
與替代治療有關的治療費用及其相對效益;
|
| · |
醫生管理我們的產品候選人所需的前期費用或培訓的金額;
|
22
目錄
| · |
第三方支付人和政府當局是否有足夠的保險、償還和定價;
|
| · |
在沒有第三方支付人和政府當局的保險和補償的情況下,病人願意自費支付;
|
| · |
相對方便和易於使用,包括與替代療法和競爭性療法相比;以及
|
| · |
我們的銷售和營銷工作的有效性。
|
如果我們的產品候選人獲得批准,但未能獲得醫生、病人、醫院、癌症治療中心或醫學界其他人的市場接受,我們將無法產生可觀的收入。即使我們的藥物獲得市場接受,如果引進比我們的藥物更受歡迎的新產品或新技術、成本效益更高或使我們的藥物過時,我們可能無法維持市場的接受。
我們目前沒有營銷和銷售機構,也沒有銷售藥品的經驗。如果我們無法建立市場營銷和銷售能力,或與第三方簽訂協議,以銷售和銷售我們的產品,我們可能無法創造產品銷售收入。
我們目前沒有銷售,營銷或商業產品分銷能力,也沒有銷售藥品的經驗。在中國,如果批准出售,我們打算建立自己的銷售隊伍,通過我們的中國子公司,將Plinbulin用於治療CIN和NSCLC的商業化,大連萬川布林製藥有限公司萬春·布林。普林布林been granted status as a 2017 National Science and Technology Major Project in China, or the 2017 Innovation Award. As a result of the 2017 Innovation Award, Plinabulin is included in the National Drug Priority List in China and, pending drug approval and successful pricing negotiations with the Chinese government, Plinabulin has the potential to be included in the National Insurance System, which would allow for faster access to 病人和報銷。然而,即使普林布林獲準在中國銷售,我們也可能無法成功地過渡到完全商業化。我們沒有談判定價安排的經驗,可能無法就定價達成協議。此外,建立我們自己的銷售隊伍來營銷Plinabin將需要大量的資本支出,管理資源和時間。我們將不得不與其他製藥和生物技術公司競爭,招聘、僱用、培訓和留住營銷和銷售人員。
在美國、歐洲和中國以外的其他主要市場,我們希望與一家或多家全球製藥公司合作,在CIN和先進的NSCLC中銷售Plinbulin,如果批准銷售的話。然而,我們可能無法建立或維持這種合作安排,即使我們能夠這樣做,全球製藥公司也可能沒有有效的營銷能力。我們所獲得的任何收入都將取決於這些第三方的努力,而這些努力可能並不成功。此外,根據我們與全球製藥公司達成的安排的性質,我們可能很少或根本無法控制它們的營銷和銷售努力,而且我們的產品銷售收入可能低於我們自己將產品候選人商業化的收入。我們也面臨着競爭,在我們尋找第三方協助我們的銷售和市場努力,我們的產品候選人。
我們可能無法開發內部銷售和商業分銷能力,或建立或保持與第三方全球製藥公司的關係,以成功地將任何產品商業化,因此,我們可能無法創造產品銷售收入。
23
目錄
我們面臨着巨大的競爭,這可能導致其他人發現、開發或使競爭的藥物比我們更成功地商業化。
新藥的開發和商品化具有很強的競爭力。我們目前的產品候選人面臨競爭,我們今後可能尋求開發或商業化的任何產品候選人也將面臨來自世界各地主要製藥公司和專業製藥和生物技術公司的競爭。一些大型製藥和生物技術公司目前正在銷售和銷售藥物,或正在開發治療癌症的藥物,我們正在為這些藥物開發產品候選產品。見“項目4”。B.企業概況---競爭。“其中一些有競爭力的藥物和療法是建立在與我們的方法相同或相似的科學方法基礎上的,而另一些則是基於完全不同的方法。潛在的競爭對手還包括學術機構、政府機構和其他進行研究、尋求專利保護和建立研究、開發、製造和商業化合作安排的公共和私營研究組織。此外,我們正在研究用分子膠技術標記泛素連接酶的癌基因蛋白並破壞這些蛋白質的另一種癌症治療方法,同時也有許多公司正在努力利用這種技術來靶向和破壞癌基因蛋白。見“項目4”。公司的信息--B.業務概況--我們的主要藥物候選人---普林布林---其他項目。“
如果我們的競爭對手開發和商業化比我們開發的任何藥物更安全、更有效、副作用更少或更少、更方便或更便宜的藥物,我們的商業機會就會減少或消失。我們的競爭對手也可能以比我們更快的速度獲得FDA、CFDA、EMA或其他類似監管機構的批准,這可能導致我們的競爭對手在我們能夠進入市場和/或減緩我們的監管審批之前建立強大的市場地位。
與我們競爭或將來可能與之競爭的許多公司,在研發、製造、動物試驗、進行臨牀試驗、獲得監管批准和銷售經批准的藥物等方面的財政資源和專門知識大大超過我們。製藥和生物技術行業的兼併和收購可能導致更多的資源集中在我們的競爭對手中。小型和其他早期公司也可能被證明是重要的競爭對手,特別是通過與大公司和老牌公司的合作安排。這些第三方在招聘和留住合格的科學和管理人員、建立臨牀試驗場所和為臨牀試驗登記病人以及獲取與我們的項目相輔相成或必要的技術方面與我們競爭。
我們的產品候選人,我們打算尋求批准,因為藥物產品可能會面臨競爭比預期的更快。
NDA批准的藥物產品,如我們的產品候選產品,如果獲得批准,可能會比預期的更早地面臨非專利藥品競爭。2012“食品和藥物管理局安全與創新法案”頒佈了2012的非專利藥品使用費修正案,制定了一項用户收費計劃,將為FDA的非專利藥品審查計劃籌集數億美元的資金。來自用户收費計劃的資金,以及FDA與仿製藥行業談判達成的績效目標,可以大大縮短FDA審查和批准非專利藥品應用的時間框架。
此外,在不同司法管轄區不時出現立法建議,以進一步鼓勵儘早和迅速批准非專利藥品。任何這樣的提案都會被制定成法律,如果其中任何一個獲得批准,都會增加對我們產品候選人的競爭。
我們必須獲得足夠的補償,我們的產品和管理它的醫生,成功地商業化我們的產品候選人或任何未來的產品候選人,我們可能開發。
如果我們獲得必要的批准,以推銷我們的產品候選人或任何未來的產品候選人,我們將仍然需要向政府和其他第三方付款者,以補償醫生和病人管理和使用我們的產品。新批准的醫療保健藥品面臨着重大的不確定性,無論是他們是否被覆蓋,以及他們的報銷水平。包括醫療保險在內的政府和其他醫療費用支付機構越來越多地試圖通過限制醫療保險和報銷水平來控制醫療成本。即使我們的產品候選人或我們可能開發的未來產品候選人得到監管機構的批准,第三方支付者也可能拒絕支付,或者提供的償還率不足以支付我們供應藥品的費用,或者無法提供我們預期獲得的藥品收入。他們還可以為那些不足以支付醫生費用的醫生制定報銷標準,或者以其他方式阻止他們開處方。此外,一旦確定了保險範圍和償還率,今後可能會改變或撤銷這些標準。政府和其他醫療保健付款人未能為我們的產品候選人或我們可能開發的任何未來產品候選人支付或提供足夠的報銷水平,可能會降低他們對市場的接受程度,限制我們的增長,並使我們的收入和運營結果受到損害。此外,在確定覆蓋範圍和補償方面的拖延將推遲我們的產品候選產品的商業化,這將對我們的增長、經營結果和財務狀況產生不利影響。
24
目錄
包括中國和歐洲許多國家在內的許多國家的價格都受到當地監管。在這些法域,與政府當局進行定價談判可能需要相當長的時間才能收到產品的營銷批准。因此,我們可能會在某一特定國家獲得藥品管制批准,但隨後會受到價格管制的限制,這些管制會推遲或阻止我們在商業上銷售該藥物,並對該藥物在該國的銷售產生任何負面影響(如果有的話)。直接和間接價格控制的存在和對我們產品候選人的壓力可能會對我們的財務前景和業績產生重大的不利影響。
最近頒佈的和未來的立法可能會增加我們獲得監管批准和商業化產品的難度和成本,並影響我們可能獲得的價格。
在中國、美國、歐盟和其他一些司法管轄區,已經對醫療體系進行了一些立法和監管方面的修改和擬議的改革,這些變化可能會阻止或推遲對產品候選人的監管審批,限制或規範審批後的活動,並影響我們出售任何獲得監管機構批准的產品候選人的能力。
In March 2010, former President Obama signed into law the Patient Protection and Affordable Care Act, and the Health Care and Education Reconciliation Act of 2010, or the Affordable Care Act, a sweeping law intended to broaden access to health insurance, reduce or constrain the growth of healthcare spending, enhance remedies against fraud and abuse, add new transparency requirements for the healthcare and health insurance industries, impose new taxes and 向保健行業收費,並實行額外的衞生政策改革。
“平價醫療法案”中對我們潛在的產品候選人具有重要意義的規定如下:
| · |
生產或進口指定品牌處方藥的單位的年度非扣減費用;
|
| · |
增加製造商必須根據醫療補助藥品回扣計劃支付的法定最低折扣;
|
| · |
擴大醫療欺詐和濫用法律,包括“虛假索賠法”和“反Kickback法規”,新的政府調查權力,並加強對不遵守規定的處罰;
|
| · |
醫療保險的D部分覆蓋差距折扣計劃,其中製造商必須同意提供50%的銷售點折扣談判價格;
|
| · |
延長製造商的醫療補助退税責任;
|
| · |
擴大醫療補助方案的資格標準;
|
| · |
擴大根據“公共衞生服務法”藥品定價方案有資格享受折扣的實體;
|
| · |
要求向醫生和教學醫院報告財務安排;
|
25
目錄
| · |
要求製造商和分銷商每年向醫生報告藥品樣品;以及
|
| · |
一個新的以病人為中心的結果研究所,監督,確定優先事項,並進行比較臨牀效果研究,以及這些研究的資金。
|
此外,自“平價醫療法案”頒佈以來,美國還提出並通過了其他立法改革。這些變化包括從2013開始,每個財政年度向醫療保險提供者支付的總金額減少2%。2013,美國前總統奧巴馬簽署了“2012美國納税人救濟法案”,其中包括減少了對幾個醫療機構的醫療保險支付,並將政府收回對醫療提供者的多付款項的時效期限從三年延長到五年。最近,兩黨通過的2018預算法案,除其他外,修正了“平價醫療法案”,從1月1日起生效,以縮小大多數醫療保險計劃的覆蓋面差距,並在2019增加了藥品製造商必須降低處方藥成本的百分比,從現行法律規定的50%提高到70%。
我們預計,“平價醫療法案”以及今後可能採取的其他醫療改革措施,可能會導致更嚴格的覆蓋標準,並對我們獲得批准的任何藥物的價格造成額外的下行壓力。醫療保險或其他政府項目的報銷額的任何減少都可能導致私人支付者的付款減少。“平價醫療法案”的一些規定尚未得到充分執行,而某些條款則受到司法和國會的挑戰。In particular, since the November 2016 U.S. election, President Trump and the U.S. Congress have made numerous efforts to repeal or amend the Affordable Care Act in whole or in part. In May 2017, the U.S. House of Representatives voted to pass the American Health Care Act, or the AHCA, which would repeal many provisions of the Affordable Care Act. The Senate considered but failed to pass the AHCA或類似的措施,但國會可能會考慮進一步立法,以廢除或取代“平價醫療法案”的內容。此外,特朗普總統在2017年月日簽署的減税和就業法案,廢除了“平價醫療法案”的個人健康保險授權,該法案被認為是“平價醫療法案”的一個關鍵組成部分。因此,“平價醫療法案”或任何取代其內容的法律對我們的業務的全面影響仍然不清楚。實施成本控制措施或其他醫療改革可能會使我們無法創造收入、獲得利潤或使我們的藥物商業化。
已提出立法和監管建議,以擴大批准後的要求,並限制藥品的銷售和推廣活動。我們不能確定是否會頒佈更多的立法修改,或者FDA的法規、指南或解釋是否會被改變,或者這些改變對我們的產品候選產品的監管批准(如果有的話)會產生什麼影響。此外,美國國會加強對FDA審批程序的審查,可能會大大推遲或阻止監管機構的批准,並使我們受到更嚴格的產品標籤和銷售後測試及其他要求的限制。在美國,公眾和政府對藥品和藥品定價策略的審查也越來越多,包括美國參議院、聯邦和州檢察官。美國國會和許多州立法機構正在考慮可能影響藥品製造商獲準對其產品收費的價格的立法,或要求提高藥品定價做法的透明度。我們不知道這些改變是否會被實施,如果會的話,它們是否會影響我們的產品候選人的價格,如果他們在美國獲得批准的話。
我們可能直接或間接地受制於適用的美國聯邦和州反回扣法、虛假索賠法、醫生支付透明度法、欺詐和濫用法律或類似的醫療和安全法律法規,這些法律和條例可能會使我們受到刑事制裁、民事處罰、合同損害、名譽損害以及利潤和未來收入的減少。
醫療保健提供者、醫生和其他人將在我們獲得監管批准的任何產品的推薦和處方中發揮主要作用。如果我們獲得FDA批准的任何產品候選人,並開始在美國商業化這些藥物,我們的業務可能受到各種聯邦和州欺詐和濫用法律,包括,但不限於,聯邦反Kickback法規,聯邦虛假索賠法,以及醫生支付陽光的法律和條例。這些法律可能會影響到我們潛在的銷售、營銷和教育項目。此外,我們可能受到聯邦政府和我們開展業務的州的病人隱私條例的約束。可能影響我們運作能力的法律包括:
26
目錄
| · |
the federal Anti-Kickback Statute, which prohibits, among other things, knowingly and willfully soliciting, receiving, offering or paying any remuneration (including any kickback, bribe, or rebate), directly or indirectly, overtly or covertly, in cash or in kind, to induce, or in return for, either the referral of an individual, or the purchase, lease, order or recommendation of any good, facility, item or service for which payment may be made, in whole 或者部分地,根據聯邦醫療保健計劃,如醫療保險和醫療補助計劃;
|
| · |
federal civil and criminal false claims laws and civil monetary penalty laws, including the False Claims Act, which may be pursued through civil whistleblower or qui tam actions, impose criminal and civil penalties against individuals or entities for knowingly presenting, or causing to be presented, to the federal government, claims for payment or approval from Medicare, Medicaid or other third-party payors that are false or fraudulent or making a false 避免、減少或隱瞞向聯邦政府付款的義務的聲明;
|
| · |
federal criminal statutes created through the Health Insurance Portability and Accountability Act of 1996, or HIPAA, which prohibit knowingly and willfully executing, or attempting to execute, a scheme to defraud any healthcare benefit program or obtain, by means of false or fraudulent pretenses, representations, or promises, any of the money or property owned by, or under the custody or control of, any healthcare benefit program, regardless of the payor (e.g., (二)明知故意偽造、隱瞞、隱瞞重大事實,或者作出與醫療保健事務有關的醫療福利、項目或者服務的重大虛假陳述的;
|
| · |
HIPAA, as amended by the Health Information Technology for Economic and Clinical Health Act of 2009 and their respective implementing regulations, which impose requirements on certain covered healthcare providers, health plans, and healthcare clearinghouses as well as their respective business associates that perform services for them that involve the use, or disclosure of, individually identifiable health information, relating to the privacy, security and transmission of individually identifiable health information;
|
| · |
the federal transparency requirements under the Affordable Care Act, including the provision commonly referred to as the Physician Payments Sunshine Act, which requires manufacturers of drugs, biologics, devices and medical supplies for which payment is available under Medicare, Medicaid or the Children’s Health Insurance Program to report annually to the U.S. Department of Health and Human Services information related to payments or other transfers of value made to 醫生和教學醫院,以及醫生及其直系親屬擁有的所有權和投資權益;
|
| · |
聯邦消費者保護和不公平競爭法,這些法律廣泛地規範市場活動和可能損害消費者的活動。
|
此外,我們可能受到上述每一項醫療保健法律的州和非美國同等法律的約束,其中一些法律的範圍可能更廣,並且可能適用於與支付人無關的情況。許多美國州通過了類似於聯邦反Kickback法規的法律,其中一些法律適用於將病人轉介到由任何來源償還的醫療保健服務,而不僅僅是政府支付者,包括私人保險公司。此外,一些州還通過了法律,要求製藥公司遵守“2003年度藥品製造商總督察方案指南”和/或“美國藥品研究和製造商與保健專業人員互動守則”。幾個州還實施其他營銷限制,或要求製藥公司向國家進行營銷或價格披露。對於遵守這些國家要求的規定存在模糊性,如果我們不遵守適用的州法律要求,我們可能會受到懲罰。
27
目錄
由於這些法例的範圍廣泛,而法定的例外情況和安全港範圍狹窄,我們日後的一些商業活動可能會受到一項或多項這類法例的質疑。此外,最近的保健改革立法加強了這些法律。例如,“平價醫療法案”,除其他外,修正了聯邦反Kickback法規和刑事醫療欺詐法規的意圖要求。由於這種修正,個人或實體不再需要實際瞭解這些法規或違反這些法規的具體意圖才能實施違法行為。此外,“平價醫療費用法”規定,包括因違反聯邦反Kickback法規而產生的物品或服務在內的索賠,就“虛假索賠法”而言,構成虛假或欺詐性索賠。
違反欺詐和濫用法律的行為可受到刑事和(或)民事制裁,包括處罰、罰款和(或)將其排除在聯邦和州醫療保健計劃(如醫療保險和醫療補助)之外,以及禁止與美國政府簽訂合同。此外,個人有能力根據“虛假索賠法”和幾個州的虛假索賠法代表美國政府提起訴訟。
努力確保我們與第三方的業務安排將符合適用的醫療保健法律和條例將涉及大量費用。政府當局可能會得出結論,我們的商業慣例不符合現行或今後涉及適用的欺詐和濫用的法規、條例或判例法或其他醫療保健法律和條例。If any such actions are instituted against us, and we are not successful in defending ourselves or asserting our rights, those actions could have a significant impact on our business, including the imposition of civil, criminal and administrative penalties, damages, disgorgement, monetary fines, possible exclusion from participation in Medicare, Medicaid and other federal healthcare programs, contractual damages, reputational harm, diminished profits and future earnings, and curtailment of our operations, any 其中可能會對我們經營業務的能力和業務結果產生不利影響。此外,我們在美國以外的任何產品候選人的批准和商業化,也可能使我們受到上述醫療保健法以及其他非美國法律的非美國法律的約束。
如果我們希望與之做生意的任何醫生或其他提供者或實體被發現不遵守適用的法律,他們可能會受到刑事、民事或行政制裁,包括被排除在政府資助的醫療保健項目之外。這可能會對我們經營業務的能力和業務結果產生不利影響。
與我們的知識產權有關的風險
我們知識產權組合中的一部分目前包括尚未作為已授予專利頒發的待決專利申請,如果我們的待決專利申請未能發放,我們的業務將受到不利影響。如果我們不能為我們的技術和藥品取得和保持專利保護,我們的競爭對手就可以開發和使技術和藥品類似或相同的技術和藥品商業化,我們成功地使我們的技術和藥品商業化的能力可能會受到不利的影響。
我們的成功在很大程度上取決於我們在美國、中國和其他國家獲得和保持專利保護的能力。截至2018年月28日,我們擁有13項美國專利,涉及普林布林和普林布林類似物,它們的合成及其在治療包括肺癌在內的各種疾病中的應用。此外,我們還在日本、韓國、中國、歐洲等33個外國司法管轄區獲得了相應的專利。美國的專利計劃在2021到2025年間到期,不包括任何專利期限的恢復。我們有五個正在申請的專利申請,用於減少中性粒細胞減少,使用普林布林治療RAS突變腫瘤和腦腫瘤,多態形式的Plinbulin,以及聯合使用Plinbulin和檢查點抑制劑。如果這些申請獲得批准,名義上它們將在2033至2036年間到期。我們有三個專利合作條約,或PCT,專利申請,旨在減少CIN,治療使用微管蛋白結合化合物,和劑量方案。如果申請聲稱這些PCT申請的優先權被髮出,它們名義上將在2037或2038到期。
28
目錄
關於某些法域(例如美國和歐洲)已頒發的專利,我們可能有權獲得一項專利展期,以延長專利有效期,但條件是我們符合申請延長專利期限的適用要求。我們通過在美國提交專利申請,以及通過與我們認為對我們的業務重要的新技術和產品候選產品相關的PCT,來保護我們的專利地位。這一過程很費時,我們可能無法及時提交和起訴所有必要或理想的專利申請。我們也有可能在獲得專利保護為時已晚之前,無法確定我們的研究和開發成果的可專利方面。
我們正在等待的專利申請可能不會導致在美國或非美國管轄範圍內,此類申請尚未得到批准。即使這些申請中的任何一項都有專利問題,第三方也可能對其有效性提出質疑。此外,我們可能無法在這些專利中獲得足夠的索賠範圍,以阻止第三方成功地與我們的產品候選人競爭。即使我們的專利申請是以專利的形式發出,也未必能為我們提供有意義的保障,防止競爭對手與我們競爭,或為我們提供任何競爭優勢。我們的競爭對手可以通過開發類似的或替代的技術或產品候選產品,以非侵權的方式規避我們的專利。對於專利的範圍、有效性或可執行性,專利的頒發並不是決定性的,我們的專利可能會在美國和國外的法院或專利局受到質疑。這種挑戰可能導致專利要求被縮小、失效或無法執行,這可能限制我們阻止或阻止我們阻止其他人使用或商業化類似或相同的技術和產品候選產品的能力,或限制我們的技術和產品候選者的專利保護期限。考慮到開發、測試和監管審查新產品候選人所需的時間,保護這些候選產品的專利可能在這些候選產品商業化之前或之後不久到期。因此,我們的專利組合可能不會為我們提供足夠的權利來排除其他人將類似或相同的產品候選產品商業化。
我們可能無法在全世界保護我們的知識產權。
Filing, prosecuting, maintaining and defending patents on product candidates in all countries throughout the world could be prohibitively expensive for us, and our intellectual property rights in some non-U.S. countries can have a different scope and strength than do those in the U.S. In addition, the laws of certain non-U.S. countries do not protect intellectual property rights to the same extent as U.S. federal and state laws do.因此,我們可能無法阻止第三方在美國以外的所有國家實施我們的發明,或在美國或非美國管轄區銷售或進口使用我們的發明製造的藥物。Competitors may use our technologies in jurisdictions where we have not obtained patent protection to develop their own drugs and further, may export otherwise infringing drugs to non-U.S. jurisdictions where we have patent protection, but where enforcement rights are not as strong as those in the U.S. These drugs may compete with our product candidates and our patent rights or other intellectual property rights may not be effective or adequate to prevent them from competing.
在某些法域,許多公司在保護和維護知識產權方面遇到了重大問題。一些國家的法律制度不贊成專利、商業祕密和其他知識產權的強制執行,這可能使我們難以制止侵犯或盜用我們的專利或其他知識產權的行為,也難以制止侵犯我們的所有權的競爭藥品的銷售。在非美國司法管轄區執行我們的專利和其他知識產權的程序可能會導致大量費用,並使我們的努力和注意力轉移到我們業務的其他方面。
此外,這種程序可能使我們的專利有失效的風險,無法執行,或狹義地解釋,可能使我們的專利申請處於不發放的風險之中,並可能促使第三方對我們提出侵權或挪用的主張。我們可能不會在任何訴訟中獲勝,我們所判給的損害賠償或其他補救辦法,如果有的話,可能沒有商業意義。因此,我們在世界各地實施知識產權的努力可能不足以從我們開發的知識產權中獲得重大的商業優勢。
29
目錄
我們可能會捲入保護或強制執行我們的知識產權的訴訟,這可能是昂貴、費時和不成功的。如果在法庭或美國專利和商標局,或美國專利和商標局,或類似的非美國當局提出質疑,我們與產品候選者有關的專利權可能被認定無效或不可強制執行。
競爭對手可能侵犯我們的專利權,或濫用或以其他方式侵犯我們的知識產權。為了對抗侵權或未經授權的使用,將來可能需要進行訴訟,以強制執行或保護我們的知識產權,保護我們的商業祕密,或確定我們自己的知識產權或他人的所有權的有效性和範圍。這既昂貴又費時。我們對被認為侵權者提出的任何索賠也可能促使這些當事方對我們提出反訴,聲稱我們侵犯了他們的知識產權。我們目前和潛在的許多競爭對手都有能力投入比我們更多的資源來執行和/或保護他們的知識產權。因此,儘管我們作出了努力,但我們可能無法防止第三方侵犯或盜用我們的知識產權。訴訟可能導致大量的成本和管理資源的轉移,這可能損害我們的業務和財務結果。此外,在侵權訴訟中,法院可裁定我們擁有的專利權或其他知識產權無效或不可強制執行,或以我們的專利權或其他知識產權不包括有關技術為由,拒絕阻止另一方使用所涉技術。任何訴訟程序的不利結果都可能使我們的專利以及將來可能從我們待決的專利申請中頒發的任何專利面臨無效、不可執行或狹義解釋的風險。此外,由於知識產權訴訟需要大量的披露,我們的一些機密信息可能會在這類訴訟中被披露而受到損害。
如果我們對第三方提起法律訴訟,以強制執行我們的專利,或將來可能從我們的專利申請中頒發的任何專利,而這些專利涉及我們的產品候選人之一,被告可以反訴這些專利權是無效的或不可執行的。在美國的專利訴訟中,被告聲稱無效或不可執行的反訴屢見不鮮,第三方可以根據許多理由主張專利無效或不可強制執行。第三方也可以向美國或國外的行政機構提出類似的索賠,甚至在訴訟範圍之外也是如此。這種機制包括單方面複審、黨派間審查、贈款後審查、派生和類似於非美國司法管轄區的訴訟,如反對派訴訟。這樣的程序可能會導致我們的專利被撤銷或修改,以至於它們不再涵蓋和保護我們的產品候選產品。例如,關於我們專利的有效性,我們、專利顧問和專利審查員在起訴期間可能不知道現有的技術是否無效。如果被告以無效和(或)不可強制執行的法律主張為依據,我們將至少失去對我們產品候選人的部分或全部專利保護。這種專利保護的喪失可能對我們的業務產生重大的不利影響。
我們可能無法防止我們的商業祕密或機密資料被盜用,特別是在那些法律可能沒有在美國充分保護這些權利的國家。此外,由於知識產權訴訟所需的大量披露,我們的一些機密資料在這類訴訟中可能會因披露而受到損害。
我們可能會受到對我們的專利和其他知識產權的發明權的質疑。
雖然我們目前沒有遇到任何對我們的專利的發明權或我們的知識產權的所有權提出質疑的要求,但我們將來可能會被指控前僱員、合作者或其他第三方作為發明人或共同發明者對我們的專利或其他知識產權有利害關係。例如,我們可能會因顧問或參與開發產品候選人的其他人的義務而產生發明權糾紛。訴訟可能是必要的,以捍衞這些和其他索賠挑戰發明權。如果我們不能為任何這類索賠辯護,除了支付金錢損害外,我們還可能失去諸如我們的專利權或其他知識產權的專屬所有權或使用權等權利。這樣的結果可能對我們的業務產生重大的不利影響。即使我們成功地為這類索賠辯護,訴訟也可能導致大量費用,並分散管理層和其他僱員的注意力。
30
目錄
如果我們因侵犯第三方的知識產權而被起訴,這種訴訟可能代價高昂,耗費時間,並可能阻止或拖延我們開發或商業化我們的產品候選產品。
我們的商業成功在一定程度上取決於我們避免侵犯第三方的專利和其他知識產權。在生物技術和製藥工業中,涉及專利和其他知識產權的訴訟數量很大。在我們開發產品候選產品的領域中,存在着許多第三方擁有的已頒發專利和待決專利申請。隨着生物技術和製藥業的發展和專利的增加,我們的產品候選產品可能引起侵犯他人專利權的風險增加。
第三方可以聲稱我們未經授權就使用了他們的專有技術。可能有第三方專利,我們目前不知道的材料,配方,製造方法或處理方法與我們的產品的使用或製造候選。由於專利申請可能需要數年才能發出,所以現時可能會有一些待決的專利申請,日後可能會導致我們的產品申請人可能會侵犯已批出的專利。此外,第三方可能在未來獲得專利,並聲稱使用我們的技術侵犯了這些專利。If any third-party patents were held by a court of competent jurisdiction to cover the manufacturing process of any of our product candidates, any molecules formed during the manufacturing process or any final drug itself, the holders of any such patents may be able to prevent us from commercializing such product candidate unless we obtain a license under the applicable patents, or until such patents expire or they are finally determined to be held invalid or unenforceable.Similarly, if any third-party patent were held by a court of competent jurisdiction to cover aspects of our formulations, processes for manufacture or methods of use, including combination therapy or patient selection methods, the holders of any such patent may be able to block our ability to develop and commercialize the applicable product candidate unless we obtain a license, limit our uses, or until such patent expires or is finally determined to be held invalid or unenforceable.在任何一種情況下,這種許可證都不可能以商業上合理的條件獲得,也可能根本得不到。
對我們的知識產權侵犯提出成功索賠的第三方可能獲得禁令或其他公平的救濟,這可能使我們無法開發和商業化我們的一個或多個產品候選產品。對這些索賠的辯護,不論其優點如何,都將涉及大量的訴訟費用,並將使僱員的資源大量從我們的業務中轉移出去。如果成功地向我們提出侵權或挪用索賠,我們可能需要支付大量的損害賠償,包括三倍的損害賠償和任意侵權的律師費,從第三方獲得一個或多個許可證,支付特許權使用費或重新設計侵權產品的候選產品,這可能是不可能的,也可能需要大量的時間和金錢支出。如果在任何此類訴訟中產生不利結果,甚至在沒有訴訟的情況下,我們可能需要從第三方獲得許可,以推進我們的研究或允許我們的產品候選產品商業化。任何所需的許可證可能根本無法獲得,也可能無法以商業上合理的條件獲得。如果我們不能獲得這樣的許可,我們將無法進一步開發和商業化我們的一個或多個產品候選人,這可能會嚴重損害我們的業務。我們還可以選擇簽訂許可協議,以解決專利侵權索賠或在訴訟前解決糾紛,任何此類許可協議都可能要求我們支付可能嚴重損害我們業務的特許權使用費和其他費用。
即使是對我們有利的解決,與知識產權索賠有關的訴訟或其他法律程序也可能導致我們承擔大量費用,並可能分散我們的技術人員、管理人員或兩者的正常責任。此外,可以公開宣佈聆訊、動議或其他臨時程序或事態發展的結果,如果證券分析師或投資者認為這些結果是負面的,可能會對本港普通股的市價造成重大不良影響。這類訴訟或訴訟可大大增加我們的經營損失,並減少可用於發展活動或未來任何銷售、營銷或分銷活動的資源。我們可能沒有足夠的財政或其他資源,足以進行有關的訴訟或訴訟。我們的一些競爭對手,由於他們擁有更多的財政資源,可能比我們更有效地承擔這些訴訟或訴訟的費用。專利訴訟或其他訴訟程序的啟動和繼續產生的不確定性可能對我們在市場上的競爭能力產生重大不利影響。
31
目錄
獲得和維持我們的專利保護取決於遵守各種程序、文件提交、費用支付和政府專利機構規定的其他要求,我們的專利保護可以因不遵守這些要求而減少或消除。
任何已頒發專利的定期維護費用應在專利有效期內分幾個階段支付給USPTO和其他專利機構。美國專利貿易組織和各種非美國政府專利機構要求在專利申請過程中遵守若干程序、文件、費用支付和其他類似規定。雖然在許多情況下,過失可以通過支付滯納金或根據適用規則以其他方式加以糾正,但在某些情況下,不遵守規定可能導致放棄或失效專利或專利申請,導致有關法域的專利權部分或全部喪失。可能導致專利或專利申請被放棄或失效的不符合規定的事件包括未能在規定的時限內對官方行動作出反應、不支付費用、以及沒有適當地使正式文件合法化和提交正式文件。在任何這樣的情況下,我們的競爭對手可能進入市場,這將對我們的業務產生重大的不利影響。
我們的專利條款可能不足以有效地保護我們的產品候選人和業務。
在我們提出申請的大多數國家,包括美國,一項已頒發的專利的期限通常是從適用國家的非臨時專利申請的最早提出申請之日起20年。雖然可以獲得各種擴展,但專利的壽命及其提供的保護是有限的。即使我們產品的候選產品獲得了專利,一旦藥品的專利有效期已經過期,我們也可能向其他公司和非專利藥品開放競爭。美國授予的針對物質組成、合成和使用的專利計劃在2021至2025年間到期,不包括任何潛在的專利期限恢復。在我們已簽發的專利或可能從我們的待決專利申請中頒發的專利到期後,我們將無法對潛在的競爭對手主張這些專利權,我們的業務和經營結果可能會受到不利影響。
如果我們在其他國家的“哈奇-瓦克斯曼修正案”和類似的法律下得不到額外的保護,如果我們的專利條件得到延長,我們的產品候選產品可能會受到物質上的損害。
根據美國食品和藥物管理局批准我們產品的時間、期限和具體情況,我們的一項或多項美國專利如果獲得頒發,可能有資格根據1984“藥品價格競爭和專利期限恢復法案”(簡稱Hatch-Waxman修正案)獲得有限的專利期限恢復。Hatch-Waxman修正案允許將專利期限延長五年,作為對藥物開發和FDA監管審查過程中失去的專利期限的補償。然而,專利期限的延長不能將專利的剩餘期限從FDA批准藥物之日起總共延長14年,而且對某一特定藥物只能延長一項專利。
延長專利期限的申請須經USPTO與FDA聯合批准。例如,我們不可能因為未能在適用的截止日期內申請,或在有關專利到期前未提出申請,或未能滿足適用的要求而獲準延期。此外,專利保護的適用期限或範圍可能小於我們的要求。如果我們不能為某一項專利獲得專利展期,或任何一項延長的期限少於我們的要求,我們將縮短我們的藥品獨家銷售的期限,我們的競爭對手可能會提前獲得競爭藥品的批准,我們的創收能力可能會受到重大影響。
32
目錄
專利法的改變可能會削弱專利的價值,從而損害我們保護產品候選產品的能力。
我們的成功在很大程度上取決於知識產權,特別是專利權。獲取和執行專利涉及到技術和法律的複雜性,因此成本高昂、耗時且固有的不確定性。此外,美國最近頒佈並正在實施廣泛的專利改革立法.美國最高法院最近的裁決縮小了某些情況下的專利保護範圍,削弱了專利所有者在某些情況下的權利。除了我們今後獲得專利的能力日益增加的不確定性之外,這兩項事件還對一旦獲得的專利的價值(如果有的話)造成不確定性。根據美國國會、聯邦法院和USPTO的決定,有關專利的法律和法規可能會以不可預測的方式發生變化,從而削弱我們獲得新專利或執行我們未來可能獲得的現有專利和專利的能力。例如,在最近的一個案例中,分子病理學協會訴Myriad Genetics,Inc.,美國最高法院認為,對天然物質的某些索賠是不可專利的.雖然我們不認為我們目前簽發的專利是針對我們的產品候選人,以及任何可能從我們的待決專利申請中頒發的專利,如果這些專利申請是以目前懸而未決的形式發佈的,那麼根據這一決定,我們將發現這些專利是無效的,但法院、美國國會或USPTO的未來決定可能會影響我們專利權的價值。外國法域的法律也可能有類似的變化,可能會影響我們的專利權或其他知識產權的價值。
如果我們不能保護我們的商業機密的機密,我們的業務和競爭地位將受到損害。我們可能會被指僱員錯誤地使用或披露其前僱主的商業機密。
除了我們已頒發的專利和待決的專利申請外,我們還依靠商業機密,包括未獲專利的技術、技術和其他專利信息來維持我們的競爭地位,保護我們的產品候選人。我們尋求保護這些商業祕密,在一定程度上,通過與能夠接觸到這些祕密的各方,如我們的僱員、公司合作者、外部科學合作者、受資助的研究人員、合同製造商、顧問、顧問和其他第三方簽訂保密和保密協議。我們還與我們的員工和顧問簽訂了保密、發明或專利轉讓協議。然而,任何一方都可能違反這些協議,並披露我們的專有信息,我們可能無法就此類違約行為獲得充分的補救。對非法披露或盜用商業祕密的一方實施指控可能是困難的、昂貴的和耗時的,其結果是不可預測的。如果我們的任何商業機密是由競爭對手合法獲取或獨立開發的,我們無權阻止他們使用該技術或信息與我們競爭,我們的競爭地位將受到損害。
雖然我們試圖確保我們的僱員在其工作中不使用其他人的專有信息或訣竅,但我們可能會受到指控,稱我們或這些僱員使用或披露了任何這類僱員的前僱主的知識產權,包括商業祕密或其他專有信息。我們不知道有任何與這些事項或與我們的高級管理人員達成的協議有關的威脅或未決的索賠,但在今後可能有必要對這些索賠進行辯護。如果我們不能為任何這類索賠辯護,除了支付金錢損害外,我們還可能失去寶貴的知識產權或人員。即使我們成功地為這類索賠辯護,訴訟也可能導致大量費用,並分散管理層的注意力。
此外,雖然我們通常要求可能參與開發知識產權的僱員、顧問和承包商執行將這些知識產權轉讓給我們的協議,但我們可能無法執行與事實上開發我們自己的知識產權的每一方之間的協議,這可能導致我們或對我們提出與這些知識產權的所有權有關的要求。如果我們不能起訴或辯護任何這類索賠,除了支付金錢損害外,我們還可能失去寶貴的知識產權。即使我們成功地起訴或辯護這些索賠,訴訟也可能導致大量費用,並使我們的管理人員和科學人員分心。
通過收購和許可,我們可能無法成功地獲得或維護我們的發展管道所必需的權利。
由於我們的項目隨後可能包括需要使用第三方擁有的專有權利的其他產品候選產品,我們業務的增長可能在一定程度上取決於我們獲得和維護許可證的能力或使用這些專有權利的其他權利。我們可能無法從第三方獲得或許可我們識別的任何成分、使用方法或其他第三方知識產權。對第三方知識產權的許可和收購是一個競爭性領域,更多的成熟公司可能會採取戰略來許可或獲得我們認為具有吸引力的第三方知識產權。這些已建立的公司可能比我們有競爭優勢,因為他們的規模,現金資源和更大的臨牀開發和商業化能力。
33
目錄
此外,認為我們是競爭對手的公司可能不願意轉讓或許可我們的權利。我們也可能無法許可或獲得第三方知識產權的條款,使我們能夠作出適當的回報,我們的投資。如果我們無法成功地獲得所需的第三方知識產權,我們的業務、財務狀況和增長前景可能會受到影響。
與我們對第三方的信賴有關的風險
我們依靠第三方來進行動物研究和臨牀試驗。如果這些第三方不能成功地履行他們的合同義務或在預期的最後期限前完成,我們可能無法獲得我們的產品候選產品的監管批准或商業化,我們的業務可能會受到很大的損害。
我們一直依賴並計劃繼續依賴第三方CRO來監測和管理我們正在進行的臨牀前研究和臨牀項目的數據。我們依靠這些方面來執行我們在動物和臨牀試驗中的研究,並且只控制它們活動的某些方面。然而,我們有責任確保我們的每項研究都按照適用的議定書、法律和規章要求以及科學標準進行,而我們對CRO的依賴並不免除我們的監管責任。我們和第三方,例如我們的CRO,都要遵守許多環境、健康和安全的法律和條例,包括關於實驗室程序以及危險材料和廢物的處理、使用、儲存、處理和處置的法律和條例。如果我們使用危險材料造成污染或傷害,我們將對由此造成的任何損害承擔責任,任何責任都可能超出我們的資源。我們還可能受到民事或刑事罰款和處罰,以及相關的重大費用。
我們、我們的臨牀研究人員和我們的CRO必須遵守GCPs,這是FDA、CFDA、EMA和其他類似的監管機構在臨牀開發中對我們所有藥物實施的條例和指南。監管當局通過定期檢查審判發起人、主要調查人員和審判地點來執行這些全球合作伙伴制度。如果我們、我們的臨牀研究人員或我們的任何CRO未能遵守適用的GCPs,在我們的臨牀試驗中生成的臨牀數據可能被認為是不可靠的,FDA、CFDA、EMA或類似的監管機構可能要求我們在批准我們的營銷申請之前進行更多的臨牀試驗。經某一監管機構檢查後,該監管機構可確定我們的一項或多項臨牀試驗不符合GCP規定。此外,我們的臨牀試驗必須對根據cGMP規定生產的藥物進行。如果我們不遵守這些規定,我們可能需要重複臨牀試驗,這將推遲監管審批過程。
我們的CRO有權在某些情況下終止與我們的協議。如果我們與這些第三方CRO的任何關係終止,我們可能無法與替代CRO達成協議,或以商業上合理的條件這樣做。此外,我們的CRO不是我們的僱員,如果他們沒有將足夠的時間和資源用於我們正在進行的臨牀和臨牀前研究,我們僅限於根據我們與這些CRO的協議向我們提供的補救辦法。如果CRO或臨牀調查員未能成功地履行合同職責或義務,或未達到預期的最後期限,如果他們需要被替換,或者他們所獲得的臨牀數據的質量或準確性因未能遵守我們的臨牀協議、法規要求或其他原因而受到損害,我們的臨牀試驗可能會被延長、延遲或終止,我們可能無法。獲得監管機構的批准或成功地將我們的產品候選產品商業化。因此,我們的運營結果和產品候選產品的商業前景將受到損害,我們的成本可能會增加,我們產生收入的能力可能會被推遲。
轉換或添加額外的CRO需要額外的成本,並且需要管理時間和精力。此外,有一個自然過渡時期,一個新的CRO開始工作。因此,延遲會發生,這會極大地影響我們的能力,以滿足我們期望的臨牀發展時間表。雖然我們仔細管理我們與CRO的關係,但我們將來可能會遇到類似的挑戰或延誤,這些延誤或挑戰可能會對我們的業務、財務狀況和前景產生重大的不利影響。
34
目錄
我們期望依賴第三方來製造我們的產品候選產品,並且我們打算依賴第三方來進行我們的產品候選產品的生產過程,如果獲得批准的話。如果這些第三方不能提供足夠數量的產品,或者不能以可接受的質量水平或價格提供產品,我們的業務就會受到損害。
藥物產品的製造是複雜的,需要大量的專門知識和資本投資,包括開發先進的製造技術和過程控制。我們打算依靠外部供應商來製造供應品和處理我們的產品候選產品。我們還沒有使我們的產品候選人在商業規模上被製造或加工,並且可能無法為我們的任何產品候選人這樣做。
我們對第三方製造商的預期依賴使我們面臨以下風險:
| · |
我們可能無法在可接受的條件下識別製造商,因為潛在製造商的數量有限,FDA、CFDA、EMA或其他類似的監管機構必須對任何製造商進行評估。這一評估需要由FDA、CFDA、EMA或其他類似的監管機構進行新的測試和cGMP合規檢查。此外,一個新的製造商必須接受教育,或為生產我們的藥品開發相當的工藝;
|
| · |
我們的製造商可能很少或根本沒有生產我們的產品候選產品的經驗,因此可能需要我們大量的支持來實施和維護生產我們的產品候選產品所需的基礎設施和程序;
|
| · |
我們的第三方製造商可能無法及時生產我們的產品候選產品或生產所需的數量和質量,以滿足我們的臨牀和商業需要,如果有的話;
|
| · |
我們的合同製造商可能無法適當地執行我們的製造程序和其他後勤支持要求;
|
| · |
我們的合同製造商可能不履行協議,可能沒有為我們的產品候選人投入足夠的資源,或者在提供臨牀試驗或成功生產、儲存和銷售我們的藥物所需的時間內不能繼續從事合同製造業務;
|
| · |
任何潛在的第三方製造商可能無法以及時或符合成本效益的方式通過聯邦、州或國際監管機構的檢查;
|
| · |
製造商須接受美國食品和藥物管理局及美國相關州機構和其他監管機構的定期檢查,以確保嚴格遵守cgmp和其他政府法規以及相應的非美國要求,而我們的第三方製造商可能不遵守這些規定和要求;
|
| · |
我們可能不擁有,或可能必須分享知識產權的任何改進,由我們的第三方製造商在生產過程中,我們的產品候選;
|
| · |
我們的第三方製造商可能違反或終止他們與我們的協議;
|
| · |
我們的合同製造商和關鍵試劑供應商可能受到惡劣的天氣,以及自然或人為災害;
|
| · |
我們的合約製造商可能有不可接受或不一致的產品質量成功率和產量;以及
|
35
目錄
| · |
我們可能無法獲得在製造過程中使用的適合或可接受使用的原材料和部件,特別是在我們沒有其他原材料或部件的來源或供應商的情況下。
|
這些風險中的每一個都可能推遲或阻止我們完成臨牀試驗,或阻止FDA、CFDA、EMA或其他類似監管機構批准我們的任何產品候選產品,從而導致更高的成本或對我們產品候選產品的商業化產生不利影響。
除了依賴第三方製造商和供應商來生產我們的產品候選產品外,我們還將依賴第三方在交付給病人之前對我們的產品候選人進行特定的規格測試。如果這些測試不適當,檢測數據不可靠,患者可能面臨嚴重傷害的風險,FDA、CFDA、EMA或其他類似的監管機構可能會對我們公司施加重大限制,直到缺陷得到糾正。
目前,我們的藥品原料,我們的生產活動是由多個來源的供應商。我們與製造商或供應商簽訂了藥品供應協議,我們認為這些供應商有足夠的能力滿足我們的需求。此外,我們認為,有足夠的替代來源來供應這種用品。然而,如果供應中斷,將對我們的業務造成實質性損害。
我們依賴於巴斯夫SE作為唯一的供應商的穩定劑,Solutol,用於普林布林目前的配方。如果巴斯夫SE變得無法或不願意供應Solutol,我們將無法取代巴斯夫SE,我們將被要求重新制定Plinbulin。重新制定我們的產品候選人將導致延誤,原因有很多,包括但不限於,任何替代代理的供應商必須由相關的監管機構評估或合格,這是一個昂貴和耗時的過程,在此期間,我們可能會遇到供應中斷。這種調整將導致重大延誤,並預計將減少我們的一個或多個產品候選人的整體活動。我們在與這樣的供應商談判優惠條件方面也可能不成功。因此,我們的財政狀況和業務成果可能會受到不利影響。
藥品製造商在生產中經常遇到困難,特別是在擴大或淘汰、驗證生產過程和確保生產過程的高可靠性(包括無污染)方面。這些問題包括物流和運輸、生產成本和產量的困難、質量控制,包括產品的穩定性、產品測試、操作人員的錯誤、合格人員的提供以及嚴格執行的聯邦、州和非美國法規的遵守情況。此外,如果在我們供應的產品或製造設施中發現污染物,這些生產設施可能需要長期關閉,以調查和補救污染。今後可能會出現穩定性故障或與產品候選產品的製造有關的其他問題。此外,我們的製造商可能由於資源限制或由於勞資糾紛或不穩定的政治環境而面臨生產困難。如果我們的製造商遇到任何這些困難,或者不履行他們的合同義務,我們在臨牀試驗中向病人提供產品候選的能力就會受到損害。例如,BASF SE可能無法及時生產足夠數量的穩定劑。臨牀試驗用品供應的任何拖延或中斷都可能推遲臨牀試驗的完成,增加維持臨牀試驗計劃的費用,並根據延遲期的不同,要求我們以額外費用開始新的臨牀試驗或完全終止臨牀試驗。
我們可能會在未來形成或尋求合作、戰略聯盟或收購,或達成許可安排,而我們可能無法意識到這些安排的好處。
我們可以建立或尋求戰略聯盟,建立合資企業或合作,獲得免費產品、知識產權、技術或企業,或與第三方簽訂額外的許可證安排,我們認為這些安排將補充或加強我們對產品候選人和我們今後可能開發的任何產品候選人的開發和商業化努力。任何這些關係都可能要求我們承擔非經常性費用和其他費用,增加我們的短期和長期支出,發行稀釋我們股東的證券,或擾亂我們的管理和業務。此外,我們在尋找合適的戰略夥伴方面面臨着巨大的競爭,談判過程既費時又複雜。此外,我們可能無法成功地為我們的產品候選者建立戰略夥伴關係或其他替代安排,因為他們可能被認為處於合作努力發展的過早階段,第三方可能認為我們的產品候選方不具備展示安全和效能的必要潛力。如果和當我們與第三方合作開發和商業化一個產品候選,我們可以期望放棄部分或全部控制權的未來成功的產品候選人的第三方。
36
目錄
此外,涉及我們的產品候選人的合作也會面臨許多風險,其中可能包括:
| · |
協作者在確定他們將應用於協作的努力和資源方面有很大的酌處權;
|
| · |
合作者可能不會追求我們的產品候選人的開發和商業化,也可能選擇不繼續或更新基於臨牀試驗結果的開發或商業化計劃,由於獲得有競爭力的藥物而改變其戰略重點,可獲得資金,或其他外部因素,例如轉移資源或產生競爭優先事項的商業組合;
|
| · |
合作者可以推遲臨牀試驗,提供臨牀試驗經費不足,停止臨牀試驗,放棄候選產品,重複或者進行新的臨牀試驗,或者要求新的候選產品進行臨牀試驗;
|
| · |
合作者可以獨立開發或與第三方開發直接或間接與我們的藥物或產品候選產品競爭的藥物;
|
| · |
擁有一種或多種藥物的營銷和分銷權的合作者不得為其營銷和分銷投入足夠的資源;
|
| · |
合作者可能不適當地維護或捍衞我們的知識產權,或使用我們的知識產權或專有信息的方式可能導致實際或威脅的訴訟,從而危及或使我們的知識產權或專有信息失效,或使我們面臨潛在的賠償責任;
|
| · |
我們和合作者之間可能會發生爭端,導致我們的產品候選產品的研究、開發或商業化的延遲或終止,或者導致昂貴的訴訟或仲裁,從而轉移管理層的注意力和資源;
|
| · |
可能終止合作,如果合作終止,則可能需要更多的資本,以進一步開發適用的產品候選產品或使其商業化;
|
| · |
合作者可能擁有或共同擁有知識產權,包括我們與他們合作產生的藥品,在這種情況下,我們沒有將這種知識產權商業化的專屬權利;
|
| · |
合作可能導致業務費用增加,或承擔債務或或有負債;以及
|
| · |
合作安排可能會導致關鍵人員的流失和我們維持關鍵業務關係的能力的不確定性。
|
37
目錄
因此,如果我們簽訂合作協議和戰略夥伴關係,或批准我們的藥物,如果我們不能成功地將這些交易與我們現有的業務和公司文化結合起來,我們可能無法實現這些交易的好處,這可能會延誤我們的時間表,或對我們的業務產生不利影響。在進行戰略交易或許可後,我們可能無法獲得合理的收入或特定淨收入。If we are unable to reach agreements with suitable collaborators on a timely basis, on acceptable terms, or at all, we may have to curtail the development of a product candidate, reduce or delay its development program or one or more of our other development programs, delay its potential commercialization or reduce the scope of any sales or marketing activities, or increase our expenditures and undertake development or commercialization activities at our own expense.如果我們選擇自行資助和進行發展或商業化活動,我們可能需要獲得更多的專門知識和額外的資本,而這些可能是我們無法接受的條件或根本無法獲得的。如果我們不能進行合作,沒有足夠的資金或專門知識開展必要的開發和商業化活動,我們可能無法進一步開發我們的產品候選人,或將他們推向市場並創造產品銷售收入,這將損害我們的商業前景、財務狀況和經營結果。
We have entered into an investigator-initiated clinical trial agreement with the University of California, San Diego, or UCSD, and Dr. Lyudmila Bazhenova, an employee of UCSD and the principal investigator, and a clinical study agreement with The University of Washington, in connection with the investigator-initiated Phase 1/2 studies of Plinabulin in combination with nivolumab in patients with metastatic NSCLC.這兩項協議都規定,我們將提供財政支助和獲得普林布林,以便在研究中使用,也不能保證與這些研究有關的任何知識產權將得到發展。見“項目4”。公司信息--B.業務概述--我們的主要候選藥物---
與我們的工業、商業和經營有關的風險
我們可能受到限制,在我們可以作出的宣傳主張,並可能無法使用有關競爭療法的信息,以推廣或市場上的普林布林,如果獲得批准,而不招致重大的監管或執法風險。
包括FDA和聯邦貿易委員會(FTC)在內的各種美國政府機構對FDA批准的醫療產品的推廣和廣告進行了監管。宣傳材料和陳述不得是虛假或誤導的。除其他外,fda要求宣傳要求得到“實質性證據”的支持,這需要充分的、嚴格控制的臨牀試驗。宣傳要求還必須反映醫療產品的風險和利益之間的“公平平衡”。FDA還發現,如果沒有充分的、嚴格控制的、面對面的比較試驗的支持,比較性的説法是“錯誤的和誤導的”。
免責聲明稱,這些比較性的聲明並不是基於從頭到頭的試驗,可能不足以使責任方與fda或ftc的強制行動隔離開來。虛假和具有誤導性的廣告和宣傳違反了“聯邦食品、藥品和化粧品法”(FDCA),並使責任方受到制裁,包括但不限於警告信、禁令、民事處罰和刑事起訴。此外,如果一個負責方為了推銷該產品而對競爭藥品、設備或生物作了虛假或誤導性陳述,則該產品根據條例被錯誤地貼上了標籤。我們還沒有與任何其他預防中性粒細胞減少的療法,如粒細胞集落刺激因子(G-CSF)療法進行面對面的試驗。因此,我們將受到限制,我們的能力,在市場上使用現有的數據,從不同的競爭療法的試驗。如果我們決定將普林布林的益處與其他療法相比較,我們將需要進行面對面的臨牀試驗,這些試驗可能耗時且昂貴,而且可能不成功。
我們在中國內地和香港對普林布林的權利有限。
萬春·布林是一家擁有部分股權的子公司,在中國和香港擁有Plinbulin的知識產權。我們目前間接持有萬春寶60%的股權。剩下的40%由萬春生物科技公司持有。萬春生物科技是一家中國有限責任公司,由我們的首席執行官蘭黃(Lan Huang)、我們的大股東林清佳和我們的少數股東董亮持有。因此,凡春寶因擁有股份而產生的任何分配,我們作為母公司都不會完全接受,我們向萬春布林支付的任何款項也將間接使黃博士、賈先生和樑先生受益。我們作為母公司,可能永遠沒有任何收入或其他資金來償還這些款項。此外,根據中國的法律、法規和條例,我們在中國註冊的子公司在向股東轉移部分淨資產作為股息的能力上受到限制,註冊股本和資本儲備賬户也被限制在中國退出。截至2017年月31,這些限制性資產總計1560萬元人民幣(240萬美元)。
38
目錄
我們未來的成功取決於我們是否有能力留住我們的首席執行官和其他關鍵高管,以及吸引、留住和激勵合格的人員。
我們高度依賴藍黃博士,我們的創始人,董事會主席和首席執行官,以及我們管理和科學團隊的其他主要成員。雖然我們與大部分行政人員訂有正式的僱傭合約,但這些協議並沒有阻止我們的行政人員在任何時候終止他們與我們的工作。2018年月20日,理查德·A·布蘭德辭去了我們首席財務官的職務。我們的財務總監楊愛美(AmyYang)擔任我們的臨時首席財務官,直到劉東亨(EdwardDonghengLiu)在2018年月26日被任命為我們的首席財務我們不為任何高管或其他員工提供“關鍵人物”保險。失去這些人的服務可能妨礙我們實現研究、發展和商業化目標。
為了吸引有價值的員工留在我們的公司,除了工資和現金獎勵外,我們還提供股票獎勵。隨着時間的推移,這些股權授予給員工的價值可能會受到我們無法控制的普通股價變動的重大影響,而且可能在任何時候都不足以抵消其他公司更有利可圖的出價。雖然我們與我們的主要僱員有僱傭協議,但我們的任何僱員都可以隨時離開,不論是否有通知。
招聘和留住合格的科學、臨牀、銷售和營銷人員或顧問也將是我們成功的關鍵。此外,我們依賴顧問和顧問,包括科學和臨牀顧問,幫助我們制定我們的發現和臨牀前研究發展和商業化戰略。我們的行政人員或其他主要僱員和顧問失去服務,可能會妨礙我們的研究、發展和商業化目標的實現,並嚴重損害我們成功執行業務戰略的能力。
此外,更換行政主任和主要僱員或顧問可能會有困難,而且可能需要較長的時間,因為本港業界人數有限,具備成功發展、獲得規管認可及將產品候選人商業化所需的廣泛技能和經驗。從這個有限的人才庫招聘人員的競爭十分激烈,鑑於許多製藥和生物技術公司對類似人員的競爭,我們可能無法以可接受的條件僱用、培訓、保留或激勵這些關鍵人員或顧問。
我們還經歷了從大學和研究機構招聘科學和臨牀人員的競爭。我們的顧問和顧問可能被我們以外的僱主僱用,並可能根據諮詢或諮詢合同與其他實體簽訂合同,這可能會限制我們獲得這些顧問和顧問的機會。如果我們不能繼續吸引和留住高素質的人才,我們實施增長戰略的能力將受到限制。
我們將需要擴大我們組織的規模和能力,我們可能在管理我們的增長方面遇到困難。
截至2018年月26,我們有38名全職員工.其中26人從事全職研究開發和實驗室業務,12人從事全職一般和行政工作。截至2018年月26日,我們有14名員工在中國工作,24名在美國工作。我們還聘請並可能繼續聘請非全職僱員的獨立承包商來協助我們的業務。隨着我們的發展和商業化計劃和戰略的發展,我們將需要建立和保持有效的披露和財務控制,並對我們的公司治理做法作出改變。我們將需要增加大量的管理、業務、銷售、營銷、財務和其他具有適當的上市公司經驗和技術知識的人員,我們可能無法成功地徵聘和維持這類人員。今後的增長將給管理人員帶來重大的額外責任,包括:
39
目錄
| · |
確定、招聘、整合、維持和激勵更多員工;
|
| · |
有效地管理我們的內部開發工作,包括臨牀和FDA或其他類似的監管機構對我們產品候選方的審查過程,同時遵守我們對承包商和其他第三方的合同義務;以及
|
| · |
改進我們的業務、財務和管理控制、報告制度和程序。
|
我們未來的財務表現和產品候選產品商業化的能力將在一定程度上取決於我們有效管理未來增長的能力,我們的管理層也可能不得不將過多的注意力從日常活動轉移到管理這些增長活動上。
我們現時及在可預見的將來,在很大程度上仍須倚賴某些獨立機構、顧問及顧問提供某些服務。這些獨立的組織、顧問和顧問可能無法在需要時及時提供給我們,在這種情況下,我們可能無法找到合格的替代人員。此外,如果我們不能有效地管理我們的外包活動,或由於任何原因而影響顧問所提供服務的質量或準確性,我們的臨牀試驗可能會被延長、推遲或終止,我們可能無法獲得產品候選人的監管批准或以其他方式推進我們的業務。此外,我們可能無法管理現有的顧問公司,或在經濟上合理的條件下,找到其他合資格的外判商和顧問公司。
如果我們不能通過僱用新的僱員和擴大我們的顧問和承包商小組來有效地擴大我們的組織,我們可能無法成功地執行進一步開發和使我們的產品候選人商業化所需的任務,因此可能無法實現我們的研究、開發和商業化目標。
我們的僱員、獨立承包商、顧問、商業夥伴和供應商可能從事不當行為或其他不當活動,包括不遵守監管標準和要求。
我們面臨員工、獨立承包商、顧問、商業合作伙伴和供應商的欺詐、不當行為或其他非法活動的風險。Misconduct by these parties could include intentional, reckless and negligent conduct that fails to: comply with the laws of the FDA and other similar non-U.S. regulatory authorities; provide true, complete and accurate information to the FDA and other similar non-U.S. regulatory authorities; comply with manufacturing standards we have established; comply with healthcare fraud and abuse laws in the U.S. and similar non-U.S. fraudulent misconduct laws; or report financial information or 數據準確或向我們披露未經授權的活動。如果我們獲得FDA批准,並開始在美國將這些藥物商業化,我們在美國法律下的潛在暴露將大大增加,我們遵守這些法律的相關成本也可能會增加。除其他外,這些法律可能會影響到我們目前與主要調查人員和研究病人的活動,以及我們在臨牀試驗招募病人過程中獲得的信息的使用,以及擬議的和今後的銷售、營銷和教育方案。特別是,醫療保健用品和服務的推廣、銷售和營銷,以及保健行業的某些商業安排,都要遵守廣泛的法律,以防止欺詐、回扣、自我交易和其他濫用行為。這些法律法規可以限制或禁止廣泛的定價、折扣、營銷和促銷、結構和佣金、某些客户獎勵計劃和其他一般業務安排。
不一定能夠查明和制止僱員和其他方面的不當行為,我們為發現和防止這一活動而採取的預防措施可能無法有效控制未知或非管理的風險或損失,或保護我們免受政府調查或因不遵守這些法律或條例而採取的其他行動或訴訟。如果對我們採取任何這類行動,而且我們沒有成功地捍衞自己或維護我們的權利,這些行動可能對我們的業務產生重大影響,包括處以鉅額罰款或其他制裁。
40
目錄
我們以前發現,我們對財務報告的內部控制存在重大缺陷,已得到糾正。然而,如果我們不能維持一個有效的內部控制制度,我們可能無法準確或及時地報告我們的財務狀況或經營結果,這可能會對投資者對我們的信心產生不利影響,從而影響我們普通股的價值。
作為一家上市公司,我們必須保持對財務報告的內部控制,並報告這些內部控制中的任何重大缺陷。“薩班斯-奧克斯利法案”(2002)或“薩班斯-奧克斯利法案”(Sarbanes-Oxley Act)第404條要求我們評估和確定我們對財務報告的內部控制的有效性,並就財務報告的內部控制提供一份管理報告。“薩班斯-奧克斯利法案”還要求,我們關於財務報告內部控制的管理報告必須得到我們獨立註冊的公共會計師事務所的證明,如果我們不再是“就業法案”中定義的“新興增長公司”的話。只要我們是一家新興的成長公司,我們就不會指望我們的獨立註冊會計師事務所能夠證實我們關於財務報告的內部控制的管理報告。
在審計截至12月31日、2016和2015以及截至12月31日、2016、2015和2014的財務報表時,我們發現了財務報告內部控制方面的一個重大缺陷。實質上的弱點是沒有足夠數量的財務報告人員,在適用美國公認會計準則和證券交易委員會符合我們的報告要求的規則和條例方面具有適當的知識、經驗和培訓水平。After identifying the material weakness we implemented measures designed to improve our internal control over financial reporting to remediate the material weakness, including the following: (i) we have hired a new controller, two new staff accountants and a bookkeeper intern in our accounting department in the U.S. and a cashier in our accounting department in China, all of whom have knowledge and sufficient experience in accounting and financial reporting matters, (ii) we have obtained accounting and advisory services from professional accounting consultants with U.S. GAAP and SEC reporting experience, (iii) we continue to improve the capabilities of existing financial reporting personnel through training and education in the accounting and reporting requirements under U.S. GAAP and SEC rules and regulations, (iv) we continue to develop, communicate and implement an accounting policy manual for our financial reporting personnel for recurring transactions and period-end closing processes, (v) we continue to develop, communicate and implement standard of performance on accounting control points, (vi) we continue to establish effective monitoring and oversight controls for non-recurring and complex transactions to ensure the accuracy and completeness of our consolidated financial statements and related disclosures; and (vii) we have purchased new accounting software to strengthen IT control of all of our subsidiaries.
我們的管理層在我們的首席執行官和首席財務官的參與下,評估了截至本報告所涉期間結束時我們的披露控制和程序(根據“外匯法”第13a-15(E)條)的有效性,並得出結論認為,我們的披露控制和程序自2017年月31起生效。因此,我們得出結論,截至2017年月31,我們已經糾正了先前報告的實質性弱點。
雖然我們認為我們已經糾正了這一重大弱點,但我們可能會發現今後我們在財務報告方面的內部控制中還存在其他重大弱點或重大缺陷。更廣泛地説,如果我們不能遵守“薩班斯-奧克斯利法”第404條的要求,如果我們不能斷言我們對財務報告的內部控制是有效的,或者在今後需要時,如果我們的獨立註冊公共會計師事務所不能就我們對財務報告的內部控制的有效性發表意見,投資者可能會對我們的準確性失去信心。我們的財務報告的完整性和普通股的市場價格可能受到不利影響,我們可能會受到證券交易所、證券交易委員會或其他監管機構的調查,這可能需要額外的財政和管理資源。
我們面臨着在國際上做生意的風險。
我們在世界各國開展業務,我們可能無法在這些市場上銷售我們的產品或成功地開發新產品。我們還可能遇到其他在國際上開展業務的風險,包括:
41
目錄
| · |
立法或法規要求的意外變化或規定;
|
| · |
經濟疲軟的出現,包括通貨膨脹或政治不穩定;
|
| · |
適用的非美國税收結構的影響和潛在的不利税收後果;
|
| · |
我國知識產權保護的差異,包括第三方專利權的保護;
|
| · |
遵守各種外國法律的責任,包括有效執行合同規定的困難;
|
| · |
由於難以獲得出口許可證、關税及其他壁壘和限制、付款週期可能較長、應收賬款的收取更加困難和潛在的不利税收待遇而造成的拖延;
|
| · |
任何影響國外原材料供應或製造能力的事件造成的生產短缺。
|
此外,我們在經營的外國受到一般地緣政治風險的影響,例如政治和經濟不穩定以及外交和貿易關係的變化,這可能影響到客户的庫存水平和消費者購買,這可能導致我們的結果波動,我們的淨銷售額下降。任何一個或多個國際業務風險的發生,無論是個別的,還是整體的,都會對我們的業務和經營結果產生重大影響。
如果我們不遵守美國“反海外腐敗法”或“反海外腐敗法”或其他反賄賂法,我們的名譽可能會受到損害,我們可能會受到懲罰和重大開支,這會對我們的業務、財務狀況和經營結果產生重大的不利影響。
我們受“反海外腐敗法”的約束,該法案一般禁止我們為獲取或保留業務而向非美國官員支付不當款項。我們也要遵守其他司法管轄區的反賄賂法,特別是中國的法律.隨着業務的擴大,“反海外腐敗法”和其他反賄賂法對我們的業務的適用性將增加。我們監控反賄賂合規的程序和控制措施可能無法保護我們免受我們的僱員或代理人的魯莽或犯罪行為之害。如果我們由於自己的故意或無意行為或其他人的行為而不遵守適用的反賄賂法,我們的名譽就可能受到損害,我們可能會受到刑事或民事處罰、其他制裁和/或重大開支,這可能對我們的業務產生重大的不利影響,包括我們的財務狀況、經營結果、現金流和前景。
業務中斷可能嚴重損害我們未來的收入和財務狀況,增加我們的成本和開支。
Our operations, and those of our third-party research institution collaborators, CROs, suppliers and other contractors and consultants, could be subject to earthquakes, power shortages, telecommunications failures, damage from computer viruses, material computer system failures, water shortages, floods, hurricanes, typhoons, fires, extreme weather conditions, medical epidemics and other natural or man-made disasters or business interruptions for which we are predominantly self-insured.此外,我們部分依賴第三方研究機構的合作者來進行我們的產品候選人的研究和開發,他們可能會受到政府關閉或撤回資金的影響。任何這些業務中斷的發生都可能嚴重損害我們的業務和財務狀況,增加我們的成本和開支。我們依靠第三方製造商來生產和加工我們的產品候選產品。如果這些供應商的業務受到人為或自然災害或其他業務中斷的影響,我們獲得產品候選產品的臨牀供應的能力可能會受到影響。我們的合同製造商的很大一部分業務位於一個單一的設施。由於火災、自然災害、電力損失、通信故障、未經授權的進入或其他事件對我們的公司或合同製造商的開發或研究設施造成損壞或長時間中斷,可能導致我們停止或推遲對我們的部分或全部產品的開發。
42
目錄
我們的內部計算機系統,或我們的CRO或其他承包商或顧問使用的系統,可能會失敗或遭受安全漏洞。
雖然我們已採取保安措施,但我們的內部電腦系統,以及我們的電腦系統,以及其他承建商及顧問公司,都容易受到電腦病毒及未經授權而進入的電腦系統的損害。雖然,據我們所知,迄今為止,我們還沒有經歷過任何這樣的物質系統故障或安全漏洞,但如果這樣的事件發生並造成我們業務的中斷,它可能會對我們的開發程序和業務運作造成實質性的破壞。例如,從已完成的或未來的臨牀試驗中丟失臨牀試驗數據可能導致我們的監管審批工作出現延誤,並大大增加我們收回或複製數據的成本。同樣,我們也部分依賴第三方研究機構的合作者來研究和開發我們的產品候選產品,以及其他第三方來製造我們的產品候選產品和進行臨牀試驗,而與他們的計算機系統相關的類似事件也可能對我們的業務產生實質性的不利影響。如果任何干擾或違反安全的行為導致我們的數據或應用程序損失或損壞,或不適當地披露機密或專有信息,我們就可能承擔責任,我們的產品候選產品的進一步開發和商業化可能會被推遲。
如果對我們提起產品責任訴訟,我們可能會承擔重大責任,並可能被要求限制我們的產品候選產品的商業化。
由於我們的產品候選產品的臨牀測試,我們面臨產品責任的固有風險,如果我們將任何藥物商業化,我們將面臨更大的風險。例如,我們可能會被起訴,如果我們的產品候選人造成或被認為造成傷害,或發現其他不適合在臨牀測試,製造,營銷或銷售。任何這類產品責任索賠可能包括對製造缺陷、設計缺陷、未警告藥品固有危險、疏忽、嚴格責任或違反保證的指控。也可以根據國家消費者保護法提出索賠。如果我們不能成功地針對產品責任索賠為自己辯護,我們可能會承擔大量的責任,或者被要求限制產品候選產品的商業化。即使是成功的防禦,也需要大量的財政和管理資源。不論其優點或最終結果如何,賠償責任要求都可能導致:
| · |
對毒品的需求減少;
|
| · |
損害我們的名譽;
|
| · |
臨牀試驗參與者退出和無法繼續進行臨牀試驗;
|
| · |
由監管機構發起調查;
|
| · |
為相關訴訟辯護的費用;
|
| · |
浪費管理人員的時間和資源;
|
| · |
給予試驗參與者或病人的大量金錢獎勵;
|
| · |
產品召回、退出或標籤、營銷或促銷限制;
|
| · |
收入損失;
|
| · |
用盡現有保險和我們的資本資源;
|
| · |
無法將任何產品候選產品商業化;以及
|
| · |
普通股票價格的下跌。
|
43
目錄
我們無法以可接受的成本獲得足夠的產品責任保險,以防範潛在的產品責任索賠,這可能會阻止或抑制我們單獨或與合作者共同開發的藥物的商業化。雖然我們目前的最高保險總額約為500萬元臨牀試驗保險,但這類保險的金額可能不足夠,我們可能無法維持這類保險,或我們可能無法以合理的成本獲得額外或替代保險。我們的保險單也可能有各種除外條款,我們可能會受到產品責任索賠,但我們沒有保險。我們可能必須支付法院裁定的任何金額,或在和解協議中談判達成的任何金額,這些數額超出我們的承保範圍限制,或未列入我們的保險範圍,而且我們可能沒有或能夠獲得足夠的資本支付這些款項。即使我們與任何未來的公司合作者達成的協議使我們有權對損失進行賠償,如果有任何索賠,這種賠償可能是不可行的,也是不夠的。
我們的保險範圍有限,任何超出我們保險範圍的索賠都可能導致我們承擔大量費用和挪用資源。
我們維護財產保險政策,包括對我們的建築物的有形損害或損失,以及它們的改進,設備,辦公室傢俱和庫存。我們持有僱主責任保險,一般包括僱員的死亡或與工作有關的傷害.我們持有公共責任保險,包括涉及第三方的某些事件,這些事件發生在我們的房屋內。我們持有董事和軍官責任保險,包括因對我們的董事和官員提起的某些法律訴訟而造成的損失或預付的辯護費用。我們不為任何高級管理人員或關鍵人員提供“關鍵人物”人壽保險,或業務中斷保險。我們的保險範圍可能不足以支付任何產品責任、固定資產損壞或員工傷害的索賠。我們的設施或人員在保險範圍之外的任何責任、損害或造成的損害,都可能導致我們承擔大量費用,並挪用資源。
匯率的波動可能導致外匯兑換損失,並可能大大降低您的投資價值。
我們承擔部分開支,將來可能以美元以外的其他貨幣,特別是人民幣獲得收入。因此,我們面臨外匯風險,因為我們的經營結果和現金流量受外幣匯率波動的影響。例如,我們的臨牀試驗活動的很大一部分可能在美國境外進行,相關費用可能以進行試驗的國家的當地貨幣支付,這種費用可能會受到貨幣匯率波動的影響。我們目前不從事對衝交易,以防止特定外幣與美元之間未來匯率的不確定性。在我們進行臨牀試驗的國家,美元對貨幣的貶值可能會對我們的研究和開發成本產生負面影響。外幣波動是不可預測的,可能會對我們的財務狀況、經營結果和現金流動產生不利影響。
人民幣對美元和其他貨幣的價值可能會波動,並受到政治和經濟條件的變化以及中國和其他非美國政府採取的外匯政策的影響。特別是在中國,2005年月21日,中國政府改變了人民幣與美元掛鈎的政策。在取消釘住美元政策後,人民幣兑美元匯率在未來三年內升值了18.7%。在2008至2010年間,人民幣對美元的升值停止,人民幣兑美元的匯率仍在一個狹窄的區間內。自2010以來,中國政府再次允許人民幣對美元緩慢升值。2012年4月,中國政府宣佈將允許人民幣匯率進一步波動。2015年月11日,中國央行對人民幣進行了1.8%的貶值。在接下來的兩天裏,人民幣兑美元匯率下跌了1.2%。從2015年8月13日6.40元人民幣兑1美元的匯率開始,人民幣兑美元匯率在2016年月16日繼續跌至6.96元兑1美元的低點。2017年間,美元對人民幣匯率從6.94下降到6.51。目前仍不清楚可能發生什麼進一步的波動,或這將對貨幣產生什麼影響。
中國、美國或其他政府政策可能會影響人民幣、美元和其他貨幣之間的匯率,對我們的業務產生不利影響。國際社會仍對中國政府施加巨大壓力,要求其採取更加靈活的貨幣政策,這可能導致人民幣兑美元匯率出現更大的波動。我們的成本是以美元、人民幣、澳元和歐元計價的,我們的大部分金融資產都是美元。如果我們需要將美元兑換成人民幣,人民幣兑美元的升值將對我們所收到的人民幣金額產生不利影響。相反,如果我們決定將人民幣兑換成美元,用於我們的業務或其他業務目的,那麼美元對人民幣的升值將對我們將收到的美元數額產生負面影響。
44
目錄
我們的投資面臨可能導致損失的風險。
截至12月31日、2017和2016,我們的現金、現金等價物和短期投資分別為3,060萬美元和1,170萬美元。我們可以把我們的現金投資於各種金融工具,主要是短期投資等級、有息工具。所有這些投資都受到信貸、流動性、市場和利率風險的影響。這些風險,包括持有我們的現金、現金等價物和投資的金融機構的破產或嚴重財務困難,可能導致我們的流動性損失、投資減損、未來重大損失的實現或長期投資的完全損失,這可能對我們的業務、經營結果、流動性和財務狀況產生重大不利影響。我們面對利率風險的風險來自於我們從存款中賺取的利息收入和股東貸款的利息費用的變動。為了管理風險,我們的現金被持有在我們認為是高信用質量的金融機構。雖然我們相信我們的現金狀況不會使我們面臨過度的風險,但未來的投資可能會受到市場價值的不利變化。
我們的披露控制和程序可能無法防止或發現所有錯誤或欺詐行為。
我們目前受“外匯法”的報告要求。我們的披露控制和程序旨在合理地確保我們在根據“交易法”提交或提交的報告中所需披露的信息在證券交易委員會規則和表格規定的時間內積累並傳達給管理層,並記錄、處理、彙總和報告。我們認為,任何披露管制和程序,或內部控制和程序,無論構思和運作如何良好,都只能提供合理的保證,而不是絕對的保證,以確保控制制度的目標得到實現。
這些固有的侷限性包括:決策中的判斷可能是錯誤的,而故障可能是由於簡單的錯誤或錯誤而發生的。此外,某些人的個人行為、兩人或兩人以上的串通或未經授權的控制可以規避控制。因此,由於我們的控制系統固有的侷限性,可能會發生錯誤或欺詐引起的誤報,而不會被發現。
與我們在華業務相關的風險
中國的製藥業受到高度管制,這些規定可能會改變,影響我國藥品的批准和商業化。
中國的醫藥行業受到政府的全面監管,包括新藥的批准、註冊、生產、包裝、許可和銷售。見“項目4”。公司信息-B.業務概述-政府法規-中國法規“討論適用於我們目前和計劃在中國的商業活動的監管要求。近幾年來,我國醫藥行業的監管框架發生了重大變化,我們期望繼續發生重大變化。任何此類改變或修改都可能導致我們的業務合規成本增加,或導致在中國的產品候選人的成功開發或商業化受到拖延或阻礙,並減少我們認為在中國開發和生產藥物的現有好處。中國當局在執行製藥業的法律方面變得越來越警惕,如果我們或我們的合作伙伴不遵守適用的法律和條例,或不取得和維持所需的許可證和許可證,我們在中國的業務活動就可能被中止或終止。我們相信,我們的戰略和方針與中國政府的政策是一致的,但我們不能確保我們的戰略和方針將繼續保持一致。
45
目錄
中國政府的政治和經濟政策的變化可能會對我們的業務、財務狀況和經營結果產生重大和不利的影響,並可能導致我們無法維持我們的增長和擴張戰略。
我們的財務狀況和經營成果在很大程度上受到中國經濟、政治和法律發展的影響。
中國經濟在政府參與程度、發展水平、增長率、外匯管制和資源配置等方面與大多數發達國家不同。雖然中國政府已採取措施,強調利用市場力量進行經濟改革,減少國有生產性資產,改善企業法人治理,但中國很大一部分生產性資產仍為政府所有。此外,中國政府通過實施產業政策,繼續在調控產業發展方面發揮着重要作用。中國政府還通過配置資源、控制以外幣計價的債務的支付、制定貨幣政策、規範金融服務和金融機構以及向特定行業或公司提供優惠待遇,對中國經濟增長進行重大控制。
雖然中國經濟在過去三十年中取得了顯著增長,但無論是在地理上還是在各個經濟部門之間,增長都是不平衡的。中國政府採取了多種措施,鼓勵經濟增長,引導資源配置。其中一些措施可能對中國整體經濟有利,但也可能對我們產生負面影響。我們的財務狀況和經營結果可能會受到政府對資本投資的控制或對適用於我們的税務條例的改變的重大和不利影響,從而對我們的業務、財務狀況和經營結果產生重大的不利影響。
中國法律、法規和法規的解釋和執行存在不確定性。
我們的部分業務是通過我們的中國子公司在中國進行的,並受中國法律、法規和條例的管轄。我們在中國的子公司受適用於外商在華投資的法律、法規和規章的約束。中國法律制度是建立在成文法基礎上的民事法律制度。
1979,中國政府開始頒佈一套全面的經濟法規體系。過去三十年來,立法的總體效果大大加強了對中國各種形式外國投資的保護。然而,中國還沒有形成一個完整的法律體系,最近頒佈的法律、法規、規章可能不足以涵蓋中國經濟活動的各個方面,也可能受到中國監管機構的重大解釋。特別是,由於這些法律、規則和條例是相對較新的,而且由於公佈的決定數量有限,而且這些決定不具約束力,而且由於法律、規則和條例往往賦予有關監管機構在如何執行這些決定方面的重大酌處權,因此,對這些法律、規則和條例的解釋和執行涉及不確定性,可能是不一致和不可預測的。此外,中國的法律制度部分以政府政策和內部規則為基礎,其中一些政策和內部規則沒有及時公佈或根本沒有公佈,而且可能具有追溯效力。因此,我們可能不知道我們違反了這些政策和規則,直到發生了違法行為。
在中國,任何行政和法院訴訟程序都可能曠日持久,造成大量費用和資源的轉移以及管理人員的關注。由於中國行政和法院當局在解釋和執行法定和合同條款方面有很大的酌處權,與較發達的法律制度相比,評估行政和法院程序的結果以及我們享有的法律保護水平可能更加困難。這些不確定因素可能會妨礙我們執行我們簽訂的合同的能力,並可能對我們的業務、財務狀況和業務結果產生重大和不利的影響。
46
目錄
在制定時間表、最後版本、解釋和實施中國外國投資法草案以及如何影響我國現行公司治理的可行性等方面存在着重大的不確定性。
商務部於2015年1月發佈了“外商投資法”草案,以取代現行“中外合資經營企業法”、“中外合資經營企業法”、“中外合作經營企業法”、“外商獨資企業法”三部現行外商投資法律及其實施細則和配套條例。“外國投資法”草案體現了一種預期的中國監管趨勢,即根據國際通行的慣例和統一外資和國內投資公司法律要求的立法努力,使其外國投資監管制度合理化。商務部徵求了對該草案的意見,在其頒佈時間表、最後版本、解釋和實施方面存在着很大的不確定性。
除其他外,“外國投資法”草案擴大了外國投資的定義,在確定一家公司是否被視為外商投資企業或外商投資企業時引入了“實際控制”原則。“外國投資法”草案明確規定,在中國設立但由外國投資者“控制”的實體將被視為外商投資企業,而在外國法域設立的實體在商務部或其當地對應方進入市場後,將被視為中國居民企業,條件是該實體由中國實體和(或)公民“控制”。In this connection, “control” is broadly defined in the draft law to cover the following summarized categories: (1) holding 50% of more of the shares, equity or voting rights of the subject entity; (2) holding less than 50% of the voting rights of the subject entity but having the power to secure at least 50% of the seats on the board or other equivalent decision-making bodies, or 對董事會、股東大會或者其他同等決策機構具有重大影響的表決權;或者(三)有權通過合同或者信託安排,對主體實體的經營、財務事項或者其他業務活動的關鍵方面施加決定性影響。單位確定為外商投資企業後,從事“消極清單”所列行業的,受外商投資限制或者禁止,以後由國務院另行發佈。“負面清單”需要商務部或當地對應機構批准進入市場。除非FIE的基本業務屬於否定清單,否則設立FIE將不再需要政府當局按照現行外國投資法律制度的授權事先批准。我們的主要業務,創新癌症療法的開發,屬於“指導外國投資產業目錄”(2015修訂版)或2015目錄中的鼓勵行業類別。因此,如果“外國投資法”草案以目前的形式生效,而2015目錄保持不變,我們對萬春生物技術(深圳)有限公司和萬春布林的投資將不需要獲得政府有關部門的許可,無論我們是由中國股東還是外國股東控制。
“外國投資法”草案還對外國投資者和適用的外國投資企業規定了嚴格的特別和定期信息報告要求。除了每次投資和投資細節變更所需的投資執行情況報告和投資修正報告外,年度報告是強制性的,符合某些標準的大型外國投資者必須每季度報告一次。任何被發現不遵守這些信息報告義務的公司可能會被處以罰款和/或行政或刑事責任,直接責任人員可能要承擔刑事責任。
“外國投資法”草案目前只是草案形式,關於最後立法與草案之間的差異有多大的不確定性很大。如果“外商投資法”與現行草案有實質性的不同,可能會對公司結構、業務運作和公司治理產生重大影響。雖然我們期望採取行動確保我們的業務繼續符合適用的中華人民共和國法律,包括“外國投資法”生效後,但我們可能會花費大量時間和費用來遵守,並可能需要改變我們的公司結構。
47
目錄
中國有關中國居民投資海外公司的規定可能會使我們未來的中國居民受益所有人或我們的中國子公司承擔責任或受到懲罰,限制我們向中國子公司注入資本的能力,或限制我們的中國子公司增加註冊資本或分配利潤的能力。
國家外匯管理局或國家外匯局於#date0#7月4日發佈了“關於境內居民境外投融資和專用車往返投資外匯管理有關問題的通知”或“外匯局第37號通知”,取代了國家外匯局於2005年月21日發佈的“安全通知75”。外匯局第三十七號通知要求中國居民在外匯局直接設立或者間接控制境外實體的地方分支機構辦理境外投資、融資手續,並將其合法擁有的境內企業資產、股權或者境外資產或者權益登記為“專用工具”。“安全通告”第37號進一步要求對特別用途車輛的登記作出修正,如中國個人出資的增加或減少、股份轉讓或交換、合併、分立或其他重大事件。如果持有某一專用工具的中國股東權益不符合規定的安全登記,則該專用工具的中國子公司不得向境外母公司進行利潤分配和隨後開展跨境外匯活動,專用車輛向其中國子公司增資的能力也可能受到限制。此外,如果不遵守上述各項安全登記要求,根據中國法律,規避外匯管制的責任可能會產生。
我們相信,藍黃博士和林清佳、董良先生都是我們的股東,他們都是中國居民,他們都是“安全通告”第37號通知中的中國居民。雖然藍黃博士、賈臨清先生和董良先生已根據“安全通知”第37號完成了外匯登記,但我們對這三名股東和其他實益所有人沒有控制權,我國居民受益所有人可能沒有遵守,今後也可能不遵守“安全通知”第37號及其後的實施細則。中國居民受益所有人未按照“安全通知”第37號及其後的實施細則及時登記或修改其安全註冊,或本公司未來的中國居民受益所有人未遵守“安全通告”第37號及其後的實施細則所規定的登記程序,可對該實益所有人或我們的中國子公司處以罰款和法律制裁。此外,“安全通告”第37號不清楚中國政府有關部門將如何解釋、修正和實施這一條例,以及今後有關離岸或跨境交易的任何規定,我們無法預測這些規定將如何影響我們的業務運作或未來的戰略。不註冊或不遵守相關要求也可能限制我們向中國子公司提供額外資本的能力,並限制我們在中國的子公司向我們分配股息的能力。這些風險將來可能對我們的業務、財務狀況和經營結果產生重大不利影響。
任何不遵守中國有關員工權益激勵計劃的規定,都可能會被中國計劃參與者或我們處以罰款或其他法律或行政處罰。
我們和我們的董事、執行官員和其他屬於中國公民或在中國連續居住不少於一年並將被授予限制性股份或期權的員工,須遵守外管局於2月份發佈的關於參與境外上市公司股票激勵計劃的國內個人外匯管理局有關問題的通知。to which, employees, directors, supervisors and other management members participating in any share incentive plan of an overseas publicly listed company who are Chinese citizens or who are non-Chinese citizens residing in China for a continuous period of not less than one year, subject to limited exceptions, are required to register with SAFE through a domestic qualified agent, which could be a PRC subsidiary of such overseas listed company, and complete certain other procedures.此外,還必須聘請海外受委託機構處理行使或出售股票期權和買賣股份和權益的事宜。如果不完成安全註冊,可能會受到罰款和法律制裁,也可能限制我們根據股權激勵計劃付款的能力,或獲得與此相關的股息或銷售收益的能力,或我們向我國在華外資獨資企業提供額外資本的能力,以及限制我們的外資企業向我們分配股息的能力。我們還面臨監管方面的不確定性,這可能會限制我們根據中國法律為董事和員工制定額外股權激勵計劃的能力。
48
目錄
此外,國家税務總局還發布了關於職工股票期權或限制性股份的通知。根據這些通知,在中國工作的行使股票選擇權或持有限制性股份的僱員將繳納中國個人所得税。境外上市公司的中國子公司有義務向有關税務機關提交與職工股票期權或者限制性股份有關的文件,並扣繳與其股票期權或者限制性股份有關的職工個人所得税。如果員工不繳納,或者中國子公司沒有預扣適用的所得税,中國子公司可能面臨税務機關或其他中國政府機關的制裁。
將來,我們可能會在某種程度上依賴分紅和其他來自主要運營子公司的股權分配來滿足海外現金和融資需求。
我們是一家控股公司,在開曼羣島註冊成立,將來可能在某種程度上依賴於我們主要經營子公司的股息和其他股權分配,以滿足我們在海外的現金和融資需求,包括向股東支付股息和其他現金分配所需的資金,為公司間貸款提供資金,償還我們在中國以外可能產生的任何債務,並支付我們的費用。適用於我們中國子公司和某些其他子公司的法律、規則和條例只允許根據適用的會計準則和條例確定的留存收益(如果有的話)支付股息。
根據中國的法律、法規和條例,我們在中國註冊的每一家子公司每年都必須撥出一部分淨收入,用於支付某些法定準備金。這些準備金,連同註冊股本,不能作為現金紅利分配。由於這些法律、法規和條例,我們在中國註冊的子公司在向股東轉移部分淨資產作為股息的能力上受到限制。此外,在中國,註冊股本和資本儲備賬户也被限制退出。截至2017年月31,這些限制性資產總計1560萬元人民幣(240萬美元)。
The PRC Enterprise Income Tax Law, or EIT Law, and its implementation rules, both of which became effective on January 1, 2008, provide that China-sourced income of foreign enterprises, such as dividends paid by a Chinese subsidiary to its equity holders that are non-Chinese resident enterprises, will normally be subject to Chinese withholding tax at a rate of 10%, unless any such foreign investor’s jurisdiction of incorporation has 與中國簽訂的税收條約,其中規定了不同的扣繳安排。因此,由我們的中國子公司支付給我們的股息預計將按10%的税率徵收中國代扣税。
Pursuant to the Arrangement between Mainland China and Hong Kong Special Administrative Region for the Avoidance of Double Taxation and Prevention of Fiscal Evasion with respect to Taxes on Income, or Hong Kong Tax Treaty, BeyondSpring (HK) Limited, or BeyondSpring HK, the shareholder of our Chinese subsidiaries, may be subject to a withholding tax at a rate of 5% on dividends received from our Chinese operating subsidiaries as a Hong Kong tax resident.根據“香港税務條約”,在符合某些條件的情況下,只要受助人能證明自己是香港税務居民,而且是股息的實益擁有人,則中國實體的股息可獲扣減扣繳税款。香港碧昂斯目前並無香港税務局的香港居民税務證明書,而扣減的預扣税税率亦可能無法提供。
此外,如果我們在中國的子公司將來以自己的名義負債,債務工具可能會限制它們作為母公司向我們支付股息或其他付款的能力。對子公司將來作為母公司向我們分配股息或其他付款的能力的任何限制,都會對我們進行投資或收購的能力造成重大和不利的限制,這些投資或收購可能有利於我們的業務、支付股息或以其他方式為我們的業務提供資金和進行業務。
49
目錄
根據EIT法,我們可以被視為中國的居民企業,並按25%的税率對我們的全球應税收入徵收中國税。
根據“經濟轉型期法”,在中國境外設立的具有“事實上的管理機構”的企業被視為“常駐企業”,意思是為了經濟轉型期的目的,以類似於中國企業的方式對待它。“經濟轉型法”的實施細則將“事實上的管理機構”界定為“對企業的生產和經營、人事、會計和財產實行實質性和全面管理和控制的管理機構”。In addition, the Notice Regarding the Determination of Chinese-Controlled Offshore Incorporated Enterprises as PRC Tax Resident Enterprises on the Basis of De Facto Management Bodies, or Circular 82, specifies that certain Chinese-controlled offshore incorporated enterprises, defined as enterprises incorporated under the laws of foreign countries or territories and that have Chinese enterprises or enterprise groups as their primary controlling shareholders, will be classified as resident enterprises if all of the 中國境內有下列人員或居民:負責日常生產、經營和管理的高級管理人員和部門;財務和人事決策機構;關鍵財產、會計帳簿、公司印章和董事會和股東大會記錄;半數以上有表決權的高級管理人員或董事。2011,7月27日,國家税務總局發佈了“中國境外註冊居留企業企業所得税管理辦法”(試行),自2011年9月1日起生效,並於2016年月1日修訂,為“第82號通知”的實施提供進一步指導。公報45闡明瞭與確定中國居民企業地位有關的若干問題,包括哪些主管税務機關負責確定境外註冊的中國居民企業的地位,以及確定後確定的管理。2014,中國工商行政管理局發佈了“關於根據實際管理機構承認境外中資企業為常駐企業的有關問題的公告”,補充了有關居民企業認定管理程序的一些規定,而“82號通知”中用於居民企業分類的標準保持不變。
我們不知道有任何離岸控股公司的公司結構與我們類似,被中國税務機關認為是中國的“常駐企業”。因此,我們不認為我們的公司或我們的任何海外子公司應該被視為中國的居民企業。
如果中國税務機關認定我們的開曼羣島控股公司是中國經濟轉型期的常駐企業,中國可能會產生一系列不利的税收後果,我們可能會以全球應納税收入的25%的税率接受EIT,以及中國的EIT報告義務。在這種情況下,我們的中國子公司作為母公司支付給我們的股息可能不受中國預扣税的約束。
支付給外國投資者的股息可能要繳納中國預扣税,外國投資者出售普通股所得的收益可能要繳納中國税。
如果我們被視為“---As a result, dividends paid to non-Chinese resident enterprise ordinary shareholders may be subject to Chinese withholding tax at a rate of 10% (or 20% in the case of non-Chinese individual ordinary shareholders) and gains realized by non-Chinese resident enterprises ordinary shareholders from the transfer of our ordinary shares may be subject to Chinese tax at a rate of 10% (or 20% in the case of non-Chinese individual ordinary shareholders).目前尚不清楚,如果我們或我們在中國以外設立的任何子公司被視為中國的居民企業,我們普通股的持有者是否能夠從中國與其他國家或地區簽訂的所得税條約或協議中獲得利益。如果支付給我們的非中國投資者的股息,或這些投資者轉讓我們普通股所得的收益要繳納中國税,你對普通股的投資價值可能會大幅下降。
50
目錄
我們和我們的股東在間接轉讓中國居民企業的股權或歸屬於一家非中國公司的中國公司的其他資產,或歸屬於一家非中國公司的中國公司的其他資產方面,面臨着不確定性。
2015年月3日,沙特德士古公司發行了“企業所得税和非中華人民共和國居民企業間接轉移資產公告”,即公報7。根據本公報,非中國居民企業對“中華人民共和國應税資產”(包括中國居民企業的權益)的“間接轉移”,可以重新定性,並視為中華人民共和國應税資產的直接轉讓,如果這種安排沒有合理的商業目的,是為逃避中國企業所得税而制定的。因此,從這種間接轉移中獲得的收益可能要繳納中國企業所得税。在確定交易安排是否有“合理的商業目的”時,應考慮的因素包括:有關離岸企業權益的主要價值是否來自中華人民共和國的應税資產;有關離岸企業的資產是否主要包括在中國的直接或間接投資,或者其收入是否主要來自中國;其直接或間接持有中華人民共和國應税資產的子公司具有真實的商業性質,其實際職能和風險暴露;業務模式和組織結構的存在時間;中華人民共和國應税資產直接轉移交易的可複製性;以及此類間接轉移和適用的税務條約或類似安排的税務情況。2017年月17日,國家税務總局發佈了“關於非居民企業所得税代扣代繳問題的公告”(第37號公告),於2017年月1日生效。第37號公報進一步明確了非居民企業所得税預扣繳的做法和程序。
逾期支付適用税款將使轉讓人違約利息。投資者通過公開證券交易所出售股票所得的收益不受公告7規定的中國企業所得税的影響。公告7規定,這些股票是通過公開證券交易所在交易中獲得的。然而,在公開證券交易所以外的非中國居民企業出售我們的普通股,根據公告7可能要繳納中國企業所得税。
公報7的應用存在不確定性。第7號公告可由税務機關確定適用於出售涉及中華人民共和國應税資產的海外子公司或投資項目的股份。轉讓人和受讓方可能受到納税申報、預扣繳或納税義務的約束,而我們的中國子公司可能被要求協助申報。此外,我們,我們的非居民企業和中國子公司可能需要花費寶貴的資源來遵守公報7,或確定我們和我們的非居民企業不應根據公報7被徵税,因為我們以前和將來重組或處置我們的海外子公司的股份,這可能對我們的財務狀況和經營結果產生重大的不利影響。
根據公告7,中國税務機關有權根據轉讓的應納税資產的公允價值與投資成本之間的差額,對應納税資本收益進行調整。如果中國税務機關根據公告7/公告37對交易的應税收入進行調整,我們與這些潛在收購或處置有關的所得税成本將增加,這可能會對我們的財務狀況和經營結果產生不利影響。
對貨幣兑換的限制可能限制我們有效利用收入的能力。
中國政府對人民幣兑換外幣實行管制,在某些情況下,對人民幣匯出中國實行管制。我們未來的一部分收入可能以人民幣計價。外匯短缺可能會限制我們的中國子公司向我們的離岸實體匯出足夠的外幣,以便我們的離岸實體支付股息或支付其他款項,或以其他方式履行我們以外幣計價的債務。人民幣目前在“經常賬户”下可兑換,其中包括股息、貿易和與服務有關的外匯交易,但不包括“資本賬户”,其中包括外國直接投資和貸款,包括我們可以從在岸子公司獲得的貸款。目前,我國全資企業的中國子公司,可以不經國家外匯局批准,按照一定的程序要求,購買外幣結算“往來賬户交易”,包括向我們支付股息。但是,中國政府有關部門可能會限制或取消我們將來購買外幣進行經常賬户交易的能力。由於我們未來的部分收入可能以人民幣計價,任何現行和未來對貨幣兑換的限制都可能限制我們利用人民幣產生的收入為我們在中國以外的業務活動提供資金或向我們的股東(包括普通股股東)支付外幣股利的能力。資本項目下的外匯交易仍須受限制,並須經國家外匯局和其他有關政府機關批准或登記。這可能會影響我們通過債務或股權融資為子公司獲得外匯的能力。
51
目錄
最近圍繞在美上市的中國公司提起的訴訟和負面的宣傳,可能會導致監管機構對我們進行更嚴格的審查,並對我們普通股的交易價格產生負面影響,並可能對我們的業務產生重大不利影響,包括其運營結果、財務狀況、現金流和前景。
我們認為,在美國上市的在華運營的公司的訴訟和負面宣傳對這些公司的股價產生了負面影響。各種基於股權的研究機構在審查了它們的公司治理實踐、關聯方交易、銷售慣例和財務報表後,發表了關於中國公司的報告,這些報告導致了全國性交易所的特別調查和股票停牌。對我們的任何類似審查,不論其缺乏價值,都可能導致管理資源和精力的轉移,可能導致我們抵禦流言、股價下跌和波動的潛在成本,以及董事和高級官員的保險費增加,並可能對我們的業務產生重大的不利影響,包括業務結果、財務狀況、現金流和前景。
本年度報告所載的審計報告是由沒有經過上市公司會計監督委員會(PCAOB)全面檢查的審計師編寫的,因此,我們的股東被剝奪了這種檢查的好處。
作為在美國上市的公司和在PCAOB註冊的公司的審計師,根據美國法律,安永華明有限責任公司必須接受PCAOB的定期檢查。然而,由於我們在中國境內有大量業務,而PCAOB目前無法在未經中國政府當局批准的情況下進行檢查,因此,我們的審計師及其審計工作目前沒有得到PCAOB的全面檢查。
PCAOB在中國境外對其他審計師進行的檢查有時會發現這些審計師的審計程序和質量控制程序中的缺陷,這些缺陷可以作為提高未來審計質量的檢查過程的一部分加以解決。由於缺乏對中國審計工作的PCAOB檢查,PCAOB無法定期評估我國審計人員的審計及其質量控制程序。因此,股東可能被剝奪了PCAOB檢查的好處,並可能對我們報告的財務信息和程序以及財務報表的質量失去信心。
美國證交會對包括我們獨立註冊的公共會計師事務所在內的五家中國會計師事務所提起的訴訟,可能導致我們的財務報表被認定不符合“外匯法”的要求。
2012年12月,美國證交會對中國五家會計師事務所提起行政訴訟,其中包括我們的獨立註冊會計師事務所,指控它們拒絕出示與美國證交會調查的其他中國公司有關的審計工作文件和其他文件。2014年月22日,美國頒佈了一項最初的行政法決定,譴責這些會計師事務所,並將其中四家公司暫停在證交會前執業6個月。這一決定既不是最終的,也不是法律上有效的,除非和直到得到SEC的審查和批准。2014年2月12日,四家總部位於中國的會計師事務所向美國證交會提出上訴,反對這一決定。今年2月,包括我們獨立註冊的會計師事務所在內的四家中國會計師事務所都同意對證交會進行譴責,並向美國證交會支付罰款,以解決糾紛,避免暫停其在證交會的執業能力。這些公司繼續為各自客户提供服務的能力不受和解的影響。和解要求這些公司遵循詳細的程序,以便通過中國證監會(CSRC)向SEC提供獲得中國公司審計文件的權限。如果這些公司不遵守這些程序,美國證交會可以處以停職等處罰,也可以重啟行政訴訟。和解不要求這些公司承認任何違法行為,並在重新啟動行政訴訟時保留這些公司的法律辯護。如果SEC根據最終結果重新啟動行政訴訟,在中國有重大業務的美國上市公司可能會發現很難或不可能保留其在華業務的審計師,這可能導致財務報表被認定不符合“外匯法”的要求,包括可能的退市。此外,對這些審計公司提起訴訟的任何負面消息都可能導致投資者對中國、美國上市公司的不確定性,以及我們普通股的市場價格可能受到不利影響。
52
目錄
如果我們的獨立註冊會計師事務所被剝奪了在證券交易委員會面前執業的能力,而我們又無法及時找到另一家註冊會計師事務所對我們的財務報表進行審計和發表意見,我們的財務報表就可能被認定不符合“交易所法”的要求。Such a determination could ultimately lead to delisting of our ordinary shares from the NASDAQ Capital Market or deregistration from the SEC, or both, which would substantially reduce or effectively terminate the trading of our ordinary shares in the U.S. Moreover, any negative news about the proceedings against these audit firms may adversely affect investor confidence in companies with substantial mainland China-based operations listed in the U.S. All these would 對我們普通股的市場價格產生了實質性的不利影響,並大大減少或有效地終止了我們在美國的普通股交易。
與普通股有關的風險
我們普通股的交易價格可能會波動,這可能會給你帶來巨大的損失。
我們的普通股的交易價格可能會波動不定,並且會受到多種因素的影響,其中許多因素是我們無法控制的。此外,其他在美國上市的業務主要在中國經營的公司的市場價格的表現和波動,可能會影響我們普通股的價格和成交量的波動。其中一些公司經歷了巨大的波動,包括在首次公開發行(IPO)後價格大幅下跌。這些中國公司的證券在上市時或發行後的交易表現,可能會影響投資者對在美上市的其他中國公司的整體情緒,從而影響我們普通股的交易表現。
除了市場和行業因素外,由於特定的業務原因,我們普通股的價格和成交量可能高度波動,包括:
| · |
監管批准公告或完整的回覆信,或特定的標籤標誌或使用的病人羣體,或監管審查過程中的變更或延誤;
|
| · |
由我們或我們的競爭對手宣佈治療創新或新產品;
|
| · |
監管機構對我們的臨牀試驗、製造供應鏈或銷售和營銷活動採取的不利行動;
|
| · |
對我們與製造商或供應商關係的任何不利變化;
|
| · |
我們的測試和臨牀試驗的結果;
|
| · |
我們努力獲得或許可更多產品候選人的結果;
|
| · |
與我們現有的產品候選或臨牀前研究和臨牀開發計劃相關的費用水平的變化;
|
| · |
任何我們可能捲入的知識產權侵權行為;
|
| · |
有關競爭對手或整個製藥業的公告;
|
53
目錄
| · |
實現預期的產品銷售和盈利能力;
|
| · |
製造、供應或分銷短缺;
|
| · |
操作結果的變化;
|
| · |
公佈的業績與分析師預期不符;
|
| · |
第三方,包括政府統計機構公佈與行業或金融分析師預期不同的運營或行業指標;
|
| · |
證券研究分析師的研究報告和財務估計變化;
|
| · |
我們或我們的競爭對手宣佈新產品和服務的提供、收購、戰略關係、合資企業或資本承諾;
|
| · |
關於我們業務的新聞報道,不論是否屬實;
|
| · |
增加或離開我們的管理層;
|
| · |
人民幣對美元匯率的波動;
|
| · |
釋放或終止對我們已發行普通股的鎖存或其他轉讓限制;
|
| · |
出售或認為可能出售額外普通股;
|
| · |
未來由我們、執行主管、董事或股東出售我們的普通股;
|
| · |
美國股市總體經濟和市場狀況及整體波動;
|
| · |
會計原則的變化;以及
|
| · |
中國或全球監管環境的變化或發展。
|
這些因素中的任何一個都可能導致我們普通股的交易量和交易價格發生巨大而突然的變化。在過去,隨着公司證券市場價格的波動,股東經常對該公司提起證券集體訴訟。如果我們參與集體訴訟,可能會轉移管理層的注意力,如果我們作出不利的決定,會對我們的財務狀況和業務結果產生重大的不利影響。
此外,股票市場以及小型製藥和生物技術公司的價格和數量波動往往與這些公司的經營業績無關或不成比例。廣泛的市場和行業因素可能會對我們普通股的市場價格產生負面影響,而不管我們的實際經營業績如何。此外,與我們無法控制的金融市場有關的因素可能會導致我們的普通股價格迅速而出人意料地下跌。
在公開市場上出售或出售大量普通股可能導致普通股價格大幅下跌。
在公開市場上出售普通股或其他股票證券,或認為這些出售可能發生,可能導致我們普通股的市場價格大幅下跌。截至2018年月26,我們共有22,455,702股普通股上市。Among these shares, 174,286 ordinary shares have been registered under the Securities Act of 1933, as amended, or the Securities Act, and are freely transferable by persons other than our “affiliates” without restriction or registration; the remaining shares outstanding have not been registered under the Securities Act and may be offered or sold only pursuant to an effective registration statement or pursuant to an available exemption from the registration requirements.如果這些股票被出售,或者被認為會在公開市場上出售,我們的普通股的交易價格可能會下降。
54
目錄
我們的普通股持有人Nereus Trust有權使我們根據“證券法”登記出售其股票。根據“證券法”進行這些股份的登記,將導致代表這些股份的普通股在登記生效後立即根據“證券法”不受限制地自由流通。在公開市場上出售這些註冊股票可能會導致我們的普通股價格大幅下跌。
由於我們不期望在可預見的將來分紅,你必須依靠普通股的價格升值來獲得投資回報。
我們打算保留大部分(如果不是全部)可動用的資金和收入,以資助我們業務的發展和發展。因此,我們不指望在可預見的將來支付任何現金股利。因此,你不應該依賴對普通股的投資作為未來股息收入的來源。
我們的董事會對於是否分配股息有很大的酌處權。股東可以通過普通決議宣佈股利,但股利不得超過董事會建議的數額。Even if our board of directors decides to declare and pay dividends, the timing, amount and form of future dividends, if any, will depend on, among other things, our future results of operations and cash flow, our capital requirements and surplus, the amount of distributions, if any, received by us from our subsidiaries, our financial condition, contractual restrictions and other factors deemed relevant by our board of directors.因此,你對我們普通股的投資回報很可能完全取決於普通股未來的任何價格升值。我們的普通股可能不會升值,甚至不會維持你購買普通股的價格。你可能沒有意識到你投資普通股的回報,甚至可能會失去你對普通股的全部投資。
我們是開曼羣島的公司。由於開曼羣島法律對股東權利的司法先例比美國法律對股東權利的限制更大,股東享有的股東權利可能比美國法律下的股東權利更少。
我們的公司事務受我們修訂和重申的章程大綱和章程(可能不時修訂)、開曼羣島公司法(經修正)和開曼羣島普通法管轄。股東對董事提起訴訟的權利、小股東的訴訟和我國董事的信託責任在很大程度上受開曼羣島普通法的制約。這一普通法部分來源於開曼羣島相對有限的司法先例以及英國普通法,英國普通法對開曼羣島法院具有説服力,但不具約束力。The rights of our shareholders and the fiduciary responsibilities of our directors under Cayman Islands law are not as clearly established as they would be under statutes or judicial precedent in some jurisdictions in the U.S. In particular, the Cayman Islands has a less developed body of securities law than the U.S. In addition, some states in the U.S., such as Delaware, have more fully developed and judicially interpreted bodies of corporate law than the Cayman Islands.
此外,由於開曼羣島豁免公司的股東,根據開曼羣島法律,我們的股東沒有檢查公司記錄和帳目或獲得我們的成員登記冊副本的一般權利,但股東可以要求我們修訂和重述的章程大綱和章程的副本。根據我們修訂和重述的公司章程,我們的董事可酌情決定我們的公司紀錄是否或在甚麼條件下可由股東查閲,但無須向股東提供。這可能使你更難以獲得必要的信息,以確定任何必要的事實,為股東的動議,或徵集代理人從其他股東與代理競爭。作為一家被豁免的開曼羣島公司,我們可能沒有資格在美國聯邦法院提起衍生訴訟。因此,如果你受到傷害,你可能會受到限制,如果你受到傷害,你就可以在美國聯邦法院提起訴訟。此外,開曼羣島公司的股東可能沒有資格在美國聯邦法院提起股東派生訴訟。
55
目錄
因此,面對管理層、董事會成員或控股股東所採取的行動,公眾股東可能比作為美國公司的公眾股東更難保護他們的利益。
你可能在保護你的利益方面遇到困難,你通過美國聯邦法院保護你的權利的能力可能受到限制,因為我們是根據開曼羣島的法律註冊的,我們的一些董事居住在美國以外的地方。
我們在開曼羣島註冊。我們的一些董事居住在美國境外,他們的大部分資產位於美國境外。因此,如果你認為你的權利根據美國證券法或其他法律受到侵犯,你可能很難或不可能對我們或開曼羣島或中國的這些人提起訴訟。即使你成功地提出這類訴訟,開曼羣島和中國的法律也可能使你無法執行對我們的資產或我們董事和高級官員資產的判決。開曼羣島對在美國或中國獲得的判決沒有法定承認,儘管開曼羣島法院一般承認並執行具有管轄權的外國法院的一項外國貨幣判決,而不重新審查所涉爭議的是非曲直,條件是(I)這種判決規定判定債務人有義務支付判決所涉的已清償金額(2)是最終的;(3)不是關於税收、罰款或罰款的;和(4)不是以違反自然公正或開曼羣島公共政策的方式獲得的,也不是違背開曼羣島公共政策的那種。
我們的公司行為基本上由我們的董事、執行官員和其他主要股東控制,他們可以對重要的公司事務施加重大影響,這可能會降低我們普通股的價格,並剝奪你獲得普通股溢價的機會。
截至2018年月26,我們的董事、執行官員和主要股東有權受益地擁有我們流通股的88.94%。我們的首席執行官藍黃,我們的大股東林青佳,以及我們的少數股東董亮,也是我們目前不擁有的萬春布林40%股權的實益股東。這些股東如果共同行動,可以對選舉董事和批准重大合併、收購或其他企業合併交易等事項施加重大影響。這種所有權的集中也可能阻止、拖延或阻止對我們公司控制權的改變,這可能會造成雙重影響,即剝奪我們的股東在出售我們公司的過程中獲得溢價的機會,以及降低我們普通股的價格。即使我們的其他股東,包括我們普通股的股東反對這些行動,也可以採取這些行動。此外,這些人可能會將商業機會從我們身上轉移到自己或其他人身上。
我們由於作為一家上市公司而增加了成本,我們的管理層需要投入大量時間用於新的合規計劃和公司治理實踐。
作為一家上市公司,我們承擔了大量的法律、會計和其他費用。“薩班斯-奧克斯利法案”、“多德-弗蘭克華爾街改革和消費者保護法”、納斯達克資本市場的上市要求以及其他適用的證券規則和條例對上市公司規定了各種要求,包括建立和維持有效的披露、財務控制和公司治理做法。我們的管理人員和其他人員花了大量時間在這些遵守規定的倡議上。
根據薩班斯-奧克斯利法案第404條,我們必須提供一份報告,説明我們對2017年底財務報告的內部控制。不過,雖然我們仍是一間新興的成長型公司,但我們毋須包括一份由獨立註冊會計師事務所發出的財務報告內部控制核證報告。為了遵守“薩班斯-奧克斯利法案”第404條的規定,我們參與了一個記錄和評估我們對財務報告的內部控制的過程,這既昂貴又具有挑戰性。在這方面,我們繼續投入內部資源,可能聘請外部諮詢人,並通過一項詳細的工作計劃,以評估和記錄對財務報告的內部控制是否充分,繼續採取步驟酌情改進控制程序,通過測試確認控制是否如文件所示,併為財務報告的內部控制實施持續的報告和改進程序。儘管我們作出了努力,但我們可能無法在規定的時限內或根本無法得出結論,即我們對財務報告的內部控制按照“薩班斯-奧克斯利法”第404條的要求是有效的。如果我們發現一個或多個重大弱點,就可能導致金融市場因對財務報表的可靠性失去信心而產生不利反應。
56
目錄
我們是一家“新興成長型公司”,我們正在利用適用於新興成長型公司的較低的披露要求,這可能會使我們的普通股對投資者的吸引力降低。
We are an “emerging growth company,” as defined in the JOBS Act, and we intend to take advantage of certain exemptions from various reporting requirements that are applicable to other public companies that are not “emerging growth companies” including not being required to comply with the auditor attestation requirements of Section 404(b) of the Sarbanes-Oxley Act, and exemptions from the requirements of holding a 非約束性的諮詢表決關於高管薪酬和股東批准任何金降落傘付款之前未獲批准。我們無法預測投資者是否會發現我們的普通股吸引力會降低,因為我們可能會依賴這些豁免。如果一些投資者覺得我們的普通股吸引力較低,我們的普通股可能會出現一個較不活躍的交易市場,而我們的普通股的價格可能會更不穩定。我們可以利用這些報告豁免,直到我們不再是一個新興的增長公司。We will remain an emerging growth company until the earliest of (1) the last day of the fiscal year in which we have a total annual gross revenue of $1.0 billion or more; (2) the last day of our fiscal year following the fifth anniversary of March 14, 2017; (3) the date on which we have issued more than $1.0 billion in nonconvertible debt during the previous three years; and (4)根據證券交易委員會的規則,我們被視為一名大型加速提交人的日期。
作為一家外國私人發行商,美國證券法規定我們不受多項規則的約束,並且允許我們向美國證券交易委員會提交比美國公司少的信息。這可能會限制我們的普通股持有者所能獲得的信息。
We are a “foreign private issuer,” as defined in the SEC’s rules and regulations and, consequently, we are not subject to all of the disclosure requirements applicable to public companies organized within the U.S. For example, we are exempt from certain rules under the Exchange Act, that regulate disclosure obligations and procedural requirements related to the solicitation of proxies, consents or authorizations applicable to a 根據“外匯法”註冊的證券,包括“外匯法”第14條規定的美國代理規則。此外,我們的官員和董事不受“交易法”第16條以及有關他們購買和出售證券的相關規則的報告和“短期波動”利潤回收規定的約束。此外,雖然我們打算每季度自願報告我們的經營結果,但我們將不必像美國國內發行人那樣頻繁或迅速地向證券交易委員會提交定期報告和財務報表,也不需要根據“交易所法”就表格10-Q或目前的表格8-K提交季度報告。因此,與我們不是外國私人發行者相比,公開獲得的有關我們公司的信息將會減少。
作為一家外國私人發行商,我們獲準在公司治理事項上採用某些母國做法,這些做法與納斯達克資本市場(NASDAQ)資本市場公司治理上市標準有很大不同。這些做法對股東的保護可能不如我們完全遵守公司治理上市標準時所享有的保護。
作為在納斯達克資本市場上市的外國私人發行者,我們將遵循公司治理上市標準。然而,規則允許像我們這樣的外國私人發行者遵循其本國的公司治理做法。開曼羣島是我們的母國,其某些公司治理做法可能與公司治理上市標準大不相同。目前,我們打算充分遵守納斯達克資本市場公司治理上市標準。但是,我們今後可能會選擇遵循某些母國的做法。因此,根據適用於美國國內發行人的公司治理上市標準,我們的股東可能得到的保護可能比其他公司要少。
57
目錄
我們將來可能會失去外國私人發行機構的地位,這可能會導致大量的額外費用和開支。
雖然我們目前符合外國私人發行者的資格,但外國私人發行者的地位每年在發行人最近一次完成的第二財季的最後一個營業日確定,因此,下一次決定將於2018年月30對我們作出。
將來,如果我們不符合在有關確定日期維持我國外國私人發行人地位所必需的條件,我們將失去我們的外國私人發行人地位。例如,如果我們50%以上的證券是由美國居民持有,超過50%的管理層成員或董事會成員是美國的居民或公民,我們就可能失去我們的外國私人發行者的地位。
根據美國證券法,作為美國國內發行人,我們的監管和合規成本可能遠遠高於我們作為外國私人發行者所承擔的成本。如果我們不是外國私人發行者,我們將被要求定期向美國證券交易委員會提交關於美國國內發行者表格的報告和登記報表,這些報告和登記報表在某些方面比外國私人發行者的表格更詳細和更廣泛。我們將被要求修改我們的某些政策,以符合與美國國內發行人相關的公司治理實踐。此外,我們可能會失去能力,無法依賴外國私人發行商可以在美國證券交易所獲得的某些公司治理要求的豁免,例如免除與徵求委託書有關的程序要求。
我們可能面臨更多的證券集體訴訟的風險。
從歷史上看,證券集體訴訟往往是在證券市場價格下跌後對一家公司提起的。這種風險對我們來説尤其重要,因為生物技術和生物製藥公司近年來經歷了股價的大幅波動。如果我們被起訴,可能會導致大量費用,轉移管理層的注意力和資源,從而損害我們的業務。
很可能我們會被歸類為被動的外國投資公司,或者PFIC,這可能會給美國的股東帶來不利的美國聯邦所得税後果。
一般來説,如果在任何應税年度,75%或以上的總收入是被動收入,或者至少50%的資產是用於生產或生產被動收入,我們將被定性為聯邦所得税的PFIC。在任何應税年度,我們都可被視為PFIC。如果我們被定性為PFIC,我們的美國股東可能會遭受不利的税收後果,包括將出售普通股實現的收益視為普通收入,而不是資本收益,損失適用於美國股東個人在我們普通股上收取的股息的優惠利率,並對我們分配的股票和出售我們股票的收益收取利息。有關美國税收影響的進一步信息,見“第10項”。附加信息--E.税收--美國聯邦所得税方面的考慮。“
美國國税局(IRS)可能不同意這樣的結論,即就美國聯邦所得税而言,我們不應被視為美國公司。
根據現行的美國聯邦所得税法,公司通常被認為是其組織或公司管轄範圍內的税務居民。因此,作為根據開曼羣島法律組建的公司,就美國聯邦所得税而言,我們一般應被歸類為非美國公司(因此也是非美國税務居民)。然而,在某些情況下,“1986國税法”第7874節或“守則”可能導致在美國以外組織的公司被視為美國公司(因此也是美國税務居民),除非適用一種或多種例外情況。
在2015,我們完成了我們的內部重組。關於內部結構調整的更多信息,見本年度報告其他部分所載我們合併財務報表的附註1。作為內部重組的一部分,我們執行了涉及“代碼”第7874節的某些事務。儘管如此,根據適用於2015年月日發生的交易的規則,我們認為,內部重組符合某些例外情況,這些例外情況妨礙了“守則”第7874條的適用,因此,我們不期望在美國聯邦所得税方面被視為一家美國公司。關於更詳細的討論,見“項目10”。附加信息-E.税收--美國聯邦所得税考慮--BeyondSpring公司為美國聯邦所得税目的而設的納税住所。“
58
目錄
儘管如此,“守則”第7874條的適用及其各種例外情況仍然很複雜,而且在事實和法律上也存在不確定性。此外,對該法第7874條或根據該法頒佈的美國財政部條例(或美國聯邦所得税法的其他相關規定)的修改可能具有前瞻性或追溯效力,可能會對我們的結論產生不利影響,即就美國聯邦所得税而言,我們不應被視為美國公司。因此,美國國税局可能不同意這樣的立場,即就美國聯邦所得税而言,我們不應被視為美國公司。如果美國國税局認為內部重組不符合適用“準則”第7874條的任何例外條件,而且內部重組受“守則”第7874條的約束,我們就可以被視為美國聯邦所得税的一家公司。
如果為了美國聯邦所得税的目的,我們被視為一家美國公司,我們將對我們的全球收入徵收美國公司所得税,我們的非美國子公司的收入在匯回美國時將被徵收美國税(這類收入的外國來源部分可以扣除),或者根據美國聯邦所得税規則對受控制的外國子公司予以承認。此外,我們的非美國子公司的任何遞延外國收入,如在2017或12月31日(以數額較大者為準)確定以前不受美國徵税,將受到税收改革法或減税和就業法案規定的“過渡税”的影響。此外,我們向非美國股東支付的股息總額將按30%的税率徵收美國代扣税,除非該非美國股東有資格根據適用的所得税條約獲得豁免或扣減扣繳利率。
關於內部結構調整和守則第7874節的適用的更詳細的討論,見“項目10”。附加信息-E.税收--美國聯邦所得税考慮--BeyondSpring公司為美國聯邦所得税目的而設的納税住所。“
| 項目4. |
有關該公司的資料
|
| A. |
公司的歷史與發展
|
BeyondSpringInc.於2014年月21日根據開曼羣島的法律註冊為一家豁免公司。在2015,我們完成了我們的內部重組。關於內部結構調整的更多信息,見本年度報告其他部分所載我們合併財務報表的附註1。
我們的主要行政辦公室位於紐約自由街28號,紐約,紐約,10005,電話號碼是+1(646)305-#number1#。我們在開曼羣島的註冊辦事處位於塞圖斯公司(開曼)有限公司、塞圖斯商會、總督廣場、5號-204號套房、石灰樹灣大道23號、大開曼島P.O.方框2547、開曼羣島KY1-#number1#號。我公司在美國的代理業務是位於紐約第八大道111號的CT公司系統,紐約,10011。我們的網站是www.beiondSpringpharma.com。本網站所載或可透過本網站查閲的資料,並不構成本年度報告的一部分,亦不包括在此參考資料內。
首次公開募股與兼營私募
2017年3月,我們完成了首次公開發行(IPO)和同時私人配售,在扣除承銷折扣和佣金、手續費和費用後,我們在首次公開發行(IPO)中出售了174,286股普通股,並出售了2,541,048股普通股,淨收入為4,720萬美元。我們的普通股在納斯達克資本市場上市,代號為“BYSI”。
59
目錄
| B. |
業務概況
|
概述
我們是一家全球性的臨牀階段生物製藥公司,專注於創新癌症療法的開發和商業化。在晚期臨牀試驗中,我們的領先資產Plinbulin正在進行研究,因為它在預防CIN方面有潛在的益處,並與多西他賽聯合用於晚期非小細胞肺癌(NSCLC)。我們還在結合各種免疫腫瘤學指徵,研究Plinabin的治療潛力。目前,一種適應症是在兩期1/2臨牀試驗中結合免疫腫瘤學藥物nivolumab進行Plinabin的臨牀試驗。我們還預計兩名研究人員在2018開始試驗,一個結合pd-1和ctla-4抗體作為小細胞肺癌的一種治療方法,另一種是與彭溴利祖單抗和鉑類化療藥物聯合作為非小細胞肺癌的一線治療方法。我們在除中國以外的所有國家擁有普林布林的全球權益,在中國,我們擁有中國國有子公司萬春寶林60%的股權,該公司擁有普林布林100%的股權。
普林布林是一種海洋衍生的小分子,具有許多獨特的生物活性,可能提供多種治療機會。在臨牀前的研究中,Plinbulin增加了中性粒細胞的存活,中性粒細胞是一種在預防細菌感染中非常重要的白細胞。在163例晚期非小細胞肺癌患者的1/2期臨牀試驗的第2階段,或研究101中,在標準的多西紫杉醇(一種常用的化療類型)方案中加入Plinbulin,可使3級和4級中性粒細胞減少,這是一種異常低血中性粒細胞濃度的疾病。CIN是癌症患者發病和死亡的一個重要原因,現有療法在2016年度全球銷售額超過81億美元,但由於副作用和化療後至少24小時使用這些藥物的要求而受到限制。我們相信,普林布林的臨牀概況,如其潛在的低骨痛和抗癌效應,以及它在化療後30分鐘至1小時(保留中性粒細胞)的能力,可能使它成為治療CIN的一種有吸引力的替代療法。
作為CIN註冊計劃的一部分,我們在兩期2/3期臨牀試驗中研究了多西他賽減少CIN中間危險化療(研究105),減少非小細胞肺癌(NSCLC)、乳腺癌和前列腺癌患者的CIN高危化療,以及降低乳腺癌患者TAC的CIN高危化療(研究106)。在第二階段的研究105中,55例非小細胞肺癌患者在多西紫杉醇治療30分鐘後接受了一次劑量的普林布林治療。研究105第2階段的結果確定了試驗第3階段的推薦劑量。我們計劃將大約150個非小細胞肺癌、乳腺癌或前列腺癌患者納入105個計劃的第3階段,並計劃在第106號研究的第2階段吸收約60個患者,預計將於2018年底完成。
我們還認為Plinbulin具有直接的抗腫瘤作用。在研究101的第二階段,在標準的多西紫杉醇治療方案中加入普林布林比多西紫杉醇單藥治療可測量肺部病變的患者的抗腫瘤活性提高。2016,我們在美國、中國和澳大利亞啟動了研究103號,將普林布林與多西紫杉醇聯合應用於晚期非小細胞肺癌患者。我們預計這項試驗的146個病人的死亡事件的總體生存的主要終點的臨時數據將在2018或2019年初第四季度獲得,而最終數據將在2020。在本試驗中,我們還評估了138名處於第4級中性粒細胞減少終點的患者,並證明瞭普林布林降低非小細胞肺癌患者多西紫杉醇4級中性粒細胞減少的能力(p
在我們的三項臨牀試驗(研究105、研究106和研究103)取得積極結果之前,我們希望在2018年底或前半段2019 for Plinabulin for two separate indications. The first is for the reduction of CIN in patients undergoing chemotherapy treatment for solid tumor and hematological cancers and the second is for Plinabulin in combination with docetaxel for second and third line treatment of NSCLC. Based on our previous discussions with the FDA, after finalization of all three clinical trials, which is expected in 2019 for CIN and 2020 對於非小細胞肺癌,如果取得了積極的結果,我們打算在美國提交NDAs的CIN在2019和非小細胞肺癌的治療在2020。
我們有一個新的,高度可擴展的商業模式,整合美國和中國的臨牀資源。我們相信,我們在美中兩國的雙重發展戰略已經並將繼續提供重大優勢,包括在中國進行試驗的能力,這可能導致更快的招生、降低成本、加快審批進程以及進入中國快速增長的癌症市場。我們的藥物開發能力得益於美國臨牀研究人員的強烈興趣,以及我們對中國醫藥行業、臨牀資源和監管體系的瞭解。
60
目錄
我們的主要執行辦公室設在紐約,我們還在中國大連設有辦事處,大連是製藥公司的中心。我們在開曼羣島註冊。我們的管理團隊在生物學、化學、藥物發現、臨牀開發和管理事務方面都有豐富的經驗和能力。我們從Nereus獲得了普林布林的全部全球權利,包括其第二階段臨牀試驗數據,目前在除中國以外的所有國家擁有全球權利,在中國,我們通過我們的中國子公司Wanchun Bulin擁有60%的權益。
CIN中的Plinbulin
中性粒細胞減少是一種異常低濃度的中性粒細胞,是一種白細胞,可由骨髓中白細胞的異常破壞率或較低的合成率所致。中性粒細胞減少是根據其嚴重程度來分級的,這通常取決於中性粒細胞的計數。低於500細胞/mm3(0.5×109/L)的絕對中性粒細胞計數屬於4級中性粒細胞減少,而中性粒細胞計數在500至1 000細胞/mm3之間(0.5-1.0 x 109/L)屬於3級中性粒細胞減少。中性粒細胞計數低的患者更容易受到細菌感染,細菌感染是癌症患者發病和死亡的重要原因。每年有60,000多名患者因發燒引起的中性粒細胞減少而住院。死亡率在9%~18%之間。
中性粒細胞減少是大多數化療的關鍵限制,包括多西他賽。多西他賽是一種最廣泛的化療藥物,在美國已被批准用於非小細胞肺癌、頭頸癌、胃癌、乳腺癌和前列腺癌。多西他賽有副作用,包括噁心、嘔吐、疲勞、虛弱、氣短和中性粒細胞減少。目前治療中性粒細胞減少的標準是基於G-CSF的生物藥物。G-CSF是一種促進中性粒細胞增殖、分化和成熟的生長因子,最早於20世紀90年代初被批准。While G-CSF reduces the duration of grade 4 neutropenia, or DSN, it cannot be given on the same day as chemotherapy and the expansion of bone marrow generated by G-CSF causes bone pain in 10 to 29% of patients. This bone pain causes some patients to discontinue treatment. While annual worldwide sales of G-CSF based drugs exceeded $8.1 billion in 2016, they are only used to treat approximately 20%的高危化療患者由於安全問題和化療後至少24小時的要求,這給患者和醫生帶來了極大的不便。我們相信,普林布林的臨牀概況,如其潛在的低骨痛,化療後30分鐘至1小時(保留中性粒細胞)的能力,以及其潛在的抗癌效果,可能使其成為治療CIN的一種有吸引力的替代療法。
In the Phase 2 portion of Study 101, the addition of Plinabulin to a standard regimen of docetaxel resulted in a statistically significant reduction in the incidence of grade 3 and 4 neutropenia adverse events from 26% of patients in the docetaxel monotherapy arm to 7% in the Plinabulin plus docetaxel arm based upon a retrospective analysis of the data.
根據在研究101中觀察到的臨牀概況和我們與FDA討論的結果,我們改進了我們在CIN中的兩階段2/3試驗的設計。第一個試驗,研究105,是在美國、中國、俄羅斯、匈牙利和烏克蘭的200例晚期乳腺癌、激素難治性前列腺癌和晚期非小細胞肺癌患者中聯合多西紫杉醇標準方案的第2/3階段試驗。本試驗的主要終點是在第一個化療週期中DSN的非劣性,與治療標準相比,佩格菲拉斯蒂姆是一種長期作用形式的G-CSF,通常與化療聯合使用,以減少中性粒細胞減少。DSN代表患者患上4級中性粒細胞減少(白細胞計數很低)的天數,或患者由於白細胞較低而住院的天數。臨牀上有意義的DSN少於一天,或者在醫院不到一天。我們完成了55名晚期非小細胞肺癌患者參加研究105的第二階段研究,其中大約150名晚期非小細胞肺癌、乳腺癌或前列腺癌患者將於2018被納入研究的第3階段。在2018月份,我們宣佈普林布林在研究105的第2階段被證明可以預防CIN,在此部分,這些患者在多西紫杉醇治療後30分鐘接受了一劑量的Plinbulin治療。These results established the recommended dose of 20 mg/m2 for the Phase 3 portion of the trial based on a clear dose response in grade 4 neutropenia incidence and the DSN seen in the Phase 2 portion. As agreed upon with the FDA, the trial has a pre-specified DSN non-inferiority margin of 0.65 days, to show non-inferiority in neutropenia prevention for Plinabulin as compared to pegfilgrastim, or Neulasta.因此,如果研究105的第三階段表明,接受普林布林治療的患者的DSN與用Neulasta治療的患者相比有0.65天的差異(或小於或大於),則有p值
。
61
目錄
如果沒有中性粒細胞減少症的預防,DSN超過一天,如研究105的第二階段所示,將DSN減少到0.38天是有臨牀意義的。研究105中評估的次要終點之一是骨痛的減少。骨痛是這個病人的一個重要問題,導致許多病人停止治療。
The second trial, Study 106, is a Phase 2/3 trial of Plinabulin in combination with a myelosuppressive chemotherapeutic regimen composed of three agents, Taxotere (docetaxel), Adriamycin (doxorubicin) and Cytoxan (cyclophosphamide), or TAC, in approximately 200 patients in the U.S., China, Russia, Hungary and the Ukraine with solid tumors.本試驗的設計與研究105基本相似。然而,這項試驗是為了衡量比紐拉斯塔更優越。我們計劃在研究106的第二階段中招募60名患者,並在試驗的第3階段中招募大約120名患者。我們期望在2018年底的試驗的第二階段的結果和2019的試驗的第三階段的最後結果。
Dr. Douglas Blayney of Stanford University, a founding and former member of the National Comprehensive Cancer Network, or NCCN, contributor to the NCCN guidelines for neutropenia management and former member of the FDA’s Oncologic Drugs Advisory Committee (ODAC), is our principal investigator for both Study 105 and Study 106. The two trials are designed to demonstrate that treatment with Plinabulin on the first day after chemotherapy compared 化療後第二天用Neulasta治療,可使患者在減少4級中性粒細胞減少骨痛方面有類似或更好的療效。
在我們正在進行的NSCLC第三階段試驗中,研究103,我們也正在評估Plinabin降低CIN的能力。在研究103中,我們評估了138例4級中性粒細胞減少的次級終點患者,顯示了普林布林降低非小細胞肺癌患者多西紫杉醇黴素的能力(p
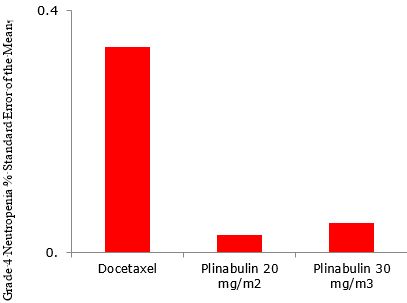
根據我們與中國監管部門的討論,我們認為我們的治療CIN的普林布林註冊程序符合根據臨牀療效趨勢數據加速批准一種新的危及生命的疾病藥物的標準。到目前為止,300多名服用Plinbulin的癌症患者表現出陽性耐受性,符合CFDA的安全數據庫標準。我們相信,研究105個階段的中期數據和預期在2018年底進行的第106個階段第2階段數據的有效性數據,如果是肯定的,將足以證明對這一趨勢的要求,因此我們預計將在2018年底或2019年初在中國提交一份關於CIN的NDA。我們預計我們將在大約6個月後在中國獲得批准。鑑於CIN的嚴重臨牀需求未得到滿足,以及Plinabin有資格加速審查2017年度授予我們的首席執行官和創始人黃博士的“千名天才創新者”獎,或2017年度創新獎。如果105號和106號研究的最終結果為陽性,我們預計將在2019年底在美國為治療CIN而提交一份普林布林的NDA。
Plinbulin在晚期非小細胞肺癌中的應用
根據美國國家癌症研究所的數據,美國每年大約有22萬名肺癌患者被診斷為肺癌。肺癌患者預後差,5年生存率僅為17.7%.肺癌是美國癌症死亡的主要原因,每年約有180萬例病例被診斷為全球性的健康問題。全世界大約三分之一的肺癌患者在中國,2015年間,中國診斷出肺癌病例約70萬例。根據腫瘤細胞的組織學表現,這些肺癌通常分為兩組:小細胞肺癌和非小細胞肺癌,兩組採用不同的化療方法。非小細胞肺癌約佔肺癌病例的87%。
62
目錄
研究101第二階段的數據表明,與單藥多西紫杉醇相比,在標準的多西紫杉醇方案中加入普林布林可提高抗腫瘤活性。特別是,38例可測量肺部病變的患者中,給予多西紫杉醇聯合30 mg/m2普林布林治療的患者中位生存期為11.3個月,而單用多西紫杉醇治療的38例可測量肺部病變患者的中位生存期為6.7個月。此外,普林布林加多西紫杉醇組有客觀的有效率,是衡量腫瘤縮小患者比例的至少30%,為18.4%,而多西紫杉醇單治組為10.5%。接受普林布林加多西他賽治療的患者的療效持續時間為12.7個月,而僅接受多西他賽單藥治療的患者為1個月。
雖然子集中的患者數量不足以顯示統計學意義,但我們和我們的臨牀合作者認為,與多西紫杉醇單藥治療相比,在標準的多西紫杉醇方案中加入普林布林可能會在臨牀上提供有意義的抗腫瘤活性增加。
在2016,我們在美國、中國和澳大利亞啟動了一項554名患者的3期試驗,聯合多西他賽治療具有可測量肺部病變的晚期非小細胞肺癌患者,或研究103。與單用多西紫杉醇相比,主要終點是聯合使用普林布林和多西紫杉醇的患者的總體生存率。次要終點包括中性粒細胞減少的頻率和嚴重程度、反應持續時間、生活質量、有效率和無進展生存率。截至這份表格20-F的年度報告之日,我們已登記了230多名患者,並期望在2018或2019年初的第四季度可獲得146個患者死亡事件總體生存的初步結果,2020年度所有患者的死亡事件的最終結果為438人。
根據我們與中國監管部門的討論,我們認為研究103符合根據趨勢數據加速批准一種威脅生命的疾病新藥的標準,並認為2018或2019年初的非小細胞肺癌中期療效數據如果為陽性,將足以證明對這一趨勢的要求。在2019上半年在中國提交一份NDA。考慮到NSCLC嚴重的臨牀需求和普林布林的資格,我們預計在提交6個月後我們將在中國獲得批准。基於收到2017年度創新獎的加速審查。如果來自103號研究的最終數據是肯定的,我們打算在美國提交一份2020年度第二或第三行非小細胞肺癌治療方案。
普林布林聯合免疫腫瘤學制劑
臨牀前的研究已經確定了一些新的和耐人尋味的活動與刺激免疫系統相一致的普林布林的能力,以提高其他免疫腫瘤學藥物的活性。我們在這些臨牀前的研究中觀察到,Plinbulin在免疫激活癌症的過程中處於多個早期階段。特別是,它可以激活和動員腫瘤抗原特異性T細胞,動物研究表明,普林布林具有一系列增強免疫的作用,可能與檢查點抑制劑的作用有協同作用,而檢查點抑制劑是一種抑制腫瘤免疫系統識別的關鍵防禦機制的抗體。在臨牀前的研究中,Plinbulin增強了檢查點抑制劑的抗腫瘤效果。我們相信Plinbulin聯合Nivolumab,一種被批准用於NSCLC和其他適應症的檢查點抑制劑,可能顯示出比Nivolumab更多的抗腫瘤活性,而沒有明顯增加毒性。當尼伏魯馬與其他檢查點抑制劑聯合使用時,累積毒性一直是人們關注的問題。
在9月份,加州大學聖迭戈分校(UniversityofCalifornia,San Diego,簡稱UCSD)將第一位患者納入了一名研究人員發起的1/2期普林布林聯合尼沃盧馬(Nivolumab)治療轉移性非小細胞肺癌(n@@此外,弗雷德·哈欽森癌症研究中心,或弗雷德·哈欽森中心,與華盛頓大學一起,啟動了一項由研究人員發起的第1/2階段的普林布林試驗,與尼沃盧馬聯合治療晚期非小細胞肺癌(NSCLC)的患者,這些患者此前的兩次治療都失敗了。
63
目錄
調查員在弗雷德哈欽森中心發起的審判最近進展到第1/2階段審判的第2階段。這兩個研究人員發起的試驗的初步安全數據在2018的ASCO-sITC會議上提交。在被評估的10名患者中,聯合治療是很好的耐受性,沒有免疫相關的嚴重不良事件。只有兩例患者出現免疫相關的不良事件,一例為一級事件,另一例為2級事件。
在2018的第二季度,我們預計羅格斯大學將啟動一項由研究者發起的普林布林1/2試驗,結合編程細胞死亡蛋白1或PD-1和CTLA-4抗體來治療小細胞肺癌或小細胞肺癌。This study will investigate whether the addition of Plinabulin results in a reduction of immune-related side effects of PD-1 and CTLA-4 antibodies and if it provides efficacy synergy. Also in 2018, we expect Johns Hopkins University to initiate an investigator-initiated Phase 1/2 trial of Plinabulin in combination with pembrolizumab and platinum-based chemotherapy agents.本研究將研究在治療中加入普林布林是否能減少Pd-1抗體的免疫相關副作用,以及是否能降低CIN。
其他程序
We have several preclinical immuno-oncology agents in development, including BPI-002, an oral CTLA-4 inhibitor; BPI-003, an IKK inhibitor; and BPI-004, an agent which we believe may have the potential to convert cold, or poorly inflamed, tumors to hot, or highly inflamed, tumors, thereby making the tumors more available to immunotherapy, potentially in combination approaches.
此外,我們正在研究一種替代的癌症治療方法,在這種方法中,引起疾病的蛋白質被標記為早期降解。這種方法使用一種叫做泛素E3連接酶的蛋白質來靶向和促進對致癌基因等致病蛋白的破壞。為了引發降解,目標蛋白被一種特定的泛素連接酶標記為聚泛素。聚泛素在細胞蛋白酶體機器上起着指示標記的作用,標記着被破壞的目標蛋白.
一種標記目標蛋白的方法是使用“分子膠”將泛素連接酶與目標蛋白結合。我們正在與華盛頓大學霍華德·休斯醫學研究所研究員鄭寧博士合作,研發一種獨特的“分子膠”,用於選擇性地將某些癌基因蛋白標記為E3連接酶。E3連接酶是一種泛素連接酶。黃博士和鄭博士是第一個發現僅有的兩類E3連接酶的晶體結構。這一工作為選擇小分子作為一種潛在的“分子膠”奠定了結構基礎。前兩個靶蛋白是癌基因KRAS和c-myc.KRAS在胰腺、結腸癌、肺癌和子宮癌中經常發生突變,而c-myc基因在乳腺癌、卵巢癌和前列腺癌中經常擴增。這一新的平臺技術具有顯著降低細胞中癌基因蛋白含量的潛力,而這種致病蛋白並不是目前治療方法所針對的目標。
我們計劃在2019將一種藥物BPI-002引入臨牀開發,目標是每年將一種臨牀前化合物轉化為臨牀開發。
此外,我們正在探索Plinbulin在治療KRAS突變的晚期非小細胞肺癌和多西紫杉醇聯合治療轉移性腦腫瘤和放射治療中的作用。雖然我們繼續主要集中在使用普林布林在CIN,晚期非小細胞肺癌和結合免疫腫瘤學制劑,如果有必要的資源和資金,我們可能決定進一步研究的作用,在RAS突變腫瘤。
64
目錄
我們的管道
下表總結了我們產品開發管道的現狀。
|
|
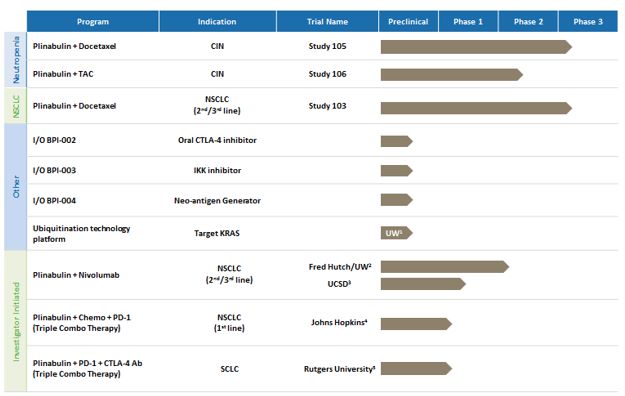 |
||
|
(1)與華盛頓大學的合作
(2)與弗雷德·哈欽森中心和華盛頓大學合作
(3)與聖迭戈加州大學的合作
(4)與約翰霍普金斯大學的合作將於2018啟動
(5)與羅格斯大學的合作將於2018啟動
|
|||
我們的戰略
| · |
通過對CIN的第2/3期試驗和NSCLC的第3階段試驗,通過結合中國研究人員的全球臨牀試驗,迅速推進了Plinbulin的發展。我們相信,我們在美中兩國的雙重發展戰略已經並將繼續提供significant advantages, including the ability to conduct trials in China with quicker enrollment and lower costs. In China, we conduct all of our trials under U.S. GCP guidelines but at lower cost than we would incur in the U.S. Also, by utilizing our Chinese subsidiary to execute on this dual development strategy, we have been able to enroll our CIN and NSCLC clinical trials more quickly than anticipated.中國每年新增癌症患者超過400萬人,佔全球癌症患者總數的三分之一。中國的病人更願意參加臨牀試驗,因為保險在中國不像在西方那麼普遍。此外,中國的癌症護理仍然高度集中,主要集中在北京、上海和廣州地區,來自全國各地的癌症患者前往這些地區接受治療。因此,根據我們在這些地區的治療中心的工作,我們的試驗將受益於在中國的更快的入學率。這種方法遵循了非小細胞肺癌藥物Afatinib開發的先例,其中72%的患者數據被用作FDA批准的依據來自中國。
|
65
目錄
| · |
根據中期趨勢數據,在中國尋求對CIN和NSCLC的Plinbulin的快速批准,並在我們的後期臨牀試驗的最終數據完成後,在美國和其他國家申請批准。在2017,cfda宣佈,它將考慮根據臨牀病人利益的趨勢加速或有條件地批准,而不是等待關於威脅生命的疾病的全部臨牀試驗數據,重點是解決未滿足的醫療需求的新藥。我們打算利用這些新規定在中國加速批准Plinbulin。在我們後期取得積極的中期結果之前。臨牀試驗,我們預計在2018年底或前半段2019用於普林布林的有條件批准。第一種是減少CIN的治療,第二種是聯合多西紫杉醇治療非小細胞肺癌。我們在2019和2020兩個階段完成了CIN治療的2/3期臨牀試驗之後,我們打算在美國和其他國家提交NDAs作為同樣的適應症,我們希望能夠根據作為1類藥物的能力,從中國的快速監管狀態中獲益。此外,我們有資格在收到2017年度創新獎的基礎上進行加速評審。有一段歷史表明,接受第三階段治療的創新腫瘤學藥物的批准率很高。臨牀試驗批准或CTA並由中國公司開發,包括伊考替尼和奇達胺。
|
| · |
探索普林布林與免疫腫瘤學制劑相結合的潛力,並通過我們的科學合作者繼續開發其他免疫腫瘤學制劑的管道。我們正在利用我們的研究合作者在臨牀試驗中推進Plinabin,以探討其作為免疫腫瘤學制劑的治療潛力。我們也有一系列臨牀前免疫腫瘤學產品的候選產品,我們正在調查泛素介導的降解途徑與華盛頓大學合作。我們利用我們的研究合作,有效地推進這些項目。
|
| · |
複製我們的普林布林全球臨牀發展計劃,在其他適應症,以及與藥物候選在我們的內部管道或獲得許可。我們相信,我們在中國正在進行的臨牀試驗中觀察到的特定優勢,可以作為我們今後可能開發的產品候選產品的模板,因此,我們打算利用我們的中國子公司,使我們能夠有效和高效地開發我們的產品候選產品。我們將機會主義地評估適合我們在美國、中國和其他國家的臨牀開發優勢的開發或許可使用的潛在化合物。
|
| · |
在中國將普林布林商業化,並與中國以外的一家或多家全球製藥公司合作。 With receipt of the 2017 Innovation Award, Plinabulin has been included in the National Drug Priority List and, pending drug approval and successful pricing negotiations with the Chinese government, Plinabulin has the potential to be included in the National Insurance System, which will allow for faster access to patients and reimbursement. We plan to build our own commercial organization for marketing Plinabulin for advanced NSCLC and in CIN在北京、上海和廣州地區,佔中國80%的地域癌症護理市場。我們還計劃保留一個在中國二級市場銷售的合同銷售機構。在美國和世界其他地區,我們打算尋找一個或多個潛在的藥物合作伙伴進行商業化。
|
普林布林,我們的主要藥物候選人
普林布林是從海洋微生物中發現的一種天然化合物衍生出來的一種小分子。它具有多種生物活性,可提供多種治療機會。普林布林是一種分子量較小的小分子,其製備相對簡單。天然產物及其衍生物(如Plinbulin)的一個優點是,其他人很難發現具有類似活性的結構上不同的分子。
總的來説,截至這份20-F表格年度報告之日,普林布林已用於300多名晚期癌症患者,到目前為止總體上是耐受性良好的。已完成和正在進行的臨牀試驗的數據表明:
| · |
在癌症患者中,在多西紫杉醇中加入普林布林後,在第101和103項研究中,4級中性粒細胞減少的不良事件有統計學意義上的減少,使患者能夠繼續接受全劑量多西紫杉醇治療一段較長的時間;
|
66
目錄
| · |
與多西他賽相比,多西紫杉醇對非小細胞肺癌患者的抗腫瘤活性有明顯的提高。
|
我們相信,這些數據表明,在治療晚期非小細胞肺癌以及預防和減少CIN方面,普林布林有一條前進的道路。
預防CIN的普林布林
除了先前所發現的破壞微管網絡的活動外,Plinbulin還在臨牀前的研究中顯示了許多免疫刺激作用。對其作用方法的研究表明,Plinbulin激活了鳥嘌呤核苷酸交換因子GEF-H1。GEF-H1激活下游信號轉導通路,導致c-Jun蛋白的激活。活化的c-Jun進入樹突狀細胞的細胞核,上調免疫相關基因,從而促進一系列基因的上調,從而導致樹突狀細胞成熟、T細胞活化和其他防止中性粒細胞減少的作用。其他微管失穩劑,如CA4P類,或微管穩定劑,如多西紫杉醇,並不能誘導樹突狀細胞成熟或防止中性粒細胞減少。這一機制的闡明是BeyondSpring、巴塞爾大學和馬薩諸塞州總醫院三年的合作努力。
細胞因子是細胞信號分子,有助於細胞與細胞之間的溝通.細胞因子是免疫反應的重要調節因子,已知某些細胞因子能刺激中性粒細胞的活化、遷移和存活。許多體外研究表明,Plinbulin能促進白細胞介素-1、白細胞介素-6和白細胞介素-12等多種細胞因子的分泌,這些細胞因子與減少中性粒細胞破壞有關。我們相信這可能是在NSCLC患者1/2期試驗的第2階段觀察到的減少中性粒細胞減少的機制。
CIN概述
中性粒細胞減少是一種異常低濃度的中性粒細胞,是一種白細胞,可由骨髓中白細胞的異常破壞率或較低的合成率所致。中性粒細胞減少是根據其嚴重程度來分級的,這通常取決於中性粒細胞的計數。低於500細胞/mm3(0.5×109/L)的絕對中性粒細胞計數屬於4級中性粒細胞減少或重度中性粒細胞減少,中性粒細胞計數在500至1 000細胞/mm3之間(0.5-1.0 x 109/L)屬於3級中性粒細胞減少。中性粒細胞減少是大多數化療的關鍵限制。中性粒細胞減少的發生率因化療類型和患者人羣而有很大差異,但在7%至65%之間。半數以上的CIN病例與藥物治療的第一個週期有關。CIN會導致多達20%的患者延遲進一步的化療劑量、劑量減少或化療的早期終止。
中性粒細胞減少患者更容易受到細菌感染,細菌感染是癌症患者發病和死亡的重要原因。每年有60,000多名患者因發燒引起的中性粒細胞減少而住院。死亡率在9%~18%之間。
目前治療中性粒細胞減少的標準最早是在20世紀90年代初批准的,是基於G-CSF的生物藥物。G-CSF是一種刺激中性粒細胞增殖、分化和成熟的人類生長因子。重組G-CSF療法包括一種短效藥物filgrtim(Neupogen)和一種長效藥物pegfilgrashtim(Neulasta).在化療後,通常每天服用一次,最多兩週,而佩格菲拉斯蒂姆通常在每個化療週期後給藥一次。
雖然這些藥物的年全球銷售額在2016年超過81億美元,但它們有一些限制,這限制了它們在高風險化療患者中的應用。根據產品標籤,G-CSF至少在化療後24小時才能使用,因為G-CSF刺激產生的中性粒細胞容易被循環化療破壞。這一方案的基礎是在多項臨牀試驗中觀察到,在化療當天服用佩格菲拉欣的患者,其中性粒細胞減少持續時間較長,且比24小時後服用該藥的患者更為嚴重。相比之下,我們認為主要是增強現有中性粒細胞的存活,而不是刺激新的中性粒細胞產生的Plinbulin,可以在化療後30分鐘到1小時使用。
67
目錄
Treatment with G-CSF therapies is also associated with adverse events including bone pain, enlarged spleen, acute respiratory distress syndrome, anaphylaxis and sickle cell disorder. 20% of patients receiving filgrastim and 25% to 38% of patients receiving pegfilgrastim experienced treatment-induced bone pain, which may cause patients to discontinue G-CSF treatment and potentially lead to delays in dosing, dose reduction or early termination of chemotherapy due to neutropenia.
考慮到這些限制,我們認為對於CIN的臨牀治療需要有一個很大的未滿足的需求,而且用藥時間更方便,而且沒有限制G-CSF使用的安全考慮。這些潛在的優勢可能會增加接受治療以減少中性粒細胞減少的患者的數量,這將導致較少的住院和改善他們的生活質量。
我們相信,普林布林的臨牀療效和安全性,以及化療後30分鐘至1小時的使用能力,可能使其成為現有G-CSF療法的一種有吸引力的替代方案。
1/2期臨牀試驗(研究101)
在研究101中,在第1/2期試驗的第2階段163例患者中對Plinabin進行了研究,並與多西紫杉醇聯合治療晚期NSCLC,這些患者在至少一輪化療後取得了進展,被認為是不可切除的、局部晚期的或轉移性的。Retrospective analysis of data from Study 101 showed that the tolerability of the combination of Plinabulin (20 mg/m2 or 30 mg/m2) on days one and eight of a 21-day chemotherapy cycle, and docetaxel (75 mg/m2) on day one of the 21-day chemotherapy cycle, was generally greater than the tolerability of docetaxel (75 mg/m2) alone on day one of a 21-day cycle.這項試驗的主要終點是總體存活,次要終點是反應持續時間、有效率和無進展生存率。
下表是從第1/2階段試驗的第2階段獲得的某些數據的摘要。每個數字代表每臂病人總數的百分比,以“n”表示,他們經歷了每一次相應的事件。在本臨牀試驗中,26%的多西紫杉醇單治臂患者出現3級和4級中性粒細胞減少,7%的患者出現3級和4級中性粒細胞減少(20 mg/m2和30 mg/m2聯合使用)。3級和4級中性粒細胞減少不良事件在普林布林加多西紫杉醇手臂觀察到在所有四個治療週期。
|
某些事件
|
普林布林+
多西他賽(n=90)
|
多西紫杉醇
(n=73)
|
||||||
|
3級和4級中性粒細胞減少
|
7% (p=0.002)
|
26%
|
|
|||||
|
G-CSF的使用
|
10%
|
30%
|
|
|||||
|
膿毒症
|
0%
|
|
3.6%
|
|
||||
|
嚴重感染
|
0%
|
|
3.6%
|
|
||||
|
多西他賽因毒性而減少劑量
|
6.7%
|
|
19.2%
|
|
||||
4級中性粒細胞減少症患者按20毫克/平方米和30毫克/平方米劑量計算的數據,定義為抽血後的500細胞/mm3以下(0.5x109/L)以下的絕對中性粒細胞計數,見下表。
68
目錄

在治療的第一個週期中,Plinbulin的影響尤為明顯。治療後第8天,多西紫杉醇單藥治療組33.3%的患者出現4級中性粒細胞減少,而20 mg/m組為2.6%。2普林布林+多西紫杉醇手臂,差異極顯著,p值為
。
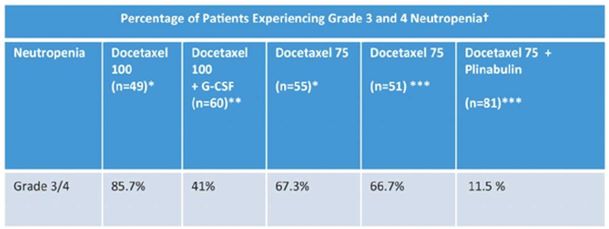
多西紫杉醇單藥治療臂的患者中,使用G-CSF治療的患者多於使用普林布林+多西紫杉醇治療的患者,而在多西紫杉醇手臂治療的患者中,無一例出現膿毒症或嚴重感染。此外,與單用多西紫杉醇治療的患者相比,普林布林加多西紫杉醇手臂的患者需要減少多西紫杉醇的劑量。
此外,普林布林對多西他賽的副作用並沒有增加額外的毒性,這些副作用包括但不限於噁心、疲勞、腹瀉、便祕、厭食症、脱髮、貧血、頭痛、頭暈和白細胞減少。嚴重的短暫性高血壓,是一種短暫的血壓升高,大約有20%的患者接受了30毫克/米的治療。2劑量的普林布林和大約5%的病人接受20毫克/米2普林布林的劑量。一些患者接受了抗高血壓藥物治療,如鈣通道阻滯劑,所有短暫性高血壓患者在發生的同一天內就會消失。採用標準疼痛管理方案治療接受Plinbulin治療的患者的腫瘤疼痛。通過X線或超聲檢查,觀察接受Plinabin治療的患者的腸梗阻情況。
下表比較了單用多西他賽(100 mg/m)治療3級和4級中性粒細胞減少的非小細胞肺癌患者的百分比。2)如其他人進行的另一項研究所報告的,(二)多西他賽(100毫克/米)2)加G-CSF(150μg/m)2)如其他人在另一項研究中所報告的,(Iii)單用多西他賽(75毫克/米)2)正如其他人進行的另一項研究所報告的,(Iv)單用多西他賽(75毫克/米)2)在上述第1/2階段試驗的第2階段,以及(V)多西他賽(75毫克/米)2)加Plinbulin(20毫克/米)2或30毫克/米2)在上述第1/2期試驗的第2階段,不使用任何G-CSF。在每一種情況下,“n”指的是接受治療的病人人數。
這些比較並不是基於對G-CSF和Plinbulin聯合多西他賽預防中性粒細胞減少的頭對頭的研究。因此,從這些單獨的臨牀研究中得出的數據可能無法比較,如果獲得批准,也不會成為普林布林營銷的基礎。然而,我們相信,根據以下數據,普林布林在預防多西紫杉醇誘導的3級和4級中性粒細胞減少方面可能與G-CSF一樣有效。
69
目錄

† 這一比較沒有反映頭對頭的研究為預防多西紫杉醇誘導的3級和4級中性粒細胞減少而進行的G-CSF和Plinbulin的研究。請參閲“第三項”。關鍵信息-D.風險因素--與我們的工業、商業和運營相關的風險--我們可能在我們可以提出的宣傳主張中受到限制,如果獲得批准,我們可能無法使用有關競爭療法的信息來推廣或銷售Plinabin,而不會產生重大的監管或執法風險“以獲取更多信息。
| * |
書名/作者by by J.
|
| ** |
阿列克索普洛斯癌症化學藥物1999;43:25。
|
| *** |
第二階段研究101。
|
我們認為Plinbulin可能能夠預防不同骨髓抑制化療藥物治療所致的中性粒細胞減少。例如,動物方面的研究表明,在多西紫杉醇以外的抑制性化療藥物中,如環磷酰胺,也會顯著減少中性粒細胞的絕對計數。
我們從我們正在進行的第103號研究中獲得了額外的數據,説明瞭普林布林減少中性粒細胞減少的情況,在該研究中,我們正在評估普林布林降低CIN作為次要終點的能力。在研究103中,我們評估了138例嚴重中性粒細胞減少症患者。這項研究顯示了Plinabin對非小細胞肺癌患者減少多西紫杉醇CIN的能力,其p值為
。
臂1:多西他賽(第1天,75毫克/米)2(第2天,6毫克)(N=14)
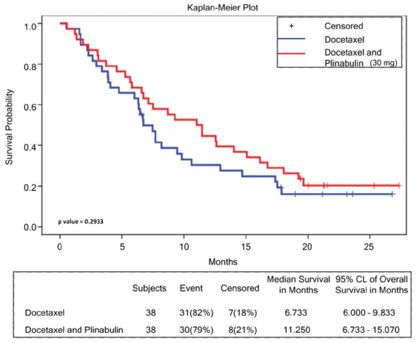
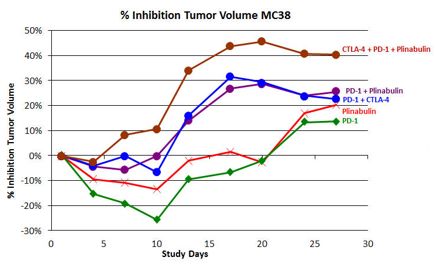
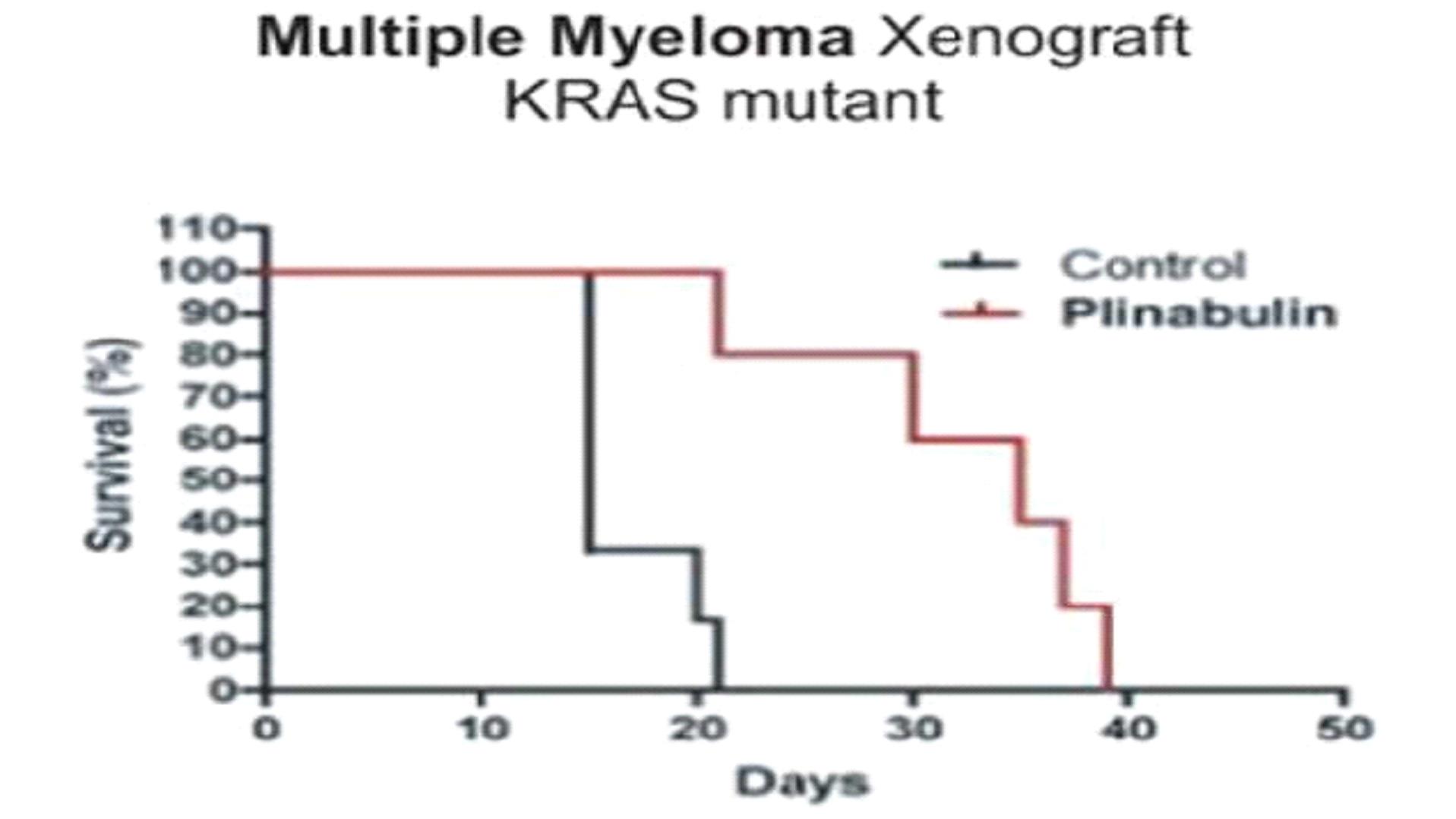
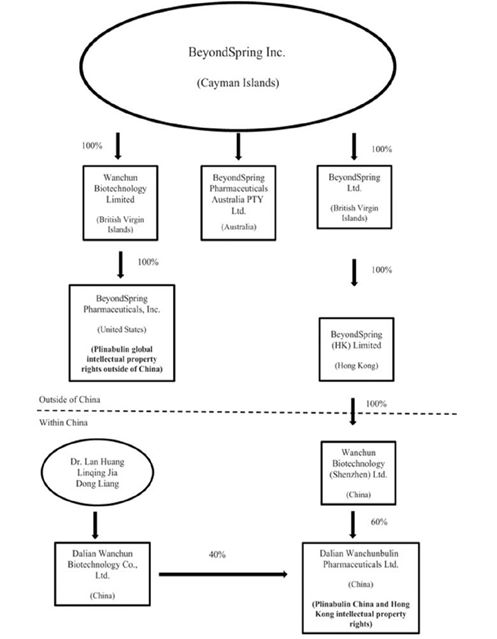
預防CIN的第2/3階段試驗(研究105和研究106)
根據在非小細胞肺癌第1/2期試驗中觀察到的初步的安全性和有效性概況,以及我們在9月份從美國食品和藥物管理局收到的反饋,我們改進了兩期預防CIN的Plinbulin 2/3試驗的設計。
研究105
我們正在進行研究105,第2/3階段的試驗,在聯合多西他賽治療晚期乳腺癌,激素難治性前列腺癌和晚期非小細胞肺癌患者。我們已經完成了55名晚期非小細胞肺癌患者參加這項試驗的第2階段的工作,並計劃在2018的試驗的第3階段中納入大約150名晚期非小細胞肺癌、乳腺癌或前列腺癌患者。患者將隨機1:1,在21天化療週期的第一天接受75毫克/平方米劑量的多西紫杉醇和20毫克/平方米的普林布林或佩格菲拉辛對照。
研究105的第3階段的主要終點是,與第一週期化療中CIN持續時間的治療標準相比,佩格菲拉辛的治療標準不差。次要端點包括:
| · |
CIN在後續週期中的發生率;
|
70
目錄
| · |
與發熱和感染有關的嚴重中性粒細胞減少的發生率;
|
| · |
因發熱引起的中性粒細胞減少症的發生率和住院時間;
|
| · |
抗生素使用的發生率;以及
|
| · |
骨痛的發生、發生及嚴重程度。
|
The primary objective of the Phase 2 portion of Study 105 was the generation of pharmacokinetic and pharmacodynamic, or pharma PK/PD, data, wherein PK represents plasma concentrations of Plinabulin at different Plinabulin dose levels (5 mg/m2, 10 mg/m2 and 20 mg/m2 dose levels), to confirm the optimal dose of Plinabulin for study in the Phase 3 portion of the trial.在2018月份,我們宣佈在105號研究的第2階段中,普林布林被證明可以預防CIN。在這部分研究中,這些患者在多西紫杉醇治療30分鐘後接受了一次Plinabin治療。These results established the recommended dose of 20mg/m2 for the Phase 3 portion of the trial based on a clear dose response in grade 4 neutropenia incidence and the DSN as indicated in the table below. The trial had a pre-specified non-inferiority margin of 0.65 days (either higher or lower), as agreed upon with the FDA, for DSN to show non-inferiority in neutropenia prevention for Plinabulin versus Neulasta.
如果沒有中性粒細胞減少症的預防,DSN就會超過一天,減少DSN到0.38天,對Plinbulin是有臨牀意義的。如果試驗的兩個手臂之間的DSN差值為0.65天(高或低),就足以達到第三階段顯示非自卑感對Neulasta的主要目標。
|
中性粒細胞減少
|
紐拉斯塔
6毫克
N=14
|
普林布林
5毫克/米2
N=14
|
普林布林
10毫克/米2
N=14
|
普林布林
20毫克/米2
N=13
|
||||
|
4年級發生率%
|
14
|
%
|
23
|
%
|
21
|
%
|
15
|
%
|
|
DSN(天數)
|
0.14
|
0.46
|
0.43
|
0.38
|
||||
手臂2:多西他賽(第1天,75毫克/米)2)+Plinbulin(第1天,20毫克/米)2) (N=14)
手臂3:多西他賽(第1天,75毫克/米)2)+Plinbulin(第1天,10毫克/米)2) (N=14)
手臂4:多西他賽(第1天,75毫克/米)2)+Plinbulin(第1天,5毫克/米)2) (N=13)
我們期望在2018年底收到試驗的第三階段的臨時數據。如果第2/3期試驗的第3階段的中期數據顯示,在第一個化療週期中DSN不處於劣勢,試驗將在不評估次級終點的情況下完成。如果中期結果沒有顯示出非自卑感,我們期望繼續按計劃全面登記所有患者,並在2019報告最終數據。
研究106
此外,我們還對大約200名Plinbulin患者進行了2/3期試驗,並結合由三種藥物TAC組成的骨髓抑制化療方案,治療乳腺實體瘤,或研究106。本試驗的設計與研究105基本相似。然而,第三階段的研究106部分是用來衡量優於紐拉斯塔。我們計劃在本試驗的第二階段中招募60名患者,並在第3階段中招收大約120名患者。我們預計試驗第二階段的初步結果將在2018年底前完成。我們預計這次試驗將在2019最終結果。
斯坦福大學的DouglasBlayney是NCCN的董事會成員,也是NCCN中性粒細胞減少症管理指南的貢獻者,他是我們研究105和研究106的主要研究者。中國中性粒細胞減少症管理NCCN指南的主席石元凱博士是我們在這兩項研究的中國部分的首席研究員。If the data from Study 105 and Study 106 demonstrate non-inferiority of Plinabulin compared to the standard of care, pegfilgrastim in the duration of CIN in the first cycle of chemotherapy, we believe Plinabulin can be approved as a new therapeutic for the prevention of CIN in all solid tumor and hematological malignancies, with the potential of being included in the NCCN guidelines as a treatment for both high risk 中危發熱的中性粒細胞減少化療患者,約80%的患者接受化療。
71
目錄
根據我們與CFDA的討論,我們認為Plinbulin治療CIN符合加速批准一種新藥物治療一種危及生命的疾病的標準。如果105號研究第3階段和第106號研究第2階段的中期結果是肯定的,我們計劃在2018年底或2019年初在中國進行加速或有條件的批准。
普林布林治療晚期非小細胞肺癌
研究101的數據表明,在標準的多西紫杉醇治療方案中加入普林布林,與多西紫杉醇單藥治療相比,可測量肺部病變的非小細胞肺癌患者的抗腫瘤活性有所提高。基於這些發現,在2016,我們在美國,中國和澳大利亞的普林布林和多西紫杉醇在晚期非小細胞肺癌患者中啟動了一項554名患者的第三階段試驗。我們目前登記了230多名患者,並期望在2018或2019年初的第四季度對146個病人的死亡事件進行總體生存的主要終點的中期結果,並在2020對所有患者進行最終結果。
非小細胞肺癌疾病概況
根據美國國家癌症研究所的數據,美國每年大約有22萬名肺癌患者被診斷為肺癌。肺癌患者預後差,5年生存率僅為17.7%.肺癌是美國癌症死亡的主要原因,每年約有180萬例病例被診斷為全球性的健康問題。全世界大約三分之一的肺癌患者在中國,2015年間,中國診斷出肺癌病例約70萬例。根據腫瘤細胞的組織學表現,這些肺癌通常分為兩組:小細胞肺癌和非小細胞肺癌,兩組採用不同的化療方法。非小細胞肺癌約佔肺癌病例的87%。全球非小細胞肺癌市場正以每年15.8%的速度增長,估計2020和2025年度的銷售額分別為129億美元和268億美元。
肺癌通常在其臨牀過程中被診斷為相對較晚,因為它已經轉移到身體的其他組織。在這些晚期的病例中,治療是無效的,患者一般採用全身療法。最初的治療通常是基於廣泛的化療藥物,如順鉑。然而,大多數患者並沒有得到長期的好處,與使用這些藥物相關的總體生存率增加只有兩個月。其他治療分為幾個一般類別:
| · |
其他化療藥物,如多西他賽或培美曲塞;
|
| · |
具有特定基因突變的細胞內酶抑制劑,包括EGFR激酶;
|
| · |
幹擾腫瘤血管形成的藥物,如ramuCirumab;以及
|
| · |
檢查點抑制劑,如尼伏魯馬。
|
雖然每一種治療方法都可能提供顯著的益處,但它們也與特定的限制有關。例如,多西他賽會導致40%的患者出現中性粒細胞減少。以EGFR為靶標的ERLATINB等激酶抑制劑只對大約15%的患者有效,而幾乎所有最初對這些抑制劑有反應的患者最終都會產生耐藥性。ramuciumab是一種抗血管生成劑,能阻止或減緩新血管的形成,與多西他賽聯合使用可提高整體存活率。然而,肺癌具有高度的血管化作用,貝伐單抗在NSCLC中的應用與肺內致命出血的風險密切相關。最後,像Nivolumab這樣的檢查點抑制劑在NSCLC中表現出了顯著的活性,但這種活性僅限於20%的患者。因此,儘管有多種藥物治療非小細胞肺癌,我們認為仍有必要對非小細胞肺癌進行新的治療。
72
目錄
晚期非小細胞肺癌1/2期(研究101)
第1/2期試驗的第2階段的主要目的是評價普林布林聯合多西紫杉醇治療晚期非小細胞肺癌的潛在抗癌效果。這項試驗在美國、澳大利亞、阿根廷、智利、巴西和印度招募了163名晚期非小細胞肺癌患者。參加試驗的病人有無法切除的、局部晚期的或轉移性的癌症,這意味着在某些患者中,這種疾病如果不擴散到全身,就會擴散到鄰近的淋巴結。在這樣的病人中,肺部可能沒有可測量的病變。
與多西紫杉醇單藥治療相比,該試驗沒有達到Plinbulin與多西紫杉醇聯合治療的總體生存率顯著提高的主要終點。然而,我們發現,與多西紫杉醇單藥治療相比,多西紫杉醇可增加抗腫瘤活性。可測量肺部病變患者的總體存活情況如下所示,稱為Kaplan-Meier圖。曲線中的每一個垂直下降代表一個或多個病人的死亡記錄。如果病人退出試驗,失去後續行動,或在試驗結束後存活,該病人將受到“審查”,並在對該病人進行最後一次可靠評估時,由曲線上的一條垂直線表示。所有在這兩個試驗中的病人要麼死亡,要麼受到審查。在這個子集分析中,普林布林加多西他賽手臂患者的中位總生存期為11.3個月,而單用多西紫杉醇治療的患者的中位總生存期為6.7個月。另外,普林布林聯合多西紫杉醇組的客觀有效率為18.4%,而多西紫杉醇單藥組為10.5%。該子集僅包括38例患者,無統計學意義(p值=0.29)。我們認為,這是由於每個手臂上的病人數量很少。此外,數據顯示,Plinabin+多西紫杉醇手臂患者的總生存期在6.7至15.1個月之間,而單用多西紫杉醇治療的患者的總生存期在6.0至9.8個月之間。這個數據有95%的置信度,即CL,這意味着如果對同一個患者羣體進行多次抽樣,那麼每個樣本的總生存期將在這些建議的時間範圍內大約95%。接受普林布林加多西他賽治療的患者的反應持續時間為12.7個月,而僅接受多西紫杉醇單藥治療的患者為1個月(p值=0.049)。

動物研究表明,Plinbulin破壞腫瘤血管排列細胞中微管蛋白網絡的穩定性,導致這些血管選擇性崩潰,進而破壞腫瘤。我們相信普林布林的免疫增強和血管靶向機制將針對小的和大的可測量的肺部病變和非小細胞肺癌腫瘤,從而使普林布林發揮其多種作用機制來治療非小細胞肺癌。
73
目錄
我們正在進行的晚期非小細胞肺癌第三階段試驗(研究103)
In the fourth quarter of 2015, we initiated enrollment in Study 103, a Phase 3 trial of Plinabulin in combination with docetaxel in advanced NSCLC patients, but decided to suspend enrollment to file amendments to the trial protocol to both increase our chances of success in obtaining approval in advanced NSCLC and expand the potential patient population to accelerate enrollment as well as gather data that could be used to support our NDA applications in CIN.我們於2016在美國、中國和澳大利亞恢復了這一試驗的註冊。
研究103正在登記晚期或轉移性非小細胞肺癌患者,他們至少失敗了一次基於白金的化療,並且有可測量的病變。與單用多西紫杉醇相比,試驗的主要終點是給予普林布林聯合多西他賽的患者的總體生存率。次要終點將是中性粒細胞減少的頻率和嚴重程度,反應持續時間,生活質量,有效率和無進展生存。這個試驗的病人是根據我們目前對Plinabin的行動方法的理解而選擇的。登記包括具有可測量肺部病變的晚期NSCLC患者,並且不會包括EGFR突變患者,因為沒有這些突變的患者有更大的未滿足的醫療需求,約佔所有二線和三線肺癌患者的70%-85%。我們還登記了免疫腫瘤學藥物PD-1和PD-L1治療失敗的患者.這項試驗預計將招收554名患者,其中80%將在中國的醫院招募,20%將在美國和澳大利亞招聘。試驗被隨機分為1:1,一隻手臂在第一天和第八天服用30毫克/平方米的潘尼布林,在21天週期的第一天服用75毫克/平方米的多西紫杉醇,另一隻在21天週期的第一天接受75毫克/平方米的多西紫杉醇。
大衞·埃廷格博士,美國NCCN指南的主席,指導了這項研究設計,並正在協助進行研究103。我們在中國的首席臨牀研究人員是中國NCCN非小細胞肺癌指南主席孫博士和北京國家GCP抗癌藥物治療中心主任,這是一家每年治療32萬病人的醫院。1997,孫中山先生還共同創立了中國臨牀腫瘤學學會指導委員會,並於1997至2013年間擔任委員會主席和主席。孫博士是其他肺癌藥物第三階段試驗的首席臨牀研究員,這些藥物得到了包括伊科替尼在內的CFDA的批准。我們目前已登記超過230個病人,並期望在2018或2019年初的第四季度,對146個病人的死亡事件的總體生存的主要終點的中期結果,以及所有病人的最終結果。2020年間438例死亡病例.
如果普林布林與多西他賽聯合治療晚期非小細胞肺癌,我們相信它有可能被納入NCCN指南,作為晚期NSCLC的一種治療方法。
此外,根據我們與CFDA的討論,我們認為我們的治療晚期非小細胞肺癌的帕林布林聯合多西他賽的目標指標符合加速批准一種新的危及生命的疾病藥物的標準。如果103號中期研究結果的療效數據是肯定的,我們計劃在2019上半年在中國提交一份NDA,以供加速或有條件的批准。
免疫腫瘤學中的Plinbulin
臨牀前的研究已經確定了一些新的和耐人尋味的活動與刺激免疫系統相一致的普林布林的能力,以提高其他免疫腫瘤學藥物的活性。我們在這些研究中觀察到,普林布林在免疫激活腫瘤的過程中處於多個早期階段,特別是激活和動員腫瘤抗原特異性T細胞到腫瘤。在下面描述的幾個研究者啟動的1/2試驗中,Plinbulin在刺激其他免疫腫瘤藥物的活性方面的潛在作用已經被探索。
74
目錄
免疫腫瘤學綜述
免疫系統能夠識別和消除腫瘤細胞,然而,腫瘤有時可以通過改變調節檢查點途徑來逃避免疫反應。其中一條通路由pd-1驅動,pd-1是一種在免疫T細胞上表達的受體.35%至100%的腫瘤,如黑色素瘤、肝細胞癌、結直腸癌和非小細胞肺癌,Pd-L1是一種天然與Pd-1結合的化合物。pd-L1與pd-1的結合抑制了免疫激活,使腫瘤能夠逃避免疫系統的破壞。針對Pd-1的免疫檢查點癌症治療方法,如尼伐馬布(Opdivo),已被批准用於治療黑色素瘤、非小細胞肺癌和腎細胞癌。雖然尼伏魯馬對一部分腫瘤非常有效,但腫瘤依靠多種途徑來逃避免疫系統,從而使許多腫瘤繼續增殖。
與大多數癌症的治療一樣,聯合治療往往是提高療效的必要條件。最近,抗Pd-1抗體nivolumab和CTLA-4抗體ipilimumab的聯合治療黑色素瘤的療效有所提高。然而,這種聯合治療導致3級和4級不良事件增加,55%的聯合用藥患者發生不良事件,而單用尼伏魯馬和單獨使用ipilimumab的患者分別為16.3%和27.3%。我們認為,在免疫檢查點抑制劑(如nivolumab)中加入普林布林,有可能在不增加嚴重不良事件發生率的情況下增加活性,或潛在地減少免疫相關的副作用。
免疫腫瘤學中支持Plinbulin的臨牀前研究數據
檢查點抑制劑,如nivolumab,在整個免疫過程中的一個相對較晚的階段-當T細胞識別癌細胞時,減輕免疫系統的阻塞。與之相反,臨牀前的研究表明,在免疫激活的早期,Plinbulin激活了免疫系統的多個步驟,因此具有補充檢查點抑制劑活性的潛力。已經發表的和未發表的臨牀前研究數據都表明,Plinbulin通過增加樹突狀細胞表達腫瘤抗原,刺激樹突狀細胞增殖,增加輔助性T細胞水平和降低免疫抑制調節性T細胞水平,刺激腫瘤細胞對腫瘤細胞的免疫應答。雖然目前還不清楚哪種活動或哪一種活動組合對Plinabin的免疫刺激活動很重要,但它在動物模型中的活性可以與其他免疫腫瘤學制劑(如nivolumab)相媲美,nivolumab是一種經批准的針對pd-1檢查點的免疫腫瘤學制劑。
這方面的一個例子是免疫能力強的小鼠的結腸癌模型。這個模型的結果被捕獲在下圖中,顯示了相對於載體控制,腫瘤體積隨時間的抑制百分比。Each demarcated line denotes whether the test mice were treated with Plinabulin alone, treated with a PD-1 antibody (the mouse equivalent of nivolumab) alone, treated with a combination of Plinabulin and a PD-1 antibody, treated with a combination of a PD-1 antibody and a CTLA-4 antibody or treated with a triple combination of Plinabulin, a PD-1 antibody and a CTLA-4 antibody.在該模型中,Pd-1抗體使腫瘤體積比載體對照減少了約12%,與Plinbulin所見的水平相似。Plinbulin和Pd-1抗體的結合導致腫瘤的體積比對照組小約25%,與Pd-1抗體和CTLA-4抗體的結合水平相似。Plinbulin、Pd-1抗體和CTLA-4抗體的三重組合導致腫瘤的體積比其他任何一種藥物或其研究組合治療的動物都小,比車輛控制的腫瘤小約40%。
75
目錄

我們認為,與聯合使用檢查點抑制劑時所見的活性增加類似,Plinbulin也可能增加已經用於臨牀的檢查點抑制劑(如nivolumab)的活性。然而,由於Plinbulin的作用機制與其他檢查點抑制劑完全不同,我們認為這種活性的增加可能與其他組合所見的毒性增加無關。
免疫腫瘤學中Plinbulin的臨牀應用方案
我們已經並計劃繼續探討Plinbulin在刺激其他免疫腫瘤藥物在臨牀項目中的活性方面的作用:
| · |
在9月份,加州大學註冊的第一名患者在一個研究人員啟動的第1/2階段的試驗,與尼沃魯馬聯合治療轉移性非小細胞肺癌患者。此外,弗雷德·哈欽森中心與華盛頓大學共同發起了一項由研究人員發起的普林布林第1/2階段試驗,並結合尼沃魯馬在晚期非小細胞肺癌患者中進行了試驗,這些患者此前的兩次治療都失敗了。Plinbulin的劑量遵循尼沃盧馬的給藥時間表,第1天、第8天和第15天的給藥週期為28天。弗雷德·哈欽森中心的審判最近已進展到第1/2階段試驗的第2階段。這些研究人員發起的初步安全數據是在2018的ASCO-SITC會議上提出的。在接受評估的10名患者中,聯合治療是耐受性好的,沒有免疫相關的嚴重不良事件。只有2名患者出現免疫相關的不良事件,1例為1級事件,另1例為2級事件。
|
| · |
在2018的第二季度,我們預計羅格斯大學將啟動一項由研究者發起的普林布林1/2試驗,並結合Pd-1和CTLA-4抗體作為治療小細胞肺癌的方法。本研究將探討Plinbulin的加入是否會減少Pd-1和CTLA-4抗體的免疫相關副作用,並提供協同作用。
|
| · |
在2018的第二季度,我們預計約翰斯霍普金斯大學將啟動一項由研究者發起的普林布林第1/2階段試驗,並將其與彭溴利祖單抗和鉑類化療藥物相結合,作為非小細胞肺癌的一線治療方案。本研究將研究Plinbulin的加入是否會減少Pd-1抗體的免疫相關副作用,以及鉑基化療引起的嚴重中性粒細胞減少。
|
該調查員---在該大學開展的研究是在一名調查員的指導下進行的---與該大學的一名僱員和首席調查員Lyudmila Bazhenova博士簽署了臨牀試驗協議。協議規定,康文署將在首席研究員的指導下進行這項研究,我們將提供財政支助,並將其用於研究中。康文署已取得IND,並已獲得有關IRBS的批准,並會每四個月向我們提供有關研究進展的中期報告。預計將有多達32名患者參加這項研究。我們會支持這項研究,撥款總額達355,000元。截至12月31日,2017我們已經支付了總計156,000美元,並預計將支付總額為19.8萬美元,通過完成研究。
76
目錄
該協議規定,學習資料的所有權利、所有權和權益都是大學教育委員會的唯一和專屬財產。與這項研究有關的任何知識產權都不可能得到發展。如果透過研究,康文署會盡快向我們披露該等物業。雙方同意,在本研究過程中開發的任何知識產權的所有權和其他權利將根據美國或加利福尼亞州的法律確定。目前,我們有一個專利申請的未決家族直接與免疫檢查點抑制劑,包括PD-1抑制劑聯合使用普林布林。如果申請發出,名義上將於2036到期。
該協議規定,可持續發展大學將在法律允許的範圍內,授予我們一份非排他性的、免費的許可,允許我們使用任何與學習有關的知識產權,這些知識產權必須使用或納入普林布林,用於我們的內部研究目的。在法律允許的範圍內,可持續發展委員會將進一步給予我們一項有時間限制的第一項權利,即就任何與學習有關的知識產權的權利進行談判。我們將有60天的時間通知康文署我們的當選,以取得使用與學習有關的知識產權的商業許可證,而我們將有90天的時間與康文署簽訂許可證協議。
除非研究提前結束或中止,否則協議在研究完成前有效。任何一方可以提前30天向另一方發出書面通知或書面通知另一方終止協議,如果終止方確定為了研究對象的安全需要終止研究。此外,如果一方實質性違反協議,而違約方在收到違反協議的書面通知後30天內未能糾正違約,任何一方均可終止該協議。
我們與華盛頓大學就第1/2階段試驗達成的協議規定,華盛頓大學將在拉斐爾·桑塔納-達維拉博士的指導下進行這項研究,他是華盛頓大學的一名僱員,也是首席調查員,我們將提供財政支持,並向普林布林提供資金支持,以便在研究中使用。華盛頓大學已經獲得了適當的IRBs的批准,並將參加與我們的每月電話會議有關研究的進展。預計將有多達33名患者參加這項研究。
該協議規定,研究中產生的所有數據和報告都屬於華盛頓大學的財產。與這項研究有關的任何知識產權都不可能得到發展。如果這些財產是通過這項研究開發出來的,華盛頓大學將及時向我們披露這些財產。雙方同意,在本研究過程中開發的任何知識產權的所有權和其他權利將根據美國專利法確定。目前,我們有一個專利申請的未決家族直接與免疫檢查點抑制劑,包括PD-1抑制劑聯合使用普林布林。我們已經支付了總計92,000美元,到12月31日,2017,如果所有的病人都登記,我們將支付額外的64萬美元。
該協議規定,華盛頓大學將授予我們永久的、非排他性的、免費的全球許可,允許我們將任何與學習相關的知識產權用於我們的內部研究目的。我們還可以選擇獲得製作、使用、進口、要約出售或出售任何與學習有關的知識產權的獨家許可,其條款和條件合理,雙方在隨後的一份書面文件中商定,在向我們披露此類知識產權後的60天內。
該協議在研究完成或協議按照其條款終止之前有效。任何一方可在向另一方發出書面通知前30天終止協議,或如一方違反協議的重要規定,但在收到違反協議的書面通知後30天內未予更正。
我們尚未就其他調查員發起的研究達成正式協議。然而,我們預計將向羅格斯大學支付總額約140萬美元,用於55名患者的Nivolumab、Ipilimumab和Plinabin複發性小細胞肺癌的1/2期研究。
77
目錄
其他程序
除了探索普林布林的治療潛力,結合免疫腫瘤學藥物,我們有一系列的臨牀前免疫腫瘤學產品候選,並利用我們的研究合作者推進這些項目。
BPI-002和BPI-003程序
我們的BPI-002計劃是基於一種類似於CTLA-4抗體的口服小分子藥物,它能誘導T細胞活化,臨牀前的研究表明,在免疫活性結腸癌動物模型中,BPI-002與檢查點抑制劑具有協同作用。BPI-002目前正在進行臨牀前研究,我們計劃在2019開始一項臨牀研究。我們的IKK計劃,BPI-003,是基於一種新的小分子抑制劑IKK,一種蛋白激酶。IKK參與了一些腫瘤細胞的存活,以及多種細胞因子和生長因子的產生,這些細胞因子和生長因子作為多種腫瘤的生存因子。我們的IKK抑制劑在多種胰腺癌動物模型上顯示出了良好的活性。
BPI-004程序
我們的BPI-004計劃的重點是一個小分子,它能誘導腫瘤細胞產生新抗原,從而使不含免疫細胞的腫瘤被免疫系統所浸潤。很大比例的人類癌症不會產生免疫系統識別的抗原。因此,這些腫瘤對通過與患者免疫反應的相互作用而起作用的治療方法沒有反應。例如,這些腫瘤對Pd-1抑制劑的治療無效.一種誘導腫瘤細胞產生抗原的治療方法有可能使這些癌症對PD-1抑制劑產生反應。
與華盛頓大學的合作
我們還在研究一種替代的癌症治療方法,在這種方法中,引起疾病的蛋白質被標記為早期降解。這種方法使用一種叫做泛素E3連接酶的蛋白質來靶向和促進對致癌基因等致病蛋白的破壞。為了引發降解,目標蛋白被一種特定的泛素連接酶標記為聚泛素。多聚泛素是細胞蛋白酶體機制中的一個指示標記,表明靶蛋白應被破壞。一種標記目標蛋白的方法是使用“分子膠”將泛素連接酶與目標蛋白結合。
我們正與霍華德·休斯醫學研究所(Howard Hughes Medical Institute)的研究員鄭寧博士(Dr.ning鄭)和他在華盛頓大學(University Of Washington)的團隊合作,研發一種獨特的“分子膠”,用於選擇性地將某些癌基因蛋白標記為E3連接酶。BeyondSpring的聯合創始人黃博士和鄭博士首先發現了僅有的兩類E3連接酶的晶體結構。這一工作為選擇小分子作為一種潛在的“分子膠”奠定了結構基礎。前兩個靶蛋白是癌基因KRAS和c-myc.KRAS在胰腺、結腸癌、肺癌和子宮癌中經常發生突變,而c-myc基因在乳腺癌、卵巢癌和前列腺癌中經常擴增。這一新的平臺技術具有顯著降低細胞中癌基因蛋白含量的潛力,而這種致病蛋白並不是目前治療方法所針對的目標。
其他適應症中的Plinbulin
RAS突變腫瘤
我們已經發現,腫瘤中含有一種叫做RAS的癌基因突變,對Plinbulin特別敏感。癌基因是一種改變或突變形式的基因,涉及正常細胞生長,有可能導致癌症。一種特殊的癌基因是RAS基因(HRAS、KRAS和NRAS)的突變。我們相信,根據臨牀前研究的數據,普林布林將與標準的護理劑在RAS突變的腫瘤,包括非小細胞肺癌和結直腸癌。KRAS突變在很大比例的腫瘤中存在,其中包括16%的NSCLC、36%的結腸腺癌和69%的胰管腺癌。
78
目錄
在一項臨牀前研究中,Plinbulin導致了一個含有突變KRAS基因的小鼠多發性骨髓瘤模型的存活率增加。下圖顯示了與未使用Plinbulin的小鼠相比,含有突變KRAS基因的小鼠在Plinbulin治療後的存活情況。劑量水平為7.5mg/kg,每週2次,共3周,小鼠中位生存期為35天,對照組為15天(p=0.0041)。

雖然特定的KRAS突變被認為不是膠質母細胞瘤的主要原因,但系統分析估計88%的膠質母細胞瘤中通過KRAS途徑的信號改變。普林布林能夠跨越血腦屏障,在KRAS驅動的膠質母細胞瘤小鼠模型中具有顯著的生存優勢。
雖然我們繼續主要集中在使用普林布林在CIN,晚期非小細胞肺癌和結合免疫腫瘤學制劑,如果有必要的資源和資金,我們可能決定進一步研究的作用,在RAS突變腫瘤。
知識產權
我們的產品候選產品及其使用方法的專利性質和保護是我們開發和商業化新藥戰略的重要組成部分,詳情如下。我們已經在美國和其他國家申請了與我們的某些產品候選者有關的美國專利和專利申請,並且正在為他們和我們的其他產品候選人和技術尋求更多的專利保護。
Our success will depend significantly on our ability to obtain and maintain patent and other proprietary protection for our product candidates and other commercially important products, technologies, inventions and know-how, as well as on our ability to defend and enforce our patents including any patent that we have or may issue from our patent applications, preserve the confidentiality of our trade secrets and operate without infringing the valid and enforceable patents and proprietary rights of other parties.
截至2018年月28,我們擁有或共同擁有72個專利,分佈在34個司法管轄區,其中包括17項美國專利。我們還擁有5項美國非臨時專利申請以及其他司法管轄區的相應專利申請和5項美國臨時專利申請。此外,我們還擁有三份根據PCT提交的國際專利申請,我們計劃在美國和其他國家提交申請,目的是減少CIN,治療使用微管蛋白結合化合物,以及劑量方案。我們還擁有一項在PCT下提交的國際專利申請,我們計劃在美國和其他國家對含有BPI-002的成分和使用BPI-002的方法提出申請。
79
目錄
截至2002年2月28日,我們的專利組合包括13項美國頒發的專利,涉及Plinabin和Plinabin類似物,它們的合成及其在治療各種疾病中的應用。In particular, we owned six issued U.S. patents directed to the Plinabulin composition of matter, methods of synthesizing Plinabulin, and methods of treating various disorders with Plinabulin including various cancers such as lung cancer, NSCLC, breast cancer, skin cancer, prostate cancer, and myeloma, and fungal infections, and methods of using Plinabulin for inhibiting cell proliferation, promotion of microtubule depolymerization, and inducement of vascular collapse in a tumor.這些美國專利原定於2021至2025年間到期,但不包括任何潛在的專利修復期。專利組合還包括在日本、韓國、中國、歐洲和其他國家等33個外國管轄區授予的相應專利。
個人專利的期限可能因獲得專利的國家而異。在我們提出申請的大多數國家,包括美國在內,所頒發的專利的期限通常是從適用國家的非臨時專利申請的最早提出申請之日起20年。在美國,在某些情況下,專利的期限可以通過專利期限的調整而延長,這種調整延長了專利的期限,以説明美國專利條約組織的行政拖延,超過了專利申請人在起訴過程中自身的拖延,或者如果專利因共同擁有的專利提前到期而被最終拒絕,則可以縮短。此外,在某些情況下,某一特定藥物產品的一項專利的期限可以恢復(延長),以收回由於FDA監管審查期而有效喪失的部分期限。但是,修復期不得超過5年,包括修復期在內的總專利期限在FDA批准後不得超過14年。我們計劃尋求將我們的一項美國專利擴展到普林布林,或者在適當的時候使用它。
在某些外國法域,也可以獲得類似於對監管拖延的補償的延期。一項專利所提供的實際保護因求償要求和各國的不同而不同,取決於許多因素,包括專利的類型、覆蓋範圍、任何專利展期或調整的可得性、某一特定國家法律補救辦法的可得性以及專利的有效性和可執行性。特別是,歐盟和日本可能可以延長五年。我們計劃酌情尋求這種延長。
此外,生物技術和醫藥產品和工藝的專利地位,如我們打算開發和商業化的專利,一般都是不確定的,涉及複雜的法律和事實問題。迄今為止,美國還沒有就此類專利允許的範圍採取一致的政策。美國以外的專利保護範圍更加不確定。美國和其他國家專利法或專利法解釋方面的變化已經削弱並可能進一步削弱我們保護髮明和執行知識產權的能力,更廣泛地説,可能會影響知識產權的價值。
此外,雖然我們已經為我們的產品候選者獲得了一些已頒發的專利,但我們無法預測從我們待決的專利申請中可能發出的索賠要求的範圍,或者可能已經或可能從其他人擁有的專利和專利申請中發出的索賠。多年來,在我們集中我們的發展努力的領域進行了大量的科學和商業研究,這導致其他各方擁有若干已頒發的專利和與這些領域有關的待決專利申請。美國和其他地方的專利申請一般在優先日期起18個月後才公佈,而科學或專利文獻中的發現的公佈往往大大晚於基礎發現的日期。因此,與我們目前產品候選產品類似的藥品的專利和專利申請,以及我們今後可能開發的任何藥物、發現或技術,可能已經頒發或提交,這可能禁止我們將產品候選品商業化。
80
目錄
生物技術和製藥業的特點是就專利和其他知識產權進行廣泛的訴訟。我們的能力,以維持和鞏固我們的專利地位,我們的產品候選人和技術將取決於我們成功地獲得有效的索賠和執行這些索賠一旦批准。我們不知道我們目前擁有的任何待決專利申請,可能會提交或許可他人將導致任何專利的頒發。我們所擁有或將來可能獲得的已發專利,可能會受到質疑、失效或規避,而根據任何已發出的專利所授予的權利,亦未必能為我們提供專利保護或競爭優勢,以對抗擁有同類技術的競爭對手。此外,我們的競爭對手可能能夠獨立開發和商業化類似的藥物,或複製我們的技術、商業模式或戰略,而不會侵犯我們的專利。由於開發一種藥物的臨牀開發和監管審查所需的時間很長,因此,在我們的任何產品候選產品商業化之前,任何相關的專利都有可能在商業化後短期內過期或繼續有效,從而減少任何此類專利的任何優勢。
在某些有限的情況下,我們可以依靠商業機密和未申請專利的技術來保護我們的技術。然而,商業祕密很難保護。我們尋求保護我們的專有技術和流程,部分是通過與顧問、科學顧問和承包商簽訂保密協議,以及與我們的員工簽訂發明轉讓協議。我們亦致力維護我們的數據和商業機密的完整性和保密性,方法是維持樓宇的實體安全,以及資訊科技系統的實物和電子保安。雖然我們對這些個人、組織和制度有信心,但協議或安全措施可能會被違反,我們可能沒有足夠的補救措施來對付任何違反行為。此外,我們的商業祕密可能會被其他競爭者所知曉或獨立發現。如果我們的顧問、承包商或合作者在為我們工作時使用他人擁有的知識產權,則可能會就相關或由此產生的技術和發明方面的權利產生爭議。
我們在商業上的成功在一定程度上還取決於不侵犯其他各方的所有權。如果有其他人聲稱涉及或涉及我們產品候選方方面的任何專利,我們就必須改變我們的商業戰略發展,重新設計我們的產品候選或工藝,獲得許可證或停止某些活動。這樣的許可可能無法在合理的商業條件下獲得,也可能要求我們停止產品候選產品的開發或商業化。此外,我們違反任何許可協議或未能獲得我們開發或商業化產品候選人可能需要的專有權利的許可,將對我們產生重大的不利影響。If others have prepared and filed patent applications in the U.S. that also claim technology to which we have filed patent applications or otherwise wish to challenge our patents, we may have to participate in interferences, post-grant reviews, inter partes reviews, derivation or other proceedings in the USPTO and other patent offices to determine issues such as priority of claimed invention or validity of such patent applications as well as our own patent applications and issued patents.
有關這些風險和與知識產權有關的其他風險的更多信息,見“項目3”。關鍵信息--D.風險因素--與我們的知識產權有關的風險。“
競爭
我們的行業競爭非常激烈,而且會發生迅速而重大的變化。我們相信,我們的發展和商業化經驗、科學知識和工業關係為我們提供了競爭優勢,但我們也面臨着來自制藥和生物技術公司,包括專業製藥公司和非專利藥品公司、學術機構、政府機構和研究機構的競爭。
G-CSF是一種促進中性粒細胞存活、增殖和分化的蛋白,可以預防或治療中性粒細胞減少。重組G-CSF療法,如短效藥物filgrtim(Neupogen)和長效藥物pegfilgrashtim(Neulasta),通常用於預防和治療CIN.這些競爭療法的主要製造商是安進。
一些大型製藥和生物技術公司目前正在銷售和銷售藥物,或正在開發治療癌症的藥物,我們正在為這些藥物開發產品候選產品。例如,Genetech公司和Eli Lilly and Company目前都在銷售和銷售藥物Tarceva和Cyramza。CYRAMZA被批准治療NSCLC,一旦疾病在含鉑化療後進展。此外,一些額外的藥物目前正在進行中的第三階段臨牀試驗作為NSCLC的第二和第三線治療,如果獲得監管批准,它們可能成為競爭對手。
我們正在研究一種替代的癌症治療方法,使用分子膠技術標記泛素連接酶的癌基因蛋白並破壞這些蛋白質,同時也有許多公司正在努力利用這種技術來靶向和破壞癌基因蛋白。見“-Plinbulin,我們的主要藥物候選人-其他項目。”
81
目錄
與我們相比,我們的許多競爭對手擁有更長的經營歷史、更好的知名度、更強的管理能力、更好的供應商關係、更多的技術人員和銷售人員以及更多的財務、技術或營銷資源。製藥和生物技術行業的兼併和收購可能導致更多的資源集中在我們的競爭對手中。如果我們的競爭對手開發或銷售比我們目前的產品候選人更有效、更安全或成本更低的產品或其他新療法,或者我們可能開發的任何未來產品候選產品,或我們可能開發的任何未來產品候選產品,我們的商業機會就會減少或消失,或者我們可能比我們目前的產品候選人或任何此類未來產品候選人獲得批准的速度更快。我們的成功在一定程度上取決於我們識別、開發和管理比競爭產品更安全、更有效的產品組合的能力。
政府管制
美國聯邦、州和地方各級政府當局以及其他國家的政府當局,除其他外,廣泛管制藥物產品的研究和臨牀開發、測試、製造、質量控制、批准、標籤、包裝、儲存、記錄保存、促銷、廣告、分銷、批准後監測和報告、營銷、定價、進出口和進口,例如我們正在開發的藥品。一般而言,在一種新藥上市之前,必須獲得大量數據,證明其質量、安全性和有效性,組織起來,以滿足每個監管當局的具體要求和格式,提交審查並經監管當局批准。這一過程非常漫長和昂貴,成功是不確定的。
毒品也受其他聯邦、州和地方法規的制約。在獲得監管批准和隨後遵守適當的聯邦、州、地方和外國法規和條例的過程中,需要花費大量的時間和財政資源。在產品開發過程、批准過程或批准之後的任何時候,如果不遵守適用的法規要求,申請人可能會受到行政或司法制裁。These sanctions could include, among other actions, the regulatory authority’s refusal to approve pending applications, withdrawal of an approval, clinical holds, untitled or warning letters, voluntary product recalls or withdrawals from the market, product seizures, total or partial suspension of production or distribution, injunctions, disbarment, fines, refusals of government contracts, restitution, disgorgement, or civil or criminal penalties.任何此類行政或司法執行行動都可能對我們產生重大不利影響。
美國法規
美國政府監管與產品審批
除其他外,美國聯邦、州和地方各級政府當局對藥品產品的研究、開發、測試、製造、質量控制、批准、標籤、包裝、儲存、記錄保存、促銷、廣告、分銷、批准後監測和報告、營銷、進出口等方面進行了廣泛的監管。在美國,FDA根據FDCA及其實施條例和“FDCA”和“公共衞生服務法”及其實施條例對藥物和生物製品進行監管。
國會不時地起草、提出和通過立法,這將大大改變FDA管制的產品的批准、製造和銷售的法定規定。除了新的立法,FDA的法規和政策經常被FDA修訂或重新解釋,其方式可能會對我們的業務和我們的產品候選人或我們可能開發的任何未來產品候選人產生重大影響。不可能預測是否會頒佈或實施進一步的立法或FDA法規或政策變化,以及這些變化的影響(如果有的話)。
82
目錄
美國藥物開發進程
獲得法規批准和保持遵守適當的聯邦、州和地方法規和條例的過程需要花費大量的時間和財政資源。在產品開發過程、批准過程或批准之後的任何時候,如果不遵守適用的美國要求,申請人可能會受到行政或司法制裁,或導致自願召回產品。行政或司法制裁可包括林業發展局拒絕批准待決的申請、撤銷批准、臨牀扣押、無名稱或警告信、沒收產品、完全或部分暫停生產或分銷、禁令、罰款、拒絕政府合同、歸還、扣押或民事或刑事處罰。FDA要求的藥品在美國上市前所需的過程通常包括以下幾個方面:
| · |
根據良好的實驗室慣例或GLP法規完成非臨牀實驗室試驗、臨牀前研究和配方研究;
|
| · |
向FDA提交IND,在人體臨牀試驗開始前必須生效;
|
| · |
在每項試驗開始之前,在每個臨牀地點由獨立的IRB批准;
|
| · |
根據GCP進行充分和嚴格控制的人體臨牀試驗,以確定該產品的安全性和有效性,以供其預期使用;
|
| · |
為一種藥物準備和提交給FDA的NDA;
|
| · |
如果適用的話,令人滿意地完成林業發展局諮詢委員會的審查;
|
| · |
令人滿意地完成食品和藥品管理局對生產該產品或其部件的生產設施的檢查,以評估是否符合cGMP要求;以及
|
| · |
支付用户費用和FDA審查和批准的NDA。
|
測試和批准過程需要大量的時間、精力和財政資源,我們無法確定我們的產品候選人或我們可能開發的任何未來產品候選人的任何批准都將被及時批准,如果有的話。
一旦確定了藥物候選產品的開發,它就進入了非臨牀試驗階段。非臨牀試驗包括產品化學、毒性、配方和穩定性的實驗室評估,以及臨牀前研究。IND贊助商必須將非臨牀測試的結果,連同製造信息、分析數據和任何可用的臨牀數據或文獻,作為IND的一部分提交給FDA,然後才開始在人體中進行任何測試。IND贊助商還必須包括一份協議,除其他外,詳細説明臨牀試驗的目標、劑量程序、主題選擇和排除標準、用於監測安全的參數,以及如果初步臨牀試驗有助於進行療效評估,將評估的有效性標準。一些非臨牀測試甚至可能在IND提交之後繼續進行。IND在FDA收到後30天自動生效,除非FDA提出與建議的臨牀試驗有關的關切或問題,並在30天的時間內對試驗進行臨牀擱置。在這種情況下,IND贊助商和FDA必須解決任何懸而未決的問題,才能開始臨牀試驗。臨牀擱置也可以由FDA在臨牀試驗之前或期間因安全問題或不遵守規定而實施,也可以對某一類產品中的所有產品實施。FDA還可以強制實施部分臨牀擱置,例如,禁止在某一時間或某一劑量啟動臨牀試驗。
我們目前正在兩個IND下進行臨牀試驗。我們的研究人員與研究者領導的臨牀試驗是在不同的獨立臨牀試驗下進行的.
83
目錄
所有臨牀試驗必須在一名或多名符合GCP規定的合格調查人員的監督下進行。這些規定包括要求所有研究對象在參與任何臨牀試驗之前都必須以書面形式提供知情同意。此外,代表每一所參與臨牀試驗的機構的IRB,必須在該機構開始進行任何臨牀試驗前,審查和批准該計劃,而IRB必須至少每年進行一次審查和重新批准該項研究。IRB負責保護臨牀試驗對象的權利,除其他外,考慮是否將參與臨牀試驗的個人的風險降到最低,與預期的利益相比是否合理。該局亦會批准有關臨牀試驗的資料,以及必須向每一臨牀試驗當事人或其法定代表提供的同意書,並須監察該項臨牀試驗,直至完成為止。每一項新的臨牀協議和對該協議的任何修改都必須提交FDA審查,並提交IRBs批准。
人類臨牀試驗通常分三個順序階段進行,這些階段可能重疊或合併:
| · |
第一階段。該產品最初被引入少數健康的人體受試者或患者,並測試安全性、劑量耐受性、吸收、代謝、分佈和排泄,並在可能的情況下獲得關於有效性的早期證據。對於某些嚴重或危及生命的疾病的產品,特別是當產品被懷疑或已知不可避免地有毒時,可以在病人中進行初步的人體測試。
|
| · |
第二階段。該藥物應用於有限的患者羣體,以確定可能的副作用和安全風險,初步評估該產品對特定目標疾病的療效,並確定劑量耐受性和最佳劑量和時間表。
|
| · |
第三階段。這種藥物通常在地理位置分散的臨牀試驗地點向擴大的病人羣體使用,以便產生數據以評估該產品的有效性和安全性以供批准,確定該產品的總體風險效益概況,併為該產品的標籤提供充分的信息。
|
詳細説明臨牀試驗結果的進度報告必須至少每年向食品和藥物管理局提交,安全報告必須在15個日曆日內提交給FDA和臨牀調查人員,以應對嚴重和意外的可疑不良事件,任何在臨牀上嚴重懷疑不良反應的發生率比禮賓手冊或調查員手冊所列的嚴重不良反應率有任何重要的增加,或其他任何發現。研究,動物或體外試驗,表明在人類暴露於藥物候選的顯著風險。此外,保薦人必須在保薦人收到信息後7個日曆日內通知FDA任何意外、致命或危及生命的可疑不良反應。第一階段、第二階段和第三階段的測試可能無法在任何指定的時間內成功完成,如果有的話。FDA或贊助商可以基於各種理由隨時暫停或終止臨牀試驗,包括研究對象或患者正面臨不可接受的健康風險的發現。同樣,如果臨牀試驗沒有按照IRB的要求進行,或者產品對受試者造成意外的嚴重傷害,IRB可以暫停或終止對其機構的臨牀試驗的批准。
在進行臨牀試驗的同時,公司通常完成額外的臨牀前研究,還必須開發關於產品的化學和物理特性的額外信息,並根據cGMP的要求,最終確定產品的商業化生產工藝。生產過程必須能夠持續地生產高質量批次的產品藥物,除其他外,製造商必須制定方法來測試最終產品的特性、強度、質量和純度。此外,必須選擇適當的包裝並進行測試,並且必須進行穩定性研究,以證明該產品的藥品在其保質期內不會發生不可接受的變質。
美國審查和批准程序
產品開發、非臨牀研究和臨牀試驗的結果,以及關於生產過程的其他詳細信息、對該產品進行的分析測試、擬議的標籤和其他相關信息,作為NDA的一部分提交給FDA,要求批准該新藥的銷售。根據經修訂的處方藥使用者費用法,申請人必須向FDA支付審查NDA的費用。這些使用費,以及商業製造機構和核準產品所需的年費,都可能很大。單是NDA的審查費目前就可能超過240萬美元,而且可能會隨着時間的推移而增加。用户費用要求須受某些有限的延期、豁免和減免的限制。
84
目錄
FDA在提交後60天內對所有提交的NDAs進行審查,以確保它們在接受提交文件之前足以完成實質性審查。FDA可能要求提供更多的信息,而不是接受NDA的備案。在這種情況下,NDA必須與補充信息一起重新提交.重新提交的申請在FDA接受備案之前也要經過審查.
一旦提交的申請被接受備案,FDA就開始進行深入的實質性審查.The FDA’s established goal is to review 90% of NDA applications given “Priority” status – where there is evidence that the proposed product would be a significant improvement in the safety or effectiveness in the treatment, diagnosis, or prevention of a serious condition – within 6 months, and 90% of applications given “Standard” status within 10 months, whereupon a review decision is to be made.然而,FDA可能不會在這些既定目標範圍內批准一種藥物,其審查目標也會不時發生變化。FDA對NDA進行審查,以確定一種產品是否安全有效,是否適合其預期用途。FDA還評估產品的製造是否符合cGMP,以確保產品的特性、強度、質量和純度。在批准NDA之前,FDA通常會檢查該產品正在或將要生產的設施。FDA將不會批准申請,除非它確定生產過程和設施符合cGMP要求,並足以確保產品在所要求的規格範圍內一致生產。FDA還可以將NDA提交給一個諮詢委員會,以審查、評估和建議是否應該批准該申請,以及在什麼條件下批准該申請。諮詢委員會是一個專家小組,包括臨牀醫生和其他科學專家,他們應FDA的要求提供諮詢意見和建議。FDA不受諮詢委員會建議的約束,但在作出決定時會考慮這些建議。
審批過程漫長而困難,如果適用的監管標準不符合或可能需要額外的臨牀數據或其他數據和信息,FDA可能拒絕批准NDA。即使提交了這些數據和信息,FDA也可能最終決定NDA不符合批准標準。從臨牀試驗中獲得的數據並不總是決定性的,FDA對數據的解釋可能與我們對相同數據的解釋不同。如果FDA決定不批准目前形式的NDA,FDA將發出一封完整的回覆信。完整的回覆信通常描述FDA在NDA中發現的所有具體缺陷,這些缺陷必須得到滿意的解決,才能得到批准。所發現的缺陷可能是輕微的,例如,需要標記改變,或主要,例如,需要額外的臨牀試驗。此外,完整的回覆信可能包括建議申請人採取的行動,以便將申請置於批准的條件下。如果發出了完整的答覆函,申請人可以重新提交NDA,解決信中指出的所有缺陷,或者撤回申請,或者要求有機會進行聽證。
如果一種產品獲得監管批准,其批准可能大大限於特定的疾病和劑量,或者使用的指徵可能受到限制,這可能限制該產品的商業價值。此外,FDA可能要求在產品標籤中包括某些禁忌、警告或預防措施。此外,FDA可能需要進行批准後的研究,包括第四階段的臨牀試驗,以便在NDA批准後進一步評估產品的安全性和有效性,並可能需要測試和監測項目來監測已商業化的核準產品的安全性。FDA還可能得出結論,NDA只能通過REMS批准,其目的是通過藥物指南、醫生溝通計劃或其他確保安全使用的因素,例如限制分發方法、病人登記和其他風險最小化工具來減輕風險。
核準後要求
85
目錄
我們獲得FDA批准的任何產品都將受到FDA的持續監管,除其他外,包括記錄保存要求、報告該產品的不良體驗、向FDA提供最新的安全和功效信息、產品取樣和分銷要求、遵守某些電子記錄和簽名要求以及遵守FDA的促銷和廣告要求。FDA嚴格規定標籤,廣告,促銷和其他類型的信息,產品投放市場。產品只能根據批准的標識和授權標籤的規定進行推廣。此外,製造商必須繼續遵守cGMP的要求,這些要求是廣泛的,需要大量的時間、資源和持續的投資來確保遵守。此外,在實施之前,對生產過程的更改通常需要事先得到FDA的批准,而對批准產品的其他類型的更改,例如添加新的標識和附加的標籤聲明,也要經過FDA的進一步審查和批准。
製造商和參與生產和銷售核準產品的其他實體必須向食品和藥品管理局和某些州機構登記其機構,並定期接受食品和藥品管理局和某些州機構的檢查,以確保符合cGMP和其他法律。cGMP要求適用於生產過程的各個階段,包括產品的生產、加工、滅菌、包裝、標籤、儲存和裝運。製造商必須建立有效的系統,以確保產品符合規格和法規要求,並在產品發佈前對每一批或每批產品進行測試。我們依賴並期望繼續依賴第三方來生產我們的產品候選產品的臨牀數量,以及我們可能開發的任何未來產品候選產品。未來的FDA和州檢查可能會在我們的合同製造商的設施中發現可能擾亂生產或分配的合規問題,或者可能需要大量的資源來糾正。
如果不遵守監管要求,或者在產品上市後出現問題,FDA可以撤回產品批准。後來發現一個產品以前未知的問題可能會限制產品的銷售,甚至完全退出市場。Further, the failure to maintain compliance with regulatory requirements may result in administrative or judicial actions, such as fines, untitled or warning letters, holds on clinical trials, product seizures, product detention or refusal to permit the import or export of products, refusal to approve pending applications or supplements, restrictions on marketing or manufacturing, injunctions or consent decrees, or civil or criminal penalties, or may lead to voluntary product recalls.
專利條款恢復與市場獨佔性
根據FDA批准使用我們的產品候選產品的時間、期限和具體情況,或者我們可能開發的任何未來產品候選產品,我們的一些美國專利可能有資格根據1984“藥品價格競爭和專利期限恢復法案”(通常稱為“哈奇-瓦克斯曼法案”)獲得有限的專利期限延長。“哈奇-瓦克斯曼法案”允許專利恢復期長達五年,作為對產品開發和FDA監管審查過程中失去的專利期限的補償。但是,專利期限的恢復不能將專利的剩餘期限延長到自產品批准之日起的14年以上。專利期限恢復期一般為IND生效日期至NDA提交日期之間的一半時間,再加上從NDA提交日期到批准該申請之間的時間,但這一審查期縮短了申請人未進行盡職調查的任何時間。只有一項適用於已批准產品的專利才有資格獲得延長,而且必須在專利期滿前提交延期申請。USPTO與FDA協商,審查並批准任何延長或恢復專利期限的申請。將來,如果有,我們打算根據臨牀試驗的預期時間和在提交有關的NDA時涉及的其他因素,為我們目前擁有的一些專利申請恢復專利期限;然而,任何此類延長都可能不會授予我們。
FDCA的市場獨家條款也可能推遲某些申請的提交或批准。FDCA向第一個獲得NDA批准的新化學實體的申請人提供了五年的非專利營銷獨佔權。藥物是一種新的化學實體,如果FDA以前沒有批准任何其他新藥物含有相同的活性單元,這是對藥物物質的作用負責的分子或離子。在排他期內,FDA不得接受由另一家公司提交的一份縮寫新藥申請,或ANDA,或505(B)(2)NDA,如果申請人不擁有或有權查閲所有需要批准的數據,則不得接受另一種藥物的另一版本。但是,如果申請中包含專利無效或不侵權的證明,則四年後可以提交申請。The FDCA also provides three years of marketing exclusivity for an NDA, 505(b)(2) NDA or supplement to an existing NDA if new clinical investigations, other than bioavailability studies, that were conducted or sponsored by the applicant are deemed by the FDA to be essential to the approval of the application, for example, new indications, dosages or strengths of an existing drug.這三年的獨家只涉及與新的臨牀調查相關的使用條件,不禁止FDA批准含有原活性藥物的ANDA。五年和三年的獨家經營不會延誤完整的NDA的提交或批准.然而,提交完整的NDA的申請人將被要求進行或獲得對所有非臨牀研究和充分和良好控制的臨牀試驗的參考權,以證明安全性和有效性。
86
目錄
臨牀試驗資料的披露
FDA監管產品的臨牀試驗的發起者,包括藥物,必須註冊和披露某些臨牀試驗信息,這些信息可在www.clinicaltrials.gov上公開查閲。有關產品、病人人數、調查階段、研究地點和調查人員以及臨牀試驗的其他方面的信息隨後作為登記的一部分公開。贊助商也有義務在完成後公佈他們的臨牀試驗結果。這些試驗結果的披露可以推遲到新產品或正在研究的新指示已經批准。競爭對手可以利用這些公開的信息來獲取有關開發項目進展的知識。
藥品覆蓋、定價和報銷
對於我們可以獲得監管批准的任何產品的覆蓋範圍和補償狀況,都存在着很大的不確定性。在美國,任何產品的銷售,如果我們可以獲得商業銷售的監管批准,部分將取決於第三方支付方是否能提供保險和補償。第三方支付者包括政府當局、受管理的醫療服務提供者、私營醫療保險公司和其他組織。確定付款人是否為產品提供保險的過程可以與設置付款人將支付產品的償還率的過程分開。第三方付款人可能會將保險範圍限制在批准清單上的特定產品上,或者處方中,而這些產品可能不包括FDA批准的所有特定產品。此外,付款人為產品提供保險的決定並不意味着將批准適當的償還率。可能無法獲得足夠的第三方補償,以使我們能夠維持足以實現產品開發投資的適當回報的價格水平。
第三方支付者除了對醫療產品和服務的安全性和有效性進行檢驗外,還越來越多地挑戰其價格,並對醫療產品和服務的醫療必要性和成本效益進行審查。為了獲得可能被批准銷售的任何產品的覆蓋範圍和補償,我們可能需要進行昂貴的藥物經濟學研究,以證明任何產品的醫療必要性和成本效益,以及獲得監管批准所需的費用。我們的產品候選人,或任何未來的產品候選人,我們可能開發,可能被認為是醫學上必要的,或成本效益。如果第三方支付者認為某一產品與其他可用療法相比不具有成本效益,他們在批准後可能不會將該產品作為其計劃下的一項福利,或者,如果他們這樣做了,付款水平可能不足以讓一家公司以盈利的方式銷售其產品。
美國政府和州立法機構對實施控制成本的計劃表現出了極大的興趣,以限制政府支付的醫療保健費用的增長,包括價格控制、報銷限制、非專利產品替代品牌處方藥的要求,以及提高藥品定價做法的透明度。例如,“平價醫療法案”載有可能降低藥品盈利能力的規定,例如,增加醫療補助方案償還的藥品的回扣,將醫療補助退税擴大到醫療補助管理的保健計劃,對某些醫療保險D部分受益人實行強制折扣,以及根據製藥公司向聯邦醫療保健項目銷售的份額收取年費。此外,公眾和政府對藥品成本和藥品定價策略的審查也越來越多,包括美國參議院、聯邦和州檢察官。通過政府管制和措施,以及在現有管制和措施的管轄範圍內收緊限制性政策,可能限制藥品的付款。
87
目錄
如果政府和第三方付款人未能提供足夠的保險和補償,我們獲得商業銷售管理批准的任何產品的可銷售性都可能受到影響。此外,美國對成本控制措施的重視也有所增加,我們預計,這將繼續加大對藥品定價的壓力。保險政策和第三方償還率也可能在任何時候發生變化.即使我們獲得監管批准的一個或多個產品獲得了有利的保險和補償地位,但在未來可能會實施較不優惠的保險政策和償還率。
其他醫療保健法律和法規
如果我們獲得我們的產品的監管批准,我們可能會受到各種聯邦和州的法律針對醫療行業的欺詐和濫用。這些法律可能會影響到,除其他外,我們建議的銷售,營銷和教育計劃。此外,我們可能受到聯邦政府和我們開展業務的州的病人隱私條例的約束。可能影響我們運作能力的法律包括:
| · |
the federal Anti-Kickback Statute, which prohibits, among other things, persons from knowingly and willfully soliciting, receiving, offering or paying remuneration, directly or indirectly, in cash or in kind, to induce or reward, or in return for, either the referral of an individual for, or the purchase, order, or recommendation of, an item or service reimbursable under a federal healthcare program, such as the Medicare and Medicaid programs;
|
| · |
federal civil and criminal false claims laws, false statement laws, and civil monetary penalty laws, which prohibit, among other things, individuals or entities from knowingly presenting, or causing to be presented, claims for payment from Medicare, Medicaid, or other third-party payors that are false or fraudulent, or making a false statement or record material to payment of a false claim or avoiding, decreasing, or concealing an obligation to pay money to the federal government;
|
| · |
HIPAA,它規定聯邦刑事和民事責任,以執行一項計劃,以欺騙任何醫療福利計劃,並作出虛假陳述有關的醫療保健事務;
|
| · |
聯邦透明度法律,包括“聯邦醫生支付陽光法”,該法案是“平價醫療法案”的一部分,要求適用的覆蓋藥品製造商披露向醫生和教學醫院以及醫生所有權和投資權益提供的付款和其他價值轉移;
|
| · |
經“經濟和臨牀健康保健信息技術法”及其實施條例修訂的“衞生信息技術促進經濟和臨牀衞生法”還對個人可識別的健康信息的隱私、安全和傳輸提出了某些要求;以及
|
| · |
state law equivalents of each of the above federal laws, such as anti-kickback and false claims laws which may apply to items or services reimbursed by any third-party payor, including commercial insurers, state laws that require pharmaceutical companies to comply with the pharmaceutical industry’s voluntary compliance guidelines, and state laws governing the privacy and security of health information in certain circumstances, many of which differ from each other 以重要的方式而不是被HIPAA搶先,從而使遵從性工作複雜化。
|
“平價醫療法案”擴大了欺詐和濫用法律的適用範圍,除其他外,修正了“聯邦反Kickback規約”和“美國法典”第42編第1320a-7b節所載適用的刑事醫療欺詐法規的意圖要求。根據該法律修正案,個人或實體不再需要實際瞭解本法規或違反該法的具體意圖才能實施違法行為。此外,“平價醫療費用法”規定,包括因違反聯邦反Kickback法規而產生的物品或服務在內的索賠,就“虛假索賠法”或民事罰款法規而言,構成虛假或欺詐性索賠。許多州通過了類似於聯邦反Kickback法規的法律,其中一些法律適用於將病人轉介到由任何來源報銷的醫療項目或服務上,而不僅僅是醫療保險和醫療補助計劃。
88
目錄
雖然我們不會直接向付款人提出索賠要求,但根據聯邦虛假索賠法和其他醫療法律,如果製造商被視為“導致”虛假或欺詐性索賠的提交,例如,向客户提供不準確的賬單或編碼信息,或推廣非標籤產品,則製造商可被追究責任。此外,我們未來與報告批發商或我們產品估計零售價格有關的活動,用於計算醫療補助退税信息和影響我們產品的聯邦、州和第三方報銷的其他信息的報告,以及我們產品的銷售和銷售,將根據“虛假索賠法”接受審查。對違反“虛假索賠法”的處罰包括政府實際遭受的損害賠償的三倍,加上強制性民事處罰,以及可能被排除在聯邦醫療保健項目之外的可能性。適用的民事罰款將因通貨膨脹而每年增加;自2017年2月3日起,對每一份虛假索賠的罰款為10,967美元至21,916美元。此外,儘管“聯邦虛假索賠法”是一項民事法規,但導致違反“虛假索賠法”的行為也可能涉及各種聯邦刑事法規。此外,個人有能力根據“聯邦虛假索賠法”提起訴訟,而且某些州也以“聯邦虛假索賠法”為範本頒佈了法律。
病人保護與平價醫療法案
2010頒佈的“平價醫療法案”包含了一些措施,這些措施已經或將顯著改變美國政府和私人保險公司為醫療保健提供資金的方式。“平價醫療法案”中對製藥業最重要的規定如下:
| · |
“醫療補助藥品回扣計劃”要求製藥企業與衞生和人類服務部部長簽訂國家退税協議,並與之生效,以此作為各州獲得聯邦匹配資金的條件,用於向醫療補助患者提供製造商的門診藥品。“平價醫療法案”將藥品製造商對大多數品牌處方藥的退税責任從平均製造商價格的15.1%增加到製造商平均價格的23.1%,增加了一種新的品牌產品固體口服劑型延伸線的退税計算,並修改了製造商平均價格的法定定義。“平價醫療法案”還擴大了醫療補助的使用範圍,但要有藥品回扣,要求製藥企業對醫療補助管理的醫療服務使用支付回扣,並擴大可能有資格享受醫療補助藥品福利的人口。
|
| · |
為了使一種藥品根據“醫療保險B部分”和“醫療補助計劃”獲得聯邦補償,或直接出售給美國政府機構,製造商必須向有資格參加340 B藥品定價計劃的實體提供折扣。“平價醫療法案”擴大了有資格獲得340 B折扣定價的實體類型。
|
| · |
“平價醫療法案”規定,品牌藥品製造商必須在醫療保險D部分患者的覆蓋率差距(即“甜甜圈洞”)的商定價格基礎上提供50%的折扣。
|
| · |
“平價醫療法案”對任何生產或進口某些品牌處方藥的實體規定了年度、不可扣減的費用,由這些實體根據它們在某些政府保健項目中的市場份額分攤,但這一費用不適用於專門為孤兒適應症批准的某些產品的銷售。
|
除這些規定外,“平價醫療法案”還設立了一些機構,其工作可能對某些藥品的市場產生未來的影響。These include the Patient-Centered Outcomes Research Institute, established to oversee, identify priorities in, and conduct comparative clinical effectiveness research, the Independent Payment Advisory Board, which has authority to recommend certain changes to the Medicare program to reduce expenditures by the program, and the Center for Medicare and Medicaid Innovation within the Centers for Medicare and Medicaid Services, to test innovative payment and service delivery models to lower Medicare and Medicaid spending.
89
目錄
“平價醫療法”一直面臨挑戰,並不斷努力廢除或部分廢除或修正該法案。自2016美國大選以來,特朗普總統和美國國會做出了大量的努力來廢除或修改“平價醫療法案”的全部或部分。2017,美國眾議院投票通過了AHCA,該法案將廢除“平價醫療法案”的許多條款。參議院曾考慮過但未能通過AHCA或類似的措施,但國會可能會考慮進一步立法,以廢除或取代“平價醫療法案”的內容。此外,特朗普總統於#date0#簽署的“減税和就業法案”廢除了平價醫療保險的個人醫療保險任務,該法案被認為是“平價醫療法案”的一個關鍵組成部分。因此,“平價醫療法案”或任何取代其內容的法律對我們的業務的全面影響仍然不清楚。這些法律和其他法律可能導致醫療保健資金的額外減少,如果我們獲得任何一個產品的批准,這可能會對我們的產品候選人的客户產生實質性的不利影響。雖然我們無法預測根據醫療保健和其他立法改革實施現有立法或頒佈補充立法對我們的業務產生的全面影響,但我們認為,如果我們獲得任何一項產品的批准,減少對我們產品的補償或限制其覆蓋範圍的立法或條例會對我們的產品候選人產生多大的負面影響,或者在何種情況下,醫療服務提供商將對我們的產品候選人進行處方或管理。
中國規則
在中國,我們在一個日益複雜的法律和監管環境中運作。我們受中國的各種法律、法規和法規的影響,影響到我們的業務的許多方面。這一部分總結了中國與我們的業務和業務有關的主要法律、法規和條例。
中國食品藥品監督管理局總條例
在中國,國家藥品監督管理局對藥品、醫療器械和設備的管理進行監督和監督。國家藥品監督管理局的主要職責包括:新藥、仿製藥、進口藥品和中成藥的評審、登記和審批;批准和發放藥品、醫療器械生產、進出口許可證;批准設立藥品生產、銷售企業;制定食品、化粧品、藥品監督管理行政法規和政策;處理重大事故。地方藥品行政主管部門負責本行政區域內藥品監督管理工作。
全國人民代表大會常務委員會於1984頒佈並分別於2001、2013和2015修訂的“中華人民共和國藥品管理法”和國務院於2002頒佈並於2016修訂的“中華人民共和國藥品管理法實施辦法”規定了藥品管理的法律框架,包括藥品的研究、開發和生產。
“中華人民共和國藥品管理法”分別於2001、2013和2015年月日進行了修訂。修訂的目的是加強對藥品的監督和管理,並確保這些供人類使用的產品的質量和安全。經修訂的“中華人民共和國藥品管理法”適用於從事藥品開發、生產、貿易、應用、監督管理的單位和個人。它規範和規定了醫療機構藥品製劑管理以及藥品開發、研究、製造、分銷、包裝、定價和廣告的框架。國務院頒佈的“中華人民共和國藥品管理法實施辦法修訂實施辦法”於2002年9月生效,2016修訂,為修訂後的“中華人民共和國藥品管理法”提供了詳細的實施條例。
根據這些規定,我們需要遵守相關的規定,非臨牀研究,臨牀試驗和新藥生產。
90
目錄
非臨牀研究良好實驗室實踐認證
為提高動物研究質量,國家食品藥品監督管理局於2003頒佈了“臨牀前實驗室良好實驗室管理辦法”,並於2017年7月修訂,並開始實施GLP認證計劃。2007年4月,中國藥監局發佈了“關於實驗室良好做法認證辦法的通知”,即“cfda通知”,規定cfda負責非臨牀研究機構的認證。根據“國家藥品監督管理局第214號通知”,藥品監督管理局根據機構的組織管理、研究人員、設備和設備以及非臨牀藥品項目的運作和管理情況,決定機構是否有資格從事非臨牀藥物研究。如果所有的要求都得到滿足,GLP認證將由CFDA頒發,其結果將在CFDA的網站上公佈。
目前我們正在進行的所有項目中,我們與CFDA認證的GLP實驗室合作,由Joinn實驗室運營,以根據GLP的要求進行研究。
批准臨牀試驗和新藥生產
根據國家藥品監督管理局2007頒佈的“藥品註冊規定”、2015年度全國人民代表大會常務委員會頒佈和修訂的“藥品管理法”、2009年度國家藥品監督管理局頒佈的“關於新藥註冊特別批准的通知”和2013年度發佈的“藥品臨牀試驗信息發佈平臺通知”,我們必須遵守以下規定:為臨牀試驗和新藥生產辦理手續並獲得多項批准。
臨牀試驗應用
非臨牀研究完成後,研究機構在進行臨牀試驗前,必須申請批准臨牀試驗申請。
國內第一類藥品專項審批
國內第1類新藥符合特殊審批條件
根據國家藥品監督管理局於2007頒佈的“藥品註冊規定”,藥品註冊申請分為三類,即國內新藥申請、國內通用藥品申請和進口藥品申請。藥物可分為三大類,即化學藥物、生物製品或中藥或天然藥物。1類藥物是一種從未在任何國家上市的新藥,將在中國生產。我們的產品候選產品符合國內一級新藥的資格。
國家藥品監督管理局根據“新藥註冊特別審批管理辦法”和國家藥品監督管理局2009年度頒佈的“特殊審批規定”,在下列情況下對新藥註冊申請進行專項審批:
| 1. |
從植物、動物、礦物等中提取的藥物及其製劑的有效成分在我國從未上市,新發現的是藥材及其製劑;
|
| 2. |
化學原料、藥品及其製劑、生物製品未經國內外市場批准;
|
| 3. |
新藥用於治療艾滋病、惡性腫瘤、罕見疾病等,在臨牀治療中具有明顯優勢;
|
| 4. |
這些新藥是用來治療沒有有效治療方法的疾病的。
|
91
目錄
“特別審批規定”規定,申請人在臨牀試驗申請階段,如屬第(一)、(二)項的範圍,可以申請特別審批。規定屬於第(三)項、第(四)項範圍內的產品候選人,在申報生產時,必須申請特別審批。
我們相信,我們目前的產品候選人屬於以上第(2)和(3)項。因此,我們可以在臨牀試驗申請階段申請特殊審批,使我們能夠在中國尋求一條更快捷的審批途徑,更快地為患者提供治療。
1類新藥相對於5類藥物的優勢
在制定“化學藥品註冊類別改革計劃”之前,3類藥品是跨國公司已在國外銷售但尚未在中國批准的藥品,並根據中國國家藥品監督管理局於2016頒佈的“化學藥品註冊類別改革計劃”,將3類藥品重新歸類為5類。與第5類藥物的申請相比,國內1類新藥的註冊途徑更為直截了當。根據“藥品註冊規定”,給予特殊審批待遇的,優先處理臨牀試驗製造申請,加強與國家藥品監督管理局藥品評價中心(簡稱CDE)的溝通,建立與申請人溝通的工作機制。臨牀試驗期間需要修改臨牀試驗方案或者其他重大變更的,申請人可以提出通信申請。當通訊申請獲得批准時,CDE將在一個月內安排與申請人的溝通。
相比之下,根據“藥品註冊條例”的規定,第5類藥物的登記途徑是複雜和不斷演變的。第5類藥物申請只能在一家公司獲得NDA批准並獲得由FDA或EMA等主要監管機構批准的CPP之後才能提交。跨國公司可能需要申請進行多區域臨牀試驗,這意味着公司沒有設計適合中國患者的臨牀試驗和護理標準的靈活性。第5類產品候選人可能沒有資格受益於快速軌道審查優先在臨牀試驗應用階段。此外,進一步開展本地臨牀試驗的要求可能會使其國際NDA批准的市場準入推遲幾年。此外,根據作為今後立法和檢驗指南的國務院“醫藥產品和醫療器械審批程序改革意見”,已在國外銷售的藥品今後可能不再屬於中國法律規定的新藥類別,因此可能無法享受新藥優惠待遇。為落實這一指導方針,國家藥監局於2016年3月發佈了“化學藥品註冊類別改革計劃”,改變了“藥品註冊規定”規定的化學藥品註冊類別。根據國家藥品監督管理局頒佈的“化學藥品註冊類別改革方案”的解釋,新藥是指從未在國內外銷售過的藥品。
我們的產品候選人都是新的治療劑,我們期望我們目前所有的產品候選人都屬於第一類申請程序。儘管監管框架通常需要在啟動臨牀發展的每個階段之前批准單獨的臨牀試驗申請,但在2015月份,cfda批准了我們的臨牀試驗應用,包括將普林布林與多西紫杉醇聯合應用於非小細胞肺癌的臨牀試驗的所有階段,並用於治療CIN。
對審查和批准程序的更改
2015年度,國務院發佈了“關於改革醫藥產品和醫療器械審批程序的意見”,提出了幾項可能有利於醫藥行業的政策調整:
| · |
一項加快創新藥物批准的計劃,其中包括特別審查和批准程序,重點是高度未得到滿足的醫療需求領域,包括艾滋病毒、癌症、嚴重傳染病、孤兒疾病和列在國家優先名單上的藥物;
|
92
目錄
| · |
制定一項政策,允許公司擔任營銷授權人,並僱用合同製造機構生產藥品;
|
| · |
一項改進臨牀試驗審批的計劃,允許公司在其他國家同時在中國進行臨牀試驗,並鼓勵當地臨牀試驗組織參與國際多中心臨牀試驗。
|
In November 2015, the Standing Committee of the National People’s Congress issued the Decision on Authorizing the State Council to Conduct the Pilot Program of the System of the Holders of Drug Marketing Licenses in Certain Areas and the Relevant Issues, which authorized the State Council to conduct the pilot program of the system of the holders of drug marketing licenses in Beijing, Tianjin, Hebei, Shanghai, Jiangsu, Zhejiang, 福建、山東、廣東、四川等地授權國務院對藥品註冊類別進行改革。
2015年度,國家藥品監督管理局發佈了“關於藥品註冊審批若干政策的通知”,進一步闡明瞭以下政策可能簡化和加快臨牀試驗審批程序:
| · |
對於新藥的臨牀試驗申請,將採用一次性總括批准程序,允許同時批准新藥臨牀試驗的所有階段,而不是目前的逐階段批准程序;
|
| · |
A fast track drug registration or clinical trial approval pathway will be available for the following applications: (1) registration of innovative new drugs treating HIV, cancer, serious infectious diseases and orphan diseases; (2) registration of pediatric drugs; (3) registration of geriatric drugs that treat China-prevalent diseases; (4) registration of drugs sponsored by national science and technology grants; (5) registration of innovative drugs using advanced technology, using innovative treatment methods, or having distinctive clinical benefits; (6) registration of foreign innovative drugs to be manufactured locally in China; (7) concurrent applications for new drug clinical trials which are already approved in the U.S. or European Union, or concurrent drug registration applications for drugs which have applied for marketing authorization and passed onsite inspections in the U.S. or European Union and are manufactured using the same production line in China; and (8) clinical 臨牀急用藥品三年內試驗申請,臨牀急用藥品市場許可申請一年內專利期滿。
|
2017年度,國家藥品監督管理局發佈了“關於鼓勵藥品創新優先評估批准的意見”,進一步規定了優先審批範圍。下列藥物將有權得到優先審查和批准:
| · |
Applications for drugs with obvious clinical benefits if any of the following circumstances applies: (1) registration applications for innovative drugs that are not marketed in China and abroad; (2) registration applications for innovative drugs to be manufactured locally in China; (3) registration applications for drugs using advanced formulation technology, using innovative treatment methods, or having distinctive clinical benefits; (4) clinical trial applications for patented drugs with patent to be expired (5)美國或歐洲聯盟已批准的新藥臨牀試驗同時申請,或已在美國或歐洲聯盟申請市場授權並通過現場檢驗的藥物同時申請,並在中國使用同一生產線製造;(6)註冊申請(七)國家科技資助的新藥註冊申請,其中臨牀試驗由國家臨牀醫學研究中心進行,經國家臨牀醫學研究中心管理部門批准。
|
93
目錄
| · |
在預防和治療以下疾病方面具有明顯臨牀效益的藥物的應用:(1)艾滋病毒;(2)肺結核;(3)病毒性肝炎;(4)孤兒疾病;(5)惡性腫瘤;(6)兒科藥物;(7)老年疾病。
|
2016年度,國務院辦公廳發佈41號通知,標誌着藥品營銷授權持有人制度最終投入實施。第41號通知允許北京、天津、河北、上海、江蘇、浙江、福建、山東、廣東、四川等地的藥品研發機構和研究人員擔任藥品註冊申請人,並提交藥品臨牀試驗和藥品營銷申請。在第41號通知生效後新註冊的藥品,申請人在提交藥品臨牀試驗或藥品銷售申請的同時,也可以提交成為藥品營銷授權人的申請。2016年度,國家藥品監督管理局發佈了“藥品營銷授權持有人制度試點工作通知”,進一步詳細介紹了41號通知規定的申請程序。2017年度,國家藥品監督管理局發佈了“藥品營銷授權持有人制度試點項目推廣事項通知”。本通知除其他外,旨在推動實施藥品銷售授權持有人制度試點方案,明確這些持有者的權利和義務,提高藥品製造過程的質量,並完善藥品生產和銷售供應鏈的責任制。
非自卑標準
在中國,一種藥物可能會得到監管機構的批准,而不會在其主要終點表現出優勢。相反,如果一種藥物在其主要終點顯示出非劣性,並且在其次要終點中顯示出優勢,則可以批准其使用。
加速或有條件批准
#date0#,中共中央、國務院辦公廳發佈了“關於深化審批制度改革和藥品、醫療器械創新的意見”。該意見規定,除其他外:
| · |
對急需臨牀實踐的藥品或醫療器械,應加快審批程序;
|
| · |
對於(一)治療不能有效治癒的危重和危及生命的疾病的藥品或者醫療器械,或者(二)迫切需要改善公眾健康的藥物或醫療器械,如果上述藥物或醫療器械的臨牀試驗的早期和中期指標顯示出療效和潛在的臨牀價值,可以有條件地批准這些藥品和醫療器械的銷售,以及希望銷售這些藥品和醫療器械的公司。藥品、醫療器械的上市,應當按照適用的要求制定風險控制方案進行研究;
|
| · |
某些新藥的專利期限可予延長,因為臨牀試驗和審批程序可能導致新藥上市延遲;以及
|
| · |
如果國外的臨牀試驗數據符合中國藥品和醫療器械註冊的適用要求,可以在中國進行藥品和醫療器械的註冊。
|
臨牀試驗的四個階段
臨牀試驗包括1、2、3和4期。第一階段指的是人體初步的臨牀藥理學和安全性評價研究。第二階段是指對患者特定適應症的藥物候選物的療效和安全性的初步評價,為第三階段臨牀試驗的設計和行政劑量方案的確定提供依據和支持。第三階段指臨牀試驗,以確認藥物的治療效果。第三階段用於進一步驗證該藥物對目標適應症患者的治療效果和安全性,評估該藥物的總體利益-風險關係,並最終為審查藥物註冊申請提供充分的證據。第四階段是指新藥上市後的研究,以評估藥物廣泛使用時的治療效果和不良反應,評估該藥物在一般人羣或特定羣體中使用時的總體利益-風險關係,以及調整給藥劑量等。
94
目錄
藥物臨牀實踐認證
為提高臨牀試驗質量,國家藥品監督管理局於2003頒佈了“藥品臨牀實習質量管理條例”。2004年度,國家藥品監督管理局發佈了“藥品臨牀實踐認證辦法(試行)辦法通知”,規定國家藥品監督管理委員會負責臨牀試驗機構的認證工作,中華人民共和國國家衞生計生委(原稱衞生部)負責與其職責範圍內的臨牀試驗機構認證有關的事項。根據“關於藥品臨牀實踐認證辦法的通知”(試行),國家藥品監督管理局和國家衞生計生委根據機構的組織管理、科研人員、設備和設施、管理制度和標準操作規程的評估,決定是否有資格進行藥品臨牀試驗。如果所有的要求都得到滿足,那麼GCP認證將由CFDA頒發,其結果將在CFDA的網站上公佈。
新藥應用
當臨牀試驗的第一、第二和第三階段已經完成時,申請人必須向國家藥品監督管理局申請批准國家藥品監督管理局。然後由CFDA根據CFDA的CDE提供的綜合評估意見確定是否批准申請。我們在中國與多西紫杉醇聯合應用普林布林作為非小細胞肺癌直接抗癌藥物的臨牀試驗申請已獲得批准,並於2016開始臨牀試驗。在我們的藥品在中國市場生產和銷售之前,我們必須獲得NDA的批准。
良好的製造實踐
在中國生產臨牀或銷售產品所使用的所有設備和技術必須按照cGMP準則操作,這是由cfda制定的。如果不遵守適用的要求,就可能導致製造業的終止和鉅額罰款。
動物試驗許可證
根據國家科學技術委員會於1988頒佈並於2011、7月修訂的“實驗動物管理條例”和國家科學技術委員會和其他監管部門於2001頒佈的“動物實驗證書管理辦法”,進行動物實驗需要有實驗動物使用證書。申請人必須符合下列條件:
| · |
實驗動物必須符合條件,並從有實驗動物生產證書的機構採購;
|
| · |
動物生存和繁殖的環境和設施必須符合國家要求;
|
| · |
動物飼料和水必須符合國家規定;
|
| · |
動物飼養實驗必須由專業人員、專業技術人員或者其他經過培訓的人員進行;
|
| · |
管理制度必須有成效和效率;以及
|
95
目錄
| · |
適用單位必須遵守中國法律、法規規定的其他要求。
|
國際多中心臨牀試驗條例
2015年月30日,國家藥監局發佈“國際多中心臨牀試驗指南(試行)”或“多中心臨牀試驗指南”(簡稱“多中心臨牀試驗指南”),自2015年3月1日起施行,旨在為規範國際多中心臨牀試驗在中國的應用、實施和管理提供指導。根據“多中心臨牀試驗指南”,國際多中心臨牀試驗申請人可以使用相同的臨牀試驗協議在不同的中心同時進行臨牀試驗。申請人計劃利用國際多中心臨牀試驗數據向國家藥品監督管理局申請批准的,該國際多中心臨牀試驗除符合“藥品管理法”及其實施條例、“藥品註冊規定”和有關法律、法規的要求外,還應當符合下列要求:
| · |
申請人應首先對全球臨牀試驗數據進行全面評估,並進一步對亞洲和中國臨牀試驗數據進行趨勢分析。在分析中國臨牀試驗數據時,申請人應考慮研究對象即參與患者的代表性;
|
| · |
申請人應分析中國研究對象的數量是否足以評估和判斷臨牀試驗藥物的安全性和有效性,並滿足統計和相關法律要求;
|
| · |
在岸和離岸國際多中心臨牀試驗研究中心應接受中國政府主管機構的現場檢查。
|
國際多中心臨牀試驗應遵循國際通行的GCP原則和倫理要求.申請應當保證臨牀試驗結果的真實性、可靠性和可信性;研究人員應當具備進行相關臨牀試驗的資格和能力;倫理委員會應當不斷審查試驗,保護受試者的利益、利益和安全。在國際多中心臨牀試驗實施前,申請人應當按照當地臨牀試驗規定的要求,取得臨牀試驗批准或者完整備案,並在CFDA藥物臨牀試驗信息平臺上登記和披露所有主要研究人員、臨牀試驗組織的信息。
在中國使用國際多中心臨牀試驗數據支持NDAS時,申請人應按照ICH-CTD(國際協調會議-共同技術文件)的內容和格式要求,提交完整的全球臨牀試驗報告、統計分析報告和數據庫以及相關的輔助數據;分組研究結果彙總和比較分析也應同時進行。
利用國際多中心臨牀試驗的臨牀試驗數據,可以避免不必要的重複臨牀試驗,從而進一步加快我國NDA的進程。
“中華人民共和國企業所得税法”及其實施
“經濟轉型法”及其實施細則允許某些高新技術企業在符合一定資格標準的前提下享受優惠的企業所得税税率。我們的一家中國子公司享有這樣的税收優惠。
2016年度3月23日,財政部和國家税務總局發佈了“關於全面推進增值税替代營業税試點項目的通知”。中華人民共和國税務機關自2016年5月1日起,對各地區、各行業徵收增值税代替營業税。增值税適用於某些服務的6%代替營業税,適用於銷售貨物和提供有形財產租賃服務的17%。一般增值税納税人在應税期間銷售的貨物或者提供的應税服務的應税增值税,是抵扣該期間投入增值税後該期間產出增值税的淨餘額。
96
目錄
關於知識產權的條例
專利
一般
根據“中華人民共和國專利法”(最近一次修訂於2008)及其實施細則(最近一次修訂於2010),中國專利分為發明專利、實用新型專利和設計專利三大類。發明專利是指就產品、方法或其改進提出的新的技術解決方案;本實用新型是指對產品的形狀、結構或組合提出的切實可行的新技術解決方案;設計專利是指某一產品的形狀、圖案或兩種顏色的組合的新設計,外形和圖案組合美觀,適合工業應用。根據“中華人民共和國專利法”,專利保護期自專利提交之日起生效。與實用新型和外觀設計有關的專利,自專利申請提出之日起10年內有效。“中華人民共和國專利法”採用“先申報”原則,即一人以上為同一發明提出專利申請的,先提出申請的人獲得專利。
現有的專利可能由於若干因素而失效或無法強制執行,包括缺乏新穎性和/或缺乏技術創新步驟,以及專利申請方面的缺陷。在中國,專利必須具有新穎性、創造性和實用性。根據“中華人民共和國專利法”,新穎性是指在專利申請提出之前,沒有任何相同的發明或實用新型在國內外的任何出版物中公開披露,也沒有以任何其他方式在中國境內或境外公開使用或向公眾公佈,也沒有任何其他人向專利當局提出描述相同情況的申請。發明或者實用新型,記錄在專利申請文件或者在備案日期後公佈的專利文件中。本發明步驟意味着,與現有技術相比,本發明具有突出的實質特徵,代表顯著的進步,實用新型具有實質性特徵,代表任何進步;實用適用性意味着可以製造或使用發明或實用新型,並可能產生積極的結果。中國的專利是向國家知識產權局(SIPO)申請的。通常,國家知識產權局在申請提出後18個月發佈發明專利申請,經申請人請求,可縮短申請時間。申請人必須在提出申請之日起三年內,向國家知識產權局申請進行實質性審查。
“中華人民共和國專利法”第二十條規定,在中國境內完成的發明或者實用新型,申請人(不限於中國公司和個人)在境外申請專利前,必須先提交國家知識產權局進行保密審查。不遵守這一要求將導致拒絕任何中國專利的主題發明。這項附加的保密審查要求引起了外國公司的關注,這些公司在中國開展研究和開發活動,或將研究和開發活動外包給中國的服務提供商。目前,我們有SIPO公佈的三項發明專利和在申請過程中的一項發明專利。
專利強制執行
未經專利權所有人同意擅自使用專利,偽造他人專利或者從事其他侵犯專利權的行為,侵權人將承擔侵權責任。偽造他人專利的嚴重罪行可受到刑事處罰。
97
目錄
當專利權人的專利權受到侵犯而產生糾紛時,中國法律要求當事人雙方必須先通過協商解決糾紛。但是,不能協商解決的,專利所有人或者認為專利被侵犯的利害關係人,可以向有關專利行政部門提起民事訴訟或者行政申訴。中國法院可以在提起任何法律程序之前或在訴訟期間,對專利所有人或利害關係方的請求發出初步強制令。侵權損害賠償按專利權人因侵權而遭受的損失計算,如果專利權人因侵權而遭受的損失不確定,侵權損害賠償應當作為侵權人從侵權行為中獲得的利益計算。如果很難以這種方式確定損害賠償,可以根據合同許可使用許可費用的合理倍數確定損害賠償。與其他司法管轄區一樣,除了一個明顯的例外,中國的專利所有者有責任證明專利受到侵犯。但是,如果一項新產品製造過程的發明專利的所有者聲稱其專利受到侵犯,則被指控的侵權人有責任證明該發明沒有被侵犯。據我們所知,我們對任何第三方專利的侵犯都是沒有爭議的。
醫學專利強制許可
根據“中華人民共和國專利法”的規定,出於公共衞生的目的,國家藥品監督管理局可以授予生產專利藥品並出口到中華人民共和國加入的有關國際條約所涵蓋的國家或地區的強制許可證。
無牌製造、使用、出售或進口專利藥物的豁免
“中華人民共和國專利法”規定,無證生產、使用、銷售或者進口專利藥品,有五種例外情況。下列情形不得視為侵犯專利權,未經專利權人許可,任何人可以生產、使用、銷售或者進口專利藥品:
| · |
使用、承諾銷售、銷售、進口專利產品或者按照專利方法直接取得的產品,由專利權人或者其被許可的單位或者個人銷售的;
|
| · |
製造相同產品、使用相同方法或者在專利申請之日前為製造或者使用作必要準備的,繼續生產或者僅在原範圍內使用;
|
| · |
臨時通過中國領土、領水或者領空的外國運輸設施,按照中國與外國運輸設施所屬國家締結的協議或者兩國締結的國際條約,或者根據互惠原則,為自己的需要使用其裝置和設施的有關專利;
|
| · |
僅為科學研究和實驗目的使用有關專利的人;或
|
| · |
為提供行政批准所需信息而製造、使用或進口專利藥品或專利醫療設備的,或為上述人員製造、使用或進口專利藥品或專利醫療設備的。
|
然而,即使專利藥品是以未經許可的製造、使用、銷售或進口“中華人民共和國專利法”規定的專利藥品為理由而使用的,未經專利所有人批准,不得為任何商業目的製造、使用、銷售或進口此類專利藥品。
商標
商標受1982年度8月23日通過的“中華人民共和國商標法”保護,隨後分別於1993、1993、2001和8月30日修訂,以及國務院於2002 8月3日通過並於2014修改的“中華人民共和國商標法實施條例”。USPTO處理商標註冊,並給予註冊商標10年的期限,如果在第一個或任何延長的十年期限屆滿時提出請求,則再授予10年。“中華人民共和國商標法”對商標註冊採用了“先登記”原則.
98
目錄
貿易機密
根據“中國反不正當競爭法”(“反不正當競爭法”),“商業祕密”一詞是指公眾不知道的技術信息和商業信息,可以為其合法所有人或持有人創造商業利益或利潤,並由其合法所有人或持有人保密的技術信息和商業信息。
Under this law, business persons are prohibited from employing the following methods to infringe trade secrets: (1) obtaining the trade secrets from the legal owners or holders by any unfair methods such as stealing, solicitation or coercion; (2) disclosing, using or permitting others to use the trade secrets obtained illegally under item (1) above; or (3) disclosing, using or permitting others to use the trade secrets, in violation of any 合同協議或合法所有人或持有人對保密的任何要求。第三人知道或者應當知道上述違法行為,但取得、使用或者泄露他人的商業祕密的,可以認為是侵佔他人的商業祕密。被侵吞商業祕密的當事人可以申請行政糾正,監管機關可以制止違法行為,並處罰款一萬元以上二萬元人民幣。或者,被盜用商業祕密的人可以向中國法院提起訴訟,以賠償侵吞行為造成的損失和損害。
保護商業祕密的措施包括口頭或書面協議或其他合理措施,要求合法所有人或持有人的僱員或與其有業務聯繫的人保守商業祕密。一旦合法所有人或持有人要求他人保守商業機密,並採取了合理的保護措施,被請求者就負有保守商業祕密的責任。
關於外匯和股利分配的條例
外匯管理
“外匯管理條例”是中國外匯管理的主要條例,最近一次修訂於2008年8月。根據中國外匯條例,經常項目,如利潤分配和與貿易和服務有關的外匯交易,可以未經國家外匯局事先批准,按照一定的程序要求以外幣支付。相反,人民幣兑換成外幣並匯出中國,以支付償還外幣貸款等資本費用時,需要得到政府有關部門的批准或登記。
#date0#,國家外匯局發佈了“關於改進外商投資企業外幣資金支付結算管理工作的有關操作問題的通知”或“安全通知142”,通過限制折算人民幣的使用,規範外商投資企業將外幣註冊資本轉換為人民幣。此外,國家外匯局於#date0#11月9日發佈了“關於進一步明確和規範部分資本賬户下外匯管理局的通知”或“第45號通知”,以澄清“安全通知142號”的適用情況。根據“安全通知”第142號和第45號通知,由外商投資企業外幣註冊資本折算的人民幣資金只能用於經政府批准的經營範圍內,不得用於中國境內的股權投資。此外,外管局還加強了對由外商投資企業外幣註冊資本轉換而成的人民幣資金的流動和使用的監督。未經國家外匯局批准,人民幣資金的使用不得變更,也不得用於償還未使用所得的人民幣貸款。Furthermore, SAFE promulgated Notice on Issues Concerning Strengthening Administration of Foreign Exchange Services in November 2010, which tightens the regulation over settlement of net proceeds from overseas offerings, such as our initial public offering, and requires, among other things, the authenticity of settlement of net proceeds from offshore offerings to be closely examined and the net proceeds to be settled in the manner described in our prospectus or otherwise approved by our board of directors.違反本安全條例的,可以處以重刑或者其他處罰,包括沒收違法行為所得的收入,對轉換自外商投資基金的人民幣資金處以30%以上的罰款,或者情節嚴重的,處30%以上100%以上由外商投資資金兑換的人民幣資金的罰款。
99
目錄
2012年度11月,國家外匯局頒佈了“關於進一步完善和調整外匯管理政策的通知”,對現行外匯管理程序進行了重大修改和簡化。Pursuant to this circular, the opening of various special purpose foreign exchange accounts, such as pre-establishment expenses accounts, foreign exchange capital accounts and guarantee accounts, the reinvestment of RMB proceeds by foreign investors in China, and remittance of foreign exchange profits and dividends by an FIE to its foreign shareholders no longer require the approval or verification of SAFE, and multiple capital accounts for the same entity may be opened 在不同的省份,這以前是不可能的。此外,國家外匯局於2013頒佈了“關於外商在華境內直接投資的外匯管理規定”及其配套文件,規定外匯局或其地方分支機構對外商在華直接投資的管理應以登記方式進行,銀行必須辦理與外商在華直接投資有關的外匯業務。根據外匯局及其分支機構提供的登記信息。
“國家外匯局關於進一步完善和調整資本賬户外匯管理政策的通知”於2014年月10日頒佈,自2014年2月10日起施行,進一步簡化了對境內機構利潤流出的管理。原則上,銀行在處理本地機構利潤流出不超過5萬元時,無須再審查交易文件。When handling the outflow of profits exceeding the equivalent of $50,000, the bank, in principle, is no longer required to examine the financial audit report and capital verification report of the domestic institution, provided that it must examine, according to the principle of transaction authenticity, the profit distribution resolution of the board of directors (or the profit distribution resolution of the partners) relating to this profit outflow and the original copy of its tax record-filing form.每次利潤流出後,銀行必須在有關納税記錄備案表正本上加蓋印章和背書,以表明利潤流出的實際數額和流出日期。
2015年月30日,國家外匯局發佈了“關於改革外商投資企業外匯資金結算管理辦法的通知”(簡稱“外匯局第19號通知”),自2015年6月1日起施行。According to SAFE Circular 19, the foreign exchange capital of foreign-invested enterprises may be settled on a discretionary basis, meaning that the foreign exchange capital in the capital account of an FIE for which the rights and interests of monetary contribution has been confirmed by the local foreign exchange bureau (or the book-entry registration of monetary contribution by the banks) can be settled at the banks based on the actual operational needs of the FIE.這種自行決定的解決辦法的比例暫時定為100%。從外匯資金兑換的人民幣將存入指定賬户,如果FIE需要從該賬户進一步付款,還必須提供證明文件,並與銀行進行審查。
此外,“安全通告”第19號規定,外商投資企業的資金使用必須遵循企業經營範圍內的真實性和自用性原則。外商投資企業的資金和外匯結算所得的人民幣資金不得用於下列目的:
| · |
直接或者間接用於企業經營範圍以外的支付或者有關法律、法規禁止的支付;
|
| · |
直接或者間接用於證券投資的,有關法律、法規另有規定的除外;
|
| · |
直接或間接用於發放人民幣委託貸款,但經業務範圍許可,償還企業間借款(包括第三方墊款),或者向第三人轉借的人民幣償還銀行貸款的除外;
|
| · |
除外商投資房地產企業外,支付非自用房地產購房費用。
|
100
目錄
#date0#6月9日,國家外匯局發佈了“關於改革和規範資本賬户結匯管理政策的通知”或“第16號安全通知”,自2016年6月9日起施行。根據國家安全理事會第16號通知,外商投資企業的外匯資金、外債和境外上市融資可以自行結算,也可以在銀行進行結算。這種自行決定的解決辦法的比例暫時定為100%。從有關外匯兑換的人民幣將存入指定賬户,如果國內企業需要進一步從該賬户付款,還必須提供證明文件,並與銀行進行審查。
此外,安全理事會第16號通知重申,國內企業使用資金必須堅持企業經營範圍內的真實性和自用性原則。境內企業從外匯結算中取得的資本賬户和人民幣的外匯收入,不得用於下列目的:
| · |
直接或者間接用於企業經營範圍以外的支付或者有關法律、法規禁止的支付;
|
| · |
直接或者間接用於證券投資和理財產品投資,但有關法律、法規另有規定的除外;
|
| · |
直接或間接用於向非附屬企業發放委託貸款,但經業務範圍許可者除外;
|
| · |
用於建設或者購買非自用房地產,但外商投資房地產企業除外。
|
我們的中國子公司分給境外母公司和開展跨境外匯活動,應符合上述各項安全登記要求。
股票期權規則
根據中國人民銀行#date0#12月25日發佈的“個人外匯管理管理辦法”,凡涉及職工持股計劃和中國公民參與的股票期權計劃的外匯事項,均需經國家外匯局或其授權分支機構批准。In addition, under the Notices on Issues concerning the Foreign Exchange Administration for Domestic Individuals Participating in Share Incentive Plans of Overseas Publicly-Listed Companies, or Share Option Rules, issued by the SAFE on February 15, 2012, Chinese residents who are granted shares or share options by companies listed on overseas stock exchanges under share incentive plans are required to (1) register with the SAFE or its local branches; (2) retain 合格的中國代理人,可以是境外上市公司的中國子公司,也可以是中國子公司選定的另一家合格機構,代表參與者進行股票獎勵計劃的安全登記和其他程序;(三)保留境外機構處理與其行使股票期權、買賣股份或權益以及資金轉移有關的事項。
中國居民或公民持有海上特殊目的公司安全規定
國家外匯局於2014年月4日頒佈了“安全通知”37號,取代了國家外匯局於2005年月21日發佈的“安全通知75”。國家安全理事會第37號通知規定了中國居民使用特殊目的工具(SPV)尋求海外投資和融資以及在中國進行往返投資的外匯事項。根據“安全通知”第37號,SPV是指中國居民或實體為海外投融資目的直接或間接建立或控制的離岸實體,擁有中國居民在國內企業的合法資產或股權或境外資產或權益,而“往返投資”是指中國居民通過SPV在中國直接投資,即設立SPV。外商投資企業取得所有權、控制權和經營權。根據安全理事會第37號通知,中國居民在進入SPV之前,必須向外滙局或其地方分支機構辦理外匯登記。“安全通告”第37號進一步要求對特別用途車輛的登記作出修改,如中華人民共和國個人出資的增減、股份轉讓或交換、合併、分立或其他重大事件。Failure to comply with the registration procedures set forth in SAFE Circular 37, or making misrepresentation on or failure to disclose controllers of an FIE that is established through round-trip investment, may result in restrictions on the foreign exchange activities of the relevant FIE, including payment of dividends and other distributions, such as proceeds from any reduction in capital, share transfer or liquidation, to its offshore parent or affiliate, and 境外母公司的資本流入,也可以根據中華人民共和國外匯管理條例對有關的中國居民處以處罰。
101
目錄
根據安全理事會第37號通知,參加境外非上市公司股份激勵計劃的中國居民可以向外滙局或其當地分支機構提交境外SPV外匯登記申請。關於遵守“安全通告”第37號的更多信息,請見“第3項”。關鍵信息---D.風險因素---與我們在華營商有關的風險---中國有關中國居民對離岸公司投資的規定可能會使我們未來的中國居民受益所有人或我們的中國子公司承擔責任或受到懲罰,限制我們向中國子公司注入資本的能力,或限制我們中國子公司增加註冊資本或分配利潤的能力。“
我們已經完成了藍黃博士、賈臨清先生和董良先生的中國居民股東的外匯登記。
股利分配的管制
The principal laws, rules and regulations governing dividend distribution by FIEs in China are the Company Law of the PRC, most recently amended in December 2013, the Wholly Foreign-owned Enterprise Law, most recently amended in October 2016, and its implementation regulations, most recently amended in February 2014, and the Sino-Foreign Equity Joint Venture Law, most recently amended in October 2016, and its implementation regulations, most recently amended in February 2014.根據本法律、法規的規定,外商投資企業只能根據中國會計準則和規定確定的累計利潤支付股息。中國境內公司和中國獨資企業必須每年將各自累積税後利潤的至少10%分配給某些資本儲備基金,直至這些準備金的總額達到企業註冊資本的50%為止。在前幾個財政年度的任何虧損被抵消之前,中國公司不得分配任何利潤。從前一個會計年度留存的利潤可與本會計年度的可分配利潤一起分配。
勞動法律與社會保險
根據“中華人民共和國勞動法”(於1994頒佈並於2009修訂)和“中華人民共和國勞動合同法”(6月頒佈並於2012修訂),用人單位必須與全職僱員簽訂書面勞動合同。所有僱主必須遵守當地最低工資標準。違反“中華人民共和國勞動合同法”和“中華人民共和國勞動法”的,情節嚴重的,可以處以罰款和其他行政刑事責任。
此外,根據#date0#頒佈的“中華人民共和國社會保險法”和#date0#頒佈並於1997年3月修訂的“住房公積金管理條例”,我國在華子公司等用人單位必須為職工提供養老保險、失業保險、生育保險、工傷保險、醫療保險和住房公積金等福利計劃。
“世界規則”的其他部分
對於美國和中國以外的其他國家,臨牀試驗、藥品許可、定價和報銷的要求因國而異。在所有情況下,臨牀試驗都必須按照“赫爾辛基宣言”中關於全球合作計劃的要求和適用的管理要求以及其起源的道德原則進行。
102
目錄
如果我們不遵守適用的外國監管要求,除其他外,我們可能受到罰款、暫停或撤銷監管批准、產品召回、扣押產品、限制經營和刑事起訴。
製造與供應
我們將普林布林的活性藥物成分的生產外包給外部服務提供商Johnson Mattey,並將最終藥物配方的生產外包給製藥國際公司,併為應急計劃的目的,我們還與其他合同製造組織建立了關係。我們希望繼續我們與合同製造商的外包關係,以滿足正在進行的開發Plinbulin的要求。我們與這些第三方沒有長期協議.我們與這些外部服務提供商達成了框架協議,根據這些協議,它們為我們提供短期、逐個項目的服務。
目前,我們的合同製造商從多個供應商那裏獲得他們為我們進行的生產活動所需的材料,我們認為這些供應商有足夠的能力滿足我們的需求。此外,我們認為,有足夠的替代來源來供應這種用品。然而,中斷供應會對我們的業務造成實質性損害,這是存在的風險。我們通常在訂購訂單的基礎上訂購材料和服務,而不參與長期的專用能力或最低限度的供應安排。
我們依賴於巴斯夫SE作為唯一的供應商的穩定劑,Solutol,用於普林布林目前的配方。如果巴斯夫SE變得無法或不願意供應Solutol,我們將無法取代巴斯夫SE,我們將被要求重新制定Plinbulin。
製造業須遵守廣泛的法規,其中規定了各種程序和文件要求,這些要求涉及記錄保存、製造過程和控制、人員、質量控制和質量保證等。我們計劃使用的合同製造機構來製造我們目前的產品候選產品,或者任何未來我們可能開發的產品候選產品,將被要求在cGMP條件下運作。這些cGMP條件是生產將用於人體的藥品的監管要求。
法律程序
我們可能會不時參與法律程序,或受到在正常業務過程中所引起的申索。我們目前不是任何法律程序的當事方,如果對我們不利,單獨或綜合起來會對我們的業務、業務結果、財務狀況或現金流動產生重大的不利影響。無論結果如何,訴訟都會對我們產生不利的影響,因為訴訟的辯護和和解費用、管理資源的轉移等因素都會對我們產生不利的影響。
| C. |
組織結構
|
下圖描述了我們目前的組織結構,這是由於於2015年月日完成的內部結構調整而產生的。請參閲本年度報告其他部分所載的合併財務報表附註1,以獲得關於內部結構調整的更多資料。
103
目錄

| D. |
財產、廠房和設備
|
在2015,我們開始在紐約租賃276個可出租的,609.75平方英尺的辦公空間,每月租金2,938.25美元。
從2015到2016 2月份,我們在紐約租用了更多的辦公空間,將總面積增加到411個可租賃的,908個可出租的平方英尺,租金增加到每月4,384.97美元。
從2016到2016年月,我們在紐約租用了更多的辦公空間,將總面積增加到695處可租賃,1,535.43平方英尺,租金增加到每月7,666.82美元。
從2016到2017 2月份,我們在紐約租用了更多的辦公空間,總面積增加到976處可租賃,2,156.23平方英尺,租金增加到每月9,972.07美元。
104
目錄
從2017到2018年月,我們在紐約租用了更多的辦公空間,總面積增加到121個可租,2476.57平方英尺,租金增加到每月11252.15美元。
在2018以後,我們在紐約租賃了更多的辦公空間,增加到2,541個可出租的,5,613.68平方英尺,每月26,382,39美元,直到2月2020。
經營租契下的付款是在各租契期內以直線方式支付的,而租約的條款並不包括租金上漲、或有租金、續期或購買期權。
我們在大連租賃了12,720.57平方英尺的辦公空間,並在2016年月31之前進行了多次租賃。根據我們與中國政府的租賃協議,在上述租賃期間,中國大連的辦公設施是免費的。從9月份開始,我們以每月2,000美元的價格在中國大連租賃了辦公室。
從2016到2018年間,我們還以每月2359美元的價格在聖地亞哥租賃了189平方英尺的辦公空間。我們租用了更多的辦公空間,到2月份為止,以每月3,708美元的價格將總面積增加到297平方英尺。在2018以後,我們租用了額外的辦公空間,增加到386平方英尺,每月4,618.8美元,到1月份2020。
| 項目4A。 |
未解決的工作人員意見
|
不適用。
| 項目5. |
經營與財務回顧與展望
|
以下對我們財務狀況和業務結果的討論和分析,應與本年度報告其他部分所載經審計的綜合財務報表和相關附註一併閲讀。這一討論包含了基於當前風險和不確定因素的預期的前瞻性聲明.由於各種因素,包括題為“項目3”一節中討論的因素,我們的實際結果可能與這些前瞻性聲明中的預期結果大不相同。關鍵信息-D.風險因素“以及本年度報告的其他部分。我們的合併財務報表是按照美國公認會計原則編制的。BeyondSpring公司的功能貨幣是美元。
| A. |
經營成果
|
概述
我們是一家全球性的臨牀階段生物製藥公司,專注於創新癌症療法的開發和商業化。Our lead asset, Plinabulin, is a GEF-H1 activator, which has demonstrated in interim results from one Phase 2/3 trial and one Phase 3 trial its ability to reduce CIN in NSCLC patients. Plinabulin is currently in three late stage clinical trials: two in the treatment of CIN and the third as an anti-cancer therapy in the treatment of advanced NSCLC. Plinabulin has been studied in preclinical models and in Phase 1/2 trials to investigate its therapeutic potential in combination with immuno-oncology agents. Pending positive results in our three late stage trials, we expect to submit two NDAs in China in late 2018 or early 2019 for conditional approval of Plinabulin; one for treatment with Plinabulin to reduce and prevent CIN and the second for the Plinabulin in combination with docetaxel for second and third line treatment of NSCLC.我們預計,在NDA提交申請後大約6個月,中國將批准這些適應症中嚴重的未滿足的臨牀需求。我們的兩個階段2/3試驗的最終結果預計在2019,我們的第三階段的非小細胞肺癌試驗預計在2020。如果這些結果是肯定的,我們打算在2019和2020的非小細胞肺癌和其他國家申請批准。除了中國以外,我們在所有國家都擁有普林布林的全球權利。在中國,我們擁有我們的中國子公司萬春·布林60%的股份,該公司擁有普林布林100%的股權。
我們的戰略是開發一系列的產品候選產品,將普林布林應用於不同的適應症和其他潛在的產品候選產品,有可能成為有利於癌症患者的多種藥物組合體系的重要組成部分。為了實施我們的戰略,我們採用了一種新的、高度可擴展的商業模式,整合了美國和中國的臨牀資源,我們相信這種模式已經產生了更快、更符合成本效益的開發項目,並在我們早期的開發和發現工作中利用了美國的合作。我們的藥物開發能力是通過美國臨牀研究人員的強烈興趣以及我們對中國醫藥行業、臨牀資源和監管體系的瞭解而增強的。
105
目錄
除了CIN和NSCLC的臨牀開發項目外,我們正在利用我們的研究合作在臨牀試驗中推進Plinbulin作為免疫腫瘤學藥物的治療潛力,我們為這些由研究者發起的臨牀試驗以及Plinbulin的藥物供應提供資金支持。除了探索普林布林的治療潛力與免疫腫瘤學制劑相結合外,我們還與華盛頓大學合作,有一系列臨牀前免疫腫瘤學產品候選和泛素介導降解途徑的新藥物發現,我們已經有效和高效地利用了我們的研究協作來推進這些項目。
We intend to commercialize Plinabulin, if approved, in China through our subsidiary, Wanchun Bulin because China recognized Plinabulin as a National Science and Technology Major Project for “essential new drug research and development.” With the 2017 Innovation Award, Plinabulin is included in the National Drug Priority List and, pending drug approval and successful pricing negotiations with the Chinese government, Plinabulin has the potential to be included 在國家保險系統中,可以更快地獲得病人和報銷費用。此外,由於中國癌症患者的治療高度集中,我們預計在北京、上海和廣州地區,商業基礎設施可管理的目標市場將達到80%。在美國和世界其他地區,我們打算尋找一個或多個潛在的藥物合作伙伴進行商業化。
萬春生物科技公司是我們美國子公司的前控股公司,自2010成立以來,我們的業務重點是組織和配置我們公司的人員、業務規劃、籌集資金、建立我們的知識產權組合,包括購買普林布林公司的權利、加強普林布林公司的專利,以及進行臨牀前研究和臨牀試驗。我們沒有任何產品候選人批准銷售,也沒有從產品銷售中產生任何收入。我們通過股權融資和來自相關方和第三方的貸款為我們的業務提供資金,這些貸款要麼由萬春生物科技承擔,作為我們內部重組的一部分,要麼轉化為股權投資,要麼由我們償還。2017年月14日,我們完成了首次公開募股,發行普通股174,286股,每股20美元,總收益約350萬美元。在我們的首次公開募股(IPO)的同時,我們向某些投資者發行了2541048股普通股,每股20美元,總收益約為5080萬美元。截至2017年月31,我們有現金、現金等價物和短期投資3060萬美元.
自成立以來,我們一直遭受運營虧損。截至12月31日、2017、2016和2015年度,我們的淨虧損分別為9,640萬美元、1,250萬美元和800萬美元。截至12月31日、2017和2016,我們的累積赤字分別為123.9百萬美元和3 210萬美元。我們的大部分損失都是由於購買普林布林的全球權利、資助我們的臨牀試驗、生產我們的藥物產品、研發計劃以及與我們的業務有關的一般和行政費用而造成的。我們預計在可預見的將來將繼續發生重大開支和經營損失。我們預計,我們的開支將大大增加與我們正在進行的活動,因為我們:
| · |
繼續進行臨牀前研究和臨牀開發,包括與Plinabin、CIN和NSCLC相關的臨牀開發項目;
|
| · |
招聘更多的研究、開發和業務人員;
|
| · |
維護、擴大和保護我們的知識產權組合;
|
| · |
在中國推出和商業化Plinbulin;
|
| · |
資助新產品候選人的發現及發展;及
|
| · |
承擔與作為上市公司經營有關的額外費用。
|
106
目錄
我們將需要大量額外資金,以支持我們的經營活動,因為我們通過臨牀開發推動我們的產品候選產品,尋求監管機構的批准,併為我們的產品候選人進行商業化做好準備,如果我們的任何產品候選人獲得批准,我們可能無法以可接受的條件獲得足夠的資金,或者根本無法獲得足夠的資金。
我們沒有生產設施,所有生產活動都外包給第三方。此外,我們目前利用第三方CRO進行臨牀開發和試驗。我們在中國還沒有銷售機構,但打算在2019開始設立一個銷售機構。
業務成果構成部分
收入
到目前為止,我們還沒有從產品銷售中獲得任何收入,也不希望在可預見的將來從產品銷售中獲得任何收入。在未來,我們可能會從產品銷售,補償,前期付款,里程碑付款和與未來合作有關的版税中獲得收入。如果我們未能及時完成產品的開發,或未能獲得他們的監管批准,我們將不會在未來產生收入。
費用
研發費用
歷史上,我們的總營運開支中最大的部分是我們對研究和開發活動的投資。Research and development expenses consist of costs associated with our research and development activities, including the purchase of the Plinabulin global rights from Nereus, conducting preclinical studies and clinical trials of Plinabulin and development of our pipeline of immuno-oncology product candidates and de novo drug discovery using our ubiquitin-mediated degradation platform. Research and development expenses also include activities related to:
| · |
與員工有關的費用,包括研發人員的工資、福利和差旅費;
|
| · |
根據與CRO、合同製造組織和顧問簽訂的協議進行和支持臨牀試驗和臨牀前研究的費用;
|
| · |
與臨牀前研究和開發活動有關的費用;
|
| · |
與管制行動有關的費用;
|
| · |
與保護知識產權有關的費用;
|
| · |
僱員、董事及非僱員顧問的股份補償;及
|
| · |
其他費用,包括用於研究和開發活動的租金、保險和其他用品的直接和分配費用。
|
研發活動是我們商業模式的核心。臨牀開發後期的產品開發成本通常比臨牀開發的早期階段高,主要是由於後期臨牀試驗規模和持續時間的增加。我們預計,在未來幾年裏,我們的研發費用將大幅增加,因為我們將繼續通過臨牀前研究和臨牀試驗來開發我們的產品流水線,併為我們在中國和美國的Plinabin NDA申請做好準備,包括在批准前準備商業生產批量的普林布林和增加庫存。我們希望增加更多的人員來支持這些活動,這將增加人員成本,包括基於股權的補償。我們目前的研究和開發活動主要涉及:
107
目錄
| · |
研究105,一個大約200例患者2/3期臨牀試驗,預防Plinbulin的CIN;
|
| · |
研究106,約200例患者2/3期臨牀試驗,預防TAC CIN;
|
| · |
研究103,約554例患者,第3期臨牀試驗聯合多西他賽治療晚期非小細胞肺癌;
|
| · |
兩期1/2研究人員-啟動的臨牀試驗聯合尼沃盧馬治療晚期非小細胞肺癌的第二和第三線;
|
| · |
臨牀前研究研究,研究Plinbulin‘s和我們的臨牀前產品的候選產品,與免疫腫瘤學療法相結合的潛力;以及
|
| · |
泛素介導降解途徑的臨牀研究。
|
當我們承擔研發費用時,我們就會為此付出代價。我們記錄一些開發活動的成本,例如臨牀試驗,基於對完成特定任務的進度的評估,使用諸如主題註冊、臨牀站點激活或我們的供應商提供給我們的信息等數據。
與我們的任何產品候選產品成功商業化有關的因素很多,包括未來的試用設計和各種監管要求,其中許多因素目前無法根據我們的發展階段準確地加以確定。此外,我們無法控制的未來商業和監管因素將影響我們的臨牀發展計劃和計劃。
我們的產品候選人的成功開發是高度不確定的。由於臨牀前研究以及臨牀開發和產品候選的商業化本質上是不可預測的,我們無法合理地估計或知道為完成其餘的開發工作所需要的努力的性質、時間和成本,或者,如果有的話,我們的任何其他產品候選產品可能開始出現實質性的淨現金流入。這種不可預測性是由於臨牀試驗的持續時間和成本以及產品候選產品的商業化所帶來的許多風險和不確定性,這些風險和不確定性在一個項目的整個過程中因許多因素而有很大差異,其中包括:
| · |
包括在試驗中的臨牀地點的數目;
|
| · |
審判設計和審判設計的變更;
|
| · |
建立適當的安全簡介;
|
| · |
登記合適病人所需的時間;
|
| · |
最終參與試驗的病人人數;
|
| · |
病人接受的劑量數;
|
| · |
患者隨訪時間;
|
| · |
我們的臨牀試驗結果;
|
| · |
與第三方製造商達成協議;
|
| · |
從適用的管理當局收到營銷批准;
|
108
目錄
| · |
在批准的情況下,將產品候選產品商業化,無論是單獨還是與他人合作;
|
| · |
為我們的產品候選人獲取和維護專利和商業祕密保護及監管專門性;
|
| · |
經批准後,產品的安全狀況持續可接受;及
|
| · |
保留關鍵的研究和開發人員。
|
如果改變這些變量中任何一個產品候選產品的開發結果,將極大地改變與開發該產品候選產品相關的成本、時間和可行性。
一般費用和行政費用
一般費用和行政費用主要包括基於份額的薪酬費用、人事費用,包括行政、財務和人力資源職能以及信息技術。其他一般和行政費用包括法律、諮詢、審計和税務服務的專業費用以及用於一般和行政活動的租金、保險和其他用品的其他直接費用。我們預計,我們的一般費用和行政費用將在今後增加,以支持我們的研究和開發活動的增加,包括繼續進行普林布林的臨牀試驗和為我們的其他產品候選人開始臨牀試驗。這些增加可能包括增加人員、擴大基礎設施和增加保險費用。我們還增加了與上市公司相關的法律、合規、會計、董事和官員保險以及投資者和公共關係費用。
其他收入(支出)
2017年度的其他收入主要包括外匯收益、我們的現金利息收入、贈款。在總額約92萬美元(610萬元人民幣)的贈款中,我們從大連金融服務發展委員會收到約45萬美元(人民幣300萬),從大連金浦新區金融和貨幣局收到約47萬美元(310萬元人民幣)。
其他費用主要包括2016年度的外匯損失。
業務結果
截至十二月三十一日、2017及2016年度之比較
下表分別彙總了截至12月31日、2017和2016年度的業務結果,以及這些項目的美元變動情況:
|
截至12月31日的年份,
|
||||||||||||
|
2017
|
2016
|
變化
|
||||||||||
|
(在成千上萬的美國。
美元(“美元”)
|
%
|
|||||||||||
|
收入
|
—
|
—
|
—
|
|||||||||
|
營業費用
|
||||||||||||
|
研發
|
(88,928
|
)
|
(10,437
|
)
|
752
|
|||||||
|
一般和行政
|
(9,053
|
)
|
(1,931
|
)
|
369
|
|||||||
|
業務損失
|
(97,981
|
)
|
(12,368
|
)
|
692
|
|||||||
|
其他(費用)收入
|
||||||||||||
|
外匯收益,淨額
|
555
|
(195
|
)
|
(284
|
)
|
|||||||
|
利息收入
|
120
|
18
|
567
|
|||||||||
|
其他收入
|
918
|
—
|
—
|
|||||||||
|
利息費用
|
—
|
—
|
—
|
|||||||||
|
財產和設備處置方面的損失
|
—
|
—
|
—
|
|||||||||
|
權益法投資淨虧損
|
—
|
—
|
—
|
|||||||||
|
其他費用共計
|
1,593
|
(177
|
)
|
(1000
|
)
|
|||||||
|
所得税前淨虧損
|
(96,388
|
)
|
(12,545
|
)
|
668
|
|||||||
|
所得税利益
|
—
|
—
|
—
|
|||||||||
|
淨損失
|
(96,388
|
)
|
(12,545
|
)
|
668
|
|||||||
109
目錄
研究與開發
截至12月31日止的年度,研究及發展開支增加7,850萬元,由截至12月31日的1,040萬元增至8,890萬元,其中約6,010萬元為非現金開支的增加,其中約6,010萬元為非現金開支的增加。1 780萬美元是由於非現金股補償費用;4 230萬美元是由於發行2,112,963股普通股歸Nereus信託公司由於我們履行了下文所述的終止協議。其餘1 840萬美元的增加額主要是由於我們的臨牀試驗的繼續,研究103、研究105和研究106,兩名研究者開始了Plinabin和nivolumab在晚期NSCLC第二和第三行治療中的第1/2階段臨牀試驗,以及與生產Plinbulin有關的費用。
|
研發活動(1)
|
截至12月31日的年份,
|
||||||||||||
|
2017
|
2016
|
變化
|
|||||||||||
|
(單位:千美元(“美元”))
|
%
|
||||||||||||
|
研究103
|
8,138
|
4,688
|
74
|
||||||||||
|
研究105
|
6,375
|
32
|
NM
|
||||||||||
|
研究106
|
3,615
|
—
|
NM
|
||||||||||
|
前臨牀
|
2,348
|
1,528
|
54
|
||||||||||
|
其他臨牀試驗
|
1,230
|
305
|
303
|
||||||||||
|
與僱員有關的開支
|
2,881
|
1,408
|
105
|
||||||||||
|
股份補償
|
17,753
|
—
|
NM
|
||||||||||
|
顧問及其他
|
4,329
|
2,476
|
80
|
||||||||||
|
以股票為基礎的對Nereus的支付(2)
|
42,259
|
—
|
NM
|
||||||||||
|
研究和開發總額
|
88,928
|
10,437
|
NM
|
||||||||||
NM:沒有意義
(1)由於臨牀前及臨牀發展本身不可預測的性質,我們並沒有按計劃逐項追蹤我們所有的內部研究及發展開支,因為這些開支主要與人員、早期研究、製造及發展有關,而這些開支都分佈在多個發展中的項目中。因此,這些費用單獨列出。
110
目錄
(2) 2015年2月2日,我們萬春生物技術公司和富通顧問有限公司,作為轉讓給萬春生物技術公司的普林布林專利的前利益相關者的代理人,簽訂了一項協議,終止我們應向專利銷售商支付的專利使用費支付安排(如果有的話)。終止協議在我們的首次公開募股完成後生效,並要求我們在發行前向賣方指定的實體發行一些普通股,相當於我們在發行前全部稀釋股本的10%。為了履行這一義務,我們於2017年月14日完成首次公開募股後,向Nereus信託公司發行了2,112,963股普通股,並終止了特許權使用費支付安排。
一般費用和行政費用
截至12月31日的一年中,一般開支和行政開支增加了720萬美元,從截至12月31日的年度的190萬美元增加到910萬美元,到2016年底增加了910萬美元。增加的主要原因是非現金股補償費用增加490萬美元,以及作為一家上市公司的經營費用增加,包括人員增加和法律費用增加。
其他(費用)收入
截至12月31日的一年中,其他收入增加了180萬美元,達到160萬美元,而截至12月31日的一年的其他支出為20萬美元。增加的主要原因是,我們共收到約90萬美元現金贈款,大約45萬美元(300萬元人民幣)來自大連金融服務發展委員會,約47萬美元(310萬元人民幣)來自大連金浦新區金融和貨幣局,以及外匯收益增加80萬美元。
截至十二月三十一日、2016及2015年度之比較
下表分別彙總了截至12月31日、2016和2015年度的業務結果,以及這些項目的變動情況:
|
截至12月31日的年份,
|
||||||||||||
|
2016
|
2015
|
變化
|
||||||||||
|
(在成千上萬的美國。
美元(“美元”)
|
%
|
|||||||||||
|
收入
|
—
|
—
|
—
|
|||||||||
|
營業費用
|
||||||||||||
|
研發
|
(10,437
|
)
|
(6,282
|
)
|
(66.36
|
)
|
||||||
|
一般和行政
|
(1,931
|
)
|
(1,193
|
)
|
(61.60
|
)
|
||||||
|
業務損失
|
(12,368
|
)
|
(7,475
|
)
|
(65.46
|
)
|
||||||
|
其他(費用)收入
|
||||||||||||
|
外匯收益,淨額
|
(195
|
)
|
13
|
(1600
|
)
|
|||||||
|
利息收入
|
18
|
13
|
38.46
|
|||||||||
|
利息費用
|
—
|
(532
|
)
|
100
|
||||||||
|
財產和設備處置方面的損失
|
—
|
(27
|
)
|
100
|
||||||||
|
權益法投資淨虧損
|
—
|
(44
|
)
|
100
|
||||||||
|
其他費用共計
|
(177
|
)
|
(577
|
)
|
69.32
|
|||||||
|
所得税前淨虧損
|
(12,545
|
)
|
(8,052
|
)
|
(55.80
|
)
|
||||||
|
所得税利益
|
—
|
—
|
—
|
|||||||||
|
淨損失
|
(12,545
|
)
|
(8,052
|
)
|
(55.80
|
)
|
||||||
研究與開發
在截至12月31日的一年中,研發費用從截至12月31日的630萬美元增加到1040萬美元,增加了410萬美元。研發費用增加的主要原因是:
| · |
繼續學習103;
|
111
目錄
| · |
開始學習105;
|
| · |
開始學習106;
|
| · |
啟動兩名研究者-啟動的第1/2階段的臨牀試驗,在第二和第三線治療晚期非小細胞肺癌的Plinabin和nivolumab;
|
| · |
其他免疫腫瘤學,臨牀前發展及泛素介導降解途徑的研究;
|
| · |
為保護知識產權而提出的附加專利申請;
|
| · |
Plinbulin的製造;
|
| · |
關於Plinbulin作用機制的臨牀前研究;以及
|
| · |
長期毒理學研究。
|
一般費用和行政費用
截至12月31日的一年中,一般開支和行政開支從截至12月31日的120萬美元增加到190萬美元,增加了70萬美元。增加的主要原因是諮詢服務費、薪金和福利以及法律和審計費用增加。
其他(費用)收入
截至12月31日的一年中,其他支出從截至12月31日的60萬美元降至20萬美元,減少了40萬美元。減少的主要原因是利息費用被外匯損失增加所抵消。
關鍵會計政策與重大判斷和估計
研究和開發費用
我們按照會計準則編纂或ASC 730核算研究和開發成本,研究與開發。研究和開發費用主要包括進行研究和開發活動的費用,包括有關人員和顧問的薪金、福利和相關費用、用於開發產品候選人的原材料和用品、與專利申請有關的專利費用以及從事臨牀開發活動和試驗的外部供應商的外部費用。我們花費研究和開發成本,因為它們是發生的。
發生的費用涉及對將用於未來研究和開發活動的貨物或服務的不可退還的預付款推遲並資本化。資本化數額在交付相關貨物或提供服務時,或當我們預期不需要交付貨物或提供服務時,作為研究和開發費用支出。
研究合同成本和應計項目
我們與中國、美國、歐洲和澳大利亞的研究機構和其他公司簽訂了各種研發合同。相關付款記作已發生的研究和開發費用。我們記錄應計項目的估計持續研究成本。在評估應計負債的充分性時,我們分析研究的進展,包括事件的階段或完成、收到的發票和合同費用。在確定任何報告所述期間結束時的應計餘額時作出了重大判斷和估計。實際結果可能與我們的估計不同。我們的歷史應計估計數與實際費用沒有重大差別。
112
目錄
外幣換算與交易
目前,除以人民幣為功能貨幣的中國實體和以澳元為功能貨幣的BeyondSpring澳大利亞製藥有限公司外,我們所有實體都使用美元作為功能貨幣。相應的功能貨幣的確定是基於ASC 830的標準,即外幣問題。我們使用美元作為報告貨幣。對於功能貨幣不是美元的子公司,我們使用當年的平均匯率和資產負債表日的匯率將經營結果和財務狀況分別轉化為報告貨幣美元。翻譯差異記錄在股東權益的一個組成部分--其他綜合收益或虧損中。
我們衡量以功能貨幣以外的貨幣計價的交易按交易日的匯率折算為功能貨幣。外幣計價的金融資產和負債按資產負債表日的匯率重新計量。我們在綜合損益表中包括匯兑損益。
所得税
我們採用所得税會計的責任法。根據這一方法,遞延税資產和負債是根據財務報告與資產和負債的税基之間的差異確定的,並使用預期差額將逆轉時生效的已頒佈税率來衡量。如果遞延税資產的某些部分或全部無法實現,則提供估值備抵。
根據會計準則更新(“會計準則”)第2015-17號,所得税(主題740)所有遞延所得税資產和負債在合併資產負債表上被列為非流動資產。我們使用ASC 740所得税的規定來評估我們不確定的税收狀況,該規定規定了一個確認門檻,即在財務報表中確認某一税種必須達到之前的要求。我們在財務報表中確認,“更有可能”維持税務狀況的好處,完全是根據該職位的技術優點進行審查的,前提是税務當局對所有相關信息進行審查。符合確認門檻的税種是使用累積概率法來衡量的,在最大的税收優惠額上,在結算時實現的可能性大於50%。我們的政策是將利息及與未獲確認的税項利益(如有的話)有關的罰則,確認為所得税開支的一部分。
最近的會計公告
2014,財務會計準則委員會(FASB)發佈了會計準則更新(“ASU”)第2014-09號,“與客户簽訂合同的收入”(“ASU 2014-09”),並經ASU第2015-14號修訂。這一新準則將取代關於這一主題的所有目前普遍接受的會計原則或公認會計原則,並確立了在向客户轉讓承諾的貨物或服務時確認收入的原則,其數額反映了為換取這些貨物或服務而獲得的預期考慮。本指南可追溯適用於每一期間提出或作為累積效應調整,從通過之日起。在2015,FASB將生效日期推遲到報告期間,從12月15日,2017,2017,並允許早日通過。我們於2018年月一日採用了這一標準。由於我們尚未訂立任何收入安排,亦預期在短期內不會有任何收入安排,因此,我們預計新標準的採用不會對我們的合併財務報表造成重大影響。
2016年2月,房協發行了第2016-02號“租賃”(“ASU 2016-02”),要求承租人在資產負債表上確認與租賃安排有關的資產和負債超過12個月。本標準還要求承租人提供額外的披露,幷包含出租人對會計的有針對性的更改。更新後的指南將在2018年月15以後的中期和年度內生效,並允許儘早採用。承租人對租賃費用和現金流量的確認、計量和列報與以往的公認會計原則沒有顯著變化。我們目前正在評估通過的財務報表的影響。
113
目錄
在2016年8月,財務會計準則委員會發布了現金流量表第2016-15號--某些現金收入的分類。ASU 2016-15(“ASU 2016-15”)的修正案涉及八個具體的現金流分類問題.ASU 2016-15適用於從12月15日開始的財政年度(2017),以及在這些財政年度內的中期。目前,我們正在評估通過的辦法對合並財務報表的影響。
2016年月日,金融服務委員會發布了第2016-16號ASU,所得税(主題740):庫存以外資產的實體內部轉移(“ASU 2016-16”),這就要求確認在發生轉移時,資產的實體內轉移(庫存除外)的所得税後果。目前,我們正在評估通過的辦法對合並財務報表的影響。
在2017年5月,聯邦會計準則委員會發布了第2017-09號ASU,薪酬-股票薪酬:變更會計的範圍(“ASU 2017-02”)該標準提供了清晰性,減少了(1)實踐中的多樣性,(2)在應用主題718的指導時,成本和複雜性。薪酬-股票補償,以更改以股票為基礎的支付獎勵的條款或條件。更新後的指南將在2017年月15以後的中期和年度內生效,並允許儘早採用。預計2018採用這一ASU不會對我們的合併財務報表產生重大影響。
就業法
根據“就業法”第107(B)條,“新興成長型公司”可推遲採用新的或經修訂的會計準則,直至這些準則適用於私營公司為止。我們不可撤銷地選擇不利用這一豁免,因此,我們將與其他非新興成長型公司的上市公司同時採用新的或經修訂的會計準則。我們目前正在評估“就業法”規定的其他豁免和減少報告要求。For example, as an emerging growth company, we are exempt from Sections 14A(a) and (b) of the Exchange Act which would otherwise require us to (1) submit certain executive compensation matters to shareholder advisory votes, such as “say-on-pay,” “say-on-frequency” and “golden parachutes”; and (2) disclose certain executive compensation related items such as the correlation between executive compensation and performance and comparisons 我們的首席執行官的薪酬與我們的僱員薪酬中位數。We intend to rely on an exemption from the rule requiring us to provide an auditor’s attestation report on our internal controls over financial reporting pursuant to Section 404(b) of the Sarbanes-Oxley Act and the rule requiring us to comply with any requirement that may be adopted by the PCAOB regarding mandatory audit firm rotation or a supplement to the auditor’s report providing additional information about 審計和財務報表,稱為審計師的討論和分析。We will continue to remain an “emerging growth company” until the earliest of the following: (1) the last day of the fiscal year following the fifth anniversary of March 14, 2017, (2) the last day of the fiscal year in which our total annual gross revenue is equal to or more than $1 billion, (3) the date on which we have issued more than $1 billion in 前三年的不可轉換債務,或(4)根據SEC的規則,我們被視為一個大型加速提交人的日期。
作為一傢俱有外國私人發行者地位的非美國公司,我們遵守“外匯法案”的報告要求。即使我們不再符合新興成長型公司的資格,只要我們符合“外匯法”規定的外國私人發行人資格,我們也不受適用於美國國內上市公司的“外匯法”某些規定的限制,其中包括:
| · |
“外匯法”中關於就根據“外匯法”登記的證券徵求代理、同意或授權的條款;
|
| · |
“交易法”中要求內部人公開報告其股票所有權和交易活動的條款,以及從短期交易中獲利的內幕人士的責任;
|
| · |
根據“外匯法”的規定,要求在發生指定重大事件時,向證券交易委員會提交關於表10-Q的季度報告,其中載有未經審計的財務和其他具體信息,或目前關於表格8-K的報告;以及
|
114
目錄
| · |
條例FD,規定發行人有選擇地披露重要信息。
|
| B. |
流動性與資本資源
|
自成立以來,我們的業務造成了淨虧損和負現金流。基本上,我們所有的負現金流都是由於我們的研究和開發計劃以及與我們的業務相關的一般和行政費用而產生的。截至12月31日、2017、2016和2015的年度,我們分別錄得9,640萬美元、1,250萬美元和800萬美元的綜合淨虧損。截至12月31日、2017和2016,我們的累積赤字分別為123.9百萬美元和3 210萬美元。我們主要使用現金來資助研究和開發費用以及一般和行政費用。在截至2017、2016和2015的年度中,我們的業務活動分別使用了2880萬美元、1370萬美元和660萬美元現金。我們主要通過公開發行和私募普通股的收益以及相關和第三方的貸款來為我們的業務提供資金,包括我們的首次公開募股和3月份完成的同期私人配售,其中扣除承銷折扣、佣金和發行費用後,我們獲得了4 720萬美元的淨收益。
我們的流動資金受到融資活動、臨牀試驗、研究和開發以及一般和行政費用的影響。我們相信,我們目前的現金水平將足以滿足我們在提交這份表格20-F的年度報告後至少12個月的預期現金需求。我們認為,在現金流量控制預算下,週轉資金足以滿足我們目前的需求。
現金流量
下表提供截至十二月三十一日、2017、2016及2015年度的現金流量資料:
|
截至12月31日的年度,
|
||||||||||||
|
2017
|
2016
|
2015
|
||||||||||
|
(單位:千美元(“美元”))
|
||||||||||||
|
用於業務活動的現金淨額
|
(28,796
|
)
|
(13,698
|
)
|
(6,570
|
)
|
||||||
|
投資活動使用/提供的現金淨額
|
(3,150
|
)
|
(64
|
)
|
355
|
|||||||
|
籌資活動提供的現金淨額
|
47,722
|
14,713
|
16,670
|
|||||||||
|
匯率變動的淨影響
|
18
|
(85
|
)
|
(26
|
)
|
|||||||
|
現金及現金等價物淨增加情況
|
15,794
|
866
|
10,429
|
|||||||||
用於經營活動的現金淨額
截至12月31日、2017、2016和2015年底,用於經營活動的現金主要是由於我們的淨虧損分別為9 640萬美元、1 250萬美元和800萬美元,並根據非現金費用和營運資本組成部分的變化進行了調整。在2017年間,這些非現金費用包括為購買普林布林剩餘的全球專利權而發行的4,230萬美元股票,以及2,270萬美元的非現金股權補償。截至12月31日的一年中,用於經營活動的淨現金為2880萬美元,而截至12月31日的一年為1370萬美元。增加1 510萬美元的主要原因是,隨着我們擴大與普林布林有關的臨牀試驗活動,研發費用增加,以及隨着我們開始作為一家上市公司開展業務,一般和行政費用也增加了。截至12月31日的一年中,用於經營活動的淨現金為1,370萬美元,而截至12月31日的年度為660萬美元。用於業務活動的現金增加的主要原因是研究和開發增加了410萬美元,一般和行政開支增加了70萬美元。
在所述期間,我們現金的主要用途是資助我們的研究和開發、監管和其他臨牀試驗費用以及相關的輔助管理。我們向供應商和其他流動資產、應付帳款和應計費用餘額提供的預付款在所有期間都受到供應商開具發票和付款的時間的影響。
115
目錄
投資活動使用/提供的現金淨額
截至12月31日,2017年度用於投資活動的淨現金為320萬美元,截至12月31日,2016年度用於投資活動的淨現金為60萬美元,12月31日終了年度投資活動提供的淨現金為40萬美元。在2017年間,淨現金主要用於購買一年的短期投資.在2016年間,淨現金主要用於為我們在中國大連的辦事處購置傢俱和固定裝置。2015年間,投資活動提供的淨現金主要來源於收購股權投資所得的現金,淨貸款為關聯方。
融資活動提供的現金淨額
截至12月31日,2017年度融資活動提供的現金淨額從截至12月31日的1,470萬美元增加到4,770萬美元,增加了3,300萬美元。增長的主要原因是我們的首次公開募股和在2017月份同時進行的私人配售,在這一過程中我們獲得了4720萬美元的淨收入。截至12月31日,2016年度融資活動提供的淨現金為1,470萬美元,而截至12月31日的年度為1,670萬美元。2016年度融資活動提供的淨現金主要與我們在9月份向某些投資者發行1,525萬美元普通股有關。2016年度融資活動提供的現金比2015減少,主要原因是發行普通股所得收益減少,2016年間沒有第三方貸款或附屬貸款。
營運資本要求
我們不期望從產品銷售中獲得可觀的收入,除非我們獲得監管機構的批准,並將我們目前的任何產品候選產品商業化。我們預計,在可預見的未來,我們將繼續產生虧損,而且我們預計,隨着我們繼續為我們目前的產品候選人開發和尋求監管批准,損失還會增加,並承擔預期在監管機構批准前會發生的商業化前費用。此外,如果獲得我們的任何產品候選人的監管批准,我們預計將承擔大量的商業化費用,產品銷售,營銷和製造。因此,我們預計,我們今後的行動將需要大量額外資金。
根據我們目前的運營計劃,我們預計,截至12月31日,我們現有的現金和現金等價物以及短期投資3060萬美元,將使我們至少在提交本年度報告後的12個月內,能夠滿足我們的運營費用和資本支出需求。在此期間,我們預計我們的開支將比目前水平大幅度增加,因為我們將繼續資助我們目前產品候選人的臨牀開發,繼續為我們的早期項目、營運資本和其他一般企業目的投資於研究和開發,因此,我們可能需要籌集更多的資金。我們的估計是基於可能被證明是錯誤的假設,我們可能比目前預期的更快地使用我們現有的資本資源。由於與產品候選人的開發和商業化有關的許多風險和不確定因素,我們無法估計完成產品候選產品的開發和商業化所必需的增加的資本支出和業務支出的數額。
我們未來的資本需求將取決於許多因素,包括:
| · |
監管審查和批准的成本、時間和結果;
|
| · |
我們的產品候選人通過臨牀開發取得進展的能力;
|
| · |
動物研究的啟動、進展、時間、成本和結果,以及我們其他項目和潛在產品候選項目的臨牀試驗結果;
|
116
目錄
| · |
我們所追求的產品候選人的數量和特點;
|
| · |
準備、提交和起訴專利申請、維護和執行我們的知識產權和維護與知識產權有關的權利主張的費用;
|
| · |
我們獲得或許可其他產品和技術的程度;
|
| · |
我們有能力與其他製藥公司建立和維持安排夥伴關係,以發展我們的資產,並使其獲得許可證和商業化;以及
|
| · |
我們有能力在有利的條件下維持和建立合作安排,如果有的話。
|
在此之前,如果我們能夠創造大量的產品收入,我們預計將通過股權發行、債務融資、合作、戰略聯盟、營銷或分銷安排、許可證安排和政府贈款等多種方式來滿足我們的現金需求。只要我們通過出售股本或可轉換債務證券籌集額外資本,我們股東的所有權權益就會被稀釋,這些證券的條款可能包括清算或其他對股東權利產生不利影響的優惠。如果有債務融資,可能涉及協議,其中包括限制或限制我們採取具體行動的能力的公約,例如增加債務、支付資本支出或宣佈股息,並可能要求發行認股權證,這可能會削弱我們股東的所有權利益。如果我們通過與第三方的合作、戰略聯盟、營銷或分銷安排或許可安排籌集額外資金,我們可能不得不放棄對我們的技術、未來收入來源或研究項目的寶貴權利,或以對我們不利的條件授予許可證。如果我們不能在需要時通過股權或債務融資籌集額外資金,我們可能需要推遲、限制、減少或終止我們的產品開發或今後的商業化努力,或授予我們開發和銷售我們本來更願意開發和推銷的產品或產品的權利。
| C. |
研發、專利和許可證等。
|
研究與開發
在2015、2016和2017財政年度,我們的研發費用分別為630萬美元、1040萬美元和8 890萬美元。我們的研究和開發費用包括與我們的研究和開發活動有關的費用、進行動物研究和普林布林臨牀試驗的費用、與管理文件有關的活動、人事開支以及在2017購買普林布林的剩餘全球專利權的費用。見“-A.經營業績---業務結果的組成部分---費用---研究和發展費用”。
知識產權
截至2018年月28,我們擁有或共同擁有72個專利,分佈在34個司法管轄區,其中包括17項美國專利。我們還擁有5項美國非臨時專利申請以及其他司法管轄區的相應專利申請和5項美國臨時專利申請。此外,我們還擁有三份根據PCT提交的國際專利申請,我們計劃在美國和其他國家提交申請,目的是減少CIN,治療使用微管蛋白結合化合物,以及劑量方案。我們還擁有一項在PCT下提交的國際專利申請,我們計劃在美國和其他國家對含有BPI-002的成分和使用BPI-002的方法提出申請。見“項目4”。有關公司的資料---B.商業概況---知識產權。“
| D. |
趨勢信息
|
我們是一個臨牀階段的公司,不能準確地預測我們的研究和開發努力的結果。因此,我們無法準確地預測任何有可能對我們的淨虧損、流動資金或資本資源產生重大影響的重大趨勢、不確定因素或事件,或使財務信息不能反映未來的經營業績或財務狀況。然而,在這一“項目5”中儘可能説明某些趨勢、不確定因素、要求、承諾和事件。經營及財務檢討及展望。“
117
目錄
| E. |
表外安排
|
我們在2015、2016和2017財政年度沒有任何表外安排,而我們目前也沒有SEC規則所定義的任何表外安排,例如與不合並實體或金融合作夥伴的關係,這些關係通常被稱為結構化金融或特殊目的實體,目的是促進不需要反映在我們的合併資產負債表上的融資交易。
| F. |
合同義務和承諾
|
我們的主要承諾包括設備和辦公空間的經營租賃義務。下表彙總了截至2017年月31到期付款時的重要合同義務:
|
按期間支付的款項
|
||||||||||||||||||||
|
共計
|
少於
1年
|
1至3年
|
3-5歲
|
多過
5年
|
||||||||||||||||
|
(單位:千)
|
||||||||||||||||||||
|
業務租賃承付款
|
$
|
66
|
$
|
66
|
—
|
—
|
—
|
|||||||||||||
我們租賃了我們所有的設施,並相信我們現有的設施足以滿足我們的需要。我們的主要執行辦公室設在紐約,我們還在中國大連設有辦事處。在2015,我們開始租賃在紐約的辦事處,每月2938美元。此後,我們又租用了額外的辦公空間,到2020年月日,租金增加到每月26382美元。經營租契下的付款是在各租契期內以直線方式支付的,而租約的條款並不包括租金上漲、或有租金、續期或購買期權。
我們在中國大連以多種經營租賃方式租賃了辦事處,租期至2016年月31。根據我們與中國政府的租賃協議,在上述租賃期內,中國大連的辦公設施的租金是免費的。從9月份開始,我們以每月約2,000美元的價格在中國大連租賃辦事處。
我們還租用了聖地亞哥的辦公空間,從2016到1月31,2017,月租金為2,359美元。此後,我們又租用了額外的辦公空間,租金增加到每月4619美元,直到1月31日,2020。
我們在正常的業務過程中與CRO和機構簽訂了知識產權許可協議。我們沒有將這些未來的付款列入上述合同義務表,因為我們可以在任何時候取消這些合同,並事先書面通知。
| 項目6. |
董事、高級管理人員和僱員
|
| A. |
董事和高級管理人員
|
以下是我們的共同創始人、董事和執行官員的姓名和年齡,以及截至2018年月26的BeyondSpring製藥公司或BeyondSpring美國公司的執行官員Mohanlal、Lloyd和Schooley先生的姓名和年齡,並簡要介紹了他們各自的業務經歷。我們的董事和官員以及BeyondSpring美國公司的職員的辦公地址是10005紐約自由街28號BeyondSpring公司的c o o beyondSpring Inc.。
118
目錄
|
姓名
|
年齡
|
職位
|
||
|
執行幹事
|
|
|||
|
蘭黃博士。
|
47
|
聯合創始人、董事長兼首席執行官
|
||
|
劉東亨
|
36
|
首席財務官
|
||
|
拉蒙·W·莫漢拉爾博士,博士。
|
59
|
美國BeyondSpring首席醫務官。
|
||
|
G.Kenneth Lloyd博士
|
73
|
美國BeyondSpring公司首席科學官。
|
||
|
戈登·L·斯科利博士。
|
71
|
美國碧昂斯春公司首席監管官。
|
||
|
非僱員董事
|
||||
|
帕特里克·法比奧,M.B.A.
|
50
|
導演
|
||
|
馬修·柯克比,M.A.
|
49
|
導演
|
||
|
宋全奇博士。
|
53
|
導演
|
||
|
謝燕斌,M.D.
|
60
|
導演
|
||
|
趙令瑩,M.B.A.
|
45
|
導演
|
執行幹事
蘭黃博士。是我們的共同創始人、董事長和首席執行官,自2014年11月以來一直是董事會成員。黃博士在中國和美國生物技術行業有十多年的創業經驗。2010,黃博士創立了萬春生物科技公司,這是我們美國子公司的前控股公司。2007,黃博士共同創辦無錫MTLH生物技術有限公司.她於2010擔任公司首席執行官,並繼續擔任董事職務。在無錫MTLH生物技術有限公司任職期間,黃博士設計的肽類藥物在中國的開發和銷售相關權利。有限公司,於2010被出售給上海醫藥集團。此外,在2008,黃博士共同創立了ParamaxInternationalInc.,這是一家為全球生物製藥和醫療器械公司進行臨牀試驗的CRO公司。Paramax國際公司於2009被研究製藥服務公司收購。黃博士於1998至2002年間在紀念斯隆·凱特林癌症中心接受培訓,她在那裏發表了關於p53降解的癌症信號通路的研究報告。科學。她在癌症信號通路中涉及RAS的翻譯研究發表在兩篇文章中。自然文件。她發明並擁有多項用於腫瘤學和皮膚科適應症的生物技術產品的專利。在2009,她獲得了中國“千才創新者獎”。黃博士從勞倫斯大學獲得了她的學士學位、大學士學位和博士學位,在那裏她在2012到2015年間擔任受託人。她在加州大學伯克利分校獲得化學博士學位,並在那裏獲得了職業婦女福利互助會國際協會頒發的國際婦女機會獎。她還在中國上海復旦大學學習。
劉東亨自2018年3月26日起擔任我們的首席財務官。劉先生在高級銀行職位方面有十年的經驗,支持公司融資和亞太地區客户的戰略交易。通過他在股票投資和投資銀行方面的經驗,他發展了一種金融分析方面的專門知識,特別是在醫療保健方面。從2016到2018年間,劉先生是EpiphronCapital的合夥人和執行董事。EpiphronCapital是一家跨境、以醫療保健為重點的投資基金,也是碧昂斯的早期投資者。2013至2016年間,他擔任香港傑富瑞香港有限公司投資銀行及資本市場小組副總裁,其後出任高級副總裁。在此之前,他在摩根大通證券(亞太)有限公司擔任各種職務,職責日益增加,他在該公司專注於亞太地區的投資銀行業務。劉先生獲得耶魯大學經濟學和數學學士學位。在進入耶魯大學之前,他還在清華大學完成了一年的生物醫學工程課程。
拉蒙·W·莫漢拉爾博士,博士。從2015開始擔任我們的首席醫務官。最近,從2015到2015,莫漢拉爾博士擔任阿斯利康免疫腫瘤學項目的顧問,幫助支持和管理幾個1/2和2/3階段的研究。在此之前,從2012到2015年間,莫漢拉爾博士擔任諾華公司(NovartisAG)一家全球性醫療公司的臨牀產品腫瘤學主管。從2009到2012年間,莫漢拉爾博士是一家生物製藥公司的顧問,他在該公司負責合作、交易以及圍繞藥物開發資產製定商業計劃。從2007到2009年間,莫漢拉爾博士擔任生物製藥公司(BioPremiere,Inc.)的首席執行官和首席醫療官,該公司專注於為嚴重疾病開發生物製劑,在那裏他負責籌資和合作活動。從2005到2007年間,莫漢拉爾博士作為白介素基因公司的首席醫務官管理藥物開發和診斷開發,該公司是一家個性化健康公司,開發用於個性化健康市場的基因測試。莫漢拉爾博士在伊利諾伊州的美國洲際大學獲得了碩士學位,並在荷蘭萊頓大學獲得了實驗簡歷藥理學的博士學位和博士學位。
119
目錄
G.Kenneth Lloyd博士自2015年月1日起擔任我們的首席科學官。勞埃德博士還在2013至2014年間擔任萬春生物科技公司的首席科學官,該公司是我們美國子公司的前控股公司。從2012到2015年間,勞埃德博士曾擔任三相加速器公司的科學顧問,該公司專注於臨牀授權和腫瘤資產外授權。從2000到2012年間,勞埃德博士擔任Nereus公司的首席科學官,在那裏他負責公司的研發和藥物發現項目,包括該公司對普林布林的開發。除了擔任他共同創立的諮詢公司gkol inc.的董事外,勞埃德博士還在凡爾納孟德爾醫療公司(Verne Mendel Medical Corporation)擔任董事,該公司專注於開發藥物候選產品,以治療線粒體退化性疾病。他被廣泛發表在期刊上,其中包括科學, 自然以及新英格蘭醫學雜誌。勞埃德博士在麥吉爾大學接受了生物化學的本科教育和碩士學位,並在多倫多大學獲得了藥理學和毒理學博士學位。他在瑞士巴塞爾的一家全球性醫療公司F.Hoffmann-La Roche AG完成了博士後研究.
戈登·L·斯科利博士。自2016年9月起擔任我們的首席監管官。Schooley博士還在2013至2016年間擔任我們的管理事務高級副總裁。Schooley博士於2008至2016年間擔任高級分析和信息學有限責任公司總裁。2008至2009年間,斯科利博士擔任Progen製藥公司的董事,2005至2009年間,他擔任監管和生物統計顧問。Schooley博士於1999至2008年間擔任Skyepharma公司和Pacira製藥公司的首席科學官和臨牀和管理事務高級副總裁。Schooley博士在楊百翰大學接受了本科培訓和碩士學位,並在密歇根大學公共衞生學院獲得了生物統計學和醫療組織與管理博士學位。
非僱員董事
帕特里克·法比奧,M.B.A.從2018年月2開始在我們的董事會任職。法比奧先生目前是公共生物技術公司Progenics製藥公司的首席財務官。在去年11月加入Progenics之前,他曾是一傢俬人控股的生物醫藥保健公司ElectrcoreLLC的首席財務官,以及Shire收購的一家上市的全球罕見疾病公司nps製藥公司的財務副總裁。Mr. Fabbio has more than 20 years of financial leadership experience in both public and private life science and pharmaceutical companies in various roles, including: Vice President, Finance of Catalent Pharma Solutions Inc.; Chief Financial Officer of Ikano Therapeutics Inc.; senior corporate finance, commercial and transactional roles at Sanofi; and Corporate Controller for Biomatrix Inc., a publicly traded biotechnology company that was acquired by Genzyme.他在佩斯大學獲得會計學學士學位,在紐約大學斯特恩商學院獲得工商管理碩士學位。
馬修·柯克比,M.A.自2016年月13日以來一直在我們董事會任職。柯克比先生為我們的董事會帶來了20多年的銀行業經驗。他曾在倫敦、香港和新加坡擔任高級管理職務。2015至2016年間,柯克比先生擔任滙豐銀行駐香港亞太區公司業務主管。從2012到2015年間,柯克比先生是中銀在香港的首席執行官、北亞和投資銀行聯席主管。他於2008至2010年間擔任蘇格蘭皇家銀行董事總經理、企業經營管理和企業財務全球主管,並於2010至2012年間擔任亞太全球銀行總裁。1999至2007年間,柯克比先生在荷蘭銀行擔任過各種職務。他目前是一些私營公司的董事或顧問。他在聯合王國牛津大學彭布羅克學院獲得法學碩士學位。
宋全奇博士。自2016年5月1日起在我們董事會任職。自2013以來,宋博士一直擔任中國煤炭國際租賃有限公司的董事,該公司提供國際租賃、諮詢和管理服務,並繼續擔任董事職務。此外,自2007以來,宋博士一直擔任深圳投資有限公司的投資經理和執行董事。宋博士在中國開封河南大學獲得地理學士學位,然後是自然資源研究生學位。宋博士在北京中國人民大學獲得金融和銀行博士學位。
120
目錄
謝燕斌,M.D.自2016年5月1日起在我們董事會任職。謝博士長期從事藥物開發研究。1997至2018年間,謝博士曾任北京醫藥諮詢有限公司的總經理,該公司是一家為生物技術、製藥和醫療器械行業提供外包開發服務的公司。在圖標,謝博士負責協調戰略目標和發展,培訓管理團隊和監督監管合規。謝博士於1997創立了中國第一家合資公司北京Wits,目的是將臨牀試驗的國際標準引入中國。謝博士繼續擔任北京威茨科技有限公司董事職務。他自1995以來一直持有該公司。自2011以來,謝博士還擔任醫學超音速公司的董事,該公司專注於超聲波設備的開發。謝博士畢業於中國太原山西醫科大學,主攻臨牀醫學。
趙令瑩,M.B.A.自2016年月13日以來一直在我們董事會任職。自2016以來,趙女士一直是元明資本的管理合夥人。元明資本是一家風投/私募基金,專注於中美之間的跨境投資和收購機會,尤其是在醫療行業。趙女士曾任最佳物流技術(中國)有限公司集團首席財務官。在此之前,趙女士曾擔任美國銀行美林(Bank Of America Merrill Lynch)董事總經理和摩根大通(JPMorgan)執行董事,她在全球企業和投資銀行部門擔任高級職位(包括地區首席財務官和首席運營官)。趙女士曾在多家公司任職,其中包括在紐約、倫敦和新加坡的美國運通(American Express)的戰略和企業風險投資,在香港的高盛(Goldman Sachs)投資銀行,以及在美國聯邦快遞公司(FedEx Corporation)的企業發展。她為董事會帶來了獨特的管理經驗,因為她管理過四大洲的團隊。趙女士目前是中國金融協會的董事會成員,中國金融協會是一個非盈利組織,在全球擁有6000多名會員。趙女士是一名特許金融分析師,擁有哈佛商學院(Harvard Business School)的碩士學位和經濟學學士學位,並與中國上海復旦大學(Fudan University)有着明顯的區別。
CFO理查德·布蘭德辭職
理查德·A·布蘭德從2018年月20日起辭去我們的首席財務官一職。布蘭德先生的離開並不是我們或董事會在任何與我們的業務、政策或做法有關的問題上有任何分歧的結果。關於布蘭德先生的離職,我們與理查德·布蘭德簽訂了離職協議,詳見下文第6項--董事、高級管理人員和僱員-B.薪酬--與理查德·布蘭德簽訂的離職協議。我們的財務總監楊愛美擔任公司的臨時首席財務官,直到劉東亨於2018年月26日被任命為首席財務官。
| B. |
補償
|
2017年度執行主任及董事薪酬
With respect to the year ended December 31, 2017, the aggregate cash compensation, including benefits in kind, accrued or paid by us and our subsidiaries to our directors and executive officers (including our former CFO Richard Brand and former directors Nanxing He and Mulong Liu) was $1.6 million, and the aggregate equity compensation by us and our subsidiaries to our directors and executive officers was $22.7 million (including stock options, 如下文“-2017總括獎勵計劃”所述)。這一數額不包括商務旅行、搬遷、專業和商業協會會費和償還給這些人的費用,以及一般由我們行業的公司償還或支付的其他福利。在截至2017年月31的一年中,我們沒有單獨為董事和執行官員的養老金、退休或其他福利留出任何款項。
董事協議
我們已與每一位非僱員董事達成董事協議,或董事協議.根據各董事協議的條款,我們的非僱員董事每年須支付的補償包括:
| · |
年現金保留費等於$30,000(任何部分服務年按比例評定),另加任何擔任賠償委員會、提名及公司管治委員會或審計委員會主席的董事的額外現金保留費,相等於$3,750(任何部分服務年按比例計算),及
|
121
目錄
| · |
an annual grant of restricted shares with a grant date value of $30,000 (pro-rated for any partial year of service), plus an additional grant of restricted shares with a grant date value of $3,750 (pro-rated for any partial year of service, but not pro-rated in respect of fiscal year 2017) for any director serving as chairman of either the Compensation Committee, the Nominating and Corporate Governance Committee, or the Audit 委員會,在每種情況下,按財政年度支付欠款。
|
這種限制性股票是在BeyondSpringInc.下發行的。2017總括獎勵計劃,或2017總括獎勵計劃,並在授予日期首三個週年時分期付款,但須經適用的歸屬日期以董事的身分繼續服務。任何授予非僱員董事的限制性股份,均須遵守2017歐姆尼布斯獎勵計劃的條款和條件,以及適用的限制性股份獎勵協議,以紀念這種授予。截至2017年月31,柯克比、宋博士、趙女士和謝博士分別獲得了846股、735股、846股和735股基於時間的限制性股票,但這些股份都沒有歸屬。
有關我們2017總括激勵計劃下基於股權的贈款的其他信息,請參閲“-2017 Omnibus獎勵計劃”。
就業協議
蘭黃博士。
我們的聯合創始人、董事長兼首席執行官黃蘭博士從成立之日起至2016年月1日一直為碧昂斯美國公司提供諮詢服務,並有權在截至12月31日2015年的一年內獲得300,000美元的諮詢服務費,其中200,000美元已於2015年底支付。從2016到2016年間,黃博士獲得了高達7.5萬美元的諮詢費。黃醫生還報銷了一些諮詢費用。2016年月1日,我們與黃博士簽訂了首席執行官職位的僱傭協議,並於2016年月10修改並重申。從2016到12月31日,黃博士從我們那裏得到了52.5萬美元的薪水。黃醫生目前的底薪為30萬美元,須根據公司政策進行審查和調整。根據公司政策,黃博士有資格獲得基於業績的獎勵。黃醫生每月最多可領取500元的醫療保險。黃博士須盡最大努力,在本港工作最少三年,但任何一方均可隨意終止她的工作。
劉東亨
2018年月26日,我們與劉東亨簽訂了首席財務官一職的就業協議,開始僱用日期為2018年3月26日。劉先生有權領取30萬美元的基薪,但須根據公司政策進行審查和調整。劉先生有資格根據某些預先規定的里程碑獲得兩個月工資的年度獎勵。劉先生每月最多可領取500元的醫療保險。劉先生必須盡最大努力在我們的工作崗位上至少呆四年,但任一方都可以隨意終止他的工作。
拉蒙·莫漢拉爾博士,博士。
美國BeyondSpring的首席醫務官RamonMohanlal博士於2015至2016年間為BeyondSpring美國提供了諮詢服務,並因在此期間提供的服務收取了14萬美元的諮詢服務費。Mohanlal博士也得到了某些醫療費用的補償。2016年月1日,我們與拉蒙·莫漢拉爾博士簽訂了一份關於首席醫療官職位的僱傭協議,並於2016年月10修改並重申。從2016到12月31日,莫漢拉爾博士從我們那裏得到了52.5萬美元的薪水。Mohanlal博士目前的基薪為30萬美元,將根據公司政策進行審查和調整。莫漢拉爾博士有資格獲得年薪的30%的年度獎勵,這是基於某些預先規定的里程碑。Mohanlal博士有資格獲得醫療保險的付款,最多每月500美元。莫漢拉爾博士被要求盡最大努力在我們的工作崗位上至少呆五年,但他的工作可以由任何一方隨意終止。
122
目錄
戈登·L·斯科利博士。
BeyondSpring美國首席監管官Gordon Schooley博士於2013至2016年間為BeyondSpring U.S.提供諮詢服務,在截至12月31日、2015和2016的期間,他的諮詢服務費分別為13.5萬美元和11萬美元。2016至2016年間,斯科利博士為他提供的服務收取了11萬美元的諮詢費。Schooley博士還可報銷某些諮詢和醫療費用。2016年月16日,我們與戈登·L·斯科利博士簽訂了一份擔任監管事務高級副總裁的僱傭協議。在2016年月10日,我們與戈登·L·斯科利博士簽訂了一份經修正並重新聲明的僱傭協議,擔任首席監管官。從2016到2017的6月16日,Schooley博士從我們那裏得到了385,416美元的薪水。Schooley博士目前的基薪為25萬美元,將根據公司政策進行審查和調整。肖利博士有資格獲得年薪的20%的獎金,這是基於某些預先規定的里程碑。作為他諮詢協議的一部分,Schooley博士還為他和他的妻子支付了醫療保險費用。斯科利博士必須盡最大努力在我們的工作崗位上至少呆三年,但他的工作可以任意被任何一方終止。
諮詢安排
G.Kenneth Lloyd博士
肯尼斯·勞埃德博士,我們的首席科學官,自2012年月16日以來,一直為美國碧昂斯春公司提供諮詢服務,在美國碧昂斯春公司成立之前,為我們的子公司萬春製藥公司提供諮詢服務。根據與勞埃德醫生簽訂的顧問服務合約,在截至十二月三十一日、2015及2017的一年內,他所提供的服務收費分別為212,500元及30,000元。作為他諮詢協議的一部分,勞埃德博士還可報銷他和妻子的健康保險費用以及某些諮詢費用。
與理查德·布蘭德(前首席財務官)簽訂的分離協議
Mr. Brand resigned as Chief Financial Officer effective as of February 20, 2018. In connection with his resignation, we entered into a Severance Agreement and General Release with Mr. Brand, dated February 20, 2018, pursuant to which we agreed to pay Mr. Brand one month base salary and to pay health insurance premiums for Mr. Brand and his dependents through May 31, 2018, in exchange for execution by Mr. 布蘭德先生將繼續受他的僱傭協議和他的相互保密和保密協議中的限制性契約的約束。布蘭德先生的未獲限制的股份獎勵在他辭職之日被沒收。
2017綜合激勵計劃
在首次公開募股方面,我們採用了2017歐姆尼布斯激勵計劃,為選定的董事、官員、僱員和顧問提供額外的激勵,並使我們的公司能夠獲得和保留這些個人的服務。2017歐姆尼布獎勵計劃使我們能夠授予期權,限制股票或其他獎勵給我們的董事,僱員和顧問。根據“2017總括獎勵計劃”的獎勵,至多2,137,037股普通股獲得了授權。裁決將根據裁決協議作出,並可能受到董事會決定的歸屬和其他限制。
限制性股份獎勵
123
目錄
We have granted restricted share awards under the 2017 Omnibus Incentive Plan to certain of our employees and consultants, including certain of our executive officers. Under the terms of the restricted share award agreements, if an executive officer is terminated without “cause” within 12 months of a “change in control” (each as defined in the 2017 Omnibus Incentive Plan), then any unvested time-based 受限制的股份將在終止之日全部歸屬。如執行主任的僱傭或聘用因死亡或傷殘而終止,則假若執行主任在適用的歸屬日期仍在本公司服務的下一批基於時間限制的股份,將於終止日期全數歸屬,而截至終止日期的任何剩餘的基於時間限制的未轉歸股份將被沒收。在任何其他終止僱用或聘用時,所有截止終止日期的無時間限制股份將被沒收。在因任何原因終止服務時,截至終止日期為止,所有未獲實績限制的股份將被沒收。
於2017年月11日,我們批出以下數目的受限制股份,並附有以下轉歸條款(在每種情況下,均須在適用的歸屬日期繼續受僱或受聘)莫漢拉爾博士、勞埃德博士、斯科利博士和布蘭德先生:
| · |
Dr. Mohanlal: 400,000 shares, vesting as follows: (i) 120,000 shares vesting on the 6-month anniversary of the grant date; (ii) 180,000 shares vesting in equal installments on each of October 12, 2017, 2018 and 2019; and (iii) 100,000 shares vesting based on the achievement of various milestones with respect to Plinabulin.
|
| · |
勞埃德博士:100,000股,轉歸如下:(I)80,000股在批出日期6個月的週年紀念日;及(Ii)20,000股於2018年月日歸屬。
|
| · |
斯科利博士:100,000股,歸屬情況如下:(1)80,000股在授予日期6個月的紀念日上歸屬;(2)20,000股於2018年月日歸屬。
|
| · |
布蘭德先生:10萬股,其中25000股於4月1、2017和75,000股在布蘭德先生於2018年月20日終止與我們的僱傭關係後被沒收。
|
在2017,11月7日,每個莫漢拉爾博士、勞埃德博士和肖利博士由於我們根據我們的備忘錄和章程,他未能支付應支付的代價,因此沒收了下列數量的限制性股份:Mohanlal博士,172,800股;Lloyd博士,72,900股;Schooley博士,73,000股。
As of December 31, 2017, each of Dr. Mohanlal, Dr. Lloyd, Dr. Schooley and Mr. Brand held the following number of restricted shares: Dr. Mohanlal, 220,098 shares (of which 98 shares were vested); Dr. Lloyd, 20,000 shares (of which none were vested); Dr. Schooley, 20,137 shares (of which 137 were vested); and Mr. Brand, 80,039 shares (of which 5,039 were vested).
期權獎勵
We have also granted non-qualified stock options to purchase our ordinary shares under the 2017 Omnibus Incentive Plan, or “options,” to certain of our executive officers. The options are subject to a combination of time-based vesting and performance-based vesting (as described further below), subject to the executive officer’s continued service with us through the applicable vesting date. The options, if not earlier 行使或沒收,在授予之日十週年起失效。
Under the terms of the 2017 Omnibus Incentive Plan and option agreements, (i) if the options are assumed or substituted for in the change in control, if the executive officer is terminated without cause within 12 months of such change in control, then any unvested options will become vested and will remain exercisable for the 90-day period following the termination date, and (ii) if the options are not assumed or 在更改控制權時,任何未獲授權的選擇將在控制權改變後獲得,否則會被視為由計劃管理人決定。
If the executive officer’s employment or engagement terminates due to death or disability, the next tranche of time-based options that would have vested had the executive officer remained employed or engaged through the applicable vesting date will become fully vested on the termination date (and will remain exercisable for one year following such termination), and any remaining unvested time-based options will be forfeited.在我方因因由終止合同時,所有既得和未歸屬的期權都將被沒收。在因任何其他原因終止時,既得期權在終止日期後三個月內仍可行使。在任何終止僱用時,截止終止之日,任何基於績效的未獲授權的選擇將被沒收.
124
目錄
在2017年月20日,我們授予莫漢拉爾博士、勞埃德博士和斯科利博士以下期權,每股29.00美元:
| · |
莫漢拉爾博士(以英語發言):17萬種選擇,取決於在研究、開發、測試和實現研究105和106以及與ASCO-SITC的介紹有關的各個組成部分里程碑的實現上。
|
| · |
勞埃德博士:80000種選擇,主要取決於在研究、開發、測試和實現研究105的各個組成部分的里程碑的實現。
|
| · |
肖利博士(以英語發言):93,000項選項,歸屬如下:(1)60,000項備選方案分別分兩期分期付款,分別在贈款日期六個月和一年的週年紀念中分期付款;以及(Ii)33,000項備選方案,用於實現研究105和研究106的研究、開發、測試和實現中的各種組成部分里程碑。
|
股票獎金獎
根據2017歐姆尼布斯獎勵計劃,我們已經授予莫漢拉爾博士一個股票紅利獎勵機會。莫漢拉爾博士將有資格獲得最多300,000普通股分期付款,在我們確認與藥物BPI-002的研究、開發、測試和實現的各個組成部分里程碑有關的累積淨收入的具體數額後,他將通過實現每一個適用的里程碑繼續受僱。Mohanlal博士還將有資格獲得最多300,000股分期支付的普通股,條件是我們確認與藥物BPI-004的研究、開發、測試和實現的各個組成部分里程碑有關的累積淨收入的具體數額,但這取決於他通過實現每一個適用的里程碑而繼續受僱。
Under the terms of the applicable stock bonus award agreements, if Dr. Mohanlal’s employment terminates for any reason (other than in connection with a change in control, as described below), any bonus payment for which the applicable milestone has not been attained as of the termination date will be forfeited, provided, that if we terminate Dr. Mohanlal’s employment without cause and within six months following such 終止任何里程碑,則他將有資格獲得普通股數,如果他仍在該日期受僱,在達到該里程碑時他會收到的普通股數。如果我們在控制變更後12個月內無故終止Mohanlal博士的工作(如2017 Omnibus獎勵計劃中的定義),然後由後續實體簽署股票獎金獎勵協議,那麼在達到下一個里程碑時應支付的下一部分獎金將在終止日期完全歸屬。如果在控制權變更中,繼承實體不承擔股票獎金獎勵協議,則在達到下一個里程碑時應支付的下一批獎金將在控制權變更之日完全歸屬。
| C. |
董事會慣例
|
董事會
我們的董事會目前由六名成員組成,所有成員都是根據我們目前的公司章程選出的。我們的提名和治理委員會和董事會考慮與被提名人的資格和背景有關的廣泛因素,這些因素可能包括多樣性,而不限於種族、性別或民族血統。我們沒有關於董事會多樣性的正式政策。我們的提名和治理委員會和董事會在挑選董事會成員時的優先事項是確定哪些人將通過其既定的專業成就記錄來促進我們股東的利益,有能力對董事會成員之間的合作文化作出積極貢獻,瞭解我們的業務,瞭解競爭環境以及與我們的增長戰略有關的專業和個人經驗和專門知識。
125
目錄
開曼羣島法律沒有規定,除非任命董事的決議規定董事任期為一段時間,否則董事必須任職一定任期並競選連任。我們修改和重申的公司章程規定,我們的董事應任職至任期屆滿,直至其繼任者當選合格為止。
可通過普通決議選出董事,以填補董事會的臨時空缺,或作為現有董事會的補充。董事經出席並在董事局會議上表決的其餘董事的簡單過半數的贊成票,有權不時及隨時委任任何人為董事,以填補董事局的臨時空缺,或增補現有董事局,但須視乎我們是否符合根據“董事提名程序”所規定的提名程序而定。適用於納斯達克資本市場的公司治理規則,只要我們公司的證券在納斯達克資本市場上交易。董事可在任期屆滿前隨時藉普通決議免職。“董事協議”沒有規定在終止對我們董事的服務時的任何福利。
獨立董事
我們的董事會決定,按照納斯達克資本市場的規則,帕特里克·法比奧、馬修·柯克比、宋全奇、謝燕斌和趙瑩是獨立的。在作出這種獨立性決定時,我們的董事會考慮了每名非僱員董事與我們的關係,以及董事會認為與決定其獨立性有關的所有其他事實和情況,包括每位非僱員董事對我們的股本的實益所有權以及“第7項”中所述的涉及他們的交易。大股東和關聯方交易---B.關聯方交易。我們的董事會和每個委員會的組成和運作符合納斯達克資本市場的所有適用要求和證券交易委員會的規則和條例。我們的董事或行政人員之間沒有家庭關係。
董事會委員會
我們的董事會設立了一個審計委員會、一個薪酬委員會以及一個提名和公司治理委員會,每個委員會都根據董事會通過的單獨章程運作。我們所有委員會的組成和運作符合“薩班斯-奧克斯利法案”、“多德-弗蘭克華爾街改革和消費者保護法”、“納斯達克資本市場”和“證券交易委員會規則和條例”的所有適用要求。
審計委員會
帕特里克·法比奧(Patrick Fabbio)、馬修·柯克比(Matthew Kirkby)和宋全奇(Quungqi Song)目前是由帕特里克·法@@我們的董事會決定,審計委員會的每一位成員都是“獨立”的,因為這一術語在美國證交會的規則和納斯達克資本市場的適用規則中得到了界定。審計委員會的職責包括:
| · |
選擇和指定獨立註冊會計師事務所,批准獨立註冊會計師事務所提供審計和非審計服務;
|
| · |
評價我國獨立註冊會計師事務所的績效和獨立性;
|
| · |
監測我們財務報表的完整性,以及我們遵守與我們的財務報表或會計事項有關的法律和法規要求的情況;
|
126
目錄
| · |
檢討我們的會計和內部控制政策和程序的充分性和有效性;
|
| · |
建立接收、保留和處理與會計有關的投訴和關切的程序;
|
| · |
與獨立註冊會計師事務所檢討及討論年終審計結果,並在檢討及討論的基礎上,向董事局建議,我們的財務報表應否包括在表格20-F的年報內;
|
| · |
審查所有潛在利益衝突情況的關聯方交易,並批准所有此類交易;以及
|
| · |
審查我們的收益新聞稿中將包括的信息的類型和格式,以及我們向分析師和評級機構提供的財務信息和收益指導。
|
賠償委員會
馬修·柯克比、謝豔斌和趙瑩目前是由馬修·柯克比擔任主席的賠償委員會成員。我們的董事會已經確定賠償委員會的每個成員都是“獨立的”,因為這一術語是在納斯達克資本市場的適用規則中定義的。賠償委員會的職責包括:
| · |
根據這些目標和目的,審查我們高管薪酬計劃的目標和目的,以及我們的高管薪酬計劃;
|
| · |
根據我們的高管薪酬計劃的目標和目的,評估我們的執行官員的業績,並就高管的薪酬向我們的董事會提出建議;
|
| · |
根據這些目標和目的,審查我們的總體薪酬計劃和其他員工福利計劃的目標和目的,以及我們的總體薪酬計劃和其他員工福利計劃;
|
| · |
保留和批准賠償顧問的報酬;
|
| · |
審查根據納斯達克上市規則提交股東批准的所有股權補償計劃,並審查和批准不受股東批准要求的所有股權補償計劃;
|
| · |
評估非僱員董事對董事局及董事會委員會服務的適當薪酬水平;及
|
| · |
審核並批准表格20-F所載的行政人員薪酬描述。
|
提名及公司管治委員會
馬太·柯克比、謝豔斌和趙令瑩目前是提名和公司治理委員會的成員,該委員會由趙麗晶擔任主席。我們的董事會已經確定提名和公司治理委員會的每個成員都是“獨立的”,因為這一術語是在納斯達克資本市場的適用規則中定義的。提名和公司治理委員會的職責包括:
127
目錄
| · |
協助董事會確定未來董事人選,推薦股東選舉或董事會任命的人選;
|
| · |
就公司治理的法律和實踐方面的重大發展以及我們遵守適用的法律和條例的情況,定期向董事會提供諮詢意見,並就公司治理的所有事項和採取的任何糾正行動向董事會提出建議;
|
| · |
監督董事局的評估工作;及
|
| · |
為我們董事會的每個董事會推薦成員。
|
我們的董事會可不時設立其他委員會。
| D. |
僱員
|
截至2018年月26,我們有38名全職員工.其中26人從事全職研究開發和實驗室業務,12人從事全職一般和行政工作。截至2018年月26日,我們有14名員工在中國工作,24名在美國工作。我們還聘請並可能繼續聘請非全職僱員的獨立承包商來協助我們的業務。我們的僱員中沒有一個是由工會或集體談判協議所代表的。我們從未經歷過任何與就業相關的停工,我們認為我們與員工的關係是良好的。下表列出過去三年按職能劃分的僱員總數。
|
2015
|
2016
|
2017
|
||||||||||
|
研究開發和實驗室運作
|
8
|
13
|
22
|
|||||||||
|
一般職能和行政職能
|
5
|
12
|
10
|
|||||||||
| E. |
股份所有權
|
有關我們董事和執行官員的股份所有權的信息,見“第7項”。大股東及關聯方交易--A.大股東。“有關我們的董事、執行官員和其他僱員的股權贈款的信息,見“第6項”。董事、高級管理人員和僱員---B.薪酬---董事協議和“項目6”。董事、高級管理人員和僱員---B.薪酬---2017總括激勵計劃。“
| 項目7. |
大股東與關聯方交易
|
| A. |
大股東
|
下表列出了截至2018年3月26日我國普通股的實益所有權情況:
| · |
我們所知道的每一個人或每一組附屬人都有權擁有我們5%或以上的流通股;
|
| · |
我們的每一位董事及指定的行政人員;及
|
| · |
我們所有的執行官員和董事都是一個整體。
|
128
目錄
我們普通股的實益所有權是根據證券交易委員會的規定確定的,一般包括任何人行使單獨或分享投票權或投資權的任何股份,還包括可在2018年月26日60天內行使的可根據股票期權發行的普通股。根據股票期權發行的普通股被視為已發行股票,用於計算持有該等選擇權的人,但在計算任何其他人的百分比方面,並無傑出表現。截至2018年月26日,根據股票期權發行的普通股有283,000只,可在60天內行使。
下表中有權受益的普通股百分比的計算依據是截至2018年3月26日已發行的22,455,702股普通股。除另有説明外,我們相信,根據該等業主向我們提供的資料,以下所列普通股的實益擁有人對該等股份擁有唯一的投資和投票權。
除非下文另有説明,每個股東的地址是:BeyondSpring公司,自由街28號,39。第四紐約,10005樓。
|
實益擁有人的姓名或名稱
|
數目
普通股
有權受益者
|
%
|
||||||
|
5%股東
|
||||||||
|
永樂集團有限公司(1)
|
4,620,000
|
20.57
|
||||||
|
仙鷹投資有限公司(1)
|
4,620,000
|
20.57
|
||||||
|
美時控股有限公司(1)
|
3,990,000
|
17.77
|
||||||
|
NPBSIPO液化信託(2)
|
1,932,963
|
8.61
|
||||||
|
附屬於聖天使風險投資的實體(3)
|
2,105,494
|
8.96
|
||||||
|
附屬於華融天澤的實體(4)
|
1,374,443
|
6.12
|
||||||
|
任命的執行幹事和董事
|
||||||||
|
藍黃(1)
|
13,527,037
|
60.24
|
||||||
|
劉東亨
|
55,555 |
*
|
||||||
|
拉蒙·莫漢拉爾(5)
|
390,098
|
*
|
||||||
|
G.肯尼斯·勞埃德(6)
|
100,000
|
*
|
||||||
|
戈登·L·斯科利(7)
|
53,137
|
*
|
||||||
|
帕特里克·法比奧
|
—
|
—
|
||||||
|
馬修·柯克比(8)
|
846
|
*
|
||||||
|
全其鬆(9)
|
686,273
|
3.06
|
||||||
|
謝燕斌(10)
|
735
|
*
|
||||||
|
趙瑩(11)
|
846
|
*
|
||||||
|
所有董事和執行幹事作為一個整體(10人)
|
14,814,527
|
65.15
|
||||||
| * |
數額不到流通普通股的1%。
|
| (1) |
藍黃博士,我們的聯合創始人,董事長和首席執行官,是永遠富豪集團有限公司的唯一所有者.黃博士的配偶賈臨清先生是仙鷹投資有限公司和羅西時代控股有限公司的唯一所有者。黃博士和賈先生共同擁有萬春生物科技公司90%的股權。黃博士及賈先生可被視為共有投票權及批發權,分別由王家集團有限公司、仙鷹投資有限公司、羅西時代控股有限公司及萬春生物科技有限公司所持有,以及佳兆業持有的十三萬七千零三十七股有限制股份,所有股份均已獲歸屬。
|
| (2) |
由NPBSIPO液化信託公司擁有的1,932,963股普通股組成。BSIPO受託人經理有限責任公司是NPBSIPO液化信託公司的管理人。Kobi Sethna先生有權全權指導行政受託人對NPBSIPO液化信託公司所擁有的股份的表決權和投資權。
|
129
目錄
| (3) |
Consisting of 800,000 ordinary shares owned by Beijing Sangel Fang Sheng Venture Capital (Limited Partnership), 300,000 ordinary shares owned by Shenzhen Sangel Jing Rui Venture Capital (Limited Partnership), 200,000 ordinary shares owned by Shenzhen Sangel Sino-Euro Venture Capital (Limited Partnership), 444,444 ordinary shares owned by Beijing Huarong Sangel Venture Capital (Limited Partnership) (previously named Beijing Sangel Venture Capital (Limited Partnership)) (“Beijing Huarong Sangel”) and 361,050 ordinary 股份由聖星生物醫學基金有限公司持有。深圳聖兆資本管理有限公司(“聖兆創業投資”)是北京聖兆方生風投(有限合夥)、深圳聖瑞風投(有限合夥)和深圳聖兆信歐風投(有限合夥)的唯一普通合夥人。聖星生物醫學基金有限公司是聖兆風險投資的附屬公司。桑爾風險投資的管理成員是劉木龍先生(聖兆風投的創始合夥人)、馮芳博士、何南星博士、劉景龍博士、楊曉明先生和張華利博士。深圳市南山區東華花園設計大廈8樓是聖兆創業投資公司的地址。聖瑞風投與華融天澤投資有限公司(“華融天澤”)是北京華融風投(有限合夥)的普通合夥人。華融天澤的管理人員是阮曉明先生和吳曉東先生。地址:中國北京市西城區金融街8號A樓二樓。
|
| (4) |
包括北京華融安琪444,444股普通股和華融天澤(香港)929,999股普通股。華融天澤(香港)是華融天澤的附屬公司。
|
| (5) |
由Ramon W.Mohanlal博士持有的220,098股限制性股份(其中98股已歸屬)組成,這些股份是根據2017歐姆尼布斯獎勵計劃和購買17萬普通股的期權授予的。
|
| (6) |
由20,000股限制性股票組成,其中沒有一股是由G.Kenneth Lloyd博士持有的,根據2017歐姆尼布斯獎勵計劃和購買80,000股普通股的期權。
|
| (7) |
由戈登·L·斯科利博士持有的20 137股限制性股份(其中137股已歸屬)組成,根據2017歐姆尼布斯獎勵計劃和購買33 000股普通股的期權授予記錄。
|
| (8) |
由馬修·柯克比根據2017歐姆尼布斯獎勵計劃授予的846股限制性股票組成,其中沒有一股已被授予。
|
| (9) |
其中685,538股普通股由漢佛龍投資有限公司全資擁有,由勝訴視圖投資有限公司全資擁有,735股限制性股份均未歸屬,均由宋全奇博士記錄在案。宋全奇博士是我們董事會的成員,是贏景投資有限公司的唯一股東。
|
| (10) |
由謝燕斌博士根據2017歐姆尼斯激勵計劃授予的735股限制性股票組成,其中沒有一股已被授予。
|
|
(11)
|
由846股限制性股票組成,其中沒有一股是歸給的,是由趙令瑩女士根據2017歐姆尼布斯獎勵計劃授予的。
|
我們有一種普通股,每一位普通股持有人都有權每股投一票。我們的股東沒有一個擁有與其他股東不同的投票權。
截至2018年月26日,我們發行的普通股中,大約有4552930股是由美國的9名紀錄保持者持有的。
我們不知道有任何安排,在以後的日期,可能導致我們公司的控制權的改變。
| B. |
關聯方交易
|
自2017年月一日以來,我們曾經或正在參與的任何重大交易或一系列類似的重大交易,我們的董事會成員或高級管理人員,持有10%以上普通股的人,或上述任何一人的直系親屬,過去或將來都沒有,目前也沒有這樣的提議。一種直接或間接的物質利益,而不是我們下面描述的交易。
130
目錄
買賣證券
在2017月份,我們與聖星生物醫學基金有限公司達成了股份認購協議,聖星生物醫學基金有限公司是聖兆風險投資的附屬公司,根據該協議,聖星生物醫學基金有限公司收購了我們361,050股普通股;
2017年3月,我們與華融天澤的附屬公司華融天澤(香港)簽訂股份認購協議,根據該協議,華融天澤(香港)購買了我們的929999股普通股;
在今年3月,在我們首次公開發行之前,我們根據我們於2月2日與Nereus簽訂的終止協議,向NPBSIPO上市信託公司發行了2,112,963股普通股。NPBSIPO是Nereus指定的一個單一的公司實體。
就業協議
見“項目6”。董事、高級管理人員和僱員---B.補償---就業協議。
諮詢安排
見“項目6”。董事、高級管理人員和僱員---B.薪酬---諮詢安排。
與理查德·布蘭德達成的分離協議
見“項目6”。董事、高級管理人員和僱員---B.薪酬---與理查德·布蘭德簽訂的離職
董事協議
見“項目6”。董事、高級管理人員和僱員---B.薪酬---董事協議“。
2017綜合激勵計劃
見“項目6”。董事、高級管理人員和僱員---B.薪酬---2017總括激勵計劃。“
賠償協議
開曼羣島法律不限制公司的章程大綱和章程規定賠償高級人員和董事的程度,但開曼羣島法院可能認為任何此類規定違反公共政策的情況除外,例如對民事欺詐或犯罪後果提供賠償。Our amended and restated memorandum and articles of association require us to indemnify every director, alternate director, secretary, assistant secretary, or other officer for the time being and from time to time of our company (but not including our auditors) and the personal representatives of the same against all actions, proceedings, costs, charges, expenses, losses, damages or liabilities incurred or sustained by such indemnified person, other than by reason of such indemnified person’s own dishonesty, willful default or fraud, in or about the conduct of our company’s business or affairs (including as a result of any mistake of judgment) or in the execution or discharge of his duties, powers, authorities or discretions, including without prejudice to the generality of the foregoing, any costs, expenses, losses or liabilities incurred by such indemnified person in defending (whether successfully 或其他方式)在開曼羣島或其他地方的任何法院對我們或我們的事務提起的任何民事訴訟。這種行為標準一般與特拉華州公司的特拉華州通用公司法所允許的相同。
131
目錄
此外,我們已與每一位董事及行政人員簽訂彌償協議,為這些人士提供額外補償,而非經修訂及重述的公司章程大綱及章程細則所規定的補償。
至於根據上述條文可容許我們的董事、高級人員或控制我們的人士就“證券法”所引起的法律責任作出賠償,我們獲悉,證交會認為,這種補償違反“證券法”所述的公共政策,因此是不可執行的。
| C. |
專家和律師的利益
|
不適用。
| 項目8. |
財務信息
|
| A. |
合併財務報表和其他財務信息
|
見“項目18”。財務報表。
法律程序
見“項目4”。有關公司的資料---B.業務概況---法律程序“
股利政策
我們從未向股東申報或支付現金股息,我們也不打算在可預見的將來支付現金紅利。我們打算將任何收益再投資於發展和擴大我們的業務。有關股息政策的任何未來決定,均由董事局酌情決定,並視乎多項因素而定,包括未來的盈利、財務狀況、經營業績、合約限制、資本需求、業務前景、我們的戰略目標及拓展業務的計劃、適用的法律及董事局認為有關的其他因素。
見“項目3”。關鍵信息--D.風險因素--與我們普通股有關的風險--因為我們不期望在可預見的將來分紅,你必須依靠普通股的價格升值來獲得投資回報和“第10項”。補充信息--A.股本--股息。“
我們是一家在開曼羣島註冊的控股公司。在某種程度上,我們將依靠美國、澳大利亞和中國子公司的股息向股東支付股息。中華人民共和國的規定可能限制我們的中國子公司向我們支付這種股息的能力。見“項目3”。關鍵信息---D.風險因素---與我們在華營商有關的風險---今後,我們可能在某種程度上依賴於我們主要經營子公司的股息和其他股權分配,以滿足離岸現金和融資要求“和”第4項“。有關公司的資料-B.業務概覽-政府規例-中國規例-股利分配規例.“
| B. |
重大變化
|
除本年報其他部分披露外,自本年報所載經審計合併財務報表之日起,我們並無任何重大變動。
| 項目9. |
要約和上市
|
| A. |
要約和上市細節
|
我們的普通股自3月9日起在納斯達克資本市場上市,代號為“BYSI”。下表顯示的是,在所述期間,納斯達克資本市場截至2018年度的普通股的市場價格高低。
132
目錄
|
日曆期
|
高
|
低層
|
||||||
|
季刊
|
||||||||
|
2017
|
||||||||
|
第一季度
|
$
|
21.91
|
$
|
16.55
|
||||
|
第二季度
|
$
|
45.00
|
$
|
19.40
|
||||
|
第三季度
|
$
|
48.49
|
$
|
34.01
|
||||
|
第四季度
|
$
|
40.87
|
$
|
28.04
|
||||
|
每月
|
||||||||
|
2017-2018
|
||||||||
|
九月
|
$
|
42.49
|
$
|
34.01
|
||||
|
十月
|
$
|
40.87
|
$
|
28.99
|
||||
|
十一月
|
$
|
36.88
|
$
|
29.14
|
||||
|
十二月
|
$
|
34.00
|
$
|
28.04
|
||||
|
一月
|
$
|
34.00
|
$
|
23.41
|
||||
|
二月
|
$
|
28.30
|
$
|
20.43
|
||||
| B. |
分配計劃
|
不適用。
| C. |
市場
|
我們的普通股自3月9日起在納斯達克資本市場上市,代號為“BYSI”。
| D. |
出售股東
|
不適用。
| E. |
稀釋
|
不適用。
| F. |
發行費用
|
不適用。
| 項目10. |
補充資料
|
| A. |
股份資本
|
不適用。
| B. |
章程大綱及章程細則
|
我們是一家免除有限責任的開曼羣島公司,我們的事務受我們不時修訂和重申的公司章程和“開曼羣島公司法”(2018修訂本)和開曼羣島普通法管轄。
以下是我們目前修訂和重新聲明的公司章程和章程的重要條款摘要,這些條款在我們於3月完成首次公開發行(IPO)之前生效,但涉及我們普通股的重要條款。
133
目錄
本公司宗旨
根據我們修訂和重申的公司章程和章程,我們公司的宗旨是不受限制的,我們有充分的權力和權力來實現開曼羣島法律不加禁止的任何目標。
董事會
見“項目6”。董事、高級管理人員和僱員---C.董事會慣例。“
普通股
我們的普通股是以註冊形式發行的,並在我們的會員登記冊上登記時發行。我們的非開曼羣島居民的股東可以自由地持有和投票他們的股份。
股利
我們普通股的持有人有權獲得我們董事會可能宣佈的股息。此外,我們的股東可以通過普通決議宣佈股息,但股息不得超過董事建議的數額。根據開曼羣島法律,股息只能從合法獲得的資金中宣佈和支付,即從利潤或我們的股票溢價賬户中支付,但在任何情況下都不得支付股息,如果這將導致我們的公司在正常業務過程中無法償還到期債務。
表決權
在任何股東大會上的投票都是舉手錶決,除非需要進行投票。該會議的主席或任何一名或多於一名共同持有本公司不少於10%的有表決權股本的股東,可要求進行投票。
股東大會所需法定人數由出席並持有不少於本公司所有有表決權股本的不少於多數的一名或多名股東組成。股東可以親自出席,也可以通過代理人出席,如果股東是法人,則由其正式授權的代表出席。股東會可以由董事會主動召開,也可以由在請求書交存之日持有的股東向董事會提出的請求召開,但不得少於所涉及的有表決權股本的百分之十。召開年度股東大會和其他大股東大會需要提前至少七個日曆日。
股東在會議上通過的普通決議,要求在會議上對普通股投贊成票,而特別決議要求在會議上對普通股投贊成票的票數不少於普通股票數的三分之二。普通決議和特別決議,也可以由公司全體股東一致簽署書面決議,並經公司法和修改、重述的公司章程大綱和章程所允許。對於重要的事項,如更改名稱或修改我們的修訂和重述的公司章程大綱和章程,將需要一項特別決議。普通股股東除其他外,可以通過普通決議分割或者合併其股份。
普通股轉讓
在符合以下限制的情況下,我們的任何股東可以以通常或共同形式的轉讓文書或董事會批准的任何其他形式轉讓其全部或任何普通股。
134
目錄
我們的董事局可行使絕對酌情決定權,拒絕登記任何未全數繳足或有留置權的普通股轉讓。我們董事會也可能拒絕登記任何普通股的轉讓,除非:
| · |
轉讓文書隨附與之有關的普通股證書,以及本公司董事會為證明出讓人轉讓權利而合理要求的其他證據;
|
| · |
轉讓文書只涉及一種股份;
|
| · |
如果需要,傳送工具應正確蓋章;
|
| · |
如轉讓予聯名持有人,則須轉讓普通股予的聯名持有人的數目不得超過四人;及
|
| · |
按納斯達克資本市場決定須繳付的最高款額或董事不時要求的較少款項,已就該等費用向我們繳付。
|
如我們的董事拒絕將轉讓登記,他們應在遞交轉讓文書之日後兩個月內,將拒絕轉讓的通知送交每一出讓人和受讓人。
轉讓登記在遵從要求納斯達克資本市場發出的任何通知後,可在董事局不時決定的時間及期間暫停註冊,而登記冊可在董事會不時決定的時間及期間內關閉,但須在董事會決定的任何一年內,不得暫停註冊或關閉登記冊超過30天。
清算
在清盤或以其他方式(股份轉換、贖回或購買除外)返回資本時,可供普通股持有人分配的資產,須按比例分配給普通股持有人。如果我們可供分配的資產不足以償還所有已償還的資本,資產將被分配,以便我們的股東按比例承擔損失。
對股份的催繳及股份的沒收
我們的董事會可以在規定的付款時間前至少14天向股東發出通知,不時要求股東支付其股票未付的任何款項。已被催繳但仍未支付的股份可予沒收。
普通股的贖回、回購及交還
我們可按該等股份須予贖回的條款發行該等股份,或由該等股份的持有人選擇發行該等股份,而發行該等股份的條款及方式,可由我們的董事局在發行該等股份前決定。我們的公司也可以回購我們的任何股份(包括任何可贖回的股份),但收購的方式和條款須經我們的董事會或股東的普通決議批准,或經我們修訂和重述的章程大綱和章程細則授權。Under the Companies Law, the redemption or repurchase of any share may be paid out of our company’s profits or out of the proceeds of a fresh issue of shares made for the purpose of such redemption or repurchase, or out of capital (including share premium account and capital redemption reserve) if the company can, immediately following such payment, pay its debts as they fall due in the ordinary course of business.此外,根據“公司法”,此類股份不得贖回或回購(A)除非已全部付清,(B)如果贖回或回購將導致沒有未發行股份,或(C)公司已開始清算。此外,我們公司可以接受任何全額支付的股份的放棄,而不作任何代價。
135
目錄
股權變動
任何類別或系列股份所附的權利(除非該類別或系列股份的發行條款另有規定),可在經修訂及重述的章程大綱及組織細則的規限下,在持有該類別或系列已發行股份的不少於三分之二的持有人的書面同意下,或在特別批准下,予以更改。在該類別或系列股份持有人的大會上通過的決議。任何已發行股份的持有人所獲賦予的權利,除非該類別股份的發行條款另有明文規定,否則不得當作因再發行或發行與該現有類別股份同級的股份而有所更改。
增發股票
我們修訂和重述的公司章程大綱和章程細則授權我們的董事會不時發行額外的普通股,這是我們的董事會應在可獲得的授權但未發行的股份的範圍內決定的。
我們經修訂和重述的公司章程大綱和章程細則,亦授權我們的董事局不時設立一個或多個優先股系列,並就任何系列優先股釐定該系列的條款及權利,包括:
| · |
系列的指定;
|
| · |
系列股票的數量;
|
| · |
股利、股息率、轉換權、表決權;及
|
| · |
贖回和清算的權利和條件優先。
|
我們的董事會可以發行優先股,而不需要我們的股東採取行動。發行這些股票可能會削弱普通股持有人的投票權。
圖書和記錄檢驗
根據開曼羣島的法律,普通股持有人無權查閲或索取我們的股東名單或公司記錄的副本。然而,我們將向股東提供年度審定財務報表。見“-H.展示的文件”。
反收購條款
我們修改和重述的公司章程和章程中的某些規定可能會阻止、拖延或防止股東認為有利的公司或管理層改變控制權,包括:
| · |
授權我們的董事會發行一個或多個系列的優先股,並指定這些優先股的價格、權利、偏好、特權和限制,而無需我們的股東進一步投票或採取任何行動;以及
|
| · |
限制股東要求召開股東大會的能力。
|
然而,根據開曼羣島的法律,我們的董事只能行使根據我們的備忘錄和公司章程賦予他們的權利和權力,以求達到適當的目的,並使他們相信符合我們公司的最大利益。
136
目錄
股東大會及股東建議書
我們的股東大會可在我們董事會認為適當的開曼羣島內外舉行。
作為一間豁免開曼羣島的公司,根據公司法,我們沒有義務召開股東周年大會。我們的修訂和重述的章程大綱和章程細則規定,我們可以(但沒有義務)在每年舉行一次大會作為我們的年度大會。
股東周年大會和其他股東大會可以由董事會過半數召集。我們的董事局須將股東大會的書面通知不少於7個歷日,發給在發出通知之日(或在我們的董事決定為該次會議的紀錄日期)並有權在會議上表決的人,而該等人的姓名在我們的成員登記冊上是以會員身分出現的。
開曼羣島法律規定,股東只有有限的權利要求召開股東大會,而沒有規定股東有權將任何提案提交大會。但是,這些權利可以在公司章程中規定。我們經修訂及重述的章程大綱及章程細則,容許我們的股東所持有的股份總額不少於我們所發行的有表決權股本的10%,可要求召開一次股東特別大會,在此情況下,我們的董事有責任召開該次大會,並將如此徵用的決議在該次會議上付諸表決;然而,我們經修訂及重述的備忘錄及章程細則,均須在該次會議上表決。協會不給予我們的股東任何權利,在年度大會或特別大會之前提出任何建議,而這些大會不是由這些股東召集的。
豁免公司
根據“公司法”,我們是一家免責有限責任公司。“公司法”對普通居民公司和豁免公司進行了區分。在開曼羣島註冊但主要在開曼羣島以外經營業務的任何公司可申請註冊為豁免公司。獲豁免公司的規定與普通公司的規定基本相同,但獲豁免的公司除外:
| · |
無須向公司註冊處處長提交股東周年申報表;
|
| · |
無須公開其會員登記冊以供查閲;
|
| · |
不必召開年度大會;
|
| · |
可以發行有價證券、無記名股票或者沒有票面價值的股票;
|
| · |
可獲得一項承諾,以防止將來徵收任何税項(該等承諾通常最初為期20年);
|
| · |
可繼續在另一法域登記,並在開曼羣島註銷登記;
|
| · |
可註冊為有限期間公司;及
|
| · |
可以註冊為獨立的投資組合公司。
|
“有限責任”是指每一股東的責任僅限於股東對公司股份未支付的數額(在特殊情況下除外,如涉及欺詐、建立代理關係、非法或不正當目的或法院可能準備刺穿或揭開公司面紗的其他情況除外)。
137
目錄
成員登記冊
根據開曼羣島法律,我們必須保存一份成員登記冊,其中應列入:
| · |
各成員的姓名或名稱及地址、每名成員所持有股份的陳述,以及已繳付或同意視為已付的每名成員股份的款額;
|
| · |
將任何人的姓名以會員身分記入註冊紀錄冊的日期;及
|
| · |
任何人終止為會員的日期。
|
Under Cayman Islands law, the register of members of our company is prima facie evidence of the matters set out therein (i.e. the register of members will raise a presumption of fact on the matters referred to above unless rebutted) and a member registered in the register of members should be deemed as a matter of Cayman Islands law to have legal title to the shares as set against its name in the register of members.一旦我們的會員登記冊被更新,記錄在會員登記冊上的股東應被視為擁有在其名下設置的股份的合法所有權。
如任何人的姓名被錯誤地記入我們的會員登記冊,或在註冊紀錄冊內有任何失責或不必要的延誤,而任何人已不再是本公司的成員,則該人或成員感到受屈(或本公司的任何成員或本公司本身)可向開曼羣島大法院申請命令更正註冊紀錄冊,而法庭可拒絕該項申請,或如信納該個案的公正,可作出更正該登記冊的命令。
| C. |
材料合同
|
關於我們的首次公開發行和同時私募,我們於2017年2月27日與某些投資者簽訂了幾項股票認購協議,根據該協議,這些投資者以每股20.00美元的價格從我們手中購買了大約5080萬美元的普通股,其依據是“證券法”條例S或D條例所載的豁免註冊。2017年月8日,我們與H.C.Wainwright&Co.,LLC或Rodman的子公司Rodman&Renshaw簽訂了一份承銷協議,根據該協議,羅德曼是我們首次公開發行(IPO)的承銷商,並獲得了我們在首次公開發行(IPO)中普通股總髮行價的7%佣金。2017年月8日,我們還與羅德曼簽訂了一項私人配售代理協議,根據該協議,羅德曼擔任同期私人配售的配售代理人,並收取配售代理費,相當於我們在同期私募中出售的普通股總購買價格的7%。
138
目錄
除上文所述外,我們沒有簽訂除正常業務以外的任何物質合同,也沒有簽訂“第7項”所述的其他合同。大股東和關聯方交易-B.關聯方交易,“或本年度報告中的其他表格20-F。
| D. |
外匯管制
|
見“項目4”。公司信息-B.業務概況---中國法規---有關外匯和股利分配的規定.“
| E. |
賦税
|
下面的討論總結了開曼羣島、中國和美國聯邦所得税對普通股投資的影響。討論並非有意,也不應將其解釋為對任何特定潛在購買者的法律或税務諮詢。討論的依據是截至本年度報告之日的法律及其相關解釋,所有這些法律或解釋都可能有變更或不同的解釋,可能具有追溯效力。討論不涉及美國州或地方税法,也不涉及開曼羣島、中國和美國以外地區的税法。你應該就普通股的收購、所有權和處置的後果徵求税務顧問的意見。就涉及開曼羣島税法的問題而言,它代表我們的開曼羣島特別法律顧問楓樹和卡爾德(香港)有限責任公司的意見;在討論涉及中華人民共和國税法的範圍內,則代表我們的中華人民共和國特別法律顧問韓坤律師事務所的意見。
開曼羣島税收
開曼羣島目前不根據利潤、收入、收益或增值對個人或公司徵税,也不對適用於我們或普通股持有人的遺產税或遺產税或預扣税徵税。開曼羣島政府可能對我們徵收的其他税收,除了適用於在開曼羣島管轄範圍內或在其管轄範圍內執行的文書的印花税外,不可能對我們造成重大影響。開曼羣島公司發行股票或轉讓股份(持有開曼羣島土地權益的公司除外),無須繳納印花税。開曼羣島不是適用於向本公司付款或由我公司支付的任何雙重徵税條約的締約國。開曼羣島沒有外匯管制條例或貨幣限制。
在開曼羣島,支付普通股的股息和資本將不受徵税,在向普通股持有人(視屬何情況而定)支付股息或資本時不需要扣繳,也不需要繳納開曼羣島所得税或公司税。
中華人民共和國税收
根據“經濟轉型期法”,在中國境外設立的具有“事實上的管理機構”的企業被視為“常駐企業”,這意味着就企業所得税而言,其待遇與中國企業類似。雖然“經濟轉型法”的實施細則將“事實上的管理機構”界定為對企業的生產、業務、人事、會計賬簿和資產實行實質性和全面管理和控制的管理機構,但目前唯一的官方指南載於國家税務總局發佈的“第82號通知”,其中規定了確定中國控股的境外股份有限公司的税務住所地位,是指按照外國法律設立的、以中國企業、企業集團為主要控股股東的企業。雖然BeyondSpring公司沒有中國企業或企業集團作為我們的主要控股股東,因此並不是第82號通知意義上的中國控股的離岸公司,但在沒有具體適用於我們的指導意見的情況下,我們已應用第82號通知中所載的指導意見來評估BeyondSpring公司及其在中國境外組織的子公司的税務居留狀況。
139
目錄
根據第八十二號通知,中國控股的離岸股份有限公司因在中國設有“事實上的管理機構”,將被視為中華人民共和國的税務居民,只有在符合下列所有條件的情況下,才會對其在世界各地的收入徵收中國企業所得税:
| · |
企業日常經營管理和高級管理部門的高級管理人員主要在中國境內執行職務;
|
| · |
關於企業財務、人力資源事項的決定,由中國的組織或者人員作出或者批准;
|
| · |
企業的主要資產、會計賬簿、公司印章、董事會和股東大會紀要在中國境內;
|
| · |
有投票權的董事會成員或高級管理人員中有50%或以上的人習慣居住在中國。
|
目前,我們管理團隊的一些成員都在中國。然而,我們並不認為我們滿足了前一段概述的所有條件。BeyondSpringInc.及其海外子公司在中國境外註冊。作為一家控股公司,我們的主要資產和記錄,包括董事會的決議和會議記錄,以及我們股東的決議和會議記錄,都在中國以外的地方保存。然而,我們並不知道有任何與我們類似的離岸控股公司被中國税務機關視為中國的“常駐企業”。因此,我們認為,如果“第82號通知”規定的“事實上的管理機構”標準適用於我們,我們不應將碧昂斯公司及其海外子公司視為中國税務方面的“常駐企業”。不過,由於企業的税務居留地位須由中華人民共和國税務機關決定,而“事實上的管理機構”一詞適用於我們的離岸實體的解釋仍有不明朗之處,因此,我們會繼續監察我們的税務狀況。
“企業所得税法實施細則”規定:(一)派息企業在中國境內居住的,或者(二)轉讓在中國境內的企業股權取得的收益,則將該紅利或者資本收益視為中國來源的收益。目前尚不清楚如何根據“經濟轉型期法”解釋“住所”,也可能將其解釋為企業是税務居民的管轄範圍。因此,如果我們被視為中國的税務常駐企業,我們支付給海外股東的任何股息以及這些股東從轉讓我們的股份中獲得的收益都可以被視為來自中國的收入。如果我們被中華人民共和國税務機關視為“非居民企業”,我們的中國子公司支付給我們的股息將被徵收10%的預扣税。外商投資企業分給境外直接控股公司的股息,如果被視為在中國境內沒有設立或者地點的非居民企業,或者收到的股息與該直接控股公司在中國境內的設立或者地點無關,則“經濟投資法”還對其分紅徵收10%的預扣繳所得税。公司註冊的管轄權與中國有一項税務條約,規定了不同的扣繳安排。我們在開曼羣島註冊的地方,沒有與中國簽訂這樣的税務條約。根據中華人民共和國和香港特別行政區關於避免雙重徵税和防止在所得税和資本税方面逃税的安排,如果收到股息的香港居民企業被視為非中國税務居民企業,並持有至少25%的權益,則可將股息預扣税税率降至5%。中華人民共和國企業分紅,經中華人民共和國地方税務機關批准。不過,如根據適用的中華人民共和國税務規例,香港居民企業並非該等股息的實益擁有人,則該等股息可按10%的税率徵收預扣税。因此,BeyondSpring香港公司如果符合税務法規規定的有關條件,並獲得必要的批准,就可以享受從其中國子公司收到的股息5%的預扣税税率。
美國聯邦所得税考慮
140
目錄
下面的討論是美國聯邦所得税一般適用於我們普通股所有權和處置的考慮因素的總結。除注意事項外,本摘要只涉及持有我們普通股作為美國聯邦所得税用途的資本資產的美國持有者(如下所述)。本摘要沒有涉及可能與特定的美國持有者相關的所有美國聯邦所得税問題(如下文所定義),也沒有詳細説明適用於根據美國聯邦所得税法可能受到特殊待遇的股東的所有美國聯邦所得税考慮因素,包括:
| · |
銀行、金融機構或保險公司;
|
| · |
房地產投資信託、受監管的投資公司或設保人信託;
|
| · |
證券、商品或貨幣的經紀人或交易商;
|
| · |
證券交易商選擇按市價計價的方法對其證券進行會計核算的;
|
| · |
免税單位或組織,包括個人退休帳户或其他遞延税款賬户;
|
| · |
美國前公民或長期居民;
|
| · |
因履行服務而獲得本公司股份的人,包括因行使職工股票選擇權而獲得股份的股東;
|
| · |
將持有我們的股票作為“套期保值”、“綜合”或“轉換”交易或其他減少風險戰略的一部分,或作為美國聯邦所得税的“跨部門”地位的人;
|
| · |
屬於美國聯邦所得税目的的合夥企業或其他過户實體,或將通過該實體持有我們股份的持有者;
|
| · |
“功能貨幣”不是美元的人;或
|
| · |
持有或已直接、間接或建設性地擁有我們股份投票權或價值的10.0%或以上的持有人。
|
下文的討論依據的是“美國國庫法典”、現行的、擬議的和暫時的“美國國庫條例”、司法和行政解釋以及“美國與中國之間的所得税條約”或“條約”的規定,在每種情況下都是有效的,並可在本合同之日獲得。這些機構可能會被替換、撤銷或修改,也許是追溯性的,並且可能會有不同的解釋,從而可能導致不同於下文所討論的美國聯邦所得税的後果。
本摘要沒有涉及美國聯邦所得税的所有方面,也沒有涉及根據股東的個人情況可能與股東相關的所有税收考慮,也沒有涉及對某些淨投資收入或任何州、地方、外國、贈與、遺產或其他最低税種徵收的醫療保險税。持有者應就在其特殊情況下持有和處置我們普通股的美國聯邦、州、地方和外國税收後果諮詢他們的税務顧問。如此處所用,“美國持有者”一詞是指普通股的實益所有人,即美國聯邦所得税的用途:
| · |
美國公民或居民;
|
| · |
在美國、其任何州或哥倫比亞特區內或根據美國法律設立或組織的公司(或作為美國聯邦所得税目的的公司的其他實體);
|
| · |
不論其來源如何,其收入均須繳納美國聯邦所得税的財產;或
|
141
目錄
| · |
如果信託(1)受美國法院的主要監督,而一名或多名美國人擁有或有權控制信託的所有重大決定,或(2)根據適用的美國財政部條例具有有效的選舉,被視為美國人。
|
美國聯邦所得税對作為美國聯邦所得税用途的合夥企業的實體或安排中的合夥人的待遇,即我們普通股的受益所有人,一般將取決於合夥人的地位和合夥企業的活動。合夥企業的合夥人應就普通股的所有權和處置所產生的税務後果徵求税務顧問的意見。
美國聯邦所得税用途的BeyondSpring公司的納税住所
根據現行的美國聯邦所得税法,公司通常被認為是其組織或公司管轄範圍內的税務居民。因此,作為根據開曼羣島法律組建的公司,就美國聯邦所得税而言,我們一般應被歸類為非美國公司(因此也是非美國税務居民)。然而,在某些情況下,根據“守則”第7874條或第7874條,在美國境外組建的公司將被視為美國公司(因此也是美國税務居民),除非適用一種或多種例外情況。
當非美國公司收購一家美國公司的所有股票時,第7874條通常會牽涉其中。如果在這種收購之後,為了第7874條的目的,美國公司的前股東被認為持有被收購的非美國公司80%或80%以上的股票,以及某些其他情況存在,則就美國聯邦所得税而言,收購的非美國公司將被視為美國公司。在這種情況下,收購的非美國公司將對其在全球範圍內的收入徵收美國公司所得税,其非美國子公司的收入在匯回美國時將被徵收美國税(對此類收入的外國來源部分可扣減),或根據美國聯邦所得税規則對受控制的外國子公司予以承認。此外,其非美國子公司的任何遞延外國收入,在2017或#date0#11月2日或12月31日(以數額較大者為準)確定的以前不受美國徵税的,將受到“減税和就業法案”規定的“過渡税”的影響。此外,支付給非美國股東的股息總額將按30%的税率徵收美國代扣税,除非非美國股東有資格根據適用的所得税條約獲得豁免或扣減扣繳利率。
The determination of the percentage of stock of the acquiring non-U.S. corporation treated as held by former shareholders of the U.S. corporation for purposes of section 7874, or the section 7874 ownership percentage, is subject to various adjustments and exceptions, including an “internal group restructuring exception” and a “foreign-parented group exception,” both of which, when they apply, generally operate to reduce the section 7874 所有權百分比(以及收購的非美國公司在美國聯邦所得税中被視為美國公司的可能性)。內部集團重組例外,在適用時,實際上允許美國公司的某些非美國子公司的收購,而不觸發第7874節的不利影響。在適用的外國母公司集團例外情況下,確保非美國收購公司的某些收購後轉讓不會挫敗內部集團重組例外在美國公司收購中的其他適當應用。第7874條還包含了一項反濫用規則,根據該規則,如果轉讓是一項計劃的一部分,而該計劃的主要目的是避免第7874條的目的,則可以不考慮包括股票在內的財產轉讓。
2015年7月,我們完成了內部重組。關於內部結構調整的更多信息,見本年度報告其他部分所載我們合併財務報表的附註1。作為內部重組的一部分,萬春生物技術公司將美國公司BeyondSpring美國公司的全部股票捐給了BVI生物技術公司,這是一個非美國實體,以換取BVI生物技術公司或BeyondSpring美國公司的所有未決權益。不久之後,萬春生物科技公司將BVI生物技術公司的所有權益轉讓給我們,以換取我們30萬股普通股,或BVI生物技術轉讓。
142
目錄
根據在內部重組時根據第7874條實施的規則,我們認為,英屬維爾京羣島生物技術轉讓並不構成間接收購美國公司直接或間接持有的所有財產,因此,英屬維爾京羣島生物技術轉讓本身並不涉及第7874條。此外,我們認為,BVI生物技術轉讓滿足了外國母公司集團例外,因此,並不妨礙內部集團重組例外適用於碧昂斯美國轉讓。因此,我們認為,根據2015年7月生效的法律,第7874條對BeyondSpring美國轉讓的所有權百分比低於80%,而BeyondSpring美國轉讓和BVI生物技術轉讓都沒有觸發第7874條的適用。因此,我們預計,我們不會被視為美國公司,以美國聯邦所得税的目的。
儘管如此,確定第7874款的百分比和適用各種例外情況是複雜的,而且在事實和法律上也存在不確定性。此外,對第7874條或根據該條款頒佈的美國財政部條例(或美國聯邦所得税法的其他相關規定)的修改可能具有潛在或追溯效力,可能會對我們作為美國聯邦所得税非美國公司的地位的第7874條分析產生不利影響。因此,美國國税局可能不同意這樣的立場,即就美國聯邦所得税而言,我們不應被視為美國公司。如果美國國税局認為上述例外情況不適用於內部重組,或者內部重組與第7874條反濫用規則或其他物質過度或類似原則相牴觸,我們就可以被視為美國聯邦所得税的一家公司。
本討論的其餘部分假設,就美國聯邦所得税而言,我們不會被視為美國公司。
股息税
根據下文“-被動外國投資公司”下的討論,我們普通股的分配總額(包括為中國預扣繳的任何款項)一般應按美國聯邦所得税原則確定的從我們當前或累積的收益和利潤中支付的股息徵税,並可作為普通收入包括在你們的總收入中。當天的收入實際上或建設性地收到了你。這類股息將不符合按照“守則”一般允許美國公司獲得的股息扣除額。下面的討論假設任何股息都將以美元支付。
如果你是非法人的美國股東,你從合格的外國公司獲得的股息可能符合降低税率的資格。外國公司在美國“已建立的證券市場”上“容易交易”的普通股上從該公司收到的股息被視為合格的外國公司,我們的普通股在納斯達克資本市場上市,但我們的普通股在本年度或以後幾年內不得在已建立的證券市場上輕易交易。如果你不符合最低持有期的規定,而在該期間內你沒有受到損失風險的保障,或你根據守則第163(D)(4)條選擇將股息收入視為“投資收入”,你便沒有資格獲得降低税率。此外,如果股息的接受者有義務就基本相似或相關財產的頭寸支付相關款項,即使已達到最低持有期,則減息將不適用於股息。如果我們是應納税年度的PFIC,或在上一個應税年度,減讓也不適用。根據下文“-被動外國投資公司”中的討論,如果你是非美國公司股東,你應該假設股息一般不會構成符合降低税率條件的“合格股息收入”。
如果根據EIT法我們被認為是中國的居民企業,您可能要對支付給您的普通股的分配徵收中國預扣税。見“-中華人民共和國税收”。在這種情況下,在某些條件和限制的情況下,中國對股息的預扣税一般將被視為外國税收,可以抵扣你的美國聯邦所得税。在計算外國税收抵免時,我們普通股支付的股息將被視為外國來源收入,一般構成被動類別收入。但是,在某些情況下,如果你持有我們的普通股少於規定的最低期限,在此期間你不受損失風險的保護,或者你有義務支付與股息有關的款項,你將不被允許對中國對我們普通股支付的股息徵收的預扣税給予外國税收抵免。如果你有資格享受條約福利,任何中國的股息税都不會抵免於你的美國聯邦所得税債務,其扣減率超過適用的條約税率。涉外税收抵免的規則是複雜的。你應該諮詢你的税務顧問,在你的特殊情況下,外國税收抵免的可得性。你可以選擇在計算你的應税收入時扣除這些中國的税收,以代替申請信用,但須受適用的限制。凡選擇扣除外國税收而不主張外國税收抵免,必須適用於在應税年度內已繳納或應計的所有外國税收。
143
目錄
根據美國聯邦所得税原則,在普通股上的任何分配金額超過我們當期和累計應納税年度的收益和利潤,該分配將首先被視為免税的資本返還,導致普通股調整税基的減少,超過調整税基的餘額將作為税基徵税。在出售或交換中確認的資本收益,如下所述:“-出售、交換或以其他方式處置普通股。”然而,我們不能按照美國聯邦所得税的原則來計算收入和利潤。因此,分配給你可以被視為紅利(如上文所述)。
普通股的出售、交換或其他應課税的處置
你方將確認我們普通股的出售、交換或其他應税處置的損益,等於在出售、交換或其他應税處置上實現的金額與您調整後的普通股税基之間的差額。經調整的普通股税基一般等於普通股的成本。根據下文“-被動外國投資公司”的討論,這種損益一般為資本損益,如果在處置時持有時間超過一年,則為長期資本損益。長期資本利得一般有資格對某些非美國公司的持有者實行優惠税率。美國聯邦所得税的資本損失可扣減受“美國聯邦所得税法”的限制。
您確認的任何損益一般都將被視為美國源損益。然而,如果我們被視為經濟和技術法規的中國居民企業,並且對任何收益徵收中國税收,如果你有資格享受條約的利益,你可以選擇將這種收益作為條約規定的中國來源收益對待。如果你沒有資格享受本條約的利益,或者你沒有選擇將任何收益作為中國的來源,則你可能無法使用因處置普通股而徵收的任何中國税收所產生的外國税收抵免,除非該抵免可以(受適用的限制)適用於對來自外國來源的其他收入應繳的税款。此外,我們亦促請你諮詢你的税務顧問,在你的特殊情況下,如因處置普通股的得益而被徵收任何中國税項,包括是否可獲得外國税收抵免,以及選擇將任何收益視為中國來源,你亦應諮詢該税務顧問的意見。
被動外商投資公司
If a non-U.S. company is classified as a PFIC in any taxable year, a U.S. Holder of such PFIC’s shares will be subject to special rules generally intended to reduce or eliminate any benefits from the deferral of U.S. federal income tax that such U.S. Holder could derive from investing in a non-U.S. company that does not distribute all of its earnings on a current basis.
根據PFIC規則,與PFIC的股票相關的任何超額分配或實現的收益都按比例分配到美國持有人在這種股票中的持有期內。分配給美國持有人當前應税年度和PFIC分類之前的任何應税年度的金額作為普通收入徵税,而分配給其他應税年度的款項按該年對此類美國持有人有效的最高税率(加上任何被視為遞延的利息)徵税。
對於美國聯邦所得税而言,非美國公司將在任何應税年度被歸類為PFIC,在對子公司的收入和資產適用某些前瞻性規則之後:
| · |
其總收入中至少75%為“被動收入”;或
|
| · |
其總資產的季度平均價值至少有50%可歸因於產生“被動收入”的資產或為生產被動收入而持有的資產。
|
144
目錄
為此目的的被動收入一般包括股息、利息、特許權使用費、租金、商品和證券交易收益以及處置產生被動收入的資產的收益超過損失。如果一家非美國公司按另一家公司的股票價值至少擁有25%,則就PFIC測試而言,該非美國公司被視為擁有其在另一公司資產中所佔的比例份額,並直接獲得其在另一公司收入中所佔的比例份額。對於上市公司,上述PFIC資產測試使用的是非美國公司資產的公平市場價值。
根據目前的業務計劃和財務預期,我們很可能成為當前應税年度和未來應税年份的PFIC。然而,由於PFIC的地位是基於我們整個應税年度的收入、資產和活動,所以在應納税年度結束之前,不可能確定我們是否會被定性為2018應税年度或其他年份的PFIC。此外,我們每年必須根據實際性質的測試來確定我們的PFIC地位,而我們今後幾年的狀況將取決於我們在這幾年中的收入、資產和活動,因此,無法肯定地預測到今後各年的收入、資產和活動。
如果我們在您持有我們普通股的任何一年中被歸類為PFIC,我們將繼續在您持有我們普通股的所有年份中作為PFIC對待您,無論我們是否繼續滿足上述測試,除非您就我們的普通股進行了某些選舉(如下文所述)。減輕PFIC待遇造成的一些不利的税收後果。如果您在我們被列為PFIC的任何一年中持有我們的普通股,您通常需要提交一份關於該公司的國税表8621,並附上當年的聯邦所得税報税表。
在PFIC中的“可銷售股票”(以下定義)的美國持有者可以對這種股票進行市場選擇,以避免上述規則下的徵税。If a U.S. Holder were to make a valid mark-to-market election for the ordinary shares of a PFIC, such U.S. Holder would include in income, for each year that such company is treated as a PFIC, an amount equal to the excess, if any, of the fair market value of the PFIC’s ordinary shares held by such U.S. Holder as of the close of the year over such 美國持有的這些普通股的調整基礎。你在市價選舉中收入的金額,以及普通股實際出售或其他處置的任何收益,都將被視為普通收入。市場對市場的選擇只適用於“適銷對路的股票”,這種股票在每個日曆季度內至少在15天內進行交易,或者按照適用的美國國庫條例的定義,在合格的交易所或其他市場上定期交易。我們的普通股在納斯達克資本市場上市,這是一個合格的交易所或其他市場。如果我們的普通股繼續在納斯達克資本市場上市,並定期交易,而你是我們普通股的持有者,我們預計,如果我們成為或成為PFIC,你就可以選擇上市。然而,由於作為技術問題,不能對PFIC的任何較低級別的PFIC進行按市價進行的選舉,從技術上講,對於我們所持有的任何投資中的任何間接權益,為了美國聯邦所得税的目的,您將繼續受到PFIC規則的約束。
另一種辦法是,美國持有PFIC股份的人可根據上述規則避免徵税,辦法是進行“合格選舉基金”選舉,以便在收入中包括其目前在PFIC收入中所佔的份額。然而,美國股東只有在該公司同意每年向美國股東提供某些税收信息的情況下,才能對PFIC的普通股進行合格的選舉基金選擇。我們目前不打算準備或提供這類資料。因此,你應該假設你不會從我們那裏收到這些信息,因此,如果我們成為或成為PFIC,你將無法就我們的任何普通股進行有資格的選舉基金選舉。
您應該諮詢您的税務顧問,我們是否是一個PFIC,以及美國聯邦所得税的潛在後果,如果我們持有和處置我們的普通股,如果我們被歸類為PFIC,包括是否可能進行市場標記選舉或合格選舉基金選舉。
境外資產報告
某些美國個人持有者必須報告與我們普通股權益有關的信息,但某些例外情況除外(包括金融機構持有的股票除外),向他們的聯邦所得税申報表提交8938國税表。美國的股東被敦促諮詢他們的税務顧問,如果他們的信息報告義務,如果他們的所有權和處置我們的普通股。
145
目錄
美國的股東被敦促諮詢他們的税務顧問關於收購,擁有和處置我們的普通股的後果,根據他們的特殊情況。
| F. |
股息和支付代理人
|
不適用。
| G. |
專家發言
|
不適用。
| H. |
陳列文件
|
我們以前已經向SEC提交了一份表格F-1(文件編號333-#number0#)的註冊聲明,並對我們的普通股進行了修改。根據證交會的允許,在本年度報告的第19項中,我們參考了以前向SEC提交的某些信息。這意味着,我們可以通過向SEC提交另一份文件,向你披露重要信息。以參考方式納入的資料被視為本年度報告的一部分。
我們受“外匯法”的定期報告和其他信息要求的約束。根據“外匯法”,我們必須向證券交易委員會提交報告和其他信息。提交報告和其他資料時,可免費查閲報告副本,並可在華盛頓特區1580室N.E.1580號F街100號證交會公共資料室按規定費率索取。市民可致電證交會1-800-SEC-0330索取有關公眾資料室的資料.證券交易委員會還在www.sec.gov網站上設有一個網站,其中載有關於以電子方式向證券交易委員會提交文件的註冊人的報告和其他信息。我們向證券交易委員會提交的年度報告和其他信息可通過本網站查閲。
作為一家外國私人發行商,我們不受“外匯法”有關提供代理報表及其內容的規則的約束,我們的高級官員、董事和主要股東將不受“交易所法”第16條所載的報告和短期利潤回收規定的約束。此外,根據“交易法”,我們不需要像根據“交易法”註冊證券的美國公司那樣頻繁或迅速地向證券交易委員會提交年度、季度和當前的報告和財務報表。然而,我們必須在每個會計年度結束後四個月內,或在證交會要求的適用時間內,向證券交易委員會提交一份關於由獨立註冊會計師事務所審計的財務報表的20-F表的年度報告,並以表格6-K向證交會提交每個會計年度前三個季度未經審計的季度財務信息。
根據納斯達克股票市場規則5250(D),我們將在我們的網站上公佈這份20-F表格的年度報告,網址是www.beiondSpringpharma.com。此外,我們將免費向股東提供年度報告的硬拷貝。
|
I.
|
附屬信息
|
不適用。
| 項目11. |
市場風險的定性和定量披露
|
利息和信用風險
146
目錄
我們沒有面臨典型的利率風險,即利率對償債和償還債務成本的影響。我們面對利率風險的風險來自於我們從存款中賺取的利息收入的變動,以及我們的共同創始人之一對一筆無息貸款的估算利息。這類貸款在2015作為我們內部重組的一部分而被收回。我們有現金、現金等值和短期投資,分別為3060萬美元和1170萬美元,分別為2017和12月31日2016。我們的現金存放在我們認為是高信用質量的金融機構。我們沒有在投資組合中使用衍生金融工具。利率工具有一定程度的利率風險.我們沒有因為市場利率的變化而暴露,也沒有預料到會受到重大風險的影響。然而,由於市場利率的變化,我們未來的利息收入可能低於預期。
外幣匯率風險
我們面臨因各種貨幣風險而產生的外匯風險。我們的功能貨幣主要是美元,但我們的部分業務交易和資產及負債是以其他貨幣,如人民幣和澳元。我們不認為我們目前有任何重大的直接外匯風險,也沒有使用任何衍生金融工具來對衝這種風險。
人民幣在資本賬户交易中不能自由兑換為外幣。人民幣兑美元和其他貨幣的價值,除其他外,還受到中國政治和經濟狀況以及中國外匯價格變化的影響。從2005的7月21日起,人民幣對一籃子特定的外幣允許在一個狹窄的管理範圍內波動。人民幣對美元的貶值在截至12月31日的一年中約為2.49%,在截至12月31日的2015年中約為4.40%。國際社會對中國政府施加了巨大壓力,要求中國政府採取更加靈活的貨幣政策,這可能導致人民幣對美元進一步大幅升值。2015年月11日,中國央行對人民幣進行了1.8%的貶值。隨後兩天,人民幣兑美元匯率下跌3.5%。從2015年8月13日人民幣兑1美元的6.40元人民幣兑1美元的匯率,人民幣兑美元的匯率在2016年月17繼續跌至6.9593元兑1美元的低點。2017年間,美元對人民幣匯率從6.94下降到6.51。目前仍不清楚可能發生什麼進一步的波動,或這將對貨幣產生什麼影響。
如果我們需要將美元兑換成人民幣,人民幣兑美元的升值將對我們從兑換中得到的人民幣金額產生不利影響。相反,如果我們決定將人民幣兑換成美元,以支付普通股的股息或其他商業用途,美元對人民幣的升值將對我們可以獲得的美元數額產生負面影響。
| 項目12. |
證券的描述(股本證券除外)
|
| A. |
債務證券
|
不適用。
| B. |
認股權證及權利
|
不適用。
| C. |
其他證券
|
不適用。
| D. |
美國保存人股份
|
不適用。
147
目錄
第二部分
| 項目13. |
違約、股利拖欠和拖欠
|
沒有。
| 項目14. |
對證券持有人權利的實質性修改和收益的使用
|
在首次公開募股方面,我們已通過一份經修訂及重述的章程大綱及章程細則,該章程大綱及章程細則於2017年月日生效,並取代了我們的發行前章程大綱及章程細則。有關我們普通股持有人權利的説明,見“第10項”。補充資料---B.備忘錄和公司章程“
以下“收益的使用”信息涉及經修正的表格F-1(檔案號333-#number0#)與我們的首次公開發行有關的登記聲明,該註冊聲明於2017年月8日被證交會宣佈生效。2017年3月,我們完成了首次公開發行(IPO)和同時私募,發行併發行了174,286股首次公開發行(IPO)普通股和2,541,048股目前私募發行的普通股。在扣除承保折扣、佣金和發行費用後,我們共收到約4720萬美元的淨收益。
從美國證交會宣佈表格F-1的登記聲明生效之日起至2017年12月31日,我們使用了首次公開發行(IPO)和同時進行私募發行的淨收益如下:
| · |
約8,300,000美元用於進行第2/3期普林布林與多西紫杉醇聯合減少多西紫杉醇化療誘導的嚴重中性粒細胞減少的臨牀試驗,以及聯合其他化療藥物預防非多西紫杉醇化療引起的嚴重中性粒細胞減少的第2/3期臨牀試驗;
|
| · |
約50萬美元,用於資助我們與弗雷德·哈欽森中心和華盛頓大學的合作;
|
| · |
大約6 900 000美元用於支付薪金和諮詢費,並支付研究和開發費用,其中包括付給勞埃德博士的諮詢費以及支付給我們的執行幹事的薪金;
|
| · |
大約8,100,000美元,以支付某些費用,與第三階段的臨牀試驗作為抗腫瘤藥物與多西紫杉醇聯合治療晚期非小細胞肺癌;
|
| · |
大約3,300,000美元,用於支付薪金和諮詢費,並支付一般費用和行政費用;
|
| · |
向中國招商銀行購買一年存單的費用約為3,000,000美元.
|
我們仍打算將首次公開募股及同時進行的私人發行所得的其餘收益,用作一般公司用途,並在表格F-1的註冊聲明中披露。
148
目錄
| 項目15. |
管制和程序
|
| (a) |
披露控制和程序
|
我們的管理層在我們的首席執行官和首席財務官的參與下,評估了截至本報告所涉期間結束時我們的披露控制和程序(根據“外匯法”第13a-15(E)條)的有效性,並得出結論認為,我們的披露控制和程序自2017年月31起生效。
| (b) |
財務報告內部控制管理年度報告
|
我們的管理部門負責根據“外匯法”建立和維持對財務報告的適當內部控制,如第13a-15(F)條和第15d-15(F)條所規定的那樣。Our internal control over financial reporting is a process designed to provide reasonable assurance regarding the reliability of our financial reporting and the preparation of financial statements for external purposes in accordance with the U.S. GAPP and includes those policies and procedures that (1) pertain to the maintenance of records that, in reasonable detail, accurately and fairly reflect the transactions and dispositions of the assets of our company; (2) provide reasonable assurance that transactions are recorded as necessary to permit preparation of consolidated financial statements in accordance with GAAP, and that receipts and expenditures of our company are being made only in accordance with authorizations of our management and directors; and (3) provide reasonable assurance regarding prevention or timely detection of the unauthorized acquisition, use or disposition of our company’s assets that could have a material effect on the consolidated financial statements.
由於其固有的侷限性,對財務報告的內部控制可能無法防止或發現誤報。此外,對未來期間的任何有效性評價的預測都會受到以下風險的影響:由於條件的變化,控制可能變得不充分,或者遵守政策或程序的程度可能惡化。
As required by Section 404 of the Sarbanes-Oxley Act and related rules as promulgated by the SEC, our management including our Chief Executive Officer and Chief Financial Officer assessed the effectiveness of internal control over financial reporting as of December 31, 2017 using the criteria set forth in the report “Internal Control—Integrated Framework (2013)” published by the Committee of Sponsoring Organizations of the Treadway Commission.基於這一評估,管理層得出結論,我們對財務報告的內部控制於2017年月31生效。
我們獨立註冊的公共會計師事務所安永華明有限公司(Ernst&Young華明有限公司)自2017年月31起無需對財務報告的內部控制進行評估。
| (c) |
註冊會計師事務所認證報告
|
見上文(B)節的説明。作為“就業法案”中定義的“新興成長型公司”,我們可以利用某些臨時豁免,不受各種報告要求的限制,包括但不限於不遵守“薩班斯-奧克斯利法”第404節(及其之下的SEC規則和條例)的審計認證要求。當這些豁免停止適用時,我們預計會產生額外的開支,並將更多的管理努力用於確保遵守這些規定。
| (d) |
財務報告內部控制的變化
|
在審計截至12月31日、2016和2015以及截至12月31日、2016、2015和2014的財務報表時,我們發現了財務報告內部控制方面的一個重大缺陷。實質上的弱點是沒有足夠數量的財務報告人員,在適用美國公認會計準則和證券交易委員會符合我們的報告要求的規則和條例方面具有適當的知識、經驗和培訓水平。
149
目錄
我們已經並將繼續採取措施,改善對財務報告的內部控制,以彌補重大缺陷,包括:
| · |
我們在美國的會計部門聘用了一名新的財務總監、兩名新的會計人員和一名會計實習生,在中國的會計部門僱用了一名出納員,他們都在會計和財務報告方面有豐富的知識和經驗;
|
| · |
我們從具有美國GAAP和SEC報告經驗的專業會計顧問那裏獲得了會計和諮詢服務;
|
| · |
我們繼續提高現有財務報告人員的能力,根據美國公認會計準則和證券交易委員會的規則和條例對其進行會計和報告要求方面的培訓和教育;
|
| · |
我們繼續為我們的財務報告人員制定、溝通和執行一份會計政策手冊,以處理經常性交易和期末結算程序;
|
| · |
繼續制定、溝通和實施會計控制點績效標準;
|
| · |
我們繼續對非經常性和複雜的交易建立有效的監測和監督控制,以確保合併財務報表和相關披露的準確性和完整性;以及
|
| · |
我們購買了新的會計軟件,以加強對公司所有子公司的IT控制。
|
這些額外資源和程序旨在使我們能夠擴大對與財務報告有關的基本信息進行內部審查的範圍和質量,並使我們的內部控制程序正規化並得到加強。如上所述,我們的管理層在我們的首席執行官和首席財務官的參與下,評估了截至本報告所涉期間結束時我們對財務報告的內部控制的有效性,並得出結論認為,我們對財務報告的內部控制於2017年月31生效。因此,我們得出結論,截至2017年月31,我們已經糾正了先前報告的實質性弱點。
| 項目16. |
[預留]
|
| 項目16A. |
審計委員會財務專家
|
帕特里克·法比奧是審計委員會的財務專家。我們的董事會認為,由於我們公司正處於初創階段,因此目前沒有必要聘請一名財務專家。
| 項目16B. |
道德守則
|
在首次公開募股方面,我們採用了一套適用於所有董事、執行官員和僱員的書面道德準則。道德準則可在我們網站的投資者部分查閲(www.beiondSpringpharma.com)。
| 項目16C. |
首席會計師費用及服務
|
下表按以下類別列出與安永華明有限公司提供的某些專業服務有關的費用總額。安永華明有限公司是我們的主要外聘核數師。
150
目錄
|
截至12月31日的年度,
|
||||||||
|
2016
|
2017
|
|||||||
|
審計費(1)
|
$
|
508
|
$
|
426
|
||||
|
與審計有關的費用(2)
|
—
|
—
|
||||||
|
税費(3)
|
—
|
—
|
||||||
|
所有其他費用(4)
|
—
|
—
|
||||||
|
共計
|
$
|
508
|
$
|
426
|
||||
| (1) |
“審計費用”是我們2017年度財務報表中期審查和年度審計的總費用。
|
| (2) |
“與審計有關的費用”是指為我們的主要核數師所提供的保證及相關服務而列出的每個財政年度的總費用,這些費用與我們的財務報表的審計或審查的執行情況有合理的關係,而且沒有在“審計費用”項下報告。
|
| (3) |
“税費”是指就我們的主要核數師所提供的專業税務服務而列明的每個財政年度的總費用。
|
| (4) |
“所有其他費用”是指我們的主要核數師所提供的服務的總費用,但在“核數費用”、“核數有關的費用”及“税務費用”下所報告的服務除外。
|
審核委員會審批前的政策及程序
我們的審計委員會已經通過了一項政策,根據這項政策,除非審計委員會事先批准,否則我們不會聘請我們的審計師從事任何非審計服務。
| 項目16D. |
豁免審計委員會的上市標準
|
不適用。
| 項目16E. |
發行人及關聯購買者購買權益證券
|
不適用。
| 項目16F. |
註冊會計師的變更
|
不適用。
| 項目16G. |
公司治理
|
作為在納斯達克資本市場上市的開曼羣島公司,我們必須遵守納斯達克公司治理上市標準。然而,納斯達克規則允許像我們這樣的外國私人發行商遵循其本國的公司治理做法。開曼羣島是我們的母國,其某些公司治理做法可能與納斯達克公司治理上市標準大不相同。目前,我們不打算在公司治理問題上依賴母國豁免。然而,如果我們選擇在未來遵循母國的做法,我們的股東所得到的保護可能會比他們在適用於美國國內發行人的納斯達克公司治理上市標準下得到的保護要少。見第3.D項.關鍵信息---風險因素---與我國普通股有關的風險---作為外國私人發行者,我們獲準在公司治理事項上採取與納斯達克資本市場公司治理上市標準大不相同的某些母國做法。如果我們完全遵守公司治理上市標準,這些做法對股東的保護可能會比他們所享受的要少。“
| 項目16H. |
礦山安全披露
|
不適用。
151
目錄
第III部
| 項目17. |
財務報表
|
我們選擇根據項目18提供財務報表。
| 項目18. |
財務報表
|
BeyondSpring公司的合併財務報表列於本年度報告末尾。
152
目錄
| 項目19. |
展品
|
|
1.1*
|
經修訂和修訂的BeyondSpring公司章程和章程。
|
|
2.1*
|
BeyondSpring公司普通股證書樣本。
|
|
4.1*
|
諮詢協議,截止日期為2013,06月18日,萬春製藥與葛蘭素公司之間的諮詢協議。
|
|
4.2*
|
該諮詢協議的第一修正案,日期為2014,03月30日,由萬春製藥、碧昂斯美國公司和GKOL公司簽署。
|
|
4.3*
|
對諮詢協議的第二次修正,日期為2015,06月1日,由BeyondSpringU.S.和GKOL公司簽訂。
|
|
4.4*
|
自2015年2月2日起,碧昂斯公司、萬春生物技術公司和Nereus公司簽訂終止協議。
|
|
4.5*
|
自2016年月7日起,碧昂斯美國公司與理查德·布蘭德簽訂了僱傭協議。
|
|
4.6*
|
自2016年月1日起,碧昂泉美國公司與蘭黃公司簽訂就業協議。
|
|
4.7*
|
自2016年月1日起,BeyondSpring美國公司與RamonMohanlal公司簽訂了就業協議。
|
|
4.8*
|
自2016年月16日起,碧昂斯美國公司與戈登·L·斯科利簽訂就業協議。
|
|
4.9*
|
自2016年月10日起,碧昂斯美國公司與理查德·布蘭德簽訂的經修訂和恢復的就業協議
|
|
4.10*
|
修訂後的就業協議,日期為2016,011月10日,由碧昂斯美國公司和蘭黃公司簽訂
|
|
4.11*
|
自2016年月10日起,碧昂斯美國公司與拉蒙·莫漢拉爾簽訂的經修訂和恢復的就業協議
|
|
4.12*
|
自2016年月10日起,BeyondSpring U.S.與Gordon L.Schooley簽訂的經修訂和重新確定的就業協議
|
|
4.13*
|
董事及行政主任補償協議表格
|
|
4.14*
|
碧昂斯公司2017綜合獎勵計劃和相關的表格協議
|
|
4.15*
|
主任協議的格式
|
|
4.16*
|
BeyondSpring公司與S類投資者的股票認購協議形式
|
|
4.17*
|
自2017年2月27日起,BeyondSpringInc.與聖星生物醫學基金有限公司簽訂股份認購協議。
|
|
4.18***
|
關於BPI-002里程碑股票獎金的信函,日期為2017,04月11日,由BeyondSpring公司與Ramon Mohanlal公司簽訂
|
|
4.19***
|
關於BPI-004里程碑股票獎金的信函,日期為2017,04月11日,由BeyondSpring公司與Ramon Mohanlal公司簽訂
|
|
4.20**
|
截止到2018年月20日,碧昂斯美國公司和理查德·布蘭德之間的遣散費協議和全面釋放協議
|
|
4.21**
|
自2018年月26日起,碧昂斯美國公司與愛德華·東亨·劉簽訂了就業協議。
|
|
8.1*
|
BeyondSpring公司子公司名單
|
|
12.1**
|
特等執行主任根據2002“薩班斯-奧克斯利法案”第302條頒發的證書
|
|
12.2**
|
根據2002“薩班斯-奧克斯利法案”第302條由首席財務官認證
|
|
13.1**
|
特等行政主任根據2002“薩班斯-奧克斯利法案”第九0六條頒發的證書
|
|
13.2**
|
根據2002“薩班斯-奧克斯利法案”第九0六條由首席財務官認證
|
|
15.1**
|
安永華明有限公司同意
|
|
15.2**
|
楓樹及山羊藿(香港)有限責任公司同意
|
|
15.3**
|
韓坤律師事務所同意
|
|
101.INS
|
XBRL實例文檔
|
|
101.SCH
|
XBRL分類法擴展模式文檔
|
|
101.CAL
|
XBRL分類法擴展計算鏈接庫文檔
|
|
101.DEF
|
XBRL分類法擴展定義鏈接庫文檔
|
|
101.lab
|
XBRL分類法擴展標籤Linkbase文檔
|
|
101.PRE
|
XBRL分類法擴展表示鏈接庫文檔
|
| * |
以前提交的登記聲明的表格F-1(檔案編號333-#number0#),經修訂,最初提交於11月15日,2016,並在此以參考文件。
|
|
**
|
本年度報告以表格20-F提供。
|
| *** |
參考了碧昂斯公司於2017年月28日向證交會提交的表格20-F的2016年度報告。
|
153
目錄
在審查作為本年度報告證物列入的協議時,請記住,這些協議是為了向你提供關於其條款的信息,而不是提供關於我們或協議其他各方的任何其他事實或披露信息。
協議可以包含適用協議的每一方的陳述和保證。這些申述和保證完全是為了適用協定的其他各方的利益而作出的,並且:
| · |
不應在所有情況下都將其視為明確的事實陳述,而應視為在事實證明不準確的情況下將風險分配給一方當事人的一種方式;
|
| · |
在談判適用協議時向另一方披露的信息,這些披露不一定反映在協議中;
|
| · |
可採用與對你或其他投資者可能視為重要的標準不同的方式適用重要標準;及
|
| · |
只在適用的協議之日或協議中可能指明的其他日期作出,並須受較近期的發展而定。
|
因此,這些陳述和保證不得描述其作出之日或任何其他時間的實際情況。
154
目錄
簽名
BeyondSpringInc.茲證明其符合表格20-F的所有要求,並已正式促使並授權以下簽名人代表其簽署這份年度報告。
|
碧昂斯公司
|
||
|
通過:
|
/S/Lan Huang
|
|
|
姓名:
|
藍黃 | |
|
標題:
|
首席執行官 | |
|
日期:2018
|
||
目錄
合併財務報表索引
|
頁
|
|
|
BeyondSpring公司經審計的合併財務報表
|
|
|
獨立註冊會計師事務所報告
|
F-2
|
|
截至12月31日、2017和2016的綜合資產負債表
|
F-3
|
|
截至12月31日、2017、2016和2015年底的綜合損失綜合報表
|
F-4
|
|
截至12月31日、2017、2016和2015年底股東權益綜合報表
|
F-5
|
|
截至12月31日、2017、2016和2015年底的現金流量表
|
F-6
|
|
合併財務報表附註
|
F-8
|
F-1
目錄
獨立註冊會計師事務所報告
致BeyondSpring公司的股東和董事會。
關於財務報表的意見
我們審計了所附的BeyondSpring公司(“公司”)截至12月31日、2017和2016的合併資產負債表、有關綜合虧損、股東權益和現金流量的綜合報表以及截至12月31日,2017的三年中的每一年的綜合報表,以及相關附註(統稱為“合併財務報表”)。我們認為,合併財務報表按照美國普遍接受的會計原則,在所有重大方面公允地列報了公司在12月31日、2017和2016年月日的財務狀況,以及公司在截至12月31日的三年中每年的經營結果和現金流量。
意見依據
這些財務報表由公司管理層負責。我們的責任是根據我們的審計,對公司的財務報表發表意見。我們是在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券法和證券交易委員會(SEC)和PCAOB的適用規則和條例,我們必須獨立於該公司。
我們的審計工作是按照PCAOB的標準進行的。這些準則要求我們規劃和進行審計,以便合理地保證財務報表是否存在重大錯報,無論是由於錯誤還是欺詐。我們的審計包括執行評估財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐。 該公司不需要對其財務報告的內部控制進行審計,我們也沒有進行審計。作為我們審計的一部分,我們必須瞭解財務報告的內部控制,但不是為了對公司財務報告內部控制的有效性發表意見。因此,我們不表示這種意見。
我們的審計包括執行評估財務報表重大錯報風險的程序,無論是由於欺詐還是錯誤,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查關於財務報表中數額和披露情況的證據。我們的審計還包括評價管理部門使用的會計原則和重大估計數,以及評價財務報表的總體列報方式。我們相信,我們的審計為我們的意見提供了合理的依據。
/S/Ernst&Young華明有限公司
自2015以來,我們一直擔任公司的審計師。
中華人民共和國北京
2018.4月3
F-2
目錄
北京中興股份有限公司
合併資產負債表
(以千美元計的金額(“美元”),但股票數量和每股數據除外)
|
截至 十二月三十一日,
|
||||||||||||
|
注
|
2016
|
2017
|
||||||||||
| $ | $ | |||||||||||
|
資產
|
||||||||||||
|
流動資產:
|
||||||||||||
|
現金
|
11,687
|
27,481
|
||||||||||
|
短期投資
|
-
|
3,074
|
||||||||||
|
給供應商的預付款
|
799
|
1,525
|
||||||||||
|
遞延首次公開發行成本
|
1,861
|
-
|
||||||||||
|
預付費用和其他流動資產
|
360
|
264
|
||||||||||
|
流動資產總額
|
14,707
|
32,344
|
||||||||||
|
非流動資產:
|
||||||||||||
|
財產和設備,淨額
|
3 |
80
|
123
|
|||||||||
|
其他非流動資產
|
121
|
361
|
||||||||||
|
非流動資產總額
|
201
|
484
|
||||||||||
|
總資產
|
14,908
|
32,828
|
||||||||||
|
負債和權益
|
||||||||||||
|
流動負債:
|
||||||||||||
|
應付帳款
|
444
|
3,379
|
||||||||||
|
應付關聯方
|
4 |
210
|
-
|
|||||||||
|
政府贈款
|
288
|
307
|
||||||||||
|
應計費用
|
1,432
|
807
|
||||||||||
|
其他流動負債
|
235
|
299
|
||||||||||
|
流動負債總額
|
2,609
|
4,792
|
||||||||||
|
負債總額
|
2,609
|
4,792
|
||||||||||
|
承付款和意外開支
|
10 | |||||||||||
|
公平:
|
||||||||||||
|
普通股(面值0.0001美元;獲授權500,000,000股;截至12月31日、2016和2017分別發行和發行的普通股16,879,628股和22,530,702股)
|
2
|
2
|
||||||||||
|
額外實收資本
|
44,369
|
151,147
|
||||||||||
|
累積赤字
|
(32,128
|
)
|
(123,891
|
)
|
||||||||
|
累計其他綜合損失
|
(91
|
)
|
(182
|
)
|
||||||||
|
BeyondSpring公司股東權益總額
|
12,152
|
27,076
|
||||||||||
|
非控制利益
|
147
|
960
|
||||||||||
|
總股本
|
12,299
|
28,036
|
||||||||||
|
負債和權益共計
|
14,908
|
32,828
|
||||||||||
所附附註是這些合併財務報表的組成部分。
F-3
目錄
北京中興股份有限公司
綜合損失報表
(以千美元計的金額(“美元”),但股票數量和每股數據除外)
|
截至12月31日的年度,
|
||||||||||||||||
|
注
|
2015
|
2016
|
2017
|
|||||||||||||
|
$
|
$
|
$
|
||||||||||||||
|
收入
|
-
|
-
|
-
|
|||||||||||||
|
業務費用:
|
||||||||||||||||
|
研究和開發,包括截至12月31日的年度的專利費用42,259美元,2017
|
(6,282
|
)
|
(10,437
|
)
|
(88,928
|
)
|
||||||||||
|
一般和行政
|
(1,193
|
)
|
(1,931
|
)
|
(9,053
|
)
|
||||||||||
|
業務損失
|
(7,475
|
)
|
(12,368
|
)
|
(97,981
|
)
|
||||||||||
|
外匯收益(虧損),淨額
|
13
|
(195
|
)
|
555
|
||||||||||||
|
利息收入
|
13
|
18
|
120
|
|||||||||||||
|
其他收入
|
-
|
-
|
918
|
|||||||||||||
|
利息費用
|
(532
|
)
|
-
|
-
|
||||||||||||
|
財產和設備處置方面的損失
|
(27
|
)
|
-
|
-
|
||||||||||||
|
權益法投資淨虧損
|
(44
|
)
|
-
|
-
|
||||||||||||
|
所得税前淨虧損
|
(8,052
|
)
|
(12,545
|
)
|
(96,388
|
)
|
||||||||||
|
所得税利益
|
5 |
-
|
-
|
-
|
||||||||||||
|
淨損失
|
(8,052
|
)
|
(12,545
|
)
|
(96,388
|
)
|
||||||||||
|
減:非控制權益造成的淨損失
|
(82
|
)
|
(535
|
)
|
(4,625
|
)
|
||||||||||
|
可歸因於BeyondSpring公司的淨虧損
|
(7,970
|
)
|
(12,010
|
)
|
(91,763
|
)
|
||||||||||
|
每股淨虧損
|
||||||||||||||||
|
鹼性稀釋
|
6 |
(0.53
|
)
|
(0.75
|
)
|
(4.40
|
)
|
|||||||||
|
加權平均股票
|
||||||||||||||||
|
鹼性稀釋
|
6 |
15,171,370
|
16,086,419
|
20,866,084
|
||||||||||||
|
其他綜合損失
|
||||||||||||||||
|
外幣折算調整損失
|
(21
|
)
|
(64
|
)
|
(1
|
)
|
||||||||||
|
總綜合損失
|
(8,073
|
)
|
(12,609
|
)
|
(96,389
|
)
|
||||||||||
|
減:非控制利益造成的全面損失
|
(92
|
)
|
(561
|
)
|
(4,535
|
)
|
||||||||||
|
可歸因於BeyondSpring公司的全面損失
|
(7,981
|
)
|
(12,048
|
)
|
(91,854
|
)
|
||||||||||
所附附註是這些合併財務報表的組成部分。
F-4
目錄
北京中興股份有限公司
股東權益合併報表
(以千美元計的金額(“美元”),但股票數量和每股數據除外)
|
BeyondSpring公司股東
|
||||||||||||||||||||||||||||||||
|
普通股
|
附加
已付
|
累積
|
累積
其他
綜合
|
非
控制
|
共計
|
|||||||||||||||||||||||||||
|
股份
|
金額
|
資本
|
赤字
|
損失
|
小計
|
利益
|
權益
|
|||||||||||||||||||||||||
|
$
|
$
|
$
|
$
|
$
|
$
|
$
|
||||||||||||||||||||||||||
|
2015年月一日結餘
|
13,910,000
|
1
|
2,796
|
(12,148
|
)
|
(42
|
)
|
(9,393
|
)
|
-
|
(9,393
|
)
|
||||||||||||||||||||
|
發行普通股(注1)
|
1,600,000
|
1
|
15,999
|
-
|
-
|
16,000
|
-
|
16,000
|
||||||||||||||||||||||||
|
獲得股權投資e
|
240,000
|
-
|
2,400
|
-
|
-
|
2,400
|
-
|
2,400
|
||||||||||||||||||||||||
|
推定利息
|
-
|
-
|
532
|
-
|
-
|
532
|
-
|
532
|
||||||||||||||||||||||||
|
外幣折算調整損失
|
-
|
-
|
-
|
-
|
(11
|
)
|
(11
|
)
|
(10
|
)
|
(21
|
)
|
||||||||||||||||||||
|
當作捐款
|
-
|
-
|
8,192
|
-
|
-
|
8,192
|
-
|
8,192
|
||||||||||||||||||||||||
|
對附屬公司的資本貢獻的影響
|
-
|
-
|
(800
|
)
|
-
|
-
|
(800
|
)
|
800
|
-
|
||||||||||||||||||||||
|
淨損失
|
-
|
-
|
-
|
(7,970
|
)
|
-
|
(7,970
|
)
|
(82
|
)
|
(8,052
|
)
|
||||||||||||||||||||
|
2015年月31的結餘
|
15,750,000
|
2
|
29,119
|
(20,118
|
)
|
(53
|
)
|
8,950
|
708
|
9,658
|
||||||||||||||||||||||
|
發行普通股(注1)
|
1,129,628
|
-
|
15,250
|
-
|
-
|
15,250
|
-
|
15,250
|
||||||||||||||||||||||||
|
外幣折算調整損失
|
-
|
-
|
-
|
-
|
(38
|
)
|
(38
|
)
|
(26
|
)
|
(64
|
)
|
||||||||||||||||||||
|
淨損失
|
-
|
-
|
-
|
(12,010
|
)
|
-
|
(12,010
|
)
|
(535
|
)
|
(12,545
|
)
|
||||||||||||||||||||
|
2016年月31的結餘
|
16,879,628
|
2
|
44,369
|
(32,128
|
)
|
(91
|
)
|
12,152
|
147
|
12,299
|
||||||||||||||||||||||
|
發行普通股(注1)
|
4,828,297
|
-
|
89,443
|
-
|
-
|
89,443
|
-
|
89,443
|
||||||||||||||||||||||||
|
對附屬公司的資本貢獻的影響
|
-
|
-
|
(1,480
|
)
|
-
|
-
|
(1,480
|
)
|
1,480
|
-
|
||||||||||||||||||||||
|
股份補償(注7)
|
822,777
|
-
|
18,815
|
-
|
-
|
18,815
|
3,868
|
22,683
|
||||||||||||||||||||||||
|
外幣折算調整(虧損)收益
|
-
|
-
|
-
|
-
|
(91
|
)
|
(91
|
)
|
90
|
(1
|
)
|
|||||||||||||||||||||
|
淨損失
|
-
|
-
|
-
|
(91,763
|
)
|
-
|
(91,763
|
)
|
(4,625
|
)
|
(96,388
|
)
|
||||||||||||||||||||
|
2017年月31的結餘
|
22,530,702
|
2
|
151,147
|
(123,891
|
)
|
(182
|
)
|
27,076
|
960
|
28,036
|
||||||||||||||||||||||
所附附註是這些合併財務報表的組成部分。
F-5
目錄
北京中興股份有限公司
現金流量表
(以千美元計的金額(“美元”),但股票數量和每股數據除外)
|
截至12月31日的年度,
|
||||||||||||||||
|
注
|
2015
|
2016
|
2017
|
|||||||||||||
|
$
|
$
|
$
|
||||||||||||||
|
業務活動現金流量:
|
||||||||||||||||
|
淨損失
|
(8,052
|
)
|
(12,545
|
)
|
(96,388
|
)
|
||||||||||
|
調整數,將淨損失與用於業務活動的現金對賬:
|
||||||||||||||||
|
購置股權的超額成本e
|
814
|
-
|
-
|
|||||||||||||
|
權益法投資淨虧損
|
44
|
-
|
-
|
|||||||||||||
|
推定利息
|
532
|
-
|
-
|
|||||||||||||
|
折舊費用
|
10
|
18
|
32
|
|||||||||||||
|
股份補償
|
7 |
-
|
-
|
22,683
|
||||||||||||
|
研究和開發費用通過發行股票結算
|
10 |
-
|
-
|
42,259
|
||||||||||||
|
財產和設備處置方面的損失
|
27
|
-
|
-
|
|||||||||||||
|
資產和負債變動:
|
||||||||||||||||
|
給供應商的預付款
|
(73
|
)
|
(710
|
)
|
(726
|
)
|
||||||||||
|
預付費用和其他流動資產
|
(22
|
)
|
(334
|
)
|
96
|
|||||||||||
|
其他非流動資產
|
-
|
(121
|
)
|
(240
|
)
|
|||||||||||
|
應付帳款
|
94
|
144
|
2,935
|
|||||||||||||
|
應付關聯方
|
(168
|
)
|
(222
|
)
|
(210
|
)
|
||||||||||
|
應計費用
|
210
|
(102
|
)
|
699
|
||||||||||||
|
其他流動負債
|
14
|
174
|
64
|
|||||||||||||
|
用於業務活動的現金淨額
|
(6,570
|
)
|
(13,698
|
)
|
(28,796
|
)
|
||||||||||
|
投資活動的現金流量:
|
||||||||||||||||
|
購置財產和設備
|
(40
|
)
|
(64
|
)
|
(76
|
)
|
||||||||||
|
對關聯方的貸款
|
(861
|
)
|
-
|
-
|
||||||||||||
|
從股權投資中獲得的現金e
|
1,256
|
-
|
-
|
|||||||||||||
|
購買短期投資
|
-
|
-
|
(3,074
|
)
|
||||||||||||
|
(用於)投資活動提供的現金淨額
|
355
|
(64
|
)
|
(3,150
|
)
|
|||||||||||
|
來自籌資活動的現金流量:
|
||||||||||||||||
|
發行普通股所得收益
|
1 |
16,000
|
15,250
|
50,505
|
||||||||||||
|
從第三方貸款中獲得的收益
|
1,000
|
-
|
-
|
|||||||||||||
|
欠關聯方的貸款收益
|
1,273
|
-
|
-
|
|||||||||||||
|
償還欠關聯方的貸款
|
(402
|
)
|
-
|
-
|
||||||||||||
|
內部重組中的現金分配給股權所有者
|
1 |
(1,201
|
)
|
-
|
-
|
|||||||||||
|
首次公開發行費用的支付
|
-
|
(537
|
)
|
(2,783
|
)
|
|||||||||||
|
籌資活動提供的現金淨額
|
16,670
|
14,713
|
47,722
|
|||||||||||||
|
匯率變動的影響
|
(26
|
)
|
(85
|
)
|
18
|
|||||||||||
|
現金及現金等價物淨增加情況
|
10,429
|
866
|
15,794
|
|||||||||||||
|
年初現金
|
392
|
10,821
|
11,687
|
|||||||||||||
|
年終現金
|
10,821
|
11,687
|
27,481
|
|||||||||||||
所附附註是這些合併財務報表的組成部分。
F-6
目錄
北京中興股份有限公司
現金流量表(續)
(以千美元計的金額(“美元”),但股票數量和每股數據除外)
|
截至12月31日的年度,
|
||||||||||||||||
|
注
|
2015
|
2016
|
2017
|
|||||||||||||
|
$
|
$
|
$
|
||||||||||||||
|
非現金活動:
|
||||||||||||||||
|
發行普通股收購萬春藥業
|
2,400
|
-
|
-
|
|||||||||||||
|
通過內部重組被視為貢獻
|
1 |
9,393
|
-
|
-
|
||||||||||||
|
應計應計費用中的首次公開發行費用
|
-
|
1,324
|
-
|
|||||||||||||
|
關聯方貸款淨額結算
|
1,800
|
-
|
-
|
|||||||||||||
|
研究和開發費用通過發行股票結算
|
10
|
-
|
-
|
42,259
|
||||||||||||
所附附註是這些合併財務報表的組成部分。
F-7
目錄
北京中興股份有限公司
合併財務報表附註
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
|
1.
|
業務性質和集團內部結構調整
|
BeyondSpring公司(“公司”)於2014年月21日在開曼羣島註冊成立。該公司及其子公司(集體,“集團”)主要從事臨牀階段生物製藥活動,重點發展創新癌症療法。The Company is advancing its lead asset, Plinabulin, into a Phase 2/3 clinical trial for the reduction of docetaxel chemotherapy-induced severe, grade 4 neutropenia, a Phase 2/3 clinical trial for the prevention of non-docetaxel chemotherapy-induced severe, grade 4 neutropenia and a Phase 3 clinical trial as an anticancer agent in combination with docetaxel in advanced non-small cell lung cancer.普林布林還進入了一系列計劃階段1/2臨牀試驗的第一階段,以研究其與免疫腫瘤學藥物nivolumab相結合的治療潛力。公司自成立以來,作為一對夫妻(集體,“創辦人”)在林青賈先生和蘭黃博士的控制下。
在2011年7月,集團在中華人民共和國(“中華人民共和國”)和香港地區獲得了普林布林的專利。2013年間,集團在美國及除中華人民共和國及香港以外的世界其他國家擁有普林布林的專利。
截至2017年月三十一日,該公司的附屬公司如下:
|
公司名稱
|
成立為法團的地方
|
日期
合併
|
百分比
擁有權
公司
|
主要活動
|
|
碧昂斯製藥公司(“BeyondSpring US”)
|
特拉華州
美利堅合眾國(“美國”)
|
2013年月18
|
100%
|
臨牀試驗活動
|
|
碧昂斯春公司
|
英屬維爾京羣島(“英屬維爾京羣島”)
|
2014年月三日
|
100%
|
控股公司
|
|
BeyondSpring(HK)Limited(“BeyondSpring HK”)
|
香港
|
2015年月13日
|
100%
|
控股公司
|
|
萬春生物科技有限公司(“BVI生物技術”)
|
英屬維爾京羣島
|
2015年月一日
|
100%
|
控股公司
|
|
萬春生物技術(深圳)有限公司。(“萬春深圳”)
|
中華人民共和國
(“中華人民共和國”)
|
2015年月23
|
100%
|
控股公司
|
|
大連萬春布林製藥有限公司。(“Wanchunbulin”)
|
中華人民共和國
|
2015.5.6
|
60%
|
臨牀試驗活動
|
|
澳大利亞BeyondSpring製藥有限公司(“澳大利亞碧昂斯春”)
|
澳大利亞
|
2016.3月3日
|
100%
|
臨牀試驗活動
|
F-8
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 1. |
業務性質和集團內部結構調整(續)
|
大連萬春生物技術有限公司。(“萬春生物技術”)於2010年月18日註冊從事藥品研發活動,自成立以來一直由創建人全資擁有,直到2015年月,賈林清先生將萬春生物技術10%的股權出售給董良先生。在內部重組之前(如下文所定義),萬春生物科技公司擁有碧昂斯美國公司、BVI生物技術公司和大連萬春製藥有限公司100%的股權。(“萬春藥業”)
2012年12月,萬春生物科技公司以90.91%的股權將普林布林在中國和香港地區的專利投資到萬春醫藥和上海復星製藥工業發展有限公司。(“上海復星”)通過現金注入持有剩餘9.09%的股權。2015年月30日,萬春生物科技與上海復星達成股份轉讓協議,以1611美元(合1萬元人民幣)的現金收購萬春醫藥9.09%的股權。在2015,股權轉讓協議完成,萬春製藥成為萬春生物科技的全資子公司。
為了準備公司在美國上市,集團進行了如下所述的內部重組(“內部重組”),使該公司成為集團的新控股公司.
該公司是由創建者通過其全資公司持有的三股首次發行的股份組成的。2014年月3日,公司在英屬維爾京羣島成立了碧昂斯春有限公司。2015年月13日,BeyondSpring香港有限公司在香港成立。2015年月23,萬春深圳,一家外商獨資企業,被香港碧昂泉公司註冊。所有這些公司都持有沒有業務的公司。
2015年3月,該公司通過其全資公司向創建人發行了13429997股股票。2015年4月,該公司通過其全資公司向董良發行了32萬股股票。此外,2015年4月13日,該公司還向萬春生物科技公司發行了10萬股股票,萬春生物科技是創辦人和董良共同擁有的一家公司。所有這些股份都被記作全額支付。
2015年4月,其中一位創辦人通過他的全資公司之一,將該公司的20萬股股份通過他的一家全資公司轉讓給深圳聖兆信歐風險投資公司(有限合夥公司),以2,000美元的現金為代價。
2015年月13日,該公司向北京聖兆方生風投(有限合夥)、深圳聖瑞風投(有限責任合夥)和漢佛龍投資有限公司發行了160萬股股票,總金額為1.6萬美元,合每股10美元。在2015年間全額支付了這一代價。
2015年月6日,萬春生物科技有限公司與深圳萬春公司成立萬春蘭。Wanchun Biotech agreed to invest the patent of Plinabulin in territories of the PRC and Hong Kong with an agreed value of $5,290 (RMB32,800) for an equity interest of 40% in Wanchunbulin, and Wanchun Shenzhen agreed to contribute cash of $7,716 (RMB49,200) for 60% equity interest in Wanchunbulin.Based on the articles of association and shareholder agreement of Wanchunbulin, the profits and losses and the equity interests in Wanchunbulin should be shared between Wanchun Biotech and Wanchun Shenzhen based on the ratio of the agreed capital contributions of Wanchun Biotech and Wanchun Shenzhen of 40% and 60%, respectively, despite the fact that Wanchun Shenzhen has not contributed the remaining committed capital in full.深圳萬春和萬春生物技術公司的投票權和股利權也與它們商定的出資成正比。根據萬春深圳在萬布林的多數表決權,該公司根據其對萬布林相關活動的控制,將萬眾集團合併為投票利益模式。
F-9
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 1. |
業務性質和集團內部結構調整(續)
|
2015年月1日,萬春藥業啟動清算程序。2015年月20日,萬春醫藥將普林布林的專利轉讓給萬春生物技術公司,後者隨後將該專利投資於萬布林。
2015年月2日,萬春生物科技公司將碧昂斯美國公司的全部股份轉讓給了BVI生物技術公司,以換取BVI生物技術公司100%的股權。2015年月20日,該公司向萬春生物科技公司發行了30萬股股票,以換取BVI生物技術公司100%的股權。同日,復星實業有限公司。(“復星香港”),上海復星的同屬子公司,以現金1,611元(10,000元人民幣)的價格,從萬春生物科技公司購得24萬股股份。由於萬春生物科技於4月份以同樣的現金價格從上海復星收購了萬春醫藥9.09%的股權,這些都被視為關聯交易,該公司向復星香港發行的24萬股股票實質上是交換萬春製藥9.09%的股權。作為內部重組的一部分,向萬春生物技術公司發行的超過6萬股股份被計入。
在2015和2017年月,萬春深圳分別向萬布林捐款2,000元(12,752元人民幣)和3,700元(25,701元)。其餘的1 652美元承諾資本(10 747元)已同意在Wanchunbulin成立之日起五年內提供。
在2015年度7月20日完成內部重組後,萬春生物科技及其子公司以前經營的藥物研究業務連同相關的資產和負債被轉移到集團,並在內部重組後成為集團各實體的控股公司。內部重組完成後,創辦人通過創始人全資擁有的公司以及萬春生物技術公司,集體持有公司85.02%的股權。
由於萬春生物技術公司及其附屬公司與內部重組有關的藥物研究業務在內部重組前後均由創建者共同控制,因此內部重組被視為共同控制下的重組,其方式類似於説明2所詳述的利益集中。根據會計準則編碼(ASC)805-50-45,對這些合併財務報表進行了回顧性調整,以反映萬春生物技術及其子公司藥物研究業務自提交以來的歷史結果和資產負債情況。
Financial assets amounting to $1,513 (consisting of cash of $1,201 and amounts due from related parties of $312) and financial liabilities amounting to $9,705 (substantially loans) retained by Wanchun Biotech were historically associated with the drug research business owned and operated by Wanchun Biotech and represented an integral part of working capital and source of funding of the drug research business since the inception of Wanchun Biotech until the completion of the Internal Restructuring.這些資產和負債在這些合併財務報表中記錄,直至內部結構調整完成,然後作為一項被視為貢獻的款項入賬。
2016年9月,該公司向幾位第三方投資者發行了1,129,628股普通股,現金總價為15,250美元,合每股13.5美元。
2017年月14日,該公司完成了在納斯達克資本市場的首次公開發行(IPO)。174 286股普通股以每股20.00美元(“首次公開發行價格”)出售。在首次公開募股(IPO)的同時,2541048股普通股以同樣的IPO價格出售給了某些投資者。在扣除承銷折扣和發行費用後,IPO和私人配售的淨收益為47,184美元。承銷折價和發行費用,包括被記為遞延IPO成本的,被記為股東權益中IPO所得收益的減少。在IPO前夕,公司向NPBSIPO液化信託公司(Nereus Trust)發行了2,112,963股普通股,涉及終止特許權使用費支付安排(注10)。
F-10
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重要會計政策摘要
|
提出依據
根據這些合併財務報表附註1所解釋的內部重組,該公司成為目前組成集團的各實體的投資控股公司。由於移交給該公司的業務在內部重組前後由創辦人共同控制,因此對這些合併財務報表進行了回顧性調整,以反映萬春生物技術公司及其子公司藥物研究業務自提交以來的歷史結果和資產負債情況。沒有作出任何調整以反映公允價值,或確認由於內部結構調整而在這種綜合資產負債表中出現的任何新資產或負債。公司的合併財務報表是按照美國公認的會計原則(“公認會計原則”)編制的。
關注
根據會計準則編纂(“ASC”)205-40,財務報表的列報---持續經營(“ASC 205-40”),管理層必須評估是否有條件或事件在總體上引起了對公司是否有能力在財務報表發佈後一年內繼續作為持續經營企業的重大懷疑。這項評價最初沒有考慮到截至財務報表印發之日尚未充分執行的管理層計劃的潛在減輕影響。當這種方法存在重大疑問時,管理層將評估其計劃的緩解效果是否足以緩解對公司作為持續經營企業的能力的重大懷疑。然而,只有在以下情況下才能考慮管理層計劃的減輕影響:(1)這些計劃很可能在財務報表發佈之日後一年內得到有效執行;(2)這些計劃一旦實施,很可能會緩解對該實體能否繼續作為持續經營企業的重大懷疑的相關條件或事件。在財務報表印發之日起一年內。
本公司自成立以來,已因營運而蒙受營運虧損及現金流量負數。該公司在截至#date0#12月31日的一年中淨虧損96,388美元,截至12月31日累計虧損123,891美元,截至12月31日,用於運營的現金淨額約為28,796美元,截至12月31日,2017。該公司主要通過股權融資為這些虧損提供資金。到目前為止,公司沒有產品收入,管理層預計在可預見的將來,運營虧損將繼續存在。截至2017年月31,該公司手頭共有現金、現金等價物和短期投資共計30555美元。
2018年3月,董事會批准實施一項降低成本計劃,其中包括推遲某些研究、開發和臨牀項目,以及減少行政費用。隨着成本削減計劃的實施,該公司預計其現有的財政資源將使其能夠在2019年度第二季度支付其運營費用和資本支出。此外,該公司的創辦人賈臨清先生及黃蘭黃博士已以書面同意向該公司提供足夠的財政支援,以確保該公司在可預見的將來能繼續經營。創辦人亦證實他們有能力及有意將其在公司的股份,以供潛在貸款人以獲得資金以支持該公司。
因此,管理層認為,在財務報表發佈之日後一年內,公司能否繼續作為持續經營企業的重大疑問已經得到緩解。所附合並財務報表是在持續經營的基礎上編制的。
F-11
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
鞏固基礎
合併財務報表包括公司及其子公司的財務報表。公司與其子公司之間的所有公司間交易和餘額在合併後即予消除。
估計數的使用
按照公認會計原則編制合併財務報表,要求管理層對報告的資產和負債數額、財務報表之日或有資產和負債的披露以及報告期間的支出數額作出估計和假設。管理層使用主觀判斷的領域包括(但不限於)基於股票的補償、臨牀試驗應計利息、估算利息費用、延期納税資產的估價津貼以及財產和設備使用壽命的估算。管理層根據歷史經驗、已知趨勢和其他各種被認為是合理的假設進行估計,這些假設的結果構成了對資產和負債的賬面價值作出判斷的基礎。實際結果可能與這些估計不同。
研究與開發(“研發”)費用
本公司按照ASC 730的規定核算研發成本,研究與開發。研發費用主要包括進行研究和開發活動的費用,包括有關人員和顧問的工資、福利和相關費用、用於開發產品候選人的原材料和用品、與專利申請有關的專利費用以及從事臨牀開發活動和試驗的外部供應商的外部費用。公司的研發費用與發生的費用一樣。
發生的費用涉及對將用於未來研究和開發活動的貨物或服務的不可退還的預付款推遲並資本化。當相關貨物交付或提供服務時,或公司預期不需要交付貨物或提供服務時,資本化金額作為研發費用支出。
研究合同成本和應計項目
公司已與中國、美國和澳大利亞的研究機構和其他公司簽訂了各種研發合同。相關付款記作已發生的研究和開發費用。公司記錄應計項目的估計持續研究成本。在評估應計負債是否充足時,公司分析研究的進展情況,包括事件的階段或完成情況、收到的發票和合同費用。在確定任何報告所述期間結束時的應計餘額時作出了重大判斷和估計。實際結果可能與公司的估計不同。該公司的歷史應計估計數與實際成本並無重大差異。
外幣翻譯及交易
功能貨幣
該公司目前使用美元作為其所有實體的功能貨幣,但以人民幣為功能貨幣的中華人民共和國實體除外,以澳元為功能貨幣的BeyondSpring澳大利亞公司除外。相應的功能貨幣的確定是基於ASC 830的標準,外幣事項。該公司使用美元作為其報告貨幣。
F-12
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
外幣換算和交易(續)
外幣換算
對於功能貨幣不是美元的子公司,公司使用當年的平均匯率和資產負債表日的匯率將經營結果和財務狀況分別換算為報告貨幣美元。翻譯差異記錄在股東權益的一個組成部分---累積的其他綜合收益/(虧損)中。以功能貨幣以外的貨幣計值的交易按交易日通行的匯率換算為功能貨幣。外幣計價的金融資產和負債按資產負債表日的匯率重新計量。匯兑損益列入綜合損益表。
現金
現金包括手頭現金和銀行存款。截至12月31日、2016和2017,該公司沒有現金等價物。
短期投資
所有原始期限超過三個月但少於一年的流動投資都被視為短期投資。截至2017年月31,短期投資為一年定期存款,金額為3074美元(人民幣20,000元),存入招商銀行(ChinaMerchantsBank)。
給供應商的預付款
給供應商的預付款包括支付給承包商和供應商的未提供或未收到的服務和材料的現金。對供應商的預付款定期進行審查,以確定其賬面價值是否受到損害。如果供應商提供的服務和材料不確定,則公司認為資產受到損害。截至12月31日、2017和2016,沒有提供任何津貼。
推遲首次公開發行(IPO)成本
公司因擬在美國首次公開發行普通股而產生的直接費用已推遲,並在合併資產負債表中記作遞延IPO費用,並從從這種發行中收到的總收入中列支。
租賃
租約在開始之日分為資本租賃或經營租賃。The Company assesses a lease to be a capital lease if any of the following conditions exist: (a) ownership is transferred to the lessee by the end of the lease term, (b) there is a bargain purchase option, (c) the lease term is at least 75% of the property’s estimated remaining economic life or (d) the present value of the minimum lease payments at the beginning of the 租賃期限為出租人在開始之日租賃財產公允價值的90%或以上。資本租賃在租賃開始時被視為資產的購置和債務的產生。該公司在提交的年份內沒有資本租賃。
所有其他租賃均作為經營租賃入賬,在其各自的租賃期限內,租金按直線計算。公司根據經營租賃協議租賃辦公空間。租賃期自租賃財產初始佔有之日起,用於在租賃期限內直線確認租賃費用。
F-13
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
政府贈款
與資產有關的政府贈款在收到後在綜合資產負債表中確認,並在相關資產的加權平均使用壽命內作為其他收入攤銷。與公司不涉及任何條件或持續履行義務的收入有關的政府贈款,在收到時被確認為其他收入。該公司收到了政府贈款914美元,這筆贈款在截至12月31日的2017年度綜合虧損報表中作為其他收入入賬。
財產和設備
財產和設備按成本、扣除累計折舊和攤銷後列報。折舊採用直線法計算,對有關資產的估計使用壽命如下:
|
範疇
|
估計使用壽命
|
|
辦公設備
|
5年
|
|
傢俱
|
5年
|
|
機動車輛
|
10年
|
|
租賃改良
|
較低的租賃期限或經濟壽命
|
修理費和維修費按所發生的費用計算,而延長廠場和設備使用壽命的更新和改良費用則作為相關資產的增加而資本化。資產的退休、出售和處置是通過從資產和累計折舊賬户中刪除成本和累計折舊以及綜合損益表中反映的任何由此產生的損益來記錄的。
長期資產減值
長期資產按照減值或處置長期資產的權威指南對減值進行審查。長期資產被審查的事件或情況的變化,這表明其賬面價值可能無法收回。長期資產按較低的賬面價值或公允價值減去出售成本報告。在截至12月31日、2017、2016和2015的年度內,該公司的長期資產沒有出現任何減值損失。
股權投資
本公司按ASC 323的規定,採用權益法對其股權投資進行入賬,投資-股權法和合資企業。被投資人的收入或損失份額在綜合損失報表中確認。權益法調整包括公司在被投資人收入或損失中所佔的比例份額以及權益法所要求的其他調整。
F-14
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
公允價值計量
本公司的金融工具主要包括現金、短期投資、欠關聯方的金額和應付帳款.截至12月31日、2017和2016,這些金融工具的賬面價值因其短期性質而接近其公允價值。
本公司採用ASC 820,公允價值計量和披露(“ASC 820”),計量公允價值。ASC 820定義了公允價值,建立了衡量公允價值的框架,並要求在公允價值計量方面提供披露。
ASC 820建立了三層公允價值層次結構,對用於計量公允價值的投入按以下順序排列:
|
•
|
一級-反映活躍市場相同資產或負債的報價(未經調整)的可觀測投入。
|
| • |
二級-市場上直接或間接觀察到的其他投入。
|
| • |
第三級-不可觀測的投入,支持很少或沒有市場活動。
|
ASC 820描述了衡量資產和負債公允價值的三種主要方法:(1)市場法;(2)收益法和(3)成本法。市場方法使用涉及相同或可比資產或負債的市場交易產生的價格和其他相關信息。收入法使用估值技術將未來數額換算為單一現值數額。計量是根據當前市場對這些未來數額的預期所表示的價值計算的。費用方法是根據目前更換資產所需的數額計算的。
分段信息
公司的首席經營決策者,首席執行官,在作出關於分配資源和評估整個公司業績的決定時,根據ASC 280,審查合併的結果,部分報告,該公司只有一個可報告的部門。為了內部報告的目的,公司不區分市場或部門。由於該公司在所有年份都沒有收入,而且其長期資產主要位於中國,因此不提供地理區域信息。
綜合收入(損失)
綜合損失是指公司在一段時間內因交易和其他事件和情況而發生的權益變化,不包括所有者投資和分配給所有者的交易。在每一段時間內,公司的綜合虧損包括淨虧損和外幣折算調整。
所得税
公司採用所得税會計責任法。根據這一方法,遞延税資產和負債是根據財務報告與資產和負債的税基之間的差異確定的,並使用預期差額將逆轉時生效的已頒佈税率來衡量。如果遞延税資產的某些部分或全部無法實現,則提供估值備抵。
根據“會計準則更新”(“會計準則”)第2015-17號, 所得税(主題740),所有遞延所得税資產和負債在合併資產負債表上都被列為非流動資產.
F-15
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
所得税(續)
該公司根據ASC 740的規定評估其不確定的税收狀況,所得税,其中規定了一個確認門檻,即在財務報表中確認某一税種之前,必須達到該税額。公司在財務報表中確認税務狀況的好處,這種狀況“更有可能發生”,僅根據該職位的技術優點進行審查,假定税務當局對所有相關信息進行審查。符合確認門檻的税種是使用累積概率法來衡量的,在最大的税收優惠額上,在結算時實現的可能性大於50%。公司的政策是確認與未確認的税收利益有關的利息和罰款,如果有的話,作為所得税支出的一部分。
股份補償
給予僱員的獎勵
公司採用ASC 718,薪酬-股票補償(“ASC 718”),説明其僱員的份額支付。根據ASC 718,公司決定是否應將一項裁決歸類為負債裁決或股權裁決。公司授予員工的所有股份獎勵都被歸類為股權獎勵,並根據授予日期公允價值在財務報表中予以確認。具體來説,股票期權的授予日公允價值是用期權定價模型來計算的,限制性股票的授予日公允價值是根據公司普通股的上市市場價格計算的。本公司已選擇在每一個獨立歸屬部分的服務期間內,以直線方式確認補償費用,猶如該獎勵實質上是對所有員工權益獎勵的多項獎勵,並根據服務條件進行分級歸屬。公司對所有獎勵採用加速法,並根據業績條件進行分級歸屬。公司選擇在沒收發生的期間作為費用減值記帳。
獲獎獲批致非僱員
本公司已按照ASC 718及ASC 505的規定,對非僱員發行的權益工具進行入賬。權益。所有以公平手段換取貨物或服務的交易,均根據所收到的價款的公允價值或發行的權益票據的公允價值記賬,以較可靠的可計量者為準。由於沒有相關的履約承諾,因此,所發行的股權工具的公允價值的計量日期是交易對手完成履約的日期。該費用的確認方式與公司已按照ASC 505-50支付了非僱員提供的服務的現金相同,非僱員權益付款。公司使用與員工相同的方法估算授予非僱員的股票期權的公允價值。
修改獲獎
裁決條款或條件的改變作為對裁決的修改而入賬。增量賠償成本是指在緊接修改條款之前,修改後的裁決的公允價值超過原裁決的公允價值的任何部分(如果有的話),根據裁決的公允價值和修改日的其他相關因素來衡量。對於既得賠償金,公司確認在修改發生期間的增量補償成本。對於未獲授予的賠償金,公司在剩餘的必要服務期、增量補償成本和未確認的剩餘補償成本的總和中確認修改日期的原始裁決。如果修改後的裁決的公允價值低於修改前原判的公允價值,公司確認的最低賠償成本是原始裁決的成本。在截至2017年度12月31日的一年中,這些獎項沒有任何修改。
F-16
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
每股虧損
每股虧損按ASC 260計算,每股收益。普通股的基本虧損是通過將普通股東的淨虧損除以當期流通股的加權平均數量來計算的。
每股稀釋虧損的計算方法是,將可歸因於普通股東的淨虧損除以按稀釋普通股(如有的話)的效果調整後的淨虧損,除以該期間流通的普通股和稀釋普通股的加權平均數。普通股包括在轉換股票期權時發行的普通股和使用國庫股法發行的限制性股份。普通股等價物如果其效果是反稀釋的,則排除在每股稀釋損失計算之外。普通股的基本虧損和稀釋虧損在公司綜合虧損報表中列出。
信貸風險集中
信貸風險集中
可能使公司面臨集中信貸風險的金融工具主要是現金和短期投資。公司的現金和短期投資都是在管理層認為具有高信用質量的金融機構進行的。本公司至今為止並無現金及短期投資虧損。本公司不認為其信用風險超出與商業銀行關係相關的正常信用風險。
商業、客户、政治、社會和經濟風險
本公司參與一個充滿活力的高科技行業,認為以下任何一個領域的變化都可能對公司未來的財務狀況、經營結果或現金流產生重大不利影響:對服務和產品的總體需求的變化;新進入者帶來的競爭壓力;新技術和行業標準的進步和新趨勢;臨牀研究機構的變化;變化在某些戰略關係或客户關係中;監管考慮因素;版權法規;以及與公司吸引員工的能力相關的風險,以支持公司的發展。該公司的業務也可能受到中國重大政治、經濟和社會不確定因素的不利影響。
F-17
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
信貸風險集中(續)
業務風險
本公司依靠第三方支持臨牀開發活動,試驗和生產過程中的產品候選。如果這些第三方不能成功地履行他們的合同義務或在預期的最後期限前完成,公司可能無法獲得公司的藥物候選人的監管批准,公司的業務可能會受到很大的影響。公司的主要業務設在美國和中國。截至2017,美國子公司負債淨額為142美元,中國子公司淨資產為2399美元。
貨幣兑換風險
該公司以美元以外的貨幣支付部分費用,特別是人民幣。1994年月一日,中華人民共和國政府廢除了雙重匯率制度,實行了中國人民銀行每日引用的單一匯率制度(“中國人民銀行”)。但是,統一匯率並不意味着人民幣可以輕易兑換成美元或其他外幣。所有外匯交易繼續通過中國人民銀行或其他獲準以中國人民銀行報價的匯率買賣外幣的銀行進行。中國人民銀行或其他機構批准的外幣付款,須提交付款申請表,連同供應商的發票、運輸文件和簽訂的合同。
此外,人民幣的價值還會受到中央政府政策的變化和影響中國外匯交易系統市場供求的國際經濟和政治發展的影響。
外幣匯率風險
從2005的7月21日起,人民幣對一籃子特定的外幣允許在一個狹窄的管理範圍內波動。截至#date0#12月31日止的一年,人民幣對美元的升值幅度約為6.5%,截至12月31日、2016和2015的年度人民幣對美元的貶值分別約為6.3%和4.4%。很難預測市場力量或中國或美國政府的政策可能會對未來人民幣與美元之間的匯率產生何種影響。
如果公司需要將美元兑換成人民幣,用於資本支出和營運資本及其他業務目的,人民幣兑美元的升值將對公司從人民幣兑換中獲得的人民幣金額產生不利影響。相反,如果公司決定將人民幣兑換成美元,以支付普通股、戰略性收購或投資或其他業務用途的股息,美元兑人民幣升值將對公司可動用的美元數額產生負面影響。此外,人民幣對美元的大幅貶值可能會顯著降低公司的美元等值損益。
F-18
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 2. |
重大會計政策摘要(續)
|
最近通過的會計公告
2014年5月,財務會計準則委員會(“財務會計準則委員會”)發佈了會計準則委員會第2014-09號,與客户簽訂合同的收入,(“ASU 2014-09”),經ASU第2015-14號修訂。這一新標準將取代目前關於這一主題的所有公認會計準則指南,並確立了在向客户轉讓承諾的貨物或服務時確認收入的原則,其數額反映了為換取這些貨物或服務而獲得的預期考慮。本指南可追溯適用於每一期間提出或作為累積效應調整,從通過之日起。在2015,FASB將生效日期推遲到報告期間,從12月15日,2017,2017,並允許早日通過。該公司計劃於2018年月一日採用這一標準。由於公司尚未訂立任何收入安排,也預計在不久的將來不會有任何收入安排,公司預計採用新標準不會對其合併財務報表產生重大影響。
在二月份,聯邦會計準則委員會發布了第2016-02號ASU,租賃(“ASU 2016-02”),要求承租人在資產負債表上確認與租賃安排有關的資產和負債超過12個月。本標準還要求承租人提供額外的披露,幷包含出租人對會計的有針對性的更改。更新後的指南將在2018年月15以後的中期和年度內生效,並允許儘早採用。承租人對租賃費用和現金流量的確認、計量和列報與以往的公認會計原則沒有顯著變化。該公司目前正在評估採用財務報表的影響。
於2016年8月,財務及社會事務委員會發出第2016-15號行政命令。(“ASU 2016-15”), 現金流量表.某些現金收入的分類。ASU 2016-15中的修正案涉及八個具體的現金流分類問題.ASU 2016-15適用於從12月15日開始的財政年度(2017),以及在這些財政年度內的中期。該公司目前正在評估採用對其合併財務報表的影響。
2016年月日,金融服務委員會發布了第2016-16號ASU,所得税(主題740):庫存以外資產的實體內部轉移(“ASU 2016-16”),這就要求確認在發生轉移時,資產的實體內轉移(庫存除外)的所得税後果。該公司目前正在評估採用對其合併財務報表的影響。
在2017年5月,聯邦會計準則委員會發布了第2017-09號ASU,薪酬-股票薪酬:變更會計的範圍(“ASU 2017-02”)該標準提供了清晰性,減少了(1)實踐中的多樣性,(2)在應用主題718的指導時,成本和複雜性。薪酬-股票補償,以更改以股票為基礎的支付獎勵的條款或條件。更新後的指南將在2017年月15以後的中期和年度內生效,並允許儘早採用。預計2018採用該ASU不會對公司的合併財務報表產生重大影響。
F-19
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 3. |
財產和設備,淨額
|
財產和設備包括:
|
十二月三十一日,
|
||||||||
|
2016
|
2017
|
|||||||
|
辦公設備
|
17
|
39
|
||||||
|
實驗室設備
|
49
|
104
|
||||||
|
傢俱
|
2
|
-
|
||||||
|
機動車輛
|
23
|
23
|
||||||
|
租賃改良
|
13
|
13
|
||||||
|
104
|
179
|
|||||||
|
減:累計折舊
|
(24
|
)
|
(56
|
)
|
||||
|
財產和設備,淨額
|
80
|
123
|
||||||
截至12月31日、2015、2016和2017年度的折舊費用分別為10美元、18美元和32美元。
| 4. |
關聯方交易
|
除了合併財務報表其他地方披露的交易外,所列年份的關聯方交易情況如下:
蘭黃博士
在截至12月31日、2015、2016和2017年間,藍黃博士分別以300美元、75美元和零的費用向碧昂斯美國公司提供了諮詢服務。
萬春生物科技作為非控股股東
#date0#11月28日和2017年1月13日,萬春生物科技公司與萬春生物技術公司簽訂採購合同,向萬春生物技術公司採購用於臨牀研究的藥物。在截至12月31日、2016和2017的幾年裏,萬春生物技術公司分別從第三方供應商那裏購買了價值110美元(人民幣754元)和547美元(3770元人民幣)的藥品,並分別在沒有任何利潤的情況下賣給了萬春。
由於有關各方的原因如下:
|
十二月三十一日,
|
||||||||
|
2016
|
2017
|
|||||||
|
欠蘭黃博士的錢
|
210
|
-
|
||||||
F-20
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 5. |
所得税
|
開曼羣島
該公司在開曼羣島註冊,根據開曼羣島現行法律,不需繳納所得税。
英屬維爾京羣島
BeyondSpring有限公司和英屬維爾京羣島生物技術公司在英屬維爾京羣島註冊,根據英屬維爾京羣島現行法律,不需繳納所得税。
美國
BeyondSpring美國公司在美國特拉華州註冊。在截至12月31日、2017、2016和2015的年份內,它必須繳納美國法定的聯邦企業所得税,税率為35%。BeyondSpring美國沒有所有年份的應税收入,因此,沒有記錄所得税的規定。
在2017,減税和就業法案(2017税法)頒佈。2017税法包括了對美國現行税法的一些修改,這些法律影響到該公司,最顯著的是將美國公司所得税税率從35%降至21%,從12月31,2017以後的課税年度開始。
澳大利亞
在澳大利亞註冊的BeyondSpring澳大利亞公司要繳納30%的公司所得税。BeyondSpring澳大利亞沒有所有年份的應税收入,因此不需要提供所得税。
香港
BeyondSpring香港有限公司在香港成立。在香港註冊的公司,須就其各自的法定財務報表中所報告的應課税入息徵收香港利得税,而該等報表是根據香港有關税法作出調整的。香港適用的税率為16.5%。BeyondSpring香港沒有所有年份的應税收入,因此不需要提供所得税。
中華人民共和國
根據“中華人民共和國企業所得税法”(“企業所得税法”)的規定,萬春深圳和萬春蘭自2008年月一日起適用25%的法定税率。
所得税前損失的組成部分如下:
|
截至12月31日的年度,
|
||||||||||||
|
2015
|
2016
|
2017
|
||||||||||
|
開曼羣島
|
489
|
894
|
2,045
|
|||||||||
|
美國
|
5,921
|
9,840
|
80,008
|
|||||||||
|
中華人民共和國
|
1,642
|
1,338
|
11,341
|
|||||||||
|
英屬維爾京羣島
|
-
|
-
|
2,498
|
|||||||||
|
澳大利亞
|
-
|
473
|
496
|
|||||||||
|
所得税前淨虧損
|
8,052
|
12,545
|
96,388
|
|||||||||
沒有關於當期和遞延所得税的備抵,因為該公司及其所有子公司均為虧損,在所列年份處於累積虧損狀態。
F-21
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 5. |
所得税(續)
|
調整所得税福利與採用35%的美國公司所得税税率計算的數額之間的差額如下:
|
截至12月31日的年度,
|
||||||||||||
|
2015
|
2016
|
2017
|
||||||||||
|
所得税前淨虧損
|
8,052
|
12,545
|
96,388
|
|||||||||
|
預期所得税利益
|
2,818
|
4,391
|
33,736
|
|||||||||
|
税率差
|
297
|
581
|
5,796
|
|||||||||
|
非扣除費用
|
(351
|
)
|
(152
|
)
|
(25,299
|
)
|
||||||
|
視為處置收益*
|
-
|
-
|
(10,506
|
)
|
||||||||
|
美國法定税率變動的影響
|
-
|
-
|
(2,943
|
)
|
||||||||
|
非應税收入
|
-
|
-
|
227
|
|||||||||
|
其他
|
28
|
(63
|
)
|
74
|
||||||||
|
估價津貼的變動
|
(2,792
|
)
|
(4,757
|
)
|
(1,085
|
)
|
||||||
|
所得税總福利
|
-
|
-
|
-
|
|||||||||
*產生於某些知識產權的集團內轉讓。
截至12月31日、2016和2017的遞延税款淨資產包括:
|
十二月三十一日,
|
||||||||
|
2016
|
2017
|
|||||||
|
遞延税款資產:
|
||||||||
|
淨營運虧損結轉
|
8,317
|
7,244
|
||||||
|
無形資產
|
428
|
329
|
||||||
|
推遲扣除研發費用
|
409
|
1,239
|
||||||
|
股份補償
|
-
|
1,427
|
||||||
|
減:估價津貼
|
(9,154
|
)
|
(10,239
|
)
|
||||
|
遞延税款資產淨額
|
-
|
-
|
||||||
對遞延税資產提供了估值備抵,根據所有現有證據,認為某些部分或所有已入賬的遞延税資產在未來期間不可能變現的情況下,更有可能出現這種情況。該公司記錄了對遞延税資產的全額估價備抵額。
F-22
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 5. |
所得税(續)
|
截至2017年月31,該公司在美國和中國的税負結轉額分別約為43,952美元和746美元。對於2017年月31以後在美國發生的損失,2017税法規定將淨營業損失的扣除額限制在本年度應納税收入的80%以內,並規定此類損失可以無限期結轉。2017及以往年份的虧損結轉不限於其目前的使用,並可在其產生的年份後20年內結轉。然而,中華人民共和國未使用的税收損失可以結轉5年,如果不使用,746美元將全部到期2022。
截至12月31日、2016和2017,該公司確定,它沒有重大的未確認的税收優惠,因此沒有相關的重大利益和處罰。管理層預計,在未來12個月內,未獲確認的免税額不會大幅增加。
該公司在美國、澳大利亞和中國的子公司分別在美國、澳大利亞和中國提交了所得税申報表。從2014開始,美國碧昂斯春公司將接受美國税務機關的聯邦和州所得税審查。從2016開始,澳大利亞的納税申報單將由澳大利亞税務局審核。對於深圳萬春和萬元布林,2015以後的納税申報表由中華人民共和國税務機關審核。
| 6. |
每股淨虧損
|
普通股東的每股基本和稀釋淨虧損計算如下:
| 截至12月31日的年度, | ||||||||||||
|
2015
|
2016
|
2017
|
||||||||||
|
分子:
|
||||||||||||
|
可歸因於BeyondSpring公司的淨虧損—鹼性稀釋
|
$
|
(7,970
|
)
|
$
|
(12,010
|
)
|
$
|
(91,763
|
)
|
|||
|
|
||||||||||||
|
分母:
|
||||||||||||
|
已發行普通股加權平均數量-基本和稀釋
|
15,171,370
|
16,086,419
|
20,866,084
|
|||||||||
|
每股淨虧損-基本損失和稀釋損失
|
$
|
(0.53
|
)
|
$
|
(0.75
|
)
|
$
|
(4.40
|
)
|
|||
為列報每股虧損,計算了截至12月31日的2015年度公司普通股加權平均數,計算的依據是該公司根據內部結構調整發行的1391萬股普通股,以交換藥物研究業務及相關資產和負債。
所有股票期權和有限股份單位的影響都被排除在每股稀釋損失的計算之外,因為它們的影響在截至#date0#12月31日的年度內是反稀釋的。
| 7. |
股份補償
|
一般
On February 24, 2017, in connection with the IPO, the Company’s board of directors and shareholders approved an equity compensation plan, the 2017 Omnibus Incentive Plan (the “2017 Plan”), which became effective on March 9, 2017, to provide an additional incentive to selected officers, employees, non-employee directors, independent contractors and consultants of the Company (the “Participants”) under certain conditions.根據2017歐姆尼布斯激勵計劃,公司的普通股最多可發行2,137,037股。
F-23
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 7. |
基於份額的賠償(續)
|
在2017年間,公司根據2017計劃共向員工和非僱員發放了1,141,477股限制性股份,其中318,700股在2017年間被沒收。受限制的股份受不同服務條件、時間表以及研究和開發進展的某些性能條件的制約。
在2017年間,公司根據2017計劃,向公司首席醫務官發放了多達60萬股普通股。普通股受一定的業績條件制約,各自受研發進展的影響,截至2017年度12月31日,沒有一隻普通股歸屬於該公司。
在2017年間,該公司共授予343,000股非合格股票期權,行使價格為每股29.00美元。根據某些服務或業績條件,股票期權的合同期限為10年。
限制性股份
下表彙總了2017計劃下公司員工的限制性股份活動:
|
數字
股份
|
加權平均
授予日期公允價值
|
|||||||
|
$
|
||||||||
|
2016年月31未繳
|
-
|
-
|
||||||
|
獲批
|
1,141,477
|
20.76
|
||||||
|
既得利益
|
(434,615
|
)
|
22.19
|
|||||
|
被沒收
|
(318,700
|
)
|
19.80
|
|||||
|
2017年月31未繳
|
388,162
|
19.93
|
||||||
|
預計將於#date0#12月31日歸屬
|
358,162
|
19.93
|
||||||
截至2017年月31,未確認的補償成本為3,906美元。這筆未確認的補償將在估計的4.0年加權平均攤銷期內確認.
F-24
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 7. |
基於份額的賠償(續)
|
股票期權
下表概述了公司在2017計劃下的股票期權活動:
|
數字
備選方案
|
加權
平均
運動
價格
|
加權
平均贈款
日期公允價值
|
加權
平均
剩餘
契約性
術語
|
平均
內稟
價值
|
||||||||||||||||
|
$
|
$
|
年數
|
$
|
|||||||||||||||||
|
2016年月31未繳
|
-
|
-
|
||||||||||||||||||
|
獲批
|
343,000
|
29.00
|
19.91
|
|||||||||||||||||
|
2017年月31未繳
|
343,000
|
29.00
|
9.98
|
27
|
||||||||||||||||
|
自2017年月31起可運動。
|
-
|
-
|
||||||||||||||||||
|
既得利益及預期將於2017年月31歸屬
|
343,000
|
29.00
|
9.98
|
27
|
||||||||||||||||
截至2017年12月31日,預計將授予343,000份未歸屬股票期權的未確認補償成本為1,281美元。這一未確認的補償將在估計的2.7個月加權平均攤銷期內確認.
期權公允價值
在確定所授予期權的估計公允價值時,應用了Black-Soles-Merton公式。該模型需要輸入高度主觀的假設,包括預期股價波動和預期獎勵條款。這些估計涉及固有的風險和不確定性,以及管理層判斷的應用。該公司歷史上有限的歷史數據,以顯示一致的早期鍛鍊行為。為了確定預期的授標期限,公司採用了一種簡化的方法,考慮到實現各種業績條件的時間、其各自的概率以及期權的合同期限等因素。期權期望值內的無風險利率是以美國國債利率為基礎的。該公司歷史上一直是一傢俬人公司,缺乏公司特有的歷史和隱含的波動性信息共享期權。因此,該公司根據一組公開交易的類似公司的歷史波動率來估算預期波動率。公司管理層最終負責確定其股票期權的估計公允價值。
下表列出了為估計2017年月31終了年度股票期權的公允價值所使用的假設:
|
年終
十二月三十一日,
|
|||
|
2017
|
|||
|
普通股公允價值
|
34.00
|
||
|
無風險利率
|
2.28
|
%
|
|
|
預期期限
|
5.5歲
|
||
|
預期波動率
|
60
|
%
|
|
|
預期股利收益率
|
0
|
%
|
|
|
契約生活
|
10年
|
F-25
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 7. |
基於份額的賠償(續)
|
下表彙總了截至2017年度的股份補償費用總額:
|
年終
十二月三十一日,
|
||||
|
2017
|
||||
|
研發
|
17,753
|
|||
|
一般和行政
|
4,930
|
|||
|
共計
|
22,683
|
|||
| 8. |
員工定義繳款計劃
|
中華人民共和國公司的全職僱員參與政府規定的繳款計劃,根據該計劃,向僱員提供某些養老金福利、醫療保健、僱員住房基金和其他福利福利。中國勞動法規要求公司在中國的子公司根據僱員工資的一定百分比向政府繳納這些福利。公司沒有法律義務的利益以外,作出的貢獻。截至12月31日、2015、2016和2017年度,這些僱員福利的支出總額分別為12美元、22美元和38美元。
| 9. |
限制淨資產
|
公司支付股息的能力可能取決於公司從其中國子公司獲得資金分配。中華人民共和國相關法律法規只允許公司在中國的子公司根據中國會計準則和條例確定的留存收益(如果有的話)支付股息。根據美國公認會計原則編制的合併財務報表所反映的業務結果與公司在中國的子公司法定財務報表中反映的結果不同。
根據“中華人民共和國外商投資企業條例”及其章程的規定,在中華人民共和國境內設立的外商投資企業,必須按照中華人民共和國法定帳户的規定,提供從淨利潤中撥付的法定準備金,即一般準備金、企業擴張基金、職工福利和獎金基金。外商投資企業必須將其年税後利潤的至少10%分配給一般準備金,直至根據該企業的中華人民共和國法定賬户達到其各自注冊資本的50%為止。外商投資企業的企業擴張基金和職工福利獎金基金,由董事會自行決定。上述準備金只能用於特定目的,不能作為現金紅利分配。萬春深圳成立為外商投資企業,受上述規定的利潤分配限制。
此外,根據“中華人民共和國公司法”的規定,國內企業必須提供法定共同準備金,至少佔其年税後利潤的10%,直至根據企業的中華人民共和國法定賬户達到其各自注冊資本的50%為止。國內企業還須根據中國法定賬户確定的利潤,根據董事會的酌處權提供酌處盈餘準備金。上述儲備只能用於特定目的,不能作為紅利分配。萬春布林是作為國內投資企業成立的,因此受到上述規定的利潤分配限制。
F-26
目錄
北京中興股份有限公司
合併財務報表附註(續)
截至十二月三十一日、2017、2016及2015
(以千美元(“美元”)和人民幣(“人民幣”)為單位,
除股份數目及每股數據外)
| 9. |
限制性淨資產(續)
|
中華人民共和國的外匯和其他規定進一步限制公司在中國的子公司以貸款、預付款或現金紅利的形式向公司轉移資金。截至12月31日、2016和2017,該公司中國子公司的限制性淨資產分別為368美元和2399美元。
| 10. |
承付款和意外開支
|
業務租賃承付款
該公司有幾個經營租賃,主要是為辦公室。經營租契下的付款在其各自的租賃期內以直線方式支付,租約的條款不包括租金上漲、或有租金、續簽或購買期權。
截至十二月三十一日、2015、2016及2017年度的經營租契所需租金分別為33元、136元及200元。
下表彙總了截至2017年度12月31日業務租約下的未來最低租賃付款:
|
$
|
||||
|
至2018年月31止
|
66
|
|||
特許權使用費
作為賣方獲得不包括中華人民共和國和香港在內的普林布林全球專利的部分考慮,萬春生物技術公司必須按季度支付特許權使用費,相當於產品銷售總收入的20%,從十年來的首次商業銷售開始。
2015年月2日,該公司、萬春生物技術公司和富通顧問有限責任公司以轉讓給萬春生物技術公司的普林布林專利的前利害關係方的代理身份,簽訂了終止此類特許權使用費支付安排的協議。終止協議將在公司在美國的首次公開募股完成後生效。如果IPO在協議日期後三年內完成,公司必須在IPO前向賣方指定的單個公司實體發行和分配相當於公司在IPO前全部稀釋股本10%的普通股。與2017年底完成的納斯達克資本市場首次公開募股有關,公司向賣方指定的實體Nereus Trust發行了2,112,963股普通股,並終止了特許權使用費支付安排。這種作為研究和開發費用獲得和支出的專利的費用為42 259美元,這是根據這種已發行普通股的公允價值每股20美元確定的。
F-27