clvs_Current_Folio_10K
美國
證券交易委員會
華盛頓特區20549
表格10-K
根據1934年度證券交易所第13或15(D)條提交的年報。
截至12月31日的財政年度,2017。
☐根據1934年度證券交易所條例第13或15(D)條提交的過渡報告。
的過渡時期。
佣金檔案號碼:001-35347
克洛維斯腫瘤學公司
(註冊人的確切名稱,一如其章程所指明者)
|
特拉華州
|
|
90-0475355
|
|
(國家或其他司法管轄區)
成立為法團或組織)
|
|
(I.R.S.僱主)
(識別號)
|
|
|
|
|
|
5500 Flatiron Parkway套房100
科羅拉多州博爾德
|
|
80301
|
|
(主要行政辦公室地址)
|
|
(郵政編碼)
|
(303) 625-5000
(登記人的電話號碼,包括區號)
根據該法第12(B)條登記的證券:
|
每一班的職稱
|
|
|
|
普通股票面價值每股0.001元
|
|
納斯達克全球精選市場
|
根據該法第12(G)條登記的證券:無
請按“證券法”第405條的定義,以勾選標記表示註冊人是否為知名的經驗豐富的發行人。是的,沒有☐。
如果註冊人不需要根據該法第13條或第15(D)條提交報告,請用複選標記表示。是的,☐否。
Indicate by check mark whether the registrant (1) has filed all reports required to be filed by Section 13 or 15(d) of the Securities Exchange Act of 1934 during the preceding 12 months (or for such shorter period that the registrant was required to file such reports), and (2) has been subject to such filing requirements for the past 90 days. Yes No ☐
Indicate by check mark whether the registrant has submitted electronically and posted on its corporate web site, if any, every Interactive Data File required to be submitted and posted pursuant to Rule 405 of Regulation S-T (§ 232.405) of this chapter) during the preceding 12 months (or for such shorter period that the registrant was required to submit and post such files). Yes 無☐
請以支票標記表示,如根據規例S-K第405項披露逾期提交人的資料不在此,而據註冊人所知,亦不會載於本表格10-K第III部所提述的最終委託書或資料陳述內,或本表格10-K.☐的任何修訂內。
通過檢查標記表明註冊人是大型加速備案者、加速備案者、非加速備案者、較小的報告公司還是新興的增長公司。參見“外匯法案”第12b-2條規則中“大型加速備案者”、“加速申報人”、“較小報告公司”和“新興增長公司”的定義。
|
大型加速箱
|
|
加速過濾器
|
☐
|
|
|
|
|
|
|
非加速過濾
|
☐(不要檢查是否有一家較小的報告公司)
|
小型報告公司
|
☐
|
|
新興成長型公司
|
☐
|
|
|
如果一家新興成長型公司,請用支票標記表明註冊人是否選擇不使用延長的過渡期來遵守根據“外匯法”第13(A)條規定的任何新的或經修訂的財務會計準則。
用複選標記表明註冊人是否是空殼公司(如“交易法”第12b-2條所定義)。是的,☐否。
The aggregate market value of the registrant’s common stock, par value $0.001 per share, held by non-affiliates of the registrant on June 30, 2017, the last business day of the registrant’s most recently completed second quarter, was $4,220,084,525 based on the closing price of the registrant’s common stock on the NASDAQ Global Market on that date of $93.63 per share.
截至2018年2月21日,註冊人普通股的流通股數量為50,573,183股,面值為每股0.001美元。
以參考方式合併的文件Portions of the registrant’s definitive proxy statement to be filed with the Securities and Exchange Commission pursuant to Regulation 14A in connection with the registrant’s 2017 Annual Meeting of Stockholders, which is to be filed within 120 days after the end of the registrant’s fiscal year ended December 31, 2017, are incorporated by reference into Part III of this Annual Report on Form 10-K to the extent stated therein.
目錄
|
|
|
頁
|
|
第一部分
|
|
|
|
項目1.
|
商業
|
3
|
|
項目1A。
|
危險因素
|
29
|
|
項目1B。
|
未解決的工作人員意見
|
53
|
|
項目2.
|
特性
|
53
|
|
項目3.
|
法律訴訟
|
53
|
|
項目4.
|
礦山安全披露
|
55
|
|
第二部分
|
|
|
|
項目5.
|
註冊人普通股市場、股東相關事項及發行者購買權益證券
|
56
|
|
項目6.
|
選定的財務數據
|
58
|
|
項目7.
|
管理層對財務狀況及經營成果的探討與分析
|
60
|
|
項目7A.
|
市場風險的定量和定性披露
|
74
|
|
項目8.
|
財務報表和補充數據
|
75
|
|
項目9.
|
會計和財務披露方面的變化和與會計師的分歧
|
75
|
|
項目9A.
|
管制和程序
|
75
|
|
項目9B.
|
其他資料
|
78
|
|
第III部
|
|
|
|
項目10.
|
董事、執行主任及公司管治
|
78
|
|
項目11.
|
行政薪酬
|
78
|
|
項目12.
|
某些受益所有人的擔保所有權、管理層和相關股東事項
|
78
|
|
項目13.
|
某些關係和相關交易,以及董事獨立性
|
78
|
|
項目14.
|
主要會計費用和服務
|
78
|
|
第IV部
|
|
|
|
項目15.
|
展品及財務報表附表
|
79
|
|
|
簽名
|
83
|
第一部分
這份以表格10-K提交的年度報告和這裏引用的信息包括那些是或可能被認為是“前瞻性報表”的陳述。在某些情況下,這些前瞻性陳述可以通過使用前瞻性術語來識別,包括“相信”、“估計”、“預期”、“預期”、“計劃”、“打算”、“可能”、“可能”、“可能”、“將”、“應該”、“大約”,或者,在每種情況下,它們的負面或其他變體或可比較的術語,雖然並非所有前瞻性陳述都包含這些詞語.They appear in a number of places throughout this Annual Report on Form 10-K and include statements regarding our intentions, beliefs, projections, outlook, analyses or current expectations concerning, among other things, the market acceptance and commercial viability of our approved product, the development of our sales and marketing capabilities, the performance of our third party manufacturers, our ongoing and planned non-clinical studies and clinical trials, the timing of and our ability to make regulatory filings and obtain and maintain regulatory approvals for our product candidates, including our ability to confirm the clinical benefit of our approved product through confirmatory trials and other post-marketing requirements, the degree of clinical utility of our products, particularly in specific patient populations, expectations regarding clinical trial data, expectations regarding sales of our products, our results of operations, financial condition, liquidity, prospects, growth and strategies, the 我們經營的行業,包括我們的競爭,以及可能影響到我們或行業的趨勢。
就其性質而言,前瞻性陳述涉及風險和不確定性,因為它們涉及事件、競爭動態和行業變化,並取決於未來可能發生或不可能發生的經濟情況,或可能發生在比預期更長或更短的時間內。我們警告您,前瞻性報表並不能保證未來的業績,而且我們的實際運營結果、財務狀況和流動性以及我們所經營的行業的發展可能與本文所載的前瞻性報表大不相同。
我們在10-K表格的年度報告中所作的任何前瞻性陳述,只在該報表的日期為止,我們沒有義務更新這些報表,以反映本年度10-K表年度報告日期之後發生的事件或情況,或反映意外事件的發生。對於所有前瞻性的陳述,我們主張保護安全港,因為前瞻性聲明包含在1995的“私人證券訴訟改革法”中。
您還應仔細閲讀本年度報表10-K中“風險因素”一節中描述的因素,以更好地理解我們業務中固有的風險和不確定性,以及任何前瞻性報表的基礎。不過,我們建議你在我們的季度報告表格10-Q、表格8-K的當前報告和我們的網站中查閲我們對相關主題的任何進一步披露。
克洛維斯腫瘤學®、Clovis徽標和Rubra是Clovis腫瘤公司在美國和其他選定國家的商標。本報告中出現的所有其他品牌名稱或商標均為其各自持有人的財產。除非上下文另有要求,本報告中提到的“Clovis”、“Company”、“we”、“us”和“Our”指的是Clovis腫瘤公司及其合併子公司。
項目1.商業
概述
我們是一家生物製藥公司,致力於在美國、歐洲和其他國際市場獲取、開發和商業化創新的抗癌藥物。我們的發展計劃旨在治療癌症患者的特定亞羣,同時與合作伙伴一起開發診斷工具,將發展中的化合物導向最有可能從其使用中受益的人羣。
Our marketed product Rubraca® (rucaparib) is approved on an accelerated basis in the United States by the Food and Drug Administration (“FDA”) as monotherapy for the treatment of patients with deleterious BRCA (human genes associated with the repair of damaged DNA) mutation (germline and/or somatic) associated advanced ovarian cancer who have been treated with two or more chemotherapies, and selected for therapy based on an FDA-approved companion diagnostic for Rubraca.這一適應症的持續批准可能取決於驗證和説明驗證性試驗的臨牀效益。為此,我們於2016在美國推出了魯布拉。
FDA目前正在優先審查我們用於Rubra的補充新藥應用程序(SNDA),作為對複發性上皮性卵巢、輸卵管或原發性腹膜癌患者的維持治療,這些患者對鉑基化療有完全或部分反應。
我們的營銷授權申請(“MAA”)提交給歐洲聯盟歐洲藥物管理局(“EMA”),用於治療Rubra卵巢癌的指示,目前正在由EMA的人類使用藥物產品委員會(CHMP)進行審查。繼科學諮詢小組-腫瘤學會議和我們在2月份的CHMP會議上所作的口頭解釋之後,CHMP傳達了對MAA的積極趨勢投票,以及他們打算在3月#number1#會議上就治療指標進行最後表決。
Beyond our labeled indication, we have a robust Rubraca clinical development program underway in a variety of solid tumor types, also including prostate and bladder cancers, and in July 2017, we entered into a broad clinical collaboration with Bristol-Myers Squibb Company to evaluate the combination of their immunotherapy Opdivo® (nivolumab) with Rubraca in several tumor types.我們擁有全世界範圍的權利。
In addition, we have two other product candidates: lucitanib, an oral inhibitor of the tyrosine kinase activity of vascular endothelial growth factor receptors (“VEGFR”) 1-3, platelet-derived growth factor receptors (“PDGFR”) alpha and beta and fibroblast growth factor receptors (“FGFR”) 1-3, and rociletinib, an oral mutant-selective inhibitor of epidermal growth factor receptor (“EGFR”). While 我們已經停止了正在進行的每一個候選人的試驗,我們繼續為臨牀醫生推薦繼續治療的患者提供藥物。我們維護着盧西坦的某些發展和商品化權利,以及羅西替尼的全球發展和商業化權利。
克洛維斯成立於2009。我們已經建立了我們的組織,以支持創新的腫瘤藥物開發,用於治療癌症人羣的特定亞羣。為實施我們的戰略,我們組建了一支經驗豐富的團隊,在全球臨牀和非臨牀開發、管理操作和腫瘤學商業化方面具有核心競爭力,並與專門從事配套診斷開發的公司建立合作關係。
一種PARP抑制劑
概述
Rubra(Rucaparib)是一種口服的小分子聚ADP-核糖聚合酶(PARP)抑制劑PARP 1,PARP 2和PARP 3。我們於2011年6月從輝瑞公司獲得了魯布拉的許可.在美國,fda批准rubra用於治療使用過兩種或兩種以上化療藥物的惡性BRCA突變(生殖線和/或體細胞)相關晚期卵巢癌患者,並被FDA批准的Rubra輔助診斷所選擇。該指示是根據FDA基於客觀應答率和持續時間的加速批准計劃批准的,並基於兩個多中心、單臂、開放標籤臨牀試驗的結果。繼續批准這一指示可能取決於驗證和描述的臨牀效益在ARIEL3和/或ARIEL4,我們的驗證性試驗。FoundationFocus™cdx是由fda批准的,並在商業上可用於選擇在此適應症中使用Rubra治療的患者,該公司已經開發了兩種配套診斷方法:FoundationFocusCDX。BRCA並創建一個CDX™。
在去年10月,我們提交了一份用於維持治療複發性上皮性卵巢、輸卵管或原發性腹膜癌患者的rubra snda,這些患者對鉑基化療有完全或部分反應。在2017,fda接受了我們的snda的魯布拉,並給予優先審查地位的申請與處方藥免費法案(“PDUFA”)的目標日期為4月6日,2018。如果獲得批准,我們預計診斷測試將不需要病人在這個維修治療的指示處方魯布拉。我們在美國大約有150名實地工作人員,這些商業和醫療事務組織將支持魯布拉號的商業發射,如果在這種擴大的維修治療指示中得到批准的話。
在2017年間,在美國批准了另外兩種PARP抑制劑後,美國迅速採用了卵巢癌的第二線維持治療模式。如果在這種情況下魯布拉獲得批准,而不需要ariel 3數據所支持的診斷測試,那麼就有可能解決患者羣體的問題。
大約四倍於我們最初的利基治療適應症,它僅限於在第三行與BRCA突變的卵巢癌婦女。BRCA突變被認為發生在大約25%的卵巢癌婦女身上。
我們提交給EMA的卵巢癌治療指示的MAA目前正在審查中。繼科學諮詢小組-腫瘤學會議和2月份的CHMP口頭解釋之後,CHMP通知我們,他們舉行了MAA的趨勢投票,結果是積極的。CHMP還向我們傳達了他們打算在2018的會議上就治療方案進行最後表決的意向。該委員會的趨勢投票在最後一票方面對該委員會沒有約束力。目前CHMP正在考慮的指標集中在鉑敏感卵巢癌的一個子集,在那裏有特殊的未滿足的需求。如果魯布拉在3月得到CHMP的好評,歐盟委員會可能會在2018第二季度批准。如果批准的治療指示,我們打算提交一個變化的營銷授權(“MA”),用於維持治療的成人患者複發性上皮性卵巢,輸卵管,或原發性腹膜癌,誰是一個完全或部分反應鉑基化療,對此,我們預計可能會在2018第四季度的意見。歐洲藥品管理局的孤兒藥品委員會(“COMP”)將於2018年3月舉行會議,審查併發布關於我們申請維持作為MAA審查進程一部分提交的魯布拉孤兒藥物指定的最後意見。雖然魯布拉目前在歐盟擁有孤兒藥物的稱號,但沒有人保證COMP會在批准後維持這種指定。如果對治療指示有負面意見,我們希望在2018第二季度提出一份新的維修處理指示。如果在歐盟獲得批准,我們打算自己將魯布拉商業化,我們正在歐洲建立商業和醫療基礎設施。這些小組的領導已經到位,我們打算在作出定價和償還決定並獲得批准時僱用外地銷售人員。
PARP抑制在腫瘤治療中的作用
人體內的細胞不斷受到可能對dna造成損害的物質的攻擊,包括陽光和其他形式的輻射,以及可引起dna組成變化的dna結合化學物質。細胞已經進化出多種機制來實現這種DNA修復,這些機制是相輔相成的,每一種機制都驅動修復特定類型的DNA損傷。如果一個細胞的DNA損傷修復系統被淹沒,那麼這個細胞就會死於一種叫做凋亡的自殺。癌症治療的一個基本原則是通過輻射或DNA結合藥物(如烷化劑或鉑類)對細胞造成嚴重損害,從而誘導細胞凋亡,進而導致癌細胞死亡。在細胞中活躍的多種DNA修復機制可能降低這些抗癌治療的活性。
PARP家族由17個結構相關的蛋白質組成,這些蛋白質都是根據序列相似性來鑑定的。PARP 1、PARP 2和PARP 3在DNA修復中起中心作用。它們被迅速地招募到DNA損傷的部位,並催化額外蛋白質的合成,從而開始修復受損的DNA。乳腺癌1(BRCA 1)和乳腺癌2(BRCA 2)基因在DNA修復途徑中也有重要作用,如同源重組。根據國家癌症研究所,BRCA 1和BRCA 2突變與卵巢癌、乳腺癌、前列腺癌和胰腺癌的風險增加有關。
Rubra是PARP酶的抑制劑,包括PARP 1、PARP 2和PARP 3。PARP抑制劑在BRCA 1/2突變體和同源重組(HR)細胞中表現出活性,其修復機制被稱為合成致命性,即細胞死亡需要兩個基因/途徑的丟失。在BRCA突變等潛在基因缺陷背景下,PARP抑制劑對修復途徑的抑制/失活通過積累未修復的DNA損傷導致腫瘤細胞死亡。
除了BRCA 1/2之外,DNA修復基因的改變在卵巢癌、乳腺癌、前列腺癌和胰腺癌中已經被觀察到,並可能導致遺傳風險。PARP抑制劑已經顯示了非BRCA HR基因改變的腫瘤的非臨牀和臨牀活性的證據。基因和表觀遺傳改變導致的DNA修復缺陷可能導致“BRCA樣”表型,這也可能使腫瘤細胞對PARP抑制劑敏感。一種鑑定因brca或其他非BRCA HR基因突變而導致dna修復缺陷的方法是評估雜合性丟失(“LOH”),或評估一個基因的正常拷貝的丟失,該基因在HR受損時由易出錯的dna修復途徑引起。
在這些科學觀察的基礎上,我們初步開發了Rubra在有BRCA突變或其他同源重組缺陷的卵巢癌患者(“HRD”)中。這些分子標記物也可用於選擇其他腫瘤患者進行Rubra治療。因此,除卵巢試驗外,開放供登記的或正在考慮進一步評估魯布拉的研究,無論是單獨還是與其他藥物結合,包括前列腺、乳腺、胰腺、膀胱、胃食道癌和肺癌。
魯布拉臨牀進展
我們正在為選定的病人羣體開發Rubra,並與合作伙伴合作進行相應的診斷開發。我們對Rubra的開發策略集中在我們認為患者羣體表現出更高頻率的突變BRCA腫瘤或HRD的適應症上,在那裏PARP抑制劑已經在腫瘤中顯示出臨牀或臨牀前活性。在其中某些審判中,我們或我們的合作伙伴將能夠定期或持續地獲得臨時數據,這些數據不會在我們獲得或完全可以獲得的同一時間框架內公開提供。下表概述了克洛維斯或合作伙伴資助的研究:
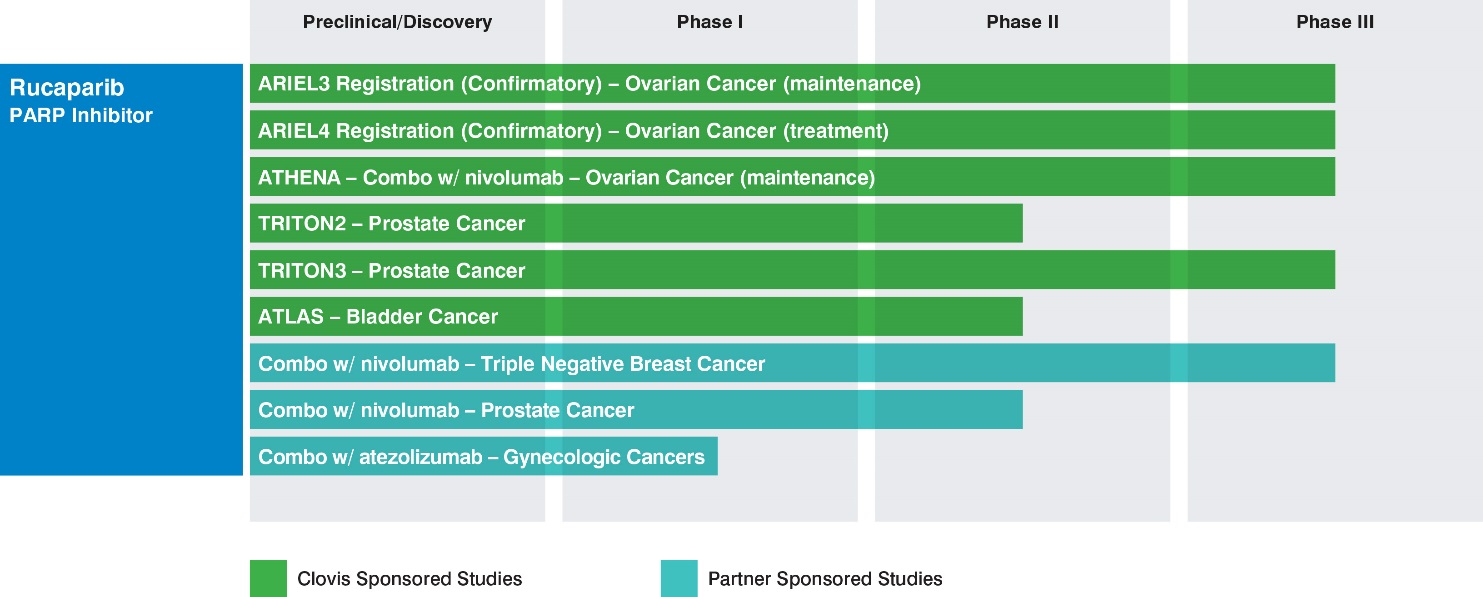
卵巢癌
據美國癌症協會(AmericanCancerSociety)估計,在2017年間,美國有超過2.2萬名女性被診斷患有卵巢癌,而根據格洛博康(GLOBOCAN)在2012年間的數據,據估計,歐洲每年有65,000多名女性被診斷患有卵巢癌,其中卵巢癌是死亡率最高的癌症之一。大約80%至85%的卵巢癌病例沒有診斷,因此仍未得到治療,直到疾病擴散到身體的其他部位,或轉移。大多數卵巢癌患者在手術和/或化療後會復發。根據一篇發表在以下文章中,BRCA突變,無論是生殖系還是體細胞,都被認為發生在大約25%的患卵巢癌的婦女中。臨牀癌症研究在2014。
艾瑞爾(A論文R卡帕瑞布IN卵巢癌Er TriaL)是一個新的,綜合的翻譯-臨牀計劃,旨在準確和前瞻性地識別卵巢癌患者與受益於Rubra治療相關的腫瘤基因型。
ARIEL2(NCT 01891344)是一項由兩部分組成的單臂開放標記研究,旨在識別預先指定的腫瘤特徵,通過DNA測序來預測對Rubra的敏感性,以評估每個患者的腫瘤。第1部分研究對象為204個鉑敏感患者,並於2016年6月公佈最新結果.第二部分納入286例晚期卵巢癌患者,他們至少接受了三種化療方案,包括鉑敏感、耐藥和難治性患者。ARIEL2是通過前瞻性地定義基因組信號來評估被分類為分子定義亞組的患者的臨牀反應,包括生殖系BRCA-突變體、體細胞BRCA-突變體和HRD。
對106例ARIEL2和研究10例(nCT 01482715,一種多中心,單臂,Rubra開放式臨牀試驗)的晚期BRCA患者進行了Rubra在卵巢癌治療中的療效評價。
經過兩次或更多次化療後進展的突變型卵巢癌。中位年齡59歲,既往化療方案中位數3例。106例患者均給予Rubra 600 mg,每日2次。兩項試驗的主要療效結果是客觀有效率(ORR)和反應持續時間(DOR),由研究者根據實體腫瘤反應評估標準(RECIST)1.1版進行評估。所有答覆均得到確認。調查人員評定OR為54%(95%可信區間,或CI:44,64),DOR中位數為9.2個月(95%CI:6.6,11.6)。經獨立放射學檢查,OR為42%(95%:32,52),DOR中位數為6.7個月(95%CI:5.5,11.1)。
在晚期卵巢癌治療環境中,Rubra的總體安全性評估是基於來自ARIEL2和研究10的377例卵巢癌患者的數據。最常見的不良反應(≥20%,1~4級)為噁心、乏力/疲勞、嘔吐、貧血、便祕、便祕、食慾減退、腹瀉、腹痛、血小板減少和呼吸困難。最常見的實驗室異常(≥35%,1~4級)是肌酐升高,天冬氨酸轉氨酶(AST)升高,丙氨酸轉氨酶(ALT)升高,血紅蛋白下降,淋巴細胞減少,膽固醇升高,血小板減少,中性粒細胞絕對計數下降。ALT/AST濃度的升高通常是自我限制的,與其他肝臟毒性症狀無關。Rubra要求在基線時監測完整的血液計數,此後每月進行監測。最常見的3-4級不良反應是貧血,最常見的3-4級實驗室異常是血紅蛋白下降。在接受Rubra治療的377例卵巢癌患者中,有2例報告了骨髓增生異常綜合徵/急性髓系白血病(MDS/AML)。這兩位患者都曾接受過鉑和其他DNA損傷劑的治療。此外,兩份報告(
)也報告了AML。
這兩項研究的數據構成了我們在2016年底向美國食品藥品管理局提交一份新藥物申請(“nda”)的基礎。The application was granted priority review and approved under FDA’s accelerated approval program on December 19, 2016 as monotherapy for the treatment of patients with deleterious BRCA mutation (germline and/or somatic) associated advanced ovarian cancer, who have been treated with two or more chemotherapies, and selected for therapy based on an FDA-approved companion diagnostic for Rubraca. Continued approval for this indication may be contingent upon verification and description 在ARIEL3和/或ARIEL4中的臨牀益處,我們的驗證性試驗。
The efficacy of Rubraca in the ovarian cancer maintenance treatment setting was investigated in ARIEL3 (NCT01968213), a double-blind, multicenter clinical trial in which 564 patients with recurrent epithelial ovarian, fallopian tube, or primary peritoneal cancer who were in response to platinum-based chemotherapy were randomized (2:1) to receive Rubraca tablets 600 mg orally twice daily (n=375) or placebo (n=189).治療一直持續到疾病進展或無法接受的毒性。所有患者都對他們最近的鉑基化療(完全或部分)有了反應。隨機分組是根據對最後一次白金(完全或部分)的最佳反應,倒數第二次鉑治療後的進展時間(6到
)來分層的。
The primary efficacy analysis evaluated three prospectively defined molecular sub-groups in a step-down manner: 1) tumor BRCA mutant (tBRCAmut) patients, inclusive of germline and somatic BRCA mutations (n=196); 2) HRD patients, including tBRCAmut patients and BRCA wild-type with high LOH (n=354), and, finally, 3) the intent-to-treat population, or all patients treated in ARIEL3 (n=564).ARIEL3顯示,與安慰劑相比,隨機服用Rubra患者的PFS在所有患者以及HRD和tBRCAmut亞組中均有顯著改善。tBRCAmut組PFS中位數為16.6個月(95%CI:13.4~22.9),而安慰劑組為5.4個月(95%CI:3.4~6.7)(危險比或HR:0.23)。[95%CI:0.16-0.34];p[95%CI:0.24-0.42];p[95%CI:0.30-0.45]]; p
盲目的獨立放射學檢查(BICR)的結果是一致的。In a pre-specified analysis of the key stand-alone secondary endpoint of progression-free survival assessed by BICR, PFS was also improved in the Rubraca group compared with placebo in all three populations. Median PFS in the tBRCAmut patients was 26.8 months (95% CI: 19.2 to not reached) in the Rubraca group versus 5.4 months (95% CI: 4.9–8.1) in the placebo group (HR: 0.20[95%
CI:0.13-0.32];p[95%CI:0.24-0.47]; p[0.28–0.45]; p
ARIEL3的註冊對象包括對其先前的白金療法完全有反應的三分之一的患者和對其先前的白金治療有部分反應的三分之二的患者。在有部分應答的患者中,37%的人在登記時患有可測量的疾病,因此可對其進行評估。經RECISTv1.1評定的tBRCAmut治療組總有效率為37.5%(15/40),其中17.5%(7/40)為完全應答。與安慰劑組9%(2/23)相比,P=0.0055。tBRCAmut安慰劑組未見完全反應。BRCA野生型HRD陽性和BRCA野生型HRD陰性亞組也有RECIST反應.RECIST的反應沒有通過獨立的盲目審查進行評估。
ARIEL3的安全數據與先前的Rubra研究結果一致。ARIEL3Rubra組的治療緊急不良事件(“TEAES”)通常是通過劑量調整來管理的,與安慰劑組相比沒有增加死亡率或發病率。The most common (occurring in ≥5% of patients) TEAEs of grade ≥3 reported in patients treated with Rubraca in the ARIEL3 study were anemia/decreased hemoglobin (21%), increase in ALT/AST (10%), neutropenia (7%), asthenia/fatigue (7%) and thrombocytopenia (5%).TEAES(不包括疾病進展)的終止率,Rubra治療組為15%,安慰劑組為2%。在ARIEL3中,Rubra手臂的緊急骨髓增生異常綜合徵(MDS)/急性髓系白血病(AML)的治療率為
。
在對PFS進行分析時,總的生存率(OS)數據還不成熟(佔22%)。ARIEL3的綜合數據集是在2017月初舉行的2017屆歐洲醫學腫瘤學會(ESMO)大會上提出的,隨後發表在柳葉刀.
基於ARIEL3數據,我們在10月份提交了一份補充的nda,作為對複發性上皮性卵巢、輸卵管或原發性腹膜癌患者進行維持治療的補充,這些患者對鉑基化療有完全或部分反應。該申請被FDA授予優先審查地位,並有一個PDUFA日期為4月6日,2018。
ARIEL4驗證性研究(NCT 02855944)是一項第三階段的多中心隨機研究,對復發的BRCA突變患者(包括生殖細胞株和/或體細胞)進行Rubra和化療的研究。研究的主要終點是PFS。
由我們贊助的第一階段Ruca-J研究,最近在日本第一位服用Rubra的病人開始。第一階段的研究試圖確定在日本病人中推薦的魯卡帕瑞布的劑量。
前列腺癌
美國癌症協會(AmericanCancerSociety)估計,到2018,美國將有超過16.4萬名男性被診斷患有前列腺癌,而GLOBOCAN癌症概況介紹估計,2012年間,歐洲約有345,000名男性被診斷患有前列腺癌。去勢耐藥前列腺癌有很高的可能性發生轉移。轉移性去勢耐藥前列腺癌(Mcrpc)是一種不治之症,通常與預後不良有關.根據美國癌症協會的數據,mCRPC的5年生存率約為29%.根據發表在mcrpc中的一篇文章,brca、atm和其他dna修復基因的生殖細胞或體細胞突變被認為在mcrpc中以20%或更高的頻率出現。JCO精密腫瘤學在2017。這些分子標記可能被用來選擇病人使用PARP抑制劑治療。此外,臨牀前對rucaparib的研究表明,在缺乏BRCA或ATM的前列腺癌細胞中有活性。
Triton(T裏亞爾R烏卡帕iB在Pros中t艾特印地安上(S)前列腺癌項目於2016下半年啟動,目前包括兩項克洛維斯贊助的潛在註冊研究,目前開放供註冊:
|
·
| |
The TRITON2 study (NCT02952534), a Phase 2 single-arm study of Rubraca in men with mCRPC enrolling patients with BRCA mutations and ataxia-telangiectasia mutations, or ATM, (both inclusive of germline and/or somatic) or other deleterious mutations in other homologous recombination repair genes.在去勢的情況下,所有患者在接受一種基於紫杉烷的化療和一到兩種雄激素受體(“AR”)靶向治療後都會有進展。這項研究的主要終點是可測量疾病患者的放射ORR和沒有可測量疾病的患者的蛋白特異性抗原(PSA)應答率。TRITON 2於2016第四季度啟動,中期數據預計將在2018下半年的醫療會議上發佈。TRITON 2的初步完工日期估計為2019的下半年。在獲得積極數據之前,TRITON 2可能成為美國加速批准的基礎。 |
|
·
| |
TRITON 3研究(NCT 02975934)是一項第三階段的比較研究,研究對象為mCRPC登記BRCA突變體和ATM(包括生殖系和/或體細胞)患者,這些患者已經進行AR靶向治療,但尚未在去勢抗性環境中接受化療。TRITON 3將比較魯布拉和醫生選擇AR靶向治療或化療在這些患者。計劃的主要終點是放射學PFS。TRITON 3是在2017第一季度開始的,這一早期的比較研究有可能作為一項在晚期前列腺環境下的驗證性研究。 |
膀胱癌
根據GLOBOCAN癌症概況介紹,截至2012,膀胱癌是美國最常見的六種癌症之一,據美國國家癌症研究所(NationalCancerInstitute)的數據,據估計,2017年間,美國新增膀胱癌病例達7.9萬例。根據美國國家癌症研究所的數據,大約20%到30%的新診斷的膀胱癌患者患有侵犯肌肉的疾病。膀胱肌浸潤癌是一種預後不佳的疾病.一篇發表在雜誌上的文章顯示,這些患者在首次順鉑化療後的總生存期為13-15個月,大多數患者在9個月內復發。歐洲癌症雜誌在2006。在第一、兩行抗癌治療之後,這些患者的選擇是有限的,目前以白金治療為標準。根據對膀胱癌數據集“腫瘤基因組圖譜”(TCGA)的分析,我們認為大約60%的膀胱癌腫瘤具有同源重組修復基因或其他與HRD相關的基因組特徵的改變。
我們在2018的第一季度開始了一項潛在的膀胱癌註冊研究,叫做atla(RUC的一項研究)。a被排斥在Pa中t與...L正眼A舞蹈或梅塔s(泌尿繫上皮癌)。ATLAS (NCT03397394) is a phase 2 single-arm study enrolling patients with relapsed metastatic urothelial carcinoma following one or two prior standard of care regimens, with measurable disease, and no prior PARP treatment. The planned primary endpoint is overall response rate, and the study will enroll all comers, with no selection based on HRD status.在積極的數據之前,我們相信這個試驗設計可以支持所有人羣中的sNDA,而不考慮生物標記物的狀態。
組合試驗
在7月份,我們和布裏斯托爾邁爾斯斯基布公司(“bms”)宣佈了廣泛的臨牀合作,評估魯布拉與bms的免疫療法Opdivo(Nivolumab)在多種腫瘤類型中的結合。目前正在或預計將在2018上半年啟動三項試驗:
|
·
| |
雅典娜研究,晚期卵巢癌的第三階段研究,由克洛維斯贊助; |
|
·
| |
晚期三陰性乳腺癌(TNBC)的第三階段研究,由BMS贊助;以及 |
我們相信臨牀前的理論支持我們的PARP抑制劑Rubra和免疫檢查點抑制劑(如PD-1抑制劑Opdivo)的結合進行臨牀試驗。BRCA 1和BRCA 2及其他HRD突變與腫瘤突變負擔增加有關,這可能會產生額外的腫瘤特異性抗原或“新表位”。腫瘤突變負擔的增加與免疫檢查點阻斷的益處增加有關。此外,由PARP抑制劑誘導的細胞死亡被認為是免疫原性的,並且由於DNA碎裂釋放到胞漿中而刺激了一種“類似於叮咬”的途徑。在老鼠的研究中,魯卡帕利布和一種抗-
Pd-1抗體在BRCA 1突變型卵巢腫瘤中具有抗腫瘤活性.rucaparib和抗PD-L1或抗CTLA-4抗體的結合在臨牀前的研究中同樣引人注目。
ATHENA is a four-arm first-line maintenance treatment study to evaluate Rubraca and Opdivo, Rubraca, Opdivo and placebo in an estimated 1,000 newly diagnosed patients with stage III/IV high-grade ovarian, fallopian tube, or primary peritoneal cancer who have completed platinum-based chemotherapy. The primary objectives are to determine if the combination of Rubraca and Opdivo meaningfully extends PFS versus Rubraca monotherapy, or versus placebo, and to determine if Rubraca extends PFS versus placebo.對研究結果的分析將以一種逐步下降的方式評估tBRCA/HRD和有意治療的亞羣體。我們是贊助商,並將主持和資助雅典娜研究,預計將在2018上半年開始。
Rubra和Opdivo對晚期TNBC患者的聯合研究將由BMS贊助和進行,研究費用由Clovis和BMS分擔。這項研究預計將在2018上半年開始。
mCRPC是一項評估Opdivo+Rubra、Opdivo+多西紫杉醇+潑尼鬆和Opdivo+恩扎路酰胺的三臂研究,目的是確定該組合如何影響客觀有效率和PSA反應。這項研究將納入患者的生物標誌物陰性或陽性的疾病,並將使用腫瘤組織樣本,以確定生物標誌物的地位。BMS贊助、實施和資助2017第四季度在mCRPC開展的300名患者研究。
In addition, a Phase 1b study (WO39409; NCT NCT03101280) sponsored by Hoffman-La Roche (Genentech) is underway evaluating the combination of cancer immunotherapy Tecentriq® (atezolizumab; anti-PDL1) and Rubraca for the treatment of advanced gynecological cancers and TNBC in patients with a tumor BRCA or HRD mutation. This study began enrolling patients in the first half of 2017.
同伴診斷學
我們與基金會醫藥公司合作,共同開發一種配套的診斷測試,fda批准FoundationFocus™cdx。BRCA目的:選擇卵巢癌治療適應證中的Rubra進行治療。FoundationFocus CDXBRCA是一種下一代測序(NGS)方法,用於評估卵巢癌患者腫瘤組織標本中的腫瘤BRCA突變。
2017,11月30日,基金會宣佈批准其對實體腫瘤的綜合配套診斷試驗,FoundationOne™CDX,一種基於NGS的體外診斷設備,用於檢測324個基因的替換、插入和缺失改變、拷貝數的改變和選擇基因重排,以及包括微衞星不穩定性和腫瘤突變負擔在內的基因組標記。該試驗評估的基因包括BRCA 1/2,FoundationOne™CDX被批准為輔助診斷,用於選擇在晚期卵巢癌治療中使用Rubra治療的患者。
作為我們與基金會合作的一部分,我們還開發了一種NGS試驗,用於診斷腫瘤樣本中的基因組LOH,該生物標記物有可能擴大Rubra在卵巢癌和其他適應症中的臨牀應用範圍,這項試驗名為FoundationFocus™cdx。BRCA HRD在ARIEL3研究中,用試驗來評估腫瘤患者的HRD狀態。
我們還與Myriad Genetics公司建立了診斷合作伙伴關係。(“myriad”)支持與Rubra最初批准卵巢癌治療相關的營銷後監管承諾。萬通將在其現有的PMA下提交一份補充的市場前批准(“SPMA”)申請BRACAnalysisCDX,以包括Rubra。BRACAnalysisCDX是Myriad的血液檢測方法,用於BRCA 1/2基因的種系突變的定性檢測和分類。
-a VEGFR,PDGFR和FGFR抑制劑
葡聚糖是血管內皮生長因子受體(VEGFR)1-3、血小板源性生長因子受體(PDGFR)α、β和成纖維細胞生長因子受體(FGFR)1-3酪氨酸激酶活性的一種口服抑制劑。此前曾對乳腺癌和肺癌進行過評估。這些適應症的發展已經停止,我們繼續向臨牀醫生建議繼續使用利西坦治療的病人提供藥物。我們正在繼續評估,如果有的話,將進一步發展利維坦。我們擁有在美國和日本的開發和商業化權利,並擁有歐洲和世界其他市場(不包括中國)對Servier的轉授權。
口服EGFR突變體選擇性抑制劑羅西替尼
羅西替尼是一種口服突變選擇性的表皮生長因子受體抑制劑(EGFR)。我們終止了所有贊助的臨牀研究的註冊,儘管我們繼續為臨牀醫生推薦繼續使用羅西汀治療的患者提供藥物。我們正在繼續分析羅西替尼的數據,以確定某些人羣的患者是否為一個致力於進一步臨牀發展的夥伴提供了一個機會。我們擁有羅西替尼的全球發展和商業化權利。
競爭
新藥的開發和商業化具有競爭性,我們面臨着來自世界各地主要製藥和生物技術公司的競爭。我們的競爭對手可能開發或銷售比我們已經或將要商業化的任何產品或其他新技術或其他更有效、更安全或更便宜的技術,或可能比我們獲得批准的速度更快地獲得對其產品的管制批准。
收購或發放藥品許可證也具有很強的競爭力,一些比較成熟的公司承認了許可或獲得產品的戰略,它們可能比我們具有競爭優勢,其他新興公司也可能採取類似或不同的方式進行產品收購。我們的許多競爭對手的財力、技術和人力資源遠遠超過我們。製藥業的更多合併和收購可能導致更多的資源集中在我們的競爭對手身上。由於技術在商業上的適用性方面取得的進展以及在這些領域投資的資本更多,競爭可能會進一步加劇。我們的成功在一定程度上取決於我們建立和積極管理一系列藥物的能力,這些藥物能夠解決未得到滿足的醫療需求,並在病人治療中創造價值。
魯布拉競賽
Lynparza/olaparib(AstraZeneca)是第一個上市的PARP抑制劑,已在美國獲得批准,有以下跡象:
|
·
| |
作為一種單一治療方法,治療有有害或可疑有害生殖細胞株BRCA突變(GBRCAm)晚期卵巢癌的成人患者,這些患者曾接受過三種或三種以上的化療; |
|
·
| |
作為維持治療成人複發性上皮、輸卵管或原發性腹膜癌患者的單一療法,他們對鉑基化療有完全或部分反應;以及 |
|
·
| |
人表皮生長因子2(HER 2)陰性轉移性乳腺癌,在新輔助、輔助或轉移的環境下接受化療,作為對有害或可疑的gBRCAm患者的單藥治療。 |
Lynparza被歐盟批准用於維持對鉑敏感的復發BRCA突變(生殖線和/或體細胞)高級別漿液性卵巢上皮、輸卵管或原發性腹膜癌患者的維持治療,他們對鉑基化療有反應(完全反應或部分反應)。在2018,CHMP採納了一個積極的意見,建議改變這個標籤,並擴大其使用範圍,以消除BRCA變異患者的使用限制。林帕薩在57個國家有卵巢癌的跡象(截至2017年底)。
在2017,阿斯利康和默克公司宣佈了一個全球戰略腫瘤學合作,共同開發和共同商業化林帕薩多種癌症類型。Lynparza正被單獨調查,並與其他藥物結合,在包括乳腺癌、前列腺癌和胰腺癌在內的多種腫瘤類型的多種適應症中進行研究。
Zejula/niraparib(Tesaro)於2017在美國獲得批准,用於維持成人卵巢上皮癌、輸卵管或原發性腹膜癌患者對鉑類化療的完全或部分反應。澤朱拉於11月在歐盟獲得批准,以獲得同樣的指示。對Zejula在卵巢癌、乳腺癌和肺癌中的其他臨牀研究正在進行或計劃中。Janssen生物技術公司擁有專門為全世界前列腺癌患者開發和商業化尼拉培林的權利,但在日本除外。
在臨牀開發中有許多PARP抑制劑,包括AbbVie‘s veliparib和ABT-767,輝瑞的他拉唑帕林,北基因的BGB-290和檢查點治療學的CK-102。雖然大多數PARP抑制劑的開發主要集中在卵巢癌、乳腺癌和前列腺癌上,但更多的努力也是針對膀胱癌、肺癌和胰腺癌。
此外,包括PARP抑制劑,包括Lynparza或Zejula在內的聯合治療方法與其他抗癌藥物在不同的腫瘤學適應症中處於不同的臨牀發展階段。這些聯合療法可能會導致未來對Rubra的競爭壓力,並且這些研究的多個數據讀數預計在整個2018及以後。
Outside of the PARP class, Avastin®/bevacizumab is approved in the US for recurrent epithelial ovarian, fallopian tube, or primary peritoneal cancer that is platinum-resistant in combination with paclitaxel, pegylated liposomal doxorubicin, or topotecan, and was approved in December 2016 in the US for recurrent epithelial ovarian, fallopian tube, or primary peritoneal cancer that is platinum-sensitive in combination with carboplatin and paclitaxel or in combination with carboplatin and gemcitabine, followed by Avastin作為單一劑。其他被批准用於晚期卵巢癌的藥物包括化療藥物(例如鉑基雙藥、鉑單藥、非鉑化療等)、Doxil(Janssen)和Hycamtin(諾華)。在臨牀發展中,還有額外的不合格的藥物,可能會對魯布拉構成未來的競爭威脅。
許可證協議
輝瑞公司
在2011,我們與輝瑞公司達成了一項許可協議。(“輝瑞”)獲得獨家的全球權利,開發和商業化的魯布拉。排他性的權利,即使是輝瑞,也是專有的,包括授予轉授許可證的權利。根據許可證協議的條款,我們預先向輝瑞支付了700萬美元,並被要求向輝瑞支付額外的款項,以實現許可證協議所要求的某些發展、管理和銷售里程碑以及銷售特許權使用費。在fda批准魯布拉之前,我們支付了140萬美元的里程碑付款,這些款項被確認為獲得了過程中研發費用。
On August 30, 2016, we entered into a first amendment to the worldwide license agreement with Pfizer, which amends the June 2011 existing worldwide license agreement to permit us to defer payment of the milestone payments payable upon (i) FDA approval of an NDA for 1st Indication in US and (ii) European Commission approval of an MAA for 1st Indication in EU, to a date that is 18 months after the date of achievement of such milestones.如果我們推遲支付這些里程碑款項,我們已同意再支付300萬美元,用於實現每一個里程碑。
#date0#12月19日,美國食品和藥物管理局批准魯布拉作為單一治療方案,用於治療具有有害的BRCA突變(生殖線和/或體細胞)相關的晚期卵巢癌患者,他們已經接受了兩種或更多的化療治療,並根據fda批准的Rubra配套診斷選擇治療。美國食品和藥物管理局的批准導致了75萬美元的里程碑付款輝瑞,根據許可協議的要求,該協議是在2017第一季度。FDA的批准還導致了支付2000萬美元里程碑付款的義務,為此我們選擇推遲付款,同意在FDA批准之日後18個月內支付2 300萬美元。這些付款被確認為無形資產,並在Rubra的估計剩餘使用壽命內攤銷。
根據許可協議,我們有義務使用商業上合理的努力開發和商業化Rubra,我們負責Rubra的所有正在進行的開發和商業化成本。如果達到指定的臨牀研究目標和監管文件、接受和批准,我們需要向輝瑞支付高達6,975萬美元的監管里程碑付款。In addition, we are obligated to make sales milestone payments to Pfizer if specified annual sales targets for Rubraca are met, which relate to annual sales targets of $250.0 million and above, which, in the aggregate, could amount to total milestone payments of $170.0 million, and tiered royalty payments at a mid-teen percentage rate on our net sales, with standard provisions for royalty offsets to the extent we need to 從第三方獲得任何權利,使魯布拉商業化。
除非我們選擇提前終止許可協議,否則與輝瑞的許可協議將一直有效,直到我們對輝瑞的所有特許使用費和再許可收入義務到期為止。If we fail to meet our obligations under the agreement and are unable to cure such failure within specified time periods, Pfizer can terminate the agreement, resulting in a loss of our rights to Rubraca and an obligation to assign or license to Pfizer any intellectual property rights or other rights we may have in Rubraca, including our regulatory filings, regulatory approvals, patents and trademarks for Rubraca.
阿斯利康英國有限公司
在2012,我們與阿斯利康英國有限公司(“阿斯利康”)簽訂了一項許可協議,根據一系列專利和專利申請獲得與Rubra相關的專有權利,這些專利和專利申請要求使用某些適應症的PARP抑制劑治療患者。該許可證使Rubra得以開發和商業化,用於這些專利所聲稱的用途。根據許可協議的條款,我們在協議執行時預付了25萬美元。在2016的第二季度,我們在向阿斯利康支付了30萬美元的里程碑付款後,NDA提交了魯布拉。這些付款被確認為獲得過程中的研發費用.美國食品和藥物管理局於12月19日批准魯布拉,2016最終導致了35萬美元的里程碑付款阿斯利康,根據許可協議的要求。這筆付款被確認為無形資產,並在Rubra的估計剩餘使用壽命內攤銷。阿斯利康還從魯布拉的淨銷售額中獲得版税。
Advenchen實驗室有限責任公司
2008,“倫理腫瘤學”,S.p.A。(“EOS”)(現稱意大利克洛維斯腫瘤學公司,S.r.l.)與Advenchen實驗室有限公司(“Advenchen”)簽訂獨家許可協議,在全球範圍內開發和商業化利他尼亞,不包括中國。根據實現的年淨銷售額,我們有義務按中個位數的百分比支付Advenchen分級版税。此外,在實施牌照協議的第一及第二項修訂後,我們須向Advenchen支付25%的代價,但不包括特許使用費,以代替協議所列的里程碑義務。根據該協議,我們有義務利用商業上合理的努力來開發至少一種含有利維坦的產品並將其商業化,我們還負責所有剩餘的利維坦b的開發和商業化成本。
除非我們選擇提前終止協議,否則與Advenchen的許可協議將一直有效,直到我們對Advenchen的所有版税義務到期為止。如果我們未能履行我們在協議下的義務,並且無法在規定的時間內糾正這種失敗,Advenchen可以終止該協議,從而導致我們失去了獲得利他尼亞的權利。
LES實驗室
在9月份,EOS與萊斯實驗室服務公司和國際研究機構(統稱“Servier”)簽訂了一項合作和許可協議,根據該協議,EOS將在美國、日本和中國以外的所有國家開發和商業化利他尼亞的專有權利轉授給Servier。作為這些權利的交換,EOS得到了4 500萬€的預付款項。我們有權在實現指定的開發、監管和商業里程碑方面獲得額外付款,總計達100.0百萬€,其中1 000萬€是在2014第一季度收到的。此外,我們有權獲得銷售里程碑付款,如果指定的年度銷售目標的利維坦,其中每一個涉及的年銷售目標為250.0百萬€及以上,這一總額可能達到總額為250.0百萬€。我們還有權獲得版税的百分比,從低到中十幾歲的銷售利己由塞維爾。
我們和Servier正在根據雙方商定的發展計劃開發利維坦。Servier負責€高達8000萬英鎊的所有開發成本。超過€的累計全球開發成本,如果有的話,將在我們和Servier之間平均分攤。在2016的第二季度,我們和Servier同意停止發展用於乳腺癌的利西坦。在2017年間,我們完成了正在進行的開發活動,並從Servier那裏得到了我們開發費用的全額償還。償還款項記作“綜合業務報表”中研究和開發費用的減少。
合作和許可協議將繼續有效,直到Servier對我們的所有專利税義務到期為止,這一義務是根據產品副產品和國家逐個確定的,除非Servier選擇提前終止協議。如果我們未能履行協議規定的義務,並且無法在規定的時間內糾正這種不履行義務,Servier可以終止協議,從而使Servier獲得永久許可,享有利維塔尼的權利。
Celgene公司
在2010,我們與Avila治療公司(現為Celgene公司下屬的Celgene公司(“Celgene”))簽訂了獨家的全球許可協議,以發現、開發和商業化一種EGFR基因產品突變形式的共價抑制劑。根據許可協議,羅西替尼被確定為主要抑制劑候選。我們負責所有非臨牀,臨牀,監管和其他必要的活動,以開發和商業化羅西替尼。
We made an upfront payment of $2.0 million upon execution of the license agreement, a $4.0 million milestone payment in the first quarter of 2012 upon the acceptance by the FDA of our Investigational New Drug (“IND”) application for rociletinib and a $5.0 million milestone payment in the first quarter of 2014 upon the initiation of the Phase II study for rociletinib.在2015的第三季度,我們支付了總額為1,200萬美元的里程碑付款,分別由美國食品和藥物管理局(FDA)和美國食品藥品管理局(EMA)接受了NDA和MAA。我們確認所有在商業批准前的付款都是在過程中的研發費用.
我們有義務支付版税的百分比,從中個位數到低十幾年的年淨銷售額實現。如能達到某些臨牀研究目標及規管申請、接受及批准,我們須額外支付9,800萬元的發展及規管里程碑付款。此外,如果實現了某些年度銷售目標,我們需要支付總額達120.0美元的銷售里程碑付款。
We have full sublicensing rights under the license agreement, subject to our sharing equally with Celgene any upfront payments from any sub-licensing arrangements relating to Japan, or Japan and any one or more of China, South Korea and Taiwan, which we refer to herein as an Asian Partnership, and subject to our paying royalties on sales in Asia equal to the greater of the royalty rates contained in our license 協議或我們從亞洲夥伴關係獲得的版税的50%。
除非我們選擇提前終止許可協議,否則許可協議將一直有效,直到我們對Celgene的所有特許使用費和再許可收入義務到期為止。If we fail to meet our obligations under the agreement and are unable to cure such failure within specified time periods, Celgene can terminate the agreement, resulting in a loss of our rights to rociletinib and an obligation to assign or license to Celgene any intellectual property rights or other rights we may have in rociletinib, including our regulatory filings, regulatory approvals, patents and trademarks for rociletinib.
政府管制
美國政府當局(包括聯邦、州和地方當局)和其他國家的政府當局,除其他外,廣泛管制製藥產品的製造、研究和臨牀開發、營銷、標籤和包裝、儲存、分銷、批准後監測和報告、廣告和促銷、定價和進出口。在獲得監管批准和隨後遵守適當的聯邦、州、地方和外國法規和條例的過程中,需要花費大量的時間和財政資源。此外,不遵守適用的監管要求可能導致,除其他外
物品、警告信、臨牀擱置、民事或刑事處罰、召回或扣押產品、強制令、停牌、部分或全部暫停生產或退出市場。
美國政府條例
在美國,FDA根據“聯邦食品、藥品和化粧品法”(FDCA)及其實施條例對藥物進行監管。毒品也受其他聯邦、州和地方法規的制約。食品和藥物管理局要求的在美國銷售產品候選人的程序通常包括以下幾個方面:
|
·
| |
完成廣泛的非臨牀實驗室測試和非臨牀動物研究,所有這些都是按照FDA的良好實驗室實踐條例進行的; |
|
·
| |
向FDA提交一份IND,在人體臨牀試驗開始之前必須生效,並且必須至少每年更新一次; |
|
·
| |
充分和良好控制的人類臨牀試驗的表現,以建立安全和有效的產品候選每一個建議的指示; |
|
·
| |
向FDA提交一份以NDA形式提出的用於產品初步商業銷售的營銷授權申請,或向FDA提交一份新指示的批准申請,如果該產品已被批准用於另一項指示的話; |
|
·
| |
滿意地完成FDA對生產和測試活性藥物成分(“原料藥”)和成品的生產設施的預批准檢查,以評估現行良好製造做法(“cGMP”)和/或參與臨牀研究的場所是否符合良好的臨牀做法(“gcp”); |
|
·
| |
如林業發展局召開諮詢委員會會議,諮詢委員會的檢討工作便會圓滿完成;及 |
|
·
| |
FDA審查和批准營銷授權申請和產品處方信息之前,任何商業營銷或銷售該藥物的預期用途。 |
IND是從FDA獲得授權,以管理產品候選產品給人類的一種請求。國際開發署提交的報告的中心重點是一般調查計劃和人類研究議定書。IND還酌情包括動物研究或其他人類研究的結果,以及製造信息、分析數據和任何現有的臨牀數據或文獻,以支持產品候選產品的使用。IND必須在人體臨牀試驗開始前生效。IND將在FDA收到後30天自動生效,除非FDA在此之前提出與擬議的臨牀試驗有關的關切或問題,包括擔心人體研究對象將面臨不合理的健康風險。在這種情況下,IND可能處於臨牀擱置狀態,需要推遲擬議的臨牀調查,IND贊助商和FDA必須在臨牀試驗開始之前解決任何懸而未決的關切或問題。因此,提交IND可能會也可能不會導致FDA允許開始臨牀試驗。
臨牀試驗涉及在符合GCP的合格調查人員的監督下,對人體受試者進行藥物候選人的管理,其中包括要求所有研究對象在參與任何臨牀試驗時都必須徵得他們的知情同意。臨牀試驗是根據協議進行的,除其他外,詳細説明瞭研究的目的、用於監測安全的參數和要評估的療效標準。作為IND的一部分,必須向FDA提交每項臨牀試驗的規程和隨後的任何協議修正案。此外,還必須獲得機構審查委員會(“IRB”)的批准,以便每個醫療中心在試驗開始之前進行臨牀試驗,而IRB必須監督研究直到完成。臨牀試驗須遵守中央登記和結果報告要求,如www.clinicaltrials.gov。
對一種藥物的臨牀研究一般分為三個階段。雖然這些階段通常是按順序進行的,但它們可能重疊或合併。調查的三個階段如下:
|
·
| |
第一階段。第一階段包括最初將產品候選產品引入人體。第一階段的臨牀試驗通常是密切監測的,可以在目標疾病或疾病的患者或健康志願者身上進行。這些研究旨在評估產品候選產品在人體中的安全性、劑量耐受性、代謝和藥理作用,以及與增加劑量相關的副作用,並在可能的情況下,獲得有關有效性的早期證據。在第一階段的臨牀試驗中,提供了足夠的信息 |
產品候選的藥物動力學和藥理作用,可用於設計良好的控制和科學上有效的第二階段臨牀試驗。參與第一階段臨牀試驗的總人數各不相同,但一般在20至80人之間。 |
|
·
| |
第二階段。第二階段包括進行對照臨牀試驗,以初步或進一步評估候選產品對所研究疾病或疾病患者的特定適應症的有效性,確定劑量耐受性和最佳劑量,並確定與該藥物有關的可能的副作用和安全風險。第二階段的臨牀試驗通常是嚴格控制的,密切監測,並且在有限的病人羣體中進行,通常不超過幾百人。 |
|
·
| |
第三階段。第三階段臨牀試驗一般是在擴大的病人羣中進行的臨牀試驗,通常在地理上分散的臨牀試驗地點進行。這些研究是在初步證據表明藥物有效後進行的,目的是進一步評估藥物的劑量、臨牀療效和安全性,建立調查藥品產品的總體利益-風險關係,併為產品批准提供充分的依據。第三階段的臨牀試驗通常涉及幾百到幾千名參與者。 |
一項關鍵的研究是一項臨牀研究,它完全符合藥物候選藥物的有效性和安全性評估的監管機構要求,從而可以用來證明產品的批准是合理的。一般來説,關鍵的研究也是第三階段的研究,但如果試驗設計提供了對臨牀益處的良好控制和可靠的評估,特別是在沒有滿足醫療需求的情況下,則可能是第二階段的研究。
FDA、IRB或臨牀試驗發起人可以基於各種理由隨時暫停或終止臨牀試驗,包括研究對象面臨不可接受的健康風險的發現。此外,一些臨牀試驗由臨牀試驗發起人組織的一個獨立的合格專家小組監督,稱為獨立數據監測委員會(IDMC)。IDMC在臨牀試驗期間可以獲得非致盲數據,如果它確定受試者或其他原因存在不可接受的安全風險,如沒有證明療效,則可能停止臨牀試驗。我們還可以根據不斷髮展的商業目標和/或競爭環境,暫停或終止臨牀試驗。
假設根據所有適用的法規要求成功完成所有所需的測試,詳細的產品開發信息以NDA或sNDA的形式提交給FDA,要求批准將該產品用於一個或多個指標的市場。
該應用程序包括從相關的非臨牀和臨牀試驗中獲得的所有相關數據,包括陰性或模稜兩可的結果,以及積極的發現,以及與產品的化學、製造、控制和擬議的標籤等有關的詳細信息。數據可以來自公司贊助的旨在測試產品使用的安全性和有效性的臨牀試驗,也可以來自多個替代來源,包括由調查人員發起的研究。為了支持市場批准,提交的數據必須在質量和數量上足以確定產品候選產品的安全性和有效性,使FDA滿意。
一旦提交的營銷申請已被接受備案,FDA的目標是在接受提交申請後10個月內審查申請,如果申請涉及嚴重或危及生命的疾病的治療,並被授予快速通道優先審查,從接受申請起6個月內提交。FDA要求提供更多的信息或澄清,往往大大延長了審查過程。FDA可將申請提交諮詢委員會審查、評估和建議是否批准該申請。FDA不受諮詢委員會建議的約束,但它通常遵循這些建議。
在FDA對NDA或sNDA進行評估並對生產該藥物產品和/或其原料藥的臨牀研究設施和/或生產設施進行檢查之後,它可以發出批准函或完整的回覆函。批准函授權商業銷售該藥物,並提供特定適應症的具體處方信息。完整的回覆信表示申請的審核週期已經完成,申請還沒有準備好審批。一封完整的回信可能需要額外的臨牀數據和/或額外的關鍵第三階段臨牀試驗,以及/或與臨牀試驗、非臨牀研究或製造有關的其他重要、昂貴和耗時的要求。即使提交了這些附加信息,FDA也可能最終決定申請不符合批准標準。FDA還可以批准NDA的風險評估和減輕風險戰略計劃,其中可以包括
藥物指南,醫生溝通計劃或確保安全使用的要素,如限制分配方法,病人登記和其他風險最小化工具。FDA還可能會在其他方面提出條件,比如對擬議的標籤進行修改,制定適當的控制措施和規範,或者承諾進行一項或多項後市場研究或臨牀試驗。這種後市場測試可能包括第四階段的臨牀試驗和監測,以進一步評估和監測產品的安全性和商業化後的有效性。腫瘤學產品的監管批准通常要求臨牀試驗中的患者被長期跟蹤,以確定該藥物的總體生存效益。
根據FDA批准生產或銷售的產品須受FDA的持續監管,包括保存記錄要求和報告藥物不良經驗。不良事件的經驗與產品必須及時報告給FDA和藥物警戒方案,以積極尋找這些不良事件是由FDA授權。新發現或開發的安全或有效性數據可能需要對產品核準的標籤進行修改,包括添加新的警告和禁忌,還可能需要實施其他風險管理措施。
藥品製造商及其分包商必須向fda和某些州機構註冊其機構,並定期接受fda和某些州機構的檢查,以確保遵守gmp,這對我們和我們的第三方製造商規定了某些程序和文件要求。在這些檢查之後,FDA可能會在fda 483表格和警告信上發佈通知,這可能會導致我們修改某些活動。一份FDA 483表格,如果是在FDA檢查結束時發出的,可以列出FDA調查人員認為可能違反了cGMP或其他FDA法規或指南的條件。如果不能充分和迅速地糾正這些意見,就可能導致進一步的管制執法行動。除了美國食品和藥品管理局483份通知和警告函外,如果不遵守法律和法規的要求,製造商可能會受到可能的法律或管制行動,例如暫停生產、扣押產品、禁令行動或可能的民事處罰。此外,對生產過程的改變是嚴格管制的,並且根據變化的重要性,在實施之前可能需要事先得到FDA的批准。FDA法規還要求調查和糾正任何偏離cGMP的情況,並將報告和文件要求強加給我們和我們可能決定使用的任何第三方製造商。因此,製造商必須繼續在生產和質量控制領域花費時間、金錢和精力,以保持符合cGMP和其他方面的法規合規。
美國境外政府條例
除了美國的法規外,我們還須遵守其他司法管轄區的各種法規,其中包括臨牀試驗以及我們產品的任何商業銷售和分銷。各國對臨牀試驗、產品許可、定價和報銷的批准程序和要求差別很大,時間可能比FDA批准的時間更長或更短。
無論我們是否持有FDA對某一產品的批准,在這些國家開始臨牀試驗或銷售產品之前,我們必須獲得外國監管機構的必要批准。美國以外的某些國家也有類似的程序,要求提交臨牀試驗申請,就像人類臨牀試驗開始之前的IND一樣。例如,在歐洲,臨牀試驗申請(“CTA”)必須提交給每個國家的國家衞生當局和一個獨立的倫理委員會,分別與FDA和IRB類似。一旦根據一國的要求批准了CTA,臨牀試驗的發展就可以進行。
歐洲聯盟可以通過中央授權程序或國家授權程序對藥品進行授權。在集中式程序下,營銷授權申請提交給EMA,而EMA則由CHMP對申請進行審查並發表意見。歐洲委員會(“歐共體”)審議了這一意見,該委員會負責決定申請。如果申請獲得批准,歐盟委員會將頒發一份單一的營銷授權,該授權對所有歐洲聯盟成員國以及冰島、列支敦士登和挪威都有效。對於含有治療某些疾病(包括癌症)的新活性物質的人類藥物,中央程序是強制性的。
國家授權程序,即權力下放和相互承認程序,適用於不強制實行集中程序的產品。使用分散程序,申請人可在歐洲聯盟多個國家同時申請批准尚未獲得批准的醫藥產品
在任何歐洲聯盟國家獲得授權,但不屬於中央程序的強制性範圍。根據相互承認程序,一種藥物首先由一個歐洲聯盟成員國按照該國的國家程序批准。在此之後,可以通過一種程序向其他歐洲聯盟國家尋求進一步的營銷授權,在此程序中,有關國家同意承認原始的國家營銷授權的有效性。
現行特別管制程序
正式會議
我們被鼓勵參與並尋求衞生當局有關開發和審查調查藥物以及營銷應用方面的指導。在美國,我們和FDA之間可能會有不同類型的正式會議。每一種會議類型都有不同的程序。這些會議的結論和協議都在FDA發佈的正式最後會議記錄中得到。
EMA還提供了與我們對話的機會。這通常是以科學諮詢的形式進行的,科學諮詢是由CHMP的科學諮詢工作組提供的。每次科學諮詢會議都要收費。
FDA或EMA的建議通常是基於質量(化學、製造和控制測試)、非臨牀測試和臨牀研究、藥物警戒計劃和風險管理計劃等問題提供的。這種建議對發起人沒有法律約束力。為了從美國林業發展局獲得有約束力的承諾,可採用特別議定書評估(SPA)程序。SPA是FDA對一項協議的評估,目的是與主辦方達成協議,即協議設計、臨牀終點和統計分析是可以接受的,以支持監管機構批准產品候選產品在所研究的適應症中的有效性。FDA對SPA的協議對FDA有約束力,除非是在有限的情況下,例如FDA確定了在臨牀研究開始後確定該產品的安全性或有效性所必需的重大科學問題,或者如果該研究發起人未能遵循與FDA商定的協議。即使這項研究是受多項資助計劃所規限,但亦不能保證研究最終足以支持批准該項研究。
孤兒藥物名稱
美國食品和藥物管理局可授予孤兒藥品名稱,用於治療在美國影響不到20萬人的罕見疾病或疾病,或影響美國20多萬人,而且沒有合理的預期,為這類疾病或疾病研製和製造藥物的成本將從美國銷售中收回。在歐洲聯盟,歐洲醫學協會的孤兒藥品委員會授予孤兒藥品稱號,以促進旨在診斷、預防或治療危及生命或長期削弱歐洲聯盟共同體內每10 000人中不超過5人的疾病的產品的開發。此外,還指定用於診斷、預防或治療危及生命、嚴重衰弱或嚴重和慢性疾病的產品,如果沒有獎勵措施,歐洲聯盟的藥物銷售不可能足以證明有必要投資開發藥物或生物製品。
在美國,指定孤兒藥物使一方有權獲得財政獎勵,例如為臨牀試驗費用、税收優惠和用户費用減免提供資助的機會。此外,如果一種產品因其指定為孤兒的指示而獲得FDA的第一次批准,該產品有權獲得孤兒藥品專賣權,這意味着FDA在七年內不得批准任何其他申請,為同一指示銷售同一種藥物,除非在有限的情況下,例如顯示具有孤兒排他性的產品在臨牀上優於該產品。
在歐洲聯盟,指定孤兒藥物也使一方有權獲得財政獎勵,例如減少費用或免收費用,並在批准藥品或生物製品後給予10年的市場排他性。如果不再符合孤兒藥品指定標準,這一期限可縮短為六年,包括證明該產品有足夠的利潤而不足以維持市場排他性。
申請上市批准前,必須申請指定孤兒藥品。在監管審查和批准過程中,孤兒藥物的指定並不意味着任何好處,也不會縮短其持續時間。
兒科發育
在美國,FDCA規定,如果有報告稱,應FDA的書面請求,研究在兒科人羣中使用該藥物的情況,FDCA將為一種藥物增加6個月的營銷專賣權。與這種潛在的排他性利益不同,NDAs必須包含數據(或營銷後活動的建議),以評估用於所有相關兒科人羣中聲稱的適應症的調查藥物產品的安全性和有效性,以支持藥物安全有效的每個兒童亞羣體的劑量和管理。FDA可主動或應申請人的請求,批准推遲提交一些或所有兒科數據,直至批准成人使用該產品或在符合某些標準的情況下完全或部分放棄。有關兒童發展計劃的討論可以在任何時候與FDA討論,但通常在第二階段會議結束和提交國家藥品管理局之間的任何時間進行。
對於EMA,在提交營銷授權申請之前,需要提交一份兒科調查計劃和/或放棄或推遲申請。
美國突破性療法的命名
美國國會通過了2012年度“食品和藥物管理局安全與創新法案”,制定了突破療法指定計劃。當初步的臨牀證據表明藥物可能在一個或多個臨牀意義的終點上顯示出比現有療法有很大的改善時,FDA可能會授予用於治療嚴重疾病的藥物突破療法的地位。突破療法的指定,可能是由贊助商在申請或修改IND時,旨在促進和加快開發和FDA審查的產品候選。具體來説,突破療法的指定可能使主辦方在藥物開發、臨牀試驗設計的強化指導以及由高級管理人員組成的跨學科小組加快fda審查的過程中能夠與fda進行更頻繁的會議。然而,這一指定並不保證與其他藥物相比,開發或審查時間更快,也不能保證該藥物將獲得FDA最終的市場批准。一旦獲得批准,FDA可以在任何時候撤銷這一指定。
美國的快速審查和批准
FDA有各種方案,包括“快車道”、“優先審查”和“加速批准”,其目的是加快或簡化藥品和生物製品審查程序,並/或規定在替代終點的基礎上批准藥物或生物。即使一種藥物符合其中一個或多個項目的條件,FDA可能會在以後決定該藥物不再符合資格認證條件,或者縮短FDA審查或批准的時間。一般來説,有資格參加這些項目的藥物是那些嚴重或危及生命的藥物,那些有可能解決未得到滿足的醫療需求的藥物,以及那些對現有治療提供有意義的好處的藥物。For example, based on results of the Phase 3 clinical trial(s) submitted in an NDA, upon the request of an applicant, the FDA may grant the NDA a priority review designation, which sets the target date for FDA action on the application at six months from the 60-day filing date, if the drug is anew molecular entity, rather than to the standard FDA review period of 10 months.如果初步估計數表明一種產品如果獲得批准,有可能在沒有令人滿意的替代療法的情況下提供安全和有效的治療,或與市場上的產品相比有可能有重大的改進,則給予優先審查。優先審查的指定不會改變批准的科學/醫療標準或支持批准所需的證據質量。
加速批准提供了一種新藥的早期批准,該新藥的目的是治療嚴重或危及生命的疾病或疾病,前提是確定該產品對替代終點有影響,該終點有可能合理地預測臨牀效益,並優於現有的治療方法。替代終點是一種實驗室測量或物理標誌,作為一種間接或替代的測量,代表臨牀有意義的結果。FDA還將考慮病情的嚴重程度、罕見程度或流行程度。作為批准加速批准藥物的條件,一項或多項營銷後驗證性研究需要如代孕標記物試驗所預測的那樣確認對臨牀效益的影響,其定義是對患者的感覺、功能或生存有積極的影響。
歐洲聯盟加速審查
根據歐洲聯盟的中央程序,評估營銷授權申請的最長時間為210天(不包括時鐘停止,申請人應就CHMP提出的問題提供補充書面或口頭信息)。在特殊情況下,當一種醫藥產品預期具有重大的公共衞生利益時,CHMP可能會給予加速評估,這是由三個累積標準確定的:需要治療的疾病的嚴重性(例如嚴重致殘或危及生命的疾病);缺乏或缺乏適當的替代治療方法;以及預期將獲得很高的治療效益。在這種情況下,EMA確保CHMP的意見在提交MAA後150天內提出,不包括時鐘停止。
藥品覆蓋、定價和報銷
我們獲得監管批准的任何藥品的覆蓋範圍和報銷狀況都存在很大的不確定性。在美國和其他國家的市場中,我們獲得商業銷售管理批准的任何產品的銷售部分取決於第三方付款人是否能償還。第三方支付者包括政府衞生行政部門、受管理的保健提供者、私營醫療保險公司和其他組織。確定付款人是否為藥品產品提供保險的過程可以與確定支付人將支付藥物產品的價格或償還率的過程分開。第三方付款人可能會將保險範圍限制在批准清單上的特定藥物產品或處方上,這些藥品可能不包括所有FDA批准的特定指示藥品。第三方支付者除了對醫療產品和服務的安全性和有效性進行檢驗外,還越來越多地挑戰其價格,並對醫療產品和服務的醫療必要性和成本效益進行審查。我們可能需要進行昂貴的藥物經濟學研究,以證明我們產品的醫療必要性和成本效益,以及獲得FDA批准所需的費用。產品檔案和預算影響模型的開發可能有助於幫助支付方評估成本效益。我們批准的產品可能被認為是醫學上必要的或成本效益的.付款人決定為藥物產品提供保險並不意味着將確定適當的償還率。可能無法獲得足夠的第三方補償,以使我們能夠維持足以實現產品開發投資的適當回報的價格水平。
近幾年來,聯邦和州就藥品定價、政府控制和美國醫療保健系統的其他改革提出了一些建議。美國政府頒佈了一項立法,為醫療保險受益人提供部分處方藥補貼。政府支付一些處方藥的費用可能會增加對我們獲得營銷批准的任何產品的需求;然而,為了根據這一計劃獲得付款,我們必須通過根據這項立法運作的處方藥計劃向醫療保險接受者出售產品。這些計劃很可能會為我們的產品談判打折價格。此外,經“衞生保健和教育和解法”(統稱“平價醫療法案”)修訂的“病人保護和平價醫療法案”於2010頒佈,目的是降低醫療費用,並在很大程度上改變政府和私營保險公司資助醫療保健的方式。除其他控制費用措施外,“平價醫療法”規定:
|
·
| |
生產或進口某些品牌處方藥和生物製劑的實體的年度、非扣減費用; |
|
·
| |
醫療保險D部分保險差距折扣方案,在該方案中,希望將其藥品納入D部分的製藥製造商必須在保險缺口期間(“甜甜圈洞”)向符合條件的受益人提供折扣;以及 |
|
·
| |
一個公式,增加折扣,製造商必須支付的醫療補助藥品回扣計劃。 |
自頒佈以來,“平價醫療法案”的某些方面一直受到司法和國會的挑戰。我們預計現任總統政府和美國國會將繼續尋求修改、廢除或以其他方式使“平價醫療法案”的所有或某些條款失效。最近頒佈了“減税和就業法”,其中除其他外,取消了對不遵守“平價醫療法案”規定的個人醫療保險的處罰。在特朗普政府和美國國會可能產生的影響方面,仍存在不確定性,任何變化都可能需要時間才能展開,而且可能會對“平價醫療法案”授權的醫療項目和服務的覆蓋範圍和補償產生影響。
此外,自“平價醫療法案”頒佈以來,還提出並通過了其他立法修改。這些變化包括每個財政年度向醫療保險提供者支付的總金額減少2%,自2013年4月1日起生效,由於隨後對該法規的立法修正案,除非國會採取額外行動,否則將在2025年底前繼續有效。此外,在2013月份,“美國2012納税人救濟法”簽署成為法律,除其他外,進一步減少了對幾類提供者的醫療保險付款,並將政府收回對提供者的多付款項的時效期限從三年延長到五年。最近,政府對製造商為其銷售產品定價的方式進行了更嚴格的審查,這導致國會進行了幾次調查,並提出了旨在改革政府方案償還方法的法案。美國各州也越來越積極地執行旨在控制藥品定價的條例,包括價格或病人報銷限制、折扣、對某些產品准入的限制、銷售成本披露和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和批量採購。我們預計,美國聯邦、州和地方政府將繼續考慮立法限制醫療費用的增長,包括處方藥的費用。未來的立法可能會限制我們產品等藥品的付款。
此外,由於醫療保健立法和監管舉措,支付方法,包括對配套診斷的支付,也會發生變化。例如,CMS開始捆綁醫療保險支付某些實驗室測試的費用,而病人在醫院門診接受服務。此外,在2014年月1日,“保護獲得2014醫療保險法案”(PAMA)被簽署成為法律,這一法案除其他外,顯著改變了臨牀實驗室收費表下的現行支付方法。從2018年月1日開始,每項臨牀診斷實驗室測試的醫療保險支付率,除某些例外情況外,等於檢驗的加權平均私人支付額,即使用適用的實驗室在數據收集期間收集的數據計算,並在特定的數據報告期間向CMS報告。此外,根據PAMA,CMS還需要採用臨時帳單代碼,以確定新的臨牀診斷實驗室測試和高級診斷實驗室測試,這些測試還沒有獨特的診斷代碼,並且已經得到FDA的批准或批准。
其他國家也有不同的定價和償還辦法。在歐洲共同體,各國政府通過其定價和報銷規則以及對國家保健系統的控制來影響藥品的價格,這些制度為這些產品的大部分成本提供資金給消費者。有些法域實行肯定和否定的清單制度,只有在商定了償還價格後才能銷售產品。為了獲得報銷或定價批准,其中一些國家可能需要完成臨牀試驗,將某一特定產品的成本效益與現有療法進行比較。其他成員國允許公司自行決定藥品價格,但監督和控制公司利潤。醫療保健費用,特別是處方藥的下降壓力已變得非常嚴重。因此,對新產品的進入設置了越來越高的壁壘。此外,在一些國家,來自低價市場的跨境進口對一國國內的定價構成了商業壓力。
如果政府和第三方付款人未能提供足夠的保險和補償,我們獲得商業銷售管理批准的任何產品的可銷售性都可能受到影響。此外,美國對降低醫療支出的重視也有所增加,我們預計將繼續加大對藥品定價的壓力。美國對藥物定價做法,特別是在相對較短時間內價格上漲幅度較大的藥物方面,特別是在立法方面,有着特殊和日益增長的興趣。某些獨立的慈善基金會為符合某些經濟需要標準並患有特定慢性病或罕見疾病的患者提供補助,以支付醫療費用(包括藥物治療費用分攤義務和醫療保險費)。最近,製藥企業對這些基金會的捐贈產生了強制執行的興趣,其依據是,這些捐贈被部分用於引導患者使用這些捐贈者的產品,或者捐贈者獲得瞭如何使用這些捐贈的數據,包括捐贈與轉介捐獻者產品的頻率之間的關係。美國國會進行了幾次調查,並提出了一些法案。除其他外,旨在提高藥品定價的透明度,審查定價與製造商病人計劃之間的關係,並改革政府對藥品的報銷方法。保險政策和第三方償還率在任何時候都可能發生變化.即使我們獲得監管批准的一個或多個產品獲得了有利的保險和補償地位,但在未來可能會實施較不優惠的保險政策和償還率。實施成本控制措施或其他醫療改革可能會使我們無法創造收入、獲得利潤或使我們的產品商業化。
廣告推廣
FDA和其他美國聯邦監管機構通過FDCA和FDA的實施條例和標準,對藥品的營銷和推廣進行了嚴格的監管。FDA對營銷和促銷活動的審查包括但不限於:直接對消費者的廣告、醫療服務提供商的廣告和促銷、向保健專業人員的銷售代表通信、關於未經批准或“標籤外”用途的通信、行業贊助的科學和教育活動以及涉及互聯網的宣傳活動。一種產品未經批准就不能進行商業推廣。經批准後,產品推廣只能包括那些與安全和有效性有關的,符合FDA批准的標籤。美國食品和藥物管理局的規定對製造商在標籤外使用方面的通信施加了嚴格的限制。不遵守食品和藥品管理局關於未經批准的藥物使用或其他違反其廣告和標籤法律和條例的規定和限制,可能導致食品和藥物管理局、司法部或衞生和公共服務部監察長辦公室以及州當局採取不利的宣傳和執法行動。有可能產生一系列可能產生重大商業後果的處罰,包括扣押產品、禁制令、民事和/或刑事罰款以及在實質上限制一家公司推銷或分發其產品或監管信函的方式的協議,這些可能要求向保健專業人員進行糾正性廣告或其他糾正性通信。
其他醫療保健法律和法規
我們受到各種針對醫療行業欺詐和濫用的法律的約束,包括反回扣法和虛假索賠法。例如,在美國,有聯邦和州的反回扣法律,禁止支付或收取回扣、賄賂或其他報酬,目的是誘使購買或推薦醫療產品和服務,或獎勵過去的購買或建議。違反這些法律可導致民事和刑事處罰,包括罰款、監禁和禁止參與聯邦醫療保健方案。
“聯邦反Kickback法”禁止個人故意直接或間接地索取、接受、提供或支付報酬,或提供、推薦或安排提供商品或服務,而這些商品或服務可在聯邦醫療保健方案(如“醫療保險”和“醫療補助方案”)下支付。“平價醫療法案”擴大了“反Kickback法”的適用範圍,該法除其他外,修正了“聯邦反Kickback規約”和“美國法典”第42編第1320 a-7b節所載適用的刑事醫療欺詐法規的意圖要求。根據該法律修正案,個人或實體不再需要實際瞭解本法規或違反該法的具體意圖才能實施違法行為。此外,“平價醫療費用法”規定,政府可以聲稱,因違反聯邦反Kickback法規而提出的包括物品或服務在內的索賠,就“民事虛假索賠法”(下文討論)或民事罰款法規而言,構成虛假或欺詐性索賠。許多州通過了類似於聯邦反Kickback法規的法律,其中一些法律適用於將病人轉介到由任何來源報銷的醫療項目或服務上,而不僅僅是醫療保險和醫療補助計劃。
“聯邦虛假索賠法”規定,任何人,除其他外,明知而提出或導致提出虛假或欺詐性的聯邦方案付款要求,包括聯邦醫療保健方案,均須承擔責任。“虛假索賠法”的“Qui Tam”條款允許個人代表聯邦政府提起民事訴訟,指稱被告向聯邦政府提出虛假索賠,並分享任何貨幣追回。此外,各州頒佈了類似於“虛假索賠法”的虛假索賠法。這些州的許多法律適用於向任何第三方支付者提出索賠要求的地方,而不僅僅是聯邦醫療項目。如果一個實體被認定違反了“虛假索賠法”,它可能需要支付政府實際損失的三倍,外加民事處罰。
In addition, a person who offers or transfers to a Medicare or Medicaid beneficiary any remuneration, including waivers of co-payments and deductible amounts (or any part thereof), that the person knows or should know is likely to influence the beneficiary’s selection of a particular provider, practitioner or supplier of Medicare or Medicaid payable items or services may be liable for civil monetary penalties of up to $15,270 for each wrongful act.此外,在某些情況下,根據“反回扣法規”和“民事虛假索賠法”,通常免除醫療保險和醫療補助受益人的報酬和免賠額的提供者也可根據“反回扣法規”和“民事虛假索賠法”承擔責任,該法律可對不法行為施加額外的處罰。該禁令的法定例外之一是非例行的、未公佈的對報酬或可扣減金額的放棄,這些豁免是基於對經濟需要的個別確定或合理的用盡。
收集工作。然而,衞生和公共事務部監察主任辦公室強調,這一例外情況只應偶爾用於解決特定病人的特殊經濟需要。雖然這一禁令僅適用於聯邦醫療保健項目受益人,但對商業付款人所涵蓋的病人提供的薪酬和免賠額的例行豁免可能涉及適用的州法律,其中除其他外涉及欺詐的非法計劃、服務費用過高、對病人合同的侵權幹預以及成文法或普通法欺詐。如果我們的病人援助計劃被發現與適用的法律不一致,我們可能被要求重組或停止這些項目,或者受到其他重大處罰。
除上述法律外,“平價醫療法”還對製藥商對醫生和教學醫院的付款以及醫生及其直系親屬擁有的所有權和投資權益規定了新的報告要求。不提交所需資料可能導致民事罰款總額達每年165,786美元(或因“明知失敗”而每年總計達1.105,000美元),對所有未及時、準確和完整地在年度提交的報告中報告的付款、價值轉移或所有權或投資權益處以民事罰款。適用的藥品製造商必須收集每個日曆年的數據,並在隨後每個日曆年的3月31日之前向CMS提交報告。此外,還有越來越多的州法律要求製造商向各州報告定價和營銷信息。這些法律可能會對我們的銷售、營銷和其他促銷活動造成行政和合規負擔。
對於那些在美國被醫療補助計劃覆蓋的市場產品,我們有各種義務,包括政府的價格報告和退税要求,這些要求通常要求產品向醫療補助和某些購買者(包括根據340 B藥品折扣計劃購買的“覆蓋實體”)提供實質性的回扣/折扣。我們還必須將這些產品貼現給通用服務管理局聯邦供應計劃的授權用户,根據該計劃,附加法律和要求適用。這些方案要求提交價格數據,並根據複雜的法定公式計算折扣和回扣,以及加入受聯邦採購條例管轄的政府採購合同,而指導這種計算的指南並不總是明確的。遵守這些要求可能需要在人員、系統和資源方面進行大量投資,但如果不適當計算我們的價格,或不提供所需的折扣或回扣,我們可能會受到很大的懲罰。醫療補助計劃和340 B計劃下的回扣和折扣計算的一個組成部分分別是“額外回扣”,這是一種複雜的計算方法,其部分依據是品牌藥品價格隨時間的增長速度超過通貨膨脹率(基於CPI-U)。這一比較是基於與品牌藥品NDA相關的第一季度銷售的基準價格數據,而且基準數據一般不能重置,甚至是在將NDA轉移到另一家制造商的基礎上。這種“額外回扣”計算,在某些情況下,與NDA第一季度的銷售額相比,價格漲幅相對較高,從而導致醫療補助的退款高達一種藥品“平均製造商價格”的100%,340 B美元的價格為一便士。在第89/105/EEC號指令的控制下,歐盟/歐洲經濟區的定價和償還受國家規則和政策的制約,各成員國可能有所不同。
此外,1996“健康保險可攜性和問責製法”(“HIPAA”)產生了幾種新的聯邦犯罪,包括保健欺詐和與保健事項有關的虛假陳述。大多數醫療服務提供者,誰是處方我們的產品,並從誰,我們從病人健康信息,是受隱私和安全要求,根據HIPAA。儘管我們不直接受到HIPAA的影響,但如果我們在知情的情況下從HIPAA覆蓋的實體中以未經HIPAA授權或允許的方式獲取可識別的健康信息,我們可能會受到刑事處罰。類似於聯邦反Kickback法規,個人或實體不需要實際瞭解法規或違反法規的具體意圖即可實施違法行為。其他國家也有或正在制定關於收集、使用和傳輸個人信息的法律。For example, the EU Data Privacy Directive (95/46/EC), which will be replaced on May 28, 2018 by the more restrictive General Data Protection Regulation (Regulation (EU) 2016/679) and the Swiss Federal Act on Data Protection, regulate the processing of personal data within the European Union and between countries in the European Union and countries outside of the European Union, including the U.S. Failure to provide adequate privacy protections and maintain 遵守新的歐盟-美國隱私保護框架,它將取代以前的安全港機制,可能危及跨境商業交易並導致重大處罰,這些法律可能為我們造成責任或增加我們做生意的成本。
診斷試驗規則
在美國,FDCA及其實施條例,以及其他聯邦和州法規和條例,除其他外,管理醫療設備的設計和開發、非臨牀和臨牀測試、市場前批准或批准、註冊和上市、製造、標籤、儲存、廣告和促銷、銷售和分銷、進出口和市場後監督。根據FDCA,診斷測試被歸類為醫療設備。除非有豁免,診斷測試需要在商業銷售前獲得FDA的市場許可或批准。適用於醫療器械的兩種主要類型的FDA營銷授權是市場前通知,也稱為510(K)許可和市場前批准或PMA批准。由於我們的第三方合作者正在開發的診斷測試在預防人類健康損害方面具有重大的重要性,因此它們必須經過pma批准程序。
PMA應用必須得到有效的科學證據的支持,這通常需要大量的數據,包括技術、非臨牀、臨牀和製造數據,以證明FDA對該設備的安全性和有效性感到滿意。對於診斷測試,PMA應用程序通常包括有關分析和臨牀驗證研究的數據。作為PMA審查的一部分,FDA將對生產設施或設施進行預批准檢查,以確保符合質量體系條例(QSR),該法規要求製造商遵循設計、測試、控制、文件和其他質量保證程序。FDA對最初的PMA申請進行審查需要六到十個月的時間,儘管通常需要更長的時間,而且可能需要幾年才能完成。如果FDA對PMA申請和製造設施的評價都是有利的,FDA將簽發批准函或批准信,其中通常包含一些必須滿足的條件,以確保PMA的最終批准。如果FDA對PMA或生產設施的評估不佳,FDA將拒絕PMA的批准或發出一封不可批准的信函。一封不可批准的信件將概述申請中的缺陷,並在實際可行的情況下,確定需要什麼才能使PMA獲得批准。FDA還可以確定是否需要進行額外的臨牀試驗,在這種情況下,PMA的批准可能會被推遲幾個月或幾年,同時進行試驗,然後將數據提交給PMA修正案。一旦獲得批准,如果不遵守批准後的要求、批准條件或其他管理標準,或在初始營銷之後發現問題,FDA可以撤回PMA批准。
我們與正在開發配套診斷技術的第三方合作者合作,以生成提交pma應用程序所需的數據,並與食品和藥物管理局的設備和放射健康中心(“CDRH”)保持密切聯繫,以確保將需求的任何變化納入發展計劃。與FDA就我們的藥品候選產品以及配套診斷產品候選人舉行會議,通常包括來自藥物評估和研究中心和CDRH的代表,以確保NDA和PMA的提交得到協調,使FDA能夠對這兩項提交進行並行審查。FDA已經發布了指導文件,涉及“體外輔助診斷設備”的開發和批准過程。根據這些指導文件,對於新的治療產品,如我們的產品候選,PMA作為配套診斷設備,一般應開發和批准或清除與治療同時。
在歐洲經濟區,體外醫療設備必須符合歐洲聯盟關於體外診斷醫療設備的指示(經修正的第98/79/EC號指令)的基本要求。為了證明符合基本要求,製造商必須經過合格評定程序。合格評定因醫療器械的類型及其分類而異。對於低風險設備,合格評估可以在內部進行,但對於高風險設備,則需要經認證的EEA通知機構的幹預。如果成功,合格評估結束時由製造商起草一份歐共體合格聲明,授權制造商在其產品上貼上CE標記並在整個EEA中銷售。為美國登記產生的數據將足以滿足歐盟和其他國家的監管要求。
專利和所有權
我們產品的專利性質和保護,我們的產品候選人,過程和技術是重要的,我們的業務。我們的成功在一定程度上取決於我們是否有能力保護我們的產品候選者、技術和訣竅的專有性質,在不侵犯他人專有權利的情況下運作,並防止他人侵犯我們的專有權利。我們在美國和國際上為我們的產品尋求專利保護。
候選人和其他技術。我們的政策是為我們認為對我們的業務發展很重要的技術、發明和改進申請專利或許可。我們還依靠商業祕密、技術訣竅和不斷創新來發展和保持我們的競爭地位.我們不能肯定將來我們的任何待決專利申請或我們提出的任何專利申請都會獲得專利,我們也不能肯定我們現有的專利或將來授予我們的任何專利對保護我們的技術具有商業價值。
2011年月,我們獲得了輝瑞公司的獨家全球許可證,以開發和商業化rucaparib。美國的6,495,541號專利及其在數十個國家頒發的相應專利,針對的是物質的Rucaparib組成,於2020到期,並有可能在不同的司法管轄區延長五年的專利期限。我們相信,根據1984“藥品價格競爭和專利期限恢復法案”(“哈奇-瓦克斯曼法案”)延長專利期限,可以將我們對魯卡帕利布的專利專屬權延長到美國2023年度第四季度。在歐洲,我們相信,在補充保護證書下的專利展期可以再延長5年至至少2025年。在2012年4月,我們獲得了阿斯利康的專利和專利申請家族的獨家許可,這將允許開發和商業化的魯卡帕瑞布某些方法治療患者的PARP抑制劑。Additionally, other patents and patent applications are directed to methods of making, methods of using, dosing regimens, various salt and polymorphic forms and formulations and have expiration dates ranging from 2020 through potentially 2035, including the camsylate salt/polymorph patent family licensed from Pfizer, which expires in 2031 and a patent application directed to high dosage strength rucaparib tablets that, if issued, will expire in 2035.截至2018年月27日,Rucaparib Camsyate鹽專利已在47個國家(包括美國和歐洲)頒發,有9個國家申請待決,48個國家頒發了Rucaparib物質專利。我們意識到鹽和多形性專利的一些挑戰。Two oppositions were filed in the granted European counterpart of the rucaparib camsylate salt/polymorph patent on June 20, 2017. European oppositions are commonly filed against patents related to pharmaceutical products. The grounds of opposition related to Rubraca were lack of novelty and lack of inventive step. The novelty and inventive step challenges are based on prior art references (or closely related disclosures) that were previously raised by the European patent 在對申請進行起訴過程中,被授予專利的權利主張可對本現有技術申請專利。雖然專利挑戰的最終結果可能難以預測,但我們相信,包括一系列意想不到的特性在內的許多因素,支持了我們的Rucaparib camsyate鹽/多形性專利組成的新穎性和非明顯性。基於這些事實,我們認為,成功地挑戰這項專利將是困難的。
我們於2013收購了EOS,並與Advenchen和Servier簽訂了許可協議,從而獲得了對Lucitanib的權利。在2008,EOS與Advenchen簽訂了一項獨家許可協議,在全球範圍內開發和商業化利他坦,不包括中國。在9月份,EOS與Servier簽訂了一項合作和許可協議,根據該協議,EOS將在美國、日本和中國以外的所有國家開發和商業化利維坦的專有權利轉授給Servier。專利保護的物質組成和使用方法在美國、歐洲和日本發佈,在其他司法管轄區發佈或待決。在美國,物質專利的組成將於2030到期,而在其他司法管轄區,該專利的組成將於2028到期。我們認為,根據“哈奇-瓦克斯曼法案”,可以將我們的物質專利組合延長五年。此外,針對製造方法的專利或專利申請也在美國、歐洲、日本和中國頒發或待決。
在2010,我們獲得了獨家的,世界範圍內的許可證,從Celgene。美國針對羅西替尼物質組成的專利8,975,927在2032到期,美國9,108,927號專利,針對羅西替尼HBR鹽和多形性的專利,在2033到期。其他專利申請正在等待中,這一主張普遍認為,如果發佈,將有在2029到期日期。今年1月,我們從“守門人制藥公司”獲得了dana Farber專利家族的獨家全球次級許可證,該專利家族聲稱擁有野生型、不可逆的EGFR抑制劑,如羅西萊替尼。我們或我們的許可人已經提出了額外的專利申請,涉及羅西替尼的使用方法,代謝物,組合,診斷方法和劑量方案。
此外,我們打算在任何時候為我們將來獲得的任何產品或產品候選產品及相關技術尋求專利保護。
像我們這樣的製藥公司的專利地位通常是不確定的,涉及複雜的法律、科學和事實問題。此外,專利申請中所要求的範圍在專利申請之前可以大大減少。
已經發布了。因此,我們不知道我們獲得或許可的任何產品候選人是否會獲得專利保護,或者,如果有任何專利被授予,它們是否會提供重要的專利保護,或者是否會受到質疑、規避或失效。由於美國和某些其他司法管轄區的專利申請被保密18個月,而且由於科學或專利文獻中的發現的公佈往往落後於實際發現,在此之前,我們無法確定我們是第一個提出與我們的產品候選人有關的任何專利申請的人。此外,我們可能必須參加美國專利和商標局(“美國專利和商標局”)宣佈的干涉程序,以確定發明的優先權或在美國或外國專利局進行的反對或其他第三方程序,這兩種程序中的任何一種都可能給我們帶來巨大的成本,即使最終的結果對我們有利。沒有人能保證這些專利如果被頒發,將由一個有管轄權的法院維持有效。第三方專利糾紛的不利結果可能會使我們對第三方承擔重大責任,要求有爭議的權利獲得第三方的許可,或者要求我們停止使用特定的化合物或技術。
個人專利的期限取決於獲得專利的國家的專利的法律期限。在我們所申請的大多數國家,專利期限是從提出非臨時專利申請的最早日期起20年。在美國,專利期限調整可以延長專利期限,對美國專利授予中的行政拖延給予專利權人補償,或者如果專利因另一項專利被最終拒絕而被縮短。
涵蓋fda批准的藥物的專利期限也可能符合延長專利期限的資格,這允許專利期限恢復作為對在fda監管審查過程中丟失的專利期限的補償。“哈奇-瓦克斯曼法案”允許專利有效期延長至專利期滿後五年。延長專利期限的時間長短與藥物接受監管審查的時間長短有關。從產品批准之日起,專利延期不能將專利的剩餘期限延長14年以上,只有一項專利適用於已批准的藥品。歐洲和其他非美國司法管轄區也有類似的規定,以延長專利期限,包括批准的藥物。在未來,如果我們的藥品獲得FDA批准,我們希望申請專利期限的專利涵蓋這些產品。
為保障我們對任何已發出的專利及專有資料的權利,我們可能需要就侵犯權利的第三者提出訴訟,或利用法庭或參與聆訊,以決定該等專利或其他專有權利的範圍及有效性。這類訴訟往往代價高昂,對我們來説可能很費時,我們不能向你保證,裁決當局會對我們有利。不利的決定可能允許第三方使用我們的技術,而不需要支付許可費,或者可能迫使我們向第三方授權所需的技術。這樣的決定甚至可能導致我們的專利範圍無效或受到限制,或喪失與我們的專利或待決專利申請有關的權利。在審慎的範圍內,我們打算對我們認為侵犯了我們的一項或多項專利的第三方提起訴訟。
此外,我們已經並打算在有孤兒毒品的情況下繼續尋求這種地位。If a product which has an orphan drug designation subsequently receives the first regulatory approval for the indication for which it has such designation, the product is entitled to orphan exclusivity, meaning that the applicable regulatory authority may not approve any other applications to market the same drug for the same indication, except in certain very limited circumstances, for a period of seven years in the United States and ten years in the European Union.孤兒藥品的名稱並不妨礙競爭對手開發或銷售不同的藥物作為指示。
我們也依靠商業祕密保護我們的機密和專有信息。我們不能保證其他人不會獨立發展實質上等同的專有資料和技術,或以其他方式取得我們的商業機密或披露這些技術,或保證我們能夠有意義地保護我們的商業機密。然而,我們相信,發展技術創新所需的大量費用和資源將有助於我們保護我們產品的競爭優勢。
我們的政策是要求我們的僱員、顧問、外部科學合作者、贊助的研究人員和其他顧問在與我們開始僱用或諮詢關係時執行保密協議。這些協議規定,在個人與我們的關係過程中向個人披露的所有機密信息應保密,除非在特定情況下,不得向第三方披露。就僱員而言,協議規定由個人構思的所有發明
將成為我們的專屬財產。然而,我們不能保證這些協議會為我們的商業機密提供有意義的保護或適當的補救,以防未經許可使用或泄露這些資料。
製造業
我們目前與第三方簽訂合同,為非臨牀研究和臨牀試驗生產我們的產品候選產品,並打算在今後這樣做。我們目前與第三方合同製造組織(“CMO”)簽訂了長期協議,生產魯布拉的活性成分和最終產品。我們不擁有或經營生產我們的候選產品的臨牀數量的生產設施。我們目前沒有計劃建立我們自己的臨牀或商業規模的製造能力。為了滿足我們對商業製造的預期需求,我們正與我們現有的第三方供應商合作,以擴大其生產規模,我們正在評估更多的第二來源供應商。雖然我們依賴於合同製造商,但我們有豐富的生產經驗來監督與我們的合同製造商的關係。
我們開發了魯布拉活性藥物成分(“原料藥”)的生產工藝,其程度足以滿足臨牀需求,並隨着生產能力的增加,如下文“Lonza協議”所述,預計的商業需求。RubraAPI的製造是在一個CMO中進行的。魯布拉製藥產品的配方和生產工藝已開發到足以滿足臨牀需求和預期商業需求的程度。一位能夠同時開發和生產藥品的第三方首席商品官目前正在生產魯布拉藥品。我們今後12個月的業務計劃包括對庫存進行大量投資,以滿足魯布拉的預計商業需求。
到目前為止,我們的第三方製造商已經滿足了我們的生產要求.我們期望第三方製造商能夠提供足夠數量的產品,以滿足預期的全面商業需求。
Lonza協議
2016年月3日,我們與Lonza有限公司(“Lonza”)簽訂了一項長期生產和供應Rucaparib原料藥的協議。
根據這項協議,Lonza將是非排他性的製造商的魯卡帕里布API在10年期間的協議。Lonza將在現有的Lonza工廠中建造一輛生產列車,專門用於生產Rucaparib API。專用生產列車將提供製造能力,以滿足我們目前預期的需求,商業供應的Rucaparib原料藥。我們有義務按計劃向建造專用生產列車的資本設備和其他費用支付資本設備和其他費用,一旦設施投入使用,在協議期限內每季度支付一筆固定的設施費。預計專用生產列車將在2018第四季度完成,屆時Lonza將根據該協議開始生產API。
Lonza將生產和儲存一種先進的中間體,用於隨後的Rucaparib API的生產。我們將按每公斤的價格支付我們訂購的先進中間體和Rucaparib原料藥的數量,但須作某些調整。在專用設施建成並符合運營條件之前,Lonza將在現有Lonza設施中按協議規定的價格生產Rucaparib API。
任何一方可因另一方重大違反協議而終止協議,但須事先書面通知和補救期限。我們可以終止協議,但需事先提前90天書面通知,如果rucaparib因某些原因退出市場的話。In the event of such a termination by us, or termination by Lonza due to material breach by us, we are obligated to compensate Lonza for any services rendered, or for which costs have been incurred by Lonza in anticipation of services to be provided to us, and to pay to Lonza the remaining amount of any capital program fees and quarterly fixed facility fees for the remainder of the term of the agreement.如果我們因Lonza重大違約而終止協議,Lonza有義務償還我們以前支付的全部或部分資本計劃費用。
利西坦的活性藥物成分目前正由第三方供應商生產,目前的生產工藝已足以滿足臨牀上的即時需求。我們可能會進行更多的開發工作,以進一步優化活性藥物成分的生產工藝。利西坦的成品目前正在CMO中生產,目前的產品和工藝已經足夠開發,以滿足臨牀上的即時需求。額外的規模工作和/或額外的生產能力將是必要的,以支持更大的臨牀開發或商業化要求。
洛西替尼的活性藥物成分目前正在由一個CMO生產。目前的藥物生產工藝已經得到了充分的發展,以滿足臨牀的迫切需求。我們聘請了一個既能開發製劑,又能生產藥品的單一的中藥製劑。目前的藥品生產工藝已經得到了充分的發展,以滿足臨牀的迫切需求。為了支持更大的臨牀開發或商業化需求,可能需要額外的規模工作和/或額外的生產能力。
商業運作
我們在美國的商業組織已經到位,並支持Rubra的商業銷售。我們認為,魯布拉的美國腫瘤學市場在其批准的兩項指標中都有一個目標明確的銷售和營銷組織,其能力包括管理管理護理機構、團體採購組織、腫瘤學集團網絡和政府賬户等關鍵賬户的管理。我們通過有限的分銷網絡銷售魯布拉,包括一些特定的藥店和分銷商。醫療保健提供者給病人開Rubra,專業藥房和分銷商直接給病人配發Rubra。我們打算繼續在美國推廣魯布拉,因為它目前的跡象和任何其他跡象,我們可能在未來獲得。我們在世界其他地方保留對魯布拉的權利。目前正在審查與EMA一起提交的卵巢癌治療指示的MAA。如果在歐盟獲得批准,我們打算自己將魯卡帕瑞布商業化,我們正在歐洲建立商業和醫療基礎設施。這些小組的領導已經到位,我們將僱用外地銷售人員,因為定價和報銷決定和獲得批准。
客户
我們目前獲準在美國市場銷售魯布拉。我們的產品主要通過有限數量的專業經銷商和專業藥房供應商,集體,我們的客户。我們的客户隨後將我們的產品出售給病人和醫療服務提供商,屆時我們確認了相關收入。
我們的客户,分銷我們的產品,由三家專業經銷商和四家專業藥房供應商組成。此外,我們不認為失去其中一個客户會對我們的產品分銷能力產生重大影響,因為我們預計剩餘客户將平均吸收銷售量。
員工
截至2018年月16,我們僱用了360名全職員工.我們的僱員中沒有一個是由工會代表的,很少有國際僱員參加集體談判協議。我們認為我們與員工的關係很好。
As part of the Compensation Committee’s annual review of overall employee compensation, effective March 1, 2018, in order to align their base salary compensation with the 50th percentile of similarly situated employees at the Company’s peer group companies, the Compensation Committee approved for Mr. Mahaffy a base salary increase of 7.1% to $696,300, for Mr. Muehl a base salary increase of 15.7% to $433,800, for Ms. 艾弗斯-閲讀基薪增加3.0%至450 246美元,羅爾夫博士基薪增加4.1%至489 300美元,胡克斯先生基薪增加5.3%至421 300美元。Also, the Compensation Committee approved new bonus targets (as a percentage of their new annual base salaries) for each of these executive officers as follows: for Mr. Mahaffy, 70%; for Ms. Ivers-Read and Dr. Rolfe, 50%; and for Messrs. Muehl and Hooks, 45%. In addition, as part of the annual grants of equity awards to employees of the Company, the Compensation Committee approved the following equity awards to such executive officers to be made on March 1, 2018: Mr. Mahaffy, options to purchase 120,000 shares of the Company’s common stock; Mr. Muehl, options to purchase 9,000 shares of the Company’s common stock and 9,000 restricted stock units (“RSUs”); Ms. Ivers-Read, options to purchase 11,000 shares of the Company’s common stock and 11,000 restricted
股票股;Rolfe博士,購買公司普通股1.1萬股和限制性股1.1萬股的期權;Hooks先生,購買公司普通股9000股和限制性股9000股的期權。
研究與開發
在截至12月31日、2017、2016和2015的研究和開發方面,我們分別投資了142.5百萬美元、251.1百萬美元和269.3百萬美元。
克洛維斯
我們於2009年4月根據特拉華州的法律註冊成立,並於11月2011完成了我們普通股的首次公開發行(IPO)。我們的普通股在納斯達克全球精選市場上市,代號為“CLVS”。我們的主要執行辦公室位於科羅拉多州博爾德100套房5500 Flatiron Parkway,我們的電話號碼是(303)625-5000。我們在舊金山,加利福尼亞,劍橋,英國和意大利米蘭都設有辦事處。我們的網站地址是www.clovisoncology.com。我們的網站和網站所包含的或可以通過該網站訪問的信息將不被視為以引用方式納入本報告,也不被視為本報告的一部分。
可得信息
作為一家上市公司,我們向證券交易委員會(SEC)提交報告和委託書。These filings include our annual reports on Form 10-K, quarterly reports on Form 10-Q, current reports on Form 8-K and proxy statements on Schedule 14A, as well as any amendments to those reports and proxy statements, and are available free of charge through our website as soon as reasonably practicable after we file them with, or furnish them to, the SEC.一次www.clovisoncology.com,到投資者&新聞/證券交易委員會的文件中查找此類報告的副本。你也可以閲讀和複製我們提交給證交會的材料,這些資料在美國華盛頓特區東北方向的100F街的證交會公共資料室。請致電1-800-SEC-0330向證交會查詢公共資料室的運作情況。證券交易委員會還在www.sec.gov其中包括報告、委託書和其他有關我們和其他發行人的信息,這些信息以電子方式提交給美國證交會。
項目1A.風險因素
我們的業務面臨重大風險和不確定性。某些因素可能會對我們的業務前景、財務狀況和經營結果產生重大的不利影響,你應該仔細考慮這些因素。因此,在評估我們的業務時,我們鼓勵您考慮以下對風險因素的全面討論,以及本年度報告中所載或以參考方式納入本年度報告中關於表10-K和我們向證券交易委員會提交的其他公開文件中所包含的其他信息。其他我們目前不預期或我們認為不重要的事件也可能影響我們的業務、前景、財務狀況和經營結果。
與我們的財務狀況和資本要求有關的風險
自成立以來,我們蒙受了重大損失,並預計在可預見的將來,我們將繼續遭受損失。我們只創造了少量的歷史收入,這使我們很難評估我們未來的生存能力。
我們是一家有有限經營歷史的生物製藥公司。生物製藥產品開發是一項高度投機性的事業,涉及到相當程度的風險。我們主要集中在授權和開發我們的產品候選人。自2009年4月成立以來,我們一直沒有盈利,每年都有虧損。我們只有有限的經營歷史,你方可以評估我們的業務和前景。在新的、快速發展的領域,特別是在生物製藥領域,公司經常會遇到許多風險和不確定性。我們的三個候選產品,CO-101,CO-1686(羅西替尼)和CO-3810(盧西坦),在最初的有希望的數據之後遇到了發展和/或監管上的挫折,導致我們在當時正在進行的臨牀試驗中停止註冊。我們已獲得監管機構批准在美國銷售魯布拉,但我們還不知道該產品是否會在其他司法管轄區獲得批准,或者是否會獲得市場認可並在商業上取得成功。迄今為止,我們從產品銷售中只獲得了微薄的收入。我們繼續
與我們正在進行的業務相關的大量研發和其他開支。截至12月31日、2017、2016和2015的年度,我們分別淨虧損346.4百萬美元、349.1百萬美元和352.9百萬美元。截至2017年月31,我們的累計赤字為14.474億美元。我們預計在可預見的將來將繼續遭受損失。因此,我們受到開發新生物製藥產品和相關配套診斷的所有風險的影響,我們可能會遇到意外的費用、困難、複雜情況、監管審查、延誤和其他可能對我們的業務產生不利影響的未知因素。如果我們的任何產品候選人在臨牀試驗中失敗或沒有獲得監管機構的批准,或者如果魯布拉或我們的任何產品候選人,如果獲得批准,未能獲得市場接受,我們可能永遠不會盈利。即使我們在未來取得盈利能力,我們也可能無法在隨後的時期內維持盈利能力。我們先前的損失,加上預期的未來損失,已經並將繼續對我們的股東權益和營運資本產生不利影響。
我們將需要大量額外資金,而這些資金可能無法以可接受的條件提供,或根本無法獲得。如果我們不能獲得額外的資金,我們可能無法完成我們的產品候選人的開發和商業化,或繼續我們的發展計劃。
自成立以來,我們的業務消耗了大量的現金。我們預計將繼續花費大量資金推動我們的產品候選產品的臨牀開發,並將我們獲得監管批准的任何產品候選產品推出和商業化,包括建立我們自己的商業組織,以應對某些市場。
根據目前的估計,我們相信,我們現有的現金、現金等價物和可供出售的證券將使我們能夠至少在未來12個月內為我們的運營計劃提供資金。我們沒有為我們的發展努力承諾的任何物質、外部資金來源或其他支持。
在我們能夠創造足夠的產品收入來滿足我們的現金需求(我們可能永遠不會做到這一點)之前,我們期望通過公共或私人股本、合作、戰略聯盟和其他類似的許可安排來滿足未來的現金需求。我們不能肯定是否會以可接受的條件提供額外的資金。如果我們無法以我們可以接受的條件籌集到足夠的額外資金,我們可能不得不大大推遲、縮減或停止開發或商業化我們的一個或多個產品候選人,或我們的新產品候選人的收購或許可計劃。我們也可以尋找合作者,為我們目前或未來的產品候選人中的一個或多個,條件是不那麼有利的,否則可能是可用的。任何這些事件都會嚴重損害我們的業務、財務狀況和前景。
償還我們的長期債務需要大量現金,而且我們的業務可能沒有足夠的現金流量來償還我們的鉅額債務。
在9月份,我們完成了287.5百萬美元的私募發行,本金總額為2.5%的可轉換高級債券,到期金額為2021(“債券”),扣除發行費用後,公司的淨收益為278.3百萬美元。這些票據受公司作為發行人與紐約梅隆銀行信託公司作為託管人之間的契約條款管轄。債券每半年付息一次,債券於2021年月15到期,但在該日期前贖回、贖回或轉換者除外。此外,如契約條款所界定的情況發生根本改變,債券持有人可要求我們以現金形式回購全部或部分債券,購買價格相等於擬回購債券本金的100%,另加任何應累算利息及未付利息(如有的話)至但不包括基本更改回購日期。截至2017年月三十一日,該批債券的本金共達287.5,000萬元,仍未償還。
我們能否按期支付債券的利息和本金,或在根本改變時支付回購價格,取決於我們未來的表現,而這些表現須受經濟、財政、競爭和其他我們無法控制的因素所影響。我們未來可能沒有足夠的現金來償還債務。如果我們無法產生這樣的現金流或獲得額外的資金來源,我們可能需要採取一種或多種替代辦法,例如重組債務或按照可能繁重或高度稀釋的條件獲得額外的股本。我們再融資的能力取決於當時的資本市場和財政狀況。我們可能無法從事任何這些活動或以適當的條件從事這些活動,這可能導致我們債務義務的違約。
我們和我們的某些官員和董事在幾起訴訟中被指定為被告,這些訴訟可能導致大量費用,轉移管理層的注意力。
在一些訴訟中,我們和我們的某些官員被指定為被告,這些訴訟一般指控我們和我們的某些官員違反了聯邦證券法,就FDA批准的進展以及羅西替尼在市場上取得成功的可能性做出了虛假和誤導性的陳述。其中一些訴訟已經解決,而其他訴訟仍未了結,其他訴訟可能仍在提起。見本報告第一部分,第3項---法律程序。
我們打算對這些訴訟進行有力的辯護,但我們目前無法預測這些問題的結果。如果我們不能成功地為這些訴訟事項辯護,我們可能被迫向我們的證券持有人及其律師支付大筆款項,或與他們達成其他和解(在某些情況下,償還承銷商的費用和費用),這種付款或結算安排可能對我們的業務、經營結果和財務狀況產生重大不利影響。例如,我們可能會受到嚴重的負面影響,我們的聲譽,並轉移管理層的注意力和資源從其他優先事項,其中任何可能對我們的業務產生重大不利影響。此外,任何這些事項都可能要求支付我們現有董事和高級人員責任保險所不包括的或超過其限額的款項,這可能對我們的經營業績或財務狀況產生重大不利影響。我們將不會再從我們的保險公司收到與公司有關的任何金額(包括損害賠償、和解費用或律師費)的繳款。美國食品和藥物管理局在11月發佈的最新監管公告中要求提供更多的臨牀數據,以瞭解洛昔替尼的療效和安全性。
其他當事人也可以對我們和我們的高級職員和董事提起類似的訴訟。即使這些申索不成功,這些訴訟或日後的其他類似行動,或其他規管上的查詢或調查,可能會導致大量費用,對我們的聲譽造成重大的不良影響,並轉移管理層的注意力和資源,從而對我們的業務、經營業績或財務狀況造成重大的不利影響。
最近通過的全面税制改革法案可能會對我們的商業和財政狀況產生不利影響。
2017年月22日,特朗普總統簽署了一項新的法律,對經修正的“1986國税法”進行了重大修改。新頒佈的聯邦所得税法,除其他外,包含了對公司税的重大修改,包括將公司税率從35%的最高邊際税率降至21%的統一税率,將利息費用的扣減額限制在調整後收益的30%(某些小企業除外),將淨營業虧損的扣除額限制在本年度應納税收入的80%以內,以及elimination of net operating loss carrybacks, one time taxation of offshore earnings at reduced rates regardless of whether they are repatriated, elimination of U.S. tax on foreign earnings (subject to certain important exceptions), immediate deductions for certain new investments instead of deductions for depreciation expense over time, and modifying or repealing many business deductions and credits (including reducing the business tax credit for certain clinical testing expenses incurred in the 檢驗某些罕見疾病或疾病的藥物,一般稱為“孤兒藥物”)。儘管公司所得税税率降低,但新的聯邦税法的總體影響仍不確定,我們的業務和財務狀況可能受到不利影響。此外,目前還不確定各州是否和在多大程度上符合新頒佈的聯邦税法。這一税制改革對我們普通股持有者的影響也是不確定的,可能是不利的。投資者應就這一立法以及投資或持有我們的普通股可能產生的税務後果與他們的法律和税務顧問進行協商。
與我們的商業和工業有關的風險
我們在很大程度上依賴於魯布拉在美國的商業成功;魯布拉可能無法獲得市場認可,也可能無法在商業上取得成功,我們可能無法從運營中獲得盈利能力和正現金流。
On December 19, 2016, the FDA granted approval for Rubraca as monotherapy for the treatment of patients with deleterious BRCA mutation (germline and/or somatic) associated advanced ovarian cancer, who have been treated with two or more chemotherapies, and selected for therapy based on an FDA approved companion diagnostic for Rubraca. Our MAA submitted to the EMA for an ovarian cancer treatment indication is currently under review by the CHMP, 在二月份,醫療管理委員會向我們傳達他們打算就治療方案進行最後表決。
2018次會議。魯布拉在美國有商業用途。市場接受程度和魯布拉的商業成功將取決於若干因素,包括:
|
·
| |
保持遵守適用於魯布拉和我們商業活動的所有監管要求,包括fda所要求的營銷後要求和營銷後承諾,如果在歐洲獲得批准,則通過完成某些驗證性試驗、藥理學研究和附加診斷開發;來驗證rubra的臨牀效益或安全性。 |
|
·
| |
病人和醫學界接受Rubra,以及替代和競爭產品和療法;的可用性、感知優勢和相對成本、安全性和有效性 |
|
·
| |
魯布拉持續可接受的安全狀況,以及在這些領域發生的任何意外副作用、不良反應或誤用,或任何不利的宣傳(;)。 |
|
·
| |
我們的第三方製造商有能力製造魯布拉的商業供應品,在監管機構中保持良好的地位,並開發、驗證和維護在商業上可行的生產工藝,這些工藝在必要的範圍內符合現行的良好製造慣例(Cgmp);。 |
|
·
| |
由管理下的護理計劃、私人健康保險公司及其他第三者付款人提供的保險及足夠的補償,以及病人是否願意及是否有能力為魯布拉;支付費用 |
|
·
| |
對Rubra的營銷和分銷支持,包括已批准的標籤在多大程度上支持商業成功的推廣活動; |
|
·
| |
Rubra的實際市場規模,這可能與預期的;不同 |
|
·
| |
我們在Rubra;和向Rubra;實施我們的知識產權的能力 |
|
·
| |
我們避免第三方專利幹擾或專利侵權的能力要求;和 |
|
·
| |
我們的能力,以獲得監管批准,使魯布拉在美國以外的市場商業化。 |
由於這些因素中有許多是我們無法控制的,我們無法向您保證,我們將永遠能夠通過出售Rubra來創造有意義的收入。此外,我們可能會經歷在不同時期的魯布拉的銷售大幅波動。我們目前沒有任何其他產品的候選產品正在積極開發,儘管我們正在探索在其他適應症的魯卡帕利布。如果我們不能在美國和任何可能獲得批准的外國領土成功地將Rubra商業化,或此類批准的任何重大拖延,都可能對我們執行我們的業務戰略的能力產生重大不利影響,並最終從魯布拉產生足夠的收入,以達到或維持盈利或維持我們預期的業務水平。
魯布拉可能會產生不良的副作用,或具有其他可能限制其商業潛力的特性。
如果我們或其他人發現以前未知的副作用,或者已知的副作用比過去更頻繁或更嚴重,那麼:
|
·
| |
我們可能決定或被要求向醫生、藥劑師和醫院;發送產品警告信或現場警報。 |
|
·
| |
;可能需要額外的非臨牀或臨牀研究、標記的改變或製造工藝、規格和/或設備的更改。 |
|
·
| |
政府的調查或訴訟,包括集體訴訟,可針對我們;及 |
上述任何事件都會損害或阻止Rubra的銷售,增加我們的開支,並損害我們成功地將Rubra商業化的能力。由於Rubra是商業化的,它可以用於更廣泛的人羣和一個不那麼嚴格的控制環境比臨牀研究。因此,監管機構、醫療從業者、第三方支付者或患者可能會認為或得出結論,使用rubra與先前未知的嚴重不良影響有關,破壞了我們的商業化努力。
如果我們的銷售,營銷和銷售能力,魯布拉或我們的產品候選人,我們獲得了市場營銷 由於審批不足,我們可能無法從銷售我們的產品中獲得收入。
在Rubra推出之前,我們還沒有將任何藥物產品作為一個公司進行商業化。為了在商業上取得成功,我們必須繼續擴大我們的銷售、營銷、管理和其他非技術能力,或者與第三方作出安排來提供這些服務。我們將與目前擁有廣泛、資金充足、經驗更豐富的銷售和營銷業務的公司競爭。我們可能無法成功地與這些更成熟的公司競爭。
我們最近在美國建立了一個銷售、銷售和分銷Rubra的外地組織和其他能力,並在歐洲聯盟僱用了商業基礎設施,而且在建立和管理銷售組織方面存在重大風險。可能妨礙我們自己有效地使Rubra商業化的因素包括:
|
·
| |
我們無法招聘、培訓、保留和激勵足夠數量的合格有效的銷售和營銷人員;。 |
|
·
| |
銷售人員無法產生足夠的銷售線索,無法接觸醫生或説服足夠數量的醫生使用或處方Rubra; |
|
·
| |
我們無法有效地管理地理上分散的銷售和營銷團隊。 |
如果我們不能為魯布拉保持有效的銷售、營銷和分銷能力,或者如果我們不能建立和維持美國以外的魯布拉的銷售、營銷和分銷能力,如果得到批准,或者對於我們獲得營銷批准的任何其他產品,無論是獨立的還是與第三方的,我們可能無法創造產品收入,也可能無法盈利。如果建立和維持銷售和營銷組織的成本超過了成本效益,我們可能無法盈利。
關於我們的產品候選人,我們可以選擇與擁有直接銷售力量和已建立的分銷系統的第三方合作,或者擴大我們自己的銷售力量和分銷系統,或者取代我們在某些地區的銷售力量和分銷系統。如果我們為我們的任何產品候選人簽訂許可或合作推廣安排,我們的產品收入可能低於我們直接銷售或銷售我們批准的產品。此外,我們因這種安排而獲得的任何收入,將全部或部分取決於這些第三方的努力,而這些努力可能並不成功,而且通常不在我們的控制範圍之內。如果我們不能以可接受的條件達成這樣的安排,我們可能無法成功地將獲得監管機構批准的產品候選產品商業化。如果我們自己或通過與一個或多個第三方的合作,不能成功地將我們的產品候選產品商業化,我們未來的產品收入將受到損失,我們可能會遭受重大的額外損失。
我們不能保證rucaparib將在美國境外獲得監管批准,或者在其他治療和適應症領域的rucaparib開發項目將獲得成功,或者我們的其他產品候選人將獲得監管機構的批准。
到目前為止,我們已經投入了相當一部分的努力和財政資源,以獲得和發展我們的產品候選人。我們的業務完全取決於產品的成功開發和商業化。
我們的每一個產品候選人都需要臨牀開發、臨牀、非臨牀和製造活動的管理、多個管轄區的監管批准、獲得製造供應、建立一個商業組織和重要的營銷努力,以便從產品銷售中獲得任何收入。在獲得fda的批准之前,我們不允許推銷或推銷我們的任何產品候選產品。
或者類似的外國監管機構。到目前為止,我們已經從FDA獲得監管批准,在美國銷售魯布拉,因為某種有限的跡象。我們可能不會獲得類似的美國以外的監管批准,我們可能永遠不會得到監管批准,我們的任何其他產品的候選人。此外,我們的產品開發計劃考慮由第三方合作者開發配套診斷。配套診斷作為醫療設備必須受到監管,並且必須在我們的產品候選產品商業化之前,由FDA或某些其他外國監管機構批准銷售。
我們不能確定Rucaparib將在其他治療領域、腫瘤類型或其他適應症中成功開發,或者我們的任何產品候選產品將在臨牀試驗中成功或獲得監管批准。此外,即使我們的產品候選人在臨牀試驗中獲得成功,他們也可能得不到監管機構的批准。我們的三個候選產品,CO-101,羅西替尼和盧西坦在最初的有希望的數據之後遇到了發展和監管上的挫折,導致我們停止了正在進行的臨牀試驗的註冊。即使我們成功地獲得監管批准來銷售我們的一個或多個產品候選產品,我們的收入在一定程度上將取決於我們的診斷合作者是否有能力獲得與我們的產品候選人一起使用的配套診斷的監管批准,以及我們獲得監管批准並擁有商業權利的地區的市場規模。如果我們所針對的病人子集的市場沒有我們估計的那麼重要,我們可能不會從這些產品的銷售中獲得可觀的收入,如果獲得批准。
我們計劃尋求監管機構的批准,將我們的產品候選產品商業化,以及在美國、歐洲聯盟和更多的外國尋求其他治療、適應症或腫瘤類型的商業化。儘管監管批准的範圍在其他國家相似,但在許多其他國家,要獲得單獨的監管批准,則需要遵守這些國家在安全和效率方面的許多不同的監管要求,以及除其他外,管制我們產品候選產品的臨牀試驗和商業銷售、定價和分銷,我們無法預測這些國家的成功。
臨牀藥物開發涉及一個漫長而昂貴的過程,結果不確定,早期研究和試驗的結果可能無法預測未來的試驗結果。
臨牀試驗費用昂貴,需要許多年才能完成,其結果也是固有的不確定性。在臨牀試驗過程中,任何時候都可能發生故障。非臨牀研究的結果和我們的產品候選早期臨牀試驗的結果可能不能預測後期臨牀試驗的結果。在臨牀試驗的後期階段,產品候選人可能無法表現出所期望的安全性和有效性特徵,儘管通過非臨牀研究和初步臨牀試驗取得了進展。生物製藥行業的公司由於缺乏療效或不良的安全狀況而在高級臨牀試驗中遭遇重大挫折,儘管在早期試驗中取得了可喜的結果,但這並不少見。事實上,基於一項關鍵研究的負面結果,我們停止了先前產品候選產品CO-101的進一步開發,並且我們決定停止正在進行的羅西替尼的開發,因為FDA發佈了一封完整的回覆信。此外,我們未來的臨牀試驗結果可能並不成功。
雖然我們正在進行臨牀試驗,但我們可能會在正在進行的臨牀試驗中遇到延誤,而且我們不知道計劃中的臨牀試驗是否會按時開始,是否需要重新設計,是否需要按時登記病人,或者是否能夠按時完成。臨牀試驗可能因各種原因而推遲,包括下列方面的延誤:
|
·
| |
與預期的合同研究組織(“CRO”)和臨牀試驗場所就可接受的條件達成協議,其條款可以經過廣泛的談判,並且在不同的合同研究組織和試驗地點之間可能有很大的差異; |
|
·
| |
在每個地點獲得機構審查委員會(“IRB”)的批准; |
病人登記是臨牀試驗時間上的一個重要因素,它受到許多因素的影響,包括病人的人數和性質、病人與臨牀地點的距離、試驗的資格標準、臨牀試驗的設計、相互競爭的臨牀試驗以及臨牀醫生和病人對所研究藥物相對於其他藥物的潛在優勢的看法。可用的治療方法,包括任何可能被批准用於我們正在調查的適應症的新藥。此外,我們依靠CRO和臨牀試驗地點來確保我們的臨牀試驗能夠正確和及時地進行,雖然我們已經就他們承諾的活動達成協議,但我們對他們的實際表現的影響有限。
如果臨牀試驗被我們、正在進行此類試驗的機構的IRBs、數據安全監測委員會或FDA或其他監管當局暫停或終止,我們可能會遇到延誤。這些當局可能因若干因素而暫停或終止,包括不按照監管要求或我們的臨牀協議進行臨牀試驗,由FDA或其他管理當局檢查臨牀試驗操作或試驗場,結果造成臨牀擱置、意外的安全問題或不良副作用、未能證明使用藥物有好處,改變政府規章或行政行為,或缺乏足夠的資金繼續進行臨牀試驗。如果我們在完成或終止對我們產品候選人的任何臨牀試驗方面出現延誤,我們的產品候選人的商業前景將受到損害,我們從這些產品候選人中的任何一個產生產品收入的能力將被推遲。此外,任何延誤完成我們的臨牀試驗將增加我們的成本,減緩我們的產品候選開發和批准過程,並危及我們開始產品銷售和創造收入的能力。這些事件中的任何一次都可能嚴重損害我們的業務、財務狀況和前景。此外,導致或導致臨牀試驗開始或完成的延誤的許多因素也可能最終導致我們的產品候選人被拒絕接受監管批准。
FDA和類似的外國機構的監管審批過程宂長、耗時且本質上不可預測,如果我們最終無法在其他適應症和治療項目中獲得對rucaparib的監管批准,或無法獲得對我們其他產品候選產品的批准,我們的業務將受到很大的損害。
獲得FDA和類似外國機構批准所需的時間是不可預測的,但通常需要在臨牀試驗開始後許多年,並取決於許多因素,包括監管當局的重大酌處權。此外,審批政策、法規或獲得批准所需的臨牀數據的類型和數量在產品候選人的臨牀開發過程中可能會發生變化,並可能因司法管轄區而異。我們已就某項具體指示在美國獲得對Rubra的監管批准,而且有可能在美國境外,或就更廣泛的適應症和治療線或其他腫瘤類型獲得監管批准,或者我們現有的任何其他產品候選人或我們今後可能尋求開發的任何產品候選人都將獲得監管批准。事實上,隨着FDA就羅西替尼NDA發佈了一封完整的回覆信,我們決定停止正在進行的羅西替尼的開發。
我們的產品候選人可能無法獲得監管機構的批准或批准,可能由於許多原因而延遲,包括以下原因:
|
·
| |
FDA或類似的外國監管機構可能不同意我們臨牀試驗的設計或實施; |
|
·
| |
我們可能無法證明令FDA或類似的外國監管機構滿意的產品候選產品是安全和有效的,其擬議的指示; |
|
·
| |
臨牀試驗的結果可能不符合FDA或類似的外國監管機構要求批准的統計意義水平; |
|
·
| |
FDA或類似的外國監管機構可能不同意我們對非臨牀研究或臨牀試驗數據的解釋; |
|
·
| |
從我們的產品候選產品臨牀試驗中收集的數據可能不足以支持NDA或其他提交材料的提交,也不足以在美國或其他地方獲得監管批准; |
|
·
| |
FDA或類似的外國監管機構可能無法批准與我們簽訂臨牀和商業用品合同的第三方製造商的製造工藝或設施; |
|
·
| |
FDA或類似的外國監管機構可能無法批准我們計劃與合作伙伴一起開發的配套診斷方法;以及 |
|
·
| |
FDA或類似的外國監管機構的批准政策或法規可能會發生重大變化,使我們的臨牀數據不足以獲得批准。 |
這種漫長的審批過程,以及未來臨牀試驗結果的不可預測性,可能導致我們無法獲得監管機構的批准來推銷我們的產品候選產品,這將極大地損害我們的業務、運營結果和前景。
即使我們獲得了產品候選產品的監管批准,我們也將面臨持續的義務和持續的監管審查,這可能會導致大量的額外開支。此外,我們的產品候選人,如果獲得批准,可能受到標籤和其他限制和市場退出,如果我們不遵守監管要求或遇到意外的問題,我們的產品可能會受到處罰。
我們為我們的產品候選人獲得的任何監管批准都可能受到產品可能銷售的已批准的指定用途的限制,或受批准條件的限制,或者包含對潛在昂貴的營銷後測試和臨牀試驗及監督的要求,以監測產品候選產品的安全性和有效性。此外,如果FDA或類似的外國監管機構批准我們的任何產品候選產品,則該產品的製造工藝、定價、標籤、包裝、分銷、不良事件報告、儲存、廣告、促銷和記錄保存將受到廣泛和持續的監管要求的制約。這些要求包括提交安全和其他營銷後信息和報告,註冊,以及繼續遵守當前良好的生產實踐和良好的臨牀實踐,任何臨牀試驗,我們進行後批准。後來發現一種產品以前未知的問題,包括意外的嚴重程度或頻率的不良事件,或與我們的第三方製造商或製造過程的不良事件,或未能遵守監管要求,可能會導致,除其他外:
|
·
| |
限制產品的銷售或製造、產品退出市場或自願或強制召回產品; |
|
·
| |
美國食品藥品監督管理局和類似的外國機構拒絕批准我們提出的待批准申請或補充申請,或暫停或撤銷產品許可證批准; |
上述所有限制、義務和要求也適用於Rubra,我們已在美國因某些有限的跡象獲得監管批准。
我們可以在有條件的基礎上尋求美國和外國監管機構批准一個或多個產品候選人,但完全批准的條件是滿足監管機構的要求。例如,我們獲得了FDA關於魯布拉初步指示的加速批准,並正在尋求歐盟對魯卡帕的有條件的營銷授權。這些批准途徑中的每一條都有一定的批准條件,其中有些可能是批准後的,例如使用盡職調查進行後批准或驗證性試驗。For example, continued approval of Rubraca by the FDA may be contingent upon verification and description of clinical benefit in ARIEL3 and/or ARIEL4, our confirmatory trials. If we are unable to fulfill the requirements of regulators that are conditions of a product’s accelerated or conditional approval, if the confirmatory trial shows unfavorable results or increased or additional undesirable side effects, or if regulators re-evaluate the data or 我們的產品候選產品的風險-利益簡介,加速或有條件批准的可用性可能會被撤回,或者我們的有條件批准可能不會導致完全批准,或者可能被撤銷或不再更新。或者,我們可能被要求改變產品候選人的標籤,或甚至撤回產品,如果批准,從市場。
FDA和類似的外國主管部門的政策可能會改變,政府可能會頒佈更多的法規,以防止、限制或延遲對我們產品候選產品的審批。無論是在美國還是在國外,我們都無法預測未來立法或行政行動可能產生的政府管制的可能性、性質或程度。如果我們緩慢或無法適應現有需求中的更改,或者
採納新的要求或政策,或者如果我們不能保持監管合規,我們可能失去任何可能獲得的營銷批准,我們可能無法實現或維持盈利能力,這將對我們的業務產生不利影響。上述任何一種情況都可能對我們的產品候選人的商業前景造成實質性損害。
魯布拉和我們的其他產品候選人可能會造成不良的副作用,或者具有其他可能延遲或阻止其監管批准的特性,限制已批准的標籤的商業形象,或者在市場批准後造成重大的負面後果(如果有的話)。
可歸因於我們的產品候選者的不良事件(“AES”)可能導致我們或監管機構中斷、延遲或停止臨牀試驗,並可能導致更嚴格的標籤,或導致FDA或其他類似的外國機構延遲或拒絕批准監管。迄今為止進行的臨牀研究已經產生了與我們的產品候選人有關的AES,其中一些非常嚴重。接受Rubra治療的患者通常有噁心、嘔吐、便祕、失代償症、貧血/血紅蛋白下降、食慾下降、腹瀉、腹痛、血小板減少和疲勞/乏力。在對利西坦的研究中,高血壓、蛋白尿和亞臨牀甲減需要補充是觀察到的最常見的AES。洛西替尼治療的最顯著的AES包括高血糖和OTC延長。與所有腫瘤學藥物的情況一樣,在今後的試驗中可能存在與其使用有關的其他潛在有害特徵,包括更大和更長的第三階段臨牀試驗。當我們評估產品候選產品與其他活性物質結合使用時,由於每種製劑的綜合安全狀況,我們可能會遇到安全問題,這可能對這一發展戰略構成重大挑戰。
我們的試驗結果可能會揭示這些或其他副作用的嚴重程度和普遍性,這是無法接受的。在這種情況下,我們的試驗可能被暫停或終止,FDA或類似的外國監管機構可以命令我們停止進一步開發或拒絕批准我們的產品候選人的任何或所有有針對性的指示。與藥物相關的安眠藥可能會影響病人的招募,或者影響登記病人完成試驗的能力,或者導致潛在的產品責任索賠。這些事件中的任何一次都可能嚴重損害我們的業務、財務狀況和前景。
此外,如果我們或其他人後來查明這些產品造成的不良副作用,可能會產生一些潛在的重大負面後果,包括:
|
·
| |
我們可能需要建立一個藥物指南,概述這種副作用的風險,分發給病人; |
|
·
| |
我們可能會被起訴,並就對病人造成的傷害承擔責任;以及 |
這些事件中的任何一個都會阻止我們獲得或保持市場對特定產品候選產品的認可,如果獲得批准,可能會嚴重損害我們的業務、運營結果和前景。
如果不能成功地驗證、開發和獲得配套診斷的監管批准,可能會損害我們的藥物開發戰略。
作為我們臨牀發展戰略的關鍵要素之一,我們尋求在疾病類別中確定哪些患者可以從我們正在開發的產品候選產品中獲得選擇性和有意義的利益。與合作伙伴合作,我們計劃開發配套診斷,以幫助我們更準確地識別特定子集中的病人,無論是在臨牀試驗中,還是在產品候選產品的商業化方面。配套診斷作為醫療設備須受FDA和可比外國監管機構的監管,並在商業化之前需要單獨的監管批准。我們不開發內部的配套診斷,因此,我們依賴於我們的第三方合作者的持續合作和努力,在開發和獲得這些配套診斷的批准。我們和我們的合作者可能會遇到困難,在開發和獲得批准的配套診斷,包括問題的選擇性/特異性,分析驗證,重複性,或臨牀驗證。我們的任何延誤或失敗
合作者開發或獲得配套診斷的法規批准,可能會延遲或阻止我們的產品候選批准。此外,我們的合作者可能會遇到生產上的困難,這可能會限制配套診斷的供應,他們和我們都可能很難在臨牀社區中接受這一輔助診斷方法的使用。如果這種配套的診斷方法不能獲得市場的認可,就會對我們從產品銷售中獲得收入的能力產生不利影響。此外,我們與之簽訂合同的診斷公司可能決定停止銷售或製造我們預期用於產品候選產品開發和商業化的配套診斷,或者我們與該診斷公司的關係可能終止。我們可能無法與另一家診斷公司達成協議,以獲得替代診斷測試的供應,以便與產品候選人的開發和商業化有關,或以商業上合理的條件這樣做,這可能對我們的產品候選人的開發和/或商業化產生不利影響和/或推遲其商業化。
我們依靠第三方來進行我們的非臨牀和臨牀試驗。如果這些第三方不能成功地履行他們的合同義務或在預期的最後期限前完成,我們可能無法獲得我們的產品候選產品的監管批准或商業化,我們的業務可能會受到很大的損害。
我們一直依賴並計劃繼續依賴第三方CRO來監測和管理我們正在進行的非臨牀和臨牀項目的數據。我們依靠這些各方來執行我們的非臨牀和臨牀試驗,並僅控制其活動的某些方面。然而,我們有責任確保我們的每一項研究都按照適用的議定書、法律、規章和科學標準進行,而我們對CRO的依賴並不免除我們的監管責任。我們和我們的CRO必須遵守GCP,GCP是由FDA、EEA和類似的外國監管機構對我們的所有產品在臨牀開發中實施的條例和指南。監管當局通過定期檢查審判發起人、主要調查人員和審判地點來執行這些全球合作伙伴制度。如果我們或我們的任何CRO未能遵守適用的GCPs,在我們的臨牀試驗中生成的臨牀數據可能被認為是不可靠的,而FDA、EMA或類似的外國監管機構可能要求我們在批准我們的營銷申請之前進行更多的臨牀試驗。我們不能向您保證,在由某一監管機構進行檢查後,該監管機構將確定我們的任何臨牀試驗都符合GCP規定。此外,我們的臨牀試驗必須與產品生產的現行GMP規定。如果我們不遵守這些規定,我們可能需要重複臨牀試驗,這將推遲監管審批過程。
我們的CRO有權終止與我們的協議,如果沒有治癒的材料違約。此外,如果我們能夠合理地證明參與臨牀試驗的受試者的安全需要終止,如果我們為了債權人的利益或如果我們被清算的話,我們的一些CRO有能力終止與我們各自的協議。
如果我們與這些第三方CRO的任何關係終止,我們可能無法與替代CRO達成協議,或以商業上合理的條件這樣做。此外,我們的CRO不是我們的僱員,除了根據我們與這些CRO的協議提供的補救外,我們無法控制他們是否將足夠的時間和資源用於我們正在進行的臨牀和非臨牀項目。如果CRO未能成功地履行其合同義務或義務,或未達到預期的最後期限,如果他們需要被替換,或者他們所獲得的臨牀數據的質量或準確性因未能遵守我們的臨牀協議、監管要求或其他原因而受到損害,我們的臨牀試驗可能會被延長、延遲或終止,我們可能無法獲得監管。批准或成功地使我們的產品候選人商業化。因此,我們的運營結果和產品候選產品的商業前景將受到損害,我們的成本可能會增加,我們產生收入的能力可能會被推遲。
轉換或添加額外的CRO需要額外的成本,並且需要管理時間和精力。此外,有一個自然過渡時期,一個新的CRO開始工作。因此,延遲會發生,這會極大地影響我們的能力,以滿足我們期望的臨牀發展時間表。儘管我們認真管理與CRO的關係,但我們無法保證今後不會遇到類似的挑戰或延誤,也無法保證這些延誤或挑戰不會對我們的業務、財務狀況和前景產生重大的不利影響。
我們完全依賴第三方來製造我們的臨牀藥品供應,我們打算依靠第三方來生產任何經過批准的產品候選產品的商業供應,如果這些第三方未能獲得fda或類似的外國監管機構的批准,我們的任何產品候選產品的商業化都可能被停止、推遲或降低利潤,如果這些第三方不能向我們提供足夠數量的藥品。藥品或未達到可接受的質量水平或價格。
我們目前沒有,也沒有計劃在內部獲得基礎設施或能力,以製造用於臨牀試驗的臨牀藥品供應品,而且我們也缺乏資源和能力,無法在臨牀或商業規模上製造我們的任何產品候選產品。我們不控制我們的合同製造夥伴的生產過程,並且完全依賴於我們的合同製造夥伴,以遵守GMP對生產活性藥物物質和成品的監管要求。如果我們的合同製造商不能成功地製造符合FDA或其他機構嚴格的管理要求的材料,他們將無法獲得和/或維持對其生產設施的管理批准。此外,我們沒有控制我們的合同製造商的能力,以保持充分的質量控制,質量保證和合格的人員。如果FDA或類似的外國監管機構不批准這些設備用於我們的產品候選產品的生產,或者如果它在未來撤回任何此類批准,我們可能需要找到替代的製造設施,這將極大地影響我們開發、獲得監管批准或銷售我們的產品候選產品的能力,如果批准的話。
我們依賴於我們的製造商從第三方供應商那裏購買必要的材料,以生產我們的產品候選產品,供我們的臨牀試驗。我們用於生產藥品的原材料供應商數量有限,可能需要評估替代供應商,以防止生產我們的產品候選產品所需材料的生產可能中斷,以便臨牀試驗,如果獲得批准,最終用於商業銷售。我們對製造商獲取這些原材料的過程或時間沒有任何控制。此外,我們現時並無任何協議,以商業生產這些原料。任何由於需要替換第三方製造商而導致的正在進行的臨牀試驗的產品候選產品或其原材料部件的供應的任何重大延遲,都會大大推遲我們的臨牀試驗、產品測試和潛在的產品候選認證的完成。如果我們的製造商或我們在我們的產品候選產品獲得監管批准後無法購買這些原料,我們的產品候選產品的商業推出將被推遲,或出現供應短缺的情況,這將損害我們從銷售我們的產品候選產品中賺取收入的能力。
我們依賴於我們的第三方製造商進行過程開發和擴大工作,以支持更大的臨牀開發和商業化的要求,我們的產品候選人。以商業上合理的條件及時開展這些活動,對我們產品的成功開發和商業化至關重要。我們期望我們的第三方製造商能夠提供足夠數量的我們的產品候選產品,以滿足預期的臨牀和全面的商業需求,然而,如果我們目前工作的第三方無法滿足我們的供應需求,我們將需要確保替代供應商。雖然我們認為有其他合同製造商有技術能力來製造我們的產品候選產品,但我們不能肯定,與這些來源確定和建立關係不會造成重大延誤或材料額外費用。
在可預見的將來,我們預計將繼續依賴第三方合同製造商。雖然我們與Lonza就魯布拉原料藥的生產和成品製造商達成了長期協議,但我們尚未與任何替代供應商簽訂協議。目前,我們通過個人定購訂單獲得藥品成品的供應。
我們的商業成功取決於在醫生、病人、醫療保健支付人和癌症診所的主要經營者中,如果我們的產品獲得批准,我們的產品將獲得市場的廣泛接受。
即使我們獲得其他產品候選產品的監管批准,該產品也可能無法獲得醫生、醫療保健支付人、病人和醫學界的認可,這對商業成功至關重要。市場對任何我們獲得批准的產品候選人的接受程度取決於多種因素,包括:
|
·
| |
經監管部門批准的藥品和產品標籤的臨牀適應症,包括標籤上可能要求的警告; |
|
·
| |
被醫師、癌症診所的主要經營者和病人接受為安全有效的治療方法; |
|
·
| |
這類候選產品相對於替代治療的潛在優勢和感知優勢,特別是我們針對此類產品候選對象的患者子集; |
|
·
| |
在更廣泛的病人羣體中看到的這類產品的安全性,包括它在批准的適應症之外的使用; |
|
·
| |
第三方付款人和政府當局是否有足夠的償還和定價; |
如果我們的產品候選人獲得批准,但未能獲得醫生、醫療費用支付人和病人的充分接受,我們將無法產生可觀的收入,我們可能無法或保持盈利。
我們面臨來自其他生物技術和製藥公司的重大競爭,如果我們不能有效地競爭,我們的經營結果將受到影響。
生物技術和製藥業競爭激烈,技術變革迅速而重大。此外,腫瘤學市場競爭激烈。我們在美國和國際上都有競爭對手,包括大型跨國製藥公司、生物技術公司和大學以及其他研究機構。
Lynparza™ (olaparib) is approved in the U.S. as monotherapy in patients with germline BRCA mutated advanced ovarian cancer who have been treated with three or more prior lines of chemotherapy, as monotherapy for the maintenance treatment of adult patients with recurrent epithelial, fallopian tube or primary peritoneal cancer, who are in a complete or partial response to platinum-based chemotherapy and as monotherapy in patients with deleterious or suspected 有害的gBRCAm,人表皮生長因子2(HER 2)陰性轉移性乳腺癌,他們在新輔助、輔助或轉移環境中接受了化療。Lynparza還被歐盟批准用於BRCA突變的鉑敏感複發性漿液性卵巢癌的維持治療。在2018,CHMP採納了一個積極的意見,建議改變這個標籤,並擴大其使用範圍,以消除BRCA變異患者的使用限制。林帕薩在57個國家有卵巢癌的跡象(截至2017年底)。在2017,阿斯利康和默克公司宣佈了一個全球戰略腫瘤學合作,共同開發和共同商業化林帕薩多種癌症類型。Lynparza正被單獨調查,並與其他藥物結合,在包括乳腺癌、前列腺癌和胰腺癌在內的多種腫瘤類型的多種適應症中進行研究。
Zejula/niraparib(Tesaro)於2017在美國獲得批准,用於維持成人卵巢上皮癌、輸卵管或原發性腹膜癌患者對鉑類化療的完全或部分反應。澤朱拉於11月在歐盟獲得批准,以獲得同樣的指示。對Zejula在卵巢癌、乳腺癌和肺癌中的其他臨牀研究正在進行或計劃中。Janssen生物技術公司擁有專門為全世界前列腺癌患者開發和商業化尼拉培林的權利,但在日本除外。
在臨牀開發中有許多PARP抑制劑,包括AbbVie‘s veliparib和ABT-767,輝瑞的他拉唑帕林,北基因的BGB-290和檢查點治療學的CK-102。雖然大多數PARP抑制劑的開發主要集中在卵巢癌、乳腺癌和前列腺癌上,但更多的努力也是針對膀胱癌、肺癌和胰腺癌。
此外,包括PARP抑制劑,包括Lynparza或Zejula在內的聯合治療方法與其他抗癌藥物在不同的腫瘤學適應症中處於不同的臨牀發展階段。這些聯合療法可能會導致未來對Rubra的競爭壓力,並且這些研究的多個數據讀數預計在整個2018及以後。
我們的許多競爭對手擁有更多的資金、技術和其他資源,例如更多的研發人員和經驗豐富的營銷和製造機構。生物技術和製藥業的更多合併和收購可能導致更多的資源集中在我們的競爭對手身上。因此,這些公司可能比我們能夠更快地獲得監管批准,在銷售和銷售他們的產品方面也可能更有效。小型或早期公司也可能被證明是重要的競爭對手,特別是通過與大型、老牌公司的合作安排。由於技術在商業上的適用性方面的進步和這些行業更多的資本可供投資,競爭可能會進一步加劇。我們的競爭對手可能會成功地開發、獲取或許可在獨家基礎上的藥物產品,這些產品比我們目前正在開發或我們可能開發的任何藥物候選產品更有效或成本更低。如果獲得批准,我們的產品候選人將面臨來自商業藥品的競爭,以及我們競爭對手的開發管道中的藥物,然後進入市場。
老牌製藥公司可能會投入巨資,以加速新化合物的發現和開發,或在許可範圍內開發新化合物,從而降低我們產品的競爭力。此外,任何與核準產品競爭的新產品都必須在功效、方便、耐受性和安全性方面顯示出令人信服的優勢,以克服價格競爭並取得商業上的成功。因此,我們的競爭對手可能在獲得專利保護、獲得FDA、歐洲委員會或其他監管機構的批准或在我們之前發現、開發和商業化藥物方面取得成功,這將對我們的業務產生重大的不利影響。
補償可能是有限的,或無法在某些市場細分,我們的產品候選,這可能使我們難以出售我們的產品有利可圖。
新批准的藥物的第三方覆蓋率和報銷方面存在很大不確定性.我們已在美國獲得魯布拉有限指示的批准。我們打算尋求更多的批准,在美國、歐洲和其他選定的外國管轄區銷售魯布拉和其他產品。市場接受和銷售我們的產品候選人在國內和國際市場將在很大程度上取決於是否有足夠的覆蓋範圍和償還來自第三方支付任何我們的產品候選人,並可能受到現有和未來的醫療改革措施的影響。政府和其他第三方付款人越來越多地試圖通過限制新藥的覆蓋範圍和報銷水平來控制醫療成本,因此,他們可能無法支付或提供足夠的費用給我們的產品候選人。這些付款人可能會得出結論,我們的產品候選人比現有的或後來推出的產品安全、效率低或成本效益低,第三方支付人可能不會批准我們的產品候選產品的承保範圍和補償,或者停止為這些產品候選人提供保險和補償。
從政府或其他第三方付費機構獲得產品的覆蓋範圍和報銷批准是一個耗時而昂貴的過程,可能需要我們向付款人提供科學、臨牀和成本效益數據,以便我們使用我們的產品。我們可能無法提供足夠的數據,以獲得接受的保險和償還。我們不能確定我們的任何產品候選人都能得到保險或足夠的補償。即使我們獲得產品候選人的保險,第三方付款人也可能無法確定足夠的補償金額,這可能會降低對我們產品的需求或價格。如果我們的未來產品無法償還,或在範圍或數量上受到限制,或者如果定價設定在不能令人滿意的水平,我們可能無法實現或維持盈利能力。
在美國和某些外國司法管轄區,醫療保健制度已經並預期會繼續有多項法例和規管上的改變,影響我們出售產品的能力。美國政府和其他政府對推行醫療改革表現出極大的興趣。特別是,2003的“醫療保險現代化法案”修訂了美國醫療保險計劃下的許多產品的支付方法。這導致償還率降低。2010頒佈了“病人保護和平價醫療法案”,經“保健和教育和解法”(統稱為“平價醫療法案”)修訂。“平價醫療法案”極大地改變了政府和私營保險公司為醫療保健提供資金的方式。政府採取的這些改革措施可能會對其定價產生不利影響。
美國或國際上的醫療保健產品和服務,以及政府機構或其他第三方付款人提供的補償金額。
此外,支付方法,包括對配套診斷的支付,可能會受到保健立法和監管舉措的影響。例如,CMS已經開始捆綁醫療保險支付的某些實驗室測試,而病人接受服務在醫院門診設置,並在2018,CMS開始支付臨牀實驗室服務,根據加權平均報告的價格,私人支付,醫療保險優勢計劃,和醫療補助管理護理計劃支付實驗室服務。
在聯邦和州一級,已經並很可能將繼續提出立法和監管提案,旨在擴大醫療保健的可獲得性,並控制或降低醫療費用。最近,政府對製造商為其銷售產品定價的方式也進行了更嚴格的審查,這導致國會進行了幾次調查,並提出了旨在改革政府方案償還方法的法案。美國各州也越來越積極地執行旨在控制藥品定價的條例,包括價格或病人報銷限制、折扣、對某些產品准入的限制、銷售成本披露和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和批量採購。我們無法預測今後可能採取的主動行動。政府、保險公司、管理下的護理機構和其他醫療服務付款人繼續努力控制或降低醫療保健費用,可能會對我們可能獲得監管批准的任何藥物產品的需求,以及我們為我們的產品制定令人滿意的價格、創造收入、實現和保持盈利的能力產生不利影響。
在一些外國,特別是在歐洲聯盟,處方藥的定價受政府控制。在這些國家,與政府當局進行定價談判可能需要相當長的時間才能得到產品候選產品的市場批准。為了在一些國家獲得補償或定價批准,我們可能需要進行額外的臨牀試驗,比較我們的產品選擇與其他可用療法的成本效益。如果某一國家無法償還我們的產品候選產品或限制其範圍或數量,或者如果定價設定在不令人滿意的水平,我們可能無法在該國家實現或維持我們產品的盈利能力。
如果我們不能成功地吸引和留住高素質的人才,我們可能無法成功地實施我們的商業戰略。此外,我們將需要發展我們的組織,我們可能會在管理這種增長方面遇到困難,這可能會擾亂我們的業務。
近幾年來,我們這個行業的管理人員流失率很高。我們能否在競爭激烈的生物技術和製藥行業競爭,取決於我們能否吸引和留住高素質的管理、科學和醫療人員。We are highly dependent on our management, scientific and medical personnel, especially Patrick J. Mahaffy, our President and Chief Executive Officer, Lindsey Rolfe, our Executive Vice President of Clinical and Preclinical Development and Pharmacovigilance and Chief Medical Officer, Dale Hooks, our Senior Vice President and Chief Commercial Officer and Gillian C. Ivers-Read, our Executive Vice President, Technical Operations and Chief Regulatory Officer, whose services are critical to the successful implementation 我們的產品候選收購,開發和監管策略。
儘管我們努力挽留有價值的僱員,但我們的管理人員、科學、發展和商業團隊的成員可能會在短時間內終止其在我們的工作。根據他們的聘用安排,我們的每一位行政人員可隨時自願終止聘用,並可提供最少三十天的通知。我們與所有僱員的僱傭安排,均規定隨時聘用,即任何僱員均可在任何時間,或在行政主任以外的任何時間離職,而無須另行通知。例如,我們的前臨牀及臨牀前發展執行副總裁兼首席醫務官安德魯·R·艾倫(Andrew R.Allen)於7月份辭職,我們的前執行副總裁兼首席商業官史蒂文·霍爾特(Steven L.Hoerter)於2016年月辭職,我們的前執行副總裁兼首席財務官埃勒·馬斯特(Erle T.Mast)於今年3月辭職。我們的任何一名行政官員或其他關鍵僱員的服務喪失,以及我們無法找到合適的替代人員,都可能損害我們的業務、財務狀況和前景。我們的成功還取決於我們是否有能力繼續吸引、留住和激勵高技能的初級、中級和高級管理人員以及初級、中級和高級科學和醫療人員。
截至2018年月16,我們僱用了360名全職員工.隨着我們的發展計劃和戰略的發展,我們希望擴大我們的管理、運營、財務和其他資源的員工基礎。未來的增長將給管理層成員帶來重大的額外責任,包括需要確定、招聘、維持、激勵和整合更多的員工。此外,我們的管理層可能需要將不成比例的注意力從日常活動中轉移開來,並投入大量時間來管理這些增長活動。我們可能無法有效地管理業務的擴展,以致基礎設施出現弱點,導致運作上出現錯誤,喪失營商機會,流失僱員,以及令其餘僱員的生產力下降。我們的預期增長可能需要大量的資本支出,並可能從其他項目中挪用財政資源。如果我們的管理層不能有效地管理我們的預期增長,我們的開支可能會比預期的增加更多,我們創造收入的能力可能會降低,我們可能無法實施我們的業務戰略。
由於生物製藥、生物技術、製藥等行業對人才的激烈競爭,今後我們可能無法吸引或留住合格的管理和科學人才。我們與之競爭的許多其他製藥公司擁有比我們更多的財力和其他資源,不同的風險狀況,以及更長的行業歷史。他們還可以提供更多的機會和更好的機會,為職業發展。其中一些特點可能比我們所提供的更吸引高質量的候選人。為了吸引有價值的員工繼續在我們公司工作,我們提供了長期的股票期權。隨着時間的推移,股票期權對員工的價值受到我們無法控制的股價變動的顯著影響,而且可能在任何時候都不足以抵消其他公司更有利可圖的出價。如果我們不能繼續吸引和留住高素質的人才,我們開發和商業化產品候選人的速度和成功將是有限的。
我們的員工可能從事不當行為或其他不當活動,包括不遵守監管標準和要求,這可能對我們的業務產生重大不利影響。
我們面臨員工欺詐或其他不當行為的風險。員工的不當行為可能包括故意不遵守FDA的規定,向FDA提供準確的信息,遵守我們制定的製造標準,遵守聯邦和州的醫療欺詐和濫用法律法規,準確地報告財務信息或數據,或向我們披露未經授權的活動。特別是,醫療行業的銷售、營銷和商業安排要遵守廣泛的法律法規,以防止欺詐、回扣、自我交易和其他濫用行為。這些法律法規可以限制或禁止範圍廣泛的定價、折扣、營銷和促銷、銷售佣金、客户獎勵計劃和其他業務安排。僱員的不當行為也可能涉及不當使用臨牀試驗過程中獲得的信息,這可能會導致監管制裁和嚴重損害我們的聲譽。我們已通過了“商業道德守則”和其他合規政策,但並不總是能夠查明和制止僱員的不當行為,我們為發現和防止這種行為而採取的預防措施可能無法有效地控制未知或非管理的風險或損失,或保護我們不遵守這些法律或條例而受到政府調查或其他行動或訴訟。如果對我們採取任何此類行動,而我們沒有成功地捍衞自己或維護我們的權利,這些行動可能對我們的業務和業務結果產生重大影響,包括處以鉅額罰款或其他制裁。
我們與醫療專業人員、調查人員、顧問、客户(實際和潛在的)和第三方付款人的關係,現在和將來都直接或間接地受制於聯邦和州醫療欺詐和濫用法律、虛假索賠法、透明度和披露(或“陽光”)法、政府價格報告以及健康信息隱私和安全法。如果我們不能遵守或沒有完全遵守這些法律,我們將面臨重大的懲罰。
我們的業務可能直接,或間接通過我們的客户,受各種聯邦和州欺詐和濫用法律,包括,但不限於,聯邦反Kickback法規和聯邦虛假索賠法。這些法律可能影響到,除其他外,我們目前與臨牀研究人員和研究對象的活動,以及建議的和未來的銷售、營銷、疾病意識和病人援助計劃。此外,我們可能受到聯邦政府和我們開展業務的州的病人隱私條例的約束。可能影響我們運作能力的法律包括但不限於:
|
·
| |
“聯邦反回扣法”,其中除其他外,禁止任何人故意直接索取、收受、提供或支付報酬,包括任何回扣、賄賂或某些回扣。 |
或間接地誘使或作為交換,使個人轉介,或購買、租賃、訂購或推薦任何商品、設施、項目或服務,這些商品、設施、項目或服務將全部或部分按照聯邦醫療保健計劃,如醫療保險和醫療補助計劃支付。個人或實體不需要實際瞭解“聯邦反Kickback法規”或違反法律的特殊意圖才能實施違法行為;此外,政府可以聲稱,違反“聯邦反Kickback法規”而提出的索賠,包括因違反“聯邦反Kickback法規”而產生的物品或服務,構成“聯邦虛假索賠法”所指的虛假或欺詐性索賠; |
|
·
| |
federal false claims laws, including the False Claims Act, which impose criminal and civil penalties, including through civil “qui tam” or “whistleblower” actions, against individuals or entities from knowingly presenting, or causing to be presented, claims for payment or approval from federal programs, such as Medicare and Medicaid, that are false or fraudulent, or knowingly making a false statement to improperly avoid, decrease or 隱瞞向聯邦政府付款的義務; |
|
·
| |
“1996健康保險運輸和問責法”規定,除其他外,故意實施或企圖執行一項欺騙任何保健福利方案和就醫療事項作出虛假陳述的計劃,應負刑事和民事責任。類似於“聯邦反Kickback規約”,個人或實體不需要實際瞭解法規或違反法規的具體意圖即可實施違法行為; |
|
·
| |
HIPAA, as amended by the Health Information Technology for Economic and Clinical Health Act and its implementing regulations, which also imposes certain requirements on certain covered healthcare providers, health plans, and healthcare clearinghouses, as well as their respective business associates that perform services for them that involve the use, or disclosure of, individually identifiable health information, with respect to safeguarding the privacy, security and transmission of individually identifiable health information; |
|
·
| |
聯邦民事罰款法規,其中除其他外,禁止向該人知道或應當知道的醫療保險或醫療補助受益人提供或給予報酬,這可能會影響受益人選擇可由聯邦或州政府方案償還的某一特定項目或服務的供應商; |
|
·
| |
the federal Physician Payment Sunshine Act, which requires certain manufacturers of drugs, devices, biologics and medical supplies for which payment is available under Medicare, Medicaid or the Children’s Health Insurance Program (with certain exceptions) to report annually to the Centers for Medicare and Medicaid Services, or CMS, information related to payments or other transfers of value made to physicians (defined to include doctors, dentists, optometrists, podiatrists and chiropractors) 教授醫院,以及上述醫生及其直系親屬;持有的所有權和投資權益。 |
|
·
| |
聯邦消費者保護和不公平競爭法,這些法律廣泛地規範市場活動和可能損害消費者;的活動。 |
|
·
| |
聯邦政府價格報告法,其中要求藥品製造商計算複雜的定價指標並向政府機構報告,包括CMS,在這些機構中,此類報告價格可用於計算銷售產品的報銷和/或折扣。參加這些方案和遵守適用的要求,可能會導致聯邦醫療保健計劃下的報銷和基礎設施費用增加的產品有可能大幅折扣,並有可能限制藥品製造商提供某些市場折扣的能力---;和 |
|
·
| |
analogous state laws and regulations, such as state anti-kickback, false claims, consumer protection and unfair competition laws which may apply to pharmaceutical business practices, including but not limited to, research, distribution, sales and marketing arrangements as well as submitting claims involving healthcare items or services reimbursed by any third-party payer, including commercial insurers; state laws that require pharmaceutical companies to comply with the pharmaceutical industry’s voluntary compliance guidelines 以及聯邦政府頒佈的相關合規指南,以其他方式限制向醫療保健提供者和其他潛在轉診來源支付費用---;州法律,這些法律要求藥品製造商向各州提交關於價格和營銷信息的報告,如向保健專業人員和實體;提供的禮品、補償和其他報酬以及價值項目的跟蹤和報告,以及關於隱私的州法律。在某些情況下,健康信息的安全性,其中許多在重要方面彼此不同,可能沒有同樣的效果,從而使合規工作複雜化。 |
此外,我們的產品候選人在美國境外的研究和開發,以及我們的產品或產品候選產品一旦在美國境外商業化後的任何銷售,也很可能使我們受到上述醫療保健法以及其他外國法律的外國同等法律的約束。
努力確保我們的業務安排符合適用的醫療保健法,可能涉及大量費用,包括基礎設施投資和額外資源。由於這些法律涉及面廣,法定例外情況和安全港範圍狹窄,我們的一些商業活動,包括我們的諮詢協議和與醫生的其他關係,可能會受到一項或多項此類法律的質疑。政府和執法當局可能得出結論,我們的商業慣例不符合現行或未來的法規、條例或判例法,解釋適用的欺詐和濫用或其他醫療保健法律和條例。If our operations are found to be in violation of any of the laws described above or any other governmental regulations that apply to us, we may be subject to, without limitation, civil, criminal, and administrative penalties, damages, monetary fines, disgorgement, possible exclusion from participation in Medicare, Medicaid and other federal healthcare programs, contractual damages, reputational harm, diminished profits and future earnings and curtailment or restructuring of our operations, any 其中可能會對我們經營業務的能力和業務結果產生不利影響。
如果對我們提起產品責任訴訟,我們可能會承擔重大責任,並可能被要求限制我們的產品候選產品的商業化。
我們面臨產品責任的固有風險。例如,如果我們開發的任何產品在產品測試、製造、營銷或銷售過程中被發現造成傷害或被發現不合適,我們可能會被起訴。任何這類產品責任索賠可能包括對製造缺陷、設計缺陷、未警告產品固有危險、疏忽、嚴格責任和違反保證的指控。也可以根據國家消費者保護法提出索賠。如果我們不能成功地針對產品責任索賠為自己辯護,我們可能會承擔重大責任,或者被要求限制我們的產品候選產品的商業化,如果批准的話。即使是成功的防禦,也需要大量的財政和管理資源。不論其優點或最終結果如何,賠償責任要求都可能導致:
|
·
| |
對我們的產品候選人或我們可能開發的產品的需求減少; |
我們無法以可接受的成本獲得和保留足夠的產品責任保險,以防範潛在的產品責任索賠,這可能會阻止或抑制我們開發的產品的商業化。我們有一個產品責任保險計劃,涵蓋我們正在進行的臨牀試驗;然而,我們維持的保險金額可能不足以支付我們可能承擔的所有責任。雖然我們維持這類保險,但任何可能向我們提出的申索,都可能導致法院作出判決或和解,而該款額並非全部或部分由我們的保險所涵蓋,或超出我們的保險範圍的限額。我們的保險單也有各種除外條款,我們可能會受到產品責任索賠,但我們沒有保險。我們得付任何錢
法院裁定的金額,或在和解中談判達成的金額,超出我們的保險範圍限制,或不包括在我們的保險範圍內,而且我們可能沒有或能夠獲得足夠的資本支付這些金額。
我們的內部計算機系統,或我們的CRO或其他承包商或顧問使用的系統,可能會失敗或遭受安全漏洞。
我們和我們的商業夥伴在我們的計算機網絡上保存敏感的公司數據,包括我們的知識產權和專有商業信息,以及某些臨牀試驗信息。網絡安全攻擊越來越普遍,包括但不限於惡意軟件、企圖未經授權訪問數據和其他可能導致系統中斷、信息被盜用和數據腐敗的電子安全漏洞。儘管採取了安全措施,但我們的內部計算機系統和我們的CRO系統以及其他承包商和顧問系統很容易受到計算機病毒、未經授權的訪問、自然災害、恐怖主義、戰爭和電信以及電力故障的破壞。雖然到目前為止,我們還沒有經歷過任何這樣的物質系統故障、事故或安全破壞,但如果這樣的事件發生並在我們的運營中造成中斷,可能會對我們的開發計劃和業務運作造成實質性的破壞。例如,從已完成或正在進行的或計劃中的臨牀試驗中丟失臨牀試驗數據,可能會導致我們的監管審批工作出現延誤,並大大增加我們收回或複製數據的成本。如果任何干擾或安全漏洞導致我們的數據或應用程序丟失或損壞,或不適當地披露機密或專有信息,我們可能會承擔責任,我們的產品候選產品的進一步開發可能會被推遲。
與我們的知識產權有關的風險
如果我們在保護與我們的技術有關的知識產權的專利性質方面的努力不夠,我們可能無法在我們的市場上有效地競爭。
我們依靠專利、商業祕密保護和保密協議相結合來保護與我們的技術有關的知識產權。任何向第三方披露或盜用我們的機密專有信息,都可能使競爭對手迅速複製或超過我們的技術成就,從而削弱我們在市場上的競爭地位。
生物技術和製藥領域的專利實力涉及複雜的法律和科學問題,而且可能是不確定的。我們擁有的專利申請或許可可能導致在美國或其他國家頒發專利。即使專利確實成功頒發,第三方也可能對其有效性、可執行性或範圍提出質疑,這可能導致此類專利被縮小、失效或持有不可執行。2017年月20日,兩項反對申請被授予了歐洲的Rucaparib camsyate鹽/多形性專利。此外,即使我們的專利和專利申請沒有受到質疑,也可能無法充分保護我們的知識產權或阻止其他人圍繞我們的索賠進行設計。如果我們對產品候選人的專利申請所提供的保護的廣度或力度受到威脅,它可能威脅到我們將產品候選產品商業化的能力。此外,如果我們在臨牀試驗中遇到延誤,我們可以在專利保護下推銷我們的產品候選人的時間將會縮短。由於在美國和其他大多數國家的專利申請在提交後一段時間內是保密的,我們無法確定我們是第一個提出與我們的產品候選人有關的專利申請的人。此外,干涉程序可以由第三方發起,也可以由美國專利和商標局(“美國專利商標局”)發起,以確定誰是第一個發明我們申請專利主張所涉及的任何主題的人。
除了專利所提供的保護之外,我們還尋求依靠商業祕密保護和保密協議來保護專利知識---這是不可專利的,專利難以執行的程序,以及我們藥品開發過程中涉及專有技術的任何其他要素---專利不包括在內的信息或技術。Although we require all of our employees to assign their inventions to us, and all of our employees, consultants, advisors and any third parties who have access to our proprietary know-how, information or technology to enter into confidentiality agreements, we cannot be certain that our trade secrets and other confidential proprietary information will not be disclosed or that competitors will not otherwise gain access to our trade secrets or independently develop substantially equivalent information and techniques.此外,一些外國的法律並沒有以與美國法律相同的程度或同樣的方式保護所有權。因此,我們在保護和保護美國的知識產權方面可能會遇到重大問題。
國內外。如果我們不能阻止向第三方披露與我們的技術有關的知識產權,我們就無法在我們的市場上建立或保持競爭優勢,這會對我們的業務、經營結果和財務狀況產生重大的不利影響。
第三方的知識產權侵權主張可能會阻礙或拖延我們的藥物發現和開發努力。
我們的商業成功在一定程度上取決於我們避免侵犯第三方的專利和所有權。在生物技術和製藥業中,涉及專利和其他知識產權的訴訟數量很大,包括干涉、當事人間審查和複審美國專利貿易組織或反對的程序,以及外國法域的其他類似程序。在我們開發產品候選產品的領域中,有許多由第三方擁有的美國和外國已頒發的專利和待決專利申請。隨着生物技術和製藥業的發展和專利的增加,我們的產品候選產品可能引起侵犯他人專利權的風險增加。
第三方可以聲稱我們未經授權就使用了他們的專有技術。有或可能有第三方專利,對材料、配方、製造方法或與我們產品的使用或製造有關的處理方法提出要求。由於專利申請可能需要數年才能發出,所以現時可能會有專利申請待決,這可能會導致我們的產品候選公司日後可能會侵犯已批出的專利。此外,第三方可能在未來獲得專利,並聲稱使用我們的技術侵犯了這些專利。如果任何第三方專利是由具有管轄權的法院持有的,以涵蓋我們的任何產品候選產品的製造過程、在製造過程中形成的任何分子或任何最終產品本身,則任何此類專利的持有者都可以阻止我們將該產品候選產品商業化的能力,除非我們根據適用的專利獲得許可,或者直到這些專利到期或者它們是最終被裁定無效或不可執行。Similarly, if any third-party patent were held by a court of competent jurisdiction to cover aspects of our formulations, processes for manufacture or methods of use, including combination therapy or patient selection methods, the holders of any such patent may be able to block our ability to develop and commercialize the applicable product candidate unless we obtain a license, limit our uses, or until such patent expires or is finally determined to be held invalid or unenforceable.在任何一種情況下,這種許可證都不可能以商業上合理的條件獲得,也可能根本得不到。
對我們提出索賠的各方可以獲得禁令或其他公平的救濟,這會有效地阻礙我們進一步開發和商業化我們的一個或多個產品候選人的能力。對這些索賠的辯護,不論其優點如何,都將涉及大量的訴訟費用,並將使僱員的資源大量從我們的業務中轉移出去。如果成功地向我們提出侵權索賠,我們可能需要支付大量的損害賠償,包括三倍的賠償金和任意侵權的律師費,從第三方獲得一個或多個許可證,限制我們的使用,支付版權費或重新設計我們侵權產品的候選品,這可能是不可能的,也可能需要大量的時間和金錢支出。我們無法預測是否會有任何這樣的許可,或它是否會以商業上合理的條件提供。此外,即使在沒有訴訟的情況下,我們也可能需要從第三方獲得許可,以推進我們的研究或允許我們的產品候選產品商業化。如果有的話,我們可能無法以合理的成本或合理的條件獲得這些許可證中的任何一個。在這種情況下,我們將無法進一步開發和商業化我們的一個或多個產品候選人,這可能會嚴重損害我們的業務。
我們的一些產品的專利保護、專利起訴和專利執行取決於第三方。
雖然我們通常尋求並獲得充分起訴、維持和執行與我們產品候選人有關的專利的權利,但有時與我們產品候選者有關的平臺技術專利可能由我們的許可方控制。這就是在阿斯利康許可下使用專利的方法。我們的羅西替尼許可證也是如此,根據該許可證,Celgene有權起訴和維護涉及其核心發現技術的專利和專利申請,包括由該技術產生的分子骨架、積木和化合物類別,其中一些方面與羅西汀有關。我們有權共同起訴和維護羅西替尼的物質構成專利權,並享有第一項強制執行權。如果阿斯利康、賽爾吉恩或我們未來的任何許可夥伴未能適當起訴、維持或酌情強制執行涉及我們任何產品候選方的專利保護,我們開發這些產品並將其商業化的能力。
候選人可能會受到不利影響,我們可能無法阻止競爭對手製造、使用和銷售競爭產品。
我們可能會捲入保護或強制執行我們的專利或許可人的專利的訴訟,這可能是昂貴、耗時和不成功的。
競爭對手可能侵犯我們的專利或我們的許可人的專利。為了對抗侵權或未經授權的使用,我們可能需要提出侵權索賠,這可能是昂貴和耗時的。此外,在侵權訴訟中,法院可裁定我們或許可人的專利無效或不可執行,或以我們的專利不包括有關技術為由,拒絕另一方使用有關技術。任何訴訟或辯護程序的不利結果都可能使我們的一項或多項專利面臨無效、不可執行或狹義解釋的風險,並可能使我們的專利申請處於不頒發的風險之中。
由第三方挑起或由美國PTO提起的干涉程序可能是必要的,以確定發明相對於我們的專利或專利申請或我們許可人的發明的優先權。不利的結果可能會要求我們停止使用相關技術,或者試圖從主流方獲得許可。如果盛行方不以商業上合理的條件向我們提供許可證,我們的生意就會受到損害。訴訟或幹預程序可能失敗,即使成功,也可能導致大量費用,分散我們的管理層和其他僱員的注意力。
我們可能無法單獨或與許可人一起防止我們的商業祕密或機密資料被盜用,特別是在那些法律可能不像在美國那樣充分保護這些權利的國家。此外,由於知識產權訴訟需要大量的披露,我們的一些機密信息有可能在這類訴訟中被披露而受到損害。此外,還可以公開宣佈聽訊、動議或其他臨時程序或事態發展的結果。如果證券分析師或投資者認為這些結果是負面的,可能會對我們普通股的價格產生重大不利影響。
我們可能無法在全世界保護我們的知識產權。
在全世界範圍內,我們所有產品的專利申請、起訴和辯護都是昂貴得令人望而卻步的。競爭對手可以在我們沒有獲得專利保護的司法管轄區使用我們的技術來開發自己的產品,此外,還可以將侵權產品出口到我們擁有專利保護的地區,但執法力度不如美國。這些產品可能會與我們的產品在我們沒有任何已頒發專利的管轄區內競爭,而我們的專利申索或其他知識產權可能並不有效或不足以防止它們如此競爭。
許多公司在保護和捍衞外國法域的知識產權方面遇到了重大問題。某些國家,特別是某些發展中國家的法律制度不贊成執行專利和其他知識產權保護,特別是與生物製藥有關的知識產權保護,這可能使我們難以制止侵犯專利或銷售競爭產品的行為,普遍侵犯我們的專有權利。在外國司法管轄區執行我們的專利權的程序可能會導致大量費用,並使我們的努力和注意力轉移到我們業務的其他方面。
如果我們違反了任何協議,根據這些協議,我們可以從第三方獲得產品的商品化權,我們可能會失去對我們的業務很重要的許可權利。
我們為我們所有的產品候選人授權使用、開發和商業化的權利,並可能在將來加入類似的許可。根據我們現有的每一項許可協議,我們都要承擔商業化和開發、勤奮義務、里程碑付款義務、特許權使用費和其他義務。如果我們不遵守任何這些義務或以其他方式違反我們的許可協議,包括沒有利用商業上合理的努力開發或商業化產品候選產品,我們的許可夥伴可能有權全部或部分終止許可證。一般來説,我們的任何一個許可證或其他許可證在未來可能會對我們的業務、前景、財務狀況和經營結果造成重大損害。
知識產權並不一定能解決對我們競爭優勢的所有潛在威脅。
我們的知識產權將來所提供的保護程度是不確定的,因為知識產權有侷限性,可能無法充分保護我們的業務,或使我們無法保持我們的競爭優勢。以下例子具有説明性:
|
·
| |
其他人可能能夠製造出類似於我們產品候選的化合物,但這些化合物不屬於我們擁有或完全許可的專利的範圍; |
|
·
| |
我們或我們的許可人或戰略夥伴可能不是第一個提出我們擁有或專門許可的已頒發專利或待決專利申請所涵蓋的發明的人; |
|
·
| |
我們或我們的許可人或戰略合作伙伴可能不是第一個提出專利申請的人,涉及我們的某些發明; |
|
·
| |
其他人可以獨立開發類似或替代技術,或複製我們的任何技術,而不侵犯我們的知識產權; |
|
·
| |
我們擁有或擁有專門許可的專利可能不會為我們提供任何競爭優勢,或者由於競爭對手的法律質疑而被認為無效或不可執行; |
|
·
| |
我們的競爭對手可能在我們沒有專利權的國家開展研究和開發活動,然後利用從這些活動中獲得的信息,開發具有競爭力的產品,在我們的主要商業市場銷售; |
如果這些事件發生,可能會嚴重損害我們的業務、經營結果和前景。
與持有普通股及可轉換高級債券有關的風險
我們的普通股可能沒有一個可行的公開市場,因此你可能很難出售我們普通股的股份。
我們的普通股在11月首次公開發行(IPO)之前沒有公開交易。納斯達克全球精選市場上我們普通股的活躍交易市場可能無法維持。由於這些因素和其他因素,你可能無法以對你有吸引力的價格轉售你的股票。此外,一個不活躍的市場也可能損害我們通過出售普通股籌集資金的能力,並可能損害我們以普通股作為考慮因素而締結戰略夥伴關係或收購公司或產品的能力。
我們的股票的價格一直是,而且可能會繼續波動,你可能會失去你的全部或部分投資。
我們的普通股的交易價格一直並可能繼續波動,可能會受到各種因素的廣泛波動,其中一些因素是我們無法控制的。在截至#date0#12月31日的12個月內,我們在納斯達克全球選擇市場的普通股價格從每股39.83美元到99.45美元不等。除了本“風險因素”一節和本報告其他部分討論的因素外,這些因素還包括:
|
·
| |
如果獲得批准,我們未能成功地將我們的產品候選產品商業化; |
|
·
| |
意外的嚴重安全問題與使用我們的任何產品候選人有關; |
|
·
| |
適用於我們的產品候選人的法律或法規的變化,包括但不限於臨牀試驗的批准要求; |
|
·
| |
與專利、訴訟事項和產品申請人獲得專利保護的能力有關的糾紛或其他進展; |
|
·
| |
我們決定啟動臨牀試驗,不啟動臨牀試驗或終止現有的臨牀試驗; |
|
·
| |
不能為任何核準的藥物產品獲得足夠的產品供應,或無法以可接受的價格獲得足夠的產品供應; |
|
·
| |
我們對第三方的依賴,包括CMOS和CRO,以及為我們提供配套診斷產品的合作伙伴; |
|
·
| |
未能達到或超過我們可能向公眾提供的關於發展里程碑的任何財務指導或期望; |
|
·
| |
股票市場的整體表現和其他可能與我們的經營業績或競爭對手的經營業績無關的因素,包括類似公司的市場估值的變化; |
|
·
| |
宣佈我們或我們的競爭對手的重大收購、戰略夥伴關係、合資企業或資本承諾; |
|
·
| |
發表有關我們或我們行業的研究報告,或證券分析師提出正面或負面建議或撤回研究範圍; |
此外,股票市場,特別是納斯達克全球選擇市場,特別是生物技術公司,經歷了與這些公司的經營業績不相關或不成比例的價格和數量的極端波動。廣泛的市場和行業因素可能會對我們普通股的市場價格產生負面影響,而不管我們的實際經營業績如何。實現上述任何風險或任何廣泛的其他風險,包括在這些“風險因素”中描述的風險,都可能對我們普通股的市場價格產生巨大和重大的不利影響。
由於我們的未償還債券可轉換為我們普通股的股份,因此,我們的普通股的波動或壓低價格可能對我們的債券的交易價格產生類似的影響。此外,債券的存在可能會鼓勵市場參與者賣空我們的普通股,因為債券的轉換會壓低我們普通股的價格。
部分或全部債券的轉換可能會稀釋現有股東的所有權權益。未發行債券的持有人可在緊接2021年月15日營業日營業結束前的任何時間將其兑換。轉換後,債券持有人將獲得普通股股份。任何在公開市場出售在轉換後發行的普通股股份,都會對我們普通股的交易價格造成不利影響。我們無法預測未來發行債券的規模或它們可能對
我們普通股的市場價格。發行和出售大量普通股,或認為可能發生這種發行和出售,可能會對我國普通股的市場價格產生不利影響,並損害我們通過出售更多股本或可轉換債務證券籌集資金的能力。
隨着公司股價的波動,人們常常對公司提起訴訟。隨着我們的股價在11月的最新監管更新相關的下跌,已經對我們提起了許多訴訟(見“第一部分,第3項---法律訴訟”)。如果對我們提起這些訴訟和其他類似的訴訟,可能會造成大量費用,轉移管理層的注意力和資源,從而對我們的業務和財務狀況造成重大和不利的影響。
管理層的某些成員及其附屬公司擁有我們很大一部分股票,並能夠對股東批准的事項施加影響。
截至2018年月21日,我們的執行官員、董事及其附屬公司有權受益地擁有大約6.7%的有表決權股票。這些股東可能有能力影響提交我們的股東批准的事項的結果。我們執行官員、董事及其附屬公司的利益可能與我們資本存量的其他持有人的利益不一致,這些利益可能會阻止或阻止非邀約收購建議或對我們普通股的出價,而您可能認為這符合您作為我們的股東之一的最佳利益。
在公開市場上出售大量我們的普通股可能導致我們的股票價格下跌。
根據我們的股權激勵計劃,普通股如有未獲發行的期權,或留待日後發行,則可在各歸屬附表的規定所容許的範圍內,在公開市場出售。如果這些增發的普通股被出售,或者被認為會在公開市場上出售,我們的普通股的交易價格就會下降。
今後出售和發行我們的普通股或購買普通股的權利,包括根據我們的股權激勵計劃,可能會進一步稀釋我們股東的所有權百分比,並可能導致我們的股價下跌。
我們預計,今後將需要大量額外資本,以繼續我們計劃中的業務。為了籌集資金,我們可以以我們不時決定的價格和方式,在一次或多次交易中出售普通股、可轉換證券或其他股票證券。如果我們在多個交易中出售普通股、可轉換證券或其他股票證券,投資者可能會因隨後的出售而被大幅稀釋。這種出售也可能導致對我們現有股東的物質稀釋,新投資者可以獲得比我們普通股股東更高的權利、優惠和特權。
根據我們的股權激勵計劃,我們的薪酬委員會(或其指定的人)被授權向我們的員工、董事和顧問發放股權激勵獎勵。截至2017年月31,根據我們的2011股激勵計劃(“2011計劃”),我們的普通股可供未來捐贈的股份數為3,147,903股。The number of shares of our common stock reserved for issuance under our 2011 Plan will be increased (i) from time to time by the number of shares of our common stock forfeited upon the expiration, cancellation, forfeiture, cash settlement or other termination of awards under our 2009 Equity Incentive Plan, and (ii) at the discretion of our board of directors, on the date of each annual meeting of our 股東,由(X)中的少數人在該日增持我們的一些普通股,相當於我們當時流通股的4%,以及(Y)2,758,621股我們的普通股。根據我們的2011計劃,未來期權和限制性股票單位(RSU)授予和發行普通股可能會對我們普通股的市場價格產生不利影響。此外,我們的普通股中有相當一部分是保留在轉換債券後發行的。
我們的租船文件和特拉華州法律中的一些條款可能會產生反收購效應,可能會阻止其他人收購我們,即使收購對我們的股東有利,也可能阻止我們的股東試圖取代或撤換我們的現有管理層。
我們修訂和重述的註冊證書和章程中的規定,以及特拉華州法律的規定,可能會使第三方更難收購我們或增加收購我們的成本,即使這樣做會使我們的股東受益,或解除我們目前的管理層。這些規定包括:
|
·
| |
授權發行“空白支票”優先股,其條件可以確定,其股票可以未經股東批准發行; |
|
·
| |
禁止股東以書面同意的方式採取行動,從而要求所有股東在股東會議上採取行動; |
|
·
| |
允許我們的董事會加速將未償還的期權授予給某些導致控制權改變的交易;以及 |
|
·
| |
為董事會選舉或提出可在股東會議上採取行動的事項確定事先通知要求。 |
這些規定可能會使我們的股東更難以取代負責委任我們管理層成員的董事會成員,從而挫敗或阻止我們的股東試圖更換或撤換我們目前的管理層。由於我們是在特拉華州註冊的,我們受“特拉華普通公司法”第203條的規定管轄,該條款可能會阻止、拖延或阻止任何人收購我們或與我們合併,無論股東是否願意或對我們的股東有利。根據特拉華州的法律,公司一般不得與持有其15%或以上股本的任何股東進行商業合併,除非持有人持有該股票三年,或除其他事項外,董事會批准了該項交易。我們的公司章程或章程或特拉華州法律規定的,具有延緩或阻止控制變更的效果,可以限制股東獲得普通股的溢價機會,也可能影響某些投資者願意為普通股支付的價格。此外,我們的未償還票據的某些條款可能會使第三方更難或更昂貴地收購我們。債券的回購價格必須以現金支付,這一義務可能會阻止、推遲或阻止對我們的證券持有人有利的公司收購。
如果證券或行業分析師不發表研究報告或發表不準確或不利的研究,我們的股票價格和交易量可能下降。
我們普通股的交易市場在一定程度上取決於證券或行業分析師公佈的有關我們或我們業務的研究和報告。如果一位或多位分析師對我們的股票進行評級下調,或者發表對我們業務的不準確或不利的研究,我們的股價可能會下跌。如果其中一位或多位分析師停止對我們公司的報道或不定期發佈我們的報告,對我們股票的需求可能會減少,這可能導致我們的股價和交易量下降。
我們可能無法籌集所需的資金,以便在發生根本性變化時回購債券,而我們未來的債務可能限制了我們回購債券的能力。
如我們在債券到期日前經歷契約所界定的根本改變,持有人可要求我們以現金形式回購全部或部分債券,其基本換回價格相等於擬回購的債券本金的100%,另加基本更改回購日期的應計利息及未付利息,但不包括基本更改回購日期。我們可能沒有或能夠借入所需的資金,以在基本更改回購日期回購債券。此外,我們回購債券的能力可能會受到法律、規管當局或有關我們未來負債的協議的限制。當契約要求回購時,我們未能回購Notes將構成契約下的違約。契約下的違約或根本變化本身也可能導致我們未來債務協議的違約。如果在任何適用的通知或寬限期後加快償還有關的債項,我們可能沒有足夠的資金償還有關的債項,並在有需要時回購該批債券。
我們可能會招致更多債務,或採取其他會加劇上述風險的行動;而我們在未來的經營活動中,可能不會產生足夠的現金流量,以應付我們在“債券”項下所承擔的義務,以及我們日後可能招致的任何負債。
我們今後可能會承擔大量額外債務,但須遵守我們今後訂立的任何債務工具所載的限制,其中一些可能是擔保債務。根據“債券契約”的條款,我們不受額外債務、現有或未來債務的擔保、債務資本重組或採取一些不受債券契約條款限制的其他行動的限制,這些行動可能會削弱我們在到期時支付債券的能力。我們再融資債券或未來負債的能力,會視乎資本市場和當時的財政狀況而定。此外,管理我們未來債務的協議可能包含金融和其他限制性公約,這將限制我們從事可能符合我們長期最佳利益的活動的能力。我們不遵守這些公約可能導致違約,如果不加以糾正或放棄,可能導致我們的部分或全部債務加速。
項目1B。未解決的工作人員意見
不適用。
項目2.特性
Our principal offices are located at five leased facilities, a 29,177 square foot facility in Boulder, Colorado used primarily for corporate functions, a 24,877 square foot facility in San Francisco, California and a 32,660 square foot facility in Oakland, CA used for clinical development operations and research laboratory space, a 3,350 square foot facility in Cambridge, United Kingdom used for our European regulatory and clinical operations and a 416 square 意大利米蘭的足部設施用於臨牀手術。這些契約分別於2023、2021、2028、2019和2018年月日到期。我們相信,在可預見的將來,我們現有的設施足以應付我們的需要。
項目3.法律訴訟
羅西替尼相關訴訟
Following Clovis’ regulatory announcement in November 2015 of adverse developments in its ongoing clinical trials for rociletinib, Clovis and certain of its current and former executives were named in various securities lawsuits, the largest of which was a putative class action lawsuit in the District of Colorado (the “Medina Action”) which was settled on October 26, 2017 (the “Medina Settlement”). The 目前對克洛維斯的未決訴訟將在下文討論。雖然其他實體威脅要提出與羅西替尼有關的索賠和11月2015的聲明,但截至本文件提交之日,沒有任何實體提起訴訟。
On January 22, 2016, the Electrical Workers Local #357 Pension and Health & Welfare Trusts, a purported shareholder of Clovis, filed a purported class action complaint (the “Electrical Workers Complaint”) against Clovis and certain of its officers, directors, investors and underwriters in the Superior Court of the State of California, County of San Mateo (the “Electrical Workers Court”).電氣工人的投訴聲稱是代表一羣在7月份的股票發行中購買股票的人提出的。根據1933“證券法”(“證券法”)的某些條款(“證券法”),根據與麥地那行動中提出的基本相似的指控,申訴聲稱根據“1933證券法”(“證券法”)的某些規定,對克洛維斯證券的發行(“7月2015發行”)採取後續行動。2016年月30日,電力工人原告提交了一份修改後的申訴,增加了新的指控(“修正投訴”)。
2016年月28日,被告提出動議,要求在麥地那行動通過之前,暫緩電力工人的訴訟,並對修改後的申訴提出異議。2016年月23日,在聽取口頭辯論後,電力工人法院批准了暫緩執行的動議,並保留了對被告待決異議者作出裁決的決定。
該公司認為,“電業工人行動”中所稱的索賠通過Medina解決方案得到了法律的釋放和禁止,因此計劃在此基礎上尋求解僱“電業工人行動”。
2016,11月10日,AntipodeHomePartners(“AntipoDean”)在紐約州紐約州最高法院對Clovis及其某些官員、董事和承銷商提出了申訴(“反對投訴”)。“反對意見”指控被告違反了“證券法”的某些條款,向AntipoDean作了據稱虛假的陳述,並在2015年月日的發行材料中提供了與“證券法”有關的虛假陳述。
羅西替尼的功效、安全性和市場成功前景。除了“證券法”的主張外,反波蒂的申訴還主張科羅拉多州的法律主張和普通法主張。州法律和普通法的説法都是基於對羅西替尼取得FDA批准的錯誤和誤導性的陳述。反對訴訟要求賠償、衰退和懲罰性賠償。
2016年月15日,原告提交了一份經修正的申訴(“反對修正申訴”),聲稱對同一被告提出的申訴實質上是相同的,並聲稱糾正了原“反波蒂控訴”中的某些細節。
2017,1月31日,被告提出了一項動議,要求在科羅拉多州麥地那行動通過之前暫緩起訴。被告還於2017年3月29日提出動議,要求駁回“反對修正案”。
2017年月14日,克洛維斯的被告和反波迪安參加了調解,但沒有達成和解。
2017年8月8日,雙方參加了一次預定的聽證會,審理被告提出的暫緩起訴動議,並要求在紐約州紐約州最高法院法官馬斯利面前解職。在聽證會上,馬斯利法官批准了被告的請求。Per the Court’s August 10, 2017 order, Defendants’ motion to dismiss was held in abeyance and deemed submitted on November 1, 2017. On November 1, 2017, the Defendants provided a status update to the Court regarding the outcome of the hearing. The update informed the Court that Antipodean had excluded itself from the Medina Settlement, as memorialized in the final judgment entered by the 麥地那法院。目前還沒有就被告提出的駁回申請進行辯論的日期。
該公司打算對修改後的訴狀中的指控進行有力的辯護。然而,無法保證辯方會成功。
2017年3月,該公司的兩名假定股東---Macalinao和McKenry(“衍生原告”)向特拉華州法院對公司的某些董事和高級人員提出股東派生訴訟。在2017,5月4日,馬卡利諾和麥肯利的行動被合併在一個單一的程序中的所有目的,標題在重新克洛維斯腫瘤學,公司。派生訴訟,案件編號:2017-0222(“綜合衍生訴訟”)。
2017年5月18日,衍生產品原告提交了一份經綜合核實的股東衍生產品投訴(“綜合衍生產品投訴”)。綜合衍生產品申訴一般指稱,被告違反了其對公司的信託義務,據稱造成或允許歪曲公司的業務和前景,未能確保Tiger-X臨牀試驗是按照適用的規則、條例和協議進行的,並從事內幕交易。綜合衍生產品申訴的目的是依賴公司提供的文件,以響應事先要求檢查8 Del以下的Macalinao和McKenry向公司送達的公司賬簿和記錄的要求。C.第220節綜合衍生產品申訴除其他事項外,要求賠償金錢損失。
2017年7月31日,被告提出一項動議,要求駁回綜合衍生產品申訴。原告於2017年8月31日提出反對駁回的動議,被告於2017年月26日提交了一份答覆,進一步支持駁回申請。至於被告提出的駁回綜合衍生工具申訴的動議,則未有日期進行辯論。
該公司打算對綜合衍生產品申訴中的指控進行有力的辯護,但無法保證辯護會成功。
2017年月20日,據稱是該公司股東的該公司向美國科羅拉多州地區法院提交了股東派生訴訟(“郭訴”),指控該公司的某些高級人員和董事。郭樹清的申訴一般指稱,被告違反了他們欠公司的信託責任,要麼是輕率行事,要麼是重大疏忽,批准或允許虛假陳述公司的業務運作和前景。郭樹清的申訴還指控公司資產被浪費和不當得利。最後,郭申訴稱,某些被告個人違反了“證券交易法”第14(A)條,據稱是由於發行疏忽,導致發行,並參與發行“證券交易法”第14(A)條。
與2015年月11日召開的2015年度股東大會有關的公司表中的委託書中對股東的重大誤導陳述。郭樹清的申訴除其他外,要求賠償賠償金。
2017年月19日,雙方提出一項聯合動議,要求在駁回合併衍生產品申訴的動議得到解決之前,暫緩郭樹清的訴訟。2017年月20日,法院批准了暫緩執行的動議。
該公司打算對郭臺銘申訴中的指控進行有力的辯護,但無法保證辯護會成功。
此外,該公司還收到包括美國證券交易委員會和美國司法部在內的政府機構的詢問和要求,這些機構與該公司在11月發佈的監管更新公告有關,該公告稱美國食品和藥物管理局要求提供更多關於洛西替尼的有效性和安全性的臨牀數據。該公司繼續與這些機構合作進行調查。麥地那和解協議沒有解決這些問題,公司也無法預測它們的時間或結果。
董事補償訴訟
2017年5月10日,據稱是該公司股東的約翰·索拉克(JohnSolak)向特拉華州大法官法院(“Solak控告”)提出了股東派生訴訟(Solak控告),控告公司的某些董事和一名高級職員。Solak的申訴一般指控被告違反了他們欠公司的信託責任,採取了一項補償計劃,對非僱員董事被告進行了超額補償,涉及市值和規模相當的公司。Solak的申訴還指稱,由於這一據稱的錯誤賠償計劃,公司資產被浪費和不當得利。Solak的申訴除其他外,要求賠償金錢損失和實行公司治理改革。
法院下達了若干命令,延長被告對Solak申訴作出答覆的時間,除其他因素外,其依據是雙方正在進行討論,以努力解決Solak的訴訟。2018年月14日,當事雙方向法院提交了一封聯名信,要求在雙方進行最後解決討論時暫緩執行訴訟的所有最後期限。
2018年2月26日,被告與原告達成了妥協和和解的協議,旨在解決索拉克的訴訟。建議的和解須在就擬議和解的條款是否公平而舉行的和解聆訊結束後獲得法院批准,而該項聆訊將在向公司股東發出通知後才會進行。
根據擬議和解的條款,公司將在下一次股東大會上提交一份新的非僱員董事補償政策,供股東表決。根據擬議的新非僱員董事薪酬政策,現任非僱員董事的年度基本薪酬將定為35萬元至42.5萬元,為期兩年至五年。此外,擬議的政策還規定,新的非僱員董事的年度基本薪酬在52.5萬美元至637500美元之間,幷包括董事會和委員會服務的固定年費。擬議的和解方案還規定了公司將進行的若干公司治理改革,包括加強代理披露、編撰公司董事持股準則,以及加強對某些形式的董事報酬的披露要求。雖然作為擬議和解的一部分,將不向投資者支付現金,但預計原告的律師將提交一份費用申請,該公司已同意不反對達成一致同意的金額。擬議的解決方案中沒有承認有不當行為。
項目4.礦山安全披露
不適用。
第二部分
項目5.註冊人普通股市場、股東相關事項及發行者購買權益證券
市場信息和持有者
我們的普通股在納斯達克全球精選市場上的交易代號為“CLVS”。下表列出了在所述期間,我們的普通股的高、低銷售價格,如納斯達克全球精選市場所報告的那樣:
|
|
|
|
|
|
|
|
|
|
|
|
高
|
|
低層
|
|
|
2017年月31
|
|
|
|
|
|
|
|
|
第一季度
|
|
$
|
74.94
|
|
$
|
39.83
|
|
|
第二季度
|
|
$
|
96.92
|
|
$
|
45.42
|
|
|
第三季度
|
|
$
|
99.45
|
|
$
|
64.61
|
|
|
第四季度
|
|
$
|
86.26
|
|
$
|
57.33
|
|
|
2016年月31
|
|
|
|
|
|
|
|
|
第一季度
|
|
$
|
34.75
|
|
$
|
16.78
|
|
|
第二季度
|
|
$
|
20.90
|
|
$
|
11.57
|
|
|
第三季度
|
|
$
|
40.29
|
|
$
|
13.43
|
|
|
第四季度
|
|
$
|
46.97
|
|
$
|
25.50
|
|
在2018年月21日,我們的普通股有大約24名持有者。記錄號的持有者不包括更多的通過銀行、經紀人和/或其他金融機構持有其股票記錄的被指定人或街道名稱賬户的持有人。
股利
我們從來沒有宣佈或支付任何現金股利在我們的資本存量。我們目前打算保留所有可用的資金和任何未來的收益,以支持我們的業務,併為我們業務的增長和發展提供資金。在可預見的將來,我們不打算對我們的普通股支付現金紅利。日後有關股息政策的決定,將由董事局酌情決定,並視乎我們的經營結果、財務狀況、資本要求、合約限制、業務前景及董事局認為有關的其他因素而定。
根據股權補償計劃獲授權發行的證券
權益補償計劃資訊
截至2017年月31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
數目
|
|
|
|
|
|
|
|
|
|
證券
|
|
|
|
|
|
|
|
|
|
剩餘
|
|
|
|
|
|
|
|
|
|
可得
|
|
|
|
|
|
|
|
|
|
供發放
|
|
|
|
|
|
|
|
|
|
低於權益
|
|
|
|
|
|
|
|
|
|
補償
|
|
|
|
|
|
|
加權-
|
|
計劃
|
|
|
|
|
有價證券數量
|
|
平均
|
|
(不包括
|
|
|
|
|
在行使時發出
|
|
行使價格
|
|
證券
|
|
|
|
|
未完成的備選方案
|
|
未付
|
|
反射
|
|
|
|
|
和限制性股票
|
|
備選方案
|
|
(A)欄)
|
|
|
計劃類別
|
|
(a)
|
|
(b)
|
|
(c)
|
|
|
證券持有人批准的權益補償計劃(1)(2)
|
|
6,379,264
|
|
$
|
46.77
|
|
3,147,903
|
|
|
證券持有人未批准的權益補償計劃
|
|
—
|
|
|
—
|
|
—
|
|
|
共計
|
|
6,379,264
|
|
$
|
46.77
|
|
3,147,903
|
|
(1)截至#date0#12月31日,根據我們的2011股激勵計劃(“2011計劃”),我們已批准發行9,590,378股股票,該計劃在我們於11月完成首次公開發行時生效,其中包括根據2009股權激勵計劃(“2009計劃”)可供未來發行的192,185股股份,該計劃已轉入2011計劃。The number of shares of our common stock reserved for issuance under the 2011 Plan will be increased (i) from time to time by the number of shares of our common stock forfeited upon the expiration, cancellation, forfeiture, cash settlement or other termination of awards under the 2009 Plan and (ii) at the discretion of our board of directors, on the date of each annual meeting of our stockholders, by (X)在該日,我們增持的一些普通股,佔當時已發行普通股的4%,以及(Y)2,758,621股普通股。
(2)截至#date0#12月31日,我們的2011名員工股票購買計劃(“ESPP”)為我們保留了558,870股股票,該計劃於11月份我們的首次公開發行(IPO)結束時生效。The number of shares of our common stock reserved for issuance under the ESPP will be increased at the discretion of our board of directors, on the date of each annual meeting of our stockholders, by up to the lesser of (x) a number of additional shares of our common stock representing 1% of our then-outstanding shares of common stock on such date and (y) 344,828 shares of our common stock.
性能圖(1)
下面的圖表顯示了從12月31日到12月31日的累計總收益的比較,假設100美元的現金投資於我們的普通股,納斯達克綜合指數和納斯達克生物技術指數。這種回報是基於歷史結果,並不是為了表明今後的業績。納斯達克綜合指數和納斯達克生物技術指數的數據假設股息再投資。
(1)此績效圖不應被視為“徵集材料”或為經修正的“1934證券和交易法”第18節的目的而“提交”證交會,或以其他方式承擔該節規定的責任,也不應被視為以參考方式納入克洛維斯腫瘤學公司根據經修正的1933證券法提交的任何文件。
項目6.選定的財務數據
下表列出了我們在所述日期和期間選定的某些歷史財務數據。以下所列截至12月31日、2017、2016和2015年度的業務歷史數據和截至12月31日、2017和2016的歷史資產負債表數據是從我們已審計的財務報表中得出的,這些報表載於本年度10-K表的其他部分。下文所列截至12月31日、2014和2013年度的業務數據的歷史報表和截至12月31日、2015、2014和2013的歷史資產負債表數據是從本報告中未出現的已審計財務報表中得出的。
我們的歷史結果不一定表明在未來任何時期預期的結果。
以下精選的歷史財務數據應與“管理層對財務狀況和經營結果的討論和分析”以及我們的財務報表及其相關附註一併閲讀,這些內容載於本年度報表表10-K的其他部分。本節中選定的歷史財務信息無意取代我們的財務報表及其相關附註。
業務報表數據:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
2014
|
|
2013
|
|
|
|
|
(單位:千,但每股數額除外)
|
|
|
收入:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
產品收入淨額
|
|
$
|
55,511
|
|
$
|
78
|
|
$
|
—
|
|
$
|
—
|
|
$
|
—
|
|
|
許可證和里程碑收入
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
13,625
|
|
|
—
|
|
|
總收入
|
|
|
55,511
|
|
|
78
|
|
|
—
|
|
|
13,625
|
|
|
—
|
|
|
業務費用:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
銷售成本-產品
|
|
|
10,251
|
|
|
70
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
銷售成本-無形資產攤銷
|
|
|
1,486
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
研發
|
|
|
142,498
|
|
|
251,129
|
|
|
269,251
|
|
|
137,705
|
|
|
66,545
|
|
|
銷售、一般和行政
|
|
|
138,907
|
|
|
40,731
|
|
|
30,524
|
|
|
21,457
|
|
|
16,567
|
|
|
獲得過程中的研究和開發
|
|
|
—
|
|
|
1,300
|
|
|
12,000
|
|
|
8,806
|
|
|
250
|
|
|
無形資產減值
|
|
|
—
|
|
|
104,517
|
|
|
89,557
|
|
|
3,409
|
|
|
—
|
|
|
或有購買考慮的公允價值變動
|
|
|
—
|
|
|
(24,936)
|
|
|
(24,611)
|
|
|
707
|
|
|
405
|
|
|
總開支
|
|
|
293,142
|
|
|
372,811
|
|
|
376,721
|
|
|
172,084
|
|
|
83,767
|
|
|
營運損失
|
|
|
(237,631)
|
|
|
(372,733)
|
|
|
(376,721)
|
|
|
(158,459)
|
|
|
(83,767)
|
|
|
其他收入(費用):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
利息費用
|
|
|
(10,428)
|
|
|
(8,491)
|
|
|
(8,372)
|
|
|
(2,604)
|
|
|
—
|
|
|
外幣收益(虧損)
|
|
|
(82)
|
|
|
(580)
|
|
|
2,740
|
|
|
3,580
|
|
|
(535)
|
|
|
法定賠償損失
|
|
|
(105,477)
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
其他收入(費用)
|
|
|
3,643
|
|
|
633
|
|
|
416
|
|
|
(240)
|
|
|
(178)
|
|
|
其他收入(費用),淨額
|
|
|
(112,344)
|
|
|
(8,438)
|
|
|
(5,216)
|
|
|
736
|
|
|
(713)
|
|
|
所得税前損失
|
|
|
(349,975)
|
|
|
(381,171)
|
|
|
(381,937)
|
|
|
(157,723)
|
|
|
(84,480)
|
|
|
所得税福利(費用)
|
|
|
3,578
|
|
|
32,034
|
|
|
29,076
|
|
|
(2,308)
|
|
|
(52)
|
|
|
淨損失
|
|
$
|
(346,397)
|
|
$
|
(349,137)
|
|
$
|
(352,861)
|
|
$
|
(160,031)
|
|
$
|
(84,532)
|
|
|
基本和稀釋後普通股淨虧損
|
|
$
|
(7.36)
|
|
$
|
(9.07)
|
|
$
|
(9.79)
|
|
$
|
(4.72)
|
|
$
|
(2.95)
|
|
|
基礎和稀釋加權平均普通股已發行
|
|
|
47,047
|
|
|
38,478
|
|
|
36,026
|
|
|
33,889
|
|
|
28,672
|
|
資產負債表數據:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
2014
|
|
2013
|
|
|
|
|
(單位:千)
|
|
|
現金、現金等價物和可供出售的證券
|
|
$
|
563,731
|
|
$
|
266,183
|
|
$
|
528,588
|
|
$
|
482,677
|
|
$
|
323,228
|
|
|
營運資本
|
|
|
545,423
|
|
|
213,813
|
|
|
464,125
|
|
|
443,400
|
|
|
307,644
|
|
|
總資產
|
|
|
735,230
|
|
|
364,557
|
|
|
713,386
|
|
|
786,206
|
|
|
649,635
|
|
|
可轉換高級票據
|
|
|
282,406
|
|
|
281,126
|
|
|
279,885
|
|
|
278,680
|
|
|
—
|
|
|
普通股及額外繳入資本
|
|
|
1,887,249
|
|
|
1,174,989
|
|
|
1,130,016
|
|
|
785,123
|
|
|
762,204
|
|
|
股東權益總額(赤字)
|
|
|
367,636
|
|
|
(3,634)
|
|
|
300,650
|
|
|
331,630
|
|
|
497,886
|
|
項目7.管理層對財務狀況及經營成果的探討與分析
請參閲以下有關本公司財務狀況及經營結果的討論及分析,以及本年報末的財務報表及有關附註,請參閲表格10-K。本年度報告中關於10-K表格的討論和分析或其他部分所載的一些信息,包括關於我們業務和相關融資的計劃和戰略的信息,包括涉及風險和不確定因素的前瞻性陳述。您應該閲讀本報告的“風險因素”一節,以瞭解可能導致實際結果與以下討論和分析中所包含的前瞻性聲明所描述或暗示的結果大不相同的重要因素。
概述
我們是一家生物製藥公司,致力於在美國、歐洲和其他國際市場獲取、開發和商業化創新的抗癌藥物。我們的發展計劃旨在治療癌症患者的特定亞羣,同時與合作伙伴一起開發診斷工具,將發展中的化合物導向最有可能從其使用中受益的人羣。
Our marketed product Rubraca® (rucaparib) is approved on an accelerated basis in the United States by the Food and Drug Administration (“FDA”) as monotherapy for the treatment of patients with deleterious BRCA (human genes associated with the repair of damaged DNA) mutation (germline and/or somatic) associated advanced ovarian cancer who have been treated with two or more chemotherapies, and selected for therapy based on an FDA-approved companion diagnostic for Rubraca.這一適應症的持續批准可能取決於驗證和説明驗證性試驗的臨牀效益。為此,我們於2016在美國推出了魯布拉。
美國食品和藥物管理局目前正在優先審查的時間表,我們的snda作為維持治療的成人患者複發性上皮卵巢,輸卵管,或原發性腹膜癌,誰是一個完全或部分反應鉑為基礎的化療。
我們的MAA提交給EMA,用於治療Rubra卵巢癌的指示,目前正在由EMA的CHMP進行審查。繼科學諮詢小組-腫瘤學會議和我們在2月份的CHMP會議上所作的口頭解釋之後,CHMP傳達了對MAA的積極趨勢投票,以及他們打算在3月#number1#會議上就治療指標進行最後表決。
In addition, we have two other product candidates: lucitanib, an oral inhibitor of the tyrosine kinase activity of vascular endothelial growth factor receptors (“VEGFR”) 1-3, platelet-derived growth factor receptors (“PDGFR”) alpha and beta and fibroblast growth factor receptors (“FGFR”) 1-3, and rociletinib, an oral mutant-selective inhibitor of epidermal growth factor receptor (“EGFR”). While 我們已經停止了正在進行的每一個候選人的試驗,我們繼續為臨牀醫生推薦繼續治療的患者提供藥物。我們維護着盧西坦的某些發展和商品化權利,以及羅西替尼的全球發展和商業化權利。
我們於2009開始運營。到目前為止,我們已經投入了大量的資源,用於確定產品候選人併為其頒發許可證,對這些產品候選人進行開發活動,併為這些業務提供一般和行政支持。從12月31日到2017,我們與Servier的合作和許可協議已經創造了1360萬美元的許可和里程碑收入,在截至12月31日的一年中,2017已經創造了5550萬美元的產品收入與Rubra的銷售相關,我們於12月19日開始將其商業化。我們主要是利用出售可轉換優先股、發行可轉換本票、公開發行普通股和可轉換高級票據發行所得的淨收入為我們的業務提供資金。
我們從未盈利過,截至2017年月31,我們的累計赤字為14.474億美元。截至12月31日、2017、2016和2015,我們分別遭受了346.4百萬美元、349.1百萬美元和2.79億美元的淨虧損,截至12月31日,我們擁有現金、現金等價物和可供出售的證券總計1.8億美元。
我們預計在可預見的將來將遭受重大損失,因為我們承擔與Rubra有關的商業活動的費用。今年1月,我們以每股41.00美元的價格公開發行了575萬股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為221.2美元。2017年6月,我們以每股88.00美元的價格,公開發行了3920454股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為324.6美元。根據我們目前的估計,我們相信我們的現金、現金等價物和可供出售的證券將使我們能夠至少在未來12個月內為各項活動提供資金。Until we can generate a sufficient amount of revenue from Rubraca, we expect to finance our operations in part through additional public or private equity or debt offerings and may seek additional capital through arrangements with strategic partners or from other sources. Adequate additional financing may not be available to us on acceptable terms, or at all. Our failure to raise capital as and when needed would have a 對我們的財務狀況和我們執行業務戰略的能力產生負面影響。我們需要創造大量收入才能實現盈利,而且我們可能永遠也不會這樣做。
產品許可證協議
有關我們的產品許可協議的討論,請參見注13,許可證協議,載於第二部分第8項的綜合財務報表説明,財務報表和補充數據,本年報表格10-K。
財務業務概覽
收入
在2017年間,我們記錄了5,550萬美元的收入與魯布拉的銷售有關,我們於#date0#開始商業化。此外,我們通過我們的病人援助計劃向符合條件的病人免費分發藥物,該項目的商業價值約為1 410萬美元。關於我們的收入確認政策的進一步討論,見下文“關鍵會計政策和重大判斷和估計”。我們能否創造收入和盈利取決於我們成功地將產品商業化的能力。如果我們不能在美國和任何可能獲得批准的外國領土成功地將Rubra商業化,或此類批准的任何重大拖延,都可能對我們執行我們的業務戰略的能力產生重大不利影響,並最終從魯布拉產生足夠的收入,以達到或維持盈利或維持我們預期的業務水平。
目前,我們只在專業分銷商或專業藥房供應商將產品出售給病人或醫療服務提供者時才確認產品銷售的收入,因此降低了對產品回報所作估計的重要性。自2018年月1日起,我們採用了會計準則編碼(ASC),題目606,“與客户簽訂合同的收入”。當我們的客户、專業經銷商和專業藥房供應商控制我們的產品時,我們將開始確認我們的收入。這將使我們比採用新標準前大約提前兩至四周確認收入,並將增加估計可變考慮因素的重要性,包括產品回報、回扣和回扣。
我們採用了改進的回顧性方法來採用新的標準。這意味着我們不會重述先前發佈的財務報表,而是將一次性調整為230萬美元的留存收益。這一調整是指我們的產品在2018年月1日前銷售給我們的客户,這些產品還沒有出售給病人或醫療服務提供商,但被相關的淨調整總額和其他直接成本(包括版税和銷售獎勵補償)所抵消。
在2017年間,當我們的產品被賣給專門的分銷商和藥店時,税收被確認為美國的税收,這是一種不同於圖書處理的方法。收入確認上的差異導致了我們的專業經銷商和藥房供應商在2017年月31持有的我們產品的銷售價值的遞延税資產的建立。遞延税資產被全額估價備抵抵消,對我們的業務報表沒有影響。自2018年月1日起採用ASC 606後,當我們的產品出售給專業分銷商藥店時,收入將被確認,這將與税收待遇相匹配,從而不會產生遞延税資產。
關於這一採用和淨產品收入核算的完整討論,見注2,重要會計政策摘要在“最近發佈的會計準則”中 第11節和注11,收入確認.
研發費用
研究和開發費用包括開發產品候選人和配套診斷所需的費用,其中包括:
|
·
| |
許可證費用和里程碑付款與獲得許可的產品,這是報告我們的綜合報表的運營和綜合損失,以獲得過程中的研究和開發; |
|
·
| |
與員工有關的費用,包括工資、福利、差旅費和股票補償費用; |
|
·
| |
根據與CRO和進行臨牀試驗的調查場所達成的協議而產生的費用; |
|
·
| |
市場研究、疾病教育和其他商業產品規劃活動,包括僱用一個美國銷售、營銷和醫療事務組織,為Rucaparib的商業推出做準備;以及 |
|
·
| |
與開發我們的產品候選產品的配套診斷相關的活動。 |
研究和開發費用按已發生的費用計算。許可證費用和與授權產品和技術相關的里程碑付款,如果確定它們沒有其他未來用途,將被支出。某些開發活動的成本,例如臨牀試驗和臨牀供應的製造,是根據對完成特定任務的進展情況的評估,使用諸如病人登記、臨牀站點激活或我們供應商提供給我們的信息來確認的。由於美國食品和藥物管理局批准魯布拉和停止註冊的羅西替尼,我們的研究和開發費用減少了2017,因為商業化相關的費用被歸類為銷售,一般和行政費用,而不是研究和開發成本。我們的研究和開發費用將在2018增加,因為我們正在進行的Rucaparib研究進展。
下表列出了我們正在開發的產品的研發和過程中研發成本。與人員有關的成本、折舊和基於份額的補償不分配給特定的項目,因為它們被部署在正在開發的多個項目中,因此,在下表中被單獨列為人事和其他費用。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
|
|
(單位:千)
|
|
|
Rucaparib費用
|
|
|
|
|
|
|
|
|
|
|
|
研發
|
|
$
|
72,901
|
|
$
|
101,598
|
|
$
|
58,922
|
|
|
獲得過程中的研究和開發
|
|
|
—
|
|
|
1,300
|
|
|
—
|
|
|
Rucaparib共計
|
|
|
72,901
|
|
|
102,898
|
|
|
58,922
|
|
|
利便費
|
|
|
|
|
|
|
|
|
|
|
|
研究與開發(A)
|
|
|
(1,187)
|
|
|
(1,337)
|
|
|
1,923
|
|
|
利維坦b共計
|
|
|
(1,187)
|
|
|
(1,337)
|
|
|
1,923
|
|
|
羅西替尼費用
|
|
|
|
|
|
|
|
|
|
|
|
研發
|
|
|
7,712
|
|
|
43,768
|
|
|
122,912
|
|
|
獲得過程中的研究和開發
|
|
|
—
|
|
|
—
|
|
|
12,000
|
|
|
羅西替尼b共計
|
|
|
7,712
|
|
|
43,768
|
|
|
134,912
|
|
|
人事和其他費用
|
|
|
63,072
|
|
|
107,100
|
|
|
85,494
|
|
|
共計
|
|
$
|
142,498
|
|
$
|
252,429
|
|
$
|
281,251
|
|
(a)這一數額反映了根據附註13所述的協作和許可協議,Servier應償還的開發費用減去實際發生的費用,許可證協議,本年報所載經審計的綜合財務報表,以表格10-K。
在2017和2016年間,研發費用繼續下降,主要是由於羅西替尼項目的開發活動減少。
銷售、一般和行政費用
銷售、一般和行政費用主要包括行政、財務、法律、投資者關係、人力資源和信息技術職能人員的薪金和相關費用。其他一般和行政費用包括設施費用、通信費用、信息技術費用、公司保險和法律、諮詢和會計服務的專業費用。隨着林業局於12月19日批准魯布拉,2016,所有與魯布拉相關的銷售和營銷費用都包括在銷售、一般和行政費用中。我們預計,我們的銷售,一般和行政費用將繼續增加,以支持我們的商業活動,在美國和歐洲的魯布拉。
獲得過程中的研究和開發費用
獲得的過程中研發費用包括購買一種新藥物化合物的前期付款,以及隨後的里程碑付款。獲得的過程中研究和開發付款立即被支出,條件是該藥物尚未獲得市場營銷的監管批准,並且在沒有獲得這種批准的情況下,沒有替代的未來用途。一旦獲得監管批准,收購權的付款和相關的里程碑付款就會資本化,並將這些資產的攤銷記為產品銷售成本。
無形資產減值
與2013年度收購EOS有關,我們記錄了無形資產,以反映截至收購之日所獲得的過程中研發(IPR&D)的公允價值。公允價值是根據貼現現金流模型確定的,使用的假設涉及開發時間、開發和管理成功的概率、銷售和商業化因素以及產品壽命估計。在2016第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦,我們記錄了104.5百萬美元的減值費用。在2015第四季度,我們記錄了8 960萬美元的知識產權無形資產減值費用。截至2017年月31,綜合資產負債表上記錄的知識產權無形資產為零。
或有購買考慮的公允價值變化
在11月收購EOS方面,我們還記錄了一項購買考慮負債,該負債相當於未來付款的估計公允價值,這取決於各項監管和銷售里程碑的實現情況。在收購日期之後,我們在每個報告期內按公允價值重新計量或有考慮安排,並記錄公允價值的變化,以改變或有購買考慮的公允價值和外幣損益,以反映業務和綜合損失綜合報表中外幣折算率的變化。公允價值的變化主要歸因於關於實現這些里程碑的可能性和時間推移的新信息。在缺乏新的信息的情況下,公允價值的變化只反映了隨着我們在實現未來里程碑方面的進展,時間的推移。在2016第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦,我們的或有購買考慮負債的公允價值減少了2,550萬美元。在2015第四季度,我們記錄了2,690萬美元的或有購買考慮負債的公允價值減少,因為估計的概率加權未來里程碑付款的變化,以及這種付款的時間,為盧吉塔尼計劃。截至#date0#12月31日,綜合資產負債表上記錄的或有購買考慮負債仍為零,原因是實現任何一項盈利監管里程碑的不確定性,因此未來里程碑付款的可能性極小,相當於前EOS股東。
其他收入和費用
其他收入和支出主要包括與CRO、調查地點和合同製造商之間的交易所產生的外匯損益,這些交易是以美元以外的貨幣支付的。其他費用還包括與我們的可轉換高級票據相關的利息費用。
關鍵會計政策與重大判斷和估計
我們對我們的財務狀況和經營結果的討論和分析是以我們的財務報表為基礎的,這些報表是根據美國公認的會計原則編制的。這些財務報表的編制要求我們對報告的資產、負債、支出和收入以及相關披露的數額作出估計和判斷。在持續的基礎上,我們評估我們的估計和判斷,包括那些與收入,無形資產減值,臨牀試驗應計和基於股票的補償費用。我們的估計依據的是歷史經驗、已知的趨勢和事件以及在當時情況下被認為是合理的各種其他因素,這些因素的結果構成了對其他來源不容易看出的資產和負債的賬面價值作出判斷的基礎。在不同的假設或條件下,實際結果可能與這些估計不同。
我們的重要會計政策更詳細地描述在本年度報告的其他地方的合併財務報表的附註中,表10-K。我們認為以下會計政策對我們編制財務報表所用的判斷和估計是最重要的。
收入確認
We are currently approved to sell Rubraca in the United States markets. We distribute our product principally through a limited number of specialty distributor and specialty pharmacy providers, collectively, our customers. Our customers subsequently sell our products to patients and health care providers. Separately, we have arrangements with certain payors and other third parties that provide for government-mandated and privately-negotiated rebates, chargebacks and discounts.
當有有説服力的安排證據時,產品銷售收入被確認,交貨已經發生,產品的所有權和相關的損失風險已轉給客户,價格是固定的或可確定的,向客户收取的款項已得到合理的保證,所有的履約義務都已得到履行,還可以合理地估計退貨和津貼。產品銷售記錄在扣除估計的回扣、回扣、折扣和其他扣減以及估計的產品回報之後。估算回扣、回扣、折扣、產品退貨和其他扣減需要對未來事件和不確定性做出重大判斷,並要求我們在很大程度上依賴於假設和歷史經驗。我們只在產品被專業經銷商或專業藥房供應商出售給病人或醫療服務提供者後,才能確認產品銷售的收入,因此降低了對產品回報的估計的重要性。
在截至12月31日的2017年度,我們確認了5,550萬美元的產品收入。根據我們在監管批准前生產產品的相關費用政策,在截至12月31日的一年中,被確認為收入的Rubra單位的某些費用在美國食品和藥物管理局12月19日批准之前被支出,並且在本期的銷售成本中包含了最低數額。當我們耗盡這些庫存時,我們期望銷售成本與產品收入相關的增加。2017年度,大部分產品的銷售都是商品化前的庫存。
在符合下列標準的情況下,從里程碑付款中確認收入:(1)存在有説服力的安排證據;(2)已經交付或提供了服務;(3)價格是固定或確定的;(4)合理地保證了可收取性。我們會作出判斷,以確定是否有合理的保證,或服務是否已按照安排提供。我們根據與交易相關的支付條件來評估費用是固定的還是可確定的,以及銷售價格是否需要退款或調整。我們主要根據客户的付款歷史和客户的信譽來評估可收性。以實現里程碑為條件的付款將在實現里程碑的時期內予以確認。
應計研發費用
在編制財務報表的過程中,我們必須估算應計費用。這一過程涉及審查未結合同和定購單,與我們的人員溝通,以確定代表我們執行的服務,並估計在我們尚未收到發票或以其他方式通知實際費用時所執行的服務水平和所產生的相關費用。我們的大多數服務供應商每月向我們開具拖欠服務的發票,或在合同里程碑達到時支付。我們製造
根據我們當時所知道的事實和情況,對我們財務報表中每個資產負債表日期的應計費用作出估計。我們定期與服務供應商確認我們的估算的準確性,並在必要時作出調整。估計應計研究和開發費用的例子包括:
|
·
| |
支付給供應商與產品製造,開發和分配臨牀用品有關的費用。 |
我們的臨牀研究費用是基於我們對所獲得的服務的估計和根據與多個代表我們進行和管理臨牀研究的CRO簽訂的合同而花費的。這些協定的財務條件須經過談判,合同各不相同,可能造成付款流動不平衡。在某些情況下,向我們的供應商支付的費用將超過所提供的服務水平,並導致提前支付臨牀費用。其中一些合同的付款取決於一些因素,如患者的成功註冊和臨牀試驗里程碑的完成。在收取服務費時,我們估計服務所需的時間、病人登記人數、已啟用的場地數目及每段時間內所需付出的努力程度。如果服務的實際執行時間或工作水平與我們的估計不同,我們將相應地調整應計或預付款項。雖然我們不期望我們的預算與實際發生的數額有重大的不同,但我們對所提供服務的現狀和時間相對於實際情況和所提供服務的時間的理解可能有所不同,並可能導致我們在任何特定時期報告數額過高或過低。
股份補償
要確定股票補償的記錄金額,就需要我們對股票期權的公允價值作出估計,以確定其授予日期。補償費用在裁決的歸屬期內確認。以股票為基礎的獎勵的公允價值的計算要求我們作出高度主觀的假設。我們使用Black-Soles期權定價模型來評估我們的股票期權獎勵.使用這種估值方法需要我們對預期股息率、普通股價格波動、接近股票期權預期期限和股票期權預期期限的無風險利率進行假設。我們使用的股息收益率為零,因為我們從未支付過現金紅利,也沒有支付現金紅利的當前意圖。
截至12月31日、2017、2016和2015歲的年度股票期權的公允價值是在贈款日期使用下列加權平均假設估算的:
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
股利收益率
|
|
—
|
|
—
|
|
—
|
|
|
波動性(A)
|
|
89
|
%
|
93
|
%
|
72
|
%
|
|
無風險利率(B)
|
|
2.16
|
%
|
1.77
|
%
|
1.77
|
%
|
|
預期任期(年份)(C)
|
|
5.8
|
|
5.8
|
|
6.1
|
|
(a)波動率*預期波動率是根據我們的歷史數據估計的。
(b)無風險利率:利率是基於美國國債零息票的授予日的收益率,美國國債的到期日接近期權的預期期限。
(c)預期期限::預計的獎項期限是根據我們的歷史數據估算的。
我們確認,截至12月31日、2017、2016和2015的年度,基於股票的薪酬支出分別約為4,470萬美元、3,980萬美元和4,040萬美元。截至2017年月31,我們有8,940萬美元的未確認股票補償費用,扣除相關的沒收預算,預計將在3.3年的加權平均剩餘歸屬期內確認。我們預計,由於我們的普通股價值和員工數量的潛在增長,我們的基於股票的薪酬將在未來期間繼續增長。
我們估計了預計會發生的沒收的程度,並只記錄那些最終將授予的賠償金的賠償費用。
企業合併產生的或有代價的估值
因業務合併而產生的或有考慮按其在購置日的公允價值報告。在下一個報告所述期間,或有考慮債務被重新估值,公允價值的變化記錄為或有購買考慮的公允價值和“業務和綜合損失綜合報表”中外幣折算率變化的外幣損益。
對或有考慮義務的改變可以通過對貼現率和時間段的調整、任何發展里程碑的假設實現或時間的更新或某些臨牀事件和規章批准的可能性的變化而產生。與確定或有代價價值有關的假設需要作出重大判斷,對這些假設的改變可能對任何特定期間記錄的費用數額產生重大影響。收購EOS後,根據可能的未來支付金額、估計貼現率、每個里程碑成就的成功概率以及向前EOS股東支付里程碑款項的估計時間,確認了一項或有考慮負債。
在2016的第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦,我們的或有購買考慮的公允價值減少了2,550萬美元。截至#date0#12月31日,綜合資產負債表上記錄的或有購買考慮負債仍為零,原因是實現任何一項盈利監管里程碑的不確定性,因此未來里程碑付款的可能性極小,相當於前EOS股東。
無形資產
與許可協議下資本化里程碑有關的確定壽命無形資產按剩餘使用壽命按直線攤銷,估計為剩餘專利壽命。如果我們對產品使用壽命的估計比剩餘專利壽命短,則使用期限較短。攤銷費用作為銷售成本的一個組成部分記入“業務和綜合損失綜合報表”。
2013年11月,作為收購EOS的一部分,IPR&D資產成立,尚未攤銷,但已被評估為減值。
如果存在減值指標,無形資產至少在第四季度每年進行評估,如果存在減值指標,則更頻繁地進行評估。可能導致損傷或觸發中期損害評估的事件包括決定停止藥物開發、收到關於我們的候選藥物或具有潛在競爭力的候選藥物的額外臨牀或非臨牀數據、改變藥物候選藥物的臨牀發展計劃或關於該藥物潛在銷售的新信息。就任何減值評估而言,無形資產的公允價值在評估之日與無形資產的賬面價值進行比較。如果無形資產的賬面價值既不能收回,又超過公允價值,則確認減值損失。在2016第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利吉他明,我們記錄了104.5百萬美元的知識產權無形資產減值,從而將剩餘的賬面價值降至零。
業務結果
2017至12月31日止年度與截至12月31日2016年度之比較
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
變化
|
|
|
|
|
截至12月31日的年度,
|
|
有利/(不利)
|
|
|
|
|
2017
|
|
2016
|
|
$
|
|
%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
產品收入淨額
|
|
$
|
55,511
|
|
$
|
78
|
|
$
|
55,433
|
|
|
71,068
|
%
|
|
業務費用:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
銷售成本-產品
|
|
|
10,251
|
|
|
70
|
|
|
10,181
|
|
|
14,544
|
%
|
|
銷售成本-無形資產攤銷
|
|
|
1,486
|
|
|
—
|
|
|
1,486
|
|
|
100
|
%
|
|
研發
|
|
|
142,498
|
|
|
251,129
|
|
|
(108,631)
|
|
|
(43)
|
%
|
|
銷售、一般和行政
|
|
|
138,907
|
|
|
40,731
|
|
|
98,176
|
|
|
241
|
%
|
|
獲得過程中的研究和開發
|
|
|
—
|
|
|
1,300
|
|
|
(1,300)
|
|
|
(100)
|
%
|
|
無形資產減值
|
|
|
—
|
|
|
104,517
|
|
|
(104,517)
|
|
|
(100)
|
%
|
|
或有購買考慮的公允價值變動
|
|
|
—
|
|
|
(24,936)
|
|
|
24,936
|
|
|
(100)
|
%
|
|
總開支
|
|
|
293,142
|
|
|
372,811
|
|
|
(79,669)
|
|
|
(21)
|
%
|
|
營運損失
|
|
|
(237,631)
|
|
|
(372,733)
|
|
|
135,102
|
|
|
(36)
|
%
|
|
其他收入(費用):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
利息費用
|
|
|
(10,428)
|
|
|
(8,491)
|
|
|
(1,937)
|
|
|
23
|
%
|
|
外幣收益(虧損)
|
|
|
(82)
|
|
|
(580)
|
|
|
498
|
|
|
(86)
|
%
|
|
法定賠償損失
|
|
|
(105,477)
|
|
|
—
|
|
|
(105,477)
|
|
|
100
|
%
|
|
其他收入(費用)
|
|
|
3,643
|
|
|
633
|
|
|
3,010
|
|
|
476
|
%
|
|
其他收入(費用),淨額
|
|
|
(112,344)
|
|
|
(8,438)
|
|
|
(103,906)
|
|
|
1,231
|
%
|
|
所得税前損失
|
|
|
(349,975)
|
|
|
(381,171)
|
|
|
31,196
|
|
|
(8)
|
%
|
|
所得税利益
|
|
|
3,578
|
|
|
32,034
|
|
|
(28,456)
|
|
|
(89)
|
%
|
|
淨損失
|
|
$
|
(346,397)
|
|
$
|
(349,137)
|
|
$
|
2,740
|
|
|
(1)
|
%
|
產品收入淨額截至12月31日,2017年度的產品收入是由於確認了從出售魯布拉獲得的5 550萬美元的淨產品收入,該產品於12月19日獲準在美國市場銷售。收入是扣除包括回扣、回扣和其他折扣在內的銷售扣減後入賬的。銷售扣減額約佔截至12月31日為止的年度內確認的總收入的8.1%,其摘要如下:
|
|
|
|
|
|
|
|
|
|
|
|
年終
|
|
|
|
|
2017年月31
|
|
|
|
|
$
|
|
佔銷售總額的百分比
|
|
|
|
|
(單位:千)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
生產總值收入
|
|
$
|
60,384
|
|
|
100.0%
|
|
|
銷售扣減額:
|
|
|
|
|
|
|
|
|
政府回扣及回扣
|
|
|
2,575
|
|
|
4.3%
|
|
|
折扣及費用
|
|
|
2,298
|
|
|
3.8%
|
|
|
銷售扣除總額
|
|
|
4,873
|
|
|
8.1%
|
|
|
產品收入淨額
|
|
$
|
55,511
|
|
|
91.9%
|
|
銷售成本-產品。截至12月31日,2017年度的產品銷售成本與期間魯布拉銷售相關的運費和版税費用有關。根據我們在監管批准前生產產品的相關費用政策,在截至12月31日,2017年度確認為收入的Rubra單位的某些費用在美國食品和藥物管理局12月19日批准之前已支出,因此不包括在本期的銷售成本中。當我們耗盡這些庫存時,我們期望銷售成本與產品收入相關的增加。2017年度,大部分產品銷售都是商品化前庫存。
銷售成本-無形資產攤銷。12月終了年度餘31,2017,我們確認銷售成本150萬美元與攤銷相關的資本里程碑付款與林業發展局批准魯布拉。
在美國食品和藥物管理局於#date0#12月19日批准之前,所有獲得的許可和里程碑付款都是按發生的方式支出的。
研發費用。在截至12月31日的一年中,研究和開發費用從2016降至2016,主要是由於魯卡帕利布和西西替尼的研究和開發費用較低,以及與Rubra有關的銷售、一般和行政費用而不是研究和開發費用的分類與商業化有關的費用。在截至#date0#12月31日的一年中,包括銷售、一般和行政費用在內的魯布拉商業化費用為9 520萬美元。
與去年同期相比,rucaparib的臨牀試驗費用減少了30萬美元,原因是我們完成了ARIEL2和Ariel 3研究,部分抵消了ARIEL4、我們的證實性卵巢癌試驗以及我們的TRITON 2和TRITON 3前列腺癌研究的費用增加。診斷開發費用比上一年低440萬美元,因為前一年包括我們與基金會醫藥公司合作開發一種新的配套診斷測試,以確定最有可能對魯卡帕瑞布有反應的病人的相關費用。最後,臨牀供應和相關的製造開發成本比2016美元低1590萬美元,原因是這些成本在FDA批准rucaparib後資本化。
羅西替尼的臨牀試驗費用比2016少2,360萬美元,主要原因是完成了對非小細胞肺癌的所有老虎研究的患者註冊,臨牀供應和相關的製造開發成本比生產時間驅動的支持我們臨牀研究的2016美元低660萬美元。
銷售,一般和行政費用。在截至12月31日的一年中,銷售、一般和行政費用從2016增加到2016,這主要是因為與魯布拉有關的銷售、一般和行政費用的分類,而不是研究和開發費用。
採購過程中的研發費用。在2016年間,我們在NDA提交給Rucaparib時向AstraZeneca支付了30萬美元,在FDA和EMA分別接受NDA和MAA後,我們向輝瑞支付了總額為100萬美元的里程碑付款。在2017年間沒有發生這種付款。
無形資產減值在2016第二季度,我們記錄了與我們的利己產品候選產品相關的知識產權無形資產減值104.5美元,使與該產品相關的無形資產的賬面價值降至零。這一估計公允價值的下降是由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦。
或有購買考慮的公允價值變動。在截至#date0#12月31日的一年中,或有購買考慮的公允價值減少了2 490萬美元,這是由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利吉他明,使我們在2016第二季度記錄的或有購買考慮負債的公允價值減少了2 550萬美元。
法定賠償損失,扣除保險應收賬款。在2017年間,我們記錄了105.5,000,000美元的法律結算損失,其中扣除了應收保險,涉及到一項規定的和解協議,根據該協議,我們向原告和參加的班級成員發放了總額為2,500萬美元的現金和發行的150萬股股票。現金部分由克洛維斯的保險公司提供資金。
其他收入(費用)。截至12月31日的一年中,由於我們的可供出售證券的利息收入,其他收入增加了2017,而不是2016。
所得税福利(費用)在截至#date0#12月31日的一年中,我們確認了與2016第二季度記錄的知識產權和發展無形資產減值有關的2 840萬美元遞延税收福利。此外,在2016第一季度,我們確認了360萬美元的遞延税收福利,這是因為我們所經營的一個外國管轄區頒佈的公司税税率有所降低。
2016至12月31日止年度與截至12月31日2015年度之比較
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
變化
|
|
|
|
|
截至12月31日的年度,
|
|
有利/(不利)
|
|
|
|
|
2016
|
|
2015
|
|
$
|
|
%
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
產品收入淨額
|
|
$
|
78
|
|
$
|
—
|
|
$
|
78
|
|
|
100
|
%
|
|
業務費用:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
銷售成本-產品
|
|
|
70
|
|
|
—
|
|
|
70
|
|
|
100
|
%
|
|
研發
|
|
|
251,129
|
|
|
269,251
|
|
|
(18,122)
|
|
|
(7)
|
%
|
|
銷售、一般和行政
|
|
|
40,731
|
|
|
30,524
|
|
|
10,207
|
|
|
33
|
%
|
|
獲得過程中的研究和開發
|
|
|
1,300
|
|
|
12,000
|
|
|
(10,700)
|
|
|
(89)
|
%
|
|
無形資產減值
|
|
|
104,517
|
|
|
89,557
|
|
|
14,960
|
|
|
17
|
%
|
|
或有購買考慮的公允價值變動
|
|
|
(24,936)
|
|
|
(24,611)
|
|
|
(325)
|
|
|
1
|
%
|
|
總開支
|
|
|
372,811
|
|
|
376,721
|
|
|
(3,910)
|
|
|
(1)
|
%
|
|
營運損失
|
|
|
(372,733)
|
|
|
(376,721)
|
|
|
3,988
|
|
|
(1)
|
%
|
|
其他收入(費用):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
利息費用
|
|
|
(8,491)
|
|
|
(8,372)
|
|
|
(119)
|
|
|
1
|
%
|
|
外幣收益(虧損)
|
|
|
(580)
|
|
|
2,740
|
|
|
(3,320)
|
|
|
(121)
|
%
|
|
其他收入(費用)
|
|
|
633
|
|
|
416
|
|
|
217
|
|
|
52
|
%
|
|
其他收入(費用),淨額
|
|
|
(8,438)
|
|
|
(5,216)
|
|
|
(3,222)
|
|
|
62
|
%
|
|
所得税前損失
|
|
|
(381,171)
|
|
|
(381,937)
|
|
|
766
|
|
|
(0)
|
%
|
|
所得税利益
|
|
|
32,034
|
|
|
29,076
|
|
|
2,958
|
|
|
10
|
%
|
|
淨損失
|
|
$
|
(349,137)
|
|
$
|
(352,861)
|
|
$
|
3,724
|
|
|
(1)
|
%
|
產品收入淨額截至12月31日,2016年度的產品收入是由於確認了2016年12月19日批准在美國市場銷售的魯布拉的10萬美元的淨產品收入。
銷售成本-產品。截至12月31日,2016年度的產品銷售成本與期間魯布拉銷售相關的運費和版税費用有關。根據我們在監管批准前生產產品的相關費用政策,在截至12月31日,2016年度確認為收入的Rubra單位的某些費用在美國食品和藥物管理局12月19日批准之前已支出,因此不包括在本期的銷售成本中。
研發費用。與2016相比,截至12月31日,2017年度研發費用的減少主要是由於羅西替尼方案的開發活動減少,但部分被與魯卡帕瑞布計劃有關的較高開支所抵消。
rucaparib的臨牀試驗費用在2016比前一年高出1,400萬美元,這主要是因為卵巢癌ARIEL2和ARIEL3研究的註冊人數增加了。市場研究、疾病教育和其他商業產品規劃活動比前一年高出1 660萬美元,原因是為可能的監管批准和Rucaparib的商業啟動做好了準備。臨牀供應和相關的製造開發成本比前一年高920萬美元,因為我們增加了生產以支持擴大的臨牀研究。此外,Rucaparib的診斷開發費用比前一年高出90萬美元,原因是我們與基金會醫學公司合作開發了一種新的配套診斷測試,以確定最有可能對rucaparib有反應的患者。
2016年度,工資、基於股份的薪酬支出和其他人事相關費用增加了2400萬美元,原因是員工數量增加,以支持我們擴大的發展和商業規劃活動。在2015的第三季度,我們完成了我們的美國銷售、市場營銷和醫療事務組織的招聘工作,為潛在的監管批准和羅西替尼的商業推出做準備。
2016年度洛西替尼的臨牀試驗費用比前一年減少了4,100萬美元,主要是因為完成了對非小細胞肺癌的TIGER-1、Tiger-2和Tiger-X研究。這一減少是
部分抵消了較高的臨牀試驗費用的虎-3研究,該研究開始登記病人在2015第二季度。市場研究、疾病教育和其他商業規劃活動比上一年減少1 970萬美元。我們在2015年間花費了更高的成本,因為我們準備了潛在的監管批准和在商業上推出羅西替尼。此外,臨牀供應和相關的製造業發展成本比前一年低1 720萬美元,這是由於生產時間的安排,以支持我們的臨牀研究。
銷售,一般和行政費用。在截至12月31日的一年中,銷售、一般和行政費用比2015增加了2016,主要是由於與魯布拉商業化有關的310萬美元的銷售費用、530萬美元的法律費用以及較低程度上的更高的人事費用。研究和開發費用中包括了魯布拉的商業化前活動。
採購過程中的研發費用。在截至12月31日的一年中,獲得的過程中研發費用從2015下降到2016.在2015的第三季度,我們向Celgene支付了總額為1,200萬美元的里程碑付款,這兩個項目分別被FDA和EMA接受了NDA和MAA。在2016的第二季度,我們在NDA提交給Rucaparib後,向阿斯利康支付了30萬美元的里程碑款。在2016年間,我們向輝瑞公司支付了總額為100萬美元的里程碑式付款,分別由美國食品和藥物管理局(FDA)和美國食品藥品管理局(EMA)接受了NDA和MAA的Rucaparib。
無形資產減值在2016第二季度,我們記錄了與我們的利己產品候選產品相關的知識產權無形資產減值104.5美元,使與該產品相關的無形資產的賬面價值降至零。這一估計公允價值的下降是由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦。在2015第四季度,我們記錄了與我們的利己產品候選者有關的知識產權無形資產的8 960萬美元減值費用。這一估計公允價值的下降是由於我們和我們的發展夥伴決定終止用於肺癌的盧西坦的發展,以及對乳腺癌指標的概率加權貼現現金流假設的更新。
或有購買考慮的公允價值變動。在截至12月31日的一年中,或有購買考慮因素的公允價值變化減少了2 490萬美元,而截至12月31日的年度則減少了2 460萬美元。在2016第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦,我們的或有購買考慮負債的公允價值減少了2,550萬美元。在2015第四季度,我們記錄了2,690萬美元的或有購買考慮負債的公允價值減少,因為估計的概率加權未來里程碑付款的變化,以及這種付款的時間,為盧吉塔尼計劃。
其他收入(費用),淨額。截至12月31日的一年中,其他支出從2015增加到2016。2016年間,我們確認了60萬美元的外匯損失,而2015年度的收益為270萬美元。外匯損益的變化是由外幣匯率的波動所驅動的,而外幣匯率的波動是為了將我們以歐元計價的或有購買考慮負債換算成美元。
所得税福利(費用)在截至#date0#12月31日的一年中,我們確認了與2016第二季度記錄的知識產權和發展無形資產減值有關的2 840萬美元遞延税收福利。此外,在2016第一季度,我們確認了360萬美元的遞延税收福利,這是因為我們所經營的一個外國管轄區頒佈的公司税税率有所降低。
在截至#date0#12月31日的一年中,我們確認了主要與2015第四季度記錄的知識產權和發展無形資產減值有關的2,910萬美元遞延税金。
流動性與資本資源
迄今為止,我們通過公開發行普通股和私募可轉換債務證券和優先股來為我們的業務提供資金。今年1月,我們以每股41.00美元的價格公開發行了575萬股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為221.2美元。2017年6月,我們以每股88.00美元的價格,公開發行了3920454股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為324.6美元。截至2017年月31,我們擁有現金、現金等價物和可供出售的證券,總額達563.7百萬美元.
下表列出了下表所列各期間現金的主要來源和使用情況:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
|
|
(單位:千)
|
|
|
用於業務活動的現金淨額
|
|
$
|
(260,904)
|
|
$
|
(266,680)
|
|
$
|
(253,066)
|
|
|
投資活動提供的現金淨額(用於)
|
|
|
(54,102)
|
|
|
199,299
|
|
|
(254,578)
|
|
|
籌資活動提供的現金淨額
|
|
|
562,075
|
|
|
5,176
|
|
|
304,480
|
|
|
匯率變動對現金及現金等價物的影響
|
|
|
943
|
|
|
(365)
|
|
|
(757)
|
|
|
現金和現金等價物淨增(減少)額
|
|
$
|
248,012
|
|
$
|
(62,570)
|
|
$
|
(203,921)
|
|
經營活動
截至12月31日的年度,2017用於業務活動的現金淨額比2016減少580萬美元,原因是調整後的非現金項目淨虧損減少6 330萬美元,主要原因是2017年度確認收入5 550萬美元,部分抵消了庫存購買和存款4 800萬美元和2017年度確認應收賬款620萬美元。
在截至12月31日的一年中,用於經營活動的淨現金增加了1,360萬美元,而在2016年底完成的非臨牀和臨牀發展研究項目的其他應計費用的支付增加了2015美元。
投資活動
截至12月31日,2017年度用於投資活動的淨現金包括263.5百萬美元可供出售證券的購買,而2016沒有購買。
截至12月31日,2016年度投資活動提供的淨現金包括200.0百萬美元的可供出售證券銷售,而2015年度的淨買入額為251.5百萬美元。
籌資活動
截至12月31日,2017年度的融資活動提供的淨現金包括從我們在1月和6月的普通股發行中收到的545.8百萬美元淨收入和根據僱員股票購買計劃從員工股票期權活動和股票購買中收到的1 620萬美元。
截至12月31日,2016年度融資活動提供的淨現金是由於僱員股票期權活動和根據僱員股票購買計劃購買股票而收到的520萬美元。
在截至12月31日的一年中,2015年度融資活動提供的淨現金包括2015年7月我們的普通股發行所得的淨收益298.5百萬美元,以及僱員股票期權活動和根據僱員股票購買計劃購買股票所得的600萬美元。
營運資本要求
#date0#12月19日,美國食品和藥物管理局批准魯布拉片作為單一療法,用於治療與晚期卵巢癌相關的有害的BRCA突變(生殖線和/或體細胞),他們已經接受了兩種或兩種以上的化療,並根據fda批准的魯布拉輔助診斷選擇了治療。我們預計在可預見的將來將遭受重大損失,因為我們將Rubra商業化,並擴大我們的銷售、一般和行政職能,以支持我們商業組織的發展。此外,我們今後12個月的業務計劃包括對庫存進行大量投資,以滿足魯布拉的預計商業需求。我們從一個供應商那裏獲得了魯布拉的活性藥物成分,並且我們經歷了與其生產相關的長期準備時間。因此,我們預期在生產週期開始時,我們的流動性會減少,而隨着庫存的出售,我們的流動性將會增加。
截至2017年月31,我們擁有現金、現金等價物和可供出售的證券,總額為563.7百萬美元,流動負債總額為8,150萬美元。今年1月,我們以每股41.00美元的價格公開發行了575萬股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為221.2美元。2017年6月,我們以每股88.00美元的價格,公開發行了3920454股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為324.6美元。我們打算將所提供產品的淨收益用於一般企業用途,包括商業規劃、銷售和營銷費用,這些費用與在美國推出Rubra有關,如果歐洲委員會批准,則用於為其發展項目提供資金、銷售、一般和行政費用、購買或發放額外產品候選人或企業的許可證以及營運資金。根據目前的估計,我們相信,我們現有的現金、現金等價物和可供出售的證券將使我們能夠至少在未來12個月內為我們的運營計劃提供資金。
由於與藥品的研究、開發和商業化有關的許多風險和不確定性,我們無法估計我們所需週轉金的確切數額。我們未來的資金需求將取決於許多因素,包括但不限於:
|
·
| |
產品的數量和特點,我們追求的配套診斷和適應症; |
|
·
| |
實現各種發展、監管和商業里程碑,從而根據我們的許可協議條款向合作伙伴支付所需款項; |
|
·
| |
研究和開發我們的產品候選產品和相關的配套診斷以及進行臨牀和非臨牀試驗的範圍、進展、結果和成本; |
|
·
| |
獲取產品候選產品和配套診斷的監管批准的時間和成本; |
|
·
| |
準備、提交、起訴、維護、辯護和執行專利索賠所涉及的費用,包括訴訟費用和訴訟結果; |
|
·
| |
我們的產品候選產品的銷售時機、收據和銷售金額(如果有的話)。 |
合同義務和承諾
下表概述了我們在2017(千)月31日的合同義務:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
較少 比 1
|
|
|
|
|
|
|
|
更多 比 5
|
|
|
|
|
|
|
|
年
|
|
1 到 3 年數
|
|
3 到 5 年數
|
|
年數
|
|
共計
|
|
|
可轉換高級票據
|
|
$
|
—
|
|
$
|
—
|
|
$
|
287,500
|
|
$
|
—
|
|
$
|
287,500
|
|
|
可轉換高級票據利息
|
|
|
7,187
|
|
|
14,376
|
|
|
5,091
|
|
|
—
|
|
|
26,654
|
|
|
業務租賃承付款
|
|
|
3,050
|
|
|
7,646
|
|
|
6,374
|
|
|
11,563
|
|
|
28,633
|
|
|
里程碑付款(A)
|
|
|
23,000
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
23,000
|
|
|
採購和其他承付款(B)
|
|
|
137,154
|
|
|
25,179
|
|
|
24,630
|
|
|
36,945
|
|
|
223,908
|
|
|
共計
|
|
$
|
170,391
|
|
$
|
47,201
|
|
$
|
323,595
|
|
$
|
48,508
|
|
$
|
589,695
|
|
(a)金額涉及2000萬美元的里程碑付款,我們通過同意在林業局於#date0#12月19日批准魯布拉後的18個月內支付2300萬美元,選擇推遲付款。
(b)2016年月3日,我們與一家非獨家第三方供應商簽訂了一份製造和服務協議(“協議”),用於生產魯卡帕瑞布的有效成分。根據協議條款,我們將向第三方供應商提供Rucaparib活性成分供應的滾動預測,並將由我們每季度更新一次。我們有義務訂購足以滿足任何預測中規定的初始數量的材料。此外,第三方供應商將在其現有設施中建造一輛生產列車,專門用於生產魯卡帕瑞布活性成分。我們有義務按計劃向資本設備支付資本計劃費用,並支付與建造專用生產列車相關的其他費用。此外,一旦該設施投入使用,我們有義務在本協議有效期內每季度支付一筆固定的設施費,該費用將於2025年月31到期,除非經雙方同意延長。
特許權使用費和許可費承諾
根據與第三方的許可協議,我們有一定的義務,條件是實現各種發展、監管和商業里程碑。在2016,08月30日,我們與輝瑞達成了一項全球許可協議的第一修正案,修正了6月份現有的全球許可協議,允許我們推遲支付在fda批准nda 1的里程碑付款。聖美國和(Ii)歐洲聯盟委員會批准MAA為1聖在歐盟,在達到這些里程碑之日後18個月的日期。如果我們推遲支付這些里程碑付款,我們已同意支付與實現這些里程碑有關的某些較高的付款。
#date0#12月19日,美國食品和藥物管理局批准魯布拉片作為單一療法,用於治療與晚期卵巢癌相關的有害的BRCA突變(生殖線和/或體細胞),他們已經接受了兩種或兩種以上的化療,並根據fda批准的魯布拉輔助診斷選擇了治療。FDA的批准導致了75萬美元的里程碑付款輝瑞,根據許可協議的要求。FDA的批准還導致了支付2000萬美元里程碑付款的義務,在這一支付中,我們通過同意在FDA批准之日後18個月內支付2 300萬美元來選擇推遲付款。這些付款被確認為無形資產,並將在Rucaparib的估計剩餘使用壽命內攤銷。
根據我們開發Rucaparib的許可協議,如果達到指定的臨牀研究目標和管理文件、接受和批准,我們必須支付額外的6975萬美元的管理里程碑付款。此外,我們有義務支付銷售里程碑付款,如果具體規定的年度銷售目標的魯卡帕瑞布,涉及250.0美元及以上的年銷售目標,這可能是總計可能達到170.0百萬美元的里程碑付款總額, 並對我們的淨銷售額按中期的比例支付特許使用費,並在我們需要從第三方獲得使rucaparib商業化所需的任何權利的範圍內,為版税補償提供標準規定。
如果未來某些監管和盈利相關的銷售里程碑得以實現,我們有義務向前EOS股東支付額外的代價。這些付款的估計公允價值被記錄在我們的綜合資產負債表上,作為或有購買考慮。潛在的或有里程碑付款範圍從零支付(假設利維坦未能實現任何監管里程碑)到186.0百萬美元(6 500萬美元和€115.0百萬美元),如果所有監管和銷售里程碑都能實現,使用的是12月31,2017的翻譯率。2017年月31,負債的估計公允價值為零。由於實現任何盈利監管里程碑的不確定性,因此未來里程碑支付的可能性極小,相當於前EOS股東。我們也有義務支付25%的任何代價,不包括版税,根據任何分許可證協議收到的利維坦,包括與Servier協議。
根據我們開發和商業化羅西替尼的許可協議,如果達到某些臨牀研究目標和監管申請、驗收和批准,我們可能需要額外支付9,800萬美元的監管里程碑付款。此外,我們可能需要支付總額120.0百萬美元的銷售里程碑付款,如果某些年度銷售目標是達到羅西替尼。
最後,根據我們的每一項產品許可協議的條款,我們將向我們的許可方支付相應產品的銷售的版税(如果有的話)。
表外安排
在提交的期間,我們沒有,目前也沒有,任何表外安排,如美國證券交易委員會頒佈的規則所定義的那樣。
税負結轉
截至2017年月31,我們有大約10億美元的淨營運虧損(“NOL”)結轉,以抵消未來的聯邦所得税。我們還擁有研發和孤兒藥品税抵免245.1美元,以抵消未來的聯邦所得税。聯邦政府的淨經營虧損、結轉和研發以及孤兒藥品税收抵免結轉在不同時間到2037年間到期。
我們相信,根據美國國內收入法典第382條的定義,股權的改變是由於我們在2012年4月完成的普通股公開發行的結果。今後利用聯邦淨營業損失和税收抵免結轉從開始到所有權日期的變化將受到年度限制,以抵消未來的應納税收入。目前,我們不認為這一限制將阻止使用聯邦NOL或信用結轉到期前。將來可能會發生所有權變化,這將限制自上次估計所有權變化以來產生的無觀測線數量。截至2017年月31,我們在美國的遞延税金淨額中記錄了100%的估值備抵,約為561.1百萬美元,而對外國司法管轄區的税務資產的估值備抵額為300萬美元,因為我們認為,這些税收優惠更有可能無法完全實現。在未來,如果我們確定我們的税收結轉的一部分或全部税收福利將實現,淨收入將在確定期間增加。
最近採用和發佈的會計準則
關於最近通過和發佈的會計準則的討論,見注2,重要會計政策摘要,載於第二部分第8項的綜合財務報表説明,財務報表和補充數據,本年報表格10-K。
項目7A.市場風險的定量和定性披露
我們面臨與利率變化有關的市場風險。截至2017年月31,我們擁有現金、現金等價物和可供出售的563.7美元證券,其中包括銀行活期存款、貨幣市場基金和美國國債。我們投資政策的主要目標,是維持本金和維持適當的流動資金,以應付經營需要。我們的投資政策為我們的投資規定了信用質量標準,並限制了對任何單一發行、發行者或投資類型的信用敞口。我們對市場風險的主要風險是利率敏感性,利率敏感性受到美國利率總體水平變化的影響,特別是因為我們的投資是短期證券。我們可供出售的證券受到利率風險的影響,如果市場利率上升,其價值將下降.由於我們的投資組合期限較短,投資風險較低,利率即時100個基點的變動不會對投資組合的公允價值造成重大影響。
我們與全球的合同研究機構、調查網站和合同製造商簽訂合同,在那裏以美元以外的貨幣支付。此外,2016年月3日,我們與一家瑞士公司簽訂了一項生產和供應魯卡帕瑞布活性成分的製造和服務協議。根據本協議的條款,Rucaparib中活性成分的供應以及計劃中的資本計劃費用將以瑞士法郎支付給資本設備和與建造專用生產列車有關的其他費用。一旦生產設施投入使用,我們有義務在協議有效期內每季度支付一筆固定的設備費,該協議將於2025年月31到期。
截至#date0#12月31日,根據“瑞士製造和服務協定”,有223.9,000,000美元的採購承諾,我們必須以瑞士法郎匯出欠款。由於其他可能存在的變數,很難量化匯率某一特定變化的影響。然而,我們估計,如果美元的價值比瑞士法郎升值10%,到#date0#,它將使根據瑞士製造和服務協定承擔的美元購買總額減少約2 040萬美元。同樣,如果美元兑瑞士法郎貶值10%,美元購買承諾總額將增加約2 490萬美元。
雖然我們定期持有外幣,主要是歐元和英鎊,但我們不使用其他金融工具來對衝外匯風險。以功能貨幣以外的貨幣計值的交易是根據發生這種交易時的匯率記錄的。截至12月31日、2017和2016,約1%的負債是以功能貨幣以外的貨幣計價的。
項目8.財務報表和補充數據
本項目所要求的財務報表載於本報告第15項,並從第F-1頁開始列報。
項目9.會計和財務披露方面的變化和與會計師的分歧
沒有。
項目9A.管制和程序
關於披露控制和程序有效性的結論
我們的披露控制和程序旨在確保在我們根據經修正的“1934證券交易法”(“交易法”)提交或提交的報告中披露的信息在證券交易委員會規則和表格規定的時限內得到記錄、處理、彙總和報告,並確保這些信息得到積累並傳達給我們的管理層,包括首席執行幹事和首席財務和會計幹事,以便及時作出必要的披露決定。任何管制和程序,無論設計和操作如何良好,都只能為達到預期的控制目標提供合理的保證。
截至2017年月31,我們的管理層在我們的首席執行官和首席財務和會計官的參與下,對“外匯法”第13a-15(E)條和第15d-15(E)條規定的披露控制和程序的設計和運作的有效性進行了評估。根據這項評估,我們的首席執行官和首席財務和會計官得出結論,截至2017年月31,我們的披露控制和程序的設計和運作在合理的保證水平上是有效的。
管理層關於財務報告內部控制的報告
我們的管理層負責建立和維持對財務報告的有效內部控制,並負責評估財務報告內部控制的有效性。財務報告的內部控制是公司首席執行官和首席財務官設計或監督的過程,受董事會、管理層和其他人員的影響,目的是根據公認的會計原則,為財務報告的可靠性和為外部目的編制財務報表提供合理的保證。我們對財務報告的內部控制包括:
|
·
| |
涉及記錄的維護,在合理的細節,準確和公正地反映我們的資產的交易和處置; |
|
·
| |
提供合理保證,證明交易記錄為必要,以便按照公認的會計原則編制合併財務報表,而且我們的收支只是根據管理層和董事的授權進行的;以及 |
|
·
| |
就防止或及時發現可能對合並財務報表產生重大影響的資產的未經授權的獲取、使用或處置提供合理保證。 |
由於其固有的侷限性,對財務報告的內部控制可能無法防止或發現誤報。此外,對未來期間的任何有效性評價的預測都有可能由於條件的變化或遵守政策或程序的程度可能惡化而導致管制不足。
截至2017年月31,我們的管理層在我們的首席執行官和首席財務和會計官的參與下,評估了我們對“外匯法”第13a-15(F)條或第15d-15(F)條規定的財務報告的內部控制的有效性。在進行評估時,管理層採用了內部控制---綜合框架(2013框架)由特雷德韋委員會贊助組織委員會發布。根據其評估,我們的管理層決定,截至2017年月31,我們根據這些標準對財務報告保持有效的內部控制。
此外,截至2017年度12月31日,我們對財務報告的內部控制的有效性已由安永會計師事務所(一家獨立註冊的公共會計師事務所)進行了審計。
財務報告內部控制的變化
在截至12月31日的第2017季度,我們對財務報告的內部控制沒有發生任何變化,這些變化對我們財務報告的內部控制產生了重大影響,或合理地可能會對其產生重大影響。
獨立註冊會計師事務所報告
克洛維斯腫瘤公司的股東和董事會。
關於財務報告內部控制的幾點看法
我們根據Treadway委員會贊助組織委員會發布的內部控制標準(2013框架)(COSO標準),審計了截至2017年度12月31日克洛維斯腫瘤學公司對財務報告的內部控制。我們認為,克洛維斯腫瘤公司(該公司)在所有重要方面,保持了有效的內部控制的財務報告截至12月31日,2017,根據COSO標準。
We also have audited, in accordance with the standards of the Public Company Accounting Oversight Board (United States) (PCAOB), the consolidated balance sheets of the Company, as of December 31, 2017 and 2016, and the related consolidated statements of operations and comprehensive loss, stockholders' equity (deficit), and cash flows for each of the three years in the period ended December 31, 2017, and the related notes and our 2018年月27日的報告對此發表了毫無保留的意見。
意見依據
公司管理層負責維持對財務報告的有效內部控制,並對財務報告內部控制的有效性進行評估,包括在所附的管理部門關於財務報告內部控制的報告中。我們的職責是根據我們的審計,就公司財務報告的內部控制發表意見。我們是一家在PCAOB註冊的公共會計師事務所,根據美國聯邦證券法以及證券交易委員會和PCAOB的適用規則和條例,我們必須獨立於該公司。
我們按照PCAOB的標準進行審計。這些標準要求我們規劃和進行審計,以合理保證是否在所有重大方面保持對財務報告的有效內部控制。
我們的審計包括瞭解財務報告的內部控制,評估重大弱點存在的風險,根據評估的風險測試和評估內部控制的設計和運作效果,以及執行我們認為在這種情況下必要的其他程序。我們認為,我們的審計為我們的意見提供了合理的依據。
財務報告內部控制的定義與侷限性
公司對財務報告的內部控制是一個程序,目的是根據公認的會計原則,為財務報告的可靠性和為外部目的編制財務報表提供合理的保證。公司對財務報告的內部控制包括以下政策和程序:(1)保存記錄,以合理詳細、準確和公正的方式反映公司資產的交易和處置情況;(2)提供合理的保證,證明為按照公認的會計原則編制財務報表而記錄交易是必要的,以及財務報表的收支情況。公司只有根據公司管理層和董事的授權才能作出;(3)對防止或及時發現可能對財務報表產生重大影響的未經授權的公司資產的收購、使用或處置,提供合理的保證。
由於其固有的侷限性,對財務報告的內部控制可能無法防止或發現誤報,而且,對未來期間的任何有效性評價的預測都有可能由於條件的變化而導致控制不足,或可能使遵守政策或程序的程度惡化。
/S/Ernst&Young LLP
科羅拉多州丹佛
2018年月27
項目9B.其他資料
沒有。
第III部
Certain information required by Part III is omitted from this Annual Report on Form 10-K and is incorporated herein by reference from our definitive proxy statement relating to our 2018 annual meeting of stockholders, pursuant to Regulation 14A of the Securities Exchange Act of 1934, as amended, also referred to in this Form 10-K as our 2018 Proxy Statement, which we expect to file with the SEC no later than April 30, 2018.
項目10.董事、執行主任及公司管治
有關我們董事的信息,包括審計委員會和審計委員會財務專家,以及執行官員以及遵守“外匯法案”第16(A)條的情況,將包括在我們的2018份委託書中,並以參考的方式納入其中。
我們已按照納斯達克治理規則的要求和適用的SEC規則,為我們的所有董事、官員和僱員制定了商業道德守則。股東可在我們的網站上找到我們的商業道德守則的副本www.clovisoncology.com或免費向下列機構索取副本:
克洛維斯腫瘤學公司
注意:投資者關係
5500 Flatiron Parkway套房100
博爾德,CO 80301
我們將在我們的網站上張貼對“商業道德守則”的任何修改,以及任何要求由SEC或NASDAQ規則披露的豁免。
項目11.行政薪酬
本項目所要求的有關高管薪酬的信息將包括在我們的2018委託書中,並以參考的方式納入本聲明。
項目12.某些受益所有人的擔保所有權、管理層和相關股東事項
本項所要求的有關某些受益所有人和管理的安全所有權的信息將包括在2018代理聲明中,並以參考方式納入其中。
項目13.某些關係和相關交易,以及董事獨立性
本項所要求的有關某些關係、相關交易和董事獨立性的信息將包括在2018委託書中,並以參考的方式納入其中。
項目14.主要會計費用和服務
本項所要求的有關主要會計費用和服務的信息將包括在2018委託書中,並以參考的方式納入其中。
第IV部
項目15.展品及財務報表附表
(a)現將下列文件作為本報告的一部分提交:
(1)財務報表。
請參閲本報告第F-1頁上的Clovis腫瘤公司財務報表索引。
(2)財務報表附表。
所有財務報表附表都被省略,因為它們不適用或不需要,或者因為這些信息包括在財務報表或其附註的其他地方。
(3)證物。
請參閲作為本年度報告(表格10-K)的一部分而提交的證物索引。
展品索引
|
陳列品
數
|
|
展品描述
|
|
|
|
|
|
3.1(5)
|
|
克洛維斯腫瘤學公司註冊證書的修訂和恢復。
|
|
|
|
|
|
3.2(5)
|
|
修正和恢復克洛維斯腫瘤學公司的章程。
|
|
|
|
|
|
4.1(3)
|
|
克洛維斯腫瘤學股份有限公司普通股證書格式。
|
|
|
|
|
|
4.2(8)
|
|
自2014年月9日起,由公司與紐約梅隆銀行信託公司(N.A.)簽訂的契約。
|
|
|
|
|
|
10.1*(4)
|
|
修訂後的“戰略許可證協議”,日期為2011年月16日,由克洛維斯腫瘤公司和艾維拉治療公司共同修訂和恢復。
|
|
|
|
|
|
10.2*(4)
|
|
許可證協議,日期為2011年月2日,由克洛維斯腫瘤公司和輝瑞公司共同簽署。
|
|
|
|
|
|
10.3+(1)
|
|
克洛維斯腫瘤學公司2009股權激勵計劃。
|
|
|
|
|
|
10.4+(4)
|
|
克洛維斯腫瘤學公司2011股票激勵計劃。
|
|
|
|
|
|
10.5+(1)
|
|
克洛維斯腫瘤學公司的形式2009股權激勵計劃股票期權協議。
|
|
|
|
|
|
10.6+(4)
|
|
克洛維斯腫瘤學公司的形式2011股票激勵計劃股票期權協議。
|
|
|
|
|
|
10.7+(3)
|
|
截止到2011年月24日,克洛維斯腫瘤學公司和帕特里克·馬哈菲之間的就業協議。
|
|
|
|
|
|
10.8+(3)
|
|
截止到2011年月24日,克洛維斯腫瘤學公司和吉莉安·C·艾弗斯之間的就業協議。
|
|
|
|
|
|
10.9+(1)
|
|
截止2009年月15日,克洛維斯腫瘤公司與保羅·克林根斯坦之間的賠償協議。
|
|
|
|
|
|
10.10+(1)
|
|
2009年月15日克洛維斯腫瘤學公司與詹姆斯·布萊爾之間的賠償協議。
|
|
|
|
|
|
10.11+(1)
|
|
截止2009年月15日,克洛維斯腫瘤公司與愛德華·J·麥金利之間的賠償協議。
|
|
|
|
|
|
10.12+(1)
|
|
截止2009年月15日,克洛維斯腫瘤公司與索勒夫·斯皮克申之間的賠償協議。
|
|
|
|
|
|
10.13+(1)
|
|
截止2009年月15日,克洛維斯腫瘤公司與M.詹姆斯·巴雷特簽訂的賠償協議。
|
|
|
|
|
|
10.14+(1)
|
|
2009年月15日克洛維斯腫瘤學公司與布賴恩·阿特伍德簽訂的賠償協議。
|
|
|
|
|
|
10.15+(1)
|
|
2009年月12日克洛維斯腫瘤學公司與帕特里克·馬哈菲之間的賠償協議。
|
|
|
|
|
|
10.16+(1)
|
|
賠償協議,日期為2009年月12日克洛維斯腫瘤公司與ErleT.Mast之間的賠償協議。
|
|
|
|
|
|
10.17+(1)
|
|
2009年月12日克洛維斯腫瘤學公司和吉莉安·艾弗斯之間的賠償協議。
|
|
|
|
|
|
陳列品
數
|
|
展品描述
|
|
10.18+(1)
|
|
截止2009年月12日,克洛維斯腫瘤公司與安德魯·艾倫之間的賠償協議。
|
|
|
|
|
|
10.19+(4)
|
|
克洛維斯腫瘤學公司2011員工股票購買計劃。
|
|
|
|
|
|
10.20+(4)
|
|
克洛維斯腫瘤學公司2011現金獎勵計劃。
|
|
|
|
|
|
10.21+(6)
|
|
賠償協議,日期自2012年月22,克洛維斯腫瘤公司和史蒂文·霍爾特之間。
|
|
|
|
|
|
10.22+(2)
|
|
截止2013年月13日,克洛維斯腫瘤公司與金傑·L·格雷厄姆之間的賠償協議。
|
|
|
|
|
|
10.23+(2)
|
|
2013年月13日,克洛維斯腫瘤公司與基思·弗萊厄蒂簽訂的賠償協議。
|
|
|
|
|
|
10.24(7)
|
|
自2013年月19日起,公司、EOS、表A所列賣方以及Sofinnova Capital V FCPR以賣方代表的身份簽訂的股票購買協議。
|
|
|
|
|
|
10.25*(7)
|
|
“發展和商業化協定”,日期為2008年月24日,由Advenchen實驗室有限責任公司和倫理腫瘤學有限公司共同簽署,經2010年4月13日第一修正案和2012年月30第二修正案修正。
|
|
|
|
|
|
10.26*(7)
|
|
“協作與許可協議”,日期為2012年月28日,由倫理腫瘤學科學有限公司和萊斯實驗室服務公司和國際研究所簽訂。
|
|
|
|
|
|
10.27+(12)
|
|
賠償協議,自2015年8月3日起生效,由克洛維斯腫瘤學公司和林賽·羅爾夫公司和林賽·羅爾夫公司簽訂。
|
|
|
|
|
|
10.28+(12)
|
|
就業協議,日期為2016,02月25日,由克洛維斯腫瘤公司和林賽羅爾夫公司和林賽羅爾夫公司簽訂。
|
|
|
|
|
|
10.29+(12)
|
|
賠償協議,自2016年2月1日起生效,由克洛維斯腫瘤學公司和戴爾·胡克斯公司簽訂。
|
|
|
|
|
|
10.30+(12)
|
|
就業協議,自2016年2月1日起生效,由克洛維斯腫瘤學公司和戴爾·胡克斯公司簽署。
|
|
|
|
|
|
10.31+(9)
|
|
賠償協議,日期自2016年月17,由克洛維斯腫瘤公司和丹尼爾W.穆爾共同簽署。
|
|
|
|
|
|
10.32+(15)
|
|
“僱傭協議”,日期為2017年月6日,由克洛維斯腫瘤公司和丹尼爾·穆爾共同簽署。
|
|
|
|
|
|
10.33+(10)
|
|
截止2016年月9日,克洛維斯腫瘤公司和帕特里克·馬哈菲公司之間的工資減免信。
|
|
|
|
|
|
10.34*(11)
|
|
“許可證協議”的第一修正案,由克洛維斯腫瘤公司和輝瑞公司簽署,日期為2016,08年8月30日。
|
|
|
|
|
|
10.35+(13)
|
|
克洛維斯腫瘤學公司的形式2011股激勵計劃RSU協議。
|
|
|
|
|
|
10.36*(13)
|
|
製造服務協議,由克洛維斯腫瘤學公司和隆扎有限公司簽訂,日期為2016年月3日。
|
|
|
|
|
|
陳列品
數
|
|
展品描述
|
|
10.37*(14)
|
|
地層試驗合作協議,由克洛維斯腫瘤學公司和斯特拉塔腫瘤學公司簽訂,日期為2017,01月30日。
|
|
|
|
|
|
12.1
|
|
收入與固定費用比率的計算
|
|
|
|
|
|
21.1(16)
|
|
克洛維斯腫瘤學公司子公司名單
|
|
|
|
|
|
23.1
|
|
獨立註冊會計師事務所的同意
|
|
|
|
|
|
31.1
|
|
根據經修訂的“1934證券交易法”第13a-14(A)/15d-14(A)條認證首席執行官。
|
|
|
|
|
|
31.2
|
|
根據經修訂的1934“證券交易法”第13a-14(A)/15d-14(A)條認證首席財務官。
|
|
|
|
|
|
32.1
|
|
根據“美國法典”第18編第1350節,根據“薩班斯-奧克斯利法案”第2002條第906條認證首席執行官。
|
|
|
|
|
|
32.2
|
|
根據“美國法典”第18編第1350節,根據“薩班斯-奧克斯利法案”第2002條第906條認證首席財務官。
|
|
|
|
|
|
101.INS
|
|
XBRL實例文檔
|
|
|
|
|
|
101.SCH
|
|
XBRL分類法擴展模式文檔
|
|
|
|
|
|
101.CAL
|
|
XBRL分類法擴展計算鏈接庫文檔
|
|
|
|
|
|
101.lab
|
|
XBRL分類法擴展標籤Linkbase文檔
|
|
|
|
|
|
101.PRE
|
|
XBRL分類法擴展表示鏈接庫文檔
|
|
|
|
|
|
101.DEF
|
|
XBRL分類法擴展定義鏈接庫文檔
|
|
(1)
| |
於2011年月23在表格S-1(檔案編號333-#number0#)上作為證物提交註冊人的登記聲明。 |
|
(2)
| |
於2013年月14日,作為證物提交給註冊官關於表格8-K(檔案編號001-#number0#)的最新報告。 |
|
(3)
| |
於2011年8月31日以表格S-1(檔案編號333-#number0#)上的註冊人登記陳述書第2號修訂案提交作證物。 |
|
(4)
| |
在表格S-1(檔案編號333-#number0#)上的註冊聲明第3號(檔案編號333-#number0#)於2011年月31提交作證物。 |
|
(5)
| |
2012年月15,以表格10-K的形式向註冊官的年度報告提交展覽. |
|
(6)
| |
於2012年月23在表格S-1(檔案編號333-#number0#)上作為證物提交註冊人的登記聲明。 |
|
(7)
| |
作為一個展覽提交給註冊官目前的報告,表格8-K(檔案編號001-#number0#)於2013. |
|
(8)
| |
於2014年月9日,作為證物提交給註冊官關於表格8-K(檔案編號001-#number0#)的最新報告。 |
|
(9)
| |
於2016年月一日,作為證物提交給註冊官關於表格8-K(檔案編號001-#number0#)的最新報告。 |
|
(10)
| |
於2016年月9向註冊官提交10-Q表格的季度報告. |
|
(11)
| |
於2016年月4日向註冊官提交10-Q表格的季度報告. |
|
(12)
| |
於2016年月29向註冊官提交10-K表格的年度報告. |
|
(13)
| |
於2017年月23以表格10-K的形式向註冊官的年度報告提交. |
|
(14)
| |
於2017年月4日向註冊官提交10-Q表格的季度報告. |
|
(15)
| |
作為一個證物提交給註冊官目前的報告8-K(檔案編號001-#number0#),在7月7日,2017。 |
|
(16)
| |
於2017年月3向註冊官提交10-Q表格的季度報告. |
+表示管理合同或補償計劃。
*已就本證物的某些部分尋求或批准保密處理,而該等部分已被略去,並分別提交證券及交易管理委員會。
簽名
根據1934“證券交易法”第13或15(D)節的要求,登記人已正式安排由下列簽名人代表其簽署本報告,並經正式授權。
|
|
克洛維斯腫瘤學公司
|
|
|
|
|
|
通過:
|
S/Patrick J.Mahaffy
|
|
|
|
帕特里克·馬哈菲
|
|
日期:2018年2月27日
|
|
總裁兼首席執行官;主任
|
根據經修正的“1934證券交易法”的要求,下列人士以登記人的身份和日期簽署了本報告:
|
名稱
|
|
標題
|
|
日期
|
|
|
|
|
|
|
|
S/Patrick J.Mahaffy
|
|
總裁兼首席執行官;主任
(特等行政主任)
|
|
2018年月27
|
|
帕特里克·馬哈菲
|
|
|
|
|
|
|
|
S/Daniel W.Muehl
丹尼爾·穆爾
|
|
高級財務副總裁
(首席財務主任及首席會計主任)
|
|
2018年月27
|
|
|
|
|
|
|
|
S/Brian G.Atwood
布賴恩·阿特伍德
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/M.James Barrett
詹姆斯·巴雷特先生
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/James C.Blair
詹姆斯·布萊爾
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/KeithFlaherty
基思·弗萊厄蒂
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/姜L.Graham
姜·格雷厄姆
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/Paul Klingenstein
保羅·克林根斯坦
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/Edward J.McKinley
愛德華·麥金利
|
|
導演
|
|
2018年月27
|
|
|
|
|
|
|
|
S/THORLEF SPICKSCHEN
|
|
導演
|
|
2018年月27
|
合併財務報表索引
|
綜合財務報表索引
|
|
|
|
|
|
獨立註冊會計師事務所報告
|
F-2
|
|
|
|
|
綜合業務和綜合損失報表
|
F-3
|
|
|
|
|
合併資產負債表
|
F-4
|
|
|
|
|
股東權益合併報表(赤字)
|
F-5
|
|
|
|
|
現金流動合併報表
|
F-6
|
|
|
|
|
合併財務報表附註
|
F-7
|
獨立註冊會計師事務所報告
克洛維斯腫瘤公司的股東和董事會。
關於財務報表的意見
We have audited the accompanying consolidated balance sheets of Clovis Oncology, Inc. (the Company) as of December 31, 2017 and 2016, and the related consolidated statements of operations and comprehensive loss, stockholders' equity (deficit), and cash flows for each of the three years in the period ended December 31, 2017, and the related notes (collectively referred to as the consolidated “financial statements”).我們認為,合併財務報表按照美國普遍接受的會計原則,在所有重大方面公允地列報了公司在12月31日、2017和2016年度的合併財務狀況,以及截至12月31日,2017的三年期間公司業務和現金流量的合併結果。
We also have audited, in accordance with the standards of the Public Company Accounting Oversight Board (United States) (PCAOB), the Company’s internal control over financial reporting as of December 31, 2017, based on criteria established in Internal Control-Integrated Framework issued by the Committee of Sponsoring Organizations of the Treadway Commission (2013 framework) and our report dated February 27, 2018 expressed an unqualified opinion thereon.
意見依據
這些財務報表由公司管理層負責。我們的責任是根據我們的審計,對公司的財務報表發表意見。我們是一家在PCAOB註冊的公共會計師事務所,根據美國聯邦證券法以及證券交易委員會和PCAOB的適用規則和條例,我們必須獨立於該公司。
我們的審計工作是按照PCAOB的標準進行的。這些準則要求我們規劃和進行審計,以便合理地保證財務報表是否存在重大錯報,無論是由於錯誤還是欺詐。我們的審計包括執行評估財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查關於財務報表中數額和披露情況的證據。我們的審計還包括評價管理部門使用的會計原則和重大估計數,以及評價財務報表的總體列報方式。我們相信,我們的審計為我們的意見提供了合理的依據。
/S/Ernst&Young LLP
自2009以來,我們一直擔任公司的審計師。
科羅拉多州丹佛
2018年月27
克洛維斯腫瘤學公司
綜合業務和綜合損失報表
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的一年,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
|
|
(單位:千,但每股數額除外)
|
|
|
收入:
|
|
|
|
|
|
|
|
|
|
|
|
產品收入淨額
|
|
$
|
55,511
|
|
$
|
78
|
|
$
|
—
|
|
|
業務費用:
|
|
|
|
|
|
|
|
|
|
|
|
銷售成本-產品
|
|
|
10,251
|
|
|
70
|
|
|
—
|
|
|
銷售成本-無形資產攤銷
|
|
|
1,486
|
|
|
—
|
|
|
—
|
|
|
研發
|
|
|
142,498
|
|
|
251,129
|
|
|
269,251
|
|
|
銷售、一般和行政
|
|
|
138,907
|
|
|
40,731
|
|
|
30,524
|
|
|
獲得過程中的研究和開發
|
|
|
—
|
|
|
1,300
|
|
|
12,000
|
|
|
無形資產減值
|
|
|
—
|
|
|
104,517
|
|
|
89,557
|
|
|
或有購買考慮的公允價值變動
|
|
|
—
|
|
|
(24,936)
|
|
|
(24,611)
|
|
|
總開支
|
|
|
293,142
|
|
|
372,811
|
|
|
376,721
|
|
|
營運損失
|
|
|
(237,631)
|
|
|
(372,733)
|
|
|
(376,721)
|
|
|
其他收入(費用):
|
|
|
|
|
|
|
|
|
|
|
|
利息費用
|
|
|
(10,428)
|
|
|
(8,491)
|
|
|
(8,372)
|
|
|
外幣收益(虧損)
|
|
|
(82)
|
|
|
(580)
|
|
|
2,740
|
|
|
法定賠償損失
|
|
|
(105,477)
|
|
|
—
|
|
|
—
|
|
|
其他收入
|
|
|
3,643
|
|
|
633
|
|
|
416
|
|
|
其他收入(費用),淨額
|
|
|
(112,344)
|
|
|
(8,438)
|
|
|
(5,216)
|
|
|
所得税前損失
|
|
|
(349,975)
|
|
|
(381,171)
|
|
|
(381,937)
|
|
|
所得税利益
|
|
|
3,578
|
|
|
32,034
|
|
|
29,076
|
|
|
淨損失
|
|
$
|
(346,397)
|
|
$
|
(349,137)
|
|
$
|
(352,861)
|
|
|
其他綜合收入(損失):
|
|
|
|
|
|
|
|
|
|
|
|
外幣折算調整,扣除税額
|
|
|
5,517
|
|
|
(357)
|
|
|
(22,629)
|
|
|
可供出售證券未實現收益(虧損)淨額,扣除税後
|
|
|
(110)
|
|
|
237
|
|
|
(383)
|
|
|
其他綜合收入(損失)
|
|
|
5,407
|
|
|
(120)
|
|
|
(23,012)
|
|
|
綜合損失
|
|
$
|
(340,990)
|
|
$
|
(349,257)
|
|
$
|
(375,873)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
基本和稀釋普通股的損失:
|
|
|
|
|
|
|
|
|
|
|
|
基本和稀釋後普通股淨虧損
|
|
$
|
(7.36)
|
|
$
|
(9.07)
|
|
$
|
(9.79)
|
|
|
基礎和稀釋加權平均普通股已發行
|
|
|
47,047
|
|
|
38,478
|
|
|
36,026
|
|
見所附合並財務報表附註。
克洛維斯腫瘤學公司
合併資產負債表
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
|
|
|
|
|
|
|
|
|
資產
|
|
|
|
|
|
|
|
|
流動資產:
|
|
|
|
|
|
|
|
|
現金和現金等價物
|
|
$
|
464,198
|
|
$
|
216,186
|
|
|
應收賬款淨額
|
|
|
6,181
|
|
|
121
|
|
|
盤存
|
|
|
27,508
|
|
|
—
|
|
|
可供出售的證券
|
|
|
99,533
|
|
|
49,997
|
|
|
預付研發費用
|
|
|
1,559
|
|
|
6,427
|
|
|
存貨押金
|
|
|
20,461
|
|
|
—
|
|
|
其他流動資產
|
|
|
7,500
|
|
|
6,679
|
|
|
流動資產總額
|
|
|
626,940
|
|
|
279,410
|
|
|
財產和設備,淨額
|
|
|
4,007
|
|
|
4,440
|
|
|
無形資產,淨額
|
|
|
19,561
|
|
|
21,047
|
|
|
善意
|
|
|
65,217
|
|
|
57,192
|
|
|
其他資產
|
|
|
19,505
|
|
|
2,468
|
|
|
總資產
|
|
$
|
735,230
|
|
$
|
364,557
|
|
|
負債和股東權益(赤字)
|
|
|
|
|
|
|
|
|
流動負債:
|
|
|
|
|
|
|
|
|
應付帳款
|
|
$
|
15,147
|
|
$
|
10,912
|
|
|
應計研發費用
|
|
|
18,465
|
|
|
35,198
|
|
|
里程碑責任
|
|
|
22,022
|
|
|
—
|
|
|
其他應計費用
|
|
|
25,883
|
|
|
19,487
|
|
|
流動負債總額
|
|
|
81,517
|
|
|
65,597
|
|
|
里程碑責任
|
|
|
—
|
|
|
20,062
|
|
|
可轉換高級票據
|
|
|
282,406
|
|
|
281,126
|
|
|
延期租金,長期
|
|
|
3,671
|
|
|
1,406
|
|
|
負債總額
|
|
|
367,594
|
|
|
368,191
|
|
|
承付款和意外開支(附註14)
|
|
|
|
|
|
|
|
|
股東權益(赤字):
|
|
|
|
|
|
|
|
|
優先股,每股票面價值0.001美元;在2017和2016年月31和2016年月日,未發行和發行股票10,000,000股。
|
|
|
—
|
|
|
—
|
|
|
普通股,每股0.001美元,2017,012月31日和2016,012月31日授權發行股票100,000,000股;分別於12月31日、2017和12月31日,分別發行和發行股票50,565,119和38,724,090股和38,724,090股。
|
|
|
51
|
|
|
39
|
|
|
額外實收資本
|
|
|
1,887,198
|
|
|
1,174,950
|
|
|
累計其他綜合損失
|
|
|
(42,173)
|
|
|
(47,580)
|
|
|
累積赤字
|
|
|
(1,477,440)
|
|
|
(1,131,043)
|
|
|
股東權益總額(赤字)
|
|
|
367,636
|
|
|
(3,634)
|
|
|
負債和股東權益總額(赤字)
|
|
$
|
735,230
|
|
$
|
364,557
|
|
見所附合並財務報表附註。
克洛維斯腫瘤學公司
股東權益合併報表(赤字)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
累積
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
額外
|
|
其他
|
|
|
|
|
|
|
|
|
|
|
普通股
|
|
已付
|
|
綜合
|
|
累積
|
|
|
|
|
|
|
|
股份
|
|
金額
|
|
資本
|
|
收入(損失)
|
|
赤字
|
|
共計
|
|
|
|
|
(單位:千,份額除外)
|
|
|
2015年1月1日結餘
|
|
33,977,187
|
|
$
|
34
|
|
$
|
785,089
|
|
$
|
(24,448)
|
|
$
|
(429,045)
|
|
$
|
331,630
|
|
|
發行普通股,扣除發行費用17 741美元
|
|
4,054,487
|
|
|
4
|
|
|
298,505
|
|
|
—
|
|
|
—
|
|
|
298,509
|
|
|
根據員工股票購買計劃發行普通股
|
|
32,021
|
|
|
—
|
|
|
493
|
|
|
—
|
|
|
—
|
|
|
493
|
|
|
行使股票期權
|
|
295,759
|
|
|
—
|
|
|
5,534
|
|
|
—
|
|
|
—
|
|
|
5,534
|
|
|
股份補償費用
|
|
—
|
|
|
—
|
|
|
40,357
|
|
|
—
|
|
|
—
|
|
|
40,357
|
|
|
可供出售證券未變現損失淨額
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(383)
|
|
|
—
|
|
|
(383)
|
|
|
外幣折算調整
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(22,629)
|
|
|
—
|
|
|
(22,629)
|
|
|
淨損失
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(352,861)
|
|
|
(352,861)
|
|
|
2015年月31結餘
|
|
38,359,454
|
|
|
38
|
|
|
1,129,978
|
|
|
(47,460)
|
|
|
(781,906)
|
|
|
300,650
|
|
|
根據員工股票購買計劃發行普通股
|
|
110,508
|
|
|
—
|
|
|
1,965
|
|
|
—
|
|
|
—
|
|
|
1,965
|
|
|
行使股票期權
|
|
247,431
|
|
|
1
|
|
|
3,268
|
|
|
—
|
|
|
—
|
|
|
3,269
|
|
|
發行從受限制的股票單位轉歸的普通股,扣除扣繳税款的股份
|
|
6,697
|
|
|
—
|
|
|
(57)
|
|
|
—
|
|
|
—
|
|
|
(57)
|
|
|
股份補償費用
|
|
—
|
|
|
—
|
|
|
39,796
|
|
|
—
|
|
|
—
|
|
|
39,796
|
|
|
可供出售證券未實現淨收益
|
|
—
|
|
|
—
|
|
|
—
|
|
|
237
|
|
|
—
|
|
|
237
|
|
|
外幣折算調整
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(357)
|
|
|
—
|
|
|
(357)
|
|
|
淨損失
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(349,137)
|
|
|
(349,137)
|
|
|
2016年月31結餘
|
|
38,724,090
|
|
|
39
|
|
|
1,174,950
|
|
|
(47,580)
|
|
|
(1,131,043)
|
|
|
(3,634)
|
|
|
發行普通股,扣除發行成本
|
|
9,670,454
|
|
|
10
|
|
|
545,828
|
|
|
—
|
|
|
—
|
|
|
545,838
|
|
|
根據員工股票購買計劃發行普通股
|
|
51,681
|
|
|
—
|
|
|
2,312
|
|
|
—
|
|
|
—
|
|
|
2,312
|
|
|
行使股票期權
|
|
465,690
|
|
|
1
|
|
|
13,924
|
|
|
—
|
|
|
—
|
|
|
13,925
|
|
|
發行從受限制的股票單位轉歸的普通股,扣除扣繳税款的股份
|
|
180,912
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
股份補償費用
|
|
—
|
|
|
—
|
|
|
44,707
|
|
|
—
|
|
|
—
|
|
|
44,707
|
|
|
合法解決
|
|
1,472,324
|
|
|
1
|
|
|
105,477
|
|
|
—
|
|
|
—
|
|
|
105,478
|
|
|
可供出售證券未變現損失淨額
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(110)
|
|
|
—
|
|
|
(110)
|
|
|
外幣折算調整
|
|
—
|
|
|
—
|
|
|
—
|
|
|
5,517
|
|
|
—
|
|
|
5,517
|
|
|
淨損失
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
(346,397)
|
|
|
(346,397)
|
|
|
2017年月31結餘
|
|
50,565,151
|
|
$
|
51
|
|
$
|
1,887,198
|
|
$
|
(42,173)
|
|
$
|
(1,477,440)
|
|
$
|
367,636
|
|
見所附合並財務報表附註。
克洛維斯腫瘤學公司
現金流動合併報表
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
|
|
(單位:千)
|
|
|
經營活動
|
|
|
|
|
|
|
|
|
|
|
|
淨損失
|
|
$
|
(346,397)
|
|
$
|
(349,137)
|
|
$
|
(352,861)
|
|
|
調整數,將淨損失與用於業務活動的現金淨額對賬:
|
|
|
|
|
|
|
|
|
|
|
|
股份補償費用
|
|
|
44,707
|
|
|
39,796
|
|
|
40,357
|
|
|
折舊和攤銷
|
|
|
2,504
|
|
|
1,141
|
|
|
761
|
|
|
可供出售證券的溢價和折扣的攤銷
|
|
|
354
|
|
|
211
|
|
|
1,400
|
|
|
發債成本攤銷
|
|
|
1,279
|
|
|
1,242
|
|
|
1,205
|
|
|
法定賠償損失
|
|
|
105,477
|
|
|
—
|
|
|
—
|
|
|
無形資產減值
|
|
|
—
|
|
|
104,517
|
|
|
89,557
|
|
|
或有購買考慮的公允價值變動
|
|
|
—
|
|
|
(24,661)
|
|
|
(27,792)
|
|
|
財產和設備處置方面的損失
|
|
|
—
|
|
|
105
|
|
|
39
|
|
|
遞延所得税
|
|
|
(3,218)
|
|
|
(31,771)
|
|
|
(28,874)
|
|
|
經營資產和負債的變化:
|
|
|
|
|
|
|
|
|
|
|
|
應收賬款
|
|
|
(6,061)
|
|
|
(121)
|
|
|
—
|
|
|
盤存
|
|
|
(27,508)
|
|
|
—
|
|
|
—
|
|
|
預付和應計研發費用
|
|
|
(17,297)
|
|
|
(15,364)
|
|
|
14,122
|
|
|
存貨押金
|
|
|
(20,461)
|
|
|
—
|
|
|
—
|
|
|
其他經營資產
|
|
|
(6,476)
|
|
|
1,039
|
|
|
(4,380)
|
|
|
應付帳款
|
|
|
5,637
|
|
|
(1,544)
|
|
|
8,105
|
|
|
其他應計費用
|
|
|
6,556
|
|
|
7,867
|
|
|
5,295
|
|
|
用於業務活動的現金淨額
|
|
|
(260,904)
|
|
|
(266,680)
|
|
|
(253,066)
|
|
|
投資活動
|
|
|
|
|
|
|
|
|
|
|
|
購置財產和設備
|
|
|
(487)
|
|
|
(766)
|
|
|
(3,035)
|
|
|
出售財產和設備的收益
|
|
|
—
|
|
|
65
|
|
|
—
|
|
|
購置財產和設備的押金
|
|
|
(2,515)
|
|
|
—
|
|
|
—
|
|
|
購買可供出售的證券
|
|
|
(263,500)
|
|
|
—
|
|
|
(392,540)
|
|
|
出售可供出售的證券
|
|
|
213,500
|
|
|
200,000
|
|
|
140,997
|
|
|
採購過程中的研究和開發-里程碑付款
|
|
|
(1,100)
|
|
|
—
|
|
|
—
|
|
|
投資活動提供的現金淨額(用於)
|
|
|
(54,102)
|
|
|
199,299
|
|
|
(254,578)
|
|
|
籌資活動
|
|
|
|
|
|
|
|
|
|
|
|
出售普通股的收益,扣除發行成本
|
|
|
545,838
|
|
|
—
|
|
|
298,509
|
|
|
行使股票期權及購買僱員股票所得收益
|
|
|
16,237
|
|
|
5,176
|
|
|
5,971
|
|
|
籌資活動提供的現金淨額
|
|
|
562,075
|
|
|
5,176
|
|
|
304,480
|
|
|
匯率變動對現金及現金等價物的影響
|
|
|
943
|
|
|
(365)
|
|
|
(757)
|
|
|
現金和現金等價物增加(減少)
|
|
|
248,012
|
|
|
(62,570)
|
|
|
(203,921)
|
|
|
期初現金及現金等價物
|
|
|
216,186
|
|
|
278,756
|
|
|
482,677
|
|
|
期末現金及現金等價物
|
|
$
|
464,198
|
|
$
|
216,186
|
|
$
|
278,756
|
|
|
補充披露現金流動信息:
|
|
|
|
|
|
|
|
|
|
|
|
支付利息的現金
|
|
$
|
7,188
|
|
$
|
7,188
|
|
$
|
7,307
|
|
|
非現金投融資活動:
|
|
|
|
|
|
|
|
|
|
|
|
獲得過程中的研究和開發-里程碑在期間結束時未支付
|
|
$
|
—
|
|
$
|
21,100
|
|
$
|
—
|
|
|
受限制股票單位的歸屬
|
|
$
|
12,170
|
|
$
|
175
|
|
$
|
—
|
|
|
|
|
|
|
|
|
|
|
|
|
|
見所附合並財務報表附註。
克洛維斯腫瘤學公司
合併財務報表附註
1.業務性質
我們是一家生物製藥公司,致力於在美國、歐洲和其他國際市場獲取、開發和商業化創新的抗癌藥物。我們的發展計劃旨在治療癌症患者的特定亞羣,同時與合作伙伴一起開發診斷工具,將發展中的化合物導向最有可能從其使用中受益的人羣。我們已經並打算繼續在臨牀發展的各個階段授權或獲得腫瘤化合物的權利。為了換取開發和商業化這些化合物的權利,我們通常希望向許可方提供預付付款、里程碑付款和未來銷售的特許權使用費。此外,我們通常期望對今後的藥物開發和商業化費用承擔責任。我們目前經營在一個部門。自成立以來,我們的業務主要包括開發在許可的化合物,評估新的產品收購候選和一般的公司活動。
Our marketed product Rubraca® (rucaparib) is approved on an accelerated basis in the United States by the FDA as monotherapy for the treatment of patients with deleterious BRCA (human genes associated with the repair of damaged DNA) mutation (germline and/or somatic) associated advanced ovarian cancer who have been treated with two or more chemotherapies, and selected for therapy based on an FDA-approved companion diagnostic for Rubraca.這一適應症的持續批准可能取決於驗證和説明驗證性試驗的臨牀效益。為此,我們於2016在美國推出了魯布拉。
美國食品和藥物管理局目前正在優先審查的時間表,我們的snda作為維持治療的成人患者複發性上皮卵巢,輸卵管,或原發性腹膜癌,誰是一個完全或部分反應鉑為基礎的化療。
Our MAA submitted to the European Union’s EMA for an ovarian cancer treatment indication for Rubraca is currently under review by the EMA’s CHMP. Following a Scientific Advisory Group - Oncology meeting and an oral explanation by us before the CHMP in February 2018, the CHMP has communicated a positive trend vote for the MAA and their intention to hold a final vote on the treatment indication at their March 2018 meeting.
流動資金
自成立以來,我們遭受了巨大的淨虧損,並依賴於我們通過債務和股權融資為我們的業務提供資金的能力。我們預計,在可預見的未來,運營虧損和負現金流將繼續存在。由於我們繼續遭受虧損,向盈利能力的過渡取決於從魯布拉獲得足夠的收入來支持我們的成本結構。我們可能永遠無法實現盈利,除非和直到它實現,我們將繼續需要籌集更多的現金。
今年1月,我們以每股41.00美元的價格公開發行了575萬股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為221.2美元。2017年6月,我們以每股88.00美元的價格,公開發行了3920454股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為324.6美元。我們打算將所提供產品的淨收益用於一般企業用途,包括商業規劃、銷售和營銷費用,這些費用與在美國推出Rubra有關,如果歐洲委員會批准,則用於為其發展項目提供資金、銷售、一般和行政費用、購買或發放額外產品候選人或企業的許可證以及營運資金。根據我們目前的估計,我們相信我們的現金、現金等價物和可供出售的證券將使我們能夠在未來12個月內為各項活動提供資金。.
2.重要會計政策摘要
提出依據
所附財務報表是按照美國公認的會計原則(“美國公認會計原則”)編制的。合併財務報表包括我們的帳目和我們的全資子公司.公司間的所有重要餘額和交易在合併中均已消除。
估計數的使用
按照美國公認會計原則編制財務報表,要求管理層作出影響所報告的資產、負債、費用和收入以及相關披露數額的估計和假設。在持續的基礎上,我們評估我們的估計,包括與收入,無形資產減值,臨牀試驗應計和股票補償費用有關的估計。我們的估計是基於歷史經驗和其他我們認為在當時情況下是合理的特定市場或其他相關假設。實際結果可能與這些估計或假設不同。
收入確認
We are currently approved to sell Rubraca in the United States market. We distribute our product principally through a limited number of specialty distributor and specialty pharmacy providers, collectively, our customers. Our customers subsequently sell our products to patients and health care providers. Separately, we have arrangements with certain payors and other third-parties that provide for government-mandated and privately-negotiated rebates, chargebacks and discounts.
當有有説服力的安排證據時,產品銷售收入被確認,交貨已經發生,產品的所有權和相關的損失風險已轉給客户,價格是固定的或可確定的,向客户收取的款項已得到合理的保證,所有的履約義務都已得到履行,還可以合理地估計退貨和津貼。產品銷售記錄在扣除估計的回扣、回扣、折扣和其他扣減以及估計的產品回報之後。估算回扣、回扣、折扣、產品退貨和其他扣減需要對未來事件和不確定性做出重大判斷,並要求我們在很大程度上依賴於假設和歷史經驗。我們只在產品被專業經銷商或專業藥房供應商出售給病人或醫療服務提供者後,才能確認產品銷售的收入,因此降低了對產品回報的估計的重要性。
在截至12月31日的2017年度,我們確認了5,550萬美元的產品收入。根據我們在監管批准前生產產品的相關費用政策,在截至12月31日的一年中,被確認為收入的Rubra單位的某些費用在美國食品和藥物管理局12月19日批准之前被支出,並且在本期的銷售成本中包含了最低數額。當我們耗盡這些庫存時,我們期望銷售成本與產品收入相關的增加。2017年度,大部分產品的銷售都是商品化前的庫存。
我們每個客户的產品收入佔總收入的10%或10%以上,其中包括:
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
2017
|
|
客户A
|
|
35%
|
|
客户B
|
|
27%
|
|
客户C
|
|
12%
|
|
客户D
|
|
10%
|
自2008年1月1日起,採用新的税收確認標準ASC 606,採用改進的回顧性方法。有關此採用和淨產品收入核算的完整討論,請參閲最近發佈的會計準則下面一節和注11,收入確認.
金融工具的公允價值
現金、現金等價物、可供出售的證券和或有購買的考慮均按公允價值進行.包括其他流動資產和應付帳款在內的金融工具按成本記賬,鑑於其短期性質,公允價值接近公允價值(見附註4,公允價值計量).
現金、現金等價物和可供銷售的證券
我們認為所有在購買之日具有原始到期期限的高流動性投資都是現金等價物。現金和現金等價物包括銀行活期存款和貨幣市場基金,它們主要投資於存款證明、商業票據和美國政府和美國政府機構的債務。
有價證券被認為是可供出售的證券,由美國國債組成.可供出售的證券按公允價值在綜合資產負債表上報告,未實現損益包括在綜合資產負債表上的其他累計綜合損失中。已實現損益、保費和折扣攤銷以及所獲利息和股息列入“業務和綜合損失綜合報表”的其他收入(費用)。為計算已實現和未實現損益而進行的投資成本是根據具體的識別方法計算的。期限超過一年的投資被歸類為短期投資,這是基於我們打算用這些證券為目前的業務提供資金,或者將它們用於當前業務。
低於其成本的證券的市值低於臨時成本的下降被視為非臨時性的,這將計入收益,並導致為該證券建立新的成本基礎。評估一項投資是否受到暫時損害的因素包括:發行人的收益表現、信用評級、資產質量或業務前景顯著惡化;發行人經營的一般市場條件發生不利變化;以及我們持有證券的意圖和能力,直至預期的價值恢復為止。
應收賬款
截至12月31日,2017和2016,我們沒有備抵可疑帳户。我們根據經驗和具體確定的風險為可疑賬户提供備抵。應收帳款按公允價值記帳,當我們確定不可能收回並停止收取款項時,從可疑賬户備抵項下扣除。
財產和設備
財產和設備按成本減去累計折舊。財產和設備按資產的估計使用壽命使用直線法折舊。對購買用於製造和臨牀試驗的設備進行評估,以確定該設備是否僅對處於研發階段的候選藥物有益,還是具有替代用途。具有替代用途的設備被資本化。租賃權改良按資產的經濟壽命或租賃期限攤銷,以較短的為準。維修費按已發生的費用計算。我們資本化資產的估計使用壽命如下:
|
|
|
|
|
|
|
|
估計值
|
|
|
|
|
使用壽命
|
|
|
計算機硬件和軟件
|
|
3至5年
|
|
|
租賃改良
|
|
6年
|
|
|
實驗室、製造和辦公設備
|
|
5至7年
|
|
|
傢俱和固定裝置
|
|
10年
|
|
長壽資產
當事件或情況的變化表明資產的賬面價值可能無法收回時,我們會檢查長期資產的減值情況。可收回性是通過將資產的賬面價值與資產預期產生的未來未折現現金流量進行比較來衡量的。如果資產的賬面價值超過其未來未貼現現金流量淨額,則對資產的賬面價值超過資產公允價值的數額確認減值費用。
無形資產,淨額
與許可協議下資本化里程碑有關的確定壽命無形資產按剩餘使用壽命按直線攤銷,估計為剩餘專利壽命。如果我們對產品使用壽命的估計比剩餘專利壽命短,則使用期限較短。攤銷費用作為銷售成本的一部分記入“業務和綜合損失綜合報表”。
在過程中的研究和開發(“IPR&D”)無形資產是作為收購倫理腫瘤學,S.P.A.的一部分而建立的。(“EOS”)於11月,未攤銷。
如果存在減值指標,無形資產至少在第四季度每年進行評估,如果存在減值指標,則更頻繁地進行評估。可能導致損傷或觸發中期損害評估的事件包括決定停止藥物開發、收到關於我們的候選藥物或具有潛在競爭力的候選藥物的額外臨牀或非臨牀數據、改變藥物候選藥物的臨牀發展計劃或關於該藥物潛在銷售的新信息。就任何減值評估而言,無形資產的公允價值在評估之日與無形資產的賬面價值進行比較。如果無形資產的賬面價值既不能收回,又超過公允價值,則確認減值損失。在2016的第二季度,我們記錄了104.5百萬美元的知識產權無形資產減值,將剩餘的賬面價值減少到零(見附註6,無形資產與商譽那就是。此前,該公司在2015第四季度記錄了對知識產權和開發無形資產的8 960萬美元減值費用。
善意
商譽是指購買價格超過按收購會計方法入賬的企業合併中獲得的淨資產公允價值的超額,未攤銷,但至少在第四季度每年接受減值測試,或在發現可能出現潛在損害的觸發事件時接受減值測試。---我們是一個單一的報告單位,通過比較報告單位的賬面價值和公司的公允價值進行減值測試。由於EOS的收購,商譽被記錄下來。
其他流動資產
其他流動資產包括下列資產(千):
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
從夥伴處收到的應收款
|
|
$
|
9
|
|
$
|
2,882
|
|
|
預付保險
|
|
|
1,926
|
|
|
1,234
|
|
|
預付費用-其他
|
|
|
3,355
|
|
|
2,109
|
|
|
應收款-其他
|
|
|
2,023
|
|
|
364
|
|
|
其他
|
|
|
187
|
|
|
90
|
|
|
共計
|
|
$
|
7,500
|
|
$
|
6,679
|
|
其他應計費用
其他應計費用包括下列費用(千):
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
應計人事費
|
|
$
|
13,889
|
|
$
|
15,850
|
|
|
應付應計利息
|
|
|
2,096
|
|
|
2,096
|
|
|
應付所得税
|
|
|
—
|
|
|
556
|
|
|
應計法人律師費和專業服務
|
|
|
415
|
|
|
589
|
|
|
應計版税
|
|
|
2,984
|
|
|
—
|
|
|
應計銷售扣減額
|
|
|
1,008
|
|
|
—
|
|
|
支付給第三方物流供應商的款項
|
|
|
2,661
|
|
|
—
|
|
|
應計費用-其他
|
|
|
2,830
|
|
|
396
|
|
|
共計
|
|
$
|
25,883
|
|
$
|
19,487
|
|
企業合併產生的或有代價的估值
在收購日期之後,我們在每個報告期內按公允價值重新計量或有考慮安排,並記錄公允價值的變化,以改變或有購買考慮的公允價值和外幣損益,以反映業務和綜合損失綜合報表中外幣折算率的變化。公允價值的變化主要歸因於有關知識產權資產的新信息,包括時間表和成功可能性的變化,以及時間的推移。在沒有新資料的情況下,公允價值的變化只反映時間的推移。During the fourth quarter of 2015, we recorded a $26.9 million reduction in the fair value of the contingent purchase consideration liability due to a change in the estimated probability-weighted future discounted milestone payments, as well as the timing of such payments, for the lucitanib program. Then, during the second quarter of 2016, we recorded a $25.5 million reduction in the fair value of the contingent purchase consideration liability 由於我們和我們的發展夥伴決定停止發展對乳腺癌的利西坦。截至#date0#12月31日,綜合資產負債表上記錄的或有購買考慮負債仍為零,原因是實現任何一項盈利監管里程碑的不確定性,因此未來里程碑付款的可能性微乎其微。
研發費用
研究和開發費用按所發生的費用計算,包括但不限於:工資和福利、基於股份的補償、臨牀試驗活動、藥物開發和製造、配套診斷開發和第三方服務費用,包括合同研究機構和調查地點。在2015年間,我們完成了我們在美國的銷售、營銷和醫療機構的招聘工作,為魯布拉的潛在商業推出做好準備。在FDA批准Rubra之前,這些費用也包括在研發費用中。
某些開發活動的成本,如臨牀試驗,是基於對完成特定任務的進展情況的評估,使用諸如病人登記、臨牀站點激活或供應商向我們提供的有關其實際成本的信息等數據。這些活動的付款依據的是個別安排的條款,這些條款可能與發生的費用模式不同,並作為預付的或應計的研究和開發費用反映在綜合資產負債表上。
過程中研發費用
我們已經獲得並期望繼續獲得開發新藥物候選人和使其商業化的權利。The upfront payments to acquire a new drug compound, as well as subsequent milestone payments, are immediately expensed as acquired in-process research and development provided that the drug has not achieved regulatory approval for marketing and, absent obtaining such approval, has no alternative future use. Once regulatory approval is received, payments to acquire rights, and the related milestone payments, are capitalized and the amortization of such assets recorded to product cost of sales.
股份補償費用
基於股票的薪酬被確認為所有基於股票的獎勵給員工和董事的費用,並基於估計的公允價值。我們使用Black-Schole期權定價模型在授予日期確定基於股權的補償.最終預期授予的獎勵的價值被確認為在所需服務期間的直線基礎上的費用。對估計的沒收率的任何變化都將前瞻性地加以説明。
盤存
庫存按成本的較低或可變現淨值的估計數計算,以先入先出或先出先出為基礎。在魯布拉獲得監管批准之前,我們支付了生產藥物的費用,這些費用可能會用於支持魯布拉的商業發射。直到第一個報告期間,當得到監管批准時,我們記錄所有這些成本,如研發費用。我們定期分析我們的庫存水平,並記錄已過時的庫存、成本基礎超過其估計可變現價值的庫存和/或超過預期銷售需求的庫存,作為產品收入成本。過期庫存將予以處置,相關費用將作為產品收入成本核銷。
活性藥物魯布拉的化學成分目前由單一供應商生產。
在12月31日,2017,合併資產負債表上的庫存存款是一筆2,050萬美元的現金存款給一家制造商,用於購買庫存,我們預計將在未來12個月內將其轉換為成品。
信貸風險集中
可能使我們面臨集中信貸風險的金融工具主要是現金、現金等價物和可供出售的證券。我們以貨幣市場賬户的形式維持我們的現金和現金等值餘額,我們認為這些金融機構是值得信賴的。可供出售的證券是按照我們的投資政策進行投資的.投資政策包括有關機構和金融工具質量的指導方針,並界定了我們認為儘量減少信貸風險集中風險的允許投資。我們沒有資產負債表外的會計損失風險的金融工具.
外幣
我們的外國業務的資產和負債按當前匯率折算成美元,業務結果按報告所述期間的平均匯率折算。由此產生的翻譯調整數包括在綜合資產負債表上累計的其他綜合損失中。以功能貨幣以外的貨幣計值的交易是根據發生這種交易時的匯率記錄的。交易損益記為“業務和綜合損失綜合報表”中的外幣損益。截至12月31日、2017和2016,約1%的負債是以功能貨幣以外的貨幣計價的。
所得税
我們根據資產和負債法計算所得税。遞延税資產和負債因財務報表中現有資產和負債數額與其各自税基之間的差異而產生的未來税收後果確認為遞延税資產和負債,所採用的税率為預計差額將影響應納税收入的年度生效的税率。如果在審計期間更有可能維持税收狀況,就會確認税收優惠。如果目前的證據表明,認為這些福利不可能實現的可能性更大,則遞延税資產將通過估值備抵額予以削減。
最近採用的會計準則
2016,財務會計準則委員會發布了“會計準則更新第2016-09號,薪酬-股票補償(主題718):改進員工股票支付會計”(2016-09)。ASU 2016-09簡化了基於股票的支付的幾個方面的會計核算和財務報表中的列報。ASU 2016-09在2016年月15以後的年度報告期內對上市公司有效.我們採用了這個ASU
在2017的第一季度。我們有多餘的税收優惠,以前無法確認的福利約為1 820萬美元。在通過後,未確認的超額税收優惠的餘額被倒轉,其影響記錄在留存收益中,包括由於採用而對估值津貼的任何變動。由於對美國遞延税資產的全額估價備抵,這種做法對財務報表沒有任何影響。
最近發佈的會計準則
2014年5月,財務會計準則委員會(FASB)發佈了ASU第2014-09號“與客户簽訂合同的收入”,並隨後發佈了幾份補充和/或澄清Asus(統稱為“ASC 606”)。ASC 606規定了一個單一的通用收入標準,取代了大多數現有的美國GAAP收入確認指南。ASC 606的目的是提供一個更一致的解釋和適用標準中概述的原則,在多個行業和同一行業內,與目前的做法相比,這應該提高可比性。採用ASC 606是必要的年度和中期後,從12月15日,2017。在通過時,我們必須選擇對提交的每一個報告所述期間追溯採用,或採用經修改的追溯性過渡方法,其累積效果是在初次申請之日確認的初次收養。我們選擇在2018年月1日採用新的標準,採用修改後的追溯方法。
根據ASC 606,一個實體在其客户獲得承諾的貨物或服務的控制權時確認收入,其數額反映了該實體期望以這些貨物或服務為交換條件而得到的考慮。To determine revenue recognition for arrangements that an entity determines are within the scope of ASC 606, the entity performs the following five steps: (i) identify the contract(s) with a customer; (ii) identify the performance obligations in the contract; (iii) determine the transaction price; (iv) allocate the transaction price to the performance obligations in the contract; and (v) recognize revenue when (or as) the entity satisfies a performance obligation.ASC 606還影響到某些其他領域,例如獲取或履行合同的成本核算。該標準還要求披露與客户簽訂的合同所產生的收入和現金流量的性質、數額、時間和不確定性。
我們已經審查了我們的收入確認政策,具體來自代表合同的收入來源於魯布拉的產品銷售,並得出了關於使用ASC 606規定的5步流程的新標準的影響的結論。我們已經審查了一份具有代表性的合同樣本,包括我們與Servier和Bristol-Myers Squibb在注13中討論的合作協議,許可證協議,並確定了對我們的會計政策、財務控制和業務的潛在影響。我們的結論包括確認產品銷售收入,一旦產品被出售給專業經銷商和專業藥房供應商。目前,我們預計收養的效果將如注11所述,收入確認.
2016年2月,房協頒佈了第2016-02號“租賃(主題842)”,要求承租人在資產負債表上確認大部分租賃所產生的權利和義務的資產和負債。該指南適用於從2018年月15以後開始的財政年度,包括那些財政年度內的過渡時期。允許提前申請。我們計劃於2019年月一日通過。ASU 2016-02要求對所有在初始申請日期存在或簽訂的租賃進行修改後追溯採用,並可選擇使用某些過渡救濟。我們目前正在評估該標準可能對我們的合併財務報表和相關披露產生的影響。
2017年月日,聯邦會計準則委員會發布了ASU第2017-01號,“澄清業務的定義”,其中澄清了ASC 805中對業務的定義。該指南適用於從2017年月15以後開始的財政年度,包括那些財政年度內的過渡時期。允許提前申請。我們於2018年月一日採用了這一標準,該標準的採用並沒有改變我們的合併財務報表和相關披露。
2017年5月,聯邦會計準則委員會發布了“補償-股票補償(主題718):修正會計的範圍”的2017-09年度會計準則,對基於股票的支付安排的變更會計範圍進行了修正。ASU就基於股票的支付獎勵的條款或條件的更改提供指導,我們將根據ASC 718適用修改會計。具體來説,如果公允價值、歸屬條件和裁決的分類在緊接修改前後相同,我們將不適用修改會計。該指南適用於年度報告期間,包括從2017年月15以後開始的這些年度期間內的中期。允許提前通過,包括在任何臨時收養中。
期間。我們於2018年月一日採用了這一標準,該標準的採用並沒有改變我們的合併財務報表和相關披露。
3.財產和設備
財產和設備包括下列(千):
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
實驗室、製造和辦公設備
|
|
$
|
2,853
|
|
$
|
2,555
|
|
|
租賃改良
|
|
|
2,285
|
|
|
2,276
|
|
|
傢俱和固定裝置
|
|
|
1,416
|
|
|
1,411
|
|
|
計算機硬件和軟件
|
|
|
1,141
|
|
|
855
|
|
|
財產和設備共計
|
|
|
7,695
|
|
|
7,097
|
|
|
減:累計折舊
|
|
|
(3,688)
|
|
|
(2,657)
|
|
|
財產和設備共計,淨額
|
|
$
|
4,007
|
|
$
|
4,440
|
|
與財產和設備有關的折舊費用約為$1.0截至12月31日、2017、2016和2015年度,分別為100萬美元、110萬美元和80萬美元。
4.公允價值計量
公允價值是指在計量日,市場參與者之間有秩序地進行交易時,在本金或最有利的市場中出售資產或支付債務以轉移負債(以出口價格支付)的交易所價格。可用於衡量公允價值的三種投入包括:
|
第1級:
|
同一資產或負債活躍市場的報價。我們的一級資產包括貨幣市場投資。我們沒有一級負債。
|
|
|
|
|
2級:
|
一級價格以外的可觀測的投入,例如活躍市場中類似資產或負債的報價,或其他可觀察或可被可觀測市場數據證實的投入,其實質是資產或負債的整個期間。我們的二級資產包括美國國債。我們沒有二級負債。
|
|
|
|
|
第3級:
|
由很少或根本沒有市場活動支持的不可觀測的投入。我們沒有三級資產。與2013年月日購買EOS所獲得的未開發的利他尼亞產品權利有關的或有購買考慮是第三級責任。這一負債的公允價值是以不可觀察的投入為基礎的,其中包括幾乎沒有(如果有的話)市場活動的估值。在2016的第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦,使我們或有購買考慮負債的公允價值減少了2,550萬美元,使剩餘的公允價值降至零。截至2017年月31,公允價值和賬面價值仍為零。
第三級工具公允價值的變動包括在“業務和綜合損失綜合報表”外幣折算率變動的或有購買考慮公允價值和外幣損益變動中。
|
下表列出按公允價值定期計量的資產(以千計):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
平衡
|
|
一級
|
|
2級
|
|
三級
|
|
|
2017年月31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
資產:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
貨幣市場
|
|
$
|
433,136
|
|
$
|
433,136
|
|
$
|
—
|
|
$
|
—
|
|
|
美國國債
|
|
|
99,533
|
|
|
—
|
|
|
99,533
|
|
|
—
|
|
|
按公允價值計算的資產總額
|
|
$
|
532,669
|
|
$
|
433,136
|
|
$
|
99,533
|
|
$
|
—
|
|
|
2016年月31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
資產:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
貨幣市場
|
|
$
|
202,361
|
|
$
|
202,361
|
|
$
|
—
|
|
$
|
—
|
|
|
美國國債
|
|
|
49,997
|
|
|
—
|
|
|
49,997
|
|
|
—
|
|
|
按公允價值計算的資產總額
|
|
$
|
252,358
|
|
$
|
202,361
|
|
$
|
49,997
|
|
$
|
—
|
|
截至2017年月31,沒有按公允價值計算的負債。在截至12月31日的2017年間,在第1級和第2級類別之間以及在第3級類別之間或從第3級類別之間沒有任何轉移。
未按公允價值記錄的金融工具包括我們的可轉換高級票據。截至#date0#12月31日,可轉換高級債券的賬面金額為282.4百萬美元,這是扣除剩餘債務發行成本後的本金總額,公允價值為388.3百萬美元。公允價值是根據某些投資銀行公佈的指示性定價或可轉換高級票據的交易水平確定的,這些證券沒有在任何證券交易所上市或在交易商間自動報價系統中報價。見附註7,可轉換高級債券討論可轉換的高級票據。應付帳款和應計費用的賬面金額因其短期期限而近似於其公允價值。
5.可供出售的證券
截至#date0#12月31日,可供出售的證券包括以下(千)種:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
毛額
|
|
毛額
|
|
骨料
|
|
|
|
|
攤銷
|
|
未實現
|
|
未實現
|
|
公平
|
|
|
|
|
成本
|
|
收益
|
|
損失
|
|
價值
|
|
|
美國國債
|
|
$
|
99,650
|
|
$
|
—
|
|
$
|
(117)
|
|
$
|
99,533
|
|
截至2017年月31,可供出售的有價證券的公允價值和未變現總損失(單位:千)連續未變現虧損不足12個月:
|
|
|
|
|
|
|
|
|
|
|
|
骨料
|
|
毛額
|
|
|
|
|
公平
|
|
未實現
|
|
|
|
|
價值
|
|
損失
|
|
|
美國國債
|
|
$
|
99,533
|
|
$
|
(117)
|
|
我們的投資已經有兩個月沒有實現虧損了。根據我們對所有相關因素的評估,我們認為,在低於成本的12月31日持有的證券的公允價值下降是暫時的,我們打算保留對這些證券的投資足夠一段時間,以便收回公允價值。
截至2017年月31日,按合約期限計算的可供出售證券的攤銷成本和公允價值為(千):
|
|
|
|
|
|
|
|
|
|
|
|
攤銷
|
|
公平
|
|
|
|
|
成本
|
|
價值
|
|
|
一年或一年以下到期
|
|
$
|
99,650
|
|
$
|
99,533
|
|
|
一年至兩年到期
|
|
|
—
|
|
|
—
|
|
|
共計
|
|
$
|
99,650
|
|
$
|
99,533
|
|
6.盤存
下表列出截至#date0#12月31日和2016(千)日的庫存情況:
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
在製品
|
|
$
|
24,721
|
|
$
|
—
|
|
|
成品
|
|
|
2,787
|
|
|
—
|
|
|
共計
|
|
$
|
27,508
|
|
$
|
—
|
|
在12月31日,2017,合併資產負債表上的庫存存款是一筆2,050萬美元的現金存款給一家制造商,用於購買庫存,我們預計將在未來12個月內將其轉換為成品。
7.無形資產與商譽
截至12月31日、2017和2016,與許可證協議下資本化里程碑有關的無形資產包括下列資產(千):
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
無形資產-里程碑
|
|
$
|
21,100
|
|
$
|
21,100
|
|
|
累計攤銷
|
|
|
(1,539)
|
|
|
(53)
|
|
|
無形資產共計,淨額
|
|
$
|
19,561
|
|
$
|
21,047
|
|
這些無形資產的估計使用壽命延長到2031。
我們分別在截至12月31日的2017和12月31日2016的年度中記錄了與資本化里程碑付款相關的150萬美元和0.053百萬美元的攤銷費用。截至2017年度12月31日,無形資產的未來攤銷費用估計如下(千):
|
|
|
|
|
|
|
|
|
|
2018
|
|
|
|
|
$
|
1,486
|
|
|
2019
|
|
|
|
|
|
1,486
|
|
|
2020
|
|
|
|
|
|
1,486
|
|
|
2021
|
|
|
|
|
|
1,486
|
|
|
2022
|
|
|
|
|
|
1,486
|
|
|
此後
|
|
|
|
|
|
12,131
|
|
|
|
|
|
|
|
$
|
19,561
|
|
2013年間,作為EOS採購核算的一部分,設立了知識產權和商譽,包括以下(千)項:
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
知識產權與發展資產:
|
|
|
|
|
|
|
|
|
期初餘額
|
|
$
|
—
|
|
$
|
101,500
|
|
|
無形資產減值(A)
|
|
|
—
|
|
|
(104,517)
|
|
|
外幣損益變動
|
|
|
—
|
|
|
3,017
|
|
|
期末餘額
|
|
$
|
—
|
|
$
|
—
|
|
|
|
|
|
|
|
|
|
|
|
商譽:
|
|
|
|
|
|
|
|
|
期初餘額
|
|
$
|
57,192
|
|
$
|
59,327
|
|
|
外幣損益變動
|
|
|
8,025
|
|
|
(2,135)
|
|
|
期末餘額
|
|
$
|
65,217
|
|
$
|
57,192
|
|
|
(a)
| |
在2016第二季度,由於我們和我們的發展夥伴決定停止發展用於乳腺癌的利西坦,我們記錄了104.5百萬美元的減值費用。截至2017年月31,綜合資產負債表上記錄的知識產權無形資產為零。 |
在2015第四季度,我們記錄了8 960萬美元的減值費用,原因是我們和我們的發展夥伴決定終止用於肺癌的盧西坦的研發,以及對乳腺癌適應症的概率加權貼現現金流假設的更新。
這些減少數包括在“業務和綜合損失綜合報表”無形資產減值項下。
截至2017年月31,商譽的賬面價值未見減值。
8.可轉換高級債券
#date0#9月9日,我們完成了287.5百萬美元的私募發行,本金總額為2.5%的可轉換高級債券,到期金額為2021(“債券”),扣除發行費用後,淨收益為278.3百萬美元。根據會計準則,轉換特徵不符合分叉標準,整個本金在綜合資產負債表上作為長期負債入賬。
這些票據受公司作為發行人與紐約梅隆銀行信託公司作為託管人之間的契約條款管轄。該批債券屬高級無抵押債券,年息2.5釐,每年三月十五日及九月十五日每半年繳付一次。該批債券將於2021年月十五日到期,除非較早時已轉換、贖回或回購。
持有人可在緊接到期日營業日結束前的任何時間,轉換全部或部分債券。轉換後,持有人將獲得我們普通股的股份,初始轉換率為每1,000美元債券本金16.1616股,相當於每股約61.88美元的轉換價格。折算率在發生契約中所述的某些事件時可作調整,但不因任何應計利息和未付利息而調整。此外,在某些公司活動在到期日前或在我們發出贖回通知書後,我們會提高在某些情況下選擇就該等公司活動或在有關贖回期內轉換該等債券的持有人的轉換率。
在2018年月15日或之後,如果我們的普通股上一次報告的銷售價格至少為轉換價格的150%,我們可以選擇全部或部分贖回債券,然後在截止日期前不超過兩個交易日的任何連續30個交易日期間(不論是否連續)生效至少20個交易日(不論是否連續)。我們提供贖回通知書,贖回價格相等於贖回債券本金的100%,另加贖回日期的應計利息及未付利息,但不包括贖回日期。沒有為債券提供償債基金。
如我們在債券到期日前經歷契約所界定的根本改變,持有人可要求我們以現金形式回購全部或部分債券,其基本換回價格相等於擬回購的債券本金的100%,另加基本更改回購日期的應計利息及未付利息,但不包括基本更改回購日期。
The Notes rank senior in right of payment to any of our indebtedness that is expressly subordinated in right of payment to the Notes; equal in right of payment to all of our liabilities that are not so subordinated; effectively junior in right of payment to any secured indebtedness to the extent of the value of the assets securing such indebtedness; and structurally junior to all indebtedness and other liabilities (including trade payables) of our subsidiaries.
在發行債券方面,我們招致920萬元的發債成本。債券發行成本按有效利息法攤銷,在債券預期壽命內作為利息費用攤銷。我們確定債務的預期壽命等於債券的七年期。截至12月31日、2017和2016,
未攤銷的債務發行費用餘額分別為510萬美元和640萬美元,記作綜合資產負債表可兑換高級票據的減少額。
下表列出截至十二月三十一日、2017及2016年度的“註釋”利息開支總額及里程碑負債(千元):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
合同利息費用
|
|
$
|
7,188
|
|
$
|
7,187
|
|
$
|
7,167
|
|
里程碑責任利息的增加
|
|
|
1,961
|
|
|
62
|
|
|
—
|
|
發債成本攤銷
|
|
|
1,279
|
|
|
1,242
|
|
|
1,205
|
|
利息費用總額
|
|
$
|
10,428
|
|
$
|
8,491
|
|
$
|
8,372
|
9.股東權益
普通股
在2015,我們以每股78.00美元的價格在公開發行中出售了405487股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為298.5美元。
今年1月,我們以每股41.00美元的價格公開發行了575萬股普通股。此次發行的淨收益為221美元。2百萬元,扣除包銷折扣和佣金,並提供費用。
2017年6月,我們以每股88.00美元的價格,公開發行了3920454股普通股。在扣除承銷折扣、佣金和提供費用後,此次發行的淨收益為324.6美元。
普通股持有人有權就所有將由我們的股東表決的事項每股投一票。除可適用於任何優先股流通股的優惠外,普通股持有人有權按本公司董事局的聲明,按比例收取股息(如有的話)。
累計其他綜合損失
累計的其他綜合損失包括外幣折算調整的變化,包括子公司功能貨幣的變化,以及可供銷售證券的未實現損益。
與其他綜合收入(損失)各組成部分有關的累計餘額彙總如下(千):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
外幣
|
|
未實現
|
|
累計總額
|
|
|
|
翻譯調整
|
|
(損失)收益
|
|
其他綜合損失
|
|
2015年月31結餘
|
|
$
|
(47,077)
|
|
$
|
(383)
|
|
$
|
(47,460)
|
|
其他綜合收入(損失)
|
|
|
(1,693)
|
|
|
224
|
|
|
(1,469)
|
|
税前總額
|
|
|
(48,770)
|
|
|
(159)
|
|
|
(48,929)
|
|
税收效應
|
|
|
1,336
|
|
|
13
|
|
|
1,349
|
|
2016年月31結餘
|
|
|
(47,434)
|
|
|
(146)
|
|
|
(47,580)
|
|
其他綜合收入(損失)
|
|
|
8,735
|
|
|
(110)
|
|
|
8,625
|
|
税前總額
|
|
|
(38,699)
|
|
|
(256)
|
|
|
(38,955)
|
|
税收效應
|
|
|
(3,218)
|
|
|
—
|
|
|
(3,218)
|
|
2017年月31結餘
|
|
$
|
(41,917)
|
|
$
|
(256)
|
|
$
|
(42,173)
|
與外幣折算調整有關的其他綜合收入(損失)主要是由於知識產權無形資產、商譽和遞延所得税的貨幣換算(見附註7,無形資產
和親善那就是。截至12月31日、2017、2016和2015年度的累計其他綜合損失中,沒有重新分類。
10.股份補償
股票期權
2011年8月,我們董事會批准了2011股激勵計劃(“2011計劃”),該計劃於11月2011號首次公開發行(IPO)結束時生效。2011計劃規定向我們的員工、董事和顧問授予激勵和不合格股票期權、股票增值權、限制性股票、限制性股票單位、業績獎勵和其他基於股票的獎勵。Common shares authorized for issuance under the 2011 Plan were 9,590,378 at December 31, 2017, which represents the initial reserve of 1,250,000 shares of common stock plus 192,185 shares of common stock remaining for future grant from the 2009 Equity Incentive Plan (the “2009 Plan”), which was terminated upon the closing of our initial public offering in November 2011, and 8,148,193 new shares authorized by the Board 在股東年會上擔任董事。以前根據2009計劃授予的期權的未來沒收和取消已轉移到2011計劃下並可獲得贈款。獲批股票期權的董事可按比例獲批予董事補助金,期限為一年或三年.員工股票期權通常在四年內歸屬,其中25%的期權在第一年之後歸屬,其餘的期權則在隨後的每個月按比例歸屬。所有股票期權自授予之日起滿10年。
截至12月31日、2017、2016和2015年底的按股票計算的賠償費用分別在所附的業務和綜合損失綜合報表中確認如下(千):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
研發
|
|
$
|
20,335
|
|
$
|
27,558
|
|
$
|
27,321
|
|
|
銷售、一般和行政
|
|
|
24,372
|
|
|
12,238
|
|
|
13,036
|
|
|
股份補償費用總額
|
|
$
|
44,707
|
|
$
|
39,796
|
|
$
|
40,357
|
|
在截至12月31日、2017、2016和2015的年度內,我們沒有確認與股票補償費用相關的税收優惠,因為我們保持營業淨虧損結轉,並對截至12月31日的全部遞延税款資產淨額設定了估值備抵。
下表彙總了與我們購買普通股期權有關的活動:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
加權
|
|
|
|
|
|
|
|
|
|
加權
|
|
平均
|
|
骨料
|
|
|
|
|
|
|
平均
|
|
剩餘
|
|
內稟
|
|
|
|
|
數目
|
|
運動
|
|
契約性
|
|
價值
|
|
|
|
|
備選方案
|
|
價格
|
|
任期(年份)
|
|
(千)
|
|
|
2016年月31未繳
|
|
5,520,482
|
|
$
|
42.00
|
|
|
|
|
|
|
|
獲批
|
|
1,048,700
|
|
|
66.09
|
|
|
|
|
|
|
|
行使
|
|
(465,690)
|
|
|
29.90
|
|
|
|
|
|
|
|
被沒收
|
|
(313,757)
|
|
|
49.20
|
|
|
|
|
|
|
|
截至#date0#12月31日(A)
|
|
5,789,735
|
|
$
|
46.77
|
|
7.1
|
|
$
|
145,067
|
|
|
既得利益及預期將於2017年月31歸屬
|
|
5,505,557
|
|
$
|
46.52
|
|
7.0
|
|
$
|
139,526
|
|
|
於2017年月31歸屬及行使
|
|
3,481,931
|
|
$
|
44.60
|
|
6.1
|
|
$
|
95,463
|
|
|
(a)
| |
包括在2015第一季度授予我們高管的33,750項基於業績的股票期權。,該公司於#date0#12月19日獲得美國食品和藥物管理局的批准,以商業方式分銷、銷售或銷售魯布拉。該日確認了相關的股票賠償費用。 |
上表中的內在價值總額是根據我們截至2017年月31的收盤價68.00美元計算的税前內在價值,如果所有持有貨幣期權的期權持有者在該日行使他們的期權,期權持有人就會收到這一收盤價。
下表概述截至及截至十二月三十一日、2017、2016及2015年底的股票期權資料:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
加權平均授予日期---每股公允價值
|
|
$
|
48.79
|
|
$
|
16.62
|
|
$
|
52.70
|
|
|
行使期權的內在價值
|
|
$
|
18,986,726
|
|
$
|
3,118,097
|
|
$
|
19,976,769
|
|
|
從股票期權活動中收到的現金
|
|
$
|
13,924,174
|
|
$
|
3,267,721
|
|
$
|
5,478,211
|
|
每一份股票獎勵的公允價值是在授予日期根據下表所提供的加權平均假設,使用Black-Schole期權定價模型估算的:
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
股利收益率
|
|
—
|
|
—
|
|
—
|
|
|
波動性(A)
|
|
89
|
%
|
93
|
%
|
72
|
%
|
|
無風險利率(B)
|
|
2.16
|
%
|
1.77
|
%
|
1.77
|
%
|
|
預期任期(年份)(C)
|
|
5.8
|
|
5.8
|
|
6.1
|
|
|
(a)
| |
波動率*預期波動率是根據我們的歷史數據估計的。 |
|
(b)
| |
無風險利率:利率是基於美國國債零息票的授予日期的收益率,其到期期接近期權的預期期限。 |
|
(c)
| |
預期任期:這個獎項的預期期限是根據我們的歷史數據來估算的。 |
截至十二月三十一日、2017、2016及2015年度的股票期權公允價值總額為$36.0分別為4 080萬美元和3 650萬美元。
限制性股票
在2016年間,我們根據2011股票激勵計劃向某些員工發放了限制性股票單位(“RSU”)。The RSUs vest either (i) over two years, with 50% vesting one year from the date of grant and the remaining 50% vesting two years from the date of grant or (ii) over four years, with 25% vesting one year from the date of grant and the remaining 75% vesting ratably each subsequent quarter over the following three years, as defined in the grant agreement.歸屬期結束時,以普通股的股份支付既得的RSU。RSU是根據授予日基礎股票的公允價值來衡量的。在轉歸僱員時,發行給僱員的普通股價值的最低法定税,由我們透過出售我們的普通股而繳付。
下表彙總了與我們未歸屬的RSU有關的活動:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
加權
|
|
|
|
|
|
|
平均
|
|
|
|
|
數目
|
|
授予日期
|
|
|
|
|
單位
|
|
公允價值
|
|
|
2016年月31
|
|
562,458
|
|
$
|
24.70
|
|
|
獲批
|
|
249,984
|
|
|
64.66
|
|
|
既得利益
|
|
(180,912)
|
|
|
23.83
|
|
|
被沒收
|
|
(42,001)
|
|
|
28.09
|
|
|
截至2017年月31
|
|
589,529
|
|
$
|
41.67
|
|
|
預計將於2017年月31日後歸屬。
|
|
513,069
|
|
$
|
41.40
|
|
截至12月31日,與非既得期權和RSU有關的未確認股票補償費用經預期沒收調整後為8,940萬美元。7。未確認的股票補償費用預計將在3.3年的加權平均剩餘歸屬期內確認。
預留髮行的普通股
截至2017年月31,我們為未來發行保留普通股如下:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
可供
|
|
|
|
|
|
|
|
|
格蘭特
|
|
總份額
|
|
|
|
|
普通股
|
|
或未來
|
|
普通股
|
|
|
|
|
突出
|
|
發行
|
|
預留
|
|
|
2009股權激勵計劃
|
|
331,213
|
|
—
|
|
331,213
|
|
|
2011股票激勵計劃
|
|
6,048,051
|
|
2,589,033
|
|
8,637,084
|
|
|
2011員工股票購買計劃
|
|
—
|
|
558,870
|
|
558,870
|
|
|
共計
|
|
6,379,264
|
|
3,147,903
|
|
9,527,167
|
|
員工股票購買計劃
在2011,我們的董事會批准了克洛維斯腫瘤學公司。2011員工股票購買計劃(“購買計劃”)。Each year, on the date of our annual meeting of stockholders and at the discretion of our board of directors, the amount of shares reserved for issuance under the Purchase Plan may be increased by up to the lesser of (1) a number of additional shares of our common stock representing 1% of our then-outstanding shares of common stock, (2) 344,828 shares of our common stock and (3) a lesser 經董事會批准的股份數量。“購買計劃”規定了連續六個月的公開發行期,在此期間,參與計劃的僱員可選擇提取至多10%的補償,並在每個發行期結束時將其適用於普通股的購買。普通股的買入價為每個發行期第一個交易日普通股公允價值的85%,或發行期最後一個交易日普通股公允價值的85%。購買計劃將於2021年8月24日終止,即購買計劃最初通過之日十週年。2017和2016年度,我們分別向員工出售了51,681股和110,508股股票。截至2017年月31,共有558,870股股票可根據購買計劃出售。截至12月31日、2017和2016年度,根據“購買計劃”獲得的採購獎勵的加權平均估計授予日公允價值分別為每股23.08美元和11.70美元。由於購買計劃而記錄的基於股份的補償費用總額約為$1.0截至12月31日、2017、2016和2015年度,分別為80萬美元、80萬美元和90萬美元。
在截至12月31日、2017、2016和2015的年度內,給予我們僱員的購買獎勵的公允價值分別是根據下表所提供的加權平均假設,使用Black-Schole期權定價模型估算的:
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
股利收益率
|
|
—
|
|
—
|
|
—
|
|
|
波動性(A)
|
|
79
|
%
|
92
|
%
|
71
|
%
|
|
無風險利率(B)
|
|
0.90
|
%
|
0.40
|
%
|
0.11
|
%
|
|
預期任期(年份)(C)
|
|
0.5
|
|
0.5
|
|
0.5
|
|
|
(a)
| |
波動率*預期波動率是根據我們的歷史數據估計的。 |
|
(b)
| |
無風險利率:這一利率是基於美國國債在授予時的有效收益率,其條款與購買權的合同條款類似。 |
|
(c)
| |
預期任期:獎勵的預期壽命代表了購買計劃的六個月的發行期. |
11.收入確認
自2008年1月1日起,採用新的税收確認標準ASC 606,採用改進的回顧性方法。採用後,淨產品收入的會計核算如下:
產品收入淨額
We are currently approved to sell Rubraca in the United States market. We distribute our product principally through a limited number of specialty distributor and specialty pharmacy providers, collectively, our customers. Our customers subsequently sell our products to patients and health care providers. Separately, we have arrangements with certain payors and other third-parties that provide for government-mandated and privately-negotiated rebates, chargebacks and discounts.
當客户獲得對我們產品的控制權時,產品銷售收入就會被確認,這種控制發生在某個時間點,通常是在交付給客户時。如果我們確認的資產的預期攤銷期是一年或更短,我們就會在合同發生時支付增量成本。
可變考慮準備金
Revenues from product sales are recorded at the net sales price (transaction price), which includes estimates of variable consideration for which reserves are established and which result from rebates, chargebacks, discounts, co-pay assistance, estimated product returns and other allowances that are offered within contracts between us and our customers, health care providers, payors and other indirect customers relating to the sales of our product. These reserves are based on the amounts earned or to be claimed on the related sales and are classified as reductions of accounts receivable (if the amount is payable to the customers) or a current liability (if the amount is payable to a party other than a customer). Where appropriate, these estimates take into consideration a range of possible outcomes which are probability-weighted for relevant factors such as our historical experience, current contractual and 法定要求、具體的市場事件和趨勢、行業數據和預測的客户購買和支付模式。總的來説,這些準備金反映了我們根據合同條款對我們有權得到的考慮金額的最佳估計。交易價格中包含的可變代價的數額可能受到限制,並且僅限於淨銷售價格。在未來一段時期內,可能不會出現累積收入大幅逆轉的情況。最終收到的實際考慮金額可能與我們的估計不同。如果未來的實際結果與我們的估計不同,我們調整這些估計,這將影響到這些差異所知期間的淨產品收入和收益。
回扣。回扣包括醫療補助藥品退税計劃和醫療保險覆蓋缺口計劃下的強制折扣。回扣是在最終將產品分配給福利計劃參與者後所欠的金額,並以與公共部門福利提供者的合同協議或法律要求為基礎。這些準備金記錄在同一期間---相關收入得到確認,導致產品收入減少,並形成一個流動負債,該負債包括在綜合資產負債表的應計費用中。我們估計我們的醫療補助和醫療保險折扣,基於一系列可能的結果,是概率加權的估計薪資組合。應計退税是基於法定的折扣率和已知的銷售給專業藥房病人,或預期利用專業經銷商銷售給醫療服務提供商。隨着我們獲得更多的歷史經驗,權責發生制將完全基於我們從Rubra產品推出以來積累的歷史數據中的預期利用率。回扣一般按季度開具發票並按季度支付,因此應計餘額包括對本季度活動預計發生的數額的估計,加上前幾個季度已知或估計的未付回扣的應計餘額。
回扣。回扣是合同客户的折扣,目前主要由團體採購組織、公共衞生服務組織和聯邦政府實體通過聯邦供應計劃購買,直接從我們的專業分銷商以折扣價格購買。專業分銷商,反過來,收回最初由專業經銷商支付的價格與醫療保健供應商支付給專業經銷商的折扣價格之間的差額。這些準備金是在確認相關收入的同一時期設立的,導致產品收入和應收賬款減少。專業分銷商收費的應計金額是根據已知的收費率和對專業分銷商的已知銷售額進行估算的,根據醫療服務提供商的估計利用率進行調整。
折扣。專業分銷商和專業藥房提供各種形式的考慮,包括服務費和在規定期限內支付的及時支付折扣。我們期望這些客户能獲得及時的支付折扣,因此,我們在確認收入後,從產品銷售中扣除這些折扣的全部金額。當產品銷售發生時,服務費作為銷售費用入賬。
共同支付援助。凡有商業保險並符合某些資格要求的病人,可獲得共同支付的援助.這個計劃的目的是減少病人的自掏腰包的費用。共同支付援助的責任是基於實際的項目參與和使用第三方管理人員提供的數據對項目贖回的估計。
退貨。根據行業慣例,我們通常向客户提供有限的退貨權,因為這些產品是根據產品的到期日購買的,在裝運後失效給病人。到目前為止,我們的產品回報很少,目前我們還沒有產品回報的權責發生制。隨着我們獲得更多的歷史經驗,我們將繼續評估我們對產品回報的估計。
目前,我們只在專業經銷商或專業藥房供應商將產品出售給病人或醫療服務提供者時,即當產品通過渠道銷售時,才能確認產品銷售的收入。從2018年月1日起,當我們的客户、專業分銷商和專業藥房供應商控制我們的產品或產品被銷售到渠道時,我們將開始確認我們的收入。這將影響到我們比採用新標準前大約提前兩至四周確認收入,並將增加估計可變因素的重要性。
我們採用了改進的回顧性方法來採用新的標準。這意味着我們不會重述先前發佈的財務報表,而是將一次性調整為230萬美元的留存收益。這一調整是指我們的產品在2018年月1日前銷售給我們的客户,這些產品還沒有出售給病人或醫療服務提供商,但被相關的淨調整總額和其他直接成本(包括版税和銷售獎勵補償)所抵消。
12.承付款和意外開支
我們在博爾德,科羅拉多州,舊金山,加利福尼亞州,奧克蘭,加利福尼亞,劍橋,英國和米蘭,意大利,根據不可撤銷的經營租賃協議,有效期至2028。租約載有定期增加租金,導致按某些租約的條款記錄遞延租金。
在2017,我們簽訂了一個十年的租約,在加利福尼亞州奧克蘭的新辦公空間。根據租約條款,房東將向我們償還多達250萬美元的租賃改良支出(“租户改進津貼”)。在建築工程完成後,我們會把租客改善津貼記作延期租金,並將其攤還,作為租期內租金開支的減值。
截至12月31日、2017、2016和2015,這些租約的租金支出分別為220萬美元、220萬美元和240萬美元。
按財政年度和合計計算,我們的經營租賃的未來最低租金承諾如下(千):
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
|
2018
|
|
$
|
3,050
|
|
|
2019
|
|
|
3,902
|
|
|
2020
|
|
|
3,744
|
|
|
2021
|
|
|
3,855
|
|
|
2022
|
|
|
2,519
|
|
|
此後
|
|
|
11,563
|
|
|
未來最低租賃付款總額
|
|
$
|
28,633
|
|
製造和服務協定承諾
2016年月3日,我們與一家非獨家第三方供應商簽訂了一份製造和服務協議(“協議”),用於生產魯卡帕瑞布的有效成分。根據協議條款,我們將向第三方供應商提供Rucaparib活性成分供應的滾動預測,並將由我們每季度更新一次。我們有義務訂購足以滿足任何預測的初始數量的材料。此外,第三方供應商將在其現有設施中建造專門用於生產魯卡帕瑞布活性成分的生產列車。我們有義務按計劃向資本設備和其他與建造專用生產列車相關的費用支付資金。此外,一旦該設施投入使用,我們有義務在本協議有效期內每季度支付一筆固定的設施費,該費用將於2025年月31到期,除非經雙方同意延長。截至#date0#12月31日,根據該協議,有223.9百萬美元的購買承諾。
法律程序
我們和我們的某些官員在幾起訴訟中被指定為被告,如下所述。我們不能合理地預測這些法律程序的結果,我們也不能估計可能造成的損失數額或損失範圍(如果有的話)。這些訴訟的不利結果可能對我們的業務結果、現金流量或財務狀況產生重大不利影響。
羅西替尼相關訴訟
Following Clovis’ regulatory announcement in November 2015 of adverse developments in its ongoing clinical trials for rociletinib, Clovis and certain of its current and former executives were named in various securities lawsuits, the largest of which was a putative class action lawsuit in the District of Colorado (the “Medina Action”) which was settled on October 26, 2017 (the “Medina Settlement”). The 目前對克洛維斯的未決訴訟將在下文討論。雖然其他實體威脅要提出與羅西替尼有關的索賠和11月2015的聲明,但截至本文件提交之日,沒有任何實體提起訴訟。
On January 22, 2016, the Electrical Workers Local #357 Pension and Health & Welfare Trusts, a purported shareholder of Clovis, filed a purported class action complaint (the “Electrical Workers Complaint”) against Clovis and certain of its officers, directors, investors and underwriters in the Superior Court of the State of California, County of San Mateo (the “Electrical Workers Court”).電氣工人的投訴聲稱是代表一羣在7月份的股票發行中購買股票的人提出的。該申訴聲稱根據1933“證券法”(“證券法”)的某些規定,與2015年7月克洛維斯證券的後續發行有關的索賠(“證券法”)。
根據與麥地那行動中聲稱的基本相似的指控。2016年月30日,電力工人原告提交了一份修改後的申訴,增加了新的指控(“修正投訴”)。
2016年月28日,被告提出動議,要求在麥地那行動通過之前,暫緩電力工人的訴訟,並對修改後的申訴提出異議。2016年月23日,在聽取口頭辯論後,電力工人法院批准了暫緩執行的動議,並保留了對被告待決異議者作出裁決的決定。
該公司認為,“電業工人行動”中所稱的索賠通過Medina解決方案得到了法律的釋放和禁止,因此計劃在此基礎上尋求解僱“電業工人行動”。
2016,11月10日,AntipodeHomePartners(“AntipoDean”)在紐約州紐約州最高法院對Clovis及其某些官員、董事和承銷商提出了申訴(“反對投訴”)。該訴狀稱,被告違反了“證券法”的某些條款,向AntipoDean和在2015年月日發行的供稿中作了虛假陳述,內容涉及羅西利替尼的功效、其安全狀況和市場成功的前景。除了“證券法”的主張外,反波蒂的申訴還主張科羅拉多州的法律主張和普通法主張。州法律和普通法的説法都是基於對羅西替尼取得FDA批准的錯誤和誤導性的陳述。反對訴訟要求賠償、衰退和懲罰性賠償。
2016年月15日,原告提交了一份經修正的申訴(“反對修正申訴”),聲稱對同一被告提出的申訴實質上是相同的,並聲稱糾正了原“反波蒂控訴”中的某些細節。
2017,1月31日,被告提出了一項動議,要求在科羅拉多州麥地那行動通過之前暫緩起訴。被告還於2017年3月29日提出動議,要求駁回“反對修正案”。
2017年月14日,克洛維斯的被告和反波迪安參加了調解,但沒有達成和解。
2017年8月8日,雙方參加了一次預定的聽證會,審理被告提出的暫緩起訴動議,並要求在紐約州紐約州最高法院法官馬斯利面前解職。在聽證會上,馬斯利法官批准了被告的請求。Per the Court’s August 10, 2017 order, Defendants’ motion to dismiss was held in abeyance and deemed submitted on November 1, 2017. On November 1, 2017, the Defendants provided a status update to the Court regarding the outcome of the hearing. The update informed the Court that Antipodean had excluded itself from the Medina Settlement, as memorialized in the final judgment entered by the 麥地那法院。目前還沒有就被告提出的駁回申請進行辯論的日期。
該公司打算對修改後的訴狀中的指控進行有力的辯護。然而,無法保證辯方會成功。
2017年3月,該公司的兩名假定股東---Macalinao和McKenry(“衍生原告”)向特拉華州法院對公司的某些董事和高級人員提出股東派生訴訟。在2017,5月4日,馬卡利諾和麥肯利的行動被合併在一個單一的程序中的所有目的,標題在重新克洛維斯腫瘤學,公司。派生訴訟,案件編號:2017-0222(“綜合衍生訴訟”)。
2017年5月18日,衍生產品原告提交了一份經綜合核實的股東衍生產品投訴(“綜合衍生產品投訴”)。綜合衍生產品申訴一般指稱,被告違反了其對公司的信託義務,據稱造成或允許歪曲公司的業務和前景,未能確保Tiger-X臨牀試驗是按照適用的規則、條例和協議進行的,並從事內幕交易。綜合衍生產品申訴的目的是依賴公司提供的文件,以響應事先要求檢查8 Del以下的Macalinao和McKenry向公司送達的公司賬簿和記錄的要求。C.第220節綜合衍生產品申訴除其他事項外,要求賠償金錢損失。
2017年7月31日,被告提出一項動議,要求駁回綜合衍生產品申訴。原告於2017年8月31日提出反對駁回的動議,被告於2017年月26日提交了一份答覆,進一步支持駁回申請。至於被告提出的駁回綜合衍生工具申訴的動議,則未有日期進行辯論。
該公司打算對綜合衍生產品申訴中的指控進行有力的辯護,但無法保證辯護會成功。
2017年月20日,據稱是該公司股東的該公司向美國科羅拉多州地區法院提交了股東派生訴訟(“郭訴”),指控該公司的某些高級人員和董事。郭樹清的申訴一般指稱,被告違反了他們欠公司的信託責任,要麼是輕率行事,要麼是重大疏忽,批准或允許虛假陳述公司的業務運作和前景。郭樹清的申訴還指控公司資產被浪費和不當得利。最後,郭申訴指稱,某些被告個人違反了“證券交易法”第14(A)條,據稱是由於疏忽發行,導致發佈,並參與了公司在附表DEF 14A中就2015年月日舉行的2015次股東年會向股東發佈的具有重大誤導性的陳述。郭樹清的申訴除其他外,要求賠償賠償金。
2017年月19日,雙方提出一項聯合動議,要求在駁回合併衍生產品申訴的動議得到解決之前,暫緩郭樹清的訴訟。2017年月20日,法院批准了暫緩執行的動議。
該公司打算對郭臺銘申訴中的指控進行有力的辯護,但無法保證辯護會成功。
此外,該公司還收到包括美國證券交易委員會和美國司法部在內的政府機構的詢問和要求,這些機構與該公司在11月發佈的監管更新公告有關,該公告稱美國食品和藥物管理局要求提供更多關於洛西替尼的有效性和安全性的臨牀數據。該公司繼續與這些機構合作進行調查。麥地那和解協議沒有解決這些問題,公司也無法預測它們的時間或結果。
董事補償訴訟
2017年5月10日,據稱是該公司股東的約翰·索拉克(JohnSolak)向特拉華州大法官法院(“Solak控告”)提出了股東派生訴訟(Solak控告),控告公司的某些董事和一名高級職員。Solak的申訴一般指控被告違反了他們欠公司的信託責任,採取了一項補償計劃,對非僱員董事被告進行了超額補償,涉及市值和規模相當的公司。Solak的申訴還指稱,由於這一據稱的錯誤賠償計劃,公司資產被浪費和不當得利。Solak的申訴除其他外,要求賠償金錢損失和實行公司治理改革。
法院下達了若干命令,延長被告對Solak申訴作出答覆的時間,除其他因素外,其依據是雙方正在進行討論,以努力解決Solak的訴訟。2018年月14日,當事雙方向法院提交了一封聯名信,要求在雙方進行最後解決討論時暫緩執行訴訟的所有最後期限。
2018年2月26日,被告與原告達成了妥協和和解的協議,旨在解決索拉克的訴訟。建議的和解須在就擬議和解的條款是否公平而舉行的和解聆訊結束後獲得法院批准,而該項聆訊將在向公司股東發出通知後才會進行。
根據擬議和解的條款,公司將在下一次股東大會上提交一份新的非僱員董事補償政策,供股東表決。根據擬議的新非僱員董事薪酬政策,現任非僱員董事的年度基本薪酬將定為35萬元至42.5萬元,為期兩年至五年。此外,擬議的政策還規定,新的非僱員董事的年度基本薪酬在52.5萬美元至637500美元之間,幷包括董事會和委員會服務的固定年費。提議的解決辦法也
公司將進行多項公司治理改革,包括加強委託書披露、編纂公司董事股票所有權準則以及加強某些形式的董事報酬的披露要求。雖然作為擬議和解的一部分,將不向投資者支付現金,但預計原告的律師將提交一份費用申請,該公司已同意不反對達成一致同意的金額。擬議的解決方案中沒有承認有不當行為。
13.許可證協議
魯卡帕瑞布
在2011,我們與輝瑞公司簽訂了一項許可證協議,以獲得開發和商業化Rubra的獨家全球權利。排他性的權利,即使是輝瑞,也是專有的,包括授予轉授許可證的權利。根據許可證協議的條款,我們預先向輝瑞支付了700萬美元,並被要求向輝瑞支付額外的款項,以實現許可證協議所要求的某些發展、管理和銷售里程碑以及銷售特許權使用費。在fda批准魯布拉之前,我們支付了140萬美元的里程碑付款,這些款項被確認為獲得了過程中研發費用。
在2016,08月30日,我們與輝瑞達成了一項全球許可協議的第一修正案,修正了6月份現有的全球許可協議,允許我們推遲支付在fda批准nda 1的里程碑付款。聖美國和(Ii)歐洲聯盟委員會批准MAA為1聖在歐盟,在達到這些里程碑之日後18個月的日期。如果我們推遲支付這些里程碑付款,我們已同意支付與實現這些里程碑有關的某些較高的付款。
#date0#12月19日,美國食品和藥物管理局批准魯布拉作為單一療法,治療與晚期卵巢癌相關的有害的BRCA突變(生殖細胞和/或體細胞),他們已經接受了兩種或兩種以上的化療,並根據fda批准的魯布拉輔助診斷選擇了治療。美國食品和藥物管理局的批准導致了75萬美元的里程碑付款輝瑞,根據許可協議的要求,該協議是在2017第一季度支付。FDA的批准還導致了支付2000萬美元里程碑付款的義務,為此我們選擇推遲付款,同意在FDA批准之日後18個月內支付2 300萬美元。這些付款被確認為無形資產,並在Rucaparib的估計剩餘使用壽命內攤銷。
根據許可協議,我們有義務使用商業上合理的努力開發和商業化Rubra,我們負責Rubra的所有正在進行的開發和商業化成本。如果達到指定的臨牀研究目標和監管文件、接受和批准,我們需要向輝瑞支付高達6,975萬美元的監管里程碑付款。In addition, we are obligated to make sales milestone payments to Pfizer if specified annual sales targets for Rubraca are met, which relate to annual sales targets of $250.0 million and above, which, in the aggregate, could amount to total milestone payments of $170.0 million, and tiered royalty payments at a mid-teen percentage rate on our net sales, with standard provisions for royalty offsets to the extent we need to 從第三方獲得任何權利,使魯布拉商業化。
除非我們選擇提前終止許可協議,否則與輝瑞的許可協議將一直有效,直到我們對輝瑞的所有特許使用費和再許可收入義務到期為止。If we fail to meet our obligations under the agreement and are unable to cure such failure within specified time periods, Pfizer can terminate the agreement, resulting in a loss of our rights to Rubraca and an obligation to assign or license to Pfizer any intellectual property rights or other rights we may have in Rubraca, including our regulatory filings, regulatory approvals, patents and trademarks for Rubraca.
在2012,我們與AstraZenecaUK有限公司簽訂了一項許可協議,根據一系列專利和專利申請獲得與Rubra相關的專有權利,這些專利和專利申請要求對某些適應症中的PARP抑制劑患者進行治療方法。該許可證使Rubra得以開發和商業化,用於這些專利所聲稱的用途。根據許可協議的條款,我們在協議執行時預付了25萬美元。在2016的第二季度,我們在向阿斯利康支付了30萬美元的里程碑付款後,NDA提交了魯布拉。這些付款被確認為獲得過程中的研發費用.美國食品和藥物管理局於12月19日批准魯布拉,2016最終導致了35萬美元的里程碑付款阿斯利康,根據許可協議的要求。這項付款已在
無形資產和攤銷,按Rubra估計剩餘使用壽命攤銷。阿斯利康還從魯布拉的淨銷售額中獲得版税。
利維坦
與我們在2013收購EOS有關,我們獲得了發展和商業化利西他尼,一種口服的,選擇性酪氨酸激酶抑制劑的權利。如下文所述,EOS授權除中國以外的世界範圍內的Advenchen實驗室有限公司(“Advenchen”)開發和商業化利基他尼。隨後,EOS將在美國和日本以外的市場上開發和商業化利維坦的權利轉授給Servier,以換取預付的里程碑費、在分許可證領土上銷售Lucitanib的特許權使用費以及研發資金承諾。
在2008,EOS與Advenchen簽訂了一項獨家許可協議,在全球範圍內開發和商業化利他坦,不包括中國。根據實現的年淨銷售額,我們有義務按中個位數的百分比支付Advenchen分級版税。此外,在實施許可協議的第一和第二修正案後,我們必須向Advenchen支付根據任何利潤協議(包括與Servier的協議)收取的任何代價的25%,不包括版税。根據該協議,我們有義務利用商業上合理的努力,開發至少一種含有利維坦的產品,並將其商業化,我們還負責所有剩餘的利西坦b的開發和商業化成本。
在2014的第一季度,我們確認獲得了340萬美元的過程中研發費用,這相當於在歐洲專利局結束反對和上訴時從Servier那裏收到的1360萬美元的分包協議的25%。
除非我們選擇提前終止協議,否則與Advenchen的許可協議將一直有效,直到我們對Advenchen的所有版税義務到期為止。如果我們未能履行我們在協議下的義務,並且無法在規定的時間內糾正這種失敗,Advenchen可以終止該協議,從而導致我們失去了獲得利他尼亞的權利。
在9月份,EOS與Servier簽訂了一項合作和許可協議,根據該協議,EOS將在美國、日本和中國以外的所有國家開發和商業化利維坦的專有權利轉授給Servier。作為這些權利的交換,EOS得到了4 500萬€的預付款項。我們有權在實現指定的開發、監管和商業里程碑後獲得額外付款,總計達100.0百萬€,其中1 000萬€是在2014第一季度收到的。此外,我們有權獲得銷售里程碑付款,如果指定的年度銷售目標的利吉他明,這一總額,可達250.0百萬€。我們還有權按從低到十幾歲之間的比例收取特許權使用費。
發展,監管和商業里程碑代表不可退還的金額,將由Servier支付給我們,如果某些里程碑是在未來實現。這些里程碑如果實現,是實質性的,因為它們只涉及過去的執行情況,與由於我們的業績而實現每一個里程碑的價值的估計提高相稱,相對於安排的其他可交付成果和條件而言,這些里程碑是合理的,而且與安排下任何其他要素的交付無關。
我們和Servier正在根據雙方商定的發展計劃開發利維坦。Servier負責高達8,000萬英鎊的€的全球開發成本。超過€的累計全球開發成本,如果有的話,將在我們和Servier之間平均分攤。在2016的第二季度,我們和Servier同意停止發展用於乳腺癌的利西坦。我們正在繼續評估,如果有的話,將進一步發展利維坦。在2017年間,我們在2017完成了承諾的持續發展活動,並從Servier那裏得到了我們開發費用的全額償還。償還款項記作減少“業務和綜合損失綜合報表”的研究和開發費用。
我們記錄了一張$0.0和截至12月31日、2017和2016的130萬美元應收款項,用於支付全球發展計劃下的可償還發展費用,該計劃已列入綜合資產負債表的其他流動資產。在截至12月31日、2017、2016和2015的幾年裏,我們共支出了20萬美元,
研究和開發費用分別為770萬美元和1 370萬美元,研究和開發費用分別減少100萬美元、900萬美元和1 180萬美元,這是Servier應償還的發展費用。
羅西替尼
在2010,我們與Celgene達成了獨家的全球許可協議,以發現、開發和商業化表皮生長因子受體(EGFR)基因產物突變形式的共價抑制劑。根據許可協議,羅西替尼被確定為主要抑制劑候選。我們負責所有非臨牀,臨牀,監管和其他必要的活動,以開發和商業化羅西替尼。
我們在許可證協議執行時提前支付了200萬美元,在2012的第一季度,在FDA接受我們對羅西替尼的新藥物調查申請後,我們支付了400萬美元的里程碑付款,並在2014第一季度開始了對羅西替尼的第二階段研究後,我們支付了500萬美元的里程碑付款。在2015的第三季度,我們支付了總額為1,200萬美元的里程碑付款,分別由美國食品和藥物管理局(FDA)和美國食品藥品管理局(EMA)接受了NDA和MAA。我們確認所有在商業批准前的付款都是在過程中的研發費用.
在2016的第二季度,我們收到了美國食品和藥物管理局的羅西汀NDA的CRL。我們終止了所有贊助的臨牀研究的註冊,儘管我們繼續為臨牀醫生推薦繼續使用羅西汀治療的患者提供藥物。我們正在繼續分析羅西替尼的數據,以確定某些人羣的患者是否為一個致力於進一步臨牀發展的夥伴提供了一個機會。
我們有義務支付版税的百分比,從中個位數到低的十幾根據年淨銷售額實現的數量。如能達到某些臨牀研究目標及規管申請、接受及批准,我們須額外支付9,800萬元的發展及規管里程碑付款。此外,如果實現某些年度銷售目標,涉及每年500.0百萬美元及以上的銷售目標,我們必須支付總額達120.0美元的銷售里程碑付款。
14.普通股淨虧損
每股基本淨虧損的計算方法是將淨虧損除以當期流通普通股的加權平均數量。稀釋後每股淨虧損的計算方法是將淨虧損除以股票期權的國庫股法和票據折算法計算的普通股等值物的加權平均數。由於我們的淨虧損,所有可能稀釋的普通股等價物都被認為是反稀釋的,並被排除在稀釋後每股淨虧損的計算之外。
下表所列各期終了時發行的股票因其抗稀釋效應(單位:千)而不包括在計算每股稀釋淨損失:
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
期權普通股
|
|
4,260
|
|
3,398
|
|
2,031
|
|
|
可轉換高級票據
|
|
4,646
|
|
4,646
|
|
4,646
|
|
|
總潛在稀釋股
|
|
8,906
|
|
8,044
|
|
6,677
|
|
15.所得税
我們要繳納美國聯邦、州和外國所得税。所得税前的收入(損失)的地理成分包括以下(千):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
國內
|
|
$
|
(351,338)
|
|
$
|
(277,776)
|
|
$
|
(290,342)
|
|
|
外國
|
|
|
1,363
|
|
|
(103,395)
|
|
|
(91,595)
|
|
|
所得税前全損
|
|
$
|
(349,975)
|
|
$
|
(381,171)
|
|
$
|
(381,937)
|
|
所得税備抵包括下列當期和遞延税(福利)費用數額(千):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
現行税收:
|
|
|
|
|
|
|
|
|
|
|
|
美國聯邦和州
|
|
$
|
—
|
|
$
|
—
|
|
$
|
—
|
|
|
外國
|
|
|
(360)
|
|
|
64
|
|
|
—
|
|
|
當期(福利)費用總額
|
|
|
(360)
|
|
|
64
|
|
|
—
|
|
|
遞延税:
|
|
|
|
|
|
|
|
|
|
|
|
美國聯邦和州
|
|
|
(3,218)
|
|
|
—
|
|
|
—
|
|
|
外國
|
|
|
—
|
|
|
(32,098)
|
|
|
(29,076)
|
|
|
遞延(養卹金)共計
|
|
|
(3,218)
|
|
|
(32,098)
|
|
|
(29,076)
|
|
|
所得税總額(福利)
|
|
$
|
(3,578)
|
|
$
|
(32,034)
|
|
$
|
(29,076)
|
|
美國聯邦法定所得税税率與我們的實際税率之間的調節如下:
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
2017
|
|
2016
|
|
2015
|
|
|
按法定税率計算的聯邦所得税福利
|
|
(34.0)
|
%
|
(34.0)
|
%
|
(34.0)
|
%
|
|
州所得税優惠,聯邦福利淨額
|
|
(3.2)
|
|
(3.6)
|
|
(3.0)
|
|
|
税收抵免
|
|
(1.2)
|
|
(10.8)
|
|
(13.6)
|
|
|
對未來外國税收抵免的限制
|
|
—
|
|
(5.9)
|
|
(5.0)
|
|
|
不確定税收狀況的變化
|
|
0.2
|
|
4.2
|
|
—
|
|
|
其他
|
|
(1.1)
|
|
2.3
|
|
0.4
|
|
|
2017年度減税與就業法案的税收影響
|
|
46.4
|
|
—
|
|
—
|
|
|
估價津貼的變動
|
|
(8.1)
|
|
39.4
|
|
47.6
|
|
|
有效所得税税率
|
|
(1.0)
|
%
|
(8.4)
|
%
|
(7.6)
|
%
|
我們的遞延税款資產和負債的重要組成部分如下(千):
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2016
|
|
|
遞延税款資產:
|
|
|
|
|
|
|
|
|
淨營運虧損結轉
|
|
$
|
272,710
|
|
$
|
275,898
|
|
|
税收抵免結轉
|
|
|
222,150
|
|
|
217,948
|
|
|
無形資產
|
|
|
29,900
|
|
|
42,745
|
|
|
股份補償費用
|
|
|
27,844
|
|
|
31,390
|
|
|
外幣換算
|
|
|
3,012
|
|
|
10,510
|
|
|
產品採購成本
|
|
|
5,881
|
|
|
9,764
|
|
|
應計負債和其他
|
|
|
3,879
|
|
|
5,384
|
|
|
遞延税款資產共計
|
|
|
565,376
|
|
|
593,639
|
|
|
估價津貼
|
|
|
(564,122)
|
|
|
(592,423)
|
|
|
遞延税款資產,扣除估價備抵額
|
|
|
1,254
|
|
|
1,216
|
|
|
遞延税款負債:
|
|
|
|
|
|
|
|
|
預付費用和其他
|
|
|
(1,254)
|
|
|
(1,216)
|
|
|
遞延税款負債總額
|
|
|
(1,254)
|
|
|
(1,216)
|
|
|
遞延税款淨額
|
|
$
|
—
|
|
$
|
—
|
|
2017年月22日,特朗普總統簽署了減税和就業法案(“法案”),這是一項税收改革法案,其中包括將目前的企業聯邦所得税税率從35%降至21%。減息將於2018年月一日生效。我們相信,該法案將導致我們將我們的遞延税資產和負債重估到較低的聯邦税率。遞延所得税是由於資產和負債的税基與財務報表中報告的數額之間的臨時差額造成的,這將導致今後幾年的應税或可扣減數額。遞延税資產和負債的計量採用預期適用於應納税收入的規定税率,而這些臨時差額預計將在這些年度內收回或解決。隨着税法或税率的變化,遞延税資產和負債通過所得税支出進行調整。
根據證券交易委員會工作人員會計公報(“SAB”)第118號,“減税和就業法案的所得税會計影響”(SAB 118),我們可以選擇三種方案中的一種來確定税法產生的合理估計。這些情況是:(一)最終估計,實際上關閉了計量窗口;(二)合理估計,使計量窗口開放供今後修訂;(三)由於法律仍在分析之中,沒有作出估計。我們能夠為遞延税的重估提供一個合理的估計,在截至12月31日的期間,我們記錄了162.2百萬美元的淨税收準備金,但由於估值津貼的變動而對税收開支沒有淨影響而抵消了這一估計數。該法的其他影響---包括但不限於臨時過渡税、合格財產的支出和利息限制---預計不會對我們的財務報表列報或披露產生重大影響。該法的最終影響可能與所報告的臨時數額不同,原因是對現有指南的解釋和假設發生了變化,以及今後發佈了新的監管指南。我們預計,整個財務影響將在我們的2017美國公司所得税申報表於2018提交時確定。
遞延税資產的實現取決於包括未來收益在內的多個因素,這些因素的時間和數額是不確定的。由於管理層認為在可預見的將來不可能實現這些資產的變現,因此為遞延淨資產餘額確定了估值備抵。在截至12月31日的一年中,我們的估值免税額淨減少了2,830萬美元,這是由於將公司聯邦税率降至21%,從而使我們的遞延淨資產重估,而扣除該年淨營業損失和貸項結轉的增長所抵消的影響。在截至12月31日的年度內,我們的估值免税額增加了143.3,000,000元,主要是由於營運虧損淨額及税款抵免結轉增加。
此外,如果公司更有可能根據技術優勢接受相關税務當局的審計,則該公司承認税收優惠。如果不確定的税收狀況在審計期間維持的可能性小於50%,則將不予確認。如果達到了這一門檻,則在結算時,在高於50%可能性閾值的最大數額上衡量和確認税收優惠。12月31日未獲確認的税收優惠餘額2,450萬美元,如果得到確認,將不會影響公司的實際税率
只要他們仍然享有全額估價津貼。下表彙總了未確認的税收優惠總額(千):
|
|
|
|
|
|
|
|
|
|
|
|
|
截至12月31日的年度,
|
|
|
|
|
|
2017
|
2016
|
|
|
年初餘額
|
|
$
|
24,075
|
|
$
|
—
|
|
|
與以往各期税收狀況有關的增列
|
|
|
—
|
|
|
17,844
|
|
|
與當期税收狀況有關的增列
|
|
|
437
|
|
|
6,231
|
|
|
與税務當局達成和解
|
|
|
—
|
|
|
—
|
|
|
時效屆滿
|
|
|
—
|
|
|
—
|
|
|
年底結餘
|
|
$
|
24,512
|
|
$
|
24,075
|
|
截至2017年月31,我們分別擁有約10億美元,12億美元和40萬美元的美國聯邦,州和國外的淨營業虧損結轉。如果不加以利用,美國聯邦的淨經營損失將從2029到2037到期,而美國的淨營業損失將從2024到期到2037,如果不加以利用,我們將有2.79億美元的研發和孤兒藥品税收抵免,如果不加以利用,這筆款項將從2029美元到2037美元到期。
我們相信,根據美國國內收入法典第382條的定義,股權的改變是由於我們在2012年4月完成的普通股公開發行的結果。今後使用聯邦淨經營損失(“NOL”)和税收抵免結轉從開始到所有權日期的變化將受到年度限制,以抵消未來的應税收入。目前,我們不認為這一限制將阻止使用聯邦NOL或信用結轉到期前。未來可能會發生所有權變化,這將限制自上次估計變化以來產生的NOL數量。從成立到12月31日,我們的聯邦和州所得税仍在接受審計。我們的外國子公司也要接受税務當局的税務審核,這些税務機關的經營期限為2011,2011至12月31,2017。
我們可能會被評估利息和與結清税收頭寸有關的罰款,這些數額將在所得税費用內確認。到目前為止,還沒有承認任何利息和懲罰。
16.僱員福利計劃
我們維持一個退休計劃,這是根據美國國內收入法典第401(K)條為我們的美國僱員。該計劃允許符合條件的僱員自行決定,將税前補償推遲到國税局的年度限額。我們的供款最高可達合資格僱員補償金額的4%,或法例所準許的最高款額。向美國僱員繳款的費用總額約為美元1.9百萬美元、160萬美元和80萬美元百萬截至12月31日,分別為2017、2016和2015。我們的國際僱員參加退休計劃或退休後人壽保險計劃,這些計劃受當地法律管轄,適用於他們居住的國家。我們為國際僱員的退休計劃或退休後人壽保險計劃繳納了約$0.3截至12月31日、2017、2016和2015年度,分別為20萬美元、20萬美元和20萬美元。
17.季度資料(未經審計)
截至12月31日、2017和2016的年度的季度業務結果如下(千):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
三月三十一日,
|
|
六月三十日,
|
|
九月三十日
|
|
十二月三十一日,
|
|
三月三十一日,
|
|
六月三十日,
|
|
九月三十日
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
2017
|
|
2017
|
|
2017
|
|
2016
|
|
2016 (1)
|
|
2016
|
|
2016
|
|
|
收入:
|
|
|
`
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
產品收入淨額
|
|
$
|
7,045
|
|
$
|
14,620
|
|
$
|
16,806
|
|
$
|
17,040
|
|
$
|
—
|
|
$
|
—
|
|
$
|
—
|
|
$
|
78
|
|
|
業務費用:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
銷售成本-產品
|
|
|
1,163
|
|
|
2,730
|
|
|
3,026
|
|
|
3,332
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
70
|
|
|
銷售成本-無形資產攤銷
|
|
|
372
|
|
|
372
|
|
|
372
|
|
|
370
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
研發
|
|
|
32,447
|
|
|
33,108
|
|
|
38,924
|
|
|
38,019
|
|
|
74,608
|
|
|
67,729
|
|
|
54,338
|
|
|
54,454
|
|
|
銷售、一般和行政
|
|
|
29,224
|
|
|
36,149
|
|
|
35,011
|
|
|
38,523
|
|
|
9,827
|
|
|
9,552
|
|
|
9,162
|
|
|
12,190
|
|
|
獲得過程中的研究和開發
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
300
|
|
|
500
|
|
|
500
|
|
|
無形資產減值
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
104,517
|
|
|
—
|
|
|
—
|
|
|
或有購買考慮的公允價值變動
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
516
|
|
|
(25,452)
|
|
|
—
|
|
|
—
|
|
|
總開支
|
|
|
63,206
|
|
|
72,359
|
|
|
77,333
|
|
|
80,244
|
|
|
84,951
|
|
|
156,646
|
|
|
64,000
|
|
|
67,214
|
|
|
營運損失
|
|
|
(56,161)
|
|
|
(57,739)
|
|
|
(60,527)
|
|
|
(63,204)
|
|
|
(84,951)
|
|
|
(156,646)
|
|
|
(64,000)
|
|
|
(67,136)
|
|
|
其他收入(費用):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
利息費用
|
|
|
(2,581)
|
|
|
(2,598)
|
|
|
(2,618)
|
|
|
(2,631)
|
|
|
(2,104)
|
|
|
(2,106)
|
|
|
(2,108)
|
|
|
(2,173)
|
|
|
外幣收益(虧損)
|
|
|
(159)
|
|
|
76
|
|
|
(44)
|
|
|
45
|
|
|
(551)
|
|
|
183
|
|
|
(66)
|
|
|
(146)
|
|
|
法定賠償損失
|
|
|
—
|
|
|
(117,000)
|
|
|
—
|
|
|
11,523
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
—
|
|
|
其他收入(費用)
|
|
|
354
|
|
|
594
|
|
|
1,291
|
|
|
1,404
|
|
|
25
|
|
|
196
|
|
|
252
|
|
|
160
|
|
|
其他收入(費用),淨額
|
|
|
(2,386)
|
|
|
(118,928)
|
|
|
(1,371)
|
|
|
10,341
|
|
|
(2,630)
|
|
|
(1,727)
|
|
|
(1,922)
|
|
|
(2,159)
|
|
|
所得税前損失
|
|
|
(58,547)
|
|
|
(176,667)
|
|
|
(61,898)
|
|
|
(52,863)
|
|
|
(87,581)
|
|
|
(158,373)
|
|
|
(65,922)
|
|
|
(69,295)
|
|
|
所得税(費用)福利
|
|
|
83
|
|
|
1,281
|
|
|
1,234
|
|
|
980
|
|
|
4,181
|
|
|
29,059
|
|
|
227
|
|
|
(1,433)
|
|
|
淨損失
|
|
$
|
(58,464)
|
|
$
|
(175,386)
|
|
$
|
(60,664)
|
|
$
|
(51,883)
|
|
$
|
(83,400)
|
|
$
|
(129,314)
|
|
$
|
(65,695)
|
|
$
|
(70,728)
|
|
|
基本和稀釋後普通股淨虧損
|
|
$
|
(1.33)
|
|
$
|
(3.88)
|
|
$
|
(1.24)
|
|
$
|
(1.04)
|
|
$
|
(2.17)
|
|
$
|
(3.37)
|
|
$
|
(1.70)
|
|
$
|
(1.83)
|
|
|
基礎和稀釋加權平均普通股已發行
|
|
|
44,039
|
|
|
45,176
|
|
|
48,917
|
|
|
49,973
|
|
|
38,360
|
|
|
38,389
|
|
|
38,538
|
|
|
38,624
|
|
|
(1)
| |
在2016的第二季度,我們記錄了104.5百萬美元的知識產權無形資產的減值費用,這與我們的利己產品候選產品有關。 |

