
O c u p h i または e i n v e s e s e s e o r p または e s e n t a t i o n M a c h 2
4 展示品 99.1

このプレゼンテーションには、以下の意味における将来の見通しに関する記述が含まれています
1995年の民間証券訴訟改革法。このような記述には、後期段階の登録エンドポイントと研究パラメータについて合意するためのFDAとのフェーズ2の終了、開始に関する声明が含まれますが、これらに限定されません
RYZUMVIについて、PSとLDPの継続的な開発、Viatrisとのパートナーシップ、当社のキャッシュポジションの強さ、そして非増殖性糖尿病網膜症患者の経口治療薬としてのAPX3330の可能性。これら
将来の見通しに関する記述は、当社、当社の事業展望、および経営成績に関するものであり、当社の実際の事業、見通し、および業績を引き起こす可能性のある多くの要因や出来事によってもたらされる特定のリスクと不確実性の影響を受けます
そのような将来の見通しに関する記述で予想されるものと大きく異なる業務。このような違いを引き起こしたり寄与したりする可能性のある要因には、「リスク要因」という見出しに記載されているものが含まれますが、これらに限定されません
フォーム10-Kの年次報告書に記載されています。読者は、これらの将来の見通しに関する記述に過度に依存しないように注意してください。これらの記述は、このプレゼンテーションの日付の時点でのみ述べられています。場合によっては、将来の見通しに関する記述は次の方法で識別できます
次の言葉:「期待する」、「信じる」、「続ける」、「できる」、「見積もる」、「期待」、「意図」、「かもしれない」、「継続中」、「計画」、「可能性」、「予測」、「プロジェクト」、「すべき」、「意志」、「だろう」、またはこれらの用語または他の同等の用語の否定語
用語。ただし、すべての将来の見通しに関する記述にこれらの言葉が含まれているわけではありません。当社は、その後に発生する可能性のある出来事や状況を反映するために、将来の見通しに関する記述を改訂する義務を負いません。これらの将来を見据えた
記述はOcuphireの現在の期待に基づいており、決して実現しないか、正しくないことが判明する可能性のある仮定が含まれています。実際の結果やイベントのタイミングは、そのような場合に予想されるものと大きく異なる可能性があります
さまざまなリスクと不確実性の結果としての将来の見通しに関する記述。これには、規制当局への提出の成功と時期、登録とデータ読み出しを含む前臨床試験と臨床試験が含まれますが、これらに限定されません。
規制要件または開発、臨床試験のデザインと規制経路の変更または予期しない出来事、臨床試験への患者登録の遅延または困難、激しい競争
と急速な技術変化、当社の販売およびマーケティングインフラの開発、将来の収益損失と収益性、比較的短い営業履歴、資本資源要件の変化、不能に関連するリスク
Ocuphire社が製品候補や前臨床プログラムを推進し続けるのに十分な追加資金を調達したい、国内外の立法、規制、政治、経済の発展、従業員の不正行為、変更
市場機会と受け入れ、第三者への依存、将来起こり得る製造物責任と証券訴訟、システム障害、予期せぬ出来事、またはサイバーインシデント、潜在的な対象となるかなりの数の株式
LPCとのエクイティ・ライン・オブ・クレジット契約に関連する発行。Viatrisとのパートナーシップ、またはその他のライセンス契約により、Ocuphire製品の商品化や市場での受け入れが容易にならない場合がある
候補者、当社の普通株式の市場価格の将来の変動、Ocuphireの製品候補の商品化の成功と時期、Ocuphireの知的財産権の取得と維持。その
実際の出来事が予想と異なる原因となる可能性のある重要な要因についての前述のレビューは、網羅的なものとして解釈されるべきではありません。読者は、このプレゼンテーションで私たちが行ったさまざまな開示を注意深く見直し、検討するようにしてください
また、SECに提出した報告書には、当社の事業に影響する可能性のあるリスクや要因について利害関係者に助言しています。このプレゼンテーションに含まれるすべての将来の見通しに関する記述は、それらが作成された日付の時点でのみ述べられています。
Ocuphireは、その記述が行われた日以降に発生した出来事や状況を反映するようにそのような記述を更新する義務を負いません。2 開示事項と将来の見通しに関する記述

糖尿病性網膜症の治療3 NPDR市場を変革する立場にあります
2023年のDR市場規模の合計89億ドル、2023年のNPDR収益シェア70.38%に基づいて計算されています。AMD、加齢性黄斑変性症、DR、糖尿病性網膜症、DRSS、糖尿病性網膜症重症度尺度、FDA、食品医薬品局
管理、GA、地理的萎縮、NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症、SPA、特別プロトコル評価。Vabysmo® はジェネンテック社の商標です。Syfovre® は登録商標です
アペリスファーマシューティカルズ社の商標、Meiboはバウシュ・アンド・ロム社またはその関連会社の商標、Oxervate® はドンペ・ファーマシューティチ社の登録商標、RYZUMVIはオキュファイア・ファーマ社の商標、Xiidra® は登録されています
Bausch + Lomb Incorporatedまたはその関連会社の商標。Eysuvis® とInveltysはアルコン社の登録商標です。1.フラクセルCJ、他糖尿病性網膜症プリファードプラクティスパターン®。眼科。2020; 127:66-145. 2.の有病率
糖尿病性網膜症。疾病管理予防センター。2023年12月21日にアクセスしました。https://www.cdc.gov/visionhealth/vehss/estimates/dr-prevalence.html 3.ファイルDRのデータは、労働年齢の成人の失明の主な原因です。
米国の1,000万人の患者に影響を与えています。2 ほとんどの患者は初期段階の疾患(非増殖性糖尿病性網膜症)を患っていますが、これは一般的に治療されておらず、60億ドルの市場を占めています。3 糖尿病性網膜症の市場は大きく、十分なサービスが行き届いていません
治療法は侵襲的であり、多くの場合、進行したDRに限定され、複数の疾患経路に対処しません。APX3330は、Ref-1を阻害すると同時に血管新生にも作用することにより、DRの進行を遅らせるための有望な経口選択肢となる可能性があります。
酸化ストレスと炎症経口APX3330は、複数の経路を介して初期段階のDRを標的としています。APX3330で治療を受けた被験者は、プラセボと比較してDRの悪化を経験した被験者は少なく、FDAが確認した3ステップ以上のエンドポイントでの有効性が実証されました
双眼鏡スケールでのDRSSの悪化 APX3330の治療を受けた被験者は、プラセボと比較して増殖性糖尿病網膜症(進行性DR)を発症した人は少なかった。DRの進行を遅らせるためのAPX3330の第2相の有効性:FDAとの第2相会議は終了しました
主要評価項目の調整 SPAを提出し、研究設計と統計分析計画の調整を確実に行いました。今後の重要な第2/3相試験の準備が整いました。60年以上にわたる眼科の経験を組み合わせた眼科の上級管理職の経験です
Vabysmo®、Syfovre®、Miebo、Oxervate®、Ryzumvi、Xiidra®、Eysuvis®、Inveltys® を含む多数の眼科用製品の研究、開発、承認Ryzumviは、Viatrisと提携して、2024年上半期に逆転に向けて発売される予定です
薬理学的に誘発された散瞳と、暗い場所や老眼下での視力低下に関する2つの進行中の第3相試験と、2桁のロイヤリティとマイルストーンの支払いが可能実証済みの開発実績
収益を生み出すチームパートナーシップ
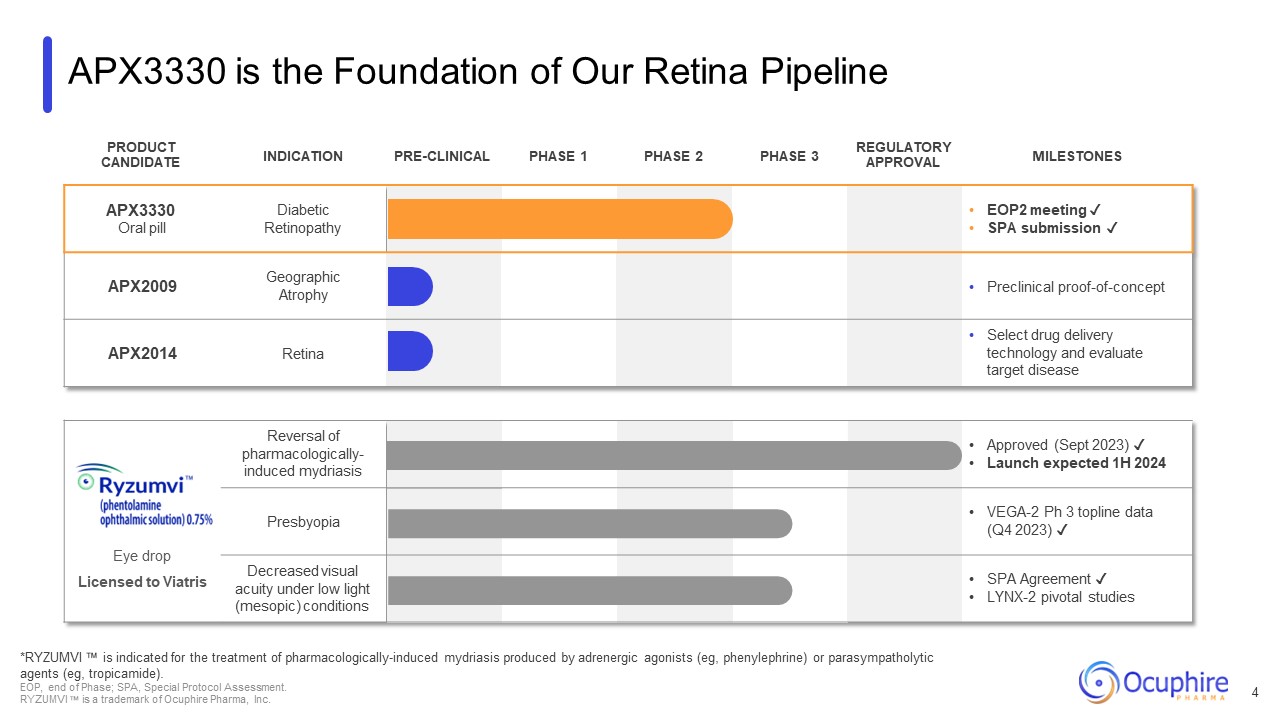
APX3330は当社の網膜パイプライン製品の基礎です
適応候補前臨床フェーズ 1 フェーズ 2 フェーズ 3 規制承認マイルストーン APX3330 経口ピル糖尿病性網膜症 EOP2 ミーティング ✓ SPA提出 ✓ APX2009 地理的萎縮前臨床試験
概念実証APX2014 Retina Selectの薬物送達技術と対象疾患の評価点眼薬 Viatrisへのライセンス薬理学的に誘発された散瞳の逆転承認済み (2023年9月) ✓ 上半期発売予定
2024年老眼VEGA-2 Ph 3のトップラインデータ(2023年第4四半期)✓ 低照度(中視)条件下での視力低下(SPA契約)✓ LYNX-2の重要な研究 *RYZUMVIは薬理学的に誘発された散瞳症の治療に適しています
アドレナリン作動薬(例、フェニレフリン)または副交感神経遮断薬(例、トロピカミド)によって産生されます。EOP、フェーズ終了、SPA、特別プロトコル評価。RYZUMVIはオクファイアファーマ社の商標です。4
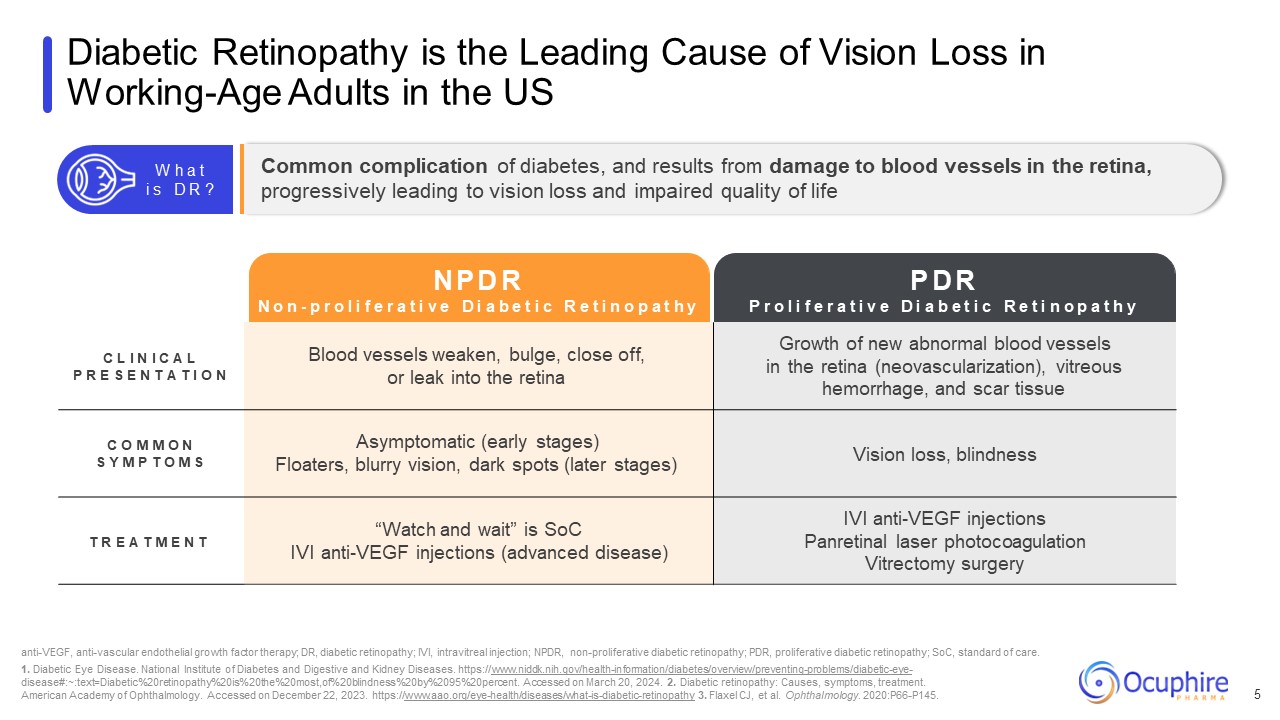
糖尿病性網膜症は、労働年齢の成人の視力喪失の主な原因です
米国では 5 C L I N I C A L P R E S E N T A T I O N 血管が弱くなったり、膨らんだり、閉じたり、網膜に漏れたりする網膜の新しい異常な血管の成長(血管新生)、硝子体出血、瘢痕組織 C O M M O
N S Y M P T O M S 無症候性(初期段階)、かすみ目、ぼやけた視力、ダークスポット(後期)視力喪失、失明 T R E A T M E N T「見て待ってください」は、SoC IVI抗VEGF注射(進行疾患)IVI抗VEGF注射です
汎網膜レーザー光凝固硝子体切除手術、抗VEGF、抗血管内皮成長因子療法、DR、糖尿病網膜症、IVI、硝子体内注射、NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病
網膜症; SoC、標準治療。1.糖尿病性眼疾患。国立糖尿病・消化器・腎臓病研究所。https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-problems/diabetic-eye-
病気#: ~: text=糖尿病%20網膜症%20は 20% が一番多く、失明率が 20%、失明率が 20%、20%、2095% 20パーセントです。2024年3月20日にアクセスされました。2.糖尿病性網膜症:原因、症状、治療。米国眼科学会。2023年12月22日にアクセスされました。
https://www.aao.org/eye-health/diseases/what-is-diabetic-retinopathy 3。フラクセルCJ、他。眼科。2020年:P66-P145。糖尿病の一般的な合併症、網膜の血管が損傷し、次第に視力に至ることが原因です
生活の質の低下や生活の質の低下n p d r n o n-p r o l i if e r a t i v e d i a b e t i c e t i c r e t i o p a t h y P r i f e p d d i a b e t i c r e t i a b e t i c r e t i t i o a t h y

DRの進歩は機能的ビジョンに大きな影響を与える可能性があります。注意:
視力喪失の重症度は、DR、糖尿病性網膜症、NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症の患者によって異なります。1.[著者はリストされていません]。ETDRSレポート番号12です。眼科。
1991; 98:823-833. 2.糖尿病性眼疾患。国立糖尿病・消化器・腎臓病研究所。https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-
問題/糖尿病・眼疾患#: ~: text=糖尿病%20網膜症%20は、20パーセントが最多で、失明%20%が20%20%20パーセントです。2024年3月5日にアクセスしました。N P D R P D R M i n i i m i n i m a l v i s u a l d i s r u u a l d i s i o n s i g n i f i c a n t v i s i o
重度のNPDR患者の約50%が1年でPDRに進行します1 糖尿病性網膜症を早期に治療することで、失明のリスクを95%減らすことができます 2 6
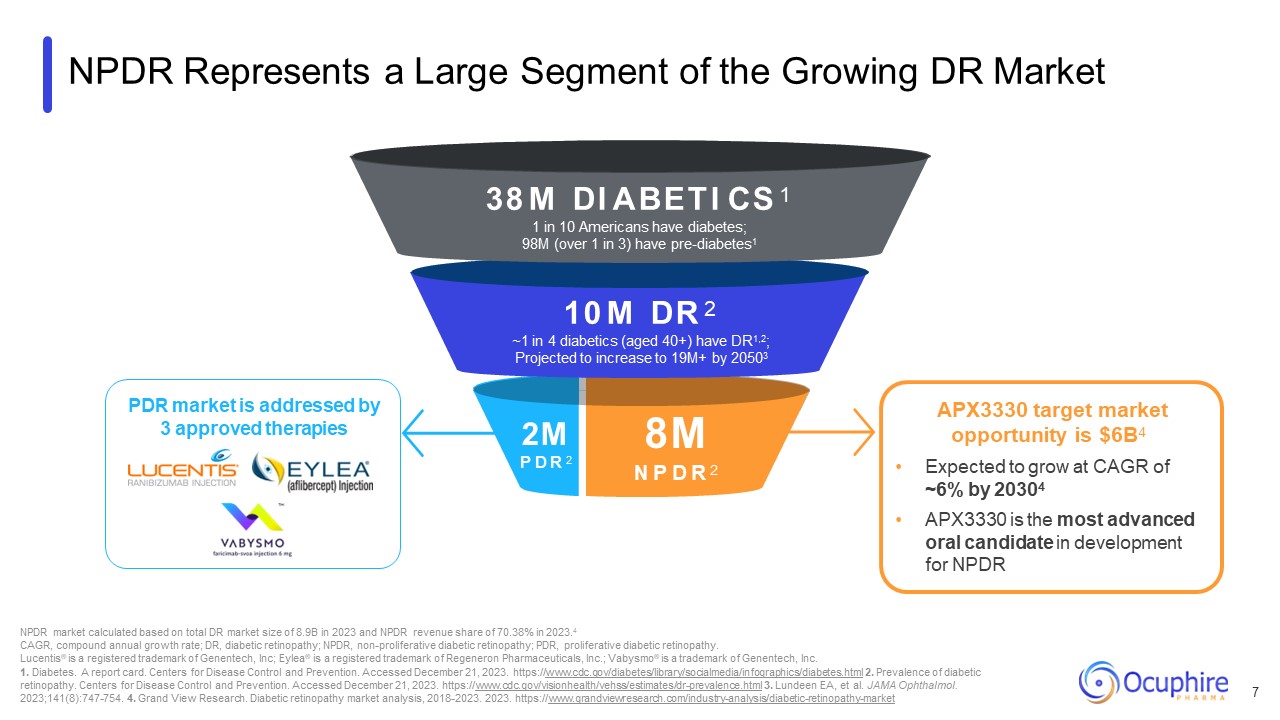
NPDRは成長を続けるDR市場の大部分を占めています。200万P D R 2 38M DI
ABETI CS アメリカ人の10人に1人が糖尿病を患っています。9800万人(3人に1人以上)が前糖尿病です。1 1000万人のDR 糖尿病患者(40歳以上)の4人に1人~4人に1人がDR1,2を患っています。20503年までに1900万人以上に増加すると予測されています。DR市場全体に基づいて計算すると、800万のNP D R、2 NPDR市場は
2023年には89億ドル、2023.4年のNPDRの収益シェアは70.38%でした。4 CAGR、複合年間成長率、DR、糖尿病性網膜症、NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症。Lucentis® は登録されています
ジェネンテック社の商標、Eylea® はリジェネロン・ファーマシューティカルズ社の登録商標、Vabysmo® はジェネンテック社の登録商標です。糖尿病。レポートカード。疾病管理予防センター。2023年12月21日にアクセスしました。
https://www.cdc.gov/diabetes/library/socialmedia/infographics/diabetes.html 2。糖尿病性網膜症の有病率。疾病管理予防センター。2023年12月21日にアクセスしました。
https://www.cdc.gov/visionhealth/vehss/estimates/dr-prevalence.html 3。ランディーン EA、他。ジャーマ・オプタルモール。2023; 141 (8): 747-754。4.グランドビューリサーチ。糖尿病性網膜症の市場分析、2018-2023年。2023年。
https://www.grandviewresearch.com/industry-analysis/diabetic-retinopathy-market APX3330のターゲット市場機会は64億ドルです。20304年までにCAGRが約6%で成長すると予想されています APX3330は、開発における最も進んだ経口候補です
NPDR 7 PDR市場は、3つの承認された治療法によって対応されています
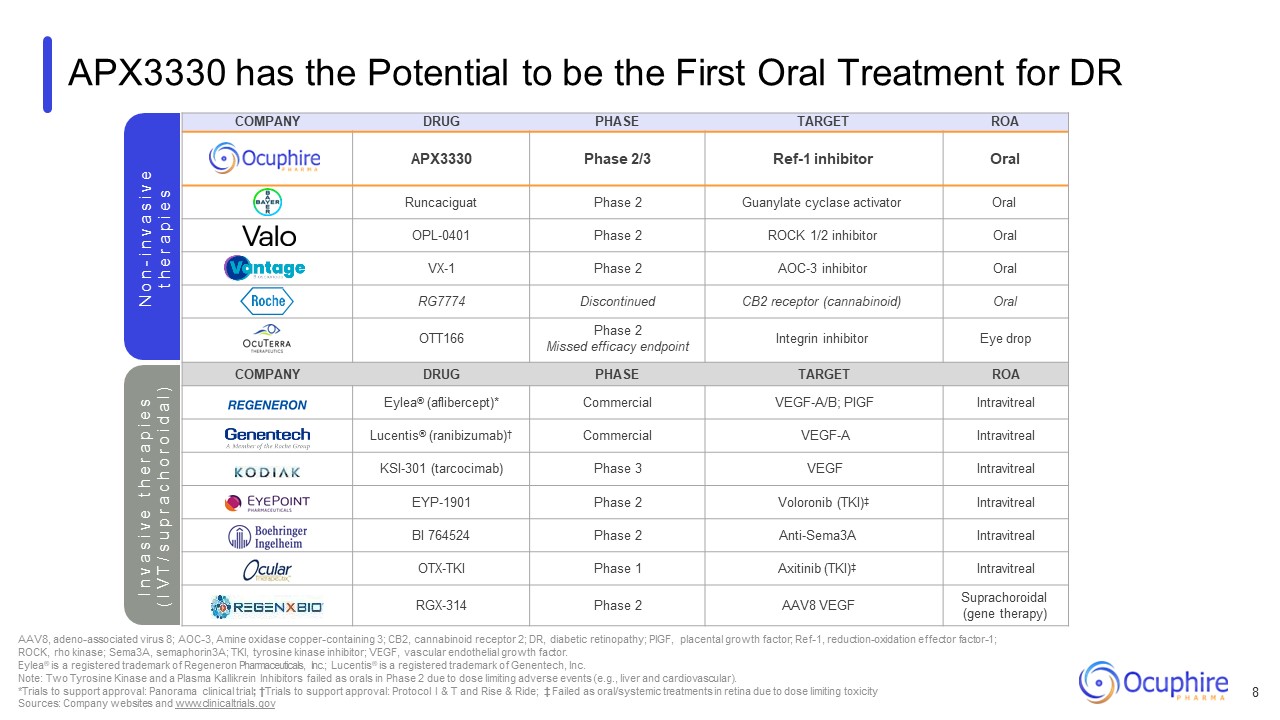
会社の医薬品フェーズ目標ROA APX3330 フェーズ 2/3 Ref-1
阻害剤経口ランカシグアートフェーズ 2 グアニル酸シクラーゼ活性化剤経口 OPL-0401 フェーズ 2 ロック 1/2 阻害剤経口 VX-1 フェーズ 2 AOC-3 阻害剤経口 RG7774 廃止 CB2 受容体 (カンナビノイド) 経口 OTT166 フェーズ 2 逃しました
有効性エンドポイントインテグリン阻害剤点眼薬会社薬剤相ターゲット ROA Eylea®(aflibercept)* 市販のVEGF-A/B; PIGF Intravitreal Lucentis®(ラニビズマブ)† 市販のVEGF-A 硝子体内投与KSI-301(タルコシマブ)フェーズ
3 VEGF 硝子体内 EYP-1901 フェーズ 2 ボロロニブ (TKI) ‡ 硝子体内 BI 764524 フェーズ 2 抗Sema3A 硝子体内 OTX-TKI フェーズ 1 アキシチニブ (TKI) ‡ 硝子体内 RGX-314 フェーズ 2 AAV8 VEGF 脈絡膜上膜 (遺伝子治療) APX3330は
DR N o nの最初の経口治療薬になる可能性-i n v a s i v e t h e r a p i e s AAV8、アデノ随伴ウイルス 8、AOC-3、アミンオキシダーゼ銅含有3、CB2、カンナビノイド受容体2、DR、糖尿病性網膜症、PIGF、胎盤
成長因子、Ref-1、還元酸化エフェクター因子-1、ROCK、ローキナーゼ、Sema3A、セマフォリン3A、TKI、チロシンキナーゼ阻害剤、VEGF、血管内皮成長因子。Eylea® はリジェネロン・ファーマシューティカルズ登録商標です。
Inc.; Lucentis® はGenentech社の登録商標です。注:2つのチロシンキナーゼと1つの血漿カリクレイン阻害剤は、用量制限の有害事象(肝臓や心臓血管など)のため、フェーズ2で経口投与できませんでした。*サポートする試用版
承認:パノラマ臨床試験; †承認を支持する試験:プロトコルI&TおよびRise&Ride; ‡ 用量制限毒性のため、網膜の経口/全身治療として失敗しました。出典:会社のウェブサイトとwww.clinicaltrials.gov I n v a
s i v e t h e r a p i e s (I V T/s u p r a c h o r o i d a l) 8

APX3330 糖尿病患者向けに現在開発中の最も先進的な経口プログラム
網膜症
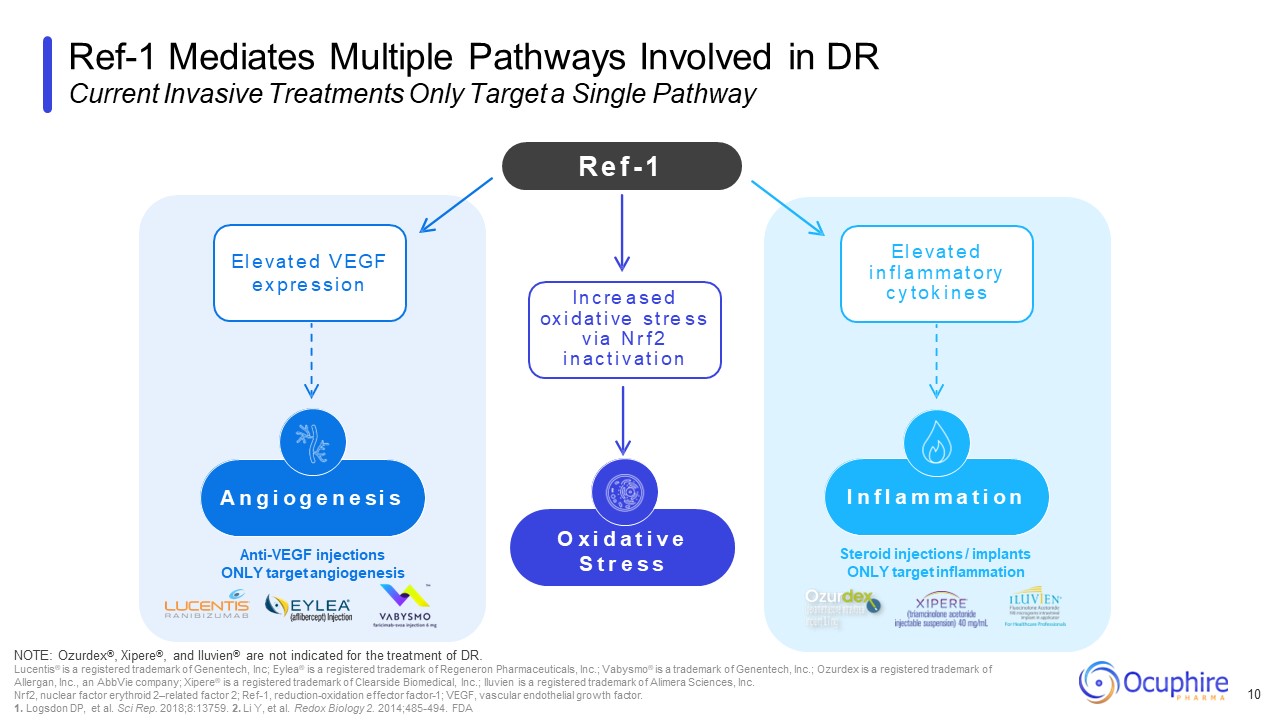
ステロイド注射/インプラントは炎症のみを対象とします抗VEGF注射
標的血管新生のみRef-1はDRに関与する複数の経路を仲介します現在の侵襲的治療は単一の経路のみを対象としています 10 注意:Ozurdex®、Xipere®、Iluvien® はDr. Lucentis® の治療には適応されません® は
ジェネンテック社の登録商標、Eylea® はリジェネロン・ファーマシューティカルズ社の登録商標、Vabysmo® はジェネンテック社の商標、Ozurdexはアッヴィの会社であるAllergan, Inc. の登録商標、Xipere® は
Clearside Biomedical社の登録商標。Iluvienはアリメラ・サイエンス社の登録商標です。Nrf2、核因子赤血球2関連因子2、Ref-1、還元酸化エフェクター因子-1、VEGF、血管内皮作用
成長因子。1.DP、等をログダウンします。サイエンスレップ2018; 8:13759. 2.Li Yら。レドックスバイオロジー 2. 2014; 485-494。FDA R e f-1 O x i d a t i v e S t r e s i n c re a s e s i n c re a s e x i d x i d x i d x i v e s i v a n r f 2 i n a c t i v a t i o n E
l e v a t e d V E G e x e x p re s s i o a n g i o e n e s i s i s i i i o e l e v a m a t i o e d i o l a m a t o ry c y t o k i n e s
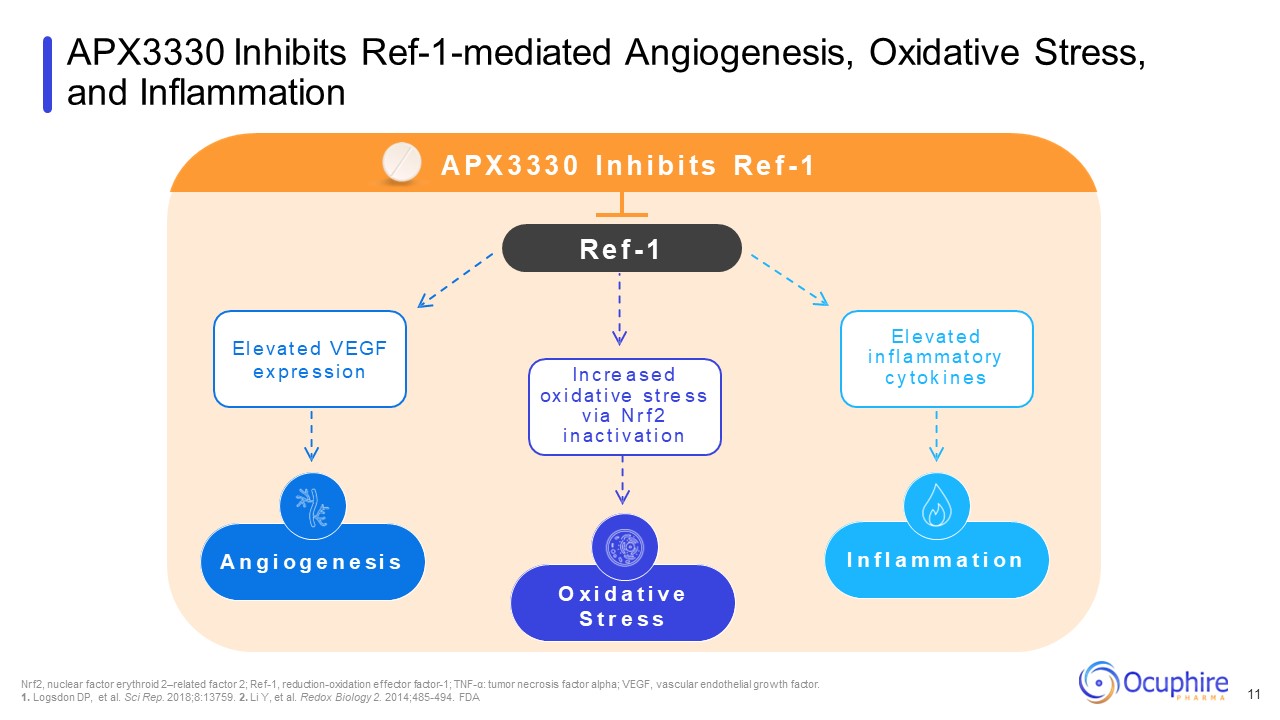
APX3330は、Ref-1を介した血管新生、酸化ストレスを阻害し、
炎症Nrf2、核因子赤血球2関連因子2、Ref-1、還元酸化エフェクター因子-1、TNF-α:腫瘍壊死因子アルファ、VEGF、血管内皮成長因子。1.DP、等をログダウンします。サイエンスレップ2018; 8:13759. 2.Li
y、等々。レドックスバイオロジー 2. 2014; 485-494。FDA O x i d a t i v e e S S t r e s a n g i o g e e n f i o l a m a t i o A P X 3 3 0 I n h i b i t s r e f-1 R e f-1 I n c re f i d x i d x i d a t i v e s t r s v i a n r f 2 私は
n a c t i v a t i o n E l e v a t e d V E G e x p re s i o n E l e v a t e d i n f l a m m a t o ry c y t o k i n e s 11
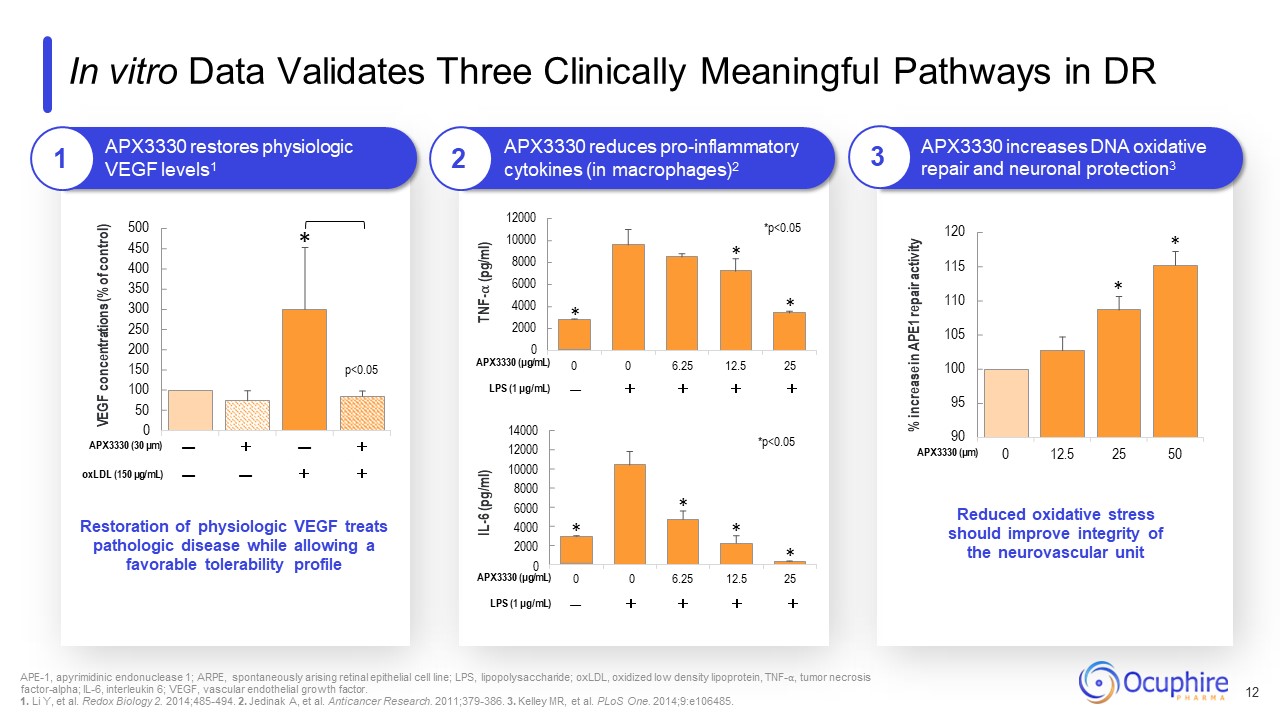
95 100 105 110 115 120 0 12.5 25 50 500 450 400 350 300 250 200 150 100 50 0 VEGF
濃度(コントロールの%)* p

ZETA-1臨床試験Aフェーズ2無作為化、プラセボ対照、ダブルマスク
DRにおけるAPX3330の研究は完了しました
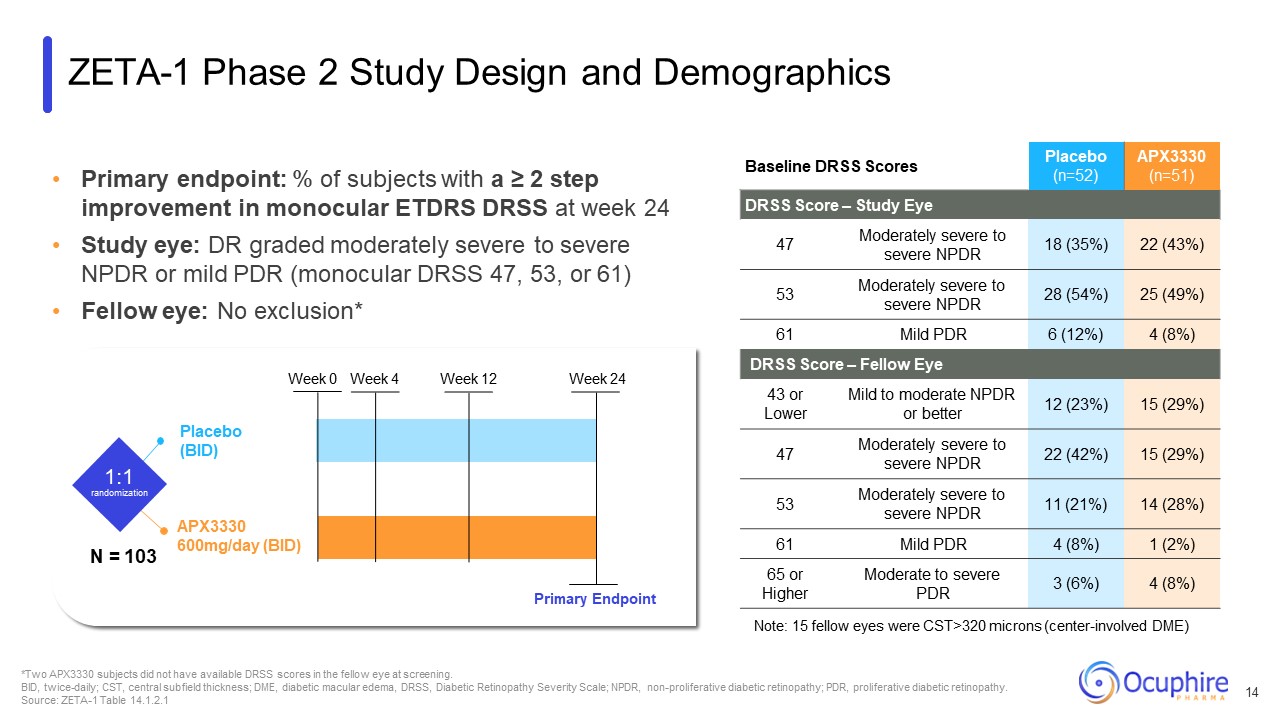
主要評価項目:単眼ETDRが2段階以上改善した被験者の割合
24週目のDRSS スタディアイ:中等度から重度のNPDRまたは軽度のPDR(単眼DRSS 47、53、または61)グレードのDR(単眼DRSS 47、53、または61)フェローアイ:除外なし* ベースラインDRSSスコアプラセボ(n=52)APX3330(n=51)DRSS スコア — スタディアイ47 中程度
重度から重度のNPDR 18(35%)22(43%)53 中等度から重度のNPDR 28(54%)25(49%)61 軽度のPDR 6(12%)4(8%)DRSSスコア — フェローアイ43以下の軽度から中等度のNPDRまたはより良い 12(23%)15(29%)47中程度です
重度から重度のNPDR 22(42%)15(29%)53 中程度から重度のNPDR 11(21%)14(28%)61軽度のPDR 4(8%)1(2%)65以上中等度から重度のPDR 3(6%)4(8%)注:15人の他人の目はCSTが320ミクロンを超えていました
(センターが関与するDME)*2人のAPX3330被験者は、スクリーニング時に他眼のDRSSスコアを取得できませんでした。BID、1日2回、CST、中央サブフィールドの厚さ、DME、糖尿病性黄斑浮腫、DRSS、糖尿病性網膜症重症度尺度、NPDR、
非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症。ソース:ZETA-1表14.1.2.1 APX3330 600mg/日(BID)プラセボ(BID)1:1 ランダム化週 0週4週12週24週プライマリエンドポイントZETA-1フェーズ2
研究デザインと人口統計 N = 103 14
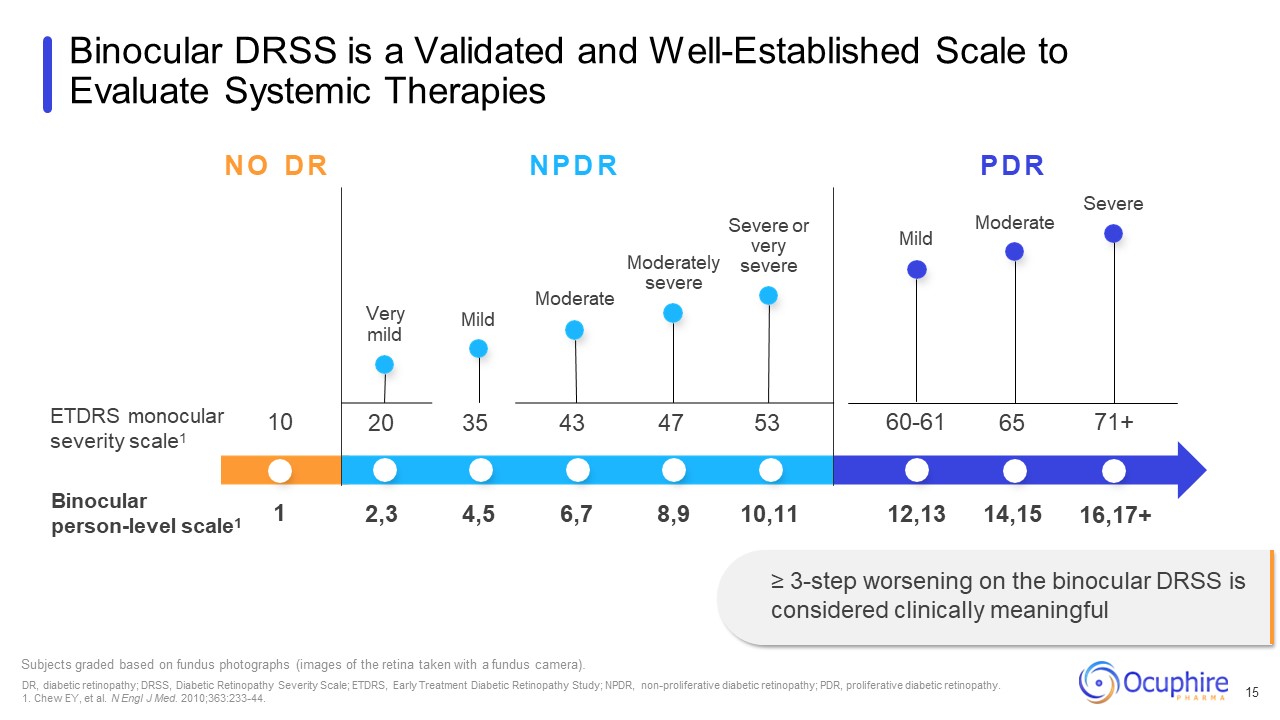
ETDRS単眼重症度計1 双眼個人レベル尺度1 中程度
眼底写真(眼底カメラで撮影した網膜の画像)に基づいて重度重度または非常に重度の軽度の被験者を評価します。DR、糖尿病性網膜症、DRSS、糖尿病性網膜症重症度尺度、ETDRS、早期治療糖尿病
網膜症研究; NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症。1.チューイー、他。N Engl J Med。2010; 363:233-44。双眼鏡DRSSは、全身性を評価するための検証済みで確立された尺度です
治療法 15 中等度のN O D R N P D R P D R 重度の非常に軽度の中程度の軽度 10 20 35 43 47 53 60-61 65 71+ 1 2,3 4,5 6,7 8,9 10,11 12,13 14,15 16,17+ ≥ 双眼鏡のDRSSを3段階悪化させることが臨床的に考慮されています
意味のある
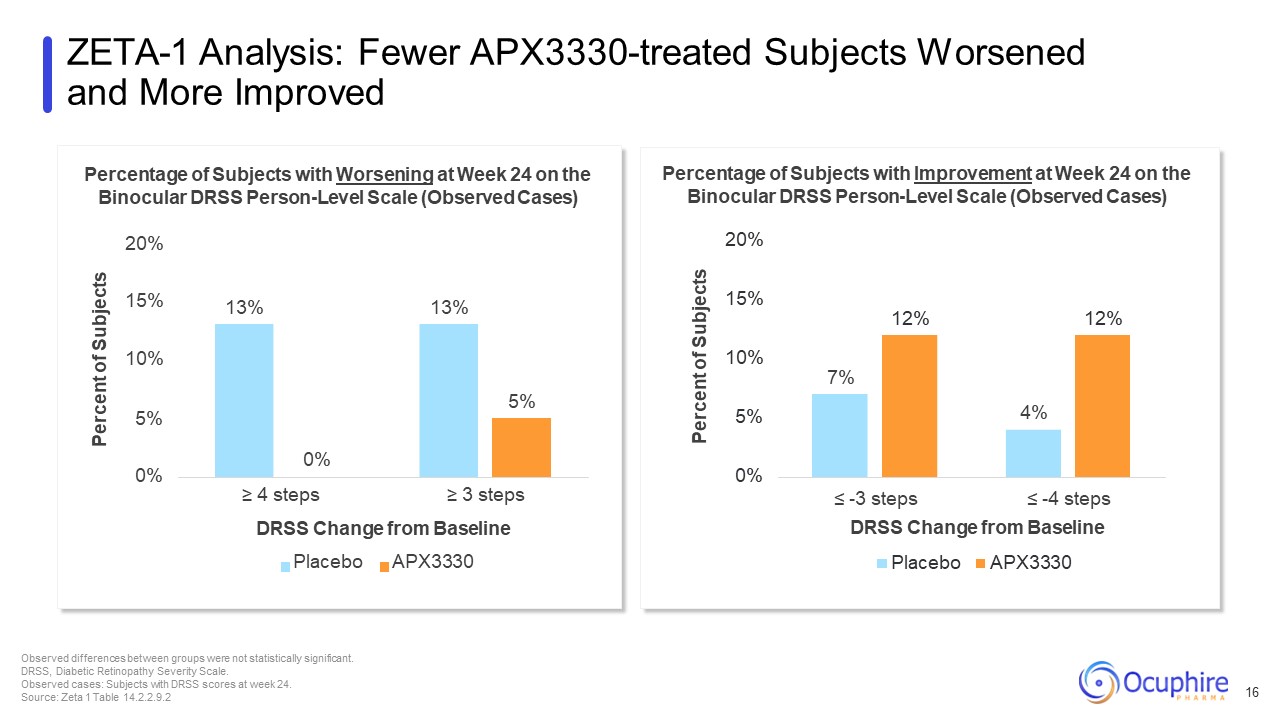
7% 4% 12% 12% 0% 5% 10% 15% サブジェクトの割合 ≤ -3 ステップ ≤ -4
ステップ DRSS ベースラインプラセボからの変更 APX3330 双眼DRSS 個人レベル尺度で24週目に改善が見られた被験者の割合(観察された症例)20% 13% 13% 5% 0% 10% 5% 15% 被験者の割合 0% ≥ 4ステップ ≥ 3ステップ
ベースラインプラセボからのDRSSの変更 APX3330双眼DRSS個人レベル尺度で24週目に悪化した被験者の割合(観察された症例)20%ZETA-1分析:APX3330の治療を受けた被験者の方が悪化し、観察された改善率が高まりました
グループ間の差は統計的に有意ではありませんでした。DRSS、糖尿病性網膜症の重症度尺度。観察された症例:24週目にDRSSスコアを獲得した被験者。ソース:ゼータ1テーブル 14.2.2.9.2 16
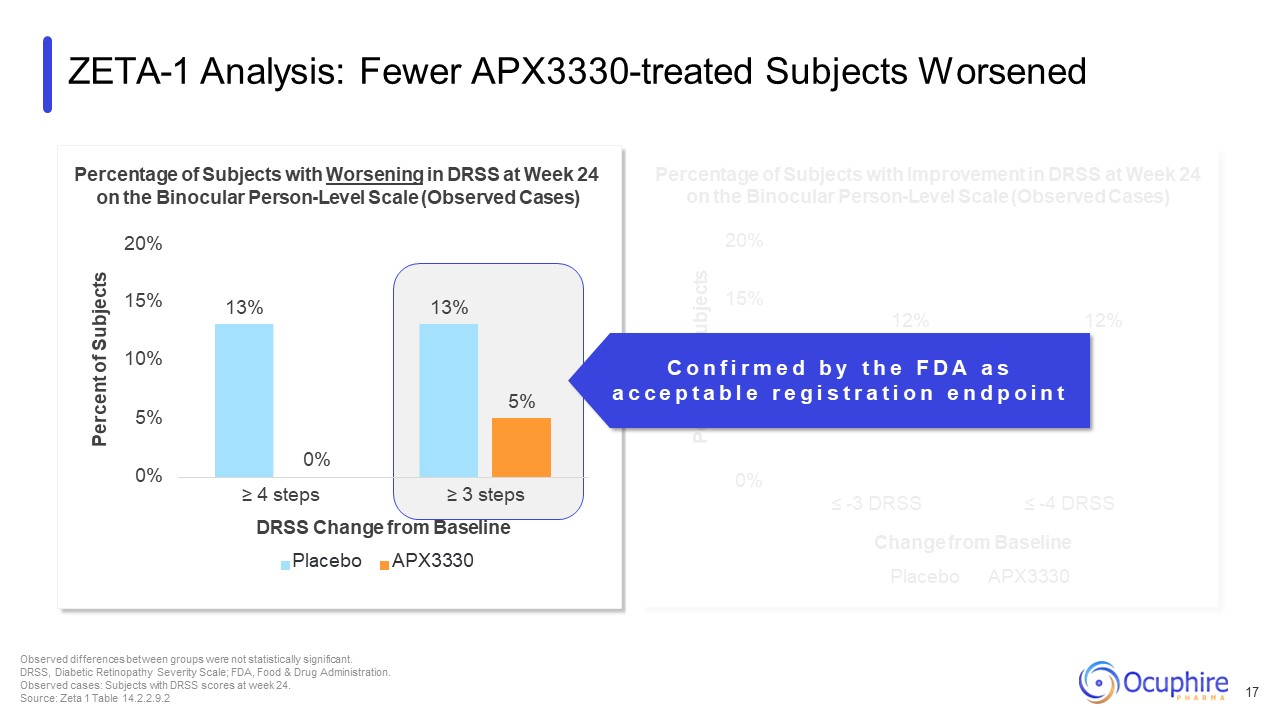
20% 15% 12% 12% 10% 7% 5% 4% 0% ≤ -3 DRSS ≤ -4 ドレスの
24週目にDRSSが改善した被験者の双眼患者レベル(観察症例)の割合は、ベースラインのプラセボAPX3330 ZETA-1分析から変化しました:APX3330の治療を受けた被験者の数が減り、悪化した被験者は17人になりました
グループ間の差は統計的に有意ではありませんでした。DRSS、糖尿病性網膜症重症度尺度、FDA、食品医薬品局。観察された症例:24週目にDRSSスコアを獲得した被験者。ソース:ゼータ1テーブル
14.2.2.9.2 13% 13% 5% 0% 5% 10% 15% 双眼鏡者レベルの尺度で24週目にDRSSが悪化した被験者の割合(観察症例)(観察症例)被験者の20% 0%≥ 4ステップ≥ 3ステップ DRSS ベースラインプラセボからの変更
APX3330 C o n f i r m e d b y t h e F D A a s a c e p t a b l e r e e g i s t r a t i o n e n d p o i n t
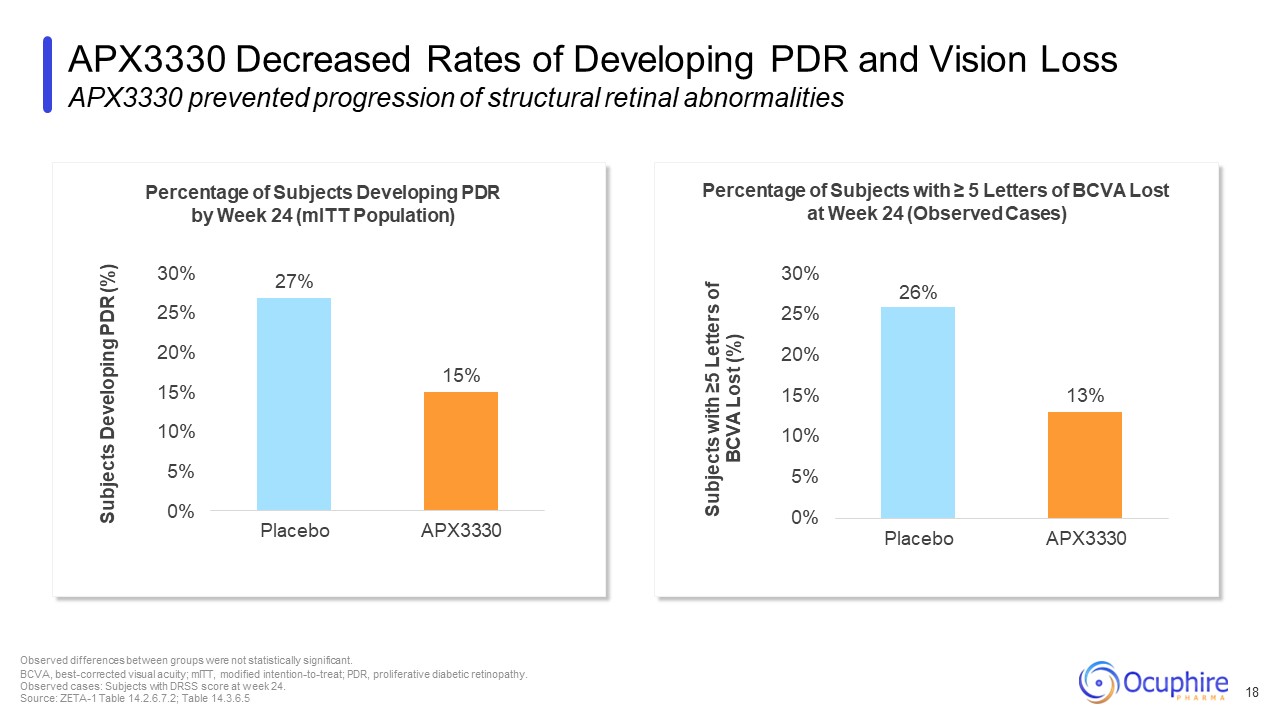
24週ごとにPDRを発症している被験者の割合(MiTT人口)のパーセンテージ
24週目に5文字以上のBCVAが失われた被験者の割合(観察された症例)26% APX3330 PDRの発症率と視力喪失率の低下 APX3330は網膜構造異常の進行を防ぎました。グループ間で観察された違いは
統計的に有意ではありません。BCVA、最も矯正された視力、mITT、治療意図の修正、PDR、増殖性糖尿病網膜症。観察された症例:24週目にDRSSスコアを獲得した被験者。ソース:ゼータ-1テーブル 14.2.6.7.2; テーブル
14.3.6.5 18 27% 15% 20% 15% 10% 5% 0% 30% プラセボ APX3330 PDR を発症している被験者 (%) 13% 10% 5% 0% 25% 20% 15% 30% プラセボ APX3330 5文字以上のBCVAが失われた被験者 (%)

APX3330は、以下と一致する良好な安全性と耐容性を示しました
以前の研究のAE総数プラセボ(n=52)APX3330(n=51)120 91治療関連のAE総数 14 14人治療関連のAEを持つ被験者10人(20%)10人(20%)10人(19%)治療関連のAEによる離脱率が 5% 以上の 1(2%)
被験者全て AES 治療関連 AE プラセボ (n=52) APX3330 (n=51) プラセボ (n=52) APX3330 (N=51) 眼球AES DME (51%) (42%) (20%) (20%) DR 6 (12%) (2%) 硝子体剥離 (36%) 0 0 白内障 (12%) 3
(60%) 非眼球AE そう痒症 (かゆみ) (12%) (12%) (2%) (6%) (2%) (6%) 発疹 (12%) (6%) (2%) (24%) COVID-19 (10%) (20%) 0 SARS CoV-2検査陽性 (36%) 0 0 APX3330 安全性プロファイル眼科AE 類似
APX3330とプラセボの間APX3330で悪化する臨床的DME/DRの発生率の低下 APX3330による掻痒症は軽度で解消しました。APX3330の用量の漸増または中止なしに、DRを受けた被験者は併存疾患を管理するために日常的な投薬を続けました
状態 AE、有害事象、DME、糖尿病性黄斑浮腫、DR、糖尿病性網膜症。ソース:ZETA-1臨床試験。テーブル:14.3.1.1、14.3.1.7、14.3.1.10、16.2.7. 19

ZETA-2臨床試験Aフェーズ2/3無作為化、
NPDRにおけるAPX3330のプラセボ対照二重マスク試験が計画されています

ZETA-2を成功に導く最適化24週間(6か月)48週間後には
(12か月) E l i g i b i l i t y スタディアイ (1つの目) 双眼鏡 (2つの目) S a m p l e s i z e N=103 N=300 P r i m a r y e n d p o i n t ≥ スタディアイの2段階のDRSS改善≥ 3段階のDRSSの改善≥双眼鏡を使う人レベルでの悪化です
スタディアイではスケール B a s e l i n e D R S S s c o r e 47、53、61、片方の目では除外なし 47 または 53; フェローアイでは 43、47、53 K e y e x c l u s i o n DME スタディアイのPDR、またはどちらかの目のDME P h e TA-1 P h a s e
2/3 Z E TA-2 DME、糖尿病性黄斑浮腫、DRSS、糖尿病性網膜症重症度尺度、PDR、増殖性糖尿病網膜症。21
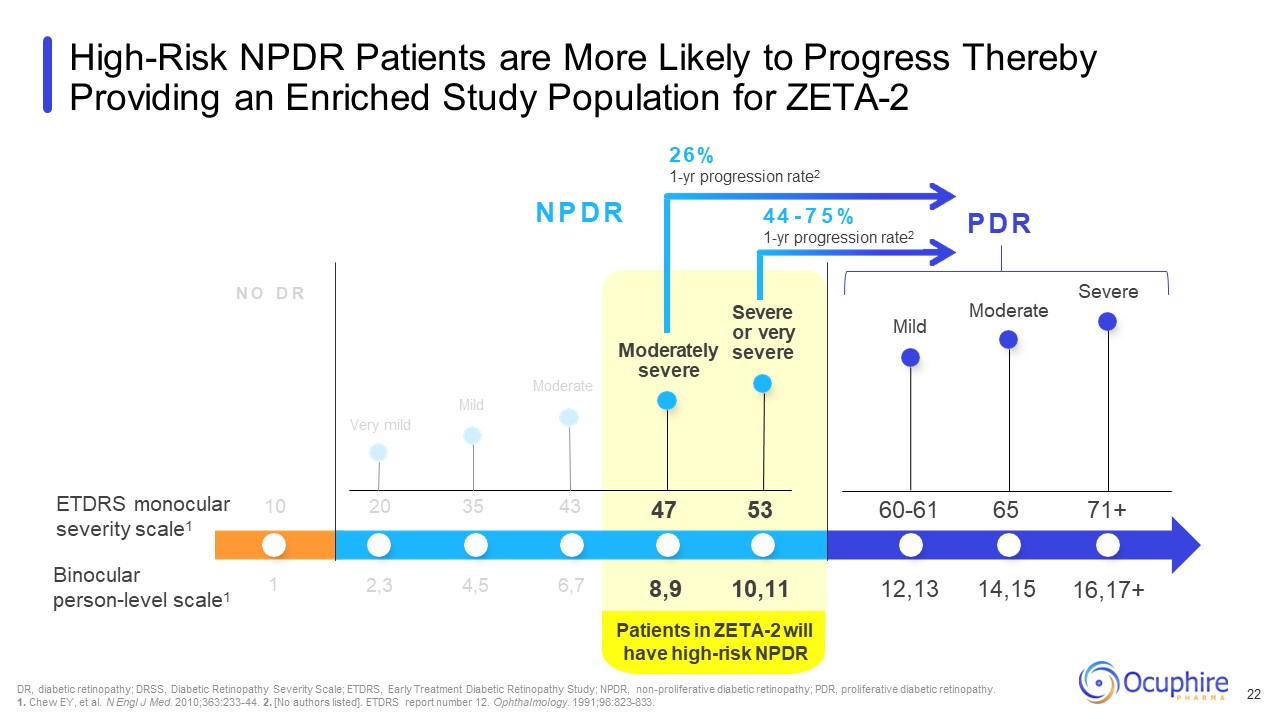
ZETA-2の患者は、NPDR N O D R N P D R P D R ETDRSのリスクが高いでしょう
単眼重症度尺度1 双眼の個人レベルの尺度1 非常に軽度中等度の中等度重度または非常に重度の軽度のDR、糖尿病性網膜症、DRSS、糖尿病性網膜症重症度尺度、ETDRS、早期治療糖尿病
網膜症研究; NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症。1.チューイー、他。N Engl J Med. 2010; 363:233-44. 2.[著者はリストされていません]。ETDRSレポート番号12です。眼科。
1991; 98:823-833。高リスクのNPDR患者は進行する可能性が高く、それによってZETA-2 10 20 35 43中等度重度2,3 4,5 6,7 47 53 60-61 65 71+ 8,9 10,11 12,13 14,15 16,17+ 1 26%の研究対象集団が提供されます
1年間の昇進率2 44-7 5% 1年間の昇進率2 22
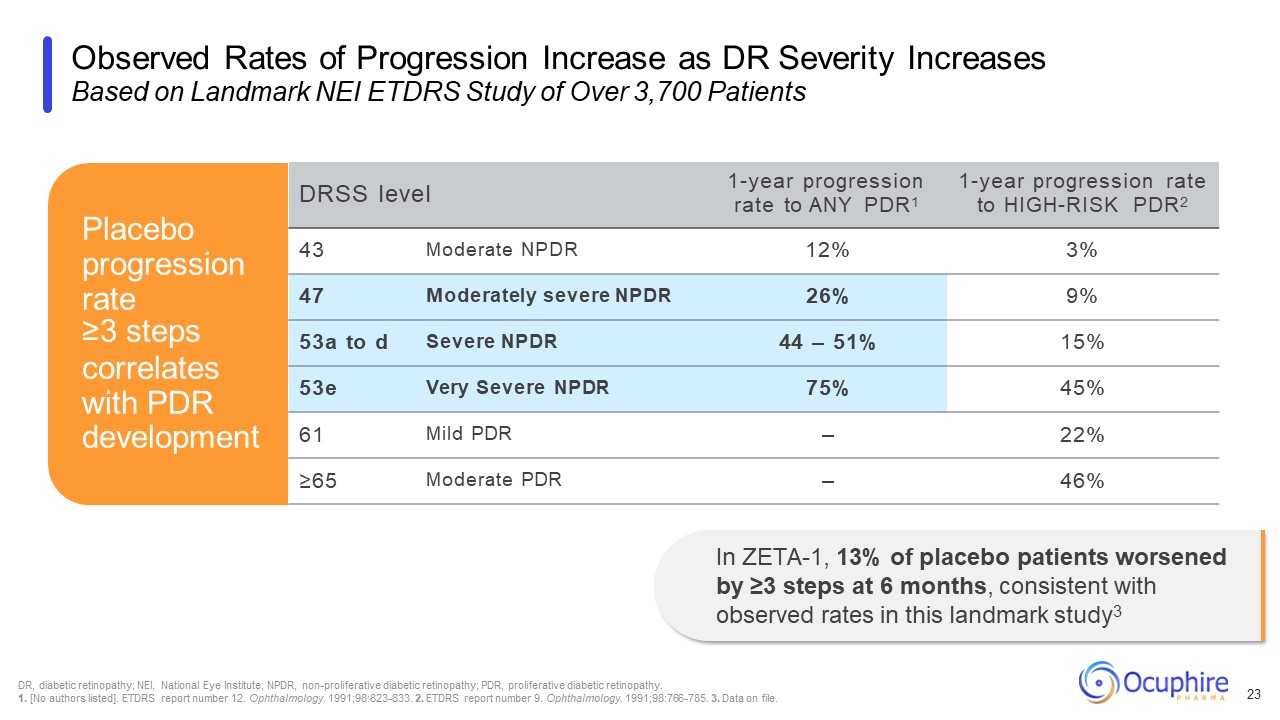
DRの重症度が上がるにつれて、観察された進行率は以下に基づいて増加します
3,700人以上の患者を対象とした画期的なNEI ETDRS研究 23 DRSSレベルの任意のPDR1への1年間の進行率任意のPDR1への1年間の進行率高リスクPDR2 43中等度NPDR 12% 3% 47中等度のNPDR 26% 9%53aからd 重度のNPDR 44 —
51% 15% 53e 非常に重篤なNPDR 75% 45% 61軽度のPDR — 22% ≥65% 中等度のPDR — 46% プラセボの進行率が3ステップ以上はPDRの発症と相関しています ZETA-1では、プラセボ患者の 13% が6か月で3ステップ以上悪化し、一貫しています。
この画期的な研究で観察された発生率と3 DR、糖尿病性網膜症、NEI、国立眼研究所、NPDR、非増殖性糖尿病網膜症、PDR、増殖性糖尿病網膜症。1.[著者はリストされていません]。ETDRSレポート番号12です。
眼科。1991; 98:823-833. 2.ETDRSレポート番号9です。眼科。1991; 98:766-785。3.ファイル上のデータ。
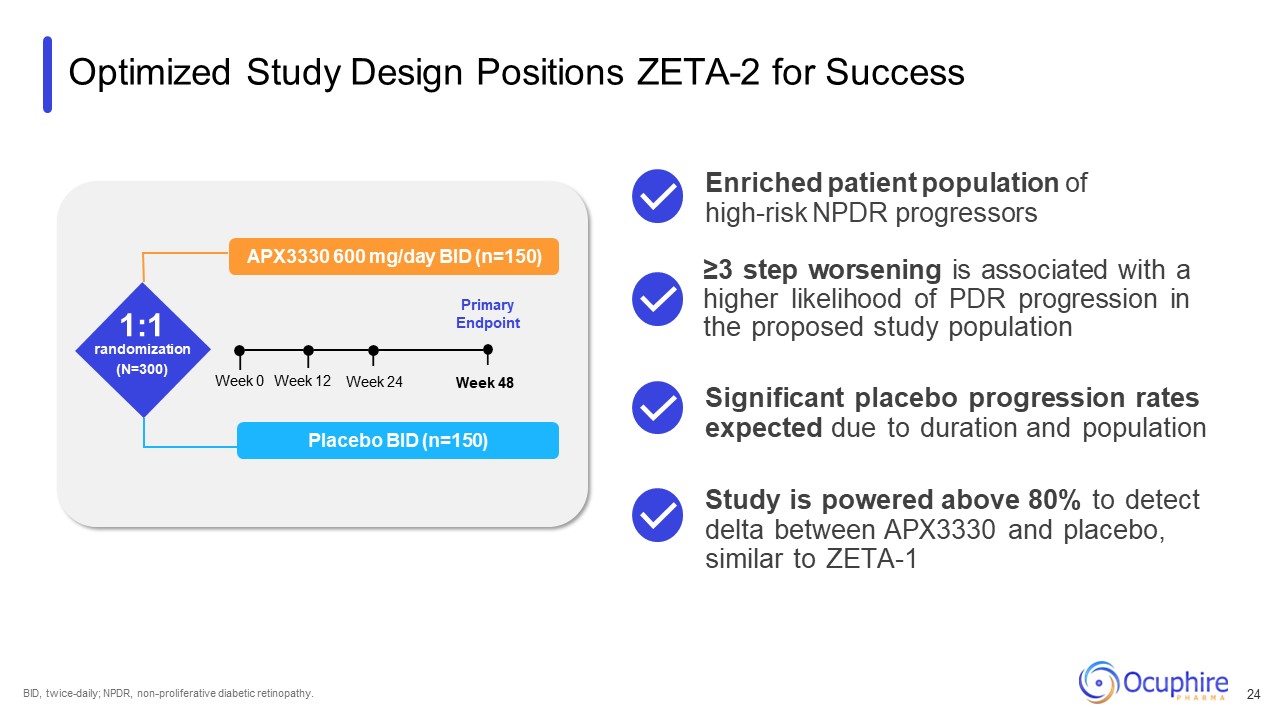
最適化されたスタディデザインポジション ZETA-2 フォーサクセス APX3330 600 mg/日 BID
(n=150) 1:1 ランダム化 (N=300) 主要評価項目プラセボBID (n=150) 0週24週 12週48BID、1日2回、NPDR、非増殖性糖尿病性網膜症。3段階以上の悪化は、PDRの可能性が高くなります
提案された研究対象集団の進行:期間と人口によりプラセボの著しい進行率が予想されます。高リスクNPDR進行者の患者集団の増加 APX3330間のデルタを検出するために、研究では80%を上回る結果が得られました
とプラセボ、ZETA-1 24に似ています

ボストンの眼科コンサルタント医学博士、ジェフ・ハイアー「もしZETA-1の結果が
フェーズ3でも繰り返しますが、私は糖尿病患者のほぼ全員に経口APX3330を投与し、必要な場合にのみ局所治療を行います。」「Ref-1の生物学は、血管新生、炎症、酸化ストレスという糖尿病性眼疾患の3つの柱を対象としています。これ
患者に非侵襲的で早期の選択肢を提供するという点で有望です。」クリーブランド・クリニック、MD Peter Kaiser「チームと協力して、最も罹患しやすい患者を登録するための革新的なプロトコル設計を開発することを楽しんでいます。
進行性疾患でありながら、入学に役立つ研究を実用的にしています。」アルシャド・カナニ、医学博士、シエラ・アイ・アソシエイツの世界的に認められた網膜スペシャリストがAPX3330開発をサポート 25

Viatris Ryzumvi(フェントロミン点眼液)とのパートナーシップ
0.75% RYZUMVIはオクファイアファーマ社の商標です。

リズンヴィ・リズムビのためのViatrisとのグローバル・パートナーシップが承認されました
薬理学的に誘発された散瞳症で、2024年上半期に開始予定のライセンス契約により、さらに2つの適応症に資金が提供され、Viatrisが商品化を担当します。老眼と薄視で2つの第3相試験が進行中です
軽度の障害ライセンス契約に基づいて3500万ドルの前払いを受け取りました。規制上および商業上のマイルストーン支払い予定額1億2000万ドル Ryzumviの承認で最初に1,000万ドルのマイルストーンを達成しました
ロイヤルティグローバル商品化のパートナー全額出資による開発。商用化を担当するViatrisにより、OcuphireはAPX3330とパイプラインに注力できるようになり、キャッシュポジションを強化します。RYZUMVIはOcuphire Pharmaの商標です。
株式会社 27

3つの適応症すべてに、米国の潜在的な患者数はかなり多いです。*RYZUMVIは
アドレナリン作動薬(例、フェニレフリン)または副交感神経遮断薬(トロピカミドなど)によって生じる薬理学的に誘発された散瞳症の治療に適しています。RYZUMVIはオクファイアファーマ社の商標です。1.リズンビさん。処方
情報。オクファイアファーマ株式会社; 2023年。2.ウィルソンFAら。J Ophthalmol。2015; 2015; 2015:435606. 3.バーダール・J、他。クリン・オプタルモール。2020; 14:3439-3450。4.リンドストローム RL。ミレニアル世代は、レーザー視力矯正の次のターゲットになります。眼鏡
手術のニュース。2019年4月1日。2023年12月12日にアクセスしました。https://www.healio.com/news/ophthalmology/20190329/millennials-will-レーザー視力矯正の次のターゲットになりましょう 5.ママリス・N・J白内障屈折矯正手術2014; 40:343-344。100万眼球
毎年実施されています2 Tr e e a t m e n t o f p h a l l y-i n d u c e d m y d r i a s i s * 1 Tr e a t m e n t o f p r e s b y o p i a Tr e a e a t m e n t o f d e c r e a s e d v s u a l a c u i t y u n d e
r l l o w l i g h t c o n d i t i o n s 13300万人の老若男女3、年間600〜700万件のレーザー視力矯正処置4 レーシック患者の 35% が薄暗い光障害を報告しています5

有意義な専門知識を持つ経験豊富なチーム 60年以上の実績があります
臨床、商業、取引の経験数多くの眼科用製品の研究、開発、承認に携わってきました。眼科専門家 29 Ash Jayagopal 博士、MBA 最高科学技術開発責任者 Vabysmo® は
ジェネンテック社の商標、Syfovre® はアペリス製薬社の登録商標、RYZUMVIはオクファイアファーマ社の登録商標、Eysuvis® とInveltysはアルコン社の登録商標、Meiboはの商標です
バウシュ・アンド・ロム・インコーポレイテッドまたはその関連会社、Oxervate® はDompé Farmaceutici S.p.A. の登録商標、Xiidra® はバウシュ・アンド・ロム・インコーポレイテッドまたはその関連会社の登録商標です。ジョージ・マグラスは医学博士、経営学修士、MS最高経営責任者
役員ニラヴ・ジャヴェリ、MBA最高財務責任者ジョセフ・シャッハル、MBA最高執行責任者

DR、糖尿病性網膜症、FDA、食品医薬品局。オクファイアは
糖尿病性網膜症の治療を変革する立場にあり、十分なサービスを受けていない大規模なDR市場に関する幅広い理解経口治療で複数のDR経路をターゲットにすることで満たされていないニーズへの対処DRを遅らせる効果を実証しました
完了した第2相試験の進捗FDAが承認したエンドポイントによる極めて重要な第2/3相試験の準備が整いました数十年にわたる眼科の専門知識を持つ実績のある開発チーム収益を生み出すパートナーシップがキャッシュポジションを強化 30