EXAI-2023123100018654082023会計年度虚像本当だよ1つはP 1 M00018654082023-01-012023-12-310001865408Dei:ビジネス連絡先のメンバー2023-01-012023-12-310001865408Exai:American DepositarySharesメンバー2023-01-012023-12-310001865408IFRS-FULL:一般共有メンバ2023-01-012023-12-3100018654082023-12-31Xbrli:共有ISO 4217:ポンド00018654082022-01-012022-12-3100018654082021-01-012021-12-31ISO 4217:ポンドXbrli:共有00018654082022-12-310001865408IFRS-Full:IssuedCapitalMembers2020-12-310001865408IFRS-Full:SharePremiumMembers2020-12-310001865408Exai:遅延共有メンバ2020-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2020-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2020-12-310001865408IFRS-FULL:他の総合収入を累積メンバー2020-12-310001865408IFRS-Full:MergerReserveメンバー2020-12-310001865408IFRS-Full:RetainedEarningsMembers2020-12-3100018654082020-12-310001865408IFRS-Full:RetainedEarningsMembers2021-01-012021-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2021-01-012021-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2021-01-012021-12-310001865408IFRS-FULL:他の総合収入を累積メンバー2021-01-012021-12-310001865408IFRS-Full:IssuedCapitalMembers2021-01-012021-12-310001865408IFRS-Full:SharePremiumMembers2021-01-012021-12-310001865408IFRS-Full:MergerReserveメンバー2021-01-012021-12-310001865408Exai:遅延共有メンバ2021-01-012021-12-310001865408IFRS-Full:IssuedCapitalMembers2021-12-310001865408IFRS-Full:SharePremiumMembers2021-12-310001865408Exai:遅延共有メンバ2021-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2021-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2021-12-310001865408IFRS-FULL:他の総合収入を累積メンバー2021-12-310001865408IFRS-Full:MergerReserveメンバー2021-12-310001865408IFRS-Full:RetainedEarningsMembers2021-12-3100018654082021-12-310001865408IFRS-FULL:CapitalRedemptionReserveメンバー2021-12-310001865408IFRS-Full:RetainedEarningsMembers2022-01-012022-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2022-01-012022-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2022-01-012022-12-310001865408IFRS-Full:IssuedCapitalMembers2022-01-012022-12-310001865408IFRS-Full:SharePremiumMembers2022-01-012022-12-310001865408Exai:遅延共有メンバ2022-01-012022-12-310001865408IFRS-FULL:CapitalRedemptionReserveメンバー2022-01-012022-12-310001865408IFRS-Full:IssuedCapitalMembers2022-12-310001865408IFRS-Full:SharePremiumMembers2022-12-310001865408Exai:遅延共有メンバ2022-12-310001865408IFRS-FULL:CapitalRedemptionReserveメンバー2022-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2022-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2022-12-310001865408IFRS-FULL:他の総合収入を累積メンバー2022-12-310001865408IFRS-Full:MergerReserveメンバー2022-12-310001865408IFRS-Full:RetainedEarningsMembers2022-12-310001865408IFRS-Full:RetainedEarningsMembers2023-01-012023-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2023-01-012023-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2023-01-012023-12-310001865408IFRS-Full:IssuedCapitalMembers2023-01-012023-12-310001865408IFRS-Full:SharePremiumMembers2023-01-012023-12-310001865408IFRS-Full:IssuedCapitalMembers2023-12-310001865408IFRS-Full:SharePremiumMembers2023-12-310001865408Exai:遅延共有メンバ2023-12-310001865408IFRS-FULL:CapitalRedemptionReserveメンバー2023-12-310001865408IFRS-FULL:Reserve OfExchangeDifferencesOnTranslationMember2023-12-310001865408IFRS-FULL:共有ベースの予約支払いメンバー2023-12-310001865408IFRS-FULL:他の総合収入を累積メンバー2023-12-310001865408IFRS-Full:MergerReserveメンバー2023-12-310001865408IFRS-Full:RetainedEarningsMembers2023-12-31輸出:合弁企業0001865408出口:REVenturesILLCMメンバー2023-01-012023-12-31Xbrli:純0001865408出口:REVenturesIILLCMメンバー2023-01-012023-12-310001865408IFRS-FULL:コンピュータソフトウェアのメンバー2023-01-012023-12-310001865408Exai:AcquiredIntelligence ectualPropertyMember2023-01-012023-12-310001865408出口:PlantAndEquipmentMember2023-01-012023-12-310001865408IFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001865408IFRS-Full:ComputerEquipmentMembers2023-01-012023-12-310001865408出口:MiamiFloridaUnitedStatesメンバー2022-12-310001865408出口:MiamiFloridaUnitedStatesメンバー2023-01-012023-12-310001865408出口:百時美施貴宝社とセルジニアスイスLLCMメンバー2023-01-012023-12-310001865408出口:百時美施貴宝社とセルジニアスイスLLCMメンバー2022-01-012022-12-310001865408出口:百時美施貴宝社とセルジニアスイスLLCMメンバー2021-01-012021-12-310001865408出口:SanofiMembers2023-01-012023-12-310001865408出口:SanofiMembers2022-01-012022-12-310001865408出口:SanofiMembers2021-01-012021-12-310001865408出口:MerckKGaADarmstadtGermanyMembers2023-01-012023-12-310001865408出口:MerckKGaADarmstadtGermanyMembers2022-01-012022-12-310001865408出口:MerckKGaADarmstadtGermanyMembers2021-01-012021-12-310001865408Exai:GTApeiron治療メンバー2023-01-012023-12-310001865408Exai:GTApeiron治療メンバー2022-01-012022-12-310001865408Exai:GTApeiron治療メンバー2021-01-012021-12-310001865408Exai:他のクライアントは単独でメンバを発見していない2023-01-012023-12-310001865408Exai:他のクライアントは単独でメンバを発見していない2022-01-012022-12-310001865408Exai:他のクライアントは単独でメンバを発見していない2021-01-012021-12-310001865408国:GB2023-12-310001865408国:はい2023-12-310001865408Exai:RestOfTheWorldNoteSeparatelyDisclosedMembers2023-12-310001865408国:GB2022-12-310001865408国:はい2022-12-310001865408Exai:RestOfTheWorldNoteSeparatelyDisclosedMembers2022-12-31EXAI:細分化市場0001865408Exai:ServiceFeesMember2023-01-012023-12-310001865408Exai:ServiceFeesMember2022-01-012022-12-310001865408Exai:ServiceFeesMember2021-01-012021-12-310001865408Exai:ライセンス料OptInPaymentsとマイルストーン達成メンバー2023-01-012023-12-310001865408Exai:ライセンス料OptInPaymentsとマイルストーン達成メンバー2022-01-012022-12-310001865408Exai:ライセンス料OptInPaymentsとマイルストーン達成メンバー2021-01-012021-12-310001865408Exai:ライセンス料前置支払と研究財団メンバー2023-01-012023-12-310001865408Exai:ライセンス料前置支払と研究財団メンバー2022-01-012022-12-310001865408Exai:ライセンス料前置支払と研究財団メンバー2021-01-012021-12-310001865408Exai:CelgenMembers2021-01-012021-12-310001865408出口:SanofiMembers2022-01-04Exai:小説“小分子”0001865408出口:SanofiMembers2022-01-042022-01-04ISO 4217:ドル0001865408出口:百時美施貴宝社とセルジニアスイスLLCMメンバー2022-03-112022-03-110001865408Exai:バイエルメンバー2022-05-302022-05-300001865408出口:MerckKGaADarmstadtGermanyMembers2023-09-190001865408出口:MerckKGaADarmstadtGermanyMembers2023-09-192023-09-190001865408出口:SanofiMembers2023-09-272023-09-270001865408出口:SanofiMembers2024-02-012024-02-290001865408出口:SanofiMembers2023-12-210001865408出口:百時美施貴宝社とセルジニアスイスLLCMメンバー2023-12-310001865408国:GB2023-01-012023-12-310001865408国:GB2022-01-012022-12-310001865408国:GB2021-01-012021-12-310001865408国:フランス2023-01-012023-12-310001865408国:フランス2022-01-012022-12-310001865408国:フランス2021-01-012021-12-310001865408輸出:ヨーロッパメンバーの回復2023-01-012023-12-310001865408輸出:ヨーロッパメンバーの回復2022-01-012022-12-310001865408輸出:ヨーロッパメンバーの回復2021-01-012021-12-310001865408国:アメリカ2023-01-012023-12-310001865408国:アメリカ2022-01-012022-12-310001865408国:アメリカ2021-01-012021-12-310001865408輸出:その他の国/地域/地域のメンバー2023-01-012023-12-310001865408輸出:その他の国/地域/地域のメンバー2022-01-012022-12-310001865408輸出:その他の国/地域/地域のメンバー2021-01-012021-12-310001865408IFRS-FULL:PerformanceObligationsSquisifiedOverTimeMembers2023-01-012023-12-310001865408IFRS-FULL:PerformanceObligationsSquisifiedOverTimeMembers2022-01-012022-12-310001865408IFRS-FULL:PerformanceObligationsSquisifiedOverTimeMembers2021-01-012021-12-310001865408IFRS-FULL:PerformanceObligationsSquisifiedAtPointInTimeMember2023-01-012023-12-310001865408IFRS-FULL:PerformanceObligationsSquisifiedAtPointInTimeMember2022-01-012022-12-310001865408IFRS-FULL:PerformanceObligationsSquisifiedAtPointInTimeMember2021-01-012021-12-310001865408IFRS-Full:1年遅れないメンバー2023-12-310001865408IFRS-Full:1年遅れないメンバー2022-12-310001865408IFRS-Full:1年遅れないメンバー2021-12-310001865408IFRS-Full:1年遅れのメンバー2023-12-310001865408IFRS-Full:1年遅れのメンバー2022-12-310001865408IFRS-Full:1年遅れのメンバー2021-12-3100018654082023-01-01出口:グラント0001865408Exai:オープンチャリティープロジェクトLLCMメンバー2023-11-152023-11-150001865408Exai:研究開発メンバー2023-01-012023-12-31出口:従業員0001865408Exai:研究開発メンバー2022-01-012022-12-310001865408Exai:研究開発メンバー2021-01-012021-12-310001865408輸出:管理と運営メンバー2023-01-012023-12-310001865408輸出:管理と運営メンバー2022-01-012022-12-310001865408輸出:管理と運営メンバー2021-01-012021-12-310001865408Exai:役員と管理メンバー2023-01-012023-12-310001865408Exai:役員と管理メンバー2022-01-012022-12-310001865408Exai:役員と管理メンバー2021-01-012021-12-31出口:役員0001865408Exai:HighestPaidDirectorMembers2023-01-012023-12-310001865408Exai:HighestPaidDirectorMembers2022-01-012022-12-310001865408Exai:HighestPaidDirectorMembers2021-01-012021-12-310001865408SRT:管理メンバ2023-01-012023-12-310001865408SRT:管理メンバ2022-01-012022-12-310001865408SRT:管理メンバ2021-01-012021-12-3100018654082023-04-012023-04-0100018654082023-03-312023-03-310001865408IFRS-Full:重み平均メンバー2023-01-012023-12-3100018654082023-12-312023-12-310001865408IFRS-FULL:一般共有メンバExai:InitialPublicOfferingMember2021-10-050001865408IFRS-FULL:Goodwill Members2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:コンピュータソフトウェアのメンバー2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2021-12-310001865408IFRS-Full:Gross CarryingAmount Member2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:コンピュータソフトウェアのメンバー2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount Member2022-01-012022-12-310001865408IFRS-FULL:Goodwill Members2022-01-012022-12-310001865408IFRS-FULL:Goodwill Members2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:コンピュータソフトウェアのメンバー2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-12-310001865408IFRS-Full:Gross CarryingAmount Member2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2023-01-012023-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:コンピュータソフトウェアのメンバー2023-01-012023-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-01-012023-12-310001865408IFRS-Full:Gross CarryingAmount Member2023-01-012023-12-310001865408IFRS-FULL:Goodwill Members2023-01-012023-12-310001865408IFRS-FULL:Goodwill Members2023-12-310001865408IFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2023-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-FULL:コンピュータソフトウェアのメンバー2023-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-12-310001865408IFRS-Full:Gross CarryingAmount Member2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバー2021-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMemberExai:一般·管理費メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバー2022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMemberExai:一般·管理費メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:AcquiredIntelligence ectualPropertyMember2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-FULL:コンピュータソフトウェアのメンバー2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバー2023-12-310001865408Exai:AcquiredIntelligence ectualPropertyMember2023-12-310001865408IFRS-FULL:コンピュータソフトウェアのメンバー2023-12-310001865408IFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2023-12-310001865408Exai:AcquiredIntelligence ectualPropertyMember2022-12-310001865408IFRS-FULL:コンピュータソフトウェアのメンバー2022-12-310001865408IFRS-Full:著作権特許およびその他の業界財産権利サービスおよび経営権メンバー2022-12-310001865408出口:AlcyteMembersIFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2021-08-182021-08-180001865408出口:AlcyteMembersExai:AcquiredIntelligence ectualPropertyMember2021-08-182021-08-180001865408IFRS-FULL:Goodwill Members出口:AlcyteMembers2021-08-182021-08-180001865408出口:AlcyteMembers2021-08-182021-08-18出口:現金生成単位0001865408出口:AlcyteMembersIFRS-Full:キャッシュフローのメンバーを割引する2023-01-012023-12-310001865408出口:AlcyteMembersIFRS-Full:キャッシュフローのメンバーを割引する2023-12-310001865408Exai:GTApeiron治療メンバーExai:AcquiredIntelligence ectualPropertyMember2021-07-012021-07-010001865408Exai:GTApeiron治療メンバー2021-07-012021-07-010001865408Exai:GTApeiron治療メンバーIFRS-Full:Gross CarryingAmount MemberExai:AcquiredIntelligence ectualPropertyMember2021-07-012021-07-010001865408Exai:GTApeiron治療メンバーExai:AcquiredIntelligence ectualPropertyMemberIFRS-Full:キャッシュフローのメンバーを割引する2023-12-310001865408Exai:GTApeiron治療メンバーIFRS-Full:キャッシュフローのメンバーを割引する2023-01-012023-12-310001865408IFRS-FULL:Goodwill MembersExai:動的発見制限メンバ2018-11-232018-11-230001865408IFRS-Full:Gross CarryingAmount MemberIFRS−FULL:施工進捗メンバー2021-12-310001865408IFRS-Full:Gross CarryingAmount Member出口:PlantAndEquipmentMember2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:レンタル改善メンバー2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:ComputerEquipmentMembers2021-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS−FULL:施工進捗メンバー2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount Member出口:PlantAndEquipmentMember2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:レンタル改善メンバー2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:ComputerEquipmentMembers2022-01-012022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS−FULL:施工進捗メンバー2022-12-310001865408IFRS-Full:Gross CarryingAmount Member出口:PlantAndEquipmentMember2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:レンタル改善メンバー2022-12-310001865408IFRS-Full:Gross CarryingAmount MemberIFRS-Full:ComputerEquipmentMembers2022-12-310001865408Exai:付加コンテンツメンバIFRS−FULL:施工進捗メンバー2023-01-012023-12-310001865408Exai:付加コンテンツメンバ出口:PlantAndEquipmentMember2023-01-012023-12-310001865408Exai:付加コンテンツメンバIFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001865408Exai:付加コンテンツメンバIFRS-Full:レンタル改善メンバー2023-01-012023-12-310001865408Exai:付加コンテンツメンバIFRS-Full:ComputerEquipmentMembers2023-01-012023-12-310001865408Exai:付加コンテンツメンバ2023-01-012023-12-310001865408Exai:付加コンテンツメンバIFRS−FULL:施工進捗メンバー2023-12-310001865408Exai:付加コンテンツメンバ出口:PlantAndEquipmentMember2023-12-310001865408Exai:付加コンテンツメンバIFRS-Full:FixturesAndFittingsMember2023-12-310001865408Exai:付加コンテンツメンバIFRS-Full:レンタル改善メンバー2023-12-310001865408Exai:付加コンテンツメンバIFRS-Full:ComputerEquipmentMembers2023-12-310001865408Exai:付加コンテンツメンバ2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2021-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2021-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2022-01-012022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS−FULL:施工進捗メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバー出口:PlantAndEquipmentMember2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:FixturesAndFittingsMember2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:レンタル改善メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:ComputerEquipmentMembers2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2022-01-012022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2022-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2022-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2023-01-012023-12-310001865408Exai:研究開発費メンバーIFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS−FULL:施工進捗メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバー出口:PlantAndEquipmentMember2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:レンタル改善メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーExai:一般·管理費メンバーIFRS-Full:ComputerEquipmentMembers2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2023-01-012023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS−FULL:施工進捗メンバー2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバー出口:PlantAndEquipmentMember2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:レンタル改善メンバー2023-12-310001865408IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:ComputerEquipmentMembers2023-12-310001865408IFRS−FULL:施工進捗メンバー2023-12-310001865408出口:PlantAndEquipmentMember2023-12-310001865408IFRS-Full:FixturesAndFittingsMember2023-12-310001865408IFRS-Full:レンタル改善メンバー2023-12-310001865408IFRS-Full:ComputerEquipmentMembers2023-12-310001865408IFRS−FULL:施工進捗メンバー2022-12-310001865408出口:PlantAndEquipmentMember2022-12-310001865408IFRS-Full:FixturesAndFittingsMember2022-12-310001865408IFRS-Full:レンタル改善メンバー2022-12-310001865408IFRS-Full:ComputerEquipmentMembers2022-12-310001865408出口:REVenturesILLCMメンバー2019-01-012019-12-310001865408出口:REVenturesILLCMメンバー2022-01-012022-12-310001865408IFRS-Full:JointVenturesWhere EntiyIsVenterMember出口:REVenturesILLCMメンバー2023-01-012023-12-310001865408IFRS-Full:JointVenturesWhere EntiyIsVenterMember出口:REVenturesILLCMメンバー2022-01-012022-12-310001865408IFRS-Full:JointVenturesWhere EntiyIsVenterMember出口:REVenturesILLCMメンバー2023-12-310001865408IFRS-Full:JointVenturesWhere EntiyIsVenterMember出口:REVenturesILLCMメンバー2022-12-310001865408出口:REVenturesILLCMメンバー2021-01-012021-12-310001865408出口:REVenturesILLCMメンバー2023-12-310001865408出口:REVenturesILLCMメンバー2022-12-310001865408出口:REVenturesILLCMメンバー2021-12-310001865408出口:REVenturesIILLCMメンバー2022-01-012022-12-310001865408Exai:EvotecAGMember2021-01-012021-12-310001865408Exai:EvotecAGMember2021-12-31Exai:化合物0001865408Exai:EvotecAGMember2023-01-012023-12-310001865408SRT:最小メンバ数Exai:EvotecAGMember2023-01-012023-12-310001865408EXAI:EQRxIncMember2023-10-09EXAI:目標0001865408EXAI:EQRxIncMember2023-10-122023-10-120001865408出口:MDAndersonMembers2022-11-14出口:レンタル契約0001865408国:GB2023-01-01輸出:不動産0001865408国:はい2023-01-010001865408出口:ウィーンオーストリアメンバー2021-09-030001865408出口:ウィーンオーストリアメンバー2021-09-032021-09-030001865408出口:Vienna MiamiAndBoston Members2023-12-310001865408出口:DundeeUnitedKingdomMembers2023-05-232023-05-230001865408出口:MiamiFloridaUnitedStatesメンバー2023-12-282023-12-280001865408出口:LeaseholdProperty 1メンバー2022-01-012022-12-310001865408Exai:LeaseholdProperty 2メンバー2022-01-012022-12-310001865408IFRS-Full:1年遅れ、5年遅れないメンバー2023-12-310001865408IFRS-Full:1年遅れ、5年遅れないメンバー2022-12-310001865408IFRS-Full:5年遅れのメンバー2023-12-310001865408IFRS-Full:5年遅れのメンバー2022-12-310001865408Exai:GrantsMember2022-12-310001865408Exai:GrantsMember2023-01-012023-12-310001865408Exai:GrantsMember2023-12-310001865408Exai:GrantsMember2021-12-310001865408Exai:GrantsMember2022-01-012022-12-310001865408Exai:連携メンバ2021-12-310001865408Exai:連携メンバ2022-01-012022-12-310001865408Exai:連携メンバ2022-12-310001865408IFRS-FULL:一般共有メンバ2023-12-310001865408IFRS-FULL:一般共有メンバ2022-12-310001865408IFRS-FULL:一般共有メンバ2023-01-012023-12-31Exai:投票0001865408Exai:遅延共有メンバ2023-12-310001865408国:GB2023-12-310001865408国:GB2022-12-310001865408Exai:ShortTerm時間差NetMembers国:GB2023-12-310001865408Exai:ShortTerm時間差NetMembers国:GB2022-12-310001865408国:GBExai:紛失とその他のNetMemberの削減2023-12-310001865408国:GBExai:紛失とその他のNetMemberの削減2022-12-310001865408Exai:FixedAssetTimingDifferencesNetMember国:GB2023-12-310001865408Exai:FixedAssetTimingDifferencesNetMember国:GB2022-12-310001865408IFRS-Full:その他の臨時差異メンバ国:GB2023-12-310001865408IFRS-Full:その他の臨時差異メンバ国:GB2022-12-310001865408Exai:固定資産仮差異メンバ国:GB2023-12-310001865408Exai:固定資産仮差異メンバ国:GB2022-12-310001865408脱退:損失とその他の減価メンバー国:GB2023-12-310001865408脱退:損失とその他の減価メンバー国:GB2022-12-310001865408国:はいIFRS-Full:その他の臨時差異メンバ2023-12-310001865408国:はいIFRS-Full:その他の臨時差異メンバ2022-12-310001865408国:はいExai:固定資産仮差異メンバ2023-12-310001865408国:はいExai:固定資産仮差異メンバ2022-12-310001865408国:はい2023-12-310001865408国:はい2022-12-310001865408IFRS-Full:その他の臨時差異メンバ国:アメリカ2023-12-310001865408IFRS-Full:その他の臨時差異メンバ国:アメリカ2022-12-310001865408国:アメリカ2023-12-310001865408国:アメリカ2022-12-310001865408国:アメリカ2023-01-012023-12-310001865408国:アメリカ2022-01-012022-12-310001865408Exai:収入生成連携メンバ2023-12-310001865408Exai:収入生成連携メンバ2022-12-310001865408輸出:契約責任メンバー2023-12-310001865408輸出:契約責任メンバー2022-12-310001865408IFRS-Full:JointOperationsMember2023-12-310001865408IFRS-Full:JointOperationsMember2022-12-310001865408EXAI:他の上級メンバー2023-12-310001865408EXAI:他の上級メンバー2022-12-310001865408Exai:収入生成連携メンバ2023-01-012023-12-310001865408IFRS-Full:JointOperationsMember2023-01-012023-12-310001865408出口:MerckKGaADarmstadtGermanyMembersExai:収入生成連携メンバ2023-01-012023-12-310001865408出口:SanofiMembersExai:研究マイルストーンのメンバー2023-01-012023-12-310001865408EXAI:InitiationOfNewDrugDiscoveryMember出口:SanofiMembers2023-01-012023-12-310001865408Exai:収入生成連携メンバ2021-12-310001865408Exai:収入生成連携メンバ2022-01-012022-12-310001865408IFRS-Full:JointOperationsMember2021-12-310001865408IFRS-Full:JointOperationsMember2022-01-012022-12-310001865408EXAI:RestorationProvisionMembers2021-12-310001865408IFRS-FULL:OnerousContractsProvisionMember2021-12-310001865408EXAI:RestorationProvisionMembers2022-01-012022-12-310001865408IFRS-FULL:OnerousContractsProvisionMember2022-01-012022-12-310001865408EXAI:RestorationProvisionMembers2022-12-310001865408IFRS-FULL:OnerousContractsProvisionMember2022-12-310001865408EXAI:RestorationProvisionMembers2023-01-012023-12-310001865408IFRS-FULL:OnerousContractsProvisionMember2023-01-012023-12-310001865408EXAI:RestorationProvisionMembers2023-12-310001865408IFRS-FULL:OnerousContractsProvisionMember2023-12-3100018654082020-01-012020-12-310001865408IFRS-Full:財務資産償却コスト種別メンバーIFRS-Full:売掛金メンバー2023-12-310001865408IFRS-Full:財務資産償却コスト種別メンバーIFRS-Full:売掛金メンバー2022-12-310001865408Exai:現金と現金等価物のメンバーIFRS-Full:財務資産償却コスト種別メンバー2023-12-310001865408Exai:現金と現金等価物のメンバーIFRS-Full:財務資産償却コスト種別メンバー2022-12-310001865408Exai:ShortTermBank DepositsMemberIFRS-Full:財務資産償却コスト種別メンバー2023-12-310001865408Exai:ShortTermBank DepositsMemberIFRS-Full:財務資産償却コスト種別メンバー2022-12-310001865408IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーIFRS-Full:株式投資メンバー2023-12-310001865408IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーIFRS-Full:株式投資メンバー2022-12-310001865408Exai:TradePayablesメンバIFRS-Full:財務負債償却コストカテゴリメンバー2023-12-310001865408Exai:TradePayablesメンバIFRS-Full:財務負債償却コストカテゴリメンバー2022-12-310001865408IFRS-Full:財務負債償却コストカテゴリメンバーExai:融資メンバー2023-12-310001865408IFRS-Full:財務負債償却コストカテゴリメンバーExai:融資メンバー2022-12-310001865408IFRS-Full:財務負債償却コストカテゴリメンバーIFRS-Full:レンタル担当メンバー2023-12-310001865408IFRS-Full:財務負債償却コストカテゴリメンバーIFRS-Full:レンタル担当メンバー2022-12-310001865408IFRS-Full:財務負債償却コストカテゴリメンバーExai:OtherAdvancesFrom JointOperationPartnersMember2023-12-310001865408IFRS-Full:財務負債償却コストカテゴリメンバーExai:OtherAdvancesFrom JointOperationPartnersMember2022-12-3100018654082023-06-30輸出:契約0001865408SRT:最小メンバ数2023-04-012023-06-300001865408SRT:最大メンバ数2023-04-012023-06-300001865408IFRS-Full:ForwardContractMember2023-04-012023-06-300001865408IFRS-Full:Level 3 of FairValueHierarchyMembersIFRS-Full:株式投資メンバー2022-12-310001865408IFRS-Full:Level 3 of FairValueHierarchyMembersIFRS-Full:株式投資メンバー2023-01-012023-12-310001865408IFRS-Full:Level 3 of FairValueHierarchyMembersIFRS-Full:株式投資メンバー2023-12-310001865408通貨:ドルIFRS-Full:CurrencyRiskMember2023-01-012023-12-310001865408IFRS-Full:CurrencyRiskMember通貨:ユーロ2023-01-012023-12-310001865408通貨:ドルIFRS-Full:CurrencyRiskMember2022-01-012022-12-310001865408IFRS-Full:CurrencyRiskMember通貨:ユーロ2022-01-012022-12-310001865408IFRS-Full:InterestRateRiskMember2023-12-310001865408IFRS-Full:InterestRateRiskMember2022-12-310001865408IFRS-Full:InterestRateRiskMember2023-01-012023-12-310001865408IFRS-Full:InterestRateRiskMember2022-01-012022-12-310001865408IFRS-Full:LiquidityRiskMember2023-12-310001865408IFRS-Full:LiquidityRiskMemberIFRS-Full:3ヶ月遅れていないメンバー2023-12-310001865408IFRS-Full:3ヶ月遅れと1年遅れのメンバーIFRS-Full:LiquidityRiskMember2023-12-310001865408IFRS-Full:1年遅れ、2年遅れないメンバーIFRS-Full:LiquidityRiskMember2023-12-310001865408IFRS-Full:2年遅れと5年遅れのメンバーIFRS-Full:LiquidityRiskMember2023-12-310001865408IFRS-Full:5年遅れのメンバーIFRS-Full:LiquidityRiskMember2023-12-310001865408出口:AlcyteMembers2023-12-31ISO 4217:ユーロ0001865408IFRS-Full:LiquidityRiskMember2022-12-310001865408IFRS-Full:LiquidityRiskMemberIFRS-Full:3ヶ月遅れていないメンバー2022-12-310001865408IFRS-Full:3ヶ月遅れと1年遅れのメンバーIFRS-Full:LiquidityRiskMember2022-12-310001865408IFRS-Full:1年遅れ、2年遅れないメンバーIFRS-Full:LiquidityRiskMember2022-12-310001865408IFRS-Full:2年遅れと5年遅れのメンバーIFRS-Full:LiquidityRiskMember2022-12-310001865408IFRS-Full:5年遅れのメンバーIFRS-Full:LiquidityRiskMember2022-12-310001865408Exai:InterestBearingLoansand BorrowingsMember2022-12-310001865408Exai:InterestBearingLoansand BorrowingsMember2023-01-012023-12-310001865408Exai:InterestBearingLoansand BorrowingsMember2023-12-310001865408IFRS-Full:レンタル担当メンバー2022-12-310001865408IFRS-Full:レンタル担当メンバー2023-01-012023-12-310001865408IFRS-Full:レンタル担当メンバー2023-12-310001865408Exai:InterestBearingLoansand BorrowingsMember2021-12-310001865408Exai:InterestBearingLoansand BorrowingsMember2022-01-012022-12-310001865408IFRS-Full:レンタル担当メンバー2021-12-310001865408IFRS-Full:レンタル担当メンバー2022-01-012022-12-3100018654082022-06-2100018654082022-06-212022-06-2100018654082023-03-2400018654082023-03-242023-03-2400018654082023-07-2700018654082023-07-272023-07-2700018654082023-08-1100018654082023-08-1600018654082023-08-162023-08-1600018654082023-08-112023-08-110001865408IFRS-Full:共有オプションのメンバー2023-01-012023-12-310001865408IFRS-Full:共有オプションのメンバー2022-01-012022-12-310001865408Exai:PerformanceShareOptionsMembers2023-01-012023-12-310001865408Exai:PerformanceShareOptionsMembers2022-01-012022-12-310001865408Exai:PerformanceShareUnitsPSUMember2023-01-012023-12-310001865408Exai:PerformanceShareUnitsPSUMember2022-01-012022-12-310001865408EXAI:制限された共有単位RSUメンバ2023-01-012023-12-310001865408EXAI:制限された共有単位RSUメンバ2022-01-012022-12-310001865408出口:Clawback SharesMember2023-01-012023-12-310001865408出口:Clawback SharesMember2022-01-012022-12-310001865408出口:AlcyteMembers出口:Clawback SharesMemberSRT:管理メンバ2021-12-310001865408出口:AlcyteMembers出口:Clawback SharesMemberSRT:管理メンバ2021-01-012021-12-310001865408出口:AlcyteMembers出口:Clawback SharesMemberSRT:管理メンバ2023-01-012023-12-310001865408出口:AlcyteMembers出口:Clawback SharesMemberSRT:管理メンバ2022-01-012022-12-310001865408IFRS-Full:共有オプションのメンバー2022-12-310001865408IFRS-Full:共有オプションのメンバー2023-12-310001865408SRT:最小メンバ数2023-12-310001865408SRT:最大メンバ数2023-12-310001865408SRT:最小メンバ数2022-12-310001865408SRT:最大メンバ数2022-12-31Utr:はい0001865408Exai:PerformanceShareOptionsMembers2022-12-310001865408Exai:PerformanceShareOptionsMembers2023-12-310001865408Exai:PerformanceShareUnitsPSUMember2022-12-310001865408Exai:PerformanceShareUnitsPSUMember2023-12-310001865408EXAI:制限された共有単位RSUメンバ2022-12-310001865408EXAI:制限された共有単位RSUメンバ2023-12-310001865408Exai:RestratedShareUnitsRSUNetSettlementArrangementMember2023-01-012023-12-310001865408Exai:企業管理インセンティブ·オプションのメンバー2022-01-012022-01-010001865408Exai:企業管理インセンティブ·オプションのメンバー2022-01-012022-12-310001865408出口:PlantAndEquipmentMember2023-12-310001865408出口:PlantAndEquipmentMember2022-12-310001865408IFRS-Full:ComputerEquipmentMembers2023-12-310001865408IFRS-Full:ComputerEquipmentMembers2022-12-310001865408IFRS-FULL:コンピュータソフトウェアのメンバー2023-12-310001865408IFRS-FULL:コンピュータソフトウェアのメンバー2022-12-310001865408IFRS-Full:FixturesAndFittingsMember2023-12-310001865408IFRS-Full:FixturesAndFittingsMember2022-12-310001865408IFRS-Full:レンタル改善メンバー2023-12-310001865408IFRS-Full:レンタル改善メンバー2022-12-310001865408Exai:American DepositarySharesメンバーExai:BillAndMelindaGatesFoundationMemberExai:PrivatePlacementMember2021-10-052021-10-050001865408Exai:American DepositarySharesメンバーExai:BillAndMelindaGatesFoundationMemberExai:PrivatePlacementMember2021-10-05ISO 4217:ドルXbrli:共有0001865408Exai:BillAndMelindaGatesFoundationMemberExai:PrivatePlacementMember2021-10-052021-10-050001865408Exai:BillAndMelindaGatesFoundationMember2021-10-050001865408Exai:BillAndMelindaGatesFoundationMember2021-10-052021-10-050001865408Exai:BillAndMelindaGatesFoundationMember2023-12-310001865408Exai:BillAndMelindaGatesFoundationMember2022-12-3100018654082024-01-1900018654082024-01-192024-01-190001865408SRT:CEO実行官メンバExai:共有オプションとパフォーマンス共有オプションのメンバ2024-02-132024-02-130001865408出口:REVenturesILLCMメンバー2024-03-132024-03-13 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表20-F
(マーク1)
| | | | | |
| ☐ | 1934年証券取引法第12(B)又は(G)条に基づく登録声明 |
あるいは…
| | | | | |
| ☒ | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2023
あるいは…
| | | | | |
| ☐ | 1934年証券取引法第13条又は13(D)条に基づいて提出された移行報告 |
あるいは…
| | | | | |
| ☐ | 1934年証券取引法第13条又は15(D)条に基づいて提出された幽霊会社報告 |
この幽霊会社が報告した事件の日付が必要です
手数料書類番号001-40850
EXSCIENTIA PLC
(登録者の正確な氏名及び登録者名の英文訳)
イングランドとウェールズ
(登録成立または組織の司法管轄権)
シュレーディンガービル
オックスフォード科学学園
オックスフォード大学OX 4 4 GE
イギリス.イギリス
電話:+44(0)1865 818941
(主にオフィスアドレスを実行)
デヴィッド·ハレット
臨時行政総裁
ExScience a plc
シュレーディンガービル
オックスフォード科学学園
オックスフォード大学OX 4 4 GE
イギリス.イギリス
電話:+44 (0) 1865 818941
(会社の連絡先名、電話、電子メールおよび/またはファックス番号および住所)
この法第12条(B)に基づいて登録又は登録される証券:
| | | | | | | | | | | | | | |
| | | | |
| クラスごとのタイトル | | 取引コード | | 登録された各取引所の名称 |
| 米国預託株式は1株当たり普通株に相当し,額面は1株当たり0.0005 GBである | | EXAI | | ナスダック世界ベスト市場 |
| | |
| 普通株、額面1株当たり0.0005 GB | | * | | ナスダック世界ベスト市場* |
*取引はできませんが、米国預託株式の登録のみに関連しています。
同法第12条(G)に基づいて登録又は登録される証券。ない
同法第15(D)条により報告義務のある証券が規定されている。ない
年度報告までの期間終了時の発行者毎の資本または普通株の流通株数を説明した普通株:125,702,3962023年12月31日現在の未返済金
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。*はい*☒違います。
本報告が年次報告又は移行報告である場合は、登録者が1934年“証券取引法”第13又は15(D)節に基づいて報告を提出する必要がないか否かを勾印で示してください違います。
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示すはい、そうです☐番号をつける
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T法規第405条(本章232.405節)に従って提出を要求した各対話データファイルを電子的に提出したか否かを示す。☒:はい、そうです☐番号をつける
登録者が大型加速ファイルサーバ,加速ファイルサーバ,非加速ファイルサーバであるか新興成長型会社であるかをチェックマークで示す.取引法第12 b-2条の規則における“大型加速申請者”、“加速申請者”、“新興成長型会社”の定義を参照されたい
| | | | | | | | | | | | | | | | | | | | |
大型加速ファイルサーバ☐ | | 加速ファイルサーバ☐ | | 非加速ファイルサーバ ☒ | | 新興成長型会社☒ |
ある新興成長型会社が国際財務報告基準に従ってその財務諸表を作成する場合、登録者が延長された移行期間を使用しないことを選択したかどうかをチェック番号で示し、取引所法第13(A)節に提供される任意の新しいまたは改正された財務会計基準を遵守する☐
“新又は改正財務会計基準”とは、財務会計基準委員会が2012年4月5日以降に発表したその会計基準編纂の任意の更新を意味する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる☐
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が本文書に含まれる財務諸表を作成する際にどのような会計基盤を使用しているかをチェックマークで示す
| | | | | | | | | | | | | | |
アメリカ公認会計基準☐ | | 国際財務報告基準国際会計基準委員会が発表した | | 他にも☐ |
前の質問に答えたときに“その他”をチェックした場合は、登録者がどの財務諸表項目に従うかをチェックしてください。☐プロジェクト17プロジェクト18
これが年次報告書である場合は、登録者が空殻会社であるか否かをチェックマークで示してください(取引法第12 b-2条で定義されているように)。☐はい☒違います
カタログ
| | | | | |
序言:序言 | 1 |
前向き陳述に関する特別説明 | 2 |
第1部:報告 | 4 |
項目1.役員、上級管理者、コンサルタントの身分 | 4 |
項目2.見積統計データと予想スケジュール | 5 |
プロジェクト3.重要な情報の発表 | 6 |
項目4.会社に関する情報 | 87 |
プロジェクト4 Aです。未解決従業員意見 | 136 |
プロジェクト5.業務と財務の回顧と展望 | 137 |
項目6.役員、上級管理職、従業員 | 156 |
項目7.大株主と関連者取引 | 178 |
項目8.財務情報 | 184 |
項目9.見積もりとリスト | 185 |
項目10.補足情報 | 186 |
プロジェクト11.市場リスクに関する定量的かつ定性的開示 | 200 |
第12項.持分証券を除く証券説明 | 201 |
第II部 | 203 |
第13項:違約、配当利セット、延滞 | 203 |
項目14.保持者の権利を保証するための実質的な修正および収益の使用 | 204 |
プロジェクト15.制御とプログラム | 205 |
プロジェクト16 A。監査委員会財務専門家 | 207 |
プロジェクト16 B。道徳的規則 | 208 |
プロジェクト16 Cです。チーフ会計士費用とサービス | 209 |
プロジェクト16 Dです。監査委員会の上場基準の免除 | 210 |
プロジェクト16 E。発行者および関連購入者が株式証券を購入する | 211 |
プロジェクト16 Fです。登録者の認証会計士を変更する | 212 |
プロジェクト16 Gです。会社の管理 | 212 |
16 H項です。炭鉱安全情報開示 | 213 |
プロジェクト16 I。検査妨害に関する外国司法管区の開示 | 214 |
プロジェクト16 Jです。インサイダー取引政策 | 215 |
プロジェクト16 Kです。ネットワーク·セキュリティ | 216 |
第三部 | 218 |
プロジェクト17.財務諸表 | 218 |
プロジェクト18.財務諸表 | 219 |
プロジェクト19.展示品 | 220 |
サイン | 222 |
序言:序言
別の説明がない限り、本20−F年次報告または年次報告で言及された用語“ExScience a”、“ExScience a plc”、“the Company”、“We”、“Us”および“Our”は、いずれもExScience a plcおよびそれらの子会社を意味する
本年度報告書には、商標、商号、サービスマークが含まれており、その中のいくつかは、私たちおよび他の組織に属する財産である。便宜上、本年度報告で言及された商標、商標名、およびサービスマークは使用されていないが、これらの記号がないことは、私たちの権利または適用すべての人が、適用法に基づいて、これらの商標、商号、およびサービスマークの権利をいかなる方法でも主張しないことを意味するわけではない。私たちは、他の当事者の商標、商号、またはサービスマークを使用または表示することを意図しておらず、そのような使用または表示は、これらの他の当事者と関係があることを示唆するものとして解釈されるべきではなく、またはこれらの他の当事者によって裏書されたり、後援されたりするべきではない
財務情報の列報
本年度報告における財務諸表は、国際会計基準委員会(“IASB”)が発表したIFRS会計基準に基づいて作成された。私たちの財務諸表はすべてアメリカ公認会計基準に従って作成されたものではありません。
私たちの財務情報はポンドで表されています。読者の便宜のため、本年報では、別途説明がない限り、ポンドをドルに換算した為替レートは1.00 GB対1.27ドルであり、これはニューヨーク連邦準備銀行2023年12月29日正午の購入レートである。このようなドル金額は必ずしも指定された日や他の日付でポンドに両替する際に実際に購入できるドルの金額を示すとは限らない。
本年度報告書で言及されている“$”はドルを指し、言及されているすべての“GB”および“GBP”はポンドを指す。
私たちは本年度報告書のいくつかの数値を四捨五入した。したがって、いくつかのテーブルで合計として表示される数字は、前の数字の算術集約ではない可能性がある。
業界と市場データ
この年間報告書には、私たちの業界、私たちの業務、そして私たちの製品の市場に関する見積もり、予測、その他の情報が含まれています。見積り,予測,予測,市場研究や類似手法に基づく情報自体が不確定要因の影響を受け,実際のイベントや状況は本情報で想定しているイベントや状況とは大きく異なる可能性がある.他に明確な規定がない限り、私たちは、私たちの内部推定と研究、および市場研究会社および他の第三者が準備した報告、研究調査、研究および類似データ、業界、医療および一般出版物、政府データ、および同様のソースから、これらの産業、商業、市場、および他のデータを取得する。我々はこのような情報の正確性に責任を負い,わが社内のこのような事項に関する研究は信頼でき,市場定義は適切であると信じているが,このような研究やこれらの定義はいかなる独立したソースも確認されていない.
また、様々な要素のため、私たちと私たちの業界の未来の業績に対する仮説と推定は、タイトルを含む高度な不確実性とリスクの影響を受けなければならない“プロジェクト3.D--重要な情報--リスク要因”このような要素と他の要素は私たちの未来の業績が私たちの仮定と見積もりと大きく違うことをもたらすかもしれない。参照してください“前向きな陳述に関する特別な説明“と述べた
前向き陳述に関する特別説明
本年度報告書には、重大なリスクと不確定要素に関する前向きな陳述が含まれている。場合によっては、前向き陳述は、“可能”、“将”、“可能”、“将”、“すべき”、“予想”、“計画”、“計画”、“目標”、“予想”、“信じ”、“推定”、“予測”、“潜在”、“継続”、“進行中”といった用語または他の同様の用語の否定によって識別することができる。これらの表現は既知および未知のリスク、不確定性および他の重要な要素に関連し、私たちの実際の結果、活動レベル、業績または業績を招く可能性があり、これらの前向き表現の中で明示または示唆する情報とは大きく異なる。本年度報告に含まれる前向き陳述や意見は,本年度報告日までに我々が把握した情報に基づいており,これらの情報はこのような陳述の合理的な基礎を構成していると考えられるが,これらの情報は限られているか不完全である可能性があり,我々の陳述は,入手可能なすべての情報について詳細な調査や検討が行われていることを示していると解釈されてはならない.前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
•私たちの技術プラットフォーム、正確な医学プラットフォーム、私たちの任意の薬物発見計画の潜在的な利点
•私たちの第三者戦略パートナーは、私たちの候補薬物に関する研究開発活動の能力と意志を継続している
•私たちの内部薬物発見計画や私たちの協力者の薬物発見計画の研究と開発努力の開始、時間、進捗、結果、コスト
•私たちは現在と未来の任意の臨床前と臨床研究の開始、時間、進度、結果とコスト
•私たちがこのような承認を得たり維持したりする能力を含む、届出と承認の時間と計画を規制する
•承認された製品の市場受容度と臨床的実用性の速度と程度
•臨床開発が可能な新薬候補薬の能力を決定し、これらの候補薬の速度を決定する予定です
•私たちの薬物設計と開発におけるビジネス戦略、目標、方法、および任意の関連する潜在的なメリット
•私たちのパートナーシップの有効性と収益性、私たちが既存のパートナーシップを維持する能力、そして私たちがどんな新しいパートナーシップに参加して利益を得る能力
•私たちは様々なパートナーシップの下で私たちの義務を履行することができる
•私たちの候補薬の市場機会の大きさは私たちの目標疾患を患っている患者数の推定を含みます
•私たちの費用、資本需要、追加融資需要の推定
•私たちの現金、現金等価物、短期銀行預金の使用に関する予想、およびこれらの財務資源はどのくらい続くと予想される
•私たちの第三者サプライヤーと製造業者のパフォーマンスは
•私たちは特許保護を受け、利用可能な範囲で既存の特許期間を延長することができる
•私たちのビジネスの秘密を守ること
•第三者が保有する知的財産権の有効性、およびいかなる第三者知的財産権を侵害、流用、または他の方法で侵害しない能力。
タイトルを参考にすべきです“プロジェクト3.D--重要な情報--リスク要因”討論は私たちの実際の結果が私たちの前向き陳述で明示的または暗示的な結果と大きく異なる重要な要素を招く可能性がある。このような要因のため、本年度報告書の展望的な陳述が正確であることが証明されることを保証することはできません。しかも、もし私たちの展望的な陳述が不正確であることが証明されたら、この不正確さは実質的である可能性がある。このような展望的陳述の重大な不確実性を考慮して、あなたはこれらの陳述を私たちまたは任意の特定の時間枠内で、または私たちの目標と計画の陳述または保証を完全に達成しないために、私たちまたは他の誰もと見なしてはならない。私たちは法律の要求がなければ、新しい情報、未来の事件、または他の理由でも、いかなる前向きな陳述も公開更新する義務はない。したがって、あなたはこのような前向きな陳述に依存して、私たちの今年度の報告日以降の任意の日付の観点を代表してはいけません。
第1部
項目1.役員、上級管理者、コンサルタントの身分
適用されません
項目2.見積統計データと予想スケジュール
適用されません
プロジェクト3.重要な情報
A. [保留されている]
B.資本化と負債
適用されません
C.報酬を提案し使用する理由
適用されません
D.リスク要因
本年度報告書と、私たちが米国証券取引委員会または米国証券取引委員会に提出した他の文書に記載されているすべての情報は、私たちが直面している業界が直面している以下のリスク要因を含むすべての情報を慎重に考慮しなければなりません。このようなどんなリスクも、私たちの業務、財務状況、または経営結果に重大な悪影響を及ぼす可能性がある。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちが現在知らない他の危険と不確実性はまた私たちの業務に悪影響を及ぼすかもしれない。
リスク要因をまとめる
私たちの業務は多くの危険と不確実性の影響を受けている。以下のいずれかのリスクが発生すれば、私たちの業務、財務状況、経営結果は重大な悪影響を受ける可能性があります。あなたは私たちの年間報告書のこの部分での危険要素の全面的な討論を慎重に検討して考慮しなければならない。本年度報告書を提出した日までの主なリスク要因集計表を以下に示す
•私たちは重大な運営赤字の歴史があり、私たちは今後数年も赤字になると予想している。
•もし私たちと私たちと未来の協力者が薬品の開発に成功して商業化できなければ、私たちの収入は私たちが達成したり利益を維持したりするのに十分ではないかもしれない。
•私たちの中期と年度業績は大幅に変動する可能性があり、これは私たちのアメリカ預託証明書の価値に悪影響を及ぼす可能性があります。
•私たちは未来に追加的な資金が必要かもしれないが、このような資金は私たちが受け入れられる条件で提供できないかもしれないし、根本的に提供できないかもしれない。もし私たちが追加資本を調達したり、業務を維持または拡大するために必要なキャッシュフローを発生させることができなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、運営、財務状況、そして将来性を損なうことになります。
•私たちは薬物の発見と開発を加速するために、私たちの技術プラットフォームに大きく依存して有望な分子を識別する。私たちのプラットフォーム技術は治療可能性のある分子を発見し、設計することができないかもしれないし、あるいは私たちあるいは私たちの協力者のために商業的に実行可能な製品を発見し、開発することができないかもしれない。
•不利なグローバル経済と地政学的条件は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
•我々のすべての候補薬物は早期臨床開発段階あるいは臨床前開発段階にある。もし私たちが臨床開発を通じて私たちの候補薬物を推進できなければ、規制部門の承認を得ることができず、最終的に私たちの候補薬物を商業化することができなければ、あるいはもし私たちがこの点で重大な遅延があったら、私たちの業務は実質的に損害を受けるだろう。
•臨床開発は長くて高価な過程に関連しており、結果は不確定である。もし私たちの臨床前研究と臨床試験が規制部門が私たちの任意の候補薬物を承認するのを支持するのに十分でなければ、私たちはその候補薬物の開発を完成または最終的に達成できない過程で追加コストや遅延を生じる可能性がある。
•我々の研究活動および臨床試験は、GTAEXS 617または任意の他の候補薬剤の安全性および有効性を十分に証明できない可能性があり、開発、規制承認および商業化を阻害または延期する。
•候補薬剤を決定または発見する努力では成功しない可能性があり、より大きなビジネス機会またはより成功の可能性をもたらす可能性の高いレジメン、協力または候補薬剤を利用できない可能性がある。
•私たちは激しい競争に直面しており、これは他の人たちが私たちよりも製品の発見、開発、商業化に成功する可能性がある。
•私たちはすでに研究開発に投資して、私たちの技術プラットフォームをさらに向上させるつもりだ。もしこのような投資の見返りが私たちの期待や発展速度よりも遅くなれば、私たちの収入と運営結果は影響を受けるかもしれない。
•我々の薬物発見協力者は協力プロジェクトの臨床開発において大きな裁量権を持っている。もし私たちの協力者が私たちの協力協定に規定された義務を履行できなければ、私たちの業務に負の影響を与えるかもしれません。私たちは私たちの薬物発見協力に資源を投資する見返りを決して達成しないかもしれない。
•第三者と契約を結び,臨床前開発や臨床試験のための候補薬を生産し,事業化を継続する予定である。このような第三者への依存は、許容可能なコストで十分な数の候補薬剤または製品またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止、または損害する可能性がある。
•我々は第三者に依存してGTAEXS 617の臨床試験を行い,第三者による将来の臨床試験や,他の候補薬剤の研究者が後援する臨床試験を行う予定である。もしこれらの第三者が契約義務を履行せず、規制要求を守らない、あるいは予想される期限までに完成しなければ、私たちは規制部門の私たちの候補薬物の承認を得ることができないか、あるいは商業化することができず、私たちの業務は実質的に損害を受ける可能性がある。
•もし私たちが既存の知的財産権許可協定や任意の未来の知的財産権許可下の義務を履行できなかった場合、あるいは私たちと現在または任意の未来の許可者との業務関係が妨害された場合、私たちは私たちの業務に重要な知的財産権を失う可能性がある。
•
•もし私たちの技術および候補薬物のために特許保護を獲得、維持、実行、保護することができない場合、または取得した特許保護範囲が十分でなければ、私たちの競争相手は私たちと類似または同じ技術および製品を開発し、商業化する可能性があり、私たちの技術および候補薬物の開発と商業化に成功する能力は不利な影響を受ける可能性がある。
•私たちの未来の成功は私たちが肝心な幹部を維持する能力、及び合格した人材を吸引、維持、激励する能力にかかっている。
•米国以外に本社を置く会社として、国際業務に関連する経済、政治、規制、その他のリスクに直面している
▪厳格かつ変化するグローバルプライバシーおよびデータセキュリティ要件を遵守することは、追加のコストと負債をもたらしたり、これらの要求を遵守しないことで、私たちのグローバルなデータ収集と処理能力を抑制したりすることができ、これらの要求を遵守しないことは、私たちを巨額の罰金と処罰に直面させる可能性があり、これは私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性がある。
私たちの財務状況に関連するリスク
私たちは重大な運営赤字の歴史があり、私たちは今後数年も赤字になると予想している。
私たちは重大な運営損失の歴史を持っている。2023年12月31日までの年度、私たちの税引き前純損失は1.621億GBです。2023年12月31日現在、私たちは設立以来累計3億495億GBの赤字を計上しています。私たちはまだ私たち自身の薬物発見計画を立てる初期段階にいる。今まで、私たちはまだ商業販売許可を得ていない薬品も、私たち自身の薬品販売から何の収入も得ていません。私たちは今後数年間巨額の費用と運営損失が発生すると予想している。私どもの運営費と純損失は四半期間と年度の間に大きく変動する可能性があります。私たちの費用は大幅に増加すると予想されています
•私たちのコンピューティングプラットフォームやソフトウェアソリューションへの投資と開発を続けています
•私たちの内部と共同配置のための薬物発見案の研究と開発を続けている
•臨床前研究を行い、試験性新薬申請、またはIND、および類似の外国申請を提出し、現在または未来の任意の候補薬物に対して臨床試験を行う
•臨床試験に成功した候補薬物のために発売承認を求める
•販売、マーケティング、流通インフラの構築、製造能力の拡大、単独でも第三者との協力も、規制の承認を得る可能性のある任意の候補薬物を商業化する
•私たちの知的財産権を維持し、拡大し、実行し、保護し、
•私たちのソフトウェアソリューションの開発を支援するために、より多くのソフトウェアエンジニア、プログラマ、販売、マーケティング担当者、および他の人を招聘します
•より多くの臨床、品質管理、他の科学者を招聘する
•研究失敗、結果複雑、安全問題、または他の規制課題を含むが、これらに限定されないが、上記のいずれかの任意の遅延に遭遇するか、または任意の問題に遭遇する
•新しい技術、業務、その他の資産を買収し、統合すること
•上場企業としての私たちの運営を支援するために、運営、財務、管理情報システムや人員を増やします。
私たちの経営の歴史は、私たちの業務のこれまでの成功度を評価することが難しいかもしれませんし、私たちの将来の生存能力を評価することも難しいかもしれません。
私たちは2012年7月に運営を開始し、これまで私たちの運営は組織と会社のための人員、業務計画、資金調達、発見と研究活動、私たちの薬物発見プラットフォームの開発、特許出願の提出、潜在的な候補薬物の決定、研究活動の展開、決定と協力に限られており、実行可能な候補薬物をさらに開発できるようになった。私たちは、どんな臨床試験を成功させ、市場の承認を得て、商業規模の製品を製造したり、第三者代表たちがそうすることを手配したり、成功した製品の商業化に必要な販売、マーケティング、流通活動を行うことができるかを証明していません。したがって、私たちの未来の成功や生存能力に対するあなたのどんな予測も、私たちがもっと長い運営歴史を持っている時のように正確ではないかもしれません。
また、スタートアップ企業として、私たちは予見できない費用、困難、合併症、遅延などの既知と未知の要素に遭遇する可能性がある。私たちはある時点で研究開発に集中している会社からビジネス活動を支援できる会社に転換する必要があります。そのような移行で、私たちは成功しないかもしれない。
もし私たちと私たちと未来の協力者が薬品の開発に成功して商業化できなければ、私たちの収入は私たちが達成したり利益を維持したりするのに十分ではないかもしれない。
私たちは薬品販売から収入を得たことがなく、私たちの最先端の候補薬は1/2段階の臨床試験を行っている。パートナーとの合意によると、私たちの現在の収入は主に前払いとマイルストーン支払いから来ている。利益を達成し、維持するためには、相当な収入をもたらす1つ以上の医薬製品を成功的に開発し、最終的に商業化しなければならない。したがって,われわれはわれわれのプラットフォームが臨床前と臨床のために有望な分子を識別する能力を開発することに依存する。薬物開発に成功するためには、候補薬物の臨床前テストと臨床試験を完成し、これらの候補薬物の監督管理許可を得ること、および私たちまたは私たちの協力者が規制許可を得る可能性のある任意の製品を含む一連の挑戦的な活動の中で作用する必要がある。私たちが完全に所有しているすべての候補薬と、私たちがパートナーと共同開発した薬物は、これらの活動の大多数の初期段階にある。私たちと彼らはこのような活動で決して成功しないかもしれない。たとえ私たちや彼らが成功しても、私たちは利益を達成するのに十分な収入を生むことができないかもしれない。私たちの技術プラットフォームは市場で激しい競争に直面し、生物製薬製品の開発に関連する多くのリスクと不確定性に直面しているため、私たちはいつ、あるいは利益を維持できるかどうかを正確に予測することができない。
私たちが利益を達成しても、私たちは収益性を維持したり向上させることができないかもしれない。もし私たちが実現して利益を維持できなければ、会社の価値を弱化させ、資金の調達、業務の拡大、研究開発努力の維持、ソフトウェア販売の増加、候補薬物パイプラインの開発、協力、さらには運営を継続する能力を弱める可能性がある。わが社の価値の低下はあなたの投資損失の全部または一部を招く可能性もあります。
私たちの中期と年度業績は大幅に変動する可能性があり、これは私たちのアメリカ預託証明書の価値に悪影響を及ぼす可能性があります。
私たちの経営業績は、私たちの収入、毛利益、収益力とキャッシュフローを含めて、以前から異なる時期に違いがあり、私たちはそれらが引き続きこのようにすることを予想しています。したがって、私たちの経営業績の期間間比較には意味がないかもしれませんが、私たちの中期と年度業績は将来の業績の指標と見なすべきではありません。私たちの中期と年度の財務業績は様々な要素によって変動する可能性があり、その多くの要素は私たちがコントロールできない。私たちの中期および年度の財務業績の変動を引き起こす可能性のある要因には、本“リスク要因”の一部の他の部分に記載されている要因および以下に掲げる要因が含まれているが、これらに限定されない
•私たちの業務、運営、インフラの維持と拡張に関連する運営費用の額と時間
•私たちの薬物発見協力者は、事前支払い、マイルストーン、または特許権使用料を得る権利がある医薬製品を開発し、それを商業化することの成功状況と、そのような支払いを受ける時間(あれば)、
•新しい協力協定を締結する能力は
•私たちはパートナーから売掛金を回収する能力
•予測不可能な業務中断は私たちのコストや支出を増加させます
•私たちまたは私たちの競争相手が新しいソフトウェア解決策を発売するタイミングと成功、または競争相手、顧客、または戦略パートナー間の統合を含む、私たちの業界の競争動態の任意の他の変化
•私たちの薬物は協力者が保有する株式、分配または収益の公正な価値または収入の変化を発見したからである
•将来の会計公告や会計政策の変更
•生命科学業界の状況を含む一般的な経済、業界、市場状況
•我々の薬物発見計画、技術又は業務の開発又は買収に関連する費用の時間及び金額、並びに将来発生する可能性のある被買収会社の営業権減価費用。
私たちは未来に追加的な資金が必要かもしれないが、このような資金は私たちが受け入れられる条件で提供できないかもしれないし、根本的に提供できないかもしれない。もし私たちが追加資本を調達したり、業務を維持または拡大するために必要なキャッシュフローを発生させることができなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、運営、財務状況、そして将来性を損なうことになります。
私たちは、現在と未来の薬物発見計画の開発、私たちの技術プラットフォームへの投資を含む、私たちが行っている活動と計画中の活動に大量の財源を投入する予定です。これらの活動に関連する費用は大幅に増加することが予想され,特に内部薬物発見計画の推進に伴い,臨床前·研究性新薬イネーブル研究の開始と完成,我々のプラットフォームへの投資のさらなる発展が期待される
私たちと現在の薬物発見協力者は、私たちが彼らと締結した協力協定に基づいて、様々な開発、法規、商業マイルストーンを実現する際に彼らから記念碑的な支払い、商業販売の特許権使用料(あれば)を得る権利があり、彼らは臨床前と臨床試験を行い、監督許可を得、製品販売を実現することを含む薬物開発において多くのリスクに直面している。また、これらのマイルストーンを実現する際に、私たちが獲得する権利がある金額は、最近の開発マイルストーンでは少なく、協力候補薬が開発によって商業化に入ると、獲得する権利がある金額が増加し、規制部門の承認と取得された商業成功レベル(あれば)によって異なる。したがって、私たちは私たちの持続的な運営に資金を提供するために多くの追加資本を得る必要があるかもしれない。
私たちは2023年12月31日現在、現金、現金等価物、短期銀行預金3.63億GBを持っている。私たちは、私たちの既存の現金、現金等価物、および短期銀行預金は、私たちの少なくとも今後12ヶ月の運営と資本支出需要を満たすのに十分だと信じている。しかし,我々のこの推定は誤りであることが証明される可能性があるという仮定に基づいており,我々の運営計画は現在我々が知らない多くの要因によって変化する可能性がある.したがって、私たちは現在予想されているよりも早く私たちの資本資源を枯渇させるかもしれない。私たちの将来の資本需要は多くの要素に依存します
•著者らの候補薬物の研究と開発努力の範囲、時間、進度と程度を支持し、臨床前研究と臨床試験を含む
•私たちの候補薬の規制検討のコスト、時間、結果
•私たちが追求するかもしれない他の候補薬の開発要求は
•薬物発見技術の取得、許可、投資のコスト
•私たちは支払いのスケジュールと入金を協力します
•私たちは有利な条件でより多くの発見協力を作ることができる
•私たちは私たちの会社の株式から得られる任意の分配または収益の時間と収受
•特許出願を準備、提出、起訴し、私たちの知的財産権を取得、維持、実行、保護し、知的財産権に関するクレームを弁護するコスト;
•私たちのプラットフォームに対する市場の認可と競争発展への対応のための販売とマーケティング努力を含む、私たちの業務のコストを拡大します
•私たちが発売許可を得た任意の候補薬物について、将来の商業化活動のコストは、製品販売、マーケティング、製造、流通を含む
•世界的な地政学的緊張、サプライチェーンの中断、金利上昇とインフレの影響を含むマクロ経済状況の悪化
•上場企業の運営コストとして。
もし私たちが追加的な資金調達が必要なら、私たちは私たちが受け入れられる条項やそのような資金を調達できないかもしれない。また、有利な市場条件や戦略的考慮のため、現在または将来の運営計画のために十分な資金があると信じていても、追加の資本を求めることができる。もし私たちが受け入れられる条項で追加資本を調達できない場合、あるいは私たちの業務と私たちの計算プラットフォームに投資するために必要なキャッシュフローを維持または拡大することができなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、財務状況、運営結果、将来性を損なうことになります。
不利なグローバル経済と地政学的条件は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
私たちの財務状況や経営結果は、ウクライナ戦争、戦争、またはハマスとイスラエルの間の紛争のような、世界経済および世界金融市場の全体的な状況または地政学的事件の悪影響を受ける可能性がある。例えば、インフレ率は、特にアメリカとイギリスでは、2023年には数十年ぶりの水準に上昇している。インフレが上昇し、差が下がっても、経営コスト(労働コストを含む)が増加し、私たちの経営予算に影響を与える可能性がある。疲弊した経済や衰退した経済は、私たちのサプライヤーに圧力を与え、供給中断を招く可能性があり、または第三者支払者または私たちのパートナーが私たちのサービスの支払いを遅延させる可能性があります。ウクライナ戦争やハマスがイスラエルと衝突した長期的な経済影響の評価や予測は困難であるにもかかわらず、これらの事件は世界金融市場に大きな妨害を与えている。また、私たちの潜在的協力者の業務とキャッシュフローは最近、世界経済発展と地政学的不確実性の負の影響を受け続ける可能性があり、地政学的不確実性はすでに生命科学業界全体が新たな研究開発パートナーシップや協力を確立する意欲を低下させ続ける可能性がある。中断と減速が深まったり持続したりすれば、私たちは私たちが受け入れられる条項で新しい協力合意を達成したり、追加資金を調達することができないかもしれない。上記のいずれも私たちの業務を損なう可能性があり、現在の経済気候や金融市場の状況が私たちの業務に悪影響を及ぼす可能性のあるすべての方法を予見することはできません。
私たちの候補薬の発見と開発に関するリスク
私たちは薬物の発見と開発を加速するために、私たちの技術プラットフォームに大きく依存して有望な分子を識別する。私たちのプラットフォーム技術は治療可能性のある分子を発見し、設計することができないかもしれないし、あるいは私たちあるいは私たちの協力者のために商業的に実行可能な製品を発見し、開発することができないかもしれない。
私たちは私たちの技術プラットフォームを使って人工知能実験室実験を行い、私たちの技術プラットフォームは私たちのすべての努力を支えている。そのため、私たちが協力した伝統的な方法と比較して、私たちのプラットフォームと技術の品質と先端程度は、私たちが研究発見活動、設計と将来性のある候補分子を提供し、薬物発見コストを加速と低減する能力に重要である。著者らは初めて3種類の人工知能設計の正確な薬物を人体臨床試験に入れた。人工知能設計の候補薬物は新しいため、人工知能設計過程を用いて候補薬物の開発、推進と商業化の能力にはより大きな不確実性がある。
私たちのいくつかの内部薬物発見計画と薬物発見が協力した結果、私たちのプラットフォームは薬物発見を加速し、高品質の候補薬物を決定することができることを示しているが、これらの結果は私たちの薬物発見協力者あるいは私たちの内部薬物発見計画が将来成功することを保証することはできない。私たちや私たちの薬物発見協力者が臨床前研究で潜在力を示す候補薬を開発できたとしても、私たちや彼らは成功しないかもしれません
ヒト臨床試験ではこれらの候補薬物の安全性と有効性を示した。そのほか、臨床前と臨床データは誤りと不正確或いは変化の解釈と分析が出現しやすく、多くの会社は彼らの候補薬物は臨床前研究と臨床試験で満足できると考えているが、しかしまだ候補薬物の発売許可を得られなかった。
我々のすべての候補薬物は早期臨床開発段階あるいは臨床前開発段階にある。もし私たちが臨床開発を通じて私たちの候補薬物を推進できなければ、規制部門の承認を得ることができず、最終的に私たちの候補薬物を商業化することができなければ、あるいはもし私たちがこの点で重大な遅延があったら、私たちの業務は実質的に損害を受けるだろう。
われわれが開発した4種類の候補薬は現在臨床試験が行われている:GTAEXS 617の1/2期臨床試験は2023年7月に開始され,GTAEXS 617はGT ApeIron(“GTA”)と共通して保有する候補薬である。BMYが許可したEXS 4318と我々の1つの協力者のために開発された他の2つの化合物は現在臨床試験中であり,これらの化合物に経済的興味がない。これまで人工知能を用いて承認された治療法は開発されていない。私たちの候補薬物が現在または未来のどの臨床試験も成功または陽性の臨床データを産生することは保証されず、私たちはアメリカ食品·薬物管理局またはFDAまたは他の規制機関による私たちの任意の候補薬物の発売承認を得られないかもしれない。私たちはINDをFDAに提出したことがない。私たちの他の候補薬は臨床前開発を行っている。FDAが私たちの任意の候補薬物のINDの適時な効力を許可するか、あるいは全く許可されないという保証はない。
生物製薬開発は長く、高価で不確定な過程であり、私たちのどの臨床試験のどの段階でも遅延または失敗が生じる可能性がある。もし私たちの候補薬が規制部門の承認を得られなければ、私たちの候補薬物を商業化し、マーケティングすることができないだろう。私たちの候補薬の開発は多くの要素に依存します
•臨床前の研究を完成させ
•索引ファイルを提出する比較可能な外国申請私たちが計画している臨床試験や他の将来の臨床試験を継続するための手当を受けています
•臨床試験を開始し登録して完成させ
•われわれの前臨床研究と臨床試験から積極的な結果を得て、候補薬物の安全性と有効性を証明した
•規制当局による候補薬物の商業化の承認を得ています
•販売、マーケティング、流通能力を確立し、承認されれば、単独でも他人と協力しても、私たちの製品の商業販売を開始することに成功した
•第三者製造業者と臨床的および商業的製造能力を手配または確立する
•許容可能なコストで候補薬を生産します
•患者、医学界、第三者支払者が私たちの製品を承認した場合、私たちの製品を受け入れます
•科学者、医療専門家、商人からなる組織を維持し、発展させ、彼らは私たちの製品と技術を開発し、それを商業化することができる。
その中の多くの要素は私たちがコントロールできないことであり、臨床テストと監督提出過程を十分に完成するのに要する時間を含む。私たちが規制部門の承認を求めるのに時間と資源がかかっても、私たちの候補薬は規制部門の承認を得られないかもしれない。もし私たちが上述の1つ以上の要求を適時あるいは根本的に達成できない場合、あるいは任意の他の要素が生物製薬製品の開発成功に影響を与える場合、私たちは重大な遅延や私たちの候補薬物の開発に成功できない可能性があり、これは私たちの業務、財務状況、運営結果、将来性に深刻な損害を与える。
臨床開発は長くて高価な過程に関連しており、結果は不確定である。もし私たちの臨床前研究と臨床試験が規制部門が私たちの任意の候補薬物を承認するのを支持するのに十分でなければ、私たちはその候補薬物の開発を完成または最終的に達成できない過程で追加コストや遅延を生じる可能性がある。
われわれのすべての候補薬は臨床前開発や早期臨床試験段階にあり,彼らは失敗するリスクが高い。臨床試験費用が高く、設計と実施が困難であり、完成まで数年かかる可能性があり、しかも結果は確定していない。私たちのどの臨床試験も計画通りに行われるか、計画通りに完成されるか、あるいは全くできないことは保証されない。1つまたは複数の臨床試験の失敗は、試験設計の欠陥、用量選択問題、参加者募集基準、および有利な安全性または有効性特徴を証明できなかったが、これらに限定されないが、試験の任意の段階で発生する可能性がある。
候補薬物の臨床試験を開始する前に、私たちは米国と海外で提出される予定のINDおよび他の規制文書を支持するために、広範な臨床前試験と研究を完成させなければならない。著者らは著者らの臨床前テストと研究が適時に完成或いは結果を確定することができず、監督機関が著者らの提案した臨床計画を受け入れるかどうか、或いは著者らの臨床前テストと研究の結果が最終的に任意の候補薬物の更なる開発を支持するかどうかを予測することができない。したがって、私たちは私たちが予想していたスケジュールで私たちの臨床前計画にINDまたは対応する規制文書を提出できることを保証することができず、INDや非米国規制文書の提出が規制機関が臨床試験の開始を許可することを保証することもできません。
FDA、欧州委員会、あるいは他の非米国規制機関から承認を得るのに要する時間は予測できないが、通常は臨床試験開始後数年で承認される必要があり、監督機関の重大な裁量権を含む多くの要素に依存する。監督部門の許可を得て任意の候補薬物を販売する前に、私たちは臨床前開発を完成し、それから広範な臨床試験を行い、この候補薬物の人体上の安全性と有効性を証明しなければならない。臨床試験では,われわれの候補薬物が指定用途に対して安全かつ有効であることを証明できない可能性がある。臨床試験が成功しても、開発期間中の上場承認政策の変化、付加法規、法規或いはガイドラインの制定或いは公布の変化、或いは各提出された製品申請に対する監督審査の変化は、申請の承認或いは拒否の遅延を招く可能性がある。
また,候補薬物は臨床前安全性研究を継続する必要があり,これらの研究はわれわれの臨床試験と同時に行われる可能性がある。これらの安全性研究の結果は,将来の臨床試験の開始や登録を遅らせる可能性があり,臨床試験を継続する能力に影響する可能性がある。
成功を妨げたり、速やかに臨床開発を完了したりする可能性がある他のイベントには、
•臨床試験の開始を支持するために、十分な臨床前、毒理学或いは他の体内試験或いは体外試験データを生成することができない
•遅延と規制当局は試験設計について合意した
•将来の契約研究組織またはCROと臨床試験場所との間で許容可能な条項について合意することを遅延させる
•各臨床試験地点において、臨床試験場所の開放を遅延させるか、または必要な機関審査委員会または機関生物安全委員会またはIBCの承認を得るか、または倫理委員会の積極的な意見、または米国以外の場所の同等の審査グループの承認を得る
•監督当局は、深刻な不良事件が発生したため、あるいは私たちの臨床試験運営または試験場所を検査した後、臨床一時停止を強制的に実施した
•私たちが招いたCROや他の第三者は臨床試験の要求を守ることができませんでした
•良好な臨床実践またはGCPに従って実行できなかった
•研究者と臨床サイトは異なる結果をもたらす方案を遵守できなかった
•私たち人間の出産方法は失敗しました
•私たちと契約していくつかの機能を実行する第三者の遅延を含む、私たちの候補薬物のテスト、検証、製造、および臨床場所への送達の遅延
•私たちの第三者請負業者は、法規の要求を遵守できなかったか、または私たちに対する契約義務をタイムリーに履行できなかったか、または全く遵守しなかった
•参加者を募集したり、参加者を試験を完了させたり、治療を受けた後の後続の行動に戻すことはできない
•臨床試験場所や参加者が試験から撤退した者は
•より長い時間を要する臨床観察または結果データ分析の臨床終点を選択する
•私たちの候補薬物の臨床試験は否定的または不確定な結果をもたらす可能性があり、私たちは決定したり、監督機関が追加の臨床試験を要求したり、開発計画を放棄することを要求するかもしれない
•候補薬物または候補薬物の投与に関連する深刻な有害事象が発生し、これらの有害事象はその潜在的利益を超えると考えられている
•他の発起人が行った同種の薬物試験で深刻な有害事象または他の意外事件が発生した
•新しい臨床試験案の規制要求とガイドラインの変化を修正または提出する必要がある
•国内または国際的に患者の権利およびプライバシーに関する法律または規制制度の変化;
•与えられた臨床試験を継続するのに十分な資金が足りない。
臨床前研究と臨床試験を成功させることができないいかなる状況も、私たちの追加コストを招くことができ、あるいは製品販売、監督管理と商業化マイルストーン、特許権使用料から収入を創出する能力を弱める可能性がある。また,候補薬剤の生産や処方変更を行う場合には,修正された候補薬剤を早期バージョンに関連付けるために,追加の臨床前研究や臨床試験を行う必要があるかもしれない。臨床試験の遅延は、候補薬物を商業化する独占的な権利を持つ可能性のある任意の期限を短縮することもできますし、私たちの競争相手が私たちの前に製品を市場に出すことを可能にすることは、候補薬物を商業化することに成功する能力を弱める可能性があり、私たちの業務、財務状況、運営結果、将来性を損なう可能性があります。
われわれの研究活動や臨床試験ではGTAEXS 617の安全性と有効性を十分に証明できない可能性がある 開発、規制承認、商業化を阻止または延期する他の候補薬もあるだろう。
GTAEXS 617を含む任意の候補薬物商業販売の規制承認を得る前に、私たちの候補薬は各目標適応において安全かつ有効であることを、長い、複雑で高価な研究活動および臨床試験によって証明しなければならない。研究活動や臨床試験は費用が高く,完成までに数年かかる可能性があり,その結果自体も不確定である。失敗は臨床試験中のいつでも発生する可能性があり,またGTAEXS 617は開発の初期段階であるため,失敗のリスクが高く,適切な製品としての開発には決して成功しない可能性がある。
私たちが行う可能性のあるすべての臨床試験は、規制部門の許可を得て、私たちの候補薬物を市場に出すために必要な安全性と有効性を証明できないかもしれない。もし私たちが行っているあるいは未来の臨床試験結果が私たちの候補薬物の安全性、効力、純度および有効性に対して確定されていない結果であれば、もし私たちが統計的かつ臨床的意義のある臨床終点に達していなければ、もし私たちの候補薬物に関連する安全問題があれば、私たちはこのような候補薬物の発売承認を阻止または延期される可能性がある。場合によっては、同じ候補薬の異なる臨床試験間の安全性と有効性の結果に有意差がある可能性がある
これらの要素は方案中に規定された試験プログラムの変化、製造差異、患者群の大きさとタイプの差異、臨床試験方案の変化と遵守状況及び臨床試験参加者の退学率を含む。
私たちは一回の臨床試験に成功しましたが、私たちが開発した任意の候補薬については、再完成できないかもしれません。
私たちはただ一つの臨床試験を成功させただけで、私たちは監督部門の許可を得ることに成功し、商業規模の製品を製造したり、第三者代表を手配したり、あるいは候補薬物の商業化に成功するために必要な販売とマーケティング活動を行うことができることを証明していません。私たちは予想されるタイムラインで私たちの候補薬に任意の追加のCTAまたは任意のINDを提出することができないかもしれない。さらに、INDまたは同様の外国申請の提出がFDAまたは非米国規制機関にさらなる臨床試験の開始を許可するかどうか、または開始すると、臨床試験の一時停止、変更、または終了を要求する問題は生じないことを確認することができない。これらの臨床試験の開始のいずれもFDAや他の規制機関との検討に基づいて最終的に試験設計を決定する必要がある。私たちが規制部門から得たどんな指導も変化する可能性がある。例えば、規制機関は、私たちの試験設計または選択された臨床終点の受容可能性を含むその立場を変えることができ、これは、私たちが現在予想しているよりも厳しい承認条件を適用することを要求することができるかもしれない。
もし私たちの候補薬に対して、現在予想されている以上の追加の臨床前研究または臨床試験または他の試験を行うことを要求された場合、もし私たちの候補薬の臨床試験または他の試験を成功させることができなければ、これらの試験または試験の結果が陽性でないか、またはわずかに陽性である場合、または安全問題がある場合、私たちは:
•私たちの候補薬の発売承認を遅延させます
•市場の承認を得ていません
•承認された適応や患者集団は期待や期待ほど広くない
•発売後のテスト要求を受ける
•発売承認を得た後にこの製品を市場から撤退させます。
私たちは、私たちの候補薬剤の開発と商業化の過程で追加のコストが発生したり、遅延が生じたりする可能性がある。
将来のINDまたは同様の非米国応用の臨床試験を開始するために、FDAまたは同様の非米国規制機関の許可を得るか、または得ることができないことを含む、我々の臨床前研究および臨床試験の開始または完了を遅延させる可能性がある。また,候補薬物の臨床前研究や臨床試験は再設計を必要とせず,時間どおりに十分な数の被験者を募集する必要がない,あるいは時間どおりに完成する必要はないことを確認することはできない。前臨床研究と臨床試験の間、あるいは前臨床研究と臨床試験のため、私たちは多くの予見できない事件に遭遇する可能性があり、これらの事件は私たちの上場許可を得たり、私たちの候補薬物を商業化する能力を延期または阻害する可能性がある
•私たちは監督部門からフィードバックを受け、前臨床研究や臨床試験の設計や実施を修正することを要求するかもしれない
•規制機関やIRBsは、私たちまたは私たちの研究者を許可していないかもしれないし、倫理委員会は積極的な意見を発表しないかもしれません。私たちまたは私たちの研究者が予想される試験場所で臨床試験を開始したり、臨床試験を行ったりすることができます
•私たちは、潜在的な試験地点および潜在的なCROと受け入れ可能な条項との合意に遅延または合意できない可能性があり、これらの条項は、広範な交渉を必要とする可能性があり、異なるCROと試験地点との間に大きな差があるかもしれない
•私たちの候補薬物の臨床前研究または臨床試験は否定的または不確定な結果をもたらす可能性があり、私たちは決定または監督機関が追加の臨床前研究または臨床試験を要求するか、あるいは製品開発計画を放棄することを決定するかもしれない
•私たちの候補薬の臨床試験に必要な患者の数は私たちが予想していたよりも多いかもしれません。これらの臨床試験の登録速度は私たちが予想していたよりも遅いかもしれません。あるいは参加者はこれらの臨床試験を脱退したり、私たちが予想したより高い速度で治療後のフォローアップを受けることができないかもしれません
•私たちの第三者請負業者は、規制要件を遵守できなかったり、十分な品質管理を維持できなかったり、臨床前研究または臨床試験を行うのに十分な製品供給を提供してくれなかったり、私たちに対する契約義務をタイムリーに履行できなかったり、その契約義務を履行できなかったり、臨床試験案から外れたり、試験から離脱したりする可能性があり、新しい臨床試験場所または研究者を増加させる必要があるかもしれない
•私たちは選択するかもしれません、または規制機関、IRBs、または倫理委員会は、規制要件を遵守しないこと、または参加者が受け入れられない健康リスクにさらされていることを含む、様々な理由で、私たちまたは私たちの研究者に臨床研究の一時停止または終了を要求するかもしれません
•候補薬の臨床試験コストは予想以上に高いかもしれません
•候補薬物の供給や品質、あるいは候補薬物の臨床試験を行うために必要な他の材料が不足しているか不足している可能性がある
•私たちの候補薬剤は、不良な副作用または他の予期しない特徴を有する可能性があり、私たちまたは私たちの研究者、規制機関、IRBsまたは倫理委員会が試験を一時停止または終了させるか、または他の癌療法の臨床前または臨床試験によって報告される可能性があり、それによって、候補薬剤の安全性または治療効果の懸念を引き起こす可能性がある;
•規制部門は私たちの候補薬物に対する承認要求を修正するかもしれないし、これらの要求は私たちが予想していたのとは違うかもしれない。
臨床試験が我々、そのような試験を行う機関のIRBsまたは倫理委員会、データ安全監視委員会またはDSMBによって一時停止または終了された場合、またはFDAまたは他の規制機関によって一時停止または終了される場合、遅延に遭遇する可能性がある。このような主管部門は様々な要素のために臨床試験を強制的に一時停止、終了または一時停止する可能性があり、これらの要素は、監督管理要求または著者らの臨床規程に従って臨床試験を行うことができなかったこと、FDAまたは他の監督機関の臨床試験操作または試験場所の検査、予見できない安全問題または副作用、製品の使用による利益、政府法規または行政措置の変化、あるいは十分な資金の不足を含む。臨床試験の開始または完了遅延を引き起こす多くの要素は、最終的に私たちの候補薬物が監督部門の承認を拒否される可能性もある。また,FDAや類似の非米国規制機関は,われわれの臨床試験設計や臨床試験データの解釈に同意しない可能性があり,あるいはわれわれの臨床試験設計を審査·レビューした後であっても,承認要求を変更する可能性がある。
また、私たちの現在と未来の臨床試験の首席研究員は時々私たちの科学顧問や顧問を務め、このようなサービスに関連する報酬を得るかもしれない。場合によっては、いくつかの関係をFDAまたは同様の非米国規制機関に報告する必要があるかもしれない。FDAや同様の非米国規制機関は、私たちと主要調査者との財務関係が利益の衝突をもたらしたり、他の方法で研究の解釈に影響を与えたりすると結論するかもしれない。したがって,FDAや同様の非米国規制機関は,適用された臨床試験地点で発生するデータの完全性を疑問視する可能性があり,臨床試験自体の効用が脅かされる可能性がある。これは、FDAまたは同様の非米国規制機関が私たちの上場申請の承認を遅延または拒否することを招き、最終的に私たちの1つ以上の候補薬が上場承認を拒否することにつながる可能性がある。
もし私たちがテストや規制の承認を得る上で遅延に遭遇したら、私たちの製品開発コストも増加するだろう。われわれの将来の臨床試験が計画通りに開始されるかどうかは不明であり,現在あるいは将来の臨床試験が再構成が必要かどうか,あるいは予定通りに完成するかどうかも分からない。重大な臨床前研究または臨床試験遅延は、候補薬物を商業化する独占的な権利を持つ可能性のある任意の期限を短縮するか、または私たちの競争相手が私たちの前に製品を市場に投入し、候補薬物を商業化することに成功する能力を弱めることを可能にするかもしれない。著者らの臨床前或いは未来の臨床開発計画のいかなる遅延も著者らの業務、財務状況と成長の将来性を深刻に損害する可能性がある。
もし私たちが患者の臨床試験への参加を募集する上で遅延や困難に遭遇した場合、必要な監督管理の承認を受けることは延期または阻止される可能性がある。
FDAや米国以外の同様の規制機関の要求に応じて,これらの試験に十分な数の合格者を見つけて募集することができなければ,候補薬剤の臨床試験を開始または継続できない可能性がある。特に,広いターゲット領域に薬物発見プラットフォームを配置しているため,合格患者を募集する能力が制限される可能性があり,あるいは予想よりも募集速度が遅くなる可能性がある。例えば、私たちのいくつかの候補薬はまれな疾患を対象としているので、十分な数の合格患者を募集することが困難であるか、あるいは登録が私たちが予想しているよりも遅いかもしれない。また,われわれの競争相手の中には,われわれの候補薬と同じ適応を治療する候補薬の臨床試験を行っており,本来われわれの臨床試験に参加する資格のある患者は,われわれのライバル候補薬の臨床試験に参加することができる。
競争試験環境に加えて、我々が計画している臨床試験の資格基準は、彼らの癌が十分に深刻でないか、またはあまり深刻ではないことを保証するために、患者に測定可能な特定の特徴を有することが要求されるので、利用可能な研究参加者プールをさらに制限する。臨床研究を完成させるのに十分な数の患者を識別し募集することができないかもしれません
•調査中の病気の重症度は
•臨床試験に関する資格基準と全体設計
•研究を受けた候補薬の既知のリスクと利益
•研究中の候補薬の他の既存療法に対する潜在的優位性に対する臨床医および患者の見方は、私たちが調査している適応のために承認される可能性のある任意の新薬を含む
•患者の同意を得て維持する能力
•臨床試験に参加するための努力を促進し
•医者の患者の回診のやり方
•実験の主要な終点に必要な患者群の大きさと性質を分析した
•治療中および治療後に患者の能力を十分に監視する;
•臨床試験地点の近似性と潜在患者に対する可用性
•臨床試験に参加した患者が治療を完了する前に臨床試験を脱退するリスク;および
•将来的に患者、主要な研究者、スタッフ、または臨床場所の利用可能性の大流行を制限する可能性があるような、私たちは制御できない要素があるかもしれない。
患者募集の遅延はコスト増加を招く可能性があり,あるいは計画された臨床試験の時間や結果に影響を及ぼす可能性があり,これらの臨床試験の完了を阻止し,候補薬物開発を進める能力に悪影響を及ぼす可能性がある。さらに、臨床試験の開始遅延や完成を招く可能性のある多くの要素は、最終的に私たちの候補薬物が規制部門の承認を得ることを拒否される可能性もある。
臨床前研究或いは臨床試験の成功は未来の臨床試験の結果を予測できないかもしれない。
著者らの候補薬物の早期臨床前研究と臨床試験の陽性結果は必ずしも著者らの候補薬物の後の臨床前研究と任意の未来の臨床試験の結果を示唆するとは限らない。我々が現在の開発スケジュールに基づいて著者らが計画した候補薬物の臨床前研究と臨床試験を完成することができても、著者らの候補薬物のこのような臨床前研究と臨床試験の結果は後続の臨床前研究或いは臨床試験結果に複製されない可能性がある。もし私たちが今後の臨床前研究と未来の臨床試験でこれらの積極的な結果を複製できなければ、私たちは開発、監督部門の承認を得て、私たちの候補薬物を商業化することに成功できないかもしれない。例えば,EXS 21546の1/2期臨床試験を中止したが,候補薬がさらなる臨床開発が合理的であることを証明する十分な将来性がないことが示唆されたからである
製薬やバイオテクノロジー業界の多くの会社が早期開発に積極的な成果をあげた後,後期臨床試験で大きな挫折を経験し,類似した挫折に直面しないことは確認できない。その他を除いて,これらの挫折は,臨床試験が行われている間の臨床前や他の非臨床発見,あるいは前臨床研究や臨床試験で行われた安全性や有効性観察によるものであり,以前に報告されていない有害事象を含む。そのほか、臨床前、非臨床と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補薬物が臨床前研究と臨床試験で満足できると考えているが、しかし依然としてFDA或いは欧州委員会の許可を得られなかった。
また,我々が計画する可能性のある将来の臨床試験は“オープンラベル”試験設計を用いる可能性がある。オープンタグ“臨床試験”とは、患者および研究者の両方が、患者が研究候補薬または既存の承認薬またはプラセボを受け入れているかどうかを知っているかどうかを意味する。最も典型的なのは,開放ラベル臨床試験は研究候補薬物のみをテストし,異なる用量レベルで試験を行うことがある。開放ラベル臨床試験は様々な制限を受けており,これらの制限は任意の治療効果を誇張する可能性があり,開放ラベル臨床試験中の患者が治療を受ける際に知られているからである。オープンラベル臨床試験は“患者偏見”の影響を受ける可能性があり,すなわち患者が症状が改善したと考えているのは,実験的治療を受けていることを意識しているだけである。また,オープンラベル臨床試験は,“調査者偏見”の影響を受ける可能性があり,すなわち臨床試験の生理結果を評価·審査する人は,どの患者が治療を受けているかを知り,その知識を知っている場合に治療群の情報をより有利に解釈することが可能である。オープンラベル試験の結果は、我々の任意の候補薬物の将来の臨床試験結果を予測できない可能性があり、制御された環境でプラセボまたは能動対照を用いて研究を行う場合、われわれは開放ラベル臨床試験を含む。
著者らが時々発表或いは公表した臨床試験の一時、“背線”と初歩的なデータはより多くの患者データの獲得に従って変化する可能性があり、そして監査と検証手続きの制限を受け、これは最終データの重大な変化を招く可能性がある。
私たちは時々私たちの臨床試験の初歩的または主要なデータを公開するかもしれない。これらのデータは、当時利用可能なデータの予備分析に基づいて、特定の研究または試験に関連するデータをより全面的に検討した後、結果および関連する発見および結論が変化する可能性がある。私たちはまた、私たちのデータ分析の一部として、すべてのデータを全面的かつ詳細に評価する機会がないか、または受け取る機会がないかもしれないという仮説、推定、計算、および結論を出した。したがって、私たちの報告の裏線または予備結果は、同じ研究の将来の結果と異なる可能性があり、またはより多くのデータを受信して十分に評価されると、異なる結論または考慮要因がこれらの結果を合格させる可能性がある。バックラインデータも依然として監査と確認手続きの制約を受けており、これにより最終データと予備データに実質的な差が生じる可能性がある
前に出版されました。したがって、最終データが利用可能になる前に、バックラインデータは慎重に表示されなければならない。私たちはまた臨床試験の中間データを時々開示するかもしれない。私たちが完成する可能性のある臨床試験の中期データは、患者登録の継続とより多くの患者データの獲得に伴い、あるいは私たちの臨床試験の患者が彼らの疾患の他の治療を継続するにつれて、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクを受ける可能性がある。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。さらに、私たちまたは私たちの競争相手が中間データを開示することは、アメリカの預託証明書の価格変動を招く可能性がある。
もし私たちが報告した中期、主要または予備データが実際の結果と異なる場合、あるいは規制機関を含む他の人が結論に同意しない場合、私たちが承認を得て候補薬物を商業化する能力が損なわれる可能性があり、これは私たちの業務、財務状況、運営結果、および将来性を損なう可能性がある。さらに、開示された特定の臨床試験に関する情報を選択することは、通常、広範な情報に基づいており、あなたまたは他の人は、私たちが決定した重要な情報または他の適切な情報が私たちの開示に含まれることに同意しない可能性がある。
著者らの現在と未来の臨床試験或いは著者らの現在或いは未来の協力者の臨床試験は著者らの臨床前或いは非臨床研究に見られない重大な不良事件を掲示する可能性があり、そして安全状況を招く可能性があり、監督部門の許可或いは市場が私たちの任意の候補薬物を受け入れることを阻害するかもしれない。
いかなる製品の商業販売の監督管理の承認を得る前に、私たちは長い、複雑で高価な臨床前研究と臨床試験を通じて、私たちの候補薬物は各目標適応において安全かつ有効であることを証明しなければならない。臨床試験費用は高価であり,完成まで数年かかる可能性があり,その結果自体も確定していない。臨床試験を行う過程で,候補薬物は通常極めて高い流出率を有する。非臨床研究と初歩的な臨床試験で進展が得られたが、臨床試験後期段階の候補薬物も期待される安全性と有効性を示すことができない可能性がある。もし私たちが行っているあるいは未来の臨床前研究と臨床試験の結果が私たちの候補薬物の安全性と有効性に対して定説がなければ、もし私たちが統計的かつ臨床的意義のある臨床終点に達していなければ、あるいは私たちの候補薬物に関連する安全問題があれば、私たちはこのような候補薬物の発売承認を阻止または延期される可能性がある。ある場合、多くの要素のため、同じ候補薬物の異なる臨床試験間の安全性或いは有効性結果は有意差が存在する可能性があり、方案中に規定された試験プログラムの変化、患者群の大きさとタイプの差異、臨床試験方案の変化と遵守及び臨床試験参加者の退学率を含む。われわれはまだいくつかの候補薬の臨床試験を開始していないが,多くの腫瘍学的療法のように,これらの薬剤の使用に関連する副作用が出現する可能性が高い。我々の実験結果は副作用の重症度と一般性を示す可能性があり,これは受け入れられない。また,われわれの候補薬は標的毒性に関連する臨床試験で副作用を引き起こす可能性がある。標的毒性が観察された場合、または候補薬剤が予期しない特徴を有する場合、それらの開発を放棄する必要があるかもしれないし、その開発をより狭い用途または亜集団に制限する必要があるかもしれないが、これらの亜群では、リスク−収益の観点から、副作用または他の特徴がそれほど一般的ではなく、それほど深刻ではない、またはより容易に受け入れられるかもしれない。また,われわれの候補薬は,これまで観察されていなかった副作用を引き起こす可能性がある。将来の候補薬を開発し、1つ以上の既存の癌療法と組み合わせて使用することも可能である。われわれの候補薬と他の癌療法との併用による不確実性は,将来の臨床試験で副作用を正確に予測することが困難になる可能性がある。臨床試験を開始した候補薬剤の多くは製品として承認されていないし、現在あるいは未来のいかなる臨床試験も最終的に積極的な結果を示すことが保証されていない、あるいは私たちの任意の候補薬物の更なる臨床開発を支持する。
現在または未来の任意の臨床試験において重大な有害事象または他の副作用が観察された場合、患者を我々の臨床試験に参加することは困難である可能性があり、患者は私たちの試験から撤退する可能性があり、または1つまたは複数の候補薬剤の試験または私たちの開発努力を完全に放棄することが要求される可能性がある。我々、FDA、または他の適用可能な規制機関、またはIRBまたは倫理委員会は、そのような試験の対象が許容できない健康リスクまたは副作用に直面していると考えることを含む、様々な理由で候補薬剤の臨床試験を随時一時停止または終了することができる。早期試験で最初に治療の将来性を示した潜在療法のいくつかは,その後副作用が認められ,さらなる発展を阻害する。副作用が製品の発売承認の獲得や保持を妨げなくても,他の療法と比較して耐性があるため,副作用は承認された製品への市場の受け入れを阻害する可能性がある。どのような事態も、私たちの業務、財務状況、運営結果、将来性に実質的な損害を与える可能性がある。
GTAEXS 617を開発し,他の将来の候補薬を開発し,他の療法と組み合わせて使用することが可能であり,追加のリスクに直面するであろう。
現在承認されている1つまたは複数の癌療法と組み合わせてGTAEXS 617を開発する予定である。我々が開発した候補薬がこれらの既存療法との併用が承認された場合,FDAや同様の外国規制機関が我々の候補薬物と併用した治療法の承認を撤回する可能性があること,あるいはこれらの既存療法が安全性,有効性,製造または供給問題になる可能性があるリスクを負い続ける。他の薬剤や癌以外の適応と組み合わせて任意の候補薬を開発すれば,類似したリスクに直面する。これは私たち自身の製品が市場から撤退されたり、商業的にあまり成功しないことをもたらすかもしれない。
我々はまた、FDAまたは同様の外国規制機関の承認を得ていない1つまたは複数の他の癌療法と組み合わせて、他の候補薬剤を評価することも可能である。私たちはこのような癌療法と共同開発した候補薬をマーケティング·販売することはできません。単独でも私たちの製品と併用しても、これらの薬剤は最終的にマーケティング承認を得ることができません。また,未承認癌療法は,重篤な副作用が出現する可能性があること,臨床試験遅延,FDAや同様の非米国規制機関の承認の欠如など,我々が現在開発·臨床試験中の候補薬剤と同様のリスクに直面している。候補薬剤と組み合わせて評価する製品を選択すると、安全性、有効性、製造または供給の問題が生じ、そのような組み合わせの承認や販売が得られない可能性がある。
我々は現在,将来的には米国以外で候補薬物の臨床試験を行う可能性があり,FDAや類似の外国規制機関はこのような試験からのデータを受け入れない可能性がある。
我々は現在米国以外の場所で臨床試験を行っており,将来的には中国,オーストラリア,ヨーロッパ,アジアの他の地方や他の外国司法管轄区を含む米国以外の場所で臨床試験を行う可能性がある。FDAあるいは非アメリカ監督機関がアメリカ国外で行われた臨床試験を受ける試験データはある条件によって制限される可能性がある。米国国外で行われた臨床試験のデータが米国での上場承認の唯一の根拠となることを意図している場合、FDAは通常、(I)このデータが米国の人口および米国の医療実践に適用されない限り、(I)このデータが米国の人口および米国の医療実践に適用されない限り、(Ii)この試験は公認能力を有する臨床研究者によってGCP規定に従って行われる。および(Iii)データは、FDAによる現場検査を必要とすることなく、有効であると考えることができ、または、FDAがこのような検査を行う必要があると考えた場合、FDAは、現場検査または他の適切な手段によってデータを検証することができる。一般的に患者は
アメリカ国外でどんな臨床試験を行っている人たちは私たちがアメリカで候補薬物ラベルを貼りつけようとしている人たちを代表しなければならない。そのほか、十分な患者群と統計能力を含むFDAの臨床試験要求を満たさなければならない。多くの外国の規制機関もまた似たような承認要求を持っている。また、このような外国裁判は、裁判を行う外国司法管轄区域に適用される現地法によって管轄される。FDAや同様の外国規制機関が米国や適用司法管轄区域以外で行われた試験データを受け入れることは保証されない。FDAや同様の外国の規制機関がこのようなデータを受け入れない場合、追加の試験が必要になり、これは高価で時間がかかり、私たちの業務計画の様々な側面が遅延することになり、これは、私たちの候補薬が適用司法管轄区域で商業的な承認や許可を得ることができない可能性がある。
私たちは私たちのいくつかの候補薬のための孤児薬の指定を求めるかもしれないし、私たちは潜在的な市場排他性を含む孤児薬の指定に関連する利点を維持できないかもしれない。
私たちのビジネス戦略の一部として、私たちは私たちのいくつかの候補薬のために孤児薬の指定を求めるかもしれないが、この努力は成功しないかもしれない。米国やEUを含むいくつかの管轄区の規制機関は、患者数が比較的少ない薬物を孤児薬に指定する可能性がある。孤児医薬品法によれば、1つの薬剤がまれな疾患または疾患を治療するための薬剤である場合、FDAは、その薬剤を孤児薬として指定することができる。米国では、まれな疾患または疾患は、通常、年間患者数が20万人未満であるか、または米国では患者数が20万人を超えると定義されているが、米国では、薬剤の開発コストが米国の販売から回収されることは合理的に予想できない。米国では,孤児薬を指定することで一方が臨床試験費用,税収割引,ユーザ費用減免のために贈与資金を提供する機会などの財政的インセンティブを得る権利がある。
同様に、欧州連合(EC)第141/2000号条例では、欧州委員会は、欧州薬品管理局孤児薬物製品委員会の積極的な意見を受けた後、薬物の開発を促進するために孤児薬物の称号を付与することができ、スポンサーが証明できることを条件として、(1)この製品は、生命または慢性衰弱に危険な疾患を診断、予防または治療することを目的としている。(2)または(A)申請時に、この状況は、EUの10,000人当たり5人以下に影響を与え、または(B)孤児の身分が利益をもたらす製品がEUで十分な見返りを与えず、医薬製品を開発するための必要な投資が合理的であることを証明するのに十分ではない、(3)欧州連合が許可したこのような状況を診断、予防または治療するための満足できる認可方法がない、またはそのような方法があっても、製品はその状況の影響を受ける人に大きな利益を与えるであろう。孤児薬品指定は申請者に費用減免、方案援助、集中マーケティング許可手続きへの進入などの激励措置を得る権利がある。
一般に、孤児薬物の称号を有する候補薬剤がその後、米国またはEUでこのような称号を有する適応の最初の発売許可を得た場合、その薬剤は、限られた場合を除いて、一定期間内に市場排他期を得る権利があり、FDAまたは欧州委員会は、限られた場合を除いて、同じ薬剤および適応を承認することができない。EUでは、EMAは別のマーケティング許可申請を受け入れることができず、同様の製品の既存の許可を延長する申請を受け入れることもできない。適用期間はアメリカが7年、EUが10年だ。EUでは,発売許可所持者が関連して合意した小児科調査計画を遵守している薬品については,この10年の期限を2年間延長することができる。小児科研究をもとに追加保護証明書の延期を承認することはできません
孤児の症状。いかなる補充保護証明書も孤児の症状に関する小児科研究によって延期してはならない。孤児薬品指定は規制審査と承認過程でいかなる利点も伝達することはなく、監督審査と承認過程の持続時間を短縮することもない。5年目の終了時に、市場排他性がもはや合理的ではないように十分に利益がある場合、または疾患の流行率が閾値を超えている場合、欧州連合の専門期間を6年に短縮することを含む、孤児薬として指定された基準に適合しないと決定された場合
我々が薬物の孤児薬物排他性を獲得しても,この排他性は競合から効果的に保護できない可能性があり,異なる薬物が同じ条件で承認される可能性があるからである。孤児薬が承認された後であっても、FDAまたは欧州委員会(適用される場合)が、より安全で、より効果的であることが証明されているので、後者の薬物が臨床的に良いと結論付けられた場合、FDAおよび欧州委員会はその後、同じ疾患の治療を別の薬物で承認することができる。また,指定された孤児薬物が孤児指定の適応を得るよりも広い用途で許可されていれば,孤児薬物排他性を得ることはできない。さらに、FDAが後に指定要求に重大な欠陥があると判断した場合、米国における孤児薬の独占営業権を失う可能性がある。米国またはEUにおいて、製造業者は、このようなまれな疾患または疾患を有する患者の需要を満たすのに十分な数の薬剤を保証することができず、孤児の称号を失う可能性もある。孤児薬物を指定することは薬物の開発時間や監督審査時間を短縮することもなく、監督審査或いは承認過程において薬物にいかなる利点をもたらすこともない。私たちは私たちの候補薬のために孤児薬の名前を求めるかもしれないが、私たちは決してそのような名前を受け取っていないかもしれない。私たちが確かにこのような指定を受けても、私たちの製品が承認され、孤児指定の治療適応に使用される保証はありません。
私たちの候補薬物が規制部門の承認を得ても、私たちは持続的な規制義務と持続的な規制審査の制約を受けることになり、これは多くの追加費用を招く可能性がある。また、もし私たちの候補薬物が承認されれば、発売後の研究要求、マーケティングとラベル制限を受ける可能性があり、承認後に意外な安全問題が発見されれば、市場を呼び戻したり撤退したりする可能性もある。しかも、もし私たちが規制要求を守らなければ、私たちは処罰を受けたり、他の法執行行動を取るかもしれない。
FDAまたは同様の外国規制機関が私たちの任意の候補薬物を承認する場合、製品の製造過程、ラベル、包装、流通、輸入、輸出、有害事象報告、貯蔵、広告、販売促進、監視、および記録保存は、広範かつ持続的な規制要件を受けるだろう。これらの要求は、安全および他の上場後の情報および報告の提出、機関登録および上場、および現在の良好な製造規範またはCCMPを継続的に遵守すること、および私たちが承認後に行った任意の臨床試験のGCPを含む。また、製造業者は、品質管理および製造プロセスがcGMP法規および適用される製品追跡および追跡要求に適合することを確保することを含む、広範なFDAおよび同様の外国規制機関の要求を遵守しなければならない。候補薬物のために得られた任意の規制承認は、製品が発売される可能性のある承認指示用途の制限または承認条件によって制限される可能性があり、または第4段階の臨床試験、および製品の安全性および有効性を監視するモニタリングを含む可能性の高い発売後の研究要件を含む可能性がある。医師がその独立した医学的判断に基づいて、合法的に得られた製品を“ラベル外”に開くことができるにもかかわらず、FDAまたは他の規制機関によって承認されていない使用に使用することはできない。もし私たちが現在または未来の任意の候補薬の発売が承認され、私たちがこれらの製品のラベル外用途を不正に普及させることが発見されれば、私たちは重大な責任を負うかもしれない。FDAはリスク評価と緩和を要求する可能性もあります
私たちの候補薬剤を承認するための戦略、またはREMSは、薬物ガイドライン、医師コミュニケーション計画、または分配方法の制限、患者登録、および他のリスク最小化ツールのような安全な使用を保証する追加の要素を必要とする可能性がある。非アメリカ当局は似たような戦略を必要とするかもしれない。予想されていない深刻度または頻度の不良事象、または当社の第三者製造業者または製造プロセスを含む、以前に未知の製品問題が発見されたか、または規制要件を遵守できなかったことは、以下のような状況を引き起こす可能性がある
•製品の販売または製造を制限し、製品を市場からリコールするか、または自発的または強制的に製品をリコールすること
•生産遅延と供給中断、監督検査は救済が必要な違反を発見した
•ブロック警告を含む承認の用途を制限するか、または警告、禁忌症、または他のセキュリティ情報を増加させることを含む修正ラベル
•再生可能エネルギー管理制度を実施し対外戦略のようなものです配布または使用制限が含まれる場合があります
•この製品の安全性を評価するために、追加の発売後の臨床試験を行うことが要求される
•臨床試験が有効である
•罰金、警告状、または他の規制された法執行行動;
•FDAまたは同様の外国規制機関は、係属中の出願の承認または私たちが提出した承認された申請の追加を拒否するか、または承認を一時停止、変更、または撤回する
•製品を差し押さえたり差し押さえたり、製品の輸入または輸出を許可することを拒否したり;
•民事または刑事処罰を禁令または適用する。
FDAと他の規制機関の政策は変わる可能性があり、政府は追加的な法規を公布し、私たちの候補薬物に対する規制承認を阻止、制限、または延期するかもしれない
FDA、EU加盟国の主管機関、欧州医薬品局、欧州委員会、その他の臨床試験を担当する同様の規制機関の政策が変化する可能性があり、追加の政府法規が公布される可能性がある。例えば,EUの臨床試験に関する規制構造が最近変化している。EU臨床試験条例(CTR)は2014年4月に採択され、EU臨床試験指令が廃止され、2022年1月31日に施行された。CTRは、スポンサーが各EU加盟国の主管当局と道徳委員会に意見書を提出することを可能にし、各EU加盟国が決定を下すことを可能にする。臨床試験によって許可された評価手続きも統一されており、関連するすべてのEU加盟国による共同評価と、倫理的規則を含む各EU加盟国がその領土に関する具体的な要求を個別に評価することを含む。すべてのEU加盟国の決定は連合中央ポータルサイトを介してスポンサーに伝達される。臨床試験が承認されると,臨床研究開発は継続することができる。CTRは3年間の過渡期が予想される。進行中の臨床試験と新たな臨床試験がCTRによってどの程度制御されるかはそれぞれ異なる。2023年1月31日までに“臨床試験指令”により承認を申請した臨床試験については,2025年1月31日まで移行的に適用される。その時まで、行われているすべての裁判は拷問禁止条約の規定に制限されるだろう。関連する臨床試験申請がCTRに基づいて提出されている場合、または臨床試験が2025年1月31日までにCTRフレームワークに移行している場合、CTRはより早い日の臨床試験に適用される。我々と我々の第三者サービスプロバイダ(例えばCRO)がCTR要求を遵守することは、我々の開発計画に影響を与える可能性がある。
CTRが2022年1月31日に応用を開始したことを考慮すると、著者らはCTDによって監督管理の許可を得た臨床試験をCTRの監督管理枠組みに移行する必要があるかもしれない。2025年1月30日にEUで活動する少なくとも1地点の臨床試験では,CTDが管理する臨床試験をCTRに移行する必要がある。移行申請は臨床試験情報システムを介してEU加盟国の主管当局に提出し、関連する監督管理の承認を得る必要があり、2025年1月30日以降に臨床試験を継続することができる。これは財政、技術、そして人的資源を必要とするだろう。もし私たちが直ちに私たちの臨床試験に移行できなければ、これらの臨床試験の進行は負の影響を受ける可能性がある。
イギリスが未来にどの程度その法規をEUと統合することを求めているのかは不明だ。臨床試験に関連するイギリスの規制枠組みは、既存のEU立法(二次立法によってイギリス法で実施される)に由来する。2022年1月17日、イギリスの薬品と保健品監督機関(MHRA)はイギリスの臨床試験立法の再制定について8週間の相談を展開した。英国政府は2023年3月21日に諮問への対応を公表し、立法を早期に改正することを確認した。これによって生じた立法改正はイギリスの法規がCTRとどの程度一致するかを決定するだろう。イギリスはその法規をEUと緊密に結合することができず、イギリスでの臨床試験のコストに影響する可能性があり、および/あるいはイギリスで行われた臨床試験が同社の候補製品のためにマーケティング許可を求めることをより困難にする可能性がある。
また、2023年4月26日、欧州委員会は、既存の薬品立法を改正するための新たな指令·法規を提案する提案を採択した。提案の形で採択されれば、欧州委員会が最近提出した現行のEU医薬品認可法を改正する提案は、EUのデータと市場での私たちの製品候補製品の独占的な機会を減少させ、現在よりも早く模倣薬や生物類似製品の競争を受けるようにし、関連する精算状態も低下させる可能性がある。
また、2023年12月、EU議会と理事会は、EU人工知能の開発、市場投入、使用を規範化するための立法を導入することを目的とした“人工知能法案”について臨時合意に達した。もし採択されたら、私たちは人工知能法案の下で追加的な規制要求によって制限されるかもしれない。
もし私たちが既存の要求の変化に適応できない場合、あるいは新しい要求や政策を採用することができない場合、または規制コンプライアンスを維持できない場合、私たちは、私たちが獲得する可能性のあるマーケティング承認を得ることができない、または失う可能性があり、これは、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼすだろう。
一つの管轄区域で私たちの候補薬物の規制承認を獲得し、維持することは、他の管轄区域で私たちの候補薬物の規制承認を得ることができるという意味ではない。
私たちはアメリカ以外の国でマーケティング申請を提出するかもしれない。米国以外の管轄区の規制当局は候補薬物の承認に要求があり、私たちはこれらの管轄区が発売される前にこれらの要求を守らなければならない。外国規制の承認を得て外国の規制要求を遵守することは、私たちに大きな困難とコストをもたらす可能性があり、私たちの製品が特定の国/地域で発売されることを延期または阻止する可能性がある。もし私たちが国際市場の規制要求を遵守できず、および/または適用された上場承認を得られなければ、私たちの目標市場は減少し、候補薬物市場の潜在力を十分に発揮する能力は損なわれるだろう
1つの管轄区域で候補薬物の規制承認を獲得し、維持することは、他の管轄区域で規制承認を得ることができるか、維持できる保証はなく、1つの管轄区で規制承認を得ることができなかったり、遅延したりすることは、他の管轄区の規制承認過程に悪影響を及ぼす可能性がある。例えば、FDAが候補薬物の発売を許可しても、外国司法管轄区の比較可能な監督管理機関は候補薬物のこれらの国での製造、マーケティング、普及を許可しなければならない。承認手続きは司法管轄区域によって異なり、1つの管轄区で行われる臨床試験は他の管轄区の監督機関によって受け入れられない可能性があるため、米国と異なるか、または米国の要求と行政審査期限よりも大きい場合があり、追加の臨床前研究または臨床試験を含む。簡単に言うと、外国の規制承認過程はFDA承認に関連するすべての危険に関するものだ。米国以外の多くの管轄区では、候補薬物は精算承認を受けなければならず、この管轄区で販売が許可される。場合によっては、私たちが私たちの製品のために受け取ることを意図している価格も承認されるだろう。
私たちの業務に関わるリスク
候補薬剤を決定または発見する努力では成功しない可能性があり、より大きなビジネス機会またはより成功の可能性をもたらす可能性の高いレジメン、協力または候補薬剤を利用できない可能性がある。
新薬候補薬物の研究方案を確定するには大量の技術、財政と人力資源が必要である。私たちは臨床で開発された他の潜在的な候補薬を決定できないかもしれない。我々のプラットフォームを用いて内部開発のための候補薬を自分で発見することで,我々の有効性を証明することはできなかった。我々の資源が限られているため,我々の計算分析が実験分析に予測性を持つと考えられる目標に研究計画を集中させ,分子が薬物となるために必要な特性を持つ分子を理論的に発見する可能性や,有意義なビジネス機会が存在すると信じているなどの要因が理論的に発見される可能性があると信じている。現在,われわれの内部薬物発見計画の重点は腫瘍学,免疫学と抗ウイルス薬である。私たちは、いくつかの案、協力または候補薬を探す機会、または後により大きな商業的潜在力を有することが証明された適応を放棄または延期する機会があるかもしれない。しかし、私たちが追求している任意の候補薬の開発は、最終的には成功していないことが証明されるかもしれないし、より積極的な資本資源で追求される別の潜在的な候補薬の成功を選択するかもしれない。もし私たちがある候補薬剤の商業的潜在力を正確に評価しなければ、私たちは戦略的協力、パートナー関係、許可、または他の手配を通じてその候補薬剤に貴重な権利を放棄するかもしれないが、この場合、私たちは候補薬剤の独占的な開発と商業化の権利を維持することがより有利になる。あるいは,ある治療領域の候補薬に内部資源を割り当てることができ,その領域で協力した方が有利である。
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも製品の発見、開発、商業化に成功する可能性がある。
新薬品の開発と商業化競争は激しく、迅速かつ重大な技術進歩の影響を受けている。私たちは大手多国籍製薬会社、バイオテクノロジー会社、専門製薬会社からの競争に直面している。いくつかの大手製薬やバイオテクノロジー会社は現在、癌治療のための製品をマーケティング·販売しているか、候補薬を開発している。規模が小さい企業や初期段階の会社も可能です
それらは重要な競争相手であり、特に大手老舗会社との協力を通じて手配されていることが証明された。潜在的な競争相手はまた、学術機関、政府機関、その他の公共および個人研究機関を含む。
開発段階計画を持つ競争相手は、私たちよりも早くFDAや他の同様の規制機関から候補薬の発売承認を得ることができ、私たちが市場に参入できる前に、彼らは強力な市場地位を確立するかもしれない。さらに、私たちの競争相手は、私たちが開発する可能性のある任意の候補薬剤よりも効果的で、より効果的なマーケティングおよび販売またはコストの低い技術および製品の開発、獲得、または許可を成功させる可能性があり、これは、私たちの候補薬剤を競争力および時代遅れにさせ、私たちの競争相手が市場に入る前に製品または特定の適応のための強力な市場地位を確立することができるようになる可能性がある。
私たちの多くの競争相手は、単独でも、彼らの戦略的パートナーと一緒にも、私たちよりも多くの財力、技術、人的資源を持っている。したがって、私たちの競争相手は治療の承認を得て、広範な市場受け入れを得ることで、私たちよりも成功するかもしれません。これは、私たちの治療を時代遅れにしたり、競争力を欠いたりするかもしれません。バイオテクノロジーと製薬業界の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。これらの競争相手はまた私たちと競争して、合格した科学と管理者を募集と維持し、臨床試験地点と臨床研究の患者登録を確立する上で、そして著者らの計画と相互補完或いは必要な技術を獲得する面である。
いくつかの会社が人工知能や他の複雑な計算ツールを含めて様々な技術を使用して、薬物開発を加速し、決定された候補薬物の質を向上させることが知られている。これらの会社にはRelay Treateutics,AbCellera,Schrodinger,Recursion PharmPharmticals,PathAI,Insitro,Valo Health,Cellality,XtalPI,BenvolentAI,Datavant,ATOM WISEがある。
私たちはすでに研究開発に投資して、私たちの技術プラットフォームをさらに向上させるつもりだ。もしこのような投資の見返りが私たちの期待や発展速度よりも遅くなれば、私たちの収入と運営結果は影響を受けるかもしれない。
私たちは私たちの技術能力を利用して新薬を発見し、設立以来、私たちは研究と開発に投資してきて、私たちの技術プラットフォームをさらに強化するために投資を続ける予定です。これらの投資は、これらの投資に関連する費用が私たちの利益率および運営結果に影響を及ぼす可能性があること、およびこれらの投資が市場の他の選択に対して十分な技術的利点を生じない可能性があり、これは逆に、負債およびこれらの投資に関連する費用を相殺するために、生成された収入に影響を与える可能性があることを含む、多くの時間、リスク、および不確定要素に関連する可能性がある。技術と製品の発展に伴い、ソフトウェア業界の変化は迅速であり、これは私たちのプラットフォームが候補薬物を識別と開発する能力を他の技術とプラットフォームより低くする可能性がある。私たちは私たちの競争地位を維持して向上させるために、私たちの技術プラットフォームに大量の時間と資源を投入し続けなければならないと信じている。もし私たちがこれらの投資の期待収益を達成していなければ、もしこれらの収益の実現が延期された場合、あるいは私たちの技術が私たちが予想していたように薬物発見プロセスを加速できなければ、私たちの収入と運営結果は不利な影響を受けるかもしれない。
私たちは迅速かつ重大な技術変革に適応し、競争力を維持するために、競争相手が発売した新製品や新技術に反応しなければならない。
私たちのプラットフォームを使用して私たち自身の候補薬物を発見し、開発するほか、私たちは著しく強化され、発展していく業界標準を特徴とする業界で私たちの薬物発見解決策と能力を提供する。したがって、私たちと私たちの協力者の需要は急速に発展している。もし私たちが人工知能の分野を含めて新しい技術に適切に革新して投資しなければ、私たちのプラットフォームはそれほど競争力がなくなる可能性があり、私たちの協力者は私たちの競争相手が提供する新しい技術に転向したり、自分で薬物発見に従事したりするかもしれない。我々の多くのパートナーは,我々と協力するかどうかを決定するために初期時間投資を必要とするため,これらのパートナーが競争相手とパートナーシップや提携合意を達成すれば,ビジネス関係を再獲得することは困難である可能性があると考えられる.新しい解決策や技術改善がタイムリーに発売されなければ、私たちの製品は時間の経過とともに競争力を失う可能性があり、この場合、私たちの競争地位と運営結果が影響を受ける可能性がある。そのため、我々は大量の努力と資源を新技術と市場の開発と識別に集中し、人工知能薬物の発見と開発における私たちの能力と専門知識をさらに拡大し、深化させる。私たちが新しい革新的な技術や解決策をタイムリーに導入できなければ、パートナーの需要を十分に予測できない、あるいは必要な市場受容度を得ることができなければ、私たちの業務は影響を受ける可能性があり、私たちの運営結果は悪影響を受ける可能性がある。
著者らは薬物発見プラットフォームとプロセスの中で人工知能と機械学習(“AI/ML”)技術を採用と配備することは有効ではないかもしれず、そして私たちは操作挑戦、名声損害と法律責任に直面させる可能性がある。
私たちが競争する業界の特徴は技術の進歩が迅速で、新製品が絶えず発売され、競争が激しいことです。新薬の発見と新しい目標の実現は依然として私たちの成功に重要であるが、私たちの薬物発見プラットフォームでAI/ML技術を有効に実施することは私たちの業務の重要な要素であり、私たちの業務に著しいメリットを提供する可能性がある
多くの発展途上の技術と同様に,人工知能はリスクや挑戦をもたらし,さらなる開発,採用,利用に影響を与える可能性があるため,我々の業務,特にAI/ML技術の利用にともない我々の運営が重要になってきている.我々の人工知能アルゴリズムには欠陥があるかもしれないし,我々が使用しているデータセットが不足している可能性があり,品質が悪い,あるいは偏見のある情報が含まれている可能性があり,これは欠陥のある,偏見のある,不正確な結果を招く可能性がある.また,我々の人工知能アルゴリズムは未知の第三者知的財産権にある程度依存する可能性があり,我々が生成または求めた出力はこれらの権利を侵害する可能性があり,潜在的な法的リスクに直面する可能性がある.我々のシステムのデータ科学者、エンジニア、エンドユーザーの不適切または論争のあるデータやり方は、人工知能解決策に対する人々の受け入れを弱める可能性がある。これらの欠陥は人工知能アプリケーションによる決定、予測或いは分析を破壊し、私たちに法的責任を負わせ、ブランドや名声に損害を与える可能性がある。新たに出現した倫理問題はAI/ML技術の使用をめぐり,AIベースの技術を有効にあるいは提供すれば,これらの技術がヘルスケア取得,プライバシー,あるいは他の社会問題への影響で議論され,名声や法的リスクに直面する可能性がある
AI/ML技術や関連方法を用いて薬物発見を行う他社からの日々の激しい競争に直面しており、その中には私たちよりも多くの資源を持っており、私たちよりも効果的な方法が開発されているかもしれません。これは、潜在的な目標の識別や協力者との協力の効率を低下させる可能性があります。AI/ML技術が成功しても、適応を正確に認識し、研究開発資源を効率的に割り当てることができない可能性がある
これは私たちのパイプラインと効果的な競争の能力に悪影響を及ぼすかもしれない。
人工知能/ML技術は比較的に新しい技術であり、その使用、商業化と監督管理に関する商業、法律と道徳構造はまだ確定されておらず、絶えず発展している。AI/ML技術に関連する法律規制制度の不確実性は、新しいまたは急速に変化する米国および非米国の法律および法規に適合するために、ビジネス実践を修正および維持するための大量のリソースを必要とする可能性がある。イギリス、EU、アメリカのある州を含む世界のいくつかの司法管轄区域はすでに人工知能/MLの開発と使用を管理する法律を制定、あるいは検討している。イギリスでは、政府は、責任あるAI/MLの開発と使用を指導し、告知するために、既存の規制機関に何らかの具体的な原則を実施するように呼びかける白書を発表した。EUでは、規制当局は“人工知能法案”のテキストについて政治的合意に達しており、この法案が可決され発効すると、すべてのEU司法管轄区に直接影響を与え、人工知能関連システムの使用に重い義務を課す可能性がある。他の法ドメインは、類似またはより限定的な立法によって決定される可能性があり、これは、このような技術の使用を挑戦的にする可能性がある。
私たちはクラウドベースのインフラの第三者プロバイダに依存して、私たちのソフトウェア解決策を管理しています。これらのサード·パーティ·プロバイダが運営する任意の中断、容量制限、または私たちの使用への干渉は、当社のビジネス、財務状態、運営結果、および将来性に悪影響を及ぼす可能性があります。
我々は,我々のホストソフトウェア解決策に関連するほとんどのインフラストラクチャを第三者ホストサービスにアウトソーシングする.ソフトウェアソリューションをホストするお客様は、中断や性能を低下させることなく、いつでも当社のコンピューティングプラットフォームにアクセスでき、正常な実行時間に関するサービスレベルの約束を提供する必要があります。我々のホスト·ソフトウェア·ソリューションは、サード·パーティ·ホスト·サービス·ホストを保護する仮想クラウドインフラストラクチャに依存し、方法は、その構成、アーキテクチャ、機能、および相互接続仕様を維持し、第三者インターネットサービスプロバイダによって送信されるこれらの仮想データセンターに格納された情報を維持することである。当社の第三者信託サービス能力のいかなる制限も、新規顧客の受け入れを阻害したり、既存の顧客の利用能力を拡大したりする可能性があり、これは、当社の業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。さらに、ネットワーク攻撃、自然災害、気候変動、火災、洪水、深刻な嵐、地震、停電、電気通信障害、テロ、または他の攻撃、および私たちが制御できない他の同様のイベントによって引き起こされる可能性のある任意の影響は、私たちの第三者ホスト·サービスインフラのイベントが、クラウドベースの解決策に悪影響を及ぼす可能性があります。上記の任意の理由により、クラウドベースの解決策に影響を与える長期サービス中断は、お客様にサービスを提供する能力に悪影響を与え、既存および潜在的な顧客における私たちの名声を損なう可能性があり、私たちに責任を負わせ、お客様を失ったり、他の方法で私たちの業務を損害したりする可能性があります。私たちはまた、代替デバイスを使用したり、当社が使用するサード·パーティ·ホスト·サービスを損なうイベントを準備または対応するために他の行動をとることによって、重大なコストを生じる可能性があります。
第三者ホストサービスとのサービスプロトコルが終了したり、サービス中断、私たちが使用しているサービスまたは機能がキャンセルされたり、インターネットサービスプロバイダ接続が中断されたり、そのような施設が破損したりする場合には、私たちのプラットフォームへのアクセスの中断、および新しい施設およびサービスの手配または作成および/または異なるクラウドインフラストラクチャサービスプロバイダ上での配備のための私たちのホストソフトウェア解決策の再構築の大きな遅延および追加料金に遭遇する可能性があり、これは、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。
我々の技術プラットフォームの欠陥や中断は、このようなプラットフォームを使用して発見された候補薬物の需要を減少させ、私たちの収入を減少させ、私たちに重大な責任を負わせる可能性がある。
私たちが私たちの薬物発見プラットフォームを有効に配置できるかどうかは、私たちのソフトウェア及び関連ツールと機能の持続、有効かつ信頼できる運行にかかっている。私たちの技術的プラットフォームは本質的に複雑で、欠陥や誤りを含むかもしれない。我々の技術プラットフォームにおいて、新しいソフトウェアアプリケーションを初めて導入した場合、または既存のソフトウェアアプリケーションの新しいバージョンまたは拡張機能を使用した場合、エラーのリスクが特に顕著である。私たちは時々私たちのソフトウェアの欠陥を発見して、未来に私たちの既存のソフトウェアの新しいエラーを検出するかもしれません。私たちの技術プラットフォームの任意のミス、欠陥、中断、または他の性能問題は、私たちの薬物発見プロセスの有効性に悪影響を与え、私たちの薬物発見と協力スケジュールを延期し、私たちの名声を損なうか、あるいは私たちの協力者の業務を損なう可能性がある。もし上記のいかなる事件が発生したら、私たちの協力者は私たちへの支払いを遅延或いは差し止め、私たちとの合意を取り消し、更新しないことを選択して、私たちにサービス信用クレーム、保証クレーム或いは他のクレームを提出して、私たちは未来の収入を損失する可能性があります。これらのすべての事件の発生は、私たちの技術プラットフォームとそのようなプラットフォームを介して発見された任意の候補薬物の需要の減少、私たちの収入の減少、訴訟費用、または重大な責任の増加をもたらす可能性がある。
私たちの候補薬物の市場機会は、私たちが予想していたより小さいかもしれない、または以前の治療を受ける資格がない患者または以前の治療を通過できない患者に限られる可能性があり、ターゲット患者群の流行率の推定は正確ではないかもしれない。
著者らは現在と未来の目標患者集団は候補薬物が解決可能なあるタイプの癌の発病率或いは流行率に対する著者らの信念と推定に基づいており、これらの推定は科学文献と臨床調査を含む各種の源から来ている。私たちの予測は間違っていることが証明される可能性があり、潜在的な患者の数は予想を下回るかもしれない。私たちの候補薬のためにかなりの市場シェアを得ても、潜在的なターゲット群が少ないかもしれないので、規制部門の他の適応の承認を得なければ、私たちの候補薬を一線治療と二次治療に使用することを含めて、私たちは決して利益を達成しないかもしれない。
癌療法は治療経路(1線,2線,3線など)を特徴とすることがあり,FDAは通常最初に1つまたは複数の特定経路に対する新しい療法のみを承認する。癌が十分に早く発見された時、第一線の治療は治愈を必要とすることなく、癌を治癒したり、生命を延長するのに十分であることがある。第一線の治療が成功しないことが証明された場合、通常は化学療法、抗体薬物、腫瘍標的小分子、ホルモン治療、放射線治療、手術あるいはこれらの療法の組み合わせであり、二次治療が実施される可能性がある。二線治療は、一般に、より多くの化学療法、放射線、抗体薬物、腫瘍標的小分子、またはこれらの薬剤の組み合わせを含む。三線治療は化学療法、抗体薬物と小分子腫瘍標的治療、より侵襲性のある手術形式と新しい技術を含むことができる。私たちは最初に、他の承認治療に失敗した患者の治療のための二線または三線療法として、私たちのいくつかの候補薬の承認を求める予定だ。その後,十分有益であることが証明された候補薬については,もしあれば,二次治療や潜在的な一次治療としての承認を求めたいが,我々の候補薬が三次治療のために承認されても,二次治療や一次治療のために承認される保証はない。また,現在または将来の候補薬が潜在的な二線または一線療法として承認される前に,追加の臨床試験を行わなければならないかもしれない。
私たちが現在あるいは未来の候補薬物が監督部門の許可を得ても、これらの製品は医者、患者、病院、癌治療センターと医学界の他の人の市場受け入れを得ることができないかもしれない。
人工知能、機械学習および他の技術に基づくプラットフォームを用いて化合物と分子を発見し、最適な候補薬物を開発設計することは依然として新しい現象である;そのため、このような過程を通じて生成された候補薬物は医師、患者、病院と医学界の他の人に広く受け入れられない可能性があり、適切な監督当局の許可を得てマーケティングと販売に使用されてもよい。もし私たちの現在の任意の計画または任意の未来の候補薬が規制部門の承認を得て、これらの候補薬が十分な市場受容度を得ていなければ、私たちは利益を達成することを阻止または大幅に延期されるかもしれない。候補薬が承認されれば様々な要因の影響を受けることになります
•私たちの候補薬物の臨床試験における有効性、および任意の適用当局が適応を承認することを要求すれば、私たちの候補薬物は他の既存療法と比較して患者に増加した健康利益を提供する能力を提供する
•潜在的な製品責任クレーム
•医師、病院、患者は私たちの候補薬が安全で有効な治療選択であると考えている
•対象患者群が新たな療法を試みる意欲と,医師がこれらの治療法を処方する意欲
•私たちの候補薬の副作用の流行率と重症度は
•FDAまたは他の非米国規制機関の製品ラベルまたは製品挿入要件;
•FDAまたは他の非米国規制機関によって承認されたラベルに含まれる制限または警告;
•現在および将来の治療代替案に関連する治療コスト;
•私たちの製品の定価と保証範囲と第三者支払人と政府当局の十分な補償
•第三者支払者や政府当局に保険がない場合、患者は自己負担を希望する
•現在と未来の代替療法や競争療法と比較して、相手の便や飲みやすい薬を含む
•私たちの販売とマーケティング努力の有効性。
もし私たちの候補薬物が承認され、市場から受け入れられたとしても、私たちの製品よりも人気があり、費用効果があり、あるいは私たちの製品を時代遅れにする新製品や技術を発売すれば、時間の経過とともに市場受容度を維持することができないかもしれない。
私たちまたは私たちが依存している第三者が業務運営を持っている地域では、健康流行病の影響は、私たちの臨床前研究および臨床試験、ならびに私たちのCROまたは私たちと業務往来のある他の第三者の業務または運営を含む私たちの業務に悪影響を及ぼす可能性があります。
私たちの臨床試験場所や他の業務運営が集中している地域では、私たちの業務は衛生流行病の悪影響を受ける可能性があり、私たちが依存している第三者メーカーやCROの運営が深刻に中断される可能性があります。
我々は、隔離、配置、または同様の政府命令を理解していない、またはこのような命令、閉鎖または他の業務運営の制限が発生する可能性があると考えており、新しい新冠肺炎変種または他の感染症に関連していても、イギリスおよび他の国/地域の第三者製造工場の人員、または材料の利用可能性またはコストに影響を与え、それによって私たちのサプライチェーンを乱す可能性がある。また、私たちの業務運営、臨床前研究、臨床試験は
他の大流行の影響を受け、著者らの臨床試験における患者の募集、治療と維持の遅延或いは困難を含む。
私たちは過去と将来、他の会社や技術を買収する可能性があり、これは私たちの経営陣の関心を分散させ、私たちの株主の株式をさらに希釈し、他の方法で私たちの運営を混乱させ、私たちの経営業績に悪影響を及ぼすかもしれません。
2021年8月、我々は精密薬物バイオテクノロジー会社Allcell GmbHまたはAllcellの100%流通株を買収した。買収完了後、Allcellはグループの完全子会社AlphaexScience a Beteiligungs GmbHと合併し、合併後の実体はExScience a GmbHと改称される。私たちは将来、より多くの業務、解決策、または技術を買収または投資することを求めることができ、これらの業務、解決策、または技術は、私たちの解決策を補完または拡張し、私たちの技術能力を強化したり、成長機会を提供することができると思います。潜在的買収の追求は経営陣の注意をそらす可能性があり、これらの買収が完了しているか否かにかかわらず、適切な買収を決定、調査、求める際に様々な費用が発生する可能性がある。
私たちの新しい事業の買収についての経験は限られています。もし私たちが未来にもっと多くの事業を買収すれば、私たちはこのすべての挑戦に再び直面するだろう。いかなる買収後も、取引が合理的であることを証明するために、予想される相乗効果を達成することは保証できません。これは、多くの要素が含まれているからです
•得られた技術またはサービスを利益を得るために利益を得ることができない
•購入に関する費用が発生する
•買収に関連した意外なコストや負債
•買収された企業の会計制度、業務、人員の統合が困難である
•買収された企業のレガシー製品およびホスト·インフラをサポートすることに関連する困難および追加費用
•買収された企業の顧客を収入、許可、サポート、または専門サービスモデルの違いを含む、買収された企業の解決策と契約条項に変換することは困難である
•経営陣の関心を他の業務から移す
•事業パートナーと顧客との既存の業務関係に対する買収の悪影響
•重要な従業員の潜在的な流出
•私たちの業務の他の部分に必要な資源を使用して
•私たちが使える現金の大部分を使って買収を完成させる。
また、我々が買収した会社の買収価格の大部分は、買収された営業権や他の無形資産に分配される可能性があり、これらの資産は少なくとも毎年減値評価を行わなければならない。将来、私たちの買収に予想されるリターンが生じなければ、この減価評価過程に基づいて私たちの経営業績を計上することが要求されるかもしれません。これは私たちの経営業績に悪影響を及ぼす可能性があります。
買収は株式証券の希釈発行や債務の発生を招く可能性もあり、我々の経営業績に悪影響を及ぼす可能性がある。また、買収された企業が私たちの予想に達しなかった場合、私たちの業務、財務状況、運営結果、見通しが影響を受ける可能性があります。
私たちの臨床試験と製品責任訴訟は私たちの資源を移転し、私たちが重大な責任を負い、そして私たちの候補薬物の商業化を制限する可能性がある。
我々は,臨床試験における候補薬物試験に関連する固有の臨床試験や製品責任曝露のリスクに直面しており,我々が開発可能な任意の製品を商業化販売すれば,より大きなリスクに直面するであろう。現在、商業販売のための製品は承認されていませんが、現在と将来の臨床試験で候補薬を使用し、将来的にどの承認された製品を販売するかは、私たちを責任クレームに直面させる可能性があります。これらのクレームは、その製品を使用する患者、ヘルスケア提供者、製薬会社、またはそのような製品を販売する他の人によって提起される可能性がある。もし私たちが自分自身を弁護することに成功できなければ、私たちの候補薬や製品が損傷を与えたと主張すれば、私たちは重大な責任を負うだろう。是非曲直や最終結果にかかわらず、賠償責任は
•承認されれば候補薬の需要が減少します
•私たちの名声とメディアの深刻な否定的な関心を損なう
•臨床試験参加者の脱退
•関連訴訟を正当化するための巨額の費用
•実験参加者や患者に多額の報酬を与え
•収入損失
•経営陣の資源を減らして業務戦略を推進する
•私たちの候補薬を商業化することはできない。
臨床試験を拡大したり、任意の候補薬物の商業化を開始することに伴い、私たちは私たちの保険カバー範囲を増加させる必要がある。成功した臨床試験または製品責任クレームまたは一連のクレームが、保険されていない負債または保険を超える負債によって私たちに提起された場合、私たちの資産はそのようなクレームを支払うのに十分ではない可能性があり、私たちの業務運営は損害を受ける可能性がある。
私たちの保険証書は高くて、いくつかの商業リスクから私たちだけを保護して、これは私たちを重大な未保険債務に直面させます。
私たちは私たちの業務で遭遇する可能性のあるすべての種類のリスクに保険をかけません。そして私たちの保険証書は制限と重大な賠償免除額があります。私たちが現在維持しているいくつかの保険書は臨床試験、製品責任、一般責任、財産、就職及び役員と役人保険を含む。
私たちの既存の保険範囲と未来に得られる任意の追加の保険範囲は、私たちが受ける可能性のある費用や損失を補償するのに十分ではないかもしれない。しかも、保険範囲はますます高くなっており、私たちは合理的なコストや十分な金額で保険範囲を維持して、私たちを損失から守ることができないかもしれない。いかなる重大な未保険責任も私たちが多額の金額を支払う必要があるかもしれません。成功した責任クレームや一連のクレームの判決が私たちの保険範囲を超えていれば、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性があります。
協力者や他の第三者に関連するリスク
我々の薬物発見協力者は協力プロジェクトの臨床開発において大きな裁量権を持っている。もし私たちの協力者が私たちの協力協定に規定された義務を履行できなければ、私たちの業務に負の影響を与えるかもしれません。私たちは私たちの薬物発見協力に資源を投資する見返りを決して達成しないかもしれない。
我々は,我々の技術プラットフォームを用いて薬物発見と開発に従事する協力者とともに薬物発見に従事している。このような協力者たちは商業化前のバイオテクノロジー会社と大手製薬会社を含む。これらの協力者と薬物発見を行う際には,特定の開発,薬物発見目標の規制と商業販売マイルストーンおよび潜在的な特許使用料を実現する際にオプション費用,現金マイルストーン支払いを得る権利がある契約を締結した。時々、私たちは私たちの薬に入って協力者を発見するかもしれない。
私たちの薬物発見協力は候補薬物の開発や商業化を招くことがなく、このような選択費、マイルストーン支払い、特許権使用料を適時に受け取ることができ、あるいは全く起こらないかもしれない。私たちの薬物発見協力者は、任意の候補薬物の開発と商業化を完了する過程で追加のコストが発生したり、遅延に遭遇したり、最終的には達成できない可能性がある。また,薬物発見協力からリターンを実現する能力は,以下のリスクの影響を受ける
•薬物発見協力者は、彼らが私たちの協力に適用する努力と資源の数と時間を決定する上で大きな裁量権を持っており、予想通りに彼らの義務を履行しないかもしれない
•薬物発見協力者は、オプション費用、マイルストーン支払いまたは特許権使用料を得る権利がある任意の候補薬剤を開発または商業化してはならない、または臨床試験または他の研究の結果、協力者の戦略的重点または利用可能な資金の変化または外部要因(例えば、買収)に基づいて、開発または商業化計画を継続または延長しないことを選択することができる
•薬物発見協力者は記念碑的支払いの臨床試験を遅らせることができるかもしれません
•薬物発見協力者はいつ私たちの協力状態を発表するかを決定する上で大きな裁量権があり、臨床前と臨床発展及び協力計画の推進に関するスケジュールを含む
•私たちは、私たちのパートナーが開発または商業化している候補薬物に関するいくつかの情報を取得または開示することができないか、または制限される可能性があり、したがって、このような協力下でのマイルストーン支払いまたは使用料の状況および可能性について、私たちの株主および米国預託株式保有者に通知する能力は限られている可能性がある
•薬物発見協力者は、第三者開発と直接または間接的に任意の候補薬物と競合する製品を独立して開発または間接的に開発することができ、協力者が競争製品がより経済的に魅力的な条項で商業化される可能性があると考えている場合、記念碑的支払いまたは印税の製品を得る権利がある
•私たちの薬物発見との協力で発見された候補薬は、私たちの協力者によって彼ら自身の候補薬物や製品と競争するとみなされるかもしれません。これは、私たちの協力者がこのような候補薬物の商業化への資源投入を停止させる可能性があります
•既存の薬物発見協力者と潜在的な未来の薬物発見協力者は、特に内部薬物発見計画を推進する際に、私たちとの既存の協力や私たちとの新しい協力を継続したくないかもしれない
•薬物発見協力者は候補薬物や製品の開発、製造、流通、マーケティングに関する適用法規の要求を遵守できない可能性があり、これは私たちがマイルストーン支払いを得る能力に影響を与える可能性がある
•知的財産権または特許権、契約解釈または第一選択の開発プロセスにおける相違を含む薬物発見協力者との相違は、マイルストーン支払いを得る資格のある候補薬物の研究、開発または商業化の遅延または終了、または訴訟または仲裁を引き起こす可能性がある
•薬物発見協力者は、私たちの知的財産権または固有の権利を正確に取得、維持、強制実行、保護することができないか、または紛争や法的手続きを引き起こす可能性がある方法で私たちの固有の情報を使用して、私たちまたは彼らの知的財産権または固有の情報を危険にさらしたり、私たちと彼らを潜在的な訴訟に直面させたりする可能性がある
•薬物発見協力者は、第三者の知的財産権または独自の権利を侵害、流用または他の方法で侵害する可能性があり、これは、私たちを訴訟および潜在的な責任に直面させる可能性がある
•薬物発見協力は私たちが協力から何か重要な価値を得る前に終わるかもしれない。
もし私たちが参加した任意の薬物発見協力が薬物製品の開発と商業化につながっていなければ、私たちにオプション費用、マイルストーン支払い、または特許権使用料を受け取ることができなければ、私たちは薬物発見協力に投資した資源から満足できるリターンを達成できないかもしれない(あれば)。また,薬物発見協力が最初にマイルストーンを達成し,費用を支払っても,そうし続けることはできないかもしれない。
もし私たちが内部で発見された任意の候補薬剤を開発し、商業化するために、パートナー関係を構築または維持することができなければ、これらの候補薬剤の開発と商業化計画を変更しなければならない可能性があり、私たちの業務は悪影響を受ける可能性がある。
著者らは百時美施貴宝会社(Bristol Myers Squibb Company、BMYと略称する)などのパートナーと密接に協力し、薬物発見計画を開発と推進し、発見段階を超え、臨床前研究或いは人体臨床試験に入る。候補薬物のビジネス価値を最大化するのに役立つと信じている場合には,将来のパートナーに依存して内部で発見された候補薬を開発し,潜在的に商業化することが予想される。私たちはこれらの活動のために適切な協力者を探す上で激しい競争に直面しており、いくつかのより成熟した会社も同じ或いは類似の候補薬物の開発と商業化を行っているかもしれない。これらの老舗会社は私たちより競争優位があるかもしれません。それらの規模、財務資源及びもっと多くの臨床開発と商業化専門知識のためです。しかも、協力の交渉と記録は複雑で時間がかかる。我々がこのような協力について最終的な合意に到達するかどうかは,他に加えて,協力者の資源や専門知識の評価,提案協力の条項や条件,提案された協力者のいくつかの要因の評価に依存する.これらの要因は、前臨床研究および臨床試験の設計または結果、FDAまたは米国国外の同様の規制機関によって承認された可能性、候補薬物の潜在的市場、そのような候補薬物の製造および患者への提供のコストおよび複雑さ、競合製品の潜在性、技術所有権の不確実性、挑戦の利点を考慮せずにこのような所有権に挑戦する場合、存在する可能性のある不確実性、および一般的な業界および市場状況を含むことができる。協力するための候補薬や類似の適応を代替する技術も考えられ,そのような協力は我々との協力よりも候補薬の方が魅力的であるかどうか。
もし私たちが適時に、受け入れ可能な条項で、あるいは適切な協力者と合意できない場合、私たちは候補薬物の開発を削減し、その開発計画や私たちの1つ以上の他の開発計画を減少または延期し、あるいは私たちの支出を増加させ、自費で開発または商業化活動を行わなければならないかもしれない。もし私たちが自分で開発や商業化活動を支援し、負担することを選択すれば、私たちはより多くの専門知識と追加的な資本を得る必要があるかもしれないが、これらは私たちが受け入れられない条項や根本的には得られないかもしれない。もし私たちが失敗したら
必要な開発や商業化活動を行うのに十分な資金や専門知識がなければ、候補薬剤をさらに開発したり、市場に出したりすることはできないかもしれない。
最近、私たちの収入は限られた数の協力者に依存しており、いずれの損失も私たちの業務に悪影響を及ぼす可能性がある。
ここ数年間、限られた数の協力が私たちの収入の大きな部分を占めている。2023年12月31日までの1年間、私たちのパートナーは私たちの収入の72%を占め、もう1人のパートナーはまた25%を占めた。これらの協力は契約下の多くの案をカバーしているため、下流の潜在的価値の大きな部分を占めている。したがって、もし私たちが私たちの協力者との関係を維持できなかった場合、あるいは私たちのどの協力者も彼らの計画を停止すれば、私たちの将来の運営結果は実質的な悪影響を受けるかもしれない。
私たちは薬物発見協力者への株式投資から絶対に報われないかもしれない。
私たちはすでに決定して、未来に私たちの薬物に投資することを決定して協力者を発見するかもしれない。私たちは薬物発見協力者への株式投資から絶対に報われないかもしれない。私たちが株式を持っている薬物発見協力者はいずれも薬物製品の商業販売から収入を得ていない。したがって、それらは優遇条件で資金を獲得して経営を継続することに依存する。さらに、もし私たちが株式を持っている薬物発見協力者が追加の資本を調達した場合、私たちはこれらの薬物に対する協力者の所有権権益と制御程度が希釈され、私たちが十分な資源があり、さらなる投資を選択しない限り、または私たちの株式投資に契約逆希釈保護を提供することに成功した。私たちの任意の協力者への株式投資の財務成功は、公募株、買収、あるいは私たちの保有株式価値の増加を反映する有利な市場事件のような流動性イベントに依存する可能性が高い。公開·買収の資本市場は動的であり、わが持分を保有する会社で流動性事件が発生する可能性が著しく悪化する可能性がある。また,既製の市場データが不足しているため,個人持株会社の評価自体が複雑である.もし私たちがこのような会社でのいかなる投資も価値低下を経験していると判断すれば、私たちは減価を記録する必要があるかもしれません。これは私たちの財務業績にマイナスの影響を与えるかもしれません。私たちが薬物発見協力者の中で持っているすべての持分は私たちの投資の一部または全部の損失のリスクに直面している。
第三者と契約を結び,臨床前開発や臨床試験のための候補薬を生産し,事業化を継続する予定である。このような第三者への依存は、許容可能なコストで十分な数の候補薬剤または製品またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止、または損害する可能性がある。
私たちは現在所有したり運営したりしていないし、未来にどんな製造施設や人員を設立する計画もない。私たちは依存し、引き続き第三者に依存して私たちの候補薬を生産し、臨床前開発と臨床試験のために、そして私たちの候補薬が発売承認されれば、私たちの製品の商業製造に使用することが予想される。このような第三者への依存は、すなわち、このような生産の進行、時間、および完了の直接制御が少ないため、許容可能なコストまたは品質で十分な数の私たちの候補薬剤または製品またはそのような数の薬剤を供給することができなくなり、これは、私たちの開発または商業化努力を延期、阻止または損害する可能性がある。
私たちの契約メーカーが私たちの候補薬物を生産するための施設は、FDAと非アメリカ規制機関が承認前検査に基づいて検査しなければなりません。これらの検査は、私たちがFDAと非アメリカ規制機関にマーケティング申請を提出した後に行われます。私たちは候補薬物の生産過程を制限し、私たちの契約メーカーに依存してcGMPを遵守し、彼らはこれらのcGMPを守らなければならない。もし私たちの契約メーカーが私たちの規格やFDAまたは他の非米国規制機関の厳格な規制要件に適合した材料を生産することに成功しなければ、彼らは規制検査および/またはその製造施設の規制適合性を維持することができないだろう。また、私たちの契約メーカーが十分な品質管理、品質保証、合格者の能力を維持する制御は限られています。FDAや同様の外国の規制機関が、これらの施設に欠陥があることを発見した場合、またはこれらの施設を承認して私たちの候補薬物を生産しない場合、またはそれが欠陥を発見したり、将来的にそのような承認を撤回したりすれば、代替製造施設を探す必要があるかもしれません。これは、私たちが規制機関の承認を得たり、私たちの候補薬を販売したりする能力に深刻な影響を与えます。私たちまたは私たちの契約製造業者、任意の未来の協力者、およびその契約製造業者は、cGMPに適合することを監督し、確保するために、FDAまたは他の非米国当局の定期的な抜き打ち検査を受ける可能性がある。規制適合性の審査と検証に努めているにもかかわらず、我々の1つ以上の第三者製造サプライヤーは、FDAまたは他の非米国当局の規制検査でcGMP規定に適合していないことが発見される可能性がある。私たちまたは私たちの第三者製造業者が適用された法規を遵守できなかったことは、第三者サプライヤーを閉鎖すること、または薬品ロットまたはプロセスを無効にすること、警告または無見出し手紙、臨床封印、罰金、禁止、民事処罰、遅延、一時停止、必要な承認(上場承認を含む)、販売許可証の取り消し、候補薬物または製品の差し押さえまたはリコール(承認された場合)、運営制限、刑事起訴など、私たちの業務および候補薬物の供給(承認された場合)に大きな悪影響を及ぼす可能性がある。
私たちは第三者製造業者とどんな合意にも到達できないかもしれないし、受け入れられる条項でそうすることもできないかもしれない。第三者製造業者と合意できても、第三者メーカーに依存することは、上記のようなリスクをもたらす
•第三者に依存して規制コンプライアンスと品質保証を行う
•第三者は製造協定に違反する可能性がある
•第三者が生産した欠陥製品や候補薬品がわが社のブランドの名声に損害を与えた
•私たちのビジネス秘密およびノウハウを含む私たちの固有情報を盗用する可能性があります
•第三者は、費用が高い場合、または私たちに不便をもたらした場合に、プロトコルを終了または更新しない可能性がある。
私たちの候補薬物と私たちが開発する可能性のあるどの製品も、他の候補薬や承認された製品と生産施設を競争する可能性があります。CGMP法規の下で運営されているメーカーの数は限られており、私たちのために製品を製造する能力があるかもしれない。これらの第三者製造業者はまた、私たちの競争相手を含む他の商業エンティティと関係がある可能性があり、彼らはまた、これらのエンティティのためにいくつかの製品および/または候補薬剤を生産する可能性があり、これは、私たちを代表する彼らのパフォーマンスに影響を与える可能性がある。
私たちの既存または未来のメーカーのどんな業績失敗も、臨床開発やマーケティング承認を延期する可能性がある。現在の契約製造業者が合意通りに履行できない場合、これらの製造業者の交換を要求される可能性があり、これは、追加のコストを発生させ、そのような交換のいずれかを決定して同定する際にさらに遅延する可能性があります。新しい第三者が仕事を始める時、自然な過渡期があり、これは遅延を招き、それによって私たちの能力に実質的な影響を与える可能性がある
私たちの製品と候補薬を生産する予定のスケジュールを満たしています。また、メーカーの変化は通常、製造プロセスやプロセスの変化に関連しており、これは、臨床試験で使用されている以前の臨床供給と任意の新しいメーカーの供給との間の過渡的な研究が要求されるかもしれない。臨床用品の比較可能性の証明には成功しない可能性があり,追加の臨床試験が必要かもしれない。
私たちが現在と未来に他人に依存して私たちの候補薬物や製品を生産していることを考慮して、もしこれらの第三者が彼らの契約義務や義務を成功的に履行できない場合、あるいは予想の最終期限内に完成できなければ、もし彼らが交換する必要がある場合、あるいは彼らが得た臨床データの品質や正確性が私たちの臨床方案や法規の要求や他の理由に従わなかった場合、私たちの財務業績と私たちの候補薬物の商業的見通しが損なわれ、私たちのコストが増加する可能性があり、私たちの収益能力が延期される可能性がある。
第三者によるGTAEXS 617の臨床試験を行い,将来的には第三者による臨床試験を行う予定である。もしこれらの第三者が契約義務を履行せず、規制要求を守らない、あるいは予想される期限までに完成しなければ、私たちは規制部門の私たちの候補薬物の承認を得ることができないか、あるいは商業化することができず、私たちの業務は実質的に損害を受ける可能性がある。
私たちは独立して臨床試験を行うことができない。私たちは依存し、そして引き続き医療機関、臨床研究者、契約実験室、協力者と他の第三者、例えばCROに依存して、私たちのGTAEXS 617臨床試験を含む私たちの候補薬物の臨床試験を協力する予定である。私たちはまた学術と個人の非学術機関に依存して、私たちの候補薬物に関する臨床試験を行って賛助することも可能である。研究者が支援する試験の設計または進行を制御することはできず、FDAまたは非米国規制機関は、任意の1つまたは複数の理由(試験設計または実行の要素、安全問題、または他の試験結果を含む)のために、これらの研究者が支援する試験は、我々によっても第三者によって制御されても、将来の臨床試験に十分な支援を提供できないと考えられるかもしれない。
このような第三者配置は、調査員が支援する実験に関するいくつかの情報権を提供することができ、調査員によって支援された実験によって生成されたデータにアクセスし、使用し、参考にすることを含む、私たち自身の規制届出を含む。しかし,研究者が試験のデータを賛助する時間や報告を制御することはなく,研究者が試験を支援するデータを持つこともない。研究者が後援した試験結果を確認したり複製したりできなければ,陰性結果が得られれば,我々の候補薬物のさらなる臨床開発の推進をさらに延期または阻止する可能性がある。また,研究者や機関が候補薬物の臨床開発に関する義務に違反している場合,あるいは,我々がスポンサーや研究者の後援を行う試験によって得られる可能性のある第1の知識と比較してデータが不十分であることが証明された場合,我々自身が将来の臨床試験を設計し,行う能力が悪影響を受ける可能性がある。
私たちは非常に依存し、引き続き第三者に依存して私たちの候補薬物のための臨床試験を実行し、そのため、彼らの活動のいくつかの側面だけを制御する責任があるが、私たちはすべての臨床試験が適用された方案、法律と法規の要求、そして科学的基準に従って行われることを保証する責任があり、私たちのCROへの依存は私たちの監督責任を軽減しない。私たちの臨床試験中のいかなる法律および法規に違反した行為についても、私たちは刑事起訴までの民事処罰を含む可能性がある警告状または法執行行動を受ける可能性があります
著者ら、著者らの主要な研究者と著者らのCROはGCPを含む臨床試験結果を行う、モニタリング、記録と報告する法規を遵守しなければならず、データと結果が科学的信頼性と正確性を持つことを確保し、そして試験患者が臨床試験に参与する潜在リスクを十分に理解し、彼らの権利を保護することを確保しなければならない。これらの法規は、FDA、欧州経済地域、またはEEA諸国の主管当局、および同様の非米国規制機関によって、臨床開発中の任意の製品に対して実行される。FDAと非アメリカの監督管理機関は定期的に臨床試験スポンサー、主要な研究者と試験地点を検査することによってGCP法規を実行する。もし私たち、私たちの主要な研究者、または私たちのCROが適用されたGCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれませんが、FDAまたは同様の非米国規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。FDAまたは非アメリカ規制機関が検査後に私たちの将来の任意の臨床試験がGCPに適合しているかどうかを確認することは保証できません。また,われわれの臨床試験はcGMP規定により生産された候補薬剤を用いて行わなければならない。私たちの主要な研究者やCROがこれらの規定を遵守できなかったかどうかは、私たちが臨床試験を繰り返す必要があるかもしれません。これは規制の承認過程を延期し、法執行行動の影響を受ける可能性もあります。米国では,行われている臨床試験を一定期間登録し,完成した臨床試験結果を政府助成データベースClinicalTrials.govに発表することも求められている。似たような登録と透明性要件はアメリカ以外の地域に適用される可能性がある。そうしないと罰金、否定的な宣伝、そして民事と刑事制裁につながるかもしれない。
GTAEXS 617の1/2期臨床試験を設計し,他の候補薬のための将来の臨床試験を設計する予定であるが,CROはすべての臨床試験を支援することが予想される。したがって、私たちの発展方案の多くの重要な方面に対する直接制御は限られている可能性があり、その行為とタイミングを含む。われわれ自身に完全に依存している従業員と比較して,第三者による将来の臨床試験への依存も臨床試験により開発されたデータ管理の直接制御が少ない。外部の当事者とのコミュニケーションも挑戦的である可能性があり、ミスや協調活動の困難を招く可能性がある。外部の当事者は
•人員配置が困難である
•契約義務を履行しない者
•規制コンプライアンスの問題に直面しています
•優先順位が変化したり、財務的苦境に陥ったりする
•実体との関係を構築し、その中のいくつかは私たちの競争相手かもしれない。
これらの因子は第三者の臨床試験の意思や能力に重大な悪影響を与える可能性があり、著者らのコントロール範囲を超える意外なコスト増加に直面する可能性がある。もし首席研究者やCROが満足できる方法で臨床試験を行わなかった場合、彼らの私たちの義務に違反したり、規制要求を遵守できなかった場合、私たちの候補薬物の開発、規制承認、商業化が遅れる可能性があり、私たちは規制承認を得られず、私たちの候補薬物を商業化することができないかもしれません。あるいは私たちの開発計画は重大で不可逆的な損害を受ける可能性があります。もし私たちの主要な研究者やCROが収集した臨床データに依存できなければ、私たちが行った任意の臨床試験の規模を繰り返し、延長または増加させる必要があるかもしれないが、これは商業化を著しく延期し、支出を著しく増加させる必要があるかもしれない。
もし私たちがこのような第三者首席調査員やCROとの任意の関係が終わったら、私たちは調査員やCROの代わりに手配することができないかもしれない。主要な研究者またはCROが彼らの契約義務または義務を履行していない場合、または予想される期限内に完了していない場合、彼らが交換する必要がある場合、または彼らが取得した臨床データの品質または正確性が、私たちの臨床方案、法規の要件、または他の理由を遵守できないことによって損害を受けた場合、任意のこのような臨床試験
首席研究者またはそれに関連するCROは延長、延期、または終了される可能性があり、私たちは規制部門の私たちの候補薬物の承認を得ることができないか、または商業化に成功するかもしれない。したがって、私たちの財務業績と私たちの候補薬のテーマ適応におけるビジネスの将来性が損なわれ、私たちのコストが増加する可能性があり、私たちの収益能力が遅れる可能性があると考えられる。
私たちが候補薬物で使用する活性医薬成分の供給に依存する第三者は私たちの唯一の供給源であり、これらのサプライヤーのいずれかを失っても私たちの業務を損なう可能性がある。
我々の候補薬物に使用されている活性医薬成分や原料薬の多くは単一由来の供給者から提供されている。著者らは私たちの候補薬物の開発に成功し、最終的に市場需要を満たすために十分な数量の商業製品を提供することができるかどうかは、ある程度私たちが法規の要求に基づいてこれらの製品の原料薬を獲得する能力があるかどうかに依存し、そして臨床試験と商業化に十分な数量がある。私たちは現在、どのような原料薬の既存の供給者がいかなる理由で運転を停止させる場合にも、そのような原料薬を供給する余分または第2の供給源は何もない。変化するグローバル経済状況や潜在的なグローバル健康問題が第三者サプライヤーやメーカーにどのように影響するかも予測できません。このような事件は、当社の第三者サプライヤーおよび製造業者にいかなる負の影響もまた、当社の運営結果または財務状況に悪影響を及ぼす可能性があります。
私たちのすべての候補薬剤について、新薬申請(NDA)をFDAに提出する前に、および/またはEMAに上場許可申請(MAA)を提出する前に、より多くの製造業者を識別および資格してそのような原料薬を提供する予定である。しかし、私たちの単一ソースサプライヤーが私たちの製品に対する需要を満たすことができるかどうかは、私たちがこれらのサプライヤーと合意した性質のためか、私たちとこれらのサプライヤーとの限られた経験のせいか、あるいは私たちの顧客としてのこれらのサプライヤーに対する相対的な重要性のためである。過去の表現によると、私たちは彼らが未来に私たちの需要を満たす能力を評価することが難しいかもしれない。私たちのサプライヤーは過去に彼らの製品に対する私たちの需要を適時に満たすことができますが、彼らは将来私たちの需要を彼らの他の顧客に従属するかもしれません。
必要に応じて、私たちの候補薬剤で使用される原料薬のための追加的または置換された供給業者を確立することは、すぐには完了しないかもしれない。もし私たちが代替サプライヤーを見つけることができれば、その代替サプライヤーは合格を必要とし、追加の規制検査または承認が必要になる可能性があり、これはさらなる遅延を招く可能性がある。私たちは候補薬物に使用される原料薬の十分な在庫を維持することを求めているが、いかなる構成要素や材料供給の中断や遅延、あるいは私たちは許容可能な価格で代替源からこのような原料薬を得ることができず、私たちの開発努力を阻害、遅延、制限、または阻止する可能性があり、これは私たちの業務、運営結果、財務状況、および将来性を損なう可能性がある。
私たちはCROによって発見された治療可能性のある分子を合成しますもしこれらの組織が私たちの供給要求を満たすことができなければ、どの候補薬の開発も延期される可能性がある。
我々は現在,我々が発見した治療可能性のある分子を合成するために第三者に依存し続けていると予想されている。第三者に依存することは私たち自身が分子を合成するのとは違う危険に直面させるかもしれない。もしこれらの第三者が規制要求に従って契約職責の履行に成功し、期待された期限内に分子を完成または合成できなかった場合、もし私たちとこれらの当事者との間に食い違いがある場合、あるいはこれらの当事者が生産能力を拡大できない場合、私たちは環境や気候変化などの他の要素によって十分な候補薬物の生産を満たしたり遅延したりして、私たちの供給要求を満たすことができない可能性がある。これらは
施設はまた、洪水や火災、あるいは地政学的事態の発展など、自然災害の影響(気候変動によるか否かにかかわらず)の影響を受ける可能性があり、またはそのような施設は、そのような施設の監督検査後に汚染や規制上の懸念が生じるなど、生産問題に直面する可能性がある。この場合、適切な代替第三者施設を見つけ、契約関係を確立する必要があるかもしれませんが、これは既製品または許容可能な条項で提供されていない可能性があり、追加の遅延および増加した費用をもたらし、私たちの業務に実質的な悪影響を及ぼす可能性があります。
生産能力制限または原料または原料薬市場の遅延または中断のため、我々または任意の第三者も、我々が発見する可能性のある臨床前研究または臨床試験に必要な数の任意の分子を合成するのに必要な原材料または原料薬の不足に遭遇する可能性がある。原材料や原料薬があっても、私たちは許容可能なコストや品質で十分な量を得ることができないかもしれない。私たちまたは第三者が、私たちが発見する可能性のある十分な数の分子を合成するのに必要な原材料または原料薬を得ることができない場合、私たちの開発努力を遅延、阻害、または損害し、私たちの業務に重大な悪影響を及ぼす可能性がある。
知的財産権に関するリスク
もし私たちが既存の知的財産権許可協定や任意の未来の知的財産権許可下の義務を履行できなかった場合、あるいは私たちと現在または任意の未来の許可者との業務関係が妨害された場合、私たちは私たちの業務に重要な知的財産権を失う可能性がある。
私たちは複数のライセンス協定に署名し、これらの合意に基づいて、いくつかの特許、ソフトウェアコード、およびソフトウェアプログラムの独占的および非独占的なグローバルライセンスを取得し、当社のソフトウェアソリューションのマーケティングおよび販売に関するライセンス技術を複製、使用、実行、複製、運営、再ライセンスおよび配布し、改善した。私たちの現在のライセンス契約と、私たちの将来のライセンスは私たちに特定の特許権料と他の義務を課すと予想されています。
私たちが最善を尽くしたにもかかわらず、私たちは現在または未来の許可者が結論を出すかもしれません。私たちは彼らとのライセンス合意に深刻に違反しているので、ライセンスプロトコルを終了し、既存のソフトウェアソリューションのマーケティングと販売を遅延させ、これらのライセンスプロトコルがカバーする技術を開発および商業化するための新しいソフトウェア解決策の能力を遅延させる可能性があります。これらの内部許可が終了された場合、または基礎知的財産権が予想される排他性を提供できなかった場合、競合他社は、我々と同様の製品および技術を販売する可能性がある。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
ライセンス契約によると、以下の側面を含む知的財産権紛争が発生する可能性がある
•ライセンス契約に従って付与された権利の範囲および解釈に関する他の問題;
•私たちの技術およびプロセスは、ライセンス契約に拘束されていないライセンス側の知的財産権をどの程度侵害しているか
•特許および他の権利は、任意の協力開発関係の下で再許可される
•私たちの現在または未来のライセンス者と、私たちと私たちの協力者は、知的財産権によって生成された発明および独自技術の発明および所有権を共同で創造または使用する
•特許技術発明の優先権。
また,ライセンスプロトコルは複雑であり,このようなプロトコルのいくつかは様々な解釈の影響を受ける可能性がある.可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利の範囲を縮小するか、または関連する合意の下で私たちの財務または他の義務であると考えられる私たちの義務を増加させるかもしれません。例えば、私たちの相手側は過去に支払い義務に基づいて彼らの借金を議論していましたが、今後も議論される可能性があります。私たちが許可している知的財産権をめぐる紛争が、ビジネス的に許容可能な条項で現在の許可スケジュールを維持する能力を阻害したり、損害を与えたりすれば、新しいソフトウェアソリューションの開発と商業化、既存のソフトウェアソリューションをマーケティングおよび販売する能力に遅延が生じる可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性があります。
既存または将来の薬物発見協力協定に基づく義務は、我々の業務に重要な知的財産権を制限する可能性がある。さらに、既存または将来の協力協定の下での義務を履行できなかったり、以前、現在、または未来のパートナーとの業務関係が妨害された場合、私たちは私たちの業務に非常に重要な知的財産権を失う可能性があります。
私たちはバイオ製薬会社と協力して合意する側であり、協定によると、薬物発見サービスを提供していますが、協力によって生じるいくつかの知的財産権には所有権がないか、あるいは共同所有権のみです。私たちは将来的に追加的な協力協定を締結するかもしれませんが、合意によると、私たちは未来の協力によって生じるいくつかの知的財産権に所有権がないか、または共通の所有権しか持っていないかもしれません。私たちが以前、現在、または未来の協力によって生成されたこのような知的財産権の所有権または許可を得ることができず、私たち自身の独自技術または候補薬物と重複または関連している場合、私たちの業務、財務状況、運営結果、および見通しは深刻な損害を受ける可能性がある。
私たちの既存の協力協定は、特定の期間内に特定の目標に対して私たちの協力者のために化合物を設計することを要求するいくつかの排他的義務を含む。我々の将来の協力協定は,このような協力のテーマである将来の協力者に目標(S)に関する類似排他的権利を付与する可能性がある.このような既存または未来の協力協定は私たちに職務調査義務を強要するかもしれない。例えば、既存または将来の協力協定は、私たちが開発および商業化できないように、自分または他の現在または未来のパートナーのための薬物開発目標を追求することを制限するか、または他の現在または未来のパートナー、候補薬剤、および薬物開発目標に関連する技術と共同開発および商業化することができないかもしれない。私たちが最善を尽くしたにもかかわらず、私たちの以前、現在、または未来の協力者は、私たちが協力協定に深刻に違反していると結論を出すかもしれない。これらの協力協定が終了した場合、または私たちがその所有権や許可を持っている範囲内で、基礎知的財産権は予想される排他性を提供できなかった場合、競争相手は規制部門の承認を求め、私たちと同じ製品や技術を市場に出す権利があるだろう。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
協力協定によると、知的財産権に関する論争が発生する可能性がある:
•協力協定に従って付与された所有権または許可の範囲および説明に関連する他の問題;
•私たちの技術および候補薬物は、協力によって生成されるか、または生じる知的財産権をどの程度侵害しているのか、私たちはこのような協力協定の下で所有権やライセンスを持っていない
•協力協定の下の知的財産権および他の権利の譲渡または転任;
•協力協定の下での私たちの職務義務と、どのような活動がこれらの職務義務を満たしているのか
•私たちは、現在または未来の協力者と共同で知的財産権を創造または使用することによって生成された発明およびノウハウの発明および所有権を有する。
また、協力協定は複雑であり、このようなプロトコルのいくつかの条項は様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連知的財産権に対する私たちの権利と考えられる範囲を縮小するか、または関連協定の下での私たちの義務を増加させる可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性があります。さらに、我々が協力協定に従って所有、共同所有、または許可を得る知的財産権紛争が、商業的に許容可能な条項で現在の協力計画を維持する能力を阻害または弱化させた場合、影響を受ける技術または候補薬剤の開発に成功し、商業化することができない可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性がある。
もし私たちの技術および候補薬物のために特許保護を獲得、維持、実行、保護することができない場合、または取得した特許保護範囲が十分でなければ、私たちの競争相手は私たちと類似または同じ技術および製品を開発し、商業化する可能性があり、私たちの技術および候補薬物の開発と商業化に成功する能力は不利な影響を受ける可能性がある。
私たちの成功は、私たちが単独で他人と共同で所有する可能性のある知的財産権の保護を獲得し、維持する能力があるかどうか、または私たちが開発した任意の独自技術および候補薬剤について米国および他の国から他人の許可、特に特許を得ることができるかどうかに大きく依存する。私たちは、私たちの技術および私たちが開発する可能性のある私たちの業務に重要な任意の候補薬物に関する特許出願を米国および海外に提出し、私たちの技術および候補薬物に関連する知的財産権を付与することによって、私たちの独自の地位を保護することを求めている。もし私たちが任意の特許技術または候補薬物の特許保護を獲得または維持できない場合、私たちの業務、財務状況、運営結果、および見通しは実質的な損害を受ける可能性がある。
特許訴訟過程は高価で、時間がかかり、複雑であり、私たちは合理的なコストまたはタイムリーな提出、起訴、維持、弁護、またはすべての必要または望ましい特許出願を許可することができないかもしれない。我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.さらに、場合によっては、私たちは、第三者と共同で所有する技術、または第三者から取得された許可を含む、特許出願の準備、提出および起訴を制御する権利がないか、または特許を維持、実行および擁護する権利がないかもしれない。したがって、これらの共同所有および許可された特許および出願は、私たちの業務の最良の利益に適合する方法で準備、提出、起訴、維持、弁護、実行されてはならない。
ソフトウェアや生物製薬会社の特許地位は通常高度に不確定であり,複雑な法律や事実問題に関連しており,近年多くの訴訟の対象となってきた。また、米国以外の特許保護範囲は不確定であり、米国以外の国の法律は米国の法律のように私たちの権利を保護できない可能性があり、その逆も同様である。所有および許可された特許権については、我々および我々の許可者が現在求めている特許出願が、任意の特定の司法管轄区域で特許として発行されるかどうか、または任意の発行された特許の権利主張が競争相手の攻撃から十分な保護を提供するかどうかを予測することはできない。さらに、私たちは、私たちの技術に関連する可能性のあるすべての第三者知的財産権または既存技術を知らないかもしれません
プラットフォーム、他の技術、そして私たちが開発する可能性のある任意の候補薬。さらに、科学文献における発見発表は、実際の発見よりも遅れがちであり、米国および他の司法管轄区域の特許出願は、通常、優先権出願を提出してから18ヶ月後に発表されるか、または場合によっては全く発表されない。したがって、私たち、私たちの協力者、または私たちのライセンシーは、私たち、私たちの協力者、または私たちの許可者が、私たちが現在または将来私たちが所有している特許および特許出願で主張される発明の最初に提出された発明であるかどうか、または私たち、私たちの協力者または私たちのライセンス者が、そのような発明のために特許保護を申請した最初の人であるかどうかを正確に知ることができない。したがって,我々が所有,共有,許可された特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.さらに、私たちの所有、共同所有、および許可の保留および将来の特許出願は、私たちの技術および候補薬剤の全部または一部を保護するために、または他社が競争技術および製品を商業化することを効果的に阻止するために、特許の発行を招くことができないかもしれない。米国および他の国/地域特許法または特許法解釈の変化は、私たちが所有している、共同所有または許可されている現在または未来の特許の価値を低下させる可能性があり、また、私たちの特許権を獲得、保護、維持、擁護、実行する能力は、私たちの特許保護範囲を縮小し、より広く言えば、私たちの特許権の価値に影響を与えるか、または縮小する可能性がある。例えば,最高裁の最近の裁決は,米国が特許保護を受ける資格がある主題の範囲を縮小し,それ以来,多くのソフトウェア特許が抽象概念に関連して無効と宣言されている.
私たちの臨時特許出願に基づいて保護を求めるためには、適用される期限までに特許協力条約出願、非米国出願、および/または米国非仮特許出願を提出する必要がある。上述したように、その時点でも、私たちの特許出願は決して特許を発行しない可能性があり、または任意の特許の範囲が競争優位性を提供するのに不十分である可能性がある。
さらに、私たち、私たちの協力者、または私たちの許可者は、第3の方向の米国特許商標局またはUSPTOが既存技術の事前発表を提出したり、反対、派生、撤回、再検討に参加したりする可能性がある各方面間任意の審査、認可後の審査または妨害は、私たちの特許権または他の人の特許権に挑戦します。このような提出、訴訟、または訴訟における不利な裁決は、私たちの特許権の範囲を縮小したり、無効にしたり、第三者が私たちの技術または候補薬物を商業化し、私たちに支払うことなく、直接私たちと競争することを可能にする可能性があります。もし私たちが所有している、共同所有または許可されている現在または未来の特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が私たちと協力し、現在または将来の技術または候補薬剤を許可、開発、または商業化することを阻止するかもしれない。
また、特許出願において要求されるカバー範囲は、特許発行前に大幅に縮小することができ、その範囲は特許発行後に再解釈することができる。私たちが所有し、共同所有し、許可している現在および未来の特許出願が特許として発行されていても、それらの発表形態は、競争相手が私たちと競争することを防止し、または他の方法でいかなる競争優位性を提供してくれるのか、何の意味のある保護も提供してくれないだろう。特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有し、許可された特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。このような挑戦は、排他的損失または特許主張の全部または部分的な縮小、無効、または実行不能をもたらす可能性があり、これは、他人が類似または同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または私たちの技術および候補薬剤の特許保護期間を制限する可能性がある。最終的な結果が私たちに有利であっても、このような訴訟は巨額のコストを招く可能性があり、私たちの経営陣や従業員に時間がかかる必要がある。特に,新薬候補薬の開発,試験,規制審査に要する時間を考慮すると,これらの候補薬物を保護する特許は,これらの候補薬物の商業化前または直後に満了する可能性がある。さらに、我々の競争相手は、同様の技術または代替技術または製品を非侵害的に開発することによって、私たちが所有している、共通して所有している、または許可されている現在または将来の特許を回避することができるかもしれない。だから私たちの
所有、共同所有、許可された現在または将来の特許の組み合わせは、他社が私たちの任意の候補技術および薬物と類似しているか、または同じ技術および製品を商業化することを排除するために、十分な権利を提供してくれないかもしれない。
米国や他の管轄地域の特許法の変化は,特許の全体的な価値を低下させ,製品を保護する能力を弱める可能性がある。
“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った各当事者間の関係審査と派生手続き。他の特許性要件を満たしていると仮定すると,2013年3月までは,米国では,最初に発明して保護された発明を要求した者が特許を有しているが,米国以外では,最初に特許出願を提出した者が特許を有している。2013年3月以降、“ライシー·スミス法案”(Leahy-Smith Act)によれば、米国は先に出願を提出する制度に移行し、この制度の下で、特許性の他の法定要件が満たされたと仮定すると、最初に特許出願を提出した発明者は、第三者が最初にその発明を発明した者であるか否かにかかわらず、発明の特許を取得する権利がある。したがって、Leahy-Smith法案およびその実施は、私たちの特許出願をめぐる起訴および私たちが発行された特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。
また,ソフトウェア,生物製剤,薬品の開発と商業化における会社の特許地位は特に不確定である。米国最高裁判所の最近の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。この一連の事件は特許取得後の有効性と実行可能性の面で不確実性をもたらしている。米国議会、連邦裁判所、および米国特許商標局の将来の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、私たちの特許権および私たちの将来の特許権の保護、擁護、執行能力に実質的な悪影響を及ぼす可能性がある。
米国最高裁判所が最近裁決したいくつかの案件は、要求された主題が他の新規性および創造性を有するか否かにかかわらず、抽象概念、自然規則、自然現象および/または自然製品の権利要件を引用していつ特許を取得する資格があるかどうかに関連する。これらの案件への対応として,連邦裁判所は多くの特許が主題が特許保護資格を満たしていないと主張して無効であると判断した。また,米国特許商標局は,これらのケースを試験にどのように適用するかに関する指導意見を視察隊に発表した。このような決定のすべての影響はまだ明確ではない。
我々が将来の特許を取得する能力に関する不確実性の増加に加えて,このような事件の結合は,いったん特許を取得する価値に関する不確実性をもたらしている.議会、連邦裁判所、および米国特許商標局のこれらおよび他の決定によると、特許を管理する法律および法規は変更されるか、または予測不可能な方法で解釈される可能性があり、これは私たちが新しい特許を得る能力を弱めるだろう
特許や未来に私たちに発行される可能性のある任意の特許を強制的に執行する。
私たち、私たちの以前、既存、または未来の協力者、ならびに私たちの既存または未来のライセンシーは、私たちの特許または他の知的財産権を保護または実行する訴訟に巻き込まれるかもしれません。これは高価で、時間がかかり、成功しないかもしれません。
競争相手および他の第三者は、私たち、以前、現在、および将来のパートナー、または私たちの現在および未来の許可者の発行された特許または他の知的財産権を侵害、流用または他の方法で侵害する可能性がある。したがって、私たち、以前、現在、または将来の協力者、または私たちの現在または将来の許可者は、権利侵害、流用、または他の知的財産権に関するクレームを提出する必要があるかもしれません。これは高価で時間がかかるかもしれません。私たちは侵害者と思われるいかなるクレームに対しても、私たちが侵害、流用、あるいは他の方法で彼らの知的財産権を侵害していると主張するように、このような当事者に反訴を促す可能性がある。さらに、特許侵害訴訟では、このような当事者は、私たちまたは私たちの許可者が主張する特許が無効であるか、または実行不可能であると主張することができる。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.この仕組みには再審査、贈与後審査、各当事者間の関係審査、介入訴訟、派生訴訟、および非米国司法管轄区域の同等の訴訟(例えば、反対訴訟)。法的に無効と実行不可能と断言された後の結果は予測できない。
このような訴訟のいずれかの不利な結果は、私たちが所有している、共同所有または許可されている1つまたは複数の現在または未来の特許を無効または狭義に解釈されるリスクに直面させる可能性があり、私たちが所有している、共同所有または許可されている任意の現在または未来の特許出願が、発行された特許を生成できないリスクに直面させる可能性がある。裁判所はまた、我々が所有している、共通して所有している、または許可されている現在または将来の特許がそのような技術を含まないので、訴訟において第三者が論争のある技術を使用することを阻止することを拒否することができる。さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟では、私たちのいくつかの機密情報または商業秘密が開示によって漏洩される可能性がある。上記のいずれの条項も、第三者が非侵害的な方法で競争技術と製品を開発および商業化することを可能にし、私たちの業務、財務状況、運営結果、および将来性に重大な悪影響を及ぼす可能性がある。
第三者によって引き起こされる、私たちまたは私たちのライセンシーによって提起された、または米国特許商標局によって発表された干渉または派生プログラムは、我々の特許または特許出願に関連する発明の優先権を決定するために必要である可能性がある。不利な結果は、関連技術の使用を停止すること、または勝利者から許可権を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条項で私たちに許可を提供しない場合、あるいは私たちに許可を全く提供しない場合、あるいは非排他的な許可が提供され、私たちの競争相手が同じ技術を獲得した場合、私たちの業務は損なわれる可能性がある。私たちの訴訟、介入、または派生訴訟の弁護は失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。また,訴訟に関連する不確実性は,臨床試験に必要な資金を調達し,我々の研究計画を継続し,第三者から必要な技術許可を得たり,開発協力を行ったりして,任意の候補薬剤を市場に出す能力に大きな悪影響を与える可能性がある。
第三者は、私たちが知的財産権を侵害、流用、または他の方法で侵害したことを告発する法的訴訟を提起する可能性があり、その結果は不確実であり、私たちの業務成功に実質的な悪影響を及ぼす可能性がある。
私たちのビジネス成功は、私たちと私たちの協力者が開発、製造、マーケティング、および私たちが開発する可能性のある任意の候補薬剤を開発、販売する能力、および私たちの協力者、顧客、およびパートナーが第三者の知的財産権および独自の権利を侵害、流用、または他の方法で侵害することなく、私たちのノウハウを使用する能力に依存するだろう。ソフトウェア、製薬、そしてバイオテクノロジー産業では、かなり多くの特許と他の知的財産権訴訟がある。私たちは私たちの技術や候補薬物に関連する知的財産権対抗手続きや訴訟の当事者になるか、妨害手続き、許可後の審査、各方面間米国特許商標局の審査及び派生手続、並びに欧州特許庁の反対意見のような米国司法管轄区域でない類似手続。我々が開発候補を求める分野には,第三者が所有する米国と非米国が発行する特許や係属中の特許出願が多く存在する.バイオテクノロジーや製薬業界の拡張や特許の発行に伴い、我々が識別可能な技術または候補薬剤が第三者特許権侵害の告発を受けるリスクが増加する可能性がある。
提訴や論争のある訴訟手続きの法的敷居が低いため,勝訴確率の低い訴訟や訴訟手続きが提起される可能性があり,弁護には大量の資源が必要である.訴訟と論争のある訴訟手続きはまた高価で時間がかかるかもしれないが、私たちのこのような訴訟手続きの中の相手は私たちよりも多くの資源を投入してこのような法的行動を起訴する能力があるかもしれない。いずれかの候補薬が商業化に近づき,上場企業に関するより大きな知名度を得るにつれて,このような訴訟や訴訟に巻き込まれるリスクが増加する可能性がある。第三者は、既存の特許または将来付与される可能性のある特許に基づいて、是非曲直を考慮することなく、侵害請求を私たちに提起する可能性がある。私たちは、私たちの技術および候補薬剤およびその用途に関連する可能性のあるすべてのこのような知的財産権を知らないかもしれない、または第三者知的財産権が無効であるか、または私たちの活動および候補薬剤がそのような知的財産権を侵害していないという誤った結論を誤って導出する可能性がある。したがって、私たちの技術と候補薬、あるいは私たちの開発と商業化は、いかなる第三者の知的財産権を侵害、流用、あるいは他の方法で侵害することもないことを確実に知ることはできない。
第三者は私たちが許可されていない状況で彼らのノウハウを使用していると断言するかもしれない。我々が識別する可能性のある候補薬剤の発見、使用または製造に関連する第三者特許または特許出願、または製造方法または治療方法のような我々の技術に関連する材料、製剤または方法が存在する可能性がある。特許出願が発行されるまでに数年かかる可能性があるため、現在未解決の特許出願が存在する可能性があり、これらの出願は、私たちが決定する可能性のある候補薬剤が侵害される可能性のある発行された特許をもたらす可能性がある。さらに、第三者は将来的に特許を取得し、私たちの技術を使ってこれらの特許を侵害したと主張するかもしれない。さらに、上述したように、私たちが知らない既存の特許、または私たちが誤って導出した無効または私たちの活動によって侵害されていない特許が存在する可能性がある。管轄権のある裁判所が、例えば、我々が識別する可能性のある候補薬剤の製造プロセス、製造プロセス中に形成された任意の分子または任意の最終製品自体をカバーするために、任意の第三者特許を所有している場合、そのような特許の所有者は、適用特許に基づいてライセンスを取得するか、またはそのような特許が満了するまで、候補薬剤を商業化する能力を阻止することができるかもしれない。
私たちにクレームを出した当事者は禁止または他の公平な救済を受ける可能性があり、これは、私たちが決定する可能性のある候補薬をさらに開発し、それを商業化する能力を効果的に阻止することができるかもしれない。これらのクレームの弁護は、その是非曲直にかかわらず、巨額の訴訟費用に関連し、私たちの業務の従業員資源を大量に分流する。もし私たちの侵害クレームが成功すれば、私たちは大量の損害賠償金を支払わなければならないかもしれません。三倍の損害賠償金と
故意に侵害された弁護士費、特許使用料の支払い、私たちの侵害製品の再設計、私たちの顧客または協力者の賠償を余儀なくされたか、または第三者から1つまたは複数の許可を得ることは不可能かもしれないし、多くの時間とお金の支出が必要である可能性がある。
私たちは、許可を得ることを選択することができ、あるいは、私たちが侵害、流用、または他の方法で第三者の知的財産権を侵害していることが発見された場合、私たちはまた、当社の技術および候補薬剤の開発、製造、およびマーケティングを継続するために、第三者から許可を得ることを要求される可能性がある。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。私たちが許可を得ることができても、それは非排他的である可能性があり、私たちの競争相手や他の第三者が私たちに許可された同じ技術にアクセスできるようにし、大量の許可と使用料を支払うことを要求することができるかもしれない。私たちは裁判所の命令を含む権利侵害技術や製品の開発、製造、商業化を中止することを余儀なくされるかもしれない。権利侵害の裁決は、私たちが任意の候補薬物を商業化することを阻止したり、いくつかの業務運営を停止させたりする可能性があり、これは私たちの業務に実質的な損害を与える可能性がある。また、任意の候補薬を再設計し、新たな規制承認を求め、契約協定に基づいて第三者を賠償することを余儀なくされる可能性がある。第三者の機密情報や商業秘密を盗用したと主張することは、当社の業務、財務状況、運営結果、見通しに類似した重大な悪影響を及ぼす可能性があります。
私たちは、私たちの従業員、コンサルタント、または請負業者が第三者の機密情報を誤って使用または開示したと主張する第三者のクレームを受けるかもしれないし、私たちは彼らの現在または前任雇用主のいわゆる商業機密を誤って使用または開示したり、私たちが彼らの知的財産権を流用したと主張したり、私たちが私たち自身の知的財産権を所有していると主張したりするかもしれない。
私たちの一部の従業員、コンサルタント、および請負業者は以前、私たちの競争相手または潜在的な競争相手を含む大学または他のソフトウェアまたは生物製薬会社に雇われていた。
私たちは、私たちの従業員、コンサルタント、および請負業者が、私たちのために働いているときに他人の固有情報またはノウハウを使用しないことを保証するために努力しているが、私たちは、商業秘密または他の固有情報を含む任意のそのような個人の現職または前任雇用主の知的財産権を使用または開示していると告発される可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。
また、私たちの政策は、知的財産権開発に参加する可能性のある従業員、コンサルタント、請負業者が、このような知的財産権を私たちに譲渡する協定に署名することを要求していますが、実際に私たちが自分たちの知的財産権を開発しているすべての側とこのような合意を実行することができないかもしれません。私たちと彼らの知的財産権譲渡協定は自動的に実行されないかもしれないし、違反される可能性があります。私たちは第三者にクレームを出させたり、私たちが私たちの知的財産権の所有権だと思うことを確認するために、私たちが提起したクレームを弁護することを余儀なくされるかもしれません。このようなクレームは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
もし私たちがこのような任意のクレームを起訴または弁護できなければ、金銭損害賠償の支払いに加えて、貴重な知的財産権や人員を失う可能性があり、これは私たちの競争業務の地位と将来性に実質的な悪影響を及ぼす可能性がある。このような知的財産権は第三者に付与することができ、私たちは、商業的に合理的な条項で取得されない可能性があり、または全く存在しない場合があり、またはその許可が非排他的である可能性がある第三者から、当社の技術または製品を商業化する許可を得ることを要求される可能性がある。このようなクレームの起訴や抗弁に成功しても、訴訟は巨額のコストを招き、経営陣や従業員の注意を分散させる可能性がある。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの業務と競争地位は損なわれるかもしれない。
私たちの候補薬物と私たちの技術プラットフォームのいくつかの態様のための特許を求めることに加えて、私たちは商業秘密および秘密協定に依存して、私たちの非特許技術的ノウハウ、技術、および他の固有の情報を保護する。特に,我々の技術プラットフォームを支えるソフトウェアコードは,通常,特許法ではなく商業秘密法によって保護されている.私たちは、私たちの従業員、会社の協力者、外部科学協力者、CRO、契約製造業者、コンサルタント、コンサルタント、協力者、および他の第三者のような、これらの秘密にアクセスする権利のある当事者と秘密協定を締結することによって、私たちのビジネス秘密および他のノウハウを保護することを求めています。私たちはまた、私たちの従業員やコンサルタントと秘密および発明または特許譲渡協定を締結していますが、私たちが私たちの商業秘密またはノウハウに接触している可能性があるか、または接触したことがあるすべての当事者とこのような合意を締結した保証はありません。このような努力にもかかわらず、どちらも合意に違反し、私たちのビジネス秘密を含む私たちの固有の情報を漏洩する可能性があり、私たちは十分な救済措置を得ることができないかもしれない。商業秘密の漏洩や流用を検出し、当事者に商業秘密の不法開示或いは流用を要求することは困難であり、高価で時間がかかり、結果は予測できない。しかも、アメリカ国内外のいくつかの裁判所は商業機密を保護しようとしないように見える。もし私たちの任意の商業秘密が競争相手または他の第三者によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らがそのような商業秘密を伝達する人がその技術または情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちの任意の商業秘密が競争相手または他の第三者に漏洩された場合、または競争相手または他の第三者によって独立して開発された場合、私たちの競争地位は実質的かつ不利な損害を受ける可能性がある。
政府の規制と法的コンプライアンスに関するリスク
私たちは、厳格で変化する世界的な法律、法規と規則、契約義務、業界基準、政策、その他のデータプライバシーやセキュリティに関連する義務の制約を受けています。私たちが実際にまたはそのような義務を履行できなかったことは、私たちに追加のコストと債務をもたらすかもしれないし、世界でデータを収集して処理する能力を抑制し、規制調査または訴訟、訴訟(集団クレームを含む)と大規模な仲裁要求、罰金と処罰、私たちの業務運営の中断、名声損害、収入または利益損失、および他の不利な業務結果を招く可能性があると考えられている。
通常のビジネスプロセスにおいて、私たちは、独自および機密の商業データ、商業秘密、知的財産権、臨床試験に関連する試験参加者データ、敏感な第三者データ、および商業計画、取引または財務情報のような、個人データおよび他の敏感な情報を収集、受信、格納、処理、生成、使用、送信、開示、アクセス可能、保護、保護、処置、送信および共有(共同処理)する。私たちのデータ処理活動は、様々な法律、法規、ガイドライン、業界基準、外部および内部プライバシーおよびセキュリティポリシー、契約要件、およびデータプライバシーおよびセキュリティに関連する他の義務のような多くのデータプライバシーおよびセキュリティ義務を負担することを要求します
したがって、私たちは、データプライバシーおよびセキュリティ法律、法規、および業界基準の制約を受けているか、および私たちに代わって個人データを処理するための政策、契約、および他の義務に適用されており、私たちは総称してデータ保護要件と呼ばれています。もし私たちがデータ保護要件を満たしていないか、または遵守できなかったとみなされた場合、これは、調査、罰金、処罰、監査および検査、追加の報告要件および/または監督、個人データのすべてまたは一部の処理を一時的または永久的に禁止し、個人データの廃棄または使用および監禁を命令することを含む、政府の法執行行動を引き起こす可能性がある
会社の役人です。また,個人や他の関連利害関係者は,我々が実際にあるいはデータ保護要求を遵守できなかったと考えられることについて様々なクレームを出すことができる.
ヨーロッパでは、EUとイギリスの“一般データ保護条例”(それぞれ“EU GDPR”と“イギリスGDPR”と呼ばれ、総称して“GDPR”と呼ばれる)は、個人データの処理に厳しい要求を出している:GDPRによると、会社は一時的または最終的なデータ処理と他の是正行動の禁止に直面している可能性があり、EU GDPRによると、会社は最高2000万ユーロの罰金に直面する可能性がある;イギリスGDPRによると、1750万ポンドの罰金、または各場合、罰金全世界の年収の4%は、金額が大きい者を基準とする。ヨーロッパ以外の他の国は、同様の包括的なデータプライバシーおよびセキュリティ法律法規の制定を検討しており、これは、私たちの業務の運営コストや複雑さを増加させる可能性があります。ヨーロッパや他の場所でこれらの他の類似した法律、法規、やり方を遵守することは、私たちに巨額の運営コストを発生させたり、私たちの業務やり方を変えて、重大な罰金、処罰、責任のリスクに直面させる可能性があります
通常の業務の過程で、私たちは個人データをヨーロッパや他の司法管轄区域からアメリカや他の国に移すことができる。ヨーロッパと他の司法管轄区は、データの現地化または他の国への個人データの移転を制限するための法律を公布した。特に,欧州経済圏(European Economic Area,EEAと略す)やイギリスは,米国や他のプライバシー法が不足していると一般的に考えられている国への個人データの移転に大きな制限を与えている.他の司法管轄区域はそのデータ現地化と国境を越えたデータ転送法に対して類似の厳格な解釈を行う可能性がある。欧州委員会の標準契約条項、連合王国の国際データ移転協定、連合王国移転付録、EU-米国データプライバシー枠組みおよび連合王国の拡張(遵守状況を自ら証明し、関連枠組みおよび/または拡張に参加することを可能にする関連米国組織の移転を可能にする)には、法律に基づいて個人データを欧州経済地域および連合王国から米国に移転するための様々なメカニズムがあるが、これらのメカニズムは潜在的な法的挑戦を受けている。私たちがこのような措置に満足したり、依存して個人データを合法的にアメリカに移すことができる保証もない。もし私たちが合法的な方法で個人データをヨーロッパ経済区、イギリスまたは他の司法管轄区域からアメリカに移すことができない場合、あるいは合法的な移転の要求が煩雑すぎる場合、私たちの業務中断または降格、巨額の費用で私たちの業務または全部の業務またはデータ処理活動を他の管轄区域(例えば、ヨーロッパ)に移す必要があり、より多くの規制行動に直面し、巨額の罰金と処罰、データの転送ができないこと、パートナー、サプライヤーおよび他の第三者との協力、および私たちが業務を処理または移転するために必要な個人データを禁止することを含む重大な不利な結果に直面する可能性がある。また,個人データをヨーロッパ経済区やイギリスから他の司法管轄区,特に米国に移転した会社は,規制機関,個人訴訟当事者,活動団体のより厳しい審査を受けることになる。一部の欧州規制機関は、GDPRの国境を越えたデータ移転制限に違反した疑いがあるため、一部の会社に特定の資金を欧州への移転を一時停止または永久停止するよう命じている。
さらに、EU GDPRおよびイギリスGDPRコンプライアンスに重要ないくつかの概念の分析は非常に複雑であり、主観的解釈に対して開放的であり、特に様々なデータ処理環境で発生する処理、例えば、私たちがビジネスを運営する環境である。
一般的に、これらの法律は、個人データに関連して変化する規制環境における我々の業務の脆弱性を体現しており、遵守に努めるために、高いコストと費用で私たちの処理方法を修正することが求められるかもしれない。この分野の法律や法規の変化は、私たちの業務慣行を変更し、追加のコンプライアンスメカニズムを構築することを要求するかもしれません。私たちの開発、規制、商業化活動を中断または延期し、私たちの業務コストを増加させ、政府の法執行行動、個人訴訟、および私たちへの巨額の罰金と処罰を招き、私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性があります。
過去数年間、米国の多くの州-カリフォルニア州、バージニア州、コロラド州、コネチカット州、ユタ州を含めて全面的なプライバシー法が公布され、プライバシー通知に具体的な開示を提供し、その個人データに関するいくつかの権利を住民に提供することを含むいくつかの義務がカバーされた企業に加えられた。適用可能であれば、そのような権利は、特定の個人データにアクセス、訂正または削除する権利、および指向性広告、分析、および自動決定のような特定のデータ処理活動から退出する権利を選択する権利を含むことができる。このような権利の行使は私たちの業務と製品とサービスを提供する能力に影響を及ぼすかもしれない
いくつかの州はまた、敏感な情報を含むいくつかの個人データを処理することに対して、データプライバシー影響評価を行うなど、より厳しい要求を提出している。この州の法律は規定を守らない行為に法的罰金を科すことを許可している。例えば、2020年にカリフォルニアプライバシー権法案が改正された2018年カリフォルニア消費者プライバシー法(CPRA)(総称してCCPAと呼ぶ)は、カリフォルニア州住民に属する消費者、商業代表、および従業員の個人データに適用され、プライバシー通知において具体的な開示を提供し、そのような個人が特定のプライバシー権を行使する要求を尊重することを企業に要求する。CCPAは、故意違反のたびに最高7500ドルの罰金を科すことができ、あるデータ漏洩の影響を受けた個人訴訟当事者が巨額の法定損害賠償を取り戻すことを許可すると規定している。CCPAはいくつかの臨床試験で処理されたデータを免除したが、CCPAはコンプライアンスコストを増加させ、著者らが維持しているカリフォルニア住民の他の個人データに関する潜在的な責任を増加させた。他のいくつかの州と連邦と地方の各レベルも似たような法律を考慮しており、私たちは今後もっと多くの州が似たような法律を通過することを予想している。これらの州ではCCPAと同様に臨床試験を背景に処理されたデータも免除されているが,これらの事態はさらにコンプライアンス努力を複雑化させ,我々が依存する第三者としての法的リスクやコンプライアンスコストを増加させている。我々は現在CCPAやCPRAの制約を受けていないが,我々が業務をカリフォルニアに拡張すれば,我々は制約を受ける可能性がある.他の多くの州も似たような立法を考慮している。
連邦レベルでも一連の広範囲な立法措置が導入された。私たちがこれらの法律に違反していると判断されなくても、これらの問題の調査には通常、大量の資源がかかり、否定的な宣伝が生じ、これは私たちの名声や業務を損なう可能性がある。
さらに、1996年に“健康保険携帯性と問責法”によって公布された条例に基づいてプライバシーと安全基準が確立され、単独で識別可能な健康情報または保護された健康情報の使用および開示が制限され、保護された健康情報を保護するためのプライバシー、機密性、完全性および可用性を保護するための行政、物理および技術保障措置の実施が要求される。
また、個人データおよび/または他の機密、独自または敏感な情報を処理するためのプライバシーポリシーおよび他の文書を発行することも可能です。私たちは私たちが公表した政策や他の文書を守るために努力しているにもかかわらず、私たちは遵守できなかったり、遵守できなかったとみなされたりする可能性がある。しかも、私たちは努力したにもかかわらず、以下の場合、私たちは遵守を達成することに成功しないかもしれない
私たちの従業員、第三者協力者、サービスプロバイダ、請負業者、またはコンサルタントは、私たちの政策と文書を遵守できませんでした。もしこれらの失敗が詐欺的、不公平、あるいは私たちの実際のやり方を歪曲していることが発見されれば、私たちは潜在的な外国、現地、州、そして連邦行動に直面するかもしれない。
私たちは、私たちのデータプライバシーやセキュリティ義務を守る努力に失敗することがある(または失敗したと考えられる)。また、私たちが努力しているにもかかわらず、私たちが依存している人や第三者がこのような義務を履行できない可能性があり、これは私たちの業務運営に悪影響を及ぼす可能性があります。
もし私たちまたは私たちが依存している第三者が適用されたデータプライバシーおよびセキュリティ義務を解決または遵守できなかったとみなされた場合、私たちは、政府の法執行行動(例えば、調査、罰金、監査、検査、および同様の行動)、訴訟(集団訴訟クレームを含む)および大規模な仲裁要求、追加の報告要件および/または監督、個人データの処理の禁止、個人データの廃棄または使用の禁止、および監禁会社の管理者を含む重大な結果に直面する可能性がある
このような事件は、顧客流出、私たちの業務運営(臨床試験を含む)中断または中断、私たちのアルゴリズムを訓練するために必要なデータ収集中断または停止、個人データを処理できない、またはいくつかの司法管轄区域で運営されていること、私たちの製品開発または商業化能力が限られていること、任意のクレームまたは調査のために時間と資源をかけて弁護すること、負の宣伝、または私たちのビジネスモデルまたは運営の重大な変化を含む、私たちの名声、業務または財務状態に重大な悪影響を及ぼす可能性がある
私たちと私たちの協力者たちは、適用される反リベート、詐欺と乱用、虚偽声明、透明性、健康情報プライバシーと安全、および他の医療法規の制約を受ける可能性がある。このような法律と法規を守らないと重大な処罰を受けるかもしれない。
私たちと私たちの協力者は広く適用される医療法律と法規によって制限されるかもしれません。これらの法律と法規は私たちの薬物発見協力者および私たちが発売許可を得た任意の製品との関係を制限するかもしれません。このような医療法は含まれていますがこれらに限定されません
•連邦リベート条例は、個人の転転または購入を誘導または奨励し、連邦医療保険および医療補助計画のような連邦医療計画(例えば、連邦医療保険および医療補助計画)に従って精算可能な物品またはサービスの全部または一部を推薦するために、任意の個人または実体が直接または間接的に、公開的または間接的に、現金または実物の形態で直接または間接的に、公開または隠蔽的に請求、受信、提供、または支払いを禁止することを禁止する。“報酬”という言葉は価値のあるものを含むと広く解釈されている。連邦反リベート法令もまた、薬品メーカーと処方者、購入者、処方管理人の間の手配に適用されると解釈されている。いくつかの法定例外状況と安全港保護のいくつかの一般的な活動は起訴されないが、例外状況と安全港の範囲は狭く、保護を提供するためには厳格な遵守が必要である。また、“連邦反リベート法規”の下の意図基準は“患者保護と平価医療法案”によって改正され、この法案は2010年に“保健と教育和解法案”によって改正され、あるいは総称して“反リベート法案”と呼ばれ、より厳格な基準を達成し、個人や実体が法規や法規違反の具体的な意図を実際に理解する必要がなく違反を実施することができる。
•FCAのような連邦民事·刑事虚偽請求法は、一般市民が民事強制により執行することができるりっぱな担い手法律は、個人またはエンティティが、虚偽、架空、または詐欺的な連邦資金支払い要件を意図的に提出または誘導し、連邦政府への金銭支払い義務を回避、減少または隠蔽するために、虚偽または詐欺的要件に実質的な影響を与える虚偽記録または陳述を意図的、使用または使用することを禁止する。例えば,製薬会社がFCAに起訴されたのは,薬品ラベルの外で販売促進を行った疑いがあるためであり,政府の価格報告目的に提出された定価情報に価格割引を隠蔽し,顧客に製品を無料で提供し,顧客がその製品の連邦医療計画に課金することを期待しているといわれている。また,FCAについては,連邦反リベート法規違反による物品やサービスを含むクレームが虚偽や詐欺的クレームを構成している.2009年の“詐欺法執行·回収法案”の改正により、クレームには、米国政府に提出された金銭又は財産に対する“任意の請求又は要求”が含まれている。また,メーカーが政府支払者に直接クレームを提出していなくても,虚偽や詐欺的クレームを“原因”として提出されていれば,FCAによりメーカーは責任を問われる可能性がある。
•その他の事項を除いて、HIPAAは、詐欺の任意の医療福祉計画(個人第三者支払者を含む)の計画を実行または実行しようとしているか、知っていて、医療福祉計画を故意に流用または窃取し、医療犯罪を故意に阻害した刑事調査を行い、連邦刑法を締結し、重要な事実を故意に偽造、隠蔽または隠蔽または隠蔽し、または任意の重大な虚偽、架空または詐欺的な陳述または陳述を行うことを禁止し、あるいは医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の虚偽書面または文書を作成または使用し、刑事責任を課す
•
•連邦と州消費者保護と不正競争法は、これらの法律は市場活動を広く規制し、消費者の活動を損なう可能性がある。
•ACAによって作成された医師支払い陽光法案下の連邦透明性要件によると、他にも、連邦医療保険、医療補助または児童健康保険計画によって精算されるいくつかの薬品、設備、生物製品および医療用品を要求するメーカーは、医師(医師、歯科医師、検眼士、足科医および脊医を含むと定義される)への支払いおよび他の価値移転に関する情報を毎年連邦医療保険および医療補助サービスセンター(CMS)に報告する他の医療専門家(例えば医師アシスタントや勤務看護師)医師とその直系親族が持っている所有権と投資権益です
•上述した連邦法に類似した州および外国法、例えば、リベートや虚偽請求法などは、類似またはより禁止的な制限を加えることができ、非政府第三者支払人(民間保険会社を含む)によって精算される項目またはサービスに適用される可能性がある。
•州と外国の法律は、製薬会社にコンプライアンス方案を実施し、製薬業の自発的コンプライアンス基準と政府が公布した関連コンプライアンスガイドラインを遵守し、あるいは医師および他の保健提供者に提供されたプレゼント、補償および他の報酬を追跡して報告することを要求している;州と外国の法律は、価格上昇に関する情報と価格上昇に理由を提供する情報を含むマーケティング支出または薬品定価の報告を要求している;州と地方の法律は、薬品販売代表登録を要求する;州と外国の法律は、特定のタイプのプレゼントや飲食を提供するなどのマーケティング関連活動を禁止している;州と外国の法律は、臨床試験およびその結果に関する情報の公表を要求している。そして、場合によっては、健康に関連する個人情報および他の個人情報の収集、使用、開示、および保護を管理する州健康情報プライバシーおよびデータ漏洩通知法を含む個人データ、健康情報または個人識別情報のプライバシーおよびセキュリティを管理する他の連邦、州および外国の法律は、多くの法律が互いに大きく異なり、HIPAAは往々にして先制されていないため、追加のコンプライアンス努力が必要である。
米国以外でも、製薬会社と医療専門家との相互作用は、ヨーロッパ諸国の国家反賄賂法律、国家陽光規則、法規、業界自律行動準則、医師職業行為準則のような厳格な法律によって制限されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する現行または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。適用される医療法律および法規の違反は、重大な民事、刑事および行政処罰、損害賠償、返還、罰金、個人監禁、政府援助の医療計画(MedicareおよびMedicaidまたは米国以外の同様の計画のような)から製品を排除し、追加の報告要件および/または監督(これらの法律違反に関する告発および削減または再構成業務を解決するために会社の誠実な合意または同様の合意に署名された場合)をもたらす可能性がある。しかも、違反はまた名声被害、利益減少、そして未来の収益をもたらす可能性がある。
現在と将来の医療立法改革措置は、私たちの業務や運営結果に実質的な悪影響を及ぼす可能性がある。
米国や一部の外国司法管轄地域では、医療を得る機会を拡大し、医療の質を向上させ、医療コストをコントロールまたは低減することを目的としたいくつかの立法·規制改革および提案された改革を継続することが可能である。例えば,2010年3月,ACAが採択され,政府や民間保険会社がヘルスケアに融資する方式を大きく変更し,米国製薬業に大きな影響を与えた。その他の事項以外に、ACAは生物製品を低コストの生物模倣薬の潜在競争を受けさせ、340億薬品割引計画に符合する実体タイプを拡大し、新しい方法を解決し、即ち吸入、輸液、点滴、移植或いは注射の薬物に対して、メーカーの医療補助薬物リベート計画の下でのリベートを計算し、メーカーの医療補助薬物リベート計画の下でのリベートを増加し、リベート計画を医療補助管理の看護組織に登録した個人に拡大し、あるブランドの処方薬のメーカーに対して年費と税収を設定し、そして新しい連邦医療保険D部分カバーギャップ割引計画を作成した。このうち,メーカーは保証間隔期間内に条件を満たす受益者に50%のPOS割引(2018年に両党予算法により70%に増加し,2019年1月から2019年1月から発効)を提供することに同意しなければならず,メーカーの外来薬として連邦医療保険D部分の条件に組み込まれている。
公布以来、ACAのいくつかの方面に対して多くの司法、行政、行政、立法方面の挑戦が提出され、私たちは今後もACAに対してより多くの挑戦と修正案を提出することが予想される。ACAの各部は現在米国最高裁判所で法律や憲法上の挑戦を受けており,国会議員はACAの大幅な改正や廃止を目的としたいくつかの立法を提案している。2021年6月17日、米国最高裁は、ACAが“個人権限”が国会で廃止されたため、全体的に違憲だと弁明する手続き理由に基づく挑戦を却下した。最高裁が裁決を下す前に,2021年1月28日,総裁·バイデンはACA市場による医療保険の取得を目的とした特殊な保険加入期間を開始する行政命令を発表した。2022年8月16日、総裁·バイ登は“2022年インフレ削減法案”に署名し、個人がACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は新たに設立されたメーカー割引計画により、受益者の最高自己負担コストを大幅に低減し、連邦医療保険D部分計画下の“ドーナツの抜け穴”を解消した。ACAの実施は進行中であり,この法律は薬品定価に下り圧力をかけ続ける可能性があり,特に医療保険計画の下で,我々の規制負担や運営コストを増加させる可能性もある。ACAに関連する訴訟および立法は継続される可能性があり、結果は予測可能で不確定である。
また、ACAが公布されて以来、米国は他の立法改正を提案し、採択した。例えば、2011年8月、“2011年予算抑制法案”などは国会の支出削減措置を制定した。具体的には、2013年から2021年までの間に少なくとも1.2兆ドルの赤字を的確に削減する赤字削減合同委員会が必要な目標を達成できず、立法の自動いくつかの政府計画への削減を触発することを提案した。これには、2013年4月に施行された各年度に提供者に支払われる連邦医療保険総額が2%に達し、その後の立法改正により、追加の国会行動がとられない限り、2032年まで有効になることが含まれている。2013年1月2日、2012年に米国納税者救済法が署名され、病院、画像形成センター、がん治療センターを含むいくつかの提供者に支払われる医療保険をさらに減少させ、政府が提供者に多額を支払う訴訟時効を3年から5年に延長する法律に署名した。BBAはACAも改訂し,2019年1月1日から発効し,Medicare Part Dに参加する製薬メーカーが不足している販売時点割引を追加し,大多数のMedicare薬物計画のカバーギャップを縮小し,通常“ドーナツホール”と呼ばれている
また、政府は、メーカーが販売する製品の価格設定の方式をより厳格に審査し、製品価格の透明性を向上させ、価格設定とメーカー患者援助計画との関係を審査し、薬品や生物製品の政府計画精算方法を改革するためのいくつかの国会調査および提案された立法を招いた。連邦レベルでは、前回政府はいくつかの手段を使用して、連邦予算提案、行政命令と政策計画を含む薬品定価改革を提出或いは実施した。2021年7月、総裁·バイデンは、FDAに他を除いて、模倣薬の承認枠組みを引き続き明確にし、改善し、模倣薬競争を阻害するいかなる努力を決定し、解決するように指示する行政命令を発表した。米国の個別州も、価格または患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示および透明性措置を含む薬品の価格設定を制御するための法規を立法と実施することにより、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。また,地域医療当局や個別病院では,どの薬品やサプライヤーがその処方薬や他の医療計画に組み込まれるかを決定する入札プログラムが使用されるようになってきている。そうなんです
医療分野の将来の立法構造及び私たちの業務、運営結果、財務状況と将来性への影響を予測することは困難である。しかし、私たちは将来、特に新しい大統領政府を考慮して、より多くの州と連邦医療改革措置を取ることが予想される
また、アイルランド共和軍は、他の事項を除いて、(I)衛生と公衆サービス部が連邦医療保険でカバーされているいくつかの薬品および生物製品の価格について交渉することを許可し、法律によって交渉された“最高公平価格”以下の価格を提供することによって、医薬品メーカーに民事罰金と潜在的な消費税を科し、(Ii)連邦医療保険B部分およびD部分に基づいてリベートを実施し、インフレを超える価格上昇を処罰する。アイルランド共和軍は衛生と公共サービス部が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。これらの条項は2023年から徐々に発効しているが,連邦医療保険薬品価格交渉計画は現在法的挑戦を受けている。アイルランド共和軍がどのように実施されるかは不明であるが,製薬業に大きな影響を与える可能性がある。バイデン政府の2022年10月の行政命令に応答するため、衛生·公衆サービス部は2023年2月14日に報告を発表し、CMS革新センターによってテストされた3種類の新しいモデルを概説し、これらのモデルはそれらの薬物コストを下げ、獲得性を促進し、医療の質を高める能力に基づいて評価を行う。これらのモデルが将来の任意の医療改革措置で使用されるかどうかは不明である。また、2023年12月7日、バイデン政府は“ベハ·ドール法案”下の参入権を使用することで処方薬の価格を制御するイニシアチブを発表した。2023年12月8日、米国国家標準·技術研究所は、権限行使を考慮した機関間指導枠組み草案を発表し、その中で初めて製品価格を機関が進行権を行使する際に使用できることを決定する要因とした。これまでデモの権利を行使したことはなかったが、新たな枠組みの下で、この権利が継続するかどうかは定かではない。
この計画がどのように実施されるか,どのような薬剤が選択されるか,その計画が米国やカナダで法的挑戦を受けるかどうかは不明である。他の州もFDAの審査を待っているSIP提案を提出した。このような承認された輸入計画が一旦実施されると、これらの計画がカバーする製品の薬品価格をより低くする可能性がある。また、地域衛生保健当局と個別病院はますます入札プログラムを使用して、どの薬品とどのサプライヤーがその処方薬と他の保健方案に組み入れられるかを確定する。これらの措置が承認されると、私たちの製品に対する最終的な需要を下げたり、私たちの製品の価格設定に圧力をかけるかもしれません。
私たちは将来的により多くの州と連邦医療改革措置を取ることが予想され、そのいずれも連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちのパートナーの私たちのサービスまたは私たちの現在または未来の候補薬物に対する需要の減少を招く可能性がある。米国の将来の立法や行政行動によって生じる可能性のある政府規制の可能性、性質、程度を予測することはできない。もし私たちまたは私たちが接触する可能性のある任意の第三者が既存の要求の変化にゆっくりまたは適応できない場合、または新しい要求や政策を採用することができない場合、または私たちまたはそのような第三者が規制適合性を維持できない場合、私たちの候補薬物は得られた可能性のあるいかなる規制承認も失う可能性があり、私たちは利益を達成したり維持することができないかもしれない。
私たちは反腐敗法、そして輸出規制法、税関法、規制法、その他私たちの業務を管理する法律を守らなければならない。もし私たちがこれらの法律を遵守しなければ、私たちは民事または刑事処罰、他の救済措置、法律費用を受け、米国以外で特定の製品の開発、製造、販売が禁止されたり、費用の高いコンプライアンス計画の制定と実施が要求される可能性があり、これは私たちの業務、運営結果、財務状況に悪影響を及ぼすかもしれない。
私たちの業務は、イギリスの“2010年収賄法”、米国の“海外腐敗防止法”、および私たちが業務を展開し、将来業務を展開する可能性のある国/地域に適用される他の反腐敗法律を含む反腐敗法を遵守しなければならない。収賄法、海外腐敗防止法、およびその他の法律は、一般に、業務を獲得または保留し、またはいくつかの他の商業的利益を得るために、私たち、私たちの職員、および中間者が政府官僚または他の人に贈賄、贈賄され、または他の他の禁止された金を他人に支払うことを禁止している。特に、“反海外腐敗法”を遵守することは高価で困難であり、特に腐敗は公認問題である国である。また、“海外腐敗防止法”は、多くの国で病院が政府によって運営されているため、医師や他の病院従業員が外国人官僚とされているため、バイオ製薬業界に特別な挑戦をもたらしている。臨床試験やその他の仕事に関連して病院に支払われた何らかの金は、政府関係者に支払われた不正金と考えられ、“海外腐敗防止法”の法執行行動につながった。
私たちは現在中国に業務があり、将来私たちは他の司法管轄区で業務を展開する可能性があり、これらの司法管轄区は“収賄法”や“海外腐敗防止法”に違反する高いリスクがある可能性があり、私たちはまた第三者との協力や関係に参加する可能性があり、これらの第三者の行為は私たちに“反収賄法”、“海外腐敗防止法”あるいは現地反腐敗法に規定された責任を負わせる可能性がある。また、将来の規制要求の性質、範囲、影響を予測することはできず、私たちの国際業務はこれらの要求によって制約される可能性があり、現行の法律が管理または解釈される可能性がある方式を予測することもできない。私たちがアメリカやイギリス以外での業務をさらに拡大すれば、私たちが各管轄区域で事業を展開することを計画している多くの法律や法規を遵守するために追加の資源を投入する必要があるだろう。
私たちはまた、私たちの国際業務を管理する他の法律と法規、イギリスとアメリカ政府及びEU当局が管理する法規を含み、適用される輸出規制法規、国と人員に対する経済制裁、税関要求と貨幣両替法規を含み、総称して貿易規制法と呼ばれる。さらに、様々な法律、法規、および行政命令は、米国国外での使用および伝播を制限するか、または国家セキュリティ目的のために秘密にされた情報、および特定の製品およびこれらの製品に関連する技術データを特定の非米国国民と共有することも制限される。米国以外の事業を拡大すれば、これらの法律を遵守するためにより多くの資源を投入する必要があり、これらの法律は、米国以外の場所で特定の製品や候補薬の開発、製造、販売を阻止する可能性があり、これは私たちの成長潜在力を制限し、私たちの開発コストを増加させるかもしれない。
私たちが貿易統制法を含む“反収賄法”、“海外腐敗防止法”または他の法律要件を含むすべての適用された反腐敗法律を遵守することを完全かつ効果的に保証することはできない。米国証券取引委員会(SEC、略称米国証券取引委員会)も、発行者が“海外腐敗防止法”の会計条項に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性がある。英国、米国または他の当局は、“反収賄法”、“反海外腐敗法”、その他の腐敗防止法または貿易制御法に違反する可能性のあるいかなる調査も、私たちの名声、業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
私たちが開発した任意の候補薬は、不利な第三者保険と清算方法、そして定価法規によって制限される可能性がある。
第三者支払者である政府衛生当局,個人医療保険会社,管理医療組織と他の第三者支払人を含む獲得性と保証範囲および十分な精算は,多くの患者にとって高価な治療費用を負担できる鍵である。私たちの上場承認された候補薬の販売は、米国でも国際的にも、これらの候補薬の費用がどの程度第三者支払者によって支払われ、精算されるかに大きく依存する。精算が得られない場合や,限られた精算しか得られなければ,候補薬物の商業化に成功できない可能性がある。保険を提供しても、承認された精算金額が十分に高くない可能性があり、十分な投資リターンを実現するために十分な価格設定を確立したり維持したりするのに十分ではないかもしれません。保証範囲と精算は、私たちが発売許可を得た任意の候補薬物の需要や価格に影響を与える可能性がある。保険や精算がなければ、あるいは精算が限られたレベルに限られていれば、上場承認された任意の候補薬を商業化することに成功しない可能性がある。
第三者支払者のカバー範囲や新承認製品の精算に関する不確実性が大きい。例えば、米国では、新薬製品の精算に関する主な決定は通常、衛生·公衆サービス部に属するCMS機構によって行われる。CMSは新薬製品がどの程度連邦医療保険の下でカバーと精算されるかを決定するが、個人第三者支払人は通常CMSのカバーと精算に関する決定に大きく従う。しかしながら、第三者支払者がある候補商品に保険を提供することを決定することは、他の支払者がその候補商品に保険を提供することを保証することはできない。また、米国には統一された保険や精算政策がなく、支払者によって引受や精算が大きく異なる可能性がある。したがって、カバー範囲を決定するプロセスは、しばしば時間がかかり、高価である。この過程は私たちの薬物製品を使用するためにそれぞれの第三者支払者に科学的と臨床支持を提供することを要求するが、保険と適切な精算を一貫的に応用すること、あるいは最初に十分な精算を得ることを保証することはできない。
ますます多くの第三者支払人は製薬会社に価格に基づいて所定の割引を提供し、医療製品の定価に挑戦することを要求している。また,これらの支払者は価格に挑戦し,医療の必要性を審査し,候補医療薬の費用対効果を審査することが増えている。新たに承認された薬物の保険や補償には,特に重大な遅延が生じる可能性がある。第三者支払者は、承認されたリスト上の特定の候補薬剤、いわゆる処方表にカバー範囲を制限することができ、FDAによって承認された特定の適応のすべての薬剤を含まない可能性がある。私たちは私たちの製品の医療の必要性と費用効果を証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。それにもかかわらず、私たちの候補薬は医学的に必要なものや費用効果があるとは思われないかもしれない。私たちが商業化したどの製品も保険と精算を受けることができることを確実にすることはできません。もし精算できるなら、清算レベルはいくらですか。
米国以外では,精算や医療保険支払い制度は国によって異なり,多くの国で特定製品や療法に価格上限が設定されている。EUはEU加盟国にオプションを提供し、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御する。EU加盟国は医薬製品の具体的な価格を承認することができ、メーカーが設定した価格で製品を返済することを拒否することができ、あるいは医薬製品を市場に投入する会社の収益力を直接或いは間接的に制御する制度をとることができる。多くのEU加盟国はまた、その医薬製品の精算手続きを定期的に審査しており、これは精算状況に悪影響を及ぼす可能性がある。また、いくつかのヨーロッパ諸国で、いくつかのEU加盟国を含めて私たちの製品の精算を得るために、私たちは要求されるかもしれません
より多くのデータをまとめ,我々の製品の費用対効果を他の利用可能な療法と比較した。また、多くのEUや他の外国国は、自国内の製品価格の決定を助けるために、他国で制定された医薬製品価格を“参考価格”として使用するようになっている。そのため、一部の国の医薬製品価格の低下傾向は他の国に類似した低下傾向を招く可能性がある。
任意の候補薬剤のための保証範囲を確立または維持し、第三者支払者から十分な補償を得ることができない場合、これらの製品の採用および販売収入は悪影響を受け、これは逆に、これらの候補薬剤をマーケティングまたは販売する能力に悪影響を及ぼす可能性がある。保証政策と第三者支払人の販売率はいつでも変化する可能性があります。規制部門の承認を得た1つまたは複数の製品が有利な保証·精算地位を得たとしても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。また、私たちが開発したどんなセット診断テストも、私たちが候補商品のために求めている保険と精算を除いて、単独の保険と精算を受ける必要があります。任意のペア診断が精算または精算不足を得ることができない場合、これは、このようなペアリング診断の利用可能性を制限する可能性があり、承認された場合、これは、私たちの候補製品の処方に負の影響を与える。
私たちの従業員、独立請負業者、コンサルタント、サプライヤーは、規制基準と要求およびインサイダー取引法律を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があり、これは私たちに重大な責任をもたらし、私たちの名声を損なう可能性があります。
私たちは従業員、独立請負業者、コンサルタント、そしてサプライヤーの詐欺または他の不適切な行為のリスクに直面している。これらのパートナーの不正行為は、FDA法規または非米国規制機関と比較することができる類似の法規を故意に遵守しないこと、FDAまたは非米国規制機関に正確な情報を提供すること、製造基準を遵守すること、連邦および州医療詐欺および乱用法律法規を遵守すること、および非米国規制機関よりも制定および実行可能な類似の法律法規、財務情報またはデータを正確に報告すること、または許可されていない活動を開示することを含むことができる。従業員の不当行為はまた臨床試験過程で得られた情報を不当に使用する可能性があり、これは規制制裁と著者らの名声に深刻な損害を与える可能性がある。これには、EUデータ保護条例を含むHIPAA、他の米国連邦と州法律、および非米国司法管轄区の要求に違反することが含まれる可能性がある。私たちはまた従業員や私たちと関連のある他の人たちがインサイダー取引に違反するリスクに直面している。従業員の不正行為を常に識別し、阻止できるわけではなく、このような行為を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができない可能性があり、または、このような法律、基準、法規、ガイドラインまたは行動基準に準拠できないことによる政府の調査または他の行動または訴訟から私たちを保護することができるかもしれない。また、私たちの従業員は時々雇用問題について、怪我、差別、賃金と工数紛争、セクハラ、敵対的な労働環境、または他の雇用問題を含む訴訟を起こしてくれるかもしれません。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持したりすることに成功しなかったら、これらの行動は、巨額の罰金や他の制裁を加えることを含む、私たちの業務および業務結果に大きな影響を及ぼすかもしれない。
我々の内部情報技術システムまたは私たちの第三者サプライヤー、請負業者またはコンサルタントのシステムは、規制調査または行動に限定されないが、訴訟、罰金および処罰、私たちの業務運営の中断、名声損害、収入または利益損失、顧客または販売損失、および他の不利な結果を含むが、規制調査または行動に限定されない任意の有害な結果をもたらす可能性がある、またはセキュリティホール、データ損失または漏洩、および他の中断を受ける可能性がある。
私たちはますます情報技術システム、インフラ、データに依存して私たちの業務を運営している。通常のビジネスプロセスでは、機密情報(知的財産権、独自サービス情報、および個人情報を含むがこれらに限定されない)を収集、格納、処理、および送信する。重要なのは、私たちはこのような機密情報の機密性と完全性を維持するために、安全な方法でそうしなければならないということだ。私たちはまた私たちの運営要素を第三者にアウトソーシングしているので、私たちは多くの第三者サプライヤーと他の請負業者と顧問を管理しています。彼らは私たちの機密情報にアクセスすることができます。私たちは大量の資源を費やし、高いコストで私たちの業務活動とやり方を大幅に変更したり、私たちの臨床試験活動や情報技術を修正して、セキュリティホールを防止し、実際または潜在的な脆弱性およびセキュリティホールを緩和、検出、修復するために努力する必要があるかもしれない。
我々の内部情報技術システムおよび第三者サプライヤーおよび他の請負業者およびコンサルタントのシステムの規模および複雑さ、および彼らが維持する機密情報の数が増加していることを考慮すると、我々の情報技術システムは、サービス中断、システム故障、自然災害(気候変動のような環境または他の要因によるものであっても)、テロ、戦争、電気通信および電気故障、ならびに私たちの従業員、第三者サプライヤー、請負業者、コンサルタント、業務パートナーおよび/または他の第三者の不注意または故意または悪意のある第三者のネットワーク攻撃(有害なマルウェア、恐喝ソフトウェア、恐喝ソフトウェアの配備を含む)によって起こりやすい可能性がある。分散拒否サービス攻撃、社会工学、および他の手段は、サービス信頼性に影響を与え、情報の機密性、完全性および利用可能性を脅かす)、これは、私たちのシステムインフラ、または私たちの第三者サプライヤーおよび他の請負業者およびコンサルタントのシステムインフラを危険にさらし、またはデータ漏洩を引き起こす可能性がある
特に、深刻な恐喝ソフトウェア攻撃が一般的になってきており、私たちの運営が深刻に中断され、私たちの製品やサービスを提供する能力、敏感なデータや収入の損失、名声被害、および資金移転を招く可能性があります。恐喝支払いは恐喝ソフトウェア攻撃の否定的な影響を軽減するかもしれないが、例えば、適用された法律または法規によってそのような支払いが禁止されているため、私たちはそのような支払いを望まないか、または支払うことができないかもしれない。
世界各地からの未遂攻撃と侵入の数、強度と複雑性の増加に伴い、セキュリティホールや破壊のリスクは普遍的に増加し、特にコンピュータハッカー、外国政府とネットワークテロリストを含むネットワーク攻撃或いはネットワーク侵入を介している。私たちはすべての種類の安全脅威を予見できないかもしれないし、これらすべての安全脅威に対して効果的な予防措置を取ることができないかもしれない。ネットワーク犯罪者が使用する技術は常に変化し,起動時に識別される可能性があり,外部サービスプロバイダ,組織犯罪分岐機関,テロ組織や敵対する外国政府や機関などの外部組織を含む様々なソースから来る可能性がある.このような重大なシステム障害、事故、またはセキュリティホールが発生し、私たちの運営中断を招く場合、私たちの開発計画および業務運営に重大な中断が発生する可能性があります。私たちの商業機密や他の敏感な情報の損失によっても、同様の中断であっても、私たちはこのような故障、事故、またはセキュリティホールを解決するために重大なコストを発生させなければなりません。このような重大なシステムの故障、事故、セキュリティホールは、私たちのデータや
当社のアプリケーション、または当社の第三者サプライヤーや他の請負業者やコンサルタントのアプリケーション、または機密または独自の情報を適切に開示しない場合、私たちは責任や名声の被害を招く可能性があり、私たちのソフトウェアのさらなる開発および商業化は遅延する可能性があります
我々はすでにセキュリティ事件を防ぐためのセキュリティ対策を実施しているが,これらの措置が有効である保証はない.私たちは、私たちの情報システム(例えば、私たちのハードウェアおよび/またはソフトウェア、私たちが依存するサードパーティのハードウェアおよび/またはソフトウェアを含む)における脆弱性を検出、緩和、および修復するための措置をとる。しかし、私たちはこのようなすべての抜け穴をタイムリーに検出して修復しないかもしれない。また,認識された脆弱性を解決するための修復措置や修復プログラムの導入に遅延が生じる可能性がある.抜け穴は利用されてセキュリティ事件を招く可能性がある。
重大なセキュリティホールや中断に関連するコストは巨大である可能性があり、このようなリスクに対して提供されるネットワークセキュリティ保険の制限を超える可能性がある。もし私たちの第三者サプライヤー、他の請負業者、コンサルタントの情報技術システムが中断またはセキュリティホールの影響を受けた場合、私たちはこのような第三者に対抗するのに十分な追跡権がない可能性があり、私たちはこのような事件の影響を軽減し、将来のこのような事件の発生を防止するために保護措置を制定し、実施しなければならないかもしれない。
さらに、我々の内部情報技術システムまたは第三者サプライヤー、他の請負業者およびコンサルタントシステムの深刻な中断またはセキュリティホールは、機密情報(商業秘密または他の知的財産権、独自業務情報および個人情報を含む)の損失、流用および/または不正アクセス、使用または開示、またはアクセスを阻止する可能性があり、これは、財務、法律、商業および名声を損なう可能性がある。例えば、不正アクセス、使用または個人情報(私たちの顧客または従業員に関する個人情報を含む)をもたらすこのような事件は、私たちの名声を直接損なう可能性があり、連邦および/または州の違反通知法と外国と同等の法律を遵守させ、是正措置を強制することができます。そうでなければ、個人情報のプライバシーや安全を保護する法律および法規に基づいて責任を負うことになり、重大な法律や財務リスクおよび名声の損害を招き、私たちの業務に悪影響を及ぼす可能性があります。また,経験豊富なネットワーク攻撃者(工業スパイ活動に従事する外国相手を含む)は,既存のセキュリティ技術に適応し,組織の敏感なビジネスデータを取得するための新たな方法を開発することを得意としており,ビジネス機密を含む敏感な情報の損失を招く可能性がある.さらに、実際的、潜在的、または予想される攻撃は、より多くの人員および保護技術を配置すること、従業員を訓練すること、および第三者専門家およびコンサルタントを招聘するコストを含むコストを増加させる可能性がある。
私たちの従業員の事務と管理成長に関連するリスク
私たちの未来の成功は私たちが肝心な幹部を維持する能力、及び合格した人材を吸引、維持、激励する能力にかかっている。
私たちは私たちの幹部と私たちの管理、科学、臨床とソフトウェア工学チームの他の主要なメンバーの研究開発、臨床、財務、運営、科学、ソフトウェア工学とその他の業務専門長に高度に依存している。私たちは私たちの幹部と雇用協定を締結したが、彼らの誰もが私たちとの雇用関係をいつでも終わらせることができる。私たちは私たちの役員や他の職員たちに“キーパーソン”保険を提供しない。
2024年2月、私たちのCEOは解雇され、私たちのCEOは臨時CEOに任命された。私たちの他の幹部や他の重要な従業員を失ったサービスは、私たちのソフトウェア業務開発と販売目標の実現を阻害し、私たちの薬物発見業務の研究、開発、商業化目標の実現を阻害する可能性があります。いずれの場合も、役員や他のキーパーソンのサービスを失うことは、業務戦略を成功させる能力を大きく損なう可能性があります。指名とコーポレートガバナンス委員会はすでにCEOを探し始めているが、私たちのCEOや他の任意の幹部や重要な従業員を交換することは困難かもしれないが、開発に成功し、監督機関の承認を得て生命科学業界製品を商業化するために必要な技能と経験を備えた個人数が限られているため、長い時間がかかるかもしれない。
合格した科学、臨床、製造、会計、法律、販売とマーケティング人員、及びソフトウェアエンジニアと計算化学者を募集と維持することも、著者らの成功のキーポイントとなる。科学技術業界では、設計、開発と管理ソフトウェア及び関連サービスの面で高いレベルの専門知識を持つエンジニア、及び販売主管、データ科学者と運営人員に対する競争は、すべて激しく持続的である。これらの人を採用する競争は非常に激しく、多くの生物製薬と技術会社の間の類似者に対する競争を考慮すると、私たちは受け入れ可能な条件でこれらの肝心な人員を採用、訓練、維持或いは激励することができないかもしれない。私たちはまた、大学や研究機関から科学や臨床人を募集する競争に直面している。また、私たちはコンサルタントやコンサルタントに依存して、私たちの研究開発と商業化戦略を策定し、私たちのコンピューティングプラットフォームを推進してくれます。私たちのコンサルタントやコンサルタントは、私たち以外の雇用主に雇われる可能性があり、他のエンティティと締結された相談または相談契約に基づいて約束することができ、これは、私たちが彼らを得る機会を制限するかもしれない。もし私たちが高い素質の人材を引きつけ、維持することができなければ、成長戦略を実施する能力は制限され、私たちの業務は悪影響を受けるだろう。
私たちは多様な業務戦略を推進しており、私たちの発展と規制能力を拡大することが予想されていますので、私たちの複数の業務部門や私たちの成長を管理する上で困難になる可能性があり、私たちの運営を混乱させる可能性があります。
また、私たちの従業員数と業務範囲は、特に薬物開発、臨床、規制の分野で大幅に増加することが予想される。私たちの複数の業務部門と将来の成長を管理するためには、私たちの管理、運営、財務システムを継続して実施し、改善し、私たちの施設を拡大し、より多くの合格者の募集と訓練を継続しなければならない。私たちの財務資源が限られていることと、私たちの管理チームがこのような成長を期待している会社を管理する上での関心が限られているため、私たちは私たちの複数の業務部門と私たちの業務拡張を効果的に管理したり、より多くの合格者を募集したりすることができないかもしれません。私たちの業務の拡張は巨大なコストを招き、私たちの管理と業務発展資源を移転する可能性があります。また、上場企業としての義務を履行し、期待される長期成長を支援するためには、一般的かつ行政的能力を向上させる必要がある。私たちの管理、人員、そしてシステムは未来の成長を支持するのに十分ではないかもしれない。私たちの複数の業務部門や成長を管理できない状況は、私たちの業務計画の実行を延期したり、私たちの運営と現在の私たちの業務部門との間に存在すると考えられる相乗効果を乱す可能性があります。しかも、事業部門の不利な発展の中の一つはこのような協同効果を混乱させるかもしれない。
私たちは私たちの最近の急速な成長を効果的に管理できないかもしれないが、これは私たちの業務戦略を実行しにくくするかもしれない。
2012年の設立以来、私たちは急速な成長を経験してきた。このような成長は、従業員の増加、国際業務の拡大、施設の拡大、新しい業務ラインの実行、および適切なシステムおよび制御措置の実施に関連する複雑さを含む業務の様々な側面の複雑さに直面することが要求される。私たちの成長には、私たちの経営陣が多くの時間と労力を投入し、私たちの運営システムとプロセス、財務システムと内部統制、業務の他の側面に圧力を与える必要があります。
現在は既存従業員を当社の会社に統合し、当社の目標を達成するために候補薬剤や技術プラットフォームを改善することに注力していますが、将来の業務の発展に伴い、従業員数を増やし、より多くの専門家を雇用する予定です。私たちは、私たちの成長を適切に管理するために、より多くの合格した科学者、エンジニア、実験室スタッフ、販売とマーケティング担当者を引き続き募集、訓練、管理し、私たちの技術を改善し、維持する必要があります。私たちはまた、私たちが現在持っている専門知識とは別に、補完、または異なる専門知識を持っている人を採用、訓練、管理する必要があるかもしれませんので、これらの人員の募集、訓練、管理に成功することができないかもしれません。例えば、もし私たちの新入社員がうまくいかなければ、もし私たちが採用、訓練、管理、統合といった新入社員の面で失敗したら、あるいは私たちが既存の従業員を維持することに成功しなければ、私たちの業務は損害を受ける可能性があります。私たちの技術とプロセスを改善することは、より多くの科学、工事、販売とマーケティング、ソフトウェア、製造、流通と品質保証人員を雇用し、維持することを要求します。そのため、我々の従業員数は2018年1月1日の17人から2023年12月31日の483人に急速に増加した。また、上場企業としての要求を満たすために、より多くの会計、財務、その他の人員を募集する必要があると予想されています。例えば、このような成長速度を経験することに関連するリスクの1つは、私たちが地理的にますます分散している多くの新入社員を統合し、発展させ、激励する挑戦に直面する可能性があることだ。
私たちの最近の急速な成長は私たちの報告システムと手続きに圧力を与えた。例えば、2022年12月31日と2023年12月31日までの年度の財務諸表を作成·監査する際には、本“リスク要因”の節の他の部分で述べたように、財務報告の内部統制に大きな弱点があることが分かった。私たちの成長を効果的に管理するためには、私たちの運営と製造システムとプロセス、私たちの財務システムと内部統制、そして私たちの業務の他の側面を引き続き改善し、私たちの人員を効果的に拡大、訓練、管理し続けなければならない。我々の既存のシステムおよびプログラムを改善し、新しいシステムおよびプログラムを実施し、これらの既存および新しいシステムおよびプログラムのために十分な人員を配備するのに必要な時間および資源は不確実であり、これらの作業をタイムリーかつ効率的に達成できなければ、私たちの運営に悪影響を与え、私たちの業務および財務に悪影響を及ぼす可能性がある。
もし私たちの技術運営インフラを管理できなければ、私たちの内部薬物発見チームはサービス中断に遭遇する可能性があり、私たちの新しい顧客は私たちの解決策を展開する時に遅延に遭遇する可能性があります。
私たちの運営インフラでサポートされているユーザーとデータの数は著しく増加している。私たちは、私たちのすべての顧客のニーズに応え、私たちの内部薬物発見計画を支援するために、私たちの運営インフラにおいて十分な過剰生産能力を維持することを求めています。新たな顧客展開の迅速な提供と既存の顧客導入の拡張を促進するために、過剰生産能力を維持することも求めています。さらに、バージョン制御、ハードウェア、およびソフトウェアパラメータの変更、および私たちの解決策の変化をサポートするために、私たちの技術運営インフラを適切に管理する必要があります。しかし、新しいホストインフラを提供するには十分な準備時間が必要だ。私たちは、将来的にもサイト中断、停止、その他の性能問題を経験する可能性があることを経験した。これらのタイプの問題は、インフラ変更、人為的またはソフトウェアエラー、ウイルス、セキュリティ攻撃、詐欺、使用量の急増、サービス拒否の問題を含む様々な要因によって引き起こされる可能性がある。場合によっては、私たちは、許容可能な期間内にこれらの性能問題の1つまたは複数の理由を決定することができないかもしれない。もし私たちが私たちのインフラ需要を正確に予測しなければ、私たちの既存の顧客はサービス中断を経験する可能性があり、これは私たちを財務処罰、財務責任、顧客損失に直面させるかもしれない。もし私たちの運営インフラが販売と使用の増加についていけなければ、顧客と私たちの内部薬物発見チームは、私たちがより多くの容量を得ることを求めた時に私たちの解決策の配置を遅延させる可能性があり、これは私たちの名声に悪影響を与え、私たちの収入に悪影響を及ぼすかもしれない。
労働コストの増加、潜在的な労働力組織、従業員スト、その他の労働力に関する中断は私たちの運営に悪影響を及ぼす可能性がある。
しかし、オーストリアでは、最低賃金予想を設定し、現地労働法が要求する以外の追加福祉を従業員に提供する政府の強制的な集団交渉協定の制約を受けている。私たちの将来の労働コストが競争力を維持することを保証できない理由は、(I)将来私たちの労働力が組織される可能性があり、労働協定が締結される可能性があり、これらの合意の労働料率および会社の義務が大幅に向上する可能性があること、(Ii)私たちの競争相手が著しく低い労働コストを維持し、それによって、1つ以上の競争相手やより大きな業界に対する私たちの比較優位性を弱めるか、または除去すること、および(Iii)私たちの労働コストが私たちの増加とともに増加する可能性があるからだ。
国際業務に関するリスク
米国以外に本社を置く会社として、国際業務に関連する経済、政治、規制、その他のリスクに直面している。
イギリス、イングランド、スコットランド、オーストリアに本社を置く会社として、私たちの業務は米国以外での業務展開に関するリスクに直面しています。私たちの多くのサプライヤーと臨床試験の関係はアメリカ以外に位置している。したがって、私たちの将来の業績は様々な要素の影響を受けるかもしれない
•インフレや非アメリカ経済や市場の政治的不安定さを含む経済的疲弊
•製品承認の違いと変化する規制要件
•異なる法ドメインは、これらのドメインで動作する自由を保障、維持、または獲得する上で異なる問題をもたらす可能性がある
•知的財産権と独自の権利の保護を減少させることができる
•複数の法域の異なる、複雑で変化する法律、条例、裁判所システム、および様々な外国の法律、条約、条例を遵守することが困難である
•アメリカ以外の規制と税関、関税、貿易障壁の変化
•ポンド、ユーロ為替レートの変化、通貨規制のリスク
•特定の国や地域の政治経済環境の変化
•貿易保護措置、輸出入許可要求、または政府が取った他の制限行動
•ある非アメリカ市場では異なる精算制度と価格規制が行われています
•税法や税法の変更による否定的な結果
•海外に居住または旅行する従業員は、税法、就業法、移民法、および労働法を遵守し、例えば、異なる司法管轄区域で、私たちの株式オプション計画または株式インセンティブ計画によって付与されたオプションに対する可変税収待遇を含む
•労働騒乱がアメリカよりも一般的な国では労働力の不確実性
•非解雇、差別、誤分類、または労働法違反または他の告発された行為に対するクレームを含む、現職または前任従業員またはコンサルタントが単独で、または集団訴訟の一部として、私たちに提起された訴訟または行政訴訟;
•異なる労使関係を含む人員配置と国際業務の管理に関する困難
•海外の原材料の供給や製造能力に影響を与える事件による生産不足;
•地政学的行動による業務中断は、戦争やテロ、あるいは地震、台風、洪水、火災を含む自然災害、気候変動による他の自然災害を含む。
イギリスのEU離脱は、私たちと私たちの協力者がイギリスとEUで私たちの候補薬物を獲得して規制承認を得る能力に悪影響を及ぼす可能性があり、私たちの候補薬物を開発、製造、商業化するためにイギリスとEUで追加の費用を発生させる必要があるかもしれない。
私たちの本部はイギリスにあります。2020年1月31日、イギリスは正式にEUから離脱し、いわゆる離脱だ。その離脱条項によると、連合王国は過渡期、すなわち過渡期に入り、その間、イギリスはEUのすべての規則を遵守し続け、この規則は2020年12月31日に終了した。英国とEUの過渡期後の貿易関係を概説する貿易·協力協定、あるいは貿易·協力協定と呼ばれ、2020年12月に達成され、2021年5月1日に正式に発効する。
2021年1月1日以来、イギリスはEUから独立した規制制度の下で運営されてきた。医薬品に関する欧州連合の法律は、連合王国と北アイルランドにのみ適用される(“アイルランド/北アイルランドに関する議定書”で述べたように)。二次立法を通じて連合王国法律に転換した欧州連合法律はまだ適用されている。連合王国はすでに全体的な意向を表明し、即ち連合王国の医薬製品の開発、製造と商業化に関する新しい法律はEU法律と緊密に結合するが、未来の医薬製品の監督管理に関する詳細な提案は限られている。TCAは、相互承認良好な製造規範またはGMP、医薬製品の生産施設および発行を検査するGMP文書(このような相互承認は場合によってはいずれか一方によって拒否されることができる)を含む医薬製品に関する具体的な条項を含むが、連合王国およびEUの薬品立法がバッチ試験および薬物警戒に関連する法律を含む包括的に相互承認されることは予想されておらず、これらはさらに交渉される必要がある。イギリスは連合の大量テストと一括釈放を受け入れることに一方的に同意した。しかし、連合は連合の法律を適用し続け、バッチ試験と一括放出が連合地域で行われなければならないことを要求する。これは,イギリスでテスト·発表された医薬製品がEU市場に進出して商業用途に使用される際に再テスト·再発表されなければならないことを意味する。そのため、イギリスとEUの将来の医薬製品に対する規制がどの程度異なるかについては、政治的と経済的には依然として不確実性が存在する。
イギリスが私たちの業務と私たちの候補薬物に適用される規制枠組みの大部分はEU指令と法規から来ているため、私たちの候補薬物のイギリスでの開発、製造、輸入、承認、商業化はイギリスの離脱の大きな影響を受け、私たちのイギリスでの業務を考慮すると、EUも私たちの業務に大きな影響を与えるだろう。イギリスはEUからマーケティング権限プログラムの管轄を受けなくなった(北アイルランドは中央権限プログラムによって管轄され、分散または相互承認手続きによって管轄されることができる)。イギリスで薬品を販売するにはイギリスの主管当局が付与した単独マーケティング許可が必要になるだろう。イギリスの薬品と保健製品規制機関がそれが受け取る可能性のあるますます多くのマーケティング許可申請を処理するのに十分な準備があるかどうかは不明である
2023年3月24日、離脱協定合同委員会は、英国政府と欧州委員会の“ウィンザー枠組み”に関する政治的合意を採択した。その枠組みは北アイルランド議定書を改正することを目的としている。もしこれらの変化が提案の形で採択されれば、イギリスで市場に投入された薬品は完全にイギリスの法律に基づいて許可されるだろう。ウィンザー枠組みの実施は段階的に行われ,北アイルランドへの医薬製品の供給に関する新計画は2025年に発効する予定である。
イギリスの離脱やその他の理由により、いかなるマーケティング承認を得る上でのいかなる遅延も、いかなるマーケティング承認も得ることができず、私たちと私たちの協力者や私たちの協力者と私たちの協力者がイギリスおよび/またはヨーロッパ医薬品局で私たちの候補薬物を商業化し、私たちの収入を創出し、利益を達成し、維持する能力を制限することを阻止するだろう。英国離脱後,イギリスは発売前に孤児の指定を許可しておらず,逆に孤児指定の申請は販売許可を申請しながら提出されている。英国離脱後のイギリス(またはイギリス、欧州経済圏に事前に集中マーケティング権限があるか否かに依存)の孤児指定は、イギリスが離脱する前ではなく、イギリスでの流行度に基づいており、EUの流行度が決定要因である。したがって、イギリスが離脱する前にイギリスで孤児条件として指定された条件はもはやそうではなく、現在EUで孤児条件に指定されていない条件は連合王国またはイギリスで孤児条件として指定される可能性がある。
長期的に見ると、イギリスの離脱は、イギリスで候補薬物の規制承認を得る過程と、通常EUの法的枠組みの一部である排他性(例えば、保護証明書の補充、小児科延期または孤児の排他性)を含む薬品の開発、製造、商業化にある程度の不確実性をもたらす。欧州連合と連合王国の既存の規制環境との間のどのさらなる違いも、候補薬物を市場に出すコストの増加と遅延を招く可能性がある。
さらに、私たちは税金や関税、あるいはヨーロッパ連合とイギリスの間で私たちの候補薬物貿易に関連する他の障害物、あるいは私たちがEUにこれらの障害物の費用を迂回するために製造工場を設立することを要求されるかもしれません。これらはすべて私たちがEUでビジネスをすることをもっと難しくするかもしれません。上記のいずれかの結果が生じた場合、私たちは、イギリスまたはEUで私たちの候補薬物のための規制承認を求める努力を制限または延期することを余儀なくされるか、または私たちの業務を運営するために多くの追加費用を発生させる可能性があり、これは、私たちの収入を創出したり、業務の利益を達成する能力を著しく損害したり、延期したりする可能性がある。
英国の離脱やその他の理由で、他の欧州諸国はEUに滞在し続けるかどうかについて国民投票を求める可能性がある。これらの可能性と他の我々が予想していない可能性を考慮すると、同様の前例がなく、長期的には、イギリスのEU離脱がどのような財務的、規制、法的影響をもたらすか、このような脱退が私たちにどのように影響を与えるか、私たちの業務がどの程度悪影響を受ける可能性があるかは不明である。
為替レートの変動は私たちの経営結果と財務状況に大きな影響を及ぼすかもしれない。
私たちの業務の国際範囲により、為替レートの変動、特にポンドとドルの間の変動は、私たちに悪影響を及ぼす可能性があります。私たちの本部はイギリスにありますが、私たちのCROは多くの異なる地理的な位置に分布していて、私たちはアメリカとEUから研究開発、製造、コンサルティング、その他のサービスを調達します。さらに、将来の潜在的収入は海外、特にアメリカから来るかもしれない。したがって、私たちの業務と私たちのアメリカ預託証明書の価格は外国為替レート変動の影響を受ける可能性があり、ポンドとドル間の為替変動だけでなく、ユーロ為替レートの変動もあり、これは私たちの運営業績やキャッシュフローに大きな影響を与える可能性がある。
私たちのアメリカ預託証明書はドルで取引されます。ドルとポンドの間の為替レート変動により、米国預託証明書保持者は、ホスト機関から抽出した任意の普通株をイギリスで販売して得られる収益のドル等値と、ポンドに代表される我々の普通株に代表される任意の現金配当金のドル同値値が低下する可能性がある。
私たちの証券所有権に関わるリスクは
追加資本を調達することは、私たちの既存の株主を希釈し、私たちの運営を制限したり、貴重な権利を放棄したりする可能性がある。
私たちは公共とプライベート·エクイティ発行、債務融資、戦略的パートナーシップと連合、および許可手配を組み合わせた方法で追加資本を求めるかもしれない。もし私たちが株式、転換可能な債務証券、または他の株式ベースの派生証券を売却することによって追加資本を調達する場合、あなたの所有権権益は希釈され、条項は清算または他の特典を含む可能性があり、米国預託証券所有者としての権利に悪影響を及ぼす可能性がある。私たちが発生したどんな債務も固定支払義務の増加を招き、私たちが追加債務を発生させる能力の制限、私たちが知的財産権を得ることができる能力の制限、私たちの業務展開能力に悪影響を及ぼす可能性のある他の経営制限など、限定的な契約に関連する可能性がある。私たちが調達した任意の債務または追加の株式融資には、私たちまたは私たちの株主に不利な条項が含まれているかもしれない。さらに、我々は、株式や債務、またはそのような発行の可能性にかかわらず、米国預託証明書の市場価格の下落を招く可能性がある追加証券を発行し、既存の株主は、我々の融資計画またはそのような融資の条項に同意しない可能性がある。もし私たちが戦略的パートナーシップ、協力と連合、および第三者との許可手配を通じてより多くの資金を調達すれば、私たちは私たちの知的財産権、技術、または候補薬物の貴重な権利を放棄しなければならないかもしれないし、私たちに不利な条項で許可証を授与しなければならないかもしれない。
私たちのアメリカ預託証明書の市場価格は大きく変動するかもしれません。あなたの購入価格あるいはあなたの購入価格より高いで、あなたのアメリカ預託証明書を転売できないかもしれません。
私どものアメリカ預託証明書の市場価格は大きく変動する可能性があります。株式市場全体、特にバイオ製薬会社の市場は極端な変動を経験しており、この変動は往々にして特定の会社の経営業績に関係なく、私たちの株価が制御できない要因で変動する可能性がある。このような変動のため、あなたは購入価格以上の購入価格でアメリカ預託証明書を売ることができないかもしれません。私たちのアメリカ預かり証の市場価格は多くの要素の影響を受ける可能性があります
•私たちのソフトウェアソリューションへの投資と成功
•私たちの内部および/または協力した薬物発見プログラムの研究および開発努力が成功したかどうか
•臨床前研究或いは臨床試験の不良結果或いは遅延;
•我々が開発または臨床試験している製品と類似しているか、または類似していると考えられる製品の有害事象報告;
•追加資金を得ることができません
•候補薬を開発し商業化することはできませんでした
•私たちの薬は協力者の成功を発見しこれらの協力者から得たマイルストーンや他の支払いは
•私たちまたは私たちの許可者および/または協力者は、私たちの知的財産権および独自の権利を起訴、維持、保護または実行できませんでした
•訴訟事項および私たちの技術のための特許および他の知的財産権保護を得る能力を含む、知的財産権および他の専有権に関連する紛争または他の発展;
•未来の製品に適用される法律や法規の変化
•不利な規制決定;
•私たちの競争相手は新しい製品、サービス、技術を発売します
•私たちは大衆に提供される可能性のある財政的予測を達成できなかったか、またはそれを超えることができなかった
•私たちは投資界の財務予測を達成したり超えたりできませんでした
•公衆、立法機関、規制機関、投資界の製薬業に対する見方
•医療支払い制度の構造を変え
•私たち、私たちの戦略的パートナー、または私たちの競争相手は、重大な買収、戦略的パートナーシップ、合弁企業、または資本約束を発表します
•重要な科学技術者や管理者の増減
•特許または株主訴訟を含む重大な訴訟;
•同じ会社の市場予想が変化しています
•投資家はインターネット上で、ブログ、文章、伝言板またはソーシャルメディアプラットフォームを通じて、私たちの業務、私たちの普通株式またはアメリカ預託証明書の将来性についてコメントすることを含む
•一般的な経済、産業、政治、市場条件
•私たちまたは株主は将来私たちのアメリカ預託証明書または普通株を売却します
•私たちのアメリカ預託証明書の取引量。
従来、証券集団訴訟は、ある会社の証券市場価格が下落した後に提起されることが多かった。このリスクは,生物製薬会社が近年大幅な証券価格変動を経験しているため,特に我々と関連している。私たちがこのような訴訟に直面すれば、巨額のコストを招き、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務を損なう可能性があります。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちのアメリカ預託証明書の市場価格にマイナス影響を与える可能性がある。また、金融市場の下落と私たちがコントロールできない関連要素は、私たちのアメリカ預託証明書価格を迅速かつ意外に低下させる可能性がある。
証券又は業界アナリストが我々の業務に関する研究報告を発表しない場合、又は不正確又は不利な研究報告を発表しなければ、我々の米国預託株式価格及び取引量が低下する可能性がある。
私たちのアメリカ預託証券の取引市場は、証券や業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存するかもしれません。私たちはこのようなアナリストに対して何の統制権もなく、アナリストが私たちを報告したり、有利な報告書を提供することを保証することもできない。証券や業界アナリストは私たちのアメリカ預託証明書を提供しない研究カバー範囲を選択する可能性があり、このような研究カバー範囲の不足は私たちのアメリカ預託証明書の市場価格に負の影響を与える可能性がある。もし一人以上のアナリストが私たちのアメリカ預託証券の格付けを下げたり、私たちのアメリカ預託証券に対する彼らの見方を変えたりすれば、私たちのアメリカ預託株式価格は下落するかもしれません。また、1人以上のアナリストがわが社への報道を停止したり、当社に関する報告書を定期的に発表できなかったりすれば、金融市場で可視度を失う可能性があり、米国預託株式価格や取引量を低下させる可能性があります。
我々の普通株(米国預託証明書に代表される普通株を含む)の所有権は私たちの既存の幹部、取締役、主要株主の手に集中しており、新投資家が重大な会社の決定に影響を与えることを阻止する可能性がある。
2024年3月1日までの発行済み普通株数によると,我々の役員,役員と現在5%以上の普通株を保有している実益所有者とそれぞれの関連会社の合計実益は,我々が発行した普通株の約53%を持っている.
したがって、当社の株主総会に出席する人数に応じて、これらの人々が共同で行動することは、当社の株主の承認を必要とするすべての事項に重大な影響を与えることができ、選挙、再選および罷免取締役、任意の合併、計画、当社のすべての資産またはほぼすべての資産の売却、あるいはその他の重大な会社の取引および当社組織規約の改訂を含むことができる。
また、これらの人たちが一緒に行動することで、わが社の管理や事務をコントロールすることができるかもしれません。したがって、このような所有権集中は、以下のように米国預託証明書および普通株の市場価格を損なう可能性があります
•制御権の変更を延期、延期、または阻止する
•私たちの経営陣と/または取締役会を強化します
•私たちの合併、手配、買収またはその他の業務合併を妨げる;または
•潜在的な買収者が買収要約を提出することを阻止したり、他の方法で私たちを統制しようとしたりする。
もし私たちが世界的な参入約束に基づいて契約を破った場合、私たちはビルとメリンダ·ゲイツ財団またはゲイツ財団が2021年10月の私募で購入したすべてのわが社のアメリカ預託証明書を現金で買い戻すことを要求されるかもしれません。あるいは第三者がすべてのアメリカ預託証明書を購入することに便宜を提供することは、私たちに悪影響を与え、株主への分配能力を制限するかもしれません。
ゲイツ財団が1,590,909件の米国預託証明書を購入したことについて、私たちは私募方式で初の公募株を行い、2021年10月に完成し、私たちはグローバルアクセス約束協定やグローバルアクセス協定を締結し、この合意に基づいて、ゲイツ財団の使命を支援するために何らかの行動を取らなければならない。もし私たちが世界的な参入協定のいくつかの関連条項に違反した場合、治療期間が過ぎた後、私たちは、同時に私募で購入したすべてのアメリカ預託証明書を現金で買い戻すこと、または第三者が私たちに不利な条項ですべてのアメリカ預託証明書を購入することを促進することを要求されるかもしれない。このような状況が発生すれば、この目的のための現金は、私たちの流動性に悪影響を与え、他の業務分野の支出を減らしたり、成長計画を削減したりする可能性があります。もし私たちの手元に十分な現金がなければ、私たちは私たちの義務を履行するための融資代替案を求めなければならないかもしれないし、融資が合理的な条件で存在するかどうか、あるいは全く存在しないかどうかは定かではない。ゲイツ財団が保有している米国預託証明書を買い戻すことができない間、または第三者がこのような米国預託証明書を購入するように手配している間、私たちは配当金の支払い、他の株主の証券の買い戻し、または他の方法で私たちの任意の株主にその証券に関連する任意の他の分配を許可されない可能性が高い。したがって、必要であれば、この購入義務を履行することは、我々の業務や財務業績に実質的な悪影響を及ぼす可能性がある。
将来的に私たちの大量の証券の売却、あるいは将来の売却の可能性は、株価に悪影響を与え、株主の権益を希釈する可能性がある。
私たちの大量のアメリカ預託証明書はいつでも公開市場で販売することができますが、以下に述べるいくつかの制限を受けなければなりません。もし私たちの既存株主が公開市場で私たちの証券を大量に売却したり、意図していることを表明したりすれば、米国預託証券の取引価格は大幅に低下する可能性がある。2023年12月31日現在、私たちは125,702,396株の発行済み普通株(米国預託証明書に代表される普通株を含む)を持っている。2023年12月31日現在、合計約59,017,200株の普通株の保有者は、条件付きでその株式の登録声明の提出を要求する権利があり、またはその株式を自分または他の株主に提出する可能性のある登録声明に入れ、そのような普通株のいくつかの公開発行で協力する権利がある。また、私たちは株式補償計画に従って発行可能なすべての普通株を登録しており、これらの普通株は発行後に公開市場で自由に販売することができるが、関連会社に適用される数量制限によって制限されている。
アメリカの預託証明書所持者は私たちの普通株式の所有者とみなされません。
アメリカ預託証明書所有者は、彼らが預金協定と適用された法律法規に基づいて、そのアメリカ預託証明書に関連する普通株式を抽出しない限り、私たちの普通株式の所有者とみなされない。信託銀行はアメリカ預託証明書関連普通株の保有者です。したがって、預金協定によって享受される権利を除いて、米国預託証明書所持者には、当社の普通株式保有者としての権利は何もない
米国預託証明書保持者は、その米国預託証明書の譲渡と関連普通株の撤回に制限される可能性がある。
アメリカ預託証明書は預かり人の帳簿に譲渡することができます。しかし,保管人は,職務遂行に関与していると考えられる場合には,その帳簿を随時あるいは随時閉鎖することができる。信託銀行は、一般に、私たちの帳簿またはホスト銀行の帳簿が閉鎖されたときに、米国預託証明書の交付、譲渡または登録を拒否することができ、または当業者または信託銀行が、法律、政府または政府機関の任意の要求、または預金協定の任意の条項または任意の他の理由によって適切であると考えられるいつでも、米国預託株式保有者がその米国預託証明書を解約し、関連する普通株を抽出する権利があると考えられる場合には、米国預託証明書の交付、譲渡、または登録を拒否することができる。あなたのアメリカ預託証明書の解約と関連する普通株の撤回は一時的な遅延が生じる可能性があります。信託機関が譲渡帳簿を閉鎖したので、私たちは譲渡帳簿を閉鎖しました。普通株譲渡は株主総会での投票を許可するために阻止されますか、または私たちの普通株のために配当金を支払っています。さらに、米国預託株式保有者は、手数料、税金、および同様の費用を借りた金、および米国預託証明書または普通株または他の預金証券に適用される任意の法律または政府法規を遵守するために引き出しを禁止する必要がある場合には、米国預託証明書を無効にし、関連する普通株を抽出することができない可能性がある
我々は、預金契約を修正し、米国預託株式保有者のこの合意条項の下での権利を変更したり、米国預託株式保有者の事前同意を必要とせずに預金協定を終了する権利がある。
我々は、事前に米国預託株式保有者の同意を得ることなく、預金契約を修正し、米国預託株式保有者のこの合意条項の下での権利を変更する権利がある。私たちと保管人は私たちまたは保管人に必要あるいは有利だと思う任意の方法で保管プロトコルを修正することに同意することができます。改訂は、アメリカ預託株式計画の業務変化、アメリカ預託証明書に影響を与える法律の発展、あるいは私たちと信託銀行との業務関係条項の変化を反映する可能性がある。修正条項が米国預託株式保有者に重大な不利をもたらした場合、米国預託株式保有者は修正30日間の事前通知を受けるだけであり、預金合意に基づいて、事前に米国預託株式保有者の同意を得る必要はない。また、吾らは、信託銀行に任意の理由で米国預託株式融資を随時終了するよう指示することを決定することができる。例えば、非米国証券取引所に我々の普通株を上場することを決定し、米国預託株式メカニズムの担保を継続しないと決定した場合や、買収や民営化取引の対象となった場合には、中止される可能性がある。米国預託株式融資が終了すれば、米国預託株式保有者は少なくとも30日前の通知を受けるが、事前に同意する必要はない。吾らが預金協定の改訂が米国預託株式保有者に不利または預金協定を終了することを決定した場合、米国預託株式保有者は、その米国預託証明書を売却するか、またはその米国預託証明書を放棄して関連普通株の直接所有者となることを選択することができるが、いかなる補償を得る権利もない。
米国預託株式保有者は、預金協定に基づくクレームを陪審裁判する権利がない可能性があり、これは、いずれのような訴訟においても原告(S)に不利な結果を招く可能性がある。
当社の普通株を代表する米国預託証明書を管理する預金協定は、法律で許可されている最大範囲内で、米国預託証明書の所持者及び実益所有者は、米国預託証明書又は預金協定により吾等又は受託保管者に対して提起された任意のクレームに対して陪審裁判を行う権利を撤回することができない。
法律が適用されてこの陪審裁判免除条項が許可されていない場合、訴訟は陪審裁判の保証金合意の条項によって行うことができる。もし私たち又は保管人が放棄に基づく陪審裁判要求に反対する場合、裁判所は適用された州及び連邦法律に基づいて、事件の事実及び状況に基づいて、放棄が強制的に執行できるか否かを決定する。私たちの知る限り、契約紛争前の陪審員による連邦証券法に基づくクレームの裁判免除の実行可能性は、米国最高裁判所の最終裁決を得ていない。しかし、契約紛争前の陪審裁判免除条項は、一般に、預金協定を管轄するニューヨーク州法律に基づいて、預金協定の下で生じる事項に対して非排他的管轄権を有するニューヨーク市の連邦または州裁判所によって実行されることができると考えられる。契約中の論争前の陪審裁判免除条項を執行するか否かを決定する際、裁判所は通常、一方の当事者が知っているかどうか、賢明かつ自発的に陪審裁判を受ける権利を放棄したかどうかを考慮する。私たちは預金協定とアメリカの預金証明書がこのような状況だと思う。保証金契約を締結する前に、陪審員免除条項に関する法律顧問に相談することをお勧めします。
もしあなたまたはアメリカ預託証明書の任意の他の所有者または実益所有者が預金契約またはアメリカ預託証明書の下で発生した事項について、連邦証券法に基づいて提出されたクレームを含む場合、私たちまたは信託銀行にクレームを提出し、あなたまたはその他の所有者または実益所有者は、このようなクレームについて陪審裁判を行う権利がないかもしれません。これは、私たちおよび/または信託銀行に対する訴訟を制限し、阻止する可能性があります。預金協定に基づいて吾等および/または信託銀行に対して訴訟を提起する場合、適用される初審裁判所の裁判官または裁判官によってしか審理されない場合、これは、異なる民事手続きに従って行われ、任意のこのような訴訟において原告(S)に不利になる可能性のある結果を含む、陪審裁判とは異なる結果をもたらす可能性があり、具体的には、クレームの性質、そのようなクレームを審理する裁判官または裁判官、および聴聞場所などに依存する。
預金協定又は米国預託証明書の任意の条件、規定又は規定は、米国預託証明書のいかなる所有者又は実益所有者を構成しないか、又は我々又は信託機関が米国連邦証券法及びその公布された規則及び法規の任意の実質的な規定を遵守することを放棄する。
あなたは私たちの普通株式保有者と同じ投票権を持っていないだろうし、あなたの投票権を行使するために投票材料をタイムリーに受け取ることができないかもしれない。
本年度報告および預金協定に記載されている以外に、米国預託証明書所持者は、米国預託証明書に代表される普通株に付属する投票権を行使することができない。預金協定の条項によると、米国預託証明書の保有者は、その米国預託証明書に関連する普通株に投票するように信託機関に指示することができる。そうでなければ、米国預託証明書保持者は、彼らが適用される法律法規と私たちの組織規約に基づいて、自らまたは代表に米国預託証明書に関連する普通株の撤回を依頼しなければ、彼らの投票権を行使できないだろう。それでも、米国預託株式の保有者は会議が開催されることを長く前に知ることはないかもしれないため、これらの普通株を撤回することはない。米国預託証明書所持者の指示を求めた場合、信託銀行は私たちの適時な通知を受けた後、アメリカ預託株式保有者に間もなく行われる投票を通知し、私たちの投票材料を彼らに配信するように手配します。私たちの要求に応じて、委託者は、投票指示方式に関する声明を含む株主総会通知を所持者に郵送する。アメリカの株式保有者が投票権を獲得する保証はありません
彼らが米国預託証明書に関連する普通株に投票するようにホスト機関に指示することができることを確実にするために、材料をタイムリーに提供する。株主は、株主総会に参加して株主総会に投票する権利があるのみであり、当該株主が当該会議の記録日に当社の普通株式を保有し、その他の点で当社の定款に適合することを前提としている。また,預託機関による米国預託株式保有者が採決指令や採決指令を実行していない方式に対する責任は,預金管理プロトコルによって制限される.したがって、米国預託証明書保持者は、投票指示を行うか、または代表投票を自ら委任する権利を行使できない可能性があり、その普通株がその要求に応じて投票できない場合、またはその株式が投票できない場合には、管理者または吾などに追跡する権利がない可能性がある。
米国預託証明書を米国預託証明書所有者に提供することが不法または非現実的であれば、米国預託証明書に代表される私たちの普通株の分配またはそのいかなる価値も受信しない可能性がある。
アメリカ預託証券の受託者は、私たちの普通株または他の預金証券から受け取った現金配当金またはその他の分配、その費用および支出および任意の税金をあなたに支払うことに同意しました。あなたはあなたのアメリカ預託証明書に代表される私たちの普通株式数に比例したこれらの分配を得るだろう。しかし、預金協定に規定されている制限により、米国預託証明書保持者に流通を提供することは不法または非現実的である可能性がある。私たちは米国預託証明書、普通株式、権利、または他の何かを米国預託証明書所有者に割り当てることを可能にする他の行動を取る義務はない。これは、普通株式をあなたに提供することが不法または非現実的である場合、あなたは普通株に対する私たちの配布または普通株から得られたいかなる価値も受信しない可能性があることを意味する。このような制限はあなたのアメリカ預託証明書の価値に悪影響を及ぼすかもしれない。
私たちは予測可能な未来に私たちのアメリカ預託証明書に現金配当金を支払わないと予想されているので、資本付加価値(あれば)があなたの唯一の収益源になり、あなたの投資は永遠に報われないかもしれません。
イギリスの現行法律によると、配当金の発表と支払い前に、ある会社の累計は利益を達成しており、以前に分配または資本化利用されていなかった場合は、その累積が損失を達成したことを超えなければならず、以前に適切な資本減少または再編で販売されていなかった場合(非合併ベースで決定される)。したがって、配当金を発表して支払う前に、私たちは分配可能な利益を持っていなければならない。また、イングランドとウェールズに登録して設立された上場有限会社として、純資産額が催促配当金と分配不可準備金の合計よりも少なくない場合と、これらの資産の金額をその合計以下にある程度減少させない場合にのみ、分配を行うことができる。
私たちは過去に私たちの普通株に配当金を支払ったことがない。私たちは収益を維持して、私たちの業務のために、予測可能な未来に現金配当金を支払わないつもりです。したがって、予測可能な未来に、私たちのアメリカ預託証明書の資本増加(あれば)はあなたの唯一の収益源になり、もしあなたがあなたの購入価格以上であなたのアメリカ預託証明書を売ることができなければ、あなたの投資は損失を受けるだろう。現金配当を求める投資家は私たちのアメリカ預託証明書を購入してはいけません。
アメリカの民事責任に対するクレームは私たちに強制的に施行できないかもしれない。
私たちはイギリスの法律登録に基づいて設立され、登録事務所はイギリスに設置されている。私たちの取締役会の一部のメンバーと高級管理者はアメリカ人ではありません。私たちの全部または大部分の資産とこれらの人の資産はアメリカ以外にあります。したがって、米国証券法の民事責任条項によると、これらの人や私たちに訴訟手続きを送達したり、米国の裁判所で得られた彼らまたは私たちに不利な判決を執行することができない可能性がある。
米国と連合王国は現在、民商事判決の承認と執行について規定された条約を下していない。したがって、米国裁判所による最終支払い判決は、米国証券法に完全に基づいているか否かにかかわらず、自動的にイギリスで認められたり強制的に執行されることはない。また、イングランドとウェールズの裁判所は、米国または米国のいずれの州の証券法に基づいてイギリスで我々または我々の役員や上級管理者に提起されたオリジナル訴訟を受理するかどうかには、不確実性がある。米国裁判所で得られた我々の確定金額に対する最終的かつ決定的な金銭判決は、連合王国裁判所によって訴訟自体の原因とされ、一般法に基づいて債務として訴訟が提起されるため、何らかの要求を満たせば、これらの問題を再審する必要はない。米国証券法民事責任条項に基づく判決が,これらの要求に適合しているかどうかは,このような法律による金銭損害賠償が処罰となるかどうかを含め,裁判所がこのような裁決を下す問題である。もし英国裁判所が米国の判決に基づいて支払うべき金額について判決を下した場合、イギリスの判決は通常この目的に使用可能な方法で実行される。このような方法は一般的にイギリスの裁判所が強制執行の方法を適宜規定することを可能にする。
したがって、米国投資家は、米国連邦証券法による判決を含む、私たちまたは私たちの上級管理職、取締役会、または本明細書で言及したイギリスまたはアメリカ以外の国に住むいくつかの専門家に対して、米国裁判所で得られた任意の民事および商業判決を実行することができないかもしれない。
あなたが将来の株式発行に参加する権利は制限される可能性があり、これはあなたの保有株式の希釈を招くかもしれない。
私たちは時々私たちの証券を購入する権利を含めて私たちの株主に権利を割り当てるかもしれない。しかし、私たちはアメリカであなたに権利を提供することができません。権利関連の権利と証券は私たちが証券法に基づいて登録するか、あるいは登録要求の免除がない限り、あなたに提供できません。また、預金契約によれば、口座開設銀行は、権利およびどの関連証券が証券法に基づいて登録されているか、またはこれらの権利を米国預託株式所有者に配布して証券法による登録を免れない限り、権利を提供しない。私たちは、そのような権利や証券について登録声明を提出する義務がありません、またはその登録声明の発効を促すために努力しています。しかも、私たちは証券法に基づいて登録免除を確立することができないかもしれない。保管人が権利を割り当てない場合、保管者プロトコルに従って、それは可能な場合にこれらの権利を販売することができ、またはこれらの権利の失効を許可することができる。したがって、あなたは私たちの株式発行に参加できず、あなたの保有株式の希釈を経験することができるかもしれない。
私たちは外国の個人発行者になる資格があり、これは私たちがアメリカ証券法の下の多くの規則に制約されていないことを意味し、アメリカ国内登録業者よりもアメリカ証券取引委員会に提出することが許可されている情報が少ないことを意味する。
我々は、米国証券取引委員会規則及び条例で定義されている“外国個人発行者”の資格に適合しているため、米国内で設立された会社又は米国内登録者の開示義務に制約されている会社のすべての要件に適用されない。例えば、私たちは現在、1934年に改正された米国証券取引法または取引法の下のいくつかの規則の制約を受けておらず、これらの規則は、取引法に従って登録された証券の募集に適用される依頼書、同意または許可に関連する開示義務および手続き要件を規範化している。また、我々の役員及び取締役は、我々の証券を購入·販売する際には、“取引法”(16)節の報告及び“短期”利益回収条項及び関連規則の制約を受けない。しかも、私たちはアメリカ国内登録者のように頻繁に、あるいは適時にアメリカ証券取引委員会に定期報告書と財務諸表を提出する必要はありません そして私たちの財務諸表はアメリカ公認会計基準に従って作成される必要はありません。したがって,米国内登録業者よりもわが社に関する公開情報の方が少ない可能性があり,我々が報告義務を履行するためにかかる資源も米国国内登録業者よりも少ない。
外国の個人発行者として、12月31日までの各会計年度終了後4ヶ月以内にForm 20-F年次報告書を提出し、これらの事件を公開発表し、当社の財務業績を開示した後、特定の重大事件に関連するForm 6-K報告書を直ちに提出します。しかし、上記のような外国個人発行者に対する免除により、我々の株主は、米国国内登録業者株を保有する投資家と同様の保護や情報を得ることはできない。
外国の個人発行者として、私たちは米国で組織された上場企業のいくつかのナスダック社の管理規則に適用される制約を受けない。
私たちは私たちが会社統治のいくつかの側面でイギリスの会社法に従うことを可能にするナスダック社のガバナンス規則の条項に依存する権利がある。これにより、私たちはいくつかの重大な面でナスダックに上場するアメリカ上場会社に適用される会社管理要求とは異なる会社管理やり方に従うことができ、これらの要求は私たちの株主の保護よりも米国上場会社に適用されるナスダック規則が投資家に保護を与えるよりも劣るかもしれない。
私たちは私たちの取締役会の運営と関連して開示されたナスダック基準と規則から逸脱する権利がある。イギリスの法律は独立取締役のみが出席する会議を定期的に手配することを独立役員に要求しないため、ナスダック上場規則第5605条(B)(2)条の制約を受けない。同様に、イギリスの法律は私たちに報酬委員会を設立することを要求しないし、その委員会が完全に独立した役員で構成されることも要求しない。したがって、私たちの給与委員会の実践はナスダック上場規則第5605条(D)条の要求とは異なる可能性があり、後者は報酬委員会の職責、構成、独立性に対していくつかの要求を提出した。イギリスの法律は、取締役が私たちの指名(直接または間接)によって任命された取締役の子会社業務としてのサービスおよび任意の他の業務の取締役サービスの報酬情報を開示することを要求しているが、私たちの取締役または取締役が有名人になった他の第三者の報酬ではない。したがって、我々のやり方は、ナスダック上場規則第5250(B)(3)条の第三者報酬開示要件とは異なる。また、私たちはナスダック上場規則第5605条(E)条の規定に制限されていません。イギリスの法律によると、董事が著名人を獲得するには、半数の独立取締役または完全に独立取締役からなる指名委員会を経て選択または推薦する必要がないからです。
また,イギリス法は我々の委託書募集規制制度には適用されていないため,我々のやり方はナスダック上場規則第5620(B)条の依頼書募集に関する要求とは異なる。さらに、あるイベント、例えば、他の会社の株式または資産の買収、株式ベースの従業員報酬計画の確立または改訂、私たちへの支配権の変更、およびいくつかの私募については、株主が証券の発行を承認する必要がないことを選択しました。この程度では、我々のやり方は、ナスダック上場規則第5635条の要求とは異なり、後者は、発行者がこのような活動に関連する証券発行前に株主承認を得ることを一般的に要求する。また、商業行為と道徳基準を採用していますが、イギリスの法律は、取締役会が4営業日以内に承認したこの基準の免除を公開することを要求していません。したがって、私たちのやり方はナスダック上場規則第5610条の米国上場企業に対する要求とは異なる。私たちはその後の20-F表年次報告書でこのような免除を報告することを望んでいる。また,我々は“FD規例”と実質的に類似した企業開示政策を自発的にとっているにもかかわらず,重要資料の選択的開示を制限する“FD規約”を遵守する必要はない。これらの免除と寛大な処理は、あなたが本来取得する資格があるアメリカ上場企業に関する情報と保護の頻度と範囲を減らすことになります。
ナスダックに上場する私たちの規定によると、私たちの監査委員会は、2002年の“サバンズ-オクスリ法案”第301節または“サバンズ-オクスリー法案”と“取引所法案”第10 A-3条の規定を遵守しなければならず、この2つの規定は米国上場企業にも適用される。しかし、私たちは外国のプライベート発行者であるため、私たちの監査委員会は、監査委員会のすべてのメンバーが“独立している”と肯定的に決定することを含む、米国上場企業に適用される追加的な要求に制約されておらず、外国のプライベート発行者として適用される基準よりも厳しい基準を使用して、取引法規則10 A-3で許可されているいくつかの段階的な要件を遵守している。
我々は“新興成長型企業”であり、新興成長型会社に適用される開示要求を低減することは、私たちの米国預託証明書の投資家に対する魅力を低下させる可能性がある。
私たちは新興成長型会社、またはEGCと呼ばれ、以下のような以前に発生する日までEGCと呼ばれる:(I)2026年までの最終日、(Ii)私たちの年間総収入が少なくとも12.35億ドルの会計年度の最終日まで、(Iii)米国証券取引委員会の規則によると、“大型加速申告会社”の会計年度の最終日とみなされ、これは前年6月30日まで、非関連会社が保有する株式証券の時価が7億ドルを超えることを意味する。そして(Iv)私たちは前3年間に10億ドルを超える転換不可能債券を発行した日。私たちがまだEGCである限り、私たちは他のEGCではない上場企業に適用されるいくつかの開示要求の免除に依存することを許可され、意図されている。これらの免除には
•サバンズ-オキシリー法404節または404節の監査人認証要件の遵守が要求されていない;
•本年度報告では、いかなる規定も監査されていない中期財務諸表を除いて、2年間の監査済み財務諸表しか提供できず、それに応じて“第5項--経営·財務回顧及び展望”の開示を減少させる
•役員報酬に関する開示義務の削減;
•役員報酬や黄金パラシュート手配について拘束力のない相談投票を求める要求を免除する。
私たちは利用可能な免除の部分を利用することを選択するかもしれない。この年間報告書で、私たちは減少した報告書の負担を利用した。特に、私たちは私たちがEGCでなければ必要なすべての役員報酬情報を含まない。私たちがこれらのいくつかまたはすべての免除に依存すれば、投資家が私たちのアメリカ預託証明書の魅力が低下していることを発見するかどうかは予測できない。もし一部の投資家が私たちのアメリカ預託証券の吸引力が低下していることを発見すれば、私たちのアメリカ預託証券取引市場はそれほど活発ではなくなり、私たちのアメリカ預託株式価格はもっと変動する可能性があります。
また,JumpStart Our Business Startups ActやJOBS Actは,EGCは延長された過渡期間を利用して新たな会計基準や改訂された会計基準を遵守することができると規定している。これにより、企業会計基準委員会は、これらの基準が民間会社に適用されるまで、特定の会計基準の採用を延期することを可能にする。この延長された移行期間を利用しないことを撤回できないことを選択したので、他の上場企業では新たな会計基準や改訂された会計基準を採用する必要がある関連日にこのような基準を採用する。
米国預託証明書が米国で公開取引されている会社として、私たちの運営にコストがかかり、私たちの経営陣は現在も将来も新たなコンプライアンスを実施するために多くの時間を投入する必要があります。
サバンズ-オクスリ法案及びその後アメリカ証券取引委員会とナスダックが実施した規則は上場企業の有効な情報開示、財務制御と会社管理実践に対して各種の要求を提出した。私たちの経営陣と他の人たちはこのようなコンプライアンス計画を実施するために多くの時間を投入する必要があるだろう。しかも、このような規則と規制は私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をより時間的で高価にするだろう。例えば、これらの規制は、私たちが役員や上級職員責任保険を獲得することをより困難で高価にする可能性があると予想されます。
第404節によれば、当社の経営陣による財務報告内部統制に関する報告書を提出しなければならない。当社の独立公認会計士事務所が発行した財務報告内部統制に関する認証報告書を含む。しかし、私たちはまだEGCですが、私たちは私たちの独立公認会計士事務所が発行した財務報告書の内部統制に関する認証報告書を含むことを要求されません。規定された時間内に第404条の規定に到達するために、コストが高く、挑戦的である財務報告書に対する私たちの内部統制の過程を記録して評価する。この点では、外部コンサルタントを招聘することが可能な内部資源を継続的に提供する必要があり、詳細な作業計画により、財務報告内部制御の十分性を評価して記録し、適宜ステップ改善制御プログラムを採用し、制御措置がファイルのように機能しているかどうかをテストすることにより、財務報告内部制御の継続報告及び改善手順を実施する。私たちが努力したにもかかわらず、私たちは規定された時間枠内で結論を出すことができないというリスクがあり、すなわち、私たちは財務報告書の内部統制に有効であり、404節の要求に適合する。これは、私たちの財務諸表の信頼性に自信を失ったため、金融市場に不利な反応をもたらす可能性がある。
財務報告書の内部統制に重大な欠陥があることが発見され、将来的に重大な欠陥が発見されたり、適切かつ効率的な内部統制が維持されなかったりする可能性があり、タイムリーかつ正確な財務諸表を作成したり、詐欺を防止する能力を弱める可能性があります。もし私たちが効果的な内部統制を確立し維持できなければ、株主は私たちの財務や他の公開報告書に自信を失う可能性があり、これは私たちの業務と私たちのアメリカ預託証明書の取引価格を損なうだろう。
会社財務報告内部統制とは、会社の主要な行政人員と主要な財務官或いは類似の機能を履行する人員が設計或いは監督するプログラムであり、国際会計基準委員会(IASB)が発表したIFRS会計基準に基づいて財務報告の信頼性と財務諸表の作成に対して合理的な保証を提供するために、会社の取締役会、管理層及びその他の人員によって実施される。重大な欠陥は財務報告内部制御の欠陥或いは欠陥の組み合わせであり、年度或いは中期財務諸表の重大な誤報が合理的な可能性があり、適時に防止或いは発見できないようにする。
改正された“2002年サバンズ-オキシリー法案”(Sarbanes-Oxley Act)第404(A)条は、経営陣に財務報告書の内部統制に対する私たちの有効性を毎年評価し、報告し、財務報告書の内部統制に対する私たちの重大な弱点を見つけることを要求する。“サバンズ·オキシリー法案”第404(B)節では、財務報告に対する内部統制の有効性を示す独立公認会計士事務所の年次報告書の発表を求めているが、“雇用法案”で提供された免除に依存することを選択しているため、新興成長型企業でなくなる前に、第404(B)節を実施する米国証券取引委員会規則の遵守を求められなくなる。
今回の評価では、2023年12月31日現在の財務報告内部統制における以下のような大きな弱点が発見され、いずれも2022年12月31日までの年度総合財務諸表を作成した際に発見された
1.私たちは全体的な過程で効率的なプロセスや制御を維持していませんCOに関するものも含めて私たちの財務諸表の終了過程で一貫した審査手続きを維持する適切な職責分担を維持すると同時に、会計事項を適時、正確に適切に分析、記録、開示する
2.我々は,財務諸表作成に重要な意味を持つ情報システムの有効な情報技術一般制御を実施·維持しておらず,変革管理やシナリオ開発の制御に加え,このようなシステム内で衝突する役割を適切に分離した制御を行っている
上記のような重大な欠陥のため、我々の経営陣は、2023年12月31日現在、財務報告に対する内部統制が合理的な保証水準に達していないと結論した。
上級管理職と監査委員会の監督の下で、財務報告に対する私たちの内部統制を評価し続け、発見された重大な弱点をさらに解決するためのいくつかの救済措置を取っている
•私たちは、適切な役割分担を維持するための制御を含む、設計された情報技術一般的な制御措置を実施し、運営している
•我々は、COSOフレームの構成要素を処理するために、正式なプロセスと制御を実施して記録することを含む財務報告の内部制御の実施と評価を支援するために、十分な技術会計専門知識を有する外部専門顧問を招聘し、正式な会計政策とプログラム、制御運営の証拠を維持し、職責を会計者に分離する
•私たちは、情報技術の一般的な制御と適切な役割分担を維持するための制御を含む、私たちの財務制御環境の設計を決定するために、十分な技術会計の専門知識を備えた外部専門顧問を招聘した
•我々は、財務チーム内に必要な専門知識と帯域幅を確保するために、上記のような重大な弱点を解決するために、情報技術の一般的な制御を実施·実行する上で豊富な経験を有する上級者を雇用することを確保し、我々の人員に対する訓練を強化し、制御責任を明確に伝達する。
しかし、上記のような重大な弱点のため、経営陣は、2023年12月31日現在、財務報告の内部統制が合理的な保証水準では有効ではないと結論しており、2023年12月31日現在、財務報告の内部統制の大きな弱点はまだ完全に救済されていないと結論している。
私たちが取っている行動は私たちの実行管理層の持続的な検討を受け、監査委員会によって監視されるだろう。私たちは可能な状況でできるだけ早くこの救済過程を完成させるつもりだが、現在のところ、どのくらいの時間がかかるかは推定できず、私たちの計画は重大な弱点を解決することに成功しないかもしれない。
財務報告書の内部統制の有効性を独立して評価すれば、我々の経営陣の評価では発見できない可能性のある問題が発見される可能性がある。財務報告書の内部統制には、発見されていない重大な欠陥があり、財務諸表の再記述を招く可能性があり、救済費用が発生することを要求しています。もし私たちが発見した重大な弱点の是正に成功できなければ、もし私たちが他の重大な弱点を発見した場合、あるいは私たちが財務報告に対して有効な内部統制を持っていることを他の方法で継続的に決定できなければ、私たちの財務報告の正確性とタイミングは不利な影響を受ける可能性があり、私たちは定期報告書のタイムリーな提出に関する証券法の要求を守り続けることができず、適用される証券取引所の上場要求は、投資家が私たちの財務報告に自信を失う可能性があり、私たちのアメリカ預託証明書の価格はしたがって下落する可能性がある。私たちはまたナスダック、アメリカ証券取引委員会、または他の規制機関の調査の対象になる可能性がある。私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
私たちは取引法の特定の報告書の要求事項を守らなければならない。我々の開示制御および手続きは、取引所法案に基づいて提出または提出された報告書において開示されなければならない情報が蓄積され、米国証券取引委員会規則および表で指定された期間内に管理層、記録、処理、まとめおよび報告に伝達されることを合理的に確保することを目的としている。任意の開示制御およびプログラムまたは内部制御およびプログラムは、発想および動作がどのように完全であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを確保することしかできないと信じている。これらの固有の限界には,意思決定における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実がある.さらに、ある人の個人的な行動、2人以上の人の結託、または不正に制御を超えることは、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤った陳述や開示不足が発見されることなく発生する可能性がある.
もし私たちが(または私たちの非米国子会社である)“制御された外国企業”またはフルオロ塩化炭素であれば、あるアメリカ投資家に不利なアメリカ連邦所得税の結果をもたらすかもしれない。
一般的に、米国投資家が私たちの株式の総価値または総投票権の少なくとも10%を直接、間接的または建設的に所有しているとみなされる場合、米国連邦所得税の目的で、米国投資家は、私たちのグループの各CFC(あれば)の“米国株主”とみなされる可能性がある。米国連邦所得税については、米国株主が当該会社の株式総価値または総投票権の50%以上を直接、間接的または建設的に所有している場合、その非米国会社は通常CFC株となる。私たちのグループにはアメリカ子会社が含まれているので、私たちの現在の非アメリカ子会社、および将来新たに設立または買収される可能性のある任意の非アメリカ子会社は、私たちがフルオロカーボンとみなされているかどうかにかかわらず、フルオロカーボンとみなされるであろう。CFCsの米国株主は、米国の課税収入に比例して分配された“F分部収入”、“世界無形低税収入”と米国財産への収益投資を毎年報告することを要求される可能性があり、このCFCsがその株主にどのように分配されているかにかかわらず。また、フッ化炭素については、米国の株主である個人は通常、何らかの減税や外国税収控除を受けることは許されず、米国会社の米国株主はそうすることを許可される。フルオロカーボン報告義務を守らないことも米国の株主を巨額の罰金に直面させる可能性がある。“フルオロカーボン規則”に規定されている届出や納税義務を遵守するために必要な情報を米国の株主に提供することは保証されない。アメリカの投資家は彼らの税務顧問に相談して、彼らが私たちの普通株あるいはアメリカ預託証明書に投資する時にフッ化炭素規則が適用可能かどうかを知るべきです。
いずれの納税年度も“受動型外国投資会社”やPFICであれば、米国連邦所得税は米国投資家に悪影響を及ぼす可能性がある。
一般的に、私たちは、任意の課税年度に米国連邦所得税のPFICとなり、私たちの子会社にいくつかの前向き規則を適用した後、その年度内に、(1)私たちの総収入の75%以上が受動的収入からなるか、または(2)私たちの資産の平均四半期価値の50%以上は、受動的収入(現金および現金等価物を含む)を生成する資産からなる。これらのテストの場合、受動的収入には、他の事項に加えて、一般に、配当金、利息、いくつかの投資物件の売却または交換収益、およびいくつかの賃貸料および特許使用料が含まれる。もし私たちがいかなる納税年度内にアメリカ投資家が私たちの株を持っているPFICであれば、このアメリカ投資家が私たちの株を持っている後続の納税年度内に、このアメリカ投資家にとってはPFIC地位のハードル要求を満たさなくてもPFICとみなされ続ける。これらの米国投資家は、資本収益または実際または配当とみなされる任意の優遇税率、繰延税金とみなされるいくつかの利息費用、および追加の報告要件を含む、不利な税金結果の影響を受ける可能性がある。PFICルールの適用による届出や納税義務を履行するために必要な情報をこのような米国投資家に提供する保証はない
私たちの資産価値と私たちの収入と資産の性質と組成に基づいて、2023年12月31日までの納税年度中にPFICではないと予想されていますが、この点では保証できません。私たちが個人投資委員会の決定であるかどうかについては、毎年多くの事実に基づいて決定されており、採用されている原則や方法は場合によっては不明であり、異なる解釈がある可能性がある。例えば、私たちの現在と未来の納税年度について、PFICテストに使用されている資産(営業権を含む)の総価値は、私たちの普通株やアメリカ預託証明書の市場価格を部分的に参考にして決定される可能性があり、市場価格は大きく変動する可能性があります。もし私たちの時価が下がったら、私たちは任意の納税年度に大量の現金と現金等価物を持っていて、私たちはこの納税年度のPFICかもしれません。また、利子審査の下で、私たちの個人投資会社としての地位は、関連課税年度における私たちの収入構成にかかっており、これは
私たちが未来に行う取引と私たちの会社の構造。私たちの収入と資産の構成はまた私たちがどの発行で調達した現金をどのように使用するかの影響を受ける。候補薬物の商業化から収入を得ていないため,どの納税年度においても,受動的融資収入を相殺するのに十分な能動的収入が生じていなければPFICになる可能性がある。したがって,本課税年度や将来のいかなる納税年度でもPFICにならないことは保証されず,我々の米国弁護士は我々の前,本年度または未来納税年度のPFICの地位について何の意見も発表しない。私たちがある納税年度にPFICではないことを確認しても、アメリカ国税局(IRS)が私たちの結論に同意する保証はなく、IRSが私たちの地位に挑戦することに成功しない保証はありません。
PFICルールのさらなる議論と、私たちがPFICに分類された場合の米国連邦所得税の不利な結果、および米国投資家が獲得する可能性のある選挙については、本年度報告のタイトルを参照してください“第10.E項--付加情報--税金--米国連邦所得税の米国投資家に対する重要な考慮”アメリカの投資家は彼らの税務顧問に相談して、彼らが私たちの普通株あるいはアメリカ預託証明書に投資する時にPFIC規則を適用することが可能かどうかを知るべきだ。
私たちは純営業損失、税収控除、いくつかの固有損失を使用して、将来の納税を減らしたり、有利なイギリス税法から利益を得ることができないかもしれません。
イギリスの登録会社と税務住民実体として、私たちはイギリス会社の税金を払わなければならない。私たちの業務性質のため、私たちは設立以来赤字が発生したため、イギリスの会社税は何も納めていません。2023年12月31日まで、私たちは累計2.025億GBのイギリスの税金損失を繰越した。これらの基準および制限は、任意の関連する使用基準および制限(繰越損失によって減少可能な利益の割合を制限する基準および制限を含み、企業の普通株式の過半所有権が変化し、取引の性質、行為または規模が大きく変化する場合には、繰越損失の基準および制限の使用を制限することができる)を遵守した場合、これらの基準および制限は、将来の営業利益のための資格および制限を有することが予想される。
広く研究開発や研究開発活動を展開する会社として、私たちはイギリスの研究開発税収控除制度から利益を得ることを求めている。私たちの中小企業資格に適合する会計期間については、私たちが資格に適合する研究開発支出が総支出の40%(または2024年4月1日から総支出の30%を占める)以上(すなわち、この会計期間中には、私たちも“研究開発集約型”の資格に適合している)であれば、この制度によれば、条件を満たす研究開発支出の26.97%の現金リベートと引き換えに、私たちの研究開発活動による取引損失を返金することができる。したがって、今後私たちが研究開発集約型中小企業の資格に適合しなければ、私たちの研究開発活動について現金還付を申請することができなくなるか、あるいは現在よりもはるかに低い税率で現金支払いや他の税金減免を得ることしかできなくなる(イギリスの研究開発税収控除制度に基づく他の条項)。さらに、この制度の規則は複雑であり、税務機関が私たちの申請に疑問を提起したり、拒否(全部または一部)を求めたり、例えば、私たちが税金控除(または現金リベート)の技術的条件を獲得していないと断言することによって、成功すれば、このような挑戦または拒否は、私たちのキャッシュフローおよび財務業績に実質的な影響を与える可能性がある。また、将来的にイギリスが開発した税収控除制度の変化は、私たちが税金免除を受ける資格がなくなったこと、あるいは私たちが申請(またはそこから利益を受ける)の程度に実質的な影響を与えることを意味するかもしれない。
私たちは将来、特許製品の収入(および他の資格に合った収入)からのいくつかの利益を10%の実際の税率で課税し、追加の税務減額を与えることを可能にするイギリスの“特許箱”制度に恩恵を受けるかもしれない。私たちはいくつかの特許出願の独占許可者または所有者であり、これらの特許出願が発行されれば、私たちの候補薬物をカバーするので、将来の前払い費用、マイルストーン費用、製品収入、および印税はこの減額を受ける資格があるかもしれない。私たちの研究開発支出が強化された減免と組み合わせた場合、長期会社税率は法定税率を下回ると予想される。しかし、イギリスが開発した税収控除制度や“特許箱”制度に予期せぬ不利な変化が生じた場合、または何らかの理由で、私たちは
もし私たちがこのような優遇された税法を受ける資格がない場合、あるいは純営業損失と税収控除といくつかの内在的な損失を利用して未来の納税を減らすことができなければ、私たちの業務、経営業績、財務状況は不利な影響を受けるかもしれません。これは私たちの現在の投資需要と追加投資が必要な時間枠に影響を及ぼすかもしれない。
私たちが事業を展開している国では、税制の変化や不確実性が私たちの財務状況や経営結果に大きな悪影響を与え、株主の純利益を減少させる可能性があります。
私たちは世界で事業を展開し、複数の管轄区域で所得税申告書を提出した。我々の総合的で有効な所得税率および私たちの米国預託証明書および普通株の税務処理は、税法、法規および条約の変化、またはその解釈、国または国際レベルで考慮または実施されている税収政策の措置および改革(例えば、経済協力開発組織またはOECDの税ベース侵食および利益移転プロジェクトに関する改革、またはEU委員会の措置)、私たちが業務を展開している司法管轄区域の税務当局のやり方、税務監査または審査によって生じる問題の解決、および任意の関連する利息または処罰を含む、複数の要因の重大な悪影響を受ける可能性がある。これらの変動は、限定される訳ではないが、営業収入、投資収入、受信された配当金または支払いされた配当金(特定の源泉徴収税の場合)への課税、または私たちの米国預託証明書または普通株に対する印紙税または印紙税備蓄税待遇を含むことができる。例えば、最近公布された“インフレ低減法案”は、他の規定を除いて、ある大企業の帳簿収入に対して15%の最低税率を徴収する。
将来どのような税制改革が提案され、公布されるか、あるいはこれらの変化が私たちの業務にどのような影響を与えるかは予測できませんが、これらの変化は、それらが私たちの運営する司法管区の税収立法、法規、政策、または実践に組み込まれていれば、私たちがこれまで支出し、私たちの財務諸表に支払うか、または計算すべき推定税負担を増加させ、他の方法で私たちの財務状況、将来の運営結果、特定の時期のキャッシュフロー、および私たちの運営している国の将来の全体的または有効な税率を増加させ、株主の税バックリターンを減少させ、税務コンプライアンスの複雑性、負担、コストを増加させるかもしれません。
税務機関はいくつかの税務立場に対する私たちの立場と結論に同意しないかもしれないし、予測できない方法で既存の規則を適用する可能性があり、意外なコスト、税収、あるいは予想される収益を達成できない可能性がある。
税務機関は私たちの税務立場に同意しないかもしれないが、これは税金負担の増加を招くかもしれない。例えば、イギリスの税務税関総署、アメリカ国税局、あるいは他の税務機関は、私たちの会社間の手配と譲渡定価政策に基づいて、私たちの知的財産権開発に関連する金額を含む、税収管轄権による収入分配と私たちの関連会社間で支払う金額を疑問視する可能性があります。同様に、税務当局は、私たちが課税関係が確立されていないと考えている司法管轄区域で納税し、国際税務条約によると、このような関連は一般に“常設機関”と呼ばれ、成功すれば、この断言が1つ以上の司法管轄区での予想納税義務を増加させる可能性があると断言することができる。
税務機関は私たちが重大な所得税債務、利息、罰金を支払うべきだと思うかもしれないが、この場合、私たちはこの評価に異議を唱える可能性があると予想される。このような評価に異議を唱えるには長い時間とコストがかかる可能性があり,評価に異議を唱えることが成功しなければ,その影響は適用された場合に予想される実際の税率を上げる可能性がある.
私たちの中央管理·制御場所がまだイギリス以外(または海峡諸島またはマーン島)にある場合、イギリス都市買収·合併規則または買収規則の条項における株主保護は適用されないだろう。
2021年9月22日、ExScience a Limitedは、ExScience a plcと呼ばれる上場株式会社に再登録された。司法基準に適合する場合には、買収法はイングランドとウェールズに登録設立された公共有限会社に適用される。本文書が発行された日まで,我々の中央管理·制御地点はイギリス(あるいは海峡諸島やマーン島)にはなく,“買収規則”の司法基準に適合していると考えられる。したがって、吾らは吾らが現在買収規則に制約されていないと信じているため、吾らの株主は現在、買収規則が提供するいくつかの買収要約保障を有しており、強制買収要約に関する規則を含む権利がない。
これが変化した場合、または買収規則に対する買収·合併委員会または買収委員会の解釈や適用が変化した場合(買収委員会評価買収規則がイギリス以外に上場するイギリス企業に適用される証券のあり方の変更を含む)、買収規則は将来的にわれわれに適用される可能性がある。
“買収規則”は、会社の買収を監督·進行する枠組みを提供する。以下は、買収規則の中でいくつかの最も重要なルールの簡単な概要である
•潜在要約では,潜在入札者やその代表が交渉した後,同社が“デマや推測の対象”となったり,会社の株価に“不利な変動”が生じたりする場合には,潜在入札者に同社に対する潜在要約の公開発表を要求したり,潜在要約の審査を公開したりすることを要求する.
•(A)一定期間内の一連の取引または一連の取引によって、企業が30%以上の投票権を有する株式の権益(買収規則において有効な制御を得るレベルとみなされる)または一連の取引によって、企業が30%以上の投票権を有するが保有していない株式の50%を超える株式を取得した場合、他の株式の権益を獲得し、投票権を有する株式の割合を増加させる。彼らは彼らまたは彼らと一致して行動した任意の人が要約発表前の12ヶ月以内に支払った最高価格で他のすべての株主に現金要約を提出しなければならない。
•要約者(すなわち、購入者)及びその任意の一致行動者が、要件期間内(すなわち、買収要約が指す株式の前)又は前12ヶ月以内に、あるカテゴリの投票権10%以上の株式を有する権益を買収する場合には、要約は、現金形式で行わなければならない場合、又は要約者又は任意の要人と一致して行動する者が当該期間中に支払う最高価格を当該カテゴリのすべての株主が選択する現金に添付しなければならない。また、契約者または任意の要人と一致して行動する者が要件期間内に任意の株式権益を取得する場合、株式に対する要約は現金または現金代替案が添付されていなければならず、価格は少なくとも要件期間内にこのような株式を購入する価格に等しい。
•公告が出された後,要人またはそれと一致して行動する誰かが被要約会社(すなわちターゲット会社)の株式権益を要約価値よりも高い価格で買収した場合,カプセルはそのように買収した株式権益のために支払われた最高価格を下回らないように引き上げなければならない.
•被要約会社は適任な独立コンサルタントを任命しなければならず,その要約財務条項に関する意見はすべての株主に通知しなければならないことと,被要約会社取締役会の意見を任命しなければならない.
•場合によっては独立株主の承認を得ない限り、被要人の財務顧問は、手配が公平で合理的であると考えない限り、選定された株主の特別または有利な取引を許可しない。
•すべての株主に同じ情報を提供しなければならない。
•要人又は被要人又はその代表の要約が発表した各文書について説明しなければならず,要人又は被要人の取締役(場合によっては)はその中に掲載されている情報に対して責任を負う。
•利益予測、数量化財務利益報告書および資産推定値は、規定された基準に従って行われなければならず、専門顧問が報告しなければならない。
•文書内またはメディアに発表された誤解、不正確、または確認されていない声明は、直ちに公開されて訂正されなければならない。
•被要約会社が要約過程で要約を挫折させる可能性がある行動は、株主がこれらの計画を承認しない限り、通常禁止されている。落胆させる行動は、例えば、サービス契約下での取締役の通知期間を延長すること、または目標集団の売却に同意することの重要な部分を含むであろう。
•要約期間中に関連証券の取引を開示し、要約当事者及び任意(直接又は間接)が1%以上の任意の種類の関連証券権益を有する者を含む場合は、関連証券の保有倉及び取引を迅速に開示しなければならず、これに対して厳格かつ詳細な規定がある。
•契約者と要人会社の従業員および要人会社の年金計画の受託者に告知しなければなりません。また、要約会社の従業員代表と年金計画受託者は、要約会社取締役会に通知したり、サイト上で要約の雇用への影響に関する単独意見を発表したりする権利がある。
私たちの株主の権利はアメリカの会社の株主に通常提供される権利とは異なるかもしれない。
私たちはイギリスの法律登録に基づいて設立された。普通株式所有者の権利、及びアメリカ預託証明書所有者のいくつかの権利は、イギリスの“2006年会社法”或いは“会社法”の規定、及び著者らの組織定款を含むイギリスの法律によって管轄されている。このような権利はいくつかの側面で典型的なアメリカ会社の株主権利とは違う。本年度報告の“プロジェクト10.B--補足情報である会社定款と定款”を参照して、我々に適用される“会社法”とデラウェア州会社法における株主権利と保護に関する規定との主な違いを説明した。
主な違いは以下の点である
•私たちの規定によると、総会の投票に提出されたどんな決議案も投票によって完全に決定されなければならない。イギリスの法律によると、私たちの定款は、会議に出席する各株主が1票のみとなり、投票方式での投票が要求されない限り、各株主が株式1株を保有するごとに1票となるように改正される可能性がある。米国の法律によると、各株主は通常、すべての会議で1株1票の方法で投票する権利がある
•イギリスの法律によると、いくつかの例外および適用されない場合を除いて、各株主は、一般に、任意の普通株を比例的に引受する優先購入権を有するか、または証券を現金と交換するために証券を普通株に変換する権利を有する。米国の法律によると、株主は通常、会社登録証明書または他の態様で特別に付与されない限り、優先購入権を持っていない
•イギリス法律及び当社の組織定款細則によると、ある事項は、組織定款細則の改正を含む、関連決議案(あるいは投票方式で75%普通株式を代表する株主に投票(自ら或いは代表を委任))の75%株主の承認を受けなければならない。これは私たちが取締役会が適切だと思う会社の取引を終わらせることをもっと難しくするかもしれない。米国の法律によると、会社の登録証明書の修正や他の重大な取引の承認は通常、多数の株主の承認を得るだけでよい
•イギリスでは、買収は買収要約や手配案として構築されることができる。イギリスの法律によると、買収要約による買収を求める入札者は、私たちが発行したすべての普通株/アメリカ預託証明書に対して買収要約を提出する必要があります。約90%以上の普通株式/米国預託証明書の受け入れを受けていない場合、イギリスの法律によると、入札者は私たちの100%の支配権を得るために“押出”を完了することができない。したがって、私たちが発行した普通株式/アメリカ預託証明書の90%を受け入れることは、デラウェア州の法律に基づいて組織された会社への買収要約の50%のように、私たちの任意の買収要約を買収する条件である可能性がある。対照的に、手配計画が成功した場合、入札者が私たちの100%の支配権を獲得することになり、会議で投票し、75%の普通株式(米国預託証明書代表の普通株式を含む)を代表する多数の株主の承認を得る必要がある
•イギリスの法律及び当社の組織定款細則によると、株主及び当社の株式に利害関係があると信じている他の者は、当社の要求に応じて自社の株式の権益に関する資料を開示する必要がある可能性があり、必要な資料を提供できないことは、株式譲渡の禁止、配当金の差し止め、投票権の喪失を含む株式付随権利の喪失や制限を招く可能性がある。アメリカの法律には一般的に似たような条項は存在しません
•株主総会の定足数は、総会で投票し、自ら代表出席を委任する権利のある少なくとも2人の株主、または株主が会社である場合は、正式に許可された代表が出席することを要求する。米国の法律によると、投票資格のある株式の多くは通常、株主総会に出席(自らまたは代表を依頼)しなければならず、定足数を構成している。定足数に必要な最低株式数は、会社登録証明書や定款の規定によって減少することができるが、通常は会議で投票する権利のある株式の3分の1を下回らない。
イギリス上場有限会社として、ある資本構造決定には株主の承認が必要となり、これは私たちの資本構造を管理する柔軟性を制限するかもしれない。
2021年9月22日、ExScience a Limitedは、ExScience a plcと呼ばれる上場株式会社に再登録された。イギリスの法律では、当社の取締役会は、株主の事前許可を得た場合にのみ株式(または任意の証券を株式として承認または転換する権利を付与する)を発行することができ、当該許可は、それがカバーする株式の額面総額を記載し、有効期間は最長5年であり、各認可は株主総会で採択された組織定款の細則又は関連する一般株主決議に規定されている。私たちは株主から許可を得ており、2021年9月15日から5年間の追加株式を割り当てており、満期時(すなわち少なくとも5年に1回)には継続許可が必要であるが、追加の5年間(またはより短い期限)がより頻繁に求められる可能性がある。
イギリスの法律はまた、新株が現金形式で発行された場合、株主は優先的に権を購入できると規定している。しかし、組織規約の細則あるいは株主は株主総会で特別決議案を採択することができ、この決議案は少なくとも75%の投票者が通過して、優先購入権を無効にする必要がある。この優先購入権の不適用期間は最長5年とすることができ、会社定款が可決された日から計算したり、株主特別決議案の日から計算したりすることができるが、それに適用されない株式を分配する許可期間よりも長くてはならない。いずれの場合も、このようなキャンセル申請は、満期時に我々の株主によって更新される必要がある(すなわち、少なくとも5年に1回)。私たちは株主から許可を得ており、2021年9月15日から5年間優先購入権を適用することができ、満期後(すなわち少なくとも5年に1回)に優先購入権を更新する必要がありますが、追加の5年期限(またはより短い期限)がより頻繁に求められる可能性があります。
イギリスの法律では、上場企業が株主の事前承認なしに自分の株を買い戻すことも一般的に禁止されています。一般的な決議とは、簡単な多数投票で採択された決議、その他の手続きのことです。この承認の最長期限は5年かもしれない。参照してください“プロジェクト10.B--補足資料--組織覚書と規約”
我々の組織規約では,イングランドとウェールズ裁判所はすべての株主苦情を解決する独占的なフォーラムであるが,証券法や取引法に基づく訴えは除外され,米国ニューヨーク南区地域裁判所は,証券法または取引法に基づいて提出された訴因を解決する任意の株主苦情を解決する独占フォーラムとなる。
我々の組織規約では,イングランド及びウェールズ裁判所は,すべての株主苦情(すなわち,我々を代表して提起した任意の派生訴訟又は訴訟,我々の取締役,上級管理者又は他の従業員が受託責任に違反したと主張する訴訟又は訴訟,会社法又は我々の組織定款細則のいずれかの規定により生じたクレームを主張する任意の訴訟又は訴訟,又はクレーム又は会社事務に関連する任意の訴訟又は訴訟を主張する任意の訴訟又は訴訟)を解決する独占的フォーラムであるが,証券法又は取引法に基づいて訴訟理由を提起する株主クレームは除く。米国ニューヨーク南区地域裁判所は、証券法または取引法に基づいて提起された訴訟理由の任意の株主苦情を解決する独占フォーラムである。また、当社の規約では、任意の個人または実体が当社の株式を購入または他の方法で取得するいかなる権益も、これらの規定に同意しているとみなされています。
このような裁判所条項の選択は、株主が司法裁判所において、私たちまたは私たちの役員、上級管理者、または他の従業員と紛争することに有利であると考えるクレームを提出する能力を制限する可能性があり、このような訴訟を阻止する可能性がある。他社の組織文書では,類似した排他的裁判所条項(証券法による訴訟,訴訟や訴訟に対する排他的連邦裁判所条項を含む)の実行可能性が法的手続きで挑戦されており,裁判所がわが社規約における排他的な裁判所条項を実行するかどうかには不確実性がある.しかも、私たちの株主は連邦証券法とその下の規制を遵守することを放棄してはいけない。もし裁判所が私たちの組織規約に含まれている任意の選択された裁判所条項が訴訟で適用されないか、または実行できないことを発見した場合、私たちは他の管轄区域でこのような訴訟の解決に関連する追加費用を発生させる可能性があり、これは私たちの運営結果や財務状況に悪影響を及ぼす可能性がある。イングランドおよびウェールズ裁判所、および米国ニューヨーク南区地域裁判所も、クレームを提起する株主が、クレームを提起する裁判所に位置するか、またはクレームを提起することを選択する裁判所を含む他の裁判所とは異なる判決または結果を行う可能性があり、このような判決は、私たちの株主に多かれ少なかれ有利である可能性がある。
一般リスク
重要な会計政策の見積もりや判断が正しくないことが証明されたり、財務報告基準や解釈が変化したりすれば、私たちの経営結果は悪影響を受ける可能性があります。
“国際財務報告基準”に従って財務諸表を作成することは、連結財務諸表および付記報告の額に影響を与えるために、管理層に推定および仮定を要求する。私たちの推定は歴史的経験、既知の傾向と事件、そしてこのような状況で合理的だと思う様々な他の要素に基づいていますプロジェクト5−経営と財務レビューと展望“これらの見積りの結果は,資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他のソースからは容易には見えない.総合財務諸表を作成する際に使用される重大な仮定と推定は、株式に基づく支払い準備、リース、収入確認、赤字契約、繰延税金回収可能性に関連している。もし私たちの仮説が変化したり、実際の状況が私たちの仮定と異なっていれば、私たちの運営結果は不利な影響を受ける可能性があり、これは私たちの運営結果が証券アナリストや投資家の期待よりも低くなり、私たちのアメリカ預託証明書の取引価格を低下させる可能性がある。
また、私たちは定期的に財務報告基準の適用に対する遵守状況を監視し、私たちに関連する新しい公告と草案を検討します。新しい基準、既存の基準の変化、およびその解釈の変化のために、私たちの会計政策を変更し、私たちの運営政策を変更し、新しいまたは修正された財務報告基準を反映するために、既存のシステムを実施または改善する必要があるかもしれません。または、私たちが公表した財務諸表を再陳述することを要求されるかもしれません。既存の基準のこのような変更またはその解釈の変更は、私たちの名声、業務、財務状態、および利益に悪影響を及ぼす可能性がある。
項目4.会社に関する情報
A.会社の歴史と発展
ExScience aは2012年に設立され、名称はExScience a Limitedであり、スコットランドの規則に基づいて設立された民間会社である。二零二一年六月二十九日、ExScience a plcはイングランド及びウェルズ法律によりExScience a Holdings Limitedとして登録設立され、名目上資産及び負債を有し、ExScience a AI Limited(前身はExScience a Limited)となる最終持株会社となり、会社再編を完了した。私たちの完全子会社はアメリカデラウェア州の会社であるエスダンカ社です。2021年8月、我々は正確な医薬バイオテクノロジー会社Allcell 100%流通株を買収した。2021年10月、我々は米国預託証券のナスダック世界精選市場における初の公募株を完成させた。私たちのアメリカ預託証券取引コードはEXAIです。私たちの普通株は上場していません
イギリスの登録事務所はイギリスのオックスフォードOX 4 4 GEオックスフォード科学学園シュレーディンビルにあります。登録事務所の電話番号は
+44(0)1865 818941。アメリカの主な実行事務所と送達代理店はビスカベイ大通りI 00番オフィスにあります。2106号室です。アメリカフロリダ州マイアミ33132号、私たちの電話番号は+1 954 406 8602です
2023年、2023年、2022年12月31日までの年間の実資本支出はそれぞれ2,670万GBと2,240万GBです。これらの資本支出は主に連合王国とオーストリアの不動産、工場と設備、レンタル改善、実験室設備及びコンピュータ設備とソフトウェアを含む。また,2023年12月31日,2023年12月31日,2022年12月31日までの年間で,RallyBio IPB,LLC,RE Ventures I,LLCの合弁企業とそれぞれ180万GBと20万GBを出資している。
米国証券取引委員会は、米国証券取引委員会に電子的に提出された報告書、依頼書、声明、その他の発行者に関する情報を含むインターネットサイトを維持している。このサイトの住所はwww.sec.govです。私たちのサイトの住所はwww.exScience a.aiです。本ウェブサイトへの参照は、非アクティブなテキスト参照のみであり、本年度報告で参照される本ウェブサイトまたは任意の他のウェブサイトに含まれる、または本ウェブサイトまたは任意の他のウェブサイトを介してアクセス可能な情報は、本年度報告の一部に属さない。
B.業務概要
我々は薬物設計会社であり,人工知能(AI)や他の技術を用いて患者のニーズを高度に満たしていない疾患に対する差別化薬物を効率的に設計·開発している。著者らのプラットフォームの重点は著者らの人工知能設計技術、翻訳システムと臨床モデリングを用いることによって可能な故障点を識別と解決し、それによって薬物開発の成功確率を高めることである。我々のプラットフォームは、異なる特性を有する複数の開発候補を発売することによって、現在の業界標準を超える設計目標を達成することができ、そのうちの4つは現在臨床試験中であることを証明した。私たちの内部チャネルは主に腫瘍学に集中していますが、私たちもパートナーとの設計能力を利用して、私たちのチャンネルを拡大して収入を創出しています
多くの候補薬剤が失敗したのは,予見可能な薬物設計問題によるものと考えられる。10年以上にわたって人工知能を利用してこれらの設計問題を克服し、より質の良い候補薬を作ってきました。我々はまた,人工知能に基づくシミュレーションをテスト·検証するための斬新な実験と自動化システムを統合した.我々の仮想設計と物理実験の閉ループはわが社の重要な利点であり、私たちのプラットフォームが迅速に学習でき、外部では得られないデータを生成でき、コスト効果と再現性があるからである
我々の技術プラットフォームは,プロダクション人工知能,能動学習,機械学習,物理に基づくシステム,大型言語モデル,他の多くの予測システムをカバーしている.しかし、私たちの技術の生産は永遠に測定可能な薬だ。我々は20以上の薬物計画を進めており,そのうち少なくとも2つの計画は2024年に臨床マイルストーンに達すると予想されている。私たちが作ったすべての薬物は、既知の競争相手に対して有意な設計優位性が必要であり、臨床的利益が予想され、明確に測定することができる
われわれの主要な内部候補薬はCDK 7阻害剤GTAEXS 617(‘617)であり,現在1/2期試験中であり,今年下半期に初歩的なデータが予想される。617は、CDK 7に関連する潜在的毒性を管理し、標的治療効果を最大限に向上させるために薬物動態を最適化することを目的とした正確に設計されている
著者らは百時美施貴宝のためにPKC-theta阻害剤を設計し、彼らはその後許可を得て、現在第一段階の臨床試験を行っている。PKC-thetaは関心の高い目標であり、十数社がこの目標のために化合物を設計しようとしているにもかかわらず、まだ競争相手の候補薬は十分な効力と選択性を持っておらず、私たちの候補薬物は一流になる可能性がある。私たちはこのプログラムと関連した持続的なマイルストーンと印税を持っている。
我々がINDを支援する研究には,LSD 1とMALT 1に対して別の2つの内部プランがある.この二つの候補者は競争的プロジェクトで知られている毒性を軽減するために設計されている。これらの毒性の源を知り,それらを設計することにより,臨床開発においてより高い成功確率を有する2つの候補薬剤が産生されていると信じている。
時間の経過とともに,我々が設計·開発した薬物の変革的な方式は,この業界の基本的な薬物経済学的モデル,すなわち私たちが言う“曲線転移”を変えることができると信じている。我々の目標は,より質の良い薬物を設計するとともに,技術やプロセスを改善することで投資需要を減少させ,同時に成功の可能性を高めることができることを証明することである
2023年と2024年のこれまでの主な成果
パイプ面の成果
•我々のパートナーである百時美施貴宝(BMY)は2023年2月にEXS 4318(‘4318)の第一段階臨床試験を開始し、EXS 4318はPKC-theta阻害剤であり、BMYは2021年に許可を得て、炎症と免疫学的潜在力を持っている
•2023年3月、他の2つの内部案は持続可能な発展を促進する研究に入った。それぞれの化合物、我々のLSD 1阻害剤EXS 74539(‘539)および私たちのMALT 1阻害剤EXS 73565(’565)は、ExScience aの完全資本によって所有され、血液学的および腫瘍学的潜在力を有する。
•著者らは2023年に1つの1/2期試験を開始し、著者らのCDK 7阻害剤GTAEXS 617(‘617)とGT ApeIron(GTA)の協力による卵巣癌、膵臓癌、HR+HER 2-乳癌、頭頚部癌、非小細胞肺癌と結腸直腸癌を含む6種類の異なる腫瘍タイプを研究した
パートナーシップの成果
•2023年9月、私たちはドイツのダムシュタットのメルクKGaA社と新しい多目的人工知能薬発見協力に署名した。協力の重点は新しい小分子薬物候補薬物を発見することであり、腫瘍学、神経炎症と免疫学に関連する。
•2023年10月、私たちは現在のセノフィ協力の最初のマイルストーンを実現したことを発表した。これはセノフィと始まった最初のプロジェクトだ。
•2023年12月、私たちはオープン慈善団体から230万ドルの寄付を得て、宿主インターフェロン反応の研究を推進し、これを大流行性インフルエンザの治療と予防の道とすることを発表した
•2023年12月、私たちは以前のセノフィとの協力に基づいて新しいプロジェクトを追加しました。これはExScience aが内部で発見したものです。この計画は腫瘍学的適応ではなく,内部で価値の高い腫瘍学的適応に集中できるようにしている。改訂された合意条項によると、ExScience aは4500万ドルまでの前金と臨床前マイルストーン支払いを受ける資格がある。
プラットフォーム成果
•2023年3月、私たちはベルリンシャーロット大学と協力することを発表した。これは、Charitéがクラウドベースの人工知能を使用して、現場で画像化されたサンプルを分析することができるので、私たちの主要な患者組織プラットフォームの拡張性を強調する。
•私たちは2023年に新しい自動発見実験室を開設しました人工知能と自動化のこのような統合は薬物設計過程に顕著な効率をもたらす可能性があると信じている。
•2023年7月、私たちはEXCYTE-1を発売し、これは展望的な観察研究であり、私たちの機能正確な医学プラットフォームの卵巣癌治療における潜在力を評価した。これは私たちの正確な医療プラットフォームの範囲を固形腫瘍に拡大する。
•2023年第4四半期には、目標仮説生成のための大型言語モデルを内部に展開しました。これらのモデルは,共通および独自データセットに基づいて,我々の既存の目標認識インフラと統合されており,我々の発見プラットフォームの生産性の向上を目指している.
•2024年2月、我々は急性骨髄性白血病(AML)に対する観察的臨床研究であるEXCYTE-2を開始し、我々の機能精密医学プラットフォームを用いて一次血液または骨髄サンプルで測定した体外薬物反応と実際の患者の臨床反応との関係を調査することを目的とした。
私たちの戦略
我々の戦略は精密設計と集積実験を組み合わせることであり,前者は原子ごとに意図的に化合物に置き,後者は実験を我々の技術プラットフォームに埋め込むことである.これは私たちが業界の平均レベルよりもっと速く、もっと有効な方法で、患者のためにもっと高品質、バランスと差別化された薬物を設計と開発することができ、成功確率がもっと高い。主に小分子の設計に注目することにより、私たちは他の薬物の成功に影響する複雑な問題を克服できると信じている。我々が新規設計を開始してから最終候補薬物の初回合成までの平均時間は約1年であり,従来法と比較して通常合成される化合物の数は10分の1未満である。
著者らの方法は薬物発見と開発過程を現代化し、薬物発見の複雑性に適した集成、人工知能優先、患者を基礎とする学習システムを現在主導業界の順序手作り方法に置き換えることを目的としている
私たちは薬が最初の段階で失敗することが多いと思う:設計。精密設計と総合実験により,薬物の発見を加速し,臨床成功の確率を高めることができると信じている。我々は薬物発見のコード化と最適化を駆り立て,従来の順序設計から脱却し,人工知能に基づく多パラメータ最適化を利用して精密工学薬物の創造を拡大した。
私たちの革新と先進的な技術と自動化は伝統的な方法よりも良い分子を設計することを目的としている。私たちは私たちのプラットフォームが臨床と商業成功の可能性を根本的に向上させる可能性があると信じている。
精密設計
薬物の潜在的効用は、最初に設計された瞬間からその化学構造にコードされる。化合物が合成および試験される前に、各原子および結合の位置は、それがヒト生物学的および疾患の信じられない複雑さとどのように相互作用するかを予め決定しておくであろう。化合物の分子構造はその効力、選択性、安全性、吸収、用量要求と製造可能性、及び薬物製品を定義する多くの他の特徴を決定する。いずれの候補薬剤も原子レベルで設計し,副作用を最大限に減少させ,最適な治療効果を実現すべきであると考えられる
任意のデータに基づいて設計する。高品質の薬物は数十個の異なるパラメータを満たす必要があり、これらのパラメータは目標製品プロファイルまたはTPPとして定義される。タンパク質構造や細胞解析のような単一のデータタイプは、TPPを設計するために必要なすべてのパラメータを提供することはできない。我々の人工知能プラットフォームはデータが知られておらず,数千個の機械学習,物理的および他の予測モデルに基づいてタンパク質構造,高含有量スクリーニング,薬理学,その他のデータを含む異なるデータタイプをモデル化し利用することができる.また,独自技術支援の実験室機能を開発し,各種高保真スクリーニングデータ(高含有量,生物物理,薬理と生化学)と構造生物学データを生成し,我々のプロジェクトに差別化された知見を提供した。
私たちの技術駆動の設計サイクルです私たちの設計理念はすべての分子がアルゴリズムで設計されるべきだということです我々は,強化学習,ディープラーニング,進化アルゴリズムを用いて人工知能の創造力を放出し,我々の設計目標に合った新しい化合物を正確に設計し選択する.我々の設計周期は以下のとおりである
多パラメータ最適化の利点。伝統的な薬物発見方法は順序設計の改善に重点を置いており、通常標的効力から始まり、それから選択性、それから他の特性を精製し、これはよく次善分子を招く。人工知能は多パラメータ最適化に優れており,我々のプラットフォームは通常可能なより複雑な端末に対して設計することができる.我々は非常に少ない開始データで分子を設計することに成功しており,X線構造があるかないか,高次元,高含有量のデータを直接用いることに成功している。我々はまた小分子二重特異性薬物と複雑な表現型終点を有する薬物を設計することができる。我々の知る限り,このような広いデータタイプを設計に統合できる他の設計システムはない
薬のデザインは学習の問題だ真の革新的な薬物を設計する際には,プロジェクト開始時に利用可能な情報が不足し,正確な解決策は大規模なデータセットやスクリーニングライブラリにはほとんど存在しない。言い換えれば、薬物設計はスクリーニングの問題ではなく、学習された問題だ。新しい目標も既定の目標もそうであり、前者は以前に何の仕事もしておらず、後者は既存の努力とは異なる新しい方法を作らなければならない。我々が新たな化学空間を探索し始めるにつれて,我々は現在のモデルの予測能力や適用分野の限界にある可能性が高い。私たちのシステムとモデルは学習と進化のために設計されています自然のように最適化された問題解決策を見つけることを可能にしています
総合実験
独自のデータと実験特許データの開発は,最も差別度の高い薬物の設計と開発に重要であると信じている。我々は,実験を内部に導入し,我々の技術プラットフォームと統合することで,その分野の他社と区別した.我々はすでに分析開発能(我々自身のタンパク質や細胞試薬を産生する)を開発し,患者からも直接組織を獲得している。内部で実験を行うことにより,我々が生成したデータの潜在的な品質を向上させることができる.高品質で再現可能な実験データは,我々の機械学習モデルを駆動するダイナミクスである.
効率的なデータ収集により情報利得を最大化する内部での実験もデータ収集効率の重要性を強調した.我々のチームは設計実験に能動学習を利用している.これにより,得られた情報を最大化するために,正確な化合物を効率的に選択して合成とテストを行うことができ,我々のモデルの有効性を推進することができる。これは我々の薬物設計原則と一致しており,個々の実験が重要であり,これらの実験を行うのはスクリーニングのために大きなデータセットを生成するのではなく学習システムを構築するためであり,これらのデータセットは余分であることが多い。これにより、仮想プラットフォームを精密実験と統合することができる
総合実験の進化です人工知能と自動化の統合は薬物設計過程に顕著な効率をもたらし、情報獲得を加速できると信じている。化学合成や実験に自動化技術を用いることで,サイクル時間を同時に減少させ,生物評価を多様化することが可能である。自動化すればより複雑な生物学を探索することが可能になります例えば,我々は現在,新たなアッセイタイプを検討し,複数の実験要素を同時に評価することができる(分析のスループットを増加させる)。我々の薬物設計と実験過程で自動化を実現すべき重要な点を確認し,2023年6月に牛津郡ミルトン公園に最先端の自動化施設を開設した。私たちはこれが私たちが価値のある分子知的財産権の発生を拡大するのにさらに役立つと信じている。
仮想と物理の間のループを閉じる私たちは自動化施設を設立した最初の会社であり、人工知能主導の薬物設計と実験の間の循環を閉鎖する可能性があると信じている。この施設は化合物管理,自動化化学合成,自動化生物スクリーニング能力を有しており,時間の経過とともにタンパク質の生産とDMPK分析の開発が可能になると予想される。また,AI生成設計,能動学習,AI逆合成/化学反応設計モジュールをハードウェアと統合した.我々は,物理世界における合成と実験と化合物の計算精度設計を協調させ,仮想世界と実世界との統合を推進するソフトウェアを開発した最初の会社であると信じている.これは私たちがもっと早く多くのことを学ぶことができるということを意味する
正確な医療プラットフォーム
患者は最高のモデルです。現在のモデルシステム、例えば成長細胞系は、臨床研究の前に薬物作用をシミュレートするために必要な細胞と環境の複雑な相互作用を持っていない。それらは文化適応、遺伝子移動の影響を受け、人類疾病の複雑性を概括することができない。著者らは疾患に最も関連するモデルシステムとして一次患者サンプルを利用し、薬物行為をシミュレーションするだけでなく、次世代目標の決定にも用いられている。我々は,初代細胞画像を解析するためのカスタマイズされたディープラーニングアルゴリズムのような様々な技術や人工知能駆動のデータ分析技術を展開している離体する薬物が妨害する。著者らはさらに単細胞トランスクリプトーム、ゲノム学、エピジェネティクスとプロテオミクスを含む直交マルチプレクスデータを収集し、薬物作用を定量化し、疾病状態を理解できるようにした。初のこのような展望性介入性研究において、著者らのプラットフォームは末期血液病患者自身の組織サンプル中の薬物活性からどの治療法が末期血液病患者に対して最も有効であるかを予測した。EALT−1はわれわれのプラットフォームの真の患者選択能力を証明し,54%の患者がこのプラットフォームのアドバイスに従い,彼らの以前の治療と比較して無進展生存期間(PFS)が1.3倍以上向上していることを示した
患者プラットフォームを拡張する。著者らの専門家チームがあれば、著者らは著者らの主要なサンプル収集を拡大し、主要なサンプルの事前分析を理解し、公表された検証された臨床妨害と疾病関連結果を利用して最先端の優先技術を配置し、多グループ学データに対して強力な分析と解釈を行うことができる。著者らの実験過程は血液(白血病)、リンパ節(リンパ腫)と固形腫瘍適応(組織、例えば悪性胸腹水と固体組織サンプル)を含む多種の組織タイプと腫瘍適応と互換性がある。2023年7月、著者らは卵巣癌展望性観察研究EXCYTE-1を発売し、著者らの機能正確な医学プラットフォームを評価した。2024年2月、私たちはEXCYTE-2を開始し、これは急性骨髄性白血病に対する観察性臨床研究であり、このプラットフォームをさらに評価する。この二つの研究とも両者の関係を調べた離体する私たちのプラットフォームを通じて薬物反応と患者の臨床反応を測定した。2023年3月には、欧州最大の大学病院の一つであるベルリンCharité-University≡tsmedizin(Charité)と協力することも発表され、病院はクラウドに基づく人工知能を用いてサンプルを現場分析し、実世界環境における当社のプラットフォームの拡張性を強調します。
プラットフォーム理念
モデル駆動の適応学習は,目標認識から臨床応用までである。著者らの全体理念は著者らの独自のデータセット、精確な設計と総合実験を用いて、現在の薬物設計と開発が直面している複雑な問題を解決する方法を学習することである。我々が調査している目標の40%以上は,我々の独自データベース中のデータを用いて生成された(表現型スクリーン,一次患者サンプル,および我々の知識画像と大型言語モデルの出力を含む).我々はこの方法をこれらの重要な発見分野に応用するだけでなく,同様の方法を臨床に応用し,臨床と臨床前データセットの生物学的および統計的モデルを応用して臨床試験設計に情報を提供することを目標としている。これは治療指数をよりよく定義する潜在的な利点を持つ。
パイプとパートナー関係
高度差別化された薬物を創出することで,重大な満たされていないニーズを解決し,患者の生活を改善することを目標としている。我々はすでに我々のプラットフォームで発表した上位8つの候補開発プロジェクトを通じて、業界推定と比較して、発見段階の時間を70%減少させることができ、これは資本効率の80%向上に転化する可能性があり、これまでよりも迅速に患者に新しい治療法をもたらす可能性があることを示した。私たちは急速に発展した発見管を持っていて、分子をここから私たちの臨床導管に進展させ続けるだろう
パイプに焦点を合わせる私たちのプラットフォームは私たちが新しい分子を迅速に発見できるようにしてくれる。われわれの精密な設計方法を駆動する技術は治療分野では知られていないが,内部で腫瘍学に専念することを選択した。我々の生物,翻訳,臨床インフラは腫瘍学を中心に構築されており,この分野の高い価値目標に資源を集中させることができるようになった。私たちは、財務的、戦略的観点から私たちの業務リスクを低減するために、他の治療分野でパートナーシップを構築したい。協力プロジェクトでも内部プロジェクトでも、私たちは厳格なプロジェクト選択の流れを経るつもりだ。これは私たちが何を提案して協力するのかを評価する時に熟慮して批判的にすることができるようにする。例えば,2023年10月に我々の仕事の重点を再配置し,差別化された価値の高い腫瘍学的目標に重点を置くことを発表した。これにはEXS 21546をサポートする臨床計画が含まれています2ARアンタゴニスト化合物。
分化した分子すべてのプロジェクトに対して,内部的にも協力的にも,特定の問題を解決するために異なる性質を持つ分子を設計したい.私たちの精密設計プラットフォームは、歴史的に扱いにくい目標や既知の設計欠陥を持つ目標に集中できることを意味します。次の表には、現在の候補導管および各候補目標が解決するための設計欠陥を説明します
| | | | | | | | | | | | | | |
| 目標.目標 | 位相.位相 | ターゲット市場 | 工業設計欠陥 | 重要なExScience a技術は |
| CDK 7 | ステップ1/2 | 複数の再発/難治性固形腫瘍の特徴 (n=約7.5万米国患者/年) | 他の臨床化合物は不可逆的であり,外部排出(トランスポーター)責任や他の臨床的により高い有害事象(AE)を引き起こす可能性のあるPK/PD問題がある | 能動学習と機械学習設計最適体内PK/PDパラメータと人体投与量
|
| PKC-theta | ステップ1 | 多種類の免疫学的指標 | 胃腸と心血管副作用の報告は、以前の化合物は比較的に悪い選択性と次善PKと関係がある可能性がある 低効力による亜治療性投与量 | 局所とグローバルのキナーゼ選択性を向上させるためのホットスポットとマルチタスクモデル 人工知能と実験の結合は、通常の人類の全血検査を強調した |
| LSD 1 | IND-Enablingを有効にする | 小細胞肺癌,急性骨髄性白血病と潜在的付加適応 (n=約45000人のアメリカ人患者/年) | 他に開発されているLSD 1阻害剤は不可逆的か、半減期が長い LSD 1阻害延長に関連する血小板減少症は,これらの化合物の用量制限毒性となる可能性がある | 能動的学習による新しい化学空間の探索を推進する 中枢神経系の露出率、効力、およびADMET特性を含む複数のパラメータを最適化するための機械学習モデル |
| Malt 1 | IND-Enablingを有効にする | 複数の血液学的指標 | 発育中の他の化合物は選択性に乏しく、UGT 1 A 1の抑制に関連する高ビリルビン血症は用量制限性毒性である可能性があることを意味する | 分子動力学モデルのホットスポット分析は、ポケットを定義し、キー相互作用を発見し、生成アルゴリズムを駆動する |
ADMET=吸収、分布、代謝、排泄、毒性;
CNS=中枢神経系;
Pk=薬物動態;
Pd=薬効学;
UGT 1 A 1=UDP−グルクロン酸基転移酵素1−1
GTAEXS 617(CDK 7阻害剤):第1/2段階;GTAは50%の所有権を持つ

未満足の需要/問題:細胞周期阻害剤の重要性はCDK 4/6阻害剤により明らかにされており,2022年に約90億ドルの売上を生み出している。CDK 7異常過剰発現は多くの癌適応によく見られ,予後不良に関与している。CDK 7は、細胞周期と転写におけるCDK 7のSの二重作用により、CDK 4/6阻害剤の治療結果を改善する機会を提供する
従来の開発作業で顕著な副作用を示したのは,共有結合作用機序や経口吸収不良による可能性がある。現在開発されているCDK 7分子の多くは共有結合あるいは長い半減期を有しており,有意な標的毒性が存在する可能性を意味している。また,開発されている2つの可逆阻害剤は輸送体基質であり,悪い吸収と高い胃腸毒性をもたらすことが予想される
私たちの解決策は業界標準の順序問題解決ではなく、我々の人工知能駆動の過程と多パラメータ最適化を使用して、開発中の他のCDK 7阻害剤の潜在的な設計欠陥を識別し、改善された目標製品プロファイルを決定し、差別化された分子を設計することができる。
•136種類の化合物のみをテストしたところ,まず我々のシステムによって設計された分子を認識し,我々のすべての特徴基準を満たすことができた.我々の選択的非共有結合候補化合物は、競合他社と比較してより良い吸収特性を有する高い標的効力および選択性を含む複数の基準に適合する
•抑制持続時間をもっとよく制御し、人体の半減期が比較的に短いことを予測し、そして非共有結合作用機序(MOA)を採用する:治療効果を増加させない場合、暴露時間を延長することはシステム毒性の増加を招く。
•他の可逆化合物と比較して、より高い効力およびより良い選択性:目標効力を維持しながら、目標から逸脱するリスクが小さい。
•流出減少(トランスポーター)問題:トランスポーターの問題は,可変吸収や胃腸(GI)中の化合物蓄積による胃腸問題を引き起こす可能性がある
•良好な経口生物利用度:CDK 7が腫瘍以外の任意の部位に保持されていれば、CDK 7を抑制することは全身標的毒性を引き起こす。吸収の可変性は超治療用量或いは亜治療用量を招くことができる。
臨床前には,24時間ごとにCDK 7 8−10時間のみを抑制することが重要であることが証明されている。マウスモデルでは,これよりも長い曝露時間が有意な体重減少をもたらすことが証明されている。
著者らの正確な医学プラットフォームは人々に異なる腫瘍タイプにおける単一療法としての‘617の活性を更に理解できるようにした。面と向かって離体する肺癌と卵巣癌適応を主に由来する原発患者材料を用いた解析では,‘617は免疫細胞に対する中位毒性は低いが,腫瘍細胞に対する殺傷作用は他の候補CDK 7 iと類似しており,非小細胞肺癌や卵巣癌に市販されているCDK 4/6 iである。
さらに、我々の正確な医学プラットフォームは、‘617と標準看護薬物/多標的治療との間の結合潜在力を研究するためにさらに配置された。
このプラットフォームはまた、相乗的組み合わせおよび薬効学(PD)バイオマーカーを探索するために使用される。下の図はこれらと現在の看護標準治療方案との相乗効果を示している。
1/2期試験を行っているELISTIFE試験は多中心、開放ラベル、2段階の臨床試験であり、‘617経口投与は単一療法及び標準看護療法と結合して使用する安全性、薬物動態学、薬効学と治療効果を評価することを目的としている。同社は固形腫瘍を有し、末期、再発または転移性疾患を有し、標準治療に合格できなかった患者を募集している。
試験の単一療法と併用療法用量増加部分はいずれも最大7用量レベルの患者を募集し,RP 2 Dを定義するにはいくつの用量レベルが必要かに依存する。試験の用量拡大段階はRP 2 Dを決定した後に開始する。拡張段階の主な治療効果の終点は客観応答率(OOR)である。
EXS 4318(PKC-theta阻害剤):ステップ1,BMYによるネットワークアクセス許可
未満足の需要/問題:PKC-thetaは魅力的な免疫調節薬物標的である;しかし、いくつかの大型製薬会社は必要な効力と選択性を有する小分子を設計できず、他の密接に関連するキナーゼに対抗する。以前のPAN−PKC阻害剤は臨床試験で胃腸や心血管に関連する有害事象が発生したことがある。これは,より悪い選択性および次善PKと関連している可能性がある.
私たちの解決策は私たちのプラットフォームは設計過程開始後11ヶ月以内に1種の高効力、高選択性の次世代免疫調節薬物候補薬物を設計しました。わずか150ですこれは…。分子が合成された。多様な薬理特性(種間PKと効力を含む)の総合計算から得られるヒト用量予測は非常に有利である。私たちのバランス候補者は高い選択性と有利な耐性を維持しながら、高い目標活性を示した
2023年2月、BMYはEXS 4318が米国で臨床試験に入ることを発表した。
EXS 74539(LSD 1阻害剤):INDをサポートしています
 未満足の需要/問題:LSD 1はAMLと小細胞肺癌(SCLC)において潜在力があると信じている。この2つの適応は高度に満たされていない需要があり,米国では毎年約45000名の確定診断患者がいる。LSD 1はヒストンを脱メチル化させ、ヒストンは分化抑制と多種の腫瘍タイプの増殖と生存を駆動する遺伝子発現を調節する上で重要な役割を果たしている。半減期の短い可逆性化合物は、タンパク質の重要な機能を回避するために重要であり、同時に癌細胞の静止および/または細胞死への分化を促進する。約50%の小細胞肺癌患者が脳転移を発生するため、血液脳関門を貫通することは小細胞肺癌(SCLC)に対する治療の重要な特徴である。これまで,他に開発されているLSD 1阻害剤は,適切な薬物動態,良好な脳透過性と可逆作用機序の組み合わせは実現できなかった
未満足の需要/問題:LSD 1はAMLと小細胞肺癌(SCLC)において潜在力があると信じている。この2つの適応は高度に満たされていない需要があり,米国では毎年約45000名の確定診断患者がいる。LSD 1はヒストンを脱メチル化させ、ヒストンは分化抑制と多種の腫瘍タイプの増殖と生存を駆動する遺伝子発現を調節する上で重要な役割を果たしている。半減期の短い可逆性化合物は、タンパク質の重要な機能を回避するために重要であり、同時に癌細胞の静止および/または細胞死への分化を促進する。約50%の小細胞肺癌患者が脳転移を発生するため、血液脳関門を貫通することは小細胞肺癌(SCLC)に対する治療の重要な特徴である。これまで,他に開発されているLSD 1阻害剤は,適切な薬物動態,良好な脳透過性と可逆作用機序の組み合わせは実現できなかった
私たちの解決策はEXS 74539(‘539)は、最初の有効な、選択的、可逆的、脳透過性LSD 1阻害剤である。我々は機械学習モデルを用いて、中枢神経系の顕在率、効力、ADMET特性を含む複数のパラメータを最適化した。539は、特定の癌サブタイプにおいてよく見られる脳転移を標的とする適切な中枢神経系貫通設計目標を達成する。以下の表では‘539が他のLSD 1阻害剤と比較した主要な特性を重点的に紹介した
生体内539の研究は、小細胞肺癌異種移植モデルにおいて良好な活性を有し、用量依存性の腫瘍増殖を阻害する作用を有することを示している。また,‘539は吸収,分布,代謝と排泄あるいはADMEにおいて良好なプロファイルを有しており,これらは重要な分子特徴であることが示唆された。現在臨床試験が行われている他のLSD 1阻害剤に比べて,‘539の予測ヒト半減期も短い。これまで行われてきた臨床前研究では安全問題は認められていない
EXS 73565(MALT 1プロテアーゼ阻害剤):INDをサポートしています
未満足の需要/問題:MALT 1はNF-κB経路の活性化に重要なタンパク質加水分解酵素であり、この経路は血液腫瘍中の悪性T細胞とB細胞の制御されない増殖を支持する。各種の血液病の治療方案は選択できるが、多くの治療方案は患者の需要を完全に満たしていない。そのため、併用投与はこれらの患者に重要な役割を果たす。現在の多くの治療方案(例えばBTK阻害剤)は薬物誘導肝障害、あるいはDILIを引き起こすことが知られている。Hyの法則は,Dilisを引き起こす可能性のある療法はビリルビンレベルを向上させる療法とペアリングすべきではないことを示唆している。臨床では他のMALT 1阻害剤のステントはUGT 1 A 1を著しく抑制し、UGT 1 A 1はビリルビン代謝に参与する酵素であり、臨床ではよく用量制限性毒性を招く。
私たちの解決策は我々の精密な設計方法はMALT 1に対する薬物の安全性を最適化するとともに,効力と選択性を生じた。565のインビボ研究は、単独治療においてもイブルチニブ(BTK阻害剤)との併用においても、マウスモデルにおいて抗腫瘍活性を有し、良好な薬物動態を有することを示している。毒理学研究により、‘565は受け入れ可能な治療指数があり、高いレベルの効力、選択性と安全基準を維持することができ、同時に意味的にUGT 1 A 1を抑制することを避け、後者は高ビリルビン血症を招く可能性がある。下図に‘565の製品概要,特にUGT 1 A 1の抑制レベル,および他のMALT 1阻害剤との比較を示す。
他の配管計画
私たちはいくつかの進行中のプロジェクトがあり、範囲は目標分析からリード最適化まで、私たちは絶えず私たちの業務モデルの中で新しいプロジェクトを起動し、私たちのプラットフォームによる資本効率を利用しています。我々の初代設計プラットフォームを用いて,住友製薬(Sumitomo Pharma)との“設計すなわちサービス”(DaaS)パイロット計画により,現在第1段階研究中のDSP−0038を含めてより多くの候補薬剤を開発した。私たちはこれらの住友プロジェクトに経済的利益がないにもかかわらず、それらは確かに私たちが分子を設計する能力に概念証明を提供し、これらの分子は人類に薬物を服用するために必要な監督管理、安全と毒理学要求を安全に満たすことができることを証明した。
私たちの協力は
私たちは現在メルクKGaA、セノフィ、BMYと重要な協力合意に達している。これらの合意のそれぞれに基づいて、候補者が選択されるまで、すべての薬物設計を行います。われわれの内部腫瘍学的パイプラインと同様に,われわれは最も成功確率の高い計画のみを進め,満たされていない需要を満たしている。パートナー関係は私たちの設計能力をパートナーに適した治療分野に拡張することができる。私たちのパートナーシップは、私たちのシステムに学習と改善の追加的な方法を提供し、リスク(財務的および戦略的なものを含む)をある程度低減するとともに、パートナーからマイルストーンと特許使用料支払いを受け取ることで、これらの候補の価値を維持することができるようにしている
著者らは自動化、精密設計と精密医学方面の技術と能力を通じて、著者らは硬目標のスクリーニングにおいて著者らのパートナーのために実質的な価値を増加させることに努力した-精確な設計候補薬物と臨床試験の患者選択を結合した。私たちは私たちの新しい技術と能力が未来の価値創造パートナーシップに変換されなければならないと信じている
私たちの医療パートナーは
| | | | | |
| メルク·カーガドイツのダムシュタットです2023年9月、私たちはメルクKGaAと新しい協力を達成した。この長年の協力はExScience aの人工知能駆動の精確な薬物設計と発見能力を利用し、同時にメルクKGaA、Darmstadt、ドイツの腫瘍学と神経炎症方面の疾病専門知識、臨床開発能力と全世界の足跡を利用した。協定条項によると、ドイツDarmstadtのMerck KGaAから2000万ドル(320万ドルの源泉徴収税を差し引くと、2024年下半期に受け取る予定)を取得し、3つの初期計画のすべてのマイルストーンが実現すれば、合計6.74億ドルにのぼる発見、開発、監督、販売に基づくマイルストーン支払いを受ける資格がある。ドイツのダムシュタットのメルクKGaA社が協力して最初の目標の一つである治療薬を商業化すれば、そこから2桁から低い2桁までの製品販売分級印税を得る資格がある |
| |
| 百時美施貴宝(BMY)著者らはBMYと腫瘍学、自己免疫、免疫学と炎症領域と協力して一連の複数の標的を研究している。パートナーシップは2019年にCelgeneと始まり,Celgeneを買収した後2021年にBMYと直接パートナーシップを拡大し,ExScience aの条項がますます報われている.BMYは貴重な治療領域の専門知識を提供し、臨床を通じて分子開発に資金を提供することを約束した。第二の取引は最初の取引の2年後に発生し、著者らのプラットフォームの力を示し、BMYの厳格な臨床前候補標準に高品質の候補薬物を提供することに成功した。このような取引は合わせて7500万ドルの前金を持ってきた。2021年8月、BMYは第1の協力協定に従って作成した免疫調節候補薬の選択権を行使し、2021年第3四半期に2000万ドルの記念碑的支払いをトリガした。この候補者、EXS 4318は、現在第1段階の研究にあり、ExScience aにマイルストーンと特許使用料を獲得させる可能性がある。2つ目のBMYプロトコルによると、私たちは1.25億ドルまでの臨床前マイルストーン支払いを受けるかもしれない。この取引の各目標は、臨床および販売マイルストーン支払いを含む2億5千万ドル以上の潜在的価値を私たちに支払い、各マーケティング資産の特許使用料を提供してくれます。2023年10月、我々はBMY協力の範囲内で他のプロジェクトを開発しないように、いくつかのプロジェクトを優先することを共同で決定した。 |
| |
| サイノフィです2022年1月、私たちはサイノフィと協力し、協力により、私たちの人工知能駆動のエンドツーエンド統合プラットフォームを使用して、腫瘍学と免疫治療分野の15個の新しい標的を発見し、検証する。われわれはサイノフェイと協力し,これらの目標のいくつかを小分子阻害剤薬物研究プロジェクトに進め,いくつかの小分子開発候補薬の決定を加速している。今回の協力では、私たちは1億ドルの前払い現金を受け取り、52億ドルまでのマイルストーン支払いと等級版税を得ることが可能です。2023年1月、協力を改訂し、新たな目標を発見·検証する翻訳研究計画を盛り込んだ。2023年7月、私たちは協定を第2回改正し、協力目標のいくつかの条項を変更した。2023年12月、セノフィは、私たちが最初に内部で発見した協力に追加の計画を追加した。私たちの2022年の協力は私たちとセノフィの二番目の協力だ。2019年に開始された最初の協力は、意図的に複数の治療標的に対する二重特異性分子を設計することであり、この協力下での作業は完了した。 |
私たちの非営利パートナーは
| | | | | |
| ビルとメリンダ·ゲイツ財団です2020年12月にゲイツ財団からマラリア、結核、非ホルモン避妊の治療法を開発するための420万ドルの寄付を受けました2021年6月、私たちはまた150万ドルの贈与を得て、私たちの人工知能薬物設計プラットフォームを使用して作成した新しい冠肺炎療法の最適化を加速するために使用した。2020年9月、我々はさらに協力を拡大し、ゲイツ財団と4年間の合意を達成し、現在のコロナウイルスの大流行に対応し、将来の大流行の準備を支援するための小分子療法を開発した。拡大後の協力は最初に広域コロナウイルス製剤(例えばSARS-CoV-2及びその変種MERS)の開発に重点を置き、SARS-CoV-2の主要なプロテアーゼ或いはMproに対する主導計画を加速することを含み、SARS-CoV-2は新冠肺炎を引き起こすウイルスである。私たちはすでに体外研究で私たちの設計目標に合った有望な化合物を設計し合成した。協力はインフルエンザとNipahのような副ミクソウイルス科に集中するプロジェクトに拡張された。この協力の一環として、ゲイツ財団は2021年10月に初めて公募しながら私募で1,590,909件の米国預託証明書を購入し、4年間で運営と第三者活動に資金を提供することで3500万ドルの全額寄付を約束した |
私たちが共有している協力は
| | | | | |
| ラリービオです2019年,我々はRallybioと共同開発と共有の合弁企業を設立し,複数のまれな疾患分野を調査した。7000から8000種類の稀な疾患があり、アメリカだけで3000万人以上の患者が影響を受けている。しかし,これらの疾患の潜在的治療法に関するデータは少なく,まったく存在しない。我々のプラットフォームのディープラーニング法は,このような知識の乏しい地域での新たな治療法の発見を加速させることができる。Rallybioの重要な治療領域と臨床知識は、私たちが本来解決を試みていない治療領域に入ることができるようにした。この合弁企業では,我々の人工知能プラットフォームを介して生物経路関連性と化学的薬物性リスクを評価した後,共同で目標を選択した。われわれは臨床前毒理学研究を完成させることでこの計画を推進しており,RallyBioはいずれかの候補薬が承認されれば臨床試験と商業化の過程で候補薬物を推進する。腫瘍学のような非まれな疾患適応を探索する分子を選択することもできますこのパートナーシップは、挑戦的な目標ENP 1上で最初の発見候補を交付した。 |
| |
| GT ApeIron治療会社(GTA)2019年、私たちの投資家の一人であるGT HealthcareはGTAを発売し、彼らは直ちに私たちと協定を結び、多種の腫瘍適応を治療するための新しい細胞周期阻害剤化合物を発見するために資金を提供した。最初の候補者はIND Enabling毒理学研究に参加した。このマイルストーンを実現した後、私たちはGTAの約13%の株式を得る資格がある。2021年7月、私たちは共同でこの協力を終了し、2019年に署名された合意に基づいて開発された候補者を含む、複数のプロジェクトを開発し、商業化するための共同運営とコスト分担手配をGTAと達成した。この新しい計画を実行する際には、元の取引によって取得する資格のある株式を30%削減し、GTAに200万ドルの現金を支払うことに同意した。 |
私たちのチームは
私たちは世界的な科学者と技術専門家チームを集めて、彼らはすべての薬物開発過程で協力して働いています。彼らは深い産業経験を持つ管理チームによって指導されている。私たちは世界的な会社で、イギリスのオックスフォードに本部を置き、ミルトン公園(イギリス牛津郡)に支店を設置しています。マイアミ(フロリダ州)、ボストン(マサチューセッツ州)、ウィーン(オーストリア)、ダンディ(イギリススコットランド)。私たちは世界各地から人材を募集し、引き続き私たちの業務に集中して募集する予定です。2023年12月31日まで、私たちのチームは50以上の国から483人で構成されている。我々のPharmaTech資質は技術者(会社の35%)と薬物発見科学者(会社53%)とのバランスに現れている。私たちのチームの約49%がオックスフォード本社で働いており、その中には2021年1月に完成した最先端の実験室が含まれている。
私たちの人々は独特な背景を持っているが、一つの共通の目標があり、それは技術と実験革新の合流点でもっとスマートで、もっと速い方法を見つけて新薬を発見し、開発することである。
私たちの文化は
私たちは人が私たちの最も重要な資産だと信じている。私たちは、非階層的な方法で協力、起業、革新の文化を作ることに集中していることが、私たちの成功の重要な理由だと信じています。
私たちの目標は、私たちの従業員が自分の専門分野で起業家になり、革新と卓越を追求していくことだ。文化的適合度は私たちの採用過程の重要な部分であり、採用したい人はいつも自分に挑戦し、リスクを負い、私たちと同じビジョンを持っているからです。私たちは積極的に進んでいる人たちに奨励し、失敗を学習と改善方法を知らせる機会と見なしている。
人材募集に成功したほか、従業員に発展、追加責任を負い、事業を発展させる機会を提供することにも取り組んでいる。内部人材の成長は重要であり,我々は根本的に異なる方法で薬物を設計しているため,我々の創始者が開発した方法に基づく機関知識は,薬物のより迅速な設計·開発を支援するために重要である
多様性は重要な重点分野だ。私たちは世界的な会社で、私たちの国際化は私たちの従業員チームに現れていて、彼らは6大陸から50以上の国を代表しています。私たちはExScience aが依然として包容的で歓迎される職場であり、すべての人のために働きながら、組織のすべてのレベルで私たちの性別、人種、文化的多様性を改善するために、内部計画とプロセスに引き続き努力するつもりだ。
競争
人工知能薬物発見と設計市場は急速に発展し、競争が激しく、そして絶えず変化する技術の影響を受けている。私たちの競争相手が使う技術は規模、広さ、範囲がそれぞれ違います。薬物発見と設計技術の発展に伴い、私たちは激しい競争と日々の競争に直面することを予想しています。
私たちは人工知能、予測モデル、先進的な生物分析を応用して、正確な薬物を迅速に設計し、開発している。我々の技術の広さを踏まえて,製薬やバイオテクノロジー業界の複数のカテゴリで競争を展開し,人工知能と計算技術を統合して薬物発見·開発活動の速度や精度の向上,および我々が追求している適応または選択可能な適応に対する治療法を開発している他の会社に取り組んでいる。そのため,大手製薬会社,バイオテクノロジー会社,学術機関,政府機関,財団,公共·民間研究機関などからの競争に直面している。
私たちの多くの競争相手は、単独でも、彼らの戦略的パートナーと一緒にも、私たちよりも多くの財力、技術、人的資源を持っている。したがって、私たちの競争相手は私たちよりも治療の承認を得ることに成功し、広範な市場受け入れを得ることができ、私たちの治療を時代遅れにしたり、競争力を欠いたりする可能性がある。バイオテクノロジーと製薬業界の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。これらの競争相手はまた、合格した科学·管理職を募集し、維持し、私たちの技術と相補的な技術を獲得する面で私たちと競争している。規模が小さいかスタートアップ段階にある会社も重要な競争相手かもしれません。
いくつかの会社が人工知能や他の複雑な計算ツールを含めて様々な技術を使用して、薬物開発を加速し、決定された候補薬物の質を向上させることが知られている。これらの会社にはRelay Treateutics,AbCellera,Schrodinger,Recursion PharmPharmticals,PathAI,Insitro,Valo Health,Cellarity,XtalPI,BenvolentAI,Absci,ATOM WISEがある。
製造業
私たちはどんな候補製品を生産するための製造施設も持っていないし、今のところ私たち自身の製造業務を発展させる計画もありません。我々は,我々が必要とするすべての原材料,薬物物質,完成品を第三者契約メーカーに依存して提供し,我々自身が開発した任意の開発候補薬物の臨床前と臨床開発に利用したい。私たちの発展に伴い、生産能力を再評価し、内部製造を構築する可能性がありますが、私たちはすべての予想される製造要求を複数のサプライヤーから得ることができると信じています。
知的財産権
私たちは新しい精密薬物と技術を設計し、特許と商業秘密の組み合わせによって私たちの革新を保護することを求めて、私たちが開発したすべての新しい技術や改善について、適切な知的財産権保護過程を考慮します。
私たちのビジネス成功は、候補薬物および私たちの未来の任意の候補薬、新たな発見、製品開発技術、およびノウハウの独自の保護を獲得し、維持する能力があるかどうかにある程度依存する;他人の独占権を侵害、流用、または他の方法で侵害することなく運営する;および他の人の侵害、流用、または他の方法で私たちの独占権を侵害することを防止する。私たちの政策は、米国と外国の特許の出願または許可と、私たちの独自技術、発明、および改善に関連する特許出願とを含む、私たちの独自の地位の保護を求めることであり、これらは私たちの業務の発展と実施に非常に重要である。私たちはまた、商標、商業秘密、技術ノウハウ、持続的な技術革新、許可機会の潜在力に依存して、私たちの独自の地位を発展させ、維持しています。
特許
我々は、2023年12月31日現在、公開されている4つの米国特許、14件の係属中の米国特許出願、および未公表の外国優先出願を含む150件以上の係属中の外国特許出願を有している。
これらの特許と特許出願は世界最大の27の異なる司法管轄区の25個の異なる特許家族に属している。我々の人工知能技術プラットフォームは、通常、数百種類のアルゴリズムおよび2500以上の予測モデルを含むので、商業秘密保護に依存する。私たちは時々私たちのプラットフォーム技術に関する特許出願を提出する。例えば、私たちは、許可された米国特許、許可された欧州特許、許可されたインド特許、係属中の米国特許出願、および欧州で係わっている外国特許出願を含む特許シリーズを有しており、その権利要件は、私たちのプラットフォームのいくつかの態様をカバーしており、発行された場合、特許期限調整または特許期間延長を含まない2030年に満了すると予想される。私たちはまた、私たちのプラットフォームのいくつかの態様に関連する未公表の係属中の国際特許出願を持っており、発行された場合、2043年に満了すると予想され、特許期限調整または特許期限延長を含まず、3つの公表された国際特許出願を含み、これら3つの出願は現在様々な国の段階に入っており、それぞれ2041年および2042年に満了する予定であり、特許期限調整または特許期間延長を含まない。
我々が設計した分子の特許保護については,我々は独自にこのような出願を持っているか,我々のパートナーと特許出願を共同で所有しているか,あるいは場合によっては我々のパートナーが独自に特許出願を持っている.例えば、我々は、我々の新規化合物に対する5つの公表された国際特許シリーズを有し、共同所有しており、その中には、許可された米国特許出願、4つの国際特許出願が含まれており、そのうちの3つは、現在異なる国段階に入っており、1つの未公表国際出願、3つのイギリス/欧州優先出願、およびオーストラリア、カナダ、中国、欧州、日本などの司法管轄区域で審査される100件以上の外国特許出願があり、これらの出願が発行されると、2039年から2042年の間に満了する予定である
私たちのような会社の特許地位は通常不確実であり、複雑な法律と事実の問題に関連している。バイオテクノロジー分野特許で許容される権利要件の範囲については,米国やヨーロッパなどでは一致した政策が出現していない。特許法律や規則の変化は、他の国の立法、司法裁決、または規制解釈によっても、私たちの発明を保護し、私たちの知的財産権を実行する能力を弱める可能性があり、より広く言えば、私たちの知的財産権の価値に影響を与える可能性がある。特に、第三者が私たちの任意の特許発明を直接または間接的に製造、使用、販売、提供、輸入、または他の方法で商業化することを阻止する能力があるかどうかは、私たちが私たちの技術、発明、および改善をカバーする特許主張を成功的に獲得、弁護、実行できるかどうかにかかっている。会社が持っている知的財産権については、私たちの任意の未解決特許出願または将来提出された任意の特許出願が特許を得ることを保証することはできませんし、私たちの任意の既存特許または将来私たちに付与される可能性のある任意の特許が、私たちのプラットフォームおよび候補薬物を保護し、それらを製造するための方法に商業的な用途を持つことを確実にすることはできません。また、私たちが発行した特許と将来発行される可能性のある特許は、私たちのプラットフォームの候補薬物の商業化において私たちの技術を実践する権利があることを保証できないかもしれません。バイオテクノロジーにおける特許や他の知的財産権分野は、多くのリスクと不確実性を有する発展している分野であり、これは、私たちの候補薬物や将来の候補薬物を商業化し、私たちの独自技術を実践することを阻止するかもしれない。
私たちが発行した特許および将来発行される可能性のある特許は、挑戦、縮小、回避、または失効される可能性があり、これは、競争相手のマーケティング関連プラットフォームまたは候補薬物を阻止する能力を制限するか、または候補薬物、将来の候補薬物、およびプラットフォームに対する私たちの特許保護期間を制限するかもしれない。さらに、発行された任意の特許によって付与された権利は、同様の技術を有する競合他社と比較して完全な保護または競合優位性を提供してくれない可能性がある。また,我々の競争相手は類似した技術を独立に開発し,類似した結果を実現する可能性があるが,方法は異なる.このような理由で、私たちは候補薬物の側面で競争するかもしれない。また、我々の候補製品の開発、テスト、規制審査に要する時間は、商業化後の有効特許保護の時間を短縮する可能性がある。当社のノウハウ、発明、改善、プラットフォーム、および候補薬剤に関連するこのリスクおよび他のリスクについては、タイトルを参照してください“プロジェクト3.D--重要な情報--私たちの知的財産権に関するリスク要因-リスク”
私たちのビジネス成功はまた第三者の独占権を侵害しないことにある程度依存するだろう。いかなる第三者特許を発行することが、私たちの製品やプロセスの開発または商業戦略の変更を要求するかどうか、あるいは許可証を取得したり、いくつかの活動を停止する必要があるかどうかはまだ確定されていません。私たちは、私たちの将来の製品を開発または商業化するために、任意の許可協定に違反したり、私たちが必要とする可能性のある所有権許可を得られなかったりして、私たちに悪影響を及ぼすかもしれません。もし第三者が米国で特許出願を準備して提出する場合、これらの特許出願も私たちが権利を持つ技術を要求する場合、私たちは干渉や派生手続きに参加しなければならないかもしれない
米国特許商標局、またはUSPTOは、発明の優先権を決定する。詳細は参照のこと“プロジェクト3.D--重要な情報--私たちの知的財産権に関するリスク要因-リスク”
私たちは時々アメリカで臨時特許出願を提出するかもしれない。仮特許出願は、1つ以上の関連仮特許出願を提出してから12ヶ月以内に非仮特許出願を提出しない限り、発行された特許となる資格がない。もし私たちがいかなる非臨時特許出願を直ちに提出しなければ、私たちは私たちの臨時特許出願に関する優先日と、私たちの臨時特許出願に開示された発明に対する任意の特許保護を失う可能性がある。私たちが提出する可能性のある任意の臨時特許出願に関連する非一時的特許出願をタイムリーに提出する予定であるが、このような特許出願が競争優位性を提供する特許の発行につながるかどうかは予測できない。
個別特許の期限は特許を取得した国の法的期限に依存する。私たちが出願したほとんどの国では、特許期限は、その特許に関連する非臨時特許出願が提出された最初の日から20年である。しかしながら、特許によって提供される実際の保護は、製品によって異なり、特許のタイプ、そのカバー範囲、規制に関連する延長の利用可能性、特定の国の法的救済措置の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する。場合によっては、米国特許は、USPTOからの特許取得の遅延を補償するために、特許期限調整、すなわちPTAを得ることもできる。場合によっては、このようなPTAは、米国特許期間を、米国特許に関連する非臨時特許出願を提出する最も早い日から20年以上延長する可能性がある。また、米国では、FDAが承認した薬物をカバーする米国特許の期限を延長する資格がある可能性もあり、これにより、FDA規制審査中に失われた特許期間の補償として特許期限の回復が可能となる。
商標
私たちの商標組み合わせは、2023年12月31日現在、世界77の商標登録または活発な商標出願を含む。このようなポートフォリオには、70個の非米国商標登録、4つの処理すべき非米国商標出願、3つの処理すべき米国商標出願が含まれる。
ビジネスの秘密。 私たちの発明、候補薬物、計画は特許保護に依存する以外に、私たちは商業秘密、技術ノウハウ、秘密保護協定、持続的な技術革新に依存して、私たちの競争地位を発展させ、維持します。例えば、特許分析、分析技術およびプロセスのいくつかの要素、投与および患者の管理方法、ならびに計算−生物学的アルゴリズム、ならびに関連するプロセスおよびソフトウェアのような臨床経験によって得られた知識は、開示されていない未開示の特許の商業秘密およびノウハウに基づいている。私たちは、従業員、コンサルタント、コンサルタントとの契約を含む、私たちの固有の情報やビジネス秘密を保護する措置を取っていますが、これらの合意は違反される可能性があり、私たちはどんな違反にも対応する十分な救済策がないかもしれません。さらに、サードパーティは、実質的に同じ独自の情報および技術を独立して開発することができ、または他の方法で私たちのビジネス秘密を取得したり、私たちの技術を開示したりすることができる。したがって、私たちは私たちの商業秘密を意味的に保護することができないかもしれない。私たちの政策は、私たちの従業員、コンサルタント、外部科学協力者、協賛研究者、および他のコンサルタントに、私たちとの雇用や相談関係を開始する際に秘密協定を実行することを要求します。これらの合意は、当方との関係過程において、関係個人又は実体に開示されたすべての当方の業務又は財務に関連する機密情報を秘密にしなければならず、特定の場合を除き、第三者に開示してはならないと規定している。従業員の場合、合意は、個人が雇用されている間に構想された、私たちの現在または計画中の業務または研究および開発に関連した、または合理的に私たちに使用できるすべての発明が私たちの独自の財産であることを規定している。また、第三者が私たちのノウハウを盗用することを防止するために、物理的および技術的セキュリティ対策のような他の適切な予防措置を講じている。しかし、そのような合意と政策は違反される可能性があり、私たちはこのような違反に対応するための十分な救済策がないかもしれない。私たちの知的財産権に関連するリスクに関するより多くの情報は、参照されたいプロジェクト3.D-重要な情報-リスク要因-私たちの知的財産権に関するリスク。”
政府の監督管理
アメリカ連邦、州と地方の各レベル及びヨーロッパ連合と他の国と司法管轄区の政府当局は、他の以外に、私たちが開発している薬物の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、普及、広告、流通、承認後のモニタリングと報告、マーケティングと輸出入などの方面に対して広範な監督管理を行った。私たちは、私たちのサプライヤー、第三者協力者、CRO、契約製造組織(CMO)と共に、研究を行いたい、あるいは私たちの候補薬物の承認を求める国家規制機関の様々な臨床前、臨床、商業承認要求を満たすことが要求されるだろう。米国や他の国や司法管轄区で上場承認を得る過程、その後適用される法規や法規、その他の規制機関の遵守には、多大な時間と財力が必要である。
アメリカの薬物開発の流れ米国では,FDAは連邦食品,薬物と化粧品法案(FDCA)とその実施条例に基づいて薬品を規制している。薬物開発プロセス、承認プロセス、または承認後の任意の時間に適用されるFDAまたは他の要件を遵守することができない場合、出願人は行政または司法制裁または他の法的結果を受ける可能性がある。他の事項に加えて、これらの制裁は、FDAが未解決の申請の承認の拒否、一時停止または承認の撤回、臨床的一時停止、警告または無見出しの手紙、製品のリコールまたは撤回、製品の差し押さえ、製造または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返還、または民事または刑事罰を含むことができる。
FDAが米国で発売される前に必要とされるプログラムは、一般に以下のような態様を含む
•FDAの良好な実験室規範或いはGLP要求と他の適用法規に従って臨床前研究を完成し、実験室テスト、動物研究と調合研究を含む
•ヒト臨床試験が開始される前に発効しなければならず、毎年更新または重大な変化が発生しなければならない研究用新薬出願またはINDをFDAに提出する
•各臨床試験が開始される前に、各臨床サイトの独立機関は、委員会または倫理委員会の承認を審査する
•良好な臨床実践またはGCPの要求に基づいて、その期待用途に使用されるべき薬物の安全性と有効性を決定するために、十分かつ制御されたヒト臨床試験を行う
•すべての重要な試験を完了した後、新薬申請またはNDAをFDAに提出する準備ができている
•FDAがNDAの使用料を審査するために支払う
•FDAは、セキュリティプロトコルを受信してから60日以内にセキュリティプロトコルを審査に提出することを決定した
•適用されれば、FDA諮問委員会の審査が満足的に完了する
•現在の良好な製造仕様またはcGMP要件に適合する状況を評価して、施設、方法、および制御が薬剤の特性、強度、品質、および純度を確保および維持するのに十分であることを保証するために、医薬品を製造する1つまたは複数の製造施設の承認前検査を良好に完了させることが好ましい
•FDAは、GCP要求のコンプライアンスを評価するために、NDAをサポートするためにデータを生成した臨床試験地点を監査することができる
•FDAは、米国で使用される特定の適応の薬物の商業マーケティングを可能にするためにNDAを審査および承認する。
人体でいかなる薬物をテストする前に、候補製品は厳格な臨床前テストを経なければならない。臨床前研究は化学、調合と安定性の実験室評価、及び体外実験と動物研究を含み、安全性を評価し、ある場合に治療使用の理論基礎を確立する。臨床前研究の進行はGLPの安全性と毒理学研究に対する要求を含む連邦と州の法規と要求を遵守しなければならない。米国で候補薬の第1回臨床試験が開始される前に,INDをFDAに提出しなければならない。INDはFDAがヒトを研究することを許可する薬物の要求である。IND提出の中心焦点は臨床研究の全体的な研究計画と方案(S)である。IND提出後も,いくつかの臨床前試験が継続される可能性がある。INDはまた、製品の毒性学、PK、薬理学および薬効学的特徴を評価する動物および動物のインビトロ研究の結果、化学、製造および制御情報、および研究製品の使用を支援するための任意の利用可能なヒトデータまたは文献を含む。INDはヒト臨床試験が始まる前に発効しなければならない。INDは、FDAが30日以内に提案された臨床試験に懸念または問題を提起しない限り、FDAが受信してから30日後に自動的に発効する
人間の研究対象が不合理な健康リスクに直面することが懸念されている。この場合,INDは臨床的に放置される可能性があり,INDスポンサーやFDAは臨床試験が開始される前に未解決の問題や問題を解決しなければならない。したがって,INDの提出はFDA認可による臨床試験の開始につながる可能性があり,そうでない可能性もある。
臨床試験は、GCP要求に適合する合格した研究者の監督の下で、すべての研究対象に任意の臨床研究に参加するためのインフォームドコンセントを提供することを含む、ヒト対象に研究薬を服用することを含む。臨床試験は,臨床試験の目標,投与手順,被験者の選択と排除基準,安全性モニタリングのためのパラメータ,評価すべき有効性基準などを詳細に説明する案に基づいて行った。製品開発中に行われる各後続の臨床試験および後続の任意のレジメン修正は、既存のINDに個別に提出されなければならない。また,臨床試験を行うことを推奨する各地点の独立したIRBは,その場所で臨床試験を開始する前に任意の臨床試験の計画を審査·承認し,完成まで臨床試験を監視しなければならない。IRBは試験参加者の福祉や権利の保障を担当し,臨床試験に参加する個人のリスクが最低に低下するかどうか,期待利益と比較して合理的かどうかなどの項目を考慮している。IRBはまた、各臨床試験対象またはその法律代表に提供されなければならないインフォームドコンセントを承認し、完成まで臨床試験を監視しなければならない。FDA、IRBまたはスポンサーは、対象が許容できない健康リスクに曝露されていることを発見することを含む、様々な理由で臨床試験を随時一時停止または中止することができる。同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬剤が患者に予期せぬ深刻な傷害を与えた場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。いくつかの研究はまた、臨床研究スポンサーによって組織された独立した合格専門家グループの監視を含み、このグループは、研究のいくつかのデータへのアクセスに基づいて、研究が指定されたチェックポイントで行うことができるかどうかを許可するデータ安全監視委員会と呼ばれ、被験者に受け入れられない安全リスクまたは他の理由があると判断された場合、臨床試験を停止する可能性がある。行っている臨床試験や臨床試験結果を公的登録機関に報告することも求められている。米国では,適用される臨床試験に関する情報は,臨床試験結果を含め,www.Clinicaltrials.govサイト上で発表するために特定の時間枠で提出されなければならない。
米国国外で臨床試験を行うスポンサーはFDAの認可を得ることができるが,INDによる臨床試験を希望している。試験がGCP要求に基づいて行われていれば,FDAはINDで行われていない工夫や良好な外国臨床試験を受け,必要であればFDAは現場検査でデータを検証することができる。
NDAの発売承認を支持するために治療適応を評価するヒト臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複または合併する可能性がある:
•第1期:候補薬剤は、最初に健康なヒト対象または標的疾患または状態を有する患者に導入される。これらの研究は通常、人体内での製品の安全性、用量耐性、吸収、新陳代謝と分布、および用量増加に関連する副作用をテストし、可能な場合に有効性の早期証拠を得ることを目的としている。いくつかの深刻または生命に危害を及ぼす疾患(例えば癌)を治療する製品の中で、特に製品がその固有の毒性のために道徳的に健康ボランティアに服用できない可能性がある場合、最初の人体試験は通常患者で行われる。
•第二段階:候補薬物は、初歩的な治療効果、最適な用量、用量耐性および投与スケジュールを評価し、可能な不良副作用および安全リスクを決定するために、特定の疾患または状態の限られた患者集団に使用される。より大規模かつより高価な第3段階臨床試験を開始する前に、情報を得るために複数の第2段階臨床試験が行われる可能性がある。
•第3段階: この候補薬物は拡大した患者集団に使用され、用量を更に評価し、統計学的意義のある臨床治療効果の証拠を提供し、更に安全性をテストし、通常複数の地理的に分散した臨床試験地点で行われる。これらの臨床試験は研究製品の全体的なリスク/収益比率を確定し、製品の承認に十分な基礎を提供することを目的としている。通常,FDAはNDAを承認するために2つの十分かつ制御された良好な第3段階臨床試験を必要とする。
承認後試験は,第4段階臨床試験と呼ばれることがあり,最初の上場承認後に行われる可能性がある。これらの試験は、通常、臨床環境における薬剤の使用に関する追加の安全データを生成するために、予期される治療適応下で患者の治療から追加の経験を得るために使用される。場合によっては,FDAはNDAを承認する条件として第4段階臨床試験を強制的に要求する可能性がある。
新薬開発期間中、スポンサーはいつかFDAと会う機会がある。これらの要件は、INDを提出する前、第2段階の終了時、および秘密協定の提出前にすることができる。他の時間に会議を開催することを要求することができます。これらの会議は,スポンサーにこれまで収集してきたデータに関する情報を共有する機会を提供し,FDAにアドバイスを提供し,スポンサーとFDAに次の段階の開発について合意することができる。
スポンサーは通常,第2段階試験終了時の会議を用いて第2段階臨床結果を検討し,重要な第3段階臨床試験計画を提出し,これらの計画は新薬の承認を支持すると考えている。
臨床試験と同時に、会社は通常追加の動物研究を完成し、候補薬物の化学的および物理的特徴に関する追加情報を開発し、cGMPの要求に基づいて最終的に商業的に候補薬物を量産するプロセスを決定しなければならない。製造過程は一貫して高品質の候補薬物ロットを生産することができなければならず、他の以外に、メーカーは最終薬物製品の特性、強度、品質と純度をテストする方法を開発しなければならない。
INDは活発であるが、前回の進展報告以来行われてきた臨床試験および非臨床研究結果をまとめた進展報告は少なくとも毎年FDAに提出されなければならず、書面IND安全報告は、試験スポンサーにおいて深刻かつ意外な疑わしい有害事象を報告する資格があることを決定しなければならず、他の研究から、同じまたは類似の薬物に曝露されたヒトに重大なリスクがあることを示す他の研究結果、動物または体外試験結果は、ヒトに重大なリスクがあること、および任意の臨床的に重要な疑似副作用発生率が方案または研究者マニュアルに記載されている場合と比較して増加してFDAおよび調査者に提出されなければならない。スポンサーはまた、FDAに任意の意外、致命的、あるいは生命に危害を及ぼす疑いのある副作用をできるだけ早く通知しなければならないが、いずれの場合も、スポンサーが初めて情報を受け取った後の7つの日数に遅れてはならない。
アメリカの審査と承認の流れ。すべての適用された法規要件に基づいて必要なすべてのテスト,製品開発,臨床前および他の非臨床研究および臨床試験の結果,および製造過程の記述,薬物化学の分析テスト,アドバイスのラベルおよび他の関連情報が,申請承認として1つまたは複数の適応に薬物を使用することを承認するセキュリティプロトコルの一部としてFDAに提出されると仮定する。データは、薬物の安全性および有効性を試験するために、または研究者によって開始された研究を含む多くの代替源からの臨床試験から来る可能性がある。上場承認を支持するために、提出されたデータは品質と数量で十分でなければならず、研究薬物の安全性と有効性を確定し、FDAを満足させる必要がある。機密協定の提出には多額の使用料が必要である;いくつかの条項により,このような費用の免除を受けることができる
状況が限られている。薬物がアメリカで発売される前に、NDAに対するFDAの承認を受けなければならない。
FDAがNDAを審査する目的の1つは、薬物がその予期される用途に対して安全かつ有効であるかどうかを決定し、その生産がcGMPに適合するかどうかを決定して、薬物の識別、強度、品質、および純度を確保し、維持することである。FDAが“処方薬使用料法案”(PDUFA)により達成した目標と政策によると,FDAは標準NDA提出日から10カ月以内に,新たな分子実体審査を提出させて行動させることと,優先審査のNDA提出日から6カ月以内を目標としている。FDAは、そのPDUFA規格または優先NDAの目標日を常に満たすわけではなく、審査プロセスは、FDAがより多くの情報を提供または明確にすることを要求することによって延長されることが多い。FDAは、届出を受ける前に、提出後の60日前にすべてのNDAを予備審査して、それらが十分に完全であるかどうかを決定し、実質的な審査を可能にする。FDAは秘密協定の申請を受け入れるのではなく、より多くの情報を提供することを要求するかもしれない。この場合、秘密協定と追加情報を再提出しなければならない。再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。
また,改訂されたPDUFAにより,秘密プロトコルごとに使用料が付加されなければならない.FDAは毎年PDUFAユーザ料金を調整する。場合によっては、小企業が初めて出願した出願料を免除することを含む、費用を免除または減免することができる。
FDAは薬物申請を諮問委員会に提出することができる。諮問委員会は,臨床医や他の科学専門家を含む独立した専門家からなるグループであり,申請を審査,評価し,申請を承認すべきかどうか,どのような条件でアドバイスを提供すべきかを担当する。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
NDAを承認する前に、FDAは通常、薬物を生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることが決定されず、要求された仕様内での薬物の一貫した生産を保証するのに十分であると判断しない限り、申請を承認しない。さらに、NDAを承認する前に、FDAは、通常、FDAに提出された臨床データの完全性に関連するGCPおよび他の要件に適合することを保証するために、1つまたは複数の臨床場所を検査する。FDAが申請、製造プロセス、または製造施設が受け入れられないと判断した場合、それは、提出された文書に不足点を列挙し、追加の試験または情報の提供を要求することが多い。任意の要求された補足情報が提出されたにもかかわらず、FDAは最終的に、その申請が承認された規制基準を満たしていないと決定する可能性がある。
FDAがNDAを評価した後,諮問委員会の提案(あれば)や製造施設や臨床試験地点に関する検査報告を含めて,FDAは承認状または完全な返信を発行することができる。この薬剤の商業マーケティングを承認し、特定の適応の処方情報を提供する。完全な返信は、申請の審査期間が終了し、現在の申請が承認されないことを示している。完全な応答は、一般に、FDAによって決定されたNDAにおける特定の欠陥を記述するが、FDAが申請をサポートするデータが承認をサポートするのに不十分であると判断した場合、FDAは、最初に必要な検査を行うことなく、および/または提案されたラベルを審査することなく、完全な返信を発行することができる。完全な返信を発行する際に、FDAは、追加の重要な段階3試験、または臨床試験、非臨床研究または製造に関連する他の重要かつ時間の要件のような追加の臨床データを必要とする可能性がある。完全な返事が出された場合、スポンサーは、機密協定を再提出し、手紙で発見されたすべての不足点を解決するか、または申請を撤回するか、公聴会を要求しなければならない。このようなデータや情報を提出してもFDAは
秘密保持協定が承認基準を満たしていないと判断できる。もしこのような欠陥がFDAによって満足的に解決された場合、FDAは通常承認書を発行するだろう。
製品が規制部門の承認を受けた場合、このような承認は特定の適応が付与され、製品が発売される可能性のある指定用途の制限が含まれる可能性がある。例えば、FDAは、製品の利点がそのリスクよりも大きいことを確実にするために、リスク評価および緩和戦略(REMS)を有するNDAを承認する可能性がある。REMSは、既知または潜在的な薬物に関連する深刻なリスクを管理し、薬物の安全な使用を管理することによって、患者がそのような薬物を継続的に得ることができるようにするための安全戦略であり、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全使用を保証する要素を含むことができる。FDAはまた,提案されたラベルを変更したり,十分な制御や仕様を作成したりすることを条件として承認することも可能である.承認されると、発売前と上場後の要求に対する遵守が保たれていない場合、あるいは製品が市場に進出した後に問題が発生した場合、FDAは製品承認を撤回する可能性がある。FDAはまた、製品の商業化後の安全性と有効性をさらに評価し、監視するために、1つ以上の第4段階上場後の研究とモニタリングを要求する可能性があり、これらの発売後の研究の結果に基づいて製品のさらなるマーケティングを制限する可能性がある。さらに、新しい立法によって生成された要求を含む新しい政府要求が確立される可能性があり、またはFDAの政策が変更される可能性があり、これは、規制承認のスケジュールまたは他の方法で行われている開発計画に影響を与える可能性がある。
小児科情報と排他性改訂された“小児科研究平等法”によれば、いくつかのNDAおよびいくつかのNDA補充剤は、すべての関連する小児科亜群において適応が主張される候補薬物の安全性および有効性を評価するために使用可能なデータを含み、安全で有効な各小児科亜群に対する薬剤の投与および投与をサポートしなければならない。FDAは小児科データの提出を延期することを許可するか、またはすべてまたは部分的な免除を与えることができる。FDCA要求は、新しい活性成分、新しい適応、新しい剤形、新しい用量レジメンまたは新しい投与経路を含む候補薬物がマーケティング申請を提出することを計画するスポンサーは、第2段階会議の終了後60日以内に予備小児科研究計画を提出しなければならないか、またはそのような会議がない場合、第3段階または第2/3段階研究が開始される前に、可能な限り早く予備小児科研究計画またはPSPを提出しなければならない。最初のPSPは、研究目標および設計、年齢グループ、関連する終点および統計方法、またはそのような詳細な情報を含まない理由、および小児科研究データおよび補助情報の提供を延期する必要がある任意の要件を含む、スポンサー計画によって行われる1つまたは複数の小児科研究の概要を含まなければならない。FDAとスポンサーはPSPについて合意しなければならない。臨床前研究,早期臨床試験および/または他の臨床開発計画から収集したデータに基づいて小児科計画の変化を考慮する必要があれば,スポンサーは合意した初期PSPに対する修正案を随時提出することができる。法規が別途要求されない限り、PREAは、PREAが元のNDA中の新しい活性成分に適用されることがなく、PREAが成人癌を治療するための分子標的癌製品であり、FDAに対して小児科癌の増殖または進行に密接に関連する分子標的が決定された場合、孤児によって指定された孤児として指定された適応に適用されない。
一つの薬はまたアメリカで小児科市場の排他性を得ることができる。小児科専有権が付与されれば,既存の専有期間と特許条項を6カ月増加させる。この6か月間の排他性は,他の排他的保護や特許期間の終了時から,FDAが発表したこのような研究の“書面請求”によって小児科研究を自発的に完成させることができる。
孤児薬の名前と排他性孤児医薬品法によれば、FDAは、まれな疾患または疾患を治療するための薬剤または生物に孤児薬名またはODDを付与することができる。まれな疾患または疾患の定義は、患者数が米国で20万人未満であるか、または患者数が20万人を超えるが、米国での薬剤または生物学的薬剤の開発および提供のコストが、米国での薬剤または生物学的薬剤または生物学的薬剤の販売から回収されることを合理的に予想することができないことである。秘密保護プロトコルまたはバイオ製品ライセンス申請またはBLAを提出する前に、ODDを申請しなければならない。FDAがODDを承認した後、FDAは、治療薬の模倣薬識別情報およびその潜在的孤児の使用を開示する。
ある製品が奇妙な承認を得、その後、そのような指定された疾患を有する特定の臨床活性成分に対するFDAの最初の承認を得た場合、この製品は、孤児製品の排他性を得る権利があり、これは、FDAが完全なNDAまたはBLAを含む任意の他の出願を承認することができないことを意味し、NDAまたはBLAの承認から7年以内に、限られた場合でなければ、例えば孤児に対して薬物排他性を有する製品に対する臨床的利点を示さない限り、同じ適応に対して同じ医薬または生物学的製剤を販売する。孤児薬物の排他性は、FDAが同じ疾患または条件のために異なる薬剤または生物学的薬剤を承認することを阻止しないか、または異なる疾患または条件のための同じ薬剤または生物学的薬剤を使用することを阻止しない。ODDの他の利点は、いくつかの研究に対する税金免除と、NDAまたはBLAのユーザ費用の申請を免除することとを含む。
指定された孤児薬が奇数適応を得るよりも広い用途で承認されれば,孤児薬物の排他性を得ることはできない。さらに、FDAが、指定された要求に重大な欠陥があると後に判断した場合、または製造業者が、このようなまれな疾患または疾患を有する患者の需要を満たすのに十分な数の製品を保証できない場合、米国における孤児薬の独占営業権を失う可能性がある。
開発と検討プログラムを加速させるFDAはいくつかの基準に適合した製品の開発や審査を加速させるための多くの計画を持っている。例えば、新薬が深刻な或いは生命に危害を及ぼす疾患或いは状況を治療することを目的とし、その疾病或いは状況が満たされていない医療需要を解決する潜在力を示す場合、迅速なチャンネル指定を受ける資格がある。高速チャネル指定は,製品と研究中の特定の適応の組合せに適している.高速チャネル製品のスポンサーは、製品開発中に審査チームとより頻繁に相互作用する機会があり、FDAは、完全な申請を提出する前にNDAを考慮する審査部分をスクロールさせることができ、スポンサーがNDA部分を提出するスケジュールを提供した場合、FDAはNDAの部分を受け入れることに同意し、スケジュールが許容可能であることを決定し、スポンサーはNDAの第1の部分を提出する際に任意の必要なユーザ料金を支払うことができる。
迅速なチャネル指定を有する製品を含むFDA承認製品を提出する任意のものは、優先審査のようなFDAの開発および審査を加速するための他のタイプの計画に参加する資格がある可能性もある。1つの製品が重篤な疾患の治療を意図しており、承認された場合、安全性または有効性の面で有意な改善を提供する場合、製品は優先審査を受ける資格がある。FDAは、審査を促進するために、優先審査として指定された新薬申請を評価するために追加のリソースを使用しようと試みるだろう。FDAは、提出日後6ヶ月以内に優先審査指定を有する出願を審査するように努力しているが、その現在のPDUFA審査目標に基づいて、新しい分子実体NDAを審査する期間は10ヶ月である。
しかも、製品は加速された承認を受ける資格があるかもしれない。深刻または生命を脅かす疾患または状態を治療するための候補薬剤は、臨床的利益を合理的に予測する可能性のある代替終点に有効であるか、または不可逆的な発症率または死亡率よりも早く測定可能な臨床終点に有効であることを決定する資格がある可能性があり、疾患の重症度、希少性または流行率、ならびに代替療法の利用可能性または不足を考慮して、不可逆的な発症率または死亡率または他の臨床的利益への影響を合理的に予測することができる
治療します。承認の一つの条件として、FDAは、この製品の臨床利益を検証し、説明するために、承認された薬物のスポンサーが勤勉な方法で十分かつ良好に制御された発売後の実証臨床試験を行うことを加速することを要求することができる。例えば、検証試験が製品の予期される臨床的利益を検証できなかった場合、FDAは、承認下で承認された薬物または適応の承認を加速することを撤回する可能性がある。さらに、機関から別の通知がない限り、FDAは、通常、承認を加速することを考慮している製品の販売促進材料の事前承認を要求しており、これは、製品の商業発売時間に悪影響を及ぼす可能性がある。
さらに、1つの新薬が、深刻または生命に危険な疾患または状態の治療のために単独または1つまたは複数の他の製品と組み合わせて使用されることが意図されている場合、初歩的な臨床証拠は、製品が1つまたは複数の臨床的に重要な終点で既存の療法よりも実質的に改善されている可能性があり、例えば、臨床開発早期に観察された実質的な治療効果を示す可能性がある場合、新薬は突破的な治療指定を得る資格がある可能性があることを示す。この指定は、迅速チャネル指定計画のすべての特徴と、FDAが最初の段階で開始した効率的な開発計画のより密な相互作用および指導と、適切なときに高度管理者および経験豊富な審査者との学際的審査に参加することを含む、開発を加速させる組織に対するFDAのコミットメントを含む。画期的な治療指定は加速承認や優先審査とは異なる状態であり,後者も関連基準を満たした場合に同一の薬剤を付与することができる。1つの製品が画期的な治療法として指定されていれば、FDAはこのような薬物の開発と審査を加速させるために努力するだろう。
迅速チャネル指定、画期的な治療指定、優先審査、および承認の加速は、承認の基準または承認を支援するために必要な証拠の質を変更することはありませんが、開発または承認プロセスを加速させる可能性があります。1つの製品がこれらの計画のうちの1つまたは複数に適合していても、FDAは、製品がもはや資格条件に適合していないことを後で決定することができ、またはFDAの審査または承認を決定する期間が短縮されないことができる。私たちは私たちの候補製品のためのいくつかの機会を適切に探索するかもしれない。
承認後に要求する承認後に要求する。FDAによって製造または流通が許可された任意の製品は、記録保存、有害事象報告、定期報告、製品サンプリングおよび流通、ならびに製品の広告および販売促進に関連する要件を含むFDAによって普遍的かつ持続的に規制される。承認後、承認された製品の大多数の変更は、新たな適応または他のラベル宣言を追加するなど、FDAの事前審査および承認を経なければならない。どんなマーケティング製品でも継続的な年間目標費を払わなければなりません。承認製品の生産に参加する薬品メーカーとその下請け業者は、FDAとある州機関にその機関を登録し、FDAとある州機関の定期的な抜き打ち検査を受けて、cGMPのコンプライアンスを理解しなければならず、これは私たちと私たちの第三者メーカーにいくつかの手続きと文書要求を加えている。さらに、処方薬製品の製造業者および他の医薬品サプライチェーンに参加する当事者は、製品追跡および追跡要求を遵守し、偽、移転、窃盗、および故意に偽の製品を通報し、または他の方法で米国での流通に適していない製品をFDAに通報しなければならない。製造プロセスの変更は厳しく規制されており,変更の重要性により,FDAが事前に承認して実施する必要がある可能性がある。FDAの規定はまた、cGMPから外れた状況を調査·是正し、私たちと私たちが使用を決定する可能性のある任意の第三者メーカーに報告することを要求している。そのため、メーカーは生産と品質管理の分野で時間、お金、精力をかけ続け、cGMPやその他の法規遵守性を維持しなければならない。
規制要件や基準が守られていない場合、あるいは製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。製品はその後、予期しない深刻または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題を発見し、新しいセキュリティ情報を追加するために承認されたラベルの改訂をもたらす可能性がある;新しい安全リスクを評価するために発売後研究または臨床試験を実施すること、またはREMS計画に従って流通制限または他の制限を実施することにつながる可能性がある。他の他の潜在的な結果には
•製品の販売や製造を制限し、市場から製品を完全に撤回したり、製品をリコールしたりする
•罰金、警告状、見出しなしの手紙
•臨床は臨床研究を堅持する
•FDAは、承認保留申請または承認申請の補充を拒否するか、または製品承認を一時停止または撤回する
•製品の差し押さえ、差し押さえ、あるいは製品の輸出入を許可しないことを拒否した
•法令に同意し、会社の誠実な合意に同意し、連邦医療計画の資格を取り消したり、除外したりする
•宣伝材料とラベルを強制的に修正し、訂正情報を発表する
•セキュリティ警報、親愛なるヘルスケア提供者への手紙、プレスリリース、および製品に関する警告または他のセキュリティ情報を含む他の通信;または
•民事または刑事処罰を禁令または適用する。
FDAはまた、上場後テスト、いわゆる第4段階テストを要求し、許可された製品の効果を監視するために監視を行う可能性がある。製品が以前に未知の問題を発見し、あるいは適用されたFDA要求を遵守できなかったことは、負の結果をもたらす可能性があり、負の宣伝、司法或いは行政法執行、FDAの警告状、強制要求の是正広告或いは医師とのコミュニケーション、民事或いは刑事罰などを含む。新たに発見または開発された安全性または有効性データは、新たな警告や禁忌症を増加させることを含む製品承認のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要がある場合もあります
FDAは薬品のマーケティング、ラベル、広告、販売促進を厳格に規制する。1社はFDAが承認したラベルの規定に基づいて、安全性と有効性に関する声明しか提出できない。FDAと他の機関は非ラベル用途の普及を禁止する法律法規を積極的に施行している。これらの要求を守らないことは、負の宣伝、警告状、訂正性広告、および潜在的な行政、民事、刑事罰を招く可能性がある。医師はその独立した専門医学判断に基づいて、製品ラベルに記載されていない、著者らがテストし、FDAによって許可された用途とは異なる合法的に利用可能な製品のために処方することができる。医師は,異なる場合,このような非ラベル使用が多くの患者の最適な治療法であると考えるかもしれない。FDAは医者が治療を選択する時の行動を規範化しない。しかし、FDAは製品ラベルの外使用問題に対する製造業者のコミュニケーションを制限した。連邦政府は、ラベル外使用の不当な普及の疑いがある会社に巨額の民事と刑事罰金を科し、会社がラベル外販売促進に従事することを禁止している。FDAおよび他の規制機関はまた、企業に同意法令または永久禁止を締結し、これらの法令または永久禁止に基づいて、特定の販売促進行為を変更または制限することを要求する。しかしながら、会社は、FDAによって承認された製品ラベルと一致する真で誤解されない情報を共有するかもしれない。
そのほか、処方薬製品の流通は“処方薬販売法”(PDMA)の制約を受け、この法案は連邦一級で薬品と薬品サンプルの流通を管理し、各州の薬品流通業者に対する登録と監督管理に最低基準を設定した。PDMA,州法ともに処方薬製品サンプルの配布を制限し,配布中の責任の確保を求めている。
特許期間の回復と延長FDAがスポンサー候補製品を承認する時間、期限、および詳細によれば、スポンサーのいくつかの米国特許は、1984年の“薬品価格競争および特許期限回復法”(一般にハッジ·ワックスマン修正案と呼ばれる)に基づいて限られた特許期間を延長する資格がある可能性がある。ハッジ·ワックスマン改正案は、製品開発およびFDA規制審査中に失われた特許期間の補償として、特許回復期間を最長5年とすることを許可している。しかしながら、特許期限の回復は、特許の残りの期間を製品が承認された日から合計1400年まで延長することはできず、承認された医薬製品、使用方法、または製造方法に関連する特許請求の範囲を延長することができる。特許期間回復期間は、一般にIND発効日とNDA提出日との間の時間の半分であり、NDA提出日とその出願が承認されたとの間の時間に加えて、発起人がこれらの期間内に職務調査をしていない時間を差し引く。承認された薬物に適用される特許は1つのみ延期する資格があり,延期出願は特許が満期になる前に提出されなければならない。しかも、与えられた特許は単一製品に基づいて一度だけ延期されることができる。米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。欧州や他の外国司法管区にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。今後,我々の製品がFDAの承認を受けた場合,これらの製品をカバーする特許出願のために特許期間を延長することが予想されるが,米国FDAを含む適用当局がこのような延長を承認すべきかどうか,承認された場合の期限延長の評価に同意する保証はない.私たちの知的財産権に関連するリスクに関するより多くの情報は、参照されたいプロジェクト3.D-キー情報-リスク要因-私たちの知的財産権に関するリスク.”
市場排他性FDCAによって許可された市場排他性条項は、いくつかのマーケティング申請の提出または承認を延期する可能性がある。FDCAは新しい化学実体秘密協定の承認を得た最初の申請者に5年間の米国内の非特許マーケティング排他性を提供した。FDAが以前に同じ活性部分を含む他の新薬を承認していなければ,薬物は新しい化学実体であり,活性部分は薬物物質の作用を担う分子やイオンである。排他期間内に、FDAは、同じ活性部分が別の薬剤のために提出された簡略化された新薬出願またはANDAまたは505(B)(2)条に従って提出されたNDAまたは505(B)(2)NDAに従って別の会社の審査を受けない可能性があり、その薬剤が元の革新薬と同じ適応であるか、または他の適応のために使用されるかにかかわらず、出願人が合法的な参照承認に必要なすべてのデータの権利を所有していない場合、または正当な参照承認に必要なすべてのデータの権利を有さない。しかしながら、出願がイノベーターNDA所有者がFDAに記載された特許のうちの1つを含む特許が無効または未侵害証明である場合、4年後に出願することができる。
FDCAはまた、出願人が行っているか、または後援する新しい臨床研究(バイオアベイラビリティ研究を除く)が、FDAが既存の薬剤の新しい適応、用量または強度のような承認申請に重要であると考えられる場合、NDAに3年間の市場排他性、または既存のNDAの補完を提供する。この3年間の排他性は、この薬剤が新しい臨床研究に基づいて承認された修正のみを含み、FDAがANDAまたは505(B)(2)NDAを許可することは禁止されておらず、元の適応または使用条件の有効成分を含む薬剤のために使用される。5年と3年の排他性は完全な秘密協定の提出や承認を延期したり承認したりしないだろう。しかしながら、完全なセキュリティプロトコルを提出する出願人は、安全かつ有効であることを証明するために、任意の臨床前研究および十分かつ良好に制御された臨床試験を参照するために必要な権利を行うか、または得ることを要求されるであろう。
EUの薬品承認の規制と手続きアメリカ国外で任意の製品を販売するためには、会社はまた他の国と司法管轄区の品質、安全性と有効性に関する多くの異なる監督管理要求、及び製品の臨床試験、マーケティング許可、商業販売と流通などの方面の監督管理を守らなければならない。FDAによる製品の承認を得るか否かにかかわらず、出願人は、これらの国または司法管轄区で当該製品の臨床試験またはマーケティングを開始するために、米国の監督管理機関ではない必要な承認を得る必要がある。具体的には,EUの医薬製品承認の流れは米国とほぼ同じである。それは各提案適応に対する薬物の安全性と有効性を確定するために、薬物開発、非臨床研究及び十分かつ良好な制御の臨床試験を満足的に完成させる必要がある
臨床試験、製品許可、定価と精算を指導する要求と手続きは国によって異なる可能性がある。いずれの場合も,臨床試験はGCPおよび“ヘルシンキ宣言”からの適用法規要求と倫理原則に基づいて行われなければならない。臨床試験で使用される薬品はcGMPで生産されなければならない。
EUの臨床試験ですEU医療製品の臨床試験は,EUと国家法規および国際協調理事会(ICH)のGCPに関するガイドラインに基づいて行わなければならない。欧州委員会からの追加GCPガイドラインは、特にトレーサビリティを重視し、先進的な治療薬物の臨床試験に適している。発起人は臨床試験保険を購入しなければならず、多くのEU諸国では、発起人は臨床試験で負傷したいかなる研究対象にも“非のない”賠償を提供する責任がある。
臨床試験を開始する前に,スポンサーは関連加盟国の国家主管当局の臨床試験認可,独立倫理委員会の積極的な意見を得なければならない。臨床試験許可の申請は他の事項以外に、試験方案のコピーと被調査薬品の製造と品質情報を含む調査薬品ファイルを含まなければならない
EUでは臨床試験条例(EU)第536/2014号は2022年1月31日に施行され,従来の臨床試験指令2001/20,あるいはCTDを廃止し,代替し,簡略化された臨床試験認可申請プログラムを導入した。したがって,単一の臨床試験申請,あるいはCTAは,EMAの臨床試験情報システムを介して提出されなければならず,スポンサーがその中に試験地点を設置することを予想しているすべてのEU加盟国に適している。CTRはまた、CTAを評価し、有害事象に関連する報告プログラムを含む臨床試験スポンサーの報告プログラムを簡略化するための調整された2つのプログラムを確立する。個別のEU加盟国はその領土で臨床試験を行うことを許可する権限を保持している。CTAがEU加盟国の承認を得ると、臨床試験開発はこのEU加盟国で行うことができる
行われている臨床試験がCTRによってどの程度管理されるかは,個別臨床試験の持続時間に依存する。2023年1月31日までにCTDにより承認申請を提出した臨床試験については,CTDは2025年1月31日まで過渡的な申請を継続する。その時まで、行われているすべての裁判は拷問禁止条約の規定に制限されるだろう。関連する臨床試験申請がCTRに基づいて提出されている場合、または臨床試験が2025年1月31日までにCTRフレームワークに移行している場合、CTRはより早い日の臨床試験に適用される。
連合王国は2004年の“人用薬品(臨床試験)条例”を通じてCTDを国家法律に組み入れた。したがって、イギリスの臨床試験に対する規制はEUとは異なる。
医薬製品の開発過程において、欧州薬品管理局とEU加盟国の国家主管当局は開発案について対話と指導を行う機会を提供した。EUレベルでは、医薬製品の開発者は任意の開発段階で、医薬製品が集中許可プログラムの資格に適合しているかどうかにかかわらず、EMAとして科学的な提案と方案援助を提供することができる。科学提案ワーキンググループの提案により,EMAの人は薬品委員会(CHMP)で援助している。すべての科学的提案手続きは費用を発生させるだろう。EMAは以下の具体的な問題に答えることによって相談を提供する:品質面(薬物の製造、化学、薬物と生物試験)、非臨床試験(毒理学と薬理学試験、薬物の実験室での活性を示すことを目的としている)と臨床面(患者または健康ボランティア研究の適切性、終点の選択)、方法問題(統計テストの使用、データ分析、モデリングとシミュレーション)、全体発展戦略(条件付きマーケティング許可、模倣薬の接続戦略、安全データベース)、孤児称号の維持の重大なメリット、および小児科発展。
営業許可欧州経済地域(EEA)(27のEU加盟国にノルウェー、アイスランドとリヒテンシュタインを加えて構成されている)で新しい医薬製品を販売するためには、会社はマーケティング許可或いはMAを獲得しなければならない。マーケティング許可申請またはMAAは、集中プログラムを使用してEMAに提出されてもよく、以下に概説する他のプロセス(分散プロセス、相互承認プロセス、および国家プログラム)を使用してEU加盟国の主管当局に提出されてもよい。MAは欧州経済地域に設立された出願人にのみ付与されることができる
•CHMPの科学的意見によると、欧州委員会は中央プログラムを通じて単一MAを付与する集中プログラムを発表し、欧州経済区全体の範囲で有効である。集中手順は、いくつかのタイプの製品に対して強制的であり、例えば、(I)バイオテクノロジー医薬品、(Ii)孤児医薬品、(Iii)HIV/エイズ、癌、神経変性疾患、糖尿病、自己免疫および他の免疫機能障害、ならびにウイルス性疾患を治療するための新しい活性物質を含む薬剤、ならびに(Iv)高度治療薬、すなわち遺伝子療法、体細胞療法または組織工学薬を含む。治療領域に新しい活性物質を含む製品については、集中プログラムは選択可能であるが、ヨーロッパ薬品管理局の許可されていない集中プログラムは強制的な製品とされているか、あるいは重大な治療、科学或いは技術革新或いはヨーロッパ薬品管理局の公衆健康利益に符合する製品となっている。中央プログラムによると、環境評価機関が重大な影響評価を評価する最長期限は210日であり、クロックポーズは含まれておらず、申請者はCHMPからの質問に答えるために追加の書面または口頭情報を提供する時間がある。したがって,計時を停止することは,MAAを評価する時間枠を210日を超えるように大きく延長する可能性がある.CHMPが肯定的な意見を与えた場合,EMAはその意見を支援文書とともにEU委員会に提供し,後者はMAを承認するかどうかを決定する.MAを付与する場合は,通常,EMAの意見を受けてから67日以内に発行される.CHMPは#年に評価を加速する可能性があります
特殊な場合、1種の医療製品が重大な公衆衛生利益を有することが期待される場合、特に治療革新の観点から見る。加速評価プログラムによる重大な影響評価の期限は150日であり,停止クロックは含まれていないが,CHMPが申請が加速評価に適していないと判断した場合,中央プログラムの標準時限に回復する可能性がある.
•非集中化プログラムは,集中プログラムの強制範囲に属さない製品に適用される.MAを求める各加盟国の主管当局に同じ書類を提出し、申請者は規制提出の評価を指導するために、そのうちの1つを参考加盟国またはRMSとして選択する。RMS主管当局は、評価報告書草案、製品特性概要草案、またはSmPC、および予備評価から抜粋したラベルおよび包装チラシ草案を用意し、他の欧州経済地域国(関連加盟国と呼ばれる)に提出して承認する。これにより生成された評価報告は関係加盟国に提出され、これらの加盟国は、評価報告および関連材料を受け取ってから90日以内に、その評価報告および関連材料を承認するか否かを決定しなければならない。関連加盟国が公衆健康に対する潜在的に深刻な危害に基づいて、RMSによって提案された評価、SmPC、ラベル、またはパッケージに異議を提起しなかった場合、RMSは、このプロトコルを記録し、手続きを終了し、それに応じて出願人に通知する。各関係加盟国は、承認された評価報告、SMPC、およびラベルおよび包装チラシに基づいて国MAに付与することを国の決定によって要求する。関連加盟国が公衆衛生の潜在的深刻なリスクに対する懸念から評価報告や関連材料を承認できない場合、論争内容は薬品機関担当者相互承認·委譲プログラム調整グループ(CMDHと略称する)に提出されて審査される可能性がある。欧州委員会のその後の決定はすべての国に拘束力があるEUです。加盟国です
•1つの製品が欧州経済区国家で販売されることが許可されている場合、承認された国MAは、相互認識手順を介して他の欧州経済区国で相互承認するために使用されてもよい。
•欧州経済区国家の単一主管当局が発行した,それぞれの領土のみをカバーする国MAは,集中プログラムの強制範囲に属さない製品にも適用可能である
上記の手順により,MAを付与する前に,欧州委員会または欧州経済区国家の主管当局は,製品の品質,安全性,有効性に関する科学的基準に基づいて,製品のリスク−利益バランスを評価する準備をしている。
満たされていない医療需要に対して、公衆の健康に大きな影響を与えることが期待される革新的な製品は、米国の画期的な治療指定のようなインセンティブを提供する優先薬品計画のような迅速な開発および審査計画を得る資格がある可能性がある。PRIMEは、満たされていない医療需要に対するEMAの医療製品開発の支援を強化するための自発的な計画である。条件に適合した製品は、満たされていない医療需要が存在する場合(EUには満足できる診断、予防または治療方法がない、または、あれば、新しい医療製品が重大な治療優位性をもたらす)、新しい治療方法を導入したり、既存の方法を改善することによって、満たされていない医療需要を満たす潜在力を示さなければならない。Primeの称号を持つ候補製品のスポンサーはメリットを得ることができ、しかし限らないが、早期にEMAと積極的な監督対話を行い、臨床試験設計とその他の開発計画要素を頻繁に討論し、及びファイルを提出した後にMAA評価を加速する可能性がある
EUでは,必要なすべての安全性や有効性データが得られていない場合には,“条件付き”MAが付与される可能性がある.(I)医薬製品の利益-リスクバランスが正であることが証明された場合、(Ii)出願人は、以下のような状況で包括的なデータを提供する可能性が高い--欧州委員会は、医薬製品に条件付きM&Aを付与することができる
(3)医薬製品は満たされていない医療需要を満たしている;(4)患者が直ちに医薬製品を獲得できるメリットは依然として補充データに固有のリスクより大きい。条件付きMAは,失われたデータの生成やセキュリティ対策の増加を確保する条件を満たさなければならない.それの有効期間は1年で、すべての関連条件が満たされるまで毎年更新しなければならない。任意の未解決の研究が提供されると、条件MAは従来のMAに変換されることができる。しかしながら、これらの条件がEMAが設定した時間枠内で満たされず、欧州委員会の承認を得なければ、MAは更新を停止する
“特別な場合”では、出願人が、製品が許可され、特定のプログラムを実施した後であっても、正常な使用条件下での治療効果及び安全性に関する包括的なデータを提供できないことを証明することができれば、MAを付与することができる。これらのことは,特に予想される適応では非常にまれであり,当時の科学的知識状況では,網羅的な情報を提供することは不可能である場合や,データを生成することが一般的に受け入れられている倫理原則に違反する可能性がある場合である。条件付きMAと同様に、特別な場合に付与されたMAは、まれな疾患または満たされていない医療需要を治療するために許可されることが意図された医薬製品であり、出願人は、標準MAを付与するために必要な完全なデータセットを有さない。ただし,条件付き買収と異なるのは,特殊な場合に認可を申請した出願人がその後紛失データを提供する必要がないことである.“特殊な場合”のMAは最終的に承認されているが,医薬製品のリスク−収益バランスは毎年審査されており,リスク−収益比率が有利でなければMAは撤回される。
ヨーロッパでのデータと市場の排他性(EC)第726/2004/EC号条例および2001/83/EC号指令(いずれも改正された)によると、欧州経済局はデータと市場保護または排他性に対して協調的な方法(8+2+1式と呼ぶ)を採用している。製品のデータ独占期間は,当該製品の最初のMAがヨーロッパ経済区に付与された日から計算される。これは,参考薬品のMA保持者に8年間のデータ排他性と他の2年間の市場排他性を付与する.参考薬品は1種の薬品(小分子と生物薬品を含む)であり、すでにヨーロッパ薬品管理局国家或いは欧州委員会によって完全なファイルによって許可され、即ち2001/83/EC指令第8(3)、10 a、10 b或いは10 c条に基づいて品質、臨床前と臨床データを提出し、模倣薬/交雑薬品の上場許可申請は生物等効率性証明を指し、通常適切な生物利用度研究を提出することを指す。データ排他性,模倣薬または生物類似薬を付与した出願人が模倣薬または生物類似薬の発売許可を申請した場合,8年以内に製品アーカイブに含まれる革新者の臨床前および臨床試験データを参照することはできず,参考製品が初めて欧州医薬品局で許可を得た日から8年以内である。市場排他期は成功した模倣薬或いは生物類似申請者がEUでその製品を商業化することを阻止し、参考製品がEUで初めて発売された日から10年まで。MA保持者が、10年の最初の8年間に、既存の療法と比較して有意な臨床的利益をもたらすと考えられる1つ以上の新しい治療適応の許可を得た場合、10年間の市場保護は、最長11年まで累積的に延長することができる。1種の革新的な医薬製品が規定されたデータ独占期間を獲得しても、このような交差引用に対する独占権は、別の会社がその独立研究開発計画によって生成したデータに基づいてマーケティング許可を求めることを阻止せず、前臨床試験と臨床試験に関連するデータからなる完全な独立アプリケーションをサポートする。
EUでは、生物模倣薬、即ち参考薬品と類似しているが模倣薬の定義に符合しない生物医薬製品に対して、特殊な制度がある。このような製品については,MAの申請を支援するために適切な臨床前または臨床試験結果を提供しなければならない。EMAのガイドラインは、異なるタイプの生物学的製品に提供される補足データのタイプを詳細に示す。
ヨーロッパ孤児は指定されて排他的だ条例(EC)第141/2000号及び条例(EC)第847/2000号は、そのスポンサーが、(1)生命又は慢性衰弱に危害を及ぼす疾患の診断、予防又は治療を目的としていることを証明することができることを前提として、欧州委員会により孤児薬として指定することができる。(2)申請時に、このような状況が影響する欧州連合の人数が万分の5を超えないこと、又は、インセンティブ措置がない場合、欧州連合の販売に十分な見返りを与えることができず、その開発への必要な投資が合理的であることを証明することができる。および(Iii)EUによって許可されていない疾患に関する満足できる診断、予防または治療方法、または、そのような方法が存在する場合、製品は、疾患に使用可能な製品と比較して有意な利益を有する。
孤児薬物指定は、費用の低減、規制援助、MAの申請集中の可能性を含む多くの利点を提供する。孤児薬のMAによる承認された治療適応には10年間の市場排他期がある。この市場独占期間内に、欧州医薬品管理局も欧州経済区国家の主管当局もMAAや“類似医薬製品”の延期申請を受け入れることができず、欧州委員会も同一適応のマーケティング許可を10年以内に承認することはできない。類似医薬製品“の定義は、許可された孤児医薬製品に含まれる1つ以上の類似活性物質を含む医薬製品であり、同じ治療適応のためのものである。合意した小児科調査計画にも適合した孤児薬品については,市場専門期間を2年間延長した。いかなる補充保護証明書も孤児の症状に関する小児科研究によって延期してはならない。市場独占期間内に、以下の場合にのみ、“類似医薬製品”に販売許可を承認することができる:(I)第2の申請者は、その製品が許可された製品と類似しているが、より安全で、より有効で、あるいは臨床的に良好であることを証明することができる;(Ii)許可された製品の発売許可書保持者は、2回目の孤児医薬製品の申請に同意する;または(Iii)許可された製品の発売許可書保持者は十分な孤児医薬製品を供給することができない。しかしながら、5年目の終了時に、この製品が孤児医薬品の入手目的地としての根拠である孤児薬物指定基準に適合しなくなったと判定された場合、例えば、製品の利益が十分に高く、市場専門性が合理的であることを証明するのに十分ではないので、適応治療を許可された市場専門期間を6年に短縮することができる。MAAを提出する前に、指定孤児薬を申請しなければならない。孤児薬物の指定は、監督審査と承認過程においていかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
EUの製造法です様々な要求は医薬製品の製造とEU市場への投入に適用される。EUで医薬製品を製造するには製造許可を得る必要があり、EUへの医薬製品の輸入は輸入を許可する製造許可が必要である。製造許可保持者は、EU cGMP規格を含む、適用されるEUの法律、法規、およびガイドラインに規定されている様々な要件を遵守しなければならない。同様に、EU内の医薬製品の流通は、欧州経済区国家主管当局が付与した適切な流通許可を要求することを含む、適用されるEUの法律、法規、ガイドラインを遵守しなければならない。EUまたはEU欧州経済圏諸国が医薬製品製造に適用される要件を遵守しない場合、マーケティング許可保持者および/または製造および輸入許可またはMA所有者および/または流通許可保持者は、製造許可の一時停止を含む民事、刑事または行政制裁を受ける可能性がある。
連合での許可後の義務EUである医薬製品についてMAを授与する場合、このMAの所持者は一連の医薬製品の製造、マーケティング、普及と販売に適用する監督管理規定を守らなければならない。米国と同様に、医薬製品のMA保持者とメーカーは、EMA、欧州委員会および/または個別のEEA国家の主管監督機関の全面的な監督管理を受けている。MAの所持者は,薬物警戒義務のような様々な義務の制約を受け,他の事項に加えて,副作用の詳細な記録の報告と保存を求め,定期安全更新報告やPSURsを主管当局に提出する。すべての新しいMAAは、企業が実施するリスク管理システムを記述し、製品に関連するリスクを最小限に防止または低減するための措置を記録するリスク管理計画、またはRMPを含まなければならない。規制当局はまた、販売許可の条件として特定の義務を規定することができる。このようなリスク最小化措置または認可後の義務は、追加の安全監視、PSURsのより頻繁な提出、または追加の臨床試験または認可後の安全性研究を含むことができる。RMPおよびPSURsは通常,アクセスを要求する第三者に利用可能であるが,限られた編集を行う必要がある.所有者はまた、その製品の製造とロット放出が適用される要求に適合することを確実にしなければならない。医薬製品の広告と販売促進はEUとヨーロッパ経済区国家の医薬製品の普及、医師と他の医療保健専門家との相互作用、誤解性と比較広告及び不公平な商業行為に関する法律の制約を受けている。EUの法律は、処方薬製品の直接消費者向け広告のような医薬製品の広告と販売促進の一般的な要求を規定している。しかし、詳細は各ヨーロッパ経済圏諸国の法規によって管轄されており、国によって異なる可能性がある。製品のすべての広告および販売促進活動は、承認されたSMPCと一致しなければならず、MAに関連する国の主管当局の承認が必要となる可能性がある。SmPCに該当しない販促活動は非ラベルとされ,ヨーロッパ経済圏では禁止されている.連合はまた消費者に直接向けた処方薬の広告を禁止する。M&A保有者には、その製品の広告を確保し、適用されるEU法律と欧州経済圏国家国内法律で実施されている業界行為規則を確保する義務がある。広告や販売促進規則は欧州経済圏諸国によって全国的に施行されている。
ヨーロッパ連合の小児科発展欧州医薬品局では、(EC)第1901/2006号条例では、新しい医薬製品を開発する会社は、EMAの小児科委員会またはPDCOと小児科調査計画またはPIPに同意しなければならず、延期または免除が適用されない限り、MAAと共にデータを提供しなければならない(例えば、関連疾患または状態が成人にのみ発生するため)。合意されたPIPは,市販認可が求められている薬物の小児科適応を支援するために,データ発生時間とアドバイスの措置を規定している。すべてのEU加盟国でMAを取得し、研究結果を製品情報に含めると、否定的な場合であっても、製品は、補充保護証明書またはSPC(製品のSPC申請を提出すると同時に、またはSPCの満了前のいつでもこのような延長申請を提出する限り)に従って6ヶ月の延長保護を受ける資格があるか、または孤児医薬製品については、孤児市場固有権を2年間延長する資格がある。この小児科奨励は特定の条件の制約を受け,PIPに適合したデータを開発·提出する際に自動的に獲得されない。
連合は随伴診断に対する規定を規定したヨーロッパ経済圏では診断に伴い体外培養診断医療機器或いはIVDは、法規2017/746或いはIVDRの管轄を受け、この法規は2022年5月26日に発効し、第98/79/EC号指令を廃止と置換した。IVDRは、(A)治療前および/または治療中に、対応する医療製品から利益を得る可能性が最も高い患者を識別すること、または(B)治療前および/または治療中に、対応する医療製品を使用することによって治療によって深刻な副作用のリスクを増加させる可能性のある患者を識別するために、対応する医療製品を安全かつ効率的に使用するために重要な装置として定義される。
その他の事項以外に、IVDR及びその関連する指導文書と協調標準はまた設備設計と開発、臨床前と臨床或いは性能テスト、上場前の合格評価、登録と上場、製造、ラベル、貯蔵、クレーム、販売と流通、輸出入と発売後の監督、警戒と市場監督を管理する。IVDは,それに伴う診断を含めて,IVDRの一般的な安全や性能要求やGSPRに適合しなければならない。これらの要求を遵守することは機器にCEマークを貼り付けることができる前提条件であり,CEマークがなければヨーロッパ経済圏でマーケティングや販売を行うことはできない。IVDR添付ファイル1に規定されているGSPRに適合し,CEマークを貼り付ける権利を得るためには,IVDメーカーはIVDのタイプとその分類によって異なる合格評価プログラムを行わなければならない.低リスクIVD(A類は無菌ではない)に加えて,メーカーはその製品とGSPRとの適合性の自己評価に基づいてEU適合性声明を発表することができるほか,適合性評価プログラムは欧州経済圏国の主管当局が指定して適合性評価を行う組織である通知機関の介入を必要とする。関連する合格評定プログラムにより,医療機器の製造,設計,最終検査の技術文書や品質体系を監査·審査することが機関に通知された。医療機器とそのメーカーに関する合格評価プログラムの完成に成功し,GSPRに適合させた後,CE合格証明書を発行するよう機関に通知した。この証明書と関連する適合性評価過程は,メーカーに関連するEU適合性声明を準備し署名した後,その医療機器にCEマークを貼り付ける権利を持たせる
セット診断は通知機関の適合性評価を受けなければならない。関連医薬製品がすでに或いは集中した医薬製品許可プログラムを通じて許可されている場合、通知機関はCE適合性証明書を発行する前に、関連医薬製品に関連するセット診断が環境管理専門員の科学的意見を求めるのに適しているかどうかを診断することが要求される。すでにまたはEU立法で規定されている任意の他の方法で許可されている医薬製品については、通知機関は、EU加盟国国家主管当局の意見を求めなければならない。
イギリスの離脱とイギリスの規制の枠組みイギリスは2020年1月31日にEUを離脱し、つまり通常言われているイギリスが離脱し、イギリスとEUの間の規制関係を変えた。アメリカ薬品と保健品監督局(Medicines and Healthcare Products Regulatory Agency,MHRAと略称する)は現在イギリスSの独立した医療製品と医療機器監督機構である。イギリス(イングランド、スコットランド、ウェールズ)は現在EUの3番目の国だ。EUの規制の側面で、北アイルランドは現在EUの規制規則に従っていくだろう。
イギリスの臨床試験に関連する監督管理の枠組みは改正された“2004年人用薬品(臨床試験)条例”によって管轄され、この条例はCTDに由来し、そして二次立法を通じてイギリス国家法律に組み入れられた。2022年1月17日、MHRAはイギリスの臨床試験立法を再編することについて8週間のコンサルティングを開始し、臨床試験の審査を簡略化し、革新を支持し、臨床試験の透明性を高め、より大きなリスクを支持することを目的とした
患者と公衆の臨床試験への参加を促進します英国政府は2023年3月21日に諮問への対応を公表し、立法を早期に改正することを確認した。これによって生じた立法改正はイギリスの法規がCTRとどの程度一致するかを決定するだろう。2023年10月、MHRAは、第4段階臨床試験申請と低リスク第3段階臨床試験申請の初期臨床試験申請をより簡素化とリスク割合をより高くすることができる新しい臨床試験通知計画を発表した。
イギリスの上場許可は改正された“人類薬品条例”(SI 2012/1916)によって管轄されている。2021年1月1日から、EU集中プログラムマーケティング許可を申請する出願人は、これ以上イギリスに設立することはできない。したがって、この日から、イギリスに設立された会社はEU集中プログラムを使用することができず、イギリスで製品を販売するマーケティング許可を得るために、イギリスの離脱後に残った国際協力プログラムのうちの1つまたはイギリス離脱後の残りの国際協力プログラムのうちの1つに従わなければならない。すべての既存のEU中央ライセンス製品のマーケティングライセンスは、マーケティングライセンス所有者が離脱を選択しない限り、イギリスでのみ有効であり、2021年1月1日に無料で発効する英国マーケティング許可に自動的に変換またはキャンセルされる。北アイルランドは現在も欧州連合の許可された範囲内で、中央によって許可された医薬製品と関連している。そのため、2025年1月1日にウィンザー枠組みが北アイルランドで実施されるまで、EU集中プログラムの範囲に属する製品はイギリスの国家認可プログラムでしか許可されていない。
MHRAはまた国家マーケティング許可手続きを修正した。これには、150日間の評価経路、スクロール審査プログラム、および2024年1月1日から適用される国際認可プログラムを含む、患者に利益を得る新薬を優先的に獲得するプログラムが導入される。2024年1月1日から、MHRAは、あるタイプのマーケティング許可申請を審査する際に、国際認可プログラム(IRP)に依存する可能性がある。本プログラムは、参照規制機関から同じ製品ライセンスを取得したマーケティング許可申請者に適用されます。これらの機関にはFDA、EMA、個別ヨーロッパ経済区国家の国家主管部門が含まれている。EMAとCHMPの肯定的な意見,あるいは相互承認や分散プロセスの積極的な終了プログラムの結果は,IRP目的の承認と考えられる.
イギリスでは、医薬製品は販売前の許可孤児の称号を持っていない。対照的に、MHRAは、対応するマーケティング許可申請を審査しながら、孤児指定申請を審査する。これらの基準は基本的にEUの基準と同じだが、市場のためにカスタマイズされている。これはEUではなくイギリスに含まれており、この状況の流行率は万分の5の基準を超えてはならない。孤児の地位を与えられた上場許可後、この医薬製品は承認された孤児の適応における類似製品の10年間にわたる市場排他性から利益を得る。この市場専門期間の開始日は、この製品がイギリスで初めて承認された日から発効する。
他の医療法律法規です医療保健提供者と第三者支払者は上場承認された薬品の推薦と使用に主な役割を果たしている。第三者支払者、既存または潜在的な顧客および紹介源(ヘルスケア提供者を含む)との配置は、広く適用される詐欺および乱用の影響を受ける可能性があり、これらの法律および法規は、マーケティングによって承認された製品の研究、マーケティング、販売、および流通を行う製造業者の業務または財務スケジュールおよび関係を制限する可能性がある。適用される連邦と州医療保険の法律と法規によると、このような制限は以下のように含まれる
•“連邦反リベート条例”は、他の事項に加えて、個人および実体が個人の転転を誘導または誘導または奨励するために、個人および実体が直接または間接的に、公開的または隠蔽的に請求、受信、提供または報酬を支払うことを禁止する
または、連邦医療保険および医療補助計画のような連邦医療計画に従って全部または部分的に支払うことができる任意の商品またはサービスを購入、注文、または推薦する。この法規は、一方が医薬品製造業者である一方で、処方者、購入者、処方管理者、および他の個人および実体間の配置に適用されると解釈される。“衛生保健と教育和解法案”によって改正された“患者保護と平価医療法案”、あるいは総称して“ACA”と呼ばれ、連邦反リベート法規の意図要求が改正され、個人または実体がこの法規またはこの法規に違反する具体的な意図を実際に理解する必要がなく、違反を実施することができる
•民事虚偽請求法案、またはFCA、および個人または実体が虚偽または詐欺的な連邦医療保険、医療補助または他の第三者支払者の支払い請求の提出を意図的に提出するか、または虚偽記録または声明の作成を意図的に作成または誘導することを禁止する連邦民事および刑事虚偽クレーム、または虚偽または詐欺的クレームの提出を禁止することは、連邦政府への金銭支払いの義務を回避、減少または隠蔽するために重要な意味を有する、連邦民事および刑事虚偽クレーム、またはFCA、および民事罰金法律。いくつかのマーケティング行為は、ラベル外の販売促進を含み、FCAにも関連する可能性がある。また、“反リベート法”は判例法を編纂し、すなわち“反リベート法”については、“連邦反リベート法規”違反による物品やサービスのクレームが虚偽または詐欺的クレームを構成することを含む
•連邦健康保険携行性および責任法案、またはHIPAAは、他にも、詐欺の任意の医療福祉計画を実行または実行しようとするまたは医療事項に関連する虚偽の陳述を行う計画に刑事および民事責任を適用する
•連邦医師は、ある薬品、器械、生物製品、および医療用品のメーカーに要求し、連邦医療保険、医療補助または児童健康保険計画の下で支払うことができ、医療保険および医療補助サービスセンター(CMS)に毎年医療保険および医療補助サービスセンター(CMS)に医師(医師、歯科医師、検眼師、足医および脊椎マッサージ師を含む)、他の医療専門家(例えば、医師補佐官と看護師従業員)と教育病院、および医師およびその直系親族が所有する所有権および投資権益に関する支払いおよびその他の価値移転に関する情報を報告することを要求する
•HIPAAは、2009年の“衛生情報技術促進経済·臨床健康法”およびその実施条例の改正を経て、特定の義務を含む強制的な契約条項を規定し、個別に識別可能な健康情報の伝送、安全およびプライバシーを保護するための強制的な契約条項を含むいくつかの義務を規定し、これらのエンティティは、健康計画、医療情報交換所および特定の医療保健提供者を含み、カバーされたエンティティのために個別に識別可能な健康情報を作成、受信、維持または送信することを表す事業パートナー、ならびに個別に識別可能な保護された健康情報を使用、開示、取得または取得または処理する下請け業者;および;
•州および非米国法律は、任意の第三者支払人(商業保険会社を含む)が精算する物品またはサービスに適用される可能性がある、上述した各連邦法律、例えば、反リベートおよび虚偽クレーム法律と同等であり、州および非米国の法律は、製薬会社に製薬業界の自発的コンプライアンスガイドラインおよび政府が発行した関連するコンプライアンスガイドラインを遵守することを要求し、そうでなければ、医療保健提供者および他の潜在的な転換源への支払いを制限する可能性がある。州および非アメリカの法律は、医薬品製造業者に、医師および他の医療保健提供者への支払いおよび他の方法での価値の移転、薬品の価格設定および/またはマーケティング支出に関する情報を報告することを要求する;州と地方の法律は、薬品販売代表の登録を要求する;および場合によっては健康情報のプライバシーおよび安全を管理する州および非米国の法律であり、その中の多くの法律は互いに大きく異なり、HIPAAは通常先制されず、同じ効果をもたらすこともなく、コンプライアンス作業を複雑化させる可能性がある。
米国以外でも、製薬会社と医療専門家との相互作用は、ヨーロッパ諸国の国家反賄賂法律、国家陽光規則、法規、業界自律行動準則、医師職業行為準則のような厳格な法律によって制限されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
上記の法律または任意の他の政府の法律および法規に違反することは、行政、民事および刑事罰、損害賠償、罰金、削減または再編業務、連邦および州医療計画から除外された場合、返還、契約損害、名誉損害、利益および将来の収益の減少、監禁および追加の報告要件、および監督を含む重大な処罰を招く可能性があり、もし一人が会社の誠実な合意または同様の合意の制約を受けた場合、これらの法律を遵守しない疑惑を解決する。また、商業活動や商業手配が適用される医療法律や法規に適合することを確保するための努力は費用がかかる可能性がある。
保証と精算を請け負う私たちが規制承認を受ける可能性のあるどの製品のカバー範囲や精算状態にも、大きな不確実性がある。米国では、規制部門の承認を得て商業販売を行う候補製品の販売は、保証範囲の可用性と第三者支払者の十分な補償にある程度依存する。第三者支払者には、MedicareおよびMedicaid、管理型ヘルスケア提供者、個人健康保険会社および他の組織のような政府当局および米国の医療計画が含まれる。このような第三者決済者たちはますます医療製品とサービスの精算を減少させている。支払者が薬品に保険を提供するかどうかを決定するプロセスは、支払者が薬品に支払う支払率を設定するプロセスと分離することができる。第三者支払者は、承認されたリストまたは処方表上の特定の医薬製品にカバー範囲を制限することができ、FDAによって承認された特定の適応のすべての薬剤を含まない可能性がある。また,医療費の抑制は連邦や州政府の優先事項となっており,薬品価格はこの努力の重点となってきた。アメリカ政府、州立法機関と外国政府はコスト制御計画の実施に大きな興味を示し、価格制御、精算制限とブランド処方薬の代わりに模造薬を要求することを含む。価格制御とコスト制御措置、および既存の制御·措置を講じている司法管轄区域でより制限的な政策をとることで、我々の純収入と業績をさらに制限することができる。
支払人が薬品に保険を提供することを決定することは適切な販売率を承認することを意味しない。また、薬品の保証範囲と精算範囲は支払人によって異なる。したがって、保証範囲の決定プロセスは、通常、時間がかかり、高価なプロセスであり、保証範囲および十分な補償が一致するか、または最初に得られることを保証することなく、各支払人にそれぞれ私たちの製品を使用する科学的および臨床的支援を提供する必要がある。
第三者決済者は、価格、医療製品およびサービスの医療必要性および費用効果、ならびにそれらの安全性および有効性を検討することにますます挑戦している。新しい指標は、平均販売価格、平均製造業者価格、実際の調達コストなど、販売率の基礎としてよく使用される。販売が承認される可能性のある任意の製品の保険や補償を得るためには,規制承認に要する費用に加えて,製品の医療必要性や費用効果を証明するために高価な薬物経済学的研究が必要となる可能性がある。第三者支払者が、製品が他の利用可能な療法と比較して費用対効果があると思わない場合、彼らは承認後にその製品をその計画の下の福祉としてカバーしないかもしれない、または、支払いレベルが会社にその製品を販売させて利益を得るのに十分ではない可能性があると思う場合がある。また、私たちが開発したどんなセットの診断テストも、私たちが求めている保険と精算以外に単独で保険と精算を受ける必要があります
もし私たちの製品候補が承認されれば。任意のペア診断が精算または精算不足を得ることができない場合、これは、このようなペアリング診断の利用可能性を制限する可能性があり、承認された場合、これは、私たちの候補製品の処方に負の影響を与える。
政府や第三者支払者が十分な保険や補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の候補製品の適正性が影響を受ける可能性がある。また,米国では管理型医療への重視度が向上しており,薬品定価の圧力が増加していくことが予想される。保証政策と第三者精算料率は随時変化する可能性がある。私たちまたは私たちの協力者が規制の承認を受けた1つまたは複数の製品が有利な保証範囲と精算状態を得ても、将来的にはあまり有利ではない保証政策や精算料率が実施される可能性がある。
連合では、様々な国の価格設定と補償プログラムの差が大きい。一部の国では、補償価格を合意した後にのみ、製品を販売することができると規定されている。いくつかの国は追加的な研究を完成し、特定の候補製品のコスト効果を現在利用可能な治療法と比較することを要求するかもしれない。EU加盟国は製品の具体的な価格を承認することができ、製品を市場に投入する会社の収益力を直接または間接的に制御する制度をとることもできる。他の会員国は会社が自分の製品価格を作ることを許可したが、会社の利益を監視した
また、いくつかのEU加盟国は追加の研究を完成し、特定の候補医薬製品のコスト効果を現在利用可能な治療法と比較することを要求するかもしれない。この衛生技術評価またはHTAプログラムは,特定の医療製品が個別の国の国家医療システムで使用される公共健康影響,治療影響および経済的·社会的影響を評価するプログラムである。特定の医薬製品に関するHTAの結果は、EU個別加盟国主管当局がこれらの医薬製品の価格設定と補償地位を与えることに影響を与えることが多い。2021年12月15日、衛生技術条例またはHTA条例が可決された。HTA規制は、新医薬製品を含む衛生技術の評価におけるEU加盟国の協力を促進し、これらの分野で共同臨床評価を行うEUレベルの協力に基礎を提供することを目的としている。2025年に適用が開始されると、HTA条例は、HTAに対するEU全体の臨床的利益評価を調整することを目的とする。イギリスがEUを離れたことを考慮して、HTAに関する2021/2282号法規はイギリスに適用されないだろう。しかし、イギリスの薬品と保健品監督機関(MHRA)はイギリスのHTA機構と他の国家組織と協力しており、例えばスコットランド薬品連盟(SMC)、国家健康と看護卓越研究所(NICE)と全ウェールズ薬品戦略グループ(All-Wales Medicines Strategy Group)は新しい道を導入し、安全、適時かつ効率的な医療製品開発の革新方法を支持する
過去数年間、医療コストの下振れ圧力が増加している。そのため、新製品の参入にはますます高い壁が設けられている。また、一部の国では、低価格市場からの国境を越えた輸入品に競争圧力がかかり、一国国内の定価を下げる可能性がある。価格規制や補償制限を持っている国は、有利な補償と価格設定を許可しない。
医療改革です米国や一部の外国司法管区は医療システムを変更するためにいくつかの改革提案を検討しているか公布されている。医療コストのコントロール、質の向上或いは参入拡大を既定の目標とし、医療保健システムの変革を推進することは重大な意義がある。アメリカでは、製薬業はずっとこれらの努力の重点であり、医薬品と生物製薬の定価、カバー範囲と精算を制限するための立法計画を含む連邦と州立法計画の重大な影響を受けている
製品、特に政府援助の保健方案の下で、政府の薬品定価の制御を強化する。
例えば、ACAは2010年3月に法律に署名し、医療保険を獲得する機会を拡大し、医療支出の増加を減少または制限し、詐欺や乱用に対する救済措置を強化し、医療·医療保険業界の透明性要求を増加させ、医療産業に税金を徴収し、追加の医療政策改革を実施することを目的としている。その他の事項以外に、ACAは生物製品を低コストの生物模倣薬の潜在競争を受けさせ、340億薬品割引計画に符合する実体タイプを拡大し、新しい方法を解決し、即ち吸入、輸液、点滴、移植或いは注射の薬物に対して、メーカーの医療補助薬物リベート計画の下でのリベートを計算し、メーカーの医療補助薬物リベート計画の下でのリベートを増加し、リベート計画を医療補助管理の看護組織に登録した個人に拡大し、あるブランドの処方薬のメーカーに対して年費と税収を設定し、そして新しい連邦医療保険D部分カバーギャップ割引計画を作成した。このうち,メーカーは保証期間中に条件を満たす受益者に50%のPOS割引(2018年に両党予算法により70%に増加し,2019年1月から発効)を提供することに同意しなければならず,メーカーの外来薬として連邦医療保険D部分保険の条件に組み込まれている
ACAのいくつかの側面は公布以来、行政、司法、そして国会の挑戦を受けてきた。例えば、ACAの様々な部分は現在、米国最高裁判所で法律と憲法の挑戦を受けている。また、2021年2月10日、バイデン政府はACA打倒への連邦政府の支持を撤回した。2021年6月17日、米国最高裁は、ACAが“個人権限”が国会で廃止されたため、全体的に違憲だと弁明する手続き理由に基づく挑戦を却下した。最高裁が裁決を下す前に,2021年1月28日,総裁·バイデンはACA市場による医療保険の取得を目的とした特殊な加入期間を開始する行政命令を発表した。2022年8月16日、総裁·バイ登は“2022年インフレ削減法案”に署名し、個人がACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は新たに設立されたメーカー割引計画により、受益者の最高自己負担コストを大幅に低減し、連邦医療保険D部分計画下の“ドーナツの抜け穴”を解消した。ACAの実施は進行中であり,この法律は薬品定価に下り圧力をかけ続ける可能性があり,特に医療保険計画の下で,我々の規制負担や運営コストを増加させる可能性もある。ACAに関連する訴訟および立法は継続される可能性があり、結果は予測可能で不確定である
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。例えば、2011年8月、2011年に“予算制御法案”が署名され、国会の支出削減措置を含む法律が制定された。赤字削減合同特別委員会の任務は、2012年から2021年の間に少なくとも1.2兆ドルの赤字を的確に削減することを提案することだが、この委員会はその目標を達成できず、立法の自動削減をいくつかの政府案に触発した。これには、各年度に提供者に支払われる連邦医療保険総額が2%に達し、2013年4月に施行され、その後の法規の立法改正により、追加の国会行動がとられない限り、2032年まで有効となる。2013年1月、2012年の米国納税者救済法などは、ある提供者に支払う医療保険をさらに減少させ、政府が提供者に多額の支払いを取り戻す訴訟時効期間を3年から5年に延長した。
処方薬や生物製品価格の上昇を受けて、米国政府も薬品定価の見直しを強化している。このような審査は最近の国会調査を招き、提出され、公布された
他にも、製品価格の透明性を高め、価格設定とメーカー患者案との関係を審査し、製品の政府案補償方法を改革する。米国連邦レベルでは、2021年7月、バイデン政府は“米国経済における競争を促進する”という行政命令を発表し、その中には処方薬に対する条項が複数ある。バイデン行政命令への対応として,2021年9月9日,米国衛生·公衆サービス部(HHS)は高薬価に対応する総合計画を発表し,その中で薬品定価改革の原則を概説し,国会がとりうる各種潜在立法政策と,HHSがとることができるこれらの原則を推進する潜在行政行動を示した。また、アイルランド共和軍(IRA)は、他の事項に加えて、(I)HHSが連邦医療保険(Medicare)がカバーするいくつかの高支出、単一由来の薬物および生物製品の価格について交渉し、法律で規定されているこのような薬物と生物製品との交渉に等しくない“最高公平価格”の価格を提供することによって、薬品メーカーに民事と潜在的な消費税を科し、(Ii)連邦医療保険B部分またはD部分にカバーされているいくつかの薬品および生物製品にリベートを徴収し、インフレを超える価格上昇を処罰するように指示する。アイルランド共和軍は衛生と公共サービス部が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。このような規定は2023年度から段階的に施行される。2023年8月29日、HHSは、連邦医療保険薬品価格交渉計画が現在法的挑戦を受けているにもかかわらず、価格交渉を受ける上位10種類の薬物のリストを発表した。アイルランド共和軍がどのように実施されるかは不明であるが,製薬業に大きな影響を与える可能性がある。さらにバイデン政府の2022年10月の行政命令に応答して、HHSは2023年2月14日に報告を発表し、CMS革新センターによってテストされた3種類の新しいモデルを概説し、これらのモデルはそれらの薬物コストを低減し、獲得性を促進し、医療の質を高める能力に基づいて評価を行う。これらのモデルが将来の任意の医療改革措置で使用されるかどうかは不明である。また、2023年12月7日、バイデン政府は“ベハ·ドール法案”下の参入権を使用することで処方薬の価格を制御するイニシアチブを発表した。2023年12月8日、米国国家標準·技術研究所は、権限行使を考慮した機関間指導枠組み草案を発表し、その中で初めて製品価格を機関が進行権を行使する際に使用できることを決定する要因とした。これまでデモの権利を行使したことはなかったが、新たな枠組みの下で、この権利が継続するかどうかは定かではない。
州レベルでは、アメリカ各州はますます立法を通じて、価格或いは患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示と透明性措置を含む薬品と生物製品の定価を制御するための法規を制定し、実施しており、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。例えば、FDAは2024年1月5日、特定の州医療計画のためにカナダから特定の薬剤を輸入するフロリダ州第804条輸入計画(SIP)の提案を承認した。この計画がどのように実施されるか,どのような薬剤が選択されるか,その計画が米国やカナダで法的挑戦を受けるかどうかは不明である。他の州もFDAの審査を待っているSIP提案を提出した。このような承認された輸入計画が一旦実施されると、これらの計画がカバーする製品の薬品価格をより低くする可能性がある。
これらの取り組みや将来講じられる可能性のある他の医療改革措置は,より厳しいカバー基準とより低い精算を招き,我々が受け取った任意の承認された製品の価格に追加の下振れ圧力を与える可能性が予想される。また、連邦医療保険や他の政府援助計画のいかなる精算減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは候補製品の商業化を阻止するかもしれない。
さらに、将来の立法や行政行動は、より多くの医療改革措置を生むかもしれない。
データプライバシーとセキュリティ法律です私たちが設立し、パートナーを持ち、販売したり、販売したり、私たちの製品を販売したり、臨床試験を行ったりする司法管轄区では、私たちもプライバシー法の制約を受けているか、または制限されている可能性があります。例えば、EUのGDPRおよび/または米国のイギリスGDPRおよびHIPAAなど、プライバシーおよびデータ保護法律の制約を受けているか、または制限されている可能性がある。世界各地のデータ保護とプライバシー法律法規の発展に伴い、私たちの外国司法管轄区における規制義務は、国際場所での解決策の使用やコストを損なう可能性がある。
私たちの業務のいくつかの態様は、著者、サービスプロバイダ、請負業者、または他の人に依存する態様を含み、カバーエンティティ(ヘルスケア提供者、健康計画およびヘルスケア交換所)のための基準を確立し、特定の電子ヘルスケア取引の進行を管理し、保護された健康情報の安全およびプライバシーを保護するための義務的な契約条項および技術的保障、および保護された健康情報のセキュリティおよびプライバシーを保護するための義務的な契約条項および技術的保障、および保護された健康情報セキュリティに違反する事件が発生したときに影響を受ける個人および規制機関に通知される保護された健康情報の安全およびプライバシーを保護する可能性がある。2009年の米国回復·再投資法案は、通常、HITECHが呼びかけたHIPAAのプライバシー·セキュリティ基準の全面的な拡大を含む経済刺激案と呼ばれ、2010年2月17日に発効した。他の事項に加えて、HITECHは、HIPAAのプライバシーおよびセキュリティ基準を、カバーエンティティが保護された健康情報を受信または取得する商業パートナー、独立請負業者、またはエージェントに直接適用するようにする。HITECHはまた、保証実体、商業パートナー及びその保証下請け業者に対して適用可能な民事と刑事処罰を増加させ、州総検察長に新しい権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償或いは禁止令を要求して、連邦HIPAA法律を執行し、連邦民事訴訟の提起に関連する弁護士費と費用を求めることができる。
HIPAAが適用されない場合でも,消費者の個人情報セキュリティを適切な手順で保護できなかったことは,ビジネスにおける不公平な行為ややり方やビジネスに影響を与える可能性があり,連邦貿易委員会法案第5(A)節やFTCAに違反していると解釈され,“米国法典”第15編第45(A)節である。連邦貿易委員会は、ある企業のデータセキュリティ対策が、消費者情報の感度および数、その業務の規模および複雑さ、および安全性の向上および脆弱性を低減するために使用できるツールのコストのために合理的かつ適切になると予想している。
ヨーロッパでは、EU GDPRおよびイギリスGDPRは、それぞれヨーロッパ経済地域および/またはイギリスに位置する個人データの処理および/またはヨーロッパ経済地域および/またはイギリスに機関を設立する場合に行われる処理に対して、それぞれ厳格な要求を行う。例えば、EU GDPRおよびイギリスGDPRによれば、政府規制機関は、データ処理に対して一時的または最終禁止を実施することができ、最高:EU GDPRが規定する2000万ユーロまたはイギリスGDPRに規定される1750万ポンドの罰金;世界の年収の4%を基準にしていますしかも、個人は私たちがその個人データを処理することに関する訴訟を提起することができる。欧州以外の他の国は、同様の包括的なデータプライバシーやセキュリティ法律法規の制定を検討しており、サービスや運営業務を提供するコストや複雑さを増加させる可能性がある
特に,多くの司法管轄区域でデータローカライズ法や国境を越えた個人データ転送法が制定されている。このような法律は私たちが司法管轄区域を越えて個人データを転送することを難しくするかもしれないし、これは私たちの業務を阻害するかもしれない。もし私たちが国境を越えたデータ転送のために有効なコンプライアンスメカニズムを実施できなければ、私たちはより多くの規制行動、巨額の罰金、そしてEU、イギリス、または他の場所からの個人データの処理または転送を禁止する禁止に直面するかもしれない。また、個人データをアメリカやヨーロッパ経済地域やイギリス以外の他の司法管轄区に移すことができず、ヨーロッパや他のデータプライバシーやセキュリティ制約を受けている各当事者との協力を制限する能力を含む、私たちの業務運営に重大かつ負の影響を与える可能性があります
法律または私たちは、ヨーロッパおよび/または他の場所で私たちの個人データ処理能力を増加させ、巨額の費用を支払うことを要求している。
米国では,州の法律がHIPAAよりも厳しく,範囲が広いか,あるいは健康情報の面でより多くの個人権利を提供している可能性があり,各州の法律が異なる可能性があり,コンプライアンス作業を複雑化させる可能性がある。例えば、カリフォルニアは最近“カリフォルニア消費者プライバシー法”(California Consumer Privacy Act、略称CCPA)を公布し、カリフォルニア住民のために新しいプライバシー権を創出し、このような住民のある個人データを処理するエンティティに対してより多くのプライバシーと安全義務を規定した。CCPAは、カバーする会社が、このような会社のデータ収集、使用、および共有方法に関する新しい開示をカリフォルニア住民に提供し、これらの住民に特定の個人情報を開示しないことを選択し、これらの住民に追加の訴訟理由を提供することを要求する。CCPAは2020年1月1日に施行され、(A)カリフォルニア州の総検察長の執行を許可し、非故意違反の1回当たり2,500ドル、1回の故意違反の罰金は7,500ドルであり、(B)個人訴訟が特定のデータ漏洩のために法定損害賠償を取り戻すことを許可している。また、カリフォルニアの有権者は最近、CPRAと略称する新しいプライバシー法であるカリフォルニアプライバシー権法案を2020年11月に可決した。CPRAはCCPAを大幅に修正し、さらなる不確実性を招き、遵守するための追加のコストと支出を要求している。
私たちのデータプライバシーとセキュリティに関する義務はますます厳格な方法で急速に変化している。これらの義務は、異なる適用および解釈によって制約される可能性があり、これらの適用および解釈は、法ドメイン間で不一致または衝突する可能性がある。これらの義務を準備して履行することは、私たちに大量の資源(財政や時間に関連する資源を含むが、限定されない)を投入することを要求する。これらの義務は、私たちの情報技術、システムおよび実践、ならびに個人データを処理する任意の第三者を代表する情報技術、システム、および実践を変更する必要があるかもしれません。しかも、このような義務は私たちが私たちのビジネスモデルを変えることを要求するかもしれない。適用されるすべてのデータプライバシーおよびセキュリティ義務を遵守しようと努力しているにもかかわらず、私たちはそれをできなかった場合があります(またはできなかったとみなされる)。さらに、私たちが努力したにもかかわらず、私たちが依存している人たちや第三者がこのような義務を履行できない可能性があり、これは私たちのコンプライアンス状態に影響を及ぼすかもしれない。もし私たちがデータのプライバシーとセキュリティ義務を解決できなかったり、遵守できなかったと思われた場合、私たちは深刻な結果に直面する可能性がある。これらの結果は、政府の法執行行動(例えば、調査、罰金、処罰、監査、検査、および同様の行動)、訴訟(階級に関連するクレームを含む)、追加の報告要件および/または監督、個人データの処理の禁止、個人データの廃棄または使用の禁止、および会社管理者の監禁を含むことができるが、これらに限定されない。このようなイベントは、お客様の流失、業務運営の中断または中断、個人データの処理ができない、または特定の司法管轄区域で運営できない、私たちの製品を開発することができない、またはそれを商業化する能力が限られている、任意のクレームまたは照会のための時間および資源をかけて、マイナスの宣伝または修正、または私たちの業務を再構成することを含む、私たちの名声、業務または財務状況に重大な悪影響を及ぼす可能性があります
より多くの情報については、“リスク要因-厳格かつ変化するグローバルプライバシーおよびデータセキュリティ要件を遵守することは、追加のコストおよび負債をもたらす可能性があり、またはこれらの要件を遵守しないことは、私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性があります”を参照されたい
法規を付加するこれらの規定に加えて,各省,州と連邦,米国とEUの環境保全や有害物質に関する法律も我々の業務に影響を及ぼす。これらの法律と他の法律は私たちの様々な生物、化学、放射性物質の使用、処理と処理、これらの物質は私たちの行動、そして私たちの行動によって生成された廃棄物を規範化している。もし私たちの運営が環境汚染を招いたり、個人を危険物質に曝露させたりすれば、損害賠償と政府罰金の責任を負う可能性があります。
私たちは、私たちが適用される環境法律を実質的に遵守し、これらの法律を遵守し続けることは、私たちの業務に実質的な悪影響を与えないと信じている。しかし、私たちはこのような法律の変化が私たちの未来の運営にどのように影響するか予測できない。
反腐敗法私たちは、改正されたアメリカの1977年の“海外腐敗防止法”、アメリカ“アメリカ法典”第18編201節に掲載された米国国内賄賂法規、“アメリカ旅行法”、“アメリカ愛国者法”、イギリス“2010年反賄賂法”、“2002年イギリス犯罪収益法”、および私たちが反腐敗活動に従事している国/地域の他の州と国の反賄賂と反マネーロンダリング法を遵守しなければならない。他の事項に加えて、このような腐敗防止法は、企業および個人が、任意の外国政府職員、政府職員、政党または政治候補者または特定の他の人に不正な方法で直接または間接的に支払い、金銭または任意の価値のあるものを支払うことを提案すること、または業務の取得、保留または指導、規制承認、または何らかの他の利益を提供することを禁止する。“海外腐敗防止法”、イギリス“2010年反賄賂法”、可能な他の反腐敗法律によると、私たちの第三者エージェントの行為に責任を負うことも要求される可能性があります。医療保健領域において、反腐敗リスクも医師、肝心なオピニオンリーダー及び国有付属病院、研究機関或いはその他の組織で働く他の医療保健専門家と不当な相互作用を行う背景に現れる可能性がある。
アメリカ、EU、イギリス以外の国は政府規制を持っている
アメリカ、EU、イギリスの法規のほかに、臨床研究と任意の商業販売と流通の法規を含む他の司法管轄区の様々な法規の制約を受ける可能性があります。我々の製品がFDA,MHRA,EMAの承認を得ているか否かにかかわらず,これらの国での臨床研究や製品マーケティングを開始する前に外国の規制機関の必要な承認を得なければならない。米国,イギリス,EU以外のある国にも類似したプログラムがあり,INDやCTAのようにヒトの臨床研究を開始する前に臨床研究申請の提出が求められている。臨床研究、製品許可、カバー範囲、定価と精算を指導する要求と手続きは国によって異なる。いずれの場合も,臨床研究はGCPおよび“ヘルシンキ宣言”からの適用法規要求と倫理原則に基づいて行われている。
法律訴訟時々、私たちは正常な業務過程で発生した法的訴訟に巻き込まれるかもしれない。私たちは現在、実質的な法的手続きの影響を受けていない
C.組織構造
エクソンは私たちのグループの最終親会社です。私たちの直接子会社ExScience a(イギリス)2023年12月31日現在、持株有限会社は以下の子会社の株式(直接または間接を問わず)を所有している
| | | | | | | | | | | | | | |
| 付属会社名 | | 登録国·地域 | | 所有権権益比率 |
| ExScience a Inc. | | アメリカです | | 100% |
| ExScience a Ventures,Inc. | | アメリカです | | 100% |
| Re Ventures I,LLC | | アメリカです | | 50% |
| ExScience a Ventures II社 | | アメリカです | | 100% |
| Re Ventures II,LLC | | アメリカです | | 50% |
| ExScience a KK | | 日本です | | 100% |
| Dynamic Discovery株式会社 | | スコットランド人 | | 100% |
| ExScience a GmbH | | オーストリア | | 100% |
| アイスダンカ人工知能有限公司 | | スコットランド人 | | 100% |
D.財産、工場、設備
私たちは現在イギリスのオックスフォードで工場を借りています。この工場は私たちの世界本部と研究開発と実験室空間を含み、面積は約37,000平方フィートです。私たちの本社内には4つの異なるフロアに関するレンタル契約があり、レンタル契約は2028年から2033年の間に満期になります。イギリスの牛津郡に他の24,000平方フィートの自動実験室空間を持っていますリースは2031年に満期になります2032年期限のレンタル契約によると、牛津郡には約10,000平方フィートの追加オフィススペースがあります。私たちはオーストリアウィーンにもっと多くの事務と実験室空間があります。総面積は約5.5万平方フィートで、レンタル契約は2029年に満期になります。私たちはイギリスで9000平方フィートのオフィスを借りて、アメリカ(ボストンとマイアミ)で12000平方フィートのオフィスを借りました。私たちはマイアミにも追加の事務空間があります。もう占有しないことにしました。私たちはこの空間のためにテナントを探しています
プロジェクト4 Aです。未解決従業員意見
適用されません
プロジェクト5.業務と財務の回顧と展望
あなたは本年度報告書の他の部分の私たちの財務状況と経営結果に対する以下の討論と分析、そして私たちの総合財務諸表と関連する付記を読むべきです。以下の議論は、IASBが発表した国際財務報告基準(IFRS)に基づいて作成された財務情報に基づいており、この基準は、重大な点で他の司法管轄区域(米国GAAPを含む)で公認されている会計原則とは異なる可能性がある。本議論および分析に含まれるいくつかの情報または本年度報告の他の部分に記載された情報は、リスクおよび不確実性に関する前向きな陳述を含む、我々の業務計画および戦略に関する情報を含む。あなたは、“リスク要因”というタイトルの章を読むべきであり、議論は、実際の結果が、以下の議論および分析に含まれる前向き陳述に記載されているまたは示唆された結果とは大きく異なる重要な要素、および“前向き陳述に関する特別な説明”と題する章をもたらす可能性がある
私たちはポンドで帳簿と記録を保存します。読者の便宜のため、2023年12月31日までと2023年12月31日までのポンド金額をニューヨーク連邦準備銀行2023年12月29日正午までの購入レートでドル、すなわちGB 1.00から1.27ドルに変換しました。これらの換算は、そのような金額が、その日付または任意の他の日に為替レートまたは任意の他の為替レートでドルに両替された可能性がある、または可能性がある陳述とみなされてはならない
他に説明または文意が別に言及されている以外に、“ExScience a”、“会社”、“私たち”または同様の用語が言及されているものは、ExScience a Plcおよびそれらの完全子会社を意味する
概要
我々は薬物設計会社であり,人工知能(AI)や他の技術を用いて患者のニーズを高度に満たしていない疾患に対する差別化薬物を効率的に設計·開発している。著者らのプラットフォームの重点は著者らの人工知能設計技術、翻訳システムと臨床モデリングを用いることによって可能な故障点を識別と解決し、それによって薬物開発の成功確率を高めることである。我々のプラットフォームは、異なる特性を有する複数の開発候補を発売することによって、現在の業界標準を超える設計目標を達成することができ、そのうちの4つは現在臨床試験中であることを証明した。私たちの内部チャネルは主に腫瘍学に集中していますが、私たちもパートナーとの設計能力を利用して、私たちのチャンネルを拡大して収入を創出しています
多くの候補薬剤が失敗したのは,予見可能な薬物設計問題によるものと考えられる。10年以上にわたって人工知能を利用してこれらの設計問題を克服し、より質の良い薬を作ってきました。我々はまた,人工知能に基づくシミュレーションをテスト·検証するための斬新な実験と自動化システムを統合した.我々の仮想設計と物理実験の閉ループは迅速な学習、外部では得られないデータの生成、コスト効果と再現性の面で重要な優勢を持っている
我々の技術プラットフォームは,プロダクション人工知能,能動学習,機械学習,物理に基づくシステム,大型言語モデル,他の多くの予測システムをカバーしている.しかし、私たちの技術の生産は永遠に測定可能な薬だ。我々は20以上の薬物計画を進めており,そのうち少なくとも2つの計画は2024年に臨床マイルストーンに達すると予想されている。私たちが作ったすべての薬物は、既知の競争相手に対して有意な設計優位性が必要であり、臨床的利益が予想され、明確に測定することができる
われわれの主要な内部候補薬はCDK 7阻害剤GTAEXS 617(‘617)であり,現在1/2期試験中であり,今年下半期に初歩的なデータが予想される。617は、CDK 7に関連する潜在的毒性を管理し、標的治療効果を最大限に向上させるために薬物動態を最適化することを目的とした正確に設計されている
著者らは百時美施貴宝のためにPKC-theta阻害剤を設計し、彼らはその後許可を得て、現在第一段階の臨床試験を行っている。PKC-thetaは関心の高い目標であり、十数社がその目標のために化合物を設計しようとしているにもかかわらず、強力で選択的な競争相手はおらず、私たちの候補者は一流になる可能性がある。私たちはこのプログラムと関連した持続的なマイルストーンと印税を持っている。
LSD 1とMALT 1に対するIND支援研究には,もう2つの内部シナリオがある.この二つの候補者は競争的プロジェクトで知られている毒性を軽減するために設計されている。これらの毒性の源を知り,それらを設計することにより,臨床開発においてより高い成功確率を有する2つの候補薬剤が産生されていると信じている。
時間の経過とともに,我々が設計·開発した薬物の変革的な方式は,この業界の基本的な薬物経済学的モデル,すなわち私たちが言う“曲線転移”を変えることができると信じている。我々の目標は,より質の良い薬物を設計するとともに,技術やプロセスを改善することで投資需要を減少させ,同時に成功の可能性を高めることができることを証明することである。
最新の発展動向
2023年2月2日、我々が設計し、2021年8月に百時美施貴宝(BMY)In許可を得た化合物Precision EXS 4318(‘4318)が米国で第1段階臨床試験に入ったことを発表した。この化合物は免疫学や炎症(I&I)適応に開発されている。BMYは臨床と商業開発を監督し,記念碑的な支払いを受ける資格があり,承認されれば,製品純売上高に応じて分級印税を得ることも可能である。
2023年3月14日、我々は2つの新しい完全所有の正確な腫瘍学開発候補薬、LSD 1阻害剤EXS 74539(‘539)およびMALT 1プロテアーゼ阻害剤EXS 73565(’565)を発表した。2024年に‘539のINDを提出し,’565はINDA/CTA支援研究の進展を継続していると予想される。この2つの分子はいずれも2019年にCelgeneとの連携により資金を獲得しており,CelgeneはBMYに買収されており,いずれの分子もBMYが選択権を行使できる分子の基準に適合している。BMYの候補者の選択権は無効になり、私たちはこの2つの化合物のすべての世界的な権利を維持した
2023年7月10日、著者らは最初の患者がGTAEXS 617(‘617)の1/2期解明臨床試験に参加したことを発表し、GTAEXS 617は精確に設計された有効かつ選択的CDK 7阻害剤である。この試験は6種類の末期固形腫瘍タイプの患者を募集した:頭頚部癌、結腸直腸癌、膵臓癌、非小細胞肺癌或いはNSCLC、HR+/HER 2-乳癌と卵巣癌。
2023年7月18日、我々は卵巣癌に重点を置いて、固形腫瘍における機能精密薬の潜在性を評価する最初の多中心試験であるEXCYTE-1の開始を発表した。EXCYTE-1は前向きな卵巣癌観察性研究であり、両者の関係を検討することを目的としている離体する著者らの精密医学プラットフォームを用いて原発腫瘍サンプルに対する薬物反応と患者の実際の臨床反応
2023年9月19日、著者らの完全子会社ExScience a AI LtdはドイツダムシュタットのMerck KGaA医療保健業務と協力協定を締結し、重点的にExScience aの人工知能駆動の精確な薬物設計と発見能力を利用して、腫瘍学、神経炎症学と免疫学領域の新型小分子候補薬物を発見することである。3つの潜在的な一流または一流の目標は、パートナーシップの初期重点として決定された
2023年9月27日、私たちはサイノフィと協力した最初の免疫学的および炎症目標研究マイルストーンの確認を受け、これに関連して、現金支払いを受けました$4,000,000.
2023年10月3日、最大の差別化と価値創造の潜在力を持つと考えられるプロジェクトへの関心、投資、インフラをさらに強化するために、当社のパイプ優先戦略を更新することを発表しました。これは、我々のCDK 7阻害剤(‘617)およびLSD 1阻害剤(’539)を優先的に発展させ、EXS 21546(‘546)の内部開発を停止することを含み、’546を閉じて再発/難治性腎細胞癌および非小細胞肺癌の1/2期IGITE臨床試験を治療することを含む。
2023年10月9日、Revine Medicines Inc.がEQRxの買収を発表した後、EQRxとの連携を終了しました。協力の終了については、協力開始時に前払いされた未使用資金をEQRxに返還することに同意し、協力中に作成された3つの初期目標のすべての知的財産権の完全かつ独占的権利を獲得しました。だから、$8,750,0002023年10月12日にEQRxに移され、協力協定に従って私たちが負担する財務的義務を完全に履行しました。
2023年10月には、ワーキンググループとBMYの協力範囲内で他のプロジェクトを継続して開発するのではなく、いくつかのプロジェクトの優先順位を決定することを共同で決定した。
2023年12月5日、オープン慈善団体から230万ドルの寄付を受けたことを発表しましたこれは慈善ドナーで、世界の健康と福祉にいくつかのプロジェクトがあります。この贈与により,ExScience aは宿主インターフェロン反応の活性化を大流行性インフルエンザの治療法として利用することを目標としている
2023年12月21日、私たちは、ExScience aによって決定され、最初に提案された新しい発見段階計画を追加し、サイノフィとの現在の協力を修正することを発表した。この計画は,ExScience aの研究プラットフォームとセノフィの先行開発専門知識を結合することにより,潜在的な同種最適分子を設計することを目的としている。ExScience aは既存のプロトコルに基づいて追加の前期と研究段階のマイルストーンを得る資格がある.
2024年2月7日、急性骨髄性白血病(AML)に対する観察的臨床研究であるEXCYTE−2の開始を発表した離体する薬物反応は、一次血液または骨髄試料で測定し、実際の患者の臨床反応を測定する。EXCYTE-2研究はAML一線患者の血液と骨髄サンプルを収集し、二線患者に拡大する権利がある。さらに、この研究は、大きな臨床注釈サンプルにおいて、LSD 1阻害剤‘539の活性を集中的に評価することを可能にする
2024年2月13日、私たちの取締役会はアンドリュー·ホプキンス最高経営責任者と最高経営責任者の採用を終了し、私たちの科学者David·ハリー特を臨時最高経営責任者と臨時CEOに任命した。ホプキンス博士も取締役会メンバーを解任され、ハレット博士は臨時取締役会メンバーに任命された。ホプキンス博士の行為は私たちの総合財務諸表や私たちの財務報告に対する内部統制に影響を与えていません。彼の退職は私たちの運営や財務業績とは関係ありません。
A.経営実績
経営成果の構成部分
収入を得る私たちの収入は主に私たちの主な活動に関連した2つの源から来ています
•許可料:私たちは協力プロジェクトからライセンス料を受け取り、これらのプロジェクトでは、パートナーを代表して知的財産権を開発しています。これらの合意は、最初からすべての指定された知的財産権をパートナーに譲渡するか、知的財産権の将来の開発および商業化権利を得るためにパートナーに独占的選択権を付与するか。これらの協定の一部として、私たちは臨床、規制、およびビジネスのマイルストーンに達したときに将来のマイルストーンと専門権使用料を得ることができるかもしれない
•サービス料:私たちは薬物発見協力協定からサービス料を生成し、これらの合意の中で、私たちはパートナーを代表して私たちのノウハウを利用して新しい知的財産権を開発しますが、この合意によって将来のマイルストーンや特許料を得る権利はありません。2023年3月までに,買収時の既存の連携プロトコルに関するExScience a GmbHエンティティによりサービス収入を創出した.
私たちはこの2つの収入ストリームで4つのタイプの支払いを受けました
•プリペイドは、通常、協力協定に署名するか、またはプロジェクトを開始する際に支払われる
•研究経費(支払い延期を含む)は、通常、協働期間にわたって合意によって規定された時間間隔(例えば、四半期毎または特定の作業段階の開始時)に支払われ、協力対象となる医薬化合物を開発するために研究(内部および外部)を支援することを目的とする
•マイルストーン支払いは、臨床と規制マイルストーンのような合意で定義された事件を達成することと関連がある
•加入支払いを選択することは、原則としてマイルストーン支払いと同様であるが、パートナーが指定された知的財産権の選択権を取得する際に支払う。このような支払いは私たちが最初に指定された知的財産権を保持しているところにしか存在しない。
上記の支払いに加えて、承認されれば、製品の第1回商業販売時に記念碑的な支払い、金額は販売が発生した地域、および世界の純売上高に基づく印税を受けることができる。これらの金額は、2023年12月31日と2022年12月31日まで、いかなる契約の取引価格にも含まれていない。解約不可、返却不可の収入のみを確認し、署名された協力契約規定のマイルストーンを実現しました。私たちのパートナー統制下の未来のマイルストーンやオプションに関連したいかなる支払いも確認されないだろう。
販売コスト販売コストは、IFRS 15によって顧客との契約に指定されている第三者CROのコストと、第三者協力手配および薬物発見プロトコルに関連する内部労働力および吸収の管理費用とに関連している。外部CROコストは、2023年12月31日、2023年12月31日、2022年12月31日までの総販売コストの66%、77%を占めている。この減少は,主に会社とセノフィの協力活動の増加により,セノフィの協力により高い割合の内部コストが生じたことと,プロジェクトがコストの低い司法管区の戦略CROパートナーに移行したことによるものである
私たちがより多くの協力プロジェクトを始めるにつれて、私たちは将来の販売コストが増加すると予想している。
総(赤字)/利益毛利(損失)/利益は収入から販売コストを差し引く。毛利とは毛利/(損失)が収入に占める割合のことである。私たちの薬物発見協力活動のため、私たちの毛金利は異なる時期に変動するかもしれない。例えば、協調前金に関連する収入は、時間の経過とともに確認され、関連業績義務の履行による推定コストの変化に応じて調整され、いくつかの選択加入およびマイルストーン支払いは、可能性が高いと評価されたときに確認され、これは、通常、実現時に確認される
ある時点で収入を確認する義務については,その時点は我々の顧客と共同で義務履行を合意した日である.長期的に履行された債務については,本グループが確認した収入は,本グループが関連履行義務の履行から実現した利益レベルを確実に見積もることができるように,新協力成立日から協力が十分に進展するまでの回収可能なコストに相当する.潜在的なマイルストーンや特許使用料の収入は通常、契約開始時に確認されないだろう。履行義務を含む前金は、これらの義務を履行する際に確認される。このため、総コストや完了時間を確実に見積もる前に、関連契約が全体的に利益を得ることが予想されるにもかかわらず、個別顧客契約で毛利/(損失)を確認することが可能となる。
したがって,毛利(損失)/利益は現在,我々の将来の業務パフォーマンスをうまく予測できていないと考えられる.
研究と開発費用研究開発費には,私たちが多数の持分と共同所有している薬物発見計画に関するコストと,我々の技術プラットフォームを持続的に開発するためのコストがある。すべての研究と開発コストは科学と技術の不確実性による費用で計上されている。研究と開発費は主に
•研究開発に従事している従業員の賃金、福祉、ボーナス、株式給与などの内部人事に関する費用
•CROと私たちの研究開発に参加した他のコンサルタントとの合意による外部費用
•施設、減価償却及び償却、保険、及び研究·開発活動により発生したその他の直接及び分配された費用;
•私たちのデジタルインフラを運営することに関連するコストは、割り当てられたソフトウェア、計算能力コスト、および実験室関連コストを含み、実験室設備の減価償却を含む。
すべての直接な外部研究と開発支出は1つの計画に基づいて追跡を行い、主に薬物発見の後期段階でCROに支払われる完全と共同運営の発見計画に関連する費用を含み、先導最適化、臨床前と臨床研究を含み、そして個別計画に分配する。我々は、内部従業員時間追跡データを使用して、これらのコストが複数の計画に配置されているので、内部研究開発費用(例えば、従業員コスト、実験室用品、施設、減価償却または他の間接コスト)を特定の計画に割り当てる
私たちは、予測可能な未来に、私たちの資本と共同運営の薬物パイプラインの拡大と推進、そして私たちの技術プラットフォームへの投資に伴い、私たちの研究と開発費用が増加すると予想している。プロジェクトが後期段階に入るにつれて、薬物開発のコストは通常より高くなり、これらの試験は通常より多くの患者の参加と運営を必要とするからである。薬物開発自体の予測不可能性のため、私たちの候補薬物の現在或いは未来の臨床試験の開始時間、持続時間或いは完成コストを決定することはできない。現在私たちは私たちのものを合理的に推定したり知ることはできません
番組です。したがって,我々の研究開発活動のスケジュールによると,我々の研究開発費は時期によって大きく異なる可能性がある.私たちのすべての計画は開発の初期段階にあり、臨床試験過程中あるいは臨床試験過程のため、私たちは多くの予見できない事件を経験する可能性があり、これらの事件は私たちの候補薬物の商業化を延期または阻止し、開発計画に関連するコストと時間の大きな変化を招く可能性がある。
一般と行政費用です一般的かつ行政的費用には、賃金、福祉、ボーナス、株式ベースの報酬を含む、私たちの行政、法律、財務、人的資源、情報技術、その他の行政機能に関連する人件費が含まれています。一般および行政費用には、専門費用(外部法律、会計およびコンサルティングサービスに関連する費用を含む)、分配された間接費用も含まれ、私たちの情報技術、施設、および他の行政機能に関連する減価償却費が含まれる。
私たちは私たちの一般的で行政的費用が近く中期まで相対的に維持されると予想する
株式に基づく報酬株式に基づく給与支出は、研究開発費や行政費用に記録されており、具体的には、それに関連する従業員の活動に依存する。
私たちの株式ベースの報酬は、ExScience aの株式ベースの報酬計画に関連する従業員、非従業員、および役員への株式奨励に関するものです。株式ベースの報酬報酬には主にサービスベースの報酬が含まれており、その中のいくつかは市場に基づく業績条件も持っている。私たちはブラック·スコアーズオプション定価モデルを使用して付与日ベースのサービスの奨励の公正価値を測定し、これらの奨励の公正価値は市場に基づく業績条件も含み、これらの奨励の公正価値は授与日にモンテカルロシミュレーションモデルを使用して決定された。これらのモデルは、私たちの普通株の予想変動率、奨励の期待期間、無リスク金利を含む様々な仮定を含んでいる。私たちは直線に基づいて帰属期限に応じて公正な価値を償却する。各財務諸表日に、当グループは、没収比率に基づいて、予想される行使可能な報酬数の推定値を修正し、市場に基づく表現状況の推定確率の変化に達することを除いて、帰属期間が終了したときに、累積費用が最終的に帰属する報酬数に基づくように調整する。モデルで使用される任意の仮定が将来の付与推定値に大きな変化があれば、株式ベースの報酬支出は将来的に今期に記録された報酬支出と大きく異なる可能性がある
私たちは、私たちの元最高経営責任者に関連した株式奨励金が没収されたため、私たちの株式ベースの報酬支出が減少すると予想している。
他の収入その他の収入には、贈与収入、連合王国研究開発支出免除計画(RDEC)から受け取るべき税収控除、オーストリア研究開発税控除が含まれる
2023年1月1日現在、欧州政府からの贈与、ゲイツ財団からの贈与、オーストリア研究促進機関(FFG)からの贈与、オーストリアWirtshaftsServiceからの贈与の4つがあり、欧州政府の贈与は2023年4月に終了した。ゲイツ財団との寄付は研究と開発活動を実行するために発生した一部の人員、消耗品と管理費用に補償を提供するが、FFG贈与は高含有量の顕微鏡と深度学習による固体腫瘍患者サンプル中の薬物作用の早期テストに関連する。オーストリアWirtshaftsservice贈与は、2020年8月から2022年2月末までの間に行われる資本投資に資金を提供します
2023年11月15日、専門家グループはOpen慈善プロジェクト有限責任会社の寄付を獲得し、これに関連して、専門家グループは1,895,000英ポンド(2,300,000ドル)を獲得し、インターフェロン反応を活性化する重要な側面をさらに探索する需要を援助し、これらのインターフェロン反応は既知の抗インフルエンザと新冠肺炎の抗ウイルス効果である。この贈与は,関連研究や開発活動の展開で発生した一部の人員,消耗品,間接費用を補償するために用いられる。
2023年12月31日現在、上記贈与に関するすべての金額が受領されています(2022年12月31日:未返済金額561,000 GB)
他の収入の他の部分は、当グループが受け取ったいくつかの研究開発税と以下のように相殺される
•RDECは、中小企業研究開発税減免計画や中小企業計画に組み込まれた資格に適合していない条件に適合した研究開発支出に関するイギリスの税収控除に関するものであり、我々がパートナーから収入を得たり、特定のプロジェクトに資金を提供する場合には、以下で所得税優遇と題する部分で議論されるようになっている。これらのコストはRDEC計画に基づいて申告されており,2023年4月1日までに条件に適合した支出に13%までの税収控除(その後20%)を提供し,一部の下請け支出は8.5%の税収控除(2023年4月1日以降13%)を得る予定である。RDEC制度では,条件を満たすパケットコストは,慈善機関,高等教育機関や科学研究組織などの特定機関と負担するコストに限られている.
•RDEC制度によると、税項は当社の他の収入項目の下の除税前プレミアムに入金され、関連税項は今年度全体の損失前にイギリスの現行会社税率で確認されます。英国が開発した税収控除制度の改正案は、限られた例外が適用されない限り、下請け活動または外部から提供される労働者の支出申請の税収減免に制限を加えることができ、このような下請け活動がイギリスで行われない場合、またはこれらの労働者がイギリスの給与税の制約を受けない場合には、提案されている。これらの改正は2024年4月1日以降に開始される会計期間中に施行される予定だ。また、イギリス政府は、2024年4月から中小企業計画とRDEC制度を計画に統合することを提案し、この提案が最近公表された立法草案に規定されている方法で可決された場合、私たちは“研究集約型中小企業”の資格を満たしていない場合、私たちの研究·開発活動について現金リベートを申請することができなくなるか、または現在よりもはるかに低い比率でこのような現金リベートを得ることができるようになる。これらと未来のイギリスが開発した税収減免計画の他の潜在的な変化は、私たちが申請したり、そこから利益を得る資格がなくなったり、私たちがそこから利益を得ることができる程度に実質的な影響を与えなくなったことを意味するかもしれない。
•私たちはまた、条件に合った研究と実験開発支出に関するオーストリア研究プレミアムを獲得した。研究費は14%の比率で他の収入に計上されている
外国為替(赤字)/収益為替(損失)/収益は、主に私たちの非ポンド建て現金と現金等価物の換算、および未償還通貨非ポンド金融資産および負債から、貿易売掛金を含む
長期契約の損益当該グループは契約を締結し、将来ある日に所定のレートで固定額の通貨を両替する。この等貨幣長期契約は、最初に派生契約を締結した当日に公正価値で確認し、その後、期末ごとに公正価値に従って再計量する。派生ツールは価値変動による任意の損益を損益内で確認する.
財務収入財務収入は主に現金、現金等価物、短期銀行預金の利息収入から来ている。
財務支出財務支出には、国際財務報告基準第16号“賃貸”に基づいて確認された賃貸負債に関する支払利息、当グループの賃貸物件について確認された修復支出割引の廃止に関する利息、対応するローン及び銀行利息が含まれる。
合営企業の赤字シェア合弁企業の損失部分は私たちがRallybioとRE Ventures II、LLCと二等分して所有する合弁実体RE Ventures I,LLCによるコストシェアを含む;しかし、年内には何の費用も発生していない
IFRS 11下の合弁企業の定義に適合したより多くの共同協力を構築すれば、これらの手配の利益または損失における私たちのシェアは将来のこの点に影響を与える。
所得税の割引私たちの所得税優遇には、イギリスで回収可能な研究と開発税収免除が含まれており、アメリカ、オーストリア、日本が支払うべき所得税によって相殺される。私たちはイギリスで会社税を払わなければならない。エクスタ人工知能有限公司の完全子会社であるエクシマ社、エクスタ第一リスク投資会社、エクスタaベンチャー会社II,Inc.は米国で会社税を支払う必要がある。ExScience a AI Limitedの完全子会社ExScience a KKは日本で会社税を払わなければなりません。ExScience a AI Limitedの完全子会社ExScience a GmbHはオーストリアで会社税を納めています。私たちの業務の性質のため、私たちは最初から赤字が発生しました。会社間の移転定価手配により,ExScience a,Inc.,ExScience a GmbH,ExScience a KKともに課税利益が生じた.
研究開発活動を広く展開するグループとして、私たちはイギリスのS中小企業の研究開発税収控除制度の恩恵を受け、一部の損失を返還することができ、2023年4月1日までの条件を満たす研究開発プロジェクトに関する支出の33.35%のキャッシュバックを得ることができる。条件に適合した支出には,主に関係作業者の雇用コスト,CROが提供する外部労働者および研究開発プロジェクトで使用されるソフトウェアや消耗品がある。2023年4月1日現在、ある下請けの合格した研究開発支出は21.68%に達する現金リベートを得る資格がある。私たちの研究と開発に関連するコストの大部分は税金控除現金還付申請に含まれる資格があります。中小企業計画の控除は所得税優遇で十分に確認されている。
2023年4月1日以降に発生した資格に適合した研究開発支出については、中小企業が計画している現金還付率は18.6%に低下している。最近採択された“財政条例草案”によるイギリスの研究開発税収免除制度の改正は、この日から申請できる現金還付を資格支出の26.97%に引き上げ、私たちがある会計期間(広義には、資格に適合する研究開発支出が当該会計期間の総支出の40%(あるいは2024年4月1日から、その総支出の30%を占める)以上の赤字中小企業を占める資格があることを前提としている。2023年12月31日までの会計期間に研究開発集約型中小企業の資格を満たしていると判定されれば(したがって、2023年4月1日から2023年12月31日までの間の現金還付は、現在使用されている18.6%ではなく、条件に適合した支出で26.97%申請できる)、影響は、2023年12月31日までの年度の所得税割引を3961,000 GB増加させることになると予想される。
また、改正案は、(I)(限られた例外が適用されない限り)下請け研究開発活動または外部から提供される労働者の支出に申請可能な税収減免に制限を加え、そのような下請け活動がイギリスで行われない場合、またはそのような労働者がイギリス賃金税を支払う必要がない場合、および(Ii)中小企業計画およびRDEC計画を計画に統合する2024年4月1日から施行される。もし私たちが研究開発集約型中小企業の資格を満たしていなければ、私たちの研究開発活動について現金リベートを申請することができなくなり、あるいは現在よりはるかに低い比率でこのような現金リベートを得ることができるようになるだろう。これらおよび将来的にイギリスが開発した税収減免計画の他の潜在的な変化は、私たちがこれらの税金減免を享受する資格がなくなったこと、または私たちがクレームを立てることができたり、そこから利益を得ることができる程度に実質的な影響を与えることを意味するかもしれない。
企業範囲の情報を細分化しています私たちの運営を単一の運営部門として管理し、業績を評価し、運営決定を行う。私たちの重点は小分子候補薬を発見し開発することだ。
2023年まで、2023年と2022年12月31日までの年度比較
次の表は、私たちの毎期の総合全面損失報告書(千単位)をまとめています
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 収入.収入 | $ | 25,587 | | £ | 20,079 | | £ | 27,223 |
| 販売コスト | (34,920) | | (27,403) | | (33,297) |
総(損失)/利益 | (9,333) | | (7,324) | | (6,074) |
| 研究開発費 | (163,676) | | (128,444) | | (128,865) |
| 一般行政費 | (57,766) | | (45,331) | | (38,416) |
| 為替/収益 | (1,964) | | (1,541) | | 33,609 |
| 長期契約損失 | — | | — | | (11,287) |
| その他の収入 | 8,457 | | 6,636 | | 5,742 |
営業損失 | (224,282) | | (176,004) | | (145,291) |
| 財政収入 | 21,189 | | 16,628 | | 5,681 |
| 財務費用 | (1,360) | | (1,067) | | (334) |
| 合営企業の赤字シェア | (2,096) | | (1,645) | | (691) |
税引き前損失 | (206,549) | | (162,088) | | (140,635) |
| 所得税割引 | 20,549 | | 16,125 | | 21,907 |
当期損失 | $ | (186,000) | | £ | (145,963) | | £ | (118,728) |
収入.収入
次の表に私たちの指定された年の収入(千単位)を示します
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| サービス料 | $ | 133 | | £ | 104 | | £ | 670 |
| ライセンス料--時間経過確認 | 25,454 | | 19,975 | | 26,553 |
収入.収入 | $ | 25,587 | | £ | 20,079 | | £ | 27,223 |
2023年12月31日と2022年12月31日までの1年間,サービス料はExisla GmbHが持つレガシー契約による収入に関連しており,それに関連する収入はある時点で確認されている
2022年1月4日、我々はセノフィと戦略研究協力を達成し、人工知能駆動の精密工学薬物パイプラインを開発した。協力下の研究は腫瘍学と免疫学分野の15個の新しい小分子候補対象に集中し,74,242,000 GB(100,000,000ドル)の前払い現金を受け取り,潜在的な総マイルストーン金額は5200,000,000ドルであり,協力期間中の分級特許使用料を加えた。
2022年3月11日、BMYは私たちとの最初の協力計画を6ヶ月延長して、より多くのデータを生成し、それに関連して500万ドルの現金支払いを受けた。この用語は
延期支払いは、協力部分が履行されていない設計·開発協力対象候補者に関する業績義務に関する取引価格の追加部分とみなされ、国際財務報告基準第15条21 B段落に基づいて当該日の収入を累積確認する。取引価格の残り部分は、業績義務が履行されたときに2022年残時間の収入であることが確認される
2022年5月30日、双方の同意を得て、私たちはバイエル株式会社と以前存在していた協力手配を終了しました。契約終了時には,契約に関するすべての残りの履行債務がすべて履行されているとみなされ,その時点で確認された収入総額は1,153,000英ポンドであった.
2023年7月27日、私たちとセノフィ社は、双方が2022年1月4日に署名した協力協定を修正し、この合意に基づいて、特定の目標代替およびマイルストーン支払いに関連する条項を含む協力目標に関するいくつかの条項を修正した。改訂日に、全体の契約取引価格は改訂によって変更されておらず、一部の履行責任確認を果たした収入も重大な調整がない。
2023年9月19日、私たちはドイツのダムシュタットKGaA社のヘルスケア業務と協力協定を締結し、ExScience aの人工知能駆動を利用した正確な薬物設計と発見能力に焦点を当て、腫瘍学、神経炎症と免疫学にまたがる新しい小分子候補薬物を発見した。3つの潜在的一流または一流の潜在的目標がパートナー関係の初期重点として決定されたことに関連して、私たちは20,100,000ドルの前払い現金(源泉徴収税3,181,000ドルを差し引くと、2024年後半に受信予定)を受け取り、純売上高の特許権使用料の支払いに加えて、発見、開発、規制、および販売に基づくマイルストーンプロジェクトの潜在的総金額は674,000,000ドルに達する可能性がある。
2023年9月27日、私たちはサイノフィと協力した最初の炎症と免疫学的目標の研究マイルストーンの確認を受け、これに関連する私たちは400万ドルの現金支払いを受けた。実現前には,このマイルストーンは関連項目に関連する薬物設計作業に関する制限された可変対価とされていたため,実現日から関連部分の義務履行取引価格が計上され,収入は義務履行であることが確認された
2023年12月21日、セノフィとの現在の協力を修正し、追加的な発見段階計画に加え、2024年2月に400万ドルの現金支払いを受け、収入は時間の経過とともに関連業績義務の履行であることが確認された。修正された協定の条項によると、この化合物が協力協定の下のすべてのマイルストーンに達した場合、私たちは45,000,000ドルまでの前金と臨床前マイルストーン支払い、および300,000,000ドルを超える開発、規制、販売ベースのマイルストーン支払い、および製品販売の等級別特許権使用料を得る資格がある。
2023年12月31日までの1年間に、収入には、BMYと提携しているプロジェクトの払戻不可前金に関する総額6,859,000 GBが含まれています。これらの金額は今年度の収入であることが確認されており,BMYと共同でこれらのプロジェクトをさらに開発しないことを決定し,協力中の他の項目を優先することにしたからである
私たちはビジネスパートナーとの重要な協力計画を評価し、以下の要素を考慮して確定し、2023年12月31日まで、将来の運営損失に備える必要はない
各協力の予想される将来の現金流入および残りの契約債務額は、それぞれの契約義務を履行する残りの避けられない費用に対して行われる。
販売コスト
次の表に指定期間における販売コスト(千単位)を示す
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 外部CROコスト | $ | 22,962 | | £ | 18,019 | | £ | 25,789 |
| 内部人工と管理費用 | 11,958 | | 9,384 | | 7,508 |
| 販売総コスト | $ | 34,920 | | £ | 27,403 | | £ | 33,297 |
2023年12月31日までの年間販売コストは2,740万GBであるのに対し,2022年12月31日までの同期は3,330万GBである。前年と比較して、販売コストが低下した主な原因は、チャネル優先順位と費用対効果措置である。
研究と開発費
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| EXS 21546 | $ | 2,764 | | | £ | 2,169 | | | £ | 2,735 | |
| GTAEXS 617 | 3,424 | | | 2,687 | | | — | |
| 他の研究プロジェクトは | 34,124 | | | 26,779 | | | 46,307 | |
外部研究開発費総額 | 40,312 | | | 31,635 | | | 49,042 | |
| 人員編成に関する費用 | 85,685 | | | 67,241 | | | 59,981 | |
| 実験室消耗品と設備 | 7,006 | | | 5,498 | | | 8,644 | |
| ソフトウェアとデータ | 11,557 | | | 9,069 | | | 7,893 | |
| 知的財産権の償却を獲得した | 5,862 | | | 4,600 | | | 4,611 | |
| 減価償却および償却 | 11,244 | | | 8,824 | | | 4,761 | |
| 財産·工場·設備の減価 | 1,666 | | | 1,307 | | | — | |
| 研究開発コンサルティング会社 | 3,140 | | | 2,464 | | | 1,177 | |
| 他にも | 4,541 | | | 3,564 | | | 1,059 | |
| 内部研究開発費総額 | 130,701 | | | 102,567 | | | 88,126 | |
| 協力パートナーからの精算 | (7,337) | | | (5,758) | | | (8,303) | |
| 研究開発費総額 | 163,676 | | | 128,444 | | | 128,865 | |
| | | | | |
パートナーからの精算は,パートナーが我々の共同手配合意に関する金額を受け取ることを指す.
2023年12月31日までの年度の研究開発費は1.284億GBであるが、2022年12月31日までの同期は1兆289億GBであり、これはパイプライン優先順位付け活動によるコスト減少および運営効率(より速い周期とより低いアウトソーシングコストを含む)によるコスト節約であるが、パイプラインの進展により、臨床および末期臨床前計画に関連する追加コストは大きく相殺される
本グループの工場と設備への持続的な投資は、私たちが牛津郡ミルトン公園にある自動化実験室が2023年第2四半期に開業することを含むため、発生した追加減価償却と償却支出は410万英ポンドである。
2023年12月31日までの年度中に,生物製品計画に関するいくつかの工場や設備の減値が130万ポンド用意されていることが確認され,2023年第4四半期に優先順位が取り消された。
一般と行政費用です2023年12月31日までの年度の一般·行政費は4,530万GBであるのに対し,2022年12月31日までの同期は3,840万GBである。一般や行政費用が増加した要因は,業務増加に関連する賃金や従業員費用が730万GB増加したことであるが,自動化と費用便益対策で相殺されている。
外国為替(赤字)/収益2023年12月31日までの年間外貨(赤字)/収益は150万GBの赤字だったが、2022年12月31日までの年間収益は3360万GBだった。2023年12月31日までの年間赤字は、主にドルの相対的なポンド疲弊が私たちのドル建て現金、短期銀行預金、貿易売掛金に与える影響によるものだ。
長期契約損失2022年4月、私たちは一連の期限が3ヶ月未満の長期契約を締結し、ドルを固定数量のポンドに両替して、私たちが直面している外貨リスクをヘッジすることを約束した。この間、ドルは長期契約手配で合意された為替レートに対して強くなり、2022年12月31日までの間にこれらの取引に関連する1130万GBの損失を招いた。私たちは派生金融商品を投機目的に使用しないつもりだ。
他の収入2023年12月31日までの年度のその他の収入は660万GBであるのに対し,2022年12月31日までの同期は570万GBである。その他の収入の増加は主にイギリスRDECの税収控除増加によるものであり,これは所得の基本税率引き上げの結果,2023年4月1日の13%から20%に増加したためである。
純財務収入/(費用)2023年12月31日までの年度の純財務収入は1560万GBだったが、2022年12月31日までの同期純財務収入は530万GBだった。これは主に昨年通年の金利上昇による銀行預金金利の増加によるものだ。
合営企業の赤字シェア。2023年12月31日までに、合弁企業が2023年12月31日までに発生する基本的な研究開発費が増加したため、合弁企業が占めるべき損失シェアは160万GBだったが、2022年12月31日までの期間は70万GBだった
所得税の割引2023年12月31日までの年度の所得税割引は1,610万GBであるのに対し,2022年12月31日までの同期は2,190万GBである。我々の所得税優遇残高には主に研究開発税収控除が含まれており、前年に比べて減少しており、英国中小企業の現金控除の申請比率が2023年4月1日までの33.35%からこの日から18.6%に低下したためだ。
2022年12月31日までと2021年12月31日までの年間運営結果比較は,2023年3月23日のForm 20-Fの前年ファイルで見つけることができる.
B.流動資金と資本資源
流動性の源です私たちは設立以来、候補薬物の商業化から何の収入も得ていません。私たちは私たちの普通株と優先株と私たちの協力計画によって生まれた研究資金とマイルストーン支払いを売却することで、私たちの運営に資金を提供します。私たちの現金、現金等価物、短期銀行預金は、2023年12月31日、2023年12月31日、2022年12月31日まで、それぞれ3.63億GBと5.058億GBです。
2023年12月31日現在、初公募株の完成と私募を同時に行った3.513億GB(4.771億ドル)の毛収入を含む、私たちの優先株と普通株を売却することで合計5.338億GBの資金を調達しました
我々の資本の主な用途は,研究開発費,報酬,関係者費用,施設を含めた他の運営費に引き続き利用される予定である。運営費に資金を提供するための現金は、私たちが費用を支払う時間の影響を受け、これは私たちの未済売掛金と売掛金の変化に反映されています。臨床開発段階で我々の候補薬を推進することには多くの費用が生じると予想される
次の表は、列報期間ごとの現金と短期銀行預金の主な出所と用途(単位:千):をまとめています
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2023 | | 2023 | | 2022 |
| 経営活動のためのキャッシュフロー純額 | | $ | (149,861) | | | £ | (117,602) | | | £ | (60,515) | |
| 投資活動のためのキャッシュフロー純額 | | (27,411) | | | (21,511) | | | (122,681) | |
| 資金調達活動のためのキャッシュフロー純額 | | (4,331) | | | (3,399) | | | (3,998) | |
| 現金と現金等価物純額(減少)/増加 | | $ | (181,603) | | | £ | (142,512) | | | £ | (187,194) | |
| | | | | | |
| 銀行短期預金純増 | | 2,997 | | | 2,352 | | | 101,234 | |
| 現金と現金等価物の為替(損失)/収益 | | (3,315) | | | (2,602) | | | 29,598 | |
| 現金、現金等価物および短期銀行預金純額(減少)/増加、現金および現金等価物を含む外国為替収益/(損失) | | $ | (181,921) | | | £ | (142,762) | | | £ | (56,362) | |
経営活動2023年12月31日までの年度,経営活動の現金純流出総額は1兆176億GBであったが,2022年12月31日までの年度の純現金流出は6050万GBであった。経営活動の現金純流出が増加したのは,主に2023年12月31日までの年度までの協力からの現金流入が前年度の9,190万GBから2,220万GBに減少し,2023年12月31日までの年間支払期間が2022年12月31日までの年度の支払時間よりも減少したことによる純流出1,430万GBの現金流出が含まれているためである。
2023年12月31日までに、提携からの現金流入には、ドイツのダムシュタットMerck KGaAと同側が2023年9月19日に調印した協力協定の1,360万GB、当グループとセノフィが協力して研究マイルストーンに達した際に受け取った320万GBと、当グループとOpen慈善プロジェクト有限責任会社の贈与に関する190万GBが含まれている。
私たちは、主に私たちの協力協定の構造のため、私たちの現金流入が異なる時期に高度に可変になると予想している。これらの合意には,一般に契約開始時に支払われる金が含まれており,マイルストーンを実現した際に支払われた金も含まれており,これらのマイルストーンの時間や実現度は非常に不確定であり,予測が困難である.
投資活動2023年12月31日までの年度の投資活動に用いられた現金純額は2,150万GBであったが,2022年12月31日までの年度は1兆227億GBであった。今期の大部分の純流出は,購入物件,工場および設備に係る26,500,000 GB,当グループ短期銀行預金投資に関する純流入7,000,000 GB相殺に関連している
融資活動2023年12月31日までの年度の融資活動用現金純額は340万GBであったが、2022年12月31日までの同時期の融資活動用現金純額は400万GBであった。今期の融資現金流出の大部分は賃貸負債項目下の債務の支払いと関係がある
資金要求設立以来、私たちは業務発展を支援するために大きな損失、特に私たちの研究開発費を被ってきました。私たちは予測可能な未来に引き続き大きな損失を受けることが予想され、特に私たちの候補製品を臨床開発と商業化する際に、私たちが行っている業務に関連する費用が増加することが予想される
私たちの現在の運営計画によると、私たちは私たちの既存の現金、現金等価物、短期銀行預金、および予想されるマイルストーンが、2026年まで私たちの運営と資本支出需要に資金を提供するのに十分だと信じている。私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは予想よりも早く私たちの資本資源を使用することができる。
私たちは候補薬物の開発と商業化を含めて、私たちの将来の運営を支援するために追加の資金を得る必要があるかもしれない。私たちは薬品開発と商業化に関連するリスクの影響を受け、私たちは意外な費用、困難、合併症、遅延、その他私たちの業務に悪影響を及ぼす可能性のある未知の要素に遭遇する可能性がある。私たちの業務を支持する十分な財務滑走路の予測は前向きな陳述であり、リスクと不確実性に関連しており、実際の結果は様々な要素によって異なる可能性がある。私たちの未来の資本需要は多くの要素に依存するだろうが、これらに限定されない
•私たちの臨床試験の進行、時間、範囲とコストは、私たちが行っている、計画中と潜在的な未来の臨床試験のために適時に臨床場所を開始し、被験者を募集し、候補薬物を生産する能力を含む
•私たちの研究案から新薬候補薬を決定し決定するのに要する時間とコストを決定するために研究と開発を行った
•臨床試験を実行するか、または候補薬剤を商業化するのに必要な規制許可および承認に要する時間およびコストを得ることができれば、
•承認されれば候補薬を商業化する能力に成功しました
•私たちはアメリカ食品医薬品局、ヨーロッパ医薬品局、他の規制機関に適した法規に適合した臨床および商業製品を生産することに成功した
•このような潜在的製品の販売価格および患者が十分な第三者保険および補償を受けているかどうかを含む、候補薬物の商業化された売上および他の収入(もしあれば)を含むことができる
•当社のマーケティングおよび販売能力を確立するコストおよびタイミングを含む、当社の製品の商業化に関連する販売およびマーケティングコスト(承認された場合)、
•私たちが現在未来と協力している任意の収入の条項と時間
•上場企業の運営コスト
•技術、規制、政治、市場発展に要する時間とコスト
•任意の特許権利要件および他の知的財産権の提出、起訴、弁護および実行費用;
•私たちが構築する可能性のある任意の潜在的な買収、戦略的協力、許可協定、または他の手配に関連するコスト、条項、および時間
•臨床サイトは患者を募集できず、自然災害(気候変化による可能性がある)或いは他の衛生システムの緊急事態、例えば新冠肺炎の大流行に対応するため、医療保健能力が必要である。
我々の現在および将来の任意の候補薬剤の開発に関連する任意のこれらまたは他の変数の結果は、任意の候補薬剤の開発および商業化に関連するコストおよびタイミングを大きく変化させる可能性がある。また、私たちの運営計画は将来的に変化する可能性があり、運営需要とそのような運営計画に関連する資本要求を満たすために追加の資金が必要になるかもしれません。
C.研究と開発
我々の研究·開発活動の議論については、“を参照されたい”プロジェクト4.B--ビジネスの概要“と”プロジェクト5.a--経営成果.”
D.トレンド情報
トレンドの議論については、“を参照されたい”プロジェクト4.B--ビジネスの概要,” “プロジェクト5.a--経営成果“と”プロジェクト5.b--流動資金と資本資源.”
E.重要材料会計政策と重大な判断と推定
我々がそれぞれ2023年、2023年、2022年12月31日までの総合財務諸表は、国際会計基準委員会が発表した国際財務報告基準に基づいて作成された。“国際財務報告基準”に基づいて連結財務諸表を作成するには、資産および負債価値に影響を与える推定および仮定、ならびに財務状況表の日付報告書または資産および負債、ならびに会計年度に生じる収入および費用を使用する必要がある。このような推定や関連仮定は,総合財務諸表を作成する際に得られる資料,過去の経験,その際に合理的とされている様々な他の要因に基づいて行われ,その結果は資産や負債の帳簿価値を判断する基礎となり,当該などの資産や負債の帳簿価値は他の出所から容易に見られるものではない。判断と仮定は主に収入確認に関係しており,1)プロトコル項目ごとの履行義務を決定する適切な方法,2)決定された履行義務に収入を適切に割り当てること,および3)可変対価格を実現する可能性が高いと考えられる場合を決定する。また、推定および判断は、時間とともに交付された履行責任の履行による将来コストの推定、顧客契約項の下での責任を履行する避けられない将来コストが受信する経済的利益を超えるかどうか、減値が必要なかどうか/重いレンタル手配の確認、ゲイツ財団の個人配給の買い戻し権、本グループのGTAへの投資の公正価値、および商業権および無形資産の減値にも関連する。しかし,既存の状況や将来の発展に対する仮定は,市場の変化や我々が制御できない状況の出現によって変化する可能性がある.したがって、私たちの推定値は実際の値とは違うかもしれない。
私たちの重要な会計政策は、本年報の他の部分の総合財務諸表付記により全面的に記述されています。以下の会計政策は、我々が連結財務諸表を作成する際に重大な判断と推定を行う過程に重要であると考えられる。
収入確認国際財務報告基準第15号によると、吾は顧客が約束した商品或いはサービスに対するコントロール権を取得した時に収入を確認し、金額は吾などの予想がそのような商品或いはサービスと交換した対価格を反映している。IFRS 15の範囲に適合すると考えられる手配の収入確認を決定するために,(I)クライアントとの契約の決定(S),(Ii)契約における履行義務の決定,(Iii)取引価格の決定,(Iv)契約に取引価格を割り当てる履行義務,および(V)契約義務を履行する際に収入を確認する,の5つのステップを実行する.
契約開始時に、IFRS 15の範囲内に属する各契約において約束された貨物またはサービスを評価して、異なる履行義務を決定する。そして,義務履行時または義務履行時にそれぞれの義務履行に割り当てられた取引価格の金額が収入であることを確認した。収入は契約価格で計算され、付加価値税や他の販売税は含まれていません。
私たちは制限されない推定可変対価金額を取引価格に計上します。取引価格に含まれる金額は、確認された累積収入が大きく逆転しない可能性の高い金額に制限されている。契約開始時には、制限されない収入は、通常、前金を含み、場合によっては、研究資金も含まれる。
各項目が研究、開発または規制マイルストーン支払いを含む予定の開始時に、吾等は、マイルストーン(I)が合意項目の下の1つまたは複数の異なる履行責任に関連しているかどうか、および(Ii)達成可能性があるとみなされているかどうかを評価し、最も可能な金額法を使用して取引価格に計上される金額を推定する。大きな収入逆転が起こらない可能性が高い場合、関連するマイルストーン価値は取引価格に含まれる。規制承認のような我々または被許可者の制御範囲内でのマイルストーン支払いは、これらの承認を受ける前に実現可能であるとは考えられない。
いずれの発展マイルストーン収入調整も累積追跡に従って入金され、これは調整期間中の収入と収益に影響する。
その後報告期間ごとに終了すると,吾らは取引価格に含まれる推定変動の価格や何らかの関連制限を再評価し,必要に応じて全体の取引価格の見積りを調整する.いずれの調整も累積追跡をもとに記録されており,調整期間中のナンバープレート,費用,他の収入,収益に影響を与える可能性がある.
そして,取引価格は相対的に独立した販売価格で履行義務ごとに割り当てられ,通常は各協力プロトコル下の各目標項目が代表されるため,収入が契約下の履行義務が履行された場合であることを確認する.
履行義務が履行されているか否かを決定する際には,入力法を用いて進捗状況を測定し,連携スケジュールの性質に応じて,外部コストや発生工数を用いて完了進捗を決定し推定する.経営陣は、入力法は、発生した時間とコストが顧客に移転する可能性のある基礎知的財産権の開発進捗を記述しているため、義務履行を完了する上での私たちの進展を如実に描写していると考えている。各報告期間終了時に,発生したコスト/工数と総期待コスト/工数との比較を再評価し,業績義務ごとの収入を確認した。場合によっては、予想される総費用推定数は、特定の協力協定に従って許容される目標の代替に関連する推定費用を含む。
潜在的なマイルストーンや特許使用料の収入は通常、契約開始時に確認されないだろう。履行義務を含む前払いは、このような義務が交付されたことが確認された
また,完成案の費用や時間を合理的に見積もる前に,費用の利益が発生したことは確認されない.したがって、総コストおよび完了時間を確実に推定することができる前に、関連契約が全体的に利益を得ることが予想されるにもかかわらず、個別の顧客契約で総損失を確認することが可能である。
ある時点で収入が確認された債務については、その時点は貨物所有権が顧客に転送された日である。
契約負債には、収入確認の前に受け取った請求書または支払いが含まれています。契約資産には、請求書または支払いの前に確認された収入が含まれている。
赤字の協力手配“国際財務報告基準”第15条基準に適合する協力については、各協力手配の義務を履行する推定不可避なコストが、その計画に基づいて期待される経済的利益を超えるか否かを決定するために、管理層の判断が必要である。これらの費用がこの計画によって生じる将来の収入の最適な推定値を超える場合、国際会計基準第37条の規定に従って支出される。経営陣は、2023年12月31日現在、将来の運営損失に備える必要はないと評価している
賃貸借契約2022年12月、私らはアメリカフロリダ州マイアミの物件について賃貸手配を締結し、レンタル期間は2024年第1期から始まる。上記の手配を達成した後,我々のパイプ優先順位で動作するため,これらの物件を占有せず,近くの小さい物件を借りることにした.この手配によると、最低賃貸承諾額は合計3,040,000 GBであるため、準備すべき重い契約が存在するかどうかを評価しなければならない
我々はすでに代理人を招いて,本来借りていた物件を第三者に転貸することに協力し,契約の履行責任を果たす避けられないコストの現在値を見積もり,分譲空間の期待収益807,000英ポンドを超えている2023年12月31日そして、その金額は、その日付の準備に記入されています。
ゲイツ財団は権利の買い戻しを私募しているゲイツ財団との私募条項によると、もし私たちが合意のいくつかの条項に違反すれば、ゲイツ財団は公開発行価格と株式時価の高い者でゲイツ財団が保有する任意のグループの株式を売却または買い戻す権利がある。この権利は、吾等の派生金融負債を構成し、公正価値で損益に確認されている。違約の可能性を評価しました最低でも2023年12月31日したがって、この負債の公正価値は、貸借対照表の日にゼロと推定される。
GTAでの私たちの投資の公正な価値権益ツールは、エンティティのすべての負債を差し引いた後にそのエンティティの資産に対して残りの権益があることを証明する任意の契約を構成する
2021年3月31日にGTAとの収入契約が実現したことに伴い、当社は同社のいくつかの普通株と優先株を非現金収入対価格として獲得する権利がある。これらの株式は非上場株式証券を代表し、IFRS 9で提供される選択を選択して、他の全面収益(FVOCI)内の公正価値損益を確認する
GTAは未発売の早期企業であり,その薬物開発の発見と開発段階のプロジェクトは創設前のプロジェクトである。そのため、不確定性の主要な源はこれらの非上場株式証券の1株当たり価値であると推定される。株式に関する流通性は極めて悪いが、主な推定要因は、第三者株式買収取引を行う最新投資のコストや価格であり、他の要因を反映するように適切に調整されている
商標権と薬物検査知的財産権は無形に減少した2021年8月18日,Allcell社の買収の一部として,Allcellが使用する薬物鏡技術に関する知的財産権を36,078,000 GBの公正価値で獲得した。この知的財産権は買収の日から8年以内に償却される。この買収の一部として、買収から期待される追加価値と、集まった労働力である合計5,887,000 GBの事業権も買収した。
私たちは毎年、または状況が変化した時に、商標権または獲得された知的財産権が損害を受ける可能性があるかどうかを評価する。減値が存在するかどうかを決定するには、商業権と知的財産権の買収に関連する現金生成単位(“CGU”)の回収可能な金額を推定する必要があり、その使用価値と公正価値から販売コストを引いた高い者に等しい
2022年1月1日から、本グループは営業権及び他の無形資産に関するCGUの名称を変更し、本グループが2021年8月に買収したAllcell業務を本グループの今年度のより広範な活動に統合した後、グループ全体はその薬物発見活動に関連するCGUを決定した。2021年12月31日現在、このエンティティの活動は単独のCGUとみなされ、それに基づいて減値審査が行われている。この決定は重要な判断を構成する。
使用価値の計算も判断性質に属し、そして本グループは薬物発見、開発、監督審査及び商業化のCGU期待による将来のキャッシュフローについていくつかの推定、及び適切な割引率をカバーして現在値を計算することを要求する。キャッシュフロー予測は,観察可能な市場比較性に基づいてさらにリスク調整を行い,薬物が開発の各段階で商業化に成功する可能性を考慮する。敏感性分析を行うのは,重大な仮定の合理的な変化が帳簿価値が回収可能金額を超えてしまうかどうかを決定するためである。キャッシュフロー単位の帳票価値がその回収可能金額を超えた場合、キャッシュフロー単位は減値とされ、キャッシュフロー単位内の資産をその回収可能金額に減記する。減価損失は総合損益表およびその他の包括収益表で確認した
二零二三年十二月三十一日に詳細な減価評価を行い、何の減価記録もなく、重大な仮定も帳簿額面が回収可能金額を超える合理的な変動は発見されなかった。
財務報告の内部統制
今回の評価では、2023年12月31日現在の財務報告内部統制における以下のような大きな弱点が発見され、いずれも2022年12月31日までの年度総合財務諸表を作成した際に発見された
a.全期間にわたって、財務報告書終了プロセスにおいて一貫した審査手順を維持して、適切な職責分業を維持しながら、会計事項をタイムリーかつ正確に分析、記録、開示することを含む有効なプロセスおよび制御を維持することができない。
b.我々は,財務諸表作成に重要な意味を持つ情報システムの有効な情報技術一般制御を実施·維持しておらず,変革管理やシナリオ開発の制御に加え,このようなシステム内で衝突する役割を適切に分離した制御を行っている
上記のような重大な欠陥のため、我々の経営陣は、2023年12月31日現在、財務報告に対する内部統制が合理的な保証水準に達していないと結論した。
管理する’S計画は現在の物質的弱点を補う上級管理職と監査委員会の監督の下で、財務報告に対する私たちの内部統制を評価し続け、以下に述べるように、発見された重大な弱点をさらに解決するためにいくつかの救済措置を講じている
a.我々は,適切な役割分担を維持する制御を含む,従来設計されていた情報技術一般制御措置を実施·実施している.
b.我々は、COSOフレームワークの構成要素を処理するために、正式なプロセスおよび制御を実施および記録することを含む、十分な技術会計専門知識を有する外部専門コンサルタントと協力して、財務報告の内部制御の実施および評価に協力し、正式な会計政策およびプログラム、制御操作の証拠を維持し、会計担当者の役割を分離することを含む
c.私たちは、情報技術一般制御、適切な役割分担の維持のための制御を含む、十分な技術会計専門長を有する外部専門顧問と協力して、最終的に私たちの財務制御環境の設計を決定することを支援していきます。
d.我々は、財務チーム内に必要な専門知識と帯域幅を確保するために、上記のような重大な弱点を解決するために、情報技術の一般的な制御を実施·実行する上で豊富な経験を有する上級者を雇用することを確保し、我々の人員に対する訓練を強化し、制御責任を明確に伝達する。
これらの重大な弱点があるにもかかわらず、私たちの経営陣は、本年度報告に含まれる他の部分に含まれる財務諸表が、すべての重大な面で、私たちの列報期間中の財務状況、経営業績、現金流量を公平に反映しており、国際財務報告基準に適合していると考えている。
もし私たちが未来に重大な弱点を完全に補うことができなかった場合、あるいは有効な内部統制を維持できなかった場合、私たちの財務諸表に重大な誤報が発生し、適時に予防あるいは発見できない可能性があり、これは投資家が私たちの財務情報に自信を失ったり、私たちの株価を下落させたりする可能性がある。我々の独立公認会計士事務所は、財務報告の内部統制に対する我々の有効性を評価しておらず、これは、財務報告の内部統制の弱点や欠陥が発見されないリスクを増加させる可能性がある。
財務報告書の内部統制に関するより多くの情報については、参照されたいプロジェクト15- 制御とプログラム“と言いました
近く発表·採択された会計公告
2023年1月1日現在、2023年1月1日現在、2022年1月1日までに初めて適用される基準については、本年度報告に他の部分に含まれる2023年12月31日現在の連結財務諸表付記2を参照されたい
項目6.役員、上級管理職、従業員
次の表には、2024年3月1日までの年齢を含む、我々の役員と取締役に関する情報が挙げられています。
| | | | | | | | | | | | | | |
| 名前.名前 | | 年ごろ | | ポスト |
| 行政官: | | | | |
| デイビッド·ハレット博士 | | 54 | | 取締役臨時最高経営責任者兼最高経営責任者 |
| マイケル·クラムス医学博士です | | 63 | | 首席医療官 |
| ベン·テイラー | | 46 | | 首席財務·戦略官兼取締役 |
| 非執行役員: | | | | |
エリザベス·クライン(1)(2)(3) | | 59 | | 取締役会議長 |
ロバート·ゲンチェフ(1)(2)(3) | | 41 | | 役員.取締役 |
フランセカ·マイケル博士(1)(2)(3)(4) | | 41 | | 役員.取締役 |
マリオ·ポリヴォカDPhil(2)(4) | | 61 | | 役員.取締役 |
(1)監査委員会のメンバー
(2)報酬委員会委員
(3)指名及び企業管理委員会委員
(4)科学技術委員会委員
行政員
デイビッド·ハリエット博士2024年2月から私たちの臨時最高経営責任者と取締役会のメンバーを務めてきました。これまでは、2023年2月から2024年2月まで私たちの首席科学官を務め、2020年1月から2023年2月まで私たちの首席運営官を務めていました。ハレット博士は薬物発見と連盟管理において20年以上の経験を持っている。エスダナに加入する前に、Hallett博士は2005年9月から2019年12月まで研華で化学部実行副総裁と連盟管理部執行副総裁を務めた。ハレット博士は薬物化学者で、メルク社で研究員を務めていた。ケンブリッジ大学自然科学学士号、マンチェスター大学合成有機化学博士号を持ち、テキサス大学オースティン校で合成有機化学博士後の研究に従事していた。私たちは、ハレット博士の薬物開発の経験と彼のわが社に対する理解は、彼が私たちの取締役会に就く資格があると信じている。
ベン·テイラー 私たちの最高財務·戦略官および取締役会のメンバーを務め、2020年11月にExScience aに加入します。テイラーさんは、ゴールドマン·サックス(Goldman Sachs&Co.LLC)を中心に、バイオテクノロジーとHealthTechの役員職を中心に15年間の医療投資銀行の経験を含む20年以上の経験を持っています。この期間中、Taylorさんは、バイオ製薬業界の戦略、融資、コミュニケーション、臨床開発、ビジネスの開発に専念しています。ExScience aに加入する前に、テイラーさんは、バイオ製薬の臨床開発および商業化を最適化するために実世界のデータ分析を使用して、2020年4月から2020年11月までの期間にわたって、一時的な首席財務官を務めていました。テイラー·さんは社長とティム·テクノロジー·カンパニーのチーフ財務責任者を務め、2017年4月から2020年8月までの間に、この腫瘍学の会社の運営を担当しました。テイラー·さんは商業製薬担当者で、2016年2月から2017年3月までバークレー資本会社の管理役員を務め、2006年7月から2016年2月までゴールドマン·サックスで様々な職を務めていました。彼はブラウン大学東アジア研究学士号を優秀な成績で取得した。私たちは彼の医療業界での豊富な経験が私たちの取締役会に就く資格があると信じている。
マイケル·クラームス医学博士はエスダナに入社する前、クラームス博士はジョンソンのヤンソン製薬会社に雇われ、2013年4月から2022年2月まで様々な権力が大きくなってきた職を務め、最近では定量科学のグローバル主管を務めている。クラームス博士は内科と神経学の内科医で、ミュンヘン大学の医学博士号を持っている。彼の大学院生の研究はロンドンのウェルコム認知神経病学部門で行われ、脳機能イメージングに重点を置いている
非執行役員
エリザベス·クライン2021年2月以来、私たちの取締役会に勤めており、2024年2月に取締役会長に任命されました。クレインさんはMoelis&Companyの共同創業者で、2007年から2023年10月までの間に同社の首席運営官を務め、同社のグローバル戦略、インフラと業務管理機能を担当している。クレインさんは投資銀行と私募株式業界で30年以上働いており、銀行家、依頼者、運営担当者を務めている。Moelis&Companyを創立する前、Crainさんは2001年から2007年まで瑞銀グループで働き、最近は瑞銀投資銀行オフィスで取締役社長を務め、最高経営責任者と最高経営責任者総裁を務め、瑞銀投資銀行部で高級管理職を務めている。瑞銀に加入する前に、クラインは1997年から2001年まで私募株式業界で働いていた。1988年、彼女は美林で彼女の投資銀行のキャリアを始めた。クラインさんはアリゾナ州立大学の学士号とペンシルバニア大学ウォートンビジネススクールの工商管理修士号を持っています。私たちはクレインさんの金融と業務発展の経験が彼女が私たちの取締役会に就く資格があると信じている。
ロバート·ゲンチェフ2020年5月以来私たちの取締役会に勤めており、現在はNovo Holdings A/Sの完全子会社Novo Holdings US,Inc.の管理パートナーを務め、その成長投資プラットフォームをリードしている。2018年1月にNovo Holdingsに加入する前に、GhenchevさんはロンドンのMoelis&Companyに雇われ、そこで彼は医療業界の合併と買収に専念した。ゲンチェフはオックスフォードバイオ医療会社や複数の民間会社の取締役会にも勤めています。ゲンチェフ·さんは、マギル大学で経済学と金融学の学士号、理学修士号を取得しています。オックスフォード大学金融経済学を専攻しています。我々は、根チェフさんは金融·ビジネス開発分野の経験から彼が我々の取締役会に在籍する資格を持っていると信じている。
Franziska Michor博士2023年5月から私たちの取締役会に勤めています。ミシェル博士はダナ-ファーバー癌研究所ヒト癌遺伝学のチャールズ·A·ダナ教授、ハーバード大学計算生物学、幹細胞と再生生物学教授である。ミシェル博士はオーストリアのウィーン大学で数学と分子生物学の学部研修を受け、ハーバード大学の組織と進化生物学系で博士号を取得した。その後、彼女はハーバード大学研究員協会の奨学金を得た。2007年から2010年まで、彼女はスローン·キャトリン癌センター計算生物学プロジェクトを記念するアシスタント教授だった。ミシェル博士はダナ·ファーバー癌研究所がん進化センターの取締役研究員です。彼女は進化論学会Theodsius Dobzhansky賞,Alice Hamilton賞,ヴェルチェック生物医学科学賞,第36回AACR癌研究傑出成就賞などを受賞した。Michor博士の実験室は癌の発生、発展、治療反応と薬剤耐性の出現の進化動力学を研究した。Michor博士の腫瘍学と計算生物学の専門知識は彼女が私たちの取締役会に就く資格があると信じています
マリオ·ポリヴォカディフィル2017年9月から私たちの取締役会のメンバーを務めてきました。Polywka博士は2024年1月からEvotec SEの臨時CEOを務めている。Polywka博士は2018年に退職するまでEvotec SEの首席運営官で、2019年6月からEvotec SEの監督会メンバーとなっています。ポリウォッカ博士は現在C 4 x Discovery Holdings plc,Blacksmith Medicines Inc.(2022年にForge治療会社と合併)とOrbit Discovery Limitedの取締役会に在籍している。Polywka博士は2015年から2016年までの間にNanotether Discovery Services Limited取締役会のメンバーを務め、2003年から2018年までの間にPharminox Ltd.の取締役を務め、2004年から2010年までの間にGandform Ltd.取締役会のメンバーを務めた。Polywka博士は1991年にオックスフォード非対称国際(OAI)の創始化学者となり、1993年に取締役化学会社のメンバーとなり、1996年に取締役会のメンバーとなった。1999年、OAI plcのCEOに任命され、2000年にCEOに任命された。1989年から1991年まで、彼はオックスフォードキラル有限会社で高級化学者を務め、牛津キラル有限会社はOAIの前身である。Polywka博士はSteve Davies教授の指導の下でオックスフォード大学の機械金属有機化学博士号を取得し,オックスフォード大学でJack Baldwin教授の指導の下でペニシリン生合成の博士後研究を続けている。ポリヴォーカ博士はイギリス王立化学学会の会員です。Polywka博士は生物製薬と生命科学業界の成長、運営、業務発展の豊富な経験を管理し、彼が私たちの取締役会のメンバーになる資格があると信じている。
取締役会多元化行列(2024年3月21日現在)
| | | | | | | | | | | | | | |
| 主な執行機関がある国·地域: | イギリス.イギリス |
| 外国の個人発行業者: | はい、そうです |
| 母国の法律は開示を禁止している: | 違います。 |
| 取締役総数: | 6 |
| | | | |
| 第1部:性別同意 |
| 女性は | 男性 | 非バイナリ | 性別は明かさなかった |
| 役員.取締役 | 2 | 4 | 0 | 0 |
| | | | |
| 第2部:人口統計的背景 |
| 母国管内に在任人数が足りない個人 | 0 |
| LGBTQ+ | 0 |
| 人口統計の背景は明らかにされていない | 6 |
家庭手配と選抜手配
私たちのどんな役員や役員の間にも家族関係はありません。
B.補償
行政員および役員の報酬
2023年12月31日までに、取締役会メンバーおよび行政職に支払われるすべてのポストサービスの報酬総額は、退職や類似福祉(株式ベースの奨励は含まれていない)を含む1,075,063 GBである。この総額では、161,705 GBは、我々の取締役会の非実行メンバーに支払うために使用されます。2023年、私たちの最高報酬は、私たちの元最高経営責任者アンドリュー·ホプキンス博士で、彼は私たちに提供してくれたすべてのサービスのために435,874 GBの報酬(株式ベースの報酬は含まれていません)を獲得しました
私たちは特定の役員のサービス契約条項(または私たちの適宜の年間ボーナススケジュールに基づいて)に基づいて、彼らと業績に基づくボーナススケジュールを維持します。上記の報酬額には、当社取締役会メンバーおよび当社執行役員に支払われた2023年12月31日現在の配当額(GB 94,665)が含まれています。私たちは、2023年12月31日までの年度内に、取締役または役員に年金、退職または同様の福祉を提供するためにいかなる金額も予約または累積していませんが、上記の総報酬数字に含まれている総額2,642 GBの固定拠出年金を取締役または役員を代表して支払いました。
私たちの元最高経営責任者と2023年度に取締役会のメンバーを務めた他の個人は、2023年12月31日までの年間で、以下の計算または支払うべき報酬を得ました
| | | | | | | | | | | | | | | | | | | | | | | |
| 賃金.賃金 | 優位性 | 退職金(401(K)) | 固定報酬総額 | 年間ボーナス | 株式ベースのご褒美(1) | 総報酬 |
| £ | £ | £ | £ | £ | £ | £ |
| 執行役員 |
アンドリュー·ホプキンス(2) | 433,260 | | 1,293 | | 1,321 | | 435,874 | | — | | 4,093,411 | | 4,529,285 | |
ベン·テイラー(3) | 323,640 | | 1,376 | | 1,321 | | 326,337 | | 94,665 | | 1,494,486 | | 1,915,488 | |
| 非執行役員 |
| エリザベス·クライン | 56,482 | | — | | — | | 56,482 | | — | | 225,543 | | 282,025 | |
ロバート·ゲンチェフ(4) | — | | — | | — | | — | | — | | — | | — | |
フランジスカ·ミッシェル(5) | 33,869 | | — | | — | | 33,869 | | — | | 144,986 | | 178,855 | |
デヴィッド·ニコルソン(6) | 79,581 | | — | | — | | 79,581 | | — | | 147,819 | | 227,400 | |
| マリオ·ポリヴァカ | 48,255 | | — | | — | | 48,255 | | — | | 153,434 | | 201,689 | |
(1)国際財務報告基準第2号“株式支払制”で定められた総合損益表に記録されている期間の費用。本文書の他の部分に掲載されている審査財務諸表付記30を参照して、著者らが各奨励の公正価値を決定する際に行った仮定を討論する。
(2)アンドリュー·ホプキンスは2024年2月13日まで私たちの最高経営責任者を務めてきた。ホプキンス博士は2023年の年間業績マイルストーンの実現に関する業績ベースの現金ボーナスを受け取ることはないだろう。2023年にホプキンス博士に授与されたすべての株式ベースの報酬(および他のすべての株ベースの報酬)は、2024年2月に没収された。役員の幹部として、ホプキンスは報酬を受けなかった。
(3)ベン·テイラーは私たちの最高財務責任者で戦略官です。金額には、Taylorさんが改正·重述した雇用契約に基づき、2023年の業績マイルストーン(2024年に支払う)を達成するために、Taylorさんに支給されるパフォーマンス別の現金配当が含まれています。テイラーは基本給率で表される目標ボーナスを獲得し、2023年度にテイラーのボーナス割合は45%だった。取締役会は、2023年に、表の“年間ボーナス”の欄に示すように、Taylorさん120,224ドル(業績水準を目標の65%に反映)を付与することを決定しました。彼が役員として提供しているサービスは報酬を得ていません。
(4)Robert GhenchevはNovo Holdings A/Sが私たちの第1シリーズの株主合意に従って私たちの取締役会に指名され、Novo Holdings A/Sが私たちの取締役会に個人を任命する権利を付与した。根チェフは董事非執行役員の報酬を放棄することを選択した
(5)フランジスカ·ミシェルは2023年5月1日に取締役社長に任命された。
(6)David·ニコルソンは2024年2月12日に私たちの取締役会を辞めた。
行政総裁の採用手配と役員サービス協定
私たち幹部一人当たりの給与には、基本賃金、年間業績ボーナス、個人福祉(医療·保険、移転、移民、税務面の援助を含む)年金または401(K)計画および持分インセンティブが含まれている。これらの持分インセンティブはいくつかのレガシー計画に参加することを含み、2021年の生態工業団地への参加を含むだろう
執行役員雇用協定
デヴィッド·ハレット
アイスガAI株式会社とDavid·ハレットは、2021年10月の初公募株(IPO)について、彼の雇用条項を管轄する改正·再記述された雇用協定を締結したDavid博士の本協定とその後の給与委員会の審査によると、2024年、賀立博士は375,000 GBの年間基本給総額と60,000 GBの臨時最高経営責任者手当を得る権利があり、年間業績ボーナスを得る資格があり、目標金額はその年間基本給の45%であり、私たちの取締役会またはその給与委員会によって決定される。
ハリエット博士の雇用終了に必要な通知期間は六ヶ月だった。このほかにも、ハレット博士に何らかの解散費福祉を提供しているが、クレームを効果的に解除し、ある契約終了後の義務を遵守し、私たちのすべての職を辞任することが条件である。Hallett博士の合意によると、ExScience a AI Limitedが理由なく雇用関係を終了した場合、または正当な理由があって辞任した場合(両者とも雇用合意の定義に基づいて)、以下の形式の解散費福祉を得る資格がある:(I)基本給の継続支払いと最大12ヶ月の医療保険料の支払い(サービスを提供する必要のない通知期間をHallett博士に支払う任意の基本給を差し引く)、(Ii)は、発生した年度の年間ボーナスを比例的に計算する(雇用終了日を計算する、または、より早い場合、(Iii)契約終了直前の年度のいずれかが稼いだが支払われていない年間配当に等しい現金支払いであり、(Iv)は、支払われていないすべての持分報酬の付与が加速されるので、帰属については、その雇用関係が終了した日に比例して帰属したとみなされる(または遅く、その雇用関係が終了した日であれば、通知期間の代わりにその雇用関係が終了した日である)。支配権変更前の3ヶ月以内または支配権変更後12ヶ月以内にこのような理由なく退職した解雇が発生した場合、Hallett博士は、以下の形式の解散費給付を受ける資格がある:(I)基本給の継続と、最大12ヶ月の健康保険料の支払い(サービスを提供する必要のない通知期間についてHallett博士に支払う任意の基本給を差し引く)、(Ii)は、発生当時の目標ボーナスの1倍の支払いを終了することに相当する。(Iii)一度の現金支払いであって、金額は、年度発生前年の直前に稼いだが支払われていない年間ボーナスに相当し、(Iv)は、支払われていないすべての持分報酬の付与を加速する。
私たちはハレット博士と取締役招聘書に署名し、ExScience a plcの役員役員に任命した。ハレット博士は役員役員を務めたことで何の追加報酬も得ません。
ベン·テイラー
ExScience a AI LimitedとBen Taylorは、2021年10月の初公募株(IPO)について、彼の雇用条項を管轄する改正され再説明された雇用契約を締結した。本合意およびそれに続く報酬委員会の検討によれば、2024年に、Taylorさんは、年間基本給総額340,000ポンドを享受する権利があり、年間業績ボーナスを得る資格があり、目標金額は、その年度基本給の45%であり、当社取締役会またはその報酬委員会によって決定される。
タイラーさんの雇用終了に要する通知期間は6か月である。それに加えて、プロトコルは、テイラー·さんに、いくつかの契約終了後の義務を遵守し、当社のすべてのポストを辞任するというクレームを効果的に解除することを条件として、いくつかの解散費用福利厚生を提供します。Taylorさんの合意によれば、ExScience a AI Limitedが理由なく雇用関係や彼の正当な理由のある辞任を終了した場合(どちらも雇用合意の定義によると)、次のような形の解散料を得る資格がある:(1)基本給の支払いと最大12カ月の医療保険料の支払い(サービスを提供する必要のない通知期間のTaylorさんに支払われた基本給を差し引く)、(2)解雇された当年の年間ボーナスの割合計算(彼が雇用を終了した日、または、それ以上の場合、(Iii)契約終了直前の年度のいずれかが稼いだが支払われていない年間配当に等しい現金支払いであり、(Iv)は、支払われていないすべての持分報酬の付与が加速されるので、帰属については、その雇用関係が終了した日に比例して帰属したとみなされる(または遅く、その雇用関係が終了した日であれば、通知期間の代わりにその雇用関係が終了した日である)。このような理由なく解雇または辞任があった場合、テイラーさんは、支配権変更前の3ヶ月以内または支配権変更後12ヶ月以内に理由なく解雇が発生した場合、次のような形で解散料の給付を受ける資格がある:(1)基本賃金の支払いと、最大12ヶ月の健康保険料の支払い(サービス提供の必要がない通知期間についてテイラーさんに支払われる基本給を差し引く)、(2)発生した目標ボーナスの1倍の支払いを終了する資格がある。(Iii)一度の現金支払いであって、金額は、年度発生前年の直前に稼いだが支払われていない年間ボーナスに相当し、(Iv)は、支払われていないすべての持分報酬の付与を加速する
テイラー·さんとも取締役招聘状を締結しましたが、その内容は、ExScience a plcの取締役執行役員に任命されたことについてです。テイラーは役員役員を務めたことで何の追加報酬も得られないだろう。
アンドリュー·ホプキンス
アイスガAI株式会社は、私たちの元最高経営責任者アンドリュー·ホプキンス博士と、私たちの初公募株について、彼の採用と退職条項を管轄する改訂と再記述された雇用協定を締結しました。協定条項によると、ホプキンス博士は依然としてある守秘義務を遵守しなければならず、時間制限を受けず、及びいくつかの契約終了後の制限を受けず、非募集、競業禁止と非誘因制限を含む。ホプキンス博士と彼がエクスタ社の役員に任命されたことについて、取締役招聘書に署名した。ホプキンス博士は彼の役員役員に関する追加補償を受けなかったし、解雇されたことでホプキンス博士に何の金も支払わなかった
董事非執行役員招聘状
非執行役員はその職責と責任を明らかにする委任書に任命された。非執行役員はそれぞれの役員職を終了または辞任するときは何の利益も得られません。取締役非執行役員委任書簡によると、我々の非執行役員は、以下に述べる董事非執行役員報酬政策に基づいて年会費を受け取る権利があり、いずれの場合も、年会費にはすべての職責の支払費用が含まれている
非執行役員報酬政策
2021年8月、私たちの取締役会は、報酬コンサルタントの提案に基づき、非執行役員報酬政策を採択しました
現金補償
この政策によると、私たちは、取締役会や取締役会委員会でのサービスのために、各非執行役員に現金事前招聘金を支払います。この政策によると、下記年度の現金補償額は、予想資格取締役を四半期平均分割払いで支払い、サービス発生毎の財政四半期の最終日に借金を支払う
条件を満たした取締役が我々の取締役会又は取締役会委員会に加入する時間が財政四半期の初日に発効しない場合は、以下に掲げる各年度の求人料は、適用財政年度のサービス日数に応じて比例して割り当てられ、条件を満たす取締役がサービスを提供する第1の財政四半期の金額を比例的に支払い、その後定期的に四半期費用を全額支払う
すべての年間手付金は支払い後に付与されます。彼らの選挙では、イギリスに住む合格役員は、支払い時にドルからポンドに変換する適用額を得る
役員は現金報酬を得る資格があり、具体的には以下の通り
•年間取締役会在任者:
•すべての合格役員:50,000ドル
•取締役会独立議長サービス招聘費(条件を満たす取締役サービス採用費を除く):40,000ドル
•年度委員会議長サービス招聘費(年度委員会メンバーサービス招聘費を除く):
•監査委員会議長:2万ドル
•報酬委員会議長:15,000ドル
•科学技術委員会議長:1.5万ドル
•指名·統治委員会議長:1万ドル
持分補償
本政策によって付与されたすべての株式オプションは、付与日の対象株式の公正時価の100%に等しい非法定株式オプションとなり、期限は、付与日から10年であるが、サービス終了により早期に終了する(この用語は、2021年EIPで定義される)
最初の贈与
初めて当選したか、または当社の取締役会メンバーに任命された合資格取締役は、その初めて選ばれたまたは任命された資格取締役メンバーに任命された日(またはその日が市場取引日でなければ、その後の最初の市場取引日)に約500,000ドルの普通株式の株式奨励を自動的に授与し、当社の取締役会または取締役会報酬委員会がさらに行動する必要はなく、資格取締役がより大きな割合の株式購入または予備付与を要求しない限り、さらに行動する。各初期に付与された株式は、オプションまたは制限株式が授出日の3周年に完全に帰属するために、3年以内に月均等に分割され、資格を有する取締役が、各そのような帰属日の前にサービスプロバイダであり続けることが前提である(この用語は、2021年の企業資源計画において定義される)。
年度奨学金
当社の各株主総会の営業時間が終了すると、この時点で当社の取締役会の非従業員メンバーを継続している合資格取締役は、当社の取締役会または当社の取締役会報酬委員会がさらに行動する必要がなく、資格取締役がより大きな割合の株式購入または年間贈与を要求されない限り、約250,000ドルの普通株式の持分奨励を自動的に受けることができる。年次授出規限を受けた株式は(I)授出日1周年及び(Ii)当社の次の株主周年総会日前日(早い者を基準とする)に帰属し、唯合資格取締役は帰属日が満了する前に引き続きサービス提供者としなければならない(定義は2021年企業年鑑参照)
帰属.帰属
すべての帰属は、条件を満たす取締役が、各適用される帰属日においてサービス提供者(この用語は、2021年の生態工業団地で定義される)として継続することを基準とする
費用.費用
取締役会や委員会会議への出席に関する合理的な自己負担費用も精算します。
傑出株式賞
次の表は、2023年12月31日現在、2023年12月31日までに私たちの役員と取締役を務めている個人に対する未償還持分奨励を示しています。
| | | | | | | | | | | | | | | | | |
| 名前.名前 | 普通株式基礎オプション賞 | 普通株式基礎RSU賞 | 行権価格 | 授与日 | 期日まで |
| 行政員 | | | | |
デイビッド·ハレット博士(2)(4)(8)(9)(11)(14) | 375,000 | | £ | 0.0299 | | 2020年5月22日 | 2030年5月21日 |
| 120,000 | | £ | 0.0452 | | 2021年4月3日 | 2031年4月2日 |
| 73,142 | | £ | 0.0005 | | 2022年4月1日 | 2032年3月31日 |
| 146,284 | | £ | 0.0005 | | 2022年4月1日 | 2032年3月31日 |
| 104,167 | | £ | 0.0005 | | 2023年4月3日 | 2033年4月2日 |
| 156,250 | | £ | 0.0005 | | 2023年4月3日 | 2033年4月2日 |
アンドリュー·ホプキンスDPhil(2)(8)(9)(11)(14) | 750,000 | | £ | 0.0452 | | 2021年4月3日 | 2031年4月2日 |
| 146,284 | | £ | 0.0005 | | 2022年4月1日 | 2032年3月31日 |
| 585,136 | | £ | 0.0005 | | 2022年4月1日 | 2032年3月31日 |
| 285,577 | | £ | 0.0005 | | 2023年4月3日 | 2033年4月2日 |
| 869,712 | | £ | 0.0005 | | 2023年4月3日 | 2033年4月2日 |
ベン·テイラー(1)(2)(3)(8)(9)(11)(13)(14) | 375,000 | | $ | 0.03 | | 2020年11月27日 | 2030年11月26日 |
| 120,000 | | $ | 0.05 | | 2021年4月3日 | 2031年4月2日 |
| 105,000 | | $ | 0.10 | | 2021年7月1日 | 2031年7月1日 |
| | 41,142 | £ | — | | 2022年4月1日 | 2032年3月31日 |
| | 146,284 | £ | — | | 2022年4月1日 | 2032年3月31日 |
| | 198,317 | £ | — | | 2023年4月3日 | 2033年4月2日 |
| | 7,487 | £ | — | | 2023年4月3日 | 2033年4月2日 |
| | 107,423 | £ | — | | 2023年4月3日 | 2033年4月2日 |
マイケル·クラームス医学博士です(10)(11)(14)(15) | | 86,805 | £ | — | | 2022年5月18日 | 2032年5月17日 |
| | 144,231 | £ | — | | 2023年4月3日 | 2033年4月2日 |
| | 11,207 | £ | — | | 2023年4月3日 | 2033年4月2日 |
| | 78,124 | £ | — | | 2023年4月3日 | 2033年4月2日 |
| | | | | |
非執行役員 | | | | | |
エリザベス·クライン(7)(11) (17) | 9,398 | | $ | 9.80 | | 2022年5月18日 | 2032年5月17日 |
| 19,778 | | $ | 5.67 | | 2023年5月17日 | 2033年5月16日 |
| | 19,778 | £ | — | | 2023年5月17日 | 2033年5月16日 |
| | 24,900 | £ | — | | 2021年7月1日 | 2028年7月1日 |
デヴィッド·ニコルソン博士です(7)(12) | 9,398 | | $ | 9.80 | | 2022年5月18日 | 2032年5月17日 |
| 19,778 | | $ | 5.67 | | 2023年5月17日 | 2033年5月16日 |
| | 19,778 | £ | — | | 2023年5月17日 | 2033年5月16日 |
ロバート·ゲンチェフ | — | — | — | | |
マリオ·ポリヴォカDPhil(5)(6)(7)(12) | 3,900 | | $ | 0.02 | | 2019年10月18日 | 2029年10月17日 |
| 75,000 | | | $ | 0.03 | | 2020年6月15日 | 2030年6月14日 |
| 9,398 | | $ | 9.80 | | 2022年5月18日 | 2032年5月17日 |
| 19,778 | | $ | 5.67 | | 2023年5月17日 | 2033年5月16日 |
| | 19,778 | £ | — | | 2023年5月17日 | 2033年5月16日 |
フランセカ·Michor博士(16) | 39,683 | | $ | 5.09 | | 2023年5月3日 | 2033年5月2日 |
| | 33,069 | £ | — | | 2023年5月3日 | 2033年5月2日 |
(1)2021年7月1日に付与された奨励は、奨励開始日から4年以内に授与される。2021年7月1日に付与された株式の25%は帰属開始日の1周年に帰属し、残りの株式はその後四半期分割で帰属するが、上級者が各帰属日まで継続的にサービスすることに制限されなければならない
(2)2021年4月3日に付与されたオプションは,付与開始日から4年以内に付与される。2021年4月3日に付与された株式の25%は帰属開始日の1周年に帰属し、残りの株式はその後四半期分割で帰属するが、上級者が各帰属日に継続的にサービスすることに制限される必要がある
(3)2020年11月27日に付与されたオプションは,付与された日から4年以内に付与される。2020年11月27日に奨励された株式の25%は、雇用開始日の1周年とその後の各周年に帰属するが、各帰属日における担当者の継続サービスに依存する
(4)2020年5月22日にDavid·ハレットに付与されたオプション期間は4年。2020年5月22日に奨励された株式の25%は付与された日に帰属し、残りの株式は雇用開始日の1周年とその後の毎年1周年に帰属するが、各帰属日における当該人員の継続サービスに制限されなければならない
(5)2020年6月15日にMario Polywkaに付与されたオプションは3年以内に授与される。2020年6月15日に奨励された37.5%の株式は2021年5月22日に帰属し、37.5%の株式は翌年5月22日に帰属し、最終的な25.0%は2023年5月22日に帰属するが、各帰属日における個人の継続的なサービスに依存する
(6)2019年10月18日にMario Polywkaに付与されたオプションは3年以内に付与されます。2019年10月18日に奨励された株式の3分の1は2020年5月28日に帰属し、残りの株式はその後、2022年5月28日まで毎年均等分割払いで帰属するが、個人は各帰属日にサービスを継続しなければならない。
(7)2022年5月18日に付与された奨励は、授与1周年または次年度株主総会の前(早い者を基準とする)、その帰属日前の個人の継続サービスを基準とする。
(8)2022年4月1日に付与された時間ベースの奨励は、第1回のこのような分割払いは2022年6月15日に帰属するが、各帰属日における個人の継続的なサービスに依存するが、四半期ごとにオプション制約された株式総数の1/16に帰属する。
(9)オプションは3年以内に付与されますが、時間と業績条件は以下の通りです
a.第1弾(株式の50%):25%の株式は2023年4月1日に帰属し、25.0%の株式は2024年4月1日に帰属し、50%の株式は2025年4月1日に帰属し、所有者の帰属日ごとの継続的なサービスに依存し、適用される平均株価表現目標が達成された範囲内である。
b.第2弾(奨励株式の25%):2025年4月1日に帰属する全株式は、その日までの保有者の継続的なサービス、および適用される総株主リターン目標を達成する範囲に依存する。
c.一群の人3(奨励株式の25%):2025年4月1日を時間として帰属するすべての株式は、その日までの保有者の継続的なサービスに依存し、適用される総株主リターン目標を達成する範囲内である。
(10)2022年5月18日に付与された奨励は、奨励開始日から4年以内に授与される。奨励された株式の25%は、雇われた周年記念日後の最初の予定された帰属日に帰属し、残りの株式はその後四半期分割で帰属するが、その上級者が各帰属日まで継続的にサービスする必要がある。
(11)2023年4月3日に付与された時間ベースの報酬は、第1回のこのような分割払いは2023年6月15日に帰属するが、各帰属日における個人の継続的なサービスに依存するが、四半期毎にオプション制約された株式総数の1/16に帰属する。
(12)2023年5月17日に付与された奨励は、授与1周年または次の年度株主総会の前(早い者を基準とする)、その帰属日前の個人の継続サービスを基準とする。
(13)2023年4月3日に付与された7,487個のRSUは、すべての従業員に提供される計画に参加しているためであり、この計画によれば、各従業員は、現金ではなくRSUの形態で年間ボーナスの全部または一部を得ることを選択することができる。これらのRSUは、2024年4月15日に付与されるが、そのホーム日前の個人の継続的なサービスに依存する。
(14)2023年4月3日に付与された業績株は、奨励3周年の時に授与されるが、以下の業績条件を満たす必要がある
a.第1部(奨励株式の50%):適用される総株主リターン目標を達成した範囲内である。
b.第2弾(奨励株式の50%):同業グループ-適用される総株主リターン目標を達成した範囲内。
(15)2023年4月3日にマイケル·クラムに付与された11,207個のRSUが2024年4月15日に授与されたが、個人はこのホーム日にサービスを継続した。
(16)Franziska Michorに2023年5月3日に付与されたオプションおよびRSUは、2026年5月3日までの3年間に四半期ごとに付与されるが、各ホーム日前の個人の継続的なサービスに依存する
(17)2021年7月1日に付与されたRSUは3年以内に3年間折半され、最初の帰属日は2022年2月8日であり、最後の日付は2024年2月8日である。
私たちの株式インセンティブ計画の主な特徴は以下のように概要される。これらの要約全文は計画の実テキストを参照して限定されており,いずれも本年度報告の証拠品としてアーカイブされている.
持分激励計画
私たちは、(1)改正された2019年会社株式オプション計画、または2019年CSOP、(2)改訂された2018年未承認株式オプション計画、または2018年USOP、(3)2018年USOPのRSUサブ計画、および(4)2016年企業管理インセンティブ計画、または2016 EMI計画、に基づいてオプションおよび持分インセンティブ奨励金を付与している。2021年株式インセンティブ計画または2021年EIPを通過した後、これらの計画または遺産計画に基づいてさらなるオプションまたは奨励が付与されることはない。私たちはまた2021年の生態工業団地プロジェクトの下でオプションと株式奨励金を授与した。
私たちの株式インセンティブ計画の主な特徴は以下のように概要される。これらの要約の全内容は,計画を適用した実際のテキストに基づいており,このテキストは本年度報告に属する登録宣言の証拠品としてアーカイブされている.
2021年株式インセンティブ計画
2021年EIPは最初に私たちの取締役会によって2021年8月11日に採択され、私たちの従業員および取締役に株式に基づくインセンティブ奨励を付与することが許可され、私たち従業員の取締役でもあります。2021年の生態工業団地の具体的な条項の概要は以下のとおりである。
資格と管理私たちの従業員、執行役員、子会社従業員は2021年のEIP奨励を受ける資格があります。私どものコンサルタント、非執行役員、わが子会社のコンサルタントは、以下に述べる2021年企業投資促進計画非従業員サブ計画の下での奨励を受ける資格があります。私たちのイギリス人従業員が、わが社に大きな利益がない(私たちの普通株式の実益所有権でもなく、30%を超える普通株式を直接または間接的に制御できるわけでもない)ことを含む、会社株式オプション計画(CSOP)制度下の基準に適合すれば、CSOPサブ計画に従って以下に述べる2021 EIPのオプションを付与することができる。CSOP制度下の基準を満たし続ける場合にのみ、CSOPオプションを付与することができる。2021年の企業投資促進計画(非従業員サブ計画およびCSOPサブ計画を含む)で報酬を受ける資格を有する者を以下、総称してサービス提供者と呼ぶ。
別の説明がない限り、以下に言及する2021年の企業内投資計画には、非員工サブ計画とCSOPサブ計画が含まれる。
2021年に生態工業団地は我々の取締役会によって管理され、取締役会は、その職責を私たちの役員および/または上級管理者からなる1つまたは複数の委員会(以下、行政長官計画と呼ぶ)に許可することができるが、2021年に生態工業団地および他の適用法およびナスダック規則によって適用されるいくつかの制限を受けなければならない。計画署長は2021年の生態工業団地に基づいてすべての行動とすべての決定を行い、2021年の生態工業団地と奨励協定を解釈し、それが適切と考えられる場合に2021年の生態工業団地管理規則を採択、改正、廃止する権利がある。2021年のEIPの条件と制限に基づいて、計画管理者は、任意の帰属および帰属加速条項を含む、どの条件に適合するサービスプロバイダが報酬を獲得し、報酬を付与し、2021年のEIP下のすべての報酬の条項および条件を設定する権利があるかを決定する権利がある。
報酬に使える株。私たちの2021年EIP予約に基づいて発行され、2021年9月15日に株主承認を得た普通株式または株式備蓄の最高数は、10,479,300株普通株式である(遺産計画に従って取得可能ないかなる普通株も含まれておらず、以下に述べる)。奨励的株式オプション(ISO規制)を行使する際には、2021 EIPにより発行された普通株は20,126,700株を超えてはならない。また、我々の2021年EIP予約発行に供する普通株数は毎年1月1日に自動的に増加し、2022年1月1日から2031年1月1日(2031年1月1日を含む)まで終了し、金額は前年12月31日に発行された普通株総数の5%に相当し、普通株当たり年に1回増加する。我々の取締役会は、ある年の1月1日までに、その年度が増加しないか、またはその年度の増加が少ない(ただし、それ以上ではない)数の普通株であることを規定する行動をとることができる。2021年にEIPによって発行される普通株は、新株、公開市場で購入した株または在庫株とすることができる。
2021年の企業投資促進計画下の奨励期限の満了、失効または終了、現金の交換、引き渡し、買い戻し、キャンセルが十分に行使または没収されていない場合、奨励制限された任意の未使用株式は、適用状況に応じて、2021年の企業投資促進計画下での新たな付与または回収に使用可能になる。
有効日前に既存の計画に基づいて授与された株式購入権の満期、失効または終了、現金の交換、回収、解約、有効日の当日または後に全面的に行使または没収しなければならない場合、この購入株式規約の制限を受けた任意の未使用株式は2021年の創業投資協定の下で新たに授与することができ、株式備蓄に加入するか、または回収しなければならず、最大9,647,400株の普通株に達することができる。2023年12月31日現在、株式備蓄は22,660,786株(すなわち、上記の株式備蓄に長栄年度増資を加えた)に循環後に使用可能な2,923,464株である
次の表は、2023年12月31日現在の履歴従業員株式計画使用状況の内訳を示している
| | | | | | | | |
| レガシー計画 | 2021年弾性パブリックネットワークIP |
| 発表されました | 13,837,200 | | 11,308,239 | |
| | |
| キャンセル/期限が切れた(返却済みプール) | 1,693,200 | | 1,230,264 | |
| 行使·解放 | 7,425,225 | | 1,881,070 | |
| 許可されています | 3,643,875 | | 1,212,184 | |
| 未完済-未帰属 | 1,074,900 | | 6,984,721 | |
合計する | 13,837,200 | | 11,308,239 | |
“2021年企業インセンティブ計画”によって付与された奨励によれば、エンティティが我々と合併または合併またはそのエンティティの財産または株式を買収する前に付与された任意のオプションまたは他の持分または持分ベースの奨励の代わりに、2021年の企業インセンティブ計画に従って付与可能な普通株式数を減少させることはないが、インセンティブ株式オプションを行使する際に発行可能な普通株式の最大数に計上される。
CSOPサブ計画によって付与されたオプションはCSOP制度によって時々規定される個別と全体的な制限を受ける。
本要約では、普通株式への言及は、同等の数の我々の米国預託証明書を含む。
賞.賞
2021年のEIP規定付与オプション(ローカル法律に依存する場合がある)、株式付加価値権(時価であってもよく、現地法に依存する場合もある)、またはSARS、制限株式、制限株式単位またはRSU、および他の株式ベースの報酬。2021年の企業投資促進計画下のすべての奨励は、奨励協定に記載され、適用される任意の帰属および支払い条項、制御権変更条項、および終了後の行使制限を含む報酬の条項および条件が詳細に説明される。以下に各報酬タイプの簡単な説明を示す.
オプションと非典オプション規定では、将来的には付与日普通株式額面(米国で納税した参加者またはCSOPサブ計画に従って付与されたオプションの市場価値)を下回らない使用価格で私たちの普通株を購入する。SARSはその所有者に権力を行使させた後,付与日から行使日までの間に吾等から奨励された株式増価に相当する金額を得る権利がある。計画管理人は、各オプションおよび特区がカバーする株式数を決定し、各オプションおよび特区を行使するための条件および制限を適用する。オプションはCSOPサブプログラムの下でのみ付与されることができる。
制限株とRSU制限株は普通株を譲渡できないことへの報酬である特定の条件が満たされるまで、没収可能性が維持され、購入価格を基準とすることができる。RSUは、特定の条件が満たされない限り、これらの普通株も没収される可能性がある未来に私たちの普通株を交付する契約約束である。計画管理人は,強制的にまたは参加者が選択した場合には,RSUに関連する株式の交付を延期することができる.制限株とRSUに適用される条項と条件は計画管理者によって決定され,2021年のEIPに含まれる条件と制限の制限を受ける.
他の株式ベースの奨励株式ベースの他の報酬は、普通株式に完全に帰属する報酬であり、我々の普通株式または他の財産に基づいて全体または部分的に推定される他の報酬を参照または他の方法で行うことである。他の株式ベースの報酬は、参加者に付与することができ、他の奨励決済時の支払形態として、独立支払及び参加者が他の方法で獲得する権利のある代替補償の支払いとしてもよい。計画管理人は、任意の買収価格、業績目標、譲渡制限、および帰属条件を含む可能性がある他の株式ベースの報酬の条項および条件を決定する。
業績基準です。 計画管理人は任意の報酬に業績目標を適宜設定することができる。
いくつかの取引我々の普通株式に影響を与えるいくつかの会社取引およびイベントについては、制御権変更、別の類似した会社取引またはイベントを含み、計画管理者は、2021年のEIPに基づいて行動することができる広範な自由裁量権を有する。これには、現金または財産への奨励の廃止、奨励の帰属の加速、相続人エンティティによる負担または代替奨励の規定、未完了報酬の株式数およびタイプの調整、および/または2021年の企業投資計画に従って奨励を付与することができる株式の数およびタイプ、および2021年の企業投資計画の下での奨励を置換または終了することができる。また、ある株式再構成取引が発生した場合、計画管理人は、2021年のEIPおよび未償還奨励下の限度額を適切と思われる方法に基づいて公平に調整して、取引を反映する。このような取引に関するCSOPオプションの処理はCSOP制度の要求に依存する.
図は改訂と終了です. 私たちの取締役会は、2021年のEIPを随時修正または終了することができます。しかし、2021年のEIPで利用可能な株式数を増加させる修正案を除いて、どの修正案も、参加者の同意に影響を受けることなく、2021年のEIP下の係属中の裁決に実質的かつ不利な影響を与えることはなく、どの修正も法律に適合するために必要な範囲で株主の承認を得ることになります。私たちの取締役会が早期に終了しない限り、2021年EIPはその発効日10周年まで有効になるだろう。2021年のEIP終了後、その下でいかなる賞も授与してはなりません。
譲渡可能性と参加者の支払い。 計画管理者が奨励協定において決定または規定することができない限り、2021年のEIP下の報酬は、2021年のEIPの定義に基づいて、参加者の指定された受益者を除外しない限り、通常譲渡されてはならない。2021年のEIP下での奨励に関する税収および/または社会保障源泉徴収義務、および2021年のEIP下のオプションの行使に関する価格義務については、計画管理人は、現金、電信為替または小切手、指定された条件を満たす私たちの普通株、本票、市場売票、計画管理人が適切と考える他の考慮要素または前述の事項の任意の組み合わせを適宜受け入れることができるが、CSOP選択権であれば、CSOP制度要求の制限を受けることができる。
アメリカやイギリスの参加者ではありません 計画管理人は、税金、証券、通貨、従業員福祉または他の事項におけるこのような国際司法管轄区域の法律、規則、法規または習慣の違いを解決するために、米国またはイギリス国民ではない、または米国およびイギリス以外で雇われた参加者に付与する報酬を修正するか、または奨励の付与を任意の司法管轄区域で提供可能な税収優遇制度に適合させることができる。
非従業員サブ計画です非従業員サブ計画管理は、私たちの非執行役員、顧問、顧問、その他の非従業員サービスプロバイダの株式奨励を与え、奨励の条項は2021年のEIP下の奨励と同じであることを規定している。
レガシー計画
2019年会社株式オプション計画
概要
2019年CSOPは2019年11月27日まで可決され、2021年4月3日に改正され、2003年の所得税(収入と年金)法案(ITEPA)付表4の要求に適合することを目指し、同計画に適合した“会社株式オプション計画”となった。2019年にCSOPが付与したオプションが潜在的なイギリス税収優遇オプションであり、最高個人限度額は30,000 GBであり、付与日権項下の株式の時価から計算される。
2019年CSOPにより付与されたオプションの発行価格が付与日株式の時価以上でなければならず、行使オプションが新たに発行された株式で満たされている場合は、行使価格は株式の額面を下回ってはならない。
参加/資格と管理. 2019年にCSOPが付与したオプションに基づいて取締役会がその絶対適宜決定権に基づいてITEPA付表4にオプションを付与する資格のある従業員を付与します。
オプションの帰属と行使。2019年にCSOPによって付与されたオプションは、時間ベースの条件を含む1つまたは複数のホームスケジュールに従って付与されてもよく、さらに、または代替的に、オプションの全部または一部を行使する前に満たされなければならない特定の履行条件に基づいて付与されてもよい。取締役会は業績条件をどの程度満たしているかを決定する権利があります。
取締役会は、オプションに付加された1つまたは複数の業績条件を変更または免除することができるが、元の業績条件を評価する期間が終了する前に行使可能なオプション、または取締役会が業績条件が適切な業績評価基準ではないと合理的に判断した場合にのみ、業績条件をこのように変更することができる。このような異なる履行条件は,オリジナルの履行条件を設定した場合よりも満たされにくくなければならず,オリジナルオプション付与日のオリジナル履行条件よりも容易に満たすことができない.
2019年CSOPにより付与されたオプションは、付与日10周年後に行使されてはならず、一般には、(1)他の人によって支配されている会社(第719 ITEPA条参照)の会社、(2)裁判所が承認した手配計画、(3)株主が非イギリス再編の制約を受けている場合、または(4)会社法第979~985条に従って制約または株式を取得する権利を有する者となる場合、または(5)適用オプション協定で指定された帰属条件に適合する者である。オプションはまた特定の参加者によって行使されることができ、このような参加者たちはこれ以上私たちに雇われていない。参照してください“雇用中止”下です。
オプションの条項には一般的に適用される。 故オプション所有者の死去時にオプションをその遺産代理人に譲渡する以外に、2019年にCSOPによって付与されたオプションは、譲渡、譲渡、または任意の担保または他の担保を生成することができない。
2019年にCSOPによって付与されたオプションは、以下の条件の中で最初に無効になります
•オプションの譲渡、譲渡または裁定を企てる(死亡時に遺産代理人に譲渡する場合は除く)
•実行条件が満たされず、オプション全体が行使できなくなった
•関連オプションプロトコルに記載されている失効日;
•オプション所有者が亡くなって一周年
•オプションが付与されていない場合、オプション所有者は会社員または取締役の翌日ではなく、保留する
•負傷、健康不良、障害、当社のいずれかの業務をグループ、退職またはリストラ(1996年“雇用権利法”が指す)に移転して雇用を終了した場合、雇用終了後6ヶ月以内に選択権を行使することができる
•私たちの取締役会は雇用終了後90日以内に決定することができ、雇用終了後の特定の期間内にオプションを行使することができる
•オプション所有者が会社に雇われなくなった90日後、オプションが付与され、雇用を終了したのは即時解雇によるものではない
•会社は別の人によって支配されている(第719 ITEPA条参照)6ヶ月後、(2)裁判所が承認した手配計画、または(3)株主が非イギリス再編の制約を受けている
•会社再編後6ヶ月以内に、再編の一部として買収側が代替選択権を提供した場合、または
•オプション所有者は破産した。
雇用関係を打ち切る。 オプションに帰属していないオプション所有者が当社に雇用されなくなった場合、そのオプション所有者が会社に雇用されなくなった翌日に失効しても行使できない
•雇用終了は、負傷、健康不良、障害、私たちの業務をグループ、退職またはリストラ(1996年の“雇用権利法”の意味に適合する)から移転するためであり、この場合、雇用停止後6ヶ月以内に選択権を行使することができる
•我々の取締役会は、雇用終了後90日以内に決定し、雇用終了後の特定の期間内に、当該オプションを行使することができる。
既存オプションを持つオプション所有者が会社に雇われなくなり、その雇用終了が即時解雇によるものではない場合、彼らは、雇用終了後90日以内に既存オプションを行使し、その後、オプションを無効にすることができる。
もしオプション所有者が即時解雇によって雇用を停止した場合、当社の取締役会が雇用終了後90日以内に決定しない限り、雇用終了後の特定の時間内に、その株式購入権は依然として行使可能であり、そうでなければ、当該株購入権は行使できない。
会社取引です(1)個人又は実体が会社の支配権を獲得した場合(第719条ITEPA参照)、(2)裁判所が手配計画を承認した場合、又は(3)株主が非イギリス再編の制約を受けている場合、オプション所有者は、関連事件が発生した日から6(6)ヶ月以内にそのオプションを全部又は一部行使する権利を有し、オプションがその期間内に行使されていない場合は、そのオプションは失効し、行使を停止する。しかしながら、予想上(1)~(3)項に記載のいずれかのイベントが完了した後、取締役会は、その絶対裁量決定権を行使して手配することができ、当該事件発生直前の20日以内に行使されていない購入権を行使することを許可することができる。オプションがこの期間内に行使されていない場合、これらのオプションは、その期限満了後すぐに失効する。
以下の場合、制御権の変更はオプションを行使する権利をトリガしない:購入者はエンティティであり、そのエンティティの最終的な実益所有権が不変のままである場合、そのエンティティはオプション所有者に代替オプションを提供する。この場合、代替オプションがオプション所有者に受け入れられない場合、彼らのオプションは制御権変更後6ヶ月で失効する。
“2019年市民社会行動計画”改正案. 取締役会は、2019年のCSOPを随時改訂することができるが、以下の場合を除く:(1)2019年のCSOPがITEPA付表4に従って資格を満たしていないことを意味する場合、このような改訂を行うことができない、(2)改訂が彼らの権利に重大な影響を与える場合、オプション保持者が事前に書面で同意しない場合、このような改訂を行うことができない、または(3)改訂が(A)既存のオプション付与を大幅に増加させる、(B)オプション制限を増加させる、または(C)2019年のCSOPに参加する資格がある従業員のカテゴリを拡大する場合、このような改訂を行うことはできない。
2018年未承認株式オプション計画
概要
2018年USOPは2018年2月13日に採択され、2019年9月25日と2021年4月1日に改正され、会社株式中の普通株式またはB株普通株(または同等数の米国預託証券)のオプションが付与されることが規定されている。
参加/資格と管理。 2018年にUSOPによって付与されたオプションは取締役会から個人に付与されます。
オプションの帰属と行使2018年にUSOPによって付与されたオプションは、オプションに関連するオプションプロトコルに含まれる帰属および行使条件の制限の下で付与することができる。
文意が別に許可があるか取締役会が別の決定がある以外は、既得オプションは任意の営業日に行使することができる。2018年にUSOPによって付与されたオプションは全部または部分的に行使可能であるが,任意の日に,既存株式の25%以上,その時点で行使可能な株式総数,および取締役会が決定可能な他の数に対してオプションを行使できることが条件である.
オプション所有者が雇われたり雇用されたりすることを停止すれば,オプションを行使する可能性もある.参照してください“雇用中止/採用”下です。
オプションの条項には一般的に適用される。 故オプション所有者の死去時にオプションを彼らの遺産代理人に譲渡する以外に、2018年にUSOPによって付与されたオプションは、担保または他の担保を譲渡、譲渡、または生成することができない。
2018年にUSOPによって付与されたオプションは、以下の条件の中で最初に無効になります
•贈与の日の十周年
•オプションの譲渡、譲渡または裁定を企てる(死亡時に遺産代理人に譲渡する場合は除く)
•オプション所有者が亡くなって一周年
•オプション所有者が不良離職者である場合(以下、定義参照)、雇用または採用を終了する日付;
•オプション保持者が良い離脱者であれば(以下のように定義される):
•雇用または採用を終了した日から90ヶ月後(または12ヶ月、良い離職理由はオプション所有者の死亡)と;
•雇用終了または採用オプションのうち終了時に行使できない部分の日付;
•支配権変更を引き起こす資産売却または株式売却完了から60日後(またはオプション所有者が完了前にそのオプションを行使する機会がある場合は、完了直後に完了する);または
•オプション所有者は破産した。
雇用·採用を中止するもしオプション所有者が私たちに雇われたり雇われたりしなければ:
•彼らは良い退場者でした
•終了時に行使可能なオプション部分は、最長で雇用終了または終了日後90ヶ月以内に行使することができる(良い離職理由がオプション所有者の死亡である場合は、12ヶ月間行使することができる)
•停止時に行使できないオプション部分は,停止日に失効しなければならない;
•彼らは悪人であり、選択権は停止の日に完全に無効になるだろう。
2018年のUSOPについては:
“良好離職者”とは、(A)負傷、健康不良または障害(取締役会が合理的に満足していることを証明する)、(B)退職、(C)1996年の雇用権利法で指摘されたリストラ、(D)死亡、の理由でオプション保持者が離職者になることを意味する。(E)当該会社又はその付属会社のうちの1つではない会社に雇用された会社、又は当該会社又はその付属会社のうちの1つに雇用された会社の雇用された仕事は、その被雇用に関連する業務又は一部の業務の売却を完了した後、当該会社又はその付属会社のメンバーではない者に移転する。又は(F)取締役会は、その絶対的裁量決定権で、当該持分所有者が良い離場者であることを宣言する。“Bad Leaver”は良い退場者ではないことを意味する。
会社取引です。ある人が会社に要約を提出し、会社の再編、資産売却、あるいは多数の株式売却を招き、支配権が変化した場合、取締役会はその絶対的な情動権を行使し、すべてのオプション所有者に書面通知を出すことができ、すべての未償還オプションは取締役会が指定した3(3)ヶ月を超えない期限内にすべて行使することができる(買収側がまだ終了していない場合は、その期限は買収側が会社の支配権を獲得する直前に終了しなければならない)。オプションがこの期間内に行使されていない場合、これらのオプションは、その期限満了後すぐに失効する。オプション所有者から通知がない場合、オプションは、会社再編、資産売却、または株式売却完了後60日以内に失効し、支配権変更を招く。
新持株会社を設立するのは、新持株会社の株式に対する等値オプションの代わりにオプションである。
2018年USOP修正案。 取締役会は、2018年のUSOPの管理を容易にするために、2018年のUSOPのわずかな修正または増加を時々行うことができ、立法の変化を考慮して、または参加者のために優遇された税金または規制待遇を獲得または維持することができる。
2018年未承認株式オプション計画のRSUサブ計画。 RSUサブ計画管理制限株式単位報酬(RSU)の条項は、これらの奨励はRSUサブ計画に基づいて2018年USOPを付与することができる。RSUは、将来的に私たちの普通株式または米国預託証明書を交付する契約約束であり、2018年のUSOPによって付与されたオプションとほぼ同じ条項を遵守します。
私たちの普通株に影響を与えるいくつかの会社の取引や事件については、統制権変更、もう一つの類似した会社取引や事件を含めて、私たちの取締役会は広範な情動権を持っており、RSUサブ計画に基づいて行動することができます。これは、現金または財産のためのRSUのキャンセル、RSUの帰属を加速し、後続のエンティティによって負担または代替されることを規定すること、RSUが発行された株式の数およびタイプを調整すること、およびRSUを交換または終了することを含む。
2016企業管理インセンティブ計画
概要
2016 EMI計画は、EMIに適合した企業管理インセンティブ計画であるITEPA付表5の要件を満たすことを目的とした2016年2月29日に採択された。
2016年のEMI計画の運用条項は2018年のUSOPと同じですが、以下のような違いがあります
参加/資格と管理。 会社とオプションの要求があるにもかかわらず,個人がITEPA付表5の従業員要求を満たしていれば,2016年EMI計画下のEMIオプションを取得する資格がある。
オプションの帰属と行使2018年USOPに対する上記の条項に加えて、取締役会は、ITEPA第533-539節の規定により、失格事件が発生した場合には、その確定した程度で行使可能なオプションを発表することができる。
会社取引です上述した2018年の株主権益計画に関する条項を除いて、会社再編には新しい持株会社を設立することが含まれているが、当該新持株会社の株主身分及び株主割合はほぼ同じであり、この新持株会社は2016年度百代買収計画の参加者に代替選択権を提供し、前記会社の再編に関する選択権を行使することはできない。
保険と賠償
“会社法”が許可されている範囲では、私たちの取締役が取締役の職務を担当するために負ったいかなる責任も賠償する権利があります。私たちは、これらの人員が何らかの責任を負うことを確実にするために、取締役と上級管理職の保険を維持し、私たちの各取締役と上級管理者と賠償契約を締結しました
当社の取締役会、行政者、又は前述の条文に基づいて吾等を統制している者が証券法に基づいて発生した責任を弁済することができる場合、米国証券取引委員会は、証券法で表現された公共政策に違反することを告知されているため、強制的に執行することはできない。
C.取締役会の慣例
当社の取締役会の構成
私たちの取締役会は6人のメンバーで構成されている。外国の個人発行者として、ナスダックの上場要求と規則によると、私たちの取締役会は独立取締役が必要であることを要求するのではなく、ただ私たちの監査委員会は完全に独立取締役で構成されなければならないことを要求している。私たちの取締役会は、エリザベス·クライン、ロバート·ゲンチェフ、フランジスカ·ミシェルが私たちの取締役会のメンバーであり、彼らの間の関係は、取締役が職責を履行する際に独立判断を行使することを妨害することはなく、これらの取締役はすべてナスダック規則で定義された“独立”取締役であることを決定した。
私たちの会社の定款によると、私たちの取締役の3分の1は毎年株主総会で退職します。参照してくださいプロジェクト10.B--補足情報--定款大綱と定款--取締役任命、取締役分類、再任命各株主周年総会では、任期満了の取締役が退任し、同株主周年総会で一般決議案で再委任される資格がある。各株主周年大会では、任期満了または再委任された取締役の後継者が選出され、任期は当選および資格取得日から選挙後の第3回記念大会までとなる。私たちの取締役は以下の3つに分類されます
•第一種はロバート?ゲンチェフとフランジスカ?ミシェルで構成されており、2025年に我々が開催する年次株主総会で任期が満了する
•二番目の会員たちは、2026年に開催される年間株主総会で任期が満了するMario PolywkaとElizabeth Crainを含む
•3つ目のカテゴリーはベン·テイラーとDavid·ハレットで構成されており、彼らの任期は2024年に私たちが開催する年次株主総会で満了する。
各取締役の任期は,その後継者が正式に選挙され資格を持つまで,あるいは早期に亡くなったり,辞任したり,免職されるまでである。
わが社の取締役会各委員会
私たちの取締役会には4つの常設委員会があります:監査委員会、報酬委員会、指名と会社管理委員会、科学技術委員会です。取締役会は監査委員会、報酬委員会、指名と会社管理委員会の書面規約を採択し、これらの定款は私たちのサイトで調べることができます
監査委員会。監査委員会は2023年から2024年2月12日まで、エリザベス·クライン、David·ニコルソン、マリオ·ポリボからなり、クラインさんが委員会の議長を務めた。監査委員会は2024年2月12日以来、クレインさん、ロバート·ゲンチェフさん、フランジスカ·ミシェルさんから構成され、クレインさんは引き続き委員会の議長を務めている。監査委員会は、取締役会に協力して、私たちの会計と財務報告の流れと私たちの財務諸表の監査を監督します
監査委員会は完全に財務知識に通じた取締役会のメンバーで構成されており、クレインさんはアメリカ証券取引委員会規則を適用して定義された“監査委員会財務専門家”とみなされ、ナスダック規則を適用して定義された必要な財務経験を備えている。我々の取締役会は、監査委員会のすべてのメンバーが取引所法案規則10 A-3に規定されている“独立性”の要件に適合していることを決定した。監査委員会はナスダック規則に適合した定款によって管轄されている。監査委員会の役割には、以下のことが含まれる
•私たちの財務と叙述的報告書の完全性を監視する
•会計政策と重要な推定と判断を検討する
•内部統制の適切性と完全性を検討する
•株主周年大会には、独立核数師の委任、続任、または解任を推薦する
•監査報告書の作成または発表、または他の監査サービスの実行のために、任意の会計士事務所を採用、補償、保留、監督する
•独立監査師を招聘して監査サービスおよび非監査サービスを提供する前に、当該監査師が提供する監査サービスおよび非監査サービスを予め承認しておく
•独立監査役の資格、業績、独立性を評価し、少なくとも毎年取締役会全員に結論を提出する
•私たちの財務諸表および財務報告手続きを実行者、取締役会、および独立監査人と検討し、
•詐欺の発見、賄賂の摘発、防止の手続き、および内部財務統制、財務報告、リスク管理システムに関する報告書を審査する。
報酬委員会です全体で2023年から2024年2月12日まで、給与委員会はエリザベス·クレイン、David·ニコルソン、マリオ·ポリボからなり、さん·ポリウォカは委員会の議長を務めた。給与委員会は2024年2月12日以降、クレイン氏、ロバート·ゲンチェフ氏、フランジスカ·ミシェル氏、ポリウォカ氏さん氏で構成され、委員会の議長を務めている。給与委員会は役員会が役員報酬を決定することに協力した。報酬委員会の役割には、
•役員報酬に関する政策を決定、検討、提出した
•これらの政策に基づいて各幹部の業績を評価し、取締役会に報告する
•可変報酬構成部分の可能な結果と、これらの結果が実行幹事の報酬にどのように影響する可能性があるかを分析する
•給与政策に基づいて各役員報酬の任意の持分長期インセンティブ部分を推薦し、私たちの役員報酬と福祉政策を全面的に検討する
•潜在的および既存の報酬コンサルタントは、適用されたナスダック規則で決定された独立性基準に基づいて評価される
•当社取締役の報酬を審査し、取締役会に提案し、
•私たちの給与政策と接近によって発生した危険を検討して評価する。
指名と会社管理委員会. 2023年1月1日から2023年5月1日まで、私たちの指名とコーポレートガバナンス委員会はエリザベス·クライン、マリオ·ポリウォカ、David·ニコルソンからなり、ニコルソン博士が委員会の議長を務めている。委員会は2023年5月1日から2024年2月12日まで、委員会はクレインさん、フランジスカ·ミシェル氏、ニコルソン博士からなり、ニコルソン博士は引き続き委員会の議長を務めている。2024年2月12日から、同委員会はクレイン、ミシェル博士、ロバート·ゲンチェフからなり、ミシェル博士が同委員会の議長を務めている。私たちの取締役会が制定した基準に基づいて、私たちの取締役会のメンバーや役員になる資格のある個人を探し、私たちの会社の管理原則を制定することに協力してくれました。ミシェル博士はその委員会の議長です。指名とコーポレートガバナンス委員会の役割には:
•役員の選考基準と任命手続きを制定する
•取締役会の規模と構成を審査し、評価し、少なくとも毎年取締役会の構成概要の提案を提出する
•当社の取締役会とその委員会の指名者を推薦します
•取締役会の個別メンバーと行政員の運営状況を評価し、評価結果を取締役会に報告する
•取締役会に管理取締役会のルールを策定して推薦し、管理取締役会のルールの十分性を審査·再評価し、任意の提案された変化を取締役会に提案する。
科学技術委員会です。私たちの科学·技術委員会はFranziska MichorとMario Polywkaで構成され、科学技術に関する事務で私たちの取締役会に協力して、私たちの全体的なビジョンと使命と一致することを確保します。ミシェル博士はその委員会の議長です。科学技術委員会の役割は
•科学技術に関する戦略計画、目標、措置を審査·推薦し、会社全体の戦略と一致することを確保する
•成長と価値創造を推進するために、技術投資、パートナー関係、知的財産権管理を含む、私たちの革新的な努力を監視し、評価する
•新しい科学技術の進歩、業界の傾向と競争構造を随時理解し、機会とリスクについて取締役会に提案を提供する
•科学顧問委員会の定期会議に傑出した人の指名に協力する。
D.従業員
2023年12月31日まで、私たちは483人の従業員を持っている。私たちはオーストリア以外の誰の職員も労働組合代表を持っていないし、集団交渉協定の包括的な範囲もない。オーストリアでは、私たちは政府の強制的な集団交渉協定の制約を受けており、この協定は最低賃金予想を設定し、従業員に現地労働法の要求以外の追加的な福祉を提供している。私たちは従業員との関係が良いと思う
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 機能 | 2021 | | 2022 | | 2023 |
| 行政性 | 37 | | 75 | | 58 |
| 研究開発 | 248 | | 406 | | 425 |
| 合計する | 285 | | 481 | | 483 |
| | | | | |
| 地理学 | | | | | |
| イギリス.イギリス | 242 | | 379 | | 362 |
EUとスイス | 29 | | 69 | | 86 |
アメリカとカナダ | 13 | | 32 | | 35 |
| 日本です | 1 | | 1 | | 0 |
E.株式所有権
わが役員及び役員の株式所有権に関する情報は、ご参照ください“プロジェクト6.B--賠償“と”プロジェクト7.A--主要株主.”
項目7.大株主と関連者取引
A.主要株主
次の表は、2024年3月1日までの私たちの普通株式の実益所有権情報を示しています
•私たちが発行した普通株の5%以上を持っているすべての実益所有者
•私たちのすべての役員や行政は
•私たちのすべての役員と幹部はチームです
米国証券取引委員会規則に基づいて実益権属を決定する。これらの規則は、一般に、オプションを行使する際に発行可能な普通株式を含む証券の実益所有権を、これらの証券に対して単独または共有投票権または投資権を有する者に帰属させ、これらのオプションは、直ちに行使することができるか、または2024年3月1日から60日以内に行使することができる。所有権率の計算は、2024年3月1日現在の126,119,566株の発行された普通株に基づく
別の説明を除いて、表に反映されているすべての株式は普通株であり、適用されるコミュニティ財産法の規定の下で、以下のすべての者は、その実益が所有する株式に対して唯一の投票権と投資権を有する。私たちの主要株主は私たちの普通株の他の所有者と違う投票権を持っていない。この情報は必ずしも利益所有権が他の目的のために使用されるということを見せてくれるとは限らない
次の表には別の説明があるほか,取締役,行政者および指定実益所有者のアドレスはExScience a plc the Schrödinger Building,Oxford Science Park,Oxford OX 4 4 GE,UKに渡される.
| | | | | | | | |
| 実益所有者の氏名または名称 | 実益所有普通株 | 実益が持つ割合 |
| 5%以上の株主: | | |
アンドリュー·ホプキンスDPhil FRSE FRSC(1) | 19,124,900 | 15.2% |
ソフトバンクグループです。(2) | 18,977,218 | 15.0% |
Evotec SE(3) | 14,035,200 | 11.1% |
ノ和華ホールディングスA/S(4) | 13,086,600 | 10.4% |
| 行政員および役員 | | |
デヴィッド·ハレット博士(5) | 409,111 | * |
ベン·テイラー(6) | 512,717 | * |
マイク·クラムス医学博士です(7) | 60,948 | * |
エリザベス·クライン(8) | 104,796 | * |
| ロバート·ゲンチェフ | — | * |
フランシスカ·ミッシェル(9) | 19,841 | * |
マリオ·ポリヴォカ博士(10) | 146,061 | * |
| すべての現職役員と上級職員が1組(7人) | 1,253,474 | * |
*実益所有権が1%未満です。
(1)情報はアンドリュー·ホプキンスが2024年2月12日に米国証券取引委員会に提出した付表13 G/Aに基づいている。(A)ホプキンス博士が保有する16,526,300株の普通株、(B)その配偶者Iva Hopkins Navatilovaが保有する498,600株の普通株、および(C)Nia Hopkins慈善信託基金(“この信託”)が信託形式で保有する2,100,000株の普通株を含む。ホプキンス博士はその配偶者が保有している株式に対して投票権と処分権を持っている。ホプキンス博士はこの信託基金の唯一の受託者であり、その信託基金が保有する株式に対して唯一の投票権と処分権を保持する
(2)情報はSVF II Excel(DE)LLC(“投資家”)に基づいて2023年4月11日に米国証券取引委員会の付表13 D/Aに提出された。投資家は13,295,400株の普通株および5,681,818株の普通株を保有し、5,681,818株の米国預託株式に相当する。投資家の唯一のメンバーはSVF II Investment Holdings(Subco)LLC(“SVF II Subco”)である。SVF II Subcoは、投資家の保有証券の投資適宜権をSB Global Advisors Limited(“SBGA”)に付与している。ソフトバンクはSBGAの唯一の株主であり、ソフトバンクは東京証券取引所に上場する上場企業である。SVF II Excel(DE)LLCとSVF II Investment Holdings(Subco)LLCのビジネスアドレスはそれぞれデラウェア州ウィルミントン小ブース路251号,郵便番号:19808である。SBGAの営業住所はイギリスイングランドロンドンW 1 K 3 JPロンドンメイフィールドグラフナ通り69番地です。ソフトバンクの営業先は東京開干市1-7-1、東京105-7537。
(3)研祥科学技術SEが保有する14,035,200株の普通株からなる。これらの株式の実益所有者はEvotec SEである.研華科技有限公司の住所はドイツハンブルクエセナ·ボーガン7号、郵便番号:22419。
(4)情報はノボワホールディングスA/Sが2022年2月2日に米国証券取引委員会に提出した13 Gスケジュールに基づいている。ノ和華ホールディングスA/Sは13,086,600株の普通株を保有している。ノボワホールディングスA/Sは当該等の株式の唯一の投票権及び処分権を有しており、いかなる個人又は他の実体も当該等の株式を保有する実益所有権とみなされていない。ロバート·ゲンチェフはノバホールディングス米国会社の高級パートナーとして招聘され、同社はノバホールディングスA/Sに一定のコンサルティングサービスを提供し、私たちの取締役会メンバーである。Ghenchevさんは、Novo Holdings A/Sの保有株式の受益者所有権または申告すべき金銭的権益とはみなされません。Novo Holdings A/Sの営業住所は、Tuborg Havnevej 19,2900 Hellerup,デンマークです。
(5)2024年3月1日までの1,500株の普通株と、2024年3月1日から60日以内に行使可能なオプション行使後に発行可能な追加407,611株の普通株を含む。
(6)2024年3月1日までの48,996株の普通株式と、2024年3月1日から60日以内に帰属および交収または行使可能なオプションによって発行することができる追加の463,721株の普通株とからなる。
(7)2024年3月1日までの35,050株の普通株と、追加の25,898株の普通株とを含み、RSUの帰属および受け渡しまたは行使によって2024年3月1日から60日以内に帰属および交収または行使可能なオプションによって発行することができる。
(8)2024年3月1日までの70,498株の普通株式と、追加の34,298株の普通株とからなり、これらの普通株は、RSUの帰属および受取または行使によって2024年3月1日から60日以内に帰属および交収または行使可能なオプションによって発行されることができる。
(9)2024年3月1日までの6,613株の普通株式および追加の13,228株の普通株からなり、これらの普通株は、RSUの帰属および受取または行使によって2024年3月1日から60日以内に帰属および交収または行使可能なオプションによって発行されることができる。
(10)2024年3月1日までの62,198株の普通株式と、追加の88,298株の普通株とを含み、RSUの帰属および受け渡しまたは行使によって2024年3月1日から60日以内に帰属および交収または行使可能なオプションによって発行することができる。
所有権の割合の大きな変化
我々の知る限り,我々が表に提出した米国証券取引委員会に提出された他の文書と本年度報告で提供された情報を除いて,2021年1月1日以来,我々の主要株主の普通株率の著しい変化は,2021年10月の初公募株(15,927,500株の米国預託証券を発行·売却し,同等数の普通株に相当)と同時に行われた私募によるものであり,SVF II Excel(DE)LLCとビルとメリンダ·ゲイツ財団にそれぞれ5,681,818株の普通株と1,590,909株の普通株を売却したことが知られている
アメリカの株主
2023年12月31日現在、我々の知る限り、我々の発行済み普通株式(米国預託証明形式の普通株を含む)の19,343,100株、または15%は米国に登録されている4人の株主が保有している。実際の保有者数は、利益所有者を含む記録所有者数を超え、その普通株式又は米国預託証明書は、街頭名義で仲介人及び他の被提出者が保有する
この数の登録所有者には、その株式が他のエンティティが信託形式で保有する可能性のある所有者も含まれていない
B.関連者取引
Evotecとの手配
Evotec SEまたはその付属会社Evotecと一緒に、私たちの10%以上の株式の実益所有者です。当社の取締役会のメンバーであるMario Polywkaさんは、現在Evotec監会のメンバーであるEvotecの臨時CEOです。当初,Evotecとの協力は,二重CD 73/A 2 AとCD 73−阻害剤化合物の設計を目指していた。私たちの協力プロジェクトはこの点で発展してきた。
私たちと私たちの子会社は研華と以下の商業計画を達成しました
協力プロトコルとサービスですEvotecとの協力協定条項に基づき,Aptuit(Verona)SRL(Evotecの付属会社)を招聘してEXS 21546の臨床前毒理学と製造を展開した。私たちはこの計画の費用をEvotecと二等分した2022貸方手形の総額は2023年12月31日までの年間で687,000 GBである。
薬物発見サービス協定2017年11月には,分析,スクリーニング,構造生物学,薬物化学開発に関するサービスを含む薬物発見サービスであるEvotec発見プロトコルをEEvotecと締結した。
2020年10月にEvotec発見プロトコルを修正し,その有効期限を2022年11月に延長し,2022年9月にその期限を2023年4月に延長した。これまでに,資源を直ちに再配置するためには,いずれか一方が特定の項目を終了することができ,90日前の書面で合意下の任意の項目を終了することも通知することができる.研華発見協定の規定は、私たちの要求に応じて、研華は各計画のプロジェクトに合理的で詳細なサービス、時間フレーム、交付成果と定価の見積もりを提供しなければならない。双方が同意すると、各項目は双方の同数の代表で構成された指導委員会によって監督されるだろう。いくつかの限られた例外状況を除いて、私たちは、薬物発見サービスプロトコルの下でのサービスを履行する過程で発見または作成されたすべての知的財産権の所有権を保持し、研究華がこのような知的財産権の任意の権利を私たちに譲渡することができない範囲内で、研華は、永久的、撤回不可能、全世界的に、印税免除、独占的、譲渡可能、多層再許可による許可を提供しており、いかなる方法でもこのような譲渡不可能な権利を実践している。
我々は、Emotecおよびその付属会社を招いて、本プロトコル下のいくつかのプロジェクトにサービスを提供しており、その中で最も重要なのは、2019年および2021年にそれぞれ開始されたCelgene CorporationおよびBMYとの連携プロトコルのうちの1つに基づいて、候補化合物の配信を支援するためのCROサービスを提供することである。これらのCROサービスプロジェクトについては,2021年,2022年,2023年までの年度にそれぞれ総額13,870,000 GB,8,485,000 GB,3,341,000 GBの領収書を受け取った.Evotec Discoveryプロトコルで提供されている他のすべての項目については,2021年,2022年および2023年までに,それぞれ合計130,000 GB,273,000 GBおよび1,597,000 GBの伝票を受け取っている.
複合管理サービスプロトコル2021年4月、私たちは、複合体の受信、貯蔵、貯蔵期間の維持、品質分析と制御、および出荷に関連するサービスを含む複合体管理サービスを調達するために、研華と複合体管理サービスプロトコル、またはEvotec複合体管理プロトコルを締結した。
Emotec大院管理プロトコルの有効期間は5年であるが,いずれも90日間の事前書面通知を提供することで無断でプロトコルを終了することができる.Evotec大院管理プロトコルによれば,サービス,義務,その他の重要な条項の作業注文を詳細に説明する条項に同意することでEvotecの大院管理サービスを採用することができる.いくつかの限られた例外状況を除いて、我々は、研華が合意項目の下でサービスを履行する過程で発見または製造されたすべての最終製品および知的財産権の所有権を保持し、必要であれば、研華は、私たちの所有権を決定、登録、譲渡、または他の方法で記録するために必要または適切な行動をとる。研華大院管理協定の有効期間内に、著者らは研華に使用料免除、未納費用、全世界範囲内の非独占許可を授与し、研華が合意項目の下でサービスを履行するために必要な範囲内で、研華が所有或いは許可された任意の関連知的財産権を使用する。
著者らは研華技術を招聘して、私たちのウェブサイトとパートナーに粉剤と溶液化合物の移転、受け入れ、鑑定、在庫登録、品質分析と制御、貯蔵、維持と輸送に関連する一般サービスを提供した。このスケジュールについては,2021年,2021年,2022年および2023年12月31日までに,231,000 GB,231,000 GBおよび228,000 GBをそれぞれ研華に支払った。
私たちの執行役員や役員や近親者と合意しました
私たちはすでに私たちの非従業員取締役、執行役員、そして私たちの執行役員David·ハレットとベン·テイラーとサービス契約を締結しました。参照してください“プロジェクト6--役員、上級管理職、従業員。しかし,競業制限条項の実行可能性は適用法律によって制限される可能性がある.
2016年11月以来、私たちの元最高経営責任者アンドリュー·ホプキンスの配偶者エバ·ナフラティロワ博士は私たちに雇われてきた。彼女は現在私たちの生物物理部の副社長で、彼女の給料と福祉はわが社での地位と市場実践と一致しています。
賠償協定
私たちは、Franziska Michorが2023年5月に取締役会メンバーに任命されたことに関する賠償契約を含む、私たちの役員や役員と標準的な賠償契約を締結しました。私たちの会社の定款は私たちが法律を適用することによって私たちの役員と役員を最大限保障することを許可しています。参照してくださいプロジェクト6--役員、上級管理職、従業員
関連者取引政策
我々は,関連者取引政策をとり,関連者取引の識別,審査,考慮,承認または承認の手順について述べた。吾等の政策のみで言えば、関係者取引とは、吾等や吾等の任意の付属会社及び任意の関係者が、かつて又は参加する取引、手配又は関係、又は任意の一連の類似した取引、手配又は関係を指し、関連する金額が120,000ドルを超えるか、又はその性質又は条件が尋常ではない。この保険証書は、私たちが従業員や役員として提供するサービスを補償する取引に関するものではありません。関係者とは、任意の主管者、取締役、または任意のカテゴリーの投票権を有する証券の5%以上を有する実益所有者であり、彼らの任意の直系親族、およびそのような者によって所有または制御される任意の実体を含む
関連者取引ポリシーはまた、米国の目的のために上述した関連者の定義とは異なる関連者定義を含む、ロンドン証券取引所が発表した会社のためのAIMルールまたはAIMルールの下での関連者取引を含む。AIMルールは、関連側との任意の取引(AIMルールの定義による)がAIMルールに記載されている任意のカテゴリテストにおいて5%以上(取引集約に関連するいくつかの条項を考慮する)を超えることを要求し、この公告は、AIMルールが指定されたコンサルタントに相談した後、当社等の株主にとって公正で合理的であるという声明を含むいくつかの特定の情報を含むべきである
C.専門家と弁護士の利益
適用されません
項目8.財務情報
A.連結レポートおよびその他の財務情報
連結財務諸表
我々の連結財務諸表は、本年度報告の末尾に添付され、F−1ページから引用されて本明細書に組み込まれる
配当分配政策
私たちが設立されて以来、私たちは私たちの発行された配当金を発表したり支払ったりしなかった。私たちはすべての収益を私たちの業務に保留するつもりで、今のところ私たちの普通株やアメリカ預託証明書に配当金を支払うつもりはありません。将来の任意の配当金の発表と支払いは、私たちの取締役会によって適宜決定され、私たちの運営結果、現金需要、財務状況、契約制限、任意の未来の債務協定または適用される法律、および私たちの取締役会が関連する他の要素に依存するかもしれません。タイトルをご覧くださいプロジェクト3.D.-リスク要因-私たちのアメリカ預託証明書の所有権に関連するリスク-私たちは私たちのアメリカ預託証明書に配当金を支払うつもりはありませんので、いかなる見返りも私たちの普通株の価値に限定されます
イングランドやウェールズなどの法律によると、私たちは十分な分配準備金(非合併ベースで確定)を持っている場合にのみ配当金を支払うことができ、分配準備金とは、以前に分配や資本化されていなかった累積利益から私たちの累積損失を差し引いた損失を引いたものであり、このような損失が以前に資本減少や再編でログアウトしなかった限りである。
法律訴訟
時々、私たちは正常な業務過程で発生した法的訴訟に巻き込まれるかもしれない。私たちは現在、実質的な法的手続きの影響を受けていない
B.重大な変化
参照してください“プロジェクト4.B-ビジネスの概要-最新の発展.”
項目9.見積もりとリスト
A.特典と発売詳細
2021年10月1日から、私たちのアメリカ預託証明書はすでにナスダック全世界の精選市場に発売され、コードはEXAIである。これまで、私たちのアメリカ預託証明書や普通株は公開取引市場を持っていなかった。私たちの普通株はどの取引所にも上場していません。
B.配送計画
適用されません
C.市場
2021年10月1日から、私たちのアメリカ預託証明書はすでにナスダック全世界の精選市場に発売され、コードはEXAIである。これまで、私たちのアメリカ預託証明書や普通株は公開取引市場を持っていなかった。私たちの普通株はどの取引所にも上場していません。
D.売却株主
適用されません
E.希釈
適用されません
F.債券発行費用
適用されません
項目10.補足情報
A.株
適用されません
B.組織覚書と規約
当社の定款コピーは添付ファイル1.1として本年度報告書の後に添付されています。本プロジェクトで要求された資料は本年度報告の添付ファイル2.4と添付ファイル2.5に掲載され,参考として本年度報告に組み込まれる。
C.材料契約
本年度報告書に記載されている他の場所に記載されている契約を除いて、以下は、本年度報告日の2年前に締約国としての各重要契約の要約である。
BMY連携とライセンス契約
2021年5月、私たちはBMYと協力と許可協定、またはBMY協定に署名した。“BMY協定”によると,締約国は協力目標の目的化合物の発見と臨床前開発について協力することに同意した。BMYプロトコル期間中、BMYは開発と商業化目標化合物の独占的権利を保持し、著者らは臨床前製造過程を独占的に担当する。
双方の同等数のメンバーからなる共同指導委員会は、“BMY協定”に基づいて行われた作業を監督する。この研究計画はBMYプロトコルに基づいて目標化合物の研究と開発を管理し,研究計画開始日から4年間である。BMYは6ヶ月前に研究計画を終了する権利を書面で通知する権利を保持している。あるいは、BMYは最初の4年間の任期後に研究計画をもう1年間延長することもできる。
BMYプロトコルによると、BMYは私たちに3000万ドルを前払いした。私たちはまた開発基準と規制と販売マイルストーンに到達した時に支払いを受ける権利がある。BMY協定によると、特許権使用料は含まれていない目標ごとに2.57億ドルの収入を得ることができる。さらに、BMYは、プロトコルに従って開発された規制承認された候補薬剤の販売の低さから高い一桁パーセントの特許権使用料を支払う。
BMYプロトコルによると、BMY独自の、世界的に特許権使用料を徴収する再許可可能な許可証を付与し、目的化合物を発見、開発し、商業化する。BMYはBMY協定を完全にまたは一つずつ終了する権利を保持する。いずれの一方も、他方の重大かつ是正されていない違反の場合、ライセンス製品毎にBMYプロトコルを終了することができるが、BMYがその職務調査義務に深刻に違反し、指定された期限内に救済されていない場合、市場毎または目標ごとにBMYプロトコルを終了することができる。
2022年3月11日に、BMYは、本グループの正確な医学プラットフォームを利用して協力項目の主要な目標に翻訳能力を使用することを含むより多くのデータを生成するために、当グループとの最初の協力スケジュールを6ヶ月延長し、したがって、当グループは現金支払い5,000,000ドル(GB 3,821,000)を獲得した。
2023年10月、私たちは共同で特定のプロジェクトを優先し、協力の範囲内で他のプロジェクトの開発を継続しないことを決定した。
ゲイツグローバル参入約束協定
2021年9月1日、ゲイツ財団とグローバル参入約束協定を締結し、大流行予防計画を拡大した。私たちは第三者活動を運営し支援することで、協力に3500万ドルの等額資金を提供することを約束した。
セノフィ許可協力と許可協定
2022年1月、セノフィまたはCLAと協力·許可協定を締結し、2023年1月、2023年7月、2023年12月に協力·許可協定を改訂し、改訂されたCLAを改訂CLAと呼ぶ。改訂されたCLAにより,我々の人工知能駆動のエンドツーエンド集積プラットフォームを用いて腫瘍学と免疫治療領域の新たな標的を発見·検証する。私たちはセノフィと協力して、これらの目標のいくつかを小分子阻害剤薬物研究プロジェクトに推進し、いくつかの小分子開発候補薬物の決定を加速する。
セノフィはCLA署名時に1億ドルの現金を前払いし、2023年12月の改正案に基づいて協力拡大のために400万ドルを追加支払った。改訂されたCLAによれば、ExScience aおよびSanofiは最大15個の新しい小分子計画を開始することができ、場合によっては協力に追加の目標を増加させる可能性がある。各計画が研究、開発および/または商業化に成功すれば、約3.43億ドルに達する研究、臨床開発、監督と商業マイルストーン支払いが発生し、その中のいくつかの特定の研究、開発と監督管理マイルストーンの合計は1.93億ドルに達し、ある特定の商業マイルストーンの合計は1.5億ドルに達する。改訂されたCLAは、すべての15の潜在計画の中で、約52億ドルにのぼるマイルストーン支払い総額を提供してくれるかもしれません。
研究協力による治療製品が商業化されている場合には,上位数から10代程度までの純売上高の分級印税を得る資格もある。臨床連携投資を選択することも可能であり,この選択肢を行使すれば,連合投資製品の純売上高の階層的特許権使用料を21%に引き上げることができる。
この協力は,ExScience aが人工知能に基づく能力と正確な医学プラットフォームを利用して,目標認識から患者選択までを利用する可能性がある。目標が決定されると、ExScience aは開発候補薬物を決定するために、設計、翻訳、および早期臨床前研究を指導する。改訂されたCLAによると、セノフィは、少なくとも1つの合意された主要市場で、少なくとも1つの合格した小分子製品に対する規制部門の承認を得るために、商業的に合理的な努力に同意している。
協力の研究部分はExScience aとSanofiのそれぞれ同数の代表で構成された共同指導委員会によって監督されるだろう。ExScience aとセノフィは、サイノフィの非小分子プロジェクトにおいて、患者を豊富にするために私たちの正確な医学プラットフォームを使用することに同意するかもしれない。
改訂されたCLAによると、ExScience aは、すべての目的のための世界各地の各小分子研究計画のテーマである知的財産権の独占的許可(複数のレベルで再許可を付与する権利がある)をセノフィに付与している。セノフィは知的財産権に関連する任意の特許権の起訴と維持を制御する権利があり、これらの特許権は各小分子研究計画のテーマである。
商標法の施行日の後、私たちは特定の期間内に異なる排他的手配を遵守しなければならず、これは、改正された商標法の範囲内の化合物と目標、特定の合意された利益経路を研究開発、製造、または商業化活動する能力を制限する(私たち自身も第三者との協力も)。
改訂されたCLAは、重大な違約または破産のための条項を含む標準的な終了条項を含み、セノフィの利便性を提供する。これらの停止権のいくつかの権利は、所与の目標に対して行使されてもよく、CLA全体のために行使されてもよい。場合によっては、一旦終了すると、私たちはセノフィ付与許可証を終了し、候補製品の開発、製造、商業化を継続する権利がある。
メルク研究協力協定
2023年9月20日、私たちはドイツのダムシュタットKGaAのヘルスケア業務とRCAという研究協力協定を締結し、この合意に基づいて、最初に合意した目標に基づいて候補薬剤の開発を発見するために、設計過程および翻訳および早期非臨床研究を担当する。ドイツのダムシュタットのメルクKGaA社が開発候補薬物として化合物を選択した後,ドイツダムシュタットのメルクシュタット社は独自にこのような開発候補薬物の非臨床研究と臨床開発,製造,商業化を担当し,費用と費用は自弁する。RCA、Merck KGaA、Darmstadtによると、ドイツは商業的に合理的な努力に同意し、いくつかの主要市場で少なくとも1つの候補製品の監督管理許可を得、そのような規制の承認を得た場合にそのような製品を商業化することに同意した。
協力の研究部分は、ドイツのダムシュタットからのメルクKGaAと同等の数の代表で構成された共同指導委員会によって監督されるだろう。協力にはまた、双方が同数の特許弁護士からなり、協力に関する知的財産権問題の連絡を担当する知的財産権グループ委員会がある。
RCAはメルクKGaA、Darmstadt、ドイツと私たちが腫瘍学と免疫学または他の共同で合意した疾患領域でより多くの目標を決定することを可能にする。もし私たちが協力のためにより多くの目標を決定すれば、薬物設計に加えて、目標検証を担当します。
ドイツのダムシュタットのMerck KGaAはRCAに署名した時に2000万ドルの現金を前払いし、すべての3つの初期計画のすべてのマイルストーンが実現すれば、私たちはまだ6.74億ドルに達する発見、開発、監督、販売に基づくマイルストーンを得る資格がある。この金額のうち、最高1.13億ドルは開発の発見段階で実現されたマイルストーンに基づいて支払われている。また、最初の3つの商業化目標から生成された任意の製品の純売上高の中桁から下位2桁までの特許権使用料を受け取る。もし協力のために任意の他の目標が決定された場合、私たちはその目標に基づいて追加的なマイルストーン支払いを受ける資格があるだろう。
RCAによると、ドイツのダムシュタットのMerck KGaAにグローバル独占譲渡可能許可(複数のレベルで再許可を付与する権利がある)、目的化合物および最終製品(あれば)の開発または商業化に必要または合理的に有用な知的財産権を付与し、目的化合物および最終製品(あれば)を開発、製造、商業化、販売する。ドイツのダムシュタットのMerck KGaAは、知的財産権に関する任意の特許権の起訴と維持を制御する権利があり、これらの特許権は各計画のテーマである。
RCAがその条項に従って事前に終了しない限り、RCAがマイルストーン支払いまたは特許使用料となる可能性がある日まで、2023年9月20日から有効である。RCAは、一方が他方の重大な違約または債務不履行によって終了することを含む標準的な終了条項を含み、ドイツのダムシュタットのメルクKGaA社が規制および商業化活動に関するいくつかの義務に違反した場合、他方の契約を終了し、便宜上、ドイツのダムシュタットのメルクKGaA社は契約を終了する。これらの停止権のいくつかは、所与の目標に対して行使されてもよく、またはRCA全体のために行使されてもよい。場合によっては、一旦終了すると、ドイツのダムシュタットKGaAへのライセンスの付与を終了し、目的化合物や最終製品(あれば)の開発を継続して商業化する権利がある。
RCAの有効期限内では,我々は排他的義務の制約を受けており,RCA範囲内の化合物や目標を研究·開発または商業化活動(我々自身も第三者とも協力)する能力を制限している.
RCAは標準的な機密条項と合意当事者が行った陳述と保証を含む。双方はまた、合意に基づいて相互賠償を提供し、RCAは法的に禁止されていない限り、いずれか一方の後果性または類似損害に対する責任を排除する。
D.外国為替規制
源泉徴収要件を除いて、イギリスは、私たちが使用可能な現金および現金等価物の供給を含む、資本の輸出入に影響を与える可能性がある政府の法律、法令、法規、または他の立法は、または非住民普通株または米国預託証明書保持者に配当金、利息、または他の支払いを支払うことに影響を与える可能性がある。イギリスの法律または私たちの会社の定款は非住民が保有または投票した株式の権利に何の制限もありません。
E.課税
アメリカ連邦所得税のアメリカ保有者に対する重要な考慮
以下は、我々の普通株式または米国預託証明書を所有して処分する米国保有者に一般的に適用される米国連邦所得税のいくつかの重大な結果の記述である(以下のように定義される)。それは、特定の米国所有者が私たちの普通株式または米国預託証明書を買収する可能性のある決定に関連するすべての税務考慮事項を全面的に説明していない。本議論は、米国連邦所得税資本資産として我々の普通株式または米国預託証明書を保有する米国保有者(通常は投資のために保有する財産)にのみ適用される。さらに、州および地方税の結果、相続税および贈与税の結果、最低税収の代替結果、純投資収入に適用可能な連邦医療保険料金支払い税、“規則”第451(B)節に適用可能な特殊税務会計規則、および特殊規則によって米国所有者に適用される税収結果を含む、米国所有者の特定の状況に応じて関連する可能性のあるすべての税収結果を記述していない
•銀行や保険会社や他の金融機関
•年金計画
•協同組合
•アメリカ在住者やアメリカ人の元市民や長期居住者
•時価ベースの税務会計方法を使用する証券取引業者または取引者
•普通株式または米国預託証明書を保有する者は、ヘッジ取引、“国境を越えた”売却、転換取引または総合取引の一部として、または普通株または米国預託証明書について推定販売を行う者;
•アメリカ連邦所得税の場合、その“機能通貨”はドルの人ではない
•証券、商品または通貨のブローカー、トレーダー、またはトレーダー;
•免税実体(個人基金を含む)、政府組織、または国際組織;
•Sは、米国連邦所得税の目的が組合企業の会社、共同企業または他の実体または手配(およびその投資家)に分類される
•規制された投資会社や不動産投資信託基金
•任意の従業員株式オプションの行使または他の方法で補償として私たちの普通株式または米国預託証明書を取得する人;
•私たちの10%以上の株式を所有しているとみなされている人(投票または価値によって);
•私たちの普通株またはアメリカ国外の貿易または業務、常設機関または固定営業場所に関連するアメリカ預託証明書を持っている人。
米国連邦所得税規定に基づいて組合企業に分類された実体が普通株または米国預託証明書を保有している場合、共同企業パートナーの米国連邦所得税待遇は、通常、パートナーの地位と組合企業の活動に依存する。私たちは普通株またはアメリカ預託証明書を持っている組合員とこのような組合員が私たちの普通株またはアメリカ預託証明書を持っている特殊なアメリカ連邦所得税結果について彼らの税務顧問に相談することを奨励します
この議論の根拠は“守則”、行政声明、司法裁決、最後の、仮と提案された財務部条例、連合王国と米国との間の所得税条約(“条約”)であり、これらは本条約の日までである。これらの当局は変化と異なる解釈が発生する可能性があり、追跡力を持つ可能性があり、本文で述べた税収結果に影響を与える可能性がある
本議論において、“米国保有者”とは、米国連邦所得税について、我々の普通株または米国預託証明書の実益所有者であり、本条約の利益を享受する資格を有する保有者である
(a)アメリカの市民や個人
(b)米国、米国のいずれかの州またはコロンビア特区の法律の下で作成または組織された会社または他のエンティティ、または米国連邦所得税の目的のために会社として課税されるべき他のエンティティ;
(c)その収入は、その出所にかかわらず、米国連邦所得税の遺産を納めなければならない
(d)(I)米国裁判所が信託の管理行使を主に監督することができ、かつ1人以上の米国人が信託のすべての実質的な決定を制御する権利がある場合、または(Ii)適用される米国財務省法規に基づいて、信託は米国人とみなされる有効な選択を有する。
私たちはアメリカの株主が彼らの特別な状況下で、私たちの普通株あるいはアメリカ預託証明書によって生成されたアメリカ連邦、州、地方、非アメリカの税収結果について彼らの税務顧問に相談することを奨励します。
以下の議論では,預金プロトコルに記載されている陳述が事実であると仮定し,預金プロトコルおよび任意の関連プロトコルの義務がその条項に従って遵守されると仮定する.一般的に、米国連邦所得税の目的で、米国預託株式の保有者は、米国預託株式に代表される普通株とみなされるべきである。したがって,米国預託証明書を普通株と交換する場合には,何の損益も確認されない。
受動型外国投資会社規則
一般的に、以下のいずれの課税年度においても、私たちは、米国連邦所得税のPFICとなる:(1)私たちの総収入の75%以上は受動的収入からなるか、または(2)私たちの資産の平均四半期価値の50%以上は、受動的収入(現金および現金等価物を含む)を生成するか、または受動的収入を生成するために保有される資産からなる。これらのテストの場合、受動的収入には、他の事項に加えて、一般に、配当金、利息、いくつかの投資物件の売却または交換収益、およびいくつかの賃貸料および特許使用料が含まれる。また、私たちは私たちが比例して保有している資産シェアを持っているとみなされ、任意の他社の収入に比例して割り当てられたシェアを得て、私たちはその会社の25%以上の株式を直接または間接的に所有しています(価値で計算)。もし私たちがいかなる納税年度内にアメリカ投資家が私たちの株を持っているPFICであれば、このアメリカ投資家が私たちの株を持っている後続の納税年度内に、このアメリカ投資家にとってはPFIC地位のハードル要求を満たさなくてもPFICとみなされ続ける。これらの米国投資家は、資本収益または実際または配当とみなされる任意の優遇税率、繰延税金とみなされるいくつかの利息費用、および追加の報告要件を含む、不利な税金結果の影響を受ける可能性がある。PFICルールの適用による届出や納税義務を履行するために必要な情報をこのような米国投資家に提供する保証はない。アメリカの保有者は彼らの税務顧問に問い合わせて、彼らが私たちの普通株式或いはアメリカ預託証明書に投資する時にPFIC規則を適用することが可能かどうかを知るべきである。
我々の資産価値と我々の収入と資産の性質と組成に基づいて,2023年12月31日までの納税年度中にPFICではないと予想されるが,この点では保証できないにもかかわらず。私たちが個人投資委員会の決定であるかどうかについては、毎年多くの事実に基づいて決定されており、採用されている原則や方法は場合によっては不明であり、異なる解釈がある可能性がある。例えば、私たちの現在と未来の納税年度について、PFICテストに使用されている資産(営業権を含む)の総価値は、私たちの普通株やアメリカ預託証明書の市場価格を部分的に参考にして決定される可能性があり、市場価格は大きく変動する可能性があります。もし私たちの時価が下がったら、私たちは任意の納税年度に大量の現金と現金等価物を持っていて、私たちはこの納税年度のPFICかもしれません。また、収入テストの下で、私たちのPFICとしての地位は、関連納税年度における私たちの収入構成に依存し、これは私たちが未来に行う取引と私たちの会社の構造に依存します。私たちの収入と資産の構成はまた私たちがどの発行で調達した現金をどのように使用するかの影響を受ける。候補薬物の商業化から収入を得ていないため,どの納税年度においても,受動的融資収入を相殺するのに十分な能動的収入が生じていなければPFICになる可能性がある。したがって,本課税年度や将来のいかなる納税年度でもPFICにならないことは保証されず,我々の米国弁護士は我々の前,本年度または未来納税年度のPFICの地位について何の意見も発表しない。納税年度内にPFICではないと判断しても、国税局が私たちの結論に同意する保証はありませんし、国税局が私たちの地位に挑戦することに成功しない保証はありません。
いずれの課税年度においても、米国保有者がわれわれの普通株式または米国預託証明書を保有するPFICであれば、当該米国保有者がわれわれの普通株式または米国預託証明書を保有した後のすべての年度内に、米国預託証明書保有者とみなされ続ける。われわれが米国預託証明書保持者ではなく、米国預託証明書会社の規則に基づいて“売却”する選択をした場合、上記の基準に適合し続けるか否かにかかわらず、売却とみなされる選択がなされた場合、米国の保有者は、それが保有する普通株式または米国預託証明書をその公平な市価で売却したとみなされ、これらが売却されたとみなされる任意の収益は、以下の規則に規定される。売却選択とみなされた後、次の課税年度にPFICにならない限り、このような選択をした米国所有者の普通株式または米国預託証明書はPFICの株式とみなされず、米国所有者は、米国所有者が私たちから得た任意の“超過割当”または実際の売却または他の方法で我々の普通株式を処理するか、または他の方法で我々の普通株式を処理するか、または米国所有者が私たちから得た任意の“超過割当”に関する規則によって制限されないであろう
アメリカ預かり証明書です。もし私たちがPFICではなくPFICであり、そのような選択が利用可能であれば、米国所有者は彼らの税務コンサルタントに売却とみなされる選択の可能性と結果について相談すべきである。
米国所有者に対するPFICの各課税年度について、米国所有者が受信した任意の“超過割当”と、米国所有者が“適格選挙基金”選挙またはQEF選挙(以下に述べる)を行わない限り、米国所有者が我々の普通株式または米国預託証明書から確認された任意の収益を売却または他の方法で処理する特別税規則を遵守するであろう。上記の米国保有者保有期間内のすべての課税年度については、(I)我々がPFICであるか、または(Ii)我々の普通株式または米国預託証明書が“有価証券”を構成し、当該米国所有者が時価ベースの選択を行う(以下に述べる)。米国の保有者が納税年度に受け取った割り当ては、米国の保有者が以前の3つの納税年度または米国所有者が私たちの普通株式または米国預託証明書を保有していた期間の短い年間平均割り当ての125%を超え、超過割り当てとみなされる。このような特別な税金ルールによると
•超過分配または収益は、米国の保有者が普通株式または米国預託証明書を保有している間に比例的に分配される
•本課税年度および我々が民間投資会社となる最初の課税年度までのいずれの課税年度に割り当てられた額も、一般収入とみなされる
•1年ごとに割り当てられた額にはその年度の最高税率が適用されますが、一般的に税金の少納に適用される利息費用は当該年度ごとの課税項目に徴収されます。
当該課税年度までに課税年度又は“超過分配”に割り当てられた金の税務責任は、当該年度のいかなる純営業損失から相殺することはできないが、普通株又は米国預託証明書を売却して現金化した収益(ただし損失を含まない)は資本収益と見なすことができず、たとえ米国所有者が当該等の普通株又は米国預託証明書を資本資産として持っていても、資本収益と見なすことはできない
もしいかなる課税年度においても、私たちが米国所有者が私たちの普通株式またはアメリカ預託証明書を所有している個人私募株式投資会社であれば、私たちが私たちの任意の直接または間接子会社または私たちが株式を持っている任意の他のエンティティから得られた割り当てと、その株式に対する私たちの処分について、この米国所有者は一般に、このような割り当てが当該米国所有者によって間接的に受信および/または処置されているように、同様の規則を遵守するであろう。アメリカの保有者はPFIC規則が比較的に低いレベルのPFICに適用されることについて彼らの税務顧問に相談しなければならない。
もし私たちまたは私たちのどの子会社がPFICであれば、私たちは現在、アメリカの所有者がQEFを選択することを許可する情報を提供しないと予想されますので、アメリカの所有者は、私たちまたは私たちのどの子会社がPFICであれば、このような選択は利用できないと仮定しなければなりません。
もし私たちが任意の課税年度に米国所有者が私たちの普通株式または米国預託証明書を保有する個人私募株式投資会社であれば、当該米国保有者は、普通株式または米国預託証明書を時価で選択することによって、普通株式または米国預託証明書に関連する超過割当または収益の利息費用を回避することができ、普通株または米国預託証明書が“売却可能株”であることを前提とすることができる。普通株式または米国預託証明書が、ある米国証券取引所またはいくつかの条件を満たす非米国証券取引所で“定期取引”されている場合、取引可能な株式である。このような目的については、普通株式または米国預託証明書は、いずれのカレンダーでも年内に定期取引とみなされるが、日歴ごとに最低15日で最低数で取引される。この要求を満たすことを主な目的とする産業は無視されるだろう。私たちのアメリカ預託証明書(普通株ではありません)がナスダックに上場します。これはこれらの目的に合った合格取引所です。したがって、もし私たちのアメリカ預託証明書が引き続きナスダックに上場し、定期的に取引すれば、私たちがPFICであれば、私たちのアメリカ預託証明書保有者は時価建ての選挙を行うことができると予想される。私たちの普通株式またはアメリカ預託証明書については、各アメリカの保有者は、時価計算の選挙が可能かどうか、または適切であるかどうかを決定するために、その税務顧問に相談しなければならない。
時価で選択する米国の保有者は、納税年度終了時の普通株式または米国預託証明書に相当する公平な市場価値が、米国保有者の普通株式または米国預託証明書の調整税ベースを超える額を毎年の一般収入に含まなければならない。当選した米国保有者は、米国保有者が調整した普通株または米国預託証券が納税年度終了時に普通株または米国預託証券公平時価を超えた部分について一般損失控除を申請することもできるが、この控除は数年前の時価建て純収益の範囲内に限られる。実際に普通株式または米国預託証明書を実際に売却または処分する収益は一般収入とみなされ、普通株または米国預託証明書を売却または他の方法で処分することによる任意の損失は一般損失とみなされるが、過去数年間の市価で計算された純収益は制限されている。一旦選択を下すと、米国国税局の同意を得ず、普通株または米国預託証明書が流通株でない限り、選択を撤回することはできない。
しかしながら、これらのより低いレベルのPFICの株自体が“販売可能な株”でない限り、通常、我々が所有する任意の低レベルのPFICの株式に対して時価での選挙を行うことはできない。したがって、アメリカの所有者が私たちの普通株式或いはアメリカ預託証明書について時価建ての選択をしても、私たちの任意の投資における間接的な権益について、アメリカの所有者はPFIC規則(上述したように)の制約を受け続ける可能性があり、アメリカ連邦所得税の目的で、これらの投資はPFICの持分とみなされる。米国の保有者は彼らの税務顧問に問い合わせ、時価建て選挙の実行可能性と入手可能性、及びこのような選挙がいかなるより低いレベルのPFICの利益に与える影響を理解すべきである。
米国財務省に別の規定がない限り、PFICの各米国株主は、米国財務省が要求する可能性のある情報を含む年次報告書を提出しなければならない。米国の所持者が年次報告書を提出していなければ、巨額の処罰を受け、米国所持者に対する米国連邦所得税申告書の訴訟時効を延長する可能性がある。アメリカの保有者は彼らの税務顧問に問い合わせ、PFIC規則に基づいてこのような情報申告書を提出する要求を理解すべきである。
私たちはアメリカの保有者に私たちのPFIC地位とPFICルールが彼らが私たちの普通株あるいはアメリカ預託証明書に投資する影響について彼らの税務顧問に相談することを強く促します。
分与的課税
上述した“受動型外国投資会社規則”の議論によると、我々の普通株式または米国預託証明書に対する支払いの割り当ては、我々の普通株または米国預託証明書のいくつかの比例配分を除いて、通常、私たちの現在または累積された収益および利益(米国連邦所得税原則に基づいて決定された)から支払われる配当とみなされる。私たちはアメリカ連邦所得税の原則に基づいて私たちの収入と利益を計算しないかもしれないので、分配は通常配当金としてアメリカの保有者に報告されると予想されます。適用される制限により、ある非会社の米国保有者に支払われる配当金は、“合格外国会社”から得られた“合格配当金収入”に適用される優遇税率で課税される。米国以外の会社は、一般に適格な外国企業とみなされる:(I)米国との包括的な税収条約のメリットを享受する資格がある場合、米国財務長官は、この条約がこの規則について好ましいと考え、この条約は、情報交換条項(条約を含む)、または(Ii)その支払いに関する普通株式または米国預託証明書の任意の配当金を含み、これらの普通株または米国預託証明書は、いつでも米国の成熟した証券市場で取引することができる。しかし、私たちが割り当てられた納税年度または前の納税年度に米国所有者のPFICとみなされた場合、合格配当収入待遇は適用されない。配当金の額は、米国保有者の外国配当収入とみなされ、この基準に基づいて米国会社が通常得ることができる配当金控除を受ける資格がない。配当金は通常アメリカの保有者の
米国の持株者は配当金を受け取った日の収入を実際にまたは推定する。外貨で支払われた任意の配当収入の金額は、実際に受信した日の有効為替レートを参考にして計算されたドル金額であり、実際にドルに両替するか否かにかかわらず計算される。もし配当金が受け取った日にドルに両替する場合、アメリカの保有者は配当収入の外貨収益或いは損失を確認することを要求されてはならない。配当金を受け取った日にドルに両替すれば、アメリカの保有者は外貨収益や損失がある可能性があります。そのような収益または損失は、一般に、米国からの一般的な収入または損失とみなされる。現金以外の任意の財産分与(および普通株式または米国預託証明書または普通株式または米国預託証明書を比例的に割り当てるいくつかの権利を除く)の金額は、そのような財産の分与日における公平な市価である。外国の税金控除の目的で、私たちの配当金は一般的に受動的なカテゴリー収入とみなされるだろう。
普通株式及び米国預託証明書の売却又はその他の課税処分
上記の“受動型外国投資会社規則”の検討によると、我々の普通株又は米国預託証券による収益又は損失を売却又はその他の方法で処分することは資本収益又は損失となり、米国所有者が当該等の普通株又は米国預託証明書を1年以上保有している場合は、長期資本収益又は損失である。収益または損失の金額は、売却された普通株または米国預託証明書における米国所有者の納税ベースと売却された現金化金額との差額に等しく、両者ともドルで決定される。外国の税金控除の場合、このような収益または損失は、通常、米国からの収益または損失である。資本損失の控除には制限がある。
米国の保有者が受け取った対価格がドルで支払われていない場合、現金化金額は、売却または他の処分日のスポットレートに基づいて決定される支払いを受けたドル価値となる。しかしながら、普通株または米国預託証明書が“確立された証券市場”で取引されているとみなされ、米国所有者が現金制納税者または権利責任発生制納税者であり、特別な選択がなされた場合(毎年一致して適用されなければならず、米国国税局の同意なしに変更することはできない)、米国所有者は、売却決算日にスポットレートで受信された金額に換算することによって、非ドル通貨で現金化されたドル価値を決定する。米国所有者が権利責任発生制納税者であり、決済日に即時為替レートを使用して換金金額を決定する資格がない場合、米国所有者は、売却または他の処置日に現金化されたドル金額と、決済日に即時為替レートで受信した通貨のドル価値との差額範囲内で外貨損益を確認する。
情報報告とバックアップ減納
米国内またはいくつかの米国関連金融仲介機関によって支払われる配当金および販売収益は、通常、情報報告を行う必要があり、(I)米国所有者が会社または他の免除受取人でない限り、または(Ii)予備控除の場合、米国所有者は正しい納税者識別番号を提供し、予備控除の制約を受けないことを証明する可能性がある。
予備源泉徴収は付加税ではありません。米国国税局に必要な情報をタイムリーに提供すれば、米国保有者に支払われる任意の予備源泉徴収金額は、保有者としての米国連邦所得税義務の免除が許可され、払い戻しを受ける権利がある可能性がある。予備源泉徴収規則に従って任意の金額を源泉徴収する場合、米国の保有者に税務顧問に相談し、彼らの米国連邦所得税義務から返金または免除を得る可能性および手続き(あれば)を理解するように促す。
外国金融資産に関する情報
いくつかの個人(および提案された法規に従って、いくつかのエンティティ)である米国の保有者は、私たちの普通株式または米国預託証明書に関する情報の報告を要求される可能性があるが、いくつかの例外的な状況によって制限される(いくつかの米国金融機関が開設した口座に保有されている普通株式または米国預託証明書を含む)。アメリカの持株者はその保有と処分の普通株或いはアメリカ預託証明書の申告義務について税務顧問に相談しなければならない。
イギリス税務
以下の内容は,イギリス現行税法とイギリス税務及び税関総署(HMRC)が発表した米国預託証明書を持つ慣行に関する一般ガイドライン(両者とも随時変更可能であり,トレーサビリティがある可能性がある)として,今年度までに報告することを目的としている。それは法律や税務提案を構成しないし、アメリカの預託証明書を持っているすべてのイギリスの税務考慮要素に関する完全な分析でもなく、アメリカの預託証明書所有者がイギリスの免税または減免から利益を得る可能性があるすべての状況の完全な分析でもない。その執筆根拠は、同社はイギリスの土地から75%以上の適格資産価値を直接または間接的に得ることができず、税務目的で、同社は現在もイギリスの独占住民であるため、上記の“米国連邦所得税の米国保有者に対する重大な考慮”で述べない限り、イギリスの税収制度の制約を受けることになる
非連合王国住民の場合を明確に言及する以外に、本ガイドラインは、納税目的のみで連合王国に居住しており(個人に対しては、居籍または居籍とみなされ、年次待遇は適用されない)、米国預託証明書の保有に関連する任意の他の司法管轄区域に常設機関、支店、代理機関(または同等機関)または固定基地を有していない者、またはイギリス所有者に関するものである。彼らは米国預託証明書の絶対実益所有者であり(米国預託証明書は個人貯蓄口座や自己投資による個人年金保有ではない)、米国預託証明書を投資として保有している。
本ガイドは、例えば、限定される訳ではないが、いくつかのカテゴリのイギリス人所有者には適用されない場合がある
•会社に関係している人
•金融機関;
•保険会社
•慈善団体や免税組織
•集団投資計画
•退職金計画
•証券の商人、仲介者、ブローカー、取引業者
•職務または仕事によってその米国預託証明書を取得した者、または現在、またはその会社またはその任意の関連会社の高級職員または従業員であった者;
•送金をもとにイギリスで納税した個人です。
HSBCホールディングス事件とニューヨーク·メロン銀行が英国税務総局(2012年)を訴えた事件での第1級法廷(税務分廷)の裁決は、預託証明書所持者が関連株式の実益であるかどうかを疑問視した。しかし、イギリスの税務および税関総署が発表した指針によると、イギリスの税務および税関総署は米国の預託証明書の所有者を関連株式を保有する実益権益と見なすことが予想されるので、これらの段落は米国の預託証明書の所有者が関連する普通株の実益所有者であると仮定し、関連する普通株について支払われる任意の配当金(イギリスでは、配当はその人自身の収入とみなされる)の実益所有者であると仮定する。
これらの段落は、いくつかのイギリスの税務考慮要素の要約であり、一般的なガイドラインにのみ使用される。すべてのアメリカ預託証明書所有者は、米国預託証明書のそれ自体の特定の状況下での結果について、それ自体の税務顧問に意見を求めることを提案する。特に、非イギリス住民や居留者には、任意の関連二重課税協定の潜在的な影響を考慮することを提案する。
連合王国配当税
税金を前納する会社が支払った配当金は英国税で抑留されたり控除されたりしないだろう。
所得税。 イギリスの個人持株者は、彼や彼女の特定の状況に応じて、会社から得た配当金に対してイギリス税を支払うかもしれない。税務目的の場合、米国預託証明書を持っている個人がイギリスに住んでいなければ、会社から受け取った配当金についてイギリス所得税を徴収しなければならない。彼または彼女がアメリカ預託証明書が属する支店または代理機関を通じてイギリスで経営(単独または共同経営を問わず)貿易、専門または職業を問わない限り。イギリスでは、独立した代理人による取引にもいくつかの例外があり、例えば一部のマネージャーや投資マネージャーがいる。
所得税の場合、イギリスの個人所有者が私たちまたは他の源から得たすべての配当金は、そのイギリスの所有者の総収入の一部を構成し、その収入の最高部分を構成する。英国の個人所有者が2023/2024納税年度に受け取った最初の1000 GBの課税配当金収入はゼロ税率に適用される。1,000 GBの免税免税額を超える収入が基本税率、より高い税率、または付加税率税級に属するかどうかを決定する際には、ゼロ税率範囲内の収入を考慮しなければならない。免税免税額を超える配当収入(任意の所得税個人免税額があるか否かを見る)は、超過した額が基本税率税階に属する場合は8.75%で課税され、超過した額が高い税率階に属する場合は33.75%の税率で課税され、超過した額が付加税率階に属する場合は39.35%の税率で課税される。2023年4月から、毎年の免税配当手当は1000 GBに低下し、2024年4月から500 GBに引き下げられる。
会社税です。 英国住民でない米国預託証明書の会社所有者は、当該会社が米国預託証明書に所属する常設機関を介してイギリスで経営(単独でも共同経営していても)貿易を行わない限り、その会社から得た配当金についてイギリス会社税を徴収すべきではない。
イギリスの会社の保有者が会社から得たいかなる配当金もイギリス会社税を納めるべきではなく、配当金に資格があれば免除を受けることができれば、何らかの条件を満たさなければならないにもかかわらず、状況はそうでなければならない。免除条件を満たしていない場合、またはイギリスの所有者が他の方法で免除される配当金を課税することを選択した場合、イギリスの会社税は任意の配当金の金額で徴収される(利益が250,000 GBを超える会社は25%の主要税率で徴収されるか、または利益が50,000 GBまたは50,000 GB以下の企業は19%の少額利益率で徴収されるが、いくつかの基準に適合しなければならず、50,000 GBから250,000 GBの間の利益を得ることができる主要な税率はわずかに減免されなければならない)。
課税すべき収益英国資本利得税と会社所得税については、英国所有者が米国預託証明書を処分または処分するとみなされ、英国所有者の状況に応じて、任意の利用可能な免除または救済(例えば、年間免除)の制限を受け、課税収益または許容可能な損失が生じる可能性がある。
もしイギリスの個人所有者がアメリカの預託証明書を販売する際にイギリス所得税を納めなければならず、税率が高いかそれ以上であれば、現在適用されている税率は20%である。英国所得税を基本税率で納付する英国個人所有者と、このような売却について英国資本利得税を納付しなければならない個人については、現在適用されている税率は10%であるが、英国所有者の関連納税年度の他の課税所得額の合計が未使用の基本税率税級を超えるいかなる資本利益も除外されている。この場合、現在適用されている部分を超えた税率は20%になるだろう。
イギリスの会社所有者が米国預託証明書の販売(または売却とみなされる)によってイギリス会社税を支払う必要がある場合、イギリス会社税は適用される(利益が250,000 GBを超える会社は25%の主要税率で徴収されるか、または利益50,000 GBまたは50,000 GB以下の会社は19%の少額利益率で徴収され、いくつかの基準を満たす場合、50,000 GB~250,000 GBの間の企業が享受できる主要税率はわずかに減免される)。
英国住民でない米国預託証明書保持者は、通常、米国預託証明書が属する支店または代理機関(または米国預託証明書の会社所有者の場合、常設機関)を介して英国で経営されている(単独または共同経営にかかわらず)業界、専門または職業を問わない限り、米国預託証明書の課税収益について英国資本利益税または会社税を売却(または処分する)すべきではない。しかし、米国の預託証明書を持っている個人所有者が、税務目的でイギリスに5年未満住んでいなくなり、その間に米国預託証明書を処分した場合、彼または彼女はイギリスに戻る際に、任意の現金化された資本収益についてイギリス税を納付しなければならない可能性がある(任意の利用可能な免除または猶予されている)。
イギリス印紙税と印紙税備蓄税以下の議論は、我々の普通株式または米国預託証明書保持者と関連があるが、特に規則は、市業者、ブローカー、取引業者、または仲介者のような特定の人に適用可能であることに注意されたい。また、この議論の前提は、現在イギリス国会で審議されている“財政条例草案”が現在の形で制定されており、ある“財政条例草案”の条文を一時的に発効させるための措置が、このような立法が成立するまで適用され続けることであることに注意すべきである。
普通株を発行する。 発行会社の普通株はイギリス印紙税や印紙税備蓄税(SDRT)を支払う必要がない。
普通株譲渡普通株を証明書の形態で譲渡する無条件合意は、通常、譲渡支払額または価値の0.5%のレートでSDRTに課金される費用を生成する。株式購入者は特別引出権の責任を負わなければならない。普通株式を証明書形式で譲渡するには、一般に譲渡対価金額または価値の0.5%税率で印紙税が徴収されなければならない(次のGB 5.00に四捨五入)。印紙税は一般的に購入者によって支払われる。譲渡手形が押記が生成されてから6年以内に適切な印紙(印紙税または申請の適切な猶予を支払うため)された場合、またはその手形が印紙税を免除された場合、譲渡手形の押記はキャンセルされるか、または(納付された場合)償還される(一般に利息とともに)。
決済サービス機関が1986年イギリス金融法第97 A条又は第97 A条又は第97 A条に基づいて選択及び維持選択した場合を除き、業務が預託証明書の発行又は決済サービスを提供する者又はその代名人又は代理人に普通株式を譲渡する無条件合意を含む場合は、一般に譲渡対価額又は価値の1.5%の高い税率で特別印紙税を徴収しなければならない(又は譲渡が書面文書で行われた場合は印紙税となる)
選挙です。HMRCはDTCの施設を上記の目的の通関サービスと見なしており,DTCが97 A条のいずれかの選択を行っていたことは知られていない。しかしながら、普通株が決済サービスまたは預託証明システムに譲渡されて免除の条件を満たしている場合には、印紙税や特別引き出し税を支払う必要がなく、譲渡が資格に適合した融資手配過程で発生した場合、一般的にはこのような場合がある。
普通株を預託受領書システムまたは決済サービスに譲渡して支払われる任意の印紙税または特別引き出し税は、実際には、決済サービスまたは預託受領書システムの譲渡者または参加者によって支払われるのが一般的である。
アメリカ預託証明書を発行する会社がアメリカ預託証明書を発行するにはイギリス印紙税や特別引き出し権を払う必要がありません。
アメリカ預託証明書を譲渡する。 DTCの通関サービス施設による米国預託証明書のペーパーレス化譲渡はSDRTの支払いを要求すべきではなく,DTCが97 A条の選択をしていない限り,いかなる譲渡合意にも達した場合,このADSはDTCによって行われる。
米国が保有している株式を譲渡する書面は、署名して連合王国以外に残っているものであれば、実際にイギリス印紙税を納める必要はない。上記条件を満たしていない場合には、米国預託株式の譲渡又は譲渡協定は、具体的な状況に応じて、対価金額又は価値の0.5%に応じて徴収されるイギリス印紙税を徴収する可能性がある。印紙税を支払う必要があれば、利息と罰金も払わなければならないかもしれません。
F.配当金と支払代理人
適用されません。
G.専門家の発言
適用されません。
H.展示された書類
我々は,外国民間発行者に適用される“取引法”の情報報告要求を遵守し,これらの要求に応じて,米国証券取引委員会に報告書を提出する。これらの報告書は下記の場所で無料で閲覧できます。外国個人発行者としては、取引法第16条に記載されている報告書及び短期運転利益回収条項の制約を受けず、我々の高級管理者、取締役及び主要株主も、“取引法”第16条に記載されている報告書及び短期運転利益回収条項の制約を受けない。また、取引法によれば、取引法に基づいて証券を登録している米国の会社のように、定期的な報告書や財務諸表を米国証券取引委員会に頻繁またはタイムリーに提出する必要はない。しかしながら、審査·報告された財務諸表と、独立公認会計士事務所が表明した意見とを含むForm 20−F年次報告書を米国証券取引委員会に提出していく。
私たちはウェブサイトを維持していますウェブサイトはwww.exScience a.aiです私たちはアメリカ証券取引委員会に届出をした後、すぐに私たちのウェブサイトで私たちの年間報告書を発表するつもりです。本年度報告には,本サイトに含まれる情報や本サイトで取得可能な情報は含まれていない.私たちはこの年間報告書に私たちのウェブサイトのアドレスを含めて、ただ非アクティブなテキストとして参考にしている。
米国証券取引委員会は、ExScience a plcのような登録者に関する他の情報を電子的に米国証券取引委員会に提出する報告書、依頼書、情報声明、および登録者に関する他の情報を含むウェブサイト(www.sec.gov)を維持する。
本年度報告書で当社の任意の契約または他の文書について言及することについては、このような参照は必ずしも完全ではなく、実際の契約または文書のコピーを取得するために、本年度報告に添付されているか、または本年度報告に組み込まれた証拠物を参照しなければならない。
一、付属情報
適用されません。
プロジェクト11.市場リスクに関する定量的かつ定性的開示
私たちは金利、通貨、信用、そして流動性の危険に直面している。私たちの実行委員会はこのような危険の管理を監視する。
金利リスク私たちの金利変化のリスクに対する開放は預金投資と関連がある。一般的な金利水準の変化は、これらの投資の公正価値の増加または減少をもたらす可能性がある。我々が2023年12月31日に計算した現金および現金等価物を用いて計算すると、すべての他の変数が不変のままである場合、金利が1%変化すると利益と持分が100万GB増加または減少すると仮定する。
財務状況表に表示されている負債については、私たちは現在金利リスクの影響を受けていない。
通貨リスクです外貨リスクとは、金融商品の公正価値或いは未来の現金フローが外国為替レートの変化によって変動するリスクである。私たちのアメリカと日本での業務を除いて、私たちが直面している外貨変化のリスクは主にポンド以外の通貨で価格を計算する現金と現金等価物、アウトソーシングサプライヤー協定に関連しています。
2023年12月31日現在、現金、現金等価物、短期銀行預金はそれぞれ3.63億GBと5.058億GBである2022それぞれ分析を行った。2023年12月31日まで、私たちの約すべての現金と現金等価物はイギリスで持っています。その中で78%はポンドで、21%はドルで、1%はユーロで計算されます。そのため、2022年12月31日現在、この割合はそれぞれ85%、13%、2%である。
2023年12月31日までの年間で、ポンド/ドルとポンド/ユーロの為替レートに10%の変化が生じたと仮定すると、それぞれ私たちの税引前総合損失に900万GBと360万GBの影響を与え、株主権益にそれぞれ910万GBと360万GBの影響を与える。他のすべての通貨については、為替レートが上記のいずれの期間に10%変動しても、私たちの総合財務諸表に大きな影響を与えないと仮定します。
2022年12月31日までの年間で、ポンド/ドルとポンド/ユーロの為替レートが10%変化したと仮定すると、それぞれ私たちの総合税引前損失に630万GBと20万GBの影響を与え、それぞれ株主権益に610万GBと460万GBの影響を与える。他のすべての通貨については、為替レートが上記のいずれの期間に10%変動しても、私たちの総合財務諸表に大きな影響を与えないと仮定します。
私たちはポンドとドルの現金と短期銀行預金を同時に持っていて、予想される運営現金需要を満たし、為替変動が私たちの運営に与える影響を制限することを目的としています。
信用リスク私たちの経営活動は信用リスクに直面しており、主に売掛金、銀行と金融機関が持っている現金、現金等価物、預金です。私たちの現金、現金等価物、預金はイギリス、アメリカ合衆国、オーストリアと日本の5つの異なる銀行と金融機関の口座に保管されています。私どもの売掛金は、私どもの顧客群の中で限られた数の会社が売掛金を不足している信用リスクの集中にも影響を受ける可能性があります。しかし、私たちのパートナーは通常大手製薬会社の信用品質であるため、私たちの信用損失への開放は低い。
流動性リスク私たちは資金不足の危険を監視し続けている。私たちの目標は増資と協力協定を実行することで、資金の連続性と柔軟性の間でバランスを保つことだ。私たちの財務諸表は持続的な経営に基づいて作成された。
第12項.持分証券を除く証券説明
A.債務証券
適用されません。
B.株式証明書と権利
適用されません。
C.その他の証券
適用されません。
D.アメリカ預託株式
シティバンクやシティバンクは私たちの普通株を代表するアメリカ預託証明書の保管人です。シティバンクの預かり事務所はニューヨークグリニッジ街388番地にあり、郵便番号:10013。米国預託証明書は信託機関に保管されている証券の所有権権益を代表する。米国の預託証明書は、米国の預託証明書またはADRと一般的に呼ばれる証明書によって表すことができる。預かり人は通常、保管されている証券を保管するために預かり人を指定します。この場合、預かり人はシティバンク、N.A.(ロンドン)で、シティグループの中心、カナリア埠頭、ロンドン、E 145ポンド、イギリスにあります。
預金協定によると、私たちはシティバンクを信託銀行として指定した。保証金プロトコルのフォーマットは、米国証券取引委員会のF-6表登録声明の表紙の下にアーカイブされる。アメリカ証券取引委員会のウェブサイト(www.sec.gov)から預金プロトコルのコピーを得ることができます。このコピーを検索する場合は、登録番号333-259724を参照してください。
料金と料金です預金契約の条項によると、私たちのアメリカ預託証明書所持者は以下の費用を支払うことを要求されます
| | | | | |
| サービス.サービス | 料金を取る |
| 米国預託証券の発行(例えば、米国預託株式(S)は、普通株払込又は米国預託株式(S)と普通株式比率の変化、又はその他の理由により発行される)、普通株分配により発行された米国預託株式を含まない | アメリカの預託株式1匹当たり最高$0.05 |
| 米国預託証券の解約(例えば、米国預託株式の引渡しまたは米国預託株式(S)と普通株式比率の変化、またはその他の理由で米国預託証明書を解約する) | 米国預託株式1件につき最高0.05ドルを廃止 |
| 現金配当金または他の現金分配(例えば、権利および他の権利を売却する場合) | 保有するアメリカ預託株式は最高$0.05を得ることができます |
| (I)株式配当金又はその他の分配、又は(Ii)追加の米国預託証明書を購入する権利を行使して米国預託証明書を分配する | 保有するアメリカ預託株式は最高$0.05を得ることができます |
| 米国預託証券以外の証券を流通したり、追加の米国預託証明書を購入する権利(例えば、分割時) | 保有するアメリカ預託株式は最高$0.05を得ることができます |
| アメリカ預託株式サービス | 信託銀行に設立された適用記録日(S)に保有する米国預託株式は、最高0.05ドルに達する |
| 米国預託株式譲渡登録(例えば、米国預託証明書名義変更登録の場合、米国預託証明書がDTCに移行した場合、その逆、または他の任意の理由) | アメリカ預託株式の送金は0.05ドルに達しました |
| 一連の米国預託証明書を別の一連の米国預託証明書に変換する(例えば、権利の一部の米国預託証明書を全ての権利米国預託証明書に変換するか、または制限された米国預託証明書を自由に譲渡可能な米国預託証明書に変換するか、その逆も同様である) | 転換後のアメリカ預託株式は最大0.05ドルです |
アメリカの預託証明書所持者は、例えば、いくつかの費用を支払う責任があります
•税金(適用される利息と罰金を含む)と他の政府の料金;
•普通株式は、株式登録簿に登録する際に時々受け取ることができる登録料であり、普通株の預け入れおよび引き出し時にそれぞれ係、受託者、または任意の代有名人の名義で譲渡することに適用される
•いくつかの電報、電送、およびファックスの送信および交付費用
•口座開設銀行および/またはサービス提供者(口座開設銀行の支店、支店または付属機関であってもよい)が外貨を両替する手数料、支出、利益、税費、およびその他の費用;
•口座開設銀行が普通株式、アメリカ預託証明書とアメリカ預託証明書に適用される外国為替規制条例とその他の監督管理要求を遵守するために発生する合理的かつ慣用的な自己負担費用;
•口座開設銀行、委託者、またはADR計画に関連する任意の費用、料金、コスト、および支出。
米国預託株式の手数料及び料金は、(I)米国預託証明書の発行及び(Ii)米国預託証明書の解約により、米国預託株式を発行された者(例えば、米国預託株式に属する)及びその米国預託証明書が抹消された者(例えば、米国預託株式の抹消)から徴収される。米国預託証明書がホスト銀行から預託証明書に発行される場合、米国預託株式の発行およびログアウト手数料は、預託証明書による分配から差し引くことができ、状況に応じて利益者(S)を代表して、発行中の米国預託証明書を受信した預託証明書参加者(S)またはログアウトされた預託証明書参加者(S)に受け取り、預託証明書参加者(S)がその時点で有効な預託証明書参加者(S)の手続きおよび慣例に従って適用される実益所有者(S)の口座に計上することができる。米国預託株式の流通に関する費用と料金及び米国預託株式サービス料は適用される米国預託株式記録日から保有者から徴収される。現金を配布する場合には,適用される米国預託株式手数料と手数料は配布された資金から差し引かれる。(I)非現金の配布および(Ii)米国預託株式サービス料であれば、米国預託株式記録日までの所持者は、米国預託株式発行者への配布から差し引くことができる米国預託株式費用および有料領収書を受け取る。DTCを通じて保有する米国預託証明書については、非現金で発行された米国預託株式手数料と米国預託株式手数料はDTCによる配布から差し引くことができ、DTCが規定する手続きとやり方に従ってDTC参加者に受け取ることができ、DTC参加者はさらにADSを持つ受益者にこのような米国預託株式費用と手数料を受け取ることができる。(I)米国預託株式譲渡を登録する場合、米国預託株式譲渡料は、ADSを譲り受けた米国預託株式保有者または譲渡者によって支払われ、(Ii)一連のADSを別の一連のADSに変換し、米国預託株式譲渡料は、ADSに変換された所有者または変換ADSを受けた者によって支払われる。
受託費用の支払いを拒否した場合、受託者は、信託契約の条項に従って、支払いを受信する前に要求されたサービスを拒否することができ、または米国預託株式所有者への任意の分配から、ホスト費用および課金の金額を相殺することができる。
所持者が請求される可能性のある料金や料金は、時間とともに変化する可能性があり、私たちや信託機関によって変更される可能性があることに注意してください。所持者はこのような変更の事前通知を受け取る.受託者は,吾等と係の者が時々合意した条項や条件に基づいて,ADSSについて徴収した一部の米国預託株式費用やその他の方法を提供することで,吾などのADSによる何らかの費用を返済することができる。
第II部
プロジェクト13.配当金の滞納および配当金の滞納
適用されません
項目14.保持者の権利を保証するための実質的な修正および収益の使用
E.収益の使用
2021年10月、私たちはアメリカで初の公募株を完成させた。米国証券取引委員会が2021年9月30日に発効を発表したF-1表登録声明(第333-259431号文書)とF-6表登録声明(第333-259724号文書)によると、普通株式は改正された1933年の証券法に基づいて登録されている。
プロジェクト15.制御とプログラム
A.制御とプログラムの開示
我々は、取引法第13 a-15(E)および15 d-15(E)条の規則で定義されている“開示制御および手順”を維持し、取引法に従って提出または提出された報告書で開示を要求する情報が、米国証券取引委員会の規則および表に規定されている期間内に記録、処理、集約および報告されることを確実にすることを目的としている。開示制御及び手続は、我々が“取引所法案”に基づいて提出又は提出した報告書に開示を要求する情報が蓄積され、我々の最高経営者(最高経営責任者)及び最高財務官(最高財務官)を含む管理層に伝達されることを保証することを目的としているが、開示要求に関する決定をタイムリーに行うために、制御及び手続に限定されない
我々の最高経営責任者および最高財務責任者は、2023年12月31日現在の取引所法案規則13 a-15(E)および15 d-15(E)で定義されているような開示制御および手順の有効性を評価した後、その日までに、私たちの開示制御および手続きは合理的な保証レベルでは有効ではないと結論した。
B.経営陣財務報告内部統制年次報告
我々の経営陣は、財務報告書の十分な内部統制の確立と維持を担当しており、この用語は“取引法”第13 a-15(F)条に定義されている。財務報告の内部統制は私たちの最高経営責任者と最高財務官によって設計または監督され、私たちの取締役会、管理層、その他の人員によって実施されるプログラムであり、国際会計基準委員会(IASB)が発表したIFRS会計基準に基づいて財務報告の信頼性と外部目的で財務諸表を作成するために合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また、将来の内部制御の有効性のいずれの評価予測も、条件の変化により制御が不十分になったり、政策やプログラムの遵守度が悪化したりする可能性がある。
私たちの経営陣は、臨時最高経営責任者と最高財務官を含み、テレデビル委員会(COSO)協賛組織委員会が発表した内部統制-総合枠組み(2013)に記載されている基準に基づいて、2023年12月31日までの財務報告内部統制の有効性を評価し、この評価に基づいて、2023年12月31日現在、財務報告の内部統制は有効ではなく、財務報告の信頼性や国際会計基準委員会が発表したIFRSによる外部財務諸表作成に合理的な保証を提供できないと結論した
我々の重大な欠陥と救済作業についての詳細は、参照されたい項目5.経営と財務結果
C.公認会計士事務所の認証報告
本年度報告には会社公認会計士事務所の認証報告は含まれておらず,米国証券取引委員会規則が新興成長型会社に過渡期を設定しているためである。
D.財務報告内部統制の変化
2022年12月31日までの財政年度のForm 20−F年度報告で報告されているように、我々の経営陣は、財務報告制御における大きな弱点を発見しており、これは、全期間にわたって有効なプロセスや制御が不足していることに関連しており、財務諸表の作成に重要な情報システムに対して有効な情報技術の一般的な制御を実施し、維持している。
財務報告書の内部統制の変化の一部として、2023年12月31日までの年次報告日までに、財務報告や内部統制チームに数人の経験豊富な人員を招聘し、外部コンサルタントを招いてこれらの重大な弱点を解決するための救済計画を実施しました。参照してください“プロジェクト5.E--重要材料会計政策と重大な判断と推定−財務報告の内部統制“より多くの情報を得るために。
上記の変動を除いて、2023年12月31日までの年度内に、吾らは財務報告の内部統制に他の重大な影響や合理的に重大な影響を及ぼす可能性がある財務報告の内部統制の変動は発生していない(この語の定義は取引法第13 a-15(F)及び15 d-15(F)条参照)。
プロジェクト16 A。監査委員会財務専門家
私たちの監査委員会はエリザベス·クライン、ロバート·ゲンチェフ、フランジスカ·ミシェルで構成されている。監査委員会は完全に財務知識に通じた取締役会のメンバーで構成されており、クレインさんはアメリカ証券取引委員会規則を適用して定義された“監査委員会財務専門家”とみなされ、ナスダック規則を適用して定義された必要な財務経験を備えている。我々の取締役会は、監査委員会のすべてのメンバーが取引所法案規則10 A-3に規定されている“独立性”の要件に適合していることを決定した
プロジェクト16 B。道徳的規則
私たちのビジネス行為と道徳基準は私たちのすべての従業員、高級管理者、役員に適用され、私たちのウェブサイトで得ることができます。サイトはHttps://investors.excia.ai/コーポレート/ガバナンス-Documents/それは.私たちは、本規則の任意の修正またはその要求に対するいかなる免除も、私たちのウェブサイトで開示されると予想している。当サイトに含まれている情報や当サイトを介してアクセスできる情報は、引用的に本年度報告書に組み込まれることはありません。私たちのサイト上の情報は、本年度報告の一部とみなされてはなりません
プロジェクト16 Cです。チーフ会計士費用とサービス
監査役の名前:普華永道会計士事務所*監査役PCAOB ID-876
監査役位置:レイデン、イギリス
普華永道は2019年から独立公認会計士を務めており、2023年12月31日と2022年12月31日までの総合財務諸表を監査しています。
次の表は、2023年12月31日と2022年12月31日までの財政年度に徴収された専門サービス費用の総額を示しています
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| (単位:千) |
| 料金を審査する | £1,179 | | £707 |
| 監査関連費用 | £198 | | £225 |
| 税金.税金 | — | | | — | |
| その他の費用 | — | | | — | |
| 合計する | £1,377 | | £932 |
“監査費用”とは、当社の年度財務諸表を監査するために徴収される費用総額をいう。このカテゴリはまた、米国証券取引委員会に提出された文書の同意、協力、および審査のような、普華永道によって提供されるサービスを含む
“監査関連費用”とは、監査業績に関する合理的な保証及び関連サービスの総費用を意味し、我々の公開発行に係る費用を含み、監査費用の項の下で報告されない
“税料”とは、普華永道会計士事務所が税務コンプライアンス、税務相談と税務計画関連サービスに提供する専門サービスのために徴収する総費用を指す
“その他の費用”とは、普華永道会計士事務所が提供する製品やサービスに対して徴収される任意の追加料金を意味する
2023年12月31日または2022年12月31日までの会計年度では、“税金”または“その他の費用”は発行または支払われていない
我々の監査委員会は、我々に関連する監査サービスの範囲及びコスト、並びに独立監査人が提供する許容可能な非監査サービスを審査及び事前承認しているが、監査委員会が監査完了前に承認した最低限のサービスを除外する。過去2会計年度、普華永道会計士事務所が提供したすべてのわが社関連サービスは監査委員会の承認を得た
プロジェクト16 Dです。監査委員会の上場基準の免除
適用されません
プロジェクト16 E。発行者および関連購入者が株式証券を購入する
適用されません
プロジェクト16 Fです。登録者の認証会計士を変更する
適用されません
プロジェクト16 Gです。会社の管理
米国証券取引委員会で定義されている“海外個人発行者”として、ナスダック世界選りすぐり株式市場やナスダックの国内発行者に対する他の要求ではなく、イングランドとウェールズのいくつかの会社統治実践に従うことが許可されているが、私たちは外国の個人発行者に適用されるナスダック社管理規則に従うつもりだ。大多数のナスダック社のガバナンス規則を自発的に遵守することが予想されるが、以下の限られた免除を利用することを選択する可能性がある
•特定の重大な事件が発生した場合、監査されていない財務および他の指定された資料を記載したテーブル10-Qの四半期報告またはグリッド8-Kの現在の報告書の提出を免除する
•第16条規則の制約を受けず、この規則は、内部者がその証券所有権および取引活動について公開報告書を提出し、内部者が短時間で取引から利益を得る責任を規定することを要求する
•免除は、免除役員および役員商業行動基準および道徳基準の任意の決定を4営業日以内に開示することを要求する国内発行者に適用されるナスダック規則を遵守する
•株主が株式オプション計画を承認することを含む、特定の証券発行が株主の承認を得なければならない要求を免除する
•私たちの監査委員会は、表格20-F 7.B項で定義されているように、すべての“関連者取引”に対して審査と監督責任の要求を免除する
•完全に独立した取締役会で構成され、その委員会の目的と責任を説明する書面規約がある報酬委員会の要求を免除する
•以下の要求に制限されない:取締役の被指名者は、我々の取締役会によって選択または推薦されるか、または(1)我々の取締役会の独立取締役の多数を占める独立取締役の投票によって選択されるか、または(2)完全に独立取締役からなる委員会によって選択または推薦され、正式な書面規約または取締役会決議によって決定されなければならない(場合によって決定される)
また、ナスダック第5615条(A)(3)条には、ナスダック第5600シリーズ及び第5250条のいくつかの規則の代わりに、ナスダックの非規則通知要件(第5625条)、投票権要件(第5640条)を遵守していることを前提として、我々のような外国民間発行者は、自国の企業統治慣行に依存することができると規定されている
規則5605(C)(3)に適合する監査委員会があり、会議の委員会メンバーで構成されている
ルール5605(C)(2)(A)(2)(2)の独立性要件。多くのナスダックのコーポレートガバナンス規則の代わりに、イギリスの要求に適合したいくつかのコーポレートガバナンス規則に従うことが許可されているにもかかわらず、私たちは外国の個人発行者に適用されるナスダック社ガバナンス規則を遵守するつもりだ。
したがって、私たちの株主はナスダックのすべての会社の管理要求に制約された会社の株主と同じ保護を受けないだろう。私たちが外国の個人発行者の資格を持ち続ける限り、私たちはこの免除を利用することができる
16 H項です。炭鉱安全情報開示
適用されません
プロジェクト16 I。検査妨害に関する外国司法管区の開示
適用されません
プロジェクト16 Jです。インサイダー取引政策
我々は役員、高級管理者、従業員の購入、販売および/または他の処分普通株に対してインサイダー取引政策とプログラムを採用し、インサイダー取引法律、規則と法規、およびナスダック上場基準の遵守を促進することを目的とした
プロジェクト16 Kです。ネットワーク·セキュリティ
リスク管理と戦略
我々は、以下のネットワークセキュリティ脅威の重大なリスクを識別、評価、管理するために、様々な情報セキュリティプロセスを実施し、維持した:我々のキーコンピュータネットワーク、第三者ホストサービス、通信システム、ハードウェアおよびソフトウェア、および知的財産権、独自、戦略または競争性を有する機密情報、商業秘密、私たちが収集可能な臨床試験に関連する試験参加者データ、敏感な第三者データ、業務計画、取引および財務情報を含み、総称して情報システムとデータと呼ばれる当社のキーデータを実施し、維持した
私たちのネットワークセキュリティ機能部分には、私たちの最高情報官(CIO)、私たちの情報セキュリティおよび全体情報セキュリティ機能担当者、および私たちの法律部門とリスク管理チームが含まれており、私たちのネットワークセキュリティ脅威とリスクを識別、評価、管理するのに役立ちます。我々のネットワークセキュリティ機能は、手動ツール、内部または外部監査、自動化ツール、ネットワークセキュリティ脅威および脅威行為者を識別する報告およびサービス、脅威評価およびスキャン内部および外部脅威、すべての第三者のネットワーク評価、外部情報供給、脆弱性評価、第三者による赤/青チームテストおよびデスクトップイベント対応演習、セキュリティ分析専門第三者管理を備えたセキュリティ運営センター、および法執行部門との脅威の調整を含む様々な方法を使用して、私たちの脅威環境を監視および評価することによって、ネットワークセキュリティ脅威からのリスクを識別および評価する。
環境によっては、例えば、イベント検出と応答、ネットワークイベント応答計画、災害復旧計画、サプライヤーリスク管理計画、従業員訓練、データ暗号化、アクセス制御、物理セキュリティ、ネットワークセキュリティ制御、浸透テスト、専門のネットワークセキュリティ従業員、第三者管理のセキュリティ運営センター、専門の専門家セキュリティアナリスト、リスク評価、セキュリティ基準/認証の実施、データ隔離、システム監視、ネットワーク保険および資産管理、追跡および処置を含む、ネットワークセキュリティ脅威が私たちの情報システムおよびデータに及ぼす重大なリスクを管理および低減するために、様々な技術、物理的および組織的措置およびプロセスを実施し、維持する
ネットワークセキュリティ脅威の重大なリスクの評価と管理は、私たちの全体的なリスク管理プロセスに組み込まれている。例えば、ネットワークセキュリティ機能部門は、我々の管理層と協力して、リスク管理プロセスの優先順位を決定し、より我々の業務に実質的な影響を与える可能性のあるネットワークセキュリティ脅威を緩和する
我々は、専門サービス会社(法律顧問を含む)、脅威インテルサービスプロバイダ、ネットワークセキュリティソフトウェア提供業者、ネットワークセキュリティコンサルタント、ホスト·ネットワークセキュリティサービスプロバイダ、ペンテスト会社、暗ネットワーク監視サービス、および法医学調査者を含むネットワークセキュリティ脅威からの重大なリスクを時々識別、評価、管理するのを助けるために第三者サービスプロバイダを使用する。また、ホスト会社、アプリケーション提供者、契約研究組織、サプライチェーン資源、流通業者、および契約製造組織など、第三者サービスプロバイダを使用して業務全体で様々な機能を実行する。我々は,あるプロバイダに対して監査やリスク評価を行い,サービスプロバイダに関連する脆弱性スキャンを行い,サービスプロバイダのセキュリティ担当者との対話を行い,契約義務をサービスプロバイダに課し,要求と分析(A)セキュリティアンケートの回答,(B)プロバイダの書面情報セキュリティ計画および(C)サービスプロバイダに関する報告および認証を行うことで,これらのプロバイダを使用することに関連するネットワークセキュリティリスクを管理する
我々に大きな影響を与える可能性のあるネットワークセキュリティ脅威のリスク記述と,それらがどのようにできるかについては,参照されたいプロジェクト3.d--リスク要因“タイトルのリスク要因も含めて”私たちの内部情報技術システムまたは私たちの第三者サプライヤー、請負業者またはコンサルタントのシステムは、規制調査または行動に限定されないが、訴訟、罰金および処罰、私たちの業務運営の中断、名声損害、収入または利益損失、顧客または販売損失、および他の不利な結果を含む任意のこのような事件による不利な結果をもたらす可能性があるが、訴訟、罰金および処罰、セキュリティホール、データ損失または漏洩、および他の中断を受ける可能性があります.”
統治する
私たちの取締役会は私たちのネットワークセキュリティリスク管理をその一般的な監督機能の一部としている。監査委員会は、ネットワークセキュリティ脅威からのリスクを監督し、緩和することを含む、我々のネットワークセキュリティリスク管理プロセスを監督する責任がある。
我々のネットワークセキュリティリスク評価および管理プロセスは、20年以上のIT経験を有するチーフ情報官と、20年以上のIT業界経験を有する情報セキュリティ担当者とを含むいくつかの管理層メンバーによって実施·維持されており、そのうち15人がネットワークセキュリティに従事している
私たちの首席情報官は予算を承認し、サイバーセキュリティ事件への対応を支援し、ネットワークセキュリティプロセスを承認し、セキュリティ評価や他のセキュリティに関する報告書を審査します。我々の情報セキュリティ担当者は,適切な人員の募集を担当し,ネットワークセキュリティリスク考慮を我々の全体的なリスク管理戦略に取り入れ,関係者に重要な優先事項を伝達することを支援している
我々のネットワークセキュリティイベントに対する応答プロセスは、状況に応じてCIOを含むいくつかのイベントを管理層メンバーに報告することを目的としている。私たちのCIOと情報セキュリティ担当者は、私たちのイベント応答チームの他のメンバーと協力して、通知を受けたネットワークセキュリティイベントを緩和し、修復するのを助けてくれます。しかも、私たちのイベント応答政策は監査委員会に特定のサイバーセキュリティ事件を報告することを含む。
私たちの監査委員会はまた、私たちのサイバーセキュリティ機能部門から、私たちの重大なサイバーセキュリティ脅威とリスクと、これらの脅威とリスクに対応するために実施された私たちの手続きに関する報告を定期的に受けています。監査委員会はまた、ネットワークセキュリティ脅威、リスク、緩和に関連する様々な報告書、要約、または紹介を調べることができる。
第三部
プロジェクト17.財務諸表
以下の規定に基づいて財務諸表を提供することを選択しました第十八項
プロジェクト18.財務諸表
参照してくださいF-1からF-58ページこの年間報告書です
プロジェクト19.展示品 | | | | | | | | | | | | | | | | | |
| | 引用で法団として成立する |
| 展示品番号 | 展示品説明 | 別表/表 | 書類番号 | 展示品 | 書類の日付 |
| 1.1 | 会社の定款。 | F-1/A | 333-259431 | 3.2 | 2021年9月17日 |
| 2.2 | 預金協定。 | F-1/A | 333-259431 | 4.1 | 2021年9月17日 |
| 2.3 | 米国預託証明書表(添付ファイル4.1に掲載)。 | F-1/A | 333-259431 | 4.2 | 2021年9月17日 |
2.4* | 株本及び会社定款説明 | | | | |
2.5* | アメリカ預託株式の概要 | | | | |
| 4.1 | 2021年8月10日に引受人、非投資株主およびそのマネージャーがExScience a Limitedと締結したExScience a Limited(当時はExScience a Holdings Limited)に関する株主合意。 | F-1 | 333-259431 | 10.1 | 2021年9月10日 |
4.2+ | 雇用協定は,2021年9月24日にアンドルー·ホプキンス社とExScience a AI株式会社が締結し,両者の間で締結された。 | F-1 | 333-259431 | 10.2 | 2021年9月10日 |
4.3+ | 雇用協定は,2021年9月24日にBen TaylorとExScience a AI Limitedが署名した。 | F-1 | 333-259431 | 10.3 | 2021年9月10日 |
4.4† | 特許譲渡協定は、2019年10月1日に、ダンディ大学とExScience a AI Limited(当時ExScience a Limitedと命名された)によって署名された。 | F-1 | 333-259431 | 10.5 | 2021年9月10日 |
4.6† | 研究協力とライセンスオプション協定は、2016年6月27日にセノフィ社とExScience a AI Limited(当時ExScience a Limitedと命名された)によって署名された。 | F-1/A | 333-259431 | 10.7 | 2021年9月17日 |
4.7† | 協力と許可協定は、日付は2021年5月3日で、百時美施貴宝社とExScience a AI Limited(当時はExScience a Limited)によって署名された。 | F-1/A | 333-259431 | 10.8 | 2021年9月17日 |
4.8 | 登録者とビルとメリンダ·ゲイツ財団との引受協定は、2021年9月1日となっている。 | F-1 | 333-259431 | 10.10 | 2021年9月10日 |
4.9† | 登録者とビルとメリンダ·ゲイツ財団との間のグローバル参入約束協定は、2021年9月1日である。 | F-1/A | 333-259431 | 10.12 | 2021年9月27日 |
4.10 | 登録者と権利保持者との間の登録権協定フォーマット。 | F-1/A | 333-259431 | 10.13 | 2021年9月27日 |
4.11 | オックスフォードテムズ川のほとりサンドフォードオックスフォード科学学園シュレーディンガービルの地下部分に関する賃貸契約は、ExScience a AI Limited(当時Ex Science a Limitedと命名された)とオックスフォード科学学園有限公司が締結し、レンタル期間は2018年7月27日である。 | F-1 | 333-259431 | 10.11 | 2021年9月10日 |
4.12 | 2018年4月11日にFuel 3 D Technologies Limitedとオックスフォード科学学園有限公司が締結したオックスフォード科学園に関するテムズ川のほとりサンフォードにあるシュレーディンガービル3階の賃貸契約。 | F-1 | 333-259431 | 10.12 | 2021年9月10日 |
4.13 | MEPCミルトン公園1号有限会社,MEPCミルトン公園2号有限会社とExScience a AI Limited(当時ExScience a Limitedと命名された)との間のリースは,2021年7月13日から発効した。 | F-1 | 333-259431 | 10.13 | 2021年9月10日 |
4.14 | Allcell GmbHとウィーン獣医大学との転貸は,2018年2月6日であった。 | F-1 | 333-259431 | 10.14 | 2021年9月10日 |
4.15 | HG 3 Beteiligungsverwaltung GmbH&Co KGとAlphaexScience a Beteiligungs GmbH間のレンタル契約は、2021年9月3日から発効する。 | F-1 | 333-259431 | 10.15 | 2021年9月10日 |
4.16 | HG 3 Beteiligungsverwaltung GmbH&Co KGとAlphaexScience a Beteiligungs GmbH間のレンタル契約は、2021年9月3日から発効する。 | F-1 | 333-259431 | 10.16 | 2021年9月10日 |
4.17†# | セノフィとExScience a AI Limited間の連携と許可協定は、2022年1月4日から発効する。 | 20-F | 001-40850 | 4.20 | 2023年3月23日 |
4.18†# | “セノフィとExScience a AI Limitedとの連携とライセンス契約第1修正案”は、2023年1月30日から発効する | 20-F | 001-40850 | 4.21 | 2023年3月23日 |
| | | | | | | | | | | | | | | | | |
| | 引用で法団として成立する |
| 展示品番号 | 展示品説明 | 別表/表 | 書類番号 | 展示品 | 書類の日付 |
4.19†# | セノフィとExScience a AI Limited間の協力と許可協定第2修正案は、2023年7月26日から発効する | 6-K | 001-40850 | 99.4 | 2023年8月10日 |
4.20*†# | セノフィとExScience a AI Limited間の協力と許可協定第3改正案は、2023年12月20日から発効する。 | | | | |
4.21*†# | 研究協力協定は、期日は2023年9月19日であり、メルク医療保健KGaAとExScience a AI有限会社が署名した。 | | | | |
4.22*+ | ExScience AI株式会社とDavid·ハレットが2021年9月26日に締結した雇用契約. | | | | |
4.23 | 登録者とその各役員との間の弁済証文形式。 | F-1/A | 333-259431 | 10.17 | 2021年9月17日 |
4.24 | 登録者とその各行政官との間の弁済証文形式。 | F-1/A | 333-259431 | 10.18 | 2021年9月17日 |
4.25+ | 非従業員サブ計画とCSOPサブ計画を含むExScience a Plc 2021持分インセンティブ計画。 | F-1 | 333-259431 | 10.19 | 2021年9月10日 |
4.26+ | 未承認株式オプション計画とRSUサブ計画。 | F-1 | 333-259431 | 10.20 | 2021年9月10日 |
4.27+ | ExScience a社の株式オプション計画。 | F-1 | 333-259431 | 10.21 | 2021年9月10日 |
4.28+ | 企業管理インセンティブ計画。 | F-1 | 333-259431 | 10.22 | 2021年9月10日 |
8.1* | 登録者の子会社。 | | | | |
| 12.1* | 首席執行幹事2002年“サバンズ·オキシリー法”第302条に基づく証券取引法第13 a−14(A)及び15 d−14(A)条の証明 | | | | |
| 12.2* | 2002年サバンズ·オキシリー法第302節で可決された証券取引法第13 a−14(A)及び15 d−14(A)条に基づく首席財務官の証明 | | | | |
| 13.1** | 特等執行幹事及び首席財務幹事は、米国法典第18編第1350条の規定に基づき、2002年“サバンズ-オキシリー法案”第906節で可決された証明に基づいている | | | | |
| 15.1* | 登録者の独立公認会計士事務所普華永道会計士事務所の同意 | | | | |
| 97.1* | 奨励的補償政策 | | | | |
| 101.INS* | 相互接続されたXBRLインスタンス文書(このインスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルには現れない) | | | | |
| 101.Sch* | イントラネットXBRL分類拡張アーキテクチャ文書 | | | | |
| 101.カール* | インラインXBRL分類拡張計算リンクライブラリ文書 | | | | |
| 101.定義* | インラインXBRL分類拡張Linkbase文書を定義する | | | | |
| 101.実験所* | XBRL分類拡張ラベルLinkbase文書を連結する | | | | |
| 101.前期* | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント | | | | |
| 104 | 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) | | | | |
*アーカイブをお送りします。
**関数で提供されます。+管理契約または任意の補償計画、契約、またはスケジュールを示します
表示によると、本展示品のいくつかの部分は省略されます。それらは実質的ではないので、そうかもしれません
もし開示されたら、彼らは登録者になるだろう
#:S-K条例第601(A)(5)項によれば、一部の展示品及び付表は省略されている。登録者はこれによりお知らせします
証券及び先物事務監察委員会の要求に基づいて、証券会社は、任意の漏れた証拠物又はスケジュールのコピーを提供することを承諾する
彼はアメリカ取引委員会のメンバーです
サイン
登録者は、それが20-F表を提出するすべての要件に適合していることを証明し、本年度報告書に署名するために以下の署名者を正式に手配し、許可した
| | | | | | | | | | | |
| | |
| EXSCIENTIA PLC |
| | |
日付:2024年3月21日 | 差出人: | 寄稿S/David·ハレット |
| 名前: | デイビッド·ハレット博士 |
| タイトル: | 臨時行政総裁 |
連結財務諸表索引
| | | | | |
| ページ |
| 独立公認会計士事務所レポート(PCAOB ID:876) | F-2 |
統合損失表とその他の包括損失表 | F-3 |
総合財務状況表 | F-4 |
総合権益変動表 | F-6 |
統合現金フロー表 | F-8 |
財務諸表付記 | F-10 |
独立公認会計士事務所報告
ExScience a Plc取締役会と株主へ
財務諸表のいくつかの見方
本監査人は添付のExScience a Plc及びその付属会社(“貴社”)が2023年12月31日及び2022年12月31日までの総合財務状況表、及び2023年12月31日までの3年度の各年度の関連総合損失及びその他の全面(損失)/収益、権益及び現金流量変動表を審査し、関連付記(総称して“総合財務諸表”と呼ぶ)を含む。総合財務諸表は、すべての重要な点において、会社の2023年12月31日と2022年12月31日までの財務状況、および2023年12月31日までの3年度の経営結果と現金流量を公平に反映しており、国際会計基準委員会が発表した国際財務報告基準に適合していると考えられる。
意見の基礎
これらの連結財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の総合財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従ってこれらの連結財務諸表を監査した。これらの基準は、連結財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない
我々の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/普華永道会計士事務所
イギリスのレイデン
2024年3月21日
2019年以来当社の監査役を務めております
カタログ表 | | |
総合損失その他総合(損失)/収益レポート12月31日まで、2023年、2022年および2021年までの年度 |
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日 | | 十二月三十一日 | | 十二月三十一日 |
| | 2023 | | 2022 | | 2021 |
| 注意事項 | £’000 | | £’000 | | £’000 |
収入.収入 | 5 | 20,079 | | 27,223 | | 27,359 |
販売コスト | | (27,403) | | (33,297) | | (17,112) |
総(損失)/利益 | | (7,324) | | (6,074) | | 10,247 |
| 研究開発費 | | (128,444) | | (128,865) | | (44,047) |
| 一般行政費 | | (45,331) | | (38,416) | | (25,783) |
| 為替/収益 | | (1,541) | | 33,609 | | 938 |
| 長期契約損失 | 27 | — | | (11,287) | | — |
| その他の収入 | 6 | 6,636 | | 5,742 | | 3,749 |
営業損失 | 7 | (176,004) | | (145,291) | | (54,896) |
| 財政収入 | 8 | 16,628 | | 5,681 | | 26 |
| 財務費用 | 9 | (1,067) | | (334) | | (169) |
| 合営企業の赤字シェア | 16 | (1,645) | | (691) | | (1,152) |
税引き前損失 | | (162,088) | | (140,635) | | (56,191) |
| 所得税割引 | 12 | 16,125 | | 21,907 | | 6,960 |
本年度の赤字 | | (145,963) | | (118,728) | | (49,231) |
| その他総合(赤字)/収入: | | | | | | |
| 損益に再分類できる項目 | | | | | | |
| 外貨(赤字)/対外業務換算収益 | | (1,332) | | 2,476 | | (549) |
| 損益の項目に再分類されません | | | | | | |
| 保監部による公正価値計算による金融資産の公正価値変動 | | — | | — | | (109) |
本年度その他総合(赤字)/収入合計は,税額を差し引く | | (1,332) | | 2,476 | | (658) |
本年度の総合損失総額 | | (147,295) | | (116,252) | | (49,889) |
1株当たりの基本損失と赤字(GB) | 13 | (1.18) | | (0.97) | | (0.99) |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
総合財務状況表2023年12月31日までおよび2022年12月31日まで |
| | | | | | | | | | | | | | |
| | 2023年12月31日 | | 2022年12月31日 |
| 注意事項 | £’000 | | £’000 |
| 資産 | | | | |
| | | | |
| 非流動資産 | | | | |
| 商誉 | 14 | 6,186 | | | 6,321 | |
| その他無形資産、純額 | 14 | 28,459 | | | 33,602 | |
| 財産·工場·設備·純価値 | 15 | 48,954 | | | 37,648 | |
| 合弁企業への投資 | 16 | 173 | | | — | |
| 使用権資産、純額 | 17 | 18,513 | | | 14,794 | |
| その他売掛金 | 18 | 663 | | | 100 | |
| 持分ツールへの投資 | 27 | 2,145 | | | 2,145 | |
繰延税項目純資産 | 23 | 690 | | | 1,008 | |
非流動資産総額 | | 105,783 | | | 95,618 | |
| | | | |
| 流動資産 | | | | |
| 売掛金 | | 3,372 | | | 523 | |
| その他売掛金および契約資産 | 18 | 15,351 | | | 14,618 | |
| 流動納税資産 | | 23,166 | | | 33,023 | |
| 棚卸しをする | 19 | — | | | 50 | |
| 銀行短期預金 | 27 | 103,586 | | | 101,234 | |
| 現金と現金等価物 | 20 | 259,463 | | | 404,577 | |
| 流動資産総額 | | 404,938 | | | 554,025 | |
| | | | |
総資産 | | 510,721 | | | 649,643 | |
| | | | |
| 権益と負債 | | | | |
| | | | |
| 資本と備蓄 | | | | |
| 株本 | 21 | 63 | | | 61 | |
| 株式割増 | 22 | 364,639 | | | 364,603 | |
| 資本償還準備金 | 22 | 3 | | | 3 | |
| 外貨準備 | 22 | 492 | | | 1,824 | |
| 株式支払準備金 | 22 | 46,984 | | | 35,267 | |
| 公正価値準備金 | 22 | (199) | | | (199) | |
| 合併準備金 | 22 | 54,213 | | | 54,213 | |
| (累積損失)/利益剰余金 | 22 | (110,469) | | | 23,106 | |
親会社の所有者が占めるべき総株 | | 355,726 | | | 478,878 | |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
総合財務状況表2023年12月31日までと2022年12月31日まで(続) |
| | | | | | | | | | | | | | |
|
| 2023年12月31日 | | 2022年12月31日 |
| 注意事項 | £’000 | | £’000 |
| 負債.負債 | | | | |
| | | | |
| 非流動負債 | |
| |
|
| 貸し付け金 | 27 | 306 | | | 313 | |
| 賃貸負債 | 17 | 16,221 | | | 10,942 | |
| 繰延税金負債,純額 | 23 | 5,774 | | | 7,072 | |
| 契約負債その他立て替え金 | 24 | 65,466 | | | 59,170 | |
| 条文 | 25 | 2,157 | | | 1,243 | |
| その他の支払い | 26 | — | | | 377 | |
非流動負債総額 | | 89,924 | | | 79,117 | |
| | | | |
| 流動負債 | |
| |
|
| 貿易応払い | | 11,336 | | | 30,740 | |
| 賃貸負債 | 17 | 2,396 | | | 2,641 | |
| 契約負債その他立て替え金 | 24 | 27,006 | | | 38,812 | |
| その他の支払い | 26 | 24,333 | | | 19,455 | |
| 流動負債総額 | | 65,071 | | | 91,648 | |
| | | | |
総負債 | | 154,995 | | | 170,765 | |
| | | | |
権益と負債総額 | | 510,721 | | | 649,643 | |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
総合権益変動表12月31日まで、2023年、2022年および2021年までの年度 |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 共有
資本 | 共有
割増価格 | 繰延株 | 外貨準備 | 株式支払準備金 | 公正価値備蓄 | 合併備蓄 | (累積損失)/利益剰余金 | 合計する
権益 |
| £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 |
| 2021年1月1日まで | — | | 89,099 | | — | | (111) | | 3,589 | | — | | — | | (34,054) | | 58,523 | |
| 本年度の赤字 | — | | — | | — | | — | | — | | — | | — | | (49,231) | | (49,231) | |
| 子会社が為替損失を換算する | — | | — | | — | | (548) | | (1) | | — | | — | | — | | (549) | |
| 保監所の金融資産を通じて価値変動を公正に許容する | — | | — | | — | | — | | — | | (109) | | — | | — | | (109) | |
| 本年度の総合損失総額 | — | | — | | — | | (548) | | (1) | | (109) | | — | | (49,231) | | (49,889) | |
| 株式ベースの支払費用 | — | | — | | — | | — | | 10,466 | | — | | — | | — | | 10,466 | |
| 付属会社が発行した株を買収する | 1 | | 13,886 | | — | | — | | — | | — | | — | | — | | 13,887 | |
| 株を発行する | 12 | | 533,804 | | — | | — | | — | | — | | — | | — | | 533,816 | |
| 保証所を通じて公正な価値で権益ツールを売却した収益を留保収益に移す | — | | — | | — | | — | | — | | (90) | | — | | 90 | | — | |
| 購入権を行使する | — | | 14 | | — | | — | | (1,124) | | — | | — | | 1,120 | | 10 | |
| 株で株を交換する | 630 | | — | | — | | — | | — | | — | | 217,381 | | — | | 218,011 | |
| ボーナスを支給する | 217,381 | | — | | — | | — | | — | | — | | (217,381) | | — | | — | |
| 株を減らす | (217,381) | | — | | — | | — | | — | | — | | — | | 217,381 | | — | |
| 名目減価 | (580) | | — | | — | | — | | — | | — | | — | | 580 | | — | |
| 再編成流通分録 | — | | (272,224) | | — | | — | | — | | — | | 54,213 | | — | | (218,011) | |
| 株式分割 | (3) | | — | | 3 | | — | | — | | — | | — | | — | | — | |
| 2021年12月31日まで | 60 | | 364,579 | | 3 | | (659) | | 12,930 | | (199) | | 54,213 | | 135,886 | | 566,813 | |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
総合権益変動表2023年12月31日まで、2023年、2022年、2021年までの年度(続) |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 共有
資本 | 共有
割増価格 | 繰延株 | 資本が備蓄を償還する | 外国.外国
取引所
備蓄する | 株式支払準備金 | 公正価値備蓄 | 合併備蓄 | (累積損失)/利益剰余金 | 合計する
権益 |
| £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 | £’000 |
| 2022年1月1日まで | 60 | | 364,579 | | 3 | | — | | (659) | | 12,930 | | (199) | | 54,213 | | 135,886 | | 566,813 | |
| 本年度の赤字 | — | | — | | — | | — | | — | | — | | — | | — | | (118,728) | | (118,728) | |
| 子会社が為替損益を換算する | — | | — | | — | | — | | 2,483 | | (7) | | — | | — | | — | | 2,476 | |
| 保監所の金融資産を通じて価値変動を公正に許容する | — | | — | | — | | — | | — | | — | | — | | — | | — | | — | |
| 本年度の総合損失総額 | — | | — | | — | | — | | 2,483 | | (7) | | — | | — | | (118,728) | | (116,252) | |
| 株式ベースの支払費用 | — | | — | | — | | — | | — | | 30,576 | | — | | — | | — | | 30,576 | |
| 購入権を行使する | 1 | | 24 | | — | | — | | — | | (8,232) | | — | | — | | 5,948 | | (2,259) | |
| 繰延株の解約 | — | | — | | (3) | | 3 | | — | | — | | — | | — | | — | | — | |
| 2022年12月31日まで | 61 | | 364,603 | | — | | 3 | | 1,824 | | 35,267 | | (199) | | 54,213 | | 23,106 | | 478,878 | |
| 本年度の赤字 | — | | — | | — | | — | | — | | — | | — | | — | | (145,963) | | (145,963) | |
| 子会社が為替損失を換算する | — | | — | | — | | — | | (1,332) | | — | | — | | — | | — | | (1,332) | |
| 本年度の総合損失総額 | — | | — | | — | | — | | (1,332) | | — | | — | | — | | (145,963) | | (147,295) | |
| 株式ベースの支払費用 | — | | — | | — | | — | | — | | 24,350 | | — | | — | | — | | 24,350 | |
| 購入権を行使する | 2 | | 36 | | — | | — | | — | | (12,633) | | — | | — | | 12,388 | | (207) | |
| 2023年12月31日まで | 63 | | 364,639 | | — | | 3 | | 492 | | 46,984 | | (199) | | 54,213 | | (110,469) | | 355,726 | |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
統合現金フロー表12月31日まで、2023年、2022年および2021年までの年度 |
| | | | | | | | | | | | | | | | | | | | |
| | 2023年12月31日 | | 2022年12月31日 | | 2021年12月31日 |
| 注意事項 | £’000 | | £’000 | | £’000 |
| 経営活動のキャッシュフロー | | | | | | |
| 税引き前損失 | | (162,088) | | | (140,635) | | | (56,191) | |
| 税引前損失と経営活動の純現金流量の調整: | |
| |
| |
|
| 使用権資産減価償却 | 17 | 3,567 | | | 1,747 | | | 848 | |
| 財産·工場·設備の減価償却 | 15 | 7,330 | | | 3,092 | | | 1,432 | |
| 無形資産の償却 | 14 | 4,671 | | | 4,645 | | | 1,903 | |
| 工場と設備の減価 | 15 | 1,307 | | | — | | | — | |
| 激務レンタル費用 | 25 | 807 | | | — | | | — | |
| 非現金対価で決済した収入 | 5 | — | | | — | | | (3,349) | |
| 合弁企業から確認された損失 | 16 | 1,645 | | | 691 | | | 1,152 | |
| 財政収入 | 8 | (16,628) | | | (5,681) | | | (26) | |
| 財務費用 | 9 | 1,067 | | | 334 | | | 169 | |
| 研究開発支出税収控除 | 6 | (5,387) | | | (3,923) | | | (1,653) | |
| 株式ベースの支払費用 | 30 | 24,350 | | | 30,576 | | | 10,466 | |
| 外国為替損失/(収益) | | 1,550 | | | (29,556) | | | (63) | |
| | | | | | |
| 運営資金変動: | |
| |
| |
|
| (増加)/貿易売掛金の削減 | | (5,347) | | | 666 | | | (574) | |
| その他売掛金および契約資産の増加 | | (1,631) | | | (7,558) | | | (3,571) | |
| (削減)/契約負債およびその他の立て替え金の増加 | | (5,510) | | | 51,662 | | | 35,715 | |
| (削減)/貿易支払額の増加 | | (14,341) | | | 17,287 | | | 2,705 | |
| 他の未払い増加 | | 5,732 | | | 8,984 | | | 4,202 | |
| 在庫減少/(増加) | | 50 | | | 309 | | | (184) | |
| | | | | | |
| 受け取った利息 | | 8,175 | | | 3,702 | | | 26 | |
| 支払の利子 | | (15) | | | (29) | | | (19) | |
| 研究開発費税控除を受けました | | 3,912 | | | — | | | — | |
| 所得税を徴収した | | 29,317 | | | 3,172 | | | 309 | |
| 納めた所得税 | | (135) | | | — | | | — | |
経営活動のためのキャッシュフロー純額 | | (117,602) | | | (60,515) | | | (6,703) | |
| | | | | | |
| 投資活動によるキャッシュフロー | | | | | | |
| 買収子会社の支払いは,現金買収後の純額を差し引く | | — | | | — | | | (18,036) | |
| 家屋·工場·設備を購入する | | (26,458) | | | (22,386) | | | (5,646) | |
| 無形資産を購入する | 14 | (200) | | | (53) | | | (1,460) | |
| 合弁企業への追加投資 | 16, 29 | (1,827) | | | (242) | | | (1,424) | |
| 短期預金を償還する | 27 | 257,834 | | | — | | | — | |
| 銀行の短期預金に投資する現金 | 27 | (250,860) | | | (100,000) | | | — | |
投資活動のためのキャッシュフロー純額 | | (21,511) | | | (122,681) | | | (26,566) | |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
統合現金フロー表
2023年、2022年、2021年12月31日終了年度(続) |
| | | | | | | | | | | | | | | | | | | | |
| | 2023年12月31日 | | 2022年12月31日 | | 2021年12月31日 |
| 注意事項 | £’000 | | £’000 | | £’000 |
| 融資活動によるキャッシュフロー | | | | | | |
| 株を発行して得た金は取引コストを差し引く | | 38 | | | 24 | | | 183,136 | |
| 会社の初公募と同時に行う私募に関する株式取得金を発行し,取引コストを差し引く | | — | | | — | | | 350,694 | |
| 株式ベースの支払い決済時に支払う現金 | 30 | (243) | | | (2,282) | | | — | |
| 賃貸負債の下の債務を支払う | 27 | (3,194) | | | (1,740) | | | (881) | |
資金調達活動のためのキャッシュフロー純額 | | (3,399) | | | (3,998) | | | 532,949 | |
| | | | | | |
| 現金と現金等価物純額(減少)/増加 | | (142,512) | | | (187,194) | | | 499,680 | |
| 現金と現金等価物の為替(損失)/収益 | | (2,602) | | | 29,598 | | | (91) | |
| 年明けの現金と現金等価物 | | 404,577 | | | 562,173 | | | 62,584 | |
年末現金と現金等価物 | 20 | 259,463 | | | 404,577 | | | 562,173 | |
| | | | | | |
| 総キャッシュフロー情報を補足開示する | | | | | | |
| 現金と現金等価物純額(減少)/増加 | | (142,512) | | | (187,194) | | | 499,680 | |
| 銀行短期預金純増 | | 2,352 | | | 101,234 | | | — | |
| 現金と現金等価物の為替(損失)/収益 | | (2,602) | | | 29,598 | | | (91) | |
| 現金、現金等価物および短期銀行預金純額(減少)/増加、現金および現金等価物を含む外国為替収益/(損失) | | (142,762) | | | (56,362) | | | 499,589 | |
| | | | | | |
| 運営流入資料を補充開示する | | | | | | |
| 協力によるキャッシュフロー | | 22,167 | | | 91,868 | | | 61,590 | |
| 期日内に領収書を発行する金額 | | (27,737) | | | (87,328) | | | (62,333) | |
| 売掛金為替損失/(収益) | | 223 | | | (3,874) | | | 169 | |
| (増加)/貿易売掛金の削減 | | (5,347) | | | 666 | | | (574) | |
| | | | | | |
| 売掛金における非現金変動 | | 2,498 | | | — | | | — | |
| | | | | | |
| 非現金投資情報を補充する | | | | | | |
| 貿易未払いに記録された資本支出 | | (5,063) | | | 7,163 | | | (232) | |
| 他の支払金の下に記録された資本支出 | | (1,335) | | | 2,428 | | | (230) | |
F 10~F 58ページに添付されている会計ポリシーおよび付記は、これらの財務諸表の構成要素である
カタログ表 | | |
財務諸表付記2023年12月31日まで,2022年および2021年12月31日まで年度 |
1.一般情報
この等財務諸表は、2023年12月31日、2023年12月31日、2022年12月31日及び2021年12月31日までの財務表現、及び2023年12月31日、2023年12月31日及び2022年12月31日までの財務状況及びその付属会社(“本グループ”又は“本グループ”と総称する)の財務状況を反映している。
ExScience a plcはイングランドとウェールズに登録して設立された上場企業で、以下の完全子会社を持つ:ExScience a(イギリス)株式会社ExSciences a AI Limited、ExScience a Inc.,ExSciences a Ventures I,Inc.,ExSciences a Ventures II,Inc.,ExScience a KK,Kinetic Discovery LimitedおよびExScience a GmbHおよび二つ50%は、合弁企業、RE Ventures I、LLC(“RE Ventures”)およびRE Ventures II、LLCを所有します。このような総合財務諸表の作成が許可された日に、本グループはExScience a KKをクリアしています。
この集団の主な活動は,人工知能(AI)や機械学習(ML)を新たな治療化合物の発見と設計に応用することである。ExScience aの技術プラットフォームは人類とコンピュータの最適な能力を結合し、人体臨床試験のための新型、安全と有効な化合物の設計過程を加速する。
2.材料会計政策
a) 規則に従った声明
2023年12月31日現在、2023年12月31日および2022年12月31日までの連結財務諸表および2021年12月31日現在、2023年、2022年および2021年12月31日までの年度の総合財務諸表は、国際会計基準理事会(IASB)が発表したIFRS会計基準に基づいて作成されている。
“国際財務報告基準”に従って財務諸表を作成するには、ある重要な会計推定数を使用する必要がある。また、経営陣には、本グループの会計政策を適用する際に判断することも求められている(付記3参照)。
b) 準備の基礎
これらの財務諸表を作成する際に採用する会計政策は以下のとおりである。他の説明がない限り、このような政策は列報されたすべての財政年度に適用されてきた。財務諸表は歴史コストによって作成されるが、業務合併で取得したいくつかの金融商品と資産及び負債を除いて、すべて公正価値によって計量される。
財務諸表をポンド(“ポンド”)で列記する。これは会社の機能通貨であり、会社が経営している主要な経済環境の通貨であり、グループの象徴的な通貨でもある。別の説明がない限り、すべての値は、最も近い千ポンド(‘GB’000‘)に四捨五入される。
これらの連結財務諸表は2024年3月14日に取締役会の承認を受けた。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
c) 強固な基礎
本グループの財務諸表は、ExScience a plcとそのすべての付属会社の2023年12月31日までの財務諸表を統合しています。子会社とは,会社がそれを制御する実体をいう。グループは、グループがエンティティに参加することによって可変リターンを得る権利があり、エンティティ活動を指示する権限によってこれらのリターンに影響を与える能力があるエンティティを制御する。
買収又は売却された子会社の結果は、支配権が通過した日から又はそれまでの期間に合併する。買収は買収法に従って入金され、商業権は与えられた代価の公正価値を代表し、買収した識別可能な資産と負債の公正価値より高い。
d) 経営を続ける企業
2023年12月31日現在、グループの現金、現金等価物、短期銀行預金はGB363,049,000無制限現金と短期銀行預金総額はGBに達する361,154,000それは.本グループは活動を展開して以来すでに巨額の研究開発費が発生し,経営活動の現金流出純額はGBに達している117,602,0002023年12月31日までの財政年度(2022 GB)60,515,000).
それぞれ2024年12月31日および2025年12月31日までの年度末現金、現金等価物および短期銀行預金および将来の現金流量の予測によると、取締役会は本グループが当該などの財務諸表の発行日から少なくとも12ヶ月の予測可能な未来の計画現金流出に対応するために十分な財務資源を持っていると信じている
本グループの結論は,当該等財務諸表が発表されてから1年以内に,本グループが継続経営企業として経営を継続する能力は疑いの余地がないため,本グループは継続経営仮説に基づいて当該等財務諸表を作成することである。
e) 新たに改訂された国際財務報告基準の適用
本グループは、2023年12月31日までに、以下の取締役会が発行し、2023年1月1日以降に発効する国際財務報告基準の改訂および解釈を適用している。
| | | | | |
| 会計政策開示(“国際会計基準”第1号と“国際財務報告基準”実務説明2の修正) | 修正案は実体にその重大な会計政策を開示することを要求し、その重大な会計政策ではない。追加的な改正は実体が材料会計政策をどのように決定するかを説明する。 |
| “会計見積数定義(国際会計基準第8号改正案)” | 修正案は会計推定数変動の定義の代わりに会計推定数の定義である。新たな定義によると、会計推定は“財務諸表において計量不確実性の影響を受ける貨幣量”である。 |
| 単一取引による資産·負債に関する繰延税金(“国際会計基準”改正案第12号) | これらの改正は、会社が最初に確認する際に、同額の課税と臨時差額を差し引くことができる取引確認繰延税収を要求する。 |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
これらの新しい会計公告を採用することは、本グループが採用した会計政策、計算方法あるいは列報方式に重大な影響を与えなかったが、国際会計基準第12号改正案の採択を除外した所得税それは.“国際会計基準”改正案第12号所得税2021年5月に出版され、2023年1月1日に本グループが発効した。
本グループはこの改訂の影響、特にリース繰延税金項目に関する会計処理を考慮している。改正された基準に移行したため、2022年1月1日現在、2022年12月31日までの利益剰余金は実質的な影響を受けていない。2022年12月31日現在、当グループが繰延税金資産及び負債に及ぼす影響の詳細については、付記23を参照されたい。
F)議論されているが発効していない国際基準、修正案、解釈を改正する
今後数年間以下に言及した基準、改訂、解釈を採用することは、本グループの財務諸表に大きな影響を与えないことが予想される
| | | | | |
| 発効日 |
| 当日かそれからの期間 |
| 国際財務報告基準第16号改正案−アフターとレンタル− | 2024年1月1日 |
| 負債は流動負債又は非流動負債に分類される(“国際会計基準”改正案第1号) | 2024年1月1日 |
g) 取引先と契約した収入
このグループの主要な収入は主にその主要な活動に関連する2つの源から来ている:
•ライセンス料:我々は提携プロジェクトからライセンス料を受け取り,これらのプロジェクトでは,パートナーを代表して知的財産権を開発している.これらの合意は、最初からすべての指定された知的財産権をパートナーに譲渡するか、知的財産権の将来の開発および商業化権利を得るためにパートナーに独占的選択権を付与するか。これらの協定の一部として、私たちは臨床、規制、およびビジネスのマイルストーンに達したときに将来のマイルストーンと専門権使用料を得ることができるかもしれない
•サービス料:私たちは薬物発見協力協定からサービス料を生成します。これらの合意では、私たちはパートナーを代表して私たちの独自技術を利用して新しい知的財産権を開発しますが、この合意によって将来のマイルストーンや特許使用料を得る権利はありません。2023年3月までに,買収時の既存の連携協定に関するExScience a GmbHエンティティによりサービス収入を創出した開いています。
本グループは、2つの収入源に含まれる4つの支払い方法を受信します
•プリペイド“は、一般に、協力協定に署名するか、またはプロジェクトを開始する際に支払われる
•“研究経費”(支払い延期を含む)は、通常、協働医薬化合物の開発のための研究(内部および外部)を支援することを目的とした協力期間にわたって合意された所定の時間間隔で支払われる(例えば、四半期毎または特定の作業段階の開始時)
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
•マイルストーン支払い“は、第1段階の臨床試験マイルストーンを開始し、IFRS 15による可変対価格を構成するなど、協力協定において定義されたイベントの実現とリンクされる
•加入支払いの選択“は、原則としてマイルストーン支払いと同様であるが、パートナーが指定された知的財産権の所有権の選択権を行使する場合に支払われる。この等支払いは,本グループが最初に設計知的財産権の所有権を保持している場合にのみ存在する
同等の協力協定によると、承認されれば、本グループも製品の初商業販売時に商業化マイルストーンを獲得することができ、その金額は販売所の地域を基礎とし、全世界の純売上高をもとに印税を徴収することができる。これらの金額は、2023年12月31日、2022年または2021年12月31日まで、いかなる契約の取引価格にも含まれていない。解約不可、返却不可の収入のみを確認し、署名された協力契約規定のマイルストーンを実現しました。私たちのパートナー統制下の未来のマイルストーンやオプションに関連したいかなる支払いも確認されないだろう
国際財務報告基準第15号によると、本グループはその顧客が約束した商品或いはサービス制御権を取得した時に収入を確認し、金額は本グループが当該などの商品或いはサービスと交換することを期待している対価格を反映する。本グループがIFRS 15の範囲内に属すると考えられるスケジュールの収入確認を決定するために、本グループは、(I)クライアントとの契約を決定するステップ(S)、(Ii)契約中の履行義務を決定するステップ、(Iii)取引価格を決定するステップ、(Iv)契約中の履行義務に取引価格を割り当てるステップ、および(V)グループが契約義務を履行する場合、または義務を履行する際に収入を確認するステップの5つのステップを実行する。
契約開始時に、当グループは、異なる履行義務を決定するために、IFRS 15の範囲内に属する各契約において約束された貨物またはサービスを評価する。そして,本グループは,義務履行時または義務履行時にそれに応じて割り当てられた取引価格金額が収入であることを確認する.収入は契約価格で計算され、付加価値税や他の販売税は含まれていません。
本グループは取引価格に制限されない推定変動対価格額を計上するため,累積収入が大きく逆転しないことが確認された金額のみを計上する.契約開始時には、制限されない収入は、通常、前金を含み、場合によっては、研究資金も含まれる。
各項目が研究、開発、または規制マイルストーン支払いを含む予定の開始時に、本グループは、マイルストーンが(I)合意項の下の1つまたは複数の異なる履行責任に関連しているかどうかを評価し、(Ii)は達成可能性が高いとみなされ、最も可能な金額法を使用して取引価格に計上される金額を推定する。大きな収入逆転が起こらない可能性が高い場合、関連するマイルストーン価値は取引価格に含まれる。規制承認のような我々または被許可者の制御範囲内ではない記念碑的支払いは、これらの承認を受ける前に、実現されない可能性が高いと考えられる。
その後報告期間ごとに終了すると,本グループは取引価格に含まれる推定変動コストおよび任意の関連制約を再評価し,必要に応じて全体の取引価格の見積りを調整する.
そして,相対的に独立した販売では取引価格を履行義務ごとに割り当てる
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
価格基準は、グループが契約に定められた履行義務又は契約義務を履行する際に収入を確認する。
履行義務が履行されているか否かを決定する際には,入力法を用いて進捗状況を測定し,連携スケジュールの性質に応じて,総コストや外部コストや工数を用いて完了進捗を決定し推定する.経営陣は,入力法は,本グループが履行義務を履行する上での進展を如実に反映しており,発生する時間やコストが顧客に移行可能な基礎知的財産権の開発進捗を反映していると考えている.場合によっては、予想される総費用推定数は、特定の協力協定に従って許容される目標の代替に関連する推定費用を含む。
時間とともに確認された債務については、本グループが確認した収入は、履行義務の送達によって生じる予想される総コスト/時間数を合理的に推定できるまで、発生したコストのパーセンテージにのみ相当する。ある時点で収入が確認された債務の場合、その時点は、サービスまたは知的財産権の所有権を顧客に譲渡する日である。
契約負債には、収入確認の前に受け取った請求書または支払いが含まれています。契約資産には、請求書または支払いの前に確認された収入が含まれている。
h) 贈与金
本グループが行った研究活動の補助金を補償し,支出を確認している間は系統的に損益で他の収入として確認し,関連支出を確認した後に補助金を得る条件を満たさない限りである。この場合、贈与は受取金となったときに確認されます。
i) 外貨?外貨
期末ごとに、外貨通貨項目は終値為替レートで換算されます。歴史的コストで計量された非貨幣項目は取引日の為替レートに換算し、公正価値で計量された非貨幣項目は公正価値を確定したときの為替レートによって計量される。
決済取引および期末レート換算外貨建て通貨資産および負債による為替損益は損益で確認された。
合併時には、海外業務の結果がポンドに変換され、為替レートは取引発生時の為替レートに近い。海外業務のすべての資産及び負債は報告日の規定為替レートで換算され、営業権及び当該等の業務に帰属可能ないかなる無形資産も含まれる。換算海外業務による為替差額は他の全面収益で確認され、権益内の単独準備金に蓄積される。純投資が処分された場合、累積金額は損益に再分類される。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
j) 無形資産
善意買収側が譲渡した対価格が買収の確認可能資産純資産値を超えた場合、商誉は企業合併で確認される。営業権は償却しないが、少なくとも年に1回は減値を検討する。
I営業権以外の無形資産単独で買収した無形資産は,初期確認時にコストで計測される.初歩的に確認した後、無形資産はコストから累積償却および累積減価損失を引いて帳簿に計上した。
寿命の限られた無形資産は、無形資産が使用された日から有用な経済年限内に償却され、その無形資産が減値可能であることが示された場合に減値評価を行う。まだ投入されていない資産は少なくとも年に1回の減価を評価する。耐用年数の限られた無形資産の償却期限と償却方法は、少なくとも報告期間終了ごとに審査を行う
資産が体現する未来の経済利益の期待使用年数或いは期待消費モードの変動は、償却期間或いは方法(誰が適用するかによって決まる)を変更することによって入金され、会計推定の変動に従って処理される使用年数の限られた無形資産の償却費用は、無形資産の機能と一致する費用種別の損益で確認される。
| | | | | |
| コンピュータソフト | 4直線で計算した年 |
| 特許 | 特許期間内に直線を基礎とする |
| 取得したIPアドレス | 8購入日/資産投入使用日から数年は直線で計算される |
関連支出の性質に基づいて、無形資産の償却は損失及びその他の全面損益表中の“研究及び発展支出”及び“一般及び行政支出”に分類される。
k) 販売コスト
販売コストは、第三者契約研究機関のコストと、国際財務報告基準第15号に基づいて顧客と契約を締結する第三者協力計画および薬物発見協定によって生じる内部労働力および吸収された管理費用に指定される。
l) 不動産·工場および設備
建設中の資産、工場及び設備、固定装置及び部品、コンピュータ設備及びレンタル改善は初歩的に購入コストで確認し、資産を本グループの管理層が期待する方式で運営できるようにするために必要な場所と条件に移す任意の直接占有コストを含む。これらの資産はその後、コストモデルを用いて減価償却と減価償却損失を減算して計量する減価償却は、予想寿命内の資産のコストからその推定残存価値を差し引いて計算される比率で提案されている
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
| | | | | |
| 建設中資産 | 未減価償却 |
| 工場と設備 | 5年.年 |
| 固定装置及び取付具 | 5年.年 |
| 賃借権改善 | レンタル期間または初回解除条項の期間は、早い者を基準とします |
| コンピュータ装置 | 4年.年 |
m) 現金および現金等価物と短期銀行預金
現金とは手元の現金と当座預金のことです。現金等価物は短期的で流動性の高い投資であり、既知金額の現金に容易に変換することができ、価値変化の微小リスクの影響を受けることができる。
短期銀行預金には、存続期間が12ヶ月以下の銀行預金が含まれており、償却コストに応じて計量されるS編)下です。
n) 資産減価
事件や環境変化が帳簿額面が回収できない可能性があることを示した場合、個別資産は減値テストを行うが、買収した知的財産権はまだ使用されていない場合を除き、この知的財産権は少なくとも毎年減値審査を行う。
1つの資産の帳簿金額がその回収可能金額を超えた場合は、減値となる。回収可能金額は公正価値から処分コストと使用価値の両者の中で高い者を計量する。使用価値は,現在値に割引された財務予測に基づく予測キャッシュフロー純額で計算される。
回収可能金額は、資産が他の資産または資産グループと実質的に独立した現金流入を生じない限り、個別資産のために決定される。この場合,資産が属する現金発生単位の回収可能金額を決定する.減値が必要であると考えられると,減値損失は資産の帳票金額を減少させるように割り当てられ,まず現金生成単位に割り当てられた任意の営業権の帳票金額に基づいて,単位内の資産ごとの帳票金額に比例してその単位の他の資産に割り当てられる.営業権を除いて、すべての資産はその後、以前に確認された減価損失が存在しなくなる可能性がある兆候を再評価する。資産や現金発生単位の回収可能金額がその帳簿金額を超えた場合、減価損失は打ち切られる。
o)
合営企業の投資は当グループの財務諸表に権益法を用いて入金される。権益法によると、投資は初歩的にコストで確認し、投資の帳簿金額を調整して、本グループの占める純資産の変動を確認する。
合営企業の投資は毎年減値テストを行い、投資の帳簿価値が回収できない可能性があることを示した場合に減値損失を確認する。回収可能金額は公正価値から処分コストと使用価値の両者の中で高い者を計量する。使用価値は,現在値に割引された財務予測に基づく予測キャッシュフロー純額で計算される。このグループはまた第三者と様々な共同行動を展開している。もし協力が共同行動とみなされれば、当グループは認めた
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
•共通して保有する任意の資産におけるシェアを含む資産
•共通して負担する負債のシェアを含む負債;
•その費用は、すべての共同発生費用に占めるシェアを含む。
当グループで発生した費用は共同経営協定によりパートナーと共同で分担します。返済された金額は基本支出の減少額として入金される。本グループが支出が発生する前に事前に返済していれば、受け取ったお金は他の立て替えで負債であることが確認される。他の立て替え金は返済に関連した支出が発生した時に支払われる。
p) 賃貸借証書
リースは、当社グループが使用可能な日に使用権資産と相応の負債として確認され、賃貸支払いごとに負債と融資コストの間に分配されます。融資コストは、毎期の負債残高に一定の金利を発生させるために、リース期間内の損益に計上される。使用権資産は資産使用年数と賃貸期間の短い者は直線的に減価償却します。
レンタルによって発生した資産と負債は最初に現在値で計量される。レンタル負債には、以下のリース支払いの現在値が含まれています
•固定支払いはレンタル報酬を差し引くことです
•指数またはレートに基づく可変レンタル支払い;
•購入オプションの執行価格は、テナントが合理的に確定して行使すれば
このオプション;および
•レンタル終了の罰金を支払い、レンタル期限がテナントがその選択権を行使することを反映すれば。
レンタル支払いはレンタルに隠された金利を使用して割引します。この金利を決定できない場合は、当グループの逓増借款金利(すなわち本グループが支払うべき金利を採用し、類似経済環境及び類似条項及び条件の下で類似価値資産を取得するために必要な資金を借り入れる)
市場賃貸料変動を反映した変動賃貸支払いは最初に発効日の市場賃貸料で計算される。指数またはレートに依存しない可変リース支払いは、レンタル負債および使用権資産の計量には含まれず、支払いをトリガするイベントまたは条件が発生した間に料金として確認される。
使用権資産はコストで計量され、コストは以下のようになる
•賃貸負債の初期計量
•開始日または前に支払われたレンタル金(受信したレンタル報酬を差し引く);
•初期直接コスト
•修復コスト。
内線と終了オプション本グループは、行使すると合理的に決定された場合にレンタル契約の選択権を延長することが含まれる任意の期間、または行使しないことを合理的に決定した場合にテナントを終了する選択権がカバーされる任意の期間とともに、リース期間を借款の取消不可年期とする。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
賃貸契約が修正される本グループは、以下の場合、賃貸負債を再計測します(関連使用権資産の調整)
•賃貸期間が変化したり、重大な事件や状況が変化したりして、購入選択権行使の評価が変化した場合、レンタル負債は、改訂割引率を用いて改訂賃貸支払いを割引することにより再計量される。
•賃貸支払いは、指数や金利の変動や担保剰余価値における期待支払の変動により変動し、この場合、賃貸負債は、不変の割引率を用いて改訂賃貸支払いを割引することにより再計量される(賃貸支払い変動が変動金利の変化でない限り、この場合は改訂割引率を用いる)。
•賃貸契約は改正され、賃貸改訂は独立賃貸入金として使用されないが、この場合、レンタル負債は改訂賃貸のレンタル期間に応じて再計量され、改正発効日に改訂割引率を用いて改訂賃貸支払いを割引する方法である。
短期と低価値レンタルです当社では短期と低価値賃貸の使用権資産は確認していません。短期借約(リース期間12カ月未満のリース)と低価値資産賃貸に関する支払いはレンタル期間内に直線的に確認する
減損する本グループは国際会計基準第36号を適用して、使用権資産が減値されたかどうかを決定し、任意の確認された減値損失を計上する。
q) 条文
当グループが過去の事件により現在の責任(法律または推定)がある場合、当グループはその責任を履行し、その責任の金額を確実に推定する必要がある可能性が高い。準備された金額は、その責任をめぐるリスクや不透明な要因を考慮した後、報告日に現在の責任を償還するために必要な考慮要因の最適な推定であることが確認された。
賃貸契約条項及び条件の規定により、賃貸物件の原状回復のコストを責任発生時に確認し、その責任が開始日又は賃貸契約の特定期間に関連資産を使用又は変更することによるものであるにかかわらず、取締役による資産回復に要する支出の最適な見積もり確認を行う。私たちは定期的に見積もり数字を検討し、新しい状況に応じて適切に調整するつもりだ。
契約項目の下の責任を履行する避けられないコストが予想される経済的利益を超える場合、重い契約の準備を確認し、契約履行/脱退契約の履行/脱退によって生じる流出現在値の最適な推定に基づいて、任意の関連する流入を差し引く。
r) 年金コスト
当グループは従業員のために固定拠出年金計画を推進している。この計画の資産は本グループの資産と別々に保有している.年度対応供出金は計上制で集団損益に計上する。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
s) 金融商品
金融資産です。償却コストによって計量された金融商品に分類される金融資産には、貿易及びその他の受取金、現金及び現金等価物及び短期銀行預金が含まれる。償却コストに応じて計量された金融資産は、当グループが当該ツールの契約条文に加入する際に確認し、当該金融資産のキャッシュフローの契約権利が満了した場合又は当該金融資産及びすべての重大なリスク及びリターン譲渡時に確認を終了する。金融資産は、以下の2つの基準を満たす場合、償却コストによって計量される
•金融資産は、契約キャッシュフローのビジネスモデルを受け取るために金融資産を保有することを目標としている
•金融資産の契約条項は特定の日にキャッシュフローが発生し、すなわち元金と未償還元金の利息のみを支払う。
初歩的な確認の後、金融資産は実金利法で償却コストで計量される。報告日ごとに、本グループは償却コストに応じて計量された金融資産予想信用損失の損失準備を確認した。確認された適切な損失支出金額を決定する際に、本グループは一般的な方法或いは簡略化方法を採用し、関連する金融資産グループの性質に依存する。詳細については付記27に記載した。
債務または持分に分類される債務及び権益ツールは、契約手配の実質的内容及び金融負債及び権益ツールの定義に基づいて金融負債又は権益に分類される
株式投資会社です権益ツールは、エンティティのすべての負債を差し引いた後にそのエンティティの資産に対して残りの権益があることを証明する任意の契約を構成する。本グループが発行した優先株等の権益ツールは、受け取った金額に基づいて直接発行コストを差し引いて確認します。2021年通年で発行されたすべての優先株は、一定の条件で普通株に変換することができ、固定または累積配当金がない。したがって、このような株式は株式の性質とみなされる。
当グループは2021年3月31日にGT ApeIron治療会社(“GTA”)収入契約に関する発展マイルストーンを取得した後、当社の若干の普通株および優先株を非現金収入対価格として受け取る権利がある(詳細は付記27)。この等株式は非上場株式証券であり、本グループはすでにIFRS 9内で選択し、他の全面収益(FVOCI)内の公正価値損益を確認することを選択した
財務負債。金融負債は貿易と他の対応金とローン負債を含む。財務負債とは、現金または他の金融資産を支払う責任であり、当グループが当該文書の契約条項に加入した場合にのみ財務状況表内で確認される。
金融負債は初歩的に任意の直接占有取引コスト調整後の公正価値によって確認されなければならない。初歩的な確認後、財務負債は実際の利息法に従って償却コストで計量され、利息に関する費用は財務コストのうちの1つの支出であることが確認された。
金融負債は、契約義務が終了した場合、すなわち義務が解除され、キャンセルされ、または満了した場合にのみ解除される。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
派生金融商品-長期契約貨幣長期契約に関連するデリバティブ金融商品は、最初に派生契約を締結した当日に公正価値で確認し、その後、期末ごとに公正価値に従って再計量する。派生ツールは価値変動による任意の損益を総合損益表内で確認する.
t) 株式ベースの支払い
本グループは株式決済株式に基づく報酬計画を経営しており、この計画によると、本グループのいくつかの従業員は株式購入、制限性株式単位(“RSU”)、株式購入を表現し、株式単位を表現する形式で当社の株式奨励を授与する
奨励を与えた公正価値は損益内の支出であることを確認し、それに応じて権益を増加させる。奨励の公正価値は奨励の日に計量され、関係従業員が無条件に奨励を受ける権利がある期間に分担する。株式オプション及び市場の業績条件に基づく業績オプションとPSU奨励を含まない公正価値はBlack-Scholesモデルを用いて評価を行い、市場条件に基づく業績オプションとPSUの公正価値を含めてモンテカルロモデルを用いて評価を行った。RSUの公正価値は,日関連株式の時価を授受することに基づいている.
各財務諸表日に、当グループは、没収比率に基づいて、予想される行使可能な報酬数の推定値を修正し、市場に基づく表現状況の推定確率の変化に達することを除いて、帰属期間が終了したときに、累積費用が最終的に帰属する報酬数に基づくように調整する。
オプションの条項や条件が帰属前に修正されると,修正直後に計測されたオプション公正価値が増加し,残りの帰属期間の損益でも確認される.本財政期間または前の財政期間において、代替方法の条項および条件は何も修正されていない。
株式ベースの支払奨励を行使する場合には、内部持分変動を記録し、株式ベースの支払準備金内に記録された累積費用を留保収益に移行する。
u) 税収
本年度の赤字税項には当期税項および繰延税金が含まれている。税項は損益帳で確認されているが,権益確認に直接関与している項目に関係する者は除外し,この場合は権益確認に用いる
当期税額当期税項は資産負債表の日までにすでに公布または実質公布された税率に基づいて、予想される支払うべき金額に基づいて提出される。現在の税収には税収控除が含まれており、この期間の課税控除は、中小企業に適用されるイギリスの研究開発税収控除計画に適合する計算に基づいている
イギリスの研究開発税収免除計画によると、清算資格に適合しない研究開発コスト、例えば集団が収入を獲得した研究プロジェクトで発生した支出は、イギリスの研究開発支出免除(RDEC)計画によって精算されることができる
カタログ表
| | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
RDEC計画での受取金は他の収入に記載されている。オーストリアでは、研究·開発支出の免除も、グループオーストリア子会社が研究プロジェクトで発生した条件に合った支出と関係がある。これらの金額はまた他の収入にも列挙されている。
税金を繰延する繰延税項は、資産と負債の帳簿金額とその課税基礎との間の一時的な差異に基づいてバランスシート法を用いて計算される。繰延税金資産が非業務合併取引における資産または負債の予備確認によって生成され、取引時に会計オーバーフローまたは課税オーバーフロー(課税損失)に影響を与えない限り、繰延税金資産はすべての一時的差額を差し引くことができ、すべての一時的差額を差し引くことができることを確認するが、一時的差額を差し引くことができる可能性がある場合は例外である。しかしながら、子会社投資に関連する一時的な差を差し引くことができる場合には、一時的な差が予測可能な将来に出荷される場合には、繰延税金資産が確認され、一時的な差異を相殺するために利用可能な課税利益が得られる。
繰延税項資産及び負債は予想通り資産現金化或いは負債清算期間の税率計量に適用され、税率及び税法は報告期間末に公布又は実質公布された。繰延税金資産及び負債は、当グループが法的に強制的に執行可能な権利を有して確認された金額を相殺することのみであり、かつ、当グループが純額で決済又は同時に現金資産及び負債を補償することを意図している場合にのみ相殺することができる。
v) 研究開発コスト
研究費は発生時に費用を計上する。グループが証明できる場合、単一プロジェクトの開発支出は無形資産であることが確認される
•使用または販売のための無形資産の技術的実行可能性を完了すること
•資産を完成させる意図およびその資産を使用または売却する能力;
•資産がどのように将来の経済効果を生むのか
•資産を完成させるために必要なリソースの利用可能性;
•開発期間中の支出を確実に測定することができる。
開発費が資産であることを初歩的に確認した後、コストモデルを採用し、資産がコストから任意の累積償却と累積減価損失を差し引いて入金することを要求する。開発が完了し、資産が使用可能になると、資産の償却が開始される。それは未来の収益を期待している間に償却する。償却は研究開発コストに計上される。開発期間中、この資産は毎年減値テストを行っている。本年度または数年前の支出はいずれも資本化基準に達していない。
3.重要な会計見積もりと判断
本グループの会計政策を適用する際には、取締役は資産及び負債の額面について判断、推定及び仮説を行う必要があるが、このような判断、推定及び仮定は他の出所から容易に見られるものではない。見積り数と相関仮説は,歴史経験や他に関連すると考えられる要因に基づいている.実際の結果はこれらの推定とは異なる可能性がある。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
肝心な会計見積もり
私たちは推定数字と基本的な仮定を検討していくつもりだ。取締役が本グループの会計政策を適用する過程で作成した財務諸表確認の金額に最も大きな影響を与える鍵は以下のとおりである。
収入確認収入は義務履行時に確認され,これは貨物やサービスの制御が顧客に移行する際に発生する.時間の経過とともに,2023年12月31日と2022年12月31日までの年次で行われている多くの研究や設計活動の制御権が移行している。生成された総コストまたは外部コストまたは工数は、報告期間の終了時に義務を履行する程度を評価するための関連入力方法として使用され、手配の性質に依存する。具体的な協力協定によって許容される目標に応じて代替することに関連する任意の費用を含む、時間とともに送達される履行義務を履行するために将来生じる費用を推定することは、任意の特定の期間の収入確認に関して推定される不確定な主要源であると考えられる。
2023年12月31日,2023年,2022年12月31日までの推定総予想コストは,期間内に確認された収入に大きな影響を与える変動はなかった
以下の表は,本グループが2023年12月31日に公表した利益が,本グループの2023年12月31日までの収入契約の履行に関連する部分の履行義務を履行していないことによる将来の推定コストの増加または10%減少に対する感度分析を示している。
| | | | | | | | | | | |
| 将来のコストの変化を見積もる | 除税前利益への影響 | 持分への影響 |
| | £’000 | £’000 |
| 将来の納入部分未履行の履行義務による推定費用変化への影響 | +10 | % | (1,145) | | (1,145) | |
| -10 | % | 1,289 | | 1,289 | |
潜在的マイルストーンまたは特許使用料の収入は契約開始時には確認されません。履行義務を含む前金は、これらの義務を履行する際に確認される。さらに、完成プランのコストおよび時間を合理的に推定することができるまで、利益は発生したコストとして確認されず、確認された収入は、それ以前に発生したコストのパーセンテージに等しい。したがって、総コストおよび完了時間を確実に推定することができる前に、関連契約が全体的に利益を得ることが予想されるにもかかわらず、個別の顧客契約で総損失を確認することが可能である。
賃貸借契約本グループはすでに全世界各地の異なる住宅地について賃貸手配を予約し、各報告期間が終了した時に賃貸手配が重い契約を構成しているかどうかを評価した
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
二零二二年十二月、当グループはアメリカフロリダ州マイアミの物件についてレンタルスケジュールを予約し、レンタル期間は二零二四年第一期に始まります。上記の手配を締結した後,本グループはコストを抑える措置をとっているため,そのような物件を占有せず,近くの小さい物件を借りることにした.最低レンタル承諾量合計(GB)3,040,000したがって、このグループは準備されなければならない重い契約が存在するかどうかを評価しなければならない。
本グループはすでに代理人を招いて元に借りた物件を第三者に転貸することに協力し、本グループが契約に基づいて負担した義務を履行することによる避けられないコストの現在値を推定し、GBを超えてこの空間を転貸することによる期待利益を推定した807,000この金額は2023年12月31日までにその日の支出に記入されている。
2023年12月31日現在、他に煩雑なリース準備やROU資産減価が必要とされていない。
ゲイツ財団は権利の買い戻しを私募している当社とゲイツ財団の私募条項によると、当社グループが合意のいくつかの条項に違反した場合、ゲイツ財団は、ゲイツ財団が保有する当社グループの任意の株式を公開発行価格および株式時価の高い者に売却または買い戻すことを要求する権利がある。この権利は、当社の派生金融負債を構成し、公正価値で損益確認に寄与する。当グループはすでに違約が発生する可能性が低いと評価している2023年12月31日したがって、この負債の公正価値は、貸借対照表の日にゼロと推定される。
本グループのGTAへの投資の公正価値2023年12月31日、本グループは他の全面収益を通じて公正価値に従ってGTAのいくつかの普通株と優先株を保有した。GTAは未発売の早期企業であり、その薬物開発の発見と臨床段階のプロジェクトは創立前のものである。そのため、不確定性の主要な源はこれらの非上場株証券の1株当たり価値を推定することである。株式に関する流通性は極めて悪いが、主な推定要因は、第三者株式買収取引を行う最新投資のコストや価格であり、他の要因を反映するように適切に調整されている
専門家グループはまた、現在のウクライナ戦争とハマスとイスラエルとの衝突がこの投資に与える影響を評価し、これらの事件はいかなる切り上げも必要ないと考えている。最後に、本グループはすでに関連市場権益指数の変動を評価し、特に関連期間のナスダック生物科学技術指数の変動を参考にし、それによって値を推定する必要がない。
商標権と薬学知的財産権の無形減価本グループは毎年あるいは状況が変化した場合、営業権或いは取得した知的財産権が損傷する可能性があるかどうかを評価する。減値が存在するかどうかを決定するには、商業権と知的財産権の買収に関連するCGUの回収可能な金額を推定する必要があり、その使用価値と公正価値から販売コストを引いたより高い者に等しい
使用価値の計算は判断性質であり、本グループは薬物発見、開発、監督審査及び商業化のCGU予想による将来のキャッシュフローについていくつかの推定、及び適切な割引率をカバーして現在値を計算することを要求する
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
キャッシュフロー予測は,観察可能な市場比較性に基づいてさらにリスク調整を行い,薬物が開発の各段階で商業化に成功する可能性を考慮する。敏感性分析を行うのは,重大な仮定の合理的な変化が帳簿価値が回収可能金額を超えてしまうかどうかを決定するためである。キャッシュフロー単位の帳票価値がその回収可能金額を超えた場合、キャッシュフロー単位は減値とされ、キャッシュフロー単位内の資産をその回収可能金額に減記する。減価損失は総合損益表およびその他の包括収益表で確認した
二零二三年十二月三十一日に詳細な減価評価を行い、何の減価記録もなく、重大な仮定も帳簿額面が回収可能金額を超える合理的な変動は発見されなかった。
会計判断
本グループの会計政策を適用する過程で、経営陣は、財務諸表で確認された金額に最も大きな影響を与えると判断した
収入確認IFRS第15号に基づいて各プロトコルにおける履行義務を決定し、決定された履行義務に収入を適切に割り当てる場合には、管理層の判断が必要となる。履行義務の交付による総コストを確実に推定し、発生した回収可能コストを超えて収入を確認することができる場合にも、判断する必要がある。具体的な協力協定によって許可されている場合には、代替目標の可能性及び発生可能な費用を推定し、判断する必要がある。
可変対価格に関連する不確実性がその後解決された場合、確認された累積収入額が大きな逆転を生じる可能性が低いので、報告期間の終了時に可変対価格のソースが制限されているかどうかを決定するためには、さらに判断する必要がある。取引相手が成果を提供した書面確認やプロジェクト合同指導委員会が成果を承認した場合、マイルストーン/加入金額の選択に関する制限は取り消されたと考えられる。
赤字の協力手配経営者は、契約に直接関連する費用及び他の費用の分配を含む各顧客協力手配の義務を履行するための不可避的な費用を決定し、契約に基づいて予想される経済的利益を超えるか否かを判断する必要がある。このようなコストが当グループの手配によって生じる将来の収入の最適な推定を超える場合は、国際会計基準第37号に基づいて入金される。
当社は、当社グループの顧客に関連する契約項目の責任を履行する推定余剰不可避コストに対する未履行責任に関する残り取引価格の価値を評価し、2023年12月31日に重い契約条項を必要としないことを決定した。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
4.細分化市場を運営する
業績評価および運営決定を行うために,本グループは単一部門でその業務を管理している.運営分部は企業の構成要素として定義され、グループの首席経営意思決定者又は意思決定グループは、資源をどのように割り当てるかを決定し、業績を評価する際に、異なる財務情報を定期的に評価する。本グループはその運営意思決定者が臨時CEOであることを決定した。
主な顧客に関する情報です2023年,2022年および2021年12月31日までの年間で確認された収入は,百時美施貴宝社(“BMY”)、Celgene Swiss LLC(“Celgene”)(提携開始後にBMYに買収された会社),セノフィ(“Sanofi”),Merck KGaA,ドイツDarmstadt(“Merck KGaA,Darmstadt,ドイツ”),バイエル株式会社(“Bayer”),GTA,およびグループとRallyBio IPB,LLC(“RallyBio”)の合弁企業,RE Ventures I,およびオーストリアのレガシーグループとの契約に関連している
各時期の顧客別収入比率は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| % | | % | | % |
| BMY(Celgeneを含む) | 72 | | 77 | | 80 |
| セノフィ | 25 | | 16 | | — |
| メルク社 | 3 | | — | | — |
| 一般臨時人員 | — | | — | | 13 |
| 他の人は | — | | 7 | | 7 |
| 100% | | 100% | | 100% |
地域別の非流動資産情報。 本グループの非流動資産は以下の地域に保有している2023年12月31日: | | | | | | | | | | | | | | | | | | | | | | | |
| イギリス.イギリス | | オーストリア | | 世界の他の地域 | | 合計する |
| £’000 | | £’000 | | £’000 | | £’000 |
| 商誉 | 173 | | | 6,013 | | | — | | | 6,186 | |
| その他無形資産、純額 | 2,815 | | | 25,644 | | | — | | | 28,459 | |
| 財産·工場·設備·純価値 | 42,059 | | | 6,467 | | | 428 | | | 48,954 | |
| 使用権資産、純額 | 9,177 | | | 6,634 | | | 2,702 | | | 18,513 | |
2022年12月31日現在、グループの非流動資産は以下の地域にある | | | | | | | | | | | | | | | | | | | | | | | |
| イギリス.イギリス | | オーストリア | | 世界の他の地域 | | 合計する |
| £’000 | | £’000 | | £’000 | | £’000 |
| 商誉 | 173 | | | 6,148 | | | — | | | 6,321 | |
| その他無形資産、純額 | 2,688 | | | 30,914 | | | — | | | 33,602 | |
| 財産·工場·設備·純価値 | 30,893 | | | 6,647 | | | 108 | | | 37,648 | |
| 使用権資産、純額 | 10,403 | | | 4,391 | | | — | | | 14,794 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
5.収入.収入
本グループの2023年、2022年および2021年のカテゴリ別収入は以下の通り
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| サービス料 | 104 | | | 670 | | | 452 | |
| ライセンス料-ある時点で確認された選択加入支払いとマイルストーン | — | | | — | | | 18,583 | |
| ライセンス料--時間経過確認 | 19,975 | | | 26,553 | | | 8,324 | |
| 20,079 | | | 27,223 | | | 27,359 | |
収入は契約履行義務を履行した後に確認され、履行義務は貨物又はサービスの制御権が顧客に移転したときに発生する。長期的に履行された債務については,本グループが確認した収入は,本グループが関連履行義務の履行から実現した利益レベルを確実に見積もることができるように,新協力成立日から協力が十分に進展するまでの回収可能コストに相当する.協力がスケジュールの開始時に制限された重大な可変対価格を含む場合、これは、契約の初期段階で総損失を確認することをもたらす可能性がある。
サービス料は,2023年12月31日,2022年,2021年12月31日までの年間で,サービス料はExScience a GmbHが持つレガシー契約による収入に関連しており,それに関する収入はある時点で確認されている。
2021年12月31日までの年間でGBは14,437,000GB以外にも,グループとCelgeneの連携により実現された候補選択加入マイルストーンが認められた3,349,000本グループとGTAが協力して取得した候補者選抜マイルストーンに関する収入を確認した。
2022年1月4日、同グループはセノフィと戦略研究協力を達成し、人工知能駆動の精密工学薬物パイプラインを開発した。研究は最も多くに集中します15腫瘍学と免疫学にまたがる新しい小分子候補対象と関連して、集団は前払い現金を獲得し、金額はGBです74,242,000 ($100,000,000)、潜在的価値は$5,200,000,000全体的に言えば,マイルストーンには連携期間の階層印税が加えられる.
2022年3月11日、BMYは以下のようにグループとの初の協力手配を延長した6か月専門家グループの正確な医療プラットフォームを利用して協力下の主な目標に翻訳能力を使用することを含むより多くのデータを生成するために、専門家グループは#ドルの現金支払いを受け取った5,000,000 (£3,821,000).“国際財務報告基準”第15段落の21 b段落によれば、長期延期支払は、協力部分が履行されていない設計·開発協力目標候補者に関する業績義務に関する取引価格の付加額とみなされ、関連業績義務履行の進捗状況に基づいて当該日の収入を累積確認する。取引価格の残り部分は、業績義務履行時に2022年残時間の収入であることが確認される。
2022年5月30日、双方の同意により、本グループはバイエル株式会社との以前に存在した協力手配を終了した。契約終了時には,契約に関するすべての残りの履行債務がすべて履行されたとみなされ,収入総額がGBであることが確認された1,153,000その瞬間です。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
2023年7月27日、当グループとセノフィ社は、双方が2022年1月4日に署名した協力協定を改訂し、この合意に基づいて、いくつかの目標代替およびマイルストーン支払いを含む協力目標に関するいくつかの条項を修正した。改訂日に、全体の契約取引価格は改訂によって変更されておらず、一部の履行責任確認を果たした収入も重大な調整がない。
2023年9月19日、本グループはドイツダムシュタットのメルクKGaA医療保健業務(“メルクKGaA、ドイツダムシュタット”)と協力協定を調印し、ExScience aの人工知能駆動の精確な薬物設計と発見能力を利用して、腫瘍学、神経炎学と免疫学領域の新しい小分子候補薬物を発見することに重点を置いている。3つの潜在的な一流または一流の潜在的目標は、パートナーシップの初期重点として決定されており、これに関連して、専門家グループは現金#ドルの前払いを受信した20,100,000(源泉徴収税#ドルを差し引いた純額3,181,0002024年下半期に受信予定)、潜在金額は#ドルに達する674,000,000発見、開発、規制、販売に基づくマイルストーンについては、純売上高の特許権使用料を支払うことを除いて。
2023年9月27日、専門家グループは、グループとセノフィがその最初の炎症と免疫学的目標の協力について研究マイルストーンを取得し、GBの現金支払いを受けたことを確認した3,191,000 ($4,000,000)である。実現前には,このマイルストーンは関連項目に関連する薬物設計作業に関する制限された可変対価とされていたため,実現日から関連部分の義務履行の取引価格を計上し,収入は義務履行であることが確認された
2023年12月21日、専門家グループは、現在サイノフィとの協力を修正し、ExScience aによって決定され、初歩的に提案された新しい発見段階計画を追加し、これに関連する現金支払いは#ドルである4,000,0002024年2月に受け取り、収入は関連業績義務の履行とともに時間の経過とともに確認された。修正された合意条項によると、そのグループは最大#ドルを得る資格がある45,000,000前払金と臨床前マイルストーン支払い、および開発、規制、および販売に基づくマイルストーン支払いは$を超える300,000,000製品販売の等級別印税です
2023年12月31日までの年間で、収入には総額GBの金額が含まれています6,859,000本グループとBMY持続協力プロジェクトの払戻不可前払い金に関連して,年内に収入が確認されており,双方はこのようなプロジェクトを継続しないことを決定し,協力内の他の項目を優先的に処理しているからである
当グループは、ビジネスパートナーとの重大な協力計画を評価しており、それぞれの契約義務を履行する余剰不可避コストに対する将来の現金流入および各協力の余剰契約負債金額を考慮して、2023年12月31日に将来の経営損失に備える必要がないことを決定した。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
地理的市場によって分けられます
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| イギリス.イギリス | — | | | — | | | — | |
| フランス | 5,075 | | | 4,379 | | | — | |
| ヨーロッパの他の国 | 619 | | | 1,846 | | | 1,599 | |
| アメリカ合衆国 | 14,385 | | | 20,998 | | | 22,197 | |
| 世界の他の地域 | — | | | — | | | 3,563 | |
| 20,079 | | | 27,223 | | | 27,359 | |
上表は,本グループが期間内にサービスを提供するクライアント本部の地理的位置であり,サービスを提供する場所ではない.
収入確認時間:
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 時間とともに返済された債務に関する収入 | 19,975 | | | 26,553 | | | 12,804 | |
| ある時点で返済された債務に関する収入 | 104 | | | 670 | | | 14,555 | |
| 20,079 | | | 27,223 | | | 27,359 | |
2023年度にはGBゼロ以前の期間に履行または部分的に履行された履行義務と関係があることが確認された(2022年:GB3,559,000, 2021: £ゼロ). £19,528,000契約負債残高に当初計上された当期収入(2022年:GB)の確認18,223,000).
12月31日現在、残りの履行債務(未清算または部分未償還)に割り当てられた取引価格(制約された可変対価格を含まない)は以下の通りである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 1年以内に | 25,036 | | | 29,433 | | | 21,203 | |
| 1年余り | 65,466 | | | 58,451 | | | 7,743 | |
| 90,502 | | | 87,884 | | | 28,946 | |
契約満期日は、いつ収入を確認するための本グループの基本コストの最適な見積もりを反映している。契約負債残高の詳細は付記18と24に記載されている。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
6.その他の収入 | | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 補助金収入 | 1,249 | | | 1,819 | | | 2,096 | |
| 研究開発支出を免除する | 5,387 | | | 3,923 | | | 1,653 | |
| 6,636 | | | 5,742 | | | 3,749 | |
2023年1月1日にグループ経営四つ贈与には、欧州政府贈与、ゲイツ財団贈与、オーストリア研究促進局(“FFG”)贈与、オーストリアWirtshaftsサービス機関贈与が含まれ、欧州政府贈与はその後、2023年4月に終了した。ゲイツ財団との寄付は研究と開発活動を実行するために発生した一部の人員、消耗品と管理費用に補償を提供するが、FFG贈与は高含有量の顕微鏡と深度学習による固体腫瘍患者サンプル中の薬物作用の早期テストに関連する。オーストリアWirtshaftsservice贈与は、2020年8月から2022年2月末までの間に行われる資本投資に資金を提供します
2023年11月15日,グループはOpen慈善プロジェクト有限責任会社の贈与を獲得し,これに関連してグループはGBを獲得した1,895,000 ($2,300,000)を援助して、インフルエンザおよび新冠肺炎に対する既知の抗ウイルス作用を満たすために、インターフェロン反応を活性化するための重要な側面をさらに探索するための要件を提供する。この贈与は,関連研究や開発活動の展開で発生した一部の人員,消耗品,間接費用を補償するために用いられる。
上記の贈与に関するすべての金額は、2023年12月31日までに受け取りました(2022年:GB561,000傑出している)。
7.営業損失
以下の項目はすでに営業損失に計上されている
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 財産·工場·設備の減価償却 | 7,330 | | | 3,092 | | | 1,432 | |
| 使用権資産減価償却 | 3,567 | | | 1,747 | | | 848 | |
| 無形資産の償却 | 4,671 | | | 4,645 | | | 1,903 | |
| 財産·工場·設備の減価 | 1,307 | | | — | | | — | |
| 激務レンタル費用 | 807 | | | — | | | — | |
| 研究開発費 | 128,444 | | | 128,865 | | | 44,047 | |
| 外国為替損失/(収益) | 1,541 | | | (33,609) | | | (938) | |
| 長期契約損失 | — | | | 11,287 | | | — | |
| 株式ベースの支払費用 | 24,350 | | | 30,576 | | | 10,466 | |
| 集団計数師に支払われる費用、グループ及び会社の財務諸表を監査するための | 915 | | | 904 | | | 637 | |
| 当グループの計数師が提供する他の監査サービス | 281 | | | 233 | | | 1,164 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
8.財政収入
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 銀行利子収入 | 16,628 | | | 5,681 | | | 26 | |
| 16,628 | | | 5,681 | | | 26 | |
本グループがそれぞれ2023年、2023年および2022年12月31日までの12ヶ月間に締結した各短期銀行預金取引の詳細は付記27を参照されたい。
9.財務費用
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 銀行の利子をまかなう | 12 | | | 27 | | | 16 | |
| ローンの利息を払う | 3 | | | 2 | | | 2 | |
| 賃貸負債利息支出 | 1,028 | | | 299 | | | 149 | |
| 配当金を解除する | 24 | | | 6 | | | 2 | |
| 1,067 | | | 334 | | | 169 | |
10.従業員福祉支出
従業員福祉支出(取締役を含む)は、 | | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 給料と賃金 | 54,922 | | | 42,738 | | | 15,006 | |
| 社会保障費 | 10,428 | | | 6,845 | | | 3,147 | |
| その他年金費用 | 2,523 | | | 1,542 | | | 526 | |
| 株式ベースの支払費用 | 24,350 | | | 30,576 | | | 10,466 | |
従業員福祉支出総額 | 92,223 | | | 81,701 | | | 29,145 | |
この間、同グループが雇用した平均人数(取締役を含む)は以下の通りである | | | | | | | | | | | | | | | | | |
| 2023 | | 2022 | | 2021 |
| 番号をつける | | 番号をつける | | 番号をつける |
| 研究開発 | 427 | | 344 | | 151 |
| 管理と運営 | 74 | | 62 | | 24 |
| 501 | | 406 | | 175 |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
11.役員報酬とキー管理者報酬
役員報酬: | | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 役員報酬 | 1,607 | | | 3,010 | | | 1,537 | |
| 確定拠出年金計画への供出 | 3 | | | 3 | | | 2 | |
報酬総額 | 1,610 | | | 3,013 | | | 1,539 | |
退職給付を計算する2取締役(2022年:2, 2021: 2)である。株式オプションが付与される62023年取締役(2022年:5, 2021: 4)と5取締役は2023年の間にオプションを行使する(2022年:3, 2021: 1).
最高報酬の役員について: | | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 短期従業員福祉 | 620 | | | 542 | | | 491 | |
| 確定拠出年金計画への供出 | 1 | | | 1 | | | 1 | |
| 621 | | | 543 | | | 492 | |
この間、最高を支払った役員が株式オプションを行使した。(2022年:ありません, 2021: ありません).
重要な管理職の報酬
本年度の主要管理職の報酬(執行役員に関する報酬を含む)は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 短期従業員福祉 | 2,409 | | | 1,954 | | | 1,438 | |
| 株式ベースの支払い | 8,165 | | | 7,895 | | | 3,248 | |
| 確定拠出年金計画への供出 | 38 | | | 24 | | | 15 | |
| 職を失った補償 | 360 | | | — | | | — | |
| 10,972 | | | 9,873 | | | 4,701 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
12.税収
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 当期税額 | | | | | |
| 英国の今年度の赤字当期税額 | (14,120) | | (20,459) | | (6,706) |
| 本年度の海外赤字納税状況 | 275 | | 13 | | 37 |
| 前年度の調整 | (1,411) | | (26) | | (12) |
| (15,256) | | (20,472) | | (6,681) |
| 税金を繰延する | | | | | |
| 時差の発生と逆転 | (869) | | (870) | | (279) |
| 税率変動が期初残高に及ぼす影響 | — | | (565) | | — |
| 繰延税金優遇総額 | (869) | | (1,435) | | (279) |
| | | | | |
| 所得税割引 | (16,125) | | (21,907) | | (6,960) |
| | | | | |
| 一般活動税前損失 | (162,088) | | (140,635) | | (56,191) |
| 正常適用税率 | 23.52% | | 19.00% | | 19.00% |
| 通常活動損失に通常料金をかける | (38,123) | | (26,721) | | (10,676) |
| 以下の要因の影響: | | | | | |
| 固定資産差額 | (22) | | (693) | | (181) |
| 他の恒久的差異 | (3,111) | | (3,727) | | — |
| 税務目的で差し引かれない費用 | 6,698 | | 7,304 | | 3,831 |
| 納税時に差し引くことができない収入 | — | | — | | (1) |
| 研究開発支出の追加控除 | (15,171) | | (15,503) | | (5,185) |
| 研究開発税の還付のために税金の損失を払い戻す | 15,700 | | 6,496 | | 2,173 |
| 研究開発支出を免除する | 789 | | 480 | | 295 |
| 過去の期間の税金の料金を調整する | (1,411) | | (26) | | (12) |
| 外国税収の調整 | (44) | | (395) | | (435) |
| 未確認繰延税金 | 18,570 | | 10,878 | | 3,231 |
所得税割引 | (16,125) | | (21,907) | | (6,960) |
将来の税金に影響を与える可能性がある要素:
2021年春予算で、イギリス政府は2023年4月1日から会社税率を引き上げると発表した25%(ではなく、維持する)19%は、前に作成したように)。この新しい法律は2021年5月24日に正式に公布された。2023年12月31日までの財政年度における現行の加重平均税率は23.5%です。貸借対照表日の繰延税項使用制定された25%税率は、これらの財務諸表に反映されます
イギリスの中小企業計画によると、当グループは現在、資格を満たすイギリスの研究開発費に関する損失を返還し、33.35%に達する現金リベートを獲得している。2023年4月1日以降に発生した資格に適合した研究及び発展支出は、中小企業計画の現金還付比率が18.6%に低下し、当該等の財務諸表に記録されている中小企業の現金還付率を計算する
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
最近採択された“財政条例草案”によるイギリスの研究開発税収免除制度の改正は、この日から申告できる現金還付を資格支出の26.97%に引き上げ、私たちがある会計期間(広義には、資格に適合する研究開発支出が当該会計期間の総支出の40%(あるいは2024年4月1日から、その総支出の30%を占める)あるいはそれ以上の赤字中小企業を占める資格があることを前提としている。2023年12月31日までの会計期間中に研究開発集約型中小企業の資格(したがって、2023年4月1日から2023年12月31日までの間の現金還付は、現在使用されている18.6%ではなく、条件に適合した支出の26.97%で申請できる)と判定されれば、2023年12月31日までの年度の所得税優遇を増加させることになると予想される3,961,000.
また、改正案は、2024年4月1日から施行され、(I)(限られた例外が適用されない限り)下請け研究開発活動または外部から提供される労働者の支出に申請可能な税収減免に制限が加えられ、そのような下請け活動がイギリスで行われていない場合、またはそのような労働者がイギリス賃金税を支払う必要がない場合、(Ii)中小企業計画とRDEC計画を計画に統合する。もし私たちが研究開発集約型中小企業の資格を満たしていなければ、私たちの研究開発活動について現金リベートを申請することができなくなり、あるいは現在よりはるかに低い比率でこのような現金リベートを得ることができるようになるだろう。これらおよび将来的にイギリスが開発した税収減免計画の他の潜在的な変化は、私たちがこれらの税金減免を享受する資格がなくなったこと、または私たちがクレームを立てることができたり、そこから利益を得ることができる程度に実質的な影響を与えることを意味するかもしれない。
13.1株当たり基本損失と希釈1株当たり損失 | | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £ | | £ | | £ |
| 本年度の基本損失と希釈損失(GB) | (145,963,000) | | | (118,728,000) | | | (49,231,000) | |
| 基本と希釈加重平均株数 | 124,197,000 | | | 122,119,635 | | | 49,876,081 | |
| 1株当たり基本損失と希釈損失(GB) | (1.18) | | | (0.97) | | | (0.99) | |
1株当たりの基本損失は、国際会計基準第33号(“1株当たり利益”)に基づいて、当社株主が利益及び期内に発行された株式の加重平均を占めるべきである
会社が2021年10月5日に初公募するとともに、ExScience a plcのすべての普通株と優先株株主が保有する既存株式1株ずつを300GBは普通株式を新規発行する0.0005会社のすべての人です。すべての期間に1株当たりの損失を計算するための発行済み普通株は、この株式分割を反映しており、国際会計基準第33号64段落の原則に適合している。
当社は従業員に業績株式購入、株式購入、制限株式単位(“RSU”)および業績株式単位(“PSU”)を発行し、行使後すぐに普通株を発行する。これらの奨励を含めると、期間内に発生した1株当たりの損失に対して逆償却作用が生じるため、1株当たりの基本損失と希釈後の1株当たりの損失は同じである。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
14.無形資産と商業権
| | | | | | | | | | | | | | | | | |
| 商誉 | 取得したIPアドレス | コンピュータソフト | 特許 | 合計する |
| £’000 | £’000 | £’000 | £’000 | £’000 |
| コスト | | | | | |
| 2021年12月31日 | 5,985 | | 38,054 | | 98 | | 150 | | 44,287 | |
| 足し算 | — | | — | | 53 | | — | | 53 | |
| 外貨換算 | 336 | | 2,055 | | — | | — | | 2,391 | |
| 2022年12月31日 | 6,321 | | 40,109 | | 151 | | 150 | | 46,731 | |
| 足し算 | — | | — | | 200 | | — | | 200 | |
| 外貨換算 | (135) | | (827) | | — | | — | | (962) | |
| 2023年12月31日 | 6,186 | | 39,282 | | 351 | | 150 | | 45,969 | |
| 累計償却する | | | | | |
| 2021年12月31日 | — | | 1,850 | | 77 | | 45 | | 1,972 | |
| 研究開発費を償却します | — | | 4,611 | | 16 | | 15 | | 4,642 | |
| 償却費用--G&A費用 | — | | — | | 3 | | — | | 3 | |
| 外貨換算 | — | | 191 | | — | | — | | 191 | |
| 2022年12月31日 | — | | 6,652 | | 96 | | 60 | | 6,808 | |
| 研究開発費を償却します | — | | 4,601 | | 47 | | 15 | | 4,663 | |
| 償却費用--G&A費用 | — | | — | | 8 | | — | | 8 | |
| 外貨換算 | — | | (155) | | — | | — | | (155) | |
| 2023年12月31日 | — | | 11,098 | | 151 | | 75 | | 11,324 | |
| 帳簿価値 | | | | | |
| 2023年12月31日 | 6,186 | | 28,184 | | 200 | | 75 | | 34,645 | |
| 2022年12月31日 | 6,321 | | 33,457 | | 55 | | 90 | | 39,923 | |
IP-Allcellを買収しました 2021年8月18日、グループは公正価値GBで知的財産権を買収する36,078,000Allcellが同社の一部を買収するために使用している薬物鏡技術に関連している。この知的財産権はしばらくの間償却されるだろう8買収の日から数年。
営業権合計GB5,887,000この買収の一部としても買収され、本グループが買収から期待する追加価値と、集合した労働力を代表している。
このグループは以下のメンバーからなる1つは薬物発見活動に関わるCGUよりも。2023年12月31日までの商標権と薬物検査知的財産権の減値審査を行い,使用価値モデルを用いてCGUの回収可能金額とその帳簿価値を比較する方法である。割引キャッシュフロー方法を用いて、主に本グループが提供した内部及び協力計画数、薬物開発の各段階の持続時間及び総コスト、臨床試験の完成及びいくつかの監督管理許可を取得するコスト、製品販売量及び監督管理許可を取得した後の特許失効時間に関連すると仮定した。そして成功確率を薬物開発の各段階に適用し,薬物が商業化に成功できない可能性がある可能性を反映した
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
その他の主な投入は,他の業務や行政管理費用および資本支出に関する費用に関するものである。キャッシュフローは1年以内に201年の期間は、規制部門の承認を得た特許が満了するまで、薬物設計、開発、商業化に要する時間に基づいて議論される。終値成長率は2.0その後%適用しました。
そして,このモデルから決定されたキャッシュフローは割引率を用いて現在値に割引される14%です。これらの仮定は業界文献に基づいており,可能な場合には,その集団が候補薬物を開発した経験に基づいている。今回の審査では何の減価も認められなかった。敏感性分析を行うのは,重大な仮定の合理的な変化が帳簿価値がその回収可能金額を超えるかどうかを決定するためであり,合理的な可能性のない変化が減値を招くことを示している。
IP-GT ApeIron連携を獲得する. 2021年7月1日、同集団はGTAと共同行動を展開し、持続可能な高価値、一流の治療薬物ルートを構築した。この手配の一部として、双方の以前の協力手配を終了し、専門家グループは1ポンドを支払った1,448,000そして諦めました30先に存在した協力協定でマイルストーンに達して売掛金となったGTA株式の割合と,これらの金額の公正価値総額2,543,000この日に買収された無形知的財産権として資本化する。無形資産は、共同行動に参加して共同制御権を獲得するグループが予め存在する協力目標における知的財産権に関する
期間内に知的財産権についていかなる償却費用も確認されていないため、2023年12月31日にこの資産の減価審査を行った。資産の回収可能金額がその帳簿価値を超えることを決定するために使用価値評価を行った。割引キャッシュフロー方法を採用して、肝心な仮定は薬物開発の各段階の持続時間と総コスト、臨床試験の完成とある監督管理の許可を得るコスト、製品の販売量と監督管理の許可を得た後の特許期限の時間帯に関連する。そして成功確率を薬物開発の各段階に適用し,薬物が商業化に成功できない可能性がある可能性を反映した。そして,このモデルから決定されたキャッシュフローは割引率を用いて現在値に割引される14%です。キャッシュフローは1年以内に201年の期間は、規制部門の承認を得た特許が満了するまで、薬物設計、開発、商業化に要する時間に基づいて議論される。これらの仮定は業界文献に基づいており,可能な場合には,その集団が類似候補薬物を開発した経験に基づいている。何の被害も認められなかった。
営業権-動的発見買収。 営業権はGBに相当する173,0002018年11月23日にKinetic Discovery Limitedを買収した。この名誉の価値はどうでもいいとされていることから、2023年12月31日に減値審査は行われていない。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
15.不動産·工場および設備
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 建設中資産 | | 工場と設備 | | 固定装置及び取付具 | | 賃借権改善 | | コンピュータ装置 | | 合計する |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| コスト | | | | | | | | | | | |
| 2022年1月1日 | 637 | | | 6,108 | | | 345 | | | 3,335 | | | 779 | | | 11,204 | |
| 足し算 | 25,755 | | | 4,391 | | | 398 | | | 310 | | | 1,123 | | | 31,977 | |
| 建設中資産の再分類 | (4,053) | | | 1,593 | | | — | | | 2,460 | | | — | | | — | |
| 外貨換算 | — | | | 42 | | | 3 | | | — | | | 2 | | | 47 | |
| 2022年12月31日 | 22,339 | | | 12,134 | | | 746 | | | 6,105 | | | 1,904 | | | 43,228 | |
| | | | | | | | | | | |
| 足し算 | 14,837 | | | 4,205 | | | 151 | | | 720 | | | 148 | | | 20,061 | |
| 建設中資産の再分類 | (31,045) | | | 11,019 | | | 284 | | | 19,702 | | | 40 | | | — | |
| 処置する | — | | | (4) | | | — | | | — | | | — | | | (4) | |
| 外貨換算 | 15 | | | (88) | | | (7) | | | (50) | | | (4) | | | (134) | |
| 2023年12月31日 | 6,146 | | | 27,266 | | | 1,174 | | | 26,477 | | | 2,088 | | | 63,151 | |
| | | | | | | | | | | |
| 減価償却累計 | | | | | | | | | | | |
| 2022年1月1日 | — | | | 1,301 | | | 102 | | | 829 | | | 232 | | | 2,464 | |
| 償却費-研究開発費 | — | | | 1,895 | | | 27 | | | 626 | | | 332 | | | 2,880 | |
| 減価償却費用-G&A費用 | — | | | — | | | 25 | | | 136 | | | 51 | | | 212 | |
| 外貨換算 | — | | | 21 | | | — | | | — | | | 3 | | | 24 | |
| 2022年12月31日 | — | | | 3,217 | | | 154 | | | 1,591 | | | 618 | | | 5,580 | |
| | | | | | | | | | | |
| 償却費-研究開発費 | — | | | 4,049 | | | 162 | | | 2,187 | | | 403 | | | 6,801 | |
| 減価償却費用-G&A費用 | — | | | — | | | 61 | | | 399 | | | 69 | | | 529 | |
| 研究開発費の減価費用です | 1,307 | | | — | | | — | | | — | | | — | | | 1,307 | |
| 処置する | — | | | (1) | | | — | | | — | | | — | | | (1) | |
| 外貨換算 | — | | | (13) | | | (1) | | | (1) | | | (4) | | | (19) | |
| 2023年12月31日 | 1,307 | | | 7,252 | | | 376 | | | 4,176 | | | 1,086 | | | 14,197 | |
| | | | | | | | | | | |
| 帳簿価値 | | | | | | | | | | | |
| 2023年12月31日 | 4,839 | | | 20,014 | | | 798 | | | 22,301 | | | 1,002 | | | 48,954 | |
| 2022年12月31日 | 22,339 | | | 8,917 | | | 592 | | | 4,514 | | | 1,286 | | | 37,648 | |
建設中の資産の移転は主に賃貸改善と工場や設備に関連しており、その大部分は2023年に購入して使用するミルトン公園の工事現場に関連している
減価料金はGBです1,307,000我々の生物製品計画買収のいくつかの工場や設備に関連していることが2023年12月31日までに年度内に確認された。私たちの努力を私たちの小分子計画に集中させた戦略決定に関連して、私たちの生物製品計画は2023年第4四半期に優先順位を取り消された。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
16.合弁企業と共同経営への投資
合弁企業への投資
当社グループが権益法で計測した財務状況表に保有して計上します
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 名前.名前 | | 株式種別 | | 持っている | | 登録国·地域 | | 主体活動 | | 登録住所 |
| Re Ventures I,LLC(米国) | | 普通だよ | | 50% | | アメリカです。 | | 合弁会社の設立は珍しい病気を治療する新しい化合物を開発するためです | | 1980年デラウェア州ウィルミントン小滝251番地 |
| Re Ventures II,LLC(米国) | | 普通だよ | | 50% | | アメリカです。 | | 合弁会社の設立は珍しい病気を治療する新しい化合物を開発するためです | | 1980年デラウェア州ウィルミントン小滝251番地 |
2019年の間にグループが設立されました50RallyBioはRallyBioと協力し、RallyBioチームの治療領域における深い専門知識とExScience a独自人工知能プラットフォームを結合し、ある稀な疾病に斬新な小分子療法を提供する。2023年までの追加資本貢献総額はGB1,827,000 (2022: £242,000)は、本グループが作成します。
権益法によると、この合弁企業は以下のように確認した
| | | | | | | | | | | |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 1月1日まで | — | | | 424 | |
| 追加株 | 1,827 | | | 242 | |
| 外国為替差益 | (9) | | | 25 | |
| 損失を分担する | (1,645) | | | (691) | |
| 12月31日まで | 173 | | | — | |
研究開発コスト合計1 GB2,174,000 (2022: £302,000)RE Ventures I,LLCにチャージした,違います。2023年12月に確認された契約資産(2022年:GBゼロ).
2023年12月31日または2022年12月31日現在、合弁企業の資本約束に資金を提供する約束はない。
下表は合弁実体RE Ventures I,LLCの財務情報の概要を説明した。本グループは登録成立時に共同経営実体の権益を取得したため、買収前に財務資料がなかった。
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 運営費 | (3,274) | | | (1,720) | | | (2,304) | |
| 当期損失 | (3,274) | | | (1,720) | | | (2,304) | |
全面赤字総額 | (3,274) | | | (1,720) | | | (2,304) | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 | | 2021 |
| £’000 | | £’000 | | £’000 |
| 現金と現金等価物 | 853 | | | 253 | | | 1,178 | |
| 流動資産 | — | | | 3 | | | 91 | |
| 流動負債 | (479) | | | (209) | | | (78) | |
| 会員黒字 | 374 | | | 47 | | | 1,191 | |
2022年にはさらにグループを作りました50%はRallyBio,RE Ventures II,LLCと合弁企業を設立し、目標は同じです。このエンティティが成立してから2023年12月31日まで、当該エンティティとは何の取引も行われず、何の出資も行われていない。
合同作戦
ExScience aとEvotec AGには共同契約があり,最初は双方が権利を持っていた50%の所有権を持っている三つ協力している新しい化合物ですこの連携業務は単独の法的実体で組織されているのではなく,ExSciences aとEvotec AGそれぞれの主要な営業場所で運営されている.Evotecは2021年4月にこの手配に関する選択脱退権を行使し、協力知的財産権開発の各段階でその所有権を下方に改訂し、その所有権は402023年12月31日までの割合。Evotecの所有権は将来の開発段階でさらに減少するが,商業化時の最低レベルである10%です。2023年1月1日現在、新規化合物EXS 21546(‘546)に関する活動が行われている。同社は2023年10月3日まで、’546年に内部開発を停止すると発表した
2020年9月25日、ExScience aはBlue Oak PharmPharmticals Inc.(“Blue Oak”)と共同契約取り決めを締結した。2023年8月8日、ExScience aおよびBlue Oak PharmPharmticals Inc.は、この連携プロトコルを終了した。この手配の目的は一つのプロジェクトを協力して、神経変性疾患を治療するための二重標的(二重特異性)小分子を設計することである。終了により決済金額が支払われていないし、資産減価も記録されていない。双方とも目標区域内で作業する権利を保持している。
2021年5月26日、グループは、デラウェア州の会社EQRx Inc.(“EQRx”)と共同行動を展開し、高価値療法の革新候補薬剤を決定、発見、開発した。協力は2023年10月9日に革命医薬会社がEQRxを買収した後に終了することを発表し、当時、当グループは協力開始時にEQRxが事前に支出した合意された未使用資金を返還することに同意し、当グループが協力合意に基づいて負担した財務義務を完全に履行することに同意した。手配の一部として、本グループはすべての知的財産権のすべてと独占権利を獲得します三つ連携中に作成された初期目標。したがってドルは8,750,0002023年10月12日にEQRxに移された。
上記付記14で述べたように、専門家グループは2021年7月1日にGTAと共同行動を展開した。協力の目的は多種の小分子治療薬物候補薬物の発見を加速し、細胞周期駆動癌を選択的に治療し、CDK新療法のパイプラインを確立し、双方が協力して産生した任意のパイプライン製品を平等に持ち、発生したコストを二等分することである。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
2022年11月14日、ExScience aとMD Andersonは人工知能を用いて新しい腫瘍学的治療方法を開発するための共同行動を行った。この研究協力はExScience aの精確な医学プラットフォームを利用して、共同で確定した治療標的に基づいて、新型の抗癌、細胞固有の小分子化合物を識別する。有望な候補者はMD Andersonの治療発見部門のチームとともにさらに発展する。MDアンダーソンとエクスナーは,成功した標的発現計画がMDアンダーソンの概念検証臨床試験に入る可能性が予想される。合意条項によると、ExScience aとMD Andersonは、指定されたプロジェクトごとに共同で貢献し、支援を提供します。そして、任意の協力知的財産権は共通に所有され、所有権の割合は発生するコストに依存し、目標コスト分担比率は50%.
2023年12月31日まで、2023年12月31日及び2022年12月31日までに、買収した当グループとGTAとの連携に関する無形知的財産権を除いて、上記のいずれの連携業務に関する協力知的財産権の資本化はない付記14.
17.賃貸借証書
使用権資産:
| | | | | |
| £'000 |
| コスト | |
| 2022年1月1日 | 6,625 | |
| 足し算 | 9,502 | |
| 賃貸借変更 | 1,759 | |
| 処置する | (161) | |
| 外貨換算 | 133 | |
| 2022年12月31日 | 17,858 | |
| 足し算 | 6,775 | |
| 賃貸借変更 | 742 | |
| 処置する | (157) | |
| 外貨換算 | (214) | |
| 2023年12月31日 | 25,004 | |
| 減価償却累計 | |
| 2022年1月1日 | 1,471 | |
| 償却費-研究開発費 | 1,468 | |
| 減価償却費用−G&A費用 | 279 | |
| 処置時に | (161) | |
| 外貨両替面 | 7 | |
| 2022年12月31日 | 3,064 | |
| 償却費-研究開発費 | 3,077 | |
| 減価償却費用-G&A費用 | 490 | |
| 処置する | (125) | |
| 外貨換算 | (15) | |
| 2023年12月31日 | 6,491 | |
| 帳簿価値 | |
| 2023年12月31日 | 18,513 | |
| 2022年12月31日 | 14,794 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
すべての使用権資産は賃貸物件と関連がある。2023年1月1日までにグループは10個以下の事項に関する従来のリース契約四つイギリスに本部を置く不動産と1つはオーストリアです。
当グループはすでに加入しております二つ7年制2021年9月3日オーストリアウィーンの実験室とオフィススペースでのレンタル手配。オフィススペースレンタル期間は2022年12月1日から始まり、2029年12月に満了する。この実験室空間のレンタル期間は2023年1月26日から開始される。毎年1月から、毎年のレンタル料はオーストリア統計局が前年9月に発表した消費者物価指数に基づいて指数を作成する
2022年7月1日、本グループはアメリカマサチューセッツ州ボストンにある物件について賃貸手配を締結した。賃貸借契約は2023年1月23日に開始され、2033年6月23日に満期となる
2022年12月、本グループはアメリカフロリダ州マイアミの物件について賃貸手配を締結した。賃貸開始日、すなわち所有者が当グループに物件を提供する日は、現在2024年第1四半期に満了する予定であるため、2023年12月31日までの年度内に、本賃貸に関する使用権資産確認はありません。レンタル契約は2034年6月1日に満期になります。本賃貸契約のさらなる詳細については、付記3を参照されたい。
本グループは2023年10月16日にフロリダ州マイアミの物件について2つ目の賃貸手配を締結し、2029年1月31日に満期になった。
使用権資産合計GB6,692,000本グループについては,2023年12月31日までに,本グループについてウィーン,マイアミおよびボストン賃貸物件について確認した。
2023年5月23日、グループは連合王国ダンディの一部の賃貸住宅に関する賃貸契約を脱退し、GBの使用権資産を処分した157,000.
2023年12月28日、グループは、オックスフォードの敷地の一つに位置する建物の賃貸契約のうちの1つの中断条項を行使しないことを決定した。レンタル期間はその後、レンタル満期日2028年7月28日に修正され、関連使用権レンタル資産はGB増加します742,000それは.この遺跡に関する修復準備を1 GB追加した調整も行われました84,000レンタル期間の変化により。
GBの回復規定200,000GBと500,0002022年に当社グループが年内のレンタルスペースを再開する責任があります二つ当グループの賃貸物件です。必要な作業はそれぞれ2026年と2031年に完了する予定だ。
賃貸負債が満期になる
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 現在のところ | 2,396 | | | 2,641 | |
| 当面ではない | 16,221 | | | 10,942 | |
| 18,617 | | | 13,583 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
本グループのレンタル活動について、以下の金額を確認しました
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 一般行政費で確認する | | | |
| 使用権資産減価償却費用 | 3,567 | | | 1,747 | |
| 短期借約に関する支出 | 286 | | | 409 | |
| 激務レンタル費用 | 807 | | | — | |
| | | |
| 財務費用内で確認する | | | |
| 賃貸負債利息支出 | 1,028 | | | 299 | |
2023年12月31日までの年間記録の激務レンタル費用のさらなる詳細については、付記3を参照されたい。
2023年12月31日、2023年12月31日、2022年12月31日までの未割引賃貸負債契約満期日は以下の通り
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £'000 | | £'000 |
| 1年以内に | 3,399 | | | 2,641 | |
| 1年から5年 | 14,707 | | | 9,682 | |
| 5年以上 | 4,003 | | | 3,930 | |
| 22,109 | | | 16,253 | |
18.その他売掛金および契約資産
当期その他売掛金および契約資産 | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 付加価値税は税金の払い戻しができる | 3,356 | | | 3,040 | |
| 繰り上げ返済する | 5,961 | | | 5,935 | |
| 契約資産と課税収入 | — | | | 176 | |
| 応算銀行利息 | 412 | | | 746 | |
| その他売掛金 | 5,622 | | | 4,721 | |
| 15,351 | | | 14,618 | |
非流動その他売掛金および契約資産
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| その他売掛金 | 663 | | | 100 | |
| 663 | | | 100 | |
非流動その他の売掛金は賃貸物件の保証金に関連しています。それぞれのレンタル条項の終了時に返却しなければなりません
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
本グループの契約資産の変動と計上すべき贈与収入の入金は以下の通り
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年1月1日 | | 収入と確認する | | 控除額 | | 外国為替取引 | | 2023年12月31日 |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| 贈与金 | 176 | | | 117 | | | (293) | | | — | | | — | |
契約総資産と課税収入 | 176 | | | 117 | | | (293) | | | — | | | — | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年1月1日 | | 収入と確認する | | 控除額 | | 外国為替取引 | | 2022年12月31日 |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| 贈与金 | 126 | | | 171 | | | (143) | | | 22 | | | 176 | |
| 協力する | 179 | | | (69) | | | (110) | | | — | | | — | |
契約総資産と課税収入 | 305 | | | 102 | | | (253) | | | 22 | | | 176 | |
19.棚卸しをする
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 原料.原料 | — | | | 15 | |
| 進行中の仕事 | — | | | 35 | |
| — | | | 50 | |
20.現金と現金等価物
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 現金と現金等価物 | 257,568 | | | 403,717 | |
| 制限現金 | 1,895 | | | 860 | |
| 259,463 | | | 404,577 | |
制限現金とは、Open慈善プロジェクト有限責任会社およびゲイツ財団の贈与に関連するいくつかの費用を償還するために、当グループに付与された預金金額を意味する。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
21.株本 | | | | | | | | | | | |
| 2023年12月31日 | | 2022年12月31日 |
| £ | | £ |
| 発行及び払込済み株本 | | | |
125,702,396 (2022: 122,963,545)国標準普通株0.0005どれも | 62,851 | | | 61,482 | |
| 62,851 | | | 61,482 | |
株許可を得た配布されています
| | | | | | | | | | | | | | |
| 2022年12月31日 | 株式ベースの報酬奨励を行使する | 株式を発行する | 2023年12月31日 |
| 普通株 | 122,963,545 | | 2,738,848 | | 3 | | 125,702,396 | |
| 122,963,545 | | 2,738,848 | | 3 | | 125,702,396 | |
合計する2,738,848株式ベースの支払奨励を行使する際に株式を発行する2023年12月31日までの年度内に株式を発行します。詳細は付記30を参照されたい。合計する32023年12月31日までの年間で、従業員に株式を発行する代償はその額面に相当する。
株式種別の権利
普通株保有者には権利がある1つは会社が手を挙げて投票したときの1株当たりの投票権と1つは会議で投票された決議案と書面決議案に対して1株当たり投票する。譲渡繰延株違います。株主の買い戻し前の議決権。
22.埋蔵量
株です株式とは発行された株の額面のことです。
株が割増する。株式割増とは、会社が発行済み株式の額面を超える金額を受け取った金額のことです
資本償還準備金繰延株の解約と買い戻しを代表します
外貨準備本グループの海外機関の財務諸表をポンドに換算することによる換算差異も含まれている。
株式支払準備金。 当社グループ及び会社が付与した株式購入権を代表します
公正価値準備金。 公正価値備蓄には,FVOCIで分類された投資の累積公正価値変動純額が含まれており,その等投資終了確認までである.
合併準備金合併備蓄はグループ再編取引によって発生し、株式交換時のExScience a plcとExScience a AI Limitedとの権益差額を指す。
利益剰余金/累積損失留保収益/累積損失には,本グループの税引後未分配収益と,本グループの企業再編による金額が含まれる.
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
23.税金を繰延する
イギリス.イギリス
グループは2023年12月31日、2023年12月31日および2022年12月31日の繰延税金資産および負債を確認した。本グループの損失履歴から、繰延税金資産全体の回収は十分に確定されていないため、繰延税金資産は固定資産の一時的な違い形式の繰延税金負債が存在する場合にのみ確認される。
GBでは繰延税金資産は確認されていません57,658,000 (2022: £42,358,000)は、GBの短期時間差と関係があります40,788,000 (2022: £31,372,676)およびGBの損失およびその他の控除202,495,000 (2022: £167,305,000)は、基礎固定資産時間差(GB)によって相殺される11,985,000 (2022: £29,247,000).
| | | | | | | | | | | |
| 公認の | 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 繰延税金資産 | | | |
| 他の一時的な違い | 3,115 | | | 7,312 | |
| | | |
| 繰延税金負債 | | | |
| 固定資産の一時的差異 | (3,115) | | | (7,312) | |
| 繰延税項目純資産 | — | | | — | |
| | | | | | | | | | | |
| 識別されていない | 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 繰延税金資産 | | | |
| 損失とその他の控除 | 50,576 | | | 41,827 | |
| 他の一時的な違い | 7,082 | | | 531 | |
| 繰延税項目純資産 | 57,658 | | | 42,358 | |
オーストリア
当グループは、2023年12月31日、2023年12月31日及び2022年12月31日に次の繰延税金資産及び負債を確認します:
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022(1) |
| £’000 | | £’000 |
繰延税金資産 | | | |
他の一時的な違い | 1,649 | | | 1,006 | |
| | | |
繰延税金負債 | | | |
固定資産の一時的差異 | (5,897) | | | (7,072) | |
| 他の一時的な違い | (1,526) | | | (1,006) | |
繰延税金負債,純額 | (5,774) | | | (7,072) | |
(1)“国際会計基準”第12号改正案を採択するために比較数字を再記述する所得税や付記2 eを参照。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
アメリカ合衆国
当グループは、2023年12月31日、2023年12月31日及び2022年12月31日に次の繰延税金資産及び負債を確認します:
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022(1) |
| £’000 | | £’000 |
| 繰延税金資産 | | | |
| 他の一時的な違い | 1,257 | | | 1,008 | |
| | | |
| 繰延税金負債 | | | |
他の一時的な違い | (567) | | | — | |
| 繰延税項目純資産 | 690 | | | 1,008 | |
(1)“国際会計基準”第12号改正案を採択するために比較数字を再記述する所得税や付記2 eを参照。
グループは未確認の繰延税金資産GBを持っています1,006,000 (2022: £660,000)GBの損失と関係があります4,789,000 (2022: £3,144,000).
24.契約負債その他立て替え金
| | | | | | | | | | | | | | | | | | | | | | | |
| 1年以内に | | 1年余り |
| 十二月三十一日 | | 十二月三十一日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| £’000 | | £’000 | | £’000 | | £’000 |
| 契約責任 | | | | | | | |
| 協力を創設する | 25,036 | | | 29,433 | | | 65,466 | | | 58,451 | |
| 契約総負債 | 25,036 | | | 29,433 | | | 65,466 | | | 58,451 | |
| | | | | | | |
| その他の進展 | | | | | | | |
| 贈与金 | 1,970 | | | 959 | | | — | | | — | |
| 合同作戦 | — | | | 8,420 | | | — | | | 719 | |
| その他前払合計 | 1,970 | | | 9,379 | | | — | | | 719 | |
| | | | | | | |
| 契約負債とその他の立て替え総額 | 27,006 | | | 38,812 | | | 65,466 | | | 59,170 | |
契約負債とその他の立て替え変動の入金は以下のとおりである
| | | | | | | | | | | | | | | | | | | | |
| 2023年1月1日 | 足し算 | 損益表で確認する | 他の債権者に譲渡する | 外国為替取引 | 2023年12月31日 |
| £’000 | £’000 | £’000 | £’000 | £’000 | £’000 |
| 贈与金 | 959 | | 2,141 | | (1,127) | | — | | (2) | | 1,971 | |
| 協力を創設する | 87,884 | | 22,655 | | (20,038) | | — | | — | | 90,501 | |
| 合同作戦 | 9,139 | | — | | (2,033) | | (7,106) | | — | | — | |
契約負債とその他の立て替え総額 | 97,982 | | 24,796 | | (23,198) | | (7,106) | | (2) | | 92,472 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
2023年12月31日までの年間で、創収連携に関する契約負債の増加にはGBが含まれている16,238,000 ($20,100,000)ドイツDarmstadtのMerck KGaAに2023年9月19日にこの取引相手と起動した提携に関する領収書を発行し、金額はGB3,274,000 ($4,000,000)とGB3,144,000 ($4,000,000)に研究マイルストーンの実現と新薬発見プロジェクトの起動に関する領収書を発行し,詳細は付記5を参照されたい。
本グループとEQRx International,Inc.(“EQRx”)の協力は2023年10月9日に終了し、当時革命医薬会社はEQRxの買収を発表し、その時、本グループはEQRxが協力開始時に前借りした合意された未使用資金を返還し、当グループが協力合意に基づいて負担した財務義務を完全に履行することに同意した。手配の一部として、本グループはすべての知的財産権のすべてと独占権利を獲得します三つ連携中に作成された初期目標
本グループは関連協力条項に従って創収協力に関する契約責任を確認し、最長期限は2027年12月までと予想されている。本グループは、2022年12月31日現在、2027年12月までの創収協力に関する契約負債を確認する予定です。上記帳簿年齢は、当グループが関連項目の交付によって生じる基本コストがいつ契約負債及びその他の前金を使用することが予想されるかの最適な推定を反映している。
2022年12月31日現在の年間契約負債とその他の立て替え変動状況の入金は以下の通り
| | | | | | | | | | | | | | | | | |
| 2022年1月1日 | 足し算 | 損益表で確認する | 外国為替取引 | 2022年12月31日 |
| £’000 | £’000 | £’000 | £’000 | £’000 |
| 贈与金 | 1,889 | | 715 | | (1,648) | | 3 | | 959 | |
| 協力を創設する | 28,946 | | 85,700 | | (26,769) | | 7 | | 87,884 | |
| 合同作戦 | 15,486 | | — | | (6,347) | | — | | 9,139 | |
| 契約負債とその他の立て替え総額 | 46,321 | | 86,415 | | (34,764) | | 10 | | 97,982 | |
25.条文
| | | | | | | | | | | | | | | | | |
| 条文を修復する | | 激務契約 | | 合計する |
| £’000 | | £’000 | | £’000 |
| 2022年1月1日 | 537 | | | — | | | 537 | |
| 年内に出した準備 | 700 | | | — | | | 700 | |
| 割引を廃止する | 6 | | | — | | | 6 | |
| 2022年12月31日 | 1,243 | | | — | | | 1,243 | |
| 年内に出した準備 | 84 | | | 807 | | | 891 | |
| 割引を廃止する | 23 | | | — | | | 23 | |
2023年12月31日 | 1,350 | | | 807 | | | 2,157 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
GBの規定535,000二零年には当グループに責任があります1つは当グループの賃貸物件です。必要な仕事は2024年と2028年に完了する予定だ
GBの更なる規定200,000GBと500,0002022年に当社グループが年内のレンタルスペースを再開する責任があります二つ当グループの賃貸物件です。必要な作業はそれぞれ2026年と2031年に完了する予定だ。
調整してグループオックスフォード本部の一部に関する修復経費をGBに増やしました84,000関連レンタル期間が延長された場合。現在、必要な仕事は2028年に完了すると予想されている。
流出額と時間をめぐる主な不確実性は,レンタル期間内に必要な修復費用の変化や関連建物の撤退時間に関連する。
2023年12月31日までの年度中に、当グループの1つの賃貸物件の激務契約に関する費用が入金されており、詳細は付記3参照。
26.その他の支払い
当期その他は支払うべきだ
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 応算項目 | 16,238 | | | 15,801 | |
| その他の支払い | 2,087 | | | 814 | |
| 他の税金や社会保障は | 5,897 | | | 2,830 | |
| 会社税 | 111 | | | 10 | |
| 24,333 | | | 19,455 | |
他の支払いは流れません
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| その他の支払い | — | | | 377 | |
| — | | | 377 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
27.金融商品
このグループは以下の金融商品を持っている:
| | | | | | | | | | | |
| 十二月三十一日 |
| 金融資産 | 2023 | | 2022 |
| £’000 | | £’000 |
| 償却原価で持つ | | | |
| 貿易その他売掛金(前払金や税金は含まれていない) | 10,069 | | | 6,266 | |
| 現金と現金等価物 | 259,463 | | | 404,577 | |
| 銀行短期預金 | 103,586 | | | 101,234 | |
| 保監を介して公正価値保有に処す | | | |
| 非上場持分ツールで保有する投資 | 2,145 | | | 2,145 | |
| 375,263 | | | 514,222 | |
| | | | | | | | | | | |
| 十二月三十一日 |
| 金融負債 | 2023 | | 2022 |
| £’000 | | £’000 |
| 償却原価で持つ | | | |
| 貿易その他の支払金(税金、契約債務、その他の立て替えを除く) | 29,662 | | | 47,732 | |
| 貸し付け金 | 306 | | | 313 | |
| リース責任 | 18,617 | | | 13,583 | |
| 共同行動パートナーが提供した他の前払い | — | | | 9,139 | |
| 48,585 | | | 70,767 | |
財務諸表が開示されたように、管理層は公正価値が帳簿額面と実質的に同じだと考えている。共同行動パートナーから受け取ったお金に関する他の前払いは、財務負債に分類され、上表および下表に含まれる。
償却コスト別に金融資産を分類する
本グループは、以下の2つの基準を同時に満たす場合にのみ、その金融資産を償却コストに分類する
•資産をビジネスモデルに保有し、契約キャッシュフローを収集することを目的としています
•契約条項は特定の日にキャッシュフローが発生し,すなわち元金を返済していない元金と利息のみを支払う.
公正価値に応じて確認·計量する金融商品の性質
非上場株式証券-GTAの株式2021年3月31日に発展マイルストーンに達した後、グループはGTAのいくつかの普通株と優先株を獲得する権利がある。当該等株式は非上場株式証券であり、当グループはすでに国際財務報告基準第9号内の選択を採用し、他の全面収益(FVOCI)内の公正価値損益を確認しており、当該等の証券価値に関する損益は実体取引活動の一部とはみなされないためである
2021年7月1日に、本グループと共同手配を締結する協定の一部として、当該等株式の一部の権利を放棄し、詳細は付記14を参照。残りの株式については当該日に受領する。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
本グループの現在のこの投資に対する推定値は、2022年第1期の第三者がGTAに投資する価格を参考にして決定されており、2022年の残りの時間と2023年の残りの時間の内部および他の市場要素の評価に基づいて調整する必要はないと考えられている。
外国為替長期契約2022年6月30日までの3ヶ月以内に、当グループは締結します1つは特定の外国為替取引をセットして、これによって約束をして、未来の日にドルを固定数量のポンドに両替します1つはそして3か月本グループに基づいて将来のキャッシュフロー需要を見積もる取引日から始まる.すべての取引は2022年6月30日までの四半期内に決済され、累計1 GBの損失があります11,287,000それは.この日以降はこのような取引は行われておらず,本グループではデリバティブ金融商品を投機的に使用していない.
価値階層構造を公平にする公正な価値を決定するための投入の信頼性を示すために、グループは、その金融商品を会計基準に規定されている3つのレベルに分けて以下のようにする
レベル1:市場取引を活発にする金融商品(例えば、公開取引のデリバティブや株式証券)の公正価値は、報告期末の市場オファーに基づいている。本グループが保有する金融資産に使用される見積価格は当期入札価格である.これらのツールはレベル1に含まれる.
第2レベル:市場取引が活発に行われていない金融商品(例えば、場外デリバティブ)の公正な価値は、観察可能な市場データを最大限に利用し、エンティティ固有の推定値に可能な限り依存する推定技術を使用して決定される。1つのツールの公正価値に必要なすべての重大な投入が観察される場合、ツールは第2のレベルに計上される。
第3レベル:1つまたは複数の重大な投入が観察可能な市場データに基づいていない場合、そのツールは第3のレベルに含まれる。株式証券が上場されていない場合はそうである。
評価技術の目標は、計量日に資産を売却するか、または市場参加者間の秩序ある取引において負債を移動させて支払う価格を反映する公正な価値計量を得ることである。
重大観察不能投入計量公正価値を使用する(第3級)
| | | | | |
| 非上場株式証券 |
| £’000 |
| 2023年1月1日までの期初残高 | 2,145 | |
| 買収する | — | |
| 他の全面収益で確認された損失 | — | |
| 処置する | — | |
| 2023年12月31日までの期末残高 | 2,145 | |
当グループは公正価値に基づいて非日常的な基礎に従っていかなる金融資産或いは金融負債を計量していない2023年12月31日それは.この間,2級と3級の間に遷移はなく,推定技術も変化しなかった.
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
リスク管理目標経営陣は財政的危険を識別して評価し続けている。当グループが直面している主なリスクは、市場リスク(金利リスクとキャッシュフローリスクを含む)、信用リスク、流動性リスクを含む。
市場リスクです市場リスクとは金融商品の公正価値或いは未来の現金フローが市場価格の変化によって変動するリスクである。当グループにとって、市場リスクには、金利リスクと外貨リスクの2種類のリスクがある
外貨リスク当グループは外貨貨幣資産及び負債を保有しているため外貨両替リスクに直面しているが、外貨貨幣資産及び負債は主に外貨現金及び現金等価物及び貿易売掛金に関連している。このような危険は持続的に基づいて評価される
本グループではデリバティブ金融ツールを用いて通貨両替変動を管理する政策はなく、このようなツールは特定の取引に利用可能であるにもかかわらず、ヘッジ会計を適用していない。
以下の表は,本グループの報告オーバーフローが彼らが直面している為替レートの上昇または10%低下に対する感度分析を示している。敏感性分析は,他のすべての変数が不変のままである場合に,年末未返済残高から計算される。
| | | | | | | | | | | |
| 料率の変化 | 除税前利益への影響 | 公平への影響 |
| | £’000 | £’000 |
| 2023 | | | |
| ドルの為替レート変動 | +10 | % | 9,031 | | 9,092 | |
| -10 | % | (9,031) | | (9,092) | |
| ユーロの変化 | +10 | % | (17) | | 3,648 | |
| -10 | % | 17 | | (3,648) | |
| | | |
| 2022 | | | |
| ドルの為替レート変動 | +10 | % | 6,290 | | 6,051 | |
| -10 | % | (6,290) | | (6,051) | |
| ユーロの変化 | +10 | % | 165 | | 4,631 | |
| -10 | % | (165) | | (4,631) | |
金利リスク当グループの市場金利変動リスクに対するリスクは、当グループの利回り口座に関係している。本グループは現金および現金等価物を含む複数の即時アクセスアカウントを持ち、これらのアカウントは総額GBの浮動金利を支払う必要があります97,292,000 (2022: £370,868,000)である。他のすべての変数が不変のままである場合、金利の増加または1%減少ごとの感受性分析は、GBの利益および持分の増加または減少をもたらす973,000 (2022: £3,709,000).
感受性分析は,報告年度末の変動金利ツールのリスク開放に基づいて決定された。分析を作成する際には,報告年度末の連結残高を年間の残高と仮定した。
信用リスク信用リスクとは取引相手の違約により当グループが財務損失を被るリスクである。信用リスクは、現金残高(銀行預金、現金および現金等価物を含む)、および貿易および他の入金に対する信用リスクの開放から来る。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
本グループの信用リスクに対する最大のリスクは,現金及び現金等価物及び貿易及びその他の売掛金の帳簿価値で表される
信用リスクの管理方法は、任意の顧客を受ける前に顧客に対して監視及び信用検査を行い、国際信用格付け機関が指定した信用格付けの高い銀行に資金を保管することである。
減価貿易売掛金。 既知の個別売掛金収蔵できない直接帳簿金額を減らすことで査定を行う. あったことがある違います。2023年減額(2022年: £ゼロ).
期待された信用損失報告日ごとに、本グループは簡略化方法を用いて材料残高の予想信用損失の損失準備を確認する。
簡略化方法を採用する時、本グループは“違約確率”(“PD”)方法を用いて生涯予想信用損失を確定した。PD方法の下で、予想信用損失は3つの主要なパラメータを使用して計算される:
•対局者民主党
•期待LGD(違約による損失);および
•EAD(デフォルトの場合の予想暴露)
予想信用損失を計算する際に、以下の式を採用する
期待信用損失(ECL)=PD x LGD x EAD
本グループの活動及び売掛金の性質により、管理層はこのような残高の予想信用損失が報告日に重大ではないことを確定した。
資本管理会社です本グループはその資本を管理し、継続的に経営できる企業として確保している。本グループの資本構造には、発行済み資本、株式割増帳簿、および累積損失が含まれている。
本グループはその資本構造を管理し,経済状況の変化に応じて調整する.目標、政策、手続きには、2023年12月31日と2022年12月31日までの年間で大きな変化はない。このグループには外部から適用される資本要求は何もない。本グループの資本構造管理の一部として,資本コストを考慮した
流動性リスク流動資金リスクとは、現金または他の金融資産を決済するための金融負債を履行する上で当グループが困難に遭遇する可能性があるリスクである。本グループは,十分な流動資金を確保することで予測可能な需要を満たすことで,その流動資金リスクを管理することを求めている。
経営陣が流動資金リスクを管理するための財務負債満期日集計表を以下に示す。下表に開示された金額は、契約未割引キャッシュフローであるが、連携業務パートナーから受け取った下敷きを除くものであり、これは、当該等立て替えに関連する基礎コスト発生時間に対する当グループの最適な見積もりに基づいている
12ヶ月以内の満期残高の未割引現金流量は、割引の影響が大きくないため、一般に財務状況表における帳簿価値に等しい
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
2023年12月31日の金融負債満期状況を以下のように分析する
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 帳簿金額 | | 支払いと3ヶ月未満を要求する | | 3ヶ月から12ヶ月 | | 12ヶ月から2年まで | | 2年から5年まで | | 5年以上 | | 契約キャッシュフロー総額 |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| 負債: | | | | | | | | | | | | | |
| 貿易とその他の支払い | (29,662) | | | (29,007) | | | (655) | | | — | | | — | | | — | | | (29,662) | |
| 貸し付け金 | (306) | | | (1) | | | (2) | | | (2) | | | (313) | | | — | | | (318) | |
| リース責任 | (18,617) | | | (812) | | | (2,587) | | | (3,661) | | | (11,046) | | | (4,003) | | | (22,109) | |
| (48,585) | | | (29,820) | | | (3,244) | | | (3,663) | | | (11,359) | | | (4,003) | | | (52,089) | |
利息ローンと借金を計算するグループがAllcellを買収する一部としてグループは€353,000 (£300,000)FFGから。このローンの利息は0.75%は年ごとに返済し、2026年9月30日に返済する.
2022年12月31日の金融負債満期状況を以下のように分析する | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 帳簿金額 | | 支払いと3ヶ月未満を要求する | | 3ヶ月から12ヶ月 | | 12ヶ月から2年まで | | 2年から5年まで | | 5年以上 | | 契約キャッシュフロー総額 |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| 負債: | | | | | | | | | | | | | |
| 貿易とその他の支払い | (47,732) | | | (47,355) | | | — | | | (377) | | | — | | | — | | | (47,732) | |
| 貸し付け金 | (313) | | | (1) | | | (2) | | | (2) | | | (320) | | | — | | | (325) | |
| リース責任 | (13,583) | | | (619) | | | (2,022) | | | (2,576) | | | (7,107) | | | (3,930) | | | (16,254) | |
| 共同行動パートナーが提供した他の前払い | (9,139) | | | (1,572) | | | (6,870) | | | (697) | | | — | | | — | | | (9,139) | |
| (70,767) | | | (49,547) | | | (8,894) | | | (3,652) | | | (7,427) | | | (3,930) | | | (73,450) | |
融資活動による負債変動
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年1月1日 | | キャッシュフロー | | 足し算 | | 利子支出 | | 外国為替取引 | | 処置する | | 2023年12月31日 |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| 利回りと借款 | 313 | | | (2) | | | — | | 2 | | | (7) | | | — | | | 306 | |
| 賃貸負債 | 13,583 | | | (3,194) | | | 7,434 | | | 1,028 | | | (195) | | | (39) | | | 18,617 | |
| 融資活動の総負債 | 13,896 | | | (3,196) | | | 7,434 | | | 1,030 | | | (202) | | | (39) | | | 18,923 | |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年1月1日 | | キャッシュフロー | | 足し算 | | 利子支出 | | 外国為替取引 | | 2022年12月31日 |
| £’000 | | £’000 | | £’000 | | £’000 | | £’000 | | £’000 |
| 利回りと借款 | 296 | | | — | | | — | | | 2 | | | 15 | | | 313 | |
| 賃貸負債 | 4,879 | | | (1,740) | | | 10,033 | | | 298 | | | 113 | | | 13,583 | |
| 融資活動の総負債 | 5,175 | | | (1,740) | | | 10,033 | | | 300 | | | 128 | | | 13,896 | |
他の金融商品です 2022年6月21日、グループ投資GB100,000,0001つになる12か月F 1+で格付けされたイギリスの金融機関に預金する。この短期銀行預金の応算利息は2.35%は、償却コストで計量された金融資産として分類されます。この投資は2023年6月21日に償還される
2023年3月24日、グループ投資GB150,000,0001つになる9ヶ月ですF 1級金融機関での短期預金。この短期銀行預金の応算利息は4.8%は、償却コストで計量された金融資産として分類されます。この投資は2023年12月27日に償還された
2023年7月27日、グループ投資ドル40,000,0001つになる6か月F 1+級金融機関での短期預金。2023年8月11日と8月16日、グループ投資GB45,000,000GBと25,000,000別々に二つに分ける6か月F 1級金融機関での短期預金。これらの短期銀行預金の利息は5.2%, 5.4%和5.4%と、償却コストに応じて計量された金融資産として分類されました
このようなツールについて言えば、公正価値はその帳簿額面と大きな区別がなく、受取/支払利息が現行の市場金利に近いため、あるいはそのようなツールは短期的な性質である。
28.年金承諾
本グループはすべての合資格従業員のために固定出資退職福祉計画を推進している。この計画の資産と本グループの資産はそれぞれ受託者がコントロールする基金形式で保有している.2023年12月31日までの年度確認総支出はGB2,523,000 (2022: £1,542,000)である。期末未納会費はGBです430,000 (2022: £349,000).
29.関係者取引
国際会計基準第24号の定義によると、2023年12月31日までの年度内に、本グループの主要管理者(その報酬は付記11に開示されている)または合営企業(2022年:なし)の開示すべき関連側取引にほかならない。
本グループは2023年,2023年および2022年12月31日までにその合営実体RE Ventures I,LLCと取引を行い,詳細は付記16に掲載されている。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
30.株式ベースの支払い
2022年4月から、会社はすでに従業員と非従業員取締役会メンバーにすべての株式購入権、業績購入株権、RSUとPSUを配布した2021年株式インセンティブ計画(EIP)それは.この日付までのすべての報酬は、以下のレガシー計画に従って発行されます
•企業管理インセンティブ(“EMI”)計画
•会社持分計画(“CSOP”)
•未承認株式計画(“USOP”)
株式ベースの報酬支出総額(株式回収に関する費用を含む)はGB24,350,0002023年12月31日までの年間(2022年:GB30,576,000).
次の表は、奨励タイプ別に、2023年12月31日と2022年12月31日までの年間シェアで計算された支払費用を示しています | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| £’000 | | £’000 |
| 株式オプション | 14,510 | | | 19,959 | |
| 業績株式オプション | 3,005 | | | 2,545 | |
| PSU | 718 | | | 424 | |
| RSU | 4,090 | | | 3,709 | |
| 株を取り戻す | 2,027 | | | 3,939 | |
| 24,350 | | | 30,576 | |
株を取り戻す2021年にAllcellを買収するグループの一部として、総公正価値GBの追加株式証券8,074,000会社の経営陣を務めるAllcell株主に発行されます。これらの株の回収期間は3年買収日から、上記従業員が回収期間内に本グループの職を離れた場合、本グループはその時の額面で株式を購入する。IFRS 3 B 55段落によれば、これらの証券の公正価値は、購入対価から除去され、回収に関連する期間内にシステム別に損益に計上される
2023年12月31日までの年度内に当該等株式に関する株式別支払費用内に確認された総支出はGBである2,027,000 (2022: £3,939,000)である。この費用は研究開発費に含まれている。
株式オプション本グループは従業員及び非執行役員に株式購入権を付与する。これらのオプションは通常回に分けて付与される4年このグループが継続的に雇用されることに関する唯一の帰属条件2023年12月31日までの年度の株式購入に関する資料は以下の通りである | | | | | | | | |
| 株式オプションの数 | 加重平均行権値 |
| 2023年1月1日現在保有しているオプション | 9,809,788 | £0.04 |
| 授与する | 2,946,265 | £0.14 |
| 鍛えられた | (2,294,497) | £0.02 |
| 没収される | (1,003,584) | £0.01 |
| 2023年12月31日現在保有しているオプション | 9,457,972 | £0.08 |
| | |
| 2023年12月31日に行使できます | 4,856,059 | £0.08 |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
2023年12月31日現在の発行済み株式オプションの発行権価格はGBの範囲内です0.02GBまで7.86(2022年12月31日:GB0.02GBまで0.07)である。2023年12月31日までの未償還オプションの加重平均契約期間は7.8年(2022年12月31日:7.8年)。
以下の資料は,確実な期間内に発行されたオプションの公正価値に関係しているブラック·スコアモデルは、株式決済に基づく株式支払いのオプションの公正価値を計算するために使用され、加重平均値は以下のとおりである
| | | | | |
| 行権価格 | £0.0005 |
| 期待寿命 | 6.0年.年 |
| 予想変動率 | 95.7 | % |
| 無リスク金利 | 3.12 | % |
| 期待配当率 | £0.00 |
| 公正価値 | £4.22 |
関連する普通株の公正価値は授出日を当時の為替レートで換算した終値に等しい。無リスク金利は、オプション予想期限に見合った一定期間にわたって米国政府債券が入手可能な金利を参考にして決定される。予想波幅は本グループが初めて公募してから授出日までの期間の株価波幅及び同業グループの分析を参考にして決定した。オプションの期待寿命は、ホーム日と報酬満了日に関する中間点に設定される。
株式オプションを業績する。 業績株式購入は年度ごとに本グループのいくつかの行政人員に付与され、株主の総リターンに関連する市場に基づく業績条件、及び継続的な雇用帰属要求を掲載している。これらの賞品は分けて授与します3年. 2023年12月31日までの年間業績株式オプションに関する情報は以下の通り
| | | | | | | | |
| 株式オプションの数 | 加重平均行権値 |
| 2023年1月1日現在保有しているオプション | 877,704 | | £0.00 |
| 授与する | 1,350,482 | £0.00 |
| 鍛えられた | (39,304) | £0.00 |
| 没収される | (239,192) | £0.00 |
| 2023年12月31日現在保有しているオプション | 1,949,690 | £0.00 |
| | |
| 2023年12月31日に行使できます | — | | £0.00 |
モンテカルロモデルを用いて、2023年12月31日終了年度の以下の加重平均値を含む業績オプションの付与日における公正価値を計算した
| | | | | |
| 行権価格 | £0.0005 |
| 期待寿命 | 3.0年.年 |
| 予想変動率 | 88.6 | % |
| 無リスク金利 | 3.59 | % |
| 期待配当率 | — | |
| 公正価値 | £3.33 |
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
関連普通株の公正価値は授出日の当時の為替レート換算の終値に等しい。無リスク金利は、オプション予想期限に見合った一定期間にわたって米国政府債券が入手可能な金利を参考にして決定される。予想変動率とは、授出日前にすでに発売されている予想年期にふさわしい期間の比較会社の加重平均変動率であり、オプションの期待寿命はすでに帰属日と奨励満了日に関する中点に設定されている。
業績共有単位です業績株式単位は年度ごとに本グループのいくつかの行政者に付与され、株主の総リターンに関する市場ベースの業績条件と、継続的に雇用される帰属要求が記載されている。これらの賞品は分けて授与します3年.
2023年12月31日までの年間業績シェア単位に関する情報は以下の通り
| | | | | |
| PSU数量 |
| 2023年1月1日までのPSU | 146,285 | |
| 授与する | 342,548 | |
| 2023年12月31日までのPSU | 488,833 | |
2023年12月31日までの1年間,単位あたりに付与された加重平均付与日の公正価値はGBである4.10それは.承認された契約の加重平均残存契約期間は9.02023年12月31日まで。
業績株単位の授出日の公正価値はすでにモンテカルロモデルを用いて計算され、計上したモデルは上記の業績株購入株権が詳述したものと同じである。
株を限定販売する本グループはRSU計画を経営しており、この計画により、いくつかの従業員及び取締役は当社の普通株が保有する制限株式単位を超えることができる。これらの単位は譲渡することができず,当社が定めた期限内に没収することができる.これらの奨励は、付与された日の関連株の時価によって推定され、その後、制限失効期間中に償却され、通常4年それは.報酬は,参加者が本グループに雇用された時点で満了することを終了する.
2023年12月31日までの1年間の既存のRSUの詳細は以下の通り
| | | | | |
| RSU数 |
| 2023年1月1日までのRSU | 759,696 | |
| 授与する | 745,345 | |
| 釈放されました | (443,768) | |
| 没収される | (42,087) | |
| 2023年12月31日までのRSU | 1,019,186 | |
2023年12月31日までの1年間,単位あたりに付与された加重平均付与日の公正価値はGBである4.35それは.承認された契約の加重平均残存契約期間は9.02023年12月31日まで
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
2023年12月31日までの年間で108,616賞は純和解で配布されています55,260発行済み株式数とGB数243,000関連する従業員の納税義務を清算するために会社が支払う。支払われた金額は留保収益で確認されました
2022年1月1日に保有するRSUでは600,0002021年12月31日までに年度内に廃止されたEMIオプションの代替オプションとして発行された。これらは600,0002022年12月31日までの年間で、純決済スケジュールにより賞が発表された374,887発行済み株式数とGB数2,282,000関連する従業員の納税義務を清算するために会社が支払う。支払われた金額は留保収益で確認されます。
31.資本約束
本グループは報告期末に重大な資本支出があったが、負債が確認されなかった場合は以下の通りである | | | | | | | | | | | |
| 2023年12月31日 | | 2022年12月31日 |
| £’000 | | £’000 |
| 工場と設備 | 840 | | | 8,656 | |
| コンピュータ装置 | — | | | 8 | |
| コンピュータソフト | 40 | | | — | |
| 固定装置及び取付具 | 14 | | | 447 | |
| 賃借権改善 | 12 | | | 2,639 | |
| 906 | | | 11,750 | |
ゲイツ財団は約束を私募した会社が2021年10月5日に初公募するとともに、ゲイツ財団への私募を完了し、売却した1,590,909アメリカの預託証明書、初めて発行価格は$です22.00アメリカに株式を預けていて、毛収入は約$です35,000,000 (£25,743,000)である。同社とゲイツ財団の合意条項によると、グループは#ドルを使うことを約束した70,000,000Vbl.超4年制小分子抗感染治療薬物の研究、発見と開発は、未来の大流行に対応し、重点的に多種のコロナウイルス科、インフルエンザと副ミクソウイルス科に応用できる治療薬(“大流行準備計画”)の開発である。このグループはGBを生成しました9,697,0002023年12月31日までの大流行防止計画と関係がある(2022年:GB6,459,000)、未返済の総承諾額はGBです41,789,000 (2022: £45,027,000).
当グループが合意のいくつかの条項に違反した場合、ゲイツ財団は、公開発行価格および違約日株式時価の高い者で、財団が保有する当グループの任意の株式を売却または買い戻すことを要求する権利がある。このような不正が発生したり、会社が破産手続きに入った場合、ゲイツ財団はまた、合意の一部として付与された独占的なグローバル許可を使用する権利があり、この許可は、当グループがある発展途上国の人々に利益をもたらすために発生した大流行防止計画によって生成された任意の知的財産権に関するものである。違約条件は当グループが制御し、当該等の違約が発生した場合や当グループが破産手続に入っていない限り、関連ライセンスを使用することはできません。したがって、本ライセンスには公正な価値が割り当てられていない。
カタログ表 | | |
財務諸表付記12月31日まで、2023年、2022年および2021年までの年度 |
32.究極の親会社と支配者
アイ仕達グループは当グループの最終親会社です。究極の制御者は存在しない。
33.その期間の後に起こった事件を報告する
2024年1月19日、グループ投資GB150,000,0001つになる6か月F 1級金融機関での短期預金。この短期預金の利息は5.1%と、償却コストによって金融資産に分類されました
ホプキンス博士の退職が2023年12月31日までの年間ボーナスに与える影響は、付記11に開示された総報酬に反映されている。ホプキンス博士が保有しているすべての未償還株式購入権と業績に関する株式購入権、代表2,636,709関連株は彼が2024年2月13日に退職したため没収された。
2024年3月13日、グループは1ドルを出資した750,000RallyBio,RE Ventures I,LLCとの合弁企業。
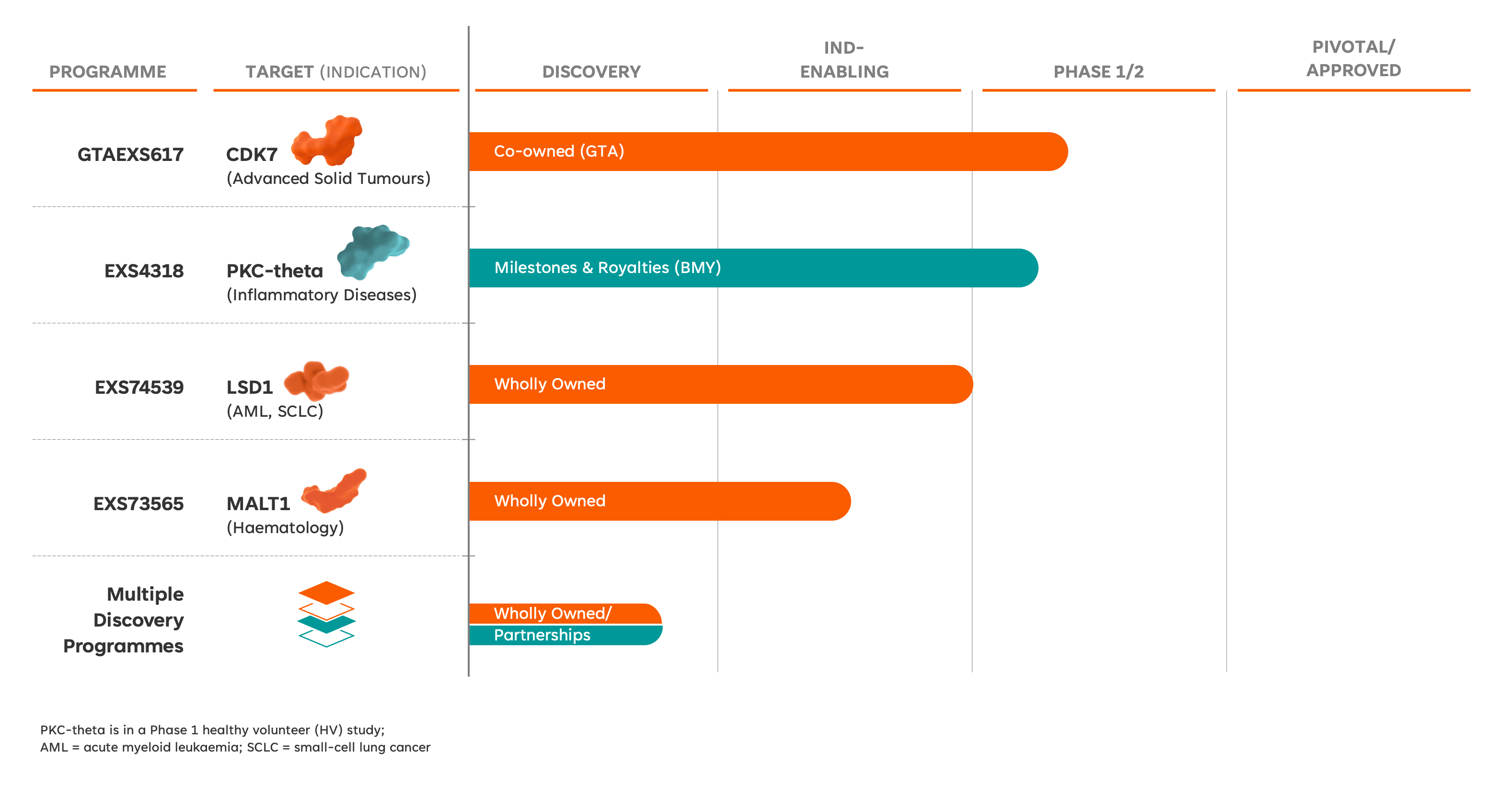

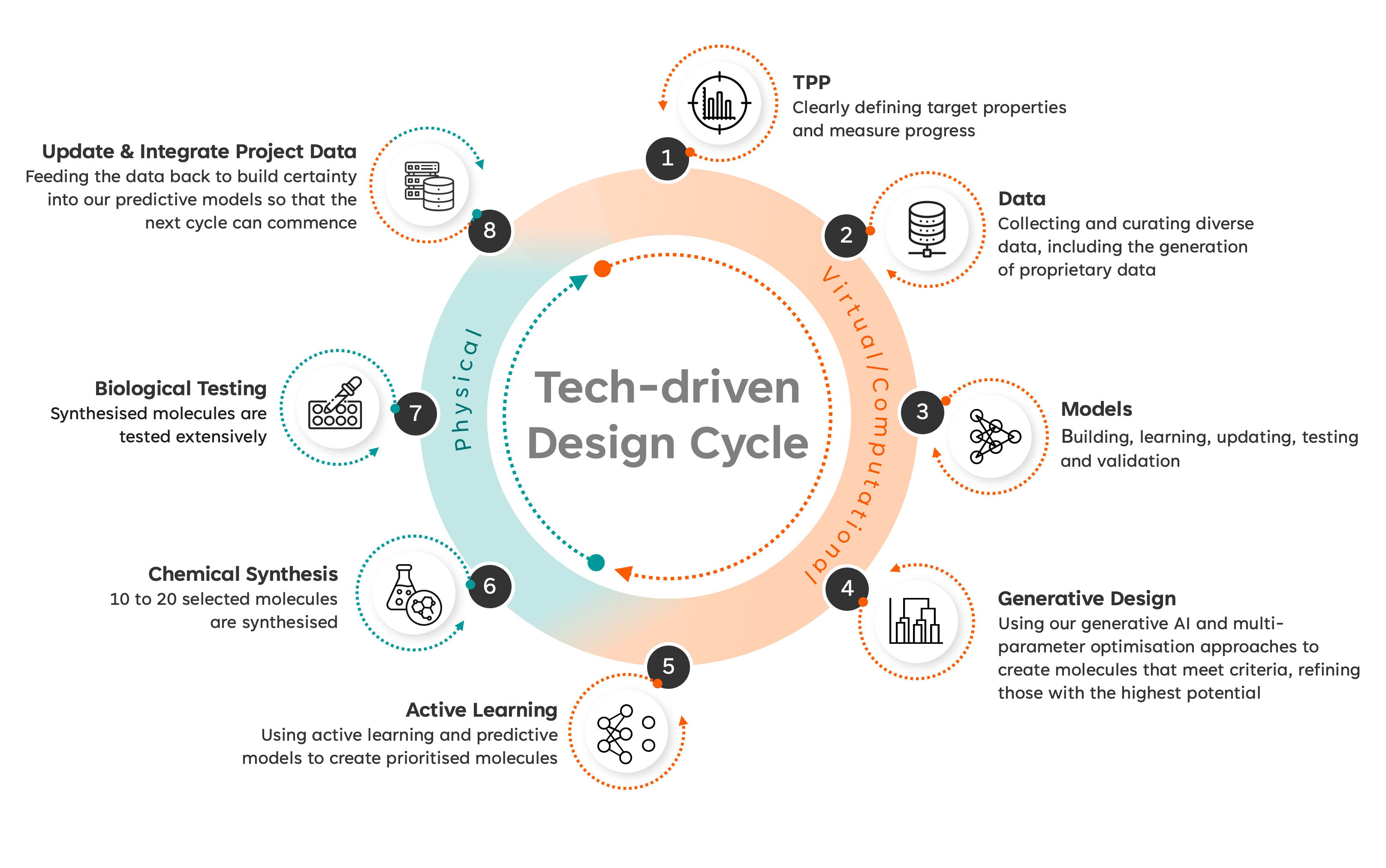
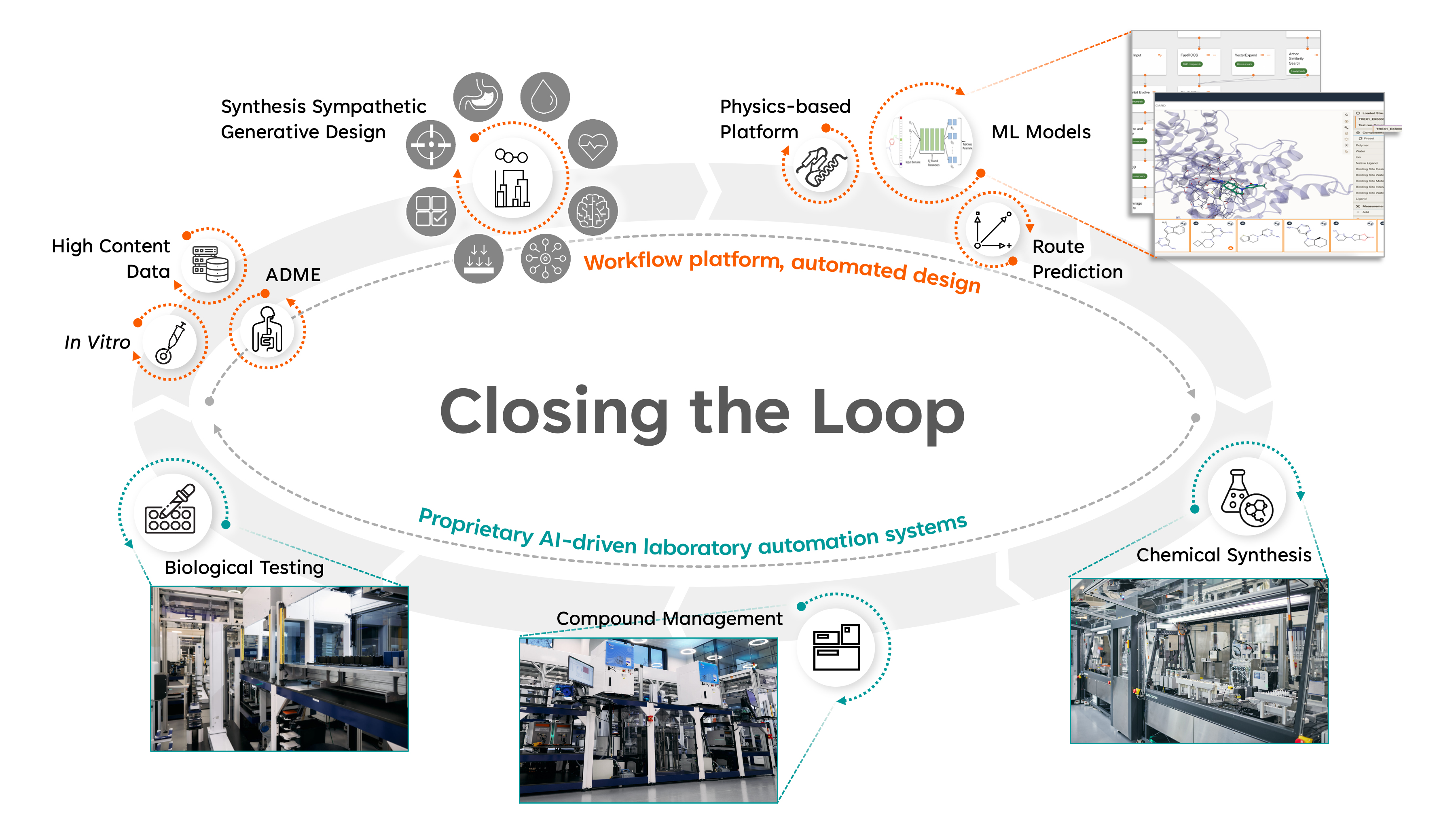

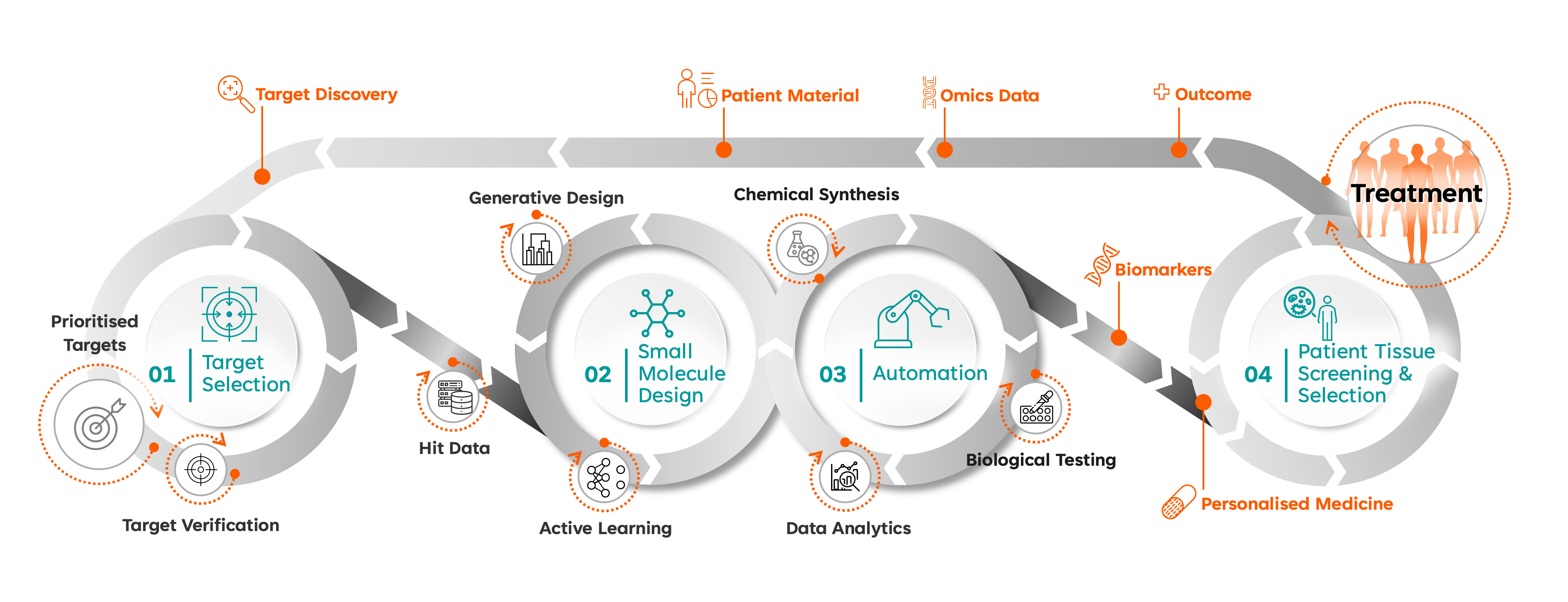

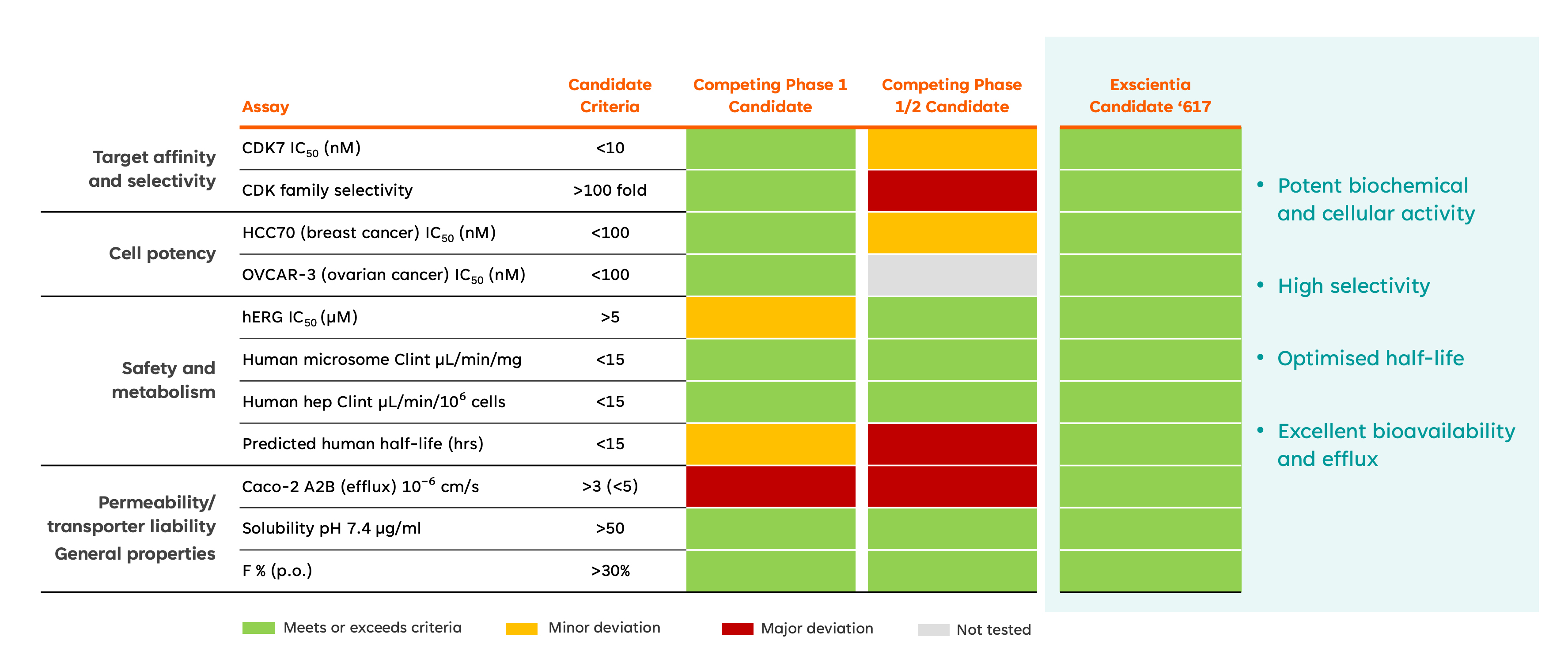
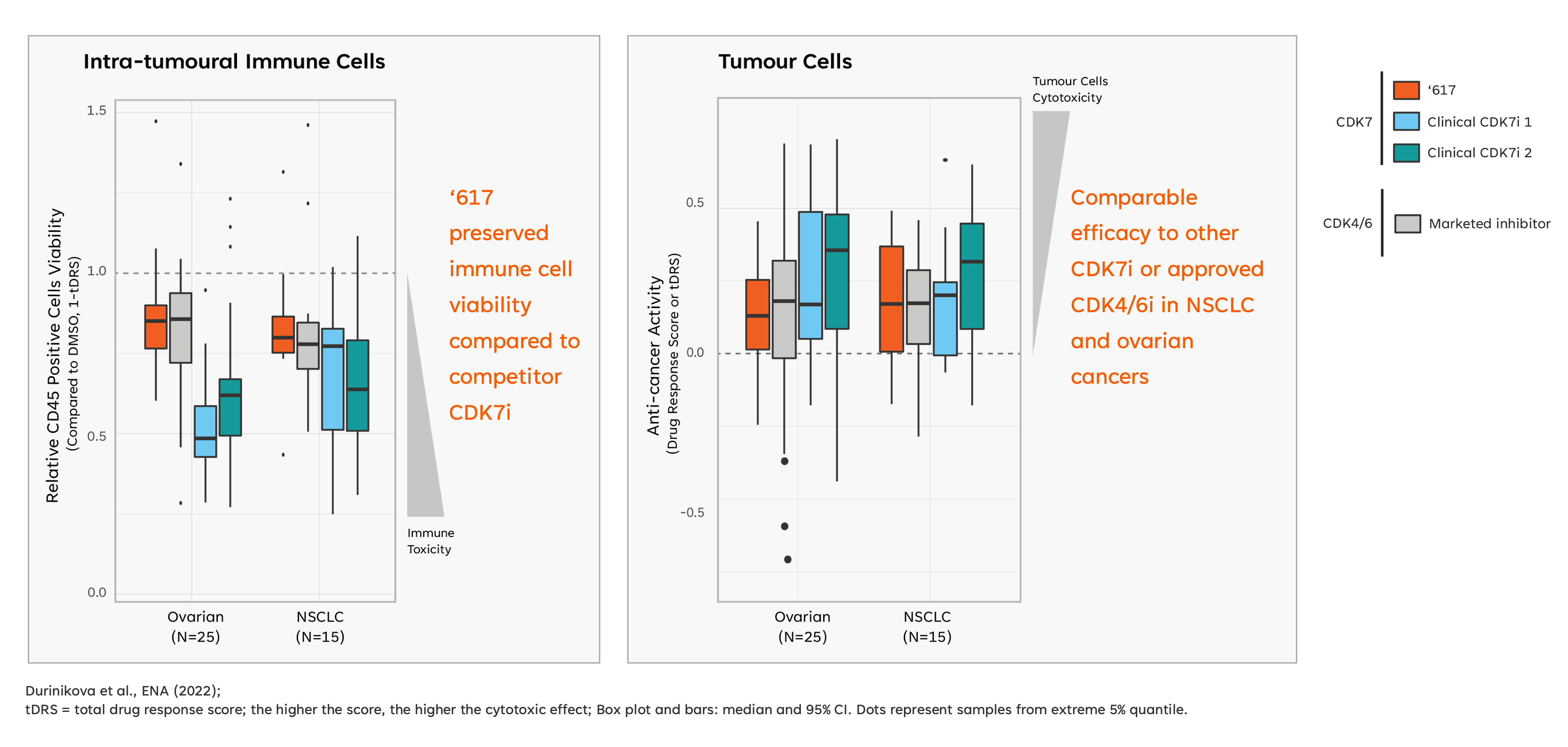
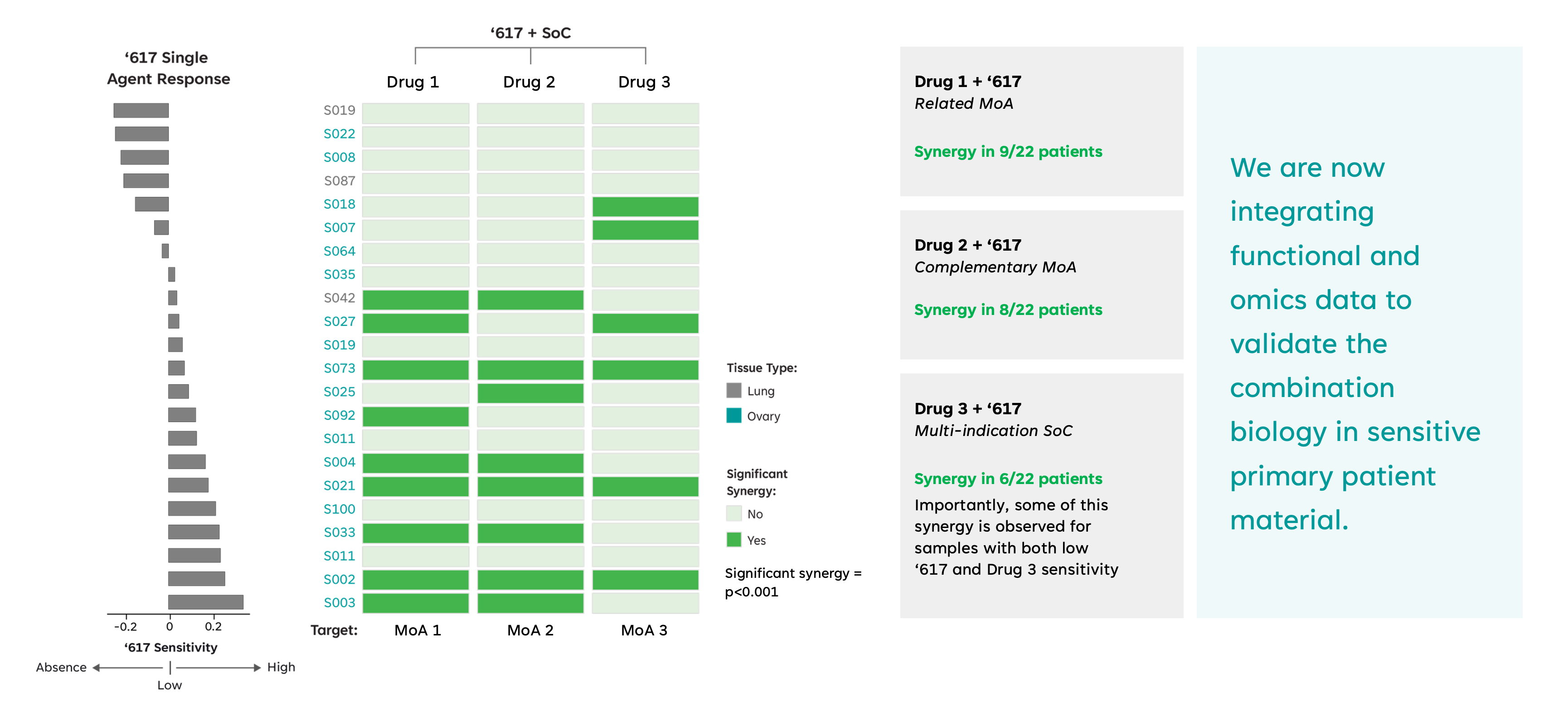
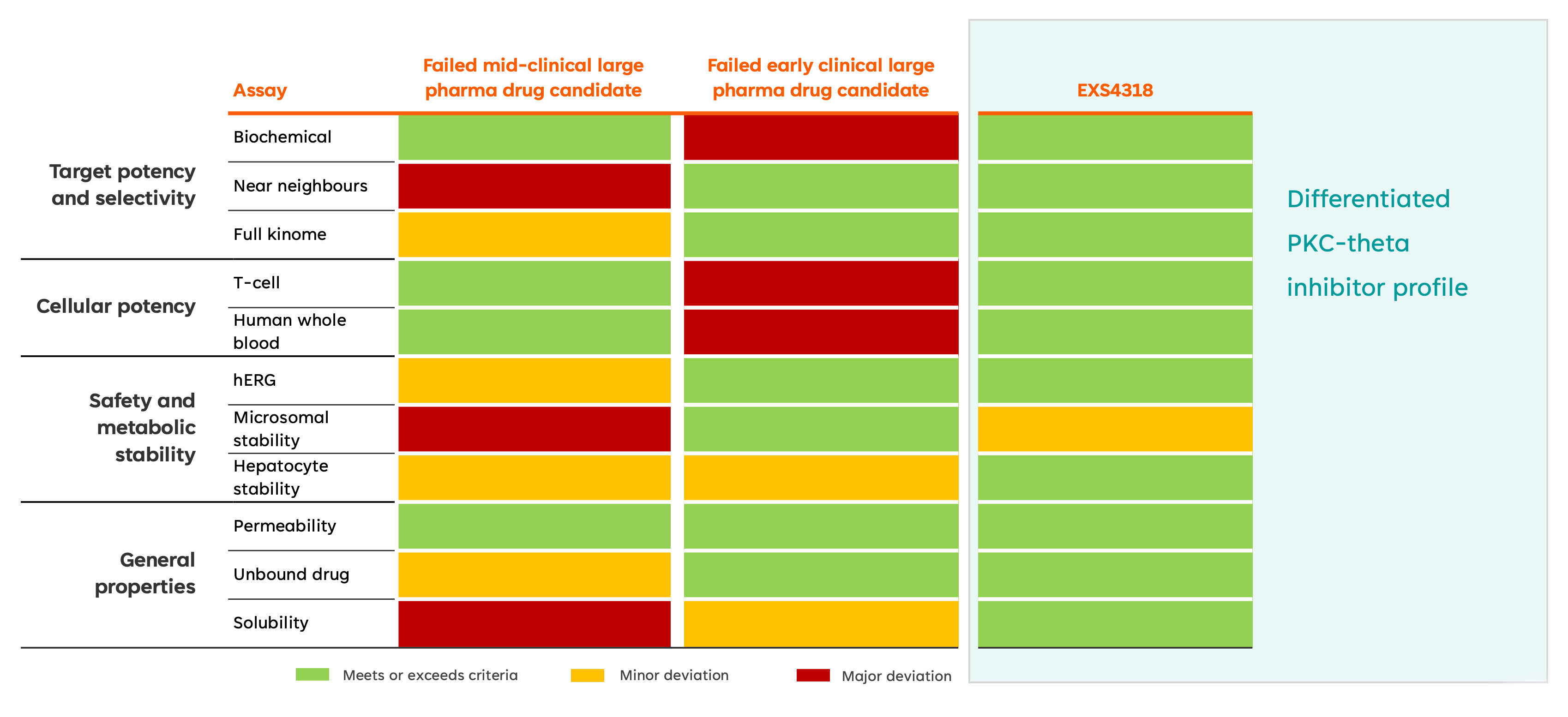
 未満足の需要/問題:LSD 1はAMLと小細胞肺癌(SCLC)において潜在力があると信じている。この2つの適応は高度に満たされていない需要があり,米国では毎年約45000名の確定診断患者がいる。LSD 1はヒストンを脱メチル化させ、ヒストンは分化抑制と多種の腫瘍タイプの増殖と生存を駆動する遺伝子発現を調節する上で重要な役割を果たしている。半減期の短い可逆性化合物は、タンパク質の重要な機能を回避するために重要であり、同時に癌細胞の静止および/または細胞死への分化を促進する。約50%の小細胞肺癌患者が脳転移を発生するため、血液脳関門を貫通することは小細胞肺癌(SCLC)に対する治療の重要な特徴である。これまで,他に開発されているLSD 1阻害剤は,適切な薬物動態,良好な脳透過性と可逆作用機序の組み合わせは実現できなかった
未満足の需要/問題:LSD 1はAMLと小細胞肺癌(SCLC)において潜在力があると信じている。この2つの適応は高度に満たされていない需要があり,米国では毎年約45000名の確定診断患者がいる。LSD 1はヒストンを脱メチル化させ、ヒストンは分化抑制と多種の腫瘍タイプの増殖と生存を駆動する遺伝子発現を調節する上で重要な役割を果たしている。半減期の短い可逆性化合物は、タンパク質の重要な機能を回避するために重要であり、同時に癌細胞の静止および/または細胞死への分化を促進する。約50%の小細胞肺癌患者が脳転移を発生するため、血液脳関門を貫通することは小細胞肺癌(SCLC)に対する治療の重要な特徴である。これまで,他に開発されているLSD 1阻害剤は,適切な薬物動態,良好な脳透過性と可逆作用機序の組み合わせは実現できなかった






