 著者らの全面的な解剖病理学テストとテストサービスは胃腸病理学、皮膚病理学、泌尿外科病理学、乳腺病理学、神経病理学と血液病理学を含む。これらのテストとテストサービスは私たちの広い地理的位置の支持を得て、私たちは1988年のいくつかの臨床実験室改善修正案、またはCLIAを持ち、これらの実験室はアメリカの許可を得た。
著者らの全面的な解剖病理学テストとテストサービスは胃腸病理学、皮膚病理学、泌尿外科病理学、乳腺病理学、神経病理学と血液病理学を含む。これらのテストとテストサービスは私たちの広い地理的位置の支持を得て、私たちは1988年のいくつかの臨床実験室改善修正案、またはCLIAを持ち、これらの実験室はアメリカの許可を得た。 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
本財政年度末まで
あるいは…。
そこからの過渡期について
手数料書類番号
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引コード |
|
登録された各取引所の名称 |
|
|
|
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してくださいはい、そうです ☐
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示すはい、そうです ☐
登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13または15(D)節に提出されたすべての報告を提出したかどうか、および(2)このような提出要求を過去90日以内に遵守してきたかどうかを、再選択マークで示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
☒ |
|
ファイルマネージャを加速する |
|
☐ |
|
非加速ファイルサーバ |
|
☐
|
|
規模の小さい報告会社 新興成長型会社 |
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)はい、そうです ☐ 違います。
2023年6月30日現在,非関連会社が保有する登録者は投票権と無投票権普通株の総時価(登録者普通株がその日に最後に売却された価格計算を参照),すなわち登録者普通株の最後の営業日である ナスダック世界市場によると、最近完成した第2四半期)は$
2024年2月15日までに
引用で編入された書類
登録者は、その2024年年次株主総会の最終委託書のいくつかの部分について、参照によって本報告の第3の部分に組み込む。
カタログ
|
|
|
|
ページ |
前向き陳述に関する注意事項 |
|
i |
||
第1部 |
|
|
|
1 |
第1項。 |
|
業務.業務 |
|
1 |
第1 A項。 |
|
リスク要因 |
|
29 |
項目1 B。 |
|
未解決従業員意見 |
|
66 |
プロジェクト1 C。 |
|
ネットワーク·セキュリティ |
|
66 |
第二項です。 |
|
属性 |
|
68 |
第三項です。 |
|
法律訴訟 |
|
69 |
第四項です。 |
|
炭鉱安全情報開示 |
|
69 |
第II部 |
|
|
|
70 |
五番目です。 |
|
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
|
70 |
第六項です。 |
|
[保留されている] |
|
71 |
第七項。 |
|
経営陣の財務状況と経営成果の検討と分析 |
|
72 |
第七A項。 |
|
市場リスクの定量的·定性的開示について |
|
84 |
第八項です。 |
|
財務諸表と補足データ |
|
86 |
第九項です。 |
|
会計と財務情報開示の変更と相違 |
|
86 |
第9条。 |
|
制御とプログラム |
|
86 |
プロジェクト9 B。 |
|
その他の情報 |
|
87 |
プロジェクト9 Cです。 |
|
検査妨害に関する外国司法管区の開示 |
|
87 |
第三部 |
|
|
|
88 |
第10項。 |
|
役員·幹部と会社の管理 |
|
88 |
第十一項。 |
|
役員報酬 |
|
88 |
第十二項。 |
|
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
|
88 |
十三項。 |
|
特定の関係や関連取引、取締役の独立性 |
|
88 |
14項です。 |
|
最高料金とサービス |
|
88 |
第4部 |
|
|
|
89 |
第十五項。 |
|
展示·財務諸表明細書 |
|
89 |
第十六項。 |
|
表格10-Kの概要 |
|
89 |
以下の方面についての警告前向きに陳述する
本報告には、1933年“証券法”(改正)第27 A条又は“証券法”及び改正された1934年“証券取引法”第21 E条又は“取引法”の意味を満たす前向きな陳述が含まれている。展望性陳述は歴史的事実とは関係のない陳述であり、未来の事件や環境あるいは私たちの未来の表現と関係があり、それらは現在の私たちの未来の発展及び私たちの業務に対する潜在的な影響の仮説、期待と信念に基づいている。“信じる”、“可能”、“そうなる”、“可能”、“推定”、“継続”、“予想”、“意図”、“可能”、“将”、“プロジェクト”、“計画”、“予想”、“可能”、および未来のイベントまたは結果の不確実性を表す類似表現は前向き表現である。
本報告書の展望的な陳述は、以下の内容に関する陳述を含む
i
これらの展望的陳述には、項目1 A“リスク要因”および本報告の他の部分で説明されたリスクおよび不確定要因を含むいくつかのリスクおよび不確定要因が存在する。しかも、私たちは競争が激しく急速に発展している業界で運営されており、新しいリスクが時々発生する。私たちが直面する可能性のあるすべてのリスクを予測することはできませんし、すべての要素が私たちの業務に与える影響を評価することもできません。あるいは任意の要素や要素の組み合わせは、実際の結果が私たちの予想とは異なる程度につながる可能性があります。これらのリスクと不確実性を考慮して、本報告書に記載されている展望的イベントおよび状況は発生しない可能性があり、実際の結果は、私たちが行った任意の前向き陳述に記載されているまたは示唆された結果とは大きく異なる可能性がある。私たちの展望的な陳述は私たちが合理的だと思う仮説と期待に基づいているが、私たちは未来の結果、活動レベル、業績、あるいは他の未来の事件を保証することはできない。そのため、展望性陳述は未来の事件の予測に依存するべきではなく、本報告を読む時に、私たちの実際の未来の結果、活動レベル、業績と業績或いは他の未来の事件は私たちの現在予想しているものと大きく異なる可能性があることを理解すべきである。
本報告の前向き記述は、本文書の発行日までの状況のみを代表しており、法律が別途要求されない限り、本報告書の発行日後に、これらの記述が実際の結果または予想される変化と一致するように、任意の理由で任意の前向き記述を公開更新する義務はない。
私たちはこの警告的な説明を通じて私たちのすべての前向きな陳述を限定する。
* * * * * * *
私たちは登録または未登録の商標権を持っていますフルギット®, 画像遺伝学®Beacon®,InFORMDX®LUMERA®そして、わが社の名前とロゴ。本報告に登場する任意の他のサービスマーク、商標、商品名は、それぞれの所有者の財産である。私たちはこの報告書に私たちの商標のすべての事例で使用または記号が現れていないが、これは私たちが適用された法律によって私たちの権利を最大限に維持しないと解釈されてはならない。
フルゴールド遺伝子会社とその子会社と付属専門会社は同社と管理サービスの手配があり、本10-K表年次報告では総称して“会社”、“フルート”、“私たち”、“私たち”と呼ばれている
II
パー?パーT I
項目1.B役に立つ。
概要
私たちは技術ベースの会社で、完全な実験室サービス業務と治療開発業務を持っています。私たちの実験室サービス業務-私たちは以前私たちの臨床診断業務と呼ばれていました-技術実験室サービスと登録医師の実験室結果に対する専門的な解釈を含む。我々の治療開発事業は、新しいおよび既存の癌薬物の治療ウィンドウおよび薬物動態特性、またはPK特徴を改善することを目的とした、新しいナノカプセルおよび標的治療プラットフォームを使用して、複数の癌を治療する候補薬物の開発に専念する。
使命とビジョン
富金特は2011年に設立され、最初に2つの簡単な考えがあった:柔軟性と負担可能性。私たちは患者の看護と生活の質を改善するために、柔軟かつ負担のできる診断と遺伝子テストとテストサービスを提供し、開発する。私たちは市場で最も有効で、範囲が最も広い遺伝子と診断検査メニューを提供することに取り組んでいる。私たちの長期ビジョンは診断業務から腫瘍学に専念する全集を正確な医学会社に転換することである。
私たちの研究室サービス業務は
私たちは幅広いテスト能力を持ち、拡張可能で顧客が負担できるテストとテストサービスメニューを持っています。私たちのテストとテストサービスは
 著者らの全面的な解剖病理学テストとテストサービスは胃腸病理学、皮膚病理学、泌尿外科病理学、乳腺病理学、神経病理学と血液病理学を含む。これらのテストとテストサービスは私たちの広い地理的位置の支持を得て、私たちは1988年のいくつかの臨床実験室改善修正案、またはCLIAを持ち、これらの実験室はアメリカの許可を得た。
著者らの全面的な解剖病理学テストとテストサービスは胃腸病理学、皮膚病理学、泌尿外科病理学、乳腺病理学、神経病理学と血液病理学を含む。これらのテストとテストサービスは私たちの広い地理的位置の支持を得て、私たちは1988年のいくつかの臨床実験室改善修正案、またはCLIAを持ち、これらの実験室はアメリカの許可を得た。
 著者らの精密診断テストサービスは次世代シークエンシング(NGS)、生物製薬研究テスト及び稀な疾病、遺伝性癌、生殖健康と多くの他の疾病亜型の臨床テストを含む。われわれの精密診断テストには専門の腫瘍学テストとテストサービスも含まれており、広範な技術を利用している。これらの検査と測定サービスはフローサイトメトリー、細胞遺伝学分析、原位置蛍光分析、免疫組織化学、分子遺伝学、神経成長因子及び血液病理学と外科病理学の相談を利用した。
著者らの精密診断テストサービスは次世代シークエンシング(NGS)、生物製薬研究テスト及び稀な疾病、遺伝性癌、生殖健康と多くの他の疾病亜型の臨床テストを含む。われわれの精密診断テストには専門の腫瘍学テストとテストサービスも含まれており、広範な技術を利用している。これらの検査と測定サービスはフローサイトメトリー、細胞遺伝学分析、原位置蛍光分析、免疫組織化学、分子遺伝学、神経成長因子及び血液病理学と外科病理学の相談を利用した。
 私たちはまた製薬或いは生物技術会社、契約研究機関或いはCRO或いは協賛の試験プロジェクトに臨床試験サービス或いはシークエンシングサービスを提供し、著者らはBioPharmaサービスと呼ばれる。
私たちはまた製薬或いは生物技術会社、契約研究機関或いはCRO或いは協賛の試験プロジェクトに臨床試験サービス或いはシークエンシングサービスを提供し、著者らはBioPharmaサービスと呼ばれる。
 個人のお客様は、私たちが直接消費者向けのPicture Geneticsプラットフォームを介していくつかのテストおよびテストサービスを購入することもできます。これらのPicture Geneticsテストは、顧客がその個人DNA中の重要な健康マーカーを識別するのを助ける。
個人のお客様は、私たちが直接消費者向けのPicture Geneticsプラットフォームを介していくつかのテストおよびテストサービスを購入することもできます。これらのPicture Geneticsテストは、顧客がその個人DNA中の重要な健康マーカーを識別するのを助ける。
私たちの治療開発事業であるフルキント製薬は
2022年には、フルゴールド製薬ホールディングスまたはフルゴールド製薬会社への買収を完了した。フルキン製薬会社での私たちの努力は新型ナノ投与プラットフォーム技術は、各種の水不溶性或いは難溶性薬物を輸送することができる。ヒト血清アルブミンなど水にしか溶けない薬物輸送材料とは異なり,薬物候補開発に用いられているナノ薬物輸送材料は水だけでなく,様々な有機溶媒にも可溶であり,活性薬物成分や原料薬と熱溶融混合することができる。これらの利点は,PKプロファイルおよび安全性と有効性を改善することを目的として,より広範な候補薬剤製剤,特に非晶質候補薬剤製剤を生成することができ,静注にも経口製剤にも利用可能であると信じている。
私たちがこのプラットフォームを利用して開発した最初の候補薬はFID-007、ナノカプセルパクリタキセルであり、私たちは次の図に示すように、頭頸部、またはH&N、膵臓癌、乳癌および非小細胞肺癌、またはNSCLCを含むターゲット市場が大きく、成熟していることを選択した
1
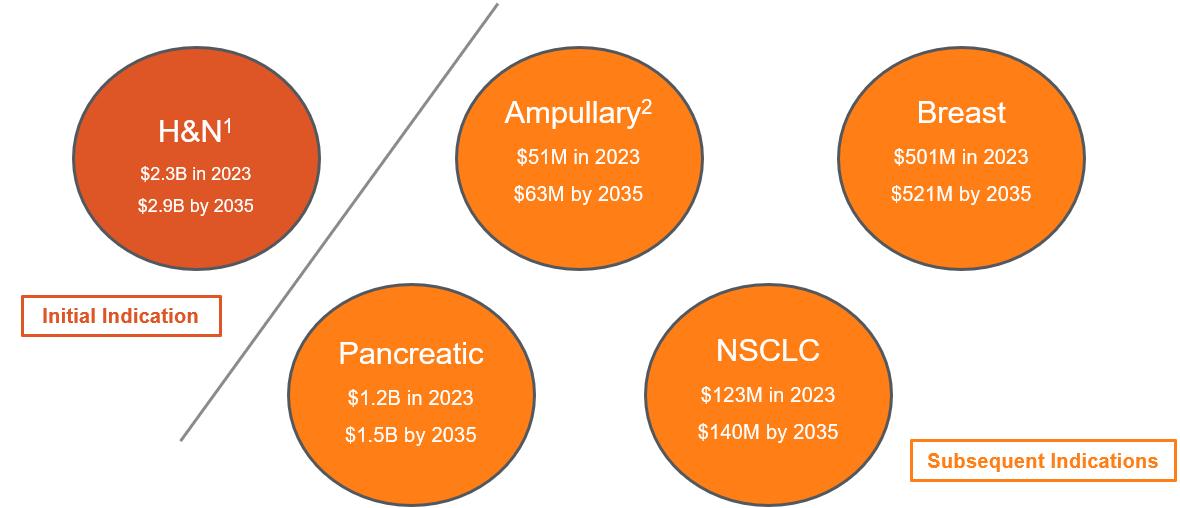
注:表示されたアメリカのビジネスチャンス
資料源:Pharma、ウォール街の研究と管理職の価格設定予想を評価する
FID−007は現在米国で研究されており,H&N,ポット腹,膵癌など様々な癌と診断された患者の治療に用いられている。著者らはすでに1/1 b期用量増加/拡張臨床試験を完成し、FID-007による固形腫瘍患者の治療効果を評価した。1/1 b期は米国の臨床試験地点で行い、FID-007の安全性、PK、および有効性を評価するために、40人の末期固形腫瘍患者を募集した。2023年6月、我々はFID-007が各種固形腫瘍を治療する1/1 b期の臨床研究の中期データを公表した。標準3+3用量逓増設計を用いて毎週用量レベル15 mg/m 2から160 mg/m 2までの40人の評価可能な患者において、FID−007は28日間の第1、8および15日目に静脈内投与された。最大耐容量(MTD)は認められなかった。2023年6月2日までに用意した水泳者図に示すように,7例(18%)の患者はRECIST 1.1(膵,胆道とHNSCC)に部分的な反応を認め,14例(35%)の患者は安定していた。36人の平均年齢61歳(39~65歳)の患者は、7つの用量レベルの治療を受けた。100 mg/m 2の3級皮疹の2用量制限毒性(DLT)を認めた。DLTの定義は皮疹の一過性と局所治療への反応を考慮して7日間持続する3級皮疹を排除するように修正され,他の3名は100 mg/m 2の治療を受け,耐えられると考えられた。1例4級白血球数125 mg/m 2のDLT,1例G 3発熱好中球160 mg/m 2のDLT減少を認めた。≥治療関連有害事象(TRAE)25%のすべての患者は皮疹(64%),脱毛(56%),白血球減少(47%),掻痒(44%),好中球減少(42%),貧血(42%),無力(39%),嘔気(33%),食欲減退(31%),感覚障害(25%),周囲感覚神経障害(25%)であった。>1 ptに発生した3/4級TRAEは斑丘疹(25%),貧血,好中球減少,白血球減少(各17%)であった。評価可能な36例中,7例(19%)はRECIST 1.1(膵,胆道とHNSCC)に部分反応し,13例(36%)は安定していた。部分反応のあるHNSCC患者4名のうち3名は以前にタキサン治療を受けていた。フォローアップ期間(月),中央値(範囲)は12.0(0.4−38.9)であった。これまで高度レベルの神経病変は認められなかった。
2
著者らはFID-007が管理可能な安全性を有することを観察し、様々な腫瘍タイプの重度前治療患者において抗腫瘍活性を有する初歩的な証拠を観察した。観察されたPKは線形であり,用量に比例し,NABパクリタキセルに相当する。
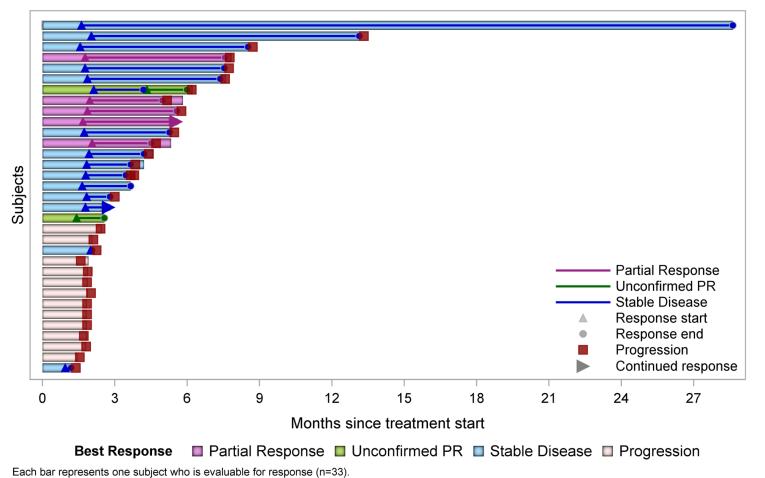
*ソース:ASCO 2023
125 mg/m 2は、全体的耐性、薬物動態および治療効果に基づいて、推奨される第2段階用量(RP 2 D)として選択されている。著者らは2024年第2四半期に再発或いは転移性H&N扁平上皮癌患者におけるFID-007の登録を開始し、2期ランダム、マルチセンター、開放ラベル研究を希望する。505(B)(2)の経路を用いて米国で規制承認を求める予定であり,臨床試験過程を短縮し,潜在的な商業化を加速させる可能性がある。
我々はまた,様々な癌に焦点を当てたナノ薬物送達プラットフォームを用いて臨床前開発に従事している。2024年末までに、結腸癌患者における候補薬剤の使用を評価するために、FID−022にINDを提出する予定である。
私たちの技術プラットフォームは
著者らが実験室サービス業務に提供する独自技術プラットフォームは、独自遺伝子プローブ、データ抑制と比較アルゴリズム、適応学習ソフトウェアと独自の実験室情報管理システムを含む。このプラットフォームは、広範なテストメニュー、迅速な開発、新しいテストを開始する能力、カスタマイズ可能なテスト製品、より低い毎回のテストコスト、および高効率を提供する。例えば、この技術プラットフォームは2019年の新型コロナウイルス病(新冠肺炎)の大流行に迅速に対応でき、そして私たちの業務を拡大し、新冠肺炎の検査に信頼できる結果と迅速な回転時間を提供し、甚だしきに至っては私たちの最大の競争相手を超えた。我々は新冠肺炎業務を削減したにもかかわらず,この努力により,2020年から2023年までに約1,940万回の新冠肺炎テストを提供し,17億ドルを超える収入を創出したことを誇りに思っている。
私たちの取引先
3
我々は現在,実験室サービス業務中の顧客を支払者タイプごとに分類している:(I)保険;(Ii)病院,医療機関,他の実験室,政府機関,支払人,市政当局と大会社,および(Iii)直接支払いの患者を含む。一般的に、私たちは機関の顧客にテスト費用を受け取り、彼らは私たちに直接支払う責任がある。私たちの顧客の一部は患者で、医者が検査を手配してくれた後、彼らは自己負担費用を選択して検査費用を支払います。
個々の課金および支払い単位は個々の顧客であり,1つの単位が複数の医師や医療提供者を代表してテストを発注する可能性があると考えられる。共同コントロールの顧客をまとめると、私たちの顧客は2023年に3570万ドルを貢献し、私たちの総収入の12%を占め、もう1人の顧客は1兆156億ドルを貢献して、私たちの2022年の収入の19%を占めた。
販売とマーケティング
当実験室サービス業務の販売とマーケティングチームは現在、当業界で豊富な経験を持つ販売とマーケティングの専門家からなる内部チームと、私たちのテストに詳しい現場販売代表ネットワークから構成されています。歴史的に見ると、私たちは有機成長と顧客の間の口コミに大きく依存して、私たちのテストに対する興味を刺激して、私たちの製品の価値を示していると信じています。近年、私たちは、内部チームの規模の拡大と組織構造の再構築、私たちの取り組みと戦略の再注目、マーケティング活動の全体的な範囲の拡大を含む、私たちの販売やマーケティング努力を強化するために多くの時間と資金を投入しています。私たちは販売チームの規模とマーケティング資源を拡大する必要性を定期的に評価し続ける。
私たちのサプライヤー
私たちは限られた数のサプライヤーに依存して化学反応のためのいくつかの実験室物質を提供し、これらの物質は私たちのテストとテストサービスに組み込まれており、私たちは試薬、シークエンサー、そして私たちが実験室運営に使用している様々な他の設備や材料と呼ばれている。特に、私たちは遺伝子テストを行うための次世代シークエンサーと関連試薬の唯一のサプライヤーとしてIllumina、Inc.あるいはIlluminaに依存し、そしてこれらのシークエンサーの唯一のメンテナンスと修理サービス提供者として依存している;私たちはローセルホールディングスに依存していくつかの実験室設備、用品と免疫組織化学サービスを提供する;Beckman Coulter Diagnosticsに依存していくつかの実験室設備、用品とサービスを提供してフローサイトメーターテストと検査サービスを提供する;そしてアボットに依存していくつかの実験室設備、用品とサービスを提供し、私たちの魚類検査と検査サービスのために使用する。また,我々の治療開発業務はANP Technologiesに依存し,Inc.は我々の研究や開発に関連するいくつかの実験室サービス,装置,ツール,および薬物中間体を提供する.私たちはIlluminaを代替することができるいくつかのシークエンサーサプライヤーがあると思いますが、私たちは私たちの他の需要を満たすのに十分な代替サプライヤーがあると信じていますが、もし私たちがこれらの用品、サービス、試薬、シークエンサー、他の設備、材料あるいはメンテナンスと修理サービスを得る上で遅延や困難に遭遇した場合、私たちの実験室操作や治療開発作業が中断される可能性があります。これは、もし私たちが私たちの有限または唯一のサプライヤーを交換または一時的に代替する必要があり、受け入れられる代替製品や一時的な代替製品を見つけることができなければ、それと手配することを含む様々な原因による可能性があります。
4
競争
著者らの実験室サービス業務の競争相手は、伝統的な単遺伝子と多遺伝子テストを提供する専門と参考実験室および他の診断試験プロバイダを含む病理、遺伝子と診断テストサービスに専念する数十社の会社を含む。主な競争相手は、以下の会社を含む:コニカミノルタ社の子会社Ambry Genetics社、ベラー遺伝子会社、カリス生命科学会社、精密科学会社、基礎医学会社、GeneDxホールディングス会社、Guardant Health社、Invitae社、アメリカ実験室ホールディングス会社、Myriad Genetics社、Natera社、NeoGentics実験室会社、PerkinElmer社、Quest診断会社、Tempus AI会社、その他の商業·学術実験室。他の老舗および新興の医療、情報技術およびサービス会社は、情報学、分析、統合遺伝子ツール、および健康サービスを含む可能性がある競争テストを開発し、販売する可能性がある。
また,産前試験や臨床試験や随伴診断試験など,市場に密接に関連する参加者は,我々が行った試験タイプと競争力のある製品に集中する可能性がある。私たちのこの分野の主な競争相手はInvitae社、アメリカ実験室会社、Natera社、Myriad Genetics社、Quest Diagnostics社、その他の商業·学術実験室を含みます。潜在的競争相手がキーサプライヤーと同盟を結んでいるか、またはそれ自体がサプライヤーである場合は、これらの潜在的競争相手に顕著な優位性を提供することができる。また,病院,研究機関および最終的な個別医師や他の事業者も,彼ら自身の施設で本来彼らのために行う遺伝子や診断テストを求めることが可能である。この点で,設備,試薬,その他の材料やデータベース,遺伝子データ解釈サービスの持続的な発展と潜在的な関連相対コストの低減は,遺伝子検出や解析により広く直接関与し,我々のような第三者検出会社の使用を削減することができるかもしれない。また、費用の減少や直接参加の増加、および政府実体や他の第三者支払者の費用節約措置は、遺伝子解析や解釈の価格が一般的に直面している下振れ圧力を増大させる可能性がある。そのほか、臨床診断測定領域は引き続き重大な統合を経験し、比較的に大きい臨床実験室サービス提供者はコスト効果とサービスレベルを高めることができ、そして更に激しい競争を招く可能性がある。新薬候補薬の開発と商業化競争は激しい。我々の競争相手は,癌治療分野の薬物送達プラットフォーム会社と505(B)(2)薬物開発者を含む。主要な競争相手は百時美施貴宝(Bristol-Myers Squibb)などのナノ薬物を製造する会社、学術研究機関、政府機関及び各種の他の公共と個人研究機関を含む。
私たちは競争相手より私たちがもっと利点があると信じている。しかし、私たちの多くの競争相手は、より長い運営歴史を持っている;より大きな顧客基盤、より広いブランド認知度、成熟した製造能力と施設、より深い市場浸透、より多くの財務、技術と研究開発資源、ならびに販売とマーケティング能力、および第三者支払い者とのより多くの経験を持っている。そのため、彼らは顧客の要求や優れた変化により迅速に反応し、彼らの技術、候補製品とテスト開発のためにより速く、より良い改善を行い、より成功したテスト普及と販売戦略を作成し、実施し、第三者支払者からより有利な製品カバー範囲と精算結果を得て、彼らのテストのためにより積極的な価格設定政策を採用し、より優遇的な条項でサプライヤーから供給を受けるか、あるいはより多くの資源をインフラとシステム開発に投入することができる。また、競争相手はより規模が大きく、歴史が長く、資金の豊富な会社に買収され、投資を受けたり、他のビジネス関係を構築したりする可能性がある。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。さらに、傘契約または地域割引によって遺伝子または診断テストを効果的に制御する会社または政府は、私たちの競争相手を宣伝したり、いくつかの地域でいくつかのテストを行うことを阻止したりする可能性がある。私たちはこのような組織と効果的に競争できないかもしれない。
他の研究と開発
私たちは高い素質のチームを結成して、私たちの業務に重要な多領域の専門知識、例えば生物情報学、遺伝学、ソフトウェア工学、実験室管理及び販売とマーケティングを持っている。このチームは,我々の膨大な遺伝子情報ライブラリの開発と管理に努力し,我々の技術プラットフォームをさらに拡大することを含む,我々の実験室サービス業務に関するすべての研究と開発活動に従事している.
5
知的財産権
知的財産権は私たちの戦略と研究成果を得る価値に必須的だ。私たちは、私たちのコア技術と知的財産権を保護するために、登録された知的財産権と未登録知的財産権の組み合わせに依存して、商業秘密、特定のライセンス、特許、商標、および習慣契約保護を含む。
私たちは主にビジネス秘密と技術ノウハウに依存して、私たちが実験室サービス業務で使用している独自技術プラットフォームを保護し、私たちの競争地位を発展させ、維持しています。私たちは、私たちのノウハウとプロセスを保護し、ある程度私たちの従業員、コンサルタント、ビジネスパートナーと秘密保護および知的財産権譲渡協定を締結することで、いくつかの技術の所有権を獲得し、維持することを求めています。一般的に、これらの合意は、特定の場合でない限り、個人が私たちとの関係の過程で開発または私たちに明らかにした私たちの業務または財務に関する機密情報が秘密にされ、第三者に開示されないことを規定している。従業員の場合、プロトコルは、個人のアイデアまたは実行に移された私たちの業務に関連する、または実際にまたは明らかに予期されている、研究または開発された発明および発見、または通常の勤務時間に私たちのオフィスまたは私たちの設備、用品または独自の情報を使用して行われる発明および発見が、私たちの固有財産であることをさらに規定する。多くの場合、私たちは、コンサルタント、外部科学協力者、賛助された研究者、および他のサービスプロバイダおよびコンサルタントとの合意が、そのようなプロトコルに従って提供された作業またはサービスによって生成された発明に対する私たちの許可を分配または付与するか、またはそのような発明を使用することを交渉するための私たちの選択権を付与することを要求する。私たちはまた、私たちのノウハウとプログラムの完全性とセキュリティ、私たちの住宅地の実体セキュリティ、そして私たちの情報技術システムの実体と電子セキュリティを維持するために努力しています。
また、私たちの候補薬剤または私たちの候補薬剤を生産するための技術、私たちの候補薬剤の物質成分およびその使用および製造方法、ならびに私たちの業務に重要な他の発明をカバーするために、特許権の獲得と維持を求めている。我々の特許組み合わせを構成する特許シリーズは、主に、癌を含む疾患を治療するための水不溶性または難溶性薬剤を送達するためのFID-007および我々が開発可能な他の候補薬剤を含む、我々のナノ薬物送達プラットフォーム技術に焦点を当てている。2023年12月31日現在、世界的に、私たちが所有または独占的に許可されている発行または許可された特許は30件を超え、有効特許出願は10件を超える。これには発行または許可された10個の米国特許が含まれている。これらの特許シリーズ中の特許は2034年に満了する予定であり、これらの特許シリーズ中の特許出願が承認されれば、任意の特許期間の免責声明、調整または延長を前提として、早ければ2044年に満了することが予想される。これらの家族の特許および/または特許出願は、米国、オーストラリア、カナダ、中国、欧州特許機関、ドイツ、ニュージーランド、日本、およびスイスを含む複数の司法管轄区域で活躍している。これらの特許及び独占的に許可された特許及び有効な特許出願に加えて、非独占的及び/又は地域的に制限された方法で特許を許可する。特に,2023年12月31日現在,我々は28件の特許とFID−007および関連製剤に関する特許出願を28件または独占的に取得している。これらの家庭は米国と外国(カナダ、中国、ドイツ、フランス、イギリス、日本、オーストラリア、ニュージーランド)の特許を取得しており、これらの特許は2034年に満了する予定で、特許期間が延長されることはない。特許出願の提出日、特許発行日及び特許が特許を取得した国における法定期限により、個別特許期間の延長時間はそれぞれ異なる。
私たちはまた、許可内の機会に依存して、候補薬物(FID−007を含む)のターゲット分野における私たちの特許地位を発展、強化、維持している。2017年6月、2017年12月28日に改訂されたANP Technologies,Inc.(略称ANP)と独占ライセンス契約を締結しました。協定によれば、ANPは、人間の治療、予防および診断用途のためのFID−007および関連処方を開発および商業化することができる、我々が独占的、世界的に、永久的、取り消すことができない、および再許可可能な特許および特許出願権を付与する。ANPライセンス契約の条項によると、私たちは現在特許使用料を支払う義務がありません。ANPライセンス契約の条項によって事前に終了しない限り、ANPライセンス契約の有効期限は、私たちに付与された最後の特許が満期または失効した日に満了します。ANPライセンス協定は、ANPは、私たちが修復していない違反、または私たちが破産、破産手続きの標的、または潜在的な他の理由で終了する権利があると規定している。私たちは90日前にANP許可協定をいつでも終了することを通知することができる。
また,ANPライセンス契約では,ANPはすべての許可された特許の準備,提出,起訴,維持を担当し,費用はANPが負担すると規定されている。ANPが特定のライセンス特許の起訴や維持に興味がないと決定した場合、それは書面で私たちに通知され、私たちはこのような責任を負う権利があり、費用は私たち自身が負担します。
再許可者が同意することを前提として再許可を付与することもできる:(I)ANP許可協定条項の制約を受ける;(Ii)再許可者が訴訟を起こし、任意の許可特許の実行可能性に疑問を提起すれば、ANPは再許可協定を終了することができる;(Iii)再許可協定と何か不一致があればANP許可協定は制御され、(Iv)再許可者はANP許可協定の報告規定に従ってANPに四半期報告を提出しなければならない。
6
適用される米国および外国の法律によると、私たちはまた、当社の会社名やロゴを含む私たちのブランドを区別および/または保護するために、登録および未登録の商標およびサービス商標権を持っています。
監督管理
私たちの研究室で運営されている連邦法規に適用されます
私たちがアメリカで臨床実験室を運営する時、私たちはいくつかの連邦免許証、証明書と許可証を持って業務を展開しなければならない。CLIAはすべての実験室測定のために品質標準を確立し、患者の測定結果の正確性、信頼性と適時性を確保する。著者らはカリフォルニア州、テキサス州、ジョージア州、マサチューセッツ州、アリゾナ州とニューヨーク州に位置する実験室はCLIA認証を獲得し、そしてアメリカ病理学者学会(CAP)、医療保険と医療補助サービスセンター(CMS)が認可した認証組織の認可を得た。
CLIAは、各実験室が行ったテスト種別に適した証明書を各実験室に持ち、人員資格、施設管理、能力テスト、品質管理と保証、および検査において様々な基準を遵守することを要求している。私たちの各実験室はCMSの証明書を取得しなければならず、CMSはCLIAを実行する機関であり、CLIAのコンプライアンスと認証は政府支払者と多くの個人支払人に私たちのテスト費用を受け取る資格がある前提条件である。
各CLIA証明書は発行日から2年間有効である.もし私たちの1つ以上の研究室がCLIA要求に違反していることが発見された場合、私たちは、私たちのCLIA証明書の一時停止、制限、または取り消し、配向是正計画、現場監視、民事罰金、民事禁止訴訟、刑事罰、MedicareおよびMedicaid計画から除外されること、および重大な負の宣伝などの制裁を受ける可能性がある。
また,CAPの認証計画に参加することを選択した。CMSはCAP標準はCLIA法規と同等或いは更に厳格であると考え、そしてすでにCAPを公認の認証組織として許可した。CAPが認められた実験室では,CMSではなくCAPが検査を行った。CAP実験室認可計画の認可を得たことから,われわれもCLIAに適合していると考えられる。
国と外国の臨床実験室許可証
私たちの臨床実験室はいくつかの州の実験室許可証を持っていなければならない。国家法律は著者らの実験室の日常運営標準を規定し、人員に必要な訓練と技能に対する要求、品質管理と能力テスト要求を含む。もし著者らの臨床実験室が適用された州法規に符合しなければ、州機構は著者らの臨床実験室運営許可証を一時停止、制限或いは取り消し、巨額の民事罰金を評価し、或いは具体的な是正行動計画を実施することができる。このようなどんな行動も私たちの業務に実質的な影響を及ぼすかもしれない。現在、私たちはすべての国家当局で良い名声を維持している。
さらに、いくつかの州は、これらの州からの標本を受け入れる州外実験室に許可を得ることを要求するかもしれない。私たちのテキサス研究所は 現在、カリフォルニア州、ニューヨーク州、メリーランド州、ペンシルベニア州、ロードアイランド州の州外許可証を持っており、これらの州のサンプルをテストすることができ、私たちのカリフォルニア実験室はニューヨーク州、メリーランド州、ペンシルバニア州、ロードアイランド州に必要な州外実験室許可証を持っており、これらの州のサンプルをテストすることができる。ニューヨーク許可証を持っている実験室は取締役実験室を持っていなければならず、ニューヨーク保健省臨床実験室評価計画(CLEP)が発行する許可種別資格を持っていなければならない。ニューヨーク州の実験室の法律と法規は人員資格、サンプル保存と測定同意に対して厳格な要求を提出した。他の事項に加えて,CLEPは特定のテストに基づいて承認を得て,ニューヨークからの標本をテストする必要がある.
7
他の州は未来に似たようなライセンス要件を採用するかもしれないが、これは私たちがこのような司法管轄区域での私たちの業務を修正、延期、または停止することを要求するかもしれない。もし私たちが他の州にこのような要求があることを発見した場合、あるいは他の州がこのような要求について私たちに連絡した場合、私たちはこのような要求をどのように遵守するかに関する州規制機関の指示に従うつもりだ。
私たちは外国の管轄区域の規制も受けており、私たちがテストの国際使用を拡大することを求めているか、あるいは私たちが業務を行っている管轄区域が新しい許可要件を採用したり、改正された許可証要求が採用されれば、これらの法規は増加すると予想されます。外国の許可要求は、ある司法管轄区域で検出を提供するために、または国際データの伝送を制限したり、私たちが検出に必要な人体血液や他の組織の輸送を制限するなど、他の制限を加えるために、私たちの検査を検討し、修正する必要があるかもしれません。これは、米国以外で広く検出を提供する能力を制限するかもしれません。
FDAによる私たちのテストとテストサービスの監視
私たちが提供する検査と検査サービスは医療機器と見なすことができる。FDAは連邦食品,薬物,化粧品法案(FDC Act)の認可により,医療機器に対して管轄権を有し,医療機器は臨床目的のための体外診断製品やIVDなどを含むと定義されている。吸入性覚せい剤の静脈注射マーケティングを管理する法律と法規は変化しており、極めて複雑であり、多くの場合、これらの法律と法規は重大な監督管理或いは司法解釈がない。FDAはアメリカの医療機器の研究、テスト、製造、安全、ラベル、貯蔵、記録保存、発売前の審査、マーケティングと販売促進及び販売と流通などの方面に対して監督管理を行い、国内で流通する医療製品がその期待用途に対して安全かつ有効であることを確保する。また,FDAは医療機器の輸出入を規制している。著者らの実験室で使用されている多くの機器、試薬、キット或いはその他の消耗性製品はすべて医療設備として監督管理されているため、FDA品質体系法規とある他の設備の要求を守らなければならない。私たちは、どのような適用可能な医療機器規制要件に適合するサプライヤーからもこのような材料を調達することを確実にするための政策と手続きを策定した。
私たちのテストは実験室開発テストやLDTの定義に合っていると信じています。LDTは、臨床的に使用するためのIVDのサブセットであり、単一の実験室内で設計、製造、および使用される。FDAには静脈注射薬を含む医療機器がその期待用途に対して安全かつ有効であることを確保する法的権限があるにもかかわらず,FDAは従来法執行自由裁量権を行使しており,FDC法案や法規におけるLDTに関する適用条項は施行されていない。しかし、2023年10月、FDAは現在の医療機器の枠組み下のLDTを規制するための提案された規則を発表し、このような診断テストに対する既存の法執行自由裁量政策を段階的に廃止することを提案した;公衆評議期間は2023年12月初めに終了した。この提案は、LDT実行政策の段階的淘汰プロセスが合計4年間で段階的に行われ、高リスクテストの上場前承認申請が3.5年前に提出されることを想定しており、発表される最後のルールでより多くの詳細を提供する予定であるが。FDAが2024年4月に最終的に提案ルールを決定する可能性(現在予測されているように)と,可能な訴訟がその機関がこのような行動をとる権力に挑戦する可能性は,現在のところ確定していない。影響を受けた利害関係者は、提案されたFDA行政行動を実施するのではなく、FDAとCMSがLDTを監督する統一的なモデルを作成するために、包括的な立法解決策を制定することを促し続け、これは業界および患者がいくつかの診断テストを得る機会を混乱させる可能性がある。
私たちが現在私たちのテストをLDTに商業化していても、FDAは私たちの市場テストがそのLDT標準の範囲内にあることに同意しないかもしれないし、あるいは私たちのテストは将来FDAによってより厳格に規制されるかもしれない。FDAがLDTまたは私たちの任意のテストに関する上場前提出法規を積極的に実行し始めた場合、新しい立法許可の結果としても、最近開始された通知および意見規則の制定が最終的に決定された後であっても、各テストのリスク分類に応じて、FDC法案510(K)条に基づいて、私たちのテストが発売前に承認されるか、または上場前承認申請またはPMAを承認する必要があるかもしれない。510(K)の発売前の通知の提出およびFDA承認を得るプロセスは、一般に3~12ヶ月を必要とするが、より長い時間を要する可能性があり、承認を保証することは決してできない。FDA承認PMAの提出および取得プロセスは、通常、1~3年またはそれ以上の時間を必要とし、承認される保証はない。PMA承認は、通常、大量の臨床データを必要とし、510(K)の承認プロセスよりも長く、より高価で、より不確実である可能性がある。もし私たちのテストの一部または全部が発売前審査を行う必要がある場合、FDAは私たちのテストおよびテストサービスの販売を停止し、承認または承認を待って、上場前の承認または承認を得るためにFDAに申請を提出する前に臨床テストを行うことを要求することができる。FDAはまた、私たちのテストを調査的にマークしたり、私たちが許可されたマーク宣言を制限することを要求することができる。
FDAは検査と市場監督を含む様々な手段でその医療機器要求を実行している。FDAが違反を発見した場合、それは、罰金、禁止、民事処罰、製品のリコールまたは差し押さえ、運営制限、部分的な一時停止または完全な生産停止、および刑事起訴など、見出しのない手紙や警告手紙からより厳しい制裁まで様々な法執行行動をとることができる。FDAの適用要件を遵守しないことは、警告状、民事罰金、罰金、禁止、刑事起訴を含むFDAの一連の法執行行動を引き起こす可能性がある
8
法令、修理、交換、払い戻し、リコールまたは差し押さえ、経営制限、経営の一部一時停止または完全閉鎖、許可または承認申請の拒否または質疑、および重大な負の宣伝に同意します。
ラボサービスまたはLDTSの広告に関する規定
我々の実験室サービスと検査広告は、連邦貿易委員会(FTC)によって施行された連邦広告真正性法律および同様の州消費者保護法によって制限されている。連邦貿易委員会法または“連邦貿易委員会法”によると、他にも、連邦貿易委員会は、(A)不公平な競争方法および商業にまたは商業に影響を与える不公平または詐欺的な行為またはやり方を防止する権利があり、(B)消費者を損なう行為のための金銭補償および他の救済を求める権利があり、(C)商業に従事する実体の組織、業務、やり方および管理に関する情報を収集して集約し、調査する。連邦貿易委員会は非常に広範な法執行権力を持っており、連邦貿易委員会法案や他の消費者保護法の実質的な要求を守らなければ、民事処罰、私たちの将来のサービスや製品の販売方法に影響を与える禁止、または刑事起訴を含む行政または司法処罰を受ける可能性がある。
私たちのテストとテストサービスの支払人の精算に関する規則
CPTコード
私たちは、米国医学会(AMA)によって発表された現在のプログラム用語またはCPTコードを使用して、私たちのテストおよびテストサービスのために第三者支払者(商業および政府を含む)に課金する。現在の形式のCPTコードは我々が行っている多くの遺伝子テストには容易に適用できない。例えば、私たちの多くの多遺伝子グループの場合、グループ内の1つまたは複数の遺伝子は適切なCPTコードを有さない可能性があり、この場合、私たちのテストは、リストされていない分子病理学的プログラムのヘテロコードで課金される可能性がある。多くの第三者決済者たちはこの雑コードの固定精算料率を持っていない。テストを行う前に,福祉調査が医学的に必要であると判断し,支払者が事前に許可していれば,支払者と販売率を協議する可能性がある。テスト結果が交付された場合、私たちがクレームを提出した後、私たちはまた文書を再提出したり、控訴否定を提出したりする必要があるかもしれない。このようなすべての問題はクレーム遅延を招くかもしれないし、私たちは補償を受けることができない。
パマ
2014年4月、国会は2014年の保護獲得連邦医療保険法案(PAMA)を可決し、連邦医療保険の臨床実験室費用スケジュール(CLFS)による臨床実験室サービスの定価と支払い方式の重大な改革を含む。CMSは2016年6月23日、実施報告書と料率設定要求の最終規則を発表した。PAMAによると,CLFSまたは医師費用スケジュールに基づいて支払われる大部分の医療保険収入の実験室は,臨床診断実験室テスト(CDLT)の個人支払率と数を3年ごとにCMSに報告しなければならない(高度診断実験室テストでは,年に1回報告される)。我々のどのテストも現在のADLTの定義に適合しているとは思わない.したがって、私たちは3年ごとにテストされた個人支払者比率を報告しなければならない。報告書に必要な支払い情報がない実験室は巨額の民事罰金を受けるかもしれない。
PAMAの要求により,CMSは実験室から報告されたデータを用いて実験室テストの連邦医療保険支払率を作成し,個人支払者支払率の数加重中央値に等しい。2018年1月1日以降に提供される試験については、CDLTの連邦医療保険支払いは、報告書の個人支払者料金に基づく。新たまたは大幅に改訂されたCPTコードが割り当てられたCDLTについては,先の法律に従ってギャップを埋める方法を用いて初期支払率を割り当てる.
2019年12月以降、国会では一連の法律が可決され、データ報告期間とCLFSにおける非ADLTに対するCDLTの段階的な減免に関するPAMAの法定要求が改正された。最近,2024年にさらに支出と他の延期法案(2023年11月16日公布のPUB.L.118−22)がさらに報告要求および15%段階削減の適用を延期した。これらの法定規定によると、ADLTでないCDLTの次のデータ報告期間は2025年1月1日から2025年3月31日までであり、2019年1月1日から2019年6月30日までの最新データ収集期間に基づく。このデータ報告期間の後、これらのテストの3年間のデータ報告期間は回復する(例えば、2028年、2031年など)。
同一一連の法律は、前年テストの支払金額と比較して、例年または2021年から2023年までのCySに0.0%の減少制限を適用するために、個人支払者料率による支払い減少を段階的に実施することを改正した。2024年のさらなる継続支出と他の延期法案はさらに0.0%の減幅を適用した
9
2024年度の制限価格。したがって,前年にテストのために決定された支払金額と比較して,2025から2027年のCySの年間支払額は15%を超える減少してはならない.
2020年3月、コロナウイルス援助、救済と経済安全法案を公布し、医療保健提供者がアメリカ衛生資源とサービス管理局(HRSA)管理の計画を通じて未加入個人に新冠肺炎検査の補償を提供することを規定した。未保険計画の有効期限は2020年5月から2022年4月までであり、HRSAは十分な資金が不足しているため、未保険計画は2022年3月22日から新冠肺炎テストのクレームを受けることを停止すると発表した。
同業界の他の実験室と同様に,同社は現在HRSAの監査を受けており,保険がないと考えられる患者に提供される新冠肺炎検査の精算状況を決定している。会社はHRSAの監査役と十分に協力して、HRSAに返金する必要がある可能性がある任意の精算金額を含む任意の問題を解決している。HRSAが使用する方法やそれらが監査結果をどのように推定するかについては,不確実性がある。HRSA監査の結果は、会社の業務、将来性、財務状況に重大な悪影響を及ぼす可能性がある。
わが国の薬物研究開発活動の規則制度に適用する
私たちは私たちの完全子会社フルギント製薬を通じて、薬物研究と開発活動を含む研究と開発活動に従事している。治療製品の開発はFDAと他の規制機関によって広く規制されている。特に、アメリカ連邦、州と地方の各レベル及びその他の国の政府当局は治療製品の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、販売促進、広告、流通、承認後のモニタリングと報告、マーケティング及び輸出入などを監督している。通常、治療製品は、米国および他の国で臨床試験および商業販売を行い、ヒト治療用途に使用するために、政府の許可を必要とする。私たちが守らなければならない正確な規制要求は定期的に改正されて改善されているだろう。
米国ではFDAはFDA法案とその実施条例に基づいて薬物を規制している。規制の承認を得て、その後、適用される連邦、州、地方、外国法規を遵守する過程には、多くの時間と財力が必要だ。製品開発過程,承認過程又は上場後のいずれかの場合,出願人が適用される米国の要求を遵守しなければ,行政又は司法制裁を受ける可能性がある。他の行動に加えて、これらの制裁は、FDAが未解決の申請の承認の拒否、承認の撤回、臨床棚上げ、無見出しまたは警告状、製品のリコールまたは市場撤回、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返還、返還、および民事または刑事罰を含むことができる。
治療製品がアメリカで発売される前に必要なステップは多く、以下のステップを含むが、これらに限定されない
10
治療製品を販売するために必要な試験および処方過程は、大量の時間、エネルギー、財力に関連しており、私たちは、承認されれば、私たちの将来の任意の治療製品の任意の承認が適時に承認されるかどうかを決定することはできない。NDAを支持するために必要なデータは、2つの異なる発展段階で生成される:非臨床と臨床。非臨床開発段階は通常、薬物化学、配合および安定性の実験室評価と、動物におけるこの分子の毒性を評価する潜在的研究を含み、これは後続の臨床試験を支持する。スポンサーは、INDの一部として、非臨床研究の結果を、生産情報、分析データ、任意の利用可能な臨床データまたは文献、提案された臨床案と共にFDAに提出しなければならない。INDはFDAがヒトに研究用新薬の使用を許可する請求であり,ヒト臨床試験が開始される前に発効しなければならない。
臨床試験
臨床開発段階は、合格した研究者の監督の下で、GCP要求に基づいて、ボランティアまたは患者に研究製品を提供することであり、通常は試験スポンサーに雇用されない、または試験スポンサーの制御下にある医師であり、すべての研究対象に任意の臨床試験への参加についてインフォームドコンセントを提供することを含む。臨床試験は,臨床試験の目標,用量プログラム,被験者の選択と排除基準,および被験者の安全性をモニタリングし,治療効果を評価するためのパラメータを詳細に説明した場合に行われる。INDの一部として、すべての議定書とその後の議定書のいかなる修正もFDAに提出されなければならない。また,臨床試験に参加する各機関の機関審査委員会またはIRBは,その機関が臨床試験を開始する前に新たな臨床案を審査·承認しなければならず,試験に関する情報と各研究対象または被験者に提供しなければならない法律代表の同意書を承認しなければならず,試験が完了するまで監視し,そうでなければIRBの規定を遵守しなければならない。
臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複または合併する可能性がある
承認後試験は,“4期”臨床試験と呼ばれることがあり,最初の上場承認後に行われる可能性がある。これらの試験は,治療適応が予想される患者の治療から追加的な経験を得るために用いられている。場合によっては、FDAはNDAを承認する条件として“4期”臨床試験を強制的に実行することができる。
その他の情報以外に、臨床試験結果の進展報告を詳しく説明するには少なくとも毎年FDAに提出しなければならず、書面IND安全報告はFDAと調査者に提出しなければならず、深刻かつ予期しない疑わしい不良事件を理解し、その他の研究は研究薬物に暴露した人類に対して重大なリスクがあることを表明した他の研究結果、動物或いは体外試験結果は人体に重大なリスクがあることを表明し、及び深刻な疑わしい副作用の発生率は方案或いは研究者のマニュアルに列挙された発生率より臨床上重要な増加であることを表明した。国会は最近FDC法案を改正し,2023年の総合支出法案の一部として,新薬発売認可を支援する3期臨床試験やその他の“重要な研究”の発起人にこのような臨床試験の設計と多様性行動計画の提出を求めている。行動計画には,スポンサーの多様な学生募集目標と,目標の理由やスポンサーがこれらの目標をどのように達成するかの記述が含まれなければならない。スポンサーはスポンサーが関連する臨床試験案をFDA審査に提出する前にFDAに多様な行動計画を提出しなければならない。FDAは多様な行動計画の一部またはすべての要求を免除することができる。多様性行動計画が第三段階試験計画と時間スケジュールにどのように影響するかは不明であり、FDAがこのような計画の中でどのような具体的な情報を期待するかも不明であるが、FDAがスポンサーの多様性行動計画に反対したり、重大な変更を要求したりすれば、関連臨床試験の開始を遅らせる可能性がある。また,臨床試験に参加する各機関を代表するIRBは,少なくとも年に1回の継続審査と再承認試験を行わなければならない。いくつかの臨床試験に関する情報は、プログラムの詳細および最終的な研究結果を含み、ClinicalTrials.govデータレジストリ上で公開伝播するために、特定の時間枠内で米国国立衛生研究院(NIH)に提出されなければならない。臨床試験登録の一部として,研究製品,患者群,調査段階,研究場所や研究者,臨床試験の他に関する情報が公開される。スポンサーも完成後にその臨床試験の結果を開示する義務がある。場合によっては、これらの裁判結果の開示は、裁判が完了した日から2年に延期されることができる。競争相手はこれらの公開された情報を用いて開発計画の進捗状況を知ることができる.NIHのClinicalTrials.gov登録と報告要件に関する最終規則が2017年に発効し,政府は要求に適合しない臨床試験スポンサーに対してこれらの要求を実行し始めている。
11
臨床試験は何の規定の時間内にも成功しないかもしれないが,もしあれば。FDAあるいはスポンサーは研究対象や患者が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で臨床試験を一時停止することができる。同様に、臨床試験がIRBの要求に従って行われない場合、または候補薬剤が患者に予期せぬ深刻な傷害を受けることに関連している場合、IRBは、その機関の臨床試験の承認を一時停止または終了することができる。さらに、いくつかの臨床試験は、データ安全監視委員会または委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループによって監督される。このグループは,実験のあるデータへのアクセスにより,許可試験が指定されたチェックポイントで行えるかどうかを決定する.
NDA提出とFDA審査の流れ
必要な臨床試験が完了した後,研究中の治療製品がその提案の指示用途に対して安全かつ有効であるかどうかを評価するために,すべてのデータを分析した。非臨床研究及び臨床試験の結果、並びに製品の化学、製造及び制御の詳細な説明、又はCMC、提案されたラベル及びその他の関連情報は、NDAの一部としてFDAに提出され、当該製品の発売承認を要求する。上場承認を支持するためには、提出されたデータは研究製品の安全性と有効性を確定し、FDAを満足させるために、品質と数量で十分でなければならない。薬物がアメリカで発売される前に、NDAに対するFDAの承認を受けなければならない。
改正された処方薬使用料法案(PDUFA)によると,NDAごとに相当な使用料を伴わなければならず,承認されたNDAのスポンサーも年度計画費を支払う必要がある。FDAは通常、このようなPDUFAユーザ費用を毎年調整する。場合によっては、小規模企業(従業員数500人未満)が最初に出願した出願料を免除することを含む、費用を免除または減免することができる。また,孤児薬として指定された製品については,NDAに対して使用料を評価せず,非孤児適応も含まれていない限りである。
FDAは、それらが届出を受ける前に十分に完全であり、実質的な審査を行うことができることを確実にするために、提出されたすべてのNDAを審査する。それは、秘密協定の提出を受け入れるのではなく、申請の提出を拒否し、より多くの情報を提供することを要求することができる。この場合、申請は追加情報と共に再提出されなければならない。再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。FDAはNDAを受け取ってから60日以内にNDA届出を受ける決定をしなければならず,FDAが提出書類を受け取ってから74日前にスポンサー申請が十分であるかどうかを通知し,実質的な審査を行うことができる。提出された申請が受け入れられると、FDAはNDAの深い審査を開始する。FDAがPDUFAで合意した目標および政策によれば、FDAは、新しい分子実体またはNME NDAの審査を完了し、出願人に応答し、優先審査を指定したNME NDAの提出日から6ヶ月間、FDAが10ヶ月間有する。非NME NDA、例えば、私たちの現在および潜在的な将来の候補製品の場合、検討目標は、標準出願を受信した日から10ヶ月、優先提出を受けた日から6ヶ月である。FDAは、常にそのPDUFA標準および優先NDAの目標日を達成するわけではなく、審査プロセスは、FDAがより多くの情報を提供または明確にすることを要求することによって延長されることが多い。提出された書類が届出を受けた後、FDAは深い実質的な審査を開始した。上述したように、FDAは国家発展機関の審査過程において具体的な業績目標を決定することに同意した。FDAは、新しい情報を考慮するために、審査プロセスをさらに3ヶ月延長することができ、または出願人が明確な説明を提供する場合には、FDAが最初の提出後に発見した係属中の欠陥を解決することができる。
革新的薬物製品の多くは、FDC法505(B)(1)条に提出されたセキュリティ協定に従ってFDAの上場承認を得ており、一般に伝統的または“包括的セキュリティ協定”と呼ばれている。1984年、“薬品価格競争と特許期限回復法”(非公式名称は“ハッチ·ウェクスマン法案”)の成立に伴い、国会はまた“薬品価格競争と特許期限回復法”を公布し、その中で伝統的なNDAと模倣薬の応用を組み合わせた混合経路が規定され、FDAが革新者または“参考”製品に基づく模造薬を承認することを許可した。第505条(B)(2)条は、出願人が、その適用を支援するために、以前のFDAの既存製品の安全性および有効性データの発見、または出版された文献に部分的に依存することを可能にする。第505条(B)(2)新薬は、FDAが以前に承認された製品の新しいまたは改善された処方または新しい用途を承認するための別の方法を提供することができ、例えば、出願人は、安全性または有効性を証明するために新しい臨床データを必要とする新しい適応または新しい患者集団のための以前に承認された薬剤の使用を承認することを求めている可能性がある。第505条(B)(2)条は、出願人が薬物が安全であるか又は有効であるかを証明するために行われた研究における情報に少なくとも部分的に依存する機密協定の提出を許可し、これらの情報は、出願人によって行われたものでもなく、出願人のために行われたものでもなく、出願人も参照権又は使用権を得ていない。第505条(B)(2)の出願人は、以前に承認された製品に対する研究の依存が科学的に適切であると判断できる場合、いくつかの非臨床的または臨床的研究の必要性を除去または減少させることができる。
FDAは、セキュリティ協定を承認する前に、通常、製造プロセスおよび施設がcGMP要件に適合しているかどうかを決定するために、新製品の製造施設を承認前に検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、この製品を承認しないであろう。FDAはまた、臨床研究者と任意の第三者臨床研究組織(CRO)がGCP要求に適合することを含む臨床試験に参加する各実体を保証するために、臨床試験のデータを監査することができる。
12
さらに、FDAは、安全性または有効性の問題を提起する新薬製品または医薬製品の申請を諮問委員会に提出することができ、一般に、申請が承認されるべきかどうか、およびどのような条件下で(あれば)承認すべきかを審査、評価および提案するための臨床医および他の独立した科学的専門家を含むグループである。FDAは諮問委員会の提案に制約されていないが,機関による上場承認の最終決定を行う際にこれらの提案を考慮する。FDAは臨床試験データを再分析する可能性があり,FDAや出願人の審査過程で広く議論される可能性がある。FDAが、薬物の利点がそのリスクよりも大きいことを保証し、薬物の安全な使用を確保するために、リスク評価および緩和戦略またはREMS計画を策定する必要があると判断した場合、FDAはまた、リスク評価および緩和戦略またはREMS計画の策定を要求する可能性がある。REMS計画は、制限された分配方法、患者登録、または他のリスク最小化ツールのような薬物ガイドライン、医師コミュニケーション計画、評価計画、および/または安全使用を保証する要素を含むことができる。FDAは具体的な状況に応じてREMSに対する要求および具体的なREMS条項を決定する。FDAがREMS計画が必要であると結論した場合、NDAのスポンサーは提案されたREMSを提出しなければならない。必要であれば、FDAはREMSなしのNDAを承認しないだろう。
承認プロセスが長く、しばしば困難であり、適用される規制基準が満たされていない場合、または追加の臨床または他のデータおよび情報が必要とされる可能性がある場合、FDAはNDAの承認を拒否する可能性がある。FDAがNDAを審査する目的の1つは、製品がその予期される用途に対して安全かつ有効であるかどうかを決定し、その製造がcGMPに適合するかどうかを決定して、製品の特性、強度、品質、および純度を確保し、維持することである。FDAによるNDAの評価および付随する情報によれば、製造施設の検査結果を含み、FDAは承認書または完全な返信を発行することができる。この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。完全な返信は、申請の審査期間が終了し、現在の申請が承認されないことを示している。完全な応答文は、一般に、NDA内のすべての特定の欠陥を説明し、FDAが出願を再検討するために、多くの追加のテストまたは情報を必要とする可能性がある。完全な返信は、追加の臨床または他のデータ、追加の重要な第3段階臨床試験(S)、および/または臨床試験、非臨床研究または生産に関連する他の重要で時間のかかる要件を必要とする可能性がある。完全な返信が発行された場合、出願人は、秘密協定を再提出し、手紙で決定されたすべての不足点を解決するか、または出願を撤回することを選択することができる。再提出されたセキュリティプロトコルにおいて、すべての欠陥がFDAによって満足的に解決された場合、FDAは承認書を発行する。FDAは、発表された完全な返信に応答するために、含まれる情報タイプに基づいて、そのような再提出を2ヶ月または6ヶ月以内に検討することを約束している。しかしながら、これらのデータおよび情報が提出されても、FDAは最終的にNDAが承認された規制基準を満たしていないことを決定する可能性がある。臨床試験から得られたデータは常に決定的ではなく,FDAは同じデータを解釈するのではなく,異なる方法でデータを解釈する可能性がある。
1つの製品が発売承認されても,承認は特定の適応や用量に限定される可能性があり,あるいは使用の適応が制限される可能性があり,その製品の商業的価値を制限する可能性がある。さらに、FDAは、いくつかの禁忌症、警告、または予防措置を製品ラベルに含めることを要求する可能性がある。FDAは、REMS計画の形態で、製品流通、処方または調剤に制限および条件を適用することができ、または他の方法で任意の承認範囲を制限することができる。さらに、FDAは、製品の安全性および有効性をさらに評価し、および/または商業化された承認製品の安全性を監視するために、市販後または第4段階の臨床試験を要求することができる。承認後、新たな適応の追加、製造変更、および追加のラベル宣言など、承認された製品のいくつかのタイプの変更は、さらなるテスト要件およびFDAの審査および承認を受けるであろう。
薬品承認後の要求
新しい治療製品が承認された後、製造業者および承認された製品は、監視および記録保存活動を含むFDAによって一般的かつ持続的に規制されるであろう。製品の副作用を報告すること、製品サンプリングおよび流通制限、未承認用途または患者集団のための薬物(すなわち“非ラベル使用”)の普及を制限すること、および業界支援を制限する科学的および教育活動を含む宣伝および広告要件を遵守する。医師はラベル外の用途のために合法的な製品を処方する可能性があるが、メーカーはこのような用途を販売したり普及させたりしてはならない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。
さらに、製品に適応、ラベルまたは製造プロセスまたは施設の変化を含む修正がある場合、出願人は、新しいNDAまたはNDA付録に対するFDAの承認を得るために提出を要求される可能性があり、これは、出願人に追加のデータを開発すること、または追加の非臨床研究および臨床試験を行うことを要求する可能性がある。特に,FDAが新たな適応を承認することは,元の適応を承認する過程と類似していることを確保し,他にも十分かつ制御された臨床試験データを提出し,新適応における安全性と有効性を証明する必要がある。このような実験を行っても,FDAはタイムリーに使用するためにラベル適応のいかなる拡張も承認しないか,あるいは全く承認しない可能性がある。
13
また,FDAの規定では,製品は特定の承認施設で生産され,cGMPに適合しなければならないことが求められている。CGMP条例には、人員、建物および施設、設備、アセンブリおよび薬品容器および閉鎖的な制御、生産およびプロセス制御、包装およびラベル制御、保有および分配、実験室制御、記録および報告、ならびに返品または回収された製品に関する要件が含まれる。医薬品メーカーおよび他の承認された治療薬の生産と流通に参与する実体は、FDAとある州機関にその機関を登録し、cGMPおよび他の要求に対する遵守状況を評価するために、FDAの定期的な抜き打ち検査を受けなければならない。承認された薬品の製造プロセス,規格や容器閉鎖システムの変更は厳しく規制されており,通常はFDAの承認を得て実施する必要がある。FDAの法規はまた、cGMPとの任意の偏差を調査および是正し、NDAスポンサーおよび承認された治療製品の生産に参加する任意の第三者製造業者に報告および文書要件を提出することを要求する。したがって、スポンサーやメーカーは、cGMPコンプライアンスおよび品質管理および品質保証の他の側面を維持し、FDC法案の他の法定要求を継続的に遵守することを確保するために、生産および品質管理の分野で時間、お金、労力をかけ続けなければならない。
したがって,新薬が承認された後であっても,規制要求や基準の遵守が保たれていなければ,あるいは製品発売後に問題が生じた場合,FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの改訂をもたらす可能性がある;新しい安全リスクを評価するために発売後研究または臨床試験を実施すること、またはREMS計画に従って流通または他の制限を実施することが可能である
開発と審査計画を加速する
FDAは特定の薬物製品を指定して加速開発或いは審査を行う権利があり、もしこれらの薬物製品が深刻な或いは生命に危害を及ぼす疾病或いは条件の治療において満たされていない医療需要を満たすことを目的としている場合。これらの計画には、高速チャネル指定、画期的な治療指定、優先審査指定が含まれる。
迅速なチャネル認証を取得する資格があるために、FDAはスポンサーの要求に基づいて、深刻なまたは生命に危害を及ぼす疾患または状態を治療することを目的とした製品を決定し、存在しない治療法または治療効果または安全要素に基づく既存の治療法よりも優れている可能性があることを証明することによって、満たされていない医療需要を満たす可能性があることを証明した。高速チャネル指定は、FDA審査チームとより頻繁な相互作用を行うための機会を提供し、製品の開発と審査を加速する。FDAはまた、スポンサーとFDAが出願部分のスケジュールについて合意し、スポンサーがNDAの第1の部分を提出する際に必要な使用料を支払うことを前提として、完全な出願を提出する前に、高速チャネル製品を審査するNDA部分をスクロールすることができる。さらに、臨床試験中に生じるデータが高速チャネル指定をもはやサポートしていない場合、スポンサーが指定を撤回する可能性があり、またはFDAが指定を取り消す可能性がある。スポンサーは、NDAの承認を得る前の任意の時間に、FDAに製品を高速チャネル状態に指定することを要求することができるが、NDA前の会議よりも遅くないことが好ましい。
FDAはまた、重篤な疾患を治療する薬剤である場合、承認されれば、安全性または有効性の面で有意な改善を提供する優先審査製品を指定することができる。上場申請が優先審査要求と共に提出された場合、FDAは具体的な状況に基づいて、他の既存療法と比較して、提案薬物が治療、予防或いは疾患の診断において有意に改善されているかどうかを決定する。顕著な改善は,ある疾患の治療の有効性の向上,治療を制限する薬物反応の除去あるいは大幅な減少,記録されている患者のコンプライアンスの向上,重篤な結果の改善,あるいは新亜群の安全性と有効性の証拠に現れる可能性がある。優先審査指定は、全体的な注意およびリソースをこのような出願の評価に誘導することを目的とし、FDAがマーケティング申請に行動する目標を提出日から10ヶ月から6ヶ月(NME NDA)に短縮するか、または非NME NDAを受信した日から10ヶ月~6ヶ月に短縮する。
14
さらに、1つの薬剤が単独で、または1つまたは複数の他の薬剤または生物学的製品と組み合わせて、深刻または生命に危険な疾患を治療するために使用され、初期臨床証拠は、製品が1つまたは複数の臨床的に重要な終点で現在承認されている療法よりも実質的に改善されている可能性があることを示している場合、薬剤は突破的療法として指定される資格がある可能性がある。FDAは画期的な治療法の承認申請の開発と審査を加速するために、適時に製品スポンサーと会議を行い、それに提案を提供するなど、突破的な治療法に対して何らかの行動を取らなければならない。
1つの製品がこれらの計画のうちの1つまたは複数に適合していても、FDAは、製品がもはや資格条件に適合していないことを後で決定することができ、またはFDAの審査または承認を決定する期間が短縮されないことができる。迅速チャネル指定、優先審査、および画期的な治療指定は、承認の基準を変更することはありませんが、開発や承認プロセスを加速させる可能性があります。
承認ルートを加速する
研究された製品は、深刻または生命に危険な疾患の治療における安全性および有効性、および既存の治療方法よりも意義のある治療利益を提供する製品は、FDAの加速承認を得る可能性があり、十分かつ制御された臨床試験によって承認される可能性があり、これらの試験は、医薬製品が臨床的利益を合理的に予測する可能性のある代替終点に影響を及ぼすことを証明する。中間臨床終点に対する製品の影響が、不可逆的発症率または死亡率またはIMMへの影響よりも早く、病状の重症度、希少性または流行率、ならびに代替治療の利用可能または欠乏の影響を考慮すると、または生存率または不可逆発症率以外の臨床終点への影響に基づいて、IMMまたは他の臨床的利益への影響を合理的に予測する可能性がある場合、FDAもそのような薬剤の承認を加速することができる。承認の一つの条件として、FDAは、IMMまたは他の臨床終点に対する予期される効果を検証および説明するために、承認された薬物のスポンサーに十分かつ良好な制御を行うことを要求することができ、迅速な薬剤停止手順を必要とする可能性がある。FDAが,流通や使用が制限されている場合にのみ,有効であることが証明された薬物を安全に使用できると結論した場合には,必要と考えられる発売後制限を実施し,その製品の安全使用を確保することが求められる。加速的な承認を得た薬品は伝統的に承認された薬品と同じ安全と有効性法定基準に適合しなければならない。
承認を加速するために、代替終点は、例えば実験室測定、放射画像、バイタルサイン、または他の臨床的利益を予測することができると考えられるが、それ自体は臨床的利益の測定基準ではない標識である。代替終点は通常、臨床終点よりも容易または迅速に測定される。中間臨床終点は治療効果の測定であり、1種の薬物の臨床利益、例えばIMMに対する効果を合理的に予測することが可能であると考えられる。FDAは中間臨床終点に基づく加速審査の経験は限られているが、終点で測定した治療効果自体が臨床利益と伝統的な審査の基礎ではなく、もし基礎治療効果が合理的に薬物の最終長期臨床利益を予測する可能性があれば、このような終点は通常加速承認を支持することができることを表明した。
加速承認経路は病気経過が比較的に長い環境に最もよく応用され、しかも薬物の期待される臨床利益を測定するために比較的に長い時間が必要であり、代替或いは中間臨床終点への影響が非常に速く発生した。例えば、加速承認は、様々な癌を治療するための薬剤の開発および承認に広く使用されており、治療の目標は、通常、生存率を向上させること、または発症率を低下させることであり、典型的な病気経過の持続時間は、臨床または生存上の利点を証明するために長い、場合によっては大型の臨床試験を必要とする。
承認を加速する方法は、一般に、薬物の臨床的利益を検証および説明するために、勤勉な方法で追加的な承認後の検証的研究を行うことにスポンサーが同意することに依存する。そのため、この基礎の上で承認された候補薬物は必ず厳格な発売後のコンプライアンス要求を遵守し、4期或いは承認後の臨床試験を完成し、臨床終点への影響を確認することを含む。また、2023年の総合支出法案の一部として、国会は、マーケティングを継続する前に加速的に承認された無効薬の患者への潜在的リスクを軽減するために、FDAに追加の法定権力を提供した。FDC法案の最近のこれらの修正案によると、機関は、承認を加速させた製品のスポンサーに、承認前に検証試験を行うことを要求することができる。スポンサーはまた、試験が完了するまで、検証性試験の進捗報告を6ヶ月ごとに提出しなければならず、このような報告はFDAのサイトで公表される。必要な承認後研究を行うことができなかったか、あるいは発売後の研究期間中にこの製品の期待される臨床利益を確認できず、FDAがこの薬物の承認を撤回することを許可した。国会では最近、スポンサーの検証性試験が製品主張の臨床的利益を検証できなかった場合、FDAは迅速なプログラムを使用して製品承認を撤回することを選択することができる法律も改正された。加速承認計画により発売された製品を承認するすべての宣伝材料はFDAの事前審査を経なければならない。
“ハッジ·ワックスマン法案”下の特許リストと規制排他性
15
上述したように、国会は1984年にFDC法案に対するハッジ·ワックスマン法案改正案の一部として505(B)(2)NDA経路を作成した。同時に、FDAが以前NDASによって承認された薬剤と同じ有効成分を含み、生物学的同等性を有することが証明された後発薬をFDAに承認することを許可する簡略化された規制計画を確立した。後発薬の承認を得るためには,申請者はこの機関に短い新薬申請,あるいはANDAを提出しなければならない。ANDAは統合文書であり,その中には他の事項のほかに,有効薬物成分,生物学的同等性,薬品調製,後発薬の規格と安定性および分析方法,製造過程検証データと品質制御プログラムに関するデータと情報が含まれている。ANDAは安全性と有効性を証明する臨床前および臨床データを含むことができないため、“略語”である。逆に,このような応用を支援するためには,後発薬メーカーは,これまで秘密保持プロトコルによって承認されていた薬物製品による臨床前と臨床試験に依存しなければならず,参考市販薬,あるいはRLDと呼ばれる。ANDA経路は、申請者がバイオアベイラビリティまたは生物学的同等性データ以外の新しい臨床データを提出することを許可しないのとは異なり、505(B)(2)監督経路は、以前に承認された薬物に対する提案された変更(S)の安全性または有効性を証明するために、後続申請者を排除しない追加の臨床試験または非臨床研究を行う必要がある。
ANDAを承認するためには,FDAは後発薬が活性成分,投与経路,剤形,薬物強度,薬物使用条件においてRLDと同様であることを発見しなければならない。同時に、FDAはこの模造製薬と革新薬が生物学的同等性を有することを確定しなければならない。この法規によると、模倣薬の吸収速度と程度が市販薬物の吸収速度と程度と有意差がなければ、この模倣薬は生物的にRLDと同等である。ANDAが承認されると、FDAは、出版物、治療同等性評価を有する承認医薬製品またはオレンジマニュアルにおいて、模倣薬がRLDと“治療的に等価であるかどうか”を示す。医師と薬剤師は同量の後発薬を治療することはRLDを完全に代替できると考えている。さらに、いくつかの州の法律および多くの医療保険計画の実施のため、FDA指定の治療同等性は、処方医または患者が知らない場合、またはその同意を得ない場合に、後発薬の代替をもたらすことが多い。
NDA審査および承認プロセスの一部として、出願人は、出願人の製品または治療使用方法をカバーすると主張する各特許をFDAに列挙することを要求される。新薬が承認されると、その薬物出願に記載されている各特許はオレンジブックに発表される。逆に、オレンジブックに記載された薬剤は、参照製品に完全にまたは部分的に依存するANDAまたは505(B)(2)NDAの承認をサポートするために、潜在的な後続の競合他社によって参照されることができる。
ANDA申請者がFDAに出願する場合、FDAオレンジブックに記載されている参照製品の任意の特許をFDAに証明する必要がある。具体的には、ANDA出願人は、(I)必要な特許情報を提出していないこと、(Ii)特許が満了していること、(Iii)記載されている特許がまだ満了していないが、特定の日に満了し、特許が満了した後に承認を求めること、または(Iv)に記載された特許が無効であるか、または新製品の侵害を受けないことを証明しなければならない。また,第505条(B)(2)条のNDA出願人は,承認された製品の検討に依存するため,出願人は,オレンジマニュアルに記載されているNDAが承認した製品の任意の特許をFDAに証明しなければならず,ANDA出願人と同程度である。
後続の出願人がイノベーティブにリストされた特許に挑戦していない場合、FDAは、すべての要件参照製品のリスト特許が満了するまで、ANDAまたは505(B)(2)出願を承認しないであろう。新製品が承認された製品の上場特許又はそのような特許を侵害しない無効な認証を第4項認証と呼ぶ。後続の出願人がFDAに第4段落の認証を提供した場合、ANDAまたは505(B)(2)NDAがFDAによって届出を受けると、出願人はまた、第4段落の認証に関する通知をNDAおよび特許所有者に送信しなければならない。そして、NDA及び特許所有者は、第4項の認証の通知に対して特許侵害訴訟を提起することができる。第4項の認証を受けてから45日以内に特許侵害訴訟を提起すると、FDAがANDAまたは505(B)(2)NDAを承認するのを自動的に阻止し、より早い30ヶ月、特許満了、訴訟和解または侵害事件においてANDA/505(B)(2)出願人に有利な裁決まで阻止される。
ANDAまたは505(B)(2)NDAも、オレンジブックに記載されている参照製品の任意の適用非特許排他性満了まで承認されないであろう。ハッジ·ワックスマン法案によるFDC法案の修正案は、新しい化学物質(NCE)NDAの承認を得た最初の出願人に、5年間の米国内の非特許データ排他期間を提供した。本条項の場合、NCEは、FDAが以前に任意の他のNDAで承認された活性部分を含まない薬剤を意味する。活性部分は薬物物質の生理的あるいは薬理作用を担う分子またはイオンである。このようなNCE排他性が付与されている場合、ANDAまたは505(B)(2)NDAは、提出された書類に第4項の証明が添付されていない限り、5年の満了前にFDAに提出することができず、この場合、出願人は、原製品の承認後4年以内に出願を提出することができる。
FDC法案はまた、NDAまたはNDA付録が1つまたは複数の新しい臨床研究の報告を含む場合、3年間のデータ排他期間があるが、以下の機関によるバイオアベイラビリティまたは生物学的同等性研究は除外すると規定している
16
申請者は,FDAが申請または補充剤を承認する鍵とされている。この3年間の専門期間は、通常、新しい適応、剤形、投与経路または成分の組み合わせなど、以前に承認された薬物製品の変化を保護する。新たな臨床研究を行う法定要求を満たしていれば,先に承認された活性部分を含む医薬製品は3年間の独占経営権を得ることになる。5年間のNCE排他性とは異なり、3年間の排他的裁決は、FDAがANDAまたは505(B)(2)NDAを受け入れることを阻止せず、元の薬物製品が承認された日にその薬物の模倣薬を承認することを求め、逆に、この3年間の排他性は、新しい臨床研究に関連する使用条件のみをカバーし、一般的な事項として、FDAが元の活性成分を含む薬物の後続申請を承認することを禁止しない。
5年および3年の排他性も、FDC法案505(B)(1)条に従って提出された従来のNDAの提出または承認を延期または承認することはないが、従来のNDAを提出する申請者は、安全性および有効性を証明するために必要なすべての非臨床研究および十分かつ制御された臨床試験を参照する権利を行うか、または得ることが要求されるであろう。
特許期間を延長する
FDA法案によれば、FDAの承認を要求する処方薬または医療機器の特許は、特定の法定および規制要件を満たす場合に、製品開発およびFDA規制審査中に失われた特許期間を5年間にわたって回復することを可能にする限られた特許期間延長を得る資格がある可能性がある。FDA規制をカバーする新医療製品の特許付与の回復期は、通常、人体臨床研究を開始する日と製品発売前承認申請提出日との間の半分の時間であり、製品承認申請提出日と最終承認日との間の時間を加える。特許期間回復は特許の残存期間の延長には利用できず,製品承認日から合計14年を超える。複数の製品をカバーする特許は、そのうちの1つが上場承認された場合にのみ延期される。
診断に伴う診断又は補充診断に関する規則及び条例
私たちの1つまたは複数の候補薬物の成功は、セット診断または補充診断の開発と商業化にある程度依存する可能性がある。同時診断および補足診断は、特定の薬物から利益を得る可能性が最も高い患者を決定することができ、特定の薬物治療の使用によって深刻な副作用のリスクを増加させる可能性がある患者を決定すること、またはより良い安全性または有効性を達成するために治療を調整することを目的とする特定の薬物治療に対する反応を監視することができる。診断と補充診断に伴うFDAは医療機器として規制されている。リスクを低減するための新しい診断試験および利用可能な制御措置と組み合わせて、セット診断装置がFDAのPMA承認を必要とするかどうか、または510(K)の発売前通知プログラムを介して510(K)の上場前通知プログラムを通過することができるかどうかを決定するかどうかは、商業的に利用可能な装置と実質的に等価であることを示すことに基づく。新薬のためには、そのセット診断装置は、製品の安全かつ有効な使用に不可欠であり、キット診断装置を開発し、FDAによる薬剤の承認と同時に、PMA承認または510(K)承認を通過すべきである。セット診断装置の使用は薬物のラベルに規定され、その逆も同様である。
処方薬製品の保証·定価·精算に関する規則
FDAと外国の監督管理機関が発売を許可した薬品の販売は、政府医療プロジェクト、商業保険と管理医療組織などの第三者支払者がどの程度このような製品をカバーするかにある程度依存する。アメリカでは、人間の薬品のカバーと精算に統一された政策がない。したがって,我々の将来の任意の薬物のカバー範囲と精算金額に関する決定は支払者ごとに行われるであろう。そのため、保証範囲の確定過程は往々にして時間と高価な過程であり、それぞれの支払人に私たちの薬物を使用した科学的かつ臨床的な支持を提供する必要があり、保証と適切な補償を得ることができない。
アメリカ政府、州立法機関と外国政府はコスト制御計画の実施に大きな興味を示し、政府が支払う医療コストの増加を制限し、価格制御、精算制限とブランド処方薬の代わりに模造薬を要求することを含む。例えば,連邦法に含まれる条項は,医療補助計画の精算薬品のリベートを増やし,医療補助リベートを医療補助管理保健計画に拡大し,ある連邦医療保険Dの一部の受益者を強制的に割引し,製薬会社の連邦医療計画における販売シェアに応じて年会費を徴収することで薬品の収益性を低下させる可能性がある。一般規定を採択する
17
制御と措置に加え、既存の制御と措置の司法管轄区は制限的な政策を引き締め、薬品への支払いを制限する可能性がある。医療補助薬品還付計画は製薬業者に衛生と公衆サービス部部長(HHS)との締結を要求し、実際に全国的な税金還付協定を達成し、各州が医療補助患者に提供する外来薬物の連邦マッチング資金を獲得する条件とした。2010年に公布された“患者保護と平価医療法案”(Patient Protection and Affordable Care Act,略称ACA)は,医療補助薬品リベート計画をいくつか改正し,製薬業者に医療補助管理のための医療使用のリベートを要求することと,医療補助薬品福祉を受ける資格のある潜在人口を拡大することにより,薬品リベート制限を受けた医療補助使用範囲を拡大した。また、2003年の“連邦医療保険処方薬、改善と現代化法案”(MMA)は連邦医療保険D部分計画を創立し、連邦医療保険受益者に自発的な処方薬の福祉を提供した。D部によると、連邦医療保険受益者は、個人実体が提供する処方薬計画に参加することができ、これらの計画は外来処方薬の保険を提供する。連邦医療保険A部やB部と異なり,D部のカバー範囲は標準化されていない。すべての連邦医療保険薬物計画は少なくとも連邦医療保険が設定した標準保険レベルを提供しなければならないが、D部分の処方薬計画発起人はすべての保険を受けたD部分の薬物に費用を支払う必要はなく、各薬物計画は自分の薬物処方を開発し、それがどの薬物および被覆のレベルまたはレベルをカバーするかを決定することができる。しかしながら、D部分処方薬処方は、必ずしも各カテゴリまたはカテゴリのすべての薬剤を含むとは限らないにもかかわらず、各治療カテゴリおよびカバーされたD部分薬剤カテゴリの薬剤を含む必要がある。D部分の処方薬計画に使用されるどの処方も薬局と治療委員会が開発·審査しなければならない。政府が処方薬の費用の一部を支払うことは、将来的に発売許可を得た製品への需要を増加させる可能性がある。しかし、D部分処方薬計画がカバーする将来の製品の任意の交渉価格は、私たちが入手可能な価格よりも低いかもしれない。また,MMAは連邦医療保険受益者の薬品福祉にのみ適用されるが,個人支払者は自分の支払率を設定する際に連邦医療保険カバー政策や支払制限に従うことが多い。MMAによる任意の支払い減少は、非政府支払者支払いの同様の減少をもたらす可能性がある。
MedicaidまたはMedicare Part B計画に従って連邦補償を獲得するか、または米国政府機関に直接販売する薬品の場合、製造業者は割引を340 B薬品定価計画に参加する資格のあるエンティティに拡大しなければならない。製造業者が340 B保証エンティティに受け取ることができる特定の製品の最高金額は、製造業者の平均価格、すなわちAMPから、製造業者がその製品の単位当たりMedicaidに支払う返金金額を減算することである。ACAは2010年から、現在の法律状況に基づいて、児童病院を除いて、これらの新たに資格を獲得したエンティティは、孤児薬品340 B割引定価を取得する資格がないにもかかわらず、340 B割引定価を取得する資格があるエンティティタイプを拡大した。また,340 B薬品定価はAMPと医療補助返却点データに基づいて決定されるため,上記の医療補助返却式やAMP定義の改訂により必要な340 B割引が増加する可能性がある。
また、政府はメーカーがその販売する製品に価格を設定する方式に対してより厳格な審査を行い、国会で数回の調査を行い、連邦と州立法を提出し、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品の精算方法を改革することを提出し、公布した。衛生と公衆サービス部はすでに薬品価格の低下と薬品自己負担コストを下げるための各種措置についてフィードバック意見を求め、そしてその現有の権力に基づいて他の措置を実施した。例えば、2022年8月、総裁·バイデンは“インフレ低減法案”に署名したり、“アイルランド共和軍”と呼ばれたりした。他の点で、アイルランド共和軍には、連邦医療保険計画と米国全体の薬品価格に影響を及ぼす可能性がある複数の条項がある。2023年から、薬品価格の上昇速度がインフレ率より速い場合、連邦医療保険B部分またはD部分でカバーされている薬品メーカーは連邦政府にリベートを支払わなければならない。この計算は薬品製品をもとに行われており、連邦政府に不足している税金還付額は、連邦医療保険B部分またはD部分で支払われている薬物製品の数に直接依存している。また、CMSは2026支払い年度から毎年、選定された数の単一由来D部分薬物について薬品価格交渉を行い、後発薬競争は存在しない。CMSはまた,選定数のB部分薬の薬品価格を2028年から交渉する。CMSが1つの薬物を選択して交渉すれば,このような薬物による収入は減少すると予想される。CMSはこれらの新しい許可の実施を開始し、2023年10月に製薬業者と第1セットの合意を締結し、価格交渉を行った。しかし,アイルランド共和軍の米国製薬業への影響は不明であり,一部の原因は複数の大手製薬会社や他の利害関係者(例えば米国商会)がCMSに対して様々な理由で違憲,その他の苦情を訴えていることである。このような訴訟は現在も進行中だ。
州レベルでは、立法機関は価格或いは患者の精算制限、割引、特定の製品への参入及びマーケティングコスト開示の制限、及び透明性措置を含む薬品の価格を制御するための法規を立法し、実施している。2020年12月、米国最高裁判所は、連邦法律は各州の監督薬局福祉マネージャー(PBM)および医療保健と薬品サプライチェーンの他のメンバーの能力を妨げないと一致して判断し、この重要な決定は各州のこの分野でのさらなるかつ積極的な努力を招くことになりそうだ。2022年中に、連邦貿易委員会はPBM業界のやり方に対して全面的な調査を展開し、これはこのような実体の運営、薬局ネットワーク或いは財務手配に対するより多くの連邦と州立法或いは規制提案を招く可能性がある。現在アメリカに存在するPBM業界を変える重大な努力は薬品サプライチェーンと他の利益関係者の業務に影響を与える可能性があり、著者らのような薬品開発業者を含む。
18
上述したように、政府や第三者支払者が十分な保険や補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の製品の適正性が影響を受ける可能性がある。私たちは、米国のコスト制御措置に対する日々の重視は引き続き薬品価格の圧力を増加させると予想している。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
また、大多数の外国では、医薬製品の提案価格は必ず承認されなければならず、合法的に発売されることができる。各国の薬品定価と精算に対する要求は大きく異なる。一部の国では、補償価格を合意した後にのみ、薬品を販売することができると規定されている。いくつかの国は、精算または定価承認を得るために、新薬候補薬物の費用対効果を既存の治療法(いわゆる衛生技術評価、またはHTA)と比較することを追加的な研究の完了を要求する可能性がある。例えば、欧州連合は、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御するために、その加盟国に様々な選択を提供している。加盟国は医薬製品の具体的な価格を承認することができ、医薬製品を市場に投入する会社の収益力に対して直接或いは間接的に制御制度をとることもできる。薬品に対して価格制御や精算制限を実行する国が、私たちの未来のいかなる商業製品に対しても有利な精算と定価手配を許可することを保証することはできません。歴史的に見ると、EUで発売された製品はアメリカの価格構造に従わず、通常価格ははるかに低くなることが多い。
私たちの業務のプライバシーとセキュリティ法律法規と患者情報アクセス法律法規に適用されます
HIPAAとHITECH
連邦経済と臨床健康情報技術法案(HITECH)によって改正された1996年連邦健康保険携帯性と責任法(HIPAA)の行政簡略化条項によると、アメリカ衛生·公衆サービス部(Department Of HHS)は法規或いはHIPAA法規を発表し、これらの法規は統一的な基準を確立し、ある電子医療取引の行為を管理し、保護された医療情報(PHI)のプライバシーと安全を保護する要求を提出し、これらの情報は医療保健提供者、医療計画と医療情報交換所によって使用または開示され、これらの医療保健提供者、医療計画と医療チケット交換によって電子方式である医療取引が行われ、これらは“カバー実体”と呼ばれる。臨床実験室として、著者らは保証実体として、HIPAAとHITECHの制約を受けている。HIPAAとHITECHによると、私たちは以下の4つの主要な法規の最終バージョンを遵守しなければならない:プライバシー法規、安全法規、違反通知規則と電子取引標準、それらはよく見られる医療取引のための標準を確立した。
HIPAAおよびHITECHのプライバシー規制は、医療記録および他のPHIの使用および配布を制限することによってそれらを保護し、彼らの医療記録にアクセスする権利を含む患者に様々な権利を与え、ほとんどの健康情報の開示を所望の目的を達成するために必要最小限に制限する。HIPAAはまた、PHIの使用または開示に関連する保証エンティティにサービスを提供する個人または組織へのHIPAAコンプライアンスの書面保証を得るために、保証エンティティに商業パートナー契約を締結することを要求し、これらのエンティティは“ビジネスパートナー”とも呼ばれる。一般に、引受エンティティまたは事業パートナーは、HIPAAおよびHITECHのプライバシー規制が許可されない限り、PHIを使用または開示してはならない。
保証実体はまたHIPAAとHITECHの安全規定を守らなければならず、この2つの規定は電子PHIの機密性、完全性と可用性を保護する要求を規定している。“HIPAA安全条例”は行政、物理、技術保障措置を実施し、書面の安全政策と手続きを採用することを要求している。
また,HITECHは他の事項に加えて,カバーエンティティが守らなければならない何らかの違反通知要求を作成している.特に、保証エンティティは、HHS大臣または大臣の指示に従って暗号化されていない、または他の方法で保護されていないPHI違反を報告しなければならない。要求された違約通知は合理的で実行可能な状況下でできるだけ早く出さなければならないが、違約発見後60日より遅れてはならない。影響を受けた個人,大臣,および侵入の規模に応じて地方や国家メディアに報告しなければならない。カバーされているエンティティもHHS HITECHが許可している監査計画の監査を受け、プライバシーやデータセキュリティに関する調査を受けることが可能です。
HIPAA違反は巨額の民事と刑事罰金、その他の処罰に処せられる可能性がある。保険を受けるエンティティまたは業務パートナーは、その任意の代理人(下流業務パートナーを含む)の行為または非作為によって違反する行為は、連邦代理一般法に基づいて決定される民事罰金責任を負わなければならない。HIPAAとHITECH要求を守らない処罰は,例年ごとに同じ要求に違反して最高約190万ドルの民事罰金を含む(2022年3月現在,年度インフレ調整に依存する)ことが大きく異なる。1回の違反は多くの要求に違反する可能性があり、190万ドルを超える罰金を招く可能性がある。さらに、HIPAAに違反し、個人識別可能な健康情報を故意に取得または開示する人は、最高50,000ドルの刑事罰および最高1年の禁固に直面する可能性がある。もし不法行為がこれらの刑事罰を増やしたら
19
商業的利益、個人的利益、または悪意のある傷害を得るために、識別可能な健康情報を使用するために、虚偽の言い訳または意図的な売却、移転、または使用に関する。含まれているエンティティはまた州総検察長によって強制され、HITECHに従ってHIPAAを実行することが許可されている。さらに、私たちが提出した電子医療クレームおよび支払い取引がHIPAAおよびHITECHによって確立された電子データ伝送基準に適合していない場合、私たちへの支払いが遅延または拒否される可能性がある。
著者らの臨床実験室サービス以外に、著者らはある会社、機構と機構に管理と技術サービスを提供し、これらの会社、機構と機構は保証実体に属し、そして業務パートナーとしてこれらの実体と業務パートナー協定を締結した。業務パートナーとして適用されるHITECH法案の要求およびHIPAA法規の遵守に直接責任を負うほか、契約上、HITECHおよびHIPAA法規の遵守に同意し、場合によっては、これらの法律法規に関連する義務および/または報告可能なPHI違反が発生した場合には、カバーする実体顧客を賠償することに同意します。
CMIA
HIPAAプライバシー、セキュリティ、違反通知条例は統一された連邦“下限”を確立したが、より厳しい州法に代わることはできず、個人により大きなプライバシー、安全、PHIを含む記録にアクセスする権利を提供する州法に代わることもできないし、このような州法がHIPAAで定義されているPHIよりも範囲の広い個人情報に適用される限りである。これらの法律のコンプライアンス要件は、追加的な違反報告要件や、違反行為に対する処罰の違いが大きく、この分野の新しいプライバシーとセキュリティ法律が進化している。例えば、カリフォルニア州などいくつかの州では全面的なプライバシー法律と法規が施行されている。カリフォルニア医療情報秘密法(CMIA)は健康情報とその他の個人身分情報の使用と開示に対して制限的な要求を提出した。違反者に罰金と罰を加えるほか、いくつかの州法は、自分の個人情報が乱用されたと思う個人に個人訴訟権利を提供している。例えば、カリフォルニアの患者プライバシー法では、罰金は最大25万ドルに達し、被害者側が損害賠償を要求することを許可すると規定されている。
CCPA/CPRA
CMIAを除いて、2020年1月1日に施行される2018年カリフォルニア消費者プライバシー法、またはCCPA。CCPAは個人情報の定義を拡大することによって、カリフォルニアの消費者のために新しいデータプライバシー権を構築し、未成年者から消費者データを収集するための特殊な規則を実施し、CCPAに違反し、及び/又は合理的なセキュリティプログラムとやり方を実施できなかった企業のためにデータ漏洩を防止するための新しい、深刻な法定損害賠償フレームワークを作成し、それによってカバーする企業のために新しいプライバシーフレームワークを構築した。CCPAはHIPAAやCMIAがカバーする医療情報に直接適用されないが,我々の業務は我々が直接消費者に向けたPicture Geneticsプラットフォームを含むいくつかの他の個人情報を収集·使用することが可能であり,CCPAの範囲に属し,CCPAの例外ではない。また、CCPAを拡大したカリフォルニアプライバシー権法案(CPRA)が2023年1月1日に施行され、カリフォルニア州のCRPAとプライバシー権の管理と実行を担当する新しい規制機関であるカリフォルニアプライバシー保護局(CPPA)が設立された。CPPAは罰金の徴収と他の法執行行動を取る権利があり、業務に影響を与える可能性のあるさらなる規定を実施している。カリフォルニア州のほか、他の州にも似たようなプライバシー法があり、2023年に発効し、バージニア州、コロラド州、コネチカット州、ユタ州を含む。国会もいくつかの連邦プライバシー提案を考慮しており,他州では2024年にプライバシー立法を導入して審議する可能性がある.CPRAや他の州プライバシー法は、私たちまたは私たちの協力者やビジネスパートナーの運営に影響を与え、新しい規制要件を適用し、コンプライアンスコストを増加させる可能性があります。
情報阻止規則
国家衛生情報技術コーディネーター(略称ONC)は全国の衛生保健部門で相互操作可能な衛生情報技術インフラを実現するために、現在行われている標準開発を協調している。2020年5月,ONCは2021年に施行された21世紀治療法案における相互操作性と患者訪問条項を実施するための最終的な情報阻止ルールを発表した。情報阻止ルールに要約された例外が適用されない限り、情報阻止ルールが禁止されているので、電子健康情報の取得、交換、または使用を妨害する可能性があるすべての潜在的なやり方を継続的に継続的に検討する必要がある。 他の事項に加えて,情報阻止ルールは,患者に必要に応じて実験室検査結果にアクセスする権限を提供することが求められている。このような要求は州の法律および/または医療または道徳基準の下での私たちの義務と一致しないかもしれない。これらの場合,ONCが患者面会を遅延させる問題にどのように対処するかは不明である。 医療提供者は実験室を含めて みな受ける情報遮断規則違反に対する民事罰金は、1回の罰金は最高100万ドルに達する。
20
外国の法律やその他の法律
私たちの販売テストの司法管轄区域で、私たちはまた外国プライバシー法の制約を受けている。米国、ヨーロッパ、その他の地域では、消費者と健康関連データ保護法の解釈、応用、相互作用はしばしば不確定で、互いに矛盾し、絶えず変化している。例えば、一般的なデータ保護条例またはGDPRおよびネットワークセキュリティ命令は、EUの個人データに適用される。これらの条例は、一般的な衛生部門と遺伝子データに特化した規則を含む、EUのプライバシーと安全面で多くの変化を導入している。いくつかの規則の解釈は主要な規制機関である欧州データ保護委員会の指導の下で変化し続け、いくつかの要求は国家立法によって達成される可能性がある。これは現在、このような外国データ保護法が私たちの業務に及ぼす影響を評価することを困難にする。
より広く言えば、データのプライバシーや安全を管理する外国の法律や解釈は進化しており、法律の解釈や応用は私たちの現在のやり方と一致しない可能性があり、この場合、私たちは政府から罰金や命令を受け、やり方の変更を要求する可能性がある。これらの罰金は非常に高いかもしれません。例えば、GDPRは、ある侵害行為に対して、集団の世界年商の4%に相当する最高約2200万ドルの罰金を科すことができると規定している。また,各国のプライバシー法規は大きく異なり,各国のデータ保護機関が実行し,これらの機関はプライバシー法規を実行する権利がある.複数のデータ保護機関はプライバシー法違反に数百万ユーロの罰金を科した。
多くの州では遺伝子テストとプライバシー法も実施され、具体的な患者の同意要求とテスト結果の保護要求が規定されている。連邦と州法律の相互作用は、裁判所と政府機関の異なる解釈を受ける可能性があり、私たちと私たちの顧客に複雑なコンプライアンス問題をもたらし、追加の費用、不利な宣伝、および法律と規制責任に直面させる可能性がある。また,規制機関のプライバシー問題への関心が高まっていることや,個人情報保護に関する法律法規が拡大し複雑になっていることにより,我々の業務に対する潜在的なリスクが悪化する可能性がある.また、消費者、健康関連とデータ保護法律の解釈と応用は往々にして不確定で、互いに矛盾し、絶えず変化している。例えば,健康情報プライバシーへの懸念は最近連邦政府に指導意見の発表を促し,彼らが実行する法律や法規の範囲に新たな拡張的な観点をとっている。このような法律の適用性と要求と違反に対する処罰の差は大きい。コンプライアンスを維持できなかった、または州または連邦のプライバシーまたはセキュリティに関する法律が変化し、民事および/または刑事罰および損害をもたらす可能性があり、私たちの業務に実質的な悪影響を及ぼす可能性がある。
多くの活動では,人工知能(AI)ツールの操作利用を含めて,新たに出現した法規やガイドラインに制約されている.2023年12月、欧州委員会、理事会、議会はEU人工知能法案である人工知能法案を構成する暫定ルールで合意した。この全面的なEU人工知能法規の範囲は広く、高リスクな人工知能活動を定義し、ある人工知能の使用禁止を求めている。人工知能法案はEUで人工知能を応用しようとする実体を規制する可能性がある。人工知能法案違反が発見された実体に対する予想罰金範囲は3500万ユーロや会社の前財政年度の世界総売上高の7%に達する可能性があり、高い者を基準としている。アメリカでは、現在少なくとも12州が人工知能を監督しています。カリフォルニア州、テキサス州、ニューヨーク州を含めて、私たちはこれらの州で業務を展開しています。一般に、このような法規は、偏見、差別、プライバシー侵害から消費者、従業員、および/または求職者などの個人を保護し、会社の人工知能の使用の透明性を促進することを目的としている。
また、連邦貿易委員会は最近、遺伝子検査製品を販売する会社に対するDNAデータ保護の指導意見を発表し、遺伝子検査会社が人工知能(DNAアルゴリズムを含む)を使用していることを密接に監視する予定であることを概説した。連邦貿易委員会の指導意見は会社が偏見、プライバシーと正確性の侵害などの人工知能使用の潜在的有害影響から消費者を保護することを指示した;遺伝子データの保護は連邦貿易委員会の最も重要な任務であることを指摘した;そして会社にその収集、使用と遺伝子情報の開示に関する通知を準備するように注意し、そして肯定的な明示的同意要求を考慮した。
多くの他の連邦、州と外国の法律は、消費者保護法律と法規を含み、患者の健康情報の収集、伝播、使用、アクセス、秘密と安全を管理する。また、国会や一部の州では、医療記録や健康情報のプライバシーや安全をより広く保護するための新たな法律法規の制定が検討されている。最近の消費者情報の不適切な伝播を招くデータ漏洩の宣伝の増加に伴い、50州すべてが法律を通過し、州法で定義されているように、企業がデータ漏洩に遭遇したときに取らなければならない行動を規範化し、場合によっては、指定された時間内に影響を受けた個人への情報開示を含む場合がある。国会もデータプライバシーやデータ保護に関する類似連邦立法を考慮してきた。連邦貿易委員会と各州の総検察長はまた、連邦貿易委員会法案と類似の州法律に基づいて、不公平および/または詐欺的な行為ややり方を理由に、法執行行動を提起し、いくつかのデータ漏洩事件を起訴した。データ漏洩通知法以外に、いくつかの州は法規と規則を公布し、企業がそれが持っているあるタイプの個人情報を合理的に保護すること、あるいは他の方法である特定の個人情報データの安全要求を遵守することを要求した。私たちはすべての個人情報を全面的に保護し続け、このような情報の保護に関する適用法律を遵守していくつもりです。
21
多くの活動では,臨床試験を含め,データのプライバシーや健康に関する情報や他の個人情報の保護に関する法律や法規を遵守している。これらの法律および法規は、個人データの収集、アクセス、使用、分析、修正、保存、送信、セキュリティホール通知、廃棄、処置を含む個人データの処理を規範化しています。個人データ源や処理場所に基づく個人データの国際移転に関する法律や法規を遵守しなければならない。
私たちまたは私たちのサプライヤーが適用されるデータプライバシーや人工知能の法律や指示に従わなかった場合、または私たちまたは私たちのサプライヤーが依存している場合、個人データをEUからアメリカ(または欧州委員会が十分なレベルのデータ保護を提供していないと考えている他の国)に移すことを可能にする法律メカニズムが不十分であると考えられる場合、私たちは政府の法執行行動と私たちに対する厳しい処罰を受ける可能性があり、もし私たちが個人データをEU以外に移す能力が制限されれば、私たちの業務は悪影響を受ける可能性があり、これは私たちの経営業績に悪影響を及ぼす可能性がある。GDPRはEU個人データの処理における私たちの責任と潜在的な責任を増加させ、GDPRの遵守を確保するために追加的なメカニズムを構築する必要があるかもしれません。しかし,我々が行っているGDPRコンプライアンスに関する努力は成功しない可能性があり,我々の業務コストが増加する可能性がある.さらに、異なるEU加盟国のデータ保護当局はGDPRに対して異なる解釈を有する可能性があり、実施およびコンプライアンスに関する指導意見はしばしば更新または他の方法で修正され、これはEUが個人データを処理する複雑さを増加させる。GDPR以外にも、他の国でもデータ保護立法が公布されており、国際業務の展開や敏感な個人情報をこれらの国から米国に移す複雑さを増している。
PHIのプライバシーおよびセキュリティ、ならびに保存、保守、受信または送信の個人識別情報は、遺伝子データを含む電子的に格納、維持、受信または送信される情報を含み、米国および海外では厳格に規制されている。我々が適用されるすべてのプライバシーおよびセキュリティ法律および法規を遵守しようと努力すると同時に、プライバシーの法律基準も発展しており、遵守されていない、または守られていないと思われるいかなる行為も、政府実体または他の人が私たちに訴訟を提起したり、行動したり、あるいは名声の損害を招く可能性があり、これは私たちの財務状況、将来性、名声、運営に実質的な悪影響を及ぼす可能性がある。
私たちの業務に適用される医療詐欺と法律の乱用
アメリカでは、様々な詐欺と乱用の法律を守らなければなりません。私たちは様々な連邦、州の規制を受けています,CMS、HHSの他の部門(例えば、衛生·公衆サービス部監察長事務室またはOIG)、米国司法省、司法省内の個別の米国検事室、および州および地方政府を含む地方当局と。私たちはまた外国の詐欺と法の乱用によって拘束されるかもしれない。
反リベートと詐欺法規
米国では、他の事項に加えて、連邦反バックル法規は、個人の推薦提供、購入、レンタル、注文または推薦購入、レンタルまたは任意の商品、施設、サービスまたは物品の注文を誘導またはリターンするために、故意に直接または間接的に、公開的または隠蔽的に現金または実物の形態で提供、支払い、請求または報酬を受けることを禁止し、連邦医療計画は、それを全部または部分的に支払うことができる。裁判所は、金融手配のいずれかの目的が患者の回診または他の連邦医療計画業務を奨励することであれば、その手配に他の合法的な目的があるかどうかにかかわらず、その手配は“反リベート法令”に違反する可能性があると表明した。報酬の定義は、プレゼント、割引、クレジット手配、現金支払い、相談料、共同支払いの免除、所有権の権益、およびその公平な市場価値よりも低い価格で何でも提供することを含む任意の価値のあるものを含むと広く解釈されている。“反リベート条例”は広範囲に関連しており、それには確かにいくつかの例外が含まれているにもかかわらず、医療業界内の多くの無害または有益な手配が技術的に禁止されている可能性がある。衛生と公衆サービス部は一連の監督管理の“安全港”を発表し、ある条項をリストし、もし満たされれば、この手配の各方面に“反リベート法規”による起訴を免れさせる。法定例外または規制安全港が連邦反リベート法規によって起訴されないことを完全に遵守しているにもかかわらず、1つの取引または手配が特定の法定例外または規制安全港に適合できなかったことは、必ずしも取引または手配が不法であることを意味するわけではなく、または反リベート法規に従って訴訟を提起するとは限らない。また,個人や実体は,法規や法規違反の具体的な意図を実際に知る必要がなく,違反行為を実施することができる.反リベート法違反の処罰は厳しく、監禁、刑事罰金、民事罰金、連邦医療計画から除外される。また、連邦“反リベート法令”違反は連邦“虚偽申告法”(以下に述べる)に規定された責任基盤とすることができる。多くの州にも反リベート規制があり、その中のいくつかは支払者タイプにかかわらず適用される可能性がある。
また,2018年10月には,オピオイド回復と患者とコミュニティ治療を促進する物質使用−障害予防法案の一部として,2018年の“回復中リベート法”が公布された。EKRAは,患者をリハビリテーションの家に転任させ,臨床治療機関や実験室のサービスを使用するように誘導するために,任意の報酬を支払うことを規定している全額支払いの逆控除法であり,あるいはこれを交換として刑事犯罪である。しかし連邦政府とは違って
22
反リベート法案は,EKRAは連邦や州医療計画でカバーされているサービスに限らず,商業保険会社を含む“医療福祉計画”がカバーするサービスにより広く適用されている。EKRAの目的は,患者との連携や類似した手配のために,物質使用回復や治療の賛助を吸引することであるようであるが,EKRAの言葉は広く書かれている。しかも、EKRAのいくつかの例外は連邦反リベート規制と規定と一致しない。EKRAは、EKRAの例外状況を明らかにしたり、追加の例外を増加させたりする規制を米司法省に発行することを許可しているが、このような法規は発表されていないことに留意されたい。
医療詐欺や医療事務に関する虚偽陳述に関する米国連邦法もある。医療詐欺法規は、他にも、個人支払者を含む任意の医療福祉計画を故意かつ故意に詐欺計画を実行することを禁止している。この法規違反は重罪であり、罰金、監禁、あるいは連邦医療保険や医療補助計画などの政府支払者計画から除外される可能性がある。虚偽陳述法令は、医療福祉、プロジェクトまたはサービスの提供または支払いに関連する重大な事実を知りながら、故意に偽造、隠蔽、または隠蔽することを禁止し、または任意の重大な虚偽、架空または詐欺的陳述を行うことを禁止する。連邦反リベート法規と同様に、個人または実体は、この法規やこの法規に違反する具体的な意図を実際に知る必要がなく、違反を実施することができる。この法規に違反することも重罪であり、罰金、監禁、または政府支払者計画から除外される可能性がある。
“虚偽申告法”
医療業界に影響を与えるもう1つの発展は,連邦虚偽申告法の施行を強化し,特に虚偽申告法の“密告者”や“虚偽申告者”条項による訴訟である。虚偽請求法は、他の事項を除いて、いかなる人または実体が故意に連邦政府に虚偽または詐欺的な支払い請求を提出することを招くかは、責任を負うと規定されている。虚偽申告法のQui-tam条項は、個人が連邦政府を代表して“虚偽申告法”に基づいて訴訟を提起することを許可し、このような個人共有エンティティが政府に支払う任意の罰金または和解金額を許可する。さらに、プロバイダおよびプロバイダは、確認後60日以内にMedicareおよびMedicaid計画から受信した任意の追加料金を報告し、返却しなければならない。このような多額の支払いを識別および払い戻しできなかったことは、プロバイダまたはサプライヤーに“虚偽請求法”の責任を負わせるであろう。1つのエンティティが虚偽請求法案に違反していると判定された場合、それは、各クレームに対する巨額の民事罰金を加えて、政府の実際の損失の3倍までの支払いを要求される可能性がある。
また、各州では連邦虚偽請求法案のような虚偽請求法が公布されているが、多くの州法は政府支払人計画だけではなく、第三者支払者に請求を提出する場合に適用されている。
“民事罰金刑”
連邦民事通貨罰法または連邦医療補助法は、(1)連邦医療保険または医療補助受益者への報酬の提供または移転を禁止し、当該人が知っているか、または知っている場合、受益者が連邦医療保険または医療補助によって精算可能なサービスの特定の提供者、従事者またはサプライヤーを選択し、例外がない限り、(2)雇用または提供者が連邦医療保健計画から除外された個人または実体と契約を締結したことを知っているか、または知るべきであることを知っている場合、(3)無証医師または除外された提供者に要求されるサービス課金、および(4)医療上不要なサービス課金を禁止する。“あらゆる形の人種差別撤廃国際条約”に違反した処罰には、排除、巨額の罰金、最高3倍の罰金が含まれており、具体的には犯罪の性質に依存する。
医師の回診を禁止する法律法規
私たちはまた、医師が例外がない限り、連邦医療保険計画がカバーする実験室サービスを含む、それと直接または間接的な経済関係にある実体に特定の医療サービスを推薦することを禁止する米国連邦法律における“自己推薦”に対する法律、すなわち一般的に言われている“スターク法”からも制限されている。スタック法違反は、転転禁止に応じて提供されるいかなるサービス支払いも拒否することになるだろう。スタック法の移転禁止を回避する計画に参加した医師や実体は、そのような手配や計画のたびに巨額の罰金を科される可能性がある。また、スタック法に違反して連邦医療保険計画に提出したり、それにクレームをつけたりした人は、最大3倍の巨額の民事罰金に直面し、連邦医療保険計画から除外される可能性がある。スタッカー法は厳格な責任法規であり、医師と実験室の財務関係がスタック法の規定する例外的な状況に適合しなければならないことを意味し、そうでなければ回診が禁止される。したがって,逆リベート法規の安全港とは異なり,実験室と紹介医の財務関係がStark法律の例外的な要求に適合していなければ,医師は実験室へのMedicareとMedicaidへの移行が禁止され,いずれのような転換も実験室への費用の多くを招き,実験室にスターク法の懲罰を受けることになる。Stark法違反は連邦虚偽申告法の規定の責任基盤とすることができる。カリフォルニア州を含む多くの州には似たような法律があり、これらの法律は医療保険転転に限定されていない。スタック法はまた、禁止された転属に応じて提供されるサービスのための連邦医療補助マッチング資金の州政府の受け入れを禁止しているが、スタック法のこの条項は法規によって施行されていない。
23
私たちの業務に適用される陽光医師法
“医師支払い陽光法案”は、医師、教育病院、およびいくつかの高度な非医師保健従事者に価値を支払いおよび移転すること、ならびに医師およびその直系親族が所有する所有権および投資権益を要求するために、いくつかのデバイス、薬物、および生物製品の製造業者に報告要件を提出する。報告計画、すなわち開放支払い計画は、CMSによって管理される。私たちが自分で生産したLDTは私たち自身の実験室でしか使用できないので、私たちはこれらの報告の要求に制限されないと信じています。現在のCMS法規の条項によれば、私たちはこのような報告要件の制約を受ける可能性がありますが、公布された連邦立法が私たちのテストをFDAによって規制されている場合、またはFDAが医療機器としてのLDTの権限を行使するために最近開始された通知およびコメント規則の制定を完了した場合、または私たちの1つ以上のテストが発売前の承認または承認を得ることを要求する場合、私たちはこのような要求の制約を受ける可能性があります。現在開発中の治療製品がFDAの承認を得ることに成功し,米国で商業化され,連邦医療保険や医療補助などの連邦医療計画によって精算される資格があれば,これらの要求や適用される州陽光法案の制約を受ける可能性もある。
わが社に適用される反賄賂法
“反海外腐敗法”
私たちは米国の“反海外腐敗法”(Foreign Corrupt Practices Act、略称FCPA)の制約を受けており、会社とその中間者が業務を取得または保留したり、任意の他の不正な利益を得るために法律に違反して非米国政府関係者にお金を支払うことを禁止している。私たちのテストの国際的な販売は腐敗活動への参加に反対する政策を維持、実行し、実行するために高度な警戒を必要とする。医療機器や製薬分野の他の米国会社も“反海外腐敗法”による巨額の罰金や刑事罰に直面しており,その代理人が非米国政府関係者と商売をする際に適切なやり方から外れることを許しているためである。
外国法
私たちが業務を展開している外国司法管轄区域では、私たちはまた似たような反賄賂法の制約を受けている。欧州では,収賄罪を犯した個人および/または会社に対して刑事罰および/または巨額の罰金を科す深刻な結果が規定されている反収賄法が採択された。例えば、連合王国では、2011年7月に施行された2010年の“収賄法”によれば、誰かが経済的または他の利益を与えることを提供、与え、または承諾して、他の人が任意の公共的または個人的な機能または活動を含む特定の機能または活動を不当に履行することを誘導または奨励する場合、賄賂が発生する。外国公職者への賄賂も2010年の反収賄法の範囲に属している。2010年の“反収賄法”に違反した個人は最高10年の禁錮刑に直面し、無制限の罰金が科される可能性があり、商業組織も賄賂を防ぐことができずに罰金を科される可能性がある。
私たちの業務に適用される医療政策法
2010年3月、アメリカは“平価医療法案”(Affordable Care Act、略称ACA)を公布し、政府と個人支払者が医療保健に資金を提供する方式に対していくつかの実質的な変化を行った。ACAには医療機器税が含まれているにもかかわらず、この税は発効しておらず、2019年12月20日にトランプ総裁が法律となった2019年の連邦支出案の公布に伴い国会で全廃された。
ACAのいくつかの態様は、ACAの発布以来、司法および国会の挑戦を受けてきたので、ACAのいくつかの条項は十分に実施されていないか、または効果的に廃止されている。しかし,連邦裁判所が数年間訴訟を行った後,2021年6月,米国最高裁はこの法案の合憲性に対する法的挑戦を却下し,ACAを維持した。ACAの下では、民主党率いる大統領政府がACAを強化するための措置を講じてきたにもかかわらず、さらなる立法と規制改革が可能である。ACA、Medicare、Medicaid計画の将来の変化や増加、および他の医療改革措置による変化、特に医療参入、融資または個別州の他の立法面では、米国の医療業界に実質的な悪影響を及ぼす可能性がある。ACAの将来をめぐる不確実性、特に精算レベルや保険加入個人数への影響は、私たちの顧客の購入決定を遅延させる可能性がある。
ACAに加えて,連邦と州の2級立法者,規制機関,個人第三者支払者が個人医療福祉を拡大しながらコストを低減するために提案を継続する可能性がある。
企業勤務禁止に関する規定
24
多くの州で法律が公布されており,我々のような商業会社の医師の行医を禁止し,医師を雇ったり雇ったりすることが禁止されており,一般に企業の医師行禁止と呼ばれている。これらの法律は任意の非勤務医が医療決定過程に介入することを防ぐことを目的としている。例えば、カリフォルニア医学委員会は、特定の状況のために適切な診断テストを決定し、患者に利用可能な治療案を提供することを含む患者の最終的な看護に責任を負い、無人によって行われれば、無免許医を構成すると述べている。私たちの付属専門会社とは、適用される国家企業医薬法の実践を遵守するための管理サービス手配を策定しているにもかかわらず、これらの企業医薬法の実践に違反することは、民事または刑事罰金を招き、許可手続きによって商業会社および/または専門家に制裁を科す可能性がある。
環境とその他の規制要件
私たちの施設は連邦、州、地方の法律法規の制約を受け続けており、これらの法規は規制された医療廃棄物、危険廃棄物および生物危険廃棄物(化学品、生物製剤と化合物、ならびに血液および他の組織標本を含む)の使用、貯蔵、処理、および処分を管理している。一般的に、私たちはこのような廃棄物を処理するために許可された他の合格した外部供給者たちを使用する。しかし、これらの法律や条例には、過ちや不注意を考慮することなく、当事者に潜在的な責任を負うことが求められている厳しい責任が多く規定されている。したがって,我々や他者の業務運営や他の行為が危険材料に接触することにより環境汚染や人身被害が生じた場合,損害賠償や罰金の責任を負う必要がある可能性がある。私たちがこれらの法律と法規を遵守するコストは、私たちが発生した廃棄物の数量と性質を含む多くの要素に依存し、これは私たちが行ったテスト数と、廃棄物処理サプライヤーと交渉した条項にある程度依存する。
我々の業務はまた、針刺または同様の貫通傷の任意の曝露を防止または最大限に減少させるために、労働者を血液伝播病原体曝露から保護する計画の策定および実施を含む、米国の職業安全および健康管理局から医療従業員の職場安全に対する広範な要求を受けている。
持続可能性
私たちは持続可能な運営に力を入れ、過去数年間、私たちの環境、社会、およびガバナンス戦略、またはESG戦略を監視し、発展させることができるように、適切な基礎と内部機能を構築することに取り組んでいる。私たちは私たちのESG努力と計画を指名と統治委員会の権限と監督の下に置く。また,様々な政策を実施し,各コミットメントを概説し,我々のESG努力に関する内部プログラムを構築した.また、私たちの実行チームメンバーと上級管理職からなるESGワーキンググループを設立しました。私たちは、四半期会議で取締役会にすべての持続的な努力、成果、挑戦を示すことで、当社のESG戦略が会社全体の業務戦略に効果的に統合されることを保証しようとしています。このような会議は私たちの取締役会がESGに関連した計画を評価してトレードオフすることを可能にする。
環境影響
富金特では、私たちの気候政策が概説したように、私たちの貴重な自然資源の保護と保存の全体的な観点を優先している。私たちは気候に関連したリスク評価を私たちの指導グループの一般的な議題に含めるために努力している。私たちの取締役会はエネルギー管理、気候リスクとチャンス、戦略と業績を全面的に監督している。委員会は、私たちのESGワーキンググループを通じて、気候に関連するプロジェクト、目標、および関連する機会に対して追加的な監視を提供する。
従業員と人的資本
私たちは強力なグループを開発して維持することが私たちの成功の鍵だと信じている。2024年2月15日まで、私たちの実験室サービス業務は1184人の常勤従業員がいて、精密診断と解剖病理テスト、生物製薬サービス、ソフトウェア工学、実験室管理、販売とマーケティング、そして会社と行政活動に従事しており、私たちは21人の常勤従業員が私たちの治療開発業務の研究と開発に従事している。私たちの業務目標を支援し、私たちの戦略目標の実現を支援し、株主の長期的な価値を創出するために必要なスキルを持つ才能のある人を誘致し、奨励するための包括的な報酬計画を提供します。私たちは競争力のある賃金、株式ベースの給与、そしてボーナス計画を提供する。私たちはまた広範な福祉サービスを提供します。医療、歯科と視力健康保険、生命保険と意外死亡と肢解離保険、オプションの法律、ペット保険、入院、重篤な疾病と意外保険、保険と障害保険、401(K)投資計画は会社と一致し、税金優遇貯蓄口座、有給休暇と休暇、そして健康計画。私たちは混合作業を通じて従業員たちに追加的な労働生活バランスを提供する。私たちの従業員は労働組合代表もなく、集団交渉合意のカバー範囲もなく、私たちは従業員との関係が良いと信じている。
25
以下の人は現在、フルギンテ社の役員と役員を務めている
役員および行政員 |
ポスト |
謝明祥 |
取締役会長兼最高経営責任者 |
ポール·キム |
首席財務官 |
高ハンリン(Harry)、M.D.,Ph.D.,D.A.B.M.G.,F.A.C.M.G. |
首席科学官 |
ありがとうケン(ジェームズ) |
社長と首席運営官 |
レギナ·グローブス |
非従業員取締役 |
リンダ·マーシュ |
非従業員取締役 |
マイケル·ノーハイアー博士です |
非従業員取締役 |
従業員研修と敬業度
私たちの1,000人以上の従業員の尊敬と成長していくチームは私たちの誇りの源だ。彼らは絶えず私たちのテスト解決策を拡張し、一貫して最高品質の看護と正確性を提供するように努力している。最高の人材バンクを募集し、各従業員の専門と個人の発展を奨励するために、著者らは合格した教育費用と認可された学院、大学と専門組織の学部生、大学院生、大学院生、専門訓練と免許課程を成功に完成させるために精算を提供する。過去数年間、従業員はスタンフォード専門発展センター、Googleプロジェクト管理課程、臨床遺伝分子生物学者科学者(CGMBS)訓練計画と学士号を含む各種課程を申請した。私たちはまた、私たちの文化、会社の目標、私たちの業務、従業員の持続的な発展に非常に重要であり、内部および/または第三者プロバイダによる差別、嫌がらせ、HIPAA、インサイダー取引、プライバシー、反腐敗、反賄賂を含む様々なテーマに関連する強制トレーニングコースを提供します。従業員の尊敬度を促進するために,2023年にTinyPulseによる恒常的な従業員フィードバック調査を行い,調査結果を用いて様々な改善を行った。
多様性と包括性
私たちの多様な職員チームは私たちの最大の資産だ。私たちは私たちの労働力の多様性が健康で尊重され、繁栄する労働環境を作るのに役立つと信じている。機会均等な雇用主として、私たちはすべての従業員と潜在的な従業員を公平で無差別に扱うことに努力している。私たちは様々な背景や考えを重視することで、すべての従業員ができる限り働くことができるようにし、差別、嫌がらせ、報復を禁止します。
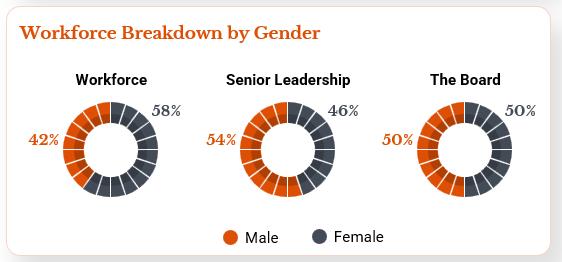
多様性と包括的価値観に対する私たちの核心的な信念と一致しており、2023年12月31日現在、代表的に不足している少数派(女性、アジア人、スペイン系人を含む)は、私たちの取締役会、上級管理職、一般従業員を含む、私たちの組織の各主要レベルの50%以上を占めている(以下図参照)。
26
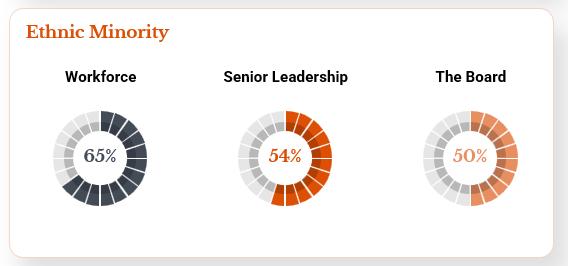
私たちの包括的な文化は、幅広い背景からの合格者を募集し、維持し、行動やコミュニケーションにおいて透明性を保ち、異なる観点を奨励し、尊重と尊厳をもって一人一人を扱うことで促進されるように努力している。しかも、私たちは職員たちが参加して管理する機会を提供する。生命科学業界の多様性と包括性基準の向上に取り組むとともに,イニシアティブの策定を求め,本組織内外の文化受容を促進している。
職場の安全と健康
我々は,安全で健康な労働環境を促進し,安全計画を支援する政策や手順を構築し,危険,薬物乱用,暴力のない職場を促進することに取り組んでいる。我々は現在全米で7つのCLIA認証とCAP認証の実験室を運営している。私たちは診断テストの最高基準を超えて、適用される安全な法律と法規を遵守するように努力している。私たちは私たちのすべての実際的な位置の懸念を報告することを奨励する。従業員の健康と安全が最優先課題であるため,職場の受傷リスクを低減するための政策や手順を策定し,全員に職場安全訓練を定期的に提供している。2023年と2022年には、私たちはそれぞれ15件と19件の記録可能なダメージしかない。
可及性と負担可能性
私たちの最優先順位は患者の健康だ。私たちは誰も経済や他の理由で自分の健康を犠牲にしてはいけないと思う。私たちは彼らの経済状況にかかわらず、質の高い診断テストを得る機会を患者に提供するために努力している。私たちは、商業保険計画を受け入れること、割引率で現金価格を提供して、私たちのテストを容易にすること、商業保険を持っているが追加の財務支援を必要とする患者に様々な基準に基づく財務援助資源を提供すること、試験保険カバー範囲政策に適合しない患者、高い賠償額計画を持っているか、または保険カバーを持っていない患者に自己負担オプションを提供すること、医療保険および限られた財務資源を持たないアメリカ患者に財務援助および非利息支払い計画を提供することを含む、柔軟で負担可能な様々な支払い選択を提供する。
企業情報
私たちは2016年5月13日にデラウェア州で登録設立された。私たちは2011年6月に設立されたフルキンソン治療有限責任会社を主に含む私たちの子会社の持株会社です。2016年9月30日、フルギンテ治療有限責任会社は、私たちが再編と呼ばれる取引で当社の完全子会社となり、再編前にフルキンソン治療有限責任会社のすべての持分所有者が再編後すぐに私たちの全株主となりました。
27
私たちの本社はカリフォルニア州エルモント聖アニタ通り4399号、郵便番号:九一七三一、電話番号は(626)350-0537です。私たちのサイトの住所はWww.fulgentgentics.comそれは.我々のサイトに含まれている,あるいは我々のサイトを介してアクセス可能な情報は,本報告の一部ではなく,本参考を介して本報告に組み込むこともない.
利用可能な情報
我々は、米国証券取引委員会または米国証券取引委員会に報告書を提出し、我々が米国証券取引委員会または米国証券取引委員会に材料を電子的に提出した後、合理的で実行可能な範囲内でできるだけ早く私たちのウェブサイト上で、または私たちのウェブサイトを介して私たちの10-K年次報告、10-Q表四半期報告、現在の8-K表報告、委託書および情報声明、および取引法第13(A)または15(D)条に基づいて提出または提供された報告の修正案を無料で提供する。米国証券取引委員会は、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の発行者に関する情報を含むインターネットサイトを維持しているWwwv.sec.gov.
28
第1 A項。RISK因子です。
リスク要因の概要
私たちの普通株に投資することは高い危険と関連がある。私たちの普通株に任意の投資決定を下す前に、以下に説明するリスクと、本報告に含まれる他のリスク要素、本報告書に含まれるすべての他の情報、および私たちがアメリカ証券取引委員会に提出した他の報告書と文書を慎重に考慮しなければなりません。以下に述べるリスク要因は,米国への投資に関連する主要なリスク要因の概要である。
ネットワークセキュリティリスク
業務と戦略リスク
精算リスク
リスクを規制する
候補薬物開発に関するリスク
29
知的財産権リスク
普通株リスク
ネットワークセキュリティリスク
実際にまたは発生しようとしているセキュリティイベントまたは脆弱性、データ損失、または他の中断は、私たちに重大な責任を負わせ、私たちの業務、財務状況、および名声に実質的な悪影響を及ぼす可能性がある。
私たちの通常の業務プロセスでは、私たちは、個人健康情報またはPHI、個人識別情報、知的財産権、および研究開発データ、商業データおよび他の商業および財務情報などの独自および他の業務キー情報を含む敏感なデータを生成し、収集し、格納する。我々は,現場システムとホスト·データセンターシステムの組合せを用いて生成したデータを管理·維持し,データを収集して蓄積する.テスト結果をまとめたレポートをお客様に提出する際には、私たちのオンライン暗号化ポータルサイト、暗号化電子メール、ファックス、または隔夜宅配便で提供される敏感な患者データも伝達します。これらの情報のセキュリティ処理、保存、維持、転送は、当社の運営および業務戦略に重要であり、これらの情報の機密性および完全性を保護するために大量のリソースを投入しています。我々は、不正アクセス、使用、または開示から敏感な情報を保護するためのセキュリティ対策および他の制御措置を2022年に実施したが、我々の子会社は、2022年にその情報システムのセキュリティイベントを経験し、PHIおよび他の機密情報の不正アクセス、使用、および開示をもたらした。このような事件は私たちの業務に実質的な影響を与えなかった。違反または中断は、重大な法的クレームまたは訴訟を引き起こす可能性があり、個人情報のプライバシーを保護する連邦、州または外国の法律に基づいて重大な責任を負うか、または罰を受ける可能性があり、以下に述べるように、私たちがテストおよび分析した情報について、私たちは広範な法的要求を受け、これらの要求を守らない行為は重大な処罰を招き、私たちの名声を深刻に損害し、私たちの業務を深刻に損なう可能性がある。さらに、許可されていないアクセス、操作、紛失、または伝播は、私たちの名声を深刻に損なう可能性があり、テストを実行し、テスト結果を分析し、提供すること、顧客または他の支払者に請求書を発行すること、精算申請を処理すること、顧客サービスを提供すること、研究および開発活動を行うこと、会社の財務情報を収集、処理、準備すること、教育および外展活動を展開すること、および私たちが運営する行政を管理する能力を含む、以下の“私たちの情報技術システムおよび任意の重大な故障に依存する”節でさらに説明するように
30
これらのシステムは、ハードウェアまたはソフトウェアの障害、実行遅延、および/または新しいまたは強化されたシステムまたはネットワークセキュリティホールの重大な障害を実施するため、私たちのトラフィックに実質的な損害を与える可能性があります“
業務と戦略リスク
私たちの運営結果は時期によって大きく変動する可能性があり、予測が難しいかもしれません。
私たちの経営業績は異なる時期の変動を経験しており、この変動は今後も続く可能性が予想されます。これらの変動は、テストおよびテストサービスの販売金額および時間、テストおよびテストサービスに対して当社が受け取る価格、顧客または支払人の組み合わせ、テストおよびテストサービスの一般的な価格低下または他の競争要因を含むが、これらに限定されないが、私たちが発行し、料金を受け取る費用率と時間、第三者支払者からテスト精算を得る能力、広範で柔軟なテストメニューを維持する能力、私たちの約束と他の支払いの時間と金額、為替変動、および本報告で議論されている他のリスク要因を含む。 私たちの結果はずっと受けていて、未来にもいくつかの事件の影響を受けるかもしれません。これらの事件は定期的ではなく、同じ数で、あるいは未来に再び起こらないかもしれません。例えば、2020年に、私たちは一連の新冠肺炎テストを開発し、提供し始めた。2020年と2021年には、我々の収入が大幅に増加したのは、主にこれらの新冠肺炎テストの販売と需要が増加しているためであるが、近年、新冠肺炎普及率の低下により、われわれの新冠肺炎収入は低下している。我々の経営業績の変動は期間間比較の意味を低下させる可能性があり、投資家はどの時期の結果にも依存して未来の業績の指標とすべきではない。私たちの経営業績のこれらの変動は、任意の特定の時期における私たちのパフォーマンスが証券アナリストや投資家の予想よりも低く、あるいは私たちが公衆に提供する指導をもたらす可能性があり、これは私たちの普通株の価格に悪影響を与える可能性がある。
私たちは損失の歴史があり、私たちは持続的に利益を得ることができないかもしれない。現在、私たちは未来に私たちの新冠肺炎テストとテストサービスを販売することから実質的な収入を得ないと予想している。
私たちは赤字の歴史があります。2020年12月31日まで、2021年、2022年までの年度に利益を達成したにもかかわらず、今後どの時期にも再び利益を上げない可能性がある。しかも、私たちの収入水準は歴史的な速度で増加しないかもしれないし、全く増加しないかもしれない。私たちは将来もっと多くの損失を受けるかもしれない。我々は数年前に新冠肺炎検査を販売することで相当な利益を得たが、これらの検査に対する需要はすでに低下しており、現在、将来的には新冠肺炎検査と検査サービスの販売から実質的な収入を得ることはないと予想されている。新冠肺炎テストや他の収入の大幅な増加の需要が再び現れても、私たちはこのような需要に効果的に応答するために、私たちの資源を再管理することができず、私たちの収入を再び大幅に増加させることができないかもしれない。どんな損失も私たちの株主権益や運営資本に悪影響を与え、私たちの運営やあなたの会社への投資にマイナス影響を与える可能性があります。私たちの収入水準を維持または増加させることができず、収益力を維持することは、私たちの業務、財務状況、運営結果、キャッシュフローにマイナス影響を与える可能性があり、私たち普通株の市場価格は低下し続けるか、低下し続ける可能性がある。
買収された事業や技術の統合に成功できない可能性があり、これは私たちの業務や運営結果に悪影響を及ぼす可能性があります。私たちの買収は思わぬ負債を生むかもしれない。
私たちが入手可能な任意の組織や技術を統合する能力は、以下のリスクを含む多くのリスクの影響を受ける
買収はまた、買収された業務の債務および負債が当該業務の履歴財務諸表に十分に反映されていない可能性があるリスクを伴うことができ、歴史財務諸表は、我々の仮説または会計政策方法と不正確または不一致の仮定に基づくリスクに基づく可能性がある。業務の買収と統合は有効に管理されていない可能性があり、統合プロセスを管理できなかった行為は、会社全体の活動中断、顧客と収入損失、費用増加を招く可能性がある。さらに、買収された業務または技術を統合することは、重大な困難に関連する可能性があり、管理および資本資源が必要とされる可能性があり、そうでなければ、私たちの既存業務の持続的な発展や他の機会を求めるために使用されることができる。私たちはまた企業の買収に関連したまたは負債を得ることができ、これは実質的であるかもしれないし、私たちはどのようなものにも
31
得られたまたは負債があり、これらの負債が現実になる可能性は、実際に発生した負債とは大きく異なる可能性がある。このような状況は私たちの業務、運営結果、そして見通しに実質的な被害を及ぼすかもしれない。
私たちは以前、将来的に事業または資産を再買収し、合弁企業を設立し、他の会社や技術に投資したり、他の戦略関係を構築したりする可能性があり、いずれも私たちの経営業績を損なう可能性があり、または私たちの株主所有権を希釈する可能性がある。
私たちの業務戦略の一部として、私たちは以前、将来的に相補的な業務または資産の買収(例えば、細胞計数専門家会社やCSI会社、富金特製薬会社;およびSYMPHONY BUBUR,Inc.,または診断会社に通知)、他の会社への投資(例えば、Helio Healthへの投資)、技術許可手配、合弁企業、または他の戦略関係の買収を再び求めることが可能である。組織として、私たちの買収、投資、あるいは戦略関係や合弁企業の形成における経験は相対的に限られている。もし私たちが戦略的パートナーや他の戦略的関係との関係を追求すれば、私たちがこれらの関係を構築し、維持する能力はいくつかの要素で挑戦的になるかもしれない。要因には、他の検査会社との競争や、製薬や他の組織に加えられる内部·外部制限が含まれており、これらは、我々のような会社と構築できる関係の数やタイプを制限している。さらに、将来の買収、投資、技術許可、合弁企業、または他の戦略関係をタイムリーに、経済的に効率的に決定または達成することができない可能性があります。私たちのコストを回収するために、任意の買収、投資、または合弁企業の期待収益を実現することができないかもしれません。
任意の買収、投資、合弁企業、または他の戦略関係に資金を提供するために、証券発行、信用手配、資産売却、または協力または許可手配を通じて追加資金を調達することを求めることができる。これらの融資取引が私たちの株式株式を発行する必要がある場合、私たちの既存の株主の私たちの株式に対する相対所有権は希釈されます。これらの資金調達方法の各々は、以下の“必要に応じて許容可能な条件で追加資本を得ることができない場合は、業務計画を実行する能力を制限する可能性があり、私たちの流動性需要は、市場変動および全体的な経済状況の実質的な影響を受ける可能性がある”という節で議論されるリスクを含む様々なリスクの影響を受ける。さらに、必要に応じて、許容可能な条件で、または資金調達取引から追加資金を得ることができない可能性がある。私たちが追求しているいかなる買収、投資、または戦略関係に資金を提供できない場合は、私たちが希望や価値があると思う機会を失う可能性があり、これは私たちの将来性を損なう可能性がある。もし私たちが株式証券を発行することで資金を調達すれば、私たちの株主は深刻な希釈を経験するかもしれない。
私たちの顧客グループは異なる時期に変動し、私たちの収入は通常一部の顧客に集中しており、どの顧客の損失や販売減少も私たちの業務に実質的な損害を与える可能性があります。
私たちの顧客群の構成と集中度は常に異なる時期に変動し、これまでのある時期には、少数の顧客が私たちの収入の大きな部分を占めていた。私たちの知る限り、私たちの顧客が共同統制下にある時、あるいは他の方法で相互に関連している場合、私たちの顧客は2023年12月31日までの年間に3570万ドルを貢献し、私たちの総収入の12%を占めている。私たちは大きな顧客に集中しているのを見続けた。これらのクライアントおよび一般顧客の場合、テストは、任意の長期購入スケジュールに基づいてではなく、個々のテストに基づいて購入される。したがって、関連する顧客または大量のテストを購入する共同制御顧客を含む我々の任意またはすべての顧客は、いつでも注文注文を減少、延期、または停止することを決定する可能性があり、これは私たちの収入に悪影響を及ぼす可能性があります。顧客ニーズの変動は、私たちの業務の性質に部分的に起因する可能性があると考えられます。私たちの伝統的な遺伝子検査顧客は正常な運営過程において、彼らの測定需要は一定期間の大幅な変動を経験する可能性があり、その中のいくつかの顧客は深刻な財務苦境を経験している。需要変動は,特にどの大顧客にとっても,その原因にかかわらず,通常我々の定期業績に大きな影響を与える.
例えば、2023年の間、私たちのいくつかのBioPharmaサービス顧客のプロジェクトは、これらの顧客が深刻な財務的苦境を経験したために縮小または終了した。我々のBeacon Expanded Carrier Screenにより,最近では生育診療所や他の実験室顧客の需要も増加している。しかし,試験管受精や他の生殖補助技術の需要が低下すれば,我々のBeaconテストやサービスへの需要も低下する可能性がある。最近RoeがWade事件の転覆と州裁判所の最近の裁決を訴えたことから、胚胎に対する潜在的な監督管理処理に不確定性が存在し、これは試験管受精或いはその他の生殖補助技術に対する需要がある司法管轄区で低下或いは低下する可能性がある。また、私たちのラボ顧客が内部で何らかのテストサービスを実行することを決定した場合、私たちの業務や運営結果は実質的な悪影響を受ける可能性があります。既存の顧客販売に対する能力を維持または増加させることは、本報告で議論されている他のリスク要因を含む様々な要因に依存し、その多くの要因は制御できません。これらおよび他の要因のため、任意のキー、関連、または共同制御を含む任意の顧客の販売は、過去のように同じ金額または速度で継続されない可能性があり、将来の任意の期間にわたって、そのような販売は歴史的レベルに到達または超えることはないかもしれない。私たちの顧客の流出、あるいは注文の減少、あるいは彼らが注文したテストの支払い困難は、私たちの収入を著しく減少させ、私たちの経営業績に悪影響を及ぼす可能性があります。
32
私たちは激しい競争に直面しており、将来さらに激化する可能性があり、もし私たちが競争に成功できなければ、私たちは収入水準を維持したり、再び収益性を維持したりすることができないかもしれない。
私たちはこれらの競争相手よりも有利だと思いますが、私たちのいくつかの競争相手は、技術やプロセス開発において、私たちよりも技術的、競争的、または他の利点があるかもしれませんし、特定の診断や治療開発分野でより多くの経験を持っているかもしれませんが、製薬、診断、バイオテクノロジー会社間の統合は、これらの利点を強化することができます。
より具体的には、私たちの多くの競争相手は、より長い運営歴史、より大きな顧客基盤、より多くの研究開発者、より広範なブランド認知度、成熟した製造能力と施設、そしてより深い市場浸透率を持っている;より多くの財務、技術と研究開発資源、そして成熟した販売チームの販売とマーケティング能力を持っている;そして第三者決済者との付き合いの経験をより多く持っている。そのため、彼らは顧客の要求や優れた変化により迅速に反応し、彼らの技術、候補製品とテスト開発のためにより速く、より良い改善を行い、彼らのテストの普及と販売のためにより成功した戦略を作成し、実施し、第三者支払者からより有利な製品カバー範囲と精算結果を得て、彼らのテストのためにより積極的な価格設定政策を採用し、より優遇された条項でサプライヤーから供給を受けるか、あるいはより多くの資源をインフラとシステム開発に投入することができる。また、競争相手はより規模が大きく、実力があり、資金の豊富な会社に買収され、投資を受け入れたり、他のビジネス関係を構築したりする可能性があり、より多くの資源が競争相手に集中する可能性がある。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。
著者らの実験室サービス競争相手は数十社の病理、遺伝子と診断検査サービスに集中する会社を含み、伝統的な単遺伝子と多遺伝子測定を提供する専門と参考実験室を含む。そのため、私たちは他の生命科学、生物技術、製薬、研究開発と診断会社からの激しい競争に直面している。このような競争は急速な変化の影響を受け、新製品やテスト発売の大きな影響を受ける可能性があり、将来的にさらに激化する可能性がある。私たちの研究開発業務において、これらの競争相手はまたトップレベルの科学と管理者を募集し、維持し、臨床試験場所と臨床試験の患者登録を確立し、そして私たちの計画と相補的あるいは必要な技術を獲得する上で私たちと競争している。もし私たちの競争相手が私たちが開発する可能性のあるどの製品よりも安全で、より効果的で、より安価で、より便利で、管理しやすい製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。私たちの競争相手も私たちよりも早くFDA、EMA、または他の規制機関のその製品の承認を得ることができ、これは私たちの競争相手が私たちが市場に入る前に強力な市場地位を確立することをもたらすかもしれない。私たちの候補薬が発売承認されても、それらの価格は競争相手の製品よりもはるかに高いかもしれません。その時までに何かが承認されていれば。私たちの候補製品の成功に影響を与える重要な競争要素は、それらの有効性、安全性、精算の可用性である可能性がある。私たちは競争力のある組織と効果的に競争できないかもしれない。もし私たちが効果的に競争できなければ、これは私たちの業務と運営結果に実質的な悪影響を及ぼすかもしれない。
もし私たちの実験室施設が作動できなければ、もし私たちが施設を空けさせられた場合、あるいは必要な時にもっと多くの実験室空間を得ることができなければ、私たちはテストを行うことができなくなり、私たちの業務は損害を受けるだろう。
カリフォルニア州エルモント、テキサス州オーウェン、マサチューセッツ州ニダム、アリゾナ州フェニックス、ジョージア州アルファレイタ、ニューヨークのCLIA認証実験室でテストを行った。私たちの実験室と私たちがテストするための設備の交換コストは高く、交換と合格使用にはかなりの準備時間が必要かもしれません。さらに、私たちが使用する可能性のある他の任意の実験室施設または設備は、悪天候イベント、自然災害(気候変動の影響が悪化する可能性がある)、または人為的災害によって破損または操作できない可能性があり、これらの災害は、しばらくの間テストを困難または不可能にする可能性がある。私たちのテストを実行できない、あるいは実験室が運行できなくても短い時間であれば滞貨を招く可能性があり、回転時間が不利な影響を受け、顧客を失ったり、私たちの名声を損なう可能性があります。私たちの財産損失と業務中断に保険を提供していますが、この保険は私たちのすべての潜在的損失をカバーするのに十分ではないかもしれませんし、受け入れ可能な条項でサービスを提供し続けないかもしれません。
さらに、1つの実験室施設から別の実験室施設に移転する必要がある場合、または追加の実験室空間を得る必要がある場合、適切な空間がタイムリーに、合理的な条件で、または全く見つからない可能性がある。許容可能な空間があっても、私たちのような商業実験室に必要なライセンスおよび認証を取得または譲渡し、私たちのテストを実行するための装置は挑戦的で時間がかかり、高価になるだろう。もし私たちまたは私たちの合弁企業や他の商業パートナーが私たちが国際拡張を求めながら、アメリカ以外の実験室空間の調達と維持を求めるならば、これらの挑戦は拡大するかもしれない。私たちが必要な新しい実験室空間を獲得したり、遅延したりすることができない場合、既存のテストを提供することができず、許容可能な回転時間内にテスト結果を提供することができない場合、または新しいテストを開発して開始することができず、これは、私たちの業務、名声、財務状況、および運営結果に損害を与える可能性があります。
33
私たちは商業宅配サービスに依存して、適時かつ経済的に効率的な方法で標本を私たちの実験室施設に輸送します。もしこれらの宅配サービスが中断すれば、私たちの業務は実質的な損害を受けるかもしれません。
私たちの業務は私たちが顧客にテスト結果を迅速かつ確実に提供する能力に依存する。このような状況は最終的に私たちの名声と業務に実質的な悪影響を及ぼすかもしれない。また、ビジネス上合理的な条件で迅速な配達サービスを継続できなければ、私たちの経営業績は大きな悪影響を受ける可能性があります。
我々は、ハードウェアまたはソフトウェア障害、実行遅延、および/または重大な障害のために、新しいシステムまたは強化されたシステムまたはネットワークセキュリティホールを実施することができず、これらのシステムの任意の重大な障害は、私たちのトラフィックに実質的な損害を与える可能性がある、我々の情報技術システムに依存する。
私たちは情報技術と電気通信システムに依存して、例えば、私たちの実験室情報管理システムは、テスト検証、サンプル追跡と品質制御、私たちのバイオインフォマティクス分析ソフトウェアシステム、私たちの遺伝子変異及び疾患における役割の参考ライブラリ、個人情報保存、維持と転送、私たちの顧客向けネットワークポータルサイトと顧客サービス機能、私たちの報告生成システム、私たちの請求書と精算プログラム、私たちの科学と医療データ分析及びその他の研究開発活動と計画、開示制御、財務報告の内部制御及び他の公共報告機能を含む私たちの一般的かつ行政活動を行う。さらに、私たちの第三者サービス提供者は技術と電気通信システムに依存して契約サービスを提供してくれます。幅広いビジネスプロセスや機能に影響を与えるいくつかの企業ソフトウェアシステムを引き続き拡大し、強化する必要があり、特に私たちの業務が増加した場合、特に私たちの業務が増加した場合、例えば、人的資源、財務および他の開示制御および報告、顧客関係管理、コンプライアンス、セキュリティ制御、および他のインフラ機能を処理するシステムを含むようになると予想される。
情報技術および電気通信システムは、停電および他の電気通信またはネットワーク障害、自然災害および戦争またはテロ行為の爆発を含む様々なソースの干渉および破壊を受けやすい。敏感な情報の漏洩、中断、降格、操作、紛失、盗難、破壊、または許可されていない敏感な情報の開示をもたらす違反は、従業員または元従業員、または私たちの情報技術システムおよび情報にアクセスする権利がある他の人の不注意または不正行為、またはハッカー、競争相手、またはいくつかの政府の不正行為を含むが、これらに限定されない様々な方法で発生する可能性がある。私たちの第三者サプライヤーと業務パートナーもまた似たような危険に直面している。さらに、ネットワークセキュリティおよびバックアップ措置がとられているにもかかわらず、我々のサーバおよび他の電子システムは、物理的または電子的侵入、コンピュータウイルス、恐喝ソフトウェア攻撃、ネットワーク釣り計画、および同様の破壊事件のようなネットワークセキュリティホールの影響を受けやすい。我々の情報技術や電気通信システムに影響を与える可能性のある問題を検出し、予防または解決するための予防措置を講じているにもかかわらず、我々の子会社の情報システムにセキュリティ事故が発生し、PHIおよび他の機密情報が不正にアクセス、使用、開示されるようになった。これまで、これらのイベントは、私たちのトラフィックに実質的な影響を与えていませんが、このようなイベントは、私たちのシステムまたは私たちの第三者サービスプロバイダによって使用されるシステムに重大な停止または障害をもたらす可能性があります。サイバー攻撃には、有害なマルウェアまたは恐喝ソフトウェアの配備、脆弱性の利用、ネットワーク釣り、および社会工学を使用する他の手段、ならびに我々の情報技術システムおよび機密情報のセキュリティ、完全性および利用可能性を損なう他の手段を含む様々な形態がある。犯罪者がコンピュータシステムを攻撃するための技術は複雑で、変化が頻繁で、規制の少ない地域や世界の遠隔地に由来する可能性がある。私たちは財産、業務中断とネットワーク責任保険を保証しましたが、保証範囲はシステム停止や故障時に発生する可能性のあるすべての損失を補償するのに十分ではないかもしれません。私たちが運営する重要な態様に依存する情報技術または電気通信システムの任意のこのような中断または損失は、私たちのトラフィックおよび名声に大きな悪影響を及ぼす可能性がある。
また、私たちの業務が成長すれば、私たちの技術システムの範囲を改善し、拡大して、私たちの業務規模に対する十分性を維持する必要があります。このような改善を行わない場合、または新たなまたは強化されたシステムの実施を計画する上でいかなる重大な遅延が生じても、我々のシステムを時代遅れまたは不足させる可能性があり、この場合、顧客および他の業務活動へのサービスが影響を受ける可能性があり、外部ソースからの電子侵入の影響を受けやすい可能性がある。
もし私たちのコンピュータシステムが破壊されたら、私たちは巨額の罰金、損害、名誉損害、訴訟と法執行行動に直面する可能性があり、私たちは商業機密を失う可能性があり、もしこのような状況が発生すれば、私たちの業務に実質的な損害を与える可能性があり、また多くの資源をかけて救済する必要があるかもしれない。
34
私たちは限られた数のサプライヤーに依存しており、場合によっては、独占サプライヤーに特定の実験室物質、設備、および他の材料を提供することにも依存しており、これらの材料を遅延または入手することが困難な場合は、私たちの実験室運営を混乱させ、私たちの業務に実質的な損害を与える可能性がある。
私たちは限られた数のサプライヤーに依存して化学反応のためのいくつかの実験室物質を提供し、これらの物質は私たちのテストと試験サービス、そして私たちが実験室運営で使用しているシークエンサー、収集キット、様々な他の設備と材料に組み込まれている。特に、著者らはIlluminaを次世代シークエンサーと関連試薬の独占サプライヤーとして頼り、そしてこれらのシークエンサーの維持と修理サービスを提供した;羅氏ホールディングスは私たちの免疫組織化学サービスに特定の実験室設備、用品とサービスを提供した;Beckman Coulter Diagnosticsは私たちのフローサイトメーターのテストと検査サービスに特定の実験室設備、用品とサービスを提供した;メダカ生物システム会社はデジタル病理業務に自動化されたデジタルスキャン解決方案を提供した;アボットは私たちの魚類測定と測定サービスにある実験室設備、用品とサービスを提供した。また,我々の治療開発業務はANP Technologiesに依存し,Inc.は我々の研究や開発に関連するいくつかの実験室サービス,装置,ツール,および薬物中間体を提供する.私たちは私たちの大多数のサプライヤーと長期的な合意がないので、私たちと供給条項について合意することができないので、彼らの業務は中断して、他の活動や業務ラインに従事しようと決心して、あるいは彼らは私たちの規格に合った十分な数の材料を提供することができないかもしれません。彼らはいつでもこれらの材料と設備を供給することを停止するかもしれません。これらのサプライヤーはまた、極端な天気事件、火災または洪水(気候変動が進行する可能性がある)、流行病および健康事件、およびグローバルサプライチェーンの中断などの自然災害の影響を受ける可能性がある。私たちはIlluminaを代替することができるいくつかのシークエンサーサプライヤーがあると思いますが、私たちは私たちの他の需要を満たすのに十分な代替サプライヤーがあると思いますが、新しいサプライヤーに移行したり、一時的な代替品を探したりするのは時間と費用がかかり、中断や他の方法で私たちの実験室運営の性能仕様に影響を与える可能性があり、あるいは私たちのテストを再検証する必要があるかもしれません。さらに、代替サプライヤーが提供する設備や材料を使用するには、実験室の操作やプログラムを変更する必要がある場合があります。また,現在,我々の実験室運営に必要ないくつかの設備や他の材料を提供し,修理することができるのは,シークエンサーや各種関連試薬を含む少数のメーカーのみであると信じている。したがって、我々の品質管理および性能要求に適合する代替設備および材料は、合理的な条項、タイムリー、または根本的に得られない可能性がある。もし私たちが私たちのテストに必要な設備、試薬、および他の材料を取得、再構成、または再検証する時に遅延または困難に遭遇した場合、私たちの運営は深刻な妨害を受ける可能性があります。私たちの予想される運転時間または適時にテストサービスを提供する能力は悪影響を受ける可能性があり、私たちの開発作業は遅延または中断する可能性があり、私たちの業務、財務状況、運営結果、および名声は悪影響を受ける可能性があります。
上級管理チームのメンバーのいずれかの流出は私たちの業務に悪影響を及ぼす可能性がある。
私たちの成功は私たちの実行管理チームとその他の重要な指導職の技能、経験と表現に大きく依存して、特に私たちの創始者、最高経営責任者兼取締役会主席の謝明輝、私たちの首席財務官Paul Kim、私たちの首席科学官兼実験室主任の林徳博士と取締役実験室の首席運営官総裁兼最高運営官の謝健。そのほか、私たちのフルキン製薬業務の成功は私たちの実行管理チームと他の重要な指導職の技能、経験と表現、特に尹雷、総裁と首席科学官に大きく依存する。私たちが私たちの技術を発展させ、業務成長に集中するにつれて、この人たちの持続的な努力は私たちに重要だ。もし私たちがこれらの重要な幹部の1人以上を失ったら、私たちは効率的な競争、技術の推進、新しいテストの開発、業務戦略を実施する能力を含む運営維持の面で困難に直面する可能性がある。うちのすべての幹部と職員は、謝家華、金さん、謝さんを含め、尹博士と高博士はみな勝手なもので、これは我々かこの幹部がいつでも彼の仕事を終えることができるということを意味する。私たちは私たちの役員や他の職員たちのためにキーパーソン保険を購入しない。しかも、私たちはどんな幹部や重要な職員たちと長期留任協定を締結しなかった。
私たちは各業界の高技能人材に依存して、もし私たちがこれらの人を採用、維持、激励することができなければ、私たちは試験の質を維持したり業務を発展させることができないかもしれません。
著者らの業務は、著者らの研究開発計画、実験室運営と行政機能を含み、大部分は著者らのために組織したすべての領域の識別、採用、訓練、激励と維持高技能者の能力に大きく依存し、生物統計学者、遺伝学者、ソフトウェアエンジニア、実験室主任、専門家、販売とマーケティング専門家及びその他の科学、技術と管理人員を含む。私たちの業界は合格幹部と他の従業員に対する競争が非常に激しく、私たちの競争相手、他の生命科学企業、大学及び公共と個人研究機関の間のこれらの人員に対する激しい競争のため、私たちは私たちが業務計画を実行するために必要な合格者を引き付けることができないかもしれません。しかも、私たちの給与配置は新入社員を誘致し、既存の従業員を維持して奨励することで成功しないかもしれない。私たちが必要な人員を引き付けて維持することができなければ、私たちの業務目標を達成することができなければ、私たちは制限に直面する可能性があり、これは私たちの業務の拡大と私たちの臨床業務を支援する能力に悪影響を及ぼすかもしれない
35
実験室の運営、そして私たちの販売とマーケティングと研究開発の仕事は、これは私たちの未来の成長と成功の見通しにマイナスの影響を与えるだろう。
否定的な宣伝は私たちの名声と業務を損なうかもしれない。
私たちは否定的な宣伝の影響を再び受けているかもしれない。否定的な宣伝の結果を含む名声リスクは、私たちの業務固有のものだ。負の宣伝は、法律および法規のコンプライアンス、会社の管理、訴訟、健康情報の保護不足、製品またはサービスを提供する第三者がとる不正または許可されていない行為、ならびに私たちの従業員または代理の行為を含む、複数の分野の実際または告発された行為から来る可能性がある。特に、新冠肺炎と生育サービスの獲得はずっと政治的に論争のある話題であり、著者らは新冠肺炎の検査と関連サービスを提供することはすでに私たちにマイナスの宣伝を受けて、私たちは再びマイナスの宣伝を受ける可能性があり、私たちは出産診療所に検査サービスを提供したり、生殖補助技術を支持したりするからである。否定的な宣伝は私たちに関するこのような声明が真実ではなくても、私たちの名声と業務を損なうかもしれない。私たちの名声を損なうことは、新しい顧客を誘致し、既存の顧客、従業員、業務関係を維持する能力に悪影響を及ぼす可能性があります。このような被害とこのような状況は私たちの財務状況、見通し、そして運営結果に実質的な悪影響を及ぼすかもしれない。
私たちは新しいテストの開発とマーケティングで成功しないかもしれません。これは私たちの表現と将来性にマイナスの影響を与えるかもしれません。
私たちの将来の成功は、私たちが私たちのテストとテストサービス製品を拡大し続け、新しいテストとテストサービスを開発·販売する能力にある程度依存し、分子診断と癌テスト市場における私たちの存在を含む、私たちの新しいおよび既存の市場での私たちの存在の能力を拡大すると信じている。私たちは私たちが開発するかもしれない新しいテストを発売したり、マーケティングしたりすることができないかもしれません。どんな新しい市場や既存の市場にも拡張できません。たとえ私たちが成功しても、どんな新しいテストの販売によっても、私たちのテストに対する需要は歴史的な速度で低下したり、成長し続けないかもしれません。新しいテストの開発は時間も費用もかかります。新しいテストの開発とマーケティングは私たちに新しいテストに関連する研究と開発活動を行うことを要求し、更に私たちの実験室の流れとインフラを拡張して、ますます多くのより多様なデータを分析することができるようにします。さらに、様々な理由で、提案されたテストが予期されたように実行されなかったこと、テストの検証または参照データが不足していること、またはテストの実用性を証明できなかったことを含む、新しいテストを発見または開発および開始することができない可能性がある。私たちが発見し開発することができる任意の新しいテストは、適時に発売されない可能性があり、適用された法規基準に適合し、他の技術および利用可能なテストとの競争に成功し、他人の独自の権利を侵害することを回避し、第三者支払者からカバーおよび十分な補償を得ることができ、合理的なコストでビジネスレベルで性能を発揮することができ、成功したマーケティングまたは十分な市場受容度を得ることができ、開発テストの時間および資本投資を回収することができる。開発、マーケティング、販売新テストに成功できなかったいかなる状況も、私たちが顧客を誘致し、維持する能力、私たちの収入と将来性にマイナスの影響を与える可能性がある。
私たちは私たちの国際業務に関連する追加のビジネス、規制、政治、運営、金融、経済リスクに直面している。
私たちの既存の顧客群は異なる地理市場からの国際顧客を含む。我々の戦略の一部として、ターゲットを絞ったマーケティング普及活動を展開し、機会が出現した場合には、販売業者と交渉したり、合弁企業や他の関係を増加させるなど、他のタイプの手配を確立することで、異なる市場での国際顧客への直売量を増加させることを目標としている。しかし、私たちは決してこれらの目標を達成することに成功しないかもしれません。たとえ私たちが成功しても、これらの戦略は私たちの顧客基盤、テスト量、収入に意味のあるものや何の増加ももたらさないかもしれません。
国際的な業務展開は、一連のリスクに関連している
36
これらの要素のいずれも、私たちと国際顧客との既存の関係を深刻に損害したり、国際拡張計画を破壊したりする可能性があり、これは私たちの収入と運営結果に影響を与えるだろう。
また、私たちは中国での合弁企業に関連するいくつかの追加的なリスクと挑戦に直面している。これらのリスクは、アジア遺伝子検出市場を予測することの困難を含むが、これらに限定されない;市場の競争要因は、市場シェアを確保するための挑戦、顧客の需要と選好、および規制環境および規制要件の地域差、法律、法規および規則の解釈または実行、および上述した多くの他の多国籍経営リスクを含む。この合弁企業はアジア遺伝子検査市場の需要を満たすためにより多くの長期的な機会をもたらすことができると信じているが、この考え方は間違っていることが証明される可能性があり、私たちは合弁企業から得たこれらや他のいかなるメリットも決して意識しないかもしれない。また、私たちが設立を求める可能性のあるいかなる合弁企業も、合弁企業における私たちの資本や他の投資を回収するのに十分な収入をもたらしてくれないかもしれません。私たちは合弁企業の運営に参加するために責任を負うかもしれません。このような危険な達成は私たちの業績と見通しに実質的な被害を及ぼす可能性がある。
もし私たちが製品や専門的な責任で起訴されたら、私たちは私たちの資源の範囲を超えた重大な責任に直面するかもしれない。
私たちの業務は、疾患における遺伝子および遺伝子変異の役割およびこれらの変異に関連する臨床結果に関する迅速な変化情報を含む試験を含む信頼性かつ正確な試験結果を提供する能力に依存する。何百もの遺伝子が特定の病気と関連しているかもしれない。重複する遺伝子や症状ネットワークは様々な状況に関連している可能性がある。したがって,特に病理検査では,我々が実行した各試験の結果を説明し,これらの結果をまとめた報告を生成するために実質的な判断が必要である。誤り、ゲノム変異を高精度に検出できなかった場合、あるいは誤り、もし遺伝子変異の重要性を完全かつ正確に識別できなかった場合、或いは疾病を検出できなかった場合、私たちは製品責任或いは専門責任クレームに直面する可能性がある。私たちに対するどんなこのようなクレームも重大な損害賠償を招く可能性があり、費用が高くて時間がかかるということを弁護する。私たちにはミスや漏れの責任保険を含む責任保険がありますが、私たちの保険は、これらのタイプのクレームやそのような任意のクレームによって生じる任意の判決、罰金、または和解費用による財務的影響から私たちを完全に保護することができないかもしれません。また、私たちに提起されたどんな責任クレームも、合理的かどうかにかかわらず、私たちの保険料率を増加させたり、未来に十分な保険カバー範囲を得ることを阻止したりする可能性がある。しかも、どんな責任訴訟も私たちの名声を傷つけたり、私たちのテストの販売を一時停止させたりする可能性がある。このような事件の発生は、私たちの業務、名声、および運営結果に実質的な悪影響を及ぼす可能性がある。
Fulgent Pharmaの業務は臨床試験中に患者に対して新薬テストを行い、未来に引き続き患者に対する追加の薬物テストに関連することを含む。著者らが臨床試験と開発過程に参加することは、患者、特に生命に危害を及ぼす疾患を有する患者の人身傷害或いは死亡のリスクをもたらし、これらの患者はそれぞれテスト期間或いは製品発売後に薬物の副作用によるものである。私たちが経営している業界と国の慣例と適切な保険タイプと金額を維持していますが、もし私たちが重大な損害賠償を要求された場合、あるいは私たちと顧客との間の賠償協定の範囲を超えたいかなる人身傷害クレームに関連していますか。もしいかなる賠償協定がその条項に従って履行されていない場合、あるいは私たちの責任が
37
任意の適用可能な賠償限度額または取得可能な保険範囲を超える場合、私たちの財務状況、経営業績、名声は実質的な悪影響を受ける可能性がある。
しかも、保険カバー範囲はますます高くなっており、得るのは難しい。許容可能なコストで十分な保険範囲を得るか維持することができない、または潜在的な製品または他の法律または行政責任クレームを他の方法で保護することは、顧客関係、臨床開発、商業生産、および販売のいずれかの製品および候補製品を阻止または抑制する可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。
必要に応じて許容可能な条件で追加資本を得ることができない場合は、業務計画を実行する能力を制限する可能性があり、私たちの流動性需要は市場変動や全体的な経済状況の大きな影響を受ける可能性がある。もし私たちが株式証券を発行することで資金を調達すれば、私たちの株主は深刻な希釈を経験するかもしれない。
私たちがインフラ、その他の商業運営、研究開発活動の拡大を求めるにつれ、今後数年で私たちの資本支出と運営費用が増加することが予想される。2023年12月31日現在、私たちは約8億477億ドルの現金、現金等価物、有価証券を持っている。私たちは、証券発行、信用手配、または他の債務融資、資産売却、協力、または許可手配を通じて、将来の現金需要に資金を提供することを求めることができる。必要な時、私たちは受け入れ可能な条件や追加的な資金を得ることができないかもしれない。例えば、新冠肺炎の疫病は最初に全世界の資本市場の極度な混乱と変動を招き、その後は市場の生命科学と診断会社株に対する高い需要時期であり、その後2022年と2023年のこれらの株に対する需要減少時期である。これらの状況および資本市場の高変動性は、通常、私たちの資本獲得能力を低下させ、および/または私たちの資産を維持する預金機関の安定性に悪影響を及ぼす可能性がある。
もし私たちが株式証券を発行することでより多くの資金を調達すれば、私たちの既存の株主は深刻な希釈を経験するかもしれない。さらに、私たちが発行した任意の優先株は、私たちの普通株よりも優先的な権利、優先または特権を提供する可能性があり、私たちが追加の株式証券を発行したり、そのような証券を発行する可能性は、私たちの普通株の市場価格の下落を招く可能性がある。私たちが発行した任意の債務証券または私たちが生成した任意の借金の条項は、利用可能であれば、追加債務の発生や追加株式の発行能力の制限、または私たちの業務を展開する能力に悪影響を及ぼす可能性のある他の制限など、当社の業務に重大な制限を加える可能性があり、固定支払義務の増加につながる可能性があります。もし私たちが資産の売却や協力や許可の手配を求めて資金を調達する場合、私たちは不利な条項を受け入れることを要求されるかもしれないし、私たちが自ら開発した重要または価値のある技術やテストを求める権利を放棄することは第三者に与えることができるかもしれない。また、私たちは将来の資本を求める過程で、投資銀行、法律、会計費用、印刷と流通費用、その他の同様のコストを含む大量のコストを発生させる可能性がある。もし私たちが必要な時に合理的な条件で資金を得ることができない場合、私たちは1つ以上の販売とマーケティング計画、研究開発計画、または他の成長計画または戦略の延期、縮小、または廃止を余儀なくされる可能性がある。さらに、私たちは、私たちのテストまたは市場開発計画または計画の1つまたは複数の面でパートナーと協力することを余儀なくされる可能性があり、これは、これらのテスト、計画、または計画の私たちに対する経済的価値を低下させるかもしれない。このようなどんな結果も私たちの業務、業績、そして将来性を深刻に損なう可能性がある。
インフレは私たちの費用を大幅に増加させ、それによって私たちに悪影響を及ぼすかもしれない。
最近、アメリカ経済全体のインフレ率が上昇している。インフレは臨床試験と研究のコスト、私たちのテストと候補製品の開発、行政管理とその他の業務コストを大幅に増加させ、私たちに不利な影響を与える。私たちは労働力価格と他のビジネスの費用の大幅な上昇を経験するかもしれない。インフレの環境下で、コスト増加は私たちの予想を大幅に超える可能性があり、私たちは予想よりも早く現金や他の流動資産を使用することになるかもしれない。このような状況が発生した場合、私たちは私たちの運営に資金を提供するために追加の資本を調達する必要があるかもしれません。これらの資金は十分な金額や合理的な条項を得ることができないかもしれません。もしあれば、予想よりも早くなるかもしれません。
もし私たちが財務報告に対して有効な内部統制を維持できなければ、投資家は私たちが報告した財務情報の正確性と完全性に自信を失う可能性があり、私たちの普通株の市場価格は下落する可能性がある。
私たちは財務報告書に対する内部統制を維持し、このような内部統制のすべての重要な弱点を報告することを要求された。サバンズ·オキシリー法404条は、財務報告書の内部統制に対する私たちの有効性を評価し、決定することを要求し、これらの内部統制に関する管理報告書を毎年提供する。私たちはすでに巨額の費用を負担し続け、サバンズ·オクスリ法案第404条の監査役認証要件を遵守するために多くの管理努力を投入することを予想している。2023年末までに、私たちはシステム、プロセス、そして制御を実施し、この評価を行ったにもかかわらず、私たちが成長すれば、私たちはこれらの統制を維持して強化する必要があるだろう。また、これをするためには、より多くの人員を募集し、財務報告機能により多くの資源を投入する必要があるかもしれませんが、これは私たちの運営費用を増加させます。
38
私たちの内部統制を評価する過程で1つ以上の重大な弱点が発見された場合、またはエラーがタイムリーに発見されなかった場合、私たちの財務諸表に重大なミスが発生する可能性があります。また、この場合、私たちの経営陣は、財務報告書の内部統制に有効であるという結論を出すことができないだろう。さらに、私たちはもう新興成長型会社ではなく、私たちの独立公認会計士事務所が発行した財務報告書の内部統制に関する証明報告書を含まなければならない。有効な制御を策定または維持できなかった場合、または実施または改善の過程でいかなる困難に遭遇しても、我々の経営業績に実質的な損害を与える可能性があり、報告義務を履行することができず、これまでの財務報告書を再記述することができなかったか、または米国証券取引委員会に提出される定期報告に含まれる財務報告内部統制の管理評価および独立公認会計士事務所監査の結果に悪影響を与えなければならない。もし私たちまたは私たちの監査人が、私たちの財務報告に対する内部統制が1つ以上の重大な弱点を発見することによって無効であると結論した場合、または内部統制の欠陥が私たちの財務業績の再記述を招いた場合、投資家は私たちの財務開示の正確性と完全性に自信を失う可能性があり、私たちの普通株式価格は下落する可能性がある。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
私たちは“取引所法案”の定期報告書と他の要求事項を守らなければならない。我々は、取引所法案に基づいて提出または提出された報告書に開示された情報が蓄積されて管理層に伝達され、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されなければならないことを確実にするための合理的な保証を提供するための開示制御および手続きを実施している。しかしながら、任意の開示制御およびプログラムは、発想および操作がどんなに綿密であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを保証する。これらの固有の限界には,意思決定における判断が誤りである可能性があり,故障は簡単な誤りや誤りによって発生する可能性があるという現実がある.さらに、ある人の個人的な行動、2人以上の結託、または無許可超越制御は、制御を回避することができる。したがって、我々の制御システムのこれらの固有の制限により、エラーや詐欺による誤った陳述や漏れが発生し、発見されない可能性があり、必要な報告書をタイムリーに提出し、不正確な情報を含む報告書を提出することができない可能性がある。これらの結果のいずれも、米国証券取引委員会の法執行行動、罰金または他の処罰を招き、私たちの名声を損ない、私たちの財務状況と株価を損なう可能性がある。
私たちの有価証券への投資はいくつかのリスクの影響を受けています。これらのリスクは私たちの全体的な財務状況、経営結果、あるいはキャッシュフローに影響を与えるかもしれません。
我々は、管理ポートフォリオにおける有価証券の購入と各種債務証券への直接投資により、会社債務証券、市政債券、米国政府·機関債務証券、外国政府発行の債務ツールを含めて、一部を現金と現金等価物で投資することができる。我々の投資活動の主な目標は、元本の安全を維持し、資本を保護し、将来の流動性需要を満たすとともに、リスクを著しく増加させることなく収益率最大化を実現することである。もし私たちの任意の投資や有価証券の切り下げやその流動性が損なわれれば、私たちの全体的な財務状況に大きな影響を与えるかもしれない。また、私たちが今後これらの証券を赤字で売却することを選択したり、要求されたりすれば、私たちの総合経営業績やキャッシュフローは実質的な悪影響を受ける可能性がある。
私たちは連邦保険の限度額を超える現金預金を維持する。金融機関の不利な発展に影響を与え、銀行倒産を含め、私たちの流動資金や財務パフォーマンスに悪影響を及ぼす可能性がある.
私たちは質が高く、認可された金融機関と私たちの現金、現金等価物、そして有価証券を維持している。しかしながら、いくつかの口座は連邦預金保険会社(FDIC)250,000ドルの保険限度額を超えており、会社はこれらのホスト機関や投資の財務力によって重大な信用リスクに直面しないと考えているが、どのようなホスト機関が私たちの預金を返却できなかった場合、または信託機関が金融や信用市場で他の不利な条件の影響を受けた場合、これは私たちが投資した現金や現金等価物の取得にさらに影響を与え、私たちの運営流動性や財務業績に悪影響を及ぼす可能性がある。さらに、1つまたは複数のこのような預金機関の倒産またはこれらの投資の違約は、これらの資産を取り戻す能力に重大な悪影響を及ぼす可能性があり、および/または私たちの財務状況に重大な損害を与える可能性がある。
私たちは損害なしに却下された株主集団訴訟の対象でした;将来さらなる株主訴訟を受ける可能性があります;私たちがそのような訴訟、仲裁および他の手続きを弁護するコスト、およびそのような訴訟、仲裁、または他の手続きの任意の不利な結果は、私たちの業務と私たちの運営結果に大きな悪影響を及ぼすかもしれません。
当社は株主訴訟を含む重大な訴訟や他の法的手続きに時々巻き込まれる可能性がある。このような訴訟はいつも私たちに有利ではなく、私たちの業務に実質的で不利な影響を及ぼすかもしれない。最近の株主集団訴訟は却下されたが,偏見なしに却下されたため,将来的に別の苦情が提起されない可能性は保証されない。結果がどうであれ、訴訟は私たちに悪影響を及ぼす可能性がある
39
弁護と和解費用、管理資源の移転、否定的な宣伝と名声損害などの要素による。
政治的不確実性は私たちの経営業績と経営結果に悪影響を及ぼすかもしれない。
普遍的な政治的不確実性は私たちの経営業績と経営結果に悪影響を及ぼすかもしれない。特に、米国は世界金融·経済市場に不確実性をもたらす重大な政治事件を経験し続けており、特に大統領選が行われる中で。米国新政府がどのような行動をとるかは不明であり,実施すれば,これらの行動が米国の製薬·診断業界にどのように影響するかは不明である。米国新政府が取ったいかなる行動も、米国経済および私たちの商業、財務状況、運営結果にマイナス影響を与える可能性がある。
私たちの営業権や無形資産に関連した減価費用は私たちの財務業績に悪影響を及ぼすかもしれません。
私たちは以前、将来的に相補的な業務や資産の買収を再び求める可能性があり、これらの買収によるすべての経済的利益を実現できない可能性があり、これは営業権や無形資産の減価につながる可能性がある。私たちは、少なくとも毎年、またはイベントや環境変化が帳簿価値が回収できない可能性があることを示した場合、営業権および無期限無形資産の減値を評価する。私たちの名誉および無形資産の減価をもたらす可能性のある事件および条件には、私たちの株価および時価の低下、将来のキャッシュフロー推定の減少、私たちが参加する業界の成長速度の鈍化、または予想される長期的な成長や収益力の低下をもたらす他の要因が含まれる。営業権または償却可能無形資産の減価を決定する間、私たちは私たちの連結財務諸表に重大な費用を記録する必要があるかもしれません。これは私たちの財務状況や経営業績に悪影響を及ぼす可能性があります。例えば、私たちの2023年度の年間営業権減価分析では、私たちは7,180万ドルのInform Diagnostics買収に関連する営業権、2,750万ドルとCSI買収関連の営業権、および2,100万ドルと福建福駿遺伝子生物技術有限会社またはFF gene Biotech再編に関する営業権減価を完全に減価した。これは主に私たちの市場価格と時価の持続的な低下によって推進された。
精算リスク
私たちが収益性を達成したり維持したりすることは、私たちが提供したテストのための費用にもかかっていて、私たちはそれに成功できないかもしれない。
著者らは従来、主に病院、医療機関と他の実験室に著者らの検査を提供することに集中しており、これらはすべて著者らの伝統的な遺伝子測定顧客の基礎である。私たちの新冠肺炎テストの顧客群は主に政府機関、市政当局と大会社で構成されています。彼らは直接あるいは第三者支払人を通じて私たちに支払います。2020年3月、コロナウイルス援助、救済と経済安全法案が公布され、医療保健提供者はHRSA管理の計画を通じて未加入個人に新冠肺炎検査の補償を提供することを規定した。しかし、HRSAは十分な資金が不足しているため、このプロジェクトは2022年3月22日から新冠肺炎検査クレームの受け入れを停止すると発表した。
また,医療融資方式に影響を与える医療政策の変化,あるいは機関や非機関顧客の支払レートに影響を与える市場他の変化も,我々のレジ率に影響を与える可能性がある。もし私たちが病院、医療機関、その他の実験室が私たちの検査と検査サービスが提供する価値と利益を信じるように説得できなければ、これらの顧客は私たちの検査の購入を減速または完全に停止するかもしれない。さらに、個人医師や他の事業者を含む新たな医療サービスプロバイダの顧客群に業務を拡張すれば、医療サービスプロバイダの顧客から試験および試験サービスの費用をタイムリーにまたは全く受け取ることができない能力が低下する可能性があり、これらの顧客群の課金率は、一般に病院、医療機関、および他の実験室よりも著しく低く、多くの追加リスクが関連しており、これらのリスクは以下のリスク要因で議論されるであろう。私たちの受取リスクには、支払責任者が違約や破産する可能性や、一般的に支払い請求に関する他のリスクも含まれています。私たちの過去の支払入金水準を維持できないものは、私たちの収入と利益を達成する能力の低下を招き、私たちの業務、将来性、財務状況に悪影響を及ぼす可能性があります。
もし第三者支払者が私たちのテストとテストサービスに保険と十分な補償を提供しなければ、私たちの成長潜在力とこれらのテストとテストサービスのために収入を受け取る能力は制限される可能性があり、私たちの運営結果は実質的で不利な影響を受ける可能性がある。
第三者支払者は、MedicareおよびMedicaidのような医療組織、他の個人健康保険会社、および政府医療計画を管理することを含み、私たちが実行するテストタイプのカバー範囲および精算は、限られて不確実である可能性がある。私たちの顧客は、第三者支払者が支払い、かなりのテスト費用を支払うために十分な精算を提供しない限り、私たちのテストサービスやテストサービスを注文しないかもしれません。もし私たちが保証範囲と受け入れ可能なテスト精算レベルを得ることができなければ
40
第三者支払人から、テストを受けた患者は通常、より多くの共同保険、賠償免除額、または共同支払い金額を支払う必要があり、あるいは自腹を切ってテストのすべての費用を支払う必要がある可能性があり、これは医師に私たちのテストを注文することを制止する可能性があり、注文すれば、患者または第三者支払者からの費用を遅延または低下させる可能性がある。医療提供者の顧客に販売されるテストおよびテストサービスの数および任意の対応する収入を増加させる能力があると信じており、これは、テストの広いカバー範囲と第三者支払者が私たちのテストを精算する能力を実現し、維持することにある程度依存する。
第三者支払人の保証範囲と精算は多くの要素に依存し、支払人がテスト或いはテストサービスが適切かどうか、医療上必要と費用効果の確定を含む。各支払者は、私たちのテストのために保険証書を作成したり、契約を締結したり、各テストの精算金額を自分で決定しますが、支払人が私たちのテストのカバー範囲と精算金額のどの決定も1つずつ指示した上で行われる可能性があります。あるテストが任意の特定の適応または任意の特定の司法管轄区域内で精算が許可されていても、そのテストが依然として精算を許可されること、または任意の類似または追加のテストが将来精算を許可されることを保証することはできない。また、私たちが発売したどんな新しいテストでも完全に精算される保証はありません。あるいは精算の費用率は以前のどの精算のテストの費用率に相当するという保証はありません。また,すべての第三者支払者が様々なプログラム(我々のテストを含む)の支払率を構築する際に使用するコードプログラムは複雑であり,現在我々が行っているテストにうまく適応できず,我々のテストにカバー範囲と十分な販売率を提供できない可能性がある.もし医者が彼らが注文したテストに適切な診断コードを提供できなかったら、私たちはテスト精算を得ることができないかもしれない。また、私たちのテストを支援するのに十分な臨床情報が得られない場合、第三者支払者は、私たちのテストを試験的または研究的テストとして指定することができ、そのため、私たちのテストの保証と清算を拒否することができる。これらの要素のため、第三者支払者の承認を得て、私たちのテストとテストサービスを支払い、十分な精算レベルを確立することは予測できない、挑戦的で、時間とコストが高い過程であり、私たちは決して成功しないかもしれない。
これまでに,国の医療保険会社と直接契約を結び,ネットワーク内の提供者となり,連邦医療保険計画のサプライヤーや一部の州の医療補助計画の提供者として登録し,ネットワーク外の提供者として他の第三者支払者からテスト費用を受け取ってきた。ネットワーク内のプロバイダになるか、またはプロバイダまたはプロバイダとして登録することは、交渉または設定された料金スケジュールレートのためにこれらの支払者と合意したことを意味するが、これは、任意の医師または他の事業者に私たちのテストを注文すること、またはこれらまたは任意の他の支払者から十分なレベルのテスト精算を得ることを保証することを要求しない。したがって、これらの支払人関係、私たちが将来構築する可能性のある他の類似した関係、またはネットワーク外プロバイダである他の支払者から得られる任意の追加支払いは、私たちがテストした受け入れ可能な精算レベルや意味のある精算レベルに達しないかもしれないし、私たちの顧客基盤または私たちが販売しているテスト数の増加には達しないかもしれない。私たちは現在のテストと私たちが開発する可能性のある未来のテストのカバー範囲と精算に重点を置く予定ですが、支払人がどのような状況で、あるいはどのような支払いレベルで私たちのテストをカバーして精算するかどうかを予測することはできません。また、私たちが成功しても、カバー範囲と第三者支払者との十分な契約補償を達成するのに数年かかるかもしれないと信じています。もし私たちのテストのために広範なカバー範囲と精算を確立し、維持することができなければ、私たちはテスト量、顧客基礎、受取可能率、収入レベルを維持または増加させる能力が制限されるかもしれません。私たちの将来の見通しと私たちの業務は影響を受けるかもしれません。
私たちのサービスクレームの提出に関連する政府の法律法規を守らないと、重大な金銭的損失や処罰を招き、MedicareやMedicaid計画、対応する外国精算計画から除外される可能性があります。私たちはまた政府監査を受けて、これは重大な払い戻しや和解につながるかもしれない。現在のHRSA監査のために、私たちの業務、見通し、および財務状況は不利な影響を受けるかもしれません。
私たちは、以下のようなサービス支払い申請の提出に関する法律法規、例えば、以下の事項に関連する法律および法規を遵守しなければならない:私たちのテストおよびテストサービスはMedicare、Medicaid、HRSAおよび他の州、連邦および外国医療保健計画の下でのカバー範囲;私たちは私たちのサービスのために費用を徴収するかもしれない;そして私たちはそれにクレームを提出しなければならない。私たちが適用された法律と法規を遵守できなかったことは、私たちがサービス支払いを受けることができなかったり、HRSA、Medicare、Medicaidのような州と連邦医療計画を取り戻すことができないかもしれない。以上のように,これらの法律や法規に違反するクレームを提出することは,監査や会社の制御フローで発見されれば,受け取った金,巨額の民事罰金の返還を招き,州や連邦医療保健計画から除外され,連邦虚偽請求法案や同様の法律に基づいて責任を負う可能性がある。過剰金の存在が確認されていない60日以内にHRSAとMedicareまたはMedicaid計画に報告して多額の支払いを返金することができず,虚偽請求法案による責任を負う可能性がある。また、もし私たちが知らずに論争のある手配に関与していることが発見された場合、政府機関は、私たちが提供するサービスについて不当に請求を提出したことに対する私たちの責任を追及しようとするかもしれない。同業界の他の実験室と同様に,同社は現在HRSAの監査を受けており,保険がないと考えられる患者に提供される新冠肺炎検査の精算状況を決定している。会社はHRSAの監査役と十分に協力して、HRSAに返金する必要がある可能性がある任意の精算金額を含む任意の問題を解決している。HRSAが使用する方法および彼らが監査結果をどのように推定するか、および監査結果に基づく金額や決済に関する不確実性については、不確実性がある。HRSA監査の結果は、会社の業務、将来性、財務状況に重大な悪影響を及ぼす可能性がある。
41
付記8の“または有”を参照債務、引受、または事項より多くの情報を得るために。
私たちがテストした請求書と入金処理は複雑で時間がかかり、転送とクレーム収集のいかなる遅延も私たちの収入に悪影響を及ぼす可能性があります。
私たちのテスト費用は複雑で時間がかかって高い。料金手配と適用される法律によると、私たちは私たちのテストのために違う当事者に費用を徴収するかもしれません。これには、私たちの病院や他の医療機関の顧客の場合のように、Medicare、Medicaid、保険会社、および患者によって課金されることが含まれており、これらはすべて異なる課金要件を有する可能性がある。これらの請求要件の複雑さには、より長い入金期間および低い入金率が含まれているため、入金作業においてより大きなリスクに直面する可能性があり、これは、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
この課金プロセスを複雑にする要因がいくつかあります
私たちはこれらの請求書や入金機能を処理するための内部システムやプログラムを開発していますが、私たちのシステムやプログラムをさらに開発して、非病院や医療機関の顧客グループのテスト量を増やし、第三者支払者と保険·精算政策を確立することに集中する必要があり、これらのシステムや手続きがますます重要になるかもしれません。したがって、これらの複雑な請求書、およびテスト支払いの獲得に関する不確実性は、私たちの収入とキャッシュフロー、私たちが利益を達成または維持する能力、および私たちの運営結果の一貫性と比較可能性に悪影響を及ぼす可能性がある。また、私たちのテストクレームが支払者にタイムリーに提出されなかった場合、または私たちが私たちの処理および請求機能を処理するために異なるサプライヤーに切り替えることを要求された場合、私たちの収入と私たちの業務は悪影響を受ける可能性があります。
リスクを規制する
マーケティング診断製品における法律、法規またはFDAの法執行裁量権の任意の変化、または私たちの法律または法規に違反する行為は、私たちの業務、将来性、運営結果、または財務状況に実質的な悪影響を及ぼす可能性があります。
診断製品マーケティングを管理する法律·法規は進化しており、極めて複雑であり、多くの場合、これらの法律·法規には重大な規制や司法解釈がない。FDA法の認可により,FDAは静注薬を含む医療機器に対して管轄権を有しているため,われわれの臨床実験室テストもある可能性がある。他の事項に加えて、FDAは、FDC法案及びその実施条例に基づいて、米国医療機器の研究、テスト、製造、安全、ラベル、貯蔵、記録保存、発売前許可又は承認、マーケティング及び普及及び販売及び流通を規制し、国内で流通された医療製品がその期待される用途に対して安全かつ有効であることを保証する。また,FDAは医療機器の輸出入を規制している。
FDAは医療機器および静脈内投与(我々の検査を含む可能性がある)を確保する法的権限を有しているが、その予期される用途に対して安全かつ有効であるが、FDAは従来、法執行自由裁量権を行使しており、FDA法案および法規におけるLDTに関連する適用条項は実行されておらず、LDTは特定のタイプの医療機器である。我々の検査は現在FDAの医療機器法規や適用されているFDC法案条項の制約を受けていないと信じている。しかしながら、FDAは、2023年10月に、現在の医療機器の枠組み下のLDTを規制するための提案された規則を発表し、このような診断テストに対する既存の法執行自由裁量政策を段階的に廃止することを提案した。この機関の提案は、LDT法執行政策の段階的淘汰プロセスが合計4年以内に段階的に行われることを想定しており、高リスクテストの上場前承認申請は3.5年前に提出されるが、発表される最終ルールでより多くの詳細を提供する予定である。FDAが2024年4月に最終的に提案ルールを決定する可能性(現在予測されているように)と,可能な訴訟がその機関がこのような行動をとる権力に挑戦する可能性は,現在のところ確定していない。影響を受けた利害関係者は、後発開発途上国を両機関が監督する協調的なパラダイムを構築するために、包括的な立法解決策を推進し続けている
42
提案されたFDA行政行動を実施するのではなく、FDAとCMSは、業界と患者がいくつかの診断テストを得る機会を乱す可能性がある。
私たちは現在私たちのテストをLDTに商業化しているにもかかわらず、私たちのテストは将来的にFDAによってより厳しい規制を受けるかもしれない。例えば,FDAは我々の評価,すなわち我々のテストがLDTの定義に属することに同意しない可能性があり,我々のテストを医療機器として規制したり,提案されたルールを医療機器として規制したりすることを求めている。
また,国会議員は数年間利害関係者と協力し,LDTを含む体外臨床試験の規制を改革する可能性のある法案を検討してきた。例えば、今国会審議のために起草して再提出されたように、チェックが正確で先端的なIVCT発展法案や有効法案は両党と両院の支持を得てきた。有効な法案は、“体外臨床試験”という用語を法律として編纂し、新しい医療製品カテゴリを作成し、それを医療機器から分離し、その中に現在規制されている静脈注射用薬とLDTを含む。この有効法案はまた、実験室と病院のための新しいシステムを作成し、テストをFDA承認に電子的に提出し、FDAがこのようなテストを承認するのに要する時間を減少させ、患者が現在満足されていない需要を満たすために、診断テストの開発を加速するための新しい計画を構築する。
この有効な法案が現在の形で国会で可決されるのか、総裁·バイデン氏が署名して法律になるのかは不明だ。FDAが行われている通知および意見規則制定プロセスによってLDT法規を最終的に決定するか、または連邦政府のLDTに対する法規を改革するために有効な法案または他の立法が通過されない限り、FDAが将来どのように私たちのテストを規制する可能性があり、どのようなテストおよびデータが必要な承認または承認をサポートする必要があるかは未知である。
もし議会が体外診断を規範化するための全面的な立法を公布した場合、またはFDAがLDT医療機器要求を実行する提案を最終的に決定した場合、またはFDAが我々の評価に同意しない場合、すなわち私たちのテストがLDT上場の基準に適合している場合、登録および上場、医療機器報告、品質管理を含む様々な規制要求の強制執行を受ける可能性があり、既存のテストおよび私たちが開発する可能性のある新しいテストのために発売前の承認または承認を得ることを要求される可能性があり、必要な承認または承認を得るまで、私たちのテストの販売を停止させる可能性がある。発売前の審査過程は長く、高価で、時間がかかって予測できないかもしれない。また、発売前の承認を得ることには、臨床試験の成功などが含まれる可能性がある。臨床試験は大量の時間と現金資源を必要とし、そして高度なリスクの影響を受け、遅延に遭遇し、試験を完成できなかった或いは思わぬ或いは負の結果を得るリスクを含む。上場前の承認または承認および/または上場前の臨床試験を要求されると、開発コストが大幅に増加する可能性があり、私たちが開発する可能性のある任意の新しいテストの導入が遅れる可能性があり、既存のテストの販売が中断または停止する可能性があります。これらの結果のいずれも、私たちの収入を減少させたり、コストを増加させたりして、私たちの業務、将来性、運営結果、または財務状況に重大な悪影響を及ぼす可能性があります。さらに、承認または承認されたラベルクレームは、私たちの現在のクレームと一致しないかもしれないし、私たちの検出を継続して採用して精算することを支持するのに十分ではないかもしれません。例えば、FDAが私たちのテストを調査的にマークすることを要求した場合、またはFDAが私たちが行うラベル宣言が限られていることを許可した場合、注文レベルが低下する可能性があり、精算が悪影響を受ける可能性がある。したがって,我々は著しく増加した開発コストと,既存のテストや我々が開発可能なテストから余分な収入が生じる遅延を経験する可能性がある.
また,我々はCLIAの法規やガイドラインに基づいて我々の製品で使用されているすべての材料の資格認証を行っているが,FDAは法規や指導文書を発行し,テストを実行するために必要な材料を購入する能力に影響を与えることができる。もし私たちがサプライヤーから入手し、私たちのテストで使用する任意の試薬が将来の規制行動の影響を受ける場合、私たちの業務は、私たちの製品との試験に必要な試薬の購入を制限、制限、または禁止することを含む、テストコストを増加させるか、延期するか、制限し、または禁止することを含む悪影響を受ける可能性がある。
警告状、民事罰金、禁止、刑事起訴、リコールまたは差し押さえ、運営制限、運営の一部の一時停止または完全閉鎖、運営の拒否または挑戦許可または承認申請、および重大な負の宣伝を含む、適用可能なFDA要件を遵守しないことは、FDAの一連の法執行行動を引き起こす可能性がある。
もし私たちが適用された連邦、州、現地、そして外国の実験室の許可要求を守らなければ、私たちはテストを実行する能力を失い、私たちの業務に実質的な中断をもたらすかもしれない。
著者らはCLIAを守らなければならない。これは連邦法律であり、すべての実験室検査のために品質標準を確立し、患者結果の正確性、信頼性と適時性を確保することを目的としている。CLIAは私たちが行った実験室テストカテゴリに特定の証明書を持ち、人員資格、施設管理、能力テスト、品質管理、品質保証と検査において様々な基準を遵守することを要求している。私たちは連邦と州医療保健計画と多くの個人第三者支払者に私たちのテストの費用を受け取る資格があるCLIA認証が必要だ。カリフォルニア州エルモント、テキサス州オーウェン、マサチューセッツ州ニデム、アリゾナ州フェニックス、ジョージア州アルファレイタ、ニューヨークの実験室でテストできるCLIA認証を取得しました。
43
また,われわれの実験室でCAP認証を通過させることを選択した。CMSはCAP標準はCLIA法規と同等或いは更に厳格であると考え、そしてすでにCAPを公認の認証組織として許可した。CAPが認められた実験室はCAPによる検査ではなく,CMSによる検査である。われわれはCAP認証であるため,CLIAを遵守しているとも考えられる。そのほか、アメリカ以外のいくつかの国家は臨床実験室がその公民から抽出したサンプルを検査することを許可する条件としてCAP認証を要求した。CAP認証を保持できなかったことは,われわれのテストの販売とわれわれの運営結果に実質的な悪影響を及ぼす可能性がある。
私たちはまたカリフォルニア州でテストの免許証を持つことを要求された。カリフォルニア州の法律はエルモントの臨床参考実験室での日常動作のために標準を制定し、人員に必要な訓練と技能、品質管理と能力テスト要求を含む。また、私たちが受け取ったテストサンプルはニューヨークから来たので、ニューヨーク州衛生局(DOH)からカリフォルニア実験室の州実験室許可証を取得しました。ニューヨーク州の実験室法律法規はCLIAと同じかそれ以上である。また、取締役実験室はニューヨーク保健省が発行した許可種別の資格を持っていなければならない。
カリフォルニア州とニューヨーク州の実験室法律法規によると、現場定例検査と苦情駆動の検査を受けなければなりません。カリフォルニア州またはニューヨーク州の要求に違反していることが発見された場合、カリフォルニア公共衛生部またはニューヨーク州衛生部は、それぞれ、我々の許可証または実験室許可証を一時停止、制限または取り消し(カリフォルニアでは、許可証を取り消した後2年以内に個人または実体所有、経営または指導実験室を排除することができる)、民事罰金を評価するか、または具体的な是正行動計画、および他の制裁措置を実施することができる。このような行為は、私たちの業務に実質的な負の影響を与えるために、私たちが検出する能力を提供することを禁止または制限するだろう。
さらに、いくつかの他の州は、これらの州のサンプルをテストするために、州外実験室許可証を維持したり、特定のテストに基づいて承認を得たりすることを要求している。将来、より多くの州が似たようなライセンス要件を採用するかもしれないが、これは私たちがこのような司法管轄地域での私たちの業務を修正、延期、または停止することを要求するかもしれない。私たちはまた、外国の管轄区域の規制を受けており、私たちがテストの国際的な使用を拡大することを求めている場合、あるいは私たちが業務を行っている管轄区域が新しい許可要件を採用したり、修正されたライセンス要件が採用されたりすれば、この規定が増加することが予想されます。外国の許可要求は、ある司法管轄区でこれらのテストを提供するために、あるいは私たちがテストに必要な人体血液や他の組織の輸送を制限するなど、他の制限を加えることができるように、私たちのテストを審査し、修正する必要があるかもしれません。これは、アメリカ国外でテストを提供する能力を制限するかもしれません。しかも、新しい管轄区域で許可証の要求を遵守することは高価で時間がかかる可能性があり、私たちに重大で予期しない遅延を受けることができる。
適用される臨床実験室ライセンス要件を遵守できないことは、取り消し、制限または免許取り消し、方向性是正計画、現場監視、民事罰金、民事禁止訴訟、刑事制裁、MedicareとMedicaid計画から除外され、重大な負の宣伝を含む一連の法執行行動を招く可能性がある。CLIA、その実施条例、または臨床実験室免許を管理する国または外国の法律または法規に基づいて実施される任意の制裁、または私たちのCLIA証明書または任意の他の必要なローカル、州または外国免許または認証を更新することができないことは、私たちの業務、財務状況および運営結果に重大な悪影響を及ぼす可能性がある。この場合、私たちの研究室を再コンプライアンスさせることができても、私たちはそうする過程で巨額の費用と収入損失を生じるかもしれない。
私たちのテストと分析に関する情報は、私たちは広範な法的要求の制約を受けており、これらの要求を守らないいかなる行為も重大な処罰を招き、私たちの名声を深刻に損害し、私たちの業務を深刻に損なう可能性がある。
当社の業務は、HIPAA、HITECH、および同様の州法律、および患者の健康情報の収集、伝播、使用、アクセス、秘密および安全を管理する消費者保護法律および法規を含む、個人情報のプライバシーおよび安全を保護する連邦および州法律を遵守します。また、連邦と州政府は、医療記録や医療情報のプライバシーや安全をさらに保護する新しい法律や法規を定期的に審議している。また、最近の消費者情報の不正伝播を招くデータ漏洩の宣伝が増加するにつれ、連邦や州政府は、影響を受けた顧客に情報を迅速に開示するなど、企業がデータ漏洩に遭遇した場合に講じなければならない行動を規範化するために、法律を制定したり、制定することを検討している。連邦貿易委員会と各州の総検察長はまた、連邦貿易委員会法案と類似の州法律に基づいて、不公平および/または詐欺的な行為ややり方を理由に、法執行行動を提起し、いくつかのデータ漏洩事件を起訴した。データ漏洩通知法以外に、いくつかの州は法規と規則を公布し、企業がそれが持っているあるタイプの個人情報を合理的に保護すること、あるいは他の方法である特定の個人情報データの安全要求を遵守することを要求した。私たちはすべての個人情報を全面的に保護し続け、このような情報の保護に関するすべての適用法律を遵守するつもりです。
個人情報の機密性および完全性を保護するための適切なセキュリティ対策が実施されていないか、またはこれらのシステムの任意の違反または他の障害は、不正アクセス、操作、開示、またはこれらの情報の損失をもたらす
44
私たちがこのような法律を守らないようにするかもしれない。HIPAAとHITECHの要求を守らない罰は遵守しないことにより大きく異なり,民事,金銭,刑事罰が含まれる可能性がある.
EUはすべてのEU加盟国に適用されるGDPRを正式に採択した。GDPRはEUで欧州住民の個人データを受信または処理する会社に厳しい新しいデータ保護と運営要求を提出し、データ保護規則に違反した会社に巨額の罰金を科す。それは個人データを処理する上での私たちの責任と責任を増加させ、私たちはGDPRに遵守することを保証するために追加的なメカニズムを維持する必要がある。GDPRは複雑な法律であり、監督管理ガイドラインはまだ発展中であり、どのようにGDPRを臨床研究に応用し、敏感な個人データを収集、処理と保存するかについての指導意見を含む。また、欧州連合内の多くの国は、臨床研究や他の健康に関する情報分野を含むGDPRが国家差を可能にする重要な分野の補足データ保護立法を起草している。さらに、2021年、イギリスのGDPR規則が施行された。法律上のこのような変化は私たちのコンプライアンスコストを増加させ、より大きな法的リスクをもたらすかもしれない。2020年7月16日,欧州連合最高裁判所(略称CJEU)はこの事件に対して記念碑的な意見を発表したマクシミリアン·シュレムスはFacebookを訴えた(ケースC-311/18)、またはSchrems II。この判決は、EU加盟国と米国との間のいくつかのデータ転送メカニズムに疑問を提起した。CJEUは欧州最高裁であるSchrems IIこの決定は,データ輸入業者が米国国家安全法の業務への負担を評価することを増加させているが,EUデータ保護当局の将来の行動はこれほど早い時期には予測が困難である。したがって、EUのどのようなデータ転送も、1つ以上のEU加盟国によって停止されるリスクがある。個人データをEUから私たちのアメリカに移すことを要求する契約手配は、より厳格な審査と評価が必要になりますSchrems IIまた、個人データの国境を越えた移動に悪影響を与えたり、コンプライアンスコストを増加させたりする可能性がある。
さらに、カリフォルニア州(私たちの臨床実験室がある)のような多くの州では、CMIAのような同様のプライバシー法律および法規が実施されており、それらは、患者の健康情報および他の個人情報の使用および開示に制限的な要件を加えている。違反者に罰金と罰を加えるほか、いくつかの州法は、自分の個人情報が乱用されたと思う個人に個人訴訟権利を提供している。例えば、カリフォルニアの患者プライバシー法では、罰金は最大25万ドルに達し、被害者側が損害賠償を要求することを許可すると規定されている。CMIAのほか、カリフォルニア州ではCCPAが公布され、2020年1月1日に施行された。CCPAは、GDPRのいくつかの重要な条項を反映しているので、米国が発行したGDPRに類似した最初のプライバシー規制として記述されている。CCPAはカリフォルニア州がカバーする企業のために新しいプライバシーフレームワークを構築し、方法は個人情報の定義を拡大し、カリフォルニア住民のために新しいデータプライバシー権を構築し、未成年者から個人データを収集するために特別な規則を実施し、CCPAに違反する行為及び合理的なセキュリティ手続きとやり方を実施できなかった企業のために新しい、深刻な法定損害賠償フレームワークを作成することである。さらに、CPRAは2023年1月1日に全面的に施行された。CPRAはCCPAを大幅に修正し、拡大し、さらなる不確実性、遵守のための追加コストと費用、および遵守しない追加的なダメージと責任を招く可能性がある。他の態様では、CPRAは、CRPAおよびカリフォルニア州のプライバシー権の管理および実行を担当する新しい規制機関であるCPPAを確立する。CPPAは罰金を徴収して他の法執行行動を提起する権利がある。CPRAは、私たちまたは私たちの協力者およびビジネスパートナーの運営に影響を与え、新しい規制要件を適用し、コンプライアンスコストを増加させる可能性があります。テキサス州、バージニア州、コネチカット州、ユタ州、コロラド州はCCPAとCPRAのような独自の消費者プライバシー法を公布し、これらのすべての法律は2023年に異なる時期に施行された。他の州も似たような立法を考慮しており、遵守の複雑さ、コスト、そしてリスクを増加させる。GDPRおよびCCPAと同様に、これらの州の多くの法律は、自然人を識別するために使用されることができる医療または健康データ、遺伝子データ、および生体認識データを“敏感データ”に分類し、これらのデータを処理または収集するためには、追加のコンプライアンス義務を必要とする。
連邦と州法律の相互作用は裁判所と政府機関の異なる解釈を受ける可能性があり、複雑なコンプライアンス問題をもたらし、私たちを追加的な費用、不利な宣伝、責任に直面させる可能性がある。また,規制機関のプライバシー問題への関心が高まっていることや,個人情報保護に関する法律法規が拡大し複雑になっていることにより,我々の業務に対する潜在的なリスクが悪化する可能性がある.また,米国,ヨーロッパ,その他では,消費者と健康に関するデータ保護法の解釈,適用,相互作用は不確実で矛盾しており,変化していることが多い。したがって、法律の解釈と適用は私たちの現在の接近と一致しないかもしれない。しかも、このような法律とその解釈は絶えず変化しており、時間の経過とともにもっと厳格または包容的になるかもしれない。例えば,健康情報プライバシーへの懸念が高まっており,最近では連邦政府に指導意見の発表を促し,彼らが施行する法律や法規の範囲を新たに広げている。これらの法律または任意の新しい法律を遵守するか、またはその適用の解釈は、大量の時間および大量のコストに関連する可能性があり、または私たちの業務に不利になる可能性がある方法で私たちの業務慣行およびコンプライアンス手順を変更することが求められています。私たちは、現在または業務を計画しているすべての司法管轄区域で異なるプライバシーおよびセキュリティ要件を獲得または遵守することができない可能性があり、これらの要件のいずれかを遵守しなければ、重大な民事または刑事罰を招き、私たちの名声に実質的な損害を与え、私たちの業務に実質的な悪影響を与える可能性がある。
45
カリフォルニア州、ニューヨーク州、マサチューセッツ州を含む多くの州でも遺伝子テスト、インフォームドコンセント或いはその他のプライバシー法が実施され、具体的な患者の同意要求といくつかのテスト結果を保護する要求が規定されている。規制機関の遺伝子プライバシー問題への関心が高まっていることや、個人情報保護に関する法律法規が拡大し、より複雑になっていることに伴い、これらの私たちの業務に対する潜在的なリスクが悪化する可能性がある。
遺伝情報の使用に関する倫理,法律,社会問題は,我々のテストへの需要を減らす可能性がある。
遺伝子検出はプライバシーや結果情報の適切な使用に関する倫理,法律,社会問題を引き起こす。社会的または他の目的のために、政府当局は、遺伝情報や遺伝子検出の使用を制限または管理したり、特定の疾患の遺伝的感受性検出、特に治癒できない疾患の使用を禁止したりすることができる。同様に,これらの懸念は,患者が使用を拒否したり,医師が許可してもこのような遺伝子テストを注文したくない可能性がある。これらと他の道徳、法律、そして社会的懸念は、市場が私たちのテストに対する受け入れと採用を制限したり、私たちのテストの潜在的な市場を減少させたりする可能性があり、いずれも私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性がある。また、カリフォルニア州は“遺伝子情報プライバシー法”を公布し、消費者に直接向けた遺伝子検査会社にプライバシー要求を加えることで、患者と医師の遺伝子検査に対する全体的な議論を変える可能性があり、より広い範囲で消費者のこのような検査に対する興味を低下させる可能性がある。
私たちは規制の厳しい産業で事業を展開している。私たちのビジネスに関連する多くの法規や法規を遵守することは高価で時間がかかり、私たち、私たちのコンサルタント、またはビジネスパートナーのいかなる守られていない行為も重大で実質的な処罰を招く可能性があります。
私たちの業界と私たちの運営は様々な連邦、州、地方、外国の法律と法規によって厳格に規制されており、私たちが運営する規制環境は将来的に重大で不利な変化が生じる可能性がある。これらの法律は現在
46
遺伝子検査産業は現在政府によって高度に検討されている。OIGおよび複数の州の総検察長は、様々な癌遺伝子検出詐欺計画について詐欺警報を発表し、司法省は、遺伝子テストおよび他の実験室を含む様々な個人および実体に関連する様々な個人および実体を発表し、彼らを治療することなく多くの患者の遺伝子テストを行う医師と、電話販売電話、公共活動の屋台、健康博覧会、および戸別訪問を通じて遺伝子テストの第三者を手配するように命じた。そして,これらの個人はMedicare,TRICARE,他の第三者支払者から得られた収益を共有し,これらの活動は連邦反リベート法規や他の刑法に違反しているといわれている.このようなより厳しい規制審査は、私たちのテストサービスの需要を減少させたり、私たちの規制コンプライアンスコストを増加させたりする可能性があり、両方とも私たちの業務に実質的な悪影響を及ぼす可能性があります。
私たちの将来のビジネスの任意の成長、特に私たちの国際業務の増加、およびコンサルタント、ビジネスパートナー、他の第三者への持続的な依存は、これらの法律に違反する可能性を増加させる可能性があります。場合によっては、適用される規制機関または裁判所がそれを完全に解釈していないため、その条項には様々な解釈がある可能性があるため、これらまたは他の法律法規に違反するリスクがさらに増加する。私たちのPicture Geneticsシリーズの家庭遺伝子テスト製品は患者によるスクリーニングテストであり、私たちが医療保健提供者に直接提供する伝統的なテストサービスよりも、監督機関のより厳しい審査を受ける可能性がある。
我々は,これらの法律や法規を遵守するための政策や手順をとり,通常の業務過程で,これらの法律を遵守している場合の内部審査を行っている。私たちのコンプライアンスはまた適用される政府機関によって検討されている。従業員、流通業者、コンサルタント、および商業パートナーの不適切な行為を常に識別し、阻止することができるわけではなく、このような活動を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、または適用された法律または法規を遵守できないことによる政府の調査または他の行動または訴訟から私たちを保護することができない可能性がある。これらや他の法律や法規に違反して私たちに提起された訴訟は、たとえ私たちが弁護に成功しても、巨額の法的費用を招き、私たちの経営陣の業務運営への注意を移し、私たちの名声を深刻に損なう可能性があります。OIGが最近発表した諮問意見について、同社の子会社は、診断会社に適切な政府連絡先と自発的開示手続きを開始したことを通知した。同社は現在、その財務諸表に、この自主開示に関連する690万ドルの負債を推定し、記録している。この推定は不正確である可能性があり、実際の負債金額はこの推定よりも低いか、またはこの推定を大きく超える可能性がある。もし私たちの業務が、私たちの従業員、コンサルタント、およびビジネスパートナーの行為を含めて、これらの任意の法律および法規(上記の自発的開示手続きに関連するものを含む)に違反していることが発見された場合、私たちは、行政、民事および刑事罰、損害賠償、罰金、個人監禁、連邦医療計画から除外され、私たちが受け取った支払いの払い戻し、および私たちの業務を削減または停止することを含む適用処罰を受ける可能性があり、これは、私たちの名声、業務、将来性、または運営結果に実質的な損害を与える可能性があります。
私たちは私たちの業務慣行を変更して、罰金を払って、巨額の費用を発生させたり、訴訟や政府の調査で損失を受けることを要求されるかもしれません。
私たちの正常な業務過程で、私たちは時々アメリカまたは外国の司法管轄区域で様々な事項について訴訟や政府調査を受けており、規制、知的財産権、製品責任、反独占、消費者、虚偽クレーム、告発者、Qui Tam、プライバシー、反賄賂、反賄賂、環境、商業、証券、雇用訴訟とクレーム、および私たちの業務行為によって引き起こされる可能性のある他の法的訴訟を含むが、これらに限定されない。上述したように、私たちは現在HRSAの監査を受けており、自発的な開示手続きを開始した。私たちの製品やサービスに関する活動はアメリカで広く規制されています
47
外国司法管轄区。私たちの業界の多くの会社のように、私たちは正常な業務過程で政府当局からの問い合わせ、伝票、民事調査要求またはCID、および他のタイプの情報請求を受けた。先に開示されたように、私たちは、医学的に不必要な実験室検査、実験室で測定された不当な請求書、および反リベート法規およびスタッカー法に違反して受信または提供された報酬に関する、“虚偽請求法案”に従って米国司法省から発行されたCIDを受け取った。このCIDは、CIDで指定されたいくつかのクライアントに関する情報およびレコードを提供することを要求する。私たちが以前に提出した文書で開示されているように、私たちはまた、CID要求で提出されたテーマと、私たちが提出した2018年から2020年までの“取引法”報告書における報告書の関連開示と収入に関連した非公開の正式な調査を行っていることを知っている。私たちは米国証券取引委員会や米司法省と十分に協力し、彼らの要請に迅速に対応している。調査がいつ解決されるか、調査の結果、あるいは私たちの業務への潜在的な影響は、最終的には私たちが予想していたよりも大きくなる可能性があると予測できない。また、政府の調査と訴訟は、通常、私たちの核心業務に対する私たちの管理チームと資源の注意をそらす可能性がある。したがって、私たちの管理チームがこれらの問題に応答する時の時間と注意力は、彼らが私たちの業務に投入する時間を制限する可能性があり、私たちはまた、これらの問題に重大な費用や損失を生じる可能性がある。このような問題のため、私たちはまた私たちの業務行動を変更したり、他の処罰を受けることを要求されるかもしれない。これらのいずれかは、私たちのビジネス、将来性、名声、および運営結果に悪影響を及ぼす可能性があります。
医療政策の変化は、最近公布·提出されたアメリカ医療システムを改革する新しい立法を含み、私たちの業務、運営と財務状況に重大な損害を与える可能性がある。
ACAは医療が政府や個人支払者が資金を提供する方式に多くの実質的な変化を行っている。ACAはまた,支出がある目標を超えると,医療保険支出の1人当たり成長率を低下させるメカニズムを導入している。このようなどんな削減も私たちがテストした精算支払いに影響を及ぼす可能性がある。ACAにはまた、連邦や州医療計画の登録、精算、詐欺、乱用を管理する条項が含まれており、これらの条項は現在予測できない方法で私たちの業界と私たちの運営に影響を及ぼすと予想される。
2014年4月,連邦医療保険CLFS下の臨床実験室サービスの支払い方式の重大な改革を含むPAMAが国会で可決された。PAMAによると、ある臨床実験室は定期的にCMS個人支払人にそのテストの支払率と支払量を報告しなければならず、必要な支払い情報を報告していない実験室は巨額の民事罰金を受ける可能性がある。CDLTの医療保険精算は,個人支払者がこれらのテストに支払った重み中央値に基づいており,個人支払者の支払いレベルが過去よりも重要となっている。したがって、将来の医療保険支払いは、より頻繁に変動する可能性があり、個人支払者が診断テストの価値、および任意の特定のテストの個別価値を全体的に認めることを望むかどうかに依存する。このような支払いシステムは、私たちが開発する可能性のある現在または未来のテストを含めて、私たちのテスト料率に与える影響は不確定だ。
そのほか、州立法機関はますます立法を通じて、臨床実験室と病理サービスを含む医療保健サービスコストを制御するための法規を実施している各国は様々な策略を採用して支出の増加を制御することが可能であり、競争を促進することに限定されないが、監督管理による価格の低下、支出目標の設定、支払い改革の推進を含む。これらのコスト制御戦略は、あまり有利ではない収益率をもたらす可能性があり、場合によっては、いくつかの州でビジネスを変更または拡大する能力に悪影響を及ぼす可能性があります。
また,米国の医療業界における連邦や州政府の役割拡大が我々の業務に与える影響は不確実であり,個人福祉を拡大しながら医療コストを低減する社会,政府,その他の圧力を含む。将来のどんな変化や計画も、私たちの業務、財務状況、運営結果、およびキャッシュフローに大きな悪影響を及ぼす可能性があります。
法律法規またはその適用の変化は、私たちの業務、財務状況、および経営結果に悪影響を及ぼす可能性があります。
臨床実験室検査業界は厳格な監督管理を受けており、適用する監督管理、監督管理、認可、登録を守らなければ要求できるかもしれず、著者らの業務、財務状況と運営結果に不利な影響を与える可能性がある。特に、臨床診断検査を管理するマーケティングや研究の法律法規は極めて複雑であり、多くの場合、これらの法律法規は明確な規制や司法解釈がなく、これらの法律違反が発見される可能性が高いリスクを増加させる。
また、遺伝子検査業界は全体として増加している業界であり、HHSやFDAなどの規制機関は、この分野の新たな発展をより厳しく検討したり、米国議会でそうしたりする可能性がある。2017年以降、国会は既存の医療機器規制の枠組みとは独立したLDTやIVD規制の枠組みを作るための立法を進めてきたが、最近の勢いは“有効法案”という包括的な法案をめぐって蓄積されているようだ。有効な法案は、医療機器とは別の新しい医療製品カテゴリを作成するために、“体外臨床試験”という用語を法律として編纂する
48
このようなすべての製品がFDAの規制範囲に組み込まれている。この有効な法案が現在の形で国会で可決されるのか、総裁·バイデン氏が署名して法律になるのかは不明だ。今国会は再び“有効法案”を提出したが、FDAは2023年10月にLDT提案規則を公表し、この規則は現有の医療機器フレームを実験室で開発した製品に応用し、これは再び利益関係者の呼びかけを引き起こし、更に的確な方法を採用し、連邦政府の臨床診断テストに対する監督管理を現代化することを要求した。この分野での国会の行動は、FDAが最近提案されたルール制定の需要を達成する代わりに依然として可能性がある。
また、最近、米国連邦と州政府は、Stark法律、連邦反リベート法規、連邦虚偽請求法案、および州相当法律を含む法律と法規によって管轄されている推薦源への支払いの規制、審査、執行を強化する傾向がある。例えば,EKRAは2018年10月に可決され,オピオイドリハビリテーションや患者やコミュニティ治療を促進する物質として使用されている疾患予防法案の一部である。EKRAは、特定の例外がない限り、直接的または間接的、公開的、隠蔽的、現金または実物であっても、“医療福祉計画”(民間保険会社を含む)の支払いを転用または誘導するための実験室検査(および他の医療サービス)の代わりに、または故意に支払いまたは提供されるか、または任意の報酬を誘致または収受する行為を刑事罰に処する。私たちと医師、販売代表、病院、顧客、または他のいかなる当事者との関係が、このような法律の審査を受けないか、または規制の挑戦に耐えないことを保証することはできません。何らかの理由で制裁が実施されれば、EKRA下の制裁は私たちの業務にマイナス影響を与える可能性がある。
もし私たちが運営に使用している危険な材料が汚染や損傷をもたらしたら、私たちはそれによる損害に責任を負うかもしれない。
私たちの業務は、化学品、生物製剤および化合物、ならびに血液および他の組織サンプルを含む、規制された医療廃棄物、危険廃棄物および生物学的危険廃棄物を使用する必要がある。私たちは連邦、州、地方法律法規の制約を受けてきて、これらの法律と法規はこれらの危険材料と他の指定廃棄物の使用、貯蔵、運搬と処分を管理している。私たちは通常、許可されたまたは他の合格した外部サプライヤーを使用してこれらの廃棄物を処理するが、もし私たちまたは他の人の業務運営または他の行為が危険材料に曝露されて環境汚染や人身被害を招いた場合、適用される法律および法規は私たちに損害と罰金の責任を要求するかもしれない。私たちは汚染や傷害のリスクを除去することはできません。私たちに与えられたいかなる損害や傷害に課せられたどんな責任も、私たちの資源や任意の適用された保険範囲を超える可能性があります。このような保険カバー範囲を確保し、これらの法律法規を遵守するコストは将来的により巨大になる可能性があり、遵守しない場合は巨額のコストおよび他の業務と名声の結果を招く可能性があり、いずれも私たちの経営業績にマイナスの影響を与える可能性がある。
改正された1940年の“投資会社法”によれば、私たちは投資会社とみなされ、適用された制限は、現在行われている業務を継続できず、私たちの業務、財務状況、経営結果に大きな悪影響を及ぼす可能性があります。
1940年の“投資会社法”または“1940年法令”によると、1940年の法令によれば、(1)1つの会社が主に証券投資、再投資または取引業務に従事しているか、または(2)証券投資、再投資、所有、保有または取引業務に従事しており、かつ、その総資産(米国政府証券や現金プロジェクトを含まない)価値の40%を超える投資証券を所有または買収しようとしている場合、その会社は一般に“投資会社”とみなされる。私たちは私たちが“投資会社”だと信じていません。この用語は1940年法案のどの節にも定義されているので、私たちは投資会社とみなされないように、私たちの業務を展開しようとしています。しかし、私たちが投資会社とみなされている場合、1940法案は、私たちの資本構造と関連会社との取引能力の制限を含む制限を加えており、現在行われている業務を継続できず、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性があります。
我々の中国における合弁企業は、中国の法律法規および米国と中国の関係変化のリスクと不確定要素の影響を受けている。もし中国政府が私たちの合弁企業が適用された法規に適合していないと認定すれば、私たちの業務は悪影響を受ける可能性がある。もし中国人民Republic of Chinaの監督管理機関が中国での業務確立構造と関係の合意が中国の外国投資に対する監督管理制限に適合していないと認定すれば、私たちは厳しい処罰を受けるかもしれない。
現指導者の中国の指導の下で、政府は対外貿易と投資の奨励を含む経済改革政策を推進してきた。しかし、中国政府がこのような政策を推進し続ける保証はなく、このような政策が成功的に実施される保証はなく、このような政策に大きな変化が生じない保証もなく、このような政策が中国での協力や活動に有利になる保証もない。中国の法体系は、特に外商投資と対外貿易の面で予測できないかもしれない。米国政府は中国とともに対外貿易政策の大幅な変更を呼びかけ、将来的にいくつかの中国商品の関税をさらに引き上げることを提案し、提案した。報復として、中国は米国商品への関税を引き上げた。また,中国の立法機関は国家安全法を可決し,香港の過去のやり方を根本的に変えた
49
1997年にイギリスがこの領土を中国に移管して以来、香港は管理状態にある。この法律は北京中央政府の香港に対する権力を増加させ、香港住民の公民の自由を制限し、香港にいる企業が業務を継続したり、以前のように業務を継続したりする能力を制限する可能性がある。米国務省は、米国は香港が中国に対して重大な自治権を持つとは考えていないと表明した。米国務省は最近、中国の香港管理に関する制裁を採択した。米国の貿易政策のいかなるさらなる変化も、中国を含む影響を受けた国の報復行動を引き起こし、貿易戦争を招く可能性がある。米国と中国関係のいかなる規制変化や変化も、私たちの中国でのパートナー関係や活動に重大な悪影響を及ぼす可能性があり、それによって私たちの業務や財務状況に重大な損害を与える可能性がある。
また、中国の法律、規則、法規の解釈と応用には不確実性があり、中国での合弁企業の有効性と実行力を管理する法律、規則、法規を含むがこれらに限定されない。多くの法律法規が比較的新しいため、多くの法律法規と規則の解釈は常に統一されているわけではない。また、法規や条例の解釈は、国内の政治的議題を反映した政府政策に支配される可能性がある。既存の法律または既存の法律に基づく契約の実行は不確定で散発的である可能性がある。中国の監督管理当局は私たちの中国の合弁企業が中国の法律、法規あるいは法規に違反していないと認定しないことを保証することはできません。もし中国の監督管理部門が私たちの現在の合弁企業あるいは私たちが将来締結する可能性のあるいかなる合弁企業が適用される中国の法律、規則または法規に違反していると認定すれば、私たちの中国での合弁企業は失効したり、強制的に実行できなくなる可能性があり、これは私たちの運営に重大な悪影響を及ぼすだろう。中国は法律や法規に違反した行為を処理する上で広範な裁量権を有しており、罰金の徴収、営業許可証の取り消し、その他の許可証を含め、必要なコンプライアンス行動を要求している。特に、関連政府機関が発行又は付与した許可証及び許可証は、今後他の規制機関によって取り消される可能性がある。私たちは既存または新しい中国の法律や法規の解釈が私たちの業務に与える影響を予測できない。このようなまたは類似した行動は、私たちの運営を大きく混乱させたり、私たちの運営を大幅に制限したりする可能性があり、これは私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。米国政府が中国の取引や投資に追加的な制限や制限を加えないことは保証できない。
私たちは海外腐敗防止法や他の反賄賂法に違反した悪影響を受けるかもしれない。
私たちの国際業務は、“海外腐敗防止法”と、私たちが業務を行っている米国の司法管轄区域ではない同様の反賄賂法律を含む様々な反賄賂法律によって制約されている。“海外腐敗防止法”は、会社およびその中間者が、業務を取得または保持するため、または任意の他の不正な利益を得るために、非米国または外国の官僚に不正な支払いを提供、支払い、または許可することを禁止する。これらの法律は複雑で影響が深く、私たちは将来、これらの法律またはこれらの法律またはその解釈の任意の変化に適合するために、私たちの1つまたは複数の接近法を変更することを要求されるかもしれない。
私たちは現在アメリカ以外で重要な業務に従事しており、将来的に私たちの国際業務を増加させる予定です。これらの行動は、政府病院のような米国以外の政府、外国の官僚、国有実体と付き合うことに関連する可能性がある。さらに、代理または請負者のような流通業者、他の商業パートナー、または第三者仲介機関を招聘したり、海外での私たちのテストを管理または販売するために合弁企業または他の手配を確立したりし、必要な許可、免許、および他の規制承認を得ることができる。このような第三者はいずれも私たちの代理人と見なすことができ、私たちは私たちが明確に権限を持っていなくても、実際にこれらの活動を理解していなくても、私たちの従業員やこのような第三者のいかなる腐敗や他の不法活動に責任を負わなければならないかもしれない。我々は“海外腐敗防止法”やその他の反腐敗法律の遵守を促進するために、合理的に設計された政策、プログラム、内部統制措置を制定し、これらの政策と制御を維持、実施、実行する上で高度な警戒を維持している。しかし、このような政策と統制は回避されたり無視されたりすることができ、私たちはこのような法律と法規を遵守することを保証できない。これらの法律に違反した行為やそのような違反に対する告発は、私たちの運営を混乱させる可能性があり、深刻な管理気晴らし、法的費用を含む重大なコストと支出に関連し、私たちの名声を損なう可能性がある。また,医療機器や製薬分野の他の米国会社も最近,“反海外賄賂法”違反により巨額の罰金や刑事罰に直面しており,我々が“海外腐敗防止法”や他の適用される反賄賂法に違反すれば,刑事や民事処罰,返還,その他の救済措置を含むこれらのタイプの懲罰を招く可能性もある。これらの結果のいずれも、私たちの業務、見通し、財務状況、または運営結果に実質的な悪影響を及ぼす可能性があります。
我々のサービスには,従業員,コンサルタント,サービスプロバイダまたはビジネスパートナーが公金を流用し,身分窃盗や他の同様の不正を行う可能性がある.
私たちの業務は、第三者になりすまして、または他の方法で彼らのデータまたは資金にアクセスするために使用される可能性がある個人および商業情報の使用および開示に関する。もし私たちの従業員、コンサルタント、サービスプロバイダ、または商業パートナーがこれらの資金またはデータを使用、変換、または乱用すれば、私たちはそれによって生じる任意の損害に責任を負う可能性があり、これは私たちの財務状況を損害し、私たちの商業的名声を損なうかもしれない。
50
私たちは連邦貿易委員会法案や他の広告真実性と消費者保護法違反の告発の悪影響を受けるかもしれない。
私たちの実験室サービス広告は連邦貿易委員会が施行した広告真実性法律と似たような州消費者保護法によって制限されています。連邦貿易委員会法によると、連邦貿易委員会は、他のものに加えて、(A)不公平な競争方法および商業にまたは商業に影響を与える不公平または詐欺的な行為またはやり方を防止する権利があり、(B)消費者を損なう行為のために金銭補償および他の救済を求める権利があり、(C)商業に従事する実体の組織、業務、やり方および管理に関する情報を収集して編集し、調査する権利がある。連邦貿易委員会は非常に広範な法執行権力を持っており、連邦貿易委員会法案や他の消費者保護法の実質的な要求を守らなければ、民事処罰、私たちの将来のサービスや製品の販売方法に影響を与える禁止、または刑事起訴を含む行政または司法処罰を受ける可能性がある。私たちのPicture Geneticsシリーズの消費者が始めた家庭遺伝子テスト製品を発売すると同時に、私たちはこれらの連邦と州の広告真実性法律によって制限される広告活動を増加させる予定です。実際にまたはこれらの法律を遵守しないと考えられるいかなる行為も、連邦貿易委員会または同様の州機関の調査をもたらす可能性があり、または個人原告の誤った広告の告発を招く可能性がある。私たちに対するこのような行動は、私たちの業務運営を混乱させ、私たちの名声を傷つけ、私たちの業務に実質的な悪影響を及ぼすだろう。
候補薬物開発に関するリスク
我々の候補薬物は開発の初期段階にあり、失敗や遅延があり、それによってその将来の商業生存能力に実質的かつ不利な影響を与える可能性がある。
我々の開発は早期段階にあり,1種の候補薬剤のみが臨床試験に入っている(FID−007)。一般に,市販候補薬の発売承認を得る前に,われわれの候補薬が患者において十分な安全性と有効性を有することを証明するために,前臨床試験や臨床試験を行わなければならない。失敗は開発や臨床試験過程のいつでも発生する可能性があり,われわれの将来の臨床試験結果は成功しない可能性がある。したがって、候補薬剤の上場承認または商業化能力を遅延または阻止する可能性があるという問題がある場合、候補薬剤の開発を継続するために追加の財務資源を使用することは慎重ではないと考えることができるかもしれない
我々が追跡した候補薬物は,上場承認に必要な安全性や有効性要求を証明できない可能性がある。
臨床試験はコストが高く、時間が長く、内在的なリスクが存在し、著者らはその安全性と有効性が適用された監督管理機関が満足していることを証明できない可能性があり、しかも永遠に監督部門の許可を得られない可能性があり、著者らのいくつか或いは任意の候補薬物を商業化することに成功できないかもしれない。
臨床開発費用は高く、時間がかかり、リスクが大きい。もしあれば、どんな臨床試験も計画通りに行われるか、予定通りに完成することは保証できません。1つまたは複数の臨床試験の失敗は、開発の任意の段階で起こる可能性がある。成功または臨床開発の即時完了を妨げる可能性があるイベントは、これらに限定されるものではない
51
もし私たちの1つ以上の候補薬が臨床開発に成功し、規制部門の承認を得ることができなければ、私たちに追加のコストをもたらしたり、収入を創出する能力を弱めるかもしれない。さらに、候補薬剤の生産または処方変更を行う場合、これらの新しい処方から得られた結果が以前の結果と一致することを示すために、追加の非臨床研究および/または臨床試験を行う必要があるかもしれない。臨床試験遅延はまた、候補薬物の特許保護の任意の期限を短縮する可能性があり、競争相手が私たちの前に製品を開発し、市場に出すことを可能にする可能性があり、これは候補薬物の商業化に成功する能力を弱める可能性があり、私たちの業務と運営結果を損なう可能性がある。
さらに、様々な理由により、臨床試験は、会社、そのような試験を行う機関のIRBs、データ安全監視委員会またはデータ安全監視委員会またはFDAまたは他の規制機関によって一時停止または終了される可能性があり、これらの要因は、規制要件または私たちの臨床規程に基づいて臨床試験を行うことができなかったこと、FDAまたは他の規制機関による臨床試験操作または試験場所の検査の実施による臨床休止、予見できない安全問題または副作用、研究薬の使用のメリットを証明できなかったこと、政府法規の変化、行政行為や臨床試験を継続するのに十分な資金が足りない。監督管理機関の潜在的な安全性とリスク問題を解決するために、さらには臨床試験が開始される前に臨床保留を行うことができ、試験期間中の任意の時間に一部或いはすべての臨床保留を実施することができる。また,我々は内部で何らかの類似した機能を果たしているが,CROと臨床試験地点により適切かつタイムリーな臨床試験を確保したいと考えており,これらのCROが承諾した活動について合意したいが,彼らの実際の表現への影響は限られている。
もし任意の候補薬物の臨床試験の完成或いは終了に遅延が発生した場合、これらの候補薬物の商業的将来性は損害を受ける可能性がある。そのほか、臨床試験を完成するいかなる遅延もコストを増加させ、製品開発と審査過程を緩和し、製品販売の開始と収入を創造する能力を脅かす。これらのいずれも、私たちの業務、財務状況、経営結果、および見通しに実質的な悪影響を及ぼす可能性がある。また、臨床試験の開始或いは完成遅延を招く多くの要素は、最終的に候補薬物の上場承認が拒否される可能性もある。
製品開発は長くて高価な過程に関連し、結果は不確定であり、早期臨床前研究と臨床試験の結果は未来の臨床試験結果を予測できないかもしれない。
臨床試験費用は高価であり,通常完成まで数年を要し,結果自体も確定していない。失敗は臨床開発過程のいつでも起こるかもしれない。臨床試験は否定的または不確定な結果をもたらす可能性があり、私たちまたは任意の現在または未来のパートナーは、追加の臨床試験または非臨床試験を行うことを決定または監督機関に要求する可能性がある
52
研究します。私たちは良好にコントロールされた臨床試験を通じて、私たちの候補薬物が異なる人々で使用されていることが安全で有効であることを大量の証拠で証明することを要求され、その後、私たちはその商業販売の市場承認を求めることができる。著者らの候補薬物の臨床前研究と早期臨床試験の結果はもっと大きな後期対照臨床試験の結果を予測できないかもしれない。早期臨床試験において有望な結果を示す候補薬物は、その後の臨床試験において依然として重大な挫折或いは失敗を受ける可能性がある。これまでわれわれの臨床試験は限られた数の臨床試験地点の少数の被験者で行われており,適応数は限られていた。我々が提案した適応でより大規模で制御された良好な試験を行わざるを得ず,これまでに得られた結果を検証し,任意の規制提出のさらなる臨床開発を支援する。生物製薬業界のいくつかの会社は高級臨床試験の中で重大な挫折或いは失敗を受け、原因は治療効果或いは不良安全性が不足であり、比較的に早い比較的に小さい規模の臨床試験で良好な結果を得たにもかかわらず。
さらに、私たちは時々私たちの臨床試験の中期または初歩的なデータを公表したり報告したりするかもしれない。例えば、私たちは以前に私たちの候補薬FID−007の中間データを発表し、本年度報告に含めた。我々がFID−007に報告した任意の中間データを含む、我々が行う可能性のある臨床試験の中期または予備データは、試験の最終結果を示すことができず、患者登録の継続およびより多くの患者データの取得に伴い、1つまたは複数の臨床結果が実質的に変化する可能性があるリスクに直面する可能性がある。一時データまたは予備データは依然として監査とチェック手続きを遵守しなければならず、これは最終データが一時データまたは予備データと大きく異なる可能性がある。したがって、最終データを得る前に、中期または予備データを慎重に見なければならない。
いくつかの場合、多くの要素のため、同じ候補薬物の異なる臨床試験間の安全性と有効性結果は有意差が存在する可能性があり、試験方案の変化、患者群の大きさとタイプの差異、投与方案と他の試験方案の差異と遵守及び臨床試験参加者の中退率を含む。したがって、私たちが行う可能性のある任意の臨床試験が一致または十分な有効性と安全性を証明するかどうか、上場承認を得て私たちの候補薬を販売するのに十分であるかどうかは分からない。
私たちが米国で開発、製造、または販売しようとしている任意の候補薬物は、開発、臨床前試験、臨床試験の性能、製造と承認後の商業化に関連する法規を含むFDAの広範な規制を受ける可能性があり、米国以外の広範な法規の制約を受けるであろう。これらと他の規制要件を満たすことは高価で、時間がかかり、不確定であり、予期しない遅延が生じる可能性がある。FDA承認を得るのに要する時間および任意の他の必要な薬品承認は、いかなる加速承認も含めて予測不可能であるが、通常は数年から数年を必要とし、永遠に得られない可能性がある。
私たちは米国以外の国で開発、製造、販売される任意の製品を望んでいるかもしれないし、これらの国での臨床試験、製造とマーケティング、定価、第三者清算などに関連する多くの外国の監督管理要求の制約を受けるかもしれない。外国上場承認手続きには、上述したFDA承認に関連するすべてのリスクと不確定性と、これらの外国司法管轄区の現地法規を満たすことによるリスクが含まれる。
薬品の発売許可を得るためには、各治療適応についてFDAと類似の監督管理機関に広範な臨床前と臨床データと支持情報を提出し、候補製品の安全性と有効性を確定する必要がある。上場承認を得るためには,通常製品の製造過程に関する情報を提出する必要があり,多くの場合,監督機関が製造,加工,包装施設の検査を行う必要がある。私たちの候補製品は有効ではないかもしれませんが、中程度の有効である可能性があり、または不良または予期しない副作用、毒性、または他の特徴を有することが証明される可能性があり、これらは、市場の承認または商業使用を阻止または制限することを阻止する可能性があり、または私たちまたは私たちの契約製造組織およびパートナーが製造適合性に欠陥があり、候補製品が承認されない可能性があります。また、私たちはどの司法管轄区域でもいかなる候補薬の発売承認も得ていません。私たちの既存の候補薬や将来開発を求める可能性のあるどの候補薬も決して上場承認を得られないかもしれません。
候補薬物は様々な原因で上場承認を得られなかったか、あるいは上場承認を遅延した可能性があり、以下のいずれか1つまたは複数の原因を含む
53
私たちが開発する可能性のある候補薬は、私たちまたは私たちの協力者がアメリカや他の国で製品を販売するために必要なマーケティング承認を得ないだろう。また,FDAによる治療製品の承認は米国以外の規制機関の承認を得ることは保証されておらず,その逆も同様である。治療製品が承認されても、このような承認は、指定された用途または適切な患者集団によって制限される可能性があり、これは、製品の潜在的市場規模を著しく縮小させる可能性がある。
FDAの505(B)(2)経路を用いて我々の候補製品の多くを開発する予定であり,これらの製品はそのナノ薬物送達プラットフォーム技術を用いて開発されている。このような経路がなければ、このような候補製品の開発は現在予想されている時間よりもはるかに長く、コストがはるかに高く、関連する複雑さやリスクもはるかに大きく、どうしても成功しない可能性がある。
FDAの505(B)(2)経路に基づいて,FID−007とそれが開発可能な他の候補薬剤を含む我々のナノ薬物送達プラットフォーム技術を用いて開発された候補薬剤を開発し,承認を求める予定である。もしFDAが私たちがこの規制経路を使用できないと判断した場合、私たちはFDC法案505(B)(1)条に従って“完全”または“独立した”秘密協定を通じて規制承認を求める必要があるだろう。これは私たちがより多くの臨床試験を行い、より多くの安全性と有効性データとその他の情報を提供し、監督部門が承認したより多くの基準を満たし、非臨床データを含む可能性がある。このような状況が発生すると、FDA承認を得るのに要する時間および財政資源、およびこれらのプロジェクトに関連する開発複雑性およびリスクが大幅に増加する可能性があり、これは私たちの業務や財務状況に実質的な悪影響を及ぼす可能性がある。
1984年の“薬品価格競争と特許期限回復法”は、非公式名称が“ハッジ·ワックスマン法”であり、“薬品価格競争と特許期限回復法”に505(B)(2)項が追加された。第505条(B)(2)条は、承認に必要な情報の少なくとも一部が、出願人又は出願人のための研究及び情報からではなく、出願人が参照権を得ていない場合に秘密協定を提出することを許可する。第505条(B)(2)NDA経路を用いて,我々の主要候補薬物FID−007の開発計画を加速させることができる。
FDAは過去数年で505(B)(2)条に基づいてますます多くの製品を承認してきたが,あるブランド製薬会社や他社は505(B)(2)条に対するFDAの解釈に反対している。FDAが505(B)(2)条の解釈に成功した場合、または現在利用可能な規制経路を変更するために国会で法規を修正した場合、FDAは505(B)(2)政策およびやり方を変更する可能性があり、これは、FDAが505(B)(2)条に従って提出した任意のNDAを承認することを延期または阻止する可能性がある。また、製薬業は競争が激しく、第505条(B)(2)項の国家薬品監督管理局は、第505条(2)で言及された先に承認された薬品の発起人の特許権を保護するために特別な要求を遵守しなければならない。私たちの1人以上の候補者に対して505(B)(2)条の規制経路を使用することができても、これが最終的により速い製品開発またはより早い承認につながることは保証されない。
さらに、FDAの505(B)(2)の経路に従うことができないことによるいかなる遅延も、新しい競合製品がその候補製品よりも早く市場に参入する可能性があり、これは、私たちの競争地位および将来性に大きな悪影響を及ぼす可能性がある。私たちの1つ以上の候補薬剤のためにFDAの505(B)(2)の経路に従うことが許可されても、これらの候補薬剤が商業化に必要な承認を得ることを保証することはできません。
もし私たちの候補薬物が承認されれば、私たちの商業成功は私たちの候補薬が医者、患者、第三者支払人、および医学界の他のメンバーで顕著な市場受容度を得ることに依存するだろう。
54
私たちの候補薬物が監督部門の承認を得ても、承認された製品は医師、第三者支払人、患者と医学界の他のメンバーの中で十分な市場受容度を得ることができない可能性があり、これは商業成功に重要である。承認された製品が十分な受容度に達していなければ、顕著な製品収入やどんな運営利益も生じないかもしれません。私たちが承認した候補薬の市場受容度は多くの要素に依存しています
著者らの候補薬物は不良副作用を招く可能性があり、その上場承認を延期或いは阻止し、承認されたラベルの商業イメージを制限し、或いは上場承認後に重大な負の結果を招く可能性がある(もしあれば)。
私たちの候補薬物による不良副作用は私たち、著者らの協力者或いは監督管理機関の中断、延期、或いは臨床試験の停止を招く可能性がある。これらの状況は、より厳格なラベルをもたらすか、またはFDAまたは他の規制機関の上場承認を延期または拒否する可能性がある。われわれの臨床試験あるいは著者らの協力者の臨床試験の結果は深刻かつ受け入れられない副作用を示す可能性があり,これらの臨床試験に参加した患者は思わぬ方法で反応する可能性がある。このような副作用はまた、患者が試験を完了する能力を募集したり、組み入れたり、あるいは潜在的な製品責任クレームを招く可能性がある。また,臨床試験の本質は潜在的な患者集団のサンプルを利用することである。私たちの候補薬のまれかつ重篤な副作用は、候補薬に接触した患者数が著しく増加した場合にのみ発見される可能性がある。
もし私たちの任意の候補薬物が発売許可を得て、私たち、私たちの協力者或いは他の人は製品或いは任意の他の類似薬物による不良副作用を発見したら、以下の任意の不良事件が発生する可能性がある:
55
さらに、私たちの候補薬物と性質的に類似している可能性のある任意の薬物による副作用は、私たちの候補薬物の発売承認を延期または阻止し、私たちの候補薬物の承認されたラベルの商業イメージを制限するか、または発売承認後に私たちの候補薬物に重大な否定的な結果をもたらす可能性がある。
承認されれば、上記のいずれの事件も、私たちの候補薬剤に対する市場の受け入れを達成または維持することを阻止し、私たちの候補薬剤の商業化コストを延期、阻害、および/または大幅に増加させる可能性があり、それによって、私たちの候補薬剤を商業化し、収入を創出する能力に著しく影響する可能性がある。上記のいずれの状況も、私たちの業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
もし私たちの候補薬物が発売と商業化を許可され、私たちは自ら販売、マーケティング、流通能力を開発することができず、第三者と合意することもできず、受け入れ可能な条項でこれらの機能を履行することができなければ、私たちはこのような候補薬物を商業化することに成功できないだろう。
私たちは現在、処方薬製品の販売、マーケティング、または流通能力を持っていない もし私たちの任意の候補薬がアメリカや他の場所での発売が許可された場合、私たちはこのような承認された候補薬物を米国および他の地域で商業化するために、私たちの内部販売、マーケティング、および流通能力を拡大する必要があり、そうでなければ、私たちは第三者と協力してこれらのサービスを提供する必要があるだろう。どんな内部努力も高価で時間がかかり、私たちは大量の財務と管理資源を投入して、技術専門長と関連支援流通、行政とコンプライアンス能力を持つ内部マーケティングと販売チームを発展させる必要があるだろう。もし私たちがこれらの能力を持つ第三者に依存して、私たちの未来の療法をマーケティングするか、または私たちの現在または未来の任意のパートナーと共同で製品を普及させることを決定するならば、私たちはこれらのパートナーと既存のマーケティングおよび流通スケジュールを確立、維持、または修正する必要があり、私たちが受け入れ可能な条項や根本的にこのような計画を達成できないという保証はないだろう。さらに、これらの第三者が十分な販売および流通能力を確立すること、または任意の承認された製品に対する市場の受け入れに成功することは保証されない。もし私たちが将来承認されたどの製品を商業化することに成功できなければ、私たち自身も第三者を通じても、私たちの業務、財務状況、運営結果、見通しは実質的な悪影響を受ける可能性がある。
著者らは第三者に依存して著者らの一部の臨床試験といくつかの非臨床研究を行い、引き続きこのようにするつもりである。これらの第三者が契約要件に従って履行されていない場合、法規や法的要件を満たしていない場合、または予想される期限を逃した場合、私たちの開発計画は延期され、私たちの業務、財務状況、運営結果、および見通しに実質的で不利な影響を与える可能性があります。
現在の臨床試験を継続し,短期的には他の候補薬の臨床試験を開始する予定であるが,独立して臨床試験を行うことはできない。特に,我々は内部で何らかの機能を果たしているが,現在は第三者CRO,臨床データ管理組織,コンサルタントに頼って候補薬物の臨床試験の設計,実施,監督,監督を支援していく予定である。したがって,われわれ自身が臨床試験を行うよりも,臨床試験の時間,品質,その他の制御が少ないであろう。我々の業務目標を実現するために必要な専門知識を専門的にあるいは持っている第三者サービスプロバイダの数は限られている.もし私たちがこれらの第三者CROまたは臨床研究者との任意の関係が終了した場合、私たちは他のCROや研究者と手配を達成できないか、または商業的に合理的な条項でそうすることができないかもしれない。
また、これらの調査者、CRO、コンサルタントは私たちの従業員ではなく、私たちのプロジェクトに使用する時間と資源の制御が限られています。これらの第三者は他のエンティティと契約関係にある可能性があり、その中のいくつかは私たちの競争相手である可能性があり、これは私たちの計画から時間と資源を消費するかもしれない。私たちと契約した第三者は私たちの非臨床研究或いは臨床試験を行う時に勤勉でない、慎重あるいは適時である可能性がある。これらの第三者も新冠肺炎の大流行或いは社会動乱或いは衝突時期のような衛生危機の妨害を受けやすい可能性がある。もし私たちが商業的に合理的な条項で受け入れられる第三者と契約を結ぶことができない場合、またはそれらの第三者が彼らの契約義務を履行していない場合、非臨床研究または臨床試験を行うための法律および法規の要件を満たしていない場合、または任意の理由で予想される最終期限を満たすことができない場合、私たちの臨床開発計画は延期され、他の側面から不利な影響を受ける可能性がある。
いずれにしても,われわれのすべての非臨床研究と臨床試験が関連研究や試験の一般的な調査計画や案に従って行われていることを確保する責任がある。FDAは非臨床研究は良好な実験室実践に従って行わなければならないことを要求し、臨床試験はGCPに従って行わなければならず、設計、進行、記録と報告非臨床研究と臨床試験結果の実践と要求を含み、データと報告の結果が信頼性と正確であることを保証し、臨床試験参加者の権利、完全性とセキュリティを保護する。私たちがコントロールできない第三者への私たちの依存は私たちのこのような責任と要求を解除しないだろう。
56
著者らの臨床試験中のいかなる不利な発展或いは遅延は著者らの業務、財務状況、運営結果と将来性に実質的な不利な影響を与える可能性がある。
私たちは第三者供給と私たちの候補薬の製造に依存しており、承認されれば、引き続き第三者の治療薬の生産と供給に依存すると予想される。これらの第三者が十分な数の候補薬剤または治療薬を提供できなかった場合、許容可能な品質レベルまたは価格で行われなかった場合、または満足できる法規準拠を維持または達成できなかった場合、候補薬剤の開発および任意の候補薬剤の商業化は、停止、延期、または利益が低下する可能性がある。
もし私たちの療法が承認されれば、私たちは今のところありませんし、内部でインフラや能力を獲得して、私たちの試験や商業供給のために私たちの候補薬を開発して製造するつもりもありません。逆に、私たちは依存し、引き続き第三者サプライヤーが私たちの非臨床研究と臨床試験のための用品を製造することに依存することが予想される。
著者らは現在、限られた数量の第三者契約メーカーに依存して、著者らの非臨床研究と臨床試験に必要な原材料と他のコンポーネントを提供し、私たちの候補薬物のための供給品を製造している。もし私たちの製造パートナーがこれらの義務をタイムリーに履行できなければ、私たちの臨床試験は延期される可能性があり、私たちの業務は不利な影響を受ける可能性がある。一般的に,我々自身が候補薬を製造するよりも,第三者サプライヤーに依存することがより大きなリスクに直面する可能性がある。私たちは、私たちと契約した契約製造組織のビジネスプロセスを制御せず、品質管理および記録およびファイルの維持を含む関連法規(例えば、cGMP)に従ってこれらの第三者に依存して候補薬剤を生産します。
知的財産権リスク
もし私たちが開発したすべての候補製品のために特許保護を得ることができなければ、私たちの競争相手は私たちと類似した製品や技術を開発して商業化するかもしれません。私たちが開発した任意の候補製品と私たちの技術を商業化することに成功した能力は悪影響を受ける可能性があります。
私たちの成功は、私たちがアメリカや他の国で任意の候補製品と私たちが開発する可能性のある他の技術の特許保護を獲得し、維持する能力があるかどうかに大きくかかっている。私たちの薬物および治療技術の発展がまだ初期段階にあることを考慮すると、私たちの知的財産権の組み合わせは、私たちの技術のいくつかの側面と、任意の薬物および任意の候補製品に関連している。しかし、このような特許出願がライセンス特許として発行される保証はない。
物質構成生物と医薬製品特許は通常、このような製品に対して最も強力な知的財産権保護形態であると考えられており、このような特許提供の保護はいかなる使用方法とも無関係であるからである。しかしながら、私たちの将来の特許出願における任意の候補製品の組成に関連する権利要件が、米国特許商標局(USPTO)または外国特許庁によって出願可能特許とみなされるかどうか、または発行された任意の特許における権利要件が、米国または外国裁判所によって有効とみなされ、強制的に実行されるかどうかを決定することはできない。
さらに、場合によっては、私たちは、その開発された任意の候補製品に関連する物質組成の発表された声明を得ることができず、使用方法および/または製造方法の宣言を含む特許出願の提出に依存する必要がある可能性がある。使用方法特許は、特定の方法を使用する製品を保護する。このようなタイプの特許は、競合他社が我々が開発したいずれの製品と同じ製品を製造および販売することを阻止するものではなく、この製品の適応は特許方法の範囲を超えている。また,競争相手がその目標適応に対して積極的に製品を普及させていなくても,医師はその使用方法特許がカバーする用途のために“ラベル外”のこれらの製品を発行する可能性がある。ラベル外の処方は使用方法特許侵害を侵害または助長する可能性があるが,このような行為は一般的であり,このような侵害行為の予防や起訴は困難である。このような特許出願がライセンス特許として発行されることは保証されず、たとえ彼らが確かに特許出願を発行したとしても、これらの特許主張は、我々の競争相手のような第三者を阻止するのに十分ではない可能性がある。私たちが開発した任意の候補製品に関連する特許保護を取得または維持できなかった場合、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性があります。
私たちは商業秘密保護、秘密保護協定に依存している。私たちの固有の情報を保護するための発明譲渡協定は無効かもしれない。
私たちは、従業員、コンサルタント、第三者と締結された商業秘密保護、秘密保護協定、および発明譲渡協定に基づいて、私たちの機密および独自の情報を保護します。我々の競争相手は,我々と類似した技術や方法を利用し続け,我々と類似した遺伝子情報ライブラリを重合し続けることが期待されているにもかかわらず,我々の成功部分は,我々が独自の方法やライブラリを開発する能力に依存し,これらの方法およびライブラリを守ることが我々に対して提供されていると信じている
57
競争相手です。もし私たちが私たちの知的財産権と他の機密情報を十分に保護しなければ、競争相手は私たちの独自技術と情報を使用して、私たちの知的財産権と他の機密情報が私たちに提供する任意の競争優位性を侵食するかもしれない。
私たちはこのような権利が効果的に秘密にされなければならないことを前提として、第三者によって不正に使用されないように、私たちの独自の商業秘密権利を保護することができるだろう。私たちは主に商業秘密と契約保護によって私たちの機密と独自の情報を保護することが予想され、私たちはこれらの情報を保護するために適切なセキュリティ措置を取っている。しかしながら、これらの措置は、私たちの商業秘密、技術的ノウハウ、または他の機密情報を十分に保護することができないかもしれない。従業員、コンサルタント、他の第三者とセキュリティ協定を締結するなどして、私たちの独自の情報を保護することを求めています。これらの秘密協定は、私たちの商業秘密および他の機密情報を保護するのに十分ではない可能性があり、これらの情報を無許可に使用または開示する場合には十分な救済措置を提供しない可能性がある。実行側が商業秘密または他の固有情報を不正に開示または流用する主張は困難であり、高価で時間がかかる可能性があり、結果は予測できない可能性がある。また,ビジネス秘密や他の機密情報は他人に知られたり独立して開発されたりして,我々の法律の追跡を阻止する可能性がある.もし私たちの任意の商業秘密や他の機密または独自の情報が漏洩または流用された場合、またはそのような情報が競争相手によって独立して開発された場合、私たちの競争地位が損なわれる可能性があり、私たちの業務は影響を受ける可能性がある。
知的財産権の侵害や公金流用に関する訴訟や他の訴訟や第三者のクレームには、多くの時間とお金がかかり、私たちのテストや開発候補薬の売却を阻止する必要があるかもしれません。
私たちが成功できるかどうかは、競争相手の知的財産権を含む第三者が所有する特許や他の独自の権利の侵害を避けることができるかどうかにある程度かかっていると信じている。多くの第三者が所有する米国および外国特許、係属中の特許出願、および他の知的財産権は、我々のテストおよびテストサービスに関連する技術をカバーしている。私たちは、第三者が私たちの業務が私たちの特許または他の知的財産権を侵害していると主張する可能性があり、未解決の特許出願が存在する可能性があり、発表されれば、私たちに不利な主張をする可能性があることを知らないかもしれない。したがって、私たちの既存または未来の業務は、他人の既存または将来の特許または他の知的財産権を侵害したとして告発されるか、または発見される可能性がある。また、既存のテストを販売し続けるとともに、新たなテストを発売して新たな市場に参入すれば、競争相手は、私たちのテストが彼らの知的財産権を侵害または流用したと主張する可能性があり、これは、私たちの既存業務を阻害したり、新しい市場に参入したりするための戦略の一部である。
もし私たちに特許侵害や知的財産権流用訴訟を提起した場合、訴訟が最終的に成功しなくても、訴訟の未解決の間にいかなるテストや他の活動の開発や販売を停止または延期することを余儀なくされる可能性がある。私たちの権利侵害請求が成功した場合、私たちは、損害賠償金と弁護士費の3倍の損害賠償を支払うことを余儀なくされる可能性があります(もし私たちが故意に特許を侵害していることが発見された場合)、必要な時にまたは商業的に合理的な条項では得られない可能性がある1つ以上の許可を得ること、印税を支払うことは、巨額である可能性があること、または任意の侵害テストまたは他の活動を再設計することは不可能であるか、または多くの時間と費用を必要とする可能性がある。さらに、その特許または他の知的財産権の侵害または流用について私たちにクレームを出した第三者は、禁止または他の平衡法救済を求めて得ることができ、承認された場合、一部またはすべてのテストの実行を禁止する可能性がある。また、これらのクレームの弁護は、その是非や成功の有無にかかわらず、巨額の費用を発生させ、私たちの経営陣や他の従業員資源に大量に移行し、私たちの名声を深刻に損なう可能性がある。これらの結果のいずれも、私たちが新しいテストを導入する時間を遅らせることができ、私たちのコストを著しく増加させたり、いくつかの基本的な活動を阻止したりすることができ、これは私たちの運営および業務成長能力に実質的な悪影響を及ぼす可能性がある。
私たちは私たちの特許と他の知的財産権発明権のクレームに疑問を受けるかもしれない。
私たちは、私たちが所有する特許、商業秘密、または他の知的財産権の利益に対して、元従業員、協力者、または他の第三者が発明者または共同発明者として告発される可能性がある。例えば、私たちは、私たちの製品または候補製品の開発に参加し、私たちが開発する可能性のある他のノウハウのコンサルタントまたは他の人の義務衝突によって在庫紛争が生じる可能性があります。訴訟は、これらおよび他の挑戦在庫、または私たちが所有する特許、商業秘密、または他の知的財産権の所有権に対する私たちのクレームに対抗するために必要かもしれない。もし私たちがこのようなクレームを弁護できなかった場合、金銭的損害賠償を支払うことに加えて、私たちは私たちの製品、候補製品、および私たちが開発する可能性のある他の独自技術の非常に重要な知的財産権の独占所有権や使用権のような貴重な知的財産権を失う可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
58
特許法の発展は私たちの業務に否定的な影響を及ぼすかもしれない。
最高裁判所、他の連邦裁判所、米国議会、または米国特許商標局は時々特許可能な基準を変更する可能性があり、このようないかなる変化も私たちの業務に否定的な影響を与える可能性がある。
ここ数年、最高裁は診断方法主張と“遺伝子特許”に関する3件の案件を裁決している。2012年3月最高裁はメオ社はプロメテウス研究所事件を訴えていますあるいは、あるいはプロメテウス特定の患者に投与される量を最適化することが意図された特許請求の範囲に関連する事件であって、特許を適用する請求項は、潜在的な自然関連性だけでなく、自然法を適用する特許資格プロセスに適合することを可能にするために、十分な発明内容を含まないと考えられる。2013年6月最高裁は分子病理学v.Myriad遺伝学あるいは、あるいは何千もの乳癌感受性遺伝子BRCA 1とBRCA 2に関する特許主張の有効性が問われる事件とともに,自然界に存在する単離されたゲノムDNA,例えばBRCA 1とBRCA 2遺伝子を構成するDNAは,特許出願可能なテーマではないが,遺伝子のリボ核酸転写による人工的に構築されたcDNAは特許資格に適合している可能性が考えられる。2014年6月最高裁はアリス社です。LTDはCLS Bank Internationalを訴えたあるいは、あるいはアリスこれは確かですプロメテウスそして何千もの補足的な説明を提供した。
もし私たちが候補製品、製品、技術、テストのために特許保護を求める努力をすれば、これらの努力は受けるかもしれませんプロメテウス, 何千ものそしてアリス米国特許商標局が発表した裁決、その他の事件の裁決又は指導又は手続。しかし完全には予測できませんプロメテウス, 何千ものそしてアリス自然法則、自然現象または抽象概念を陳述する権利主張がいつ特許資格要件に適合する可能性があるかの輪郭は不明であり、米国特許商標局および裁判所の解釈によって制定されるのに数年かかる可能性があるので、遺伝子テスト、生物製薬または他の会社がDNA、遺伝子またはゲノム関連発見に関連する特許を取得または実行する能力に関する決定は、いつ特許資格要件に適合する可能性があるかは不明である。最高裁判所の最近のこれらの裁決の前に、核酸と自然関連性に基づく診断方法を主張する多くの以前に発表された特許があり、これらの裁決に規定された基準によれば、これらの特許の多くは無効である可能性があるが、それらが挑戦される前に、それらは有効かつ強制的に実行可能であると推定され、これらの特許を有する第三者は、これらの特許を侵害したと主張するか、またはこれらの特許に基づいて許可を得ることを要求するかもしれない。これらの最高裁判所の裁決の前または後に発表された特許に基づいても、私たちは特許侵害の疑いを弁護することを余儀なくされるか、またはこれらの特許の下で許可権(あれば)を得ることができる。特に最高裁は何千もの単離されたゲノムDNAは特許条件に適合した標的ではなく,第三者は我々の活動が他のカテゴリーの遺伝子関連特許主張を侵害していると主張することができる。上記のように、“知的財産権侵害または公金流用に関する訴訟または他の訴訟または第三者のクレームは、大量の時間とお金をかけて、私たちのテストまたは候補薬の販売を阻止するのに時間とお金を要するかもしれません”で議論されているように、私たちが提起する可能性のある特許侵害クレームには多くの関連リスクがあります
また、2011年に法律となった“ライシー·スミス米国発明法”(Leahy-Smith America Invents Act、略称“米国発明法”)に署名し、米国特許法にいくつかの重大な改正を行った。これらの変化には、“先発明”制度から“先出願”制度への転換、発表された特許に対する質疑方式の変更、および審査過程における特許出願に対する論争方式の変更が含まれる。これらの変化は、より規模が大きく、より成熟した会社に有利になる可能性があり、これらの会社は特許出願と起訴のためのより多くの資源を持っている。米国特許商標局は、“米国発明法”の全面的な実施を管理するための新しい法規およびプログラムを制定しているが、“米国発明法”は、私たちが提出する可能性のある任意の特許出願を起訴するコスト、私たちがこれらの特許を獲得する能力(これらの特許を追求すれば)を発見すること、および私たちが発表可能な任意の特許を強制的に実行または擁護する能力は依然として不確定である。
米国特許法のこれらおよび他の実質的な変化は、特許侵害クレームに対する私たちの敏感性に影響を与える可能性があり、また、私たちが求める可能性のある任意の特許を得る能力に影響を与える可能性があり、これらの特許を獲得、実行または弁護する能力があれば、これらのいずれも私たちの業務に実質的な悪影響を及ぼす可能性がある。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要件を遵守することに依存し、これらの要件に適合しない場合、その特許保護は減少またはキャンセルされる可能性がある。
定期維持費、継続費、年会費及び各種他の政府特許及び出願費用は、その所有する特許及び出願の有効期間内にUSPTO及び米国以外の各種政府特許機関に支払われる。米国特許商標局および様々な非米国政府機関は、特許出願過程において、いくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。場合によっては、不注意は、滞納金を支払うことによって、または規則を適用する他の方法によって救済することができる。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効される可能性があり、それにより、関連法ドメインの特許権の一部または全部が失われる可能性がある。この場合、潜在的な競争者は似たような方法で市場に参入する可能性がある
59
製品または技術は、これは私たちの業務、財務状況、経営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
2023年12月31日現在、世界的に、私たちが所有または独占的に許可されている発行または許可された特許は30件を超え、有効特許出願は10件を超える。これには発行または許可された10個の米国特許が含まれている。これらの特許シリーズ中の特許出願が承認されれば、遅くとも2044年に満了することが予想されるが、任意の特許期限の免責声明、調整または延長の制限を受ける。これらの家族の特許および/または特許出願は、米国、オーストラリア、カナダ、中国、欧州特許機関、ドイツ、ニュージーランド、日本、およびスイスを含む複数の司法管轄区域で活躍している。これらの特許及び独占的に許可された特許及び有効な特許出願に加えて、非独占的及び/又は地域的に制限された方法で特許を許可する。私たちの知的財産権の組み合わせは私たちの技術のための重要な特許と特許出願を含む。これには、癌を含む疾患を治療するための水不溶性または難溶性薬物を送達するための、我々のナノ薬物送達プラットフォーム技術に関連する特許出願が含まれている。特に、2023年12月31日現在、私たちは、28件の特許と、FID−007に関する5つの特許出願とを有しているか、または独占的に許可されている。特許出願の提出日、特許発行日及び特許が特許を取得した国における法定期限により、個別特許期間の延長時間はそれぞれ異なる。
2017年6月、Fulgent Pharma LLCはANPと独占ライセンス契約を締結し、2017年12月28日に改訂された。プロトコルによれば、ANPは、Fulgent Pharma LLCに、独占的、グローバル範囲、特許権使用料を有する、永久的、取消不可能かつ再許可可能な特許および特許出願権利許可を付与し、これらの許可に基づいて、人間の治療、予防および診断用途のためのFID−007および関連処方を開発および商業化することができる。IPキットは、2023年12月31日現在、FID−007に関連する28特許および5つの特許出願を含む。これらの家族の特許および/または特許出願は、米国、オーストラリア、カナダ、中国、欧州特許機関、ドイツ、ニュージーランド、日本、およびスイスを含む複数の司法管轄区域で活躍している。これらの特許家族中の特許が承認された場合、2034年に満了することが予想されるが、任意の特許期間の免責声明、調整または延長の制限を受ける。
私たちが将来発行する私たちが開発した候補製品をカバーする特許は、法廷や米国や海外の行政機関で挑戦されれば、無効または強制執行できないことが発見される可能性がある。
米国の特許訴訟では,被告が無効または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.第三者は,訴訟の範囲外であっても,米国や海外の行政機関に我々の持つ特許の有効性や実行可能性を疑問視することができる.この仕組みには再審査、贈与後審査、各方面間審査手続き、介入手続き、派生手続き、外国司法管轄区の同等の手続き(例えば、反対手続き)。このような訴訟は、その候補製品または他の技術をカバーしないように、私たちの将来の特許が撤回、キャンセル、または修正される可能性がある。法的に無効と実行不可能と断言された後の結果は予測できない。例えば、有効性の問題については、私たちは無効な以前の技術がないとは確信できないが、私たちと特許審査員は起訴中にこれを知らない。第三者が法的に無効または強制執行できないと主張した場合、私たちは、その開発された任意の候補製品または他の技術の少なくとも一部、さらには全ての特許保護を失うことになる。このような特許保護の喪失は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすだろう。
特許条項は製品とサービスでの私たちの競争地位を十分に保護するのに十分ではないかもしれない。
特許の寿命は限られている。例えば、特許期間は、免責宣言、特許期限調整、補足保護証明書、および特許期限の延長を終了することによって短縮または延長されてもよい。延期することはできるが、特許の有効期限とその提供される保護は限られている。特許期限の延長や保護証明書の補充などは規制過程の影響を受ける可能性があり,特許期限を著しく延長しない可能性がある.特許料または年金の支払いを支払わないか、特許出願を遅延または延期することは、意図的であっても意図的であっても、我々の業務に重要な特許権の喪失を招く可能性がある。この場合、競争相手は他の場合よりも早く市場に参入するかもしれない。また,ある国には強制許可法があり,これらの法律により特許権者は他の者に許可を強制的に付与される可能性がある。また、多くの国は、政府機関や政府請負業者を含む他の当事者に対する特許の実行可能性を制限している。これらの国では、特許権者の救済措置は限られている可能性があり、これは任意の特許の価値を大幅に低下させる可能性がある。
米国や海外では、すべての維持費/年金費用が適時に支払われれば、特許の自然失効時間は、その最初の非一時出願日から20年であるのが一般的である。特許提供の保護は限られている。私たちの製品をカバーする特許を取得しても、特許の有効期限が満了すると、競争製品からの競争に直面する可能性があります。与えられた数の下で
60
新製品の開発、テスト、監督審査に要する時間が長いため、このような製品の特許を保護することは、このような製品の商業化の前または直後に満期になる可能性がある。したがって、私たちが将来持っている特許と許可された特許の組み合わせは、他の会社が私たちと似ているか同じ製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
もし私たちが開発する可能性のある任意の候補製品の特許期間延長および/またはデータ独占権を獲得しなければ、私たちの業務は実質的に損害を受ける可能性がある。
FDAが私たちが開発する可能性のある任意の候補製品の上場承認の時間、期限、詳細に基づいて、私たちが将来所有する1つ以上の米国特許は、“ハッジ·ワックスマン法案”によって限られた特許期間を延長する資格がある可能性がある。ハッジ·ワックスマン法は、FDA規制審査中に失われた特許期間の補償として、特許期間を最大5年間延長することを許可している。1つの特許期間の延長は、製品が承認された日から14年を超えてはならず、1つの特許を延長することしかできず、承認された薬物、その使用方法又はその製造方法に関する請求項を延長することしかできない。一部の外国国·地域では、例えばヨーロッパでは、補完特許証明書に基づいて、規制審査中に失われた特許期間の補償として同様の延長を得ることもできる。しかし、私たちは、テスト段階または規制審査中に職務調査を行わなかったこと、適用された最終期限内に出願を提出できなかったこと、関連する将来の特許が満了する前に出願を提出できなかったこと、または適用要件を満たしていなかったことなどの理由で、米国および/または他の国および地域で延期許可を得ることができない可能性がある。しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長を得ることができない場合、あるいはこのような延長の期限が私たちが要求したものよりも短い場合、私たちの競争相手は私たちの特許が満期になった後に競争製品の承認を受ける可能性があり、私たちの業務、財務状況、運営結果、見通しは実質的に損なわれる可能性がある。
私たちはその特許と他の知的財産権発明権のクレームに疑問を受けるかもしれない。
私たちは、発明者または共同発明者として、元従業員、協力者、または他の第三者によって所有されている特許権、商業秘密、または他の知的財産権の利益について告発される可能性がある。例えば、私たちは、その候補製品または他の技術の開発に参加する従業員、コンサルタント、または他の人の義務衝突によって在庫紛争が生じる可能性がある。訴訟は、これらおよび他の挑戦が所有する特許権、商業秘密または他の知的財産権の発明権または所有権のクレームに対抗するために必要である可能性がある。もし私たちがこのようなクレームを弁護できなかった場合、金銭損害賠償の支払いに加えて、その候補製品に対する重要な知的財産権や他の技術の独占所有権や使用権など、貴重な知的財産権を失う可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちはアメリカ以外で私たちの知的財産権を実行できないかもしれない。
一部の外国の法律は専有権の保護程度はアメリカの法律に及ばず、多くの会社はアメリカ国外でその専有権を設立と実行する時に重大な挑戦に直面している。このような挑戦は、いくつかの法域が知的財産権の規則および方法を確立して実行することが不足しているためかもしれない。また、一部の国の法制度、特に発展途上国の法制度は、特定の知的財産権保護、特に医療に関する保護の実行に賛成していない。多くの外国法制度のこのような側面は、これらの司法管轄区域で私たちの知的財産権を流用することを防止または阻止することを困難にするかもしれない。さらに、外国の法律と裁判所の法的裁決の変化は、私たちの技術のために十分な保護と私たちの知的財産権を実行する能力に影響を与える可能性がある。多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちまたは私たちの任意の許可者が第三者に私たちの業務に関連する任意の特許の許可を付与することを余儀なくされた場合、私たちの競争的地位が損なわれる可能性があり、私たちの業務、財務状況、運営結果、および見通しは不利な影響を受ける可能性があります。したがって、米国外で知的財産権を保護し、実行するための私たちの努力は十分ではないことが証明されるかもしれないが、この場合、私たちが競争力を維持し、業務や収入を増加させる能力は実質的に損なわれる可能性がある。
私たちは世界のすべての国で知的財産権を持っているわけではない。世界のすべての国で候補薬物出願、起訴、特許保護の費用は目を引くほど高く、私たちのアメリカやヨーロッパ以外のいくつかの国での知的財産権はアメリカほど広くないかもしれない。また、外国の法律は知的財産権の保護の程度は米国の連邦や州法に及ばない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は特許保護を受けていない管轄区で私たちの技術を使って自分の製品を開発し、さらに輸出することができます
61
そうでなければ、侵害製品は私たちが特許保護を持っているが、法執行力がアメリカに及ばない地域に移されるだろう。これらの製品は私たちの候補薬物と競争するかもしれませんが、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
第三者は、我々の従業員やコンサルタントが機密情報を誤って使用または漏洩したり、商業秘密を流用したりしたと主張する可能性がある。
私たちが雇った個人は以前、私たちの競争相手や潜在的な競争相手を含む大学と生体認証ソリューション、遺伝子検査、診断、あるいは他の医療会社に雇われていた。また、私たちは将来、私たちと他の当事者の技術や知的財産権の開発に参加するコンサルタントや他の人の義務の衝突によって所有権紛争を引き起こす可能性があります。私たちの従業員およびコンサルタントが私たちのために働いているときに他人の固有情報やノウハウを使用しないことを確実にするために努力しているにもかかわらず、私たちまたは私たちの従業員またはコンサルタントは、商業秘密または他の固有情報を含む前の雇用主または他の第三者の知的財産権を意図的または他の方法で使用または漏洩したとして告発される可能性がある。もしこのようなクレームが発生したら、弁護するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを正当化できなければ、私たちは金銭的な損害と、貴重な知的財産権や人員の損失を受けるかもしれない。このようなクレームを正当化することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させ、私たちの名声を損なう可能性がある。
もし私たちが許可や第三者と締結した技術協定で規定された義務を履行できなければ、私たちの業務に非常に重要な許可権を失う可能性があります。もし私たちの第三者許可者が私たちの許可手配の条項を守らなければ、私たちは私たちの権利を保護するために訴訟を余儀なくされるかもしれないが、これは成功しないかもしれない。
私たちは第三者からいくつかの知的財産権の許可を得て、技術と特許を含めて、これは私たちの研究開発に重要です;将来私たちは追加の協定を締結して、私たちに貴重な知的財産権や技術の許可を提供するかもしれません。例えば、我々の業務は、ANPライセンスプロトコルに従ってANPから許可を得るいくつかの知的財産権に大きく依存する。ANPライセンスプロトコルによれば、ANPは、Fulgent Pharma LLCに、特許権使用料を負担する、永久的、撤回不可能かつ再許可可能な特許および特許権利許可を独占的、世界的に付与し、これらの許可に基づいて、人間の治療、予防および診断用途のためのFID−007および関連処方を開発および商業化することができる。したがって、私たちのビジネス成功は、ANPライセンス契約下の義務を維持し、履行する能力に大きく依存するだろう。ANPライセンス協定は、ANPは、私たちが修復していない違反、または私たちが破産、破産手続きの標的、または潜在的な他の理由で終了する権利があると規定している。ANPがANP許可プロトコルを終了すれば、FID−007の開発および商業化は悪影響を受け、我々がこの計画から収入を得る潜在力は悪影響を受け、新しいパートナーを誘致することはより困難になる。したがって、私たちは市場内の競争の激化の影響を受けるかもしれない。
私たちは、私たちが未来に加入する可能性のある他の技術的許可に類似した条項が含まれ、私たちに似たような義務が適用されると予想する。もし私たちが許可協定のいかなる義務も履行できなかった場合、私たちは損害賠償金の支払いを要求される可能性があり、許可側は許可を終了する権利があるかもしれない。許可側の終了は、私たちが関連する研究や開発活動を継続すること、または他の方法で私たちの業務に実質的で否定的な影響を与えることを阻止するために、私たちの貴重な権利を失う可能性がある。もし私たちのライセンシーがライセンス契約の条項を遵守できなかった場合、もし彼らが侵害された第三者に対して許可された知的財産権を強制的に実行できなかった場合、許可された知的財産権が無効または実行不可能であることが発見された場合、または許容可能な条項または必要なライセンス合意が全く達成できない場合、私たちは訴訟を提起して私たちの権利を強制的に執行させることを余儀なくされるかもしれない。この訴訟は成功しないかもしれないし、多くの時間と資源を消費するかもしれない。これらの状況は、私たちの業務、発展努力、財務状況、または運営結果に実質的な悪影響を及ぼす可能性がある。
62
普通株リスク
我々普通株の活発で流動的な取引市場は持続できない可能性があり、株主は彼らが持っている普通株を売却することを困難にする可能性がある。
私たちの普通株の活発な取引市場は持続できないかもしれない。また、我々の創業者でCEOで取締役会長の謝さん氏は、2023年12月31日現在、約29%の未済株式と議決権を持っています。その結果、公開市場で活発に取引される株が減少し、これにより我々普通株の流動性が低下した。活発な取引市場の不足は、私たちの株主が理想的な時間にまたは合理的と思われる価格で彼らの株を売る能力を弱めるかもしれない。また、活発でない取引市場は、将来的に普通株を売却することで資金を調達する能力を弱める可能性があり、戦略関係を構築したり、普通株を対価格で会社や技術を買収する能力を弱める可能性がある。
私たちの普通株はナスダック世界市場またはナスダックに上場し、コードは“FLGT”です。しかし、もし私たちがナスダックの継続上場の基準を満たすことができなければ、私たちはカードを取られるかもしれないし、これは私たちの普通株の価格と流動性に否定的な影響を与えるだろう。
私たちの普通株の価格は変動するかもしれません。あなたはあなたの全部あるいは一部の投資を失うかもしれません。
私たちの普通株の取引価格は大幅な変動と大幅な変動を経験し続ける可能性がある。私たち普通株の市場規模は相対的に小さく、流動性が悪く、この変動を悪化させる可能性がある。このような変動を引き起こす可能性のある他の要因は
63
また、株式市場全体、特に生命科学や技術業界の株式市場は、近年極端な価格や出来高変動を経験しており、特定の会社の経営業績に関係なくあるいは比例しない場合がある。これらの広範な市場と業界要素は、私たちの実際の経営業績にかかわらず、私たちの普通株の市場価格にマイナス影響を与えるかもしれない。また、過去には、全体市場とある会社証券の市場価格が変動した後、同社に対して証券集団訴訟を起こすことが多かった。私たちにこのような訴訟を提起すれば、巨額の費用を招き、私たちの経営陣の注意力と資源を分散させ、私たちの名声を損なう可能性があります。
私たちの主要株主と経営陣は私たちのかなりの割合の株式を持っていて、株主が承認した事項に大きな制御を加えることができます。
当社の役員、取締役、未償還投票権株主の5%以上、および関連会社各社の利益の5%以上が、2023年12月31日現在、当社の未償還投票権配当金の約45%を保有しており、うち、当社の創業者でCEO兼取締役会長の謝さん氏自身が、2023年12月31日現在の未償還投票権持分の約29%を保有しております。したがって、これらの株主は、取締役を選挙すること、私たちの組織文書を修正すること、または任意の合併、資産の売却、または他の重大な会社取引を承認することを含む、私たちの株主に提出された承認事項を制御することができます。このような所有権の集中は、私たちの普通株を買収する提案や要約を自発的に提出することを阻止または奨励しない可能性がある。なぜなら、私たちの一部の株主は、これらの株主の利益が私たちの他の株主の利益と一致しない可能性があるため、彼らの行動は、必ずしも私たちのすべての株主の利益ではなく、彼らの最適な利益を促進するかもしれないからである。しかも、このような所有権の集中は私たちの普通株の現在の市場価格に悪影響を及ぼすかもしれない。
私たちの普通株の大量株を公開市場で売却したり、このような売却が発生する可能性があると考えたりすることで、私たちの普通株の価格が下落する可能性があります。
公開市場で私たちの大量の普通株を売ることはいつでも起こる可能性がある。このような売却、あるいは市場で販売が待っていると考えられたり、発生する可能性があるという見方は、私たちの普通株の市場価格を下げる可能性がある。我々普通株のほとんどの流通株は公開市場で自由に取引することができるが,我々関連会社が保有する株式の一定数や方式に適した販売制限を受けており,この用語は証券法で定義されている.また、類似した制限および任意の他の適用される法律および契約制限に基づいて、我々の普通株のうち、株式ベースの奨励を受ける必要がある未償還株、または将来付与される可能性のあるこのような奨励保留に基づいて発行される普通株は、証券法に基づいて登録されているか、または発行時に適用される証券法に基づいて公開市場で自由に取引する資格がある。
将来的に私たちの株式を発行したり、私たちの株式を購入する権利は、私たちの株式インセンティブ計画に基づいて、私たちの株主の所有権の割合をさらに希釈し、私たちの普通株の価格を下落させる可能性があります。
資本を調達するため、または他の戦略的目的のために、私たちは、1回または複数回の取引において、時々決定された価格および方法で普通株、変換可能証券、または他の株式証券を販売することができる。私たちの持分インセンティブ計画によると、私たちはまた補償目的として普通株式を発行したり、他の持分奨励を付与することができます。もし私たちが普通株、転換可能証券、あるいは他の株式証券を発行すれば、私たちの株式激励計画下の株式奨励を含めて、私たちの当時の株主はこのような発行によって大幅に希釈されるかもしれません。もし私たちが他の方法で優先株を発行すれば、新しい投資家は私たちの普通株保有者より優先する権利、優遇、特権を得ることができ、これらはすべて私たちの普通株の価格を下落させる可能性があります。
私たちは私たちの普通株に配当金を支払うつもりはないので、どんな見返りも私たちの普通株の価値に制限されるだろう。
私たちは現在、将来のどんな収益も維持し、私たちの業務の持続的な発展、運営、拡張に資金を提供すると予想しています。したがって、予測可能な未来に、私たちはどんな現金配当金や他の分配も発表したり支払うことはないと予想される。さらに、もし私たちが将来信用手配に入ったり、債務証券や優先株を発行したりすれば、私たちは契約によって制限され、配当金を支払うことができないかもしれない。もし私たちが配当金を支払わなければ、株主は価格上昇後に普通株を売ることに依存しなければならないので、私たちの普通株はもっと価値がなくなるかもしれないが、このような状況は彼らの投資収益を達成するために永遠に起こらないかもしれない。
64
証券や業界アナリストが私たちの業務に関する研究や報告を発表しない場合、または彼らが私たちの普通株に不利または誤った意見を発表した場合、私たちの株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は、業界や証券アナリストが発表した私たちまたは私たちの業務に関する研究と報告の影響を受けています。もし一人以上のアナリストが私たちの報告書を停止したり、私たちに関する報告書を定期的に発表できなかった場合、私たちは金融市場で可視性を失う可能性があり、これは私たちの普通株の価格と取引量を低下させる可能性がある。さらに、もしこれらのアナリストのいずれかが私たち、私たちのビジネスモデル、私たちの業界、または私たちの株式表現に不利または誤った意見を発表した場合、または私たちの経営業績がアナリストの予想を達成できなかった場合、私たちの普通株価格も下落するかもしれない。
私たちの定款書類とデラウェア州法律の条項はわが社の支配権の変更や私たちの経営陣の変更を阻止、延期、または阻止し、私たちの普通株の市場価格を下げるかもしれません。
当社の登録証明書や定款に含まれる条項は、私たちの普通株の市場価格を低下させる可能性があります。これらの条項は、わが社の支配権の変更を阻止、延期、または阻止する可能性があり、あるいは私たちの株主が有利と思う経営陣の変更を阻止する可能性があります。他にも、これらの規定には、
さらに、私たちは、15%以上の普通株を持っている人との合併、業務合併、および他の取引にいくつかの制限を加えたデラウェア州会社法第203条の制約を受けている。第203条は、わが社の制御権変更を阻止、延期、又は阻止する効果がある可能性がある。
もし私たちが優先株を発行すれば、普通株の保有者は不利な影響を受けるかもしれない。
当社の登録証明書によると、当社の取締役会は、株主が何の行動も必要とせず、最大100万株の優先株を発行することを許可されています。私たちの取締役会はまた、株主の承認を経ずに発行可能な任意の一連の優先株の条項を制定する権利があり、その中には、投票権、配当権、および配当または解散、清算または清算の場合の私たちの普通株に対する優先株を含む。もし私たちが未来に優先株を発行し、配当金または清算、解散または清算を支払う時に私たちの普通株に優先するか、または私たちが発行した優先株が1:1を超える比率で私たちの普通株に変換できれば、私たちの普通株式保有者の投票権と他の権利、そして私たちの普通株の市場価格は不利な影響を受けるかもしれない。
私たちの会社登録証明書は、デラウェア州衡平裁判所が私たちの株主のために開始する可能性のあるいくつかのタイプの訴訟および訴訟の唯一および独占フォーラムを指定し、これは、私たちまたは私たちの役員、上級管理者、または他の従業員とトラブルが発生すると考えられる司法フォーラムを獲得する能力を私たちの株主が獲得することを制限するかもしれない。
私たちの会社の登録証明書と定款は、私たちが書面で代替裁判所を選択することに同意しない限り、デラウェア州衡平裁判所は次の場合の唯一の独占裁判所でなければならない
65
私たちは上記の制限を独占フォーラム条項と呼ぶ。排他的フォーラムの規定は,(1)デラウェア州衡平裁判所が不可欠であると結論した側がデラウェア州裁判所の管轄を受けない訴訟,および(2)連邦裁判所が訴訟排他的管轄権を負担する訴訟には適用されない.
したがって,排他的フォーラム条項は,取引法またはその下の規則や条例や取引法のクレームを実行するために生じる義務や責任のための訴訟には適用されない.また、私たちの会社の登録証明書の条項は、排他的フォーラム条項から“連邦裁判所が法律手続きの独占管轄権を負担している訴訟”を排除し、連邦裁判所が連邦裁判所がどんな行動をとるかにかかわらず、取引法第27条がすべての取引法のクレームに対して連邦独占管轄権を創造しているので、連邦裁判所がいかなる実際的または肯定的な行動を取らなければならないということを意味しない。排他的フォーラム条項はまた、証券法またはその下の規則および法規または証券法のクレームを実行するために生じるいかなる義務または責任のために提起された連邦および州訴訟にも適用されない。適用または実行可能な範囲内で、排他的フォーラム条項は、私たちまたは私たちの役員、上級管理者、または他の従業員との紛争に有利であると考えられる司法フォーラムで株主がクレームを提起する能力を制限する可能性があり、これは、これらの訴訟を阻害する可能性がある。代替的に、証券法クレーム、取引法クレーム、または裁判所がこれらの排他的フォーラム条項が1つまたは複数の特定のタイプの訴訟または訴訟を強制的に実行する請求に適用されないか、または強制的に実行できないと考える場合、私たちは、他の司法管轄区域において、これらの問題の解決に関連する追加費用を発生させる可能性があり、これは、私たちの業務、財務状況、または運営結果に悪影響を及ぼす可能性がある。
項目1 B。未解決の従業員のコメント。
N適用されません。
プロジェクト1 C。ネットワークセキュリティです。
私たちは、お客様、お客様、患者、業務パートナー、および従業員の業務に対する信頼と信頼を維持することが重要であることを認識し、私たちの業務運営およびシステムの機密性、完全性、および可用性を保護するために努力しています。私たちの取締役会は私たちのリスク管理活動を監督することに積極的に参加して、ネットワークセキュリティは私たち全体のリスク管理方法の重要な構成要素です。我々のネットワークセキュリティ政策、標準、プロセス、プログラムと実践は国家標準と技術研究所(NIST)が構築した公認フレームワークとその他の適用業界標準に基づいている。全体的に、我々は、ネットワークセキュリティ脅威を識別、予防、緩和し、ネットワークセキュリティイベントが発生したときに効率的に対応することに重点を置いて、網羅的、機能を越えた方法によってネットワークセキュリティリスクに対応することを求めており、私たちが収集し、格納している情報の機密性、セキュリティ、完全性、および可用性を維持する。
リスク管理と戦略
ハッカーおよびハードウェアおよびソフトウェアシステムの予期しない破損または中断、データ損失および機密情報が流用されるなど、不正アクセス、ネットワークセキュリティ攻撃、および他のセキュリティイベントなどのネットワークセキュリティに関連するリスクに直面しています。サイバーセキュリティ脅威からの重大なリスクを識別し評価するために、包括的なネットワークセキュリティ計画を維持し、我々の情報資産の機密性と完全性を確保するために、我々の内部および外部脅威のセキュリティ監視計画を定期的に監視する。我々は,ネットワークセキュリティ脅威のリスクを他社リスクとともに考え,我々全体のリスク評価プロセスの一部としている.私たちは、定期的なネットワークと端末の監視、脆弱性評価、浸透テスト、脅威監視、デスクトップ練習を含む一連のツールとサービスを使用して、私たちのリスク識別と評価に情報を提供します。
我々の流れをNISTやインターネットセキュリティセンターが策定した基準と比較し,専門家を招いて我々の情報システムを浸透させようとすることで,我々のネットワークセキュリティ脅威リスクを認識する.重要なデータとシステムの可用性を提供し、法規遵守を維持し、ネットワークセキュリティ脅威からの重大なリスクを管理し、ネットワークセキュリティ事件を防止し、対応するために、ネットワークセキュリティリスクを含み、新たに出現したデータ保護法を監視し、このような法律を遵守することを目的としたプロセスを変更することを含む定期的なリスク評価を行う。私たちの政策、実践および/または契約(状況に応じて)を通じて、従業員およびいくつかの第三者に機密情報およびデータを慎重に対応することを要求し、関連する政策およびプログラムを定期的に更新する。ファイアウォール、侵入防御と検出システム、アンチマルウェア機能とアクセス制御を含む、我々の情報システムをネットワークセキュリティ脅威から保護するための技術保障措置を採用し、脆弱性評価とネットワークセキュリティ脅威情報による評価と改善を提供する
66
定期的に私たちの従業員に対してネットワークセキュリティ脅威に関する強制訓練を行い、彼らにネットワークセキュリティ脅威を識別或いは対応するために必要な有効なツールと知識を把握させ、そして私たちの発展している情報セキュリティ政策、標準、流れとやり方を伝達する;定期的に釣り電子メールシミュレーションを行い、可能な脅威に対する認識と応答能力を高める;私たちの取締役会と上級管理者に対して年間ネットワークセキュリティ訓練を行う;デスクトップ演習を実行して、ネットワークセキュリティイベントに対する応答をシミュレーションし、調査結果を使用して私たちの流れと技術を改善する;NISTイベント処理フレームワークを利用して、実際あるいは潜在的なネットワークセキュリティ事件が発生した時に識別、保護、検出、応答と回復を助ける;コンサルタントを招聘することは私たちがネットワークセキュリティリスク、プロセスとイベント対応措置を監督と管理することを助けて、そして情報セキュリティリスク保険を提供し、ネットワークセキュリティイベントによって発生した潜在的な損失に対して保護を提供する。
私たちのイベント応答計画の概要と調整は、イベントの分類、深刻さの評価、報告、制御、調査および修復の流れ、および潜在的に適用される法的義務を遵守し、私たちの業務および名声に対する損害を軽減することを含む、準備、検出、応答、およびネットワークセキュリティイベントからの活動の回復のために取られた活動を要約し、調整します。我々のイベント応答計画はさらに、重要性評価の実行と重大とされるネットワークセキュリティ事件への対応における各種従業員、マネージャー、上級指導者の役割と責任を概説し、ネットワークセキュリティ事件発生後の迅速な報告プログラムを提供した。イベントが発生した場合、私たちは、イベント検出から緩和、回復、通知までのステップを概説する予定であり、通知機能部門(例えば、法律部門)および上級指導部および私たちの取締役会(状況に応じて)を含む。
我々のネットワークリスク管理計画は,会社の企業リスク管理システムに統合されており,会社の情報技術環境に対しても,顧客向けの製品やサービスにも対応している.リスク管理計画の重点は,組織のデジタル資産を保護し,業務の継続的な運営を確保し,ネットワーク脅威の潜在的影響を最小限に抑えることである。浸透試験を含めて定期的に評価を行う。これらの情報は、企業リスク管理計画全体に統合され、さらに会社の戦略に情報を提供し、これらのリスクの可能性、影響、速度を前向きに評価するリスク登録簿の基礎を構成している。
上記の流れの一部として、私たちは定期的にコンサルタントや他の第三者と接触し、継続的に関心、改善、およびコンプライアンスが必要な分野の決定を支援するために、私たちのネットワークセキュリティ計画を検討します。我々は彼らに参加させ,特にネットワークセキュリティリスク評価,外部脅威環境審査,内部ネットワークセキュリティ政策コンプライアンス,最近の事件対応に協力してもらった。私たちのプロセスはまた、消費者、患者、および従業員のデータ、または私たちのシステムにアクセスすることができる第三者サービスプロバイダ(私たちの主要プロバイダを含む)を使用することに関連するネットワークセキュリティ脅威リスクを解決する。また、ネットワークセキュリティ面の考慮は、第三者サービスプロバイダの選択と監視にも影響を与える。我々は、定期的に、私たちのシステム、データ、またはそのようなシステムまたはデータを格納することができる施設のいくつかの第三者を調査し、そのような調査によって発見されたネットワークセキュリティ脅威リスクも監視する。
我々は、“実際にまたは発生しようとしているセキュリティイベントまたは脆弱性、データ損失、または他の中断が、私たちに重大な責任を負わせ、私たちの業務、財務状況および名声に重大かつ悪影響を及ぼす可能性がある”というタイトルの下で、識別されたネットワークセキュリティ脅威(これまでの任意のネットワークセキュリティイベントを含む)からのリスクが、私たちの業務戦略、運営結果、または財務状況を含む私たちに重大な影響を与えているかどうかを記述する。
過去3年間、私たちは重大なサイバーセキュリティ事件を経験しなかった。本報告日まで、私たちは、これまでのいかなるネットワークセキュリティイベントのリスクも含めて、私たちの業務戦略、運営結果、または財務状況を含む、私たちの業務戦略、運営結果、または財務状況を含む、いかなるサイバーセキュリティ脅威からのリスクも考慮していません。しかし、これらの脅威は、私たちのシステムとネットワークのセキュリティと、私たちのデータの機密性、可用性、および完全性にリスクを構成します。ネットワークセキュリティ攻撃はまた、患者、従業員、または顧客データ、または私たちがビジネス運営において使用するハードウェアおよびソフトウェアのセキュリティ、完全性および/または信頼性のための攻撃を含むことができる。我々の情報技術システムおよびネットワーク、またはサードパーティによって管理または提供されるシステムおよびネットワークには、一定期間気づかれない脆弱性が存在する可能性がある。このようなリスクを緩和するために様々なプログラムや制御措置が利用されているが、我々が実施し、実施している行動および制御措置が、我々のシステム、情報、または他の財産に関するリスクを保護および軽減するのに十分である保証はない。より多くの情報については、本年度報告第1 A項に記載されているリスク要因を参照されたい。
本報告日まで、私たちは、これまでのいかなるサイバーセキュリティ事件によるいかなるサイバーセキュリティ脅威のリスクが、私たちの業務戦略、運営結果、または財務状況を含めて、私たちに大きな影響を与えたり、合理的に私たちに影響を与えたりする可能性があるとは思わない。しかし、我々のITシステムの変更は、第三者が提供する変更を含めて、将来的にリスクに直面する可能性があることを認識しています。私たちは私たちが施行するこのような危険を緩和する制御措置がこのような危険を除去するという保証はない。このリスクに関する議論は、本年度報告第1 A項を参照されたい。
サイバーセキュリティ?ガバナンス
67
ネットワークセキュリティは私たちのリスク管理プロセスの重要な構成部分であり、私たちの取締役会と経営陣が注目している分野でもある。全体的に、私たちの取締役会は、私たちの経営陣が設計·実施したリスク管理活動を監督し、具体的なリスク、例えば、私たちの戦略計画、業務運営、資本構造に関連するリスクを考慮します。私たちの取締役会は、リスク管理に対する監督責任を直接履行し、その中のいくつかのリスクの監督をその委員会に許可することによって、私たちの監査委員会はネットワークセキュリティ脅威からのリスクを監督することを許可しました。
少なくとも四半期ごとに、当社の取締役会は、データセキュリティ態勢、第三者評価のいずれかの結果、予め定められたリスク緩和に関する目標の達成状況、我々のイベント対応計画、重大なネットワークセキュリティ脅威リスクまたは事件および事態の発展、および管理層がこのようなリスクに対応するためのステップを含む、我々のネットワークセキュリティ脅威リスク管理および戦略プロセスに関する管理層の最新の情報を受け取る。このような会議で、我々の取締役会は、一般に、現在および出現している重大なネットワークセキュリティ脅威リスクを議論し、これらのリスクを緩和する能力と、私たちの同業者および第三者に対して生じる最新の発展、進化し続ける基準、技術発展および情報セキュリティ考慮要因を説明し、私たちの首席情報セキュリティ官および/または総法律顧問および首席プライバシー官とこのような問題を議論するネットワークセキュリティダッシュボードおよび/または他の材料を含む材料を受け取る。私たちの取締役会はまた、既定の報告のハードルに適合したネットワークセキュリティイベントのタイムリーな情報と、イベントが解決されるまで、そのようなイベントの継続的な更新を受ける。
取締役会のメンバーはまた、管理層と定期的にネットワークセキュリティに関連するニュースやイベントについて対話することを奨励され、私たちのネットワークセキュリティリスク管理と戦略計画の任意の更新を検討している。重大なネットワークセキュリティ脅威リスクも単独の取締役会会議で企業リスク管理、運営予算、業務連続性計画、M&A、ブランド管理とその他の関連事項を討論する際に考慮する。我々の首席情報セキュリティ官は、我々が発見した特定の脆弱性と、リスク低減のために実施している我々の制御措置について取締役会に提案します。
私たちのサイバーセキュリティ計画は、私たちの最高情報セキュリティ担当者(CISO)が率いる専門チームによって管理されており、彼は最高経営責任者に報告し、必要に応じて私たちのCEOと直接コミュニケーションする能力があります。我々のCISOは20年以上のIT経験を持ち,その中には18年以上のネットワークセキュリティ経験が含まれており,情報セキュリティ修士号を有し,認証された情報システムセキュリティ専門家(CISP)である.上述したように、我々のCISOおよび/または総法律顧問および首席プライバシー官は、四半期ごとに、ネットワークセキュリティ脅威リスクおよび他のネットワークセキュリティ関連事項を取締役会に報告する。
また,我々のネットワークセキュリティリスク管理とデータ戦略プロセスはさらに管理チームメンバーが監視している.これらの管理チームのメンバーは、上述のネットワークセキュリティリスク管理と戦略プロセスを管理と参加し、私たちのイベント応答計画の実行を含むことによって、ネットワークセキュリティイベントの予防、緩和、検出と修復を理解し、監視する。これらの人たちは、情報セキュリティの管理、ネットワークセキュリティ戦略の策定、有効な情報とネットワークセキュリティ計画の実施、およびいくつかの関連する学位と証明書に関連する豊富な以前の仕事経験を持っている。
プロジェクト2.ニュースオペラです。
私たちの会社の本社と研究室が運営しています カリフォルニア州エルモントにあり、私たちは2.6エーカーの土地で61,612平方フィートの建築空間を所有し、占めています。私たちはすでにこの場所にCLIA認証の実験室を設立した。私たちはこれらの施設を実験室テストと管理活動、いくつかの研究と開発、行政、その他の機能に使用しています。
テキサス州のオーウェン、ジョージア州のアルファレッタ、アリゾナ州のフェニックス、マサチューセッツ州のニダムとニューヨーク州のニューヨークにCLIA認証の実験室が設置されています。テキサス州オーウェンでは、2024年5月に期限が切れる賃貸契約によると、約172,000平方フィートをレンタルして占有しています。ジョージア州のAlpharettaでは、2028年3月に期限が切れる賃貸契約によると、約65,000平方フィートをレンタルして占有しています。アリゾナ州フェニックスで、2025年11月に期限が切れる賃貸契約によると、私たちは約25,000平方フィートをレンタルして占有しました。2027年9月に期限が切れる賃貸契約によると、マサチューセッツ州のニダムで約21,000平方フィートをレンタルして占有しています。ニューヨークでは、2024年9月に満期になる賃貸契約によると、約400平方フィートをレンタルして占有しています。私たちはこのような施設を使用して実験室テストといくつかの行政と他の機能を行う。
テキサス州コペルにあるもう一つの不動産を持っています。敷地は六.八エーカーで、約96,500平方フィートの建築空間があります。私たちはこの場所にCLIA認証の実験室を建設している。私たちは既存の施設が現在と予想されている短期的な需要に対応するのに十分であると信じており、必要があれば、商業的に合理的な条項に従ってより多くの空間を提供します。
68
項目3.法律法律手続き。
時々、私たちは正常な業務過程で法的訴訟に巻き込まれるかもしれない。付記8に開示されているように債務、引受、または事項総合財務諸表によると、吾等はいくつかの法律調査、審査及び自発的開示手続を行っており、付記8に記載されている当該等の法律事項に関する開示はここに組み込まれて参考となる。
これらのことの結果は本質的に不確実であり,有利な結果が得られる保証もない.
結果にかかわらず、弁護と和解コスト、管理資源の移転、負の宣伝と名声損害などの要素により、訴訟は私たちに不利な影響を与える可能性がある。
4つ目:地雷の安全TYが披露する。
適用されません。
69
部分第2部:
項目5.登録者普通株式市場、関連株持株者は重要で発行者が株式証券を購入する。
市場情報
2016年9月29日、私たちの普通株はナスダックで取引され、取引コードはFLGTである。2016年9月29日まで、私たちの普通株は市場を公開しなかった。
普通株保有者
2024年2月1日現在、私たちの普通株の登録所有者は14人で、また数量不定の追加株主があり、彼らの普通株はブローカーや他の代理人が彼らを代表して保有している。
配当政策
私たちは現在、将来のどんな収益も維持し、私たちの業務の持続的な発展、運営、拡張に資金を提供すると予想しています。したがって、予測可能な未来に、私たちはどんな現金配当金や他の分配も発表したり支払うことはないと予想される。任意の配当の決定は私たちの取締役会が適宜決定し、私たちの経営結果、財務状況、取締役会の適宜に関連する他の要素に依存します.
登録証券を使って収益を得る
これまでに,我々の普通株を売却した純収益のうち1億467億ドルを使用しており,そのうち450万ドルはFF gene Biotechを買収する前のFF gene Biotechへの貢献,1.264億ドルは会社の運営と業務合併に資金を提供し,1580万ドルは投資保証金ローンの返済に用いられている.私たちの普通株を売却する他のすべての純収益は、社債、市政債券、米国政府、米国機関債務証券のような投資レベルと利息証券に投資される。我々の普通株を売却して得られる収益の計画用途は、目論見書に記載されている用途と実質的に変化しない。
普通株業績グラフ
次の図は,フメット普通株,ナスダック総合指数とナスダックバイオテクノロジー指数の2023年12月31日までの5年間の累計総株主リターン(配当再投資をもとに計算)を比較した。この比較は,2018年12月31日の終値時に,会社の普通株ナスダック総合指数とナスダックバイオテクノロジー指数が100億ドル投資されたと仮定している。歴史的株価表現は必ずしも未来の株価表現を暗示しているとは限らないことに注意されたい。
70
株式買い戻しに関する資料
2023年12月31日までの年間で、会社が買い戻した普通株数と1株当たりの平均支払価格は以下の通り
期間 |
|
(A)購入した株式総数 |
|
|
(B)1株当たり平均支払価格(1) |
|
|
(C)公開発表された計画又は案の一部として購入した株式総数 |
|
|
(D)計画または計画に従って購入可能な最高ドル価値 |
|
||||
2022年5月(2022年5月1日~2022年5月31日) |
|
|
30,000 |
|
|
$ |
49.56 |
|
|
|
30,000 |
|
|
$ |
248,515,000 |
|
2022年6月(2022年6月1日~2022年6月30日) |
|
|
185,000 |
|
|
$ |
48.97 |
|
|
|
185,000 |
|
|
$ |
239,429,000 |
|
2022年8月(2022年8月1日~2022年8月31日) |
|
|
247,000 |
|
|
$ |
47.68 |
|
|
|
247,000 |
|
|
$ |
227,657,000 |
|
2022年9月(2022年9月1日~2022年9月30日) |
|
|
533,000 |
|
|
$ |
43.04 |
|
|
|
533,000 |
|
|
$ |
204,752,000 |
|
2022年10月(2022年10月1日~2022年10月31日) |
|
|
244,000 |
|
|
$ |
37.33 |
|
|
|
244,000 |
|
|
$ |
195,661,000 |
|
2022年11月(2022年11月1日~2022年11月30日) |
|
|
234,000 |
|
|
$ |
35.83 |
|
|
|
234,000 |
|
|
$ |
187,276,000 |
|
2022年12月(2022年12月1日~2022年12月31日) |
|
|
337,000 |
|
|
$ |
34.32 |
|
|
|
337,000 |
|
|
$ |
175,718,000 |
|
2023年9月(2023年9月1日~2023年9月30日) |
|
|
80,000 |
|
|
$ |
27.65 |
|
|
|
80,000 |
|
|
$ |
173,522,000 |
|
2023年10月(2023年10月1日~2023年10月31日) |
|
|
533,000 |
|
|
$ |
25.65 |
|
|
|
533,000 |
|
|
$ |
159,864,000 |
|
2023年11月(2023年11月1日~2023年11月30日) |
|
|
222,000 |
|
|
$ |
26.95 |
|
|
|
222,000 |
|
|
$ |
153,875,000 |
|
2023年12月(2023年12月1日~2023年12月31日) |
|
|
118,000 |
|
|
$ |
27.01 |
|
|
|
118,000 |
|
|
$ |
150,686,000 |
|
合計する |
|
|
2,763,000 |
|
|
|
|
|
|
2,763,000 |
|
|
|
|
||
(1)株式買い戻し計画に従って買い戻した株式を含む手数料。
第六項です[R保存された]
71
項目7.経営陣の以下の問題の議論と分析財務状況と経営実績。
前向きに陳述する
以下、我々の財務状況及び経営結果の検討及び分析は、証券法第27 A節及び取引法第21 E節で指摘された前向きな陳述を含む、我々の連結財務諸表及び本報告に含まれる関連説明と共に読まなければならない。2021年の結果の議論は省略したが,これは余分な議論となるため,従来は我々の2022年年次報告10−K表の7項に含まれていた。展望性陳述は歴史的事実とは関係のない陳述であり、未来の事件や環境あるいは私たちの未来の表現と関係があり、それらは現在の私たちの未来の発展及び私たちの業務に対する潜在的な影響の仮説、期待と信念に基づいている。今回の討論と分析における展望的な陳述は、私たちの未来の財務と経営業績、私たちの未来のキャッシュフローと流動性、私たちの成長戦略、そして私たちの業務と業界の期待傾向に関する陳述を含む。これらの前向き陳述には、“項目1 A”に記載されたリスクおよび不確定要因が含まれるいくつかのリスクおよび不確定要因が存在する。この報告書の最初の部分の“危険要素”。しかも、私たちは競争が激しく急速に発展している業界で運営されており、新しいリスクが時々発生する。私たちが直面する可能性のあるすべてのリスクを予測することはできませんし、すべての要素が私たちの業務に与える影響を評価することもできません。あるいは任意の要素や要素の組み合わせは、実際の結果が私たちの予想とは異なる程度につながる可能性があります。これらのリスクと不確実性を考慮して、本議論および分析で説明された前向きイベントおよび状況は発生しない可能性があり、実際の結果は、私たちが行った任意の前向き陳述に記述または示唆された結果とは大きく異なる可能性がある。私たちの展望的な陳述は私たちが合理的だと思う仮説と期待に基づいているが、私たちは未来の結果、活動レベル、業績、あるいは他の未来の事件を保証することはできない。そのため、展望性陳述に依存するべきではなく、或いはそれを未来の事件の予測と見なすべきではなく、この討論と分析を読む時、未来の実際の成果、活動レベル、業績と業績は著者らの現在の予想と大きく異なる可能性があることを認識すべきである。本議論および分析における展望的陳述は、本報告日までの展望的陳述のみを代表し、法的に別の要求がない限り、本報告日の後に、これらの陳述が実際の結果または私たちが予想する変化と一致するように、任意の理由で任意の前向き陳述を公開更新する義務はない。
概要
私たちは技術ベースの会社で、完全な実験室サービス業務と治療開発業務を持っています。私たちの実験室サービス業務-私たちは以前私たちの臨床診断業務と呼ばれていました-技術実験室サービスと登録医師の実験室結果に対する専門的な解釈を含む。我々の治療開発事業は、新しいおよび既存の癌薬物の治療ウィンドウおよび薬物動態特性、またはPK特徴を改善することを目的とした、新しいナノカプセルおよび標的治療プラットフォームを使用して、複数の癌を治療する候補薬物の開発に専念する。
2023年、私たちの運営収入と純(損失)はそれぞれ2.892億ドルと1億678億ドルだったが、2022年の運営収入と純収益はそれぞれ6.19億ドルと1兆434億ドルだった。
2023年の発展
2023年には、新しいBeacon 787拡張キャリアフィルタボードを発売しました。Beacon 787は常染色体劣性遺伝とX連鎖疾患に関連する合計787個の遺伝子を含む。このグループは米国医学遺伝学とゲノム学会(ACMG)のすべての3級遺伝子を含み,ACMGはその最新のキャリアスクリーニング実践ガイドラインでこの三級遺伝子を発表し,すべての妊娠患者や妊娠を計画している人にこの遺伝子を提供されることを提案し,公平で人種を超えたスクリーニング方法としている。ACMGリストは常染色体劣性遺伝病キャリア頻度>1/200とX連鎖遺伝病携帯率>1/40,000の遺伝子を含む。我々の独自プラットフォームと情報学を利用して,Beacon 787は検出率,偽遺伝子を識別する能力と信頼できるコピー数呼び出しに優れていることが多い。これは私たちにとって重要な製品発表であり、事業者のスクリーニングの前への大きな一歩でもある。キャリアは,個人と夫婦が何らかの遺伝子疾患を子供に遺伝するリスクをスクリーニング評価している。このテストは現在妊娠中で、妊娠を考えている、または将来の妊娠を計画している女性や夫婦に適用される。多くの場合,これらの疾患のキャリアには症状や陽性の家族歴はない。キャリアスクリーニングは,これらの本来未知のリスクを認識し,家族計画に関する賢明な決定を可能にすることができる。米国産婦人科医学会は,人種や家族歴にかかわらず,妊娠を考慮したすべての女性キャリアのスクリーニングを提案している。
われわれの業績に影響を与える要素
提供されたテストの組み合わせ
72
私たちは異なる価格で私たちのテストを提供します。私たちは異なる金額とタイプのコストを生成します。これはテストの複雑さとカスタマイズ化の性質とレベル、そして私たちがテストのために交渉する特定の条項に依存します。これらの条項はお客様によって異なるかもしれません。したがって、いつの時期に渡されたテストの組み合わせや、これらのテストを注文したお客様は、私たちのこの時期の財務結果に影響を与えます。
顧客組合
個々の課金および支払い単位は個々の顧客であり,1つの単位が複数の医師や医療提供者を代表してテストを発注する可能性があると考えられる。私たちの顧客群の構成と集中度は異なる時期に変動する可能性があり、前のある時期には、少数の顧客が私たちの収入の大きな部分を占めています。一般的に、私たちは、これらの重要な顧客を含めて、私たちのどの顧客とも長期調達協定を締結していませんので、彼らのいずれかまたはすべての人は、注文を増加、加速、減少、延期、または停止することを随時決定することができます。顧客ニーズの一部の変動は私たちの業務性質に部分的に起因する可能性があり、私たちの業務性質の中で、私たちの顧客は正常な運営過程で彼らのテスト需要の著しい変動を経験する可能性があると考えられますが、これらの需要変動は、特に私たちの主要顧客にとって、原因が何であっても、私たちの期間の業績に大きな影響を与える可能性があります。
私たちは現在、私たちの顧客を(I)保険、(Ii)機関、病院、医療機関、他の実験室、政府機関、市政当局、大企業、または(Iii)直接支払いの患者を含む3つの支払人タイプに分けている。通常、私たちは機関の顧客に私たちのテスト費用を受け取り、彼らは直接私たちに支払い、それぞれの患者に支払い、あるいは患者の診断に関連するグループに関連する第三者支払人から精算を受ける。私たちの顧客の一部は患者で、医者が検査を手配してくれた後、彼らは自己負担費用を選択して検査費用を支払います。
私たちは私たちが提供するサービスに関連する病院や付属専門科を含めて私たちの顧客市場を多様化するために努力しています。また,支払人(連邦医療保険,一部の州医療補助計画,商業支払人を含む)との関係を求め,我々のテストのカバー範囲や精算を獲得し,より多くの個人医師がこれらのテストを得ることができるように努力している。一般的に、私たちはこれらの新しい顧客関係を構築する際に、適用される支払人、実験室、または他の顧客が交渉価格で私たちのいくつかのテストを提供することに同意しますが、限られた例外を除いて、これらの関係の大多数は、いずれかの当事者が任意の合意された数または頻度で、または私たちのテストを注文する義務がないことを要求する義務はありません。さらに、その後の履行中に十分な支出を提供していない場合に契約をキャンセルすることや、政府の都合の良いときに事前に通知することなく契約を修正または終了することを含む、どの政府機関との関係も、政府契約に関連する独自のリスクの影響を受ける可能性がある。これらの努力は意味のある顧客群や何の増加ももたらさないかもしれないし、私たちが利益を達成したり維持したりする能力を向上させないかもしれない。
幅広い柔軟なテストメニューを維持することができます
私たちは大量の遺伝子を私たちのテストメニューに統合し、意味のある競争優位性を提供すると信じている。我々の製品の組み合わせにおける遺伝子範囲は,より包括的な遺伝情報を提供し,我々の変異検出率を向上させることができ,我々が生成したデータの臨床操作性を増加させることができると信じている。私たちの製品グループの遺伝子範囲も私たちのいくつかの特定の遺伝条件に集中しているいくつかの事前に構築された多遺伝子グループを提供することができます焦点を合わせるそして全面的に腫瘍学専門家グループとビーコン.ビーコンキャリアスクリーニングチームと身体癌グループですさらに、私たちのすべての遺伝子パネルテストは、より多くまたはより少ない遺伝子を含むように上下に調整することができ、またはお客様は、自分の適切な仕様に基づいて自分のパネルを設計することができ、柔軟かつカスタマイズ可能なテストメニューを生成することができる。私たちは、競争相手よりも多くの遺伝子とより大きな発注柔軟性を提供し続けることができると信じています。これは、私たちの業務の長期的な成長の重要な要素かもしれません。
内部コストを低く保つことができます
私たちは様々なノウハウを開発して、私たちの実験室の効率を向上させ、私たちの独自遺伝子プローブ、データアルゴリズム、適応学習ソフトウェア、および遺伝的参考ライブラリを含むテストを行うコストを低減した。この技術プラットフォームは、多くの競争相手よりも低いコストで各テストを行い、結果を渡すことができ、この低コストは、顧客に負担される競争力のある価格を維持することができ、既存の顧客の重複注文を奨励し、新しい顧客を誘致することができると信じている。このような低内部コストは、私たちが業務を発展させ、販売から利益率を得ることができる重要な要素であり、持続的な利益を実現することができると信じている。
私たちの運営能力への投資は私たちの収入コストを増加させるかもしれませんが、これらの投資は短期的および/または長期的に私たちの運営効率を向上させ、収入コストの低下を招く可能性もあります。したがって、このような投資の数量、タイミング、性質、成功、そして私たちの収入コストに与える他の影響は、私たちのコストに影響を与える。また,我々の業務のこれらの方面の投資や他の要因による他の運営費用の変化は考慮されていないが,我々の全体的な業績に影響を与え,全体的なコスト測定ツールとしてのコストの効用を制限する可能性がある.
73
精算の能力を得る
私たちの収入の大部分は、私たちの保険と機関の顧客を含む第三者支払人から私たちのテストの精算を受けることに依存します。これらの支払人は精算申請に複雑な規則と手続きを持っており、彼らの精算方法や手続きは時期によって異なる可能性がある。精算金額は通常監査を経なければなりませんが、私たちがこれらの支払人から精算を受け取り、保留する能力は時期によって異なる可能性があります。もし私たちがいつの時期に精算を獲得したり保留したりすることができなければ、私たちの販売率は予想を下回って、あるいは精算が遅れた場合、私たちの経営業績は相応の影響を受け、異なる時期に大幅に変動する可能性があります。私たちの将来の成長事業計画の一部として、私たちは再び実現して利益を維持するために、第三者支払者から十分な保険と補償を受けるつもりです。しかし、支払人がどのような状況で保険を受けて精算するかどうか、あるいは支払いレベルが何なのかを予測することはできません。たとえ成功しても、第三者支払人との保証と十分な契約精算を実現するのに数年かかるかもしれないと信じています。これまでに国家医療保険会社と直接契約を結び、ネットワーク内のサプライヤーとなり、連邦医療保険計画やいくつかの州医療補助計画のサプライヤーとして登録されてきた これは私たちが交渉の費用率で私たちのいくつかのテストを提供するために、この支払人たちと合意したことを意味する。これは私たちがこれらや他の任意の支払人から十分なレベルのテスト精算を得ることを保証することはできないが、私たちの低コストは、私たちが第三者決済者市場で効果的に競争する能力を強化することができ、私たちは未来により多くの第三者支払者と関係を築く柔軟性を高めることができると信じている。長期的に見ると、私たちは第三者支払者の私たちのテストサービスに対する十分なカバーと補償の成功度を獲得し、維持していることが、私たちの業務の成長速度とレベルの重要な要素になると信じている。
外貨為替レートの変動
これまで、私たちのビジネスのいくつかは非アメリカの顧客から来ていますが、国際顧客基盤の拡大に注力するにつれて、非アメリカ由来の収入レベルが上昇していることを記録することができます。これらの収入源は私たちの業績を外貨為替レートの変化に関する変動の影響を受けさせ、これは私たちが記録した収入に対するドルの外貨の価値に依存する。本報告でカバーするすべての期間において、外貨為替レート変動が私たちの収入の見積もりに与える影響は重要ではないと考えられますが、私たちが国際拡張を続けるにつれて、外貨為替レート変動の影響は将来的に増加する可能性があります。
新冠肺炎検査サービス
著者らは2020年に新冠肺炎テストサービスを開始した後、2020年、2021年と2022年に著しい業務量の増加を経験した。著者らの検査測定の大部分は疫病期間中に著者らがある県、州と直轄市で行った新冠肺炎測定によるものである。しかし、疫病発生後の新冠肺炎検査に対する需要の低下、及び著者らは著者らの新冠肺炎検査サービスを削減することを決定したため、著者らは未来に新冠肺炎測定から実質的な収入を得ないことを予想している。
業務リスクと不確実性
私たちの業務と展望は多くの危険と不確実な要素に直面している。より詳細を知る必要があれば、“第1 A項”を参照されたい。危険要素“はこの報告書にある。
財務概要
収入.収入
著者らの実験室サービス部門は分子測定から来ており、精密診断と解剖病理学、生物製薬サービスと新冠肺炎測定を含む。私たちは、発注医や他の顧客に報告を渡す際に、既定の料金率に基づいて、契約や他の調整を減算して、予想される金額を達成するために収入を確認します。私たちの治療開発部門はまだ営業前にいる。
収入コスト
収入コストは、検査結果を送達することによって生成された総コストを反映し、実験室試薬および用品コストと、給与、従業員福祉コスト、ボーナス、および株式ベースの補償費用を含む人員コストと、実験室設備減価償却と、検査すべき標本の輸送に関連する配達および宅配費用と、レンタル改善償却と、賃貸料および光熱費を含む間接費用と、を含む。テストを処理する際には,テストの実行に関するコストを記録する.
74
運営費
私たちの運営費用は、研究開発、販売とマーケティング、一般と行政、無形資産の償却、再編コスト(あれば)の5つに分類される。無形資産の償却を除いて、各カテゴリの最大の構成要素は人員コストであり、その中には賃金、従業員福祉コスト、ボーナス、および株式ベースの給与支出が含まれている。
研究と開発費
研究開発費とは,我々の技術の開発や将来のテストや治療によるコストである。これらのコストには
私たちは研究開発費が発生している間にすべての研究開発費を支出する。私たちの研究開発費は絶対ドルで引き続き増加すると予想されています。研究開発活動に投資し続け、私たちのプラットフォームの応用を革新し、拡大していく予定です。また,現在開発·臨床試験中の候補薬剤に関する増量費用が生じるため,我々の治療開発部門の研究·開発費用が増加することが予想される。臨床開発後期段階にある候補薬物は通常より高い開発コストを有しており,これは主に後期臨床試験の規模と持続時間の増加によるものである。したがって,FID−007の第2段階試験を開始する際に多くの研究や開発費用が発生することが予想される。
販売とマーケティング費用
販売およびマーケティング費用には、人員コスト、顧客サービス費用、直接マーケティング費用、教育および販売促進費用、賃貸料および光熱費を含む市場研究および分析、分配された管理費用が含まれる。私たちのすべての販売とマーケティング費用は発生した費用で計算されます。私たちの販売とマーケティング費用は絶対金額で計算して引き続き増加すると予想されています。これは、主にここ数年、私たちの販売チームの発展と拡大、新しい販売とマーケティング戦略の作成と実施、そして私たちのマーケティング努力の全体的な範囲を拡大することを含む販売とマーケティングへの投資が増加したためです。
75
一般と行政費用
一般的かつ行政的費用には、行政、財務、会計、法律、人的資源機能が含まれる。これらの費用には、人員費用、監査、法律費用、相談費用、分担の間接費用が含まれ、レンタル料と光熱費が含まれる。私たちは発生したすべての一般的な費用と行政費用を負担する。私たちは引き続き業務規模を拡大し、絶対ドルで計算すると、私たちの一般と行政費用は引き続き増加すると予想しています。また、上場企業運営の結果として、米国証券取引委員会やナスダック株式市場の規制の遵守に関する費用、追加の保険費用、投資家関係活動、その他の行政·専門サービスを含む一般的かつ行政的費用が発生し続けることが予想される。
無形資産の償却
無形資産の償却は顧客関係の償却費用、印税免除技術、商号、実験室情報システムプラットフォームと業務合併によって発生した現地無形資産及び獲得した特許を含む。私たちは直線法を使って収益を推定する間に有限寿命無形資産を償却する。無期限に課金された無形資産は、毎年、またはイベントまたは状況が資産の帳簿価値を回収できない可能性があることを示すたびに減値テストを行う。減値を計算すれば、私たちは帳簿額面が資産公正価値を超えた金額で減値損失金額を計量する。
再構成コスト
再編コストは、非自発的に終了した新規買収エンティティに関連する従業員が提供する一次従業員離職福祉を指す。2022年第2四半期、経営陣は終了計画を承認し、承認した。この計画は、解雇される具体的な従業員を決定し、これらの従業員が解雇されたときに得られる福祉条件を決定した。2022年以降の離職計画では追加費用は発生せず、残高を支払いました。
所得税支給
所得税準備金にはアメリカ連邦と州所得税が含まれている。繰延税金項目負債はすべての課税の一時的な差異であることが確認され、繰延税項資産はすべて差し引くことができる一時的な差異、営業損失、税収の繰越免除であることが確認された。繰延税金資産の一部または全部が現金化できない可能性が高い場合には、推定準備を提供する。
私たちの有効税率に最も影響を与える要素は、純収益といくつかの控除のレベルを含み、株式ベースの給与、州所得税の影響、配当金調整と外国税率の違いに関連する要素を含む。私たちは、これらの要素が私たちの総合有効税率が今後しばらくアメリカ連邦所得税税率と大きく異なることをもたらすかもしれないと予想している。
76
経営成果
次の表に,我々が列挙した期間ごとに業務を継続した結果をまとめる.歴史的結果は今期または未来の任意の時期の予想結果を表すものではない。
|
十二月三十一日までの年度 |
|
|
$ |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
運営報告書データ: |
(千ドル) |
||||||||||||
収入.収入 |
$ |
289,213 |
|
|
$ |
618,968 |
|
|
$ |
(329,755 |
) |
|
(53)% |
収入コスト |
|
184,757 |
|
|
|
252,067 |
|
|
|
(67,310 |
) |
|
(27)% |
毛利 |
|
104,456 |
|
|
|
366,901 |
|
|
|
(262,445 |
) |
|
(72)% |
運営費用: |
|
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
41,440 |
|
|
|
28,910 |
|
|
|
12,530 |
|
|
43% |
販売とマーケティング |
|
41,467 |
|
|
|
38,918 |
|
|
|
2,549 |
|
|
7% |
一般と行政 |
|
88,999 |
|
|
|
111,074 |
|
|
|
(22,075 |
) |
|
(20)% |
無形資産の償却 |
|
7,845 |
|
|
|
6,497 |
|
|
|
1,348 |
|
|
21% |
営業権減価損失 |
|
120,234 |
|
|
|
— |
|
|
|
120,234 |
|
|
* |
再構成コスト |
|
— |
|
|
|
2,975 |
|
|
|
(2,975 |
) |
|
* |
総運営費 |
|
299,985 |
|
|
|
188,374 |
|
|
|
111,611 |
|
|
59% |
営業収入 |
|
(195,529 |
) |
|
|
178,527 |
|
|
|
(374,056 |
) |
|
(210)% |
利息とその他の収入,純額 |
|
21,444 |
|
|
|
5,498 |
|
|
|
15,946 |
|
|
290% |
所得税前収入 |
|
(174,085 |
) |
|
|
184,025 |
|
|
|
(358,110 |
) |
|
(195)% |
所得税支給 |
|
1,154 |
|
|
|
42,102 |
|
|
|
(40,948 |
) |
|
(97)% |
合併経営の純収入 |
|
(175,239 |
) |
|
|
141,923 |
|
|
|
(317,162 |
) |
|
(223)% |
非持株権益は純損失を占めなければならない |
|
7,414 |
|
|
|
1,480 |
|
|
|
5,934 |
|
|
401% |
富金の純収入に帰することができる |
$ |
(167,825 |
) |
|
$ |
143,403 |
|
|
$ |
(311,228 |
) |
|
(217)% |
収入.収入
|
十二月三十一日までの年度 |
|
|
$ |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
収入データ: |
(千ドル) |
||||||||||||
精密診断学 |
$ |
131,990 |
|
|
$ |
93,685 |
|
|
$ |
38,305 |
|
|
41% |
解剖病理学 |
|
104,655 |
|
|
|
74,799 |
|
|
|
29,856 |
|
|
40% |
新冠肺炎 |
|
27,152 |
|
|
|
437,507 |
|
|
|
(410,355 |
) |
|
(94)% |
バイオ製薬サービス |
|
25,416 |
|
|
|
12,977 |
|
|
|
12,439 |
|
|
96% |
合計する |
$ |
289,213 |
|
|
$ |
618,968 |
|
|
$ |
(329,755 |
) |
|
(53)% |
収入は2022年の6.19億ドルから2023年の2億892億ドルに低下し、3兆298億ドル減少し、減少幅は53%となった。期間内収入の減少は新冠肺炎テスト収入の94%減少によるものであるが、期内の他の収入源の44%増加によって部分的に相殺された。
私たちは2023年第1四半期末に新冠肺炎テスト事業を停止した。したがって、私たちは私たちの精密診断、解剖病理学、そして生物製薬サービスの収入フローを増加させることに集中してきた。2023年12月31日までの1年間に、精密診断、解剖病理と生物製薬サービスはそれぞれ著者らの総合収入の46%、36%と9%を占め、2022年と比べて、それぞれ3830万ドル、2990万ドル、1240万ドル増加した。精密診断収入と解剖病理収入の増加は,2023年に2022年に比べて4カ月の収入が増加したためであり,これは2022年4月末にInform Diagnosticsを買収したためである。精度診断の増加も生殖健康サービスの増加によるものであり,我々が拡大したBeacon 787テストも含まれている。BioPharmaサービスの増加は、いくつかの集中的な顧客が増加したためだ。
これらの収入源能力の増加に影響を与える要因としては,1)我々が提供する平均価格と第三者支払者の収益率,2)我々支払者ベースの集中度,3)広範で柔軟なテストメニュー,検出率,回転時間による我々の競争優位性,および4)潜在市場規模の増加が考えられる。第三者支払者の推定入金金額は,請求書,精算規定,クレーム処理の複雑さや曖昧性の影響,連邦医療保険や医療補助計画特有の考慮要因を受けている。当社の独自技術プラットフォームは、広範で柔軟なテストメニューの有料拡張を可能にしているので、お客様によりスケーラビリティとより手頃なテストを提供することができます。近年、私たちの収入の変化は主に私たちが提供したテスト量によって推進されており、特に私たちの新冠肺炎のテスト量は
77
私たちがこの期間内に渡したテスト。将来を展望して、私たちはこの競争優位性を維持し、私たちのマーケティング努力でこれを強調し、私たちのテスト収入を増加させるために努力します。
私たちの顧客群は保険、機関、そして個人支払人を含む。ある時期、私たちの収入は少ない数の顧客に集中していた。研究室サービス部門、すなわち共同制御されている顧客を集約する場合、1つの顧客は2023年の収入の3570万ドルまたは12%を占め、もう1つの顧客はそれぞれ2022年と2021年の収入の1.156億ドルまたは19%と2.602億ドルまたは26%を占める。このような収入リスクを低減するために、顧客数を増加させ、集中度を低下させることに焦点を当てる。
非米国由来の収入は440万ドル、あるいは28%増加し、2022年の1580万ドルから2023年の2020万ドルに増加した。期間中の非アメリカ由来の収入増加は主に私たちが合弁企業を通じて中国の顧客に販売する伝統的な遺伝子検査サービスが増加したためであり、この合弁企業は2023年に1,140万ドルの総収入に貢献した。
収入コスト
|
十二月三十一日までの年度 |
|
|
$ |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
|
(千ドル) |
||||||||||||
収入コスト |
$ |
184,757 |
|
|
$ |
252,067 |
|
|
$ |
(67,310 |
) |
|
(27)% |
収入に占める収入コストの割合 |
|
63.9 |
% |
|
|
40.7 |
% |
|
|
23.2 |
% |
|
56.9% |
私たちの総合収入コストは2022年の2億521億ドルから2023年の1兆848億ドルに低下し、減少幅は6730万ドル、減少幅は27%だった。減少の主な原因は、生産コンサルティングと外部労働コストが3,210万ドル減少し、試薬·供給費が2,590万ドル減少し、減価償却費用が1,230万ドル減少し、輸送費用が530万ドル減少し、出張·飲食費が120万ドル減少し、施設費が290万ドル減少したことが、2022年4月末にInform Diagnosticsを買収したため、2022年のコストが2022年より4ヶ月増加し、2022年4月末にInform Diagnosticsを買収したためである。
私たちの総合収入コストが収入に占める割合は40.7%から63.9%に増加した。私たちの毛利益は2022年の3兆669億ドルから2023年の1.045億ドルに減少し、2兆624億ドル減少し、減少幅は72%だった。私たちの毛利益が収入に占める割合、すなわち毛金利は、59.3%から36.1%に低下した。これらの変化は主に毛金利の高い新冠肺炎テスト収入の減少と、2023年にINFO診断会社が4ヶ月のコストを追加したためである。
研究と開発
|
十二月三十一日までの年度 |
|
|
$ |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
研究開発 |
(千ドル) |
||||||||||||
実験室サービス |
$ |
29,748 |
|
|
$ |
28,164 |
|
|
$ |
1,584 |
|
|
6% |
治療が進む |
|
11,692 |
|
|
|
746 |
|
|
|
10,946 |
|
|
1467% |
|
$ |
41,440 |
|
|
$ |
28,910 |
|
|
$ |
12,530 |
|
|
43% |
実験室サービス部門の研究と開発費用は主に私たちの技術の開発と将来のテストとテストサービスに使われます。2023年の2970万ドルの支出には、主に2550万ドルの人件費、ボーナスと株式ベースの給与、110万ドルの試薬と供給費、110万ドルの施設費用、69.8万ドルの減価償却費用、40万ドルのソフトウェアと許可費用が含まれる。2022年の2820万ドルの支出には、主に2340万ドルの人件費、ボーナスと株式ベースの給与、220万ドルの試薬および供給費、78.5万ドルの減価償却費、58.7万ドルのコンサルティングおよび外部労働コストが含まれる。
2023年と2022年,治療開発部門の研究と開発費用はそれぞれ1170万ドルと74.6万ドルであり,主にFID−007の開発に関係している。2022年は一部の年であり、この部分は2022年11月に買収されたからだ。2023年の研究開発費には、業務合併の一部である持分計画下の株式ベースの報酬と、複数のCROとの薬物研究の450万ドルが含まれる640万ドルの人件費が含まれる。2024年第2四半期にFID-007第2段階研究を募集する予定であるため、今後この分野の研究開発支出が大幅に増加することが予想される。
78
販売とマーケティング
私たちの総合販売とマーケティング費用は250万ドル、すなわち7%増加し、2022年の3890万ドルから2023年の4150万ドルに増加した。この増加は,主にソフトウェア費用が220万ドル増加し,施設費が150万ドル増加し,人員コストが742,000ドル増加したこと,株式報酬費用が増加したこと,広告やマーケティング費用が456,000ドル増加したことによるものであり,これは主に2023年に2022年4月末のInform Diagnostics買収に比べて4カ月間コストが増加したが,新冠肺炎テストの減少に関する相談や外部労働コストが260万ドル減少し,その増加を部分的に相殺したためである。
一般と行政
私たちの総合一般と行政費用は2210万ドル、すなわち20%減少し、2022年の1.111億ドルから2023年の8900万ドルに減少した。減少の要因は,2022年4月末にInform Diagnosticsを買収したため,2023年は2022年に比べて4カ月間コストが増加し,2023年の2022年の業務合併に関する買収コストは4カ月増加し,2023年は2022年に比べて4カ月増加し,信用損失準備金は3350万ドル減少し,2022年の業務合併に関連する買収費用は620万ドル減少し,Inform Diagnosticsによる一次ライセンスと許可費用は260万ドル減少したが,被人員コスト(持分ベースの給与費用を含む),施設費の610万ドル増加,減価償却費用増加360万ドル分が相殺されたためである。そして300万ドルの法律と専門費用は、付記8で述べたように、私たちの自発的な開示過程に関する法的責任である債務、引受、または事項2022年および2021年に買収されたエンティティは、財務諸表および内部統制監査および審査の範囲に含まれるため、連結財務諸表および内部統制監査および審査は150万ドルの会計費用に関連する。
無形資産の償却
私たちが合併した無形資産の償却には、2022年と2021年の業務合併によって生じた無形資産の償却費用と、2021年に購入された特許が含まれています。無形資産償却の増加は、主に2022年の業務合併により無形資産が増加したためだ。
営業権減価損失
|
十二月三十一日までの年度 |
|
|
$ |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
営業権減価損失 |
(千ドル) |
||||||||||||
実験室サービス |
$ |
120,234 |
|
|
$ |
— |
|
|
$ |
120,234 |
|
|
* |
治療が進む |
|
— |
|
|
|
— |
|
|
|
— |
|
|
* |
|
$ |
120,234 |
|
|
$ |
— |
|
|
$ |
120,234 |
|
|
|
2023年の営業権減額損失には、実験室サービス報告単位の1.202億ドルの全額営業権減価損失が含まれます。2022年12月31日まで年度は営業権減価損はなかった。全面的な減価は私たちの株価と時価が低下し続けているためです。2023年12月31日および2022年12月31日までに治療発展単位に減値損失はなかった。参照してください付記17、営業権、無形資産、もっと詳しい情報を知ります。
再構成コスト
再編費用は従業員に提供される一次退職給付であり、これらの福祉は2022年に新しい実体を買収したときに非自発的に終了した。
利息とその他の収入,純額
利息とその他の収入を差し引くと、純額は主に純利息収入で構成され、2023年と2022年はそれぞれ2110万ドルと530万ドルとなる。この利子収入は,有価証券の実現済み収益と保有収益(損失)を含む各種有価証券投資で稼いだ利息に関係しており,支払手形の利息支出や保証金ローンを差し引いている。
所得税支給
2023年と2022年の所得税支出はそれぞれ120万ドルと4210万ドル。2023年と2022年の有効所得税税率はそれぞれ所得税前収入の(0.69%)と22.7%である。2022年と比較して2023年の有効税率が変化したのは、会社の繰延税項純資産に推定準備が設けられているためである。FASB ASC 740
79
繰延所得税資産の一部または全部が現金化できない可能性が高い場合、繰延所得税資産減価準備が要求される。当社はそのいかなる繰延税金資産の現金化能力を評価しており、当社はその繰延税金資産の利益を実現できない可能性が高いため、2023年12月31日に全額推定準備を提供していると結論した。
付記11を参照所得税所得税に関するより多くの情報は、本報告に含まれる総合財務諸表を参照されたい。
非持株権益は純損失を占めなければならない
非持株権益は純損失を占めるべきであり、完全資本が実体を持っていない少数の株主は純損失を占めるべきである。
80
流動性と資本資源
流動性と現金源
私たちは2023年12月31日と2022年12月31日まで、それぞれ8.477億ドルと8.529億ドルの現金、現金等価物、有価証券を持っている。2023年12月31日と2022年12月31日まで、私たちの有価証券は主にアメリカ政府とアメリカ機関債務証券、アメリカ国庫券、社債、市政債券、ヤンキー債務証券を含みます。
私たちの現金の主な用途は、私たちの株を買い戻し、私たちの運営に資金を提供し、私たちが投資を続け、業務成長を求めると同時に、戦略買収に資金を提供することです。運営費に資金を提供するための現金は費用支払時間の影響を受けており、これは我々の未済売掛金や売掛金の変化に反映されている。
私たちは、私たちの既存の現金、現金等価物、および短期有価証券は、少なくとも今後12ヶ月間の私たちの予想される現金需要を満たすのに十分だと信じている。業務部門が提供する現金は、資本支出の支払いを含む流動性需要を満たす能力を大幅に向上させているが、当業務部門が提供する現金は過去に一定期間の変動を経験しており、この変動は今後も継続される可能性が予想される。これらの変動は、私たちのテスト需要、販売金額および時間、製品の組み合わせの変化によって請求されるテスト価格、お客様の組み合わせ、テストの一般的な価格低下または他の要因、私たちの請求書および入金サイクルの速度および時間、ならびに私たちの約束および他の支払いの時間および金額などに関連する要素によって引き起こされる可能性があります。さらに、私たちの流動性予想が正しくても、私たちは証券発行、信用手配、または他の債務融資、資産売却、または協力、または許可手配を通じて追加資本を調達することを求めることができる。
もし私たちが株式証券を発行することでより多くの資金を調達すれば、私たちの既存の株主は深刻な希釈を経験するかもしれない。さらに、私たちが発行した任意の優先株は、私たちの普通株よりも優先的な権利、優先または特権を提供する可能性があり、私たちが追加の株式証券を発行したり、そのような証券を発行したりする可能性は、私たちの普通株の市場価格を低下させる可能性がある。私たちが発行した任意の債務証券または私たちが生成した任意の借金の条項は、利用可能であれば、追加債務の発生や追加株式の発行能力の制限、または私たちの業務を展開する能力に悪影響を及ぼす可能性のある他の制限など、当社の業務に重大な制限を加える可能性があり、固定支払義務の増加につながる可能性があります。もし私たちが資産の売却や協力や許可の手配を求めて資金を調達する場合、私たちは不利な条項を受け入れることを要求されるかもしれないし、私たちが自ら開発した重要または価値のある技術やテストを求める権利を放棄することは第三者に与えることができるかもしれない。また、将来の資本を求める過程で、投資銀行、法律、会計費用、印刷·配布費用、その他の同様のコストを含む大量のコストが発生する可能性があります。必要な時、私たちは受け入れ可能な条件や追加的な資金を得ることができないかもしれない。もし私たちが必要な時に合理的な条件で資金を得ることができなければ、私たちは1つ以上の販売とマーケティング計画、研究開発計画、または他の成長計画または戦略の延期、縮小、または廃止を余儀なくされるかもしれない。さらに、私たちは、私たちのテストまたは市場開発計画または計画の1つまたは複数の面でパートナーと協力することを余儀なくされる可能性があり、これは、これらのテスト、計画、または計画の私たちに対する経済的価値を低下させるかもしれない。このようなどんな結果も私たちの業務、業績、そして将来性を深刻に損なう可能性がある。
キャッシュフロー
以下の表は、各期間継続業務のキャッシュフローをまとめたものである
|
十二月三十一日までの年度 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
経営活動が提供する現金純額 |
$ |
27,003 |
|
|
$ |
253,520 |
|
投資活動提供の現金純額 |
$ |
38,898 |
|
|
$ |
(261,314 |
) |
融資活動のための現金純額 |
$ |
(47,785 |
) |
|
$ |
(77,141 |
) |
経営活動
2023年12月31日までの1年間、我々の業務は2700万ドルの現金を提供したが、2022年は2億535億ドルだった。2022年同期と比べ、2023年の運営活動が提供する現金は2兆265億ドル減少し、主に2023年の新冠肺炎収入が枯渇し、現金収益、顧客現金収入、運営費用の現金支払いが減少したためである。私たちが計画しているFID−007臨床試験と、資源を投入して私たちの実験室サービス業務を発展させていくため、来年はより多くの運営費用が発生し、運営活動でより多くの現金を使用することが予想されます。
81
投資活動
2023年の投資活動で提供される現金は3,890万ドルで、主に5.086億ドルの有価証券満期日、4,410万ドルの有価証券販売所得と775,000ドルの有価証券販売に関連し、有価証券4.919億ドルの購入、主に医療実験室設備と建築内装からなる固定資産2,220万ドル、業務買収に関する39.9万ドルの部分相殺に関連する。
2022年の投資活動のための現金は2.613億ドルで、主に有価証券の4.18億ドルの購入、業務買収に関する1.727億ドル、主に医療実験室設備と建築改善からなる固定資産の購入に関する1,880万ドル、償還可能な優先株の購入に関する1,500万ドル、業務買収に関連するまたは対価格支出1,000万ドルであり、有価証券の満期日に関する2.325億ドルと有価証券の売却に関連した1.402億ドルが部分的に相殺される。
融資活動
2023年の融資活動のための現金は4,780万ドルで、主に普通株の買い戻しのための2,510万ドル、保証金口座の返済のための1,500万ドル、支払手形の返済のための430万ドル、従業員の納税義務のための普通株の源泉徴収のための270万ドルに関する。
2022年の融資活動のための現金は7,710万ドルで、主に普通株を買い戻すための7,430万ドルと、従業員に源泉徴収普通株を納税するための180万ドルに関連する。
2023年12月31日までの強力な現金状況のため、信用手配は一切使用されないと予想されます。
株買い戻し計画
2022年3月、私たちの取締役会は2億5千万ドルの株式買い戻し計画を承認した。株式買い戻し計画はライセンス日から満期日がありません。株式買い戻し計画によると、会社は時々公開市場またはひそかに協議した取引で株式を買い戻すことができる。
2023年12月31日までの年間で、株式買い戻し計画に基づいて953,000株の普通株を買い戻し、総コストは2,510万ドルとなった。2022年12月31日までの年間で、株式買い戻し計画に基づいて180万株の普通株を買い戻し、総コストは7,430万ドルだった。2023年12月31日現在、私たちの株式買い戻し計画によると、将来の私たちの普通株買い戻しに約1兆507億ドルが使用されています。
2023年12月31日までの材料現金需要と契約義務
2023年12月31日まで、私たちは77.5万ドルの西龍科学手形の未返済残高があります。この手形は2024年3月に満期になり、340万ドルの分割払いローンがあります。その中で今期の部分は408,000ドルです。付記8を参照債務、引受、または事項私たちの連結財務諸表は本報告書に含まれています。
以下は、2023年12月31日現在の契約義務の概要です
|
期限どおりの支払い |
|
|||||||||||||||||
|
合計する |
|
|
1年もたたないうちに |
|
|
1-3年 |
|
|
3-5年 |
|
|
5年以上 |
|
|||||
|
(単位:千) |
|
|||||||||||||||||
経営リース義務(1) |
$ |
12,242 |
|
|
$ |
4,309 |
|
|
$ |
4,140 |
|
|
$ |
2,243 |
|
|
$ |
1,550 |
|
融資リース義務(2) |
|
1,368 |
|
|
|
532 |
|
|
|
836 |
|
|
|
— |
|
|
|
— |
|
購入義務(3) |
|
51,934 |
|
|
|
29,669 |
|
|
|
22,265 |
|
|
|
— |
|
|
|
— |
|
*契約全体の義務 |
$ |
65,544 |
|
|
$ |
34,510 |
|
|
$ |
27,241 |
|
|
$ |
2,243 |
|
|
$ |
1,550 |
|
82
重要な会計政策と試算の使用
本議論と分析は、米国公認会計原則または米国公認会計原則に基づいて作成された本報告書に含まれる総合財務諸表に基づく。アメリカ公認会計原則に基づいて総合財務諸表を作成することは管理層にいくつかの推定、判断、仮説と決定を行うことを要求し、これらの推定、判断、仮説と決定は報告金額と関連開示に影響を与え、適切な会計原則と会計推定を選択するための根拠の仮定を含む。当該等の推定及び仮定及び当該等の決定を行う際に、吾らは、関連状況の理解及び分析に基づいて判断し、財務諸表の日付を総合して得られた履歴データ及び経験、及び経営陣がその状況に属すると考える他の様々な要因を含むが、最近の業務合併における無形資産及び営業権の推定値を含むが限定されない。実際の結果は私たちの推定とは違うかもしれない。私たちは会計原則、仮説と推定を組み込むことに力を入れて、財務諸表に含まれる会計情報の代表的な真実性、検証可能性、中立性、透明性を促進する。
我々の主な会計政策は、本報告に含まれる総合財務諸表付記により詳細に記載されているが、我々の総合財務諸表を作成する際に用いられる以下の議論の会計政策には、最も重要な見積もり、判断、仮説、決定が必要であると考えられる。
収入確認
私たちは私たちの検査サービスを販売することで収入を得る。私たちは現在、病院、医療機関、他の実験室、政府機関、市政当局、大企業を含む保険、機関顧客、および直接支払いの患者を含む機関から支払いを受けている。
私たちが確認した収入額は、約束された商品やサービスを私たちの顧客に移すことと引き換えに、私たちが獲得する権利があると予想された価格を反映している。
連邦医療保険、契約規定の精算料率、または他の保険がない場合、私たちの契約は可変対価格を含み、連邦医療保険または商業健康保険保証人が支払う金額が私たちの標準料率を下回る可能性があるか、または全く支払わない可能性があるので、このような違いは暗黙的な価格割引とみなされる。これらの価格特典の可変対価格に起因することができ、会計基準を使用して、顧客との契約収入またはASC 606下の“最も可能な金額”方法を所望の価値で計量することができる。金額は、可能な結果範囲、私たちの過去の経験の予測価値、不確実性の解決が期待される時間帯、および私たちの影響以外の要因(例えば、第三者の判断および行動)の影響を受ける対価格金額を考慮しながら、テストタイプおよび支払い人間の別の履歴の平均支払率によって決定される。このような可変対価格は取引価格のみを計上しており,金額に関する不確実性が解決された場合,確認された累積収入金額が大きく逆転しない可能性が高いことを前提としている.契約により償還範囲が合意されていない場合、又は支払人と予測可能なモード及び入金履歴がない場合には、可変対価格が制限され、取引価格から除外されることができる。
私たちは各報告期間の終了時に私たちの推定取引価格を再評価します。可変対価格の推定が制限されているかどうかを含めて、不確実性が解決されると、累積収入の大きな逆転が発生しない可能性が高いです。私たちはその期間の収入に必要な調整を記録する。2023年12月31日までの年間で、2,300万ドルの可変対価格は、前四半期に完了した新冠肺炎テスト収集に関連する追加収入として確認された。
営業権と無期限無形資産の価値評価
企業合併·資産減額審査で買収された資産の推定には、重大な推定と仮定が必要である。企業合併の買収会計方法は、減価償却または償却された資産と営業権との間に買収価格の価格を適切に分配するために、買収資産の公正価値、負担された負債および被買収企業の任意の非制御的権益を推定することを要求する。
83
私たちは毎年営業権と無期限無形資産の減値を評価し、もし事件や状況の変化が発生すれば、報告単位の公正価値がその帳簿価値よりも低い可能性が高く、年間テストの間で評価を行います。我々は,任意の報告単位を迂回した減値定性的評価を選択し,直接定量化評価を行うことができる.報告先の帳簿金額がその公正価値を超えた金額について減値損失を確認する。
我々の定量的評価には,各報告単位の公正価値を推定し,帳簿価値と比較することがある.私たちは収入と市場に基づく推定方法を用いて報告単位の公正価値を推定する。私たちは一般的に第三者評価会社を招いて私たちの評価を助けるつもりだ。収益法と市場法から得られる推定価値範囲に基づいて,報告単位ごとに推定公正価値を決定した。報告単位の推定公正価値がその帳簿価値を超える場合、営業権は欠陥することもなく、さらなる審査も必要ない。
収益に基づく公正価値方法は,報告単位の予測に基づいて将来のキャッシュフローを予測し,これらのキャッシュフローは報告単位の加重平均資本コストを用いて現在値に割引する.収入に基づく方法では、経営陣が経営する市場の経済状況や資本市場の状況を仮定して判断することが求められており、その多くは経営陣のコントロール下にない場合が多い。市場の公正価値方法に基づいて、上場会社の評価方法を指導することに着目して、比較可能な上場会社の価格を確定し、合併と買収方法、即ち最近販売されている類似業務に着目し、著者らの報告単位の価値を推定する。市場に基づく方法では,市場倍数と最近の取引を評価する際に判断する必要がある.
私たちは2023年12月31日に年間営業権と無形資産減価テストを行い、選択可能な定性テストを選択し、私たちの実験室サービスと治療開発報告機関に対して定量的な評価を行い、その中に不確定無形資産を含む。
営業権または進行中の研究開発またはIPR&D、減値分析のための推定および仮説管理は、将来の業績の正確な予測であることが証明されることは保証されない。営業権または無形資産の減価または回収可能性に関する結論は今後の間に変化する可能性がある。私たちは治療開発報告書を引き続き監視するつもりだ。すべての知的財産権研究開発プロジェクトに対して、これらの候補製品の開発と商業化の適時かつ成功に関連する重大なリスクと不確定性は、臨床試験データに基づいてその治療効果を確認する能力、必要な監督管理許可を得る能力、及び予算コスト内でこれらの任務を成功させる能力を含む。規制部門の承認を得ずに,ヒト治療薬を市場に出すことはできないが,この承認は臨床試験を完了し,候補製品が安全かつ有効であることを証明する必要がある。また、第三者支払者(政府医療計画および個人保険計画を含む)のカバーおよび精算の利用可能性および範囲は、製品が発生することができる収入に影響を与える。したがって、これらの買収された知的財産権研究開発プロジェクトの最終実現価値(あれば)は、その推定の公正価値とは異なる可能性がある。
最近の会計公告
注2を参照重要会計政策の概要我々の連結財務諸表は、最近の会計声明に関する情報を理解するために本報告書に含まれている。
表外手配
米国証券取引委員会の規則および規定によって定義された期間内に、私たちは、私たちの財務状況、財務状況、収入または支出、経営業績、流動性、資本支出、または投資家に重要な資本資源に現在または未来の影響を与える可能性がある表外手配もありません。
第七A項。定量と合格市場リスクの開示について。
私たちは金利変動と外貨両替の市場リスクに直面しており、これは私たちの経営業績や財務状況に悪影響を及ぼす可能性がある。
金利リスク
私たちは、会社債務証券、市政債券、アメリカ政府と機関債務証券、外国政府発行の債務ツールを含む取引可能な債務証券に投資します。私たちの投資政策と戦略は資本を保存し、私たちの流動性要求を支持することに重点を置いている。私たちは通常、格付けの高い証券に投資し、主な目標は潜在的な元本損失リスクを最小限にすることだ。私たちは固定金利収益証券への投資にある程度の金利を持っています
84
リスクです。金利上昇により、固定金利証券の公平な市場価値が悪影響を受ける可能性がある。我々が債務証券を売却できる未実現収益や損失は,主に購入時の金利と比較した金利変動によるものである。私たちは公正な価値で私たちの債務証券を計量し、他の全面収益に損益を記録して、証券が売却されるまで、任意の予想される信用損失を減算します。
我々のポートフォリオに関する金利リスクを有意に評価するために,収益率曲線が100ベーシスポイント平行移動すると仮定し,金利変化がポートフォリオ価値に及ぼす影響を決定する感受性分析を行った。2023年12月31日と2022年12月31日までの投資頭寸によると、すべての期限の金利が100ベーシスポイント上昇すると仮定すると、ポートフォリオの公平な市場価値がそれぞれ1010万ドルと730万ドル増加する。このような損失は私たちが満期前に投資を売却する時にのみ達成されるだろう。
外貨リスク
私たちは複数の通貨で取引を行い、また、私たちの非ドル機能通貨子会社の資産と負債をドルに変換します。外貨建ての外国資産、負債、収入およびコストと支出は、外貨対ドルレート変動のリスクに直面させている。私たちの外貨開放は主に人民元に集中しています。外貨両替リスクを分析するために、外貨為替レートの歴史的傾向を考慮し、短期的に為替レートに10%の不利な変化が生じる可能性があることを確認した。
貸借対照表日に10%の外貨為替レートの不利な変化を機能通貨以外の通貨で計算された総通貨資産に適用すると、2023年12月31日までの所得税前収入が約130万ドル減少し、2022年12月31日現在の所得税前収入が84.4万ドル減少する。
85
項目8.財務状況TSと補足データ。
本プロジェクト8によって要求される情報は、本報告書の署名ページの直後にあり、参照によって本明細書に組み込まれる。
項目9.Accouとの変更と分岐会計と財務情報開示の専門。
ない。
第9条。制御するプログラムがあります
情報開示制御とプログラムの評価
開示制御プログラムは、会社の制御プログラム及び他のプログラムであり、会社が取引法に基づいて提出又は提出された報告において開示を要求する情報が、米国証券取引委員会規則及び表に指定された時間帯に記録、処理、まとめ及び報告されることを確保することを目的としている。開示制御及び手続は、会社が取引所法案に基づいて提出又は提出された報告書において開示を要求する情報が蓄積され、企業管理層(その主要幹部及び主要財務官を含む)又は同様の機能を履行する者に伝達されることを保証するための制御及び手続を含むが、開示を要求する決定を直ちに行うために、これらに限定されない。取引法第13 a-15(B)及び15 d-15(B)条の要求に基づいて、我々の経営陣は、最高経営者及び最高財務官の参加の下、2023年12月31日までの開示制御及び手続の有効性を評価した。この評価に基づき、我々の最高経営責任者と最高財務責任者は、2023年12月31日から有効であると結論した。
財務報告の内部統制
財務報告書の内部統制の変化。
2023年12月31日までの年間で、財務報告の内部統制には何の変化もなく、財務報告の内部統制に大きな影響を与えたり、大きな影響を与えたりする可能性が高い。
経営陣財務報告内部統制年次報告書.
我々の経営陣は、取引法第13 a-15(F)条で定義されているように、財務報告の十分な内部統制の確立と維持を担当している。我々の経営陣は、トレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み”枠組み(2013年枠組み)に基づいて、財務報告の内部統制の有効性を評価した。この評価によると、経営陣は、財務報告書に対する内部統制は2023年12月31日から有効であると結論した。経営陣は私たちの監査とコンプライアンス委員会と共にその評価結果を検討した。2023年12月31日現在の財務報告内部統制有効性は、本年度報告の第8項Form 10−Kに含まれている独立公認会計士事務所である徳勤会計士事務所によって監査されている。
情報開示制御プログラムと財務報告内部統制の内在的限界
経営陣は,どのような制御やプログラムも,どんなに設計や操作が良くても,その目標を実現するために合理的な保証を提供するしかないことを認識しており,管理者は,そのコストに対する可能な制御やプログラムのメリットを評価する際に,その判断を運用しなければならない.これらの固有の制限のため、私たちの開示および内部統制は、すべての詐欺、誤った陳述、または他の制御問題を防止または発見できない可能性がある。さらに、将来の開示または内部制御有効性の任意の評価の予測は、他を含むリスクに直面する可能性があり、条件の変化により、制御が不十分になる可能性があり、またはポリシーまたはプログラムを遵守する程度が悪化する可能性がある
独立公認会計士事務所報告
フォックス遺伝子会社の株主と取締役会に行きました
財務報告の内部統制については
フメット遺伝子会社とその子会社(“当社”)2023年12月31日までの財務報告内部統制、根拠を監査しました内部統制--統合フレームワーク(2013)テレデビル委員会(COSO)が主催して組織委員会が発表した。私たちの考えでは会社はすべての実質的な面で主張しています
86
2023年12月31日までの財務報告書の効果的な内部統制内部統制--統合フレームワーク(2013)COSOから発表されます。
また、米国上場企業会計監督委員会(PCAOB)の基準に従って、当社の2023年12月31日までおよび2023年12月31日までの年度の総合財務諸表および2024年2月28日までの報告を監査し、このような財務諸表に対して保留のない意見を表明した。
意見の基礎
会社経営陣は、財務報告に対して有効な内部統制を維持し、添付されている“経営陣財務報告内部統制年次報告”に含まれる財務報告の内部統制の有効性を評価する責任がある。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/s/徳勤法律事務所
カリフォルニア州ロサンゼルス
2024年2月28日
プロジェクト9 B。他にも情報です。
ルール10 b 5-1取引スケジュール
2023年12月31日までの3ヶ月以内に、当社は“ルール10 b 5-1取引スケジュール”または“非ルール10 b 5-1取引スケジュール”を採択または終了した取締役や上級社員はおらず、関連定義はS-Kルール408項を参照されたい。
プロジェクト9 Cです。検査を妨害する外国司法管轄区域を開示する。
ありません
87
部分(三)
プロジェクト10.役員·役員職ICERSと会社管理。
本プロジェクトに必要な情報は,2024年年度株主総会の最終依頼書や本報告に対する修正案を参考にすることで組み込まれており,いずれの場合も,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出されなければならない。
プロジェクト11.行政官イー補償します。
本プロジェクトに必要な情報は,2024年年度株主総会の最終依頼書や本報告に対する修正案を参考にすることで組み込まれており,いずれの場合も,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出されなければならない。
プロジェクト12.特定の受益者の保証所有権従業員と経営陣と関連した株主問題。
本プロジェクトに必要な情報は,2024年年度株主総会の最終依頼書や本報告に対する修正案を参考にすることで組み込まれており,いずれの場合も,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出されなければならない。
本プロジェクトに必要な情報は,2024年年度株主総会の最終依頼書や本報告に対する修正案を参考にすることで組み込まれており,いずれの場合も,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出されなければならない。
第14項主要口座NTING費用とサービスです。
本プロジェクトに必要な情報は,2024年年度株主総会の最終依頼書や本報告に対する修正案を参考にすることで組み込まれており,いずれの場合も,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出されなければならない。
88
部分IV.IV
プロジェクト15.展示品と資金エーアールアイチェックリストです。
(A)(1)連結財務諸表。
以下の財務諸表は、本レポートの署名ページの直後に、本レポートのアーカイブの一部として保存される
独立公認会計士事務所報告(PCAOB ID: |
|
F-2 |
2023年12月31日と2022年12月31日までの連結貸借対照表 |
|
F-5 |
2023年,2022年,2021年12月31日までの年度の総合業務報告書 |
|
F-6 |
2023年,2022年,2021年12月31日までの年度総合総合収益(損失表) |
|
F-7 |
1 |
|
F-8 |
2023年,2022年,2021年12月31日終了年度までの統合キャッシュフロー表 |
|
F-9 |
連結財務諸表付記 |
|
F-10 |
(A)(2)財務諸表付表。
必要ではない、適用されない、または他の方法で必要な情報が含まれているので、すべての財務諸表の添付表は省略されています。
(A)(3)展示品。
第15(A)(3)項に記載の要求された情報は、本報告書の署名ページの直前の“証拠インデックス”に掲載され、参照されて本明細書に組み込まれる。
項目16.テーブル10-Kまとめます。
ない。
89
展示品索引
展示品 番号をつける |
|
説明する |
|
表 |
|
書類番号 |
|
以下の会社が合併する 参考文献展示表 |
|
提出日 |
|
保存済み ここから声明する |
2.1 |
|
合意と合併計画は,2016年9月16日に,登録者,Fulgent MergerSub LLCとFulgent Treateutics LLCの間で署名された。 |
|
S-1/A |
|
333-213469 |
|
2.1 |
|
9/19/2016 |
|
|
3.1 |
|
登録者登録証明書は、日付が2016年5月13日である。 |
|
10-Q |
|
001-37894 |
|
3.1 |
|
8/14/2017 |
|
|
3.1.1 |
|
登録者登録証明書修正案は、日付が2016年8月2日である。 |
|
10-Q |
|
001-37894 |
|
3.1.1 |
|
8/14/2017 |
|
|
3.1.2 |
|
登録者登録証明書修正案は、日付が2017年5月17日である。 |
|
10-Q |
|
001-37894 |
|
3.1.2 |
|
8/14/2017 |
|
|
3.2 |
|
添付例を改訂及び再編成する。 |
|
10-Q |
|
001-37894 |
|
3.2 |
|
8/4/2023 |
|
|
4.1 |
|
登録者普通株式証明書フォーマット。 |
|
S-1/A |
|
333-213469 |
|
4.1 |
|
9/19/2016 |
|
|
4.2 |
|
登録者証券の記述。 |
|
|
|
|
|
|
|
|
|
X |
10.1# |
|
登録者とその各上級管理者と取締役との間の賠償協定フォーマット。 |
|
S-1 |
|
333-213469 |
|
10.1 |
|
9/2/2016 |
|
|
10.2# |
|
フルゴールド治療有限責任会社の2015年株式激励計画を改訂と再制定した。 |
|
S-1 |
|
333-213469 |
|
10.2 |
|
9/2/2016 |
|
|
10.3# |
|
フルゴールド治療有限責任会社が改訂及び再予約した2015年株式激励計画下のオプション付与通知及びオプション合意表。 |
|
S-1 |
|
333-213469 |
|
10.3 |
|
9/2/2016 |
|
|
10.4# |
|
フルゴールド治療有限責任会社が改訂及び再予約した2015年株式激励計画下の利益、利息付与及び利益利息協定通知表。 |
|
S-1 |
|
333-213469 |
|
10.4 |
|
9/2/2016 |
|
|
10.5# |
|
富力治療有限責任会社は2015年の株式激励計画の下で販売制限株式単位の付与及び限定株式単位の協議通知書フォーマットを改訂及び再予約した。 |
|
S-1 |
|
333-213469 |
|
10.5 |
|
9/2/2016 |
|
|
10.6# |
|
2016年度登録者総合奨励計画。 |
|
S-1/A |
|
333-213469 |
|
10.6 |
|
9/26/2016 |
|
|
10.7# |
|
登録者2016年度総合インセンティブ計画株式オプション奨励及び株式オプション奨励プロトコル通知書フォーマット。 |
|
S-1 |
|
333-213469 |
|
10.7 |
|
9/2/2016 |
|
|
10.8# |
|
登録者2016年度総合インセンティブ計画限定株奨励及び限定株協議通知書フォーマット。 |
|
10-K |
|
001-37894 |
|
10.8 |
|
3/17/2017 |
|
|
10.9# |
|
登録者は2016年総合インセンティブ計画下のオプション代替奨励形式。 |
|
S-1 |
|
333-213469 |
|
10.9 |
|
9/2/2016 |
|
|
10.10# |
|
登録者2016年度総合インセンティブ計画限定株代替奨励及び限定株協議通知書フォーマット。 |
|
S-1 |
|
333-213469 |
|
10.10 |
|
9/2/2016 |
|
|
10.11# |
|
雇用協定は、日付が2016年5月25日で、フルート治療有限責任会社、登録者、謝明祥によって署名された。 |
|
S-1 |
|
333-213469 |
|
10.11 |
|
9/2/2016 |
|
|
10.12# |
|
雇用協定は,2016年5月25日にフルゴールド治療有限責任会社,登録者,ポール·キングによって署名された。 |
|
S-1 |
|
333-213469 |
|
10.12 |
|
9/2/2016 |
|
|
10.13# |
|
改正·再署名された雇用協定は、2016年5月25日にフルギンテ治療有限責任会社、登録者、韓林〓によって署名された。 |
|
S-1 |
|
333-213469 |
|
10.13 |
|
9/2/2016 |
|
|
10.14# |
|
解散費協定は、2016年7月7日にフルキン治療有限責任会社、登録者、謝明祥によって署名された。 |
|
S-1 |
|
333-213469 |
|
10.14 |
|
9/2/2016 |
|
|
10.15# |
|
解散費協定は、2016年7月7日にフルゴールド治療有限責任会社、登録者、ポール·キングによって署名された。 |
|
S-1 |
|
333-213469 |
|
10.15 |
|
9/2/2016 |
|
|
10.16# |
|
解散費協定は、2016年7月7日にフルキン治療有限責任会社、登録者、韓林〓によって署名された。 |
|
S-1 |
|
333-213469 |
|
10.16 |
|
9/2/2016 |
|
|
10.17 |
|
寄付と分配協定は、日付は2016年5月19日で、フルギンテ治療有限責任会社、フルゴールド製薬有限責任会社と謝明華が共同で署名した。 |
|
S-1 |
|
333-213469 |
|
10.17 |
|
9/2/2016 |
|
|
10.18 |
|
フルンテ治療有限責任会社の第4回改正と再署名された経営協定のフォーマットは、再編完了後に発効する。 |
|
S-1/A |
|
333-213469 |
|
2.1 |
|
9/19/2016 |
|
|
10.20 |
|
登録者役員補償案は、2016年9月28日から発効し、2017年11月2日に改訂された。 |
|
10-K |
|
001-37894 |
|
10.20 |
|
3/20/2018 |
|
|
90
展示品 番号をつける |
|
説明する |
|
表 |
|
書類番号 |
|
以下の会社が合併する 参考文献展示表 |
|
提出日 |
|
保存済み ここから声明する |
10.21§ |
|
深セン福金遺伝子科技有限公司、西龍科技有限公司と福州金強投資組合企業(福州金強投資組合企業と略称する)は2017年4月25日に調印した福建福駿遺伝子生物技術有限公司の設立に関する協力協定に調印した。 |
|
10-Q |
|
001-37894 |
|
10.1 |
|
8/14/2017 |
|
|
10.22 |
|
株式分配協定は、2019年8月30日に、Fulgent Genetics,Inc.とPiper Jaffray&Co.が署名した。 |
|
8-K |
|
001-37894 |
|
1.1 |
|
8/30/2019 |
|
|
10.23 |
|
購入契約は、日付は2019年11月13日で、フルート遺伝会社とPiper Jaffray&Coが。 |
|
8-K |
|
001-37894 |
|
1.1 |
|
11/14/2019 |
|
|
10.24 |
|
Fulgent Genetics,Inc.とPiper Sandler&Co.が2020年8月4日に署名した株式割当協定第1号修正案。 |
|
8-K |
|
001-37894 |
|
1.1 |
|
8/5/2020 |
|
|
10.25 |
|
株式割当協定は、日付は2020年9月24日で、Fulgent Genetics,Inc.とPiper Sandler&Co.が署名した。 |
|
8-K |
|
001-37894 |
|
1.1 |
|
9/25/2020 |
|
|
10.26 |
|
株式割当契約は,日付は2020年11月20日であり,Fulgent Genetics,Inc.とPiper Sandler&Co.,BTIG,LLCとOppenheimer&Co.Inc.が締結されている. |
|
8-K |
|
001-37894 |
|
1.1 |
|
11/20/2020 |
|
|
10.27 |
|
Fulgent Genetics,Inc.2016年総合インセンティブ計画の改訂と再発表 |
|
8-K |
|
001-37894 |
|
10.1 |
|
5/21/2018 |
|
|
10.28 |
|
Fulgent Genetics,Inc.2016年総合インセンティブ計画の改訂と再発表 |
|
8-K |
|
001-37894 |
|
10.1 |
|
9/18/2020 |
|
|
10.29^ |
|
物件売買協定、日付:2020年7月23日 |
|
8-K |
|
001-37894 |
|
2.1 |
|
10/21/2020 |
|
|
10.30^ |
|
ServiceMasterは、2020年8月18日に同社と同社との間の航空機調達協定を検収しました |
|
10-Q |
|
001-37894 |
|
10.2 |
|
11/9/2020 |
|
|
10.31# |
|
雇用協定は,期日は2021年3月8日であり,フルゴールド治療会社,有限責任会社,フルゴールド遺伝会社,謝健によって締結されている。 |
|
10-K |
|
001-37894 |
|
10.37 |
|
3/8/2021 |
|
|
10.32# |
|
解散費協定は、期日は2021年3月8日であり、フルート治療有限責任会社、フルキン遺伝会社と謝健によって署名された。 |
|
10-K |
|
001-37894 |
|
10.38 |
|
3/8/2021 |
|
|
10.33#^ |
|
非従業員役員報酬政策が修正されて再制定された。 |
|
10-Q |
|
001-37894 |
|
10.1 |
|
5/7/2021 |
|
|
10.34§ |
|
福建福駿遺伝子生物科学技術有限公司は制度変更協定を締結した。 |
|
10-Q |
|
001-37894 |
|
10.1 |
|
8/10/2021 |
|
|
10.35^ |
|
改訂·再署名された商業賃貸契約は、2016年5月6日にStore Master Funding IX、LLCと細胞測定専門家会社の間で署名された。 |
|
10-K |
|
001-37894 |
|
10.41 |
|
2/28/2022 |
|
|
10.36# |
|
富金特遺伝会社です。インセンティブ報酬補償政策です。 |
|
8-K |
|
001-37894 |
|
10.1 |
|
3/29/2022 |
|
|
10.37 |
|
6.20節の目的のみであり,フルゴールド遺伝会社,Ducks Acquisition Sub,Inc.,SYMPHONY BUBUR,Inc.は,SYMPHONYの証券保有者Avista Capital Partners IV GP,L.P.の代表としてのみ,および第6.21節第8条と第10.14節の目的のみであり,これらの会社株主は2022年4月16日までの第6.21節,第8条,第10.14節で述べた合併合意と計画である。 |
|
8-K |
|
001-37894 |
|
2.1 |
|
4/26/2022 |
|
|
10.38# |
|
2022年8月1日の非従業員役員報酬政策が改正され、再制定された。 |
|
10-Q |
|
001-37894 |
|
10.1 |
|
11/7/2022 |
|
|
10.39#
|
|
富勤医薬ホールディングス2022総合インセンティブ計画下での制限株式奨励と制限株式契約の通知フォーマット |
|
10-Q |
|
001-37894 |
|
10.2 |
|
11/7/2022 |
|
|
10.40^ |
|
フメット遺伝子会社,FG合併子会社,フルゴールド製薬ホールディングス間およびそれらの間の合併協定と計画は,第2.4節,第5.5節,第6条,第7.8節および第7.14節の目的のみであり,これらの会社の株主は2022年11月7日の調印ページに記載されている |
|
10-Q |
|
001-37894 |
|
10.3 |
|
11/7/2022 |
|
|
91
展示品 番号をつける |
|
説明する |
|
表 |
|
書類番号 |
|
以下の会社が合併する 参考文献展示表 |
|
提出日 |
|
保存済み ここから声明する |
10.41 |
|
ルール10 b 5-1発行者買い戻し計画は、フルート遺伝会社とパイパー·サンドラー社が共同で制定し、期日は2023年12月12日 |
|
|
|
|
|
|
|
|
|
X |
10.42^ |
|
商業賃貸契約は、日付は2008年10月20日であり、Inform Diagnostics,Inc.とiSTAR CTL I,L.Pからなる。 |
|
10-K |
|
001-37894 |
|
10.48 |
|
2/28/2023 |
|
|
10.43 |
|
ビジネスリース改正案(I)は、2013年12月30日にInform Diagnostics,Inc.とLC Med Property TT,LLCの間で署名された |
|
10-K |
|
001-37894 |
|
10.49 |
|
2/28/2023 |
|
|
10.44^ |
|
商業賃貸改正案(II)は、2014年2月3日に、Inform Diagnostics,Inc.とLC Med Property TT,LLCの間で署名された |
|
10-K |
|
001-37894 |
|
10.50 |
|
2/28/2023 |
|
|
10.45 |
|
Inform DiagnosticsとCrawford Street DE,LLC間のビジネスリース契約 |
|
10-K |
|
001-37894 |
|
10.51 |
|
2/28/2023 |
|
|
10.46# |
|
2022フルタイム医薬ホールディングス総合インセンティブ計画 |
|
10-K |
|
001-37894 |
|
10.52 |
|
2/28/2023 |
|
|
10.47*^# |
|
2023年2月23日に非従業員役員報酬政策が改正され、再制定された。 |
|
10-Q |
|
001-37894 |
|
10.1 |
|
5/5/2023 |
|
|
10.48 |
|
上級管理職インセンティブ計画 |
|
10-Q |
|
001-37894 |
|
10.3 |
|
5/5/2023 |
|
|
10.49 |
|
2016年度登録者総合インセンティブ計画の改訂と再策定 |
|
8-K |
|
001-37894 |
|
10.1 |
|
5//18/2023 |
|
|
10.50^# |
|
改正·再策定された幹部激励計画 |
|
10-Q |
|
001-37894 |
|
10.2 |
|
11/3/2023 |
|
|
21.1 |
|
登録者の子会社。 |
|
|
|
|
|
|
|
|
|
X |
23.1 |
|
独立公認会計士事務所Deloitte&Touche LLPの登録者財務諸表への同意。 |
|
|
|
|
|
|
|
|
|
X |
24.1 |
|
授権書(本文書の署名ページに含まれる) |
|
|
|
|
|
|
|
|
|
X |
31.1 |
|
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
|
|
|
|
|
|
X |
31.2 |
|
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
|
|
|
|
|
|
|
|
X |
32.1* |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による最高経営責任者と最高財務官の認証。 |
|
|
|
|
|
|
|
|
|
X |
97.1^# |
|
奨励的報酬補償政策の改正と再策定 |
|
10-Q |
|
001-37894 |
|
10.1 |
|
11/3/2023 |
|
|
101.INS |
|
イントラネットXBRLインスタンスドキュメント-インスタンスドキュメントは表示されません 相互作用データファイルは、XBRLタグがイントラネットに埋め込まれているため XBRLドキュメントです。 |
|
|
|
|
|
|
|
|
|
X |
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
|
|
|
|
|
|
X |
101.カール |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
|
|
|
|
|
|
|
X |
101.def |
|
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
|
|
|
|
|
|
|
X |
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
|
|
|
|
|
|
X |
101.Pre |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
|
|
|
|
|
|
|
X |
104 |
|
表紙インタラクションデータファイル(イントラネットXBRLに埋め込まれている) 文書) |
|
|
|
|
|
|
|
|
|
X |
*“米国法”第18編第1350条によれば、本証明書は、本報告と共にのみ提供され、1934年に改正された証券取引法第18条の目的のために提出されたものではなく、引用言語による任意の一般的な合併にかかわらず、本出願の日付の前または後に行われた登録者のいずれの出願にも組み込まれない。
#契約または補償計画、契約、またはスケジュールを管理します。
92
§“取引法”ルール24 b-2によれば,本展示品の内容の一部は本プロトコルのバージョンから編集されており,本プロトコルは参照により本報告に組み込まれている.本展覧会の完全なコピーは、編集された部分を含み、米国証券取引委員会に個別に提供されている。
S-K規則601(A)(5)項によれば、いくつかの展示品及び付表は省略されている。会社は米国証券取引委員会の要求に応じて、任意の漏れた展示品またはスケジュールのコピーを補充提供することを約束した。
93
登録する解決策
改正された1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、正式に許可された以下の署名者が代表して本報告書に署名することを正式に手配している。
|
|
フルゲンテ遺伝子会社は |
|
|
|
|
|
日付:2024年2月28日 |
|
差出人: |
/投稿S/謝明輝 |
|
|
|
謝明祥 |
|
|
|
最高経営責任者 |
授権依頼書
以下の署名の各々は、謝明華及び金保禄をその真の合法的な代理人、代表及び事実受権者として構成し、任命し、それぞれ単独で行動し、十分な代替及び再代理権力を有し、任意及びすべての身分で、その名義、場所及び代替身分(I)で本報告及びその添付ファイル及び他の関連文書を修正及び署名し、(Ii)本報告に行動し、必要又は適切な証明書、文書、合意及びその他のこれに関連する文書に署名し、それぞれの場合において米国証券取引委員会に提出する。上記代理人、受委代表及び事実受託代理人又はその任意の代替者が合法的に行うことができる一切のことを承認、承認及び確認する。
本報告書は、改正された1934年の証券取引法の要求に基づき、次の日に以下の者によって登録者として署名された。
氏名とサイン |
|
タイトル |
|
日取り |
|
|
|
|
|
/投稿S/謝明輝 |
|
CEO兼取締役会長 |
|
2024年2月28日 |
謝明祥 |
|
(首席行政官) |
|
|
|
|
|
|
|
/S/ポール·キング |
|
首席財務官 |
|
2024年2月28日 |
ポール·キム |
|
(首席財務会計官) |
|
|
|
|
|
|
|
/S/マイケル·ノーハイアー |
|
役員.取締役 |
|
2024年2月28日 |
マイケル·ノハイアー |
|
|
|
|
|
|
|
|
|
/S/レギナ·グローブス |
|
役員.取締役 |
|
2024年2月28日 |
レギナ·グローブス |
|
|
|
|
|
|
|
|
|
寄稿S/リンダ·マーシュ |
|
役員.取締役 |
|
2024年2月28日 |
リンダ·マーシュ |
|
|
|
|
94
連結財務諸表索引
独立公認会計士事務所報告(PCAOB ID:34) |
|
F-2 |
|
|
|
2023年12月31日と2022年12月31日までの連結貸借対照表 |
|
F-5 |
|
|
|
2023年,2022年,2021年12月31日までの年度の総合業務報告書 |
|
F-6 |
|
|
|
2023年,2022年,2021年12月31日までの年度総合総合収益(損失表) |
|
F-7 |
|
|
|
2023年まで、2022年、2021年12月31日まで年度株主権益総合レポート |
|
F-8 |
|
|
|
2023年,2022年,2021年12月31日終了年度までの統合キャッシュフロー表 |
|
F-9 |
|
|
|
連結財務諸表付記 |
|
F-10 |
F-1
独立登録者の報告公認会計士事務所
フォックス遺伝子会社の株主と取締役会に行きました
財務諸表のいくつかの見方
添付されているフルンテ遺伝会社及びその子会社の連結貸借対照表を監査しました(“会社” 2023年12月31日と2022年12月31日まで、2023年12月31日までの3年度の関連総合経営報告書、全面収益(損失)、株主権益と現金流量、および関連付記(総称して“財務諸表” )である。財務諸表は,すべての重要な面で,会社の2023年12月31日と2022年12月31日までの財務状況,および2023年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。
我々はまた、米国上場企業会計監督委員会(PCAOB)の基準に基づき、以下の基準に基づいて、会社が2023年12月31日までの財務報告内部統制を監査した内部統制--統合フレームワーク(2013)テレデビル委員会は組織委員会が発表した報告書と2024年2月28日の報告書を後援し、会社の財務報告書の内部統制について保留のない意見を表明した。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、財務諸表を当期監査する際に生じる、監査委員会に伝達または要求された事項であり、これらの事項は、(1)財務諸表に対して大きな意味を有する勘定または開示に関し、(2)私たちが特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、次の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
営業権-ラボサービスと治療開発報告書-付記2と17を参照 財務諸表まで
重要な監査事項の説明
当社の減価営業権の評価は、各報告単位に対する公正価値とその帳簿価値の比較に関する。同社は割引キャッシュフローモデルを用いて公正価値を推定しており,経営層には将来の収入とEBITDA(利息,所得税,減価償却と償却前の収益を差し引くと定義される)の割引率と予測および治療開発報告部門のビジネス成功時間の重大な推定と仮定が求められている。これらの仮定の変化は、公正価値、任意の営業権減価費用の金額、または両方に大きな影響を与える可能性がある。2023年12月31日まで、営業権残高は1.423億ドルであり、その中の1.202億ドルは実験室サービス報告株に割り当てられ、2210万ドルは治療発展報告株に割り当てられた。計量日まで、実験室サービス報告部門の帳簿価値はその公正価値を超え、2023年12月31日までの営業権は完全に減少した。測定日までに治療発展報告単位の公正価値はその帳簿価値より15%高かったため,2023年12月31日現在では減値は確認されていない。
F-2
管理層は各報告部門の公正価値及び公正価値と帳簿価値の間の差異を推定するため、重大な判断を行ったため、著者らは営業権を重要な監査事項として確定した。これには,監査プログラムを実行する際に当社で公正な価値のある専門知識を持つ専門家の参加が必要であり,経営陣推定の合理性を評価するための高度な監査者の判断力とより大きな努力が必要であり,実験室サービス報告単位の割引率の選択と将来の収入とEBITDA利益率の予測に関する仮定,治療開発報告単位の割引率の選択と将来の収入の予測およびビジネス成功タイミングに関する仮定が必要である。
監査で重要な監査事項をどのように処理するか
我々の監査手続きは、研究室サービスと治療発展報告株の公正価値を推定するための管理層の割引率と予測に関するものである
無形資産−知的財産権と発展−財務諸表付記2と付記17を参照
重要な監査事項の説明
同社は無期限の無形資産である研究·開発(“IPR&D”)を行っている。2023年12月31日現在、知的財産権研究開発の帳簿価値は6460万ドル。管理層は毎年その選定された評価日2023年12月31日に多期超過収益法を用いて知的財産権研究開発の公正価値を推定し、これは特定の現金流動法である。公正価値の確定は管理層が未来の収入の予測、商業成功のタイミングと割引率に対して重大な推定と仮定を行い、収入純現在値を推定することを要求する。これらの仮説の変化は知的財産権研究開発の公正価値に重大な影響を与える可能性があり、公正価値の重大な変化は重大な減値を招く可能性がある。計量日に、知的財産権研究開発の公正価値はその帳簿額面より11%高いため、減値は確認されなかった。
知的財産権研究開発の公正価値の確定要求に基づいて、管理層は未来の収入の予測、商業成功のタイミング及び割引率の選択について重大な推定と仮説を行い、監査プログラムを実行してこのような推定と仮説の合理性を評価するためには、監査師の高度な判断力とより大きな努力程度が必要であり、わが社に公正な価値の専門知識を持たせる専門家が参加する必要がある。
監査で重要な監査事項をどのように処理するか
我々の監査プログラムは、将来の収入の予測、ビジネス成功のタイミング、知的財産権研究開発割引率の選択に関するものである
F-3
/s/
2024年2月28日
F-4
連結財務諸表
フルゲンテ遺伝子会社は
統合された貸借対照表
(単位は千、額面データは除く)
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
資産 |
|
|
|
|
|
||
流動資産 |
|
|
|
|
|
||
現金と現金等価物 |
$ |
|
|
$ |
|
||
有価証券 |
|
|
|
|
|
||
売掛金、信用損失準備金#ドルを差し引く |
|
|
|
|
|
||
その他流動資産 |
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
||
長期有価証券 |
|
|
|
|
|
||
償還可能優先株投資 |
|
|
|
|
|
||
固定資産、純額 |
|
|
|
|
|
||
無形資産、純額 |
|
|
|
|
|
||
商誉,純額 |
|
|
|
|
|
||
その他長期資産 |
|
|
|
|
|
||
総資産 |
$ |
|
|
$ |
|
||
負債と株主権益 |
|
|
|
|
|
||
流動負債 |
|
|
|
|
|
||
売掛金 |
$ |
|
|
$ |
|
||
負債を計算すべきである |
|
|
|
|
|
||
契約責任 |
|
|
|
|
|
||
顧客保証金 |
|
|
|
|
|
||
投資保証金ローン |
|
— |
|
|
|
|
|
当期手形 |
|
|
|
|
|
||
その他流動負債 |
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
||
未確認税収割引 |
|
|
|
|
|
||
繰延税金負債 |
|
|
|
|
— |
|
|
その他長期負債 |
|
|
|
|
|
||
総負債 |
|
|
|
|
|
||
|
|
|
|
|
|||
株主権益 |
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
||
優先株、$ |
|
|
|
|
|||
追加実収資本 |
|
|
|
|
|
||
その他の総合収益を累計する |
|
|
|
|
( |
) |
|
利益を残す |
|
|
|
|
|
||
* |
|
|
|
|
|
||
非持株権益 |
|
( |
) |
|
|
|
|
株主権益総額 |
|
|
|
|
|
||
総負債と株主権益 |
$ |
|
|
$ |
|
||
付記はこれらの連結財務諸表の構成要素である。
F-5
連結財務諸表
フルゲンテ遺伝子会社は
合併状態運営企業
(千円、1株を除く)
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
収入.収入 |
$ |
|
|
$ |
|
|
$ |
|
|||
収入コスト |
|
|
|
|
|
|
|
|
|||
毛利 |
|
|
|
|
|
|
|
|
|||
運営費用: |
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
|
|
|
|
|
|
|||
販売とマーケティング |
|
|
|
|
|
|
|
|
|||
一般と行政 |
|
|
|
|
|
|
|
|
|||
無形資産の償却 |
|
|
|
|
|
|
|
|
|||
営業権減価損失 |
|
|
|
|
— |
|
|
|
— |
|
|
再構成コスト |
|
— |
|
|
|
|
|
— |
|
||
総運営費 |
|
|
|
|
|
|
|
|
|||
営業収入 |
|
( |
) |
|
|
|
|
|
|
||
利息とその他の収入,純額 |
|
|
|
|
|
|
|
|
|||
所得税前収入と権益法投資収益 |
|
( |
) |
|
|
|
|
|
|
||
所得税支給 |
|
|
|
|
|
|
|
|
|||
権益法投資の収益前収益 |
|
( |
) |
|
|
|
|
|
|
||
権益法投資収益 |
|
— |
|
|
|
— |
|
|
|
|
|
合併経営の純収入 |
|
( |
) |
|
|
|
|
|
|
||
非持株権益は純損失を占めなければならない |
|
|
|
|
|
|
|
|
|||
富金の純収入に帰することができる |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|||
富金の1株当たり純(損失)収入: |
|
|
|
|
|
|
|
|
|||
基本的な情報 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
薄めにする |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|||
加重平均普通株式: |
|
|
|
|
|
|
|
|
|||
基本的な情報 |
|
|
|
|
|
|
|
|
|||
薄めにする |
|
|
|
|
|
|
|
|
|||
付記はこれらの連結財務諸表の構成要素である。
F-6
フルゲンテ遺伝子会社は
合併報告書総合収益(赤字)
(単位:千)
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
合併経営の純収入 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
その他の全面収益(損失): |
|
|
|
|
|
|
|
|
|||
外貨換算収益 |
|
( |
) |
|
|
( |
) |
|
|
|
|
債務証券の売却が可能な税引き後純収益(赤字) |
|
|
|
|
( |
) |
|
|
( |
) |
|
総合業務収入 |
|
( |
) |
|
|
|
|
|
|
||
非持株権益は純損失を占めなければならない |
|
|
|
|
|
|
|
|
|||
非持株権の外貨換算(収益)損失に起因することができる |
|
( |
) |
|
|
|
|
|
( |
) |
|
非持株権に帰属できる総合的な損失 |
|
|
|
|
|
|
|
|
|||
フルタイムの総合収入 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
付記はこれらの連結財務諸表の構成要素である。
F-7
フルゲンテ遺伝子会社は
合併報告書株主権益中のS
(単位:千)
|
フランクリン株主権益 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
株 |
|
|
金額 |
|
|
その他の内容 |
|
|
積算 |
|
|
利益剰余金(累計) |
|
|
フランクリン株主権益 |
|
|
非持株権益 |
|
|
合計する |
|
||||||||
2021年1月1日の残高 |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
— |
|
|
$ |
|
||||||||
株式ベースの報酬 |
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
普通株式オプションの行使 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||||
制限株奨励 |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
普通株の平均発行価格は#ドルです |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||||
普通株前払従業員納税義務 |
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
会計変更の累積影響 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
会計変更の累積納税影響 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|||
買収に関する仮定非持株権益 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
その他の全面収益(赤字),純額 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
( |
) |
|
純収益(赤字) |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
2021年12月31日の残高 |
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
株式ベースの報酬 |
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
普通株式オプションの行使 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||||
制限株奨励 |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
普通株前払従業員納税義務 |
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
普通株買い戻し |
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
企業合併で発行される普通株式(1) |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||||
その他全面的な損失,純額 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
純収益(赤字) |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
2022年12月31日の残高 |
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
株式ベースの報酬 |
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
普通株式オプションの行使 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||||
制限株奨励 |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
普通株前払従業員納税義務 |
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
普通株買い戻し |
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
企業合併で発行される普通株式(1) |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
その他の全面的な収益、純額 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
||||
純損失 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
2023年12月31日の残高 |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||||||
(1)
付記はこれらの連結財務諸表の構成要素である。
F-8
フルゲンテ遺伝子会社は
合併状態キャッシュフロープロジェクト
(単位:千)
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
経営活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
|||
合併経営の純収入 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
純収入と経営活動が提供する現金純額を調整する: |
|
|
|
|
|
|
|
|
|||
営業権減価損失 |
|
|
|
|
— |
|
|
|
— |
|
|
株式ベースの報酬 |
|
|
|
|
|
|
|
|
|||
減価償却および償却 |
|
|
|
|
|
|
|
|
|||
信用損失準備 |
|
( |
) |
|
|
|
|
|
|
||
非現金レンタル費用 |
|
|
|
|
|
|
|
|
|||
固定資産処分損失 |
|
|
|
|
|
|
|
|
|||
有価証券の割増償却 |
|
( |
) |
|
|
|
|
|
|
||
税金を繰延する |
|
|
|
|
( |
) |
|
|
( |
) |
|
未確認税収割引 |
|
( |
) |
|
|
|
|
|
|
||
有価証券純損失 |
|
|
|
|
|
|
|
|
|||
権益法投資の収益 |
|
— |
|
|
— |
|
|
|
( |
) |
|
他にも |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
経営性資産と負債変動状況: |
|
|
|
|
|
|
|
|
|||
売掛金 |
|
|
|
|
|
|
|
|
|||
その他の流動と長期資産 |
|
( |
) |
|
|
( |
) |
|
|
|
|
売掛金 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
負債その他の負債を計上しなければならない |
|
|
|
|
( |
) |
|
|
|
||
所得税に対処する |
|
— |
|
|
|
( |
) |
|
|
( |
) |
経営と融資リース負債 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
経営活動が提供する現金純額 |
|
|
|
|
|
|
|
|
|||
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
|
|
|||
固定資産購入状況 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
無形資産を購入する |
|
— |
|
|
— |
|
|
|
( |
) |
|
固定資産所得を売却する |
|
|
|
|
|
|
|
|
|||
有価証券を購入する |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
個人持株会社の優先株を購入する |
|
— |
|
|
|
( |
) |
|
— |
|
|
企業買収に関連したり、対価格支払いがあります |
|
— |
|
|
|
( |
) |
|
— |
|
|
償還可能優先株を購入する |
|
— |
|
|
— |
|
|
|
( |
) |
|
有価証券の満期日 |
|
|
|
|
|
|
|
|
|||
有価証券を売却して得た金 |
|
|
|
|
|
|
|
|
|||
買収業務は,現金買収後の純額を差し引く |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
投資活動提供の現金純額 |
|
|
|
|
( |
) |
|
|
( |
) |
|
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
|||
普通株買い戻し |
|
( |
) |
|
|
( |
) |
|
— |
|
|
普通株前払従業員納税義務 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
普通株を公開発行して得られる収益は,発行コストを差し引く |
— |
|
|
— |
|
|
|
|
|||
非制御的権益 |
— |
|
|
— |
|
|
|
|
|||
株式オプションを行使して得られる収益 |
|
|
|
|
|
|
|
|
|||
融資リース払いの元金 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
支払手形の償還 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
保証金口座の再支払い |
|
( |
) |
|
|
— |
|
|
|
— |
|
融資活動が提供する現金純額 |
|
( |
) |
|
|
( |
) |
|
|
|
|
現金および現金等価物に及ぼす為替レート変動の影響 |
|
( |
) |
|
|
( |
) |
|
|
|
|
現金および現金等価物の純増加(減額) |
|
|
|
|
( |
) |
|
|
|
||
期初現金及び現金等価物 |
|
|
|
|
|
|
|
|
|||
期末現金および現金等価物 |
$ |
|
|
$ |
|
|
$ |
|
|||
キャッシュフロー情報の補足開示: |
|
|
|
|
|
|
|
|
|||
納めた所得税 |
$ |
|
|
$ |
|
|
$ |
|
|||
利子を支払う現金 |
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
非現金投資と融資活動の追加開示: |
|
|
|
|
|
|
|
|
|||
企業合併中の株の掛け値 |
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
その他流動資産の有価証券満期日 |
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
手形払いで固定資産を購入する |
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
融資リース賃貸負債と引き換えに使用権資産 |
$ |
— |
|
|
$ |
|
|
$ |
|
||
経営リースリース改正または終了により減少した使用権資産 |
$ |
|
|
$ |
|
|
$ |
|
|||
リース負債と引き換えに経営的リース使用権資産 |
$ |
|
|
$ |
|
|
$ |
|
|||
融資リースリースの修正または終了により減少した使用権資産 |
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
業務買収または対価格計上流動負債 |
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
売掛金に含まれる公開発行コスト |
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
付記はこれらの連結財務諸表の構成要素である。
F-9
フルゲンテ遺伝子会社は
総合備考財務諸表
注1.陳述の概要と根拠
添付されている総合財務諸表はアメリカ公認会計原則あるいはアメリカ公認会計原則に基づいて作成された。これらの財務諸表には、当社が持株権を所有しているか、または主要な受益者とされているすべての子会社および実体の資産、負債、収入、および支出が含まれている。当社があるエンティティの主要な受益者であるか否かを決定する際に、当社は定性的方法を用いて、(I)当該エンティティの重大な経済活動を指導する権限と、(Ii)当該エンティティの損失を負担するか、又は当該エンティティから当該エンティティに対して重大な意味を有する可能性のある利益を得る権利を同時に有するか否かを決定する。当社は権益法を用いてそのコントロールを受けないが経営や財務政策に重大な影響を与える能力のある実体への投資を計算している。すべての会社間口座および取引は、添付の連結財務諸表からログアウトします。
業務的性質
Fulgent Genetics,Inc.およびその子会社および付属専門会社またはパーソナルコンピュータ(他に説明や文脈がない限り、総称して会社と呼ぶ)は、技術に基づく会社であり、完全な実験室サービス業務と治療開発業務を持っている。その実験室サービス業務-同社は以前その臨床診断業務と呼ばれていた-技術実験室サービスと登録医師の実験室結果に対する専門的な解釈を含む。同社の治療開発事業は、新しいおよび既存の癌薬物の治療窓口および薬物動態特性を改善することを目的とした、新しいナノカプセルおよび標的治療プラットフォームを用いて、複数の癌を治療する候補薬物の開発に専念する。同社の目標はゲノム診断業務から完全に統合された正確な医学会社に転換することだ。
付記2.主要会計政策の概要
予算の使用
米国公認会計原則に基づいて連結財務諸表を作成することは、管理層にいくつかの推定、判断と仮定を要求し、これらの推定、判断と仮定は財務諸表の日付の資産と負債報告金額、及び報告期間内に報告された収入と費用金額に影響を与える。この等の見積もり,判断および仮定は,添付の総合財務諸表日に基づいて得られた履歴データや経験,および経営陣が当時の状況で部下が合理的であると考えていた様々な他の要因である。会社の見積もりや仮定は状況によって変わるかもしれません。
継続的な基礎の上で、管理層は、主に、(1)収入確認基準、(2)売掛金と信用損失準備、(3)固定資産と無形資産の使用年数、(4)納税負債推定数、(5)営業権と無期限寿命の推定値に関連する推定数を評価する買収時と恒常性に基づく無形資産、および(Vi)投資の推定値。
合併原則
添付されている総合財務諸表は当社の勘定を含んでいます。すべての会社間取引と残高は合併で販売された。
現金と現金等価物
当社は購入の日に原始期限が三ヶ月以下のすべての高流動性投資を現金等価物と見なしています。現金と現金同等物は銀行と通貨市場口座に保有されている現金を含む。現金等価物は公正価値に従って列報する.
有価証券
すべてのドル建て取引可能債務証券は、米国政府および機関債務証券、米国国庫券、会社債務証券、市政債券、および外国政府または実体によって発行されたヤンキー債務証券を含み、“販売可能”に分類され、公正価値で価格を計算する。純収益と純損失を実現せず,いかなる関連税収の影響も差し引いて,収益から除外し,他の全面収益(損失)に計上し,
F-10
実現前の株主権益。売却可能債務証券の実現済み収益及び損失は、付随する総合経営報告書に含まれる利息及びその他の収入純額に含まれる。売却可能な債務証券の費用は特定の識別方法に基づいている。上場可能債務証券の償却コストは、割増の償却と満期時割引の増加に応じて調整される。取引可能債務証券の利息は、利息及び他の収入に含まれ、純額である。会社の投資政策によると、経営陣は信用リスクを分散させるために投資を行い、米国政府証券を含む信用品質の高い証券にのみ投資する。
会社の有価証券への投資は公正価値で計量され、関連損益、実現済みと実現されていない、利息やその他の収入で確認された純額は添付の総合経営報告書で確認された。任意の有価証券を売却するコストは特定の識別方法によって計算される。
売却可能な債務証券については、未実現損失のうち、当社は信用損失があるかどうかを判断する。信用損失は、証券の収集可能性に関する既存の情報と、過去のイベント、現在の状況、および合理的かつサポート可能な予測に関する情報とを考慮することによって推定される。同社は証券から受け取ることが予想されるキャッシュフローの現在値と証券の償却コストベースを比較する。回収すべきキャッシュフローの現在値が証券の償却ベースより低い場合には,信用損失が存在し,信用損失にクレジット損失を計上する準備をするが,損失を実現していない金額を限度とする.引当額の変動は変動期間中は信用損失費用と記す。もし当社が売却を意図している場合、あるいは当社がその余剰コスト基準を回収する前に損失を達成していない債務証券の売却を要求される可能性が高い場合、当社はその証券をその公正価値に減記し、それに応じた費用を利息と他の収入の一部、純額とする。
売掛金と信用損失準備
売掛金は会社が回収予定の金額に応じて列報します。当社は回収できないと予想される売掛金計に対して信用損失を準備し、売掛金に対応した相殺として、信用損失準備の変化は添付の総合経営報告書に一般的かつ行政費用としている。当社は、類似したリスク特徴が存在する場合に貿易売掛金を集団評価し、信用品質が悪化し、他の売掛金と類似したリスク特徴を持つ可能性のある特定の顧客が発見された場合に、売掛金を評価する。信用損失支出金額を決定する際には、当社は損失率モデルあるいは違約確率と違約を考慮した損失モデルを使用する。損失率法によれば,予想される信用損失は推定された履歴損失率に基づいて決定される.違約確率法は違約点を確定し、信用損失を計算するために準備する目的ですでに違約点に達した受取金の信用損失を測定することを許可する。違約損失とは、違約先に達した売掛金が全額回収できない可能性である。当社は毎年その損失率と要因を更新し、最新の履歴データを格納し、その定性的備蓄によって備蓄の数量部分をカバー調整している。同社は予想信用損失を決定する際に一般経済状況などの定性的な要素を考慮している。
当社の信用損失準備活動の前転状況は以下の通りである
|
十二月三十一日 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
年初信用損失準備 |
$ |
|
|
$ |
|
|
$ |
|
|||
2016-13年のASU採用の影響 |
|
— |
|
|
— |
|
|
|
|
||
今期(収益)を計上する |
|
( |
) |
|
|
|
|
|
|
||
資産減価 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
歳末信用損失の準備 |
$ |
|
|
$ |
|
|
$ |
|
|||
償還可能優先株投資
償還可能優先株投資$
F-11
企業合併
当社は買収会計方法を採用し、買収対価格の公正価値を被買収側が買収日にそれぞれの公正価値に応じて被買収側が負担する資産と負債に分配する。購入対価格の公正価値は、これらの買収資産と負担する負債の公正価値の一部を商業権に計上することを超える。資産の買収と負債を負担する公正な価値を決定する際に、管理層は、特に無形資産の推定と仮定に関する重大な推定と仮定を行う。無形資産を評価する鍵となる推定は、予想される未来のキャッシュフローを含むが、これらに限定されず、その中には、未来の成長と利益率、未来の技術変化、進行中の研究開発の期待コストと時間、ブランド知名度と割引率の考慮が含まれている。公正価値推定は、管理層が市場参加者が資産または負債の価格設定の際に使用されると考えているという仮定に基づいている。
固定資産
固定資産はコスト、減価償却、償却純額で入金される。減価償却は資産の推定耐用年数内に直線方法で記録される。リース改善は、その予想寿命または適用リース期間の短い時間(継続オプションを含む)で資本化され、償却される。重大な交換と改善は資本化に計上され、一般的な修理とメンテナンスは発生した費用に計上される。注5を参照固定資産各主要カテゴリの固定資産の使用寿命。
限られた生存無形資産
無形資産は無期限に存在すると判断されない限りその予想寿命内に償却する。当社は無形資産を直線法で償却し,一般に以下の期限で償却する至れり尽くせり
長期資産減価準備
事件や状況の変化が長期資産が回収できない可能性があることを示すたびに、当社はその長期資産の帳簿価値を評価する。資産の使用が予想される将来のキャッシュフローを推定し、その最終的な処分が資産の帳簿金額よりも少ない場合には、減価損失が確認される。
商誉と無限の無形資産
進行中の研究開発コスト、あるいはIPR&Dは、関連する研究開発作業が完了または放棄されるまで無期限とされている。開発が完了すれば、関連資産は有限寿命とみなされ、その時点でのそれぞれの推定使用寿命に基づいて償却される。
当社は年度と年度テストの間で営業権及び無期限無形資産の減値を評価し、事件や状況の変化が発生すれば、報告単位の公平な価値はその額面を下回る可能性が高い。当社は任意の報告単位を迂回した減値定性評価を選択し,直接定量化評価を行うことができる。報告先の帳票金額がその公正価値を超えた場合には,減値損失を確認する.
同社の数量化評価には,各報告単位の公正価値を推定し,その帳簿価値と比較することが含まれている。同社は収入と市場に基づく推定方法を用いて報告単位の公正価値を推定し、通常第三者評価会社を招いて評価を協力する。報告単位ごとの見積り公正価値は,収入法と市場法による見積り値の範囲に基づいて決定される.報告単位の推定公正価値がその帳簿価値を超える場合、営業権は欠陥することもなく、さらなる審査も必要ない。
収益に基づく公正価値方法は,報告単位の予測に基づいて将来のキャッシュフローを予測し,これらのキャッシュフローは報告単位の加重平均資本コストを用いて現在値に割引する.収入に基づく方法では、経営陣が経営している市場の経済状況や資本市場の状況を仮定して判断することが求められており、その多くは経営陣のコントロール下にない場合が多い。市場の公正価値方法に基づいて、基準上場会社の推定方法に着目し、比較可能な上場会社の価格を確定し、合併と買収方法、即ち最近販売されている類似業務に着目し、報告単位の価値を推定する。市場に基づく方法では,市場倍数と最近の取引を評価する際に判断する必要がある.
F-12
同社は2023年12月31日に年間営業権と無形資産減価テストを行い、選択可能な定性テストを迂回し、実験室サービスと治療開発報告単位を定量的に評価し、その中に不確定無形資産を含む。
試薬と用品
同社は主にテストに用いられる試薬や他の消耗品を保持しており,その価値はコストあるいは可変現純値の中の低い者を基準としている。コストは先進的に先に出た実際のコストに基づいて決定される.試薬やその他の消耗品は添付の総合貸借対照表に含まれている他の流動資産に入っている。
金融商品の公正価値
同社の金融商品には、主に現金と現金等価物、有価証券、売掛金、償還可能な優先株投資、売掛金、売掛金、投資保証金ローン、または掛け値がある。その中のいくつかの金融商品の帳簿は、現金及び現金等価物、売掛金、売掛金、未計負債、投資保証金ローン及び或いは代償が含まれており、満期日が短いため、公正価値に近い。有価証券と償還可能優先株投資の公正価値が付記4に開示されている公正価値計量Sは、添付の連結財務諸表を作成する。
信用リスク、顧客、およびサプライヤーの集中度
会社を深刻な集中信用リスクに直面させる可能性のある金融商品は主に現金と現金等価物、貿易売掛金、債務証券と株式証券からなる有価証券を含む。2023年12月31日現在、同社のほとんどの現金と現金等価物が金融機関の口座に入金されており、金額は連邦保険の限度額を超える可能性がある。経営陣は、現金と現金等価物を持つ預金機関の財務力により、当社は重大な信用リスクに直面しないと考えている。
ある時期には、少数の顧客が会社の収入の大きな部分を占めていた。研究室サービス部門では共同制御の下で顧客を集め
その会社の治療開発業務はANP技術会社が研究と開発に関連するいくつかの実験室サービス、設備、ツール、薬物中間体を提供することに依存する。同社はまた、限られた数のサプライヤーに依存していくつかの実験室物質を提供し、これらの物質はその流れを取り入れた化学反応に使用され、試薬と呼ばれ、その実験室運営に使用されているシークエンサーと各種の他の設備と材料である。特に,同社は次世代シークエンサーと関連試薬の独占サプライヤーに依存して遺伝子テストを行い,これらのシークエンサーのメンテナンスとメンテナンスサービスの独占提供者としている。これらの試薬、シーケンサー、他のデバイスまたは材料またはメンテナンスおよびメンテナンスサービスを取得する上で会社が遅延または困難に遭遇した場合、会社の実験室運営が中断されるであろう。これは、会社がその限られたまたは唯一のサプライヤーを交換または一時的に代替する必要があり、許容可能な代替または一時的な代替製品を見つけることができず、それと配置することを含む様々な理由による可能性がある。同社がその治療開発活動に必要なものを調達できなければ,その開発作業が延期や中断される可能性もある。同社は現在、収集キット、配列測定器、各種関連試薬を含むいくつかの他のメーカーだけがその実験室運営に必要な設備と他の材料を提供し、修理することができると考えている。
権益法投資
同社は権益法を用いてコントロールされていないが経営や財務政策に重大な影響を与える能力のある実体の投資を計算している。各権益法投資への影響程度の判断は、会社の所有権利益、取締役会或いは他の管理機関における代表及び意思決定への参加などの重要な要素を考慮することを含む。当社は被投資先報告期間中の純収益または損失に占めるシェアを確認しています。当社は任意の権益法投資の減値準備を評価し,発生したイベントや環境変化が価値が非一時的に低下したことを示す限りである。本評価が考慮する証拠には、被投資先の財務状況と最近の見通し、最近の経営動向、被投資先の予測業績が含まれるが、必ずしも限定されるものではない
F-13
投資先が経営している地理的地域や業界の市場状況、および当社が帳簿価値の回収を期待している期待期間について当該投資の戦略計画を持っている。投資が非一時的な価値が低下していると判定された場合、推定公正価値と減記される。
その会社の
賃貸借証書
当社は、確認された資産の使用権を譲渡したか否かを評価し、当社がその資産からほぼすべての経済的利益を獲得し、その資産の使用を指導する能力があるか否かを評価することにより、開始時にリースであるか否かを決定する。経営および融資リース使用権資産、またはROU資産、短期賃貸負債および長期賃貸負債は、それぞれ他の長期資産、計算すべき負債および他の長期負債に計上され、付随する総合貸借対照表に含まれる。
リース権益資産は、会社がリース期間内に対象資産を使用する権利を代表する。リース負債とは、当社がリースによるリース金を支払う義務をいう。リースROU資産および負債は、開始日にレンタル期間内のリース支払いの現在値に基づいて確認され、当社がその選択権を行使することを合理的に決定する際にリース契約の選択権を延長することが含まれている。当社は発効日に得られた資料(その銀行に問い合わせることを含む)に基づいて、その賃貸借契約が暗黙的または明示的な金利を提供していない場合には、逓増借款金利を用いて賃貸支払いの現在値を決定する。レンタルROU資産は、レンタル負債の初期計量、レンタル開始日または前にレンタル者に支払う任意のレンタル支払い、受信された任意のレンタルインセンティブ、および当社によって生成された任意の初期直接コストを減算することを含む。レンタル支払いの経営リース料金はレンタル期間内に直線法で確認します。融資リースについては、ROU資産の開始日からROU資産の使用寿命終了またはリース期間終了までの早い者が直線的に償却される。ROU資産の償却と融資リースのリース負債利息を費用として添付の総合経営報告書に計上する。
業務合併によるリースROU資産及び負債は買収日に確認及び計量され、買収リースが買収日が新リースであるように、この割引率がリース内に隠されていない限り、当社の逓増借款金利を採用する。当社は、買収日までの残り賃貸期間が12ヶ月以下であることを確認しないリースの資産又は負債を選択します。当社も、業務合併時に何の修正もなされていないように、被購入者の賃貸契約の分類を保留しています。
同社は,取消不可能な経営テナントに基づいて,その所有する建物中の空間を第三者テナントまたはテナントに賃貸する。当社は直線法で賃貸支払いをリース期間内の収入と確認し、可変賃貸支払いを賃貸支払いを変動させることによる事実と状況が変化した期間の収入と確認した。賃貸料収入純額は,添付の総合経営報告書の利息とその他の収入純額に計上される。
内部用のソフト
同社は内部使用のためのコンピュータソフトウェアの購入によるいくつかのコストを資本化している。これらの費用には、会社が使用するために購入したパッケージが含まれている。資本化されたコンピュータソフトウェアコストはコンピュータソフトウェアの推定使用寿命内に償却され,推定使用寿命は通常至れり尽くせり
報告可能な細分化された市場と地理情報
報告部は企業の構成要素として決定され、その独立した離散財務情報は、首席運営意思決定者が資源分配と業績評価に関する決定を行う際に評価を行うことができる。その会社の最高経営決定者はその最高経営責任者だその会社はその業務を報告している
F-14
収入確認
同社はその検査サービスを販売することで収入を得ている。会社が現在受け取っている支払いは主に
同社が確認した収入額は、その顧客に約束した貨物やサービスを譲渡するために、獲得する権利があると予想されている対価格を反映している。顧客との契約の収入確認を決定するために、当社は、(1)顧客との契約を識別するステップ、またはステップ1、(2)契約における履行義務を決定するステップ、またはステップ2、(3)取引価格を決定するステップ、またはステップ3、(4)契約中の履行義務に取引価格を割り当てるステップ、またはステップ4、および(5)エンティティが契約義務を履行する場合、またはステップ5、収入を確認するステップを実行する。
同社のテスト結果は主に電子的に提供されている。会社はある顧客から会社で発生した輸送·手数料を徴収し、顧客に徴収する輸送·処理費用は収入に含まれ、当該等で発生した輸送·処理費用は添付された総合経営報告書に収入コストを計上する。
契約義務を履行する
機関と患者が直接支払う
同社の検査サービス機関契約は、通常、発注機関または患者に検査サービスを提供する単一の履行義務を有する。いくつかの手配は研究機関にテストサービスを提供することに関連し、同社はこれを“配列決定即ちサービス”と呼んでいる。病院,医療機関,その他の実験室,政府機関,市政当局,大会社を含む機関および直接支払いの患者との手配では,取引価格は契約で説明されているため,固定的な対価格である。当社の大部分のテストでは、当社は最初のステップで、病院、医療機関、他の実験室、政府機関、市政当局、大企業、および患者を含む機関を決定し、最初のステップでこれらの顧客との契約を決定しました。これらの契約は通常1つの履行義務しかないため、第4のステップでは取引価格を割り当てる必要はありません。検査サービスの制御権はある時点で会社の発注機関に転送されます。具体的には、同社は、顧客がテスト結果を渡した後にコミットメントサービスの制御権を獲得したと判断する。
保険
同社の検査サービス保険契約は,通常,発注機関や患者に検査サービスを提供する単一の履行義務を有する。当社の保険収入の大部分については、当社はステップ1で患者を顧客として決定し、ステップ1で患者との契約が存在することを決定する。保険患者との手配では、取引価格は通常契約で説明されるが、会社は契約規定価格より低い第三者支払者の支払いを受ける可能性があるため、取引価格の推定は可変対価格とみなされる。可変対価格推定を作成する際には、当社はポートフォリオ手法での期待値手法を採用している。これらの契約は通常1つの履行義務しかないため,ステップ4では取引価格を割り当てる必要はない.テストサービスの制御権はある時点で会社の発注先に移行する.具体的には、同社は、顧客がテスト結果を渡した後にコミットメントサービスの制御権を獲得したと判断する。
手数料のような保険及び機関に関連するいくつかの増分コストは、契約を取得する際に生成される。会社が契約コストの回収を希望する場合は,契約コストを資本化し,契約コストの償却は合併経営報告書で一般費用と行政費用に分類される。歴史的に見ると、契約費用は財務諸表に重要ではない。
重大な判断と契約試算
保険契約の会計計算には取引価格の推定が含まれており、取引価格の定義は、会社が契約下のサービスを提供することから利益を得る権利があることである。当社は新冠肺炎テストの多くの保険支払者とネットワーク外の状態にあるため,取引価格の見積もりは可変対価格を代表している。
連邦医療保険、契約規定の精算料率、または他の保険がない場合、私たちの契約は可変対価格を含み、連邦医療保険または商業健康保険保証人が支払う金額が私たちの標準料率を下回る可能性があるか、または全く支払わない可能性があるので、このような違いは暗黙的な価格割引とみなされる。これらの価格特典の可変対価格に起因して、ASC 606項の“最も可能性のある金額”方法に従って予想される価値で計量されることができる。金額はテストタイプと支払い人間の別の履歴の平均受取率によって決定され、考慮して
F-15
可能な結果の範囲、我々の過去の経験の予測価値、不確実性を解決することが期待される時間帯、および第三者の判断および行動のような、我々の影響以外の要因の影響を受ける可能性のある審議金額を考慮する。このような可変対価格は取引価格のみを計上しており,金額に関する不確実性が解決された場合,確認された累積収入金額が大きく逆転しない可能性が高いことを前提としている.契約により償還範囲が合意されていない場合、又は支払人と予測可能なモード及び入金履歴がない場合には、可変対価格が制限され、取引価格から除外されることができる。
当社は、各報告期間終了時にその推定取引価格を再評価し、推定可変対価格が制限されているか否かを評価することを含み、いかなる不確実性を解決すれば、累積収入に大きな逆転が生じない可能性が高い。当社は当期収入に必要な調整を記録しています。$
契約責任
会社が顧客への貨物またはサービスの譲渡義務を完了する前に支払いまたは請求書を受け取ると、契約負債が記録され、会社はその後、上述した適用収入確認基準が満たされている間に契約負債を収入として確認する。
顧客保証金
顧客保証金連結貸借対照表では、顧客から受け取った金がその未払い貿易売掛金残高を超えている。これらの保証金は未来のテスト売掛金を相殺したり、顧客に返却したりします。
間接費用
会社は従業員数や敷地面積に応じて間接費用(例えば、施設、賃貸料、光熱費)を収入コストと運営費用種別に分配する。したがって,間接料金分配は収入コストと運営費用種別ごとに反映される。
収入コスト
収入コストは、給与、従業員福祉コスト、ボーナスおよび株式ベースの補償費用を含む人員コスト、実験室用品コスト、実験室設備減価償却、テナント償却、建築改善および分配の管理費用を含むテスト結果を送達することによって生成される総コストを反映する。テストを処理する際には,テストの実行に関するコストを記録する.
研究と開発費
研究·開発費用とは,開発会社の技術や将来のテストによるコストのことである。これらの費用には、給与、従業員福祉費用、ボーナス、および株式ベースの給与費用を含む人員費用、実験室用品、相談費用、および分配された間接費用が含まれる。当社はすべての研究·開発費が発生している間にこれらの費用を支払います。
販売とマーケティング費用
販売およびマーケティング費用には、給与、従業員福祉コスト、ボーナスおよび株式ベースの報酬費用、顧客サービス費用、直接マーケティング費用、教育および普及費用、市場研究および分析、および分配された管理費用が含まれる。当社は発生したすべての販売とマーケティング費用を負担します。
一般と行政費用
一般的かつ行政的費用には、行政、財務、会計、法律、人的資源機能が含まれる。これらの費用には、給与、従業員福祉費用、ボーナス、株式ベースの給与費用、監査および法律費用、相談費用および分配された管理費用が含まれる。会社は発生したすべての一般的で行政的な費用を負担する。
F-16
再構成コスト
再編コストは、非自発的に終了した新規買収エンティティに関連する従業員が提供する一次従業員離職福祉を指す。2022年第2四半期、経営陣は終了計画を承認し、承認した。この計画は、解雇される具体的な従業員を決定し、これらの従業員が解雇されたときに得られる福祉条件を決定した
所得税
所得税は貸借対照法で計算される。同社は現在支払うべき連邦、州、外国所得税、財務諸表目的と税務目的報告収入と支出の時間差による繰延税金を規定している。繰延税金資産及び負債は、既存資産及び負債の帳簿金額とそのそれぞれの課税基礎との一時的な違いによる将来の税務結果を確認することができる。繰延税金資産と負債は、これらの臨時差額の回収または決済が予定されている年度の課税収入に適用される予定で、制定された所得税税率計量を採用する。所得税率変動の影響は,公布日を含む期間中に収入または費用であることが確認された。
所得税の頭寸がさらに持続する可能性がある場合にのみ、会社はこれらの頭寸の影響を確認する。確認された所得税の頭寸は最大金額で計量されており、実現可能性は50%を超えている。確認や計測の変化は変化が発生したと判断した期間に反映される.所得税については、税収割引が続く可能性が低い場合、会社はその連結財務諸表で税収割引を確認しません。当社は、税務状況の不確定に関する利息と罰金(適用される場合)を所得税費用の一構成要素として記録しています。
株式ベースの報酬
同社はその従業員、コンサルタント、非従業員取締役に各種持分に基づく奨励を付与した。株式ベースの報酬コストは、各受賞者の会社における役割に応じて添付された総合経営レポートに反映される。同社は主にその従業員に制限的な株式単位奨励、またはRSU奨励を付与し、通常サービス条件または業績条件が満たされた後に指定された時間帯内に授与する。サービスに基づく帰属条件を有する従業員RSU報酬の報酬支出は、報酬の帰属中に比例して確認される。パフォーマンス条件を有する従業員RSUが報酬する報酬費用は、このパフォーマンス条件の可能な結果に基づく。当社は付与日奨励の公正価値に基づいて従業員に付与された持分奨励の報酬支出を計量する。
外貨両替と外貨取引
同社は期間終了時の有効為替レートを用いて、その非ドル機能通貨子会社の資産と負債をドルに変換する。当該等の付属会社の支出は期内有効比率の比率で換算した。これらの換算の損益は外貨換算損益で確認され,外貨換算損益は付随する総合包括収益表(損益表)に含まれる。当社とドルをその機能通貨とする子会社は、期末の有効為替レートごとに貨幣性資産と負債を再計測し、歴史的な為替レートで在庫、財産、非貨幣的資産と負債を再計測する。これらの計量した損益は利息やその他の収入純額を計上し,付随する総合経営報告書に計上する。2023年、2022年、2021年、外貨両替損失は大きくない。
総合収益(赤字)
総合収益(損失)は純収益(赤字)とその他の総合収益(赤字)からなる。その他の全面収益(赤字)には、債務証券を売却できる未実現純収益や純損失、税引き後純額および子会社がその機能通貨としてドルを使用しない外貨換算調整が含まれる。2023年または2022年には、他の総合収益(損失)から純収益への再分類は顕著ではない。2021年には、会社は他の全面収益(赤字)から純損失への再分類を行っていない。債務証券の売却可能な未実現純収益または純損失に関する税収の影響は以下のとおりである
F-17
基本と希釈後の1株当たり純収益または損失
普通株の基本純収益或いは1株当たり損失の計算方法は:普通株株主は純収益或いは損失を当期に発行された普通株の加重平均で割るべきである。1株当たりの普通株式の純収益或いは1株当たりの損失の計算方法は、普通株株主は純収益或いは損失を当期に発行された普通株と希釈性普通株等価物の加重平均で割るべきである。
収入の分類
同社はその顧客を3種類の支払人タイプに分けた:(I)保険に加入していない個人がHRSAからクレーム補償を受けることを含む;(Ii)病院、医療機関、他の実験室、政府機関、市政当局と大手会社を含む機関、または(Iii)直接支払いの患者であり、会社はその収入とキャッシュフローの性質、金額、タイミング、不確実性がどのように経済要素の影響を受けるかを最もよく描写していると考えているからである
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
支払者別のテストサービス |
|
|
|
|
|
|
|
|
|||
保険 |
$ |
|
|
$ |
|
|
$ |
|
|||
体制性 |
|
|
|
|
|
|
|
|
|||
病人.病人 |
|
|
|
|
|
|
|
|
|||
総収入 |
$ |
|
|
$ |
|
|
$ |
|
|||
上記の保険収入種別には
$
契約残高
取引先との契約売掛金−顧客と契約した売掛金は、総合貸借対照表の売掛金に含まれる。保険と機関の顧客を代表する売掛金
契約資産と負債−契約資産は、契約実行に関連する顧客の契約からのものであり、添付の統合貸借対照表に含まれる他の流動資産を含む契約を履行するいくつかのコスト。会社が顧客への貨物またはサービスの譲渡義務を完了する前に支払いを受けた場合、契約債務が記録される。契約負債は総合貸借対照表に計上される。収入は3ドルです
将来の契約義務に割り当てられた取引価格
財務会計基準委員会(FASB)が発表したASC 606は、2023年12月31日までに履行されていない履行義務に割り当てられた取引価格総額の開示を会社に要求する。ASC 606は、義務を履行していない取引価格総額に割り当てられた開示の要求を制限するいくつかの実用的な便宜的な手段を提供する。
その会社はこの実際の方便を
F-18
最近の会計公告
会社はFASBが発表したすべてのASUを評価し,その適用性を考慮した。ASUSは当社の開示に含まれておらず、評価された後、適用されないか、または当社の総合財務諸表や開示に大きな影響を与えないと判断された。
2023年11月、FASBはASU 2023-07を発表した分部報告(主題280),可報告分部の改善それは.この更新は、報告可能な支部開示要求を改善し、定期的にCODMに提供される重大な支部費用に関する開示、他の支部プロジェクトの金額、および構成、支部損益の記述を強化し、CODMが分部業績を評価し、資源をどのように割り当てるかを決定する際に1つの支部の多様な損益測定基準を使用するかどうかを明らかにすることを要求する。この更新中の改訂は,2023年12月15日以降に開始される財政年度と,2024年12月15日以降に開始される財政年度内の移行期間に適用される。当社は現在、この改正が総合財務諸表および関連開示に及ぼす影響を評価している。
FASBは2023年12月にASU 2023-09を発表しました所得税(特集740):所得税の改善開示それは.最新の状況は、所得税税率、入金、および支払いされた所得税を含む、いくつかの所得税開示に関するより詳細な情報を提供することを要求する。今回の更新における改正案は、2024年12月15日から公共エンティティに対する年次期間が発効し、早期採用が許可されている。当社は現在、この改正が総合財務諸表および関連開示に及ぼす影響を評価している。
同社は最近発表された他のいかなる会計基準もその総合財務諸表に大きな影響を与えないと予想している。
F-19
付記3.持分及び債務証券
同社の株式と債務証券には、
|
2023年12月31日 |
|
|||||||||||||
|
償却する |
|
|
実現していない |
|
|
実現していない |
|
|
骨材 |
|
||||
|
(単位:千) |
|
|||||||||||||
株式証券: |
|
|
|
|
|
|
|
|
|
|
|
||||
長期の |
|
|
|
|
|
|
|
|
|
|
|
||||
私株会社の優先株 |
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
総株式証券 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
売却可能な債務証券 |
|
|
|
|
|
|
|
|
|
|
|
||||
短期.短期 |
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府債務証券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
アメリカ機関債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
アメリカ国庫券 |
|
|
|
|
|
|
|
— |
|
|
|
|
|||
会社債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
貨幣市場口座 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
市政債券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
減算:現金等価物 |
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
1年以内に満期となる債務証券総額 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
1年から5年後 |
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府債務証券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
アメリカ機関債務証券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
会社債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
市政債券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
アメリカ人債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
償還可能優先株投資 |
|
|
|
|
|
|
|
— |
|
|
|
|
|||
1年から5年後の満期債務証券総額 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
5年から10年後 |
|
|
|
|
|
|
|
|
|
|
|
||||
市政債券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
5年から10年後の債務証券総額 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
売却可能な債務証券総額 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
株式と債務証券総額 |
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
F-20
|
2022年12月31日 |
|
|||||||||||||
|
償却する |
|
|
実現していない |
|
|
実現していない |
|
|
骨材 |
|
||||
|
(単位:千) |
|
|||||||||||||
株式証券: |
|
|
|
|
|
|
|
|
|
|
|
||||
長期の |
|
|
|
|
|
|
|
|
|
|
|
||||
私株会社の優先株 |
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
総株式証券 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
売却可能な債務証券 |
|
|
|
|
|
|
|
|
|
|
|
||||
短期.短期 |
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
会社債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
アメリカ国庫券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
アメリカ機関債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
貨幣市場口座 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
市政債券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
アメリカ人債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
減算:現金等価物 |
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
1年以内に満期となる債務証券総額 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
1年から5年後 |
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府債務証券 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
アメリカ機関債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
会社債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
市政債券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
アメリカ人債務証券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
償還可能優先株投資 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
1年から5年後の満期債務証券総額 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
5年から10年後 |
|
|
|
|
|
|
|
|
|
|
|
||||
市政債券 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
5年から10年後の債務証券総額 |
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
売却可能な債務証券総額 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
株式と債務証券総額 |
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
会社の株式と債務証券の未実現損失総額は$
付記4.公正価値計量
公正価値計測に関する権威的な指針は、公正価値に応じた経常性と非日常的な基礎計量資産と負債の枠組みを確立した。この枠組みの下で、公正価値は、計量日までに市場参加者間の秩序ある取引において資産を売却するか、または負債を移動させることによって受信された金額である脱退価格として定義される。この枠組みは,公正価値を計測する際に使用する投入のための三次階層構造を構築し,観察可能な投入を最大限に利用し,獲得可能なときに最も観察可能な投入を使用することを要求することで,観察できない投入を最大限に削減する。観察可能な投入とは,市場参加者が資産や負債の投入を評価するために用いられ,当社以外のソースから得られた市場データに基づいて開発されるものである。観察できない投入は、市場参加者が資産や負債を評価するために使用される要因に対する会社の仮定を反映し、その際に得られる最適な情報に基づいて策定される。この階層構造は、以下の3つのレベルからなる
レベル1: |
投入は、報告エンティティが計量日に取得可能な同じ資産または負債のアクティブ市場でのオファー(調整されていない)である。 |
第2レベル: |
投入は第1レベルに含まれる見積以外の投入であり、資産または負債から直接または間接的に観察することができる。 |
第3レベル: |
資産や負債の投入は観察できない。 |
F-21
以下の表は、三級公正価値レベルに基づいて公正価値を日常的に計量する会社の金融資産の情報を紹介した
|
2023年12月31日 |
|
|||||||||||||
|
合計する |
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
||||
|
(単位:千) |
|
|||||||||||||
株式証券、債務証券、現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府債務証券 |
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
||
アメリカ機関債務証券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
会社債務証券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
アメリカ国庫券 |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
||
貨幣市場口座 |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
||
償還可能優先株投資 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
私株会社の優先株 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
市政債券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
アメリカ人債務証券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
株式証券、債務証券、現金等価物総額 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
|
2022年12月31日 |
|
|||||||||||||
|
合計する |
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
||||
|
(単位:千) |
|
|||||||||||||
株式証券、債務証券、現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府債務証券 |
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
||
会社債務証券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
アメリカ機関債務証券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
アメリカ国庫券 |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
||
貨幣市場口座 |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
||
市政債券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
私株会社の優先株 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
償還可能優先株投資 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
アメリカ人債務証券 |
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
株式証券、債務証券、現金等価物総額 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
同社の一級資産には、米国の国庫券と通貨市場ツールが含まれており、観察可能な市場価格に基づいて評価されている。二級資産はアメリカ政府とアメリカ機関債務証券、市政債券、会社債務証券とヤンキー債務証券を含む。二次証券の推定値は、報告書の取引、取引業者/取引業者の見積もり、入札、および要約を含む観察可能な入力に基づく。当社は、2023年、2023年、2022年12月31日まで、添付の総合貸借対照表に含まれる他の長期資産に含まれるプライベート持株会社の優先株と、不可視(3級)を用いて計量された優先株を保有している。2023年、2023年、2022年12月31日の償還可能優先株の公正価値は、第三者評価会社が市場法の下で上場会社法を指針とし、収益法の下で現金流動量法を適用した評価に基づいている。私募株式証券に投資する価値については、私募持株会社の優先株に確定しやすい公正価値がなく、2023年12月31日現在減値損失が記録されていないため、コスト減算値で計量することを選択した。
いくつありますか
F-22
注5.固定資産
固定資産の主なカテゴリは以下のとおりである
|
|
十二月三十一日 |
|
|||||
|
有用な寿命 |
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
医学実験室装置 |
$ |
|
|
$ |
|
|||
賃借権改善 |
|
|
|
|
|
|||
家を建てる |
|
|
|
|
|
|||
コンピュータソフト |
|
|
|
|
|
|||
建築改良 |
|
|
|
|
|
|||
コンピュータハードウェア |
|
|
|
|
|
|||
飛行機 |
|
|
|
|
|
|||
家具と固定装置 |
|
|
|
|
|
|||
土地改良 |
|
|
|
|
|
|||
自動車 |
|
|
|
|
|
|||
汎用設備 |
|
|
|
|
|
|||
土地 |
|
|
|
|
|
|
||
まだ使用していない資産 |
|
|
|
|
|
|
||
合計する |
|
|
|
|
|
|
||
減算:減価償却累計 |
|
|
( |
) |
|
|
( |
) |
固定資産、純額 |
|
$ |
|
|
$ |
|
||
固定資産減価償却費用は合計1ドルです
付記6.その他重要資産負債表勘定
他の流動資産には:
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
所得税を前納する |
$ |
|
|
$ |
|
||
前払い費用 |
|
|
|
|
|
||
試薬と用品 |
|
|
|
|
|
||
受取有価証券利息 |
|
|
|
|
|
||
その他売掛金 |
|
|
|
|
|
||
合計する |
$ |
|
|
$ |
|
||
2022年12月31日までのその他の売掛金は米ドルを含む
計算すべき負債には以下の内容が含まれる
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
法律責任を計算する |
$ |
|
|
$ |
|
||
赤と手数料を計算すべきである |
|
|
|
|
|
||
賃金負債 |
|
|
|
|
|
||
その他負債を計算すべき |
|
|
|
|
|
||
賃貸負債を経営しています--短期 |
|
|
|
|
|
||
休暇は費用を計算する |
|
|
|
|
|
||
合計する |
$ |
|
|
$ |
|
||
F-23
その他長期負債以下の内容を含む
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
長期経営賃貸負債 |
$ |
|
|
$ |
|
||
その他長期負債 |
|
|
|
|
|
||
長期支払手形 |
|
|
|
|
|
||
合計する |
$ |
|
|
$ |
|
||
その他の長期負債には、長期融資リース負債と、2022年に企業合併から負担される長期負債が含まれる。
注7.報告可能なゾーンと地理情報
2022年の財務諸表で、会社は#年の業務を表示して管理しています
利息、費用、所得税の部門間分配は存在しません。部門間収入や営業収入や損失は存在しない
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
サービスからの収入: |
|
|
|
|
|
|
|
|
|||
ラボサービス: |
|
|
|
|
|
|
|
|
|||
精密診断学 |
$ |
|
|
$ |
|
|
$ |
|
|||
解剖病理学 |
|
|
|
|
|
|
|
|
|||
新冠肺炎 |
|
|
|
|
|
|
|
|
|||
バイオ製薬サービス |
|
|
|
|
|
|
|
|
|||
実験室総サービス量 |
|
|
|
|
|
|
|
|
|||
治療が進む |
|
|
|
|
|
|
|
|
|||
合計する |
$ |
|
|
$ |
|
|
$ |
|
|||
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
営業(赤字)収入: |
|
|
|
|
|
|
|
|
|||
実験室サービス |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
治療が進む |
|
( |
) |
|
|
( |
) |
|
|
|
|
合計する |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
F-24
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
減価償却と償却: |
|
|
|
|
|
|
|
|
|||
実験室サービス |
$ |
|
|
$ |
|
|
$ |
|
|||
治療が進む |
|
|
|
|
|
|
|
|
|||
合計する |
$ |
|
|
$ |
|
|
$ |
|
|||
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
資産: |
|
|
|
|
|
||
実験室サービス |
$ |
|
|
$ |
|
||
治療が進む |
|
|
|
|
|
||
合計する |
$ |
|
|
$ |
|
||
収入の地理的分布:
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
収入: |
|
|
|
|
|
|
|
|
|||
アメリカです |
$ |
|
|
$ |
|
|
$ |
|
|||
外国.外国 |
|
|
|
|
|
|
|
|
|||
合計する |
$ |
|
|
$ |
|
|
$ |
|
|||
財産、工場、設備の地理分布、純額:
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
固定資産: |
|
|
|
|
|
||
アメリカを団結させる |
$ |
|
|
$ |
|
||
外国.外国 |
|
|
|
|
|
||
合計する |
$ |
|
|
$ |
|
||
付記8.債務、引受金及びその他の事項
債務
2023年12月31日現在の支払手形には$が含まれています
リースと融資リースを経営しています
注9を参照賃貸借証書より多くの情報を得るために。
購入義務
同社はそのサプライヤーといくつかの調達承諾を締結し、主にサービス、試薬と用品、コンピュータソフトウェアと医療実験室設備を含む。2023年12月31日現在、同社の購入義務は
F-25
事件があったり
当社は時々正常な業務過程で法的手続きやクレームの影響を受ける可能性があります。経営陣は、上記のいずれの事項の結果も、会社の総合財務状況、経営業績又はキャッシュフローに実質的な影響を与えるとは考えていない。
同社は、医学的に不要な実験室検査、実験室で測定された不当な請求書、および反リベート法規およびスタッカー法に違反して受信または提供された報酬に関する米司法省から“虚偽請求法”に基づいて発行された民事調査要求(CID)を受信した。他の事項に加えて、このCIDは、CID中に指名されたある会社の顧客に関する情報および記録を提供することを要求し、これらの顧客は、会社の収入の一部のみを占める。会社が以前に提出した文書に開示されているように、米国証券取引委員会または米国証券取引委員会も非公開の正式な調査を行っており、調査は、米国証券取引委員会の請求と、我々が提出した2018年から2020年までの“取引法”報告書に提出された事項と関係があるようである。会社は米司法省と米証券取引委員会に全力で協力し、今回のCIDや調査中の情報要請に迅速に対応している。会社はこれらの問題がいつ解決されるか、これらの問題の結果、あるいはそれらの潜在的な影響を予測することができず、これらは最終的に会社が現在予想しているよりも大きい可能性がある。
同業界の他の実験室と同様に,同社は現在HRSAの監査を受けており,保険がないと考えられる患者に提供される新冠肺炎検査の精算状況を決定している。同社は約$を記録しています
当社は、規制行動の予測、罰金、処罰(あれば)に固有の困難と、不利な裁決が発生した場合に当社が得ることができる様々な救済措置および司法審査レベルのため、現在参加している任意の重大な政府調査、監査、審査に生じる可能性のある損失または損失範囲を合理的に推定することができません。したがって、当社にはこのような事項に関する負債は何も記録されていません。
衛生·公衆サービス部監察長弁公室(“OIG”)が最近発表した諮問意見について、同社の子会社SYMPHONY BUBUR,Inc.または診断会社に自発的な開示手続きを開始し、適切な政府連絡先に連絡することを通知した。その会社は現在#ドルを推定して記録している
注9.賃貸借契約
借受人
当社は各種取消不能な経営賃貸契約のテナントであり、レンタル期間が通過する
本社はカリフォルニア州エルモントにあり、複数の会社事務所と
2023年12月31日と2022年12月31日までの経営·融資リース資産、短期賃貸負債、長期賃貸負債は以下の通り
F-26
|
十二月三十一日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
$ |
|
|
$ |
|
|||
$ |
|
|
$ |
|
|||
$ |
|
|
$ |
|
|||
$ |
|
|
$ |
|
|||
$ |
|
|
$ |
|
|||
$ |
|
|
$ |
|
|||
以下は経営と融資リース費用である
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
リースコストを経営する |
$ |
|
|
$ |
|
|
$ |
|
|||
融資リースコスト: |
|
|
|
|
|
|
|
|
|||
ROU資産の償却 |
|
|
|
|
|
|
|
|
|||
賃貸負債利息 |
|
|
|
|
|
|
|
|
|||
短期賃貸コスト |
|
|
|
|
|
|
|
|
|||
総賃貸コスト |
$ |
|
|
$ |
|
|
$ |
|
|||
|
2023年12月31日 |
|
|
加重平均残余賃貸期間--レンタルを経営します |
|
||
加重平均割引率−レンタル経営 |
|
% |
|
加重平均残余賃貸期間−ファイナンスリース |
|
||
加重平均割引率-融資リース |
|
% |
|
以下は、年間未割引キャッシュフロー(継続期間を含む)を用いた経営と融資リース負債の満期日分析である
|
賃貸借契約を経営する |
|
|
融資リース |
|
||
|
(単位:千) |
|
|||||
十二月三十一日までの年度 |
|
|
|
|
|
||
2024 |
$ |
|
|
$ |
|
||
2025 |
|
|
|
|
|
||
2026 |
|
|
|
|
|
||
2027 |
|
|
|
|
— |
|
|
2028 |
|
|
|
|
— |
|
|
その後… |
|
|
|
|
— |
|
|
賃貸支払総額 |
|
|
|
|
|
||
計上された利息を差し引く |
|
( |
) |
|
|
( |
) |
合計する |
$ |
|
|
$ |
|
||
貸出し人
同社は取消不可能な経営賃貸借契約に基づき,その所有する建物中の空間を第三者テナントに賃貸する。2023年12月31日までの残りレンタル期間は
F-27
主にアプリケーションレンタル期間内に直線的に確認したテナントの固定リース支払いを示す。可変賃貸収入はテナントが支払う不動産税、保険、メンテナンス費用を表す。
賃貸収入は、添付されている総合業務報告書に利息及びその他の収入純額を計上する
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
賃貸収入 |
$ |
|
|
$ |
|
|
$ |
|
|||
可変賃貸収入 |
|
|
|
|
|
|
|
|
|||
$ |
|
|
$ |
|
|
$ |
|
||||
2023年12月31日現在、テナントはキャンセル不可能なすべての経営賃貸に対する将来の固定賃貸支払いは以下の通り
|
レンタル料 |
|
|
|
テナントから |
|
|
|
(単位:千) |
|
|
十二月三十一日までの年度 |
|
|
|
2024 |
$ |
|
|
合計する |
$ |
|
|
注10.株式ベースの報酬
会社はすでに株式に基づく給与支出を収入コストと運営費用の一部とし、添付の総合経営報告書を以下のように計上している
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
収入コスト |
$ |
|
|
$ |
|
|
$ |
|
|||
研究開発 |
|
|
|
|
|
|
|
|
|||
販売とマーケティング |
|
|
|
|
|
|
|
|
|||
一般と行政 |
|
|
|
|
|
|
|
|
|||
合計する |
$ |
|
|
$ |
|
|
$ |
|
|||
付与または行使された奨励に関する税収減免から実現される実際の税収(費用)収益は,($
授賞活動
F-28
オプション大賞
次の表は、2023年、2022年、2021年12月31日までの年間で会社普通株を購入するオプション活動をまとめています
|
|
番号をつける |
|
|
重み付けの- |
|
|
重み付けの- |
|
|
重み付けの- |
|
|
骨材 |
|
|||||
2020年12月31日残高 |
|
|
|
|
$ |
|
|
|
|
|
|
|
|
$ |
|
|||||
授与する |
|
|
|
|
$ |
|
|
$ |
|
|
|
|
|
|
|
|||||
鍛えられた |
|
|
( |
) |
|
$ |
|
|
$ |
|
|
|
|
|
|
|
||||
キャンセルします |
|
|
— |
|
|
$ |
— |
|
|
$ |
— |
|
|
|
|
|
|
|
||
2021年12月31日の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
|
|
$ |
|
|||||
授与する |
|
|
|
|
$ |
|
|
$ |
|
|
|
|
|
|
|
|||||
鍛えられた |
|
|
( |
) |
|
$ |
|
|
$ |
|
|
|
|
|
|
|
||||
キャンセルします |
|
|
( |
) |
|
$ |
|
|
$ |
|
|
|
|
|
|
|
||||
2022年12月31日の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
|
|
$ |
|
|||||
授与する |
|
|
|
|
$ |
|
|
$ |
|
|
|
|
|
|
|
|||||
鍛えられた |
|
|
( |
) |
|
$ |
|
|
$ |
|
|
|
|
|
|
|
||||
キャンセルします |
|
|
— |
|
|
$ |
— |
|
|
$ |
— |
|
|
|
|
|
|
|
||
2023年12月31日の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
|
|
$ |
|
|||||
2023年12月31日から行使可能 |
|
|
|
|
$ |
|
|
|
|
|
|
|
|
|
|
|||||
2023年,2022年および2021年12月31日まで年度内に帰属するオプションの総公平価値は$
RSU賞
RSUは,所有者に帰属条件を満たした後に会社の普通株を獲得する権利を付与する奨励である.各RSUは、帰属および決済時に会社の普通株式を取得する権利または権利を表す。
次の表は、2023年12月31日、2022年12月31日、2021年12月31日までの年度における会社普通株に関するRSU活動をまとめたものである
|
量 |
|
|
加重平均 |
|
||
2020年12月31日残高 |
|
|
|
$ |
|
||
授与する |
|
|
|
$ |
|
||
仲直りしなければならない |
|
( |
) |
|
$ |
|
|
没収される |
|
( |
) |
|
$ |
|
|
2021年12月31日の残高 |
|
|
|
$ |
|
||
授与する |
|
|
|
$ |
|
||
仲直りしなければならない |
|
( |
) |
|
$ |
|
|
没収される |
|
( |
) |
|
$ |
|
|
2022年12月31日の残高 |
|
|
|
$ |
|
||
授与する |
|
|
|
$ |
|
||
仲直りしなければならない |
|
( |
) |
|
$ |
|
|
没収される |
|
( |
) |
|
$ |
|
|
2023年12月31日の残高 |
|
|
|
$ |
|
||
F-29
2023年12月31日、2022年、2021年12月31日までの年間で付与されたRSU奨励は、持分ベースの報酬支出総額を$
オプション報酬の公正価値仮定
同社はブラック·スコアーズオプション定価モデルを用いてオプション報酬の公正価値を測定した。ブラック·スコアーズオプション定価モデルは様々な仮説を入力する必要があり,いずれの仮説も主観的であり,重大な判断が必要である.これらの仮定には以下の点がある
従業員への報酬
次の表にブラック·スコアーズオプション定価モデルで用いられている加重平均仮定を示して、2023年12月31日、2022年、2021年12月31日までの年間に従業員に付与された会社普通株のオプションの公正価値を推定する。
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
予想期限(年単位) |
|
|
|
|
|
|
|
|
|||
無リスク金利 |
|
% |
|
|
|
|
|||||
配当率 |
|
— |
|
|
— |
|
|
— |
|
||
予想変動率 |
|
% |
|
|
|
|
|||||
F-30
公正価値の授権日の確定
ナスダックグローバル市場によると、会社の普通株のオプションとRSUが奨励する株式の公正価値は、会社取締役会またはその報酬委員会が付与日の会社普通株の終値に基づいて決定される。
注11.所得税
所得税準備金にはアメリカ連邦所得税と州所得税が含まれる。繰延税金項目負債はすべての課税の一時的な差異であることが確認され、繰延税項資産はすべて差し引くことができる一時的な差異、営業損失、税収の繰越免除であることが確認された。繰延税金資産の一部または全部が現金化できない可能性が高い場合には、推定準備を提供する。
所得税前収入(赤字)と権益法投資収益をまとめた表
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
米国所得税前(赤字)収入と権益法投資収益 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
所得税前の海外損失と権益法投資収益 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税前収入と権益法投資収益 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
所得税支出は以下の部分からなる
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
現在: |
|
|
|
|
|
|
|
|
|||
連邦制 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
状態.状態 |
|
( |
) |
|
|
|
|
|
|
||
総電流 |
|
( |
) |
|
|
|
|
|
|
||
延期: |
|
|
|
|
|
|
|
|
|||
連邦制 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
状態.状態 |
|
|
|
|
( |
) |
|
|
( |
) |
|
外国.外国 |
|
( |
) |
|
|
|
|
|
|
||
評価免除額を変更する |
|
|
|
|
( |
) |
|
|
( |
) |
|
遅延合計 |
|
|
|
|
( |
) |
|
|
( |
) |
|
所得税総支出 |
$ |
|
|
$ |
|
|
$ |
|
|||
F-31
連邦法定所得税率と実際の所得税率との差額は以下のとおりである
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
連邦法定税率で出された税収規定 |
|
% |
|
|
|
|
|||||
州税 |
|
% |
|
|
% |
|
|
% |
|||
不確定税収状況 |
|
% |
|
|
|
|
|||||
株に基づく報酬 |
|
- |
% |
|
|
- |
% |
|
|
- |
% |
差し引かれない賠償金--162(リットル) |
|
- |
% |
|
|
% |
|
|
% |
||
営業権の減価 |
|
- |
% |
|
|
% |
|
|
% |
||
連邦返還規定 |
|
- |
% |
|
|
- |
% |
|
|
- |
% |
国戻し規定 |
|
% |
|
|
- |
% |
|
|
- |
% |
|
他の恒久的差異 |
|
- |
% |
|
|
|
|
||||
信用を研究開発する |
|
% |
|
|
- |
% |
|
|
- |
% |
|
海外税率の違い |
|
- |
% |
|
|
% |
|
|
% |
||
他にも |
|
% |
|
|
|
|
|||||
評価免除額を変更する |
|
- |
% |
|
|
|
|
- |
% |
||
実際の税率 |
|
- |
% |
|
|
|
|
||||
下表に繰延税金資産(負債)の構成要素をまとめた。繰延税項目純資産は総合貸借対照表の他の長期資産に計上される。
|
12月31日まで |
|
|||||
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
繰延税金資産 |
|
|
|
|
|
||
休暇とその他の費用を計算しなければならない |
$ |
|
|
$ |
|
||
信用損失準備金 |
|
|
|
|
|
||
純営業損失 |
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
||
州所得税 |
|
|
|
|
|
||
FF遺伝子バイオテクノロジー純資産における超過課税基盤 |
|
|
|
|
|
||
リース責任 |
|
|
|
|
|
||
債務証券を売却可能な未実現損益 |
|
|
|
|
|
||
研究開発単位 |
|
|
|
|
— |
|
|
第174節研究と実験支出 |
|
|
|
|
|
||
投資における権益損失 |
|
|
|
|
|
||
他にも |
|
|
|
|
|
||
繰延税項目総資産 |
|
|
|
|
|
||
減算:推定免税額 |
|
( |
) |
|
|
( |
) |
繰延税項目純資産 |
|
|
|
|
|
||
繰延税金負債 |
|
|
|
|
|
||
無形資産 |
|
|
|
|
|
||
減価償却 |
|
|
|
|
|
||
使用権資産 |
|
|
|
|
|
||
他にも |
|
|
|
|
|
||
繰延税金負債総額 |
|
|
|
|
|
||
繰延税項目純資産 |
$ |
( |
) |
|
$ |
|
|
2023年12月31日現在、同社は
ASC 740−10−30−5は、繰延所得税資産の一部または全部が現金化できない可能性が高い場合、繰延所得税資産は推定準備金を減算しなければならないことを要求する。当社はその繰延税金資産の現金化能力を評価し、当社はいくつかの繰延税金資産の利益を実現できない可能性が高い可能性が高いため、#ドルを設定したと結論した
F-32
海外純営業損失は2022年12月31日に繰り越した。評価免税額は#ドル増加した
経済協力開発機構(OECD)は、新たな世界最低税収枠(BEPS Pillar II)のための模範的なルールを制定している。各管轄区域では、これらのルールに関する立法が制定されているか、または制定されている。私たちは事態の発展に細心の注意を払っており、現在私たちが運営している各司法管轄区域の潜在的な影響を評価している
不確定税収状況
その会社はアメリカ政府と特定の州の所得税を払わなければならない活動に所得税申告要求が生じた。その会社はどの外国司法管轄区でも重大な所得税申告要求を持っていない。会社の納税申告書は異なる管轄区域の制限法規によって制限されています。当社は2023年12月31日まで、米国と各州で2019年から2023年までの所得税審査を行う必要があります。他の州では納税年度に審査を行う必要があります
同社は特定の税務機関による2020年と2021納税年度の審査を受けている。審査終了時間は未定ですが、当社は起こりうる調整のために十分な金額を確保していると信じています。
当社が確認していない税収割引総額の入金は以下の通りです
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
年初残高 |
$ |
|
|
$ |
|
|
$ |
|
|||
前年のポストに増える |
|
( |
) |
|
|
|
|
|
— |
|
|
今年度はポストが増える |
|
( |
) |
|
|
|
|
|
|
||
年末残高 |
$ |
|
|
$ |
|
|
$ |
|
|||
2023年12月31日現在、同社は
会社はすべての税務頭寸のために十分な準備をしていると思っていますが、税務機関が主張している金額は会社の頭寸を計るべきである。したがって、訂正推定数がクリアされているか、または他の方法で解決される場合には、今後の間、連邦、州、および外国税務関連事項に関する追加規定を記録することができる。
F-33
付記12.1株当たり収益(損失)
以下は、基本1株当たり収益(損失)と希釈後の1株当たり収益(損失)計算の入金である
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位は千、1株当たりのデータは除く) |
|
|||||||||
普通株主は純収入を占めなければならない |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|||
加重平均普通株式-発行済み基本普通株式 |
|
|
|
|
|
|
|
|
|||
証券を希釈する加重平均効果: |
|
|
|
|
|
|
|
|
|||
*株式オプション |
|
— |
|
|
|
|
|
|
|
||
*限定株式単位 |
|
— |
|
|
|
|
|
|
|
||
発行または発行可能株 |
|
— |
|
|
|
|
|
|
— |
|
|
加重平均普通株式-発行され、希釈された後 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
(損失)1株当たり収益: |
|
|
|
|
|
|
|
|
|||
**基本版 |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
*希釈された |
$ |
( |
) |
|
$ |
|
|
$ |
|
||
♪the the the以下の証券は、それらの影響が逆希釈されるため、1株当たり希釈収益の計算から除外されている
|
十二月三十一日までの年度 |
|
|||||||||
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
(単位:千) |
|
|||||||||
株式オプション |
|
|
|
|
|
|
|
|
|||
限定株単位 |
|
|
|
|
|
|
|
|
|||
株式を発行することができます |
|
|
|
|
|
|
|
|
|||
上記逆希釈株式は在庫株方法を用いて計算した。2023年12月31日までの年度内に、会社の純損失状況により、会社はフルキント製薬会社の業務組合に関する既発行株式オプション、制限株式単位、または発行可能株を保有しており、継続運営の加重平均株式計算には含まれていない。
注13.退職計画
同社は、ある資格要求を満たす従業員のために、その役員を含めて、401(K)退職貯蓄計画または401(K)計画を提供する。1986年に改正された国内収入法は、資格のある従業員が401(K)に計画的に入金することにより、規定された限度額内で、税引き前に一部の給与の支払いを延期することを許可した。会社は、401(K)計画に対する参加者の賃金繰延入金金額に基づいて、401(K)計画に対する支払いを一致させる。その会社は一致するだろう
付記14.関連先
リンダ·マーシュは会社の取締役会メンバーで、現在AHMC Healthcare Inc.(AHMCと略称する)上級執行副総裁を務めている。当社は距離を保つために遺伝子テストや他のテストサービスを提供しています会社は認識しています$
謝明華はPTJ Associates Inc.(略称PTJ)の所有者である一定の距離で会社に飛行サービスを提供します。会社は2023年12月31日、2022年12月31日、2021年12月31日までの年間で発生した
F-34
謝明輝も取締役会のメンバーで、
注15.業務統合
通知診断
2022年4月26日、会社は対
Inform Diagnosticsの財務結果は買収日から連結財務諸表に計上される。当社は推定公正価値に基づいて買収価格を有形資産と確認された無形資産及び負担する負債に分配します。
|
金額 |
|
|
|
(単位:千) |
|
|
考慮事項 |
|
|
|
現金、受け取った現金を差し引いた純額 |
$ |
|
|
|
|
|
|
|
|
|
|
取得した確認可能資産と負担する負債の確認金額 |
|
|
|
純運営資本 |
$ |
( |
) |
固定資産 |
|
|
|
ROU資産--運営 |
|
|
|
ROU資産-財務 |
|
|
|
繰延税金資産 |
|
|
|
その他長期資産 |
|
|
|
無形資産を識別することができる |
|
|
|
リース負債を経営する |
|
( |
) |
融資リース負債 |
|
( |
) |
所得税に対処する |
|
( |
) |
その他長期負債 |
|
( |
) |
取得した確認可能資産と負担した負債の確認金額、純額 |
|
|
|
商誉 |
|
|
|
合計する |
$ |
|
|
ドルの営業権
取得された確認可能な無形資産は#ドルを含む
クライアント関係の公平価値は,収益法の多期超過収益法(MPEG)を用いて推定される.MPEGでは,無形資産の公正価値は増加した税後の現金の現在値に等しい
F-35
出資資産費用を差し引くと対象物無形資産の流量にしか帰属できない。そして、顧客関係の増加による税後キャッシュフローをリスク調整後の収益率に応じて現在値に割引することができる。この商標の公正価値は、印税免除またはRFR方法を使用して推定される。RFR方法は、会社が資産を所有していない場合、資産の使用のために支払われる特許権使用料料率に基づいて、会社が無形資産の収益部分に起因することができると推定する。原地賃貸無形資産の公正価値は収益法下での割引現金流量を用いて推定する。償却のための無形資産の使用年数は、法律、法規、契約、競争、経済、および使用年数を制限する可能性のある他の要因を含む、特定のエンティティの要因に応じて適切に調整された無形資産の公正価値を計量するための予期されるキャッシュフロー期間を考慮することによって決定される。顧客関係と商号はその推定耐用年数内に直線的に償却されます。
買収日以来、Inform Diagnostics買収の収入と運営損失は$
Inform Diagnosticsの買収に関する取引コストは、主に法律、規制、財務相談費約#ドルを含む
監査を受けていない備考財務情報
以下、監査を受けていない備考財務情報は、フルギンテと通知診断会社の総合運営結果を概説し、この2社は2021年初めに合併したようです。財務情報は以下の点について調整されたと予想される
買収に関連するコスト−フルギットと診断会社に通知して発生した買収に関連するコストはフルゴールドの純収入に含まれず,総コストは$である
フントの純収入に起因する他の調整は#ドルになる
|
十二月三十一日までの年度 |
|
|||||
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
||
収入.収入 |
$ |
|
|
$ |
|
||
富金特の純収入に帰することができる |
$ |
|
|
$ |
|
||
フントの普通株1株当たりの基本収益に帰することができる |
$ |
|
|
$ |
|
||
富金の希釈後の普通株当たりの収益に帰することができる |
$ |
|
|
$ |
|
||
フルキン医薬ホールディングス
2022年11月7日、会社は対
フルゴールド製薬会社の財務結果は買収日から合併財務諸表に含まれている。当社は推定公正価値に基づいて買収価格を有形資産と確認された無形資産及び負担する負債に分配します。次の表は、購入日に支払われた対価格および購入資産と負担した確認済み負債の最新額をまとめています
F-36
ドルの営業権
購入された確認された無形資産は#ドルを含む
買収日以来、Fulgent Pharma買収の収入と運営損失は
Fulgent Pharmaの買収に関する取引コストは主に法律、監督管理、財務相談費を含み、約#ドルである
これは1ドルです
FF遺伝子バイオテクノロジー
2017年4月、当社は買収しました
二零二一年五月、私たちは西龍科技及びFJIPと再編協定を締結し、当社の間接買収を招きました
当社は、推定公正価値に基づいて、買収された有形および識別可能な無形資産および負担する負債に買収価格を割り当てる。税務関連プロジェクトの推定公正価値の最終決定のようなより多くの情報を得るにつれて、同社は、計算期間の残り時間内(FF gene Biotech買収の日から最大1年)に予備買収価格割り当てをさらに更新する可能性がある
F-37
|
金額 |
|
|
|
(単位:千) |
|
|
要因を考慮する |
|
|
|
現金 |
$ |
|
|
会社株の公正価値 |
|
|
|
|
$ |
|
|
取得した確認可能資産と負担する負債の確認金額 |
|
|
|
金融資産 |
$ |
|
|
試薬と用品 |
|
|
|
固定資産 |
|
|
|
その他有形資産 |
|
|
|
無形資産を識別することができる |
|
|
|
その他流動負債 |
|
( |
) |
支払手形 |
|
( |
) |
取得した確認可能資産と負担した負債の確認金額、純額 |
|
|
|
非持株権益 |
|
( |
) |
商誉 |
|
|
|
合計する |
$ |
|
|
プライベートエンティティFF gene Biotechの非制御的権益またはNCIの公正価値,$
同社は#ドルの収益を確認した
ドルの営業権
FF gene Biotechを買収する際に得られた識別可能な無形資産は1ドルを含む
同社は,FF遺伝子バイオテクノロジー会社は十分な資本独立運営が不足しているため,同社は可変利益実体であると結論している。同社の結論は,FF遺伝子バイオテクノロジー会社の最も重要な活動を指導する権利があることのみであり,FF遺伝子バイオテクノロジー会社を買収した後の実体の主要な受益者である。FF gene Biotechへの影響の程度に関する判断には,会社の所有権利益,取締役会や他の管理機関における代表,意思決定への参加などの重要な要因の考慮がある.
CSI買収
2021年8月に同社は買収しました
F-38
当社は推定公正価値に基づいて買収価格を有形資産と確認された無形資産及び負担する負債に分配します。税務関連項目の推定公正価値の最終決定のようなより多くの情報を得るにつれて、会社は、計量期間の残りの時間内(CSI買収の日から最大1年)に予備買収価格割り当てをさらに更新する可能性がある。
|
金額 |
|
|
|
(単位:千) |
|
|
要因を考慮する |
|
|
|
現金 |
$ |
|
|
値段が合うかもしれない |
|
|
|
|
$ |
|
|
取得した確認可能資産と負担する負債の確認金額 |
|
|
|
無債務純運営資本 |
$ |
|
|
固定資産 |
|
|
|
ROU資産--運営 |
|
|
|
ROU資産-財務 |
|
|
|
その他の資産 |
|
|
|
無形資産を識別することができる |
|
|
|
繰延税金負債 |
|
( |
) |
リース負債を経営する |
|
( |
) |
融資リース負債 |
|
( |
) |
その他負債 |
|
( |
) |
取得した確認可能資産と負担した負債の確認金額、純額 |
|
|
|
商誉 |
|
|
|
合計する |
$ |
|
|
CSI買収は、買収合意に記載されているように、CSIに基づいて2021年12月31日までの年度の最低利益水準に基づいて追加の対価格を支払うことを当社に要求する1つまたは2つの対価格設定を含む。または対価契約によると、当社が支払う可能性のある未割引金額の範囲は
ドルの営業権
CSI買収で買収された識別可能な無形資産は#ドルを含む
買収前に、形式的な財務情報については、FF gene BiotechとCSIの財務結果は重要ではない。買収完了後、FF gene BiotechとCSIの財務結果は会社の総合財務諸表に含まれる。収入和2021年の買収日以来2回買収された営業収入または損失は、添付された2021年12月31日までの年度総合経営報告書に含まれ、単位は以下のとおりである
|
純売上高 |
|
|
営業収入(赤字) |
|
||
FF遺伝子バイオテクノロジー |
$ |
|
|
$ |
( |
) |
|
CSI |
|
|
|
|
|
||
合計する |
$ |
|
|
$ |
( |
) |
|
注16.株式買い戻し計画
2022年3月会社のS取締役会は$を承認した
F-39
買い戻し計画は許可された日から期限が切れません。当社は2023年12月31日までの年間で買い戻します
付記17.営業権と無形資産
2023年12月31日と2022年12月31日まで、報告単位に記載されている減値を差し引いた営業権帳の額面変動は以下の通り
|
実験室サービス |
|
|
治療が進む |
|
||||||||||
|
2023年12月31日 |
|
|
2022年12月31日 |
|
|
2023年12月31日 |
|
|
2022年12月31日 |
|
||||
|
(単位:千) |
|
|||||||||||||
1月1日現在の残高 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|||
年内に取得した営業権 |
|
|
|
|
|
|
|
— |
|
|
|
|
|||
減損する |
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
外貨影響 |
|
( |
) |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
年末残高 |
$ |
— |
|
|
$ |
|
|
$ |
|
|
$ |
|
|||
2023年9月30日までに会社は報告単位です同社は変化する業務状況や業界や経済要因などをモニタリングし、中期減値分析需要を引き起こす可能性のある事件を確定した。同社は第3四半期に、その株価の約3カ月間の大幅な下落を評価し、市場方法の補完的な定性分析を行った。株価下落の短い持続時間と分析によると、同社は確かに
同社は2023年12月1日現在、その実験室サービス業務と治療開発業務を決定した
会社は毎年12月31日に報告単位レベルで営業権減値をテストし、もしイベント或いは状況が減値が出現する可能性があることを表明すれば、商誉減値をより頻繁にテストする。2023年第4四半期には、会社の株価と時価が下落し続け、2023年12月31日までの量的減値分析を促した。
実験室サービス
AS2023年12月31日現在,実験室サービス報告単位の公正価値は(I)収益法(割引キャッシュフロー)を用いて重み付け計算されている
治療が進む
2023年12月31日現在,治療発展報告単位の公正価値は,以下の割合で重み付けされた収益法を用いて計算される
数量化評価の結果によると、当社は2023年12月31日まで、治療発展報告単位と知的財産権研究開発資産の公正価値が帳簿価値よりも大きく、減値は存在しないと結論した。その報告書単位の公正価値は#ドルだ
商業権或いは知的財産権の研究開発減価分析の目的のための推定と仮説管理は未来の業績に対する正確な予測であることが証明されることは保証されない。営業権または無形資産の減価または回収可能性に関する結論は今後の間に変化する可能性がある。経営陣は引き続き監督する
F-40
治療進展報告株。すべての知的財産権研究開発プロジェクトに対して、これらの候補製品の開発と商業化の適時かつ成功に関連する重大なリスクと不確定性は、臨床試験データに基づいてその治療効果を確認する能力、必要な監督管理許可を得る能力、及び予算コスト内でこれらの任務を成功させる能力を含む。規制部門の承認を得ずに,同社はヒト治療薬を市場に出すことはできないが,この承認は臨床試験を完了し,候補製品が安全かつ有効であることを証明する必要がある。また、第三者支払者(政府医療計画および個人保険計画を含む)のカバーおよび精算の利用可能性および範囲は、製品が発生することができる収入に影響を与える。したがって、これらの買収された知的財産権研究開発プロジェクトの最終実現価値(あれば)は、その推定の公正価値とは異なる可能性がある。
2023年12月31日、2023年、2022年までの無形資産残高の概要は以下の通り
|
|
十二月三十一日 |
|
|||||
|
|
|
|
|
|
|
||
|
加重平均販売期間 |
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
ラボサービス: |
|
|
|
|
|
|
||
印税免除技術 |
$ |
|
|
$ |
|
|||
差し引く:累計償却 |
|
|
( |
) |
|
|
( |
) |
印税免除技術、インターネット |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
取引先関係 |
|
|
|
|
|
|||
差し引く:累計償却 |
|
|
( |
) |
|
|
( |
) |
顧客関係、ネットワーク |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
商号 |
|
|
|
|
|
|||
差し引く:累計償却 |
|
|
( |
) |
|
|
( |
) |
商品名、純額 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
無形資産をその場でリースする |
|
|
|
|
|
|||
差し引く:累計償却 |
|
|
( |
) |
|
|
( |
) |
無形資産をその場で賃貸し,純額 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
実験室情報システムプラットフォーム |
|
|
|
|
|
|||
差し引く:累計償却 |
|
|
( |
) |
|
|
( |
) |
実験室情報システムプラットフォーム |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
購入した特許 |
|
|
|
|
|
|||
差し引く:累計償却 |
|
|
( |
) |
|
|
( |
) |
購入した特許、純額 |
|
|
|
|
|
|
||
合計する |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
治療の進展: |
|
|
|
|
|
|
||
現在行われている研究と開発 |
適用されない |
|
|
|
|
|
||
合計する |
|
|
|
|
|
|
||
無形資産総額,純額 |
|
$ |
|
|
$ |
|
||
以上の表に記載されている買収に関連する無形資産は一般に有限年であり、コストから累積償却を差し引いて帳簿に記載されているが、2022年のFulgent Pharma買収に関するIPR&Dは除外し、研究開発作業が完了または放棄されるまで、この無形資産の寿命は無限である。業務に関連する他のすべての有限寿命買収関連無形資産
F-41
2022年と2021年の組み合わせは、その推定寿命内に直線的に償却され、これは無形資産の経済効果が期待されるモデルに近い。
無形資産の償却は#ドルです
2023年12月31日までに記録された無形資産の帳簿価値に基づいて、対象資産に後続の減価がないと仮定すると、無形資産の年間償却費用は以下のように予想される
|
金額 |
|
|
|
(単位:千) |
|
|
2024 |
$ |
|
|
2025 |
|
|
|
2026 |
|
|
|
2027 |
|
|
|
2028 |
|
|
|
その後… |
|
|
|
合計する |
$ |
|
|
注18.後続事件
2024年2月28日現在、後続事件の報告はない。
F-42