カタログ表
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(Mark One)
| | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
| | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
移行期になります_____至れり尽くせり_____
依頼書類番号:
タピオカ科学会社
(登録者の正確な氏名はその定款に記載)
| | |
| (明またはその他の司法管轄権 | (税務署の雇用主 |
| 会社や組織) | 識別コード) |
(
(登録者は主に事務室の住所、郵便番号を含む)と
電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| クラスごとのタイトル | 取引 記号 | 登録された各取引所の名称 | ||
| | | | ||
|
|
|
|
|
|
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、そうです☐
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。(1つを選択):
| | 加速ファイルサーバ☐ |
| 非加速ファイルサーバ☐ | 規模の小さい報告会社 |
| 新興成長型会社 |
新興成長型企業であれば、登録者が取引法第13(A)節に従って提供された任意の新しいまたは改正された財務会計基準を遵守するために、延長された移行期間を使用しないことを選択するかどうかを再選択マークで示す。☐
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オキシリー法案”(15 USC.)第404(B)条に基づいてその財務報告の内部統制の有効性評価を行うことを証明する。7262(B))は、監査報告書を作成又は発行する公認会計士事務所により提供される
証券が同法第12条(B)に基づいて登録されている場合は,登録者が届出中の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示す
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、そうです
非関連会社が保有する投票権と無投票権のある普通株の総時価は約#ドルである
引用で編入された書類
登録者は,2023年12月31日までの財政年度後120日以内に,2024年株主総会の委託書(以下,“依頼書”と略す)の一部を米国証券取引委員会に提出し,本年度報告を引用したForm 10−Kの第3部を編入する
タピオカ科学会社
表格10-K
索引.索引
| ページ |
||
| 第1部 |
||
| 第1項。 |
業務.業務 |
6 |
| 第1 A項。 |
リスク要因 |
33 |
| 項目1 B。 |
未解決従業員意見 |
77 |
| プロジェクト1 C。 | ネットワーク·セキュリティ | 77 |
| 第二項です。 |
属性 |
77 |
| 第三項です。 |
法律訴訟 |
77 |
| 第四項です。 |
炭鉱安全情報開示 |
79 |
| 第II部 |
||
| 五番目です。 |
登録業者の市場’普通株·関連株主事項と発行者による株式証券の購入 |
79 |
| 第六項です。 |
[保留されている] |
80 |
| 第七項。 |
管理する’財務状況と経営成果に関する検討と分析 |
81 |
| 第七A項。 |
市場リスクの定量的·定性的開示について |
89 |
| 第八項です。 |
連結財務諸表と補足データ |
89 |
| 第九項です。 |
会計と財務情報開示の変更と相違 |
110 |
| 第9条。 |
制御とプログラム: |
111 |
| プロジェクト9 B。 |
その他の情報: |
113 |
| プロジェクト9 Cです。 |
検査妨害の外国司法管轄権を開示する |
113 |
| 第三部 |
||
| 第10項。 |
役員と役員と会社の管理 |
113 |
| 第十一項。 |
役員報酬 |
115 |
| 第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
115 |
| 十三項。 |
特定の関係や関連取引、取締役の独立性 |
116 |
| 14項です。 |
チーフ会計士費用とサービス |
116 |
| 第4部 |
||
| 第十五項。 |
展示品と連結財務諸表明細書 |
116 |
| 第十六項。 |
表格10-Kの概要 |
118 |
| サイン | 119 | |
第1部
前向きな陳述と通知
このForm 10−K年次報告書には,我々がここで引用した最終依頼書の部分が含まれており,1995年の民間証券改革法で指摘された“前向き陳述”が含まれている。私たちは、これらの展望的陳述が、それによって生成された安全港によって保護されることを望む。本年度報告に含まれる現在または歴史的事実に関する陳述に加えて、本年度報告に含まれるすべての陳述は、予想または他の方法で、私たちの将来の運営結果および財務状況、行われている臨床試験の将来の結果、業務戦略、将来の運営の計画および目標、ならびに予想されるイベントまたは傾向に関する声明を含み、前向き声明である。場合によっては、前向き記述は、“目標”、“予想”、“信じ”、“可能”、“駆動”、“推定”、“予想”、“予測”、“未来”、“目標”、“意図”、“可能”、“目標”、“計画”、“潜在”、“プロジェクト”、“求める”、“すべき”、“戦略のようなものである。Will“および”Will“またはこれらの用語または他の同様の用語の否定。
前向きな陳述の例は、以下の態様に関する陳述を含むが、これらに限定されない
| ● |
私たちが行っている第3段階の研究では、シモフェランはアルツハイマー病患者に対する期待される安全性または治療的利益(もしあれば); |
| ● |
私たちは第三者請負業者に依存して私たちのすべての臨床試験と非臨床試験を行い、私たちの第三段階の臨床計画のために薬を大規模に供給したり、時間通りにあるいは予算通りにそうする能力を持っています |
| ● |
無作為対照試験の臨床研究結果と比較して、著者らはアルツハイマー病患者で行われた2年間のシトロラン安全性研究の3つの臨床段階のいずれかの段階の結果のデータ解釈における限界である |
| ● |
私たちのアルツハイマー病試験では、臨床尺度は認知または健康の能力を評価する |
| ● |
アルツハイマー病患者Simufilamの第3段階研究の設計に行われている任意の重大な変化を予測しているかもしれません |
| ● |
アルツハイマー病および他の神経変性疾患の候補製品に対する追加の臨床および非臨床研究を開始、実施、または分析することができる |
| ● |
臨床前研究結果が候補製品を開発する能力に及ぼす影響 |
| ● |
第1段階および第2段階の研究のような、我々の臨床前または早期臨床研究の結果を説明する |
| ● |
私たちはSavaDxをさらに開発する予定ですこれは私たちの研究血液診断候補品です |
| ● |
私たちはシモフェランの治療適応をアルツハイマー病の外に拡張することができます |
| ● |
私たちの候補製品の安全性、有効性、または潜在的な治療利益 |
|
| ● | 我々が臨床研究で用いている探索的“研究”は安全とは無関係なバイオマーカーのみを使用している |
| ● |
私たちは私たちの候補製品のために申請して規制部門の承認を得ることができる |
| ● |
私たちの戦略と能力は、承認されれば、任意の候補製品を商業化するためのインフラを構築する |
| ● |
もし私たちの製品が承認されて商業化されれば、私たちの候補製品の潜在的な未来の収入 |
| ● |
もし私たちの製品が承認されて商業化されれば、私たちの候補製品に対する市場の受容度は |
| ● |
もし私たちの候補製品が承認されて商業化されれば、その価格と精算 |
| ● |
保護の効果や私たちの知的財産権の十分性 |
| ● |
アルツハイマー病の潜在的競争相手や競合製品を治療しています |
| ● |
私たちは時々私たちの業務を継続したり、私たちの業務を拡大するために新しい資本を調達する必要がある |
| ● |
著者らは複数の第三者サプライヤーとパートナーを用いて、臨床研究組織(CRO)を含み、著者らの主要な候補製品に対して臨床と非臨床研究を行った |
| ● |
ビジネス秘密、技術革新、ライセンス契約、およびいくつかの業務機能アウトソーシングへの期待 |
| ● |
予期せぬコスト超過、インフレ、予測不正確、活動範囲の拡大、またはその他の理由により、私たちの費用または発生コストは予算金額の実質的な増加を超えている |
| ● |
財務や経営業績の変動 |
| ● |
私たちの経営損失、予想される経営と資本支出、そして法的費用 |
| ● |
株式報酬奨励に基づいて従業員または取締役に普通株式、オプションまたは他の持分を発行する予想に基づいて、雇用税後の純額を差し引く |
|
| ● | 現金を行使した発行済株式証所持者に普通株を発行する期待 |
| ● |
私たちの内部情報システムとインフラを開発し維持します |
|
| ● | 情報システムやインフラで不利なネットワークセキュリティイベントが発生する可能性と影響を最小限にする能力 |
| ● |
私たちはより多くの人員を雇用し、私たちがこのような人々を引き付けて維持する能力が必要だ |
| ● |
アメリカと私たちが事業を展開している他の管轄区域の既存または新たに出現した法規と法規の発展 |
| ● |
私たちは事業の規模と範囲を拡大する予定です |
| ● |
私たちは私たちの業務に資金を提供するのに十分な現金と資源を持っている |
| ● |
将来的には第三者と私たちの候補製品の商業化について合意するかもしれません |
| ● |
費用、資本需要、および追加融資需要の推定の正確さ |
| ● |
私たちは株式報酬のために使用される仮説と推定を開示します |
| ● |
係属中または将来の訴訟または他の法的手続きおよび請求の費用、時間および結果は、米国政府の調査を含む |
| ● |
私たちまたは私たちの協力者に対する告発は訴訟、クレーム、または他の不確実性を引き起こす可能性がある。 |
本年度報告書の展望的な陳述は、現在利用可能な情報と計画に基づいて、私たちの未来の業績、事件、発展に対する信念、仮説、予想に基づいている。前向き陳述はリスクと不確実性に関連しており、私たちの実際の結果と事件の時間は展望性陳述で議論されているのとは大きく異なるかもしれない。このような前向きな陳述は、“項目1 A”に記載された陳述を含むが、これらに限定されない。リスク要因“投資家は、資本会社の前にこのようなリスクを考慮すべきです”したがって、あなたはいかなる前向きな陳述にも過度に依存してはいけません。
私たちは私たちが期待していた結果や発展を達成するか、または実質的な結果や発展を達成しても、それらが私たちの予想された方法で私たちの運営に影響を与えることを保証することはできません。
本年度報告におけるForm 10−Kに含まれる前向きな陳述は,本報告の発表日にのみ行われた。法律の要求がない限り、私たちは新しい情報、未来の事件、または他の理由でいかなる前向きな陳述を公開更新または修正する義務を負いません。
また、“私たちが信じる”という声明や、関連テーマに対する私たちの信念、観点、意見を反映した類似声明は、今年度の報告日までに私たちが把握した情報に基づいています。このような情報は、このような声明の合理的な基礎を構成していると考えられていますが、このような情報は限られているか不完全である可能性があり、私たちの声明は、入手可能なすべての関連情報を詳細に調査または検討していることを示すものと解釈されてはいけません。これらの陳述は本質的に不確実であり、多くの仮定と制限を関連しており、これらの陳述に過度に依存しないことを想起させる。
我々の神経変性研究プロジェクトは従来,米国国立衛生研究院(NIH)の科学と財政支援から利益を得てきた。本年度報告の内容は、NIH、衛生公衆サービス部、または米国政府の任意の他の機関、または私たちの任意のサプライヤー、協力者、または関係のない第三者のいかなる観点も代表しない完全に私たちの責任を負う.
私たちが開発しているすべての製薬資産は研究製品候補だ。これらの薬物はいかなる司法管轄区域の任意の監督機関によって任意の医学適応のために許可されておらず、その安全性、有効性または他の理想的な属性(あれば)はいかなる患者集団においても確立されていない。したがって、私たちの候補製品は承認されず、世界どこでも販売されていない。
著者らの早期臨床試験の臨床結果は後期或いは更に大規模な臨床試験の未来の結果を予測できないかもしれないし、監督部門の承認を確保できないかもしれない。あなたはこのような声明や私たちが提供したり発表したりするどんな科学的データに過度に依存してはいけない。
われわれのすべての早期臨床試験,すなわち開発段階3段階にないすべての研究は,関連する患者数が相対的に少なく,データも比較的限られている。我々の早期研究で生じた情報や結果は構成されておらず,Simufilamによるアルツハイマー病治療の安全性や有効性の証拠とも解釈されるべきではない。薬物の安全性と有効性の厳格な証拠は監督管理部門の許可を得る必要があり、これらの証拠は1つ或いは複数の大型、ランダム、プラセボ対照の3期研究から来ている。我々の早期研究の設計と限られた規模は臨床あるいは統計偏差を導入する可能性があり、あるいは薬物効果(あれば)、プラセボ効果とランダム変異を完全に区別できない結果が生じる可能性がある。同一研究の臨床データに対して異なる統計分析を行うことは客観的に異なる数値結果を招く可能性がある。これら及び著者らの早期臨床研究の他の統計と臨床特徴はデータ解釈の複雑性或いは局限性を増加させた。また、“頂線結果”は臨床データベースの全面と最終審査或いは品質管理を完成する前に臨床データをまとめたものである。我々は通常,我々の利害関係者が最終データセットを受け取る前に研究結果の要約をタイムリーに得るために最も重要な結果を伝達する.最終データは最初の収益データと変化する可能性がある.
別の説明がない限り,本年度報告におけるすべての臨床データはp の標準確率レベルで統計的に有意ではない
国家臨床試験(NCT)は8桁の識別コードであり、臨床研究がアメリカ政府が運営する国家医学図書館に登録する時、http://www.Clinicaltrials.govはそれに識別番号を割り当てる。
プロジェクト1.パートナーシップ業務.業務
概要
カサブワ科学会社は臨床段階のバイオテクノロジー会社で、本部はテキサス州オースティンに設置されている。私たちの使命はアルツハイマー病のような神経変性疾患を検出して治療することだ。私たちの新しい科学は安定に基づいていますがアルツハイマー病の脳の重要なタンパク質を除去するのではありませんわれわれの主要な候補治療薬Simufilamは臨床評価を行っており,第三段階臨床研究でアルツハイマー病認知症の治療を提案している。
12年間、私たちは最先端の技術と神経生物学の新しい知見を結合し、アルツハイマー症と他の神経変性疾患のための新しい解決策を開発した。私たちの戦略は、私たちの独特な科学/臨床プラットフォームを利用して、アルツハイマー症のような神経変性疾患を治療するための一流の計画を開発し、患者の認知と健康機能は疾病の進展に従って低下し、患者は軽度から中度まで、最終的に深刻なアルツハイマー症に発展することである。
現在2つのバイオ製薬資産が開発されています
| ● |
私たちの主要な候補治療製品はSimufilamと呼ばれ、アルツハイマー病認知症を治療する新しい経口療法である |
| ● |
著者らの先行研究による製品候補製品SavaDxの診断は小サンプルの血液中にアルツハイマー病の存在を測定する新しい方法である。 |
アルツハイマー病を治療する科学的な方法は同時に抑制を求めていますどちらもある神経変性と神経炎症です私たちは脳の多くの重要な機能を潜在的に改善することができると信じていますこれはアルツハイマー病を解決する新しい異なる重要な方法です
私たちの主な候補製品Simufilamは特許小分子薬だ。Simufilamは我々の内部で発見され設計されたものであり,我々の学術協力者は約2008年までの研究活動で特徴づけられている.
Simufilamはアルツハイマー病患者の脳におけるフィラメントA(Flna)と呼ばれるタンパク質の改変形態を対象としている。すでに発表された研究により、形式を変えたFLNAはニューロン機能障害、ニューロン変性と神経炎症を引き起こすことが示唆されている。具体的には,Simufilamはアミロイドとα7ニコチン型アセチルコリン受容体(α7 nAChR)との結合を破壊していると考えられ,アルツハイマー病治療の主な作用機序である。最近のデータでも,SimufilamがmTORシグナル伝達に有意な影響を与えていることが示唆されている。MTORは年齢に関連する細胞変化に役立つため、SimufiamはmTORの過剰活性化を抑制し、同時にインシュリン感受性を改善し、ある老化過程を緩和し、この病理特徴を弱める可能性があり、潜在的にアルツハイマー病と老化の脳機能と記憶に有利である。
私たちは私たちの薬物と診断資産および関連技術に対する世界的な独占権利を持っており、いかなる第三者にも印税義務はない。アルツハイマー病および他の神経変性疾患に対するSimufilamおよびSimufilamの他の神経変性疾患に対する特許保護は、9つの発行された米国特許を含む2039年まで継続されている。すべてのアメリカ申請は相応の外国申請を持っている。
著者らは現在、2つの無作為プラセボ対照のシモフィラン内服によるアルツハイマー病痴呆患者の3期臨床試験を行っている。この2つの試験はすべて完全に組み込まれている。これらの実験は合計約1900名の軽中度アルツハイマー病患者をベースラインとしてランダムに選択した。私たちの第三段階計画のすべての治療効果データは依然として盲目だ。現在のところ治療効果結果に関する中期的な分析はない。
著者らの第一段階研究はREThink-ALZと呼ばれ、52週間以内のSimufilam 100 mg錠剤とプラセボの安全性と有効性を評価することを目的とした(NCT 04994483)。私たちの52週間の第3段階研究の主な結果は2024年末ごろに予定されている。
著者らの第二段階3研究名はREFOCUS-ALZであり、シモフェラン100 mgと50 mg錠剤とプラセボの76週間以内の安全性と有効性を評価することを目的とした(NCT 05026177)。我々の76週間の第3段階研究の主な結果は2025年頃に予定されている。
リスクは薬物開発過程の基礎である
私たちは新薬発見と薬物開発の業務に従事しています。私たちの研究開発活動は長く、複雑で、コストが高く、危険が高い。当社の普通株式保有者は、“第1 A条”を含む今年度の報告書全文をよく読まなければならない。リスク要因です“リスクは薬物発見と開発過程の基礎ですので、投資した資金のすべての損失を受ける準備ができていない限り、私たちの公開取引証券に投資しないように注意します。
アルツハイマー病について
アルツハイマーは認知、機能、行動に影響を与える脳変性疾患である。時間の経過とともに,患者の認知や健康機能は疾患の影響とともに低下する。疾患の進行に伴い,患者は軽度から中等度まで,最終的に重篤なアルツハイマー病に進展する。疾患の末期には認知能力の低下がより顕著になり,治療も困難であろう。
アルツハイマー協会のデータによると、2023年には670万65歳以上のアメリカ人がアルツハイマー病と推定されています。同じ情報源によると、2011年、米国の人口の中で過去最大の世代であるベビーブーム世代は65歳になり始めた。2030年には米国の65歳以上の人口の割合が大幅に増加し、7400万人の高齢者米国人が総人口の20%以上を占めることが予想される。年齢はアルツハイマー病のよく知られている危険因子であるため,米国の高齢者人口の増加に伴い,アルツハイマーの新症例が上昇することが予想される。
私たちの科学的方法は違います
バイオ製薬業界はアルツハイマー病研究と薬物開発において挑戦的な記録があることから、この疾患に対抗するために革新的な方法を考慮する必要があると考えられている。
12年以上の間に、私たちはアルツハイマー病のような神経変性疾患を治療し、診断するための新しい有望な科学的方法を開発した。重要なのは脳のアミロイド除去は求めていません代わりに私たちの新しい科学は安定に基づいていますが脳の重要なタンパク質を除去するのではありません
著者らの科学的方法はFlnaと呼ばれる改変形態のステント蛋白を標的とすることによって神経変性変化を治療する。長年の基礎研究を通じて、著者らと著者らの学術協力者はFLNAは1種の構造変化の蛋白質であり、アルツハイマー病の脳において神経退化と神経炎症経路を通過できることを確定した。形質転換FLNAはアルツハイマー病患者の脳に普遍的に存在し,健常対照群の脳ではほとんど検出されないことが証明されている。
科学的洞察力と実験室技術を利用して,このタンパク質機能障害を明らかにしたと信じている。この仕事を通じて、著者らは実験証拠を産生し、変化したFLNAがアルツハイマー病において重要な役割を果たしていることを表明した。著者らは一連の高親和性の小分子を設計し、この構造が変化した蛋白質を標的とし、その正常な形状と機能を回復した。この小分子ファミリーは、私たちの主要な候補治療製品Simufilamを含めて、私たちの内部設計であり、私たちの学術協力者によって特徴付けられている。
我々の主要な候補薬Simufilamは新しい作用機序を有する小分子(経口)薬である。Simufilamの標的は変化したFlnaで、これは脳の構造が変化したタンパク質で、私たちはそれを安定させようとしています。重要なことは,Simufilamが独自の作用機序を有していることから,その潜在的な治療効果は既存のアルツハイマー病痴呆薬物治療と相乗的あるいは相乗的に作用する可能性が考えられる。
私たちの科学は脳を安定させる重要なタンパク質に基づいています
タンパク質はすべての生物学的過程にほぼ関与しているので、細胞の機能に重要である。もしタンパク質の機能が損なわれたら、その健康的な結果は破壊的かもしれない。医学的技術の進歩と生活様式の改善は私たちの寿命を延長している。しかし、年齢の増加に伴い、遺伝子突然変異とその他の要素は共に健康細胞に不利であり、蛋白質の変化を招く。時々,細胞は改変されたタンパク質を除去することができる。しかし,疾患が重要なタンパク質の形状や機能を変化させると,複数の下流過程が損なわれる。多くの臨床情況下で、蛋白質構造は変化し、細胞、組織と器官の正常な機能を損害し、それによって疾病を招く。逆に,変化したタンパク質を健康状態に戻す−タンパク質バランスと呼ばれる−臨床医学で広く受け入れられている治療戦略である。
100年以上の間、科学者たちは様々な神経変性疾患をタンパク質の誤った折り畳みに起因し、病理性に帰着させた。アルツハイマー病では、あるタンパク質、例えばアミロイドとtau蛋白は、正常な形状と機能を失う。この誤って折り畳まれたタンパク質は塊に分解または凝集し,脳内にプラークや交絡を形成することができる。ニューロンシナプスの破壊,ニューロンの加速死,および脳支持細胞の機能障害は,タンパク質の誤フォールディングの直接的な結果と広く考えられている。
Flnaは骨格タンパク質であり、脳内の含有量が高い。健康な足場タンパク質は複数のタンパク質を集め、それらの間の相互作用を調整する。しかし、アルツハイマー病患者の脳には、形態を変えたFlnaタンパク質が発見された。著者らの実験証拠は、変化したFLNA蛋白は神経細胞の正常な機能を乱すことによって、神経退化と脳炎症を招き、それによってアルツハイマー病を招くことを表明した。私たちの候補製品Simufilamは、このような重要なタンパク質の正常な機能を回復するために、脳の変化と有毒なFlna形態に対抗することを目的としています。
1薬が多効果である
Simufilamは変更後のFLNAと非常に高い親和性で結合している。Simufilamは,改変したFLNAをその天然,健康なコンホメーションに回復することで脳健康を改善し,改変したFLNAの下流毒性効果に対抗できると考えられる。この薬物効果は、α-7ニコチン型アセチルコリン受容体、N-メチル-D-アスパラギン酸(NMDA)受容体、およびインスリン受容体を含む脳の重要な受容体の正常な機能を回復する。これらの受容体は脳細胞の生存、認知、記憶に重要な役割を果たしている。また,最近のデータでは,SimufilamがmTORシグナル伝達に有益な影響を与えることが示唆されている。
Simufilamを用いて変化したFLNAを回復することにより脳の健康を改善する実験的証拠が生成され発表された。動物モデルにおいて、シトロラン治療は脳の健康を著しく改善し、例えばアミロイドとtau沈着を減少させ、受容体シグナル伝達を改善し、学習と記憶を改善する。また,シモフェロンには,脳中の炎症性サイトカインを有意に減少させるもう1つの有益な治療効果がある。疾患の動物モデルでは,シトロラン治療はIL−6レベルを有意に低下させ,腫瘍壊死因子−αとIL−1βのレベルをそれぞれ86%と80%抑制し,強い抗神経炎作用を示した。
複数の受容体の機能を回復し、強力な抗炎症作用を発揮することによって、著者らの方法は患者のアルツハイマー病の進展を遅らせる可能性があると信じている。我々の科学的方法は,このような複雑な疾患の可能な治療法の範囲を広げる可能性があると信じている。
私たちの科学は複数の同業者が評議した定期刊行物に発表された。また,我々の研究は米国国立衛生研究院の多くの研究支出の支持を得た。各贈与金はこの分野の外部専門家グループが私たちの科学と技術の利点方法に対して深い同業者審査評価を行って付与したものである。
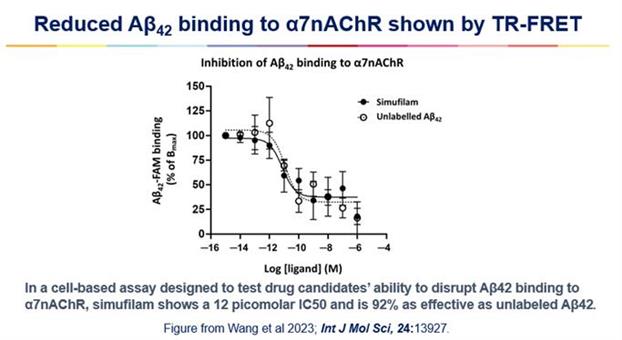
“シミュレーション映画”の出版確認作用メカニズム
2023年9月,Simufilamの生物活性を確認する新たな研究が発表された。コチン研究所(フランスパリ)の研究者はtr−fretに基づく高精度な細胞分析法を用いて,Simufilamがアミロイドとα7ニコチン型アセチルコリン受容体(α7 nAChR)との結合を遮断していることを示している。アミロイドとα7 nAChRの結合を破壊することがSimufilamによるアルツハイマー病治療の主な作用機序であると考えられる。この研究論文はニューヨークシティ大学の王浩言とペ哲,コーチン研究所のエリカ·セケン,ジュリー·ダムとラルフ·ジョックス,タピオカ科学のリンゼイ·バーンズが共同で執筆し,特集記事に発表された 質問:“国際分子科学誌”は同業者評議の定期刊行物。図1を参照。
図1.パリ都市大学コーチン研究所のErika Ceconが開発した分析で行った実験:Ceconら,2019年BrJ Pharmacol;176:3475-3488。示したデータは,4つの単独の実験±走査電子顕微鏡からまとめたデータの平均値である。

Simufilamの過剰な活躍を抑えるmTORを発表
2023年6月、私たちはまた、シムフェランがラパマイシンの機械標的(MTOR)に与える影響を示す新しい研究を発表した。科学文献により、過度に活発なmTORは老化、アルツハイマー病とその他の疾病において重要な役割を果たしている。機能が正常な時、mTORは細胞需要をモニタリングし、インシュリンによって活性化される。この新たに発表された研究は,アルツハイマー病患者の血液から分離されたリンパ球では健常対照群と比較してmTORが過剰に活性化していることを示している。アルツハイマー病患者は毎日2回シモフェロン100 mgを内服し、28日間持続した後、リンパ細胞はmTOR活性の正常化を示し、そしてインシュリンに対する敏感性を回復した。
これらのデータは,SimufilamがmTORシグナル伝達に有意な影響を与えていることを示している。過剰に活性化されたmTORシグナルを抑制し、インスリンに対する反応性を改善することは、可溶性アミロイドの病原性シグナル経路を妨害するだけではなく、シモフェランの機械的利点を表す。MTORシグナルのこれらの改善もFLNAの変化コンホメーションを逆転させ,インスリンが結合しシグナル伝達を開始するとFLNAとインスリン受容体の解離を許すためである可能性がある。MTORは年齢に関連する細胞変化に役立つため、SimufiamはmTORの過剰活性化を抑制し、同時にインシュリン感受性を改善し、ある老化過程を緩和し、アルツハイマー病のこの病理特徴を弱める可能性があり、潜在的にアルツハイマー病と老年患者の脳機能と記憶に有利である。このmTOR研究論文は,ニューヨークシティ大学のHoau−yan Wang,Zhe PeiとKuo−Chieh Lee,臨床試験プログラムの研究者Boris Nikolov,Tamara DoehnerとJohn Puente,Cassava SciencesのLindsay Burnsが共著し,発表された高齢化の最前線同業者評議の定期刊行物です
シモフィラム薬開発
FDAへのIND提出,早期臨床研究における薬物安全性
十数年来、著者らは基礎研究、体外研究と臨床前研究を行い、安全薬理学、毒理学、遺伝毒性と生物分析方法をめぐる必要な研究を含むSimufilamの新薬研究(IND)のFDAへの提出に成功した。2017年、私たちはSimufilamのIND申請をFDAに提出した。
FDAが2017年に我々のINDを受けた後、健康な人体ボランティアにおけるシモフェランの安全性、用量と薬物動態を研究した。著者らの最初の人類第一段階研究の設計は監督フィードバック、臨床と科学基礎及び以前に行われた臨床前と体外研究の観察に基づいている。第1段階の研究では、米国の単一地点で24人の健康なヒトボランティア(18名のシモフェラン、6名のプラセボ)に対して、シモフェランの安全性、耐性、および薬物動態評価を行った。対象は、シモフェランまたはプラセボの単回経口投与50、100または200 mgを投与された。薬は安全で耐性が良いように見える。重要なことは,シモフェランは治療に関する副作用を示さず,用量制限の安全発現もないことである。薬物動態学測定により、シモフェロンのような小分子薬物の吸収は迅速であることが分かった。50~200 mgの全用量範囲で用量比が観察された。
第二段階臨床研究
2019年,NIHに属する国家老齢研究所(NIA)の強力な支援のもと,米国で初の入院,臨床概念検証,オープンタグのSIMUFILAM 2 a段階研究を完了した。軽~中度アルツハイマー病患者13名に対するこの小型研究では,シモフェラン投与28日間でアルツハイマー病病理,神経変性,神経炎症の何らかの探索的バイオマーカー(p が有意に改善した
2020年9月,Simufilamを用いたアルツハイマー病治療の2 b期研究の最終結果を報告した。このアメリカ国立衛生研究院が援助した臨床研究では,アルツハイマー病患者は毎日50 mgまたは100 mgのシモフェロンを28日間服用し,統計学的有意差を示した(p )
私たちの第1段階または第2段階研究で観察されなかった用量制限効果、および強力な科学的基礎および複数の同業者評議の出版物および研究援助賞を考慮して、私たちはSimufilamがアルツハイマー病を治療する研究薬のさらなる評価として有利な原則的証拠を証明したことを決定した。
24ヶ月間の臨床安全性研究
われわれの24カ月間の臨床安全性研究プロジェクトの大部分の戦略的価値は,Simufilamの患者における長期安全性を支持することである。私たちは慎重に設計された長期安全研究が慎重なリスク管理の仕事だと信じている。臨床結果は薬物開発の内在リスクと不確定性を告知と管理することに役立つ可能性があり、同時に著者らは大規模、高価な第三段階臨床テスト計画を行う。
2020年3月、著者らはアルツハイマー病患者に対する臨床安全性研究(NCT 04388254)をスタートし、研究対象は著者らの主要な候補薬物アシムフェラン(NCT 04388254)である。この研究はアスピリンによるアルツハイマー病患者の24ケ月以上の長期臨床安全性と耐性を評価することを目的としている。この研究にはADAS-Cog 11得点の平均変化のあらかじめ指定された探索的治療効果の終点も含まれており、アルツハイマー病の臨床研究に広く用いられている認知尺度である。この研究は、米国の16の臨床場所から来た200人以上の軽~中度アルツハイマー病((MMSE)16-26)の患者を募集した。アルツハイマーは進行性疾患であり、疾患の重症度は通常MMSEスコアによって評価される。本研究では,軽度患者はMMSE 21−26,中等度患者はMMSE 16−20であった。
私たちは3つの連続段階に分けて24ヶ月の安全研究を行いました
| ● |
12ヶ月間のオープンタグ治療段階で |
| ● |
6ヶ月間の無作為プラセボ対照の禁断段階(以前は“認知維持研究”またはCMSと呼ばれていた)、その後 |
| ● |
追加6ヶ月のオープンラベル治療。 |
研究参加者は開放ラベル治療段階でシモフェロン経口錠100 mgを1日2回服用し、無作為投与段階でシモフェランまたは一致したプラセボを服用した。オープンラベル研究設計では,衛生保健提供者も患者も進行中の薬物治療を知っている。
12ケ月の開放ラベルシトロラン治療を完成したすべての研究参加者は6ケ月の無作為、プラセボ対照中止段階に参加する資格がある。同様に、無作為、プラセボ対照中止段階を完成したすべての研究参加者は、さらに6ケ月の開放ラベル治療を受ける資格がある。
12ヶ月間のオープンラベル治療段階の研究結果
2023年1月、我々は12ヶ月間の安全性研究開放ラベル治療段階の積極的な結果を発表した。あらかじめ指定した探索的治療効果の終点はADAS-Cog 11ベースラインの変化であり、ADAS-Cog 11はアルツハイマー病の臨床研究に広く応用されている認知尺度である。他の探索的終点には,認知障害による疾患段階を評価するミニ精神状態検査(MMSE),認知症関連行動を評価する神経精神医学的アンケート(NPI),および老年抑うつ尺度(GDS)がある。ベースライン(研究開始時)と12カ月で終点を測定した。
トップラインの結果-平均スコアベースラインから12ヶ月目まで(低いほどいいですが、MMSEは除く):
| ● |
ADAS−Cog 11得点は19.1(±9.2)点から19.6(±13.3)点に変化した |
| ● |
MMSE得点は21.5(±3.6)点から20.2(±6.4)点に変化した |
| ● |
NPI 10得点は3.2(±4.6)点から2.9(±4.6)点に変化した |
| ● |
GDSスコアは1.8(±1.8)点から1.4(±1.9)点に変化した |
応答分析--12ヶ月目の基準
| ● |
47%の患者のADAS-Cogスコアが改善された;このグループの患者の平均変化は-4.7(±3.8)点(低いほど良い)であった。 |
| ● |
また23%の患者ではADAS−Cogは5点未満低下し,この群の平均変化は2.5(±1.4)点であった。 |
| ● |
NPI 10スコア0の患者は42%から54%に増加し,Simufilam投与1年後に痴呆に関連する神経症状が減少したことが示唆された。 |
全分析セット(FAS)全体(N=216)を使用して治療効果の終点を統計的に分析する。軽度と中等度亜群はADAS−Cog平均得点,ベースラインから12カ月までの変化に有意差を示した(低いほど良い)
| ● |
はい穏やかであるサブグループ(MMSE 21-26)は、平均ADAS-Cogスコアが15.0(±6.3)点から12.6(±7.8)点に向上した |
| ● |
はい適度であるサブグループ(MMSE 16-20)平均ADAS-Cogスコアは25.7(±9.2)点から30.1(±13.1)点に悪化した |
シモフェランを服用した軽度患者の1年余りのADAS−Cogの改善は,多くの他の研究の歴史的プラセボ低下率の予想範囲をはるかに超えていると考えられる。図2:早期疾患(MCI+軽度)と軽度疾患のADAS-Cogの歴史低下。
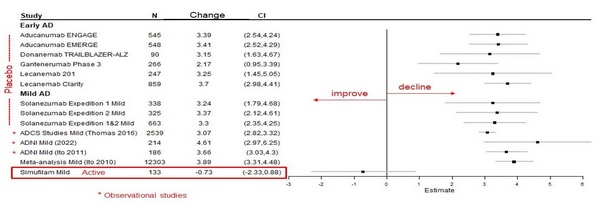
図1:早期疾患と軽度疾患患者のADAS-Cog中のシモフェロンは歴史1年のプラセボと比較した統計モデルである。独立生物統計学者ペンタラ社の林地はそれは.データは非ランダム研究(すなわちADNI)と他のスポンサーによる早期(すなわちMCI+軽度)と軽度アルツハイマー病患者における無作為対照試験に由来する’エス病です。
安全なデータ開放ラベル研究のこの治療段階では,1日2回の100 mg錠剤は安全で耐性が良好であったようである。薬物と関連した深刻な副作用は発生しなかった。7%以上の患者では、治療に関連する3つの有害事象(TEAE):新冠肺炎(12%)、尿路感染(10%)、および頭痛(9%)が発生した。報告されたTEAEは少なくとも1つの薬物を受けたすべての研究患者に基づいている。
バイオマーカーデータこの研究の開放ラベル治療段階では,ベースラインと治療6カ月後に再び腰椎穿刺術を受けることに同意した患者25名の脳脊髄液から探索性バイオマーカーを分析した。著者らはニューヨーク都市大学の学術協力者が脳脊髄液サンプルに対して時点の影響を受けない分析を行った。
以下に示すP値は,ペアt検定によるベースラインレベルと6カ月レベルである
| ● |
脳脊髄液病理バイオマーカーt-tauとp-tau 181はそれぞれ38%と18%低下した(P |
| ● |
脳脊髄液中の神経変性バイオマーカーである神経顆粒素と神経フィラメント軽鎖はそれぞれ72%と55%(P)低下した |
| ● |
脳脊髄液中の神経炎症のバイオマーカーsTREF 2とYKL−40はそれぞれ65%と44%(P)低下した |
6ヶ月間のランダム禁断研究段階第1段階(“認知維持研究”)の研究結果
2021年5月,我々は従来“認知維持研究”やCMSと呼ばれていた24カ月間の安全性研究のランダム停止段階を開始した.CMSはランダム、撤退研究設計を採用した。国際人は薬品技術要求調整理事会(ICH)を用いて、無作為投与研究では、 “テストを受けた被験者は 特定の時間内の治療は、試験治療を継続するか、またはプラセボを服用する(すなわち、能動的治療を停止する)ようにランダムに割り当てられる… 引き続き治療群とプラセボ無作為投与群の間に出現したいかなる差も積極的治療の効果を証明する.”
この研究の無作為投与段階設計は、薬物治療を継続するアルツハイマー病患者および薬物治療を中止した患者の認知および健康結果に対するシムフェランの影響を評価することを目的としている。これは軽~中度アルツハイマー病患者に対する二重盲検、無作為、プラセボ対照研究である。研究患者はランダム(1:1)にシモフェロン或いはプラセボを服用され、6ケ月間であった。CMSに参加するためには,患者はあらかじめ12カ月以上のSimufilam開放ラベル治療を完了しなければならない。最終的に157名の患者が登録された。図3を参照。
図3.ランダム脱退フェーズ(CMS)の設計案

トップラインの業績軽中度アルツハイマー病(MMSE 16−26)患者では,プラセボと比較して6カ月のSimufilam治療を受けて認知能力を低下させる速度が38%低下した。ADAS−Cogではプラセボ群で1.5点低下し,すべての測定時点でプラセボ群は低下した。6カ月でADAS−CogのSimufilam ARMは0.9点低下し,支持薬物の割合は38%(95%信頼区間,−2.1から1.0;サンプル量に有意差はなかった)であった。表1と図1を参照されたい.
表1:ランダム禁断研究の結果−認知変化,全分析集(FAS)
| 完全分析集 |
シモフェラン100 mg (N = 78) |
プラセボ (N = 77) |
数値化する 差別化する |
百分率差 |
| 6ヶ月以内の変化 Adas-Cog |
0.9ポイント 衰退する |
1.5分 衰退する |
–0.6 |
38%が薬を支持しています |
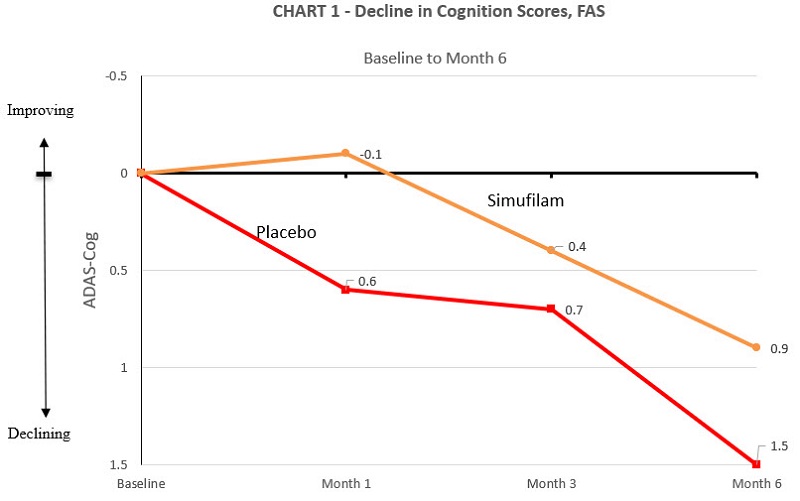
無作為無作為投与段階に入った後,セスキレン群とプラセボ群の平均ベースラインMMSE得点はそれぞれ18.6と18.1であった。シトロン群とプラセボ群の平均ベースラインADAS−Cogスコアはそれぞれ19.3と21.9であった。
Simufilamの薬物効果は軽度アルツハイマー病患者に有利である’S病– Simufilamはプラセボと比較して治療6カ月後,軽度アルツハイマー病患者の認知能力低下速度が200%以上低下した。プラセボを服用した軽度アルツハイマー病(MMSE 21−26)患者を1群とし,6カ月間でADAS−Cogスコアは0.6点低下した。シモフェランを服用した軽度アルツハイマー病患者は1群として6カ月以内に0.6点向上し,薬物に対する支持程度に205%の差があった(95%信頼区間,−2.6から0.4;試料量に有意差はなかった)。表2と図2を参照されたい.
表2:無作為禁断研究結果−軽度患者の認知変化−
| 軽症患者 |
シモフェラン100 mg (N= 40) |
プラセボ (N= 36) |
数値化する 差別化する |
百分率差 |
| 6ヶ月間の変化 Adas-Cog |
0.6ポイント 改善 |
0.6ポイント 衰退する |
–1.1 |
205%の人が薬をサポートしています |
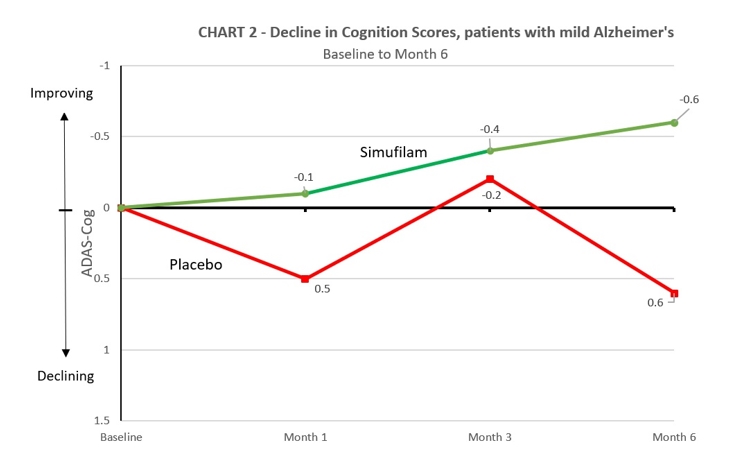
無作為に検討した無作為投与段階に入った後,軽度患者のMMSE平均ベースライン得点はそれぞれMMSE 24.0とMMSE 24.1,セスキレン群とプラセボ群であった。軽度患者の平均ベースラインADAS-Cog採点は、シトロン群とプラセボ群はそれぞれ11.0と11.2であった。
シモフェラン18カ月安定軽度アルツハイマー病患者の認知機能’S病– 76人の軽度アルツハイマー病患者(MMSE 21~26)は、投与12カ月後に無作為投与段階に入り、シモフェラン(N=40)またはプラセボ(N=36)をランダムに6カ月間治療した。CMSでランダムにシモフェラン治療を受けた軽度患者を1群とし,18カ月間ADAS−Cogスコアは実質的に低下せず,認知能力が安定していることが示唆された。無作為投与段階でプラセボを無作為に服用した軽度患者(したがってシトロラン治療6カ月中止)は18カ月のADAS−Cogで1群として0.8点低下した。図4を参照。
図4.アルツハイマー病患者(MMSE 20-30)の18ケ月間のADAS-Cogの歴史的低下状況であり、プラセボ群とシモフェロン群を比較した。
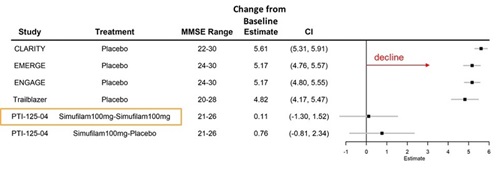
図4:独立生物統計学者ペンタラ社の森林ブロック。データは、アルツハイマー病(MMSE 20-30)において他の後援者によって行われたプラセボ群からの単一抗体無作為対照試験からのものである。LecanemabのClarity P 3試験,AducanumabのEmerge and Engage P 3試験およびdonanemabのTrailBlaer P 3試験の結果は,この図では,ランダムな投与中止段階を“PTI−125−04”研究,“Simufilam 100 mg−Simufilam 100 mg”とは開放ラベル段階と無作為投与段階でSimufilam治療を同時に受けた患者,“Simufilam 100 mg−プラセボ”は開放ラベル段階でSimufiam治療を受けた患者と,無作為投与段階でプラセボ治療を受けた患者を指す。
安全なデータ6カ月間の無作為投与段階の24カ月の安全性研究では,1日2回の10−Simufilam 100 mg錠剤は安全で耐性が良好であったようであった。
討論する.12ヶ月間の開放ラベルシモフェラン治療を完了した患者は、ランダムな中止段階に招待された。12カ月の開放ラベルシモフェランの以前の治療で頭から離れない薬物影響を除去するのにどのくらいの時間がかかるかは不明である(あれば)。軽から中等度アルツハイマー病患者に対する小規模無作為投与研究段階では,シモフェロンは6カ月間にADAS−Cogを服用した患者の認知能力低下速度を38%(統計学的有意)低下させ,薬物の安全性は良好であった。軽度患者では効果が顕著であった。各腕の小さいサイズを考慮すると、平均ベースラインMMSEとADAS−Cogスコアはほぼバランスがとれている。
24ヶ月間の安全性研究結果
2024年2月,我々はこの24カ月間の臨床安全性研究の主な結果を報告した。ADAS−COGスコアの平均変化は,ベースラインが24カ月であり,以下のことを示した
| ● |
軽度アルツハイマー病患者はシモフェラン治療を2年間連続し(n=47)、ADAS-Cog採点(±1.51 SE)の低下は見られなかった。 |
| ● |
非持続治療を受けた軽度アルツハイマー病患者(n=40)はADAS−Cog(±1.65 SE)で1群として1点低下した。非連続治療は、1年の開放ラベル薬、6ヶ月のプラセボ、および6ヶ月の開放ラベル薬を含む。 |
| ● |
軽度アルツハイマー病患者において、連続と非連続治療群との間の最大分離は、6ケ月間の無作為、プラセボ対照の中止段階の終了時に発生した。 |
| ● |
シモフェラン治療を2年間受けた中度アルツハイマー病患者(n=32)ADAS-Cog採点(±1.91 SE)は11.05点低下した。 |
軽度アルツハイマー病患者(n=87)は24カ月間のMMSE 21−26研究を開始したが,10例の例外があった。中等度アルツハイマー患者は24カ月間のMMSE 16−20研究を開始し,そのうちの1人がMMSE 15に入った。
臨床試験結果の複雑な統計分析に特化した独立コンサルティング会社が全分析集(FAS)上で予め指定された認知終点を分析した。Fas群はすべての研究参加者からなり,少なくとも1回の治療を受け,ベースラインと少なくとも1回のベースライン後評価を同時に行った。(Fasデータは研究の各段階に特化しているため,24カ月間研究したFasは他の研究段階のFasとは異なる可能性がある)。
シモフェロンの24カ月連続治療を受けた軽症患者(n=47)のベースラインから24カ月までのADAS−Cog 11スコア(±1.51 SE)での平均変化は0.07点であった。
軽度アルツハイマー病患者は12ケ月の開放ラベルセモフェラン治療を受け、その後6ケ月の無作為、プラセボ対照の中止段階でプラセボを服用し、その後6ケ月の開放ラベルシモフェラン治療(n=40)を受け、1群としてADAS-Cog 11(±1.65 SE)は平均1.04点低下し、ベースラインは24ケ月であった。図4 Bを参照する。
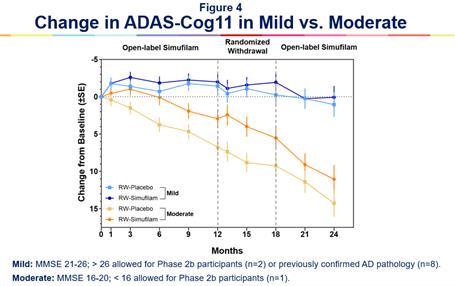
薬物治療を継続した軽度アルツハイマー病患者群では,ベースラインの平均ADAS−Cogスコアは,非持続的に薬物治療を受けている軽度アルツハイマー病患者群とほぼバランスがとれていた(それぞれ15.2と14.6)。
セキュリティデータ:-この研究では、シモフェロン100ミリグラム錠を1日2回経口投与することは安全であり、耐性が高いようである。薬物と関連した深刻な副作用は発生しなかった。最もよく見られる突発性不良事件(TEAE)は新冠肺炎と尿路感染である。
第2段階終了(EP 2)FDAとの会議
2021年1月,米国食品医薬品局(FDA)とSimufilam第2段階末(EP 2)会議を開催した。今回のEOP 2会議の目的は,アルツハイマー病認知症治療の重要な段階3計画の重要な要素について一般的に合意することであった。食品·薬物管理局の参加者は取締役臨床科学副センターと新薬事務室上級顧問ロバート·タンプル医学博士,取締役神経科学事務室医学博士ビリー·ダン,取締役神経内科医学博士エリック·バスティングスその他である。
2021年2月、私たちは私たちのEOP 2会議を成功的に完成させることを発表した。公式議事録では,我々とFDAはSimufilam第3段階臨床計画の重要な要素で一致していることが確認された。FDAは、完成した第2段階計画、および進行中の明確に定義された第3段階臨床計画に同意し、アルツハイマー病に対するSimufilamの臨床効果を証明するのに十分である。また,単独の臨床尺度を用いて認知(ADAS−COG)を評価することも一致している1)と機能(ADCS-ADL2)は適切な治療効果の終点である。IADRS3一つの治療効果の終点であり、それはADAS-COGとADCS-ADLの点数を結合し、それによって認知と健康機能の単一の総合測定基準を提供する。他の端末はNPIを含む4.
1アダス=コグ=アルツハイマー病’S疾患評価表–認知スケールというのは認知を測るツールです
2ADC-ADL=アルツハイマー病’S病の協同研究–日常生活活動−健康機能の尺度
3IADRS=総合アルツハイマー病’S疾患評価量表−認知と健康機能の総合測定−
4NPI=神経精神医学調査表、痴呆関連行為の存在と重症度を評価する臨床ツール
特別議定書評価
2021年8月、我々はFDAと特別合意評価(SPA)の下で2つの第3段階研究について合意したことを発表した。これらのSPAプロトコルファイルは、FDAがアルツハイマー病患者の治療のためのSimufilam第3段階研究スキームの重要な設計特徴を検討し、同意したことを示している。
SPAプロトコルは、FDAが全体的なスキーム設計の特定の重要な要素(例えば、進入基準、用量選択、終点など)の十分性および受容性に同意することを示す。これらの要因は私たちが計画しているアルツハイマー病西もしかして3期研究を確保するために
将来の規制提出およびマーケティング申請を支援するために、十分かつ良好な制御の研究と考えられる可能性がある。
SPAの最初の臨床研究プログラムは“52週間の3期無作為、二重盲検、プラセボ対照、平行グループ分け研究を行い、単剤シトロランによる軽中度アルツハイマー病患者の安全性と有効性を評価した’S病.”
SPAの2つ目の臨床研究プログラムは“3期、無作為、二重盲検、プラセボ対照、平行グループ分け、76週間の研究を行い、2種類の用量のシトロランによる軽中度アルツハイマー病治療の安全性と有効性を評価した’S病.”
第3段階臨床計画の概要
著者らの第三段階計画は2つの大型、二重盲検、ランダム、プラセボ対照のシトロランによる軽~中度アルツハイマー病痴呆患者の治療研究を含む。この2つの研究はいずれも治療期間中の認知と機能の変化を測るためである。図5にこの臨床計画のいくつかのハイライトをまとめた。
Premier Research Internationalは著者らの第三段階臨床計画を支持する主要なCROである。私たちの3期臨床サイトは現在アメリカ、カナダ、プエルトリコ、オーストラリアと韓国に位置している。
図5.我々の第3段階臨床計画の概要

再考-ALZと再焦点-ALZ
2021年秋,軽~中等度アルツハイマー病認知症に対するSimufilamの2つの3期研究を開始することを発表した。2023年11月末,2段階3研究の患者募集が完了したことを発表した。計約1900人の患者がランダムにこれらの研究に組み込まれている。ランダム患者の約70%が軽度アルツハイマー病(MMSE 20~27)の3期の研究に入っている。
REThink-ALZという最初の第3段階研究は、52週間以内のシモフェラン100 mg内服の安全性と有効性を評価することを目的としている(NCT 04994483)。REThink-ALZ第3段階研究の詳細は:
| ► |
約800人の患者がランダムにこの研究に組み込まれた。 |
| ► |
患者はランダム(1:1)に2群に分けられ、シモフェロン100 mg錠剤またはそれに一致するプラセボを1日2回服用した。 |
| ► |
患者は52週間の治療を受ける必要がある。 |
| ► | 治療効果の終点はADAS-Cog 12、認知尺度、およびADCS-ADL、機能尺度とiADRS(ADAS-CogとADCS-ADLスコアの組み合わせ)である。この3つの臨床測定はすべてアルツハイマー病試験における標準的な心理測定評価ツールである。 |
| ► | 他の終点は疾患の血漿バイオマーカーとNPIを含み、NPIは認知症関連行為の存在と重症度を評価する臨床ツールである。 | |
| ► | 現在のところ治療効果に関する中期分析計画はない。 |
著者らの第二段階3研究はREFocus-ALZと呼ばれ、シモフェラン100 mgと50 mgの76週間以内の安全性と有効性を評価することを目的としている(NCT 05026177)。ReFocus-ALZ第3段階研究の詳細は:
| ► |
約1100人の患者がランダムにこの研究に組み込まれている。 |
| ► |
患者はランダム(1:1:1)にシモフェラン100 mg錠剤、50 mg錠剤或いは一致したプラセボに分けられ、1日2回であった。 |
| ► |
患者は76週間の治療を受けた。 |
| ► |
治療効果の終点はADAS-Cog 12、認知尺度、およびADCS-ADL、機能尺度とiADRS(ADAS-CogとADCS-ADLスコアの組み合わせ)である。この3つの臨床測定はすべてアルツハイマー病試験における標準的な心理測定評価ツールである。 |
| ► |
その他の終点は疾患のバイオマーカー、MRI画像とNPIを含み、NPIは認知症関連行為の存在と重症度を評価する臨床ツールである。 |
| ► |
現在のところ治療効果に関する中期分析計画はない。 |
第3段階は標準に入る
著者らの第三段階の臨床研究において、資格基準は患者が満たさなければならない条件であり、研究に入れることができる。これらの要件は、特定の要素(例えば、年齢、疾患または疾患段階、一般的な健康状態および他の重要な要素)において、研究参加者が1つの集団として実質的かつ密接なマッチングを行うことを確実にするのに役立つ。資格基準は,導入基準や排除基準から構成することができ,前者は研究参加に必要であり,後者は参加を阻止する基準である。図5 Aを参照。

血漿リン酸化tau 181(p−tau 181)
血漿p−tau 181はアルツハイマー病神経病理のバイオマーカーと考えられている。REThink−ALZとREFocus−ALZの3期研究は“研究のみの使用”であり,安全性に関係のない探索性p−tau 181血漿分析法を用いて軽度から中度アルツハイマー病患者を同定した。我々が用いた血漿分析は,年齢,APOE遺伝子状態や複雑なアルゴリズムに依存せずに結果を提供する。P-Tau 181テストは独立した商業実験室で行われた。
データ·セキュリティ監視委員会(DSMB)
2023年9月、DSMBの定例会議は、私たちの2つの第3段階研究が計画通りに行われ、何の修正も行わないことを提案することを発表した。このDSMBは患者の安全のみを審査している。それは薬の効果を評価していない。
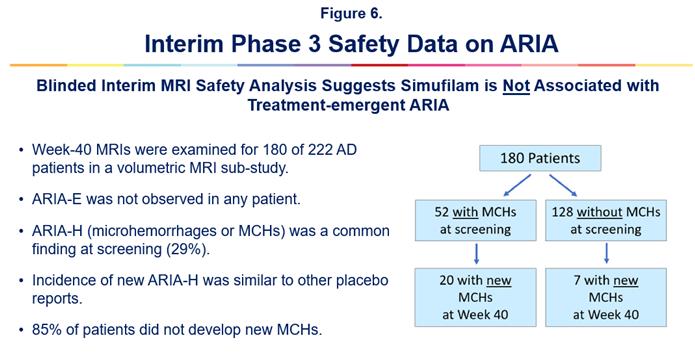
中期MRI安全データ:
2023年10月、Simufilam 3期臨床試験に参加したアルツハイマー病患者の中期磁気共鳴イメージング(MRI)脳データに基づく潜在的な重大な安全発見が発表された。これらのMRIデータは,Simufilamが治療に出現したアミロイド関連像異常(ARIA)とは無関係であることを示している。核磁気共鳴画像はいずれも独立した委員会で認証された神経放射線科医によってARIAを分析している。
ARIAは1つの医学用語であり、一連の脳MRI画像異常、例えば脳腫脹と脳出血を記述するために用いられる。ARIAはアルツハイマー病患者がアミロイドに対するモノクロナル抗体と呼ばれる薬物を服用する既知のリスク因子である。このような薬剤とは異なり,Simufilamはより小分子(経口)の候補薬である。
この新しい安全性発見は、40週目に再焦点-ALZに参加したアルツハイマー病患者180人に対する盲目研究で行われている独立した中期脳核磁気共鳴画像の神経放射線学的評価に基づいて行われている。これは、軽~中度アルツハイマー症患者に対するSimufilam第3段階臨床試験を行っている。最終的なMRIデータは、この第3段階研究終了時に発表される予定である。図6を参照されたい。
第3期臨床計画の現状
我々の3期実験は合計ランダムにベースラインレベル(MMSE 16-27)のアルツハイマー病軽~中度患者約1900人を選択し、その中の約800人の患者が52週研究(REThink-ALZ)でランダムに選択され、約1,100人の患者が76週研究(ReFocus-ALZ)でランダムに選択された。
我々の第3段階試験では,約70%の患者が軽度アルツハイマー病(MMSE 20−27)と診断され,残りの患者は中等度疾患(MMSE 16−19)と診断された。これらの試験ではランダムな患者分布が軽度患者に数字的に傾斜しているため,主に軽度患者の結果に依存して薬物の安全性と有効性を評価することが予想される。
340名を超える患者が52週間のReink−ALZ研究を完了した。215名を超える患者は76週間のREFocus-ALZ研究を完了し、合計555名を超える完成者がいた。
私たちの第三段階計画のすべての治療効果データは依然として盲目だ。現在のところ治療効果結果に関する中期的な分析はない。
我々の52週間の研究(ReThink−ALZ)の頂線データ読み取りは約2024年末であると予想される。
約2025年には76週間の研究(REFocus−ALZ)のトップラインデータが読み出されると予想される。
著者らはすでにFDAとの討論を開始し、最終的に統計分析計画(SAP)を決定し、これは正式な文書であり、著者らの独立生物統計学者が著者らの第三段階試験で収集した治療効果データに対して詳細な分析を行うことを定義した。SAPは期待される臨床試験分析、使用する統計方法とモデル、分析すべき全体、分析されるデータ変数、欠損データをどのように解釈するか、統計モデルに含まれる共変数の記述及び他の統計要素の深い技術詳細と記述を含み、これらはすべて任意の治療効果結果の盲目的を解除する前に前向きに定義、記録と最終的に確定される。
三期工事開放ラベル延伸研究
2022年10月、私たちは私たちの第3段階計画の開放ラベル拡張研究を開始することを発表した。この研究はSimufilamの第3段階研究を成功させ、他の入選基準に符合するアルツハイマー病患者に1年に及ぶ無料経口Simufilamを提供することを目的としている。
この開放ラベル拡張研究は,シモフェラン100 mgを1日2回経口投与するための追加の長期臨床安全性データを52週間以内に生成することが予想される。患者や医者は開放ラベル延長研究に参加する義務がない。各臨床研究場所と各患者はこの開放ラベル拡張研究に参加するかどうかを選択した。
この研究の患者登録は2022年11月から開始された。これまで500人以上の患者が開放ラベル拡張研究に参加してきた。
第3段階薬品供給
私たちはEvonik Industries AGとSimufilamの薬品供給協定を締結した。プロトコルによると、Evonikは供給され、大規模で臨床レベルの数のSimufiamを引き続き供給する予定だ。Evonikは世界最大の薬物成分契約開発と製造組織の一つである。他のサプライヤーは補助剤、完成品剤形(即ちシトロン錠剤)、薬品包装、包装ラベルとその他の重要な部品を提供し、第三段階の薬品供給のサプライチェーンを確保する。
SavaDx
私たちの研究製品の候補製品名はSavaDxであり、初期プロジェクトであり、一部の血液サンプルからアルツハイマー病の存在を検出することに集中している。業務、技術、そして人員の理由で、私たちは私たちの新しい診断候補薬SavaDxではなく、私たちの新薬候補薬Simufilamを優先的に開発し続けた。SavaDxは研究にのみ使用され,安全とは無関係な探索的バイオマーカーであり,SavaDxに関する開発活動は我々の研究予算の1%未満である。
第三者と協力して、我々は、FLNAまたは他の関心タンパク質を検出するために質量分析を使用することを評価し続けている。これらの評価によって生成されたデータおよび情報は、潜在的な知的財産権を有するか否かを決定するために継続的に審査される。
SavaDxの制御経路は最終的に正式な分析性検証研究と臨床研究を含む可能性があり、これらの研究は各種の健康と疾病患者群の敏感性、特異性とその他の変数の証拠を支持する。我々はまだこのような研究を行っていないし,2024年にこのような研究を行うことも望まない.
SavaDxは抗体に基づく改変フィラメントA(FLNA)の検出系として設計されている。第三者と協力して、我々は、FLNAを検出するために質量分析を使用すること、すなわち抗体を使用しないことを評価している。このような評価は進行中だ。
過去12年間に、著者らはFLNAの変化がアルツハイマー病患者の脳病理の象徴的な特徴であることを発見した。SavaDxはこの疾患の早期痕跡を明らかにし,記憶力喪失などの疾患症状が明らかになる前にも可能であると信じている。
診断試験は、一般に、疾患の生物学的指標である1つ以上のバイオマーカーを測定する。疾病の生物学を深く理解してこそ、診断方法を確定し、制定することができる。有効な診断は一定のベースライン特徴があり、作用を発揮でき、そして臨床実践に有用である。それは患者の疾患(感受性)を検出しなければならず、逆に、健康な被験者の疾患(特異性)が検出されない;それは定量的であり、いくつかの疾患の重症度または段階の指示を与えることが望ましい。全体的に、疾患指標を選択的に検出する能力は、診断情報(すなわち、疾患を検出する)または予後情報(すなわち、疾患またはその将来のプロセスを予測する)を提供するために有用である。
現在,アルツハイマー病の診断に最も確実な方法は死後剖検であり,特に有用ではない。アルツハイマー病中に検出される方法は、高価で、侵襲的で、主観的で、リスクがあり、および/または不快である可能性がある。重要なのは,現在のテストの費用や侵襲性により,多くの人が明らかな認知能力の低下が生じるまでテストを受けていることである.
現在アルツハイマー病を診断する方法は、アミロイドβ(具体的には、β)を測定することを含む42)、脳脊髄液または血漿中の総tau(T-tau)またはリン酸化tau(P-tau)レベル;磁気共鳴イメージングまたはコンピュータ断層撮影(CT)、脳アミロイドの陽電子放出断層撮影(AMYVID)、および一連の認知試験を含む構造性神経イメージング技術。通常、効率的な診断を提供するためには、1つ以上の検出の組み合わせが必要である。これらのテストが技術と共に使用される場合、すべてのデータはアルツハイマー病の検出に敏感で特異的である。しかし,実際には,このようなテストや技術は,明らかな記憶力障害症状が出現した後にのみ使用される。
アルツハイマー病の血液診断テストは非常に必要であると考えられる。迅速で簡単で、安価なテストは多くの点で医学界に利益をもたらすかもしれない。利点は、生活様式の変化および潜在的な治療法が最大の影響を与える可能性がある場合に、アルツハイマー病の存在をより早く確認すること、または逆に、そのような早期段階でアルツハイマー病の存在を排除することを含むことができる。他の潜在的な利点はアルツハイマー病と他の痴呆を引き起こす原因を区別すること;アルツハイマー病の異なる段階の決定を助けること;適切な患者を選択し、それを候補実験製品の臨床研究に入れること;および患者の具体的な診断を的確な治療とよりよく結合することを含む。
アルツハイマー病では,脳の病理変化は少なくとも臨床症状が出現する10−15年前に発生すると考えられている。これらの“症状前”の変化は、脳内のいくつかの誤ったフォールディングまたは損傷タンパク質の沈着を含む。SavaDxを用いた長期目標は,臨床症状が出現する前からアルツハイマー病患者を認識することである。早期発見は、いかなる介入措置も手遅れになる前に停止する--あるいは少なくとも--脳損傷を遅らせる鍵である可能性がある。明らかな症状が出現する前に,潜在的なアルツハイマー病の非侵襲的スクリーニングが可能であり,家族歴のあるリスク患者や認知障害を示した患者だけでなく,一般的な健康スクリーニングとして重要である。病気を治療する方法が見つかったら,早期発見が重要である可能性が高い。早期発見と治療もこのような疾病を改善する治療方法を確定するキーポイントである可能性があり、多くの人がアルツハイマー病の臨床研究に失敗した原因の1つは、治療が疾病過程中に通常遅すぎて、何の影響も与えないことであると考えているからである。
また,時間の経過とともに繰り返し測定すると,SavaDxは認知能力の低下や疾患進行の可能性を提供する可能性がある。SavaDxがアルツハイマー病の正確な数値閾値を提供していなくても,SavaDxのデータを神経変性,特にアルツハイマー病の全体診断の枠組みに組み込むことが重要である可能性が考えられる。任意の疾患の診断のように、一部の人は、臨床症状が出現する前にアルツハイマー病を発見する方法を受けるかもしれないが、他の人は、少なくともより良い治療法を見つける前にそうであることを知らないほうが良いかもしれない。
診断開発計画。
診断開発は多くの重要な点で薬物開発とは異なる。そのため,診断開発は計画,研究設計,研究実行において大きく異なる必要がある。
診断開発と薬物開発の違いは
| ● |
私たちは、予想される用途およびユーザ、試験タイプおよび複雑さ、および患者ケア決定における役割などの要因に依存して、SavaDxを承認するために、より広範な規制経路の中で選択する必要があるかもしれない |
| ● |
薬物研究は通常、主にFDA内部の1つのオフィスに関連しているが、SavaDxの規制経路は、複数の連邦または州監督機関とオフィスの政策を考慮する必要があるかもしれない |
| ● |
薬物計画と異なり、SavaDxの統計分析は治療効果と安全終点に注目しない。逆に,SavaDxの研究終点は感受性(真陽性),特異性(真陰性),陽性予測値(既知陽性例正確陽性診断のパーセンテージ),陰性予測値(既知陰性例正確陰性診断のパーセンテージ)に重点を置いている。 |
SavaDxは研究診断製品の候補製品であり、FDAの審査を受けていない。早期臨床試験は限られた範囲で血液サンプルを収集し、抗体または質量分析計を用いてSavaDxをテストと検証することを含む。このようなサンプルをテストし、正確な結果を生成する能力は様々な要素に依存し、その多くの要素は私たちが制御できない。例えば,最適な試料採取は,試料劣化のリスク,保存試料の貯蔵要求,試料貯蔵のコスト,および実際と予測の検出検証時間に依存する。
私たちはSavaDxを使って4回の早期検証テストを行った。試験サンプルに対する3つの盲検研究では、SavaDxはアルツハイマー症患者と正常健康対照被験者(N=232個の試験サンプル)との間の差が10倍を超えることが検出された。この三つの概念検証研究において、SavaDxは100%近くの正確性と特異性を示した。この3つの研究には外部サプライヤーが製造した研究レベル抗体を用いた。
SavaDxに対する4つ目の盲法研究では有意な診断データが生じなかった。4つ目の研究は外部サプライヤーからの欠陥のある研究抗体を用いていると考えられる。商業的に得られる研究抗体は、不正確な検証、ロット間の有意差或いは保存不一致などのいくつかの技術的欠陥が存在する可能性があり、その中のいずれも研究と実験の結果を脅かす可能性がある。
2021年7月、シモフェラン治療前後におけるアルツハイマー病患者の血漿フィラメントAの変化レベルを測定するためのSavaDxの陽性臨床データを発表した。米国国立衛生研究院(NIH)が後援した2 b期無作為対照試験では、シモフェランは28日間治療したアルツハイマー病患者の血漿フィラメントタンパク質Aマーカーの含有量を有意に低下させた。第三者サプライヤーQuanterix社の測定によると,これらの患者の血漿p−tau 181レベルも有意に低下した。
SavaDxは現在、抗体ベースのフィラメントA(Flna)検出システムとして設計されている。第三者と協力して、我々は、FLNAを検出するために質量分析を使用すること、すなわち抗体を使用しないことを評価している。このような評価は進行中だ。
診断方法をめぐる知的財産権法制度は高度に複雑で不確定である。米国では,特許裁判所は現代の特許資格を診断する明確な方法を定義しようと努力してきた。一般に、血液検出結果と患者の健康との間の相関に関する簡単なプロセスは、このようなプロセスが“自然法則”を含むので、特許要件に適合しない。しかしながら、連邦巡回裁判所、地域裁判所、および特許裁判および控訴委員会の裁決を含む異なる裁判所の異なる結果は、診断方法の特許権利要件を決定する資格のために、時々曖昧または相互衝突する法的枠組みを作り続ける。したがって、SavaDxが効果的な特許主張を得るために、米国の現在の法的枠組みにどのように適応するかを決定することはできない。また,診断方法に関する宣言は実行が困難である可能性がある.
私たちは現在アメリカでSavaDxの特許を取得していない。
私たちの科学を他の適応に拡張します
タンパク質の誤フォールディングは様々な生物学的過程や疾患で発生している。神経変性や神経炎症における我々の科学的知見や,分子生物学,生化学,イメージングにおける我々の先進的なツールを用いて,我々の科学を他の疾患に拡張することができる。新しい適応や新薬開発方法は私たちの最初のアルツハイマー病への関心を補うかもしれない。
臨床前プロジェクトは常に先見性があり、時々革新的であり、しかもよく高い生物医学の潜在力を持っている。定義によれば,このような項目は探索的であり,リスクもある.大多数の臨床前プロジェクトは科学或いはその他の原因で失敗し、いくら努力或いは資源を投入しても。このような理由で、私たちはそれらが私たちの候補製品の鍵になるまで、私たちの臨床前計画を開示するつもりはない。
私たちは神経変性計画の世界的権利を持っています
私たちは、特許、特許出願、技術、商業秘密、およびノウハウを含む米国および他の国に知的財産権を持っている。私たちが所有または許可している特許、外観設計、商標、および他の固有の権利を保護することは、私たちの成功と競争の地位に必須的だ。私たちは私たちの特許と他の知的財産権を全面的に保護することが実質的な価値があると考え、これらの権利を侵害から保護するために行動する。
私たちは私たちの技術や製品とその用途に関するアメリカや外国特許や特許出願などの方法を提出して起訴することで私たちの技術を保護することを求めています。私たちの特許戦略の重点は私たちの神経変性プロジェクト技術の知的財産権を保護し、維持することだ。
Simufilamは我々の内部で発見され設計されたものであり,我々の学術協力者は約2008年までの研究活動で特徴づけられている.SavaDxは外部協力者と内部開発している。私たちはこれらの薬物と診断資産および関連技術の世界的な独占的権利を持っており、いかなる第三者にも印税義務はない。アルツハイマー病および他の神経変性疾患に対するSimufilamおよびSimufilamの他の神経変性疾患に対する特許保護は、9つの発行された米国特許を含む2039年まで継続されている。さらに、私たちは、2033年まで続くいくつかの癌を治療するためのシモフェランの特許保護を持っている。私たちの特許権はまた関連化合物と治療の特許と特許出願を含む。すべてのアメリカ申請は相応の外国申請を持っている。
私たちの開発チームは
私たちの製品開発チームは経験豊富な専門家が指導し、彼らは薬物発見と開発の面で成熟した革新記録を持ち、豊富な商業専門知識を持っている。
著者らの創始者兼最高経営責任者Remi Barbierは25年を超える生物製薬業界の経験を持ち、そして指導チームはいくつかの薬物革新を担当し、オピオイド薬物の乱用抑止技術;多種の鎮痛剤候補薬物の臨床開発;癌の革新抗体計画;及び神経科学とその他の治療領域の他の計画を含む。タピオカ科学会社を設立する前に、指導者を務め、3つの生命科学会社の創業者や共同創業者であり、この3社は現在上場または買収されている。
我々の首席医療官,医学博士James Kupiecは研究プロジェクトに参加し,これらのプロジェクトはタピオカ科学の前に2つのFDA薬の承認につながった。彼は以前ファイザー社でパーキンソン病の全世界臨床副総裁と神経科学研究部門の臨床責任者を務めたことがある。クピーチ博士はサイノフィやCiba−Geigy製薬会社でも指導職を務めており,それ以前は神経科医であった。
神経科学博士で上級副社長のリンゼイ·バーンズはクーピーチ博士に仕事を報告し,Neurex(Elan製薬会社に買収)やAbgenix(安進社に買収)に勤務している間に,神経科学や他の治療分野でいくつかの候補製品を開発したことがある。
Michael Zamlootは,技術運営上級副社長であり,タピオカ科学の前に4つのFDA薬物承認の研究プロジェクトに参加している。彼は以前Boehringer Mannheim(羅氏診断会社に買収された)、Athena NeuroScience(Elan製薬会社に買収された)、Ciba-Geigy(ノワールに買収された)で薬品運営と供給チェーン管理に従事していた。
Michael Marsman,製薬D,規制事務上級副社長は,以前Impax実験室,Millennium PharmPharmticals,Syntexで高級職を担当していたが,そこではいくつかの注目されている薬物の規制承認を共同で担当していた。彼は2019年まで私たちの会社で10年近くの規制事務を指導していた。
ジョージ(本)サントン博士、技術高級副総裁、かつてジョンソンの研究開発チームを指導し、GeneMedicineとApoviaなどの生物技術草創会社で基礎科学を臨床環境に転化した。
我々の管理チームは科学コンサルタントのさらなる支持を得ており,この分野の有力な専門家であり,我々と同様にアルツハイマー病を含む神経変性疾患の新しい療法の推進に取り組んでいる。
私たちの戦略
私たちの目標はアルツハイマー病のような神経変性の診断と治療のための候補製品を開発することです。私たちがこの使命を達成するためのビジネス戦略の重要な要素は
| ● |
アルツハイマー病や他の神経変性分野の革新的な製品の開発に集中している精幹の会社を作ります |
| ● |
競争的研究支出を通じて著者らの独特な科学方法を検証し、同業者評議の定期刊行物に著者らの科学データを発表した |
| ● |
私たちの開発能力を応用して、臨床概念検証研究とその他の方面を通じて私たちの候補製品を推進します |
| ● |
我々の専門知識と経験を利用して,新たな適応や候補製品の発見に専念し,実験証拠とその分野の有力な専門家による検証を行った |
| ● |
もっと効率的に資源を調達するために、外判臨床前研究、臨床研究と調合開発活動を継続する |
学術界や他のパートナーとも協力して基礎研究と開発を行っています。2023年、2022年、2021年12月31日までの年間、私たちの研究開発費はそれぞれ8940万ドル、6800万ドル、2480万ドルです。参照してください“プロジェクト7.管理’財務状況と経営成果に関する検討と分析私たちの研究と開発活動についてもっと詳細を知っています。
競争
薬物発見と開発業界の特徴は技術の迅速な進歩、競争の激しいことと特許製品に対する高度な重視である。私たちは製薬とバイオテクノロジー会社、学術機関、政府機関、公共と個人研究機関を含む多くの異なる源からの潜在的な競争に直面している。SimufilamやSavaDxのような任意の候補製品の開発と商業化に成功し、既存の療法および将来発売される可能性のある新しい療法と競争する可能性がある。
歴史的には,製薬業は薬物開発によるアルツハイマー病の治療を試みており,βアミロイドの合成を阻止したり,βアミロイドを除去あるいは脱重合したりする方法であり,最近では脳のもう1つのtauというタンパク質である。本質的に流行的な説では,脳中のアミロイド(あるいはtau)を除去しなければならないと考えられている。この科学方法はすでに著者らの競争相手によって末期臨床研究中に繰り返しテストされ、異なる疾病段階の各種の抗体骨格、エピトープと標的コンホメーションを使用した。アルツハイマー病研究の最新の競争者は、脳内の抗炎症性または他の特性を有するタンパク質の調節に集中している。
対照的に、私たちの科学的な方法は神経変性と神経炎症を同時に改善することを求めている。脳の多様な重要な機能を改善することはアルツハイマー病を解決する新しい、異なる、重要な方法であると考えられる。
科学的方法にかかわらず、認知と健康機能の改善或いは安定は依然としてアルツハイマー病を治療する新薬がFDAの全面的、無条件的な発売許可を獲得する重要な標準である。
私たちの競争相手はもっと多くの財務資源を持って、市場でしっかりして、研究開発、製造、臨床前と臨床テストの方面で専門知識を持って、監督管理の許可を得て、そして清算とマーケティングの許可を得た製品を獲得する。これらの競争相手は合格した科学と技術者を募集と維持し、臨床研究場と臨床研究の患者登録を確立し、そして著者らのプロジェクトと相補的或いは必要な技術を獲得或いは開発する面で私たちと競争している。規模が小さいか、または初期段階にある会社も重要な競争相手になる可能性があり、特に大型および成熟会社との協力手配、大型投資家が提供する大量の資金支援および/または大型成熟会社を通じて知的財産権を獲得することができる。
承認された場合、Simufilamおよび神経変性疾患の治療のために我々が開発した任意の他の候補製品の成功に影響を与える重要な競争要因は、それらの有効性、安全性、利便性、価格、後発薬競争レベル、患者および医師の受容度、ならびに政府および他の第三者支払者が精算できるかどうかである可能性がある。もし私たちの競争相手が私たちが開発する可能性のある製品よりも効果的で、副作用が少なく、より深刻ではなく、より便利で、あるいはより安い製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。
私たちの競争相手は私たちよりも早く彼らの製品を開発してFDAの承認を得るかもしれません。例えば、FDAはアルツハイマー病の治療のためにBiogenのaducanumab(ヒトモノクロナル抗体)を許可し、その開発および商業化はその後2024年1月にBiogenによって停止されたにもかかわらず、加速承認経路を使用した。最近、2023年1月、衛材研究開発管理有限会社と生物遺伝研究会社の特許薬物lecanemab(マウス単一抗体のヒト化バージョン、市場名Leqembi)はアメリカ食品と薬物管理局の発売許可を得て、加速承認経路を用いてアルツハイマー病を治療し、そして2023年7月、アメリカ食品と薬物管理局はlecanemabのアルツハイマー病の治療に完全に許可することを許可した。また,礼来社のdonanemab薬は早期アルツハイマー病患者のための2024年上半期にFDAの承認を得ることが期待されていると信じている。これらいずれの薬剤も現在輸液により輸送されている。
他に現在市販されている薬物は、コリンエステラーゼ阻害剤と呼ばれ、症状の治療のみに集中しており、主に軽~中度アルツハイマー病患者の症状である。アルツハイマー病患者の脳ではアセチルコリンと呼ばれる神経伝達物質レベルが低い。コリンエステラーゼ阻害剤は、脳のアセチルコリンエステラーゼと呼ばれる酵素がアセチルコリンを分解することを阻止することができる。現在市販されているコリンエステラーゼ阻害剤には,ドネペジル(衛材株式会社とファイザー社が販売している名称はAricept),リヴァスミン(ノワスミン(ノワスミン販売名はexelon),ガランタミン(ヤンソン製薬社が販売している名称はRazadyne)がある。コリンエステラーゼ阻害剤はいくつかの患者に数ヶ月の利益を与える可能性があり、その後標的の脳受容体は脱感作し、薬物は効力を失う。アルツハイマー病症状の治療に承認された別の薬剤は、Namendaの名称で販売されている非競合的なnmda受容体アンタゴニストである。
近年,血液に基づく技術の開発によるアルツハイマー病の検出·モニタリングを目的とした世界各地の取り組みが観察されている。SavaDxの成功に影響を与える重要な競争要素、および神経変性を診断するために我々が開発した任意の他の候補製品は、承認されれば、特異性および敏感性、ならびにそれらの利便性、患者受容度、価格、ならびに政府および他の第三者支払い者が精算できるかどうかなどの正確性の測定基準である可能性が高い。我々の診断分野での競争相手は,製薬·バイオテクノロジー会社,学術機関と政府機関,公共·民間研究機関である。研究に力を入れたが、再現性が不足し、及びどのように学術発見を臨床応用に転化する道が明確でないため、この領域は普遍的に阻害されている。
血液に基づく技術によるアルツハイマー症の検出に加えて、競合他社は、新しいトレーサーおよびイメージング技術を用いて神経変性を描画する過程を研究している。2012年、アメリカ食品医薬品局はアミロイド斑塊脳画像のための放射性診断剤であるエメヴィ(Eli Lilly PharmPharmticals)を許可した。アミヴィッドはアルツハイマーを排除することができるが、その存在を確認することはできない。つまり、陰性スキャンはプラークが少ない或いは全く存在しないことを意味する;しかし、陽性スキャンは必ずしもアルツハイマー病を表明するとは限らない。そのほか、AMYVIDはアルツハイマー病の分期に用いることができず、一部の人はアミロイドプラーク形成後に認知能力の低下を示すのに数年かかるため、他の人は数ケ月以内に迅速に末期アルツハイマー病に発展する。
製造業
Simufilamと任意の未来の候補製品は現在の良好な製造規範(CGMP)法規に従って臨床試験のために生産されなければならない。これらの規定は広く、厳格で複雑であり、関係者、建物および施設、設備、コンポーネントおよび薬品容器および封口の制御、生産およびプロセス制御、包装およびラベル制御、保有および分配、実験室制御、記録および報告、および製品の返品または回収の要件を含むことができる。私たちの製造サプライヤーは私たちの候補製品がcGMP要件やFDAなどの外国規制機関の満足に厳密に適合するように施設を持たなければならない。我々の第三者サプライヤーはまた、cGMPの全体的なコンプライアンスを確保するために、FDAと他の外国当局によるそれぞれの施設の定期的かつ抜き打ち検査を受ける可能性がある。これらの検査は、適用される法規に適合するかどうかを評価するために、SIMUFILAMを試験および製造するためのプログラムおよび動作を検討することを含むことができる。法律および規制要件を遵守しない場合、製造業者は、警告状、製品の差し押さえまたはリコール、禁止、製造業務に重大な制限または一時停止を加える同意法令、および民事および刑事罰を含む可能性のある法律または規制行動に直面する。契約メーカーは生産生産量、品質管理と品質保証面の困難に直面し、合格者が不足している。これらの行動またはイベントのいずれもSimufilamの利用可能性に実質的な影響を与える可能性がある。もし私たちの候補薬品が政府法規と基準を満たしていなければ、私たちのサプライヤーは生産停止、貯蔵、輸送、あるいは私たちの候補薬品のテストを余儀なくされるかもしれない。
私たちはシモフェランと他の任意の未来の候補製品の生産に最終的な責任があるにもかかわらず、私たちはサプライヤーが私たちの薬物製品に影響する多くの法規と標準を遵守または遵守しない制御が限られているか、あるいはコントロールされていない。私たちは私たちの供給者たちの決定を統制することができず、これらの決定は彼らが受け入れ可能な条件で私たちの能力や意志を供給し続けるか、または全くできないことに影響を及ぼす。
私たちはどんな製造施設も所有したりレンタルしたりしない。私たちは調合、製造、関連活動を第三者にアウトソーシングする。予測可能な未来に、私たちは引き続き第三者に依存して私たちの候補製品の一定の品質管理とテスト、輸送、または貯蔵を保証するだろう。
我々は現在、Simufiamを生産するために非付属契約開発·製造組織(CDMO)-Evonik Corporation-に依存しており、引き続きそうする予定である。2021年には、Simufiamに大規模で臨床レベルの数の医薬物質を提供することでEvonik Corporationと合意した。
私たちの製造戦略は、薬物物質(すなわち活性成分)と薬物製品(すなわち経口錠剤)を含む、私たちの第3段階計画に十分な薬品供給を提供し続けると信じています。私たちの製造戦略の目標は、FDA規格に適合した薬物物質サプライチェーンの完全性を確保することです。私たちは私たちの薬品の原材料が信頼できる供給源から簡単に得られると信じている。
政府の監督管理
私たちの業務はアメリカと私たちが業務を展開している他の国で、カナダ、韓国、オーストラリアを含めて、異なる程度の政府の統制と規制を受けています。私たちは、私たちの運営においてすべての法律要求を遵守し、私たちが運営している場合が慎重だと思うビジネス慣行を採用しようとしています。アメリカ(連邦、州と地方)、カナダ、韓国、オーストラリア、その他の国の政府当局は、薬品と診断製品の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、販売促進、広告、流通、承認後の監視と報告、マーケティング、輸出入などを規制しています。通常、新薬或いは診断薬物が発売できる前に、大量のデータを獲得し、その品質、安全性、有効性及び/又は特異性を証明し、各監督管理機関の特定のフォーマットに組織し、審査を提出し、各監督管理機関によって承認されなければならない。
アメリカの薬物開発
米国では,FDAは“食品,薬物と化粧品法”(FDCA)に基づいて薬品を規制している。薬物と診断はまた他の連邦、州、そして地方法規によって制限されている。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発過程,承認過程又は上場後のいずれかの場合,出願人が適用される米国の要求を遵守しなければ,行政又は司法制裁を受ける可能性がある。他の行動に加えて、これらの制裁は、FDAが未解決の申請の承認の拒否、承認の撤回、臨床一時停止、無見出しまたは警告状、製品のリコールまたは市場撤回、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返還、返還、および民事または刑事罰を含むことができる。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない。
候補製品はFDAの承認を得て、その後アメリカで商業化されなければなりません。薬品承認の流れには通常、以下の一連のステップが含まれています
| ● |
適用法規に従って広範な臨床前研究を完成し、良好な実験室のやり方による研究を含む |
| ● |
ヒト臨床研究が開始される前に有効でなければならないINDをFDAに提出する |
| ● |
各研究を開始する前に、独立した機関審査委員会(IRB)または倫理委員会によって承認される |
| ● |
適用したIND法規、良好な臨床操作規範(CGCP)、要求とその他の臨床試験関連法規に基づいて十分かつ制御された人体臨床研究を行い、研究製品の各提案適応に対する安全性と有効性を確定した |
| ● |
FDAに新薬申請書(NDA)を提出する |
| ● |
FDAは機密協定を受け取ってから60日以内に再審申請を受けることを決定した |
| ● |
施設、方法、および薬物の特性、強度、品質、および純度を維持するのに十分な制御を保証するために、cGMPの要件に適合することを評価するために、医薬品を製造する1つまたは複数の製造施設の承認前検査を良好に完了させることが好ましい |
| ● |
FDAは、臨床前研究および/または臨床研究サイトの潜在的監査を行い、これらのサイトはNDAをサポートするデータを生成する |
| ● |
薬物が米国で任意の商業マーケティングまたは販売を行う前に、FDAの任意の諮問委員会の意見を考慮することを含むNDAの審査および承認 |
| ● |
承認後の検討を行う潜在的な要求を含む任意の承認後要求を遵守する. |
NDAを支持するために必要なデータは、2つの異なる発展段階で生成される:臨床前と臨床。臨床前と臨床テストと承認過程は大量の時間、精力と財力を必要とし、私たちは未来のいかなる候補製品のいかなる承認も適時に或いは根本的に承認されないかどうかを確定することができない。
臨床前研究とIND
臨床前開発段階は通常薬物化学、製剤と安定性の実験室評価、及び後続の臨床試験を支持する動物毒性評価研究を含む。スポンサーとして,臨床前研究の結果を,生産情報,分析データ,任意の利用可能な臨床データや文献,提案された臨床案とともにINDの一部としてFDAに提出しなければならない。INDはFDAがヒトに研究製品の使用を許可する要求であり,ヒト臨床研究が開始される前に発効しなければならない。
臨床前研究には製品化学と処方の実験室評価があります 体外と動物研究では、不良事象の可能性を評価し、場合によっては治療使用の理論的基礎を確立する。臨床前研究の進行は連邦法規と要求の制約を受け、CGCPの安全/毒理学研究に関する規定を含む。INDスポンサーは,臨床前試験の結果を生産情報,分析データ,任意の利用可能な臨床データや文献,臨床研究計画などとともにFDAに提出し,INDの一部としなければならない。いくつかの長期的な臨床前テスト、例えば長期毒性テスト、生殖不良事件と発ガン性の動物テストは、IND提出後も引き続き行われる可能性がある。INDは、FDAがその計画の任意の態様について懸念または問題を提起しない限り、FDAが受信してから30日後に自動的に有効になる。この場合,INDスポンサーやFDAは臨床研究が開始される前に未解決の問題を解決しなければならない。
臨床研究
臨床開発段階は、合格した研究者の監督の下で、CGCP要求に基づいて健康ボランティア或いは患者に研究製品を提供することに関連し、通常は研究スポンサーに雇用されない、あるいは研究スポンサーの制御下にある医師であり、その中にはすべての研究対象が任意の臨床試験に参加することについてインフォームドコンセントを提供することを含む。臨床研究は、臨床試験の目標、用量プログラム、被験者の選択および排除基準、および被験者の安全性を監視し、治療効果を評価するためのパラメータを含むプロトコルに従って行われる。INDの一部として、すべての議定書とその後の議定書のいかなる修正もFDAに提出されなければならない。また,各臨床研究は,臨床研究を行う各機関の内部審査委員会によって審査·承認されなければならず,臨床研究に参加する個人が直面するリスクが最小限に減少することを保証し,期待される利益については合理的である。IRBはまた、各臨床研究対象またはその法律代表に提供されなければならないインフォームドコンセントを承認し、完成まで臨床研究を監視しなければならない。行われている臨床研究や完成した臨床研究結果を公的登録機関に報告することに関する要求もある。
米国国外での臨床研究のスポンサーは可能であるがFDAの認可を得る必要はなく,INDの名で臨床研究を行うことが望ましい。海外の臨床研究がIND下で行われていなければ,スポンサーはNDAを支援するために臨床研究のデータをFDAに提出することができる。研究がCGCP要求に基づいて行われ,FDAが必要と考えた場合に現場検査でデータを検証できれば,FDAはINDではない工夫や良好な外国臨床研究を受けることができる。私たちは現在アメリカ以外のカナダ、プエルトリコ、韓国、オーストラリアに診療所を設置しています。
米国では,臨床研究は通常3つの連続段階で行われており,第1段階,第2段階,第3段階と呼ばれ,重なる可能性がある。
| ● |
第一段階の臨床研究は通常、少数の健康ボランティアまたは疾病の影響を受ける患者に関連し、彼らは最初に単剤に接触し、その後多剤候補製品に接触する。これらの臨床研究の主な目的は候補薬物の吸収、代謝、薬理作用、耐性と安全性を評価することである。 |
| ● |
第二段階の臨床研究は、予想される利益を産生するために必要な適切な用量を決定するために、疾患の影響を受ける患者を研究することに関する。同時に、安全性と更なる薬物動態学と薬効学情報を収集し、可能な副作用と安全リスクを識別し、そして初歩的な治療効果評価を観察する可能性がある。 |
| ● |
第三段階臨床研究は、一般に、必要なデータを提供して、その予期される用途に対する製品の有効性、その使用安全性を証明し、製品の全体的な利益/リスク関係を確立し、製品承認に十分な基礎を提供することを目的として、複数の場所で多くの患者を募集することに関連する。これらの研究は、プラセボおよび/または他の対照治療との比較を含むことができる。治療の持続時間が常に延長され、製品のマーケティング期間中の実際の使用をシミュレートする。 |
承認後の研究は,第4段階臨床研究と呼ばれることがあり,最初の上場承認後に行われる可能性がある。これらの研究は,治療適応が予想される患者の治療から追加的な経験を得るために用いられている。場合によっては,FDAはNDAを承認する条件として第4段階の臨床研究を強制的に要求する可能性がある。
その他の情報に加えて,臨床研究結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出されなければならない。書面安全報告書および調査には、深刻かつ予期せぬ有害事象、または薬物に曝露された人が重大なリスクに直面していることを示す他の任意の発見が含まれており、FDAに提出されなければならない。
第1段階、第2段階、および第3段階の臨床研究は、もしあれば、任意の指定された時間内に成功しないかもしれない。FDA或いはスポンサーはいつでも様々な理由で臨床研究を一時停止或いは中止することができ、研究対象或いは患者が受け入れられない健康リスクに直面していることを発見することを含む。同様に、ある臨床研究が委員会の要求に従って行われていない場合、またはその薬剤が患者が意外な深刻な傷害に関連している場合、委員会は、その機関による臨床研究の承認を一時停止または終了することができる。また、いくつかの臨床研究は臨床研究スポンサーによって組織された独立した合格専門家グループによって監督され、このグループはデータと安全監視委員会(DSMB)と呼ばれる。このグループは,実験のあるデータへのアクセスにより,指定されたチェックポイントで行えるかどうかの検討を許可している.臨床研究と同時に、会社は通常追加の動物研究を完成し、薬物化学と物理特性に関するより多くの情報を開発し、cGMP要求に基づいて最終的に商業大量生産製品の技術を決定しなければならない。製造過程は一貫して高品質の製品ロットを生産できる必要があり、他の以外にも、会社は最終製品の特性、強度、品質、純度をテストする方法を開発しなければならない。また,適切な包装を選択·テストし,我々の候補製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
守秘契約審査の流れ
臨床研究が完了した後、研究製品が提案された1つまたは複数の指示用途に対して安全に有効であるかどうかを評価するために、データを分析する。臨床前研究および臨床研究の結果は、その後、NDAの一部としてFDAに提出され、製品品質および他の関連データを確保するために、提案されたラベル、化学および製造情報が提供される。簡単に言うと、NDAは1つまたは複数の特定の適応に対する薬物上場の承認要求であり、薬物純度および効力の安全性および有効性証明を含まなければならない。応用は臨床前研究と臨床研究の陰性と曖昧な結果、及び陽性結果を含む可能性がある。データは、製品使用の安全性および有効性を試験するために、または研究者によって開始された研究を含むいくつかの代替源からの臨床研究からのものである可能性がある。上場承認を支持するためには、提出されたデータは研究製品の安全性と有効性を確定し、FDAを満足させるために、品質と数量で十分でなければならない。薬物がアメリカで発売される前に、NDAに対するFDAの承認を受けなければならない。
改正された“処方薬使用料法案”(PDUFA)によると、守秘協定ごとに使用料が添付されなければならない。FDAは毎年PDUFAユーザ料金を調整する。FDAの2024年度までの2024年度9月30日までの有料スケジュールによると,臨床データを必要とするアプリケーション(例えばNDA)の使用料は約400万ドルである。場合によっては、小企業が初めて出願した出願料を免除することを含む、費用を免除または減免することができる。また,孤児薬として指定された製品については,NDAに対して使用料を評価せず,非孤児適応も含まれていない限りである。
FDAは、提出されたすべてのNDA出願を受け入れる前にそれを検討し、NDA出願を受け入れるのではなく、より多くの情報の提供を要求する可能性がある。FDAは受信後60日以内に秘密保護協定の申請を受け入れるかどうかを決定しなければならない。提出された申請が受け入れられると、FDAはNDAの深い審査を開始する。FDAがPDUFAによって合意された目標および政策に基づいて、FDAは、新しい分子実体NDAの予備審査を完了し、出願人に応答し、優先審査のために指定された新しい分子実体NDAの提出日から6ヶ月間、FDAに10ヶ月の時間を有する。FDAは、常にそのPDUFA標準および優先NDAの目標日を達成するわけではなく、審査プロセスは、FDAがより多くの情報を提供または明確にすることを要求することによって延長されることが多い。
NDAを承認する前に、FDAは、それらがcGMP要件に適合しているかどうかを決定するために、新製品の製造施設を承認前に検査することができる。FDAは、製造プロセスおよび施設がcGMP要件に完全に適合していると判断しなければ、製品が要求された仕様で一貫して生産されることを保証するのに十分であることを決定しないで、この製品を承認しないであろう。FDAはまたCGCP要求に適合することを確保するために、臨床研究のデータを監査する可能性がある。さらに、FDAは、安全性または有効性の問題を提起する新製品候補申請を諮問委員会に提出することができ、一般に、申請が承認されるべきかどうか、およびどのような条件下で(ある場合)かを審査、評価、および提案するために、臨床医および他の専門家を含むグループである。FDAは諮問委員会の提案に制限されていないが、承認決定を下す際にこれらの提案を考慮する。FDAは臨床研究データを再分析する可能性があり,FDAと出願人の審査過程で広く議論される可能性がある。FDAはセキュリティプロトコルを評価した後,承認書または完全な返信(CRL)を発行する.この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。CRLは,FDAのその申請に対する審査が完了しており,その申請は現在の形で承認されていないことを示している.CRLは、一般に、FDAによって決定されたNDAにおける特定の欠陥を記述する。CRLは、追加の臨床データ、追加の重要な第3段階臨床試験(S)および/または臨床研究、臨床前研究または製造に関連する他の重要かつ時間の要件を必要とする可能性がある。CRLが発行された場合,申請者はNDAを再提出し,CRLで発見されたすべての不足点を解決したり,申請を撤回したりすることができる.このようなデータや情報を提出しても,FDAはNDAが承認基準を満たしていないと決定する可能性がある.臨床研究から得られたデータは常に決定的ではなく,FDAのデータ解釈は我々の同じデータに対する解釈とは異なる可能性がある。
商業化計画
私たちの候補製品はFDAの上場承認を得ていません。短期的には承認された候補製品は何もないと予想されます。私たちは現在薬品マーケティングの面で会社の経験がなく、販売、マーケティング、第三者支払人計画或いは商業製品流通の面でも人員、能力或いはインフラがありません。私たちの候補製品が商業化されることが承認された場合、私たちは米国および他のいくつかの重要な市場で可能な任意のこのような製品のための商業化インフラを開発する必要があるだろう。戦略的問題として、販売やマーケティング、商業流通など、より大きなバイオ製薬会社との協力や協力に依存して商業化インフラを提供することも可能である。
広告と販売促進
FDAとその他の連邦監督管理機関は直接消費者向けの広告、許可されていない用途に関する通信、業界賛助の科学と教育活動及びインターネットに関連する販売促進活動などの標準と法規を通じて、薬品のマーケティングと普及を密接に監督する。FDAの承認を得る前に、私たちの候補製品は商業的に普及することができない。承認された後、製品販売促進には、FDAによって承認されたラベルと一致する安全性および有効性に関する声明しか含まれない。医療提供者は、ラベル外用途の薬物、すなわちFDAによって承認されていない使用を許可されているので、FDAは医薬品の実践を規制していないので、薬物のラベルリストには記載されていない。しかし、FDAの規制は非ラベル使用に関する製造業者のコミュニケーションに厳格な制限を加えている。この分野におけるFDAの適用要件と制限を守らなければ、私たちはFDA、米国司法省、衛生·公衆サービス監察長事務室、および州当局の不利な宣伝と法執行行動を受ける可能性がある。これは、民事と刑事罰金、および候補製品の宣伝または流通を実質的に制限する方法を含む一連の重大な商業的影響を与える可能性のある処罰を受けることができる。
承認後に要求する
候補製品が監督管理の承認を得た後、それは通常、医薬品の発売と登録、記録保存、定期報告、製品サンプリングと流通、不良事件報告と広告、マーケティングおよび販売促進制限に関連する要求を含むFDAの普遍的かつ持続的な監督管理を受ける。
FDAがNDAを承認した後,有害事象報告と定期報告を提出する必要がある。FDAはまた、上場後テスト、いわゆる第4段階テスト、またはFDAが承認時に条件を付加し、その製品の流通または使用を制限することを要求する可能性がある。また,品質管理,薬品製造,包装,ラベルプログラムは承認された後もcGMPに適合し続けなければならない。医薬品製造業者とそのいくつかの下請け業者はFDAとある州機関に彼らの工場を登録することを要求された。登録は、FDAまたはこれらの州機関の定期的な発表または発表されていない検査をもたらす可能性があり、その間、機関は、cGMPの遵守状況を評価するために製造施設を検査する。そのため,メーカーはcGMPの遵守を維持するために,生産や品質管理に時間,お金,労力をかけ続けなければならない。ある企業が規制基準を遵守できなかった場合、初期マーケティング後に問題に遭遇した場合、または後に以前に意識されていなかった問題が発見された場合、監督管理機関は製品の承認を撤回したり、製品のリコールを要求したりすることができる。また、警告状の発行、製品の差し押さえ、禁止令、生産作業の重大な制限または一時停止の同意法令、承認保留申請の拒否、または承認された申請の補充申請、民事罰、刑事起訴など、他の規制行動をとることもできる。
FDAは、承認された薬物の持続的な安全性または有効性を確保するのを助けるために、承認された臨床研究を要求する可能性がある。FDAはまた,新たなセキュリティ情報を認識すれば,薬物のラベルに含まれるべきであると考えられるラベルの変更を要求する可能性がある。
FDA以外にも、製品承認後の製造、販売、販売促進およびその他の活動も米国の多くの監督管理機関によって監督されており、医療保険と医療補助サービスセンター、衛生と公衆サービス部の他の部門、司法省、消費財安全委員会、連邦貿易委員会、職業安全·健康管理局、環境保護局、平価医療法案(ACA)および州と地方政府を含む。
例えば、アメリカでは、販売、マーケティング、科学と教育プロジェクトも州と連邦の詐欺や乱用法律を守らなければならない。これらの法律には、処方薬製造業者(またはそれを代表する側)を含む任意の人が、インフォームドコンセントおよび意図的な場合には、連邦医療保険または医療補助などの連邦医療計画に基づいて支払われる可能性がある代替薬の購入、推薦、注文または処方を含む任意の報酬を請求、受け入れ、提供、または支払いすることが規定されている連邦反リベート法規が含まれている。この法律に違反した人は監禁、刑事罰金、行政民事罰金、連邦医療計画から除外された罰を受けるだろう。また、“反リベート法”では、政府は、“虚偽申告法”の規定により、連邦“反リベート条例”違反による物品又はサービスのクレームが虚偽又は詐欺的クレームを構成することを含むと主張することができる。
定価と返却計画は,米国の1990年の“総合予算調節法”の医療補助帰点要求およびACAの最近の要求に適合しなければならない。総務省連邦供給スケジュールの許可されたユーザに製品を提供する場合は、他の法律および要求が適用される。製品はアメリカの“毒物防止包装法”に適用される児童保護包装要求に適合しなければならない。製造、販売、販売促進、その他の活動はまた、連邦と州消費者保護および不正競争法によって制限される可能性がある。
医薬製品の流通は広範な記録保存、許可、貯蔵と安全要求を含む追加の規定と条例を遵守し、許可されていない医薬製品の販売を防止しなければならない。
これらの法律または規制要件のいずれかを守らない場合、会社は可能な法律または規制行動に直面するだろう。状況に応じて、適用される規制要件に適合しないことは、刑事起訴、罰金またはその他の処罰、禁止、リコールの要求、製品の差し押さえ、生産の完全または部分的な一時停止、製品の承認の拒否または撤回、または政府契約を含む会社の供給契約の締結の許可を拒否する可能性がある。これらの法律に違反して私たちにとった行動は、たとえ私たちが弁護に成功しても、巨額の法的費用を招き、私たちの経営陣の業務運営への注意をそらす可能性があります。私たちが販売している未来の製品の販売を禁止または制限または撤回することは、不利な方法で私たちの業務に大きな影響を与えるかもしれません。
規制、法規、または既存の規制の解釈の変化は、例えば、私たちの製造計画を変更すること、承認された場合、製品ラベルを補充または修正すること、私たちの製品をリコールまたは停止すること、または追加的な記録保存要件を要求することに影響を与える可能性がある。このような変化を強制的に実施すれば、私たちの業務運営に悪影響を及ぼす可能性がある。
“ハッジ·ワックスマン修正案”
オレンジ図書リスト
秘密協定によって候補製品の承認を求める場合、私たちは、その特許請求が医薬製品をカバーする各特許をFDAに列挙することを要求される。規制部門の承認を得ると、薬物出願に記載されている各特許は、FDAの承認された医薬製品で発行され、治療同等性評価が行われ、一般に“オレンジ書”と呼ばれる。逆に、潜在的な模倣薬競争相手は、略語NDAまたはANDAの承認をサポートするために、オレンジ書に記載されている薬剤を参照することができる。ANDAが規定して販売されている医薬製品は,列挙した薬剤と同じ強度と剤形の同じ活性成分を有し,生物学的同等性試験により治療上列挙された薬剤と同じであることが証明されている。生物学的同等性テストの要求以外に、ANDA申請者は臨床前或いは臨床テスト或いは提出結果を行う必要がなく、その薬物製品の安全性或いは有効性を証明する。このようにして承認された薬物は一般に市販薬の“模倣等価物”と呼ばれ,通常薬剤師が元の市販薬のために処方された処方に基づいて代替できる。
ANDA申請者は、FDAオレンジブックに記載されている承認製品の任意の特許についてFDAに何らかの証明を提供することを要求される。具体的には、出願人は、(1)要求された特許情報を提出していないこと、(2)上場特許が満了していること、(3)上場特許が満了していないが、特定の日に満了し、特許が満了した後に承認を求めること、または(4)上場特許が無効であるか、または新製品の侵害を受けないことを証明しなければならない。ANDA出願人はまた、列挙された使用方法特許を認証するのではなく、その提案されたANDAタグが特許使用方法に関するいかなる言語も含まない(または彫刻された)ことを証明するために、第8条の声明を提出することを選択することができる。出願人が列挙された特許に挑戦していない場合、ANDA出願は、参照製品を必要とするすべての特許が満了するまで承認されないであろう。
新製品は、承認された製品の上場特許又はそのような特許が無効であることを侵害することはなく、第4項の認証と呼ばれる。ANDA出願人が第IV段落認証をFDAに提供した場合,ANDAがFDAに届出を受けると,出願人はまたNDA及び特許保持者に第IV段落認証に関する通知を送信しなければならない。そして、NDA及び特許所有者は、第4項の証明の通知に対して特許侵害訴訟を提起することができる。第4項の認証を受けてから45日以内に特許侵害訴訟を提起すると、30ヶ月前、特許満了、訴訟和解または侵害事件においてANDA申請者に有利な裁決までFDAがANDAを承認することを自動的に阻止する。ANDA出願もオレンジブックに記載されている引用製品の任意の適用の非特許排他性が満了するまで承認されないであろう。
臨床研究情報の開示
FDAが監督する製品(薬物を含む)の臨床研究スポンサーはいくつかの臨床研究情報を登録し、開示しなければならない。製品、患者集団、調査段階、臨床研究場所と研究者、および臨床研究の他の方面に関する情報は、その後、登録の一部として公開される。スポンサーも完成後にその臨床研究結果に関する何らかの情報を発表する義務がある。これらの研究結果の開示は、研究中の新製品または新適応が承認された後に延期されることができる。競争相手はこれらの公開された情報を用いて開発計画の進捗状況を知ることができる.
その他の規制要件
私たちは“環境保護法”と“清浄空気法”を含む連邦、州、地方環境法律法規の制約を受ける可能性がある。私たちが制御材料を処理して処分するセキュリティプログラムは州と連邦法規で規定されている基準に適合していると信じているが、これらの材料は意外な汚染や傷害が発生する可能性がある。このような状況が発生した場合、私たちはそれによるいかなる損害に対しても責任を負うことができ、そのような責任は私たちの資源範囲を超える可能性がある。
私たちはまた他の連邦、州と地方法律の監督を受ける可能性があり、“職業安全と健康法”、国家の技術移転に対する制限及び輸出入と税関法規を含む。私たちの運営に基づいている規制フレームワークのどの部分も変化する可能性があり、このような変化は私たちの現在と予想されている運営に悪影響を及ぼす可能性がある。これらの要求を遵守しないことは、規制承認、リコール、禁止または民事または刑事制裁などの一時停止を招く可能性がある。
第三者支払者は保証と精算を請け負う
私たちの候補製品の商業が成功し、承認されれば、連邦、州、民間レベルの第三者支払者が保険と十分な補償を提供するかどうかにある程度依存するだろう。第三者支払者には、連邦医療保険や医療補助、個人保険計画、管理医療計画などの政府プロジェクトが含まれる。もしこれらの第三者支払者が私たちの候補製品が医療的に不適切または不必要だと判断した場合、彼らは私たちの候補製品の全部または一部の保険または精算を提供することを拒否するかもしれない。また,第三者支払者は,処方や他のコスト制御機構や特定のプログラムや薬物治療の精算金額を用いてカバー範囲を制限し,コストを制御しようとしている。
一部の第三者支払者は,新たな設備や革新的な設備や薬物療法の保証範囲をあらかじめ承認しておく必要があり,このような治療法を用いた医療提供者に精算する。将来的に提案されたコスト制御措置が採用されるか、または他の方法で実施されるかどうかは予測できないが、これらの要求または発表またはそのような提案は、私たちが承認するのに十分な価格を得る候補製品の利益運営能力に重大な悪影響を及ぼす可能性がある。
人力資本
私たちの人的資本資源管理方法は私たちの使命から始まり、即ちアルツハイマー病のような神経変性疾患の検出と治療である。私たちの産業は複雑な規制環境に存在する。私たちの業界の独特な需要と、革新薬物の発見、開発、製造と商業化に専念する企業を経営する挑戦は、高等教育を受けたことと/或いは豊富な業界経験を持つ人材が必要である。また、ある重要な機能に対して、私たちは生物製薬製品の研究開発活動と複雑な製造要求を監督と実行するために特定の科学専門知識が必要である。
私たちの従業員は重要な資産であり、私たちは私たちの採用、訓練、維持、そして従業員を激励する能力が私たちの成功に重要だと思う。私たちは機会均等な雇用主であり、私たちは従業員を尊重し尊重する労働環境の創出と維持に根本的に取り組んでいる。雇用、昇進、補償、福祉および解雇に関連するすべての人的資源政策、やり方および行動は、平等な雇用機会の原則に従って管理されており、これは、これらの政策、やり方および行動は、人種、肌色、宗教、性別、性指向、性別表現または身分、民族血統、血統、年齢、知力または身体障害、遺伝情報、任意の退役軍人身分、任意の軍事身分または兵役申請、または法的保護を適用する任意の他のカテゴリのメンバー資格を考慮することなく、個人の技能、知識、能力、仕事の表現、および他の合法的な基準に基づいていることを意味する。従業員の留任と尊敬度に集中することで、私たちの臨床試験、パイプライン、業務、運営を支援する能力を高め、私たちの株主の長期的な利益を保護しました。私たちの成功はまた私たちが違う従業員たちを引き付け、吸引し、維持する能力にかかっている。
我々の基本給計画は、管理職や従業員の役割貢献価値に応じて補償することを目的としており、各職を遂行するために必要なスキル、知識、能力、および仕事にもたらす経験を考慮している。私たちはまた、当社の管理チームや従業員を奨励し、会社の範囲内の目標を達成するための現金奨励計画を提供し、これらの目標は、当社の戦略的優先順位の様々な側面を推進し、当社全体の戦略を支援し推進することを目的としています。私たちの長期インセンティブ計画によると、私たちの管理チームと従業員は、彼らの長期利益を私たちの株主の利益と一致させることを目的とした株式奨励を得る資格がある。
私たちの福祉計画は一般的に広く、健康と全体的な福祉を促進し、退職貯蓄として強調されている。すべての管理チームと正式なスタッフは同じ核心保健、福祉、退職貯蓄計画に参加する資格がある。他の従業員福祉には、医療計画、歯科計画、休暇および病気休暇賃金計画、柔軟な支出口座、生命保険と意外保険、短期および長期障害福祉が含まれる可能性がある。
私たちの給与委員会は私たちの役員報酬計画、政策、そして計画を監視する。
2023年12月31日現在、私たちは29人のフルタイム従業員を持っています。私たちの従業員の中の一人も労働組合代表でもなく、集団交渉協定のカバー範囲もない。私たちはまた多くのコンサルタントを雇って手付金で、日ごとに、あるいは時間ごとにサービスを提供します。私たちは従業員との関係が良いと思います。
“短く曲解”活動加害者に対する訴訟
2022年11月3日、私たちはタピオカ科学会社に対して“短く歪んだ”運動を起こしたことを告発するために連邦裁判所に提訴したと発表した。150ページ以上に及ぶ起訴状によると、被告のデマ運動でタピオカ科学社の株価が暴落し、時価が数十億ドル縮小し、アルツハイマー病治療薬の開発が遅れたという。起訴状によると、被告は米国食品医薬品局に提出された資料の中で、被告がネット上やソーシャルメディアで発表した“報告書”およびプレゼンテーションで、1000件以上の虚偽や誹謗陳述が行われたと指摘している。2024年1月3日から23日までの間、この事件を担当する治安裁判官は、被告の様々な訴えを却下する動議を地裁に承認することを提案した。その会社は直ちに地方裁判所に反対意見を提出した。この問題はニューヨーク南区の連邦地域裁判所で決定されている。
内部調査
2021年8月から、同社の証券空売り者として開示されたある個人公開は、同社とその従業員および第三者協力者がSIMUFIAM開発に関する研究不正行為に関与していることを告発している。これらの疑惑の一部は、ニューヨークシティ大学(CUNY)が同社と締結した研究契約に基づく研究に関連している。
その会社は不正行為の研究に関する告発を真剣に扱っている。そのため、会社の取締役会はオレック·ヘリントン·サクリフ法律事務所にこれらの容疑の調査を依頼した。調査は会社員,通信,文書,データ,情報に触れることができ,弁護士は関連経験や知識を持つ技術専門家の協力を得た。調査では、会社やその従業員が研究不正行為に従事しているか、または知っているという証拠は何も発見されなかった。
出版物訂正
正誤あるいはそれ以上はすでに発表されたテキストの訂正であり,通常人為的,作品的あるいは著者の誤りであり,在学中には発見されなかった.このような誤りは一般にデータの結論に影響を与えない.私たちは出版された作品で次のような修正に注目した。
2021年7月にSavaDxの臨床データをアルツハイマー病の新規血漿バイオマーカーSavaDxの検出’S病でシムフェランの作用機序が証明されたコロラド州デンバー市で開催されたアルツハイマー病協会国際会議(AAIC)で。出版訂正:AAICデータとデータ分析は正しいが,会社は2021年9月にサンプリングでは発見されなかった視覚誤りを開示した。この誤りはデータの結論に影響を与えない.
2017年に“老化の神経生物学”で“老化の神経生物学”という記事を発表しましたPTI-125は、アルツハイマー病を軽減するために、フィラメントAの変化コンホメーションを結合し、逆転させる’S病機“(第55巻、2017年7月、第99-114頁)。発表訂正:図12は,12個の制御帯域を表示する画像を1枚含む.13個表示されなければなりません。データ分析は、すべての13個の対照ストリップに基づいています。本出版物の他の人為的エラーは注意され訂正された。このようなミスはデータ結論に影響を与えないだろう。
2012年に神経科学誌に記事を発表しました, “フィブロインAを標的とした小分子がアミロイド関連アルツハイマー病の発症機序を低下させる” (JNeurosci 2012;32:9773-9784). 訂正記事の図8 Bに重複パネルが表示されています。このエラーはデータの結論に影響を与えず、出版社は修正を印刷した。
企業情報
私たちは1998年5月にデラウェア州会社として設立され、疼痛治療会社と呼ばれています。2019年3月、私たちは会社名をタピオカ科学会社に変更しました。私たちの主な事務所はテキサス州ショベル金属加工首府1号棟6801 N;Suite 300、テキサス州オースティン、テキサス州、78731にあります。私たちの電話番号は512-501-2444です。私たちのサイトの住所はwww.CasavaScienceです。当社サイトに掲載されている資料は本Form 10-K年報の一部ではありませんが、本Form 10-K年報に掲載されている当社のサイトアドレスは参考にしてください。
米国や他の国における商標としては,Cassava Sciences,Cassava Sciencesロゴ,Artwork,その他のマークを用いた。便宜上、本年度報告で言及された商標および商号は、ロゴ、芸術品および他の視覚的表示を含み、商標マークまたはTMマークを持たない可能性があるが、このような言及は、適用法に基づいて、私たちの権利または適用許可者のこれらの商標および商号に対する権利を最大限に主張しないことをいかなる方法でも示すものではない。私たちは、任意の他のエンティティとの関係を示唆するために、または任意の他のエンティティによって裏書されたり、後援されたりするために、他のエンティティの商号、商標またはサービスマークを使用または提示するつもりはない。
改正された1934年証券取引法第13(A)または15(D)節によると、我々は、我々の10-K表年次報告、10-Q表四半期報告、および8-K表現在の報告を米国証券取引委員会または米国証券取引委員会に電子的に提出する。米国証券取引委員会は、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の発行者に関する情報を含むインターネットサイトを有する。このサイトの住所はHttp://www.sec.gov.
米国証券取引委員会に提出された年間報告書10-K表、四半期報告書10-Q表、現在の報告書8-K表、およびこれらの報告書の修正案を、私たちのウェブサイトで無料で取得することができますHttp://www.Casavasciences.com512-501-2450に電話して私たちの会社のオフィスに連絡したり、電子メールを送ってくださいメール:ir@Casavasciences.com.
第1 A項。..リスク要因
リスク要因
私たちの証券に投資することは高度な危険と関連がある。この部分はわが社への投資に投機的あるいはリスクを持たせる重要な要素を検討しています。本節で説明した危険は私たちが直面している唯一の危険ではない。*現在知られていませんか、または現在、どうでもいいと考えている追加のリスクおよび不確実性は、当社のビジネス運営および証券の市場価格を損なう可能性もあります。
以下のリスクと、本年度報告書に含まれる他の情報をよく考慮しなければなりません。私たちの総合財務諸表と関連付記とタイトルを含めて“管理する’S財務状況と経営成果に関する議論と分析、”私たちの証券に投資するかどうかを決定する前に。次のいずれの事件や事態が発生しても、私たちの業務、財務状況、経営結果、成長の見通しを損なう可能性があります。この場合、私たちの証券の市場価格は下落するかもしれません。あなたはすべてを失うかもしれません あなたの投資の一部です
私たちの候補製品の発見、開発、商業化に関するリスク
| ● |
大部分の研究と開発努力をアルツハイマー病の治療に集中させており,失敗率の高い研究分野である。また,我々の候補製品は新しい科学的方法や新技術に基づいており,候補製品開発の時間やコストおよび成功の可能性を予測することは困難である. |
| ● |
我々はSIMUFIAMの成功に大きく依存しており,これは我々の主要な候補製品であり,現在も開発中である.もし候補製品が私たちが行っている3期試験のうちの1つまたは2つを通過できなかった場合、あるいは規制部門の承認を得られなかった場合、私たちは製品収入を発生させることができず、私たちの業務は損害を受けるだろう。 |
| ● |
アルツハイマー病に対する業務における運営履歴は限られており、商業販売の製品承認履歴もなく、現在の業務を評価し、将来の成功や生存能力を予測することが困難になる可能性がある。 |
| ● |
私たちは私たちの任意の候補製品のために規制承認を申請する保証はありません。あるいは私たちが承認を申請すれば、私たちの製品候補は規制承認を受けることができます。これはそれらが商業化できる前に必要です。 |
| ● |
我々の大型第3段階研究では,小さい第1段階と第2段階の臨床試験や24カ月のSimufilam安全性研究の有望な結果が再現されることは保証されない。 |
| ● |
我々の小さい第1段階と第2段階の臨床試験で観察された臨床結果,あるいはシモフェロンを用いた24カ月の安全性研究は,薬物の安全性や有効性の規制証拠ではない。 |
| ● |
私たちは臨床研究で大きな遅延に遭遇するかもしれないし、もしあれば、私たちの期待したタイムライン上で私たちの臨床研究を行うことができないかもしれません。 |
| ● |
もし医者と患者が私たちの薬を受け入れて使用しなければ、私たちは十分な製品収入を達成できなくなり、私たちの業務は影響を受けるだろう。 |
| ● |
私たちは現在、私たちの候補製品を製造または商業化する内部能力がありません。私たちは第三者商業薬物製造組織に依存して臨床薬物供給を提供します。もし私たちが自分の製造、販売、マーケティング、流通能力を発展させることができなければ、もし私たちが有利な条項で第三者とこれらのサービスの契約を締結することに成功しなかった場合、あるいは全くなければ、私たちの製品収入は不利な影響を受けるかもしれない。 |
| ● |
私たちは、主にまたは完全に軽度アルツハイマー病患者からの臨床結果に依存して、私たちの第3段階の臨床試験において有効性を示す証拠(もしあれば)に依存する必要があるかもしれないが、これはSimufilamを開発する努力により多くのまたは異なる挑戦をもたらすかもしれない。 |
| ● |
私たちの臨床研究は、私たちの候補製品の安全性と有効性の実質的な証拠を証明できないかもしれません。これは、規制承認と商業化の範囲を阻止、延期、または制限するでしょう。 |
政府の規制やその他の法律的コンプライアンスに関するリスク
| ● |
私たちの財務状況や経営業績は、法的訴訟、政府調査または告発、その他のクレームの不利な結果の悪影響を受ける可能性があり、その多くのクレームは2021年にわが社に対する空売り攻撃行動を開始した後に発生します。 |
| ● |
もし私たちが最終的に私たちの候補製品のために申請して監督部門の承認を得ることができなければ、私たちは製品収入を生むことができなくなり、私たちの業務は実質的な損害を受けるだろう。 |
| ● |
私たちが候補製品をマーケティングして普及させる能力はFDA承認のラベルの決定と制限を受けるだろう。 |
| ● |
もし私たちが私たちの業務に適用される複雑な連邦、州、現地、外国の法律法規を遵守または遵守し続けることができなければ、私たちは深刻な結果を受ける可能性があり、私たちの経営業績と財務状況に実質的な悪影響を及ぼすかもしれない。 |
|
| ● | 政府機関は私たちの候補製品の使用を制限する可能性のある使用指針を作成して公表するかもしれない。 |
私たちの知的財産権に関するリスクは
| ● |
もし私たちが開発したすべての候補製品のために十分な特許保護を得ることができなければ、私たちの競争相手は私たちと類似または同じ製品を開発して商業化するかもしれません。私たちが開発した任意の候補製品を商業化することに成功した能力は悪影響を受ける可能性があります。 |
| ● |
法廷または米国または海外の行政機関で疑問が提起された場合、私たちの候補製品および他の技術に関連する発行された特許は、無効または実行不可能と認定される可能性がある。 |
| ● |
もし私たちが開発する可能性のある候補製品のために特許期間の延長とデータ独占権を得なければ、私たちの業務は実質的に損害を受ける可能性がある。 |
| ● |
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争地位は実質的に損なわれるだろう。 |
私たちの業務と運営に関するリスク
| ● |
私たちの名声と業務はその是非曲直にかかわらず、不当な行為疑惑の悪影響を受けるかもしれない。 |
| ● |
私たちが何の重大な中断もなく運営を継続できるかどうかは、製品サプライチェーンを通じて材料と臨床用品を調達する能力にある程度かかっている。 |
| ● |
私たちは第三者が私たちの候補製品に材料を提供し、製造することに依存しており、私たちはそのような材料や候補製品を十分な品質または数量で得ることができない、あるいは私たちは受け入れ可能なコストでそのような供給を得ることができず、これは私たちの開発や商業化努力を延期、阻止、または損害する可能性があるというリスクがある。 |
| ● |
私たちの組織の規模と能力は大幅に増加し、このような成長を効果的に管理する上で困難に直面する可能性があると予想される。 |
| ● |
我々の内部コンピュータシステムまたは私たちが依存する第三者が使用するコンピュータシステムは、障害または他の障害、ネットワーク攻撃、または情報セキュリティホールを受ける可能性があり、これらは、このようなシステムおよびデータの機密性、完全性および利用可能性を危険にさらし、私たちの開発計画および業務運営に重大な中断をもたらし、機密、財務または独自の情報のリスク開示を招き、私たちの名声に影響を与える可能性がある。 |
| ● |
業務中断と適切なレベルの商業保険の不足は、私たちの将来の収入と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある。 |
| ● |
ソーシャルメディアプラットフォームは企業コミュニケーションの動態を著しく変え、リスクと挑戦をもたらし、その中のいくつかは未知であり、私たちが知らないかもしれない。 |
財務状況と資本要求に関連するリスク
| ● |
私たちが設立して以来、私たちは各時期に重大な純損失を発生させ、予測可能な未来に純損失を受け続けることが予想される。 |
| ● |
私たちは資本資源を使用する上で幅広い自由裁量権を持っています 私たちの融資取引は 有効に使えないかもしれません |
| ● |
私たちは製品収入がなく、製品収入に基づく収入や利益を決して達成しないかもしれない。 |
私たちの普通株式所有権に関連するリスク
| ● |
私たちの普通株の市場価格は従来から大きく変動しており、私たちの株を購入した投資家が大きな損失を受ける可能性があると予想されています。 |
| ● |
私たちの所有権の変化は私たちが純営業損失を繰り越す能力を利用することを制限するかもしれない。 |
| ● |
私たちの株の空売り者は操作性を持っている可能性があり、私たちの普通株の市場価格を下げるかもしれません。 |
私たちの候補製品の発見、開発、商業化に関するリスク
私たちはアルツハイマーの治療にかなりの研究と開発を集中させています’S病は,失敗率の高い研究分野である。また,我々の候補製品は新しい科学的方法や新技術に基づいており,候補製品開発の時間やコストおよび成功の可能性を予測することは困難である.
我々のほとんどの研究と開発努力はアルツハイマー病治療の実験方法に集中している。生物製薬会社のこれまでの神経変性疾患領域での努力は、アルツハイマー病の新しい療法を開発する努力を含め、何度も失敗し、臨床成功も非常に限られている。2003年以降、多くの新しいタイプおよびカテゴリの薬剤が開発され、アルツハイマー病の治療に使用され、モノクロナル抗体、ガンマ分泌酵素調節剤および阻害剤、β部位アミロイド前駆体タンパク質溶解酵素阻害剤、末期グリコシル化最終産物受容体(RAGE)阻害剤、ニコチン部分アゴニストおよびアロステリック調節剤、セロトニン受容体(5 HT 6)アンタゴニストおよびその他を含むが、これらの科学的計画のほとんどは第3段階またはそれより早い試験で失敗した。アルツハイマー病を治療する新しい治療法を開発し、もし承認され、それを商業化すれば、FDAと他の監督管理機関の規制承認を得ることを含む多くの挑戦に直面することになり、彼らは限られた前例しか頼ることができない。アルツハイマー病の新しい治療法の開発は従来から大きな挑戦に直面してきたが,アルツハイマー病の神経変性や神経炎症成分を解決することで脳健康の改善が求められている。私たちがアルツハイマー病を治療する主要な候補薬は、安定性に基づいているが-脳内の重要なタンパク質を除去する新しい方法ではない。私たちの新しい技術が安全で効果的な治療製品の承認を支持する臨床結果を生成するか、あるいは承認されれば、そのような製品は販売可能になると確信できない。また,FDAが我々の主要候補薬を評価する比較器が限られているため,予想よりも長い規制審査過程を経験し,開発コストを増加させる可能性がある。
我々はSIMUFIAMの成功に大きく依存しており,これは我々の主要な候補製品であり,現在も開発中である.もしその製品候補が私たちが行っている1つまたは2つの第3段階臨床試験に合格できなかったか もし規制部門の承認を得なければ、私たちは製品収入を生むことができず、私たちの業務も損害を受けるだろう
近年、著者らはSimufilamの開発に多くの精力と財力を投入し、それぞれアルツハイマー病の治療と検査に用いられているSavaDxは、程度が小さい。私たちの業務は、私たちが臨床開発を成功させ、監督部門のSimufilamの承認を得る能力に大きく依存しており、これは決して起こらないかもしれない。臨床研究の結果は多種の要素の影響を受け、Simufilamが監督部門の承認を得ること、あるいは適用された監督管理機関の承認を得ること、あるいは商業化に成功することを保証することはできない。
私たちは今後数年間、私たちの努力と支出の大部分がSimufilamに使用され続け、SavaDxに小さく使用されると予想している。これはより多くの臨床開発、臨床と製造活動の管理、1つ以上の国家司法管轄区の監督管理許可、および商業規模の製造供給を得る必要があるだろう。私たちは私たちの候補製品の任意の商業販売から任意の収入を得るために、大量の投資と多くの努力が必要になるだろう。私たちは私たちがこのような活動のいずれかを成功的に達成できると確信できない。
アルツハイマーに対する私たちのビジネスの歴史は限られています’S病は、製品が商業販売のための歴史を承認していないことは、私たちの現在の業務を評価し、将来の成功と生存能力を予測することを困難にするかもしれません
私たちは臨床段階のバイオ製薬会社で、アルツハイマー病に対する業務運営の歴史が限られています。1998年に運営を開始して以来、私たちは商業販売のための候補製品は何も承認されておらず、製品販売から何の収入も得られていない。薬物開発は高度に不確実な仕事であり、大きなリスクに関連している。これまでアルツハイマー病の鍵となる第三段階の臨床研究は完成しておらず、候補製品のマーケティング承認も得られておらず、成功した製品の商業化に必要な販売やマーケティング活動も行われていない。製品収入のない会社として、私たちの長期的な運営歴史は、私たちの未来の成功と生存能力のどの評価も重大な不確実性の影響を受ける。
私たちは引き続き臨床段階の生物製薬会社が急速に発展する分野でよく遭遇するリスクと困難に直面する。私たちはまだこのような危険と困難を克服することに成功する能力を見せていない。もし私たちがこれらのリスクと困難を成功的に解決できなければ、私たちの業務、経営結果、財務状況は実質的な影響を受けるだろう。
私たちは私たちのどの候補製品も規制部門の承認を得ることができるという保証はありません。これはそれらが商業化できる前に必要です
今まで、私たちはすでに大量の精力と財力を投入して、知的財産権を識別、獲得し、私たちの神経変性プロジェクトを開発し、著者らの候補製品SimufilamとSavaDxに対する臨床前と臨床研究を行い、そしてこれらの操作に一般と行政支持を提供する。私たちの将来の成功は、私たちが開発に成功し、規制機関の承認を得て、私たちの候補製品を商業化することに成功する能力にかかっており、私たちは多くの理由でこれができないかもしれません
| ● |
私たちの候補製品は臨床前研究や臨床研究に成功できないかもしれません |
| ● |
さらなる研究では、候補製品は、安全または有効である可能性が高く、または適用可能な規制基準に適合していないことを示す有害な副作用または他の特徴を有することが証明される可能性がある |
| ● |
私たちの競争相手は私たちの候補製品を時代遅れや魅力を低下させる製品や療法を開発するかもしれない |
| ● |
私たちが開発した候補製品は十分な知的財産権を保護されていないかもしれない |
| ● |
私たちが開発した候補製品は、第三者特許または他の知的財産権または独占権の挑戦を受ける可能性がある |
| ● |
私たちの候補製品の市場は変化する可能性があるので、候補製品の持続的な開発はもはや合理的ではなく、あるいは商業的な魅力を持たなくなった |
| ● |
私たちの候補製品は受け入れ可能なコストで商業的に量産できないかもしれないし、根本的にはできないかもしれない |
| ● |
候補製品が規制機関の承認を得た場合、販売およびマーケティング能力を確立することができない場合、または承認された候補製品をうまくマーケティングして市場承認を得ることができない可能性がある |
| ● |
適用される場合、候補製品は、患者、医学界、または第三者支払人によって安全、有効または有用な製品として受け入れられない可能性がある。 |
上記のいずれかの事件が発生した場合、私たちは1つ以上の計画のための開発作業を放棄することを余儀なくされる可能性があり、これは私たちの業務に実質的な悪影響を与え、運営を停止させる可能性があります。
私たちは私たちの候補製品をさらに開発することに成功しないかもしれない。FDAや同様の外国規制機関の規制承認を得るまで、私たちは私たちの候補製品のマーケティングや普及は許可されておらず、私たちはいかなる候補製品の規制承認も得られないかもしれない。SavaDxは開発の初期段階にある。私たちの後期候補製品Simufilamは、私たちが行っている第三段階計画、臨床前、臨床と製造活動の管理、規制承認、十分な製造供給、商業組織、重大なマーケティングを成功させる必要があり、その後、私たちは製品販売から任意の収入を得ることができます。
私たちは神経変性製品開発計画を完成させたことがない。また,我々の任意の候補製品が臨床研究で成功するかどうかは確認できず,既存あるいは将来の臨床研究が完了する前にこれらの研究を終了する可能性がある。
もし私たちのすべての候補製品が臨床研究に成功すれば、私たちは規制部門の承認を求め、アメリカ、日本、カナダ、イギリスあるいはEU、そして実行可能なビジネス機会があると思う他の国で私たちの候補製品を販売するかもしれない。私たちは規制部門の承認を得ることができないかもしれません。これらの候補製品が臨床研究に成功しても、私たちの生存能力に悪影響を及ぼすでしょう。米国以外の国で規制承認を得るためには、これらの国と地域の安全性、有効性、製造と制御、臨床研究、商業販売、定価と流通などの面で多くの異なる規制要求を遵守する必要がある。たとえ私たちが一つの管轄区域で承認を得ることに成功したとしても、私たちは私たちが他のどんな管轄区でも承認されることを確実にすることはできない。もし私たちの候補製品が複数の管轄区域で承認されなければ、私たちの業務、財務状況、運営結果、成長の見通しはマイナス影響を受ける可能性があります。
私たちが規制部門の承認を得て、私たちの任意の候補製品を市場に出しても、神経変性疾患や他の疾患の治療や診断のためにも、私たちはどのような候補製品が商業化に成功し、市場に広く受け入れられているか、または他の商業代替製品よりも効果的であることを保証することはできない。
生物製薬製品開発への投資は重大なリスクに関連し、即ちどの候補製品も十分な有効性或いは許容可能な安全性を証明できず、監督管理部門の承認を得ることができず、商業的に実行可能ではない。私たちが私たちの候補製品を開発過程に進めることに成功することができる保証はありません。あるいは、承認されれば、私たちの任意の候補製品は商業化に成功します。
規模の小さい第1段階と第2段階の有望な結果は保証されない臨床試験あるいは24カ月間のSimufilam安全性研究は著者らの大型3期研究で再現される。
Simufilamを用いた1期,2期,24カ月の安全性研究の結果は,将来の3期の臨床試験の結果を予測することはできなかった。Simufilamは臨床前研究と初歩的な臨床試験で成功したにもかかわらず、3期臨床試験で期待される安全性と有効性を示すことができないかもしれない。多くの生物製薬会社は3期臨床試験の中で治療効果或いは不良安全性の不足による重大な挫折を受け、早期試験で人を奮い立たせる結果を得たが。私たちは私たちの候補製品が似たような挫折に直面しないということを確信できない。
また,第1段階と第2段階の臨床研究分析データと開放ラベル結果に基づく結論は,大型,制御良好な無作為臨床試験で実施した場合には再現されない可能性がある。初歩的なデータ、少数の患者に関連するデータ、および開放ラベル非対照研究からのデータを解釈する際には特に慎重であるべきであり、これらのデータは通常解釈可能な治療効果証拠を提供できない。我々の小型“人類初例”の第一段階試験の結果は,シトロランの健康ヒトボランティアにおける初歩的な安全特性を評価するためであり,この研究は患者のシモフェラン使用の安全性,耐性と有効性を評価するためではない。同様に,シモフェランの第二段階臨床試験を用いて,シモフェランの患者における安全性の特徴を評価することを目的とした。われわれの第二段階計画は,患者のシモフェロン投与の大規模あるいは長期的な安全性,耐性,有効性を評価するためではない。将来の大型,コントロール良好な多用量研究はSimufilamがアルツハイマー病を含む任意の適応を治療する患者の安全性,耐性あるいは有効性を証明することが保証されない。
私たちのSimufilam臨床試験が計画的に完了しても、私たちは彼らの結果が規制承認を得るために必要な安全性と有効性の実質的な証拠を支持することを確実にすることはできない。Simufilamが将来のどの臨床研究においても安全性、耐性、または有効性を示すことができなければ、私たちの業務を深刻に損なうことになる。
臨床効果を観察するSimufilamを用いた比較的小さい1期と2期の臨床試験や24カ月の安全性研究は,薬物の安全性や有効性の規制証拠ではない。
我々の非3期研究のデータ結果は構成されておらず、シモフェランによるアルツハイマー病治療の安全性または有効性の規制証拠と解釈されるべきではない。薬物の安全性と有効性の厳格な証拠は1つ或いは複数の大型、ランダム、プラセボ対照研究から来た。我々の非3期研究部分の大きさと開放ラベル設計は臨床や統計的ばらつきを導入する可能性があり,あるいは薬物効果とランダム変化を完全に区別できない結果が生じる可能性がある。同一研究の臨床データに対して異なる統計分析を行うことは客観的に異なる数値結果を招く可能性がある。これらと我々の非第三段階研究の他の統計と臨床特徴はデータ解釈の複雑性或いは局限性を増加させる。
私たちは臨床研究で大きな遅延に遭遇するかもしれないし、もしあれば、私たちの期待したタイムライン上で私たちの臨床研究を行うことができないかもしれません
臨床テストは高価で時間がかかり、不確実性も存在する。われわれはいかなる臨床研究も計画どおりに行い,計画どおりに患者を募集するか,あるいは計画どおりに完成することを保証することはできない。また,われわれの研究開始後も安全や他の問題が生じる可能性があり,このような臨床研究を一時停止または終了する可能性がある。1つまたは複数の臨床研究の失敗は、テストの任意の段階で起こる可能性があり、私たちが行っているまたは未来の臨床研究は成功しないかもしれない。成功またはタイムリーな臨床研究の開始または完了を妨げる可能性のあるイベントは、
| ● |
臨床研究の開始または継続を支持するために、または新薬申請シモフィランの提出を支持するために、十分または必要な臨床前、毒理学または他の体内または体外データを生成することができない |
| ● |
目標参加、患者選択、または臨床前および臨床候補製品開発のための他の関連バイオマーカーの確認を遅延させる; |
| ● |
遅延と規制機関は研究設計について合意した |
| ● |
遅延と期待された臨床研究場所は受け入れられる条項について合意し、その条項は広範な交渉を行うことができ、異なる臨床研究地点の間に著しい差がある可能性がある |
| ● |
適切な臨床研究者の確定と募集に遅延が発生した |
| ● |
各臨床研究場所を得るために必要なIRB承認または1つ以上のIRBsの副作用を遅延させる |
| ● |
臨床研究参加者に不合理なリスクをもたらす新しい安全発見 |
| ● |
著者らの臨床研究機関(CRO)、臨床研究操作或いは研究場所の検査結果は陰性であった |
| ● |
調査プログラムまたは計画がその目標を達成するのに十分ではないことを発見する |
| ● |
遅延確定、募集と適切な患者の著者らの臨床研究への参加、及び患者が臨床研究から退出或いは治療後のフォローアップに戻ってこなかったことによる遅延である |
| ● |
疾病の流行、新冠肺炎などの大流行或いはその他の健康危機による遅延; |
| ● |
患者団体や調査者と協力することは困難です |
| ● |
CROや他の第三者や臨床研究の要求を守ることができませんでした |
| ● |
FDAまたは任意の他の規制機関の良好な臨床実践規則(GCP)要件、または他の国/地域の他の規制ガイドラインに適合しない; |
| ● |
候補製品に関連する有害事象の発生は、その潜在的な利点を超えていると考えられる |
| ● |
新しい臨床プログラムの規制要件およびガイドラインの変更を修正または提出する必要がある |
| ● |
臨床開発計画に基づく看護基準の変化は、新しいまたは追加的な研究を必要とするかもしれない |
| ● |
私たちの候補製品の臨床研究コストは予想以上に高いです |
| ● |
私たちの候補製品に対する臨床研究は否定的または不確定な結果をもたらし、これは、私たちが追加の臨床研究を要求したり、製品開発計画を放棄したりすることを決定または監督機関に要求する可能性がある |
| ● |
臨床研究のために十分に安定した数の私たちの候補製品の生産、試験、発表、検証、または輸入/輸出を遅延させるか、または上記のいずれの操作も実行できません。 |
臨床研究を成功的に開始または完了できない場合は、私たちの追加コストをもたらしたり、収入を創出する能力を弱める可能性があります。さらに、私たちが私たちの候補製品を製造したり、調合を変更したりすれば、私たちの修正された候補製品を以前のバージョンに関連付けるために追加的な研究を要求されるかもしれません。臨床研究遅延はまた、私たちの製品が特許保護を持っている任意の期限を短縮することができ、私たちの競争相手が私たちの前に製品を市場に出すことを可能にすることができ、これは候補製品を商業化することに成功する能力を弱める可能性があり、私たちの業務と運営結果を損なう可能性がある。
私たちの候補製品のすべての臨床研究の完成を遅延させることは私たちのコストを増加させ、私たちの候補製品の開発と承認過程を遅くし、そして遅延して、あるいは私たちの製品販売と収入を創造する能力を脅かす可能性があります。さらに、臨床研究の開始または完了の遅延をもたらす要因の多くは、最終的には、私たちの候補製品が規制部門の承認を得ることができないか、または完了する前にこのような臨床研究を終了させる可能性があり、両方とも、私たちの業務に悪影響を及ぼす可能性がある。
われわれはすでに米国以外でわれわれの3期臨床試験の一部を継続しており,FDAは海外で行われた試験データを受け入れない可能性がある
我々はすでに米国以外で我々の3期臨床試験の一部を継続している。FDAは米国国外で行われた臨床試験のデータを受け入れることができるが、これらのデータの受け入れはFDAによって適用されるいくつかの条件に依存する。例えば、臨床試験は道徳原則に符合する合格した研究者によって行われ、実行されなければならない。試験群はまたアメリカ人口を十分に代表しなければならず、データはFDAが臨床的意義があると考えられる方式でアメリカ人口とアメリカの医療実践に適用しなければならない。一般に,米国以外で行われている任意の臨床試験の患者群は,米国でラベルを貼りつけようとしている人々を代表しなければならない。また,米国国外で行われた3期臨床試験は適用された現地法に制約されているが,FDAがデータを受け入れるかどうかは,試験がすべての適用された米国の法律や法規に適合しているかどうかに依存する。FDAがアメリカ国外で行った第三段階試験のデータの一部を受け入れることを保証することはできません。FDAがこのような臨床試験のデータを受け入れなければ、私たちは追加的な試験を行う必要があるかもしれないが、これは高価で時間がかかり、我々の主要な研究製品Simufilamの開発を延期または永久に停止するだろう。
FDAや他の規制機関は私たちの臨床研究を一時停止する可能性があり、これは私たちの業務に影響を与えるだろう。
臨床休止は、FDAまたは他の規制機関によって発行されている進行中の臨床試験を一時停止する命令であり、通常、新たに発見された対象研究または候補薬剤の欠陥、またはその研究または候補薬剤に関する追加情報が必要であるためである。例えば、FDAは2022年に2つのライバルCortexzyme Inc.とDenali Treateutics Inc.からのアルツハイマー病候補薬の臨床保留を実施していることが知られている。臨床放置を実施した理由は複雑で可変であり、具体的な事実である。FDAが私たちに臨床を見合わせている場合、新しい患者をこのテーマに入れてはいけません。FDAが患者の安全を考慮して特に治療を許可しない限り、研究中の患者は候補薬剤から除去される可能性があります。臨床的に猶予されている場合、FDAは詳細な書面回答を提出することで、言及された欠陥を解決したり、要求された追加情報を提供したりすることを期待しています。臨床的棚上げは、FDAが主張する欠陥の評価に同意しなくても、FDAが主張する欠陥の評価に同意しなくても、FDAの懸念の根本的な原因を解決するために多くの資源を必要とするだろう。もし私たちがこれらの根本的な原因を見つけて成功させることができなければ、あるいは私たちの反応が臨床的棚上げを解除するのに十分ではないと考えられる場合、これは私たちの業務に悪影響を及ぼすかもしれない。もし私たちの臨床保留が1年以上持続した場合、FDAは影響を受けた候補製品のINDが非活性化状態に入ったと考える可能性があり、これは対応する臨床計画の終了を招く可能性がある。もし私たちがFDAが適用する可能性のあるいかなる臨床保留も成功的に解除できなければ、私たちの運営および業務結果は実質的な悪影響を受けるだろう。
もし医者と患者が私たちの薬を受け入れて使用しなければ、私たちは十分な製品収入を達成できなくなり、私たちの業務は影響を受けるだろう。
FDAが私たちの薬を承認しても、医者と患者はそれらを受け入れて使用しないかもしれない。私たちの薬が受け入れられ使用されるかどうかは多くの要素に依存します
| ● |
薬品がいつ市場に投入され競争するか |
| ● |
承認されたラベルクレーム; |
| ● |
医師を含めた医療界のメンバーは、私たちの薬物の安全性、副作用、有効性に対する見方を含めている |
| ● |
医師は私たちの候補製品の費用対効果について考えています |
| ● |
発表された研究によると、私たちの薬物は競合製品と比較してコスト効果があることが明らかになった |
| ● |
私たちの製品は政府や医療支払者から補償を受けることができるかどうか |
| ● |
私たちと他の許可者たちと流通業者のマーケティングと流通努力の有効性。 |
私たちは予測可能な未来に、私たちのほとんどの収入は私たちの現在の主要候補製品による売上に依存すると予想されるため、これらの薬物のいずれも市場受け入れを得ることができず、私たちの業務を損なうことになり、追加の融資を求めることができるかもしれない。
私たちは神経変性候補製品を開発することで成功しないかもしれない
私たちのSimufilam、SavaDx、そして私たちの未来の神経変性候補製品の第3段階臨床試験に関連するリスクに加えて、SavaDxと私たちの未来の候補製品はまだ開発されている。このような早期候補製品の開発には数年の時間がかかり,広範な臨床的,科学的検証を経なければならない。 臨床と科学的検証で候補品の開発に成功したとしても、薬や診断法を開発することはできないかもしれません
| ● |
適用された規制基準にタイムリーまたは完全に適合する |
| ● |
他の技術やテストとの競争に成功しました |
| ● |
他人の財産権を侵害することを避ける |
| ● |
第三者支払者が十分に精算する |
| ● |
ビジネスレベルでまたは合理的なコストで行うことができる |
| ● |
市場に進出することに成功しました |
ある程度、私たちは神経変性変化候補新製品の開発に成功せず、私たちの運営と業務結果は実質的な不利な影響を受ける。
臨時に、“営収”私たちが時々発表あるいは公表した臨床試験の初歩的なデータはより多くの患者データの獲得に従って変化する可能性があり、そして監査と検証プログラムの影響を受け、これは最終データセットの実質的な変化を招く可能性がある。
時々、私たちは臨床試験の“第一線”や初歩的なデータを公表するかもしれない。私たちはまた、私たちが分析したデータの一部として、最初にすべてのデータを発表したときに全面的かつ詳細に評価する機会がないかもしれないという仮説、推定、計算、および結論を出した。したがって,我々が報告した主な結果は,同じ研究の将来の結果とは異なる可能性があり,あるいはより多くのデータを受け取って十分な評価を行うと,異なる結論や考慮要因がこれらの結果を合格させる可能性がある。より多くの研究データが利用可能になるにつれて、臨床試験のこれらのデータは実質的に変化する可能性がある。予備データや“トップライン”データはまだ監査と確認手続きを受ける必要があり、これは最終データが以前に公表された予備データと大きく異なる可能性がある。したがって、最終データが利用可能になる前に、予備のトップラインデータは慎重に表示されなければならない。初歩的またはトップラインデータと最終データとの間の違いは、私たちの業務の将来性を深刻に損なう可能性があり、私たちの証券市場の取引価格の大幅な変動を招く可能性がある。
さらに、規制機関を含む他の当事者は、私たちの仮定、推定、計算、結論または分析を受け入れないか、または私たちとは異なる方法でデータの重要性を解釈またはトレードオフする可能性があり、これは、特定の計画の価値、特定の候補製品の承認または商業化、およびわが社全体に影響を与える可能性がある。さらに、開示された特定の研究または臨床試験に関する情報は、一般に、より広い利用可能な情報から選択される。あなたや他の人たちは、私たちが私たちの開示に含まれる重要な情報または他の適切な情報を決定することに同意しないかもしれません。私たちが開示しないことを決定した任意の情報は、最終的に特定の候補製品または私たちの業務に関する未来の決定、結論、観点、活動、または他の側面に大きな意味を持つと考えられるかもしれません。もし私たちが報告した予備またはバックラインデータが後の最終的または実際の結果と異なる場合、または規制機関を含む他の人が結論に同意しない場合、私たちが承認を得て私たちの候補製品を商業化する能力が損なわれる可能性があり、これは私たちの業務、財務状況、運営結果、および見通しを損なう可能性がある。
私たちは現在、私たちの候補製品を製造または商業化する内部能力がありません。私たちは第三者商業薬物メーカーに臨床薬を提供することに依存しています。もし私たちが自分の製造、販売、マーケティング、流通能力を発展させることができなければ、もし私たちが有利な条項で第三者とこれらのサービスの契約を締結することに成功しなかった場合、あるいは全くなければ、私たちの製品収入は不利な影響を受けるかもしれない
私たちは様々な第三者に依存して、私たちの候補製品を製造、充填、ラベル付け、保存、テスト、そして輸送します。私たちはレシピ、製造、そして関連活動を引き続きアウトソーシングする予定だ。これらのサプライヤーは、FDAおよび他の政府機関が実行するcGMP法規を遵守し、cGMPおよび他の基準を厳格に遵守することを確実にするために、FDAおよび対応する州および外国政府機関の承認前検査を含む持続的な定期的な抜き打ち検査を受けなければならない。これらの製造業者たちは連邦、州、または地方法規を遵守しないために、私たちの候補製品を生産、製造、充填、ラベル貼り、貯蔵、テスト、輸送することが禁止されるかもしれない。私たちは私たちのサプライヤーがこれらの法規と基準を遵守しているかどうかを制御することができず、私たちはまた私たちのサプライヤーの決定を制御することができず、これらの決定は彼らが受け入れ可能な条件で私たちの能力や意志を供給し続けるか、あるいは根本的にできない。
過去にこのような第三者の中の何人かといくつかの条件と義務を履行することについて紛争があった。今後このような紛争が再発しない保証はなく,合意終了につながる可能性がある。合意が終了すれば、他のメーカーが決定され、製造契約が締結されるまで、候補製品を商業化することができません。私たちは商業的に合理的な条項で商業供給者を代替できないかもしれないし、根本的にはできないかもしれない。私たちのすべての商業供給者たちを交換することは高価で時間がかかるだろう。もし私たちのどのサプライヤーも予想通りに表現できなかった場合、私たちの候補製品の商業化または潜在的な規制承認を長い間延期または阻止し、不足、コスト超過、または他の問題を招き、私たちの業務に実質的な損害を与える可能性がある。
私たちは現在販売、マーケティング、または流通能力を持っていない。私たちはまだ私たちの候補製品のための商業戦略を立てていない。我々の製品を商業化するためには,FDAが任意の製品を承認した場合,この能力を内部で開発したり,これらのサービスを提供してくれる第三者と連携しなければならない.
もし私たちがどんな薬も商業化することに決めたら
| ● |
必要な経験者を採用して保留します |
| ● |
費用効果のある方法で新薬の発売に成功できる販売、マーケティング、流通業務を確立する |
| ● |
十分な数の医者が製品を処方してくれます |
| ● |
十分な製品収入を生み出す。 |
しかも、私たち自身がそのような業務を構築するには時間と多くの費用がかかるだろう。もし私たちの商業運営がセット製品が足りなければ、私たちは費用効果のある方法でより多くの製品を販売できる競争相手と競争することができないかもしれない。もし私たちが第三者協力者を招いて任意の商業運営を行えば、私たちの将来の収入はこれらの協力者の表現に大きく依存するかもしれない。もし私たちが第三者と新しい共同普及や他の許可手配を達成することを決定した場合、潜在的な協力者の数が限られており、他の人が類似の連合を競争しているため、受け入れ可能な協力者を見つけることができないかもしれない。私たちが1つ以上の受け入れ可能な新しい協力者を決定することができても、私たちは有利な条件でいかなる協力計画も達成できないかもしれないし、いかなる協力計画も達成できないかもしれない。
また、私たちの候補製品の市場的性質のため、私たちは私たちのすべてまたは基本的なすべての候補製品を単一のパートナーにライセンスする必要があるかもしれません。それによって、私たちはこれらの他の製品を独立して商業化する機会を失ってしまいます。もし私たちがこのような新しい協力計画を達成すれば、私たちの収入は私たち自身のマーケティングと販売製品の収入よりも低いかもしれません。
また、私たちが得たどんな収入も私たちの協力者の努力にかかっていますが、関心や資源約束、経営陣の交代、戦略的重点の変化、業務合併、または他の私たちがコントロールできない要素が不足しているため、これらの努力は十分ではないかもしれません。私たちの協力条項によると、私たちが不振な協力者に対する救済措置は限られているかもしれない。もし私たちが関係を終了すれば、代替協力者を受け入れることができないか、または根本的に不可能かもしれない。
私たちは第三者に依存して私たちの研究といくつかの方面の研究を行い、これらの第三者の表現は満足できないかもしれません。これは私たちの学習、研究、テストを遅延または損害する可能性があります
私たちは、契約研究組織(CRO)、臨床データ管理組織、医療機関、臨床研究者のような第三者に依存し続け、私たちの研究、臨床前テスト、臨床研究のいくつかの側面を行うことができると予想されています。例えば、臨床試験の複雑な統計分析に特化した独立コンサルティング会社ペンタラ社は、私たちの臨床研究における認知終点の統計分析を行っています。これらの第三者は、私たちとの協力を中止したり、その契約義務を履行できない可能性があります。もし私たちが代替計画を達成する必要があれば、これは私たちの製品開発活動を延期するだろう。
これらの第三者研究開発活動への依存は,これらの活動に対する我々の制御を減少させたが,我々の責任を軽減していない.例えば,われわれのすべての臨床研究が試験の全体的な研究計画や案に沿って行われることを確実にする責任がある。さらに、FDAはデータと報告の結果が信頼性、反復可能かつ正確であることを保証し、研究参加者の権利、完全性と機密性を保護するために、臨床研究結果を行い、記録し、報告する良好な臨床実践(GCP)規範を遵守することを要求している。われわれはまた,行われている臨床研究の登録を求められ,完成した臨床研究の結果を一定時間の範囲で政府後援のデータベースに発表する。そうしないと罰金、否定的な宣伝、そして民事と刑事制裁につながるかもしれない。
私たちの第三者サプライヤーが規制要件や私たちが規定した合意に従って契約義務の履行に成功し、期待された期限内に完了または研究を行っていない場合、私たちは私たちが開発する可能性のある任意の候補製品のマーケティング承認を得ることができないか、または遅延する可能性があり、候補製品の商業化に成功する努力を得ることができないか、または遅延する可能性がある。例えば、私たちのサプライヤーはその研究施設でいくつかの良好な実験室規範(GLP)を完全に遵守できず、これは私たちが異なる研究場所で実験室研究を繰り返すことを要求する。
私たちはまた他の第三者に私たちの臨床研究にラベルを貼って、貯蔵し、薬品を供給することに依存している。私たちの流通業者のどんな業績ミスも、どんな薬品供給の出荷も含めて、私たちが開発する可能性のある任意の候補製品の臨床開発やマーケティング承認を延期したり、私たちの候補製品を商業化したり、追加の損失をもたらし、私たちの潜在的な製品収入を奪う可能性があります。
私たちは他の適応に私たちの技術や候補製品を拡張する努力は成功しないかもしれない
我々の薬物開発戦略は,我々のアルツハイマー病認知症候補製品の臨床試験を行い,規制部門の承認を求めることであり,これがわれわれの主な適応である。われわれの研究努力をこの主な適応に加え,主要適応の遺伝,生物あるいは機序と重なることに基づいて臨床医学の他の分野に入ることができる。我々の候補製品のためにより多くの適応の臨床研究を行うには大量の技術、財政と人的資源が必要であり、薬物開発失敗の固有のリスクが出現しやすい。私たちのアルツハイマー病候補が承認されても、私たちは私たちの技術や私たちの候補製品のより多くの適応を拡大する努力が成功したかどうかを保証することはできません。
もし私たちがより多くの候補製品を認識し開発できなければ、私たちのビジネス機会はアルツハイマー病に限られます’S病や他の神経変性症
より多くの候補製品の監督管理許可を確定、開発、獲得し、それを商業化するには大量の専門知識と資金が必要であり、しかも薬物開発固有の失敗リスクが出現しやすい。他の候補製品の識別や獲得に成功し、開発中に任意の他の候補製品を推進したり、他の候補製品を識別、取得、または開発するのに十分な資源を集約することは保証されない。もし私たちがより多くの候補製品を識別、獲得、開発、商業化することができなければ、私たちのビジネス機会は制限されるかもしれない。
私たちは診断テストに対するFDAの承認を得たことがなく、私たちはこのような承認をタイムリーにすることができないかもしれないし、そのような承認を得ることができないかもしれない
我々はSavaDxという血液に基づくアルツハイマー病研究診断テストを開発しており,商業化前にFDAの承認が必要である。著者らの診断製品候補、マーケティング、販売と開発活動及び製造過程はすべてFDCA、外国類似機関及びその他の監督機関と管理機関によるFDAの広範かつ厳格な監督管理を受けている。FDCAによると、診断はFDAの承認や承認を得なければ、米国で商業的に販売することができる。新製品がFDAまたは外国の類似機関から上場承認または許可を得る過程が可能である
| ● |
長い時間がかかります |
| ● |
大量の資源が必要です |
| ● |
厳格な臨床前テストと上場後のモニタリングの強化を含む |
| ● |
製品の変更を要求し、 |
| ● |
製品の指定用途の制限を招く。 |
科学やビジネス競争相手と効果的に競争できなければアルツハイマー病の診断テストに成功できないかもしれません’エス病です。
臨床実験室検査領域の競争は激しい。診断性テストの特徴は技術変化が迅速であることである。著者らはアメリカ国内外の競争相手は数知れず、その中には大型診断会社、参考実験室、分子診断会社、大学とその他の研究機関が含まれている。私たちの潜在的な競争相手の多くは、私たちよりもはるかに大きい財政、技術、マーケティング、および他の資源を持っており、これは、これらの競争相手が私たちの前に重要なバイオマーカーを発見し、それらの機能を決定することができるかもしれない。タンパク質やバイオマーカーを発見せずに機能を決定し,これらの発見に基づいて診断,製薬,臨床サービスを開発し,必要な規制や他の承認を得,競争相手の前にこれらのテストとその関連サービスを導入すれば,悪影響を受ける可能性がある。私たちはまた、私たちが開発または商業化する可能性のあるどんな診断テストでも激しい競争に直面することを予想している。私たちが以前に新しい診断テストを市場に出した会社は、マーケティングと商業化テストの面で顕著な競争優位を得ることができるかもしれない。私たちは追加の診断テストの開発に成功できない可能性があり、私たちはこれらのテストをカバーする特許を取得または実行できない可能性があり、これらのテストは私たちの競争相手を保護する保護を提供する。また、私たちの競争相手は私たちの技術やテストを迂回した診断テストの開発に成功するかもしれない。さらに、私たちの競争相手は、私たちが開発した技術やテストよりも効率的でコストの低い技術やテストを開発することに成功したり、私たちの技術やテストをより競争力を持たせたり、時代遅れにするかもしれません。これらの分野の技術進歩と広く知られていることや,知的財産法の変化が我々の知的財産権地位に挑戦し,我々が関与する分野の競争が激化することを予想している.
私たちは私たち自身の独自抗体を開発するか、あるいは抗体に関連しない代替方法を見つけて、私たちのSavaDxと私たちの診断手順を進める必要があるだろう。
これまで,SavaDxの多くのテストは,期待タンパク質を認識し結合することができる複雑な分子である商業的に利用可能な抗体の使用に依存してきた。商業的に入手可能な抗体は、不正確な検証、バッチ間の重大な差、または不一致の記憶などの技術的挑戦をもたらす可能性があり、これらのいずれも、私たちの研究および実験を危険にさらす可能性がある。アルツハイマー病を検出する代替方法も評価されており、質量分析計を用いてFLNAを検出する、すなわち抗体を使用しない。この代替方法の複雑さはまた多くの挑戦的な技術的問題を引き起こしている。抗体に関するアルツハイマー病検出システムの開発に成功したかどうかは不明である。
アルツハイマー病患者におけるシモフェロンを用いた2期臨床研究’S病の設計は、通常、プラセボを受けた患者と薬物を受けた患者との間で認知または他の健康機能において統計的に有意な差を示すためではない。
臨床研究データは通常統計確率(p値)を用いて分析し、臨床観察が治療効果、ランダム効果或いはその他の要素と関係があるかどうかの問題を解決する。これは逆に十分な大きさのサンプル患者集団を組み入れ、適切な統計分析を推定するための臨床研究が必要である。設計によれば、私たちがSimufilamを使用する第2段階の臨床研究は、一般に、認知または他の健康機能測定に関する統計的確率を生成するのに十分な大きさの患者集団を含まない。この特徴は,Simufilamを用いた第2段階研究における臨床観察が重要であるか意義があるかを投資家に正確に説明することを困難にする可能性がある。逆に,われわれの臨床研究では統計的なデータ(すなわちp が生じる可能性がある
われわれのオープン研究では,疾患段階によって治療効果が有意に異なることが認められた。これらの所見は,われわれのその後のどの臨床研究においても重複する可能性があり,そうでない可能性もある。
アルツハイマーは進行性、退行性疾患である。疾病の重症度は通常疾病発展段階によって評価され、疾病発展段階は連続的な全体であり、範囲は大体軽度認知障害(MCI)から早期、軽度、中度、最後まで深刻な疾病である。時間の経過とともにアルツハイマー病の軽度から中等度の段階では,疾患の障害に伴い認知能力が悪化していく。しかし,候補薬Simufilamが疾患段階の患者にどのように影響するかは不明である。例えば,われわれの開放ラベルと小型プラセボ対照研究では,疾患段階によって治療効果が有意に異なることが観察された。軽度患者におけるデータは,疾患早期治療患者の重要性を強調する可能性があると信じているが,このような所見はその後のいかなる臨床研究でも繰り返されない可能性がある。
私たちは主に或いは完全に軽度アルツハイマー病患者からの臨床結果に依存することを望んでいる’S病はわれわれの3期臨床試験において治療効果を示す証拠である(あれば)。もし私たちの候補薬が規制部門の承認を得たら、私たちの軽度疾患患者への依存は、アルツハイマー病コミュニティにSimufilamを広く販売する能力を縮小するかもしれない。
私たちの第3段階実験は、ベースラインレベル(MMSE 16-27)で軽度から中等度の段階にある約1900人のアルツハイマー病患者をランダムに選択した。これらの患者の約70%が軽度アルツハイマー病(MMSE 20−27)と診断されている。これらの試験にランダムに入った患者の分布は軽度患者に数字的に偏っているため,われわれの第3段階試験では,主にあるいは完全に軽度患者の結果に依存して薬物治療効果の証拠を示すことが予想される。私たちは軽度アルツハイマー病患者が私たちの第三段階試験で薬物治療効果の証拠を示すことに依存して、これはアルツハイマー病の広いラベル適応を得るために必要な規制基準を達成できないかもしれません。これはアルツハイマー病コミュニティへのSimufilamの広範な販売能力を制限するかもしれません。もし私たちの候補薬物が規制部門の許可を得て商業的に使用されれば。
私たちが出会うかもしれない患者が我々の第三段階臨床研究に参加し続けることは困難であり、著者らの臨床開発活動は延期されたり、他の方法で不利な影響を受けたりする可能性がある
彼らの案により臨床研究を成功させることは,他の要因に加えて,研究が終了するまで患者に我々の第三段階研究に参加させる能力があるかどうかにかかっている。私たちの3期研究に参加した患者は、多くの理由で参加を中止するかもしれません
| ● |
臨床の場から離れ |
| ● |
行動能力や介護者を失って予約を履行できない |
| ● |
プラセボをランダムに服用している人を含む治療の有効性または不足に対する見方 |
| ● |
治療に関連する副作用 |
| ● |
臨床研究に参加し続ける興味や原動力を失いました |
| ● |
患者はコンプライアンスや合意偏差に依存しない; |
| ● |
他の利用可能な治療法や候補品に興味があります |
| ● |
患者の同意を撤回する |
| ● |
転倒による寛骨骨折など、研究参加とは無関係な深刻または衰弱した健康問題が出現した。 |
私たちの臨床研究は私たちの候補製品の安全性と有効性の実質的な証拠を証明できないかもしれません。これは規制の承認と商業化の範囲を阻止、延期、あるいは制限するでしょう
私たちのすべての候補製品が規制の承認を得る前に、私たちは長い、複雑で高価な臨床前実験と臨床研究を通じて、私たちの候補製品は目標者の使用に安全で効果的であることを証明しなければならない。米国FDAの規定によると、各候補製品はその予想患者群及びその期待用途が十分なリスクと利益の比較状況を有することを証明しなければならない。
新薬の発見、開発、商業化は高度なリスクに関連している。この過程は高価で複雑であり,完成には数年かかる可能性があり,その結果自体も定かではない.各新薬候補は規制部門の承認を得るために10~15年かかる可能性があり、コストは10~20億ドルを超える。少数の研究と開発プロジェクトだけが薬品の監督管理許可とその後の商業化を実現した。私たちはここ数十年間、生物製薬業界が開発している新薬候補薬のうち、約90%~95%が監督管理の承認とその後の商業化を得られなかったと考えている。薬物発見と開発過程中のいつでも失敗が発生する可能性があり、このような失敗は臨床治療効果の不足、不良な安全状況、監督管理障害、コストが高すぎ、感知に乏しい市場機会、資源の不足、保険会社の補償不足、競争できない或いはその他の原因による可能性がある。多くの生物製薬会社は3期臨床試験の中で治療効果或いは不良安全性の不足による重大な挫折を受け、早期試験で人を奮い立たせる結果を得たが。薬物発見と開発において革新記録がある経験豊富な専門家、及び豊富な商業専門知識は、通常監督部門の新製品候補製品に対する承認を得ることができない。
著者らの候補製品の臨床前研究結果は早期或いは後期臨床研究の結果を予測できない可能性があり、著者らの候補製品の早期臨床研究結果も後期臨床研究の結果を予測できない可能性がある。1つのグループの患者または疾患適応における臨床研究結果は、別のグループの患者または疾患適応で得られた結果を予測できない可能性がある。いくつかの場合、多くの要素のため、同一候補製品の異なる臨床研究間の安全性或いは有効性結果は有意差が存在する可能性があり、方案中に規定された研究プログラムの変化、患者群の大きさとタイプの差異、投与方案の変化と投与量方案の遵守、及び他の臨床研究方案と臨床研究参加者の退学率を含む。我々のオープンラベル拡張研究も,我々の臨床開発計画の時間と総コストを大幅に延長する可能性がある。臨床前研究と初歩的な臨床研究で進展を得たが、臨床研究後期段階の候補製品は必要な安全性と有効性を示すことができないかもしれない。
われわれが行っている3期臨床研究は,早期の研究で良好な結果が得られたにもかかわらず,治療効果の欠如や受け入れられない安全性の問題で大きな挫折を受ける可能性がある。アルツハイマー病を含む神経変性疾患の臨床試験は,歴史上の失敗率が多くの他の疾患領域よりもはるかに高い。大多数の臨床研究を開始した神経変性変化候補新薬は監督管理機関の商業化許可を得たことがない。
著者らは神経退行性変化の臨床研究を設計する上で経験が限られており、臨床研究を設計と実行して上場承認を支持できないかもしれない。私たちは私たちの現在の臨床研究あるいは任意の他の未来の臨床研究が成功するかどうかを確定できない。さらに、我々の目標適応のいずれの臨床研究で観察される任意のセキュリティ問題も、これらの適応および他の適応において規制部門の承認を得る見通しを制限する可能性があり、これは、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
また,このような臨床研究が成功しても,FDAや外国規制機関が我々のように結果を解読する保証はなく,承認のための候補製品を提出する前に,より多くの研究が必要である可能性がある。研究結果がFDAや外国の規制機関を満足させてマーケティング申請を支援することができない場合、私たちの候補製品の潜在的な承認を支援するために、入手できない可能性のある大量の資源を費やし、追加の研究を行う必要があるかもしれない。たとえ私たちの候補製品が規制部門の承認を得ても、このような承認の条項は私たちの候補製品の範囲と用途を制限する可能性があり、これはその商業的潜在力を制限する可能性がある。
もし私たちの候補薬が承認前または後に死亡や深刻な傷害を招いた場合、私たちは医療報告法規の制約を受け、これは自発的な是正行動や機関の法執行行動につながる可能性がある。
私たちがアルツハイマー病を治療する候補薬は、高齢または潜在的な健康問題によって虚弱になる可能性がある認知症の高齢者を対象としている。FDAの医療報告書によると、私たちの候補薬剤が死亡または深刻な傷害をもたらしたか、または促進した可能性のある情報をFDAに報告しなければならない。私たちの薬物に関連する深刻な有害事象は、検査、法執行行動、または警告、またはより深刻な場合には、私たちの臨床計画を完全に閉鎖するようなFDAの将来の行動をもたらす可能性がある。われわれが行っている臨床試験では,適用された国や地方法規に基づいてFDAに有害事象を報告する。いかなる深刻な不良事件に必要ないかなる是正措置にも対応し、自発的であっても非自発的であっても、上場前であっても上場後であっても、私たちは時間と資金を投入し、経営陣の業務運営に対する関心を分散させ、私たちの名声と財務業績を損なう可能性がある。
もし承認されれば、SimufilamとSavaDxの市場機会は私たちが予想していたより小さいかもしれない。
もし私たちの臨床開発計画が成功すれば、私たちはアルツハイマー病患者のためのSimufilamとSavaDxの承認を求める予定だ。アルツハイマー病患者数の予測は私たちの信念と推定に基づいている。これらの推定は各種の外部源から来ており、科学文献、患者基礎と市場研究を含み、不正確であることが証明されている可能性がある。実際の患者数は予想を下回る可能性がある。さらに、私たちが現在計画しているまたは未来の製品候補の潜在的な患者集団は限られているかもしれない。規制部門の承認を得て、どの候補製品のためにもかなりの市場シェアを獲得したとしても、潜在的なターゲット層は予想よりも少ないかもしれませんが、追加適応のマーケティング承認を得なければ、決して利益を達成しないかもしれません。
技術や科学が急速に変化する環境では、私たちは激しい競争に直面しており、より多くの競争相手が私たちの前に規制部門の承認を得たり、私たちよりも安全で先進的で効果的な治療法を開発したりする可能性があり、これらは私たちの業務運営を損なう可能性がある
薬物発見と開発競争が激しい。そのほか、神経退行性疾患領域の特徴は激しいと日々激しい競争、及び知的財産権に対する強い重視である。私たちは将来開発や商業化を求める任意の候補製品の面で、世界各地からの主要な製薬会社、専門製薬会社、バイオテクノロジー会社の競争に直面するかもしれない。潜在的な競争相手はまた学術機構、政府機関とその他の公共と個人研究組織を含み、これらの組織は研究を展開し、特許保護を求め、研究、開発、製造と商業化のための協力手配を確立する。
Biogen,Eisai,Eli Lillyのほか,いくつかの製薬やバイオテクノロジー会社は現在,アルツハイマー病を含む神経変性疾患の治療用製品を開発している。多くの既存または潜在的な競争相手は、単独またはその戦略パートナーと共に、研究開発、製造、臨床前テスト、臨床研究、監督管理許可およびマーケティング承認を得た製品の面で、私たちよりも多くの財務資源と専門知識を持っている。
もし他の競争相手が私たちが開発する可能性のある任意の製品よりも安全で、より効果的で、副作用が少なく、より便利で、医師および患者においてより大きな受容度またはより安い製品を得ることができれば、私たちのビジネス機会は減少または消失する可能性がある。さらに、現在承認されている製品は、神経変性疾患の治療への適応が発見される可能性があり、これは、このような製品を我々の任意の候補製品に対して有意な利点を有する可能性がある。Biogen、衛材、礼来以外の競争相手も、彼らの製品は私たちが承認されるよりも早くFDAや他の規制機関の承認を得る可能性があり、これは私たちの競争相手が私たちが市場に入る前に強力な市場地位を確立することをもたらすかもしれない。また、私たちの競争相手が開発した製品や技術は、私たちの潜在的な候補製品を経済的あるいは時代遅れにする可能性があり、私たちは私たちが開発する可能性のある任意の競争相手の候補製品をマーケティングすることができないかもしれません。
さらに、私たちは、私たちの競争相手の製品に関連する特許の範囲、所有権、有効性、および/または実行可能な訴訟または他の訴訟に直面する可能性があり、私たちの競争相手は、私たちの製品の侵害、流用、または他の方法で彼らの知的財産権を侵害すると主張するかもしれない。私たちの競争相手の製品供給は、私たちが開発し商業化する可能性のある任意の製品の需要と私たちが受け取ることができる価格を制限するかもしれません。
政府の規制やその他の法律的コンプライアンスに関するリスク
私たちの財務状況と経営業績は法律手続き、政府調査または告発、その他のクレームの不利な結果の不利な影響を受ける可能性があり、その中の多くのクレームは2021年からのわが社への空売り攻撃行動.
私たちは今、未来にも様々な調査と法的手続きを受けているかもしれない。
近年、米国証券取引委員会や米司法省、米国司法省が実施している告発者計画による調査、法的訴訟、法執行活動など、政府がわが業界で経営している会社、役員、その他の人に対する調査、法的訴訟、法執行活動が増加している傾向があるりっぱな担い手虚偽申告法の条項。
私たちは現在、アメリカ政府機関からの問い合わせと、連邦と州法律に基づいて提出された私たちの候補製品の研究と開発に関連する民事請求、および/または支出申請、証券開示、および私たちの業務の他の側面を含む民事クレームを管理しています。法律手続きの他の情報については、“項目8.財務情報--8.A.連結報告書と他の財務情報--法律手続き”を参照してください。将来的には新たなクレームや問い合わせが発生する可能性があります。
政府の文書要求や他の私たちに対するクレームに応えるために、私たちは私たちの文書とデータをどのように処理し、保存し、保護するかを厳格に管理する包括的な文書保留政策を制定した。私たちの文書保存政策を守らなければ、私たちは法律下の法執行行動と処罰を適用するリスクに直面するだろう。
法的手続きは本質的に予測不可能であり,重大な判決や処罰が生じることがある.したがって、私たちは将来、損害賠償の増加を含む、不正に獲得されたと言われる金額の返済や他の処罰を含む、多額の現金支払いに関連する可能性のある判決や処罰を招く可能性がある。私たちはいくつかのタイプのクレームに対して保険範囲を維持していますが、このような保険範囲は、起こりうるすべての損失またはすべてのタイプのクレームをカバーするのに十分ではないかもしれません。
また、私たちと協力したり、他の方法で業務を展開したりする第三者に対するこのような訴訟は、私たちの名声に影響を与える可能性があり、資本市場で資金を調達する能力を抑制し、政府の精算や贈与計画から除外される可能性のあるリスクが生じ、追加の民事訴訟を引き起こす可能性がある。根拠のないクレームであっても、私たちを否定的に宣伝させ、将来の保険獲得を阻害したり、巨額の法的費用を招いたりすることが要求される可能性がある。したがって、すべての関連要素を考慮した後、私たちは将来、それらを裁判所や他のこのような機関に提出することなく、最終的な法的判決を行うことなく、それらに重要な防御措置を持っているかもしれないが、それらが私たちの業務や名声に構成されるリスクを制限するために重要な防御措置を持っているかもしれない。このような和解は、一定期間会社の行動を規範化するために、大量の資金を支払い、会社の誠実さや同様の合意を締結する必要がある可能性があり、これらの合意の下で運営コストが高くなる可能性がある。
したがって、吾等が属する重大な請求又は法的手続き、吾等に関するいかなる吾等又は吾等に関連する第三者に係る任意の判決又は和解、及び吾等の潜在的な判決又は和解により生じる可能性のある任意の計上金は、吾等の業務、財務状況又は経営結果及び吾等の名声に重大な悪影響を及ぼす可能性がある。
未来に私たちと関連された追加訴訟は費用が高く、弁護するのにも時間がかかるかもしれない
革新的な薬物開発は非常に訴訟を起こしやすく、私たちは時々正常な業務過程中または政府または規制法執行活動によって出現する追加の法的手続き、クレームおよび告発の対象になったり、参加したりする可能性がある。是非曲直にかかわらず、私たちに対する訴訟、または関連するいかなる訴訟も、単独でも全体的にも、私たちの業務、財務状況、運営結果、またはキャッシュフローに実質的な悪影響を及ぼす可能性がある。さらに、私たちがその後に加入したどんな訴訟も巨額のコストを招き、経営陣の注意力、時間、資源を分散させる可能性があり、これは私たちの業務、財務状況、運営結果、キャッシュフローを深刻に損なう可能性があります。私たちの保険証書はこのようなクレームをカバーしていない可能性があり、1つ以上のそのようなクレームを解決するすべての費用を支払うのに十分なお金を提供できない可能性があり、私たちが受け入れられる条項でサービスを提供し続けることができない可能性がある。特に、請求が第三者パートナーと締結した賠償協定の範囲を超えている場合、または私たちの第三者パートナーが要求通りに賠償協定を遵守していない場合、または賠償責任が適用可能な賠償限度額または利用可能な保険範囲を超えている場合、どのクレームも潜在的な責任を負うことになる可能性があります。私たちが提出した未保険または保険加入不足のクレームは予期せぬコストを招く可能性があり、私たちの財務状況、運営結果、キャッシュフロー、あるいは名声に重大な悪影響を及ぼす可能性があります。
もし私たちが最終的に私たちの候補製品のために申請して監督部門の承認を得ることができなければ、私たちは製品収入を生むことができなくなり、私たちの業務は実質的な損害を受けるだろう。
FDAおよび類似の外国規制機関の承認を得るのに要する時間は予測不可能であり、通常、臨床研究開始後数年後に必要であり、関連する候補製品のタイプ、複雑性、および新規性を含む多くの要素に依存する。さらに、承認政策、法規、または承認を得るために必要な臨床データのタイプおよび数量は、候補製品の臨床開発過程で変化する可能性があり、司法管轄区域によって異なる可能性があり、これは、承認の遅延または承認申請の不承認の決定を招く可能性がある。監督管理機関は審査過程中にかなりの自由裁量権を持っており、いかなる申請を受け入れることを拒否することができ、著者らのデータが承認を得るのに十分ではなく、追加の臨床前、臨床或いはその他の研究を行う必要があることを決定することもできる。私たちはまだアルツハイマー症に対する候補製品を含む候補製品の規制承認を得ていません。私たちの既存の候補製品、あるいは私たちが将来開発を求める可能性のあるどの製品候補も決して規制承認を得られないかもしれません。
私たちの候補製品の申請は、多くの理由で、初期または後続の指示で規制部門の承認を得ることができないかもしれませんが、以下の理由に限定されません
| ● |
FDAまたは同様の外国の規制機関は、私たちの臨床研究の設計、実施、または結果に同意しないかもしれない |
| ● |
FDAまたは同様の外国規制機関は、我々の候補製品が安全ではなく、適度に有効であるか、または不良または意外な副作用、毒性または他の特徴を有することを決定する可能性があり、上場承認を得ることができない、または商業用途を阻止または制限することができる |
| ● |
臨床計画で研究されている人たちは広くて代表的ではないかもしれないし、私たちが承認を求めるすべての人々の有効性と安全性を確保するのに十分ではないかもしれない |
| ● |
私たちは、看護基準と比較して候補製品のリスク/収益率が受け入れられることをFDAまたは同様の外国の規制機関に証明することができないかもしれない |
| ● |
FDAまたは同様の外国の規制機関は、臨床前研究または臨床研究データの解釈に同意しないかもしれない |
| ● |
私たちの候補製品の臨床研究から収集されたデータは、新薬申請(NDA)の提出または他の提出をサポートするのに不十分であるか、または米国または他の場所の規制承認を得るのに十分ではないかもしれない |
| ● |
FDAまたは同様の外国の規制機関は、臨床および商業用品契約を締結する第三者製造業者の製造プロセス、試験手順および仕様または施設を承認できない可能性がある |
| ● |
FDAなどの外国規制機関の承認政策や法規は大きく変化する可能性があり、私たちの臨床データは承認を得るのに十分ではない。 |
この長い承認過程と、臨床研究結果の予測不可能性は、規制部門の承認を得ることができず、私たちのすべての候補製品を市場に出すことができず、私たちの業務、運営結果、成長の見通しを深刻に損なう可能性がある。
私たちが候補製品をマーケティングして普及させる能力はFDA承認のラベルの決定と制限を受けるだろう
私たちの候補製品の商業成功は私たちがFDA承認のラベルを得ることができるかどうかにかかっており、それらの特徴を効果的に説明するだろう。ある製品が規制部門の承認を得た場合、承認は特定の疾患段階、患者数および用量に明らかに限定される可能性があり、または使用の適応が制限される可能性があり、これは製品の供給を制限する可能性がある。さらに、FDAは、いくつかの禁忌症、警告または予防措置を製品ラベルに含めることを要求することができ、または、提案されたラベルの他の変更または承諾の1つまたは複数の市販後研究または臨床試験を行うことを条件としてNDAを承認することができる。例えば、FDAは、薬物の安全性および有効性をさらに評価するための臨床試験を含む第4の段階試験を要求することができる。
適切な情報を含む製品ラベルに対するFDAの承認を得られなかった場合、他の類似製品と区別するために、候補製品の重要な機能を宣伝し、普及させることができないだろう。一方、FDAの私たちの候補製品に対する製品ラベル要求の制限は、私たちの候補製品が適用される患者グループを制限するかもしれません。しかし、これらの結果のいずれも、私たちの製品の市場での競争力を製品の商業的価値よりも低くすることになります。
当社の従業員、独立請負業者、コンサルタント、ビジネスパートナー、およびサプライヤーは、法規基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります
私たちは、従業員、独立請負業者、コンサルタント、ビジネスパートナー、サプライヤーの詐欺、不正行為、または他の不正活動のリスクに直面しています。これらの当事者の不正行為には、故意、無謀、不注意な行為が含まれている可能性がある
| ● |
FDAや他の外国規制機関のような法律を遵守する |
| ● |
FDAおよび他の同様の外国規制機関に真実で完全かつ正確な情報を提供する |
| ● |
私たちが作った製造基準を守り |
| ● |
米国の医療詐欺や法律の乱用や類似した外国詐欺的不正行為法を遵守する |
| ● |
財務または臨床情報またはデータを正確に報告するか、または許可されていない活動を私たちに開示する;または |
| ● |
そうでなければ、その行為に関する適用刑事、民事、または規制法を遵守しなければならない。 |
法律に拘束された活動は、患者を募集して臨床研究を行う過程で得られた情報の不正使用にも関連し、これは規制制裁を招き、私たちの名声に深刻な損害を与える可能性がある。さらに、従業員および第三者の不正行為を常に識別して阻止することができるわけではなく、このような活動を発見し、防止するための予防措置は、未知または未管理のリスクや損失を効果的に制御することができない可能性があり、または、そのような法律を遵守できないことによる政府の調査または他の行動または訴訟から私たちを保護することができるかもしれない。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は巨額の罰金や他の制裁を加えることを含めて、私たちの業務に大きな影響を与えるかもしれない。
もし私たちが私たちの業務に適用される複雑な連邦、州、現地、外国の法律法規を遵守または遵守し続けることができなければ、私たちは深刻な結果を受ける可能性があり、私たちの経営業績と財務状況に実質的な悪影響を及ぼすかもしれない
私たちは私たちが業務を展開しているすべての国と管轄区域の法律を遵守する義務がある。このような法律が扱っている活動範囲は非常に広く、範囲はますます広くなっている。これらの法律要件は国によって異なる可能性があり,政府や公衆の受け入れ可能な会社行動に対する期待が変化するとともに,法執行当局が法律や規制条項の解釈を修正し,法執行優先事項を変更することにより,時々新たな要求が加えられる可能性がある。さらに、私たちは多くのパートナー、独立請負業者、コンサルタント、商業パートナー、サプライヤーに依存しており、もし彼らが規制基準および要求に違反することを含む不正行為または他の不適切な活動に従事しているか、または告発された場合、このような法律および公衆の予想に違反することは、私たちの名声、業務、および商業運営を実質的な損害のリスクに直面させる可能性がある。
私たちの業務を管理する法律と法規には
| ● |
1988年の臨床実験室改善修正案(CLIA)はアメリカ連邦監督管理標準であり、アメリカで人類に対して行ったすべての臨床実験室テストに適用し、実験室に連邦政府の認証と州許可証法を獲得することを要求した |
| ● |
非ラベルマーケティングに関連する法律および法規を含むFDA法律および法規 |
| ● |
“健康保険携帯性と責任法”(HIPAA)は、保護された健康情報のプライバシーと安全に関する全面的な連邦標準と、違反者への処罰、州総検察長の法執行権力と違反通知の要求を含むいくつかの標準化された電子取引の使用に対する要求を規定している |
| ● |
検査結果のプライバシーを検査·保護する州法と、健康情報や個人データのプライバシーや安全を保護する州法を管理し、影響を受けた個人や州規制機関に違反を報告することを要求する |
| ● |
連邦反バックル法、または“反リベート法令”は、個人の推薦を交換または誘導するために、直接または間接的に意図的に提供、支払い、勧誘、受け入れまたは報酬を提供することを禁止するか、または連邦医療計画の全部または一部によって精算可能なプロジェクトまたはサービスを提供、手配、または推薦する |
| ● |
連邦虚偽請求法案(FCA)は、任意の個人又は実体が他の事項を除いて、虚偽又は詐欺的な連邦政府への支払いのクレームを故意に提出又は提出することを規定し、それに基づいてりっぱな担い手この条項は、個人訴訟当事者(“親族”と呼ばれる)が政府を代表して印鑑を押すクレームを提出し、それによって得られた一定の割合の賠償を得ることを可能にする |
| ● |
連邦民事通貨処罰法は、他の事項に加えて、連邦医療保険または州医療計画受益者への報酬の提供または移転を禁止し、もしこの人が知っているか、またはそれが受益者の連邦医療保険または州医療計画精算サービスの特定の提供者、従事者または提供者の選択に影響を与える可能性があることを知っている場合、例外がない限り、 |
| ● |
反リベート法、自己推薦禁止、虚偽請求法案のような他の連邦と州詐欺と乱用は、個人保険会社が返済可能なサービスを含む任意の第三者支払者によって返済可能なサービスに拡張する可能性がある |
| ● |
“反海外腐敗法”(FCPA)および他の世界的な反賄賂法には、会社およびその中間者が業務を取得または保留するために政府関係者または他の第三者への不正金の支払いを禁止する法律、商業賄賂を禁止する法律、および商業賄賂を禁止する法律が含まれている |
| ● |
アメリカと他の地方の輸出入規制と経済制裁法律法規 |
| ● |
連邦証券法には、取引法とドッド·フランク法の条項が含まれており、これらの条項によると、不法行為を通報した告発者は30%までの賠償を受けることができる |
| ● |
連邦医師は陽光法案を支払い、製造業者に医師および教育病院に支払われたいくつかのお金および他の価値移転、および医師およびその直系親族が持っている所有権または投資権益を追跡し、連邦政府に報告することを要求する |
| ● |
連邦2014年医療保険保護法(PAMA)216条は、適用される実験室が3年ごと(場合によっては毎年)個人支払者データをタイムリーかつ正確に報告することを要求する |
| ● |
報告書および他のコンプライアンスに関する要件を実施する州法; |
| ● |
似たような外国の法律法規は私たちが未来にその中で運営することを選択するかもしれない外国に適用されるだろう。 |
政府機関は私たちの候補製品の使用を制限する可能性のある使用指針を作成して公表するかもしれない
政府機関,専門,医学会,その他の団体は,我々の候補製品に適した使用ガイドラインを作成する可能性がある。このようなガイドラインは使用法と用量などの要素を解決することができる。このようなガイドラインの応用は私たちの候補製品の臨床応用や商業的魅力を制限するかもしれない。
著者らの候補製品は不良副作用或いはその他の特性を招く可能性があり、その臨床開発を阻止し、その監督管理の承認を阻止し、その商業潜在力を制限し、或いは深刻な負の結果を招く可能性がある
臨床試験を行っている間、研究参加者は疾病、傷害、不快感を含む健康変化を医師に報告した。一般的に、私たちの候補製品がこのような状況を招いたかどうかを決定することは不可能だ。規制当局は異なる結論を出すかもしれないし、もしそれらが発生したら、これらの決定を確認するために臨床試験を一時停止するか、追加の試験を要求するかもしれない。また,我々はこの候補製品が人間にとって安全であるかどうかを決定するためにSimufilamの長期安全性研究を完了していない.Simufilamによって引き起こされる有害事象または他の副作用は、私たちまたは規制機関の臨床研究の中断、延期、または一時停止をもたらす可能性があり、より厳しいラベルやFDAまたは他の同様の外国規制機関の規制承認遅延または拒否をもたらす可能性がある。薬物に関連する副作用は、患者の募集に影響を与える可能性があり、入選患者が研究を完了する能力、および/または潜在的なクレームを招く可能性がある。
私たちは臨床試験に関連した法的責任を負わなければならないかもしれない。
私たちの業務はアメリカや海外のボランティアや患者での臨床研究が求められています。場合によっては、私たちの臨床試験の参加者たちは私たちに責任を負うかもしれない。例えば,我々の1つの研究に参加している臨床研究者は,意図的にまたは意図的に臨床レジメンから外れ,臨床試験参加者に傷害を与えたり,臨床試験参加者が研究完了後もFDA承認前に薬剤を供給し続けるように強要しようとしている可能性がある。
研究の性質によると、不注意、違約、傷害、傷害、死亡、あるいは他の法律理論によって、私たちにクレームをつける可能性がある。臨床試験責任は複雑かついくつかの不確定な法律領域であり、著者らが臨床研究を行っている州と国によって異なるかもしれない。また,臨床研究が完了してから,臨床研究者,臨床試験参加者,あるいは臨床研究に関連するもう一方が我々にクレームをつける可能性がある。このような行動に対する弁護は、費用が高い可能性があり、私たちの経営陣や他の資源の大量の時間と注意に関連し、金銭的責任や処罰を招く可能性があり、不利な方法で私たちの業務を変えることを要求するかもしれない事実集約的なプロセスである。
私たちの保険証書は十分ではないかもしれないし、私たちを取り返しのつかないリスクに直面させる可能性がある。
私たちは製品責任保険範囲を維持していますが、この保険は私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれません。臨床試験を始めるたびに、どんな候補製品の商業化に成功すれば、保険範囲を増やす必要があるかもしれないと予想しています。保険の獲得性、保証条項と定価は引き続き市場状況の変化に従って変化する。私たちは私たちが確定した保険可能なリスクのために適切な保険範囲を得るために努力している;しかし、私たちは保険可能なリスクを正確に予測したり定量化することができないかもしれないし、私たちは適切な保険範囲を得ることができないかもしれないし、私たちは発生する可能性のある保険事件を保険するつもりだから、保険会社は対応できないかもしれない。私たちは、ネットワークセキュリティ事件に遭遇したときに発生する可能性のある潜在的な財務損失を保証する個別のネットワークセキュリティビジネス保険証を提供しません。伝統的な会社の保険のほとんどの領域に関連する保険市場状況は迅速に変化し、より高い保険コスト、より高い保険請求額とより低い保険限度額を招く可能性がある。いくつかのリスクについては、コストまたは獲得性の理由で、私たちは保険カバー範囲を持っていないか、またはないかもしれない。
私たちのいくつかの開発と商業化協定によると、私たちは今も未来も製品責任保険を維持しなければならない。私たちは責任による損失から私たちを守るために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。成功した製品責任クレームまたは一連の私たちに対するクレームは、私たちの運営、業務、名声に悪影響を及ぼす可能性があります。また、是非曲直や最終結果にかかわらず、製品責任クレームは、私たちの商業的名声の損傷、臨床研究参加者の脱退、関連訴訟によるコスト、管理層の私たちの主要業務に対する注意力の分散、監督管理機関の調査、患者や他のクレーム者が巨額のお金の奨励を得ること、私たちの候補製品を商業化することができず、商業販売への使用が許可された場合、私たちの候補製品に対する需要は減少する可能性がある。
もし私たちの候補製品が監督管理によって承認されれば、私たちと私たちの協力者は持続的なFDA義務と持続的な規制審査、例えば持続的な安全報告の要求を受け、私たちと私たちの協力者はまた追加のFDA上場後の義務や新しい法規の制約を受ける可能性があり、これらはすべて巨額の費用を招き、私たちと私たちの協力者を制限する可能性がある’私たちの潜在的な薬物を商業化する能力です
私たちの候補製品によって得られた任意の規制承認は、この薬剤が発売される可能性のある指定された用途によって制限されるか、またはコストが高い可能性のある発売後の後続研究の要求を含む可能性がある。さらに、FDAが私たちの任意の候補製品を承認した場合、薬物のラベル、包装、有害事象報告、保存、広告、販売促進、および記録保存は、広範な規制要件を受けるであろう。その後、予期されない深刻なまたは頻度の有害事象を含むが、以前に臨床前研究または臨床研究で観察された軽微と考えられる有害事象を発見することは、実際にはより深刻な問題を構成しており、薬物のマーケティングが制限される可能性があり、その薬剤を市場からリコールすることを含む可能性がある、以前に未知の問題が発見された。
FDAの政策は変わる可能性があり、政府は追加的な法規を公布し、私たちの候補製品に対する規制承認を阻止または延期するかもしれない。米国や海外の将来の立法や行政行動によって生じる可能性のある不利な政府規制の可能性、性質、程度を予測することはできない。もし私たちが規制コンプライアンスを維持できなければ、私たちは罰金、一時停止、規制承認の撤回、製品のリコール、製品の差し押さえ、運営制限、刑事起訴を受けるかもしれない。このような事件は私たちの製品を販売することを阻止するかもしれません。私たちの業務は影響を受けるかもしれません。
公布と将来の立法は、候補製品の商業化の難しさとコストを増加させ、候補製品のために獲得できる価格を下げることができるかもしれない。
医療システムに関する法律や法規の変化および将来の変化は、候補製品の上場承認を阻止または延期し、承認後の活動を制限または規制したり、マーケティング承認された候補製品を収益的に販売する能力に影響を与える可能性があります。
米国では,2003年の“連邦医療保険処方薬,改善と近代化法案”(“連邦医療保険現代化法案”)が連邦医療保険D部分計画を構築し,この計画の下で任意の治療種別に含まれる薬物数を制限することを許可した。連邦医療保険現代化法案は、コスト削減の取り組みを含め、私たちが承認された任意の製品のカバー範囲と販売率を制限する可能性がある。個人支払者は,自分の精算料率を設定する際に連邦医療保険カバー政策や支払制限に従う可能性があり,個人支払者の支払制限が類似している。
“医療·教育和解法案”により改正された“患者保護·平価医療法案”、または総称して“平価医療法案”と呼ばれ、その他を除いて、ブランド候補処方薬を生産または輸入した会社に高額な年会費を徴収する。医療保険の入手ルートを広げ、医療支出の増加を減少または制限し、医療詐欺や乱用に対する救済措置を強化し、医療保険業界に新たな透明性要件を増加させ、追加の医療政策改革を実施することを目的とした多くの条項も含まれており、これらの改革はいずれも私たちの業務に実質的な悪影響を及ぼす可能性がある。多くの条項はまだ発効していないか、あるいは最近発効したが、“平価医療法案”は薬品定価に下振れ圧力を与える可能性があり、特に連邦医療保険計画の下で、私たちの監督管理負担と運営コストを増加させる可能性がある。
平価医療法案および将来的に採用される可能性のある他の医療改革措置は、より厳しい保険基準をもたらす可能性があり、承認された任意の製品の価格に追加の下振れ圧力を与え、将来の収入を深刻に損なう可能性がある。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、収入を創出し、利益を達成し、製品の商業化を実現する能力を損なう可能性がある。“平価医療法案”は高度に複雑な立法であり、変化が続いている。私たちは私たちの業務または私たちの薬品に対する“平価医療法案”のすべての影響と潜在的な影響を理解したり予測したりすることができない。
2022年のインフレ削減法案(IRA)の目標は、医薬品支出の削減と医薬品獲得可能性の増加を目的としたいくつかの条項が含まれている米国人の医療コストを低減することだという。具体的には、アイルランド共和軍は、連邦政府と薬品メーカーに連邦医療保険B部分とD部分がカバーするいくつかのブランド、単一由来の薬品について薬品メーカーと“最高公平価格”を交渉することを要求することで、薬品価格交渉を導入した。また、アイルランド共和軍は価格上昇を処罰し、ブランド、単一由来薬品に必要な割引を拡大した。Ireland共和軍は非常に複雑な立法であり、変化が続いている。私たちはIRAが私たちの業務や私たちの薬物に対するすべての影響と潜在的な影響を理解したり予測したりすることもできないし、しかし、私たちは現在、アメリカで承認されれば、IRAが私たちの候補製品のために得られる価格を下げるかもしれないと信じている。
医療保健提供者、医師、支払人は、私たちが市場で承認される可能性のある任意の候補製品を推薦し、処方する際に主要な役割を果たしている。私たちの現在または将来の支払者や顧客との手配は、私たちがマーケティング、販売、流通を制限する可能性があり、マーケティングの承認を得る可能性のある任意の候補製品の業務または財務的配置と関係を制限する可能性がある広範な詐欺や乱用、および他の医療法律および法規に直面する可能性があります。私たちが医療サービスの紹介を制御したり、Medicare、Medicaid、または他の第三者支払者に直接課金することはありませんが、詐欺や乱用、および患者の権利に関する連邦および州医療法律法規は現在も将来も私たちの業務に適用されます。適用される連邦、州、外国の医療法律法規の制限は、私たちの運営能力に影響を与え、私たちをリスク分野に暴露させるかもしれません
| ● |
連邦反リベート法規は、他の事項に加えて、個人の転転または購入を誘導または奨励し、任意の商品またはサービスを注文または推薦するために、故意に直接または間接的に現金または実物の形態で報酬を要求、提供、受け入れ、または提供することを禁止し、これらの商品またはサービスは、連邦および州医療保健計画(例えば、MedicareおよびMedicaid)に従って支払うことができる。個人またはエンティティは、法規または法規違反の具体的な意図を実際に知る必要がなく、違反を実施することができる |
| ● |
FCAは、故意に連邦政府に虚偽または詐欺的な支払い要求を提出するか、または虚偽陳述によって連邦政府への支払いの義務を回避、減少または隠蔽する個人または実体に刑事および民事処罰を適用し、民事告発者または刑事訴訟を含む。また、政府は、“反リベート法”については、連邦“反リベート条例”違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言できる |
| ● |
HIPAAは、任意の医療福祉計画を詐欺する計画を実行したり、医療事項に関連する虚偽の陳述をしたりすることに刑事·民事責任を課す。連邦反リベート法規と同様に、個人または実体は法規を実際に理解する必要がなく、任意の医療福祉計画またはその計画に違反する具体的な意図を詐欺することができ、違反行為を実施することができる |
| ● |
2009年に“衛生情報技術促進経済·臨床衛生法”及びその実施条例により改正された“HIPAA”は、個人が識別可能な健康情報のプライバシー、安全、伝送を保護する上で、契約義務条項を含む個人識別可能な健康情報を使用または開示するサービスに関連し、いくつかのカバーされた実体医療保健提供者、健康計画および医療情報交換所およびその業務パートナーに義務を課すことも規定されている |
| ● |
連邦法律は、連邦公開支払い計画に従って、一般に陽光法案と呼ばれる他のマーケティング活動を規制する州および外国の法律を含む、医師および他の医療提供者への支払いおよび他の価値移転に関する情報、ならびに医師およびその直系親族が所有する所有権または投資権益を報告することを医薬品製造業者に要求する |
| ● |
上記の法律の州および外国対応法律は、州反リベートおよび虚偽請求法を含み、販売またはマーケティング手配および民間保険会社を含む非政府支払人によって償還される医療項目またはサービスに関するクレームに適用可能であり、州法律は、製薬会社に製薬業界の自発的コンプライアンスガイドラインおよび連邦政府が公布した関連コンプライアンスガイドラインを遵守することを要求するか、または医療保健提供者への費用の支払いを他の方法で制限することができ、場合によっては健康情報のプライバシーおよび安全を管理する州および外国法律であり、多くの法律は重大な点で互いに異なり、HIPAAは先制者がいないことが多く、コンプライアンス作業を複雑化させる。 |
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。それにもかかわらず、政府当局は、私たちの業務実践は、現在または将来、詐欺および乱用または他の医療保健法律および法規を適用する現行または将来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの運営がこれらの法律または任意の他の私たちに適用される可能性のある政府法規に違反していることが発見された場合、私たちは重大な民事、刑事と行政処罰、損害賠償、罰金、監禁、政府援助の医療計画(例えばMedicareおよびMedicaid)から除外され、私たちの運営を削減または再構成する可能性がある。
私たちの知的財産権に関するリスクは
もし私たちがどの候補製品のために十分な特許保護を得ることができなければ、私たちの競争相手は私たちと類似または同じ製品を開発し、商業化する可能性があり、私たちが開発する可能性のある任意の候補製品を商業化することに成功する能力は不利な影響を受ける可能性がある
私たちの成功は、私たちの特許候補製品と私たちが開発する可能性のある他の技術に関連する米国および他の国で特許保護を獲得し、維持する能力に大きく依存する。私たちは、私たちのコア計画や候補製品、および私たちの業務に重要な他の技術に関する特許出願を米国と海外に提出することで、私たちの独自の地位を保護することを求めています。私たちの候補製品が早期または臨床開発段階にあることを考慮して、私たちの候補製品のいくつかの側面での知的財産権の組み合わせも初期段階にある。私たちはすでに私たちの技術およびコア製品候補について特許出願を提出しようとしているが、そのような特許出願がライセンス特許として発行される保証はない。さらに、場合によっては、私たちの技術および製品候補のいくつかの態様についてのみ仮特許出願を提出し、これらの臨時特許出願のいずれも、適用される臨時特許出願が提出された日から12ヶ月以内に非仮特許出願が提出されるまで、発行された特許となる資格がない場合がある。この時間内に非一時的特許出願を提出できなかったいかなる行為も、関連する一時的特許出願に開示された発明を特許保護する能力を失う可能性がある。
さらに、場合によっては、コアプログラムおよび候補製品、ならびに私たちのビジネスに重要な他の技術に関連する他の組み合わせの発行されたクレームを得ることができず、そのようなコアプログラム、候補製品、および他の技術を保護する使用方法および/または製造方法を含む特許出願を提出する必要がある可能性がある。このような特許出願がライセンス特許として発行されることは保証されず、たとえ彼らが確かに特許出願を発行したとしても、これらの特許主張は、我々の競争相手のような第三者を阻止するのに十分ではない可能性がある。私たちのコア計画および候補製品に関連する特許保護を獲得または維持できなかった場合、私たちの業務、財務状況、運営結果、および成長の見通しに重大な悪影響を及ぼす可能性があります。
診断方法をめぐるアメリカの知的財産権は複雑で、絶えず発展する法律領域であり、私たちはアメリカで私たちの研究診断製品候補製品SavaDxに対する有効な特許主張を得ることができないかもしれない。
診断方法をめぐる知的財産権法制度は非常に複雑で,依然として不確定であり,発展し続けている。米国では,特許裁判所は現代の特許資格を診断する明確な方法を定義しようと努力してきた。米国最高裁判所の判例法解釈は診断学分野のいくつかの重要な科学を進歩させて有効な特許主張を得られない。2012年、最高裁は、血液検査結果と患者の健康との相関に関する簡単なプロセスが特許要件を満たしていないと判断した。それ以来、連邦巡回裁判所、地域裁判所、および特許裁判および控訴委員会の裁決を含む異なる裁判所の異なる結果は、診断方法特許権利主張の資格を決定するために、時々曖昧または相互衝突する法的枠組みを創出し続けている。したがって、SavaDxが効果的な特許保護を得るために、現在の米国の法的枠組みにどのように適応するかを決定することはできない。我々は現在、米国におけるSavaDxの特許または特許出願を有しておらず、米国では商業秘密、技術的ノウハウ、および他の独自の権利技術によってのみ保護されている可能性があると考えている。また,診断方法に関する宣言は実行が困難である可能性がある.保護された診断において特許侵害を発生させるためには、特許方法は、通常、1人で全体的に実施されるか、または複数の当事者によって単一の当事者の制御または指導の下で実施されなければならない。したがって,SavaDxのために有効な特許主張を発表しても,潜在的な侵害主張を実行することは非現実的で不可能であり,さらには望ましくない可能性がある.
法廷または米国または海外の行政機関で疑問が提起された場合、私たちの候補製品および他の技術に関連する発行された特許は、無効または実行不可能と認定される可能性がある
もし私たちが候補製品または他の技術をカバーする特許を強制的に執行するために第三者に対して法的訴訟を提起した場合、被告は主張した特許を無効または強制執行できないと反訴することができる。米国や他の管轄区の特許訴訟では、被告が無効または実行不可能と主張する反訴はありふれている。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.第三者は,訴訟の範囲外であっても,米国や海外の行政機関に我々の特許の有効性や実行可能性を疑問視するクレームを出すことができる.この仕組みには再審査、贈与後審査、各方面間 審査手続き、介入手続き、派生手続き、外国司法管轄区の同等の手続き(例えば、反対手続き)。このような訴訟は、私たちの候補製品または他の技術をカバーしないように、私たちの特許が撤回、キャンセル、または修正される可能性がある。法的に無効と実行不可能と断言された後の結果は予測できない。例えば、有効性の問題については、私たちは無効な以前の技術がないことを確認することはできないが、私たちまたは私たちの許可パートナーと特許審査員は起訴中にこれを知らない。もし第三者が無効または強制不可能な法的主張を獲得した場合、私たちは私たちの候補製品または他の技術の少なくとも一部さらにはすべての特許保護を失うだろう。このような特許保護の喪失は、私たちの業務、財務状況、運営結果、および成長の見通しに実質的な悪影響を及ぼすだろう。
もし私たちが開発する可能性のある候補製品のために特許期間の延長とデータ独占権を得なければ、私たちの業務は実質的に損害を受ける可能性がある
FDAが私たちが開発する可能性のある任意の候補製品の上場承認の時間、期限、および詳細によれば、私たちの1つ以上の米国特許は、1984年の“薬品価格競争および特許期限回復法”(Hatch-Waxman Act)に従って限られた特許期間を延長する資格があるかもしれない。ハッジ·ワックスマン法は、FDA規制審査中に失われた特許期間の補償として、特許期間を最大5年間延長することを許可している。1つの特許期間の延長は、製品が承認された日から計14年の期間を超えてはならず、1つの特許を延長することしかできず、承認された薬物、その使用方法又はその製造方法に関する請求項を延長することしかできない。一部の外国国·地域では、例えばヨーロッパでは、補完特許証明書に基づいて、規制審査中に失われた特許期間の補償として同様の延長を得ることもできる。しかし、私たちは、テスト段階または規制審査中に職務調査を行わなかったこと、適用された最終期限内に出願を提出できなかったこと、関連する特許が満了する前に出願を提出できなかったこと、または適用要件を満たしていなかったことなどの理由で、米国および/または他の国および地域で延期許可を得ることができない可能性がある。しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長を得ることができない場合、あるいはどのような延長の期間が私たちが要求しているよりも短い場合、私たちの競争相手は私たちの特許が満了した後に競争製品の承認を受ける可能性があり、私たちの業務、財務状況、運営結果、成長の見通しは実質的に損なわれる可能性がある。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう
私たちの候補製品および他の技術のための特許出願に加えて、私たちは、ビジネス秘密および秘密保護協定によって、私たちの非特許ノウハウ、技術、および他の固有情報を保護し、私たちの競争的地位を維持します。私たちはビジネス秘密と技術的ノウハウが私たちの知的財産権の主要な源の一つだと思う。ビジネス秘密と技術的ノウハウを保護することは難しいかもしれない。私たちは時間の経過とともに、私たちの商業秘密と技術ノウハウが独立して開発、記述方法の定期刊行物文章を発表し、人員が学術職から業界科学職に移って業界内に伝播することを望んでいる。
私たちは、私たちの従業員、会社協力者、外部科学協力者、CRO、CDMO、コンサルタント、コンサルタント、および他の第三者のような、これらの秘密にアクセスする権利のある当事者と秘密協定を締結することによって、これらの商業秘密および他のノウハウの保護を求めています。また、私たちの従業員およびコンサルタントと秘密および発明または特許譲渡協定を締結し、私たちの従業員が前の雇用主の独自の情報や技術を私たちまたは彼らの仕事に持ってこないように訓練し、前の従業員が退職した時に守秘義務を注意するように訓練した。私たちは私たちが可能であるか、または私たちの商業秘密またはノウハウとプロセスに接触したすべての当事者とこのような合意に到達したことを保証することができない。私たちは努力したにもかかわらず、どちらも合意に違反し、私たちのビジネス秘密を含めて私たちの固有の情報を漏洩する可能性があり、私たちはこのような違反について十分な救済措置を得ることができないかもしれない。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。もし私たちの任意の商業秘密が競争相手または他の第三者によって合法的に取得または独立して開発された場合、私たちは彼らがその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちの任意の商業秘密が競争相手または他の第三者に漏洩された場合、または競争相手または他の第三者によって独立して開発された場合、私たちの競争地位は実質的かつ不利な損害を受けるだろう。
もし私たちのどの特許出願もどの管轄区でも特許として発行されていなければ、私たちは効果的に競争できないかもしれない
特許法または米国および他の国/地域におけるその解釈の変化は、私たちの発明、取得、維持、および私たちの知的財産権を保護する能力を弱める可能性があり、より広く言えば、私たちの知的財産権の価値に影響を与えたり、候補製品に関する私たちの特許の範囲を縮小したりする可能性がある。私たちの候補製品に関連する知的財産権については、私たちが現在出願している特許出願が任意の特定の司法管轄区域で特許として発行されるかどうか、または特許が発行された任意の権利主張が競争相手または他の第三者の攻撃から十分な保護を提供するかどうかを予測することはできません。
特許訴訟プロセスは高価で、時間がかかり、複雑であり、私たちは合理的なコストまたはタイムリーな提出、起訴、維持、またはすべての必要または望ましい特許出願を実行できないかもしれない。我々の研究開発成果における出願可能な特許の側面をタイムリーに決定できず,特許保護を得ることができない可能性もある.私たちは、私たちの従業員、外部科学協力者、CRO、CDMO、コンサルタント、コンサルタント、および他の第三者など、私たちの研究開発成果にアクセスできる機密または特許可能な当事者と秘密および秘密協定を締結していますが、これらの当事者のいずれも、合意に違反し、特許出願を提出する前にこのような成果を開示し、特許保護を求める能力を危険にさらしている可能性があります。さらに、有効かつ強制的に実行可能な特許を取得して保持する能力は、私たちの発明と従来技術との差が、私たちの発明が特許を取得することを可能にするかどうかに依存する。さらに、科学文献における発見発表は、実際の発見よりも遅れがちであり、米国および他の管轄区域の特許出願は、通常、出願後18ヶ月後に公表されるか、または場合によっては全く公表されない。したがって、私たちは、私たちが私たちの任意の特許または係属中の特許出願で保護を要求した最初の発明であるか、または私たちがそのような発明のために特許保護を申請した最初の会社であることを確認することができない。
もし私たちが獲得した任意の特許保護の範囲が十分に広くない場合、あるいは私たちがいかなる特許保護を失った場合、競争相手が類似または同じ技術および候補製品を商業化する能力が悪影響を受けることを阻止する
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの未解決および将来の特許出願は、私たちの候補製品または他の技術を保護する特許の発行、または他社が競争技術および候補製品を商業化することを効果的に阻止する特許をもたらすことができないかもしれません。
また,特許出願に要求されるカバー範囲は特許発行前に大幅に縮小することができ,その範囲は特許発行後に再解釈することができる.私たちが現在または未来に所有している特許出願が特許の形で発表されても、それらは私たちに任意の意味のある保護を提供し、競争相手または他の第三者が私たちと競争することを阻止し、または他の方法で私たちにどんな競争優位性を提供してくれるかの形で発表されることはない。私たちが権利を持っているどの特許も第三者によって挑戦され、範囲が縮小され、回避され、または無効にされる可能性がある。したがって、候補製品または他の技術が効果的かつ実行可能な特許によって保護されるかどうか、または保護され続けるかどうかは分からない。私たちの競争相手または他の第三者は、類似または代替技術または製品を非侵害的に開発することによって、私たちの特許を回避することができ、これは、私たちの業務、財務状況、運営結果、および成長の見通しに大きな悪影響を及ぼす可能性があります。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、我々の特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。私たちは、第3の方向の米国特許商標局(USPTO)の既存技術の発行前提出、または参加反対、派生、撤回、再審査、許可後、および各方面間私たちの特許権に挑戦する他の似たような手続き、妨害手続き。このような提出、訴訟、または訴訟における不利な裁決は、そのような特許権の範囲を縮小するか、または無効または実行できない可能性があり、第三者が私たちの候補製品または他の技術を商業化し、私たちに支払うことなく直接私たちと競争することを可能にしたり、第三者特許権を侵害することなく製品を製造または商業化することができなくなる可能性がある。さらに、私たちは、発明の優先権を決定するために、米国特許商標局が発表した干渉手順に参加しなければならないか、または特許付与後の挑戦手順において、例えば、外国特許庁の反対意見において、私たちの特許および特許出願について私たちの発明優先権または他の特許可能な特徴に挑戦しなければならないかもしれない。このような挑戦は、特許権の喪失、排他性の喪失、または特許主張の縮小、無効または実行不能をもたらす可能性があり、これは、他人が類似または同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または候補製品および他の技術の特許保護期間を制限する可能性がある。最終的な結果が私たちに有利であっても、このような手続きは大量のコストを招く可能性があり、私たちの科学者と経営陣に多くの時間がかかる必要がある。このような許可は、商業的に合理的な条項によって提供されないか、または全く提供されない場合があり、または非排他的である可能性がある。もし私たちがそのようなライセンスを取得して維持できなければ、私たちが開発する可能性のある1つまたは複数の候補製品の開発、製造、商業化を停止する必要があるかもしれない。排他性を失ったり、私たちが所有して許可したりする特許主張を縮小することは、他の人が類似または同じ技術および製品を使用または商業化することを阻止する能力を制限するかもしれない。
さらに、新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちの知的財産権は他の人たちが私たちと似ているか同じ製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
私たちは世界各地で私たちの知的財産権と固有の権利を保護できないかもしれない
世界各地で私たちの候補製品や他の技術出願、起訴、特許保護の費用は目を引くほど高く、外国の法律はアメリカの法律のように私たちの権利を保護できないかもしれない。
したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して彼ら自身の製品を開発することができ、また私たちの特許保護を持っている地域に他の侵害製品を輸出することもできますが、法執行力はアメリカほど強くありません。これらの製品は私たちの製品と競争する可能性があり、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許、商業秘密、および他の知的財産権保護、特にバイオテクノロジー製品に関する保護の実行に賛成せず、私たちの特許を侵害したり、私たちの知的財産権および独自の権利に違反する競争製品を販売することを阻止することを困難にする可能性がある。外国の管轄区域で私たちの知的財産権と独自の権利を強制的に執行する訴訟手続きは巨額のコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移すことは、私たちの特許を無効または狭義に解釈されるリスクに直面させる可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちの知的財産権および独自の権利を世界各地で強制的に実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネス的優位性を得るのに十分ではないかもしれません。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある
私たちが所有または許可している特許及び出願の有効期間内に、定期維持費、継続費、年会費、各種他の政府特許及び出願費用は、米国特許商標局及び米国以外の様々な政府特許機関に支払われる。米国特許商標局および様々な非米国政府機関は、特許出願過程において、いくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。場合によっては、不注意は、滞納金を支払うことによって、または規則を適用する他の方法によって救済することができる。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効される可能性があり、それにより、関連法ドメインの特許権の一部または全部が失われる可能性がある。この場合、潜在的な競争相手は、同様または同じ製品または技術で市場に参入する可能性があり、これは、私たちの業務、財務状況、運営結果、および成長見通しに実質的な悪影響を及ぼす可能性がある。
米国特許法の変化は特許の全体的な価値を低下させ、製品を保護する能力を弱める可能性がある
米国特許法または特許法解釈の変化は、特許出願をめぐる起訴および発行された特許の実行または弁護の不確実性およびコストを増加させる可能性がある。特許性の他の要件が満たされていると仮定すると,2013年3月までに,米国では,まず発明により保護された発明を発明した者が特許を取得する権利があり,米国以外では,最初に特許出願を提出した者が特許を取得する権利がある。2013年3月以降、2011年9月に公布された“ライシー·スミス米国発明法”(“米国発明法”)によれば、米国は第1の発明者から出願制に移行し、この制度の下で、他の特許性要件を満たすと仮定すると、最初に特許出願を提出した発明者は、第三者が第1の発明によって要求された発明であるか否かにかかわらず、発明の特許を取得する権利がある。2013年3月以降に米国特許商標局に特許出願の第三者を提出したが、我々の前に、当該第三者が発明を行う前に本発明を作成したとしても、我々の発明をカバーする特許を付与することができる。これは私たちが発明から特許出願までの時間を知ることを要求する。米国およびほとんどの他の国の特許出願は、提出後または発行前の一定期間秘密であるため、私たちは、私たちの候補品または他の技術に関連する特許出願または(Ii)発明が私たちの特許または特許出願に要求される任意の発明を最初に(I)提出する会社であることを決定することができない。
“米国発明法”も特許出願の起訴方式や特許訴訟に大きな影響を与えている。これは、第三者が特許訴訟中に米国特許商標局に以前の技術を提出することを可能にすることと、米国特許商標局によって管理される許可後プログラム(ライセンス後審査を含む)が特許有効性を攻撃することを可能にする追加のプログラムとを含む各方面間 審査と派生手続き。USPTO訴訟における証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続において、USPTOが権利請求を無効にするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって,第三者は米国特許商標局の手続きを用いて我々の特許主張の無効を宣言しようとする可能性があり,第三者が地域裁判所訴訟で最初に被告として疑問を提起すれば,我々の特許主張は無効ではない.したがって、米国発明法およびその実施は、私たちの特許出願をめぐる起訴および私たちが発行した特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらは、私たちの業務、財務状況、運営結果、および成長の見通しに実質的な悪影響を及ぼす可能性がある。
また、薬品研究開発と商業化における企業の特許地位は特に不確定である。米国最高裁判所の様々な裁決は、場合によっては特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。この一連の事件は特許取得後の有効性と実行可能性の面で不確実性をもたらしている。米国議会、連邦裁判所、および米国特許商標局の将来の行動によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、私たちの既存の特許の組み合わせおよび私たちの将来の知的財産権の保護と実行能力に重大な悪影響を及ぼす可能性がある。
私たちは私たちの特許と他の知的財産権発明権のクレームに疑問を受けるかもしれない
私たちは、発明者または共同発明者として、元従業員、科学協力者、または他の第三者から、私たちの特許、商業秘密、または他の知的財産権の利益について告発されるかもしれない。例えば、私たちは、従業員、コンサルタント、または私たちの候補製品または他の技術の開発に参加する他の技術者の義務衝突によって在庫紛争が生じる可能性があります。訴訟は、これらおよび他の私たちに挑戦する特許、商業秘密、または他の知的財産権の在庫または所有権のクレームに対抗するために必要かもしれない。このようなクレームの弁護に失敗した場合、金銭損害賠償の支払いに加えて、私たちの製品候補製品や他の技術に重要な知的財産権の独占所有権や使用権など、貴重な知的財産権を失う可能性があります。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。上記のいずれも、我々の業務、財務状況、経営結果、成長見通しに重大な悪影響を及ぼす可能性がある。
私たちは私たちの候補製品や他の技術の必要な権利を得ることに成功できないかもしれない
神経変性治療分野で我々と競合する製薬会社、バイオテクノロジー会社、学術機関の多くは特許を出願している可能性があり、我々の業務に関連する可能性のある特許出願を提出することが可能である。これらの第三者特許の侵害を回避するためには、これらの第三者知的財産権所有者からこのような特許の許可を得ることが必要または慎重であることが発見される可能性がある。私たちはまた、未来の候補製品と一緒に使用するために、第三者からのいくつかの技術的ライセンスが必要かもしれない。また、私たちが第三者と共同で所有している任意の特許については、当該共同所有者の当該特許等の利益の許可を得ることを望んでいる可能性がある。しかし、私たちは、このようなライセンスを取得することができないか、または他の方法で第三者から当社の将来の候補製品に必要と考えられる任意の成分、使用方法、プロセス、または他の知的財産権を取得することができないかもしれません。第三者知的財産権の許可または買収は競争分野であり、より多くの老舗企業は、魅力的または必要と考えられる第三者知的財産権許可または買収戦略をとることができる。これらの老舗会社はその規模、資本資源及び更に強い臨床開発と商業化能力のため、私たちより競争優位を持っているかもしれない。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資を適切なリターンを得るための条項で許可したり、第三者の知的財産権を取得することができないかもしれないし、全くできないかもしれない。もし私たちが必要な第三者知的財産権を得ることに成功したり、私たちの既存の知的財産権を維持することができなければ、関連計画や候補製品の開発を放棄しなければならないかもしれません。これは、私たちの業務、財務状況、運営結果、および成長の見通しに実質的な悪影響を及ぼす可能性があります。
私たちは、私たちの従業員、コンサルタント、またはコンサルタントが、彼らの現在または前任者のいわゆるビジネス秘密を誤って使用または開示したり、私たち自身の知的財産権を持っていると主張したりする可能性があり、これは私たちの候補製品の開発を阻害したり延期したりする可能性がある
神経変性疾患を開発する革新分野の競争は激しく、活力に満ちている。我々と我々の競争相手を含むいくつかの会社が重点研究·開発を行っているため、この分野の知的財産権構造は変化しており、将来はまだ不確定である可能性がある。また,我々の底層科学技術を利用した製品は市場に進出していない.したがって、将来的には知的財産権に関する重大な訴訟と、私たちおよび他の第三者、知的財産権、独自の権利に関する訴訟があるかもしれない。
私たちの多くの従業員、コンサルタント、そしてコンサルタントは現在あるいは以前、私たちの競争相手と潜在的な競争相手を含む大学や他のバイオテクノロジーや製薬会社に雇われています。私たちは、私たちの従業員、コンサルタント、およびコンサルタントが、私たちのために働いているときに他人の固有情報またはノウハウを使用しないことを保証するために努力しているが、私たちは、商業秘密または他の固有情報を含む、私たちまたはこれらの個人が、商業秘密または他の固有情報を含む任意のそのような個人の現職または前任雇用者の知的財産を使用または開示しているという疑惑を受ける可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
知的財産権の譲渡は自動的に実行されない可能性があり、あるいは譲渡協定が違反される可能性があり、私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起する可能性のあるクレームを弁護したりすることができます。
私たちのビジネスの成功は、私たちが開発した任意の候補製品を開発、製造、マーケティング、販売する能力と、第三者特許および他の知的財産権を侵害、流用、または他の方法で侵害することなく、私たちの独自技術を使用する能力にある程度依存します。バイオテクノロジーおよび製薬業界では、特許および他の知的財産権に関する複雑な訴訟や、米国特許商標局における干渉、派生および再審手続き、または外国司法管轄区における反対および他の同様の手続きを含む特許に挑戦する行政訴訟が数多くある。私たちはその是非曲直にかかわらず、このような行動の一方になるか、あるいは未来にそのような行動の脅威を受けるかもしれない。上述したように、最近、特許改革と呼ばれる米国法の変化により、新たなプログラムには各方面間審査と贈与後審査が実施されました。上述したように、この改革は私たちの特許に未来に挑戦する可能性の不確実性を増加させる。
我々が我々の候補製品を開発している分野には,大量の米国や外国から発行された特許と,第三者が所有する未解決特許出願が存在する.バイオテクノロジーや製薬業界の拡張や特許の発行に伴い,我々の候補製品や他の技術は他人の特許権侵害のクレームを引き起こすリスクが増加する可能性がある。私たちは第三者の特許や他の知的財産権を侵害していないと信じていますが、私たちの候補製品と、私たちが開発している、開発中、または将来開発されている可能性のある他の技術が、第三者が所有している既存または未来の特許を侵害しないことを保証することはできません。私たちは、私たちの候補製品または他の技術をカバーする成分、配合、製造方法、または使用または処理方法のクレームを含む、現在または将来の候補製品または他の技術が保有する可能性のある特許を侵害することを主張する可能性がある候補製品分野の競争相手のような、第三者に発行された特許を知らないかもしれない。私たちは第三者が持っている特許を知っていますが、これらの特許は私たちの候補製品や他の技術とは関係なく、私たちの候補製品や他の技術によって侵害される可能性もあると思います。さらに、特許出願が発行されるまでに数年かかる可能性があるため、現在処理されている特許出願が存在する可能性があり、これらの出願は、我々の候補製品または他の技術が発行された特許を侵害する可能性がある。
第三者の告発に対抗するために訴訟に参加することは、私たちが彼らの特許や他の知的財産権を侵害したり、他の方法で侵害したりすることに非常に高価であり、特に私たちのような規模の会社には時間がかかる。私たちのいくつかの競争相手は私たちよりも訴訟や行政訴訟の費用を効率的に負担するかもしれない。なぜなら私たちはより多くの財政資源を持っているからだ。特許訴訟と他の訴訟もまた多くの管理時間を取るかもしれない。私たちに対する特許訴訟や他の訴訟を開始して継続することによって生じる不確実性は、市場での私たちの競争能力を弱めるかもしれない。上記のいずれの状況の発生も、我々の業務、財務状況、経営業績、成長見通しに重大な悪影響を及ぼす可能性がある。
私たちは私たちの特許と他の知的財産権を保護したり強制したりする訴訟に巻き込まれるかもしれないが、これは高価で時間がかかり、成功しないかもしれない
競争相手は私たちの特許を侵害したり、パートナーの特許を許可したりする可能性があり、あるいは私たちは侵害クレームに対する抗弁を要求されるかもしれない。さらに、私たちの特許や私たちの許可パートナーの特許も在庫、優先権、または有効性紛争に巻き込まれる可能性があります。このような告発に反撃したり抗弁したりすることは高価で時間がかかるかもしれない。侵害訴訟では、裁判所は、私たちが利益を持っている特許が無効または強制執行できないと判断することができ、他方の特許技術の使用は特許侵害の安全港に属するか、または私たちの特許が関連技術を含まないことを理由に、他方の論争のある技術の使用を阻止することを拒否することができる。どんな訴訟手続きの不利な結果も、私たちの1つ以上の特許を無効または狭義に解釈されるリスクに直面させる可能性がある。さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。
解決策が私たちに有利であっても、知的財産権クレームに関連する訴訟や他の法的手続きは、巨額の費用を発生させ、私たちの人員の正常な責任を分散させる可能性があります。また、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスだと思う場合、私たちの普通株の価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や訴訟手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源とより成熟して発展した知的財産権の組み合わせを持っているので、このような訴訟や法的手続きの費用を私たちよりも効率的に負担するかもしれない。特許訴訟または他の訴訟の開始と継続によって生じる不確実性は、市場での競争能力に重大な悪影響を及ぼす可能性がある。
知的財産権はすべての潜在的な脅威を解決できるとは限らない
私たちの知的財産権が提供する未来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。例えば:
| ● |
他の人は、私たちの候補製品と類似した製品を製造することができるか、または同様の技術を使用することができるが、これらの製品は、私たちが所有する可能性のある特許請求の範囲内ではない |
| ● |
私たちは、私たちが現在または将来所有している発表された特許または係属中の特許出願がカバーしている最初の発明をした会社ではないかもしれない |
| ● |
私たちは最初に特許出願を提出した人ではないかもしれません。これらの出願は私たちのいくつかの発明をカバーしています |
| ● |
他の人は、私たちが持っている知的財産権を侵害することなく、類似または代替技術を開発したり、私たちの任意の技術を複製したりすることができる |
| ● |
私たちが現在または未来に処理している特許出願は発行された特許を生成しない可能性がある |
| ● |
私たちが権利を持っている発行された特許は、私たちの競争相手または他の第三者による法的挑戦を含む無効または実行不可能と認定される可能性がある |
| ● |
私たちの競争相手や他の第三者は、特許権のない国で研究や開発活動を行い、これらの活動から得られた情報を利用して競争力のある製品を開発し、私たちの主要な商業市場で販売するかもしれない |
| ● |
私たちは他の特許を申請できる独自技術を開発しないかもしれない |
| ● |
他人の特許は私たちの業務を損なうかもしれません |
| ● |
いくつかの商業秘密またはノウハウを保護するために、私たちは特許を出願しないことを選択することができ、第三者はその後、これらの知的財産権をカバーする特許を提出する可能性がある。 |
これらの事件のいずれかが発生した場合、私たちの業務、財務状況、運営結果、および成長見通しに実質的な悪影響を及ぼす可能性がある。
私たちの業務と運営に関するリスク
私たちの名声と運営は告発の不利な影響を受けるかもしれない不道徳な行為彼らの長所が何であろうと
私たちは私たちの名声が私たちの業務の成功に大きな貢献をしたと信じている。私たちはまた、研究、外部サプライヤーとの協力、合格した従業員の誘致、私たちの取締役会メンバーと科学協力者、将来の運営のための資金調達、潜在的な業界や政府協力者との協力など、私たちの名声を維持し、向上させることが、私たちの多くの核心業務に重要であると信じている。私たちの名声を維持し、向上させることは、私たちが革新的な薬物製品を開発し、信頼できる科学的データを生成し続け、私たちを批判する能力に大きく依存し、これは成功しないかもしれない。
私たちの名声は、虚偽の陳述(事実だと主張する)を散布すること、私たちの科学的データを誤って記述すること、または私たちの証券価格を下げることを求める市場参加者(“空売り者”)に関連する当事者(“空売り”)が行ったり、支払ったりする敵対行動、および上記の状況に対するメディアの報道によって損なわれる可能性がある。告発、誤った記述、あるいは類似の声明は直接私たちと相互作用する第三者に伝播される可能性があり、私たちがコントロールできないフォーラムで発表されることは、例えばオンラインソーシャルメディアチャンネルを通じて、あるいはメディア報道によって公表され、そして私たちが研究している科学或いは技術定期刊行物の編集に採用される可能性があり、定期刊行物の撤回或いは懸念を表明する可能性がある。例えば、私たちまたは私たちの従業員やコンサルタントがデータを操作したり、いかなる不当な行為に従事していないと主張する定期刊行物はありませんが、公開空売り者の告発は、いくつかの定期刊行物に著者らに関連する研究者が以前に発表したいくつかの同業者評議の文章を再評価させ、文章を撤回したり、懸念表現を発表したりするように促した
是非曲直にかかわらず、告発、誤った記述、虚偽陳述は迅速に伝播し、人々の名声に対する信頼を侵食する可能性がある。私たちの名声を維持し、向上させるには、私たちが法律行動や他の活動に大量の投資をする必要があるかもしれません。これらの投資は高価で、時間がかかり、成功しないかもしれません。もし私たちが私たちの名声を維持することに成功できなければ、あるいは私たちがこの努力で高すぎる費用を発生させた場合、私たちの業務、運営、将来の見通し、キャッシュフロー、財務状況は不利な影響を受けるかもしれない。
私たちの現在の単一供給者の薬物物質と薬物製品への依存は、候補製品を生産する能力に実質的な悪影響を与え、私たちのコストを大幅に増加させる可能性がある。
私たちは単一ソース供給者に依存して私たちの主要な候補製品Simufilamの製造に重要な材料を提供する。このような依存は私たちが十分な必要な材料供給を得ることができないかもしれないという危険に直面させる。これらの第三者がその契約義務を成功裏に履行していない場合、予想される期限内に完了できなかった場合、または規制要件に基づいてその活動を展開していない場合、またはこれらの第三者との間に相違がある場合、将来の法規提出および開発された候補製品の承認を支援するために、必要な臨床研究の完了を完了または遅延させることができない可能性がある。十分なSIMUFILAM供給をタイムリーに得ることができない場合、あるいはインフレやその他の要因によりコストが大幅に増加した場合、私たちの経営業績は重大な悪影響を受ける可能性があります。
さらに、場合によっては、私たちと契約を締結したサービスプロバイダは、私たちとの契約を終了する権利があるかもしれません。この場合、代替サービスプロバイダとの合意の決定、検証、および交渉を求めると、製品開発活動が延期される可能性がある。場合によっては、許容可能な条件で適切な代替製品を随時提供または提供することができない可能性があり、これは、我々の開発プロセスをさらに遅延させる可能性がある。Simufilamのために代替サプライヤーを探す必要があれば、生産と納品遅延を招く可能性があり、これは私たちの臨床試験の遅延を招き、私たちの業務、運営結果、財務状況に実質的な悪影響を与える可能性があります
議会は、政府閉鎖またはこれらの機関が他の妨害を受けていることを含む、食品·医薬品局、米国証券取引委員会および他の米国政府機関または同様の外国規制機関のための資金不足を提供している’運営はこれらの機関を阻害する可能性があります’重要な指導者や他の人員を採用·保留し、新製品やサービスの適時な開発や商業化を防止したり、政府機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを阻止したりする能力があり、これは私たちの業務にマイナスの影響を与える可能性がある
FDAまたは同様の外国規制機関が新製品を審査·承認する能力は、政府予算と資金レベル、キーパーソンの雇用と維持、ユーザー費用の支払いを受ける能力、法定、規制、政策変化を制定する能力を含む様々な要素の影響を受ける可能性がある。FDAや他の機関の中断も、新製品候補製品が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。
また、政府が米国証券取引委員会や私たちの業務に依存する可能性のある他の政府機関に提供する資金は、研究開発活動に資金を提供する機関を含め、政治プロセスの影響を受けており、政治プロセス自体は不安定で予測不可能であり、私たちの支配を全く受けていない。
FDAおよび他の機関の中断も、私たちとFDAが第3段階の臨床分析の重要な側面についてのコミュニケーションおよび議論を継続するのに要する時間を遅らせることができるか、または必要な政府機関によって新製品候補製品を審査および/または承認する必要があり、これは私たちの業務に悪影響を及ぼすであろう。例えば、数年前、米国政府は何度も閉店し、食品·医薬品局や米国証券取引委員会のようないくつかの規制機関は、肝心な従業員を休暇にし、肝心な活動を停止させなければならなかった。政府が長時間閉店すれば、米国食品医薬品局または米国証券取引委員会が提出した規制文書を適時に審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。また、将来的に政府の閉店は、適切な資本化と事業継続のために、私たちが公開市場に進出し、必要な資本を得る能力に影響を与える可能性がある。
FDAは薬品承認の法的要求を変えるかもしれない。
FDA業界ガイドラインはFDAが時々発表した非拘束性政策文書であり、スポンサー(例えばわが社)の候補薬物の臨床開発を支援する。このような指導文書は法的基準を制定したり、拘束力のある要求をしていないにもかかわらず、私たちを含む提案国はこれらの文書に広く従っている。さらに、指導文書がその後、互いに衝突する指導文書に置き換えられた場合、以前の指導文書を誠実に遵守する提案国は、実行行動に保証または訴えることができないであろう。著者らは現在のFDAの指導とFDAとの会議に大きく依存して、薬物開発過程におけるSimufilamの進展を推進している。FDAの既存のアルツハイマー病業界ガイドラインの任意の将来の変化は、私たちのビジネスに実質的な悪影響を及ぼす可能性があり、私たちのSimufilam薬物開発計画のために大量の時間、コストまたは複雑性を増加させるか、または一部またはすべての候補製品の開発を停止または遅延させる可能性があります。
さらに、FDA法規、法規の変化、または既存の法規および法規の解釈は、(I)私たちのSimufilamの製造スケジュールの変更、(Ii)私たちの候補製品が販売が許可された場合、製品ラベルの追加または修正、(Iii)研究臨床サイトからの私たちの候補製品のリコールまたは停止、または(Iv)追加の記録保存要件など、私たちの業務に影響を与える可能性があります。このような変化を強制的に実施する場合、それらは私たちの業務に実質的な悪影響を及ぼす可能性があり、私たちのSimufilam薬物開発計画のために大量の時間、コスト、または複雑性を増加させるか、または私たちの一部またはすべての候補製品の開発を停止または延期させる可能性があります
私たちは第三者が私たちの候補製品に材料を提供し、製造することに依存しており、私たちはそのような材料や候補製品を十分な品質または数量で得ることができない、あるいは私たちは受け入れ可能なコストでそのような供給を得ることができず、これは私たちの開発や商業化努力を延期、阻止、または損害する可能性があるというリスクがある。
私たちには何の生産施設もありません。著者らは現在、臨床前研究と臨床研究のためのすべての材料の生産はCDMOに依存しており、臨床前研究、臨床研究、および著者らが開発する可能性のある任意の候補製品の商業供給に引き続きこのようにする予定である。私たちは現在いくつかのCDMOと協力関係を構築して、私たちの候補製品を製造しています。私たちはCDMOとさらなる合意を作ることができないかもしれないし、受け入れられる条項でそうすることもできないかもしれない。たとえ第三者製造業者と合意できても、CDMOに依存することは、追加のリスクをもたらす
| ● |
第三者は製造協定に違反する可能性がある |
| ● |
第三者は、費用が高いか、または私たちに不便をもたらす時間にプロトコルを終了または更新しない可能性がある |
| ● |
法規遵守性、品質保証、安全性、薬物警戒と関連報告に第三者に依存している |
| ● |
生産に必要な数量をタイムリーに生産して品質基準を達成することはできない。 |
第三者メーカーは、米国国外のcGMP法規や同様の法規要件を遵守できない可能性があります。私たちまたは私たちのCDMOが適用された法規を遵守できなかったことは、私たちの研究が臨床的に阻害される可能性があり、罰金、禁止、民事処罰、遅延、一時停止または撤回、候補製品または候補製品の差し押さえまたはリコール、運営制限、刑事起訴を含み、これらはいずれも、私たちの候補製品の供給に重大な悪影響を与え、私たちの業務、財務状況、運営結果、成長の見通しを損なう可能性があります。
私たちが開発する可能性のあるどの候補製品も他の候補製品や製品と製造施設を競争する可能性がある。CGMP法規の下で運営されているメーカーの数は限られており、私たちのために製品を製造する能力があるかもしれない。
私たちの既存または将来の第三者製造業者の任意の性能障害は、臨床開発またはマーケティング承認を延期する可能性があります。もし私たちの既存の契約製造業者のいずれかが約束通りに契約を履行できない場合、私たちは製造業者の交換を要求される可能性があり、そのような代替製品を決定して同定する際に追加コストと遅延が生じる可能性があります。しかも、契約製造業者との生産能力の確保と保留は大きなコストを招く可能性がある。
私たちはまた、第三者が私たちの候補製品を生産するために必要な原材料を提供することに依存しており、引き続き第三者メーカーに依存して上場承認された任意の候補製品の商業供給を提供していく予定です。私たちは現在、将来的に私たちが開発する可能性のある任意の候補製品を他人に依存して生産し、私たちの将来の利益率と、私たちが適時かつ競争力のある上場承認された薬物商業化の能力に悪影響を及ぼすかもしれない。
私たちの従業員、主要な調査人員、顧問とサプライヤーは監督基準と要求を守らないこととインサイダー取引を含む不当な行為或いはその他の不当な活動に従事する可能性があります。
私たちは従業員、主要な調査者、コンサルタント、サプライヤーの詐欺や他の不適切な行為のリスクに直面している。これらの当事者の不正行為は、故意のミス、無謀および/または不注意な行為、または不正な活動、(I)FDAおよび他の規制機関の法律および法規に違反する可能性があり、これらの機関に真実、完全かつ正確な情報を報告することを要求する法律、(Ii)製造基準、(Iii)連邦および州データのプライバシー、セキュリティ、詐欺および乱用、ならびに米国および海外の他の医療保健法律法規、および(Iv)財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む可能性がある。特に、バイオテクノロジーと医療保健業界の臨床と商業配置は広範な法律と法規の制約を受け、詐欺、不当行為、リベート、自己取引とその他の乱用行為を防止することを目的としている。このような法律法規は広範囲な財政的計画、インセンティブ計画、そして他の商業的計画を制限したり禁止したりする。このような不正行為はまた個人識別可能な情報の不適切な使用に関連する可能性があり、臨床試験を行う時に得られた情報を含むが、著者らの臨床前研究或いは臨床試験中に詐欺性データを製造し、或いは薬物製品を不法に流用し、これは規制制裁を招き、著者らの名声に深刻な損害を与える可能性がある。従業員や他の第三者の不正行為を常に識別し、阻止することができるわけではなく、このような活動を発見し、防止するための予防措置は、未知または管理不可能なリスクや損失を効果的に制御することができないか、またはこれらの法律や法規を遵守できないことによる政府調査または他の行動または訴訟から私たちを保護することができない可能性がある。
さらに、誰かや政府がこのような詐欺や他の不正行為を告発する可能性があり、起こらなくてもリスクに直面している。もし私たちにこのような訴訟を提起した場合、私たちは自分たちの権利を弁護したり、維持することに成功しませんでした。これらの訴訟は、重大な民事、刑事および行政処罰、損害賠償、罰金、返還、監禁、政府援助に参加する医療計画(例えばMedicareおよびMedicaid)から除外され、追加の報告要件および監督を招く可能性があり、もし私たちが会社の誠実な合意または同様の合意の制約を受けて、これらの法律に違反した疑惑、契約損害、名声損害、および私たちの業務の削減または再編を解決するために、私たちの業務、財務状況、運営結果、および将来性にマイナスの影響を与える可能性があります。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
私たちは“取引所法案”の定期報告書の要求事項を守らなければならない。我々の開示制御および手続きは、取引所法案に基づいて提出または提供された報告書に開示されなければならない情報が蓄積され、管理層に伝達され、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されなければならないことを合理的に保証するために設計されている。任意の開示制御およびプログラムまたは内部制御およびプログラムは、発想および動作がどのように完全であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを確保することしかできないと信じている。
これらの固有の限界には,意思決定過程における判断が誤りである可能性があり,故障は簡単な誤りや人為的誤りによって発生する可能性があるという現実がある.さらに、ある人の個人的な行動、2人以上の結託、または無許可超越制御は、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤り陳述が発生し,発見されない可能性がある.
データプライバシーに関する法律を守らなければ、法執行行動のリスクに直面し、このような法律の罰を受ける可能性がある。
私たちが個人の身分情報を運営、取得、保存している各管轄区では、プライバシーとセキュリティ法律の制約を受ける可能性があります。プライバシーとデータ保護の立法と規制構造は発展し続けており、プライバシーやデータ保護問題にますます注目されており、これは私たちの業務に影響を与える可能性がある。私たちが変化する法律と法規を遵守するための持続的な努力は費用がかかるかもしれないし、私たちの政策、手続き、そしてシステムを絶えず修正する必要がある。私たちまたは私たちのパートナーやサービスプロバイダがデータ保護に関する法律を守らなければ、私たちは法執行行動のリスクに直面し、そのような法律の罰を受けるだろう。これらの法律に違反していると判断されなくても、政府のこれらの問題の調査には通常、大量の資源がかかり、負の宣伝が必要であり、これは私たちの業務、財務状況、運営結果、または将来性を損なう可能性がある。
米国内には、個人情報のプライバシーやセキュリティに関連した連邦や州法律法規が多くある。例えば、連邦レベルでは、改正された1996年の“健康保険携帯性および責任法”(HIPAA)およびその実施条例は、プライバシーおよびセキュリティ基準を確立し、個人が識別可能な健康情報または保護された健康情報の使用および開示を制限し、保護された健康情報のプライバシーを保護するために行政、物理および技術保障措置の実施を要求する。我々はHIPAAに直接拘束されている“保証エンティティ”でもなく,HIPAAに直接拘束されている“ビジネスパートナー”でもないことが確認されているが,我々とインタラクションする多くの米国のヘルスケア提供者はHIPAAに制約されており,個人情報のプライバシー保護に関する義務を担っている可能性がある.各国は個人情報のプライバシーと安全に対してますます多くの規制を行っている。例えば、2020年に施行される“カリフォルニア消費者プライバシー法案”は、会社が収集した個人資料カテゴリを開示する権利、これらの資料を収集するソースカテゴリ、消費者個人資料を収集または販売する商業目的、会社が個人資料を共有することをカバーする第三者カテゴリ、および会社が収集した特定の資料をカバーすることを要求する権利を含むカリフォルニアの消費者(すべてのカリフォルニア住民を含むと定義される)に特定の権利を与える。CCPAは,対象とする会社に,カリフォルニアの消費者にそのデータ処理活動に関する通知を提供する義務をいくつか課している.CCPAはまた,カリフォルニアの消費者にカバー会社が消費者の個人情報を削除することを要求する権利を与え,会社の個人情報の販売をカバーする能力を制限し,消費者がその個人情報を販売しないことを選択させることを含む.また、2023年に施行されたカリフォルニアプライバシー権法案(CPRA)は、特定の敏感な個人情報に対する消費者の権利を拡大することを含むCCPAの重大な改正を行い、CCPAとCPRAを実施·実行する権利を有する新たな州機関を作成した。バージニア州消費者データ保護法(CDPA)は2023年1月1日に施行された。CDPAは、対象企業が保有する彼らに関する個人情報のコピーにアクセス、修正、削除、および取得し、特定のデータ処理活動から退出することを選択することができる新しい権利を消費者に提供する。
私たちはアルツハイマー病の治療の主要な候補品を開発しました’S病,この疾患は最近新薬分子がFDAの完全承認,アルツハイマー病のすべての3期試験を得ることは少ない’S病が採用した認知および機能治療効果の終点または方法が主観的であると考えられる可能性がある場合、FDAまたは他の規制機関は、著者らの3期臨床試験または臨床試験の終点を臨床的意義のある結果の証拠または我々の臨床結果の分析が困難である可能性のあるリスクを増加させる可能性がある。
もし私たちの候補製品がFDAの審査手続きを通過すれば、FDAが私たちの候補製品の臨床治療効果と安全性を決定できるように、成功基準と終点の実現を証明する必要があるだろう。アルツハイマー病を治療する新しい方法を開発しているため、この場合、新薬承認の例は少なく、私たちの試験使用の終点または方法は主観的と考えられる可能性があるため、FDAまたは他の規制機関は、私たちの臨床試験または臨床試験の終点を患者に臨床的意義のある結果の証拠とみなすリスクが増加しないかもしれない。また,それによる臨床データや結果の解析は困難である可能性がある。FDAがわれわれの成功基準が十分に検証され臨床的意義を得ていることが確実に発見されても,あらかじめ指定された終点を統計的な閾値(すなわちp値 に到達できない可能性がある
もし私たちの1つまたは2つの第3段階試験のデータが私たちの主要候補製品の安全性または有効性を十分に証明できない場合、私たちが承認要求を満たすために努力した場合、そのような候補製品に対する規制承認が著しく遅れる可能性があり、または、これらの要求を満たすことができない場合、そのような承認は拒否される可能性がある。
我々が行っている第3段階試験では,2種類の用量(50 mgと100 mg)のシモフェランを評価している。もし私たちの第3段階試験の1つの用量のデータが安全性または有効性を十分に証明できない場合、私たちが承認要求を満たすために努力した場合、別の薬剤の規制承認が大幅に延期される可能性があり、または、これらの要求を満たすことができなければ、この承認は拒否される可能性がある。
私たちの組織の規模と能力は大幅に増加し、このような成長を効果的に管理する上で困難に直面する可能性があると予想される
私たちの発展計画と戦略の発展に伴い、私たちは多くの追加の管理、運営、財務、その他の人員を増加させると予想される。今後の成長は、経営陣のメンバーにより多くの重大な責任を負わせるだろう
| ● |
より多くの従業員を識別し、採用し、統合し、維持し、激励する |
| ● |
従業員数を増やす |
| ● |
私たちの現在と未来の候補製品の臨床およびFDA審査過程を含む、私たちの内部開発作業を効果的に管理し、同時に、請負業者および他の第三者に対する契約義務を遵守します |
| ● |
私たちの業務、財務、管理制御、報告システム、そして手続きを拡大します |
| ● |
ますます増加している運営と管理の複雑さを管理する。 |
私たちの将来の財務業績と私たちは私たちの候補製品を開発し続け、承認された後にそれを商業化する能力は、私たちが将来どのような成長を効果的に管理する能力にも部分的に依存するだろう。これらの成長活動を管理するためには、私たちの経営陣はまた、日常活動から過剰な注意を移さなければならないかもしれない。
現在、予測可能な未来に、私たちはいくつかの独立した組織、コンサルタント、およびコンサルタントに大きく依存していくつかのサービスを提供するだろう。これらの独立した組織、コンサルタント、コンサルタントのサービスが必要な時に適時に提供され続けることは保証されず、合格した代替者を見つけることも保証されない。さらに、私たちのアウトソーシング活動を効果的に管理できない場合、あるいはコンサルタントが提供するサービスの品質や正確性が何らかの理由で影響を受ける場合、私たちの臨床研究は延長、延期、または終了される可能性があり、私たちは規制機関の候補製品の承認や他の方法で私たちの業務を促進することができないかもしれません。私たちは、既存のコンサルタントを経済的に合理的な条件で管理したり、他の適任な外部請負業者やコンサルタントを見つけることができるという保証はありません。
もし私たちが新入社員を雇用し、私たちのコンサルタントや請負業者チームを拡大することで、私たちの組織を効果的に拡大することができなければ、私たちは私たちの候補製品をさらに開発するために必要な任務を実行することができないかもしれないので、私たちの研究、開発、商業化目標を達成できないかもしれません。
わが社の本社の所有権と物件賃貸は多くのリスクと不確定要素の影響を受けています。
2021年、私たちはテキサス州オースティンのオフィス総合体を全現金で購入しました。その一部は私たちの会社本部としました。この不動産の所有権はオースチン革新園有限責任会社が所有しており、同社はテキサス州の有限責任会社で、タピオカ科学会社が全額所有している。この買収には大量の前現金投資が必要であり、将来的に資源をさらに投入する必要があるかもしれない。私たちは独立した第三者と私たちのオフィス総合体の一部のレンタル者の一部を負担したり、独立した第三者と約束して、将来もそうし続けると予想されています。商業物件の所有権と関連する賃貸活動は多くの要素の影響を受け、これらの要素は重大な財務リスクと不透明な要素を構成し、テナントの違約或いはテナントが賃貸責任を支払うことができなかった。マクロ経済や他の私たちがコントロールできない要素は、私たちの所在地の賃貸オフィス空間の需要に悪影響を与えたり、わが社本社の市場価値を低下させたりする可能性があります。
2023年12月31日現在、私たちはこの物件の約25%の面積を占めており、残りの部分は賃貸するか、第三者にレンタルすることができます。ほとんどの既存のテナント賃貸契約は2024年に満期になります。2024年満期のテナント賃貸契約は、満期日後に延期、更新、再レンタルが得られない可能性が高いと考えられ、この場合、賃貸料支払いやこのようなオフィススペースの分担費用精算を受けなくなると考えられる。もし私たちが空いているオフィススペースを割引価格で借りることができない場合、あるいはこの努力の中で高すぎる費用が発生したり、過剰な賃貸改善や不動産所有費用が発生したりすれば、私たちの業務、運営、将来の見通し、キャッシュフロー、財務状況は不利な影響を受ける可能性がある。また、私たちのホテルはテキサス州オースティンの半田舎林区に位置し、極端な天気条件などの自然災害の影響を受けやすいです。洪水、竜巻、野火、冬の嵐、雷、熱波と干ばつを含むが、限らないです。このような自然災害は、私たちの物件の価値を壊したり、破壊したり、または私たちの物件のオフィス空間を借りたい、または続けることができるテナント数を減らすことができるかもしれません。私たちの不動産が自然災害にさらされているため、私たちは大量の費用を発生する可能性があり、これは私たちの業務と将来性に実質的な悪影響を及ぼすかもしれない。
我々の内部コンピュータシステムまたは私たちが依存する第三者が使用するコンピュータシステムは、障害または他の障害、ネットワーク攻撃、または情報セキュリティホールを受ける可能性があり、これらは、このようなシステムおよびデータの機密性、完全性および利用可能性を危険にさらし、私たちの開発計画および業務運営に重大な中断をもたらし、機密、財務または独自の情報のリスク開示を招き、私たちの名声に影響を与える可能性がある
私たちの正常な業務過程で、私たちは法律で保護された患者の健康情報、従業員の個人識別情報、知的財産権、および独自の業務情報を含む敏感なデータを収集して保存する。我々は、オンサイトシステムおよびクラウドベースの大量のアプリケーションおよびデータストアを使用して、当社のアプリケーションおよびデータを管理し、維持します。これらのアプリケーションおよびデータは、研究開発情報、ビジネス情報、ビジネスおよび金融情報を含む様々な業務キー情報を含む。セキュリティ対策が実施されているにもかかわらず、我々の内部コンピュータシステムおよび現在または将来のCROおよび他の請負者およびコンサルタントのコンピュータシステムは、コンピュータウイルスおよび不正アクセスによって容易に破壊される可能性がある。ネットワーク脅威構造の変化に伴い、これらのネットワーク攻撃の頻度、複雑さ、強度は増加し、検出が困難になってきている。このような攻撃は、恐喝ソフトウェアまたは他のサービス拒否を含むキーレコーダまたは他の有害および致命的なマルウェアの使用を含むことができ、悪意のあるウェブサイト、社会工学、および/または他の手段を使用して配備することができる。障害、ネットワーク攻撃、あるいは他の情報セキュリティホールが発生し、我々の運営中断を招く場合、私たちの知的財産権や財務情報を含む機密情報が流用され、我々の開発計画や業務運営に実質的な中断をもたらす可能性があります。例えば、完成された、行われている、または将来の臨床研究における臨床研究データの損失は、私たちの規制承認作業の遅延を招き、データを回復または複製するコストを著しく増加させる可能性がある。同様に、私たちは私たちの第三者研究機関の協力者に依存して私たちの候補製品を研究し、開発し、他の第三者に依存して私たちの候補製品を製造して、臨床研究を行い、私たちの臨床研究データと、彼らのコンピュータシステムに関連する類似事件を分析し、これらの事件も私たちの業務に実質的な悪影響を与える可能性がある。任意の中断またはセキュリティホールが、私たちのデータまたはシステムの損失または破損をもたらし、または私たちの関係者に関連するデータを含む機密、財務または固有情報を適切に開示しない場合、私たちは、機密、財務または独自情報の責任またはリスク開示を招く可能性があり、私たちの候補製品のさらなる開発および商業化は延期される可能性がある。当社および当社のビジネス相手側が、システムまたはデータを正常に検出、防止または完全に回復し、当社の業務および運営に悪影響を及ぼす可能性があり、および/またはキーまたは敏感なデータ損失をもたらす可能性のあるすべての障害、サービス中断、攻撃、またはシステム脆弱性を回避することは保証されません。これは、財務、法律、業務、または名声をもたらす可能性があります。
私たちの第三者への依存は、私たちの固有情報を共有することを要求し、これは、競争相手がこれらの情報や私たちの固有情報が流用されたり、無意識に開示されたりする可能性を発見する可能性を増加させる。
第三者サプライヤーへの私たちの依存は、競争相手がこれらの情報または私たちの固有情報を発見し、私たちが意図しない場合に流用または開示されるリスクを増加させる可能性がある当社の独自情報をこれらの当事者に開示することを要求します。もしこれらの事件のいずれかが発生した場合、私たちが特許保護または他の知的財産権を得る能力は取り返しのつかない脅威を受ける可能性があり、費用が高く、注意を分散させる訴訟が伴う可能性がある。また、これらの第三者サプライヤーが運営を停止した場合、代替サプライヤーを迅速に見つけることができなかったり、私たちの製品や候補製品に関する情報やプロジェクトを紛失したりして、私たちの開発計画が延期される可能性があります。私たちは第三者パートナーやCROとの関係を慎重に管理しているが、将来的に挑戦や遅延に遭遇しないこと、またはこれらの遅延や挑戦が私たちの業務、臨床運営、財務状況、および将来に実質的な悪影響を与えないことを保証することはできない。
私たちの業務は環境リスクと関連があり、私たちに責任を負わせるかもしれない。
私たちの研究と開発活動では、私たちおよび私たちの協力者とサプライヤーは、特定の材料、生物標本、化学品と廃棄物の使用、生産、製造、貯蔵、空気排出、汚水排出、処理、処分に関する連邦、州と現地の法律、規則、法規、政策を遵守しなければならない。私たちはすべての重大な面でこれらの適用された法律、法規、政策を遵守し、いかなる重大な不適合規定の是正が要求されていないと信じているが、私たちは未来に環境、健康、安全法規を遵守することによって巨額のコストが生じるかもしれない。私たちが制御材料を処理して処分するセキュリティプログラムは州と連邦法規で規定されている基準に適合していると信じているが、これらの材料は意外な汚染や傷害が発生する可能性がある。このような状況が発生した場合、私たちはそれによるいかなる損害に対しても責任を負うことができ、そのような責任は私たちの資源範囲を超える可能性がある。
業務中断と適切なレベルの商業保険の不足は、私たちの将来の収入と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある
我々の業務および我々の第三者研究機関協力者、CRO、CDMO、サプライヤーおよび他の請負業者およびコンサルタントの業務は、地震、電力不足、電気通信故障、水資源不足、洪水、ハリケーン、火災、極端な天気条件、疾病流行または流行病(例えば、新冠肺炎)および他の自然災害または人為災害または業務中断の影響を受ける可能性があり、これらの状況に対して一部または全部の保険はありません。また,我々は第三者に依存して我々の候補製品に関するいくつかの研究や開発活動を行い,政府の閉鎖や資金撤回の影響を受ける可能性がある.このような業務中断の発生は、私たちの運営と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある。私たちは第三者製造業者に依存して私たちの候補製品を生産して加工する。これらのサプライヤーの運営が人為的または自然災害または他の業務中断の影響を受ける場合、候補製品の臨床供給を得る能力が妨害される可能性がある。
私たちの日常運営はテキサス州オースチンのオフィス施設内にあります。会社、開発または研究施設の破損や長時間の中断は、候補製品の一部または全部の開発を停止または延期させる可能性があります。この場合、私たちの保険は損失を保証できない可能性があり、私たちの業務はこのような遅延と中断によって深刻な損害を受ける可能性があります。
ソーシャルメディアプラットフォームは企業コミュニケーションの動態を著しく変え、リスクと挑戦をもたらし、その中のいくつかは未知であり、私たちが知らないかもしれない。
ソーシャルメディアの持続的な拡張に伴い、それはまた私たちに新しい挑戦をもたらしてくれる。メディアプラットフォーム上での不適切な使用や許可されていない私たちの機密情報の使用は、ブランドの損傷や情報漏洩を招く可能性があり、これは私たちに法律や規制の問題をもたらすだろう。さらに、ソーシャルメディアサイト上の私たちまたは私たちの候補製品に関する否定的、不適切または不正確な投稿またはコメントは、私たちの名声、イメージ、および商業的名声を迅速かつ不可逆的に損なう可能性がある。さらに、私たちの従業員または他の人がメディアチャネルを介して意外または意図的に非公開の敏感な情報を漏洩することは、情報の損失を招く可能性があり、または法律または規制の問題を私たちにもたらす可能性がある。さらに、私たちの機密文書にアクセスしたり、当社の会社名、ロゴ、ブランドを不正に使用したりするために、詐欺的な第三者が私たちの情報技術システムを乗っ取るリスクがあります。このような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を招き、制限的な規制行動に直面したり、私たちの業務が他の損害とコストを受けたりする可能性があります。
私たちはまた他の第三者に私たちの臨床研究にラベルを貼って、貯蔵し、薬品を供給することに依存している。私たちの流通業者のどんな業績ミスも、どんな薬品供給の出荷も含めて、私たちが開発する可能性のある任意の候補製品の臨床開発やマーケティング承認を延期したり、私たちの候補製品を商業化したり、追加の損失をもたらし、私たちの潜在的な製品収入を奪う可能性があります。
私たちは従業員の人数が限られている小さな会社です。私たちは私たちのキーパーソンに高度に依存していて、私たちが高素質の人材を誘致、激励、維持することに成功できなければ、私たちの業務戦略を成功的に実施できないかもしれません
競争の激しい生物技術と製薬業界で競争する能力は私たちが高い素質管理、科学と医療人員を誘致、激励し、維持する能力にかかっている。私たちは私たちの経営陣、特に私たちの総裁兼最高経営責任者レミー·バビルと私たちの科学技術者に高く依存しています。私たちの役員、他の重要な従業員、他の科学や医療コンサルタントが提供するサービスを失って、適切な代替者を見つけることができず、候補製品の開発遅延を招き、私たちの業務を損なう可能性があります。
技術人材に対する競争は非常に激しく、流出率は非常に高いかもしれないが、これは私たちが受け入れ可能な条件で高い素質の人員を採用と維持する能力を制限し、甚だしきに至っては全くできないかもしれない。テキサス州オースティンで私たちのいる地域以外の地域から人材を募集する必要があるかもしれません。これは高くて難しいかもしれません。
価値のある従業員をわが社に引き付けるために、賃金や現金インセンティブに加え、経時的に付与された株式および/または現金ボーナス計画を提供します。これらの経時的に付与された配当金や現金配当計画の従業員への価値は、当社の株価変動の大きな影響を受ける可能性があり、これらの変動は、当社の制御範囲を超えており、他社が提供するより利益のあるオファーを相殺するには不十分である可能性があります。私たちは私たちの重要な従業員と雇用協定を持っていますが、これらの雇用協定は自由に雇用できることを規定しています。これは、私たちのどの従業員も通知するかどうかにかかわらず、いつでも私たちの仕事を離れることができることを意味します。私たちが受け入れ可能な条件で素質の高い従業員を吸引して激励することができない場合、あるいは根本的にできなければ、私たちの業務や運営業績に影響を与える可能性があります。
もし私たちが重要な人たちを引き付けて維持できなければ、私たちは私たちの業務を中断しなければならないかもしれない。
私たちは早期と臨床段階の技術の開発に取り組んでおり,予見可能な未来にこのようにしていく。大規模な組織とは異なり、ごく少数の高いスキルと人気のある従業員に頼って、私たちの開発段階技術を推進し続けています。私たちの肝心な従業員が貢献する知識と技能は代替できないかもしれないし、肝心な従業員を失うことは私たちの業務に重大な財務、運営と科学面の負の影響をもたらすかもしれない。例えば、過去には、NIHから研究補助金を受けていましたが、これはある重要な従業員の継続的な参加にある程度依存しており、これらの従業員は首席調査員と呼ばれています。米国国立衛生研究院がこのような補助金を授与した場合,首席調査員を1人失うことで1つ以上のこのような研究補助金が失われる可能性がある。同様に、我々の開発段階の技術を保護するための知的財産権はまだ発展中であり、その発展は依然として特定の専門知識を持つ少数の従業員に高度に依存している。重要な従業員を失うことは、私たちの既存または処理すべき知的財産権を危険にさらすかもしれないし、私たちの知的財産権の組み合わせを拡大するために必要な技術情報と知識を得ることを阻止するかもしれません。また、肝心な従業員の参加を失うことによる悪影響は、“キーパーソン”や“商業生命保険”のような特定の保険政策で補償することはできないと考えられる。もし私たちが重要な従業員を維持することができなければ、私たちの業務と財務状況は影響を受け、私たちは運営を停止する必要があるかもしれない。
現在の研究協力者や科学コンサルタントが私たちとの関係を終了したり、競争相手との関係を発展させたりすれば、私たちが業務運営を継続する能力は悪影響を受ける可能性があります。
我々は学術や他機関の独立した研究協力者と関係を築き,これらの協力者は我々の要求に応じて研究を行っている.この研究協力者たちは私たちの従業員ではない。したがって、私たちは彼らの活動の統制に制限があり、私たちの協力合意が別に要求されない限り、彼らは限られた時間を私たちの活動に特化することしかできない。ヒト疾患に関連する薬物やバイオマーカーおよび診断テストを検証して商業化する能力は,これらの協力の持続にある程度依存する可能性があることが分かった。もしこれらの協力のいずれかが終了したら、私たちは他の受け入れ可能な協力に入ることができないかもしれない。しかも、私たちの既存の協力は成功しないかもしれない。私たちの研究協力者や科学コンサルタントは他の商業実体と関係があるかもしれませんが、その中のいくつかは私たちと競争するかもしれません。我々の研究協力者と科学コンサルタントは協定に署名し,我々の独自の情報と我々の要求に応じて行った研究結果を秘密にしている.しかし、私たちは私たちの技術とすべての協力に関連する他の機密情報を秘密にすることができないかもしれない。私たちの機密情報の伝播は私たちの業務に実質的な悪影響を及ぼすかもしれない。
私たちの業務は政治的事件、戦争、テロ、業務中断、他の地政学的事件、そして私たちがコントロールできない不確実性の影響を受けるかもしれない。
戦争、テロ、地政学的不確実性、および他の業務中断は、世界的または地域的に行われている私たちの臨床研究に損害、中断、またはキャンセルをもたらす可能性があり、これは、私たちの業務、臨床場所、または私たちと業務往来のあるサプライヤーに実質的な悪影響を及ぼす可能性がある。このような事件はまた、患者が私たちの臨床研究に参加する需要を登録することを減少させるか、あるいは私たちの臨床研究場所に製品とサービスを提供することを困難または不可能にする可能性がある。また、領土侵入は、私たちのような衝突地域から離れた科学技術会社へのサイバーセキュリティ攻撃を招く可能性がある。地政学的事件により業務中断時間が延長されれば、重大な損失を被る可能性があり、大量の回復時間と巨額の支出を経て、私たちの業務や臨床運営を回復する必要がある。私たちはイスラエル、ロシア、ウクライナに業務がありませんが、これらの地政学的地域の現在の不確実性がエスカレートし、広範な経済·安全条件や医療用品の配給につながるかどうかもわかりませんが、これはアメリカ以外での臨床試験を行う能力を制限したり、私たちの業務に実質的な影響を与えたりする可能性があります。また、私たちの保険リストには通常、何らかの形の戦争免責条項が含まれていますが、地政学的不確実性による損失と言われている損失が発生すれば、私たちの保険会社はどのように対応するかもしれません。
我々のネットワークセキュリティイベントの可能性と影響を最小限に抑える努力は成功しない可能性があり、私たちの業務は、データ漏洩または他のネットワークセキュリティの脅威または私たちが運営する他の中断の負の影響を受ける可能性があり、これは、私たちの法的クレームを引き起こす可能性があり、またはこのようなネットワークセキュリティイベントを解決するために巨額の財務コストを生じる可能性があり、サプライヤー、臨床研究参加者、または規制機関との関係を損なう可能性がある。
我々の業務運営はデータ集約型であり,情報技術の利用に広く依存している.また、近年、生物製薬会社はますます多くのネットワーク攻撃を受け、特に知的財産権の窃盗と独自の臨床研究データ或いは患者の敏感な情報への不正アクセスに対するネットワーク攻撃を受けている。私たちの業務の性質を考慮して、私たちの情報技術インフラは、恐喝ソフトウェア、私たちの運営または敏感な患者情報への不正アクセス、サービス拒否攻撃、または様々な他の攻撃方法を含む様々な変化するネットワークセキュリティ脅威に直面している。以下に述べるように、私たちのサプライヤー、コンサルタント、サプライヤー、下請け業者、臨床研究サイト、および非臨床研究実験室は類似の安全脅威に直面している可能性がある。
このようなネットワークセキュリティの脅威は普遍的であり、しかも上昇し続けており、ますます発見が難しくなり、出所は多種多様であり、伝統的なコンピュータ“ハッカー”、脅威行為者、民族国家とごろつき民族国家行為者を含む。私たちはまた、私たちの従業員または私たちが働いている他の人を代表する不適切なネットワーク行動の影響を受ける可能性があり、彼らは私たちの固有の情報または敏感な患者情報にアクセスすることができ、これは私たちの業務や名声に悪影響を及ぼす可能性がある。どんな重大なサイバーセキュリティ事件の発生も、私たちの業務運営に重大な中断をもたらす可能性があります。ネットワークの脅威に加えて、私たちは私たちの施設や幹部の安全に対する脅威に直面する可能性があり、これらの脅威を実施すれば、私たちの業務を深刻に混乱させる可能性がある。
私たちはまた、多くのサプライヤー、コンサルタント、サプライヤー、下請け業者、臨床研究サイト、および非臨床研究実験室と協力して、私たちの独自または敏感な情報にアクセスすることができる。これらの第三者は通常私たちの制御範囲内ではなく、異なるレベルのネットワークセキュリティ専門知識と保障措置を持っている可能性があり、私たちは彼らのネットワークセキュリティ慣行を監視する能力が限られている。これらの第三者は十分なネットワークセキュリティ対策を持っていない可能性があり、彼らが受けたイベントや他の中断は、私たちが不利な結果を経験することを招くかもしれない。特に、我々の医薬品サプライチェーンにおけるネットワークセキュリティ事件は、臨床研究に参加している患者や医師に候補製品を提供する能力に適時に悪影響を与える可能性があり、進行中の臨床と非臨床研究の完成を延期またはキャンセルする可能性がある。
ネットワークセキュリティ脅威が現実になった場合、私たちまたは私たちが依存する第三者は、変化する情報セキュリティおよびデータ保護/プライバシー法規を遵守することを含む、それらを防御または敏感な情報を保護することができず、これは、サプライヤー、臨床研究参加者、臨床研究調査サイト、患者または政府当局が、私たちおよび私たちのプロバイダが採用する脅威緩和および検出プロセスおよびプログラムの十分性を疑問視する可能性がある。また、事件の重症度によって、著者らの独自の臨床研究データ、敏感な患者情報、知的財産権は、商業秘密と研究、開発と技術ノウハウを含み、損害を受ける可能性がある。
私たちのほとんどの業務は、それらが破られる可能性のあるリスク、または私たちが攻撃を検出、予防、または打撃できないリスクを含むネットワークセキュリティリスクを持っています。これらの攻撃は、経済的損失と私たちに対するクレームを招き、サプライヤーや臨床研究参加者との関係を損なう可能性があります。我々のような規模の会社にとって、重大なネットワークセキュリティ事件や他のセキュリティ脅威や中断に対応するコストと費用は巨大である可能性がある。また、ネットワークセキュリティ事件に遭遇した際に発生する可能性のある潜在的な財務損失を保証するネットワークセキュリティビジネス保険証を単独で提供していません。
財務状況と資本要求に関連するリスク
私たちが設立して以来、私たちは各時期に重大な純損失を発生させ、予測可能な未来に純損失を受け続けることが予想される
成立以来、2023年12月31日までの年度純損失9720万ドルを含む報告期間ごとに純損失が発生した。2023年12月31日現在、私たちの累計赤字は380.8ドルです。
私たちは候補製品の研究開発活動に多くの財政資源を投入した。私たちは数年以内に製品販売から収入が出ないと予想しています。もしあれば。私たちの未来の純損失額は私たちの未来の支出と収入水準に部分的に依存するだろう。また,我々の純損失は四半期ごとに大きく変動する可能性があるため,我々の運営結果を経時的に比較することは我々の将来の業績の良好な指標ではない可能性がある。
私たちは予測可能な未来に巨額の費用とより高い運営損失が続くと予想している。私たちは私たちの支出がかなり維持されると予想している
| ● |
研究と発見活動を続けています |
| ● |
臨床前と臨床開発を通じて現在と未来の候補製品を向上させます |
| ● |
私たちの候補製品のために追加的な臨床前、臨床、または他の研究を開始し、行う |
| ● |
CDMOと協力して候補製品の製造プロセスを拡大します |
| ● |
私たちの候補製品のために規制許可とマーケティング許可を求めます |
| ● |
私たちの知的財産権の組み合わせを取得し、維持し、保護し、保護し、実行する |
| ● |
人材を誘致し、採用し、引き留める |
| ● |
私たちの持続的な研究開発運営と将来の任意の計画の商業化努力を支援するために、追加の内部インフラを提供する |
| ● |
私たちの運営に関連した他の問題に遭遇したり、 |
| ● |
上場企業の要求と要求に合致する; |
| ● |
私たちまたは私たちの協力者に対する告発が引き起こす可能性のある訴訟、クレーム、または他の不確実性を弁護する。 |
私たちの以前の損失と予想された未来の損失はすでに私たちの株主権益と運営資本に悪影響を与え続けるだろう。どの四半期においても、私たちの経営業績は証券アナリストや投資家の予想を下回る可能性があり、これは私たちの株価を下落させる可能性がある。
私たちには幅広い裁量権があります私たちの資本資源は 私たちのどんな資金調達取引の純収益も、私たちはそれらを効果的に使用できないかもしれない
私たちは私たちの融資取引の純収益を含めて、私たちの資本資源を運用する広範な情動権があり、投資家はこれらの資源が適切に使用されているかどうかについて意見を述べる機会がないだろう。我々がこれらの資本資源を利用できる方式は,最初に伝達された期待用途とは大きく異なり,我々の運営結果を改善することもなく,我々の普通株の価値を高めることもない.もし私たちがこれらの資金を有効に利用できなければ、財務損失を招く可能性があり、これは私たちの業務に実質的な悪影響を与え、私たちの普通株価格の下落を招き、候補製品の開発を延期する可能性がある。使用する前に、私たちは私たちの融資取引の純収益を含めて、収入や価値を失うことなく利用可能な資本資源に投資することができる
私たちは製品収入がなく、製品収入に基づく収入や利益を決して達成しないかもしれない
私たちは商業販売を許可された製品がありません。私たちの候補製品の販売から利益を達成するために重要または十分な収入を得るためには、単独でまたは第三者と協力して、規制部門の承認を得て、製造、マーケティングの大きなビジネス価値を有する候補製品の開発、獲得に成功しなければならない。これは重要な努力であり,初期段階の生物製薬会社が成功することは少ない。私たちが収入を創出し利益を達成する能力は多くの要素に依存しています
| ● |
私たちの候補製品の研究、臨床前、臨床開発を完成させる |
| ● |
私たちが臨床開発に成功した候補製品は規制許可とマーケティング許可を得た |
| ● |
私たちの候補製品のための持続可能で拡張可能な製造プロセスを開発し、第三者と商業的に実行可能な供給関係を確立し、維持することができ、これらの第三者は、私たちの候補製品の臨床活動および商業需要を支援するのに十分な製品およびサービスを提供することができる |
| ● |
新しい候補製品の決定、評価、取得、および/または開発; |
| ● |
私たちが参加する可能性のある任意の協力、許可、または他の手配で有利な条件を交渉する |
| ● |
競争的な技術や市場の発展に対応しています |
| ● |
特許、商業秘密、およびノウハウを含む、当社の知的財産権の組み合わせの維持、保護、拡大、および実行; |
| ● |
合格した人材を引きつけ、採用し、引き留める。 |
薬物開発に関連する多くのリスクや不確実性のため、私たちが支出した時間や金額を予測することはできず、私たちがいつどんな意味のある収入を生み出すことができるか、あるいは利益を達成したり維持したりすることも予測できない。さらに、FDAや外国規制機関が現在予想されている研究以外の研究を要求している場合、または任意の臨床研究や任意の候補製品の開発に遅延が生じた場合、私たちの費用は現在の予想を超えるまで増加する可能性があります。
私たちは私たちの運営に資金を提供し、候補製品の開発を完了するために追加の資金が必要かもしれない。受け入れ可能な条項や必要な資本を全く得ることができない場合、私たちの商業化努力、製品開発、または他の運営を延期、制限、減少、または終了させることができないかもしれない
設立以来、私たちの業務は大量の現金を必要としてきて、私たちは予測可能な未来に、私たちの支出はまだ相当なものになると予想している。これまで、私たちは主に株式証券の売却、研究援助、これまでの第三者協力から受け取った支払いによって、私たちの運営に資金を提供してきました。我々の候補製品を開発し、神経変性疾患(アルツハイマー病を含む)を治療する臨床研究を行うには大量の資金が必要となる。私たちはまた承認された製品を商業化するために多くの資金を必要とするだろう。
2023年12月31日まで、私たちは121.1ドルの現金と現金等価物を持っている。また,2024年1月3日から2024年2月26日まで,未償還権証の行使から約2,180万ドルの毛収入を得た。より多くの情報は、連結財務諸表付記13を参照されたい。
私たちの現在の運営計画によると、私たちは私たちの既存の現金と現金等価物が私たちが予想している少なくとも今後12ヶ月の運営に資金を提供するのに十分だと信じている。私たちは、既存の現金と現金等価物がどのくらいの間、私たちの運営に資金を提供することが予想され、これは、正確ではないことが証明される可能性があるという仮定に基づいて、現在予想されているよりも早く利用可能な資本資源を使用する可能性があるという前向きな陳述である。また、変化する環境は、私たちの支出増加の速度が私たちの現在の予想よりも大きく速くなるかもしれませんし、現在の予期しない状況のため、私たちは今予想しているよりも多くのお金が必要かもしれません。これは私たちのコントロールを超えているかもしれません。もし私たちが現在の予想よりも速い速度で拡張することを選択すれば、私たちは予想よりも早く追加資金を調達する必要があるかもしれない。
私たちは私たちの候補製品をさらに開発するために追加的な資金が必要かもしれない。私たちが必要な時、あるいは私たちが受け入れられる条件で、あるいは追加的な資本が全くない。私たちは確定的な追加資金源を持っていない。もし私たちが十分な資本をタイムリーに得ることができなければ、私たちは私たちの研究開発計画や候補製品の商業化を大幅に延期、制限、減少または終了することを要求されるかもしれない、あるいは私たちの業務を継続または拡大することができない、あるいは他の方法で私たちのビジネスチャンスを利用することができないことは、私たちの業務、財務状況、運営結果、成長の見通しに大きな影響を与え、私たちの普通株価格を下落させる可能性がある。
私たちが株式または転換可能な債務証券を売却することで追加資本を調達する場合、私たち株主の所有権権益は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての権利に悪影響を及ぼす可能性がある。債務融資が可能であれば、追加債務を招く、資本支出を行う、または配当を宣言するなど、特定の行動をとる能力を制限または制限する契約を含むいくつかの合意が含まれる可能性がある。もし私たちが製薬パートナーとの協力、戦略連合、または許可手配を通じてより多くの資金を調達すれば、私たちは私たちの技術、将来の収入源、研究プロジェクト、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になる可能性のある条項で許可を与えなければならないかもしれない。
世界的な信用と金融市場の状況およびインフレは、私たちの現金等価物の組み合わせの価値と、私たちの融資目標を達成する能力に悪影響を及ぼすかもしれない。
私たちの現金および現金等価物は、通常、購入時の元の満期日が3ヶ月以下の高流動性投資で維持される。本文書の提出日まで、私たちは2023年12月31日以来、私たちの現金等価物の公正価値にいかなる引き下げ、重大な損失、あるいはその他の重大な悪化があることを知らないが、インフレ圧力を含む世界の信用と金融市場状況の悪化は保証されず、私たちの現在の現金等価物の組み合わせや私たちの融資目標を達成する能力にマイナスの影響を与えない。
私たちの業務は上昇するインフレの影響を受けている。
過去3年間、米国は過去最高のインフレ水準を経験した。米労働省のデータによると、2023年12月31日までの12カ月間、米国の年間インフレ率は約3.4%だったが、2022年から2021年のインフレ率はそれぞれ6.5%~7.0%だった。インフレ率が引き続き歴史的高位にある場合、例えば労働力や用品コストの増加により、従業員の給与や研究開発費などの支出に影響を与える可能性がある。研究開発費は私たちの運営費用の大きな部分を占めている。また、米国は持続的な労働力不足を経験しており、これは逆に非常に競争力のある賃金環境を創出し、私たちの運営コストを増加させる可能性がある。インフレがさらなる利上げを招き、市場に他の悪影響を与える場合、インフレは私たちの総合的な財務状況と経営業績や業務の見通しに悪影響を及ぼす可能性がある。
私たちの普通株式所有権に関連するリスク 捜査令状と
十分な市場が続くかどうかはわかりませんしたがって、投資家は私たちの普通株や株式承認証を発行した株式を売ることが難しいかもしれない
もし私たちの普通株の市場が持続できなければ、私たちの普通株の株は魅力的な価格で売ることができないかもしれないし、売るのは根本的に難しいかもしれない。同様に、私たちが発行した権利証の活発で安定した市場が持続できない場合、このような権利証を魅力的な価格で売ることは困難かもしれません。私たちの証券の取引市場は十分な規模、流動性、または価格透明性が不足している可能性があります。私たちは私たちの普通株や株式証の取引価格を予測できません。また、私たちは株式証の特徴、例えば私たちの償還権或いは9.9%の所有権の使用可能性制限を認め、このような株式証の取引価格に影響を与える可能性がある
今後の1つまたは複数の時期に、我々の運営結果やわが製品ラインの進展が公開市場アナリストや投資家の予想に合致しない可能性があるため、これらや他の要因により、取引証券の価格が低下する可能性がある。
私たちの普通株の市場価格は従来から大きく変動しており、私たちの株を購入した投資家が大きな損失を受ける可能性があると予想されています
私たちの普通株の市場価格は従来から大きく変動しています。例えば、本年度報告10-K表提出日までの12ヶ月間、私たちの普通株の終値は12.64億ドルの安値から30.11ドルの高値に変動しました。普通株市場の価格変動を引き起こす可能性があるいくつかの要素は
| ● |
既存または新しい競争力のある製品または技術の成功; |
| ● |
私たちの現在の候補製品と私たちが開発する可能性のある未来の候補製品の臨床研究の時間と結果 |
| ● |
私たちの製品開発や研究計画は失敗したり中断したりします |
| ● |
競争相手候補製品の臨床前研究、臨床研究または監督管理承認の結果、または競争相手の新しい研究プロジェクトまたは候補製品の公告; |
| ● |
アメリカや他の国の法規や法律の発展 |
| ● |
特許出願、発行された特許または他の固有の権利に関連する開発または紛争; |
| ● |
キーパーソンの採用や退職 |
| ● |
私たちが開発する可能性のある任意の研究計画、臨床開発計画、または候補製品に関する費用レベル |
| ● |
私たちはより多くの候補製品や製品の結果を開発するために努力している |
| ● |
財務結果または開発スケジュールに関する推定の実際または予想される変化; |
| ● |
追加的な資金調達努力が発表されるか、または予想される |
| ● |
私たち、私たちの内部人、または他の株主は私たちの普通株を売却します |
| ● |
私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い |
| ● |
証券アナリストの見積もりや提案(ある場合)の変化は、私たちの株をカバーしています |
| ● |
製薬とバイオテクノロジー部門の市場状況 |
| ● |
一般経済、産業、市場状況; |
| ● |
証券訴訟は,是非曲直を問わない. |
近年,株式市場ナスダックやスタートアップ会社や製薬やバイオテクノロジー会社の市場も重大な価格や出来高変動を経験しており,これらの変動は,その株がこれらの価格や出来高変動を経験している会社の経営業績の変化に関係なく,あるいは比例しないことが多い。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格に深刻な影響を与える可能性がある。ある会社の証券市場価格にこのような変動が生じた後、同社に対して証券集団訴訟が提起されることが多い。私たちの株価の潜在的な変動性のため、私たちは今、将来も証券訴訟の目標になる可能性があります。証券訴訟は巨額のコストを招き、経営陣の注意と資源を私たちの業務から移す可能性がある。
私たちの株式承認に関するヘッジスケジュールは私たちの普通株の価値と波動性に影響を与えるかもしれない。
その財務状況をヘッジするために、ある権証保持者は、私たちの普通株についてヘッジ取引を行う可能性があり、倉庫を平らにしたり、ヘッジ取引を調整したりする可能性があり、および/または1回または複数回の市場取引で私たちの普通株を大量に購入または販売する可能性がある。これらの活動が我々の普通株取引価格に与える影響(あれば)は市場状況に部分的に依存し,事前に知ることはできないが,これらの活動のいずれも我々の普通株の価値や価格変動に悪影響を及ぼす可能性がある.
我々の権利証の取引価格は、従来の推定方法や私たちの普通株の市場価格とほとんど関係がない可能性があるため、権証の取引価格は大幅に変動する可能性がある。
私たちの権利証の取引価格は、伝統的な価値指標(例えば、私たちの将来の見通しおよび業界全体の見通し)を使用して確立された価格とはほとんど関係なく、さらにはこれらの価格よりも著しく低いか、または時々高くなる可能性がある;将来の潜在収入、収益、キャッシュフローおよび他の財務および運営情報、またはその倍数;私たちと同様の薬物開発活動に従事する会社の証券および他の財務および運営情報の市場価格、および研究アナリストの観点。潜在的投資家は、権利証取引価格が大幅に変動し、下落する可能性があるリスクを負うことを望まない限り、公開市場で権利証を購入すべきではない。権利証所有者が権利証を行使する際(任意の紅株期間の紅株シェアを計上した後)に普通株式への投資価値を実行価格で回収するためには、当該普通株株式の価値は権証の行使価格よりも大きくなければならない。
さらに、私たちは、2024年4月15日以降の任意の時間に、何らかの他の条件を満たす場合に、私たちの唯一の選択権で、行使されていないすべての引受権を償還することができる。もし私たちが行使していない権利証を償還すれば、それらは償還日の後に発行を停止し、それらは取引を停止し、それらは価値がないだろう。
もし証券アナリストが私たちの業務に関する研究や報告を発表しなければ、あるいは私たちが否定的な宣伝の対象になれば、私たちの株価は下落する可能性があります
私たちの証券の取引市場は、証券または業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存しています。私たちはこのようなアナリストを統制することができない。私たちの1人以上のアナリストを追跡して私たちの株式格付けを引き下げたり、わが社や株の不正確または不利な評価を発表したりすれば、私たちの証券価格は下落する可能性がある。もし一人以上のアナリストが私たちの会社の報道を停止したり、わが社に関する報告書を定期的に発表できなかったりすれば、私たちの株は市場で可視性を失う可能性があり、これは私たちの証券価格の下落を招く可能性がある。また、もし私たちが否定的な宣伝の対象になれば、アナリスト、学術、ソーシャルメディア、業界団体、一般メディア、金融メディアからも、私たちの証券の価格が下落する可能性があります。
私たちの株の空売り者は操作性を持っている可能性があり、私たちの普通株の市場価格を下げるかもしれません。
空売り--“空売り”“空売り”または“空売り”とも呼ばれる--売り手が第三者から借りた証券や金融商品の販売を指す。空売り者たちは彼らが空にした証券価値の低下から利益を得ることを望んでいる。私たちの株価下落は空売り者の経済的利益に符合するため、一部の空売り者は私たちの業務運営に関する不実陳述、虚偽情報或いは誤った記述を発表する可能性があり、私たちの臨床前或いは臨床結果を含み、私たちに関する負の宣伝を製造し、伝播することを目的としている。負の情報がメディア上で急速に伝播できるため,空売り者の活動は我々の証券市場価格の突然,大幅な下落を招く可能性があり,これは“空攻撃”と呼ばれることがある.我々のように取引量が限られ,相対的に変動性の高い証券を持つ発行者に加え,新たな複雑な科学研究に従事する挑戦に加えて,このような空売りの攻撃を受けやすくなる可能性がある.空売りはまた私たちの株価変動を招く可能性があり、特に私たちの普通株“多頭”を持つ他の投資家がより多くの株を購入することで空売り活動に対抗しようとすれば、空売り者が利益を上げにくくなり、コストも高くなる。私たちの普通株の市場価格が未来にこのような活動のために低下しないという保証はない。
一般リスク因子
もし私たちが効果的な内部統制を維持できなければ、私たちの業務、財務状況、そして経営結果は不利な影響を受けるかもしれない
上場企業としては、取引法に規定されている報告書その他の義務を遵守しなければならない。この条項は、経営陣に財務報告の内部統制の有効性を年間評価することを要求する“サバンズ-オキシリー法案”(“サバンズ-オキシリー法案”)404(A)節の要求を含む。SOX第404条(B)はまた、財務報告書の内部統制に対する私たちの独立監査人に証明し、報告することを要求する。
管理管理層は、財務報告の内部統制に達成しなければならない基準を評価するルールは複雑であり、規則下の詳細な基準を満たすためには、大量の文書、テスト、および可能な救済措置が必要である。テスト過程において、私たちの管理層は重大な欠陥或いは欠陥を発見する可能性があり、これらの欠陥或いは欠陥は適時に修復できない可能性があり、SOXが規定する最終期限内に完成できない可能性がある。これらの報告とその他の義務は、会計資源を含む我々の管理、行政と業務資源に対して、極めて大きな要求を提出した。
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。我々の財務報告に対する内部統制は、米国公認の会計原則に基づいて財務報告の信頼性と、外部目的の総合財務諸表の作成に合理的な保証を提供することを目的としたプロセスである。有効な内部統制を維持できなかった場合、または、私たちの独立公認会計士事務所が財務報告の内部統制の有効性を証明できない場合、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
我々の定款文書とデラウェア州法律における反買収条項は、現経営陣の更迭や統制権の変更を阻止または延期する可能性がある
当社の会社登録証明書の改正および再記載の会社定款およびデラウェア州法律における反買収条項は、株主の経営陣の罷免または変更、代理権競争への参加、制御権変更の実現の試みを阻止または延期する可能性があります。私たちの憲章の文書には
| ● |
私たちの取締役会のうち3つのレベルの取締役(“取締役会”)は毎年1人しか選出されていない分類取締役会 |
| ● |
役員選挙での累積投票権を廃止する |
| ● |
株主に指名と提案の手続きを事前に通知する; |
| ● |
取締役会は株主の承認なしに私たちの定款を修正することができます |
| ● |
取締役会は、取締役会が決定可能な条項及び条件及び権利、特権及び優遇に基づいて、株主の承認なしに最大10,000,000株の優先株を発行する能力がある。 |
また、デラウェア州会社として、私たちはデラウェア州会社法第203条を含むデラウェア州法律の制約を受けている。一般的に、第203条は、デラウェア州会社が株主が利益株主になった日から3年以内に、第203条に規定する特定の要件を満たさない限り、利害関係のある株主と任意の業務合併を行うことを禁止する。
これらの規定は単独または連携して、現経営陣の変動、代理権競争または制御権変動に抑止力や遅延作用を与える可能性がある。
私たちの改正と重述の付例規定は、アメリカ合衆国連邦地域裁判所は、1933年に証券法に基づいて提出された任意の訴えを解決する唯一のフォーラムでなければならず、この訴えは私たちの株主を制限する可能性がある’私たちまたは私たちの役員、上級管理職、または従業員との紛争について有利な司法フォーラムを得ることができます。
私たちが改正して重述した付例規定は、アメリカ合衆国連邦地域裁判所は、1933年に証券法に基づいて提起された訴因の任意の苦情を解決するための独占的なフォーラムでなければならない。
デラウェア州裁判所はこのような選択の裁判所条項が有効であることを確定しているが、株主は専属裁判所条項が指定した場所以外の場所でクレームを出すことを求めることができる。このような状況で、私たちは私たちが改正して再説明した定款における独占フォーラム条項の有効性と実行可能性を強力に主張したい。これは、他の法ドメインでこのような訴訟を解決することに関連する多くの追加費用を必要とする可能性があり、これらの規定がこれらの他の法ドメインの裁判所によって実行されることを保証することはできない。
これらの排他的フォーラム条項は、司法フォーラムにおいて、私たちまたは私たちの役員、上級管理者、または他の従業員と紛争することに有利であると考える株主のクレームを出す能力を制限する可能性があり、このような訴訟を阻害する可能性がある。また,他社の会社登録証明書や定款で類似した場所条項を選択する実行可能性が法的手続きで疑問視されており,裁判所はこれらのタイプの条項が適用されないか実行不可能であると考える可能性がある。もし裁判所が私たちが改正して再説明した定款に含まれている排他的フォーラム条項が訴訟で適用されないか、実行できないことを発見した場合、私たちは他の管轄区域でこのような訴訟を解決するために、より多くの重大な追加費用が発生する可能性があり、これらのすべては私たちの業務を損なう可能性がある。
私たちの所有権の変化は私たちが純営業損失を繰り越す能力を利用することを制限するかもしれない。
2023年12月31日現在、我々が繰り越した連邦純運営損失総額は約158.7ドルで、2029年に満期となる。改正された1986年の国内税法第382条によると、私たちの所有権の変化は、将来の課税所得額を相殺するために毎年使用できる純営業損失繰越額を制限する可能性があります。この制限は一般にわが社が三年間スクロールしている間に所有権の累積変化が50%を超える場合に適用されます。このような制限は、純営業損失の繰越と税収の繰越免除を利用する能力を著しく低下させる可能性がある。このような制限は、過去の発行によっても、私たちの既存の株主が私たちの普通株を売却しても、私たちが株式承認証を行使したために普通株を発行しても、私たちが将来私たちの普通株を追加的に売却するためにも、今後数年間の経営業績に重大な悪影響を及ぼす可能性があります。私たちはまだ第382条に規定されている所有権変更が発生したかどうかを評価する研究を終えていない。
私たちは、私たちの運営に資金を提供し、私たちの普通株に行使可能な未償還証券を保有するために追加の株式または債務証券を売却することができ、これは、私たちの株主が希釈され、私たちの業務に制限を加える可能性がある。
私たちの運営を支援するために追加資本を調達するために、私たちの普通株の追加株式または他の私たちの普通株に変換できたり、私たちの普通株に交換可能な証券を売却することができ、これは私たちの株主を希釈することにつながるかもしれません。
以前の発行時に投資家が支払った1株以上の価格で任意の他の発行された株式または他の証券を売却することができ、将来私たちの株または他の証券を購入する投資家が既存の株主よりも高い権利を持つ可能性があることを保証することはできません。将来の取引では、追加の普通株を販売するか、または私たちの普通株に交換可能な証券の1株当たり価格が、以前に発行された1株当たり価格よりも高いか、またはそれ以下になる可能性がある。あなたはまた2023年12月31日に流通株オプションを行使する時に希釈され、1株15.13ドルの加重平均価格で約300万株の私たちの普通株を購入する可能性があり、将来的には私たちの2018年総合激励計画に基づいて最大約290万株の補償株式奨励を発行することと、私たちが最初に2024年1月に発行した流通権証を行使することで最大2530万株を発行する可能性があります。このような追加的な普通株を発行したり、発行される可能性があるとの見方は、我々の株価を大きな下振れ圧力に直面させる可能性がある。
我々が連結財務諸表を作成する際に行った見積もりと判断、あるいは私たちが依存している仮定は、不正確であることが証明される可能性がある。
私たちの総合財務諸表はアメリカで公認されている会計原則に基づいて作成されています。これらの総合財務諸表を作成するには、私たちの資産、負債、費用の報告金額、私たちが計算すべき費用金額、あるいは資産と負債に関する開示に影響を与える推定と判断が必要です。このような推定·判断には、開発費用、株式に基づく報酬の推定値、所得税が含まれる。私たちの推定は、私たちが知っている歴史的経験、事実と状況、そしてこのような状況で合理的だと思う様々な他の仮定に基づいている。しかし、私たちは私たちの推定またはその背後の仮定が時間の経過とともに変化しないか、または不正確であることを証明することを保証できない。この場合、私たちは私たちの連結財務諸表の再申告を要求されるかもしれません。これは逆に証券集団訴訟の影響を受ける可能性があります。私たちの連結財務諸表の再記述に関する潜在的な訴訟を弁護するのは高価であり、私たちの経営陣の多くの関心と資源が必要になるだろう。しかも、私たちがこのような訴訟の最終的な解決義務に提供する保険は十分ではないかもしれない。これらの要因により、どのような潜在的な訴訟も私たちの財務業績に重大な悪影響を与え、私たちの株価を下落させ、ひいては私たちを証券集団訴訟の影響を受ける可能性がある。
項目1 B。..未解決従業員意見
ない。
プロジェクト1 C。..ネットワーク·セキュリティ
正常な業務過程において、著者らは独自と機密業務情報、知的財産権、臨床と非臨床試験に関する情報、敏感な第三者情報と従業員情報を含む敏感な情報を収集し、保存する。
私たちのプロセスは、私たちの情報システム、データ、資産、インフラ、計算環境をネットワークセキュリティの脅威とリスクから保護することを目的としています。我々のネットワークセキュリティ戦略は、管理された検出および応答サービスを使用して、可能なネットワークセキュリティ脅威が存在するかどうかを決定するために、当社のネットワークインフラストラクチャおよび関連端末を監視することを含む。また、我々は多要素認証を用いて、抑止、予防、緩和、ネットワークセキュリティ脅威への対応を目的とした定期浸透テストと他の論理、物理と技術制御を実行する。また,我々の情報システムには継続的な警報計画が含まれており,我々は定期的に従業員にネットワークセキュリティ警告を提供し,我々のセキュリティポリシーを遵守することの重要性を強調している.
我々は組織リスク評価を行い、管理層がデータ資産を識別し、潜在的な脅威を識別し、評価し、潜在的な脆弱性を調査するのを助ける。我々は,ネットワークセキュリティリスクとその可能性のある影響を軽減するために,漸進的な情報技術戦略を検討·実施している.リスク評価は、経営陣がリスク管理決定を行い、リスクを軽減するために資源を分配することを可能にする。私たちはまた定期的に第三者に私たちのネットワークセキュリティ実践の有効性を評価するように招待する。
本年度報告日までに,過去に検出されたいかなるネットワークセキュリティ事件も,我々の業務戦略,運営結果や財務状況に重大な影響を与えたり,合理的な可能性が重大な影響を与えたりするとは考えられない.私たちは、ネットワークセキュリティ事件に遭遇したときに発生する可能性のある潜在的な財務損失を保証する個別のネットワークセキュリティビジネス保険証を提供しません。
“リスク要因-当社の業務および運営に関連するリスク”を参照して、当社のビジネスが直面しているネットワークセキュリティに関連するリスクまたは当社の情報セキュリティシステムの破壊または損害に関する他の情報を理解してください。
第2項。第2項:属性
テキサス州オースチンにオフィスビルを持っています。その一部は私たちの会社本部です。この物件は私たちが今後数年間期待している事業の成長と拡張を満たすことを目的としている。メンテナンス、実物施設、賃貸、物件管理、その他の物件所有権に関する重要な職責は専門の不動産マネージャーにアウトソーシングされる。オフィス総合体の面積は約90,000平方フィートです。2023年12月31日現在、約25%の物件を占めています。
第3項法律訴訟
私たちは、FDAに提出された米国政府の調査、調査、市民請願書を含む訴訟や他の法的手続きやクレームに時々参加している可能性があります。また、通常の業務過程で発生した問題について政府当局から問い合わせを受ける可能性もあります。このような訴訟の結果は本質的に不確実だ。結果にかかわらず、弁護と和解費用、管理資源の移転、および他の要因により、法的手続きは私たちに悪影響を及ぼす可能性がある。現在、彼らの可能な結果を評価することもできないし、結果が私たちに重要かどうかを評価することもできない。私たちは現在入手可能な情報に基づいて、私たちが法務に提供する総準備が十分だと信じている。
政府調査
2021年11月15日、いくつかの政府機関は、より多くの企業情報や文書の提供を要求していることを開示した。これらはすべて秘密の要求です。私たちは自発的に協力してきて、このような調査に協力し続けるつもりだ。会社やその役員、従業員または取締役が不正行為や不正行為を研究している証拠があることを発見した政府機関はありません。これらの調査に関連したクレームや告発を行う政府機関はありません。私たちは政府機関が私たちや他の人たちに法執行行動を取るかどうかを含めて、これらの進行中のことの結果や影響を予測することができない。
証券集団訴訟と株主派生訴訟
2021年8月27日から2021年10月26日までの間に、4件の可能性のある集団訴訟が提起され、私たちと特定の指名された官僚が連邦証券法に違反したと告発された。これらの訴えはFDAに提出された市民請願書に含まれる告発に依存し、Simufilamに関する被告の様々な陳述が実質的な虚偽と誤解されていると主張している。市民請願書はその後FDAによって拒否された。このような訴訟はアメリカテキサス州西区地域裁判所で提起された。これらの訴えはいわゆる1種類の購入者が指定されていない補償性損害賠償と他の救済を求めることを代表する。
2022年6月30日、連邦裁判官は4つの集団訴訟を1つの事件に統合し、首席原告と首席弁護士を任命した。主原告は、2022年8月18日に2020年9月14日から2022年7月26日までの間に我々の証券を購入した想定カテゴリの購入者を代表して改訂された合併起訴状を提出した。2023年5月11日,裁判所は原告のナダフ·フリードマン博士,我々の元首席医療官,現在亡くなった取締役会社に対する原告の訴訟を偏見で却下したが,被告の却下動議を却下した。被告は2023年7月3日に合併の修正後の起訴状に回答した。2024年2月22日、原告は起訴状を補完し、推定された授業時間を2023年10月12日に延長する動議を提出した。
2021年11月4日、米国テキサス州西区地区裁判所は、米国証券法と州受託責任法に基づいて、特定の指名された高級管理者と会社の取締役会メンバーにクレームを出すと主張する会社を代表すると言われる関連株主派生訴訟を提起した。この苦情は市民請願書で提起された告発に依存し、これらの請願書はFDAに提出された(その後FDAによって否定された)。起訴状によると、他の事項を除いて、個別の被告は会社に重大な虚偽と誤った陳述を招き、アメリカ証券法に違反し、彼らの会社に対する受託責任に違反し、会社を指定されていない損害賠償と証券法の責任に直面させる。その他の事項を除いて、デリバティブ事件は、個別被告が告発された不当行為による不特定の補償性損害賠償を会社を代表して追及することを求めている。当デリバティブ事件の原告は当社に救済を求めていませんが、当社は個別被告に対して一定の賠償義務を負っています。2021年11月4日から2023年6月20日までの間に、実質的に類似したクレームを告発する4つの株主派生商品訴訟が提起され、そのうちの2件は米国テキサス州西区地区裁判所、一緒にテキサス州裁判所(テルアビブ県地区裁判所)、一緒にデラウェア州衡平裁判所である。2022年7月5日、3つの連邦裁判所訴訟が一つの訴訟に合併された。上記のすべての訴訟は現在棚上げされており、上記の合併証券訴訟のさらなる発展を待っている。2023年11月9日、別の株主派生訴訟は米国テキサス州西区地区裁判所に提起され、告発クレームはほぼ似ている。この事件の当事者は既存の合併連邦裁判所株主派生訴訟に合併される予定だ。
2024年2月2日、同社と特定の指名された幹部が連邦証券法違反を告発した可能性のある集団訴訟が提起された。この訴訟は2023年10月12日の定期刊行物記事に依存しており、この文章は、同社のニューヨーク都市大学の高級科学協力者が科学的不正行為の疑いがあると言われている報告書を記述している。起訴状によると、被告はSimufilamが行った様々な陳述について、この条のために重大な虚偽と誤解性を持っているという。この訴訟はアメリカイリノイ州北区地域裁判所に提起された。起訴状代表は、2022年8月18日から2023年10月12日までの間に同社の証券を購入した一部のバイヤーが、指定されていない補償性損害賠償と他の救済を求めるという。
上記の説には根拠がなく,これらの訴訟に対して有力な抗弁を行う予定であると考えられる。私たちはこれらの訴訟に関連した可能な損失や損失範囲を推定することができない(もしあれば)。
2022年8月19日、デラウェア州衡平裁判所は会社を代表するとされる株主派生訴訟を提起し、州受託責任法に基づいて会社のある指名された幹部と取締役会メンバーにクレームを出したと主張した。起訴状によると、個別被告は他の事項を除いて、2020年8月に2020年現金インセンティブボーナス計画を承認し、彼らの受託責任に違反した。このような不満は指定されていない補償損害賠償と他の救済を求めている。2023年1月6日、原告は修正された起訴状を提出した。被告は2023年3月10日に改正された訴えに対して一部の回答を提出し、2023年3月14日に発議して修正後の訴えを部分的に却下した。2024年1月25日、双方はこの訴訟について拘束力のある和解条項説明書を締結した。和解は和解を提案する規定と裁判所の最終承認を含むいくつかの条件にかかっている。提案された和解は、当社および個別被告に対するクレームを解決し、和解は、いかなる被告が認め、譲歩し、または任意の過ち、責任、または任意のタイプの不正行為を発見することを構成しないという条項を含む。最終的な和解協議会が実行されることは保証されず、このような協議会が裁判所の承認を得る保証もない。
プロジェクト4.パートナーシップ炭鉱安全情報開示
適用されません。
第II部
プロジェクト5.パートナーシップ登録者普通株市場、関連株主事項及び発行者による株式証券の購入
市場情報
私たちの普通株はナスダックで取引され、コードは“SAVA”だ
所持者
2024年2月20日現在、私たち普通株の登録所有者は約2800人です。実際の株主数は,実益所有者であるがその株が街頭名義で仲介人や他の被命名者が保有する株主を含むこの記録保有者の数を超えていると考えられる.
非登録証券を売却する
ない。
発行者が株式証券を購入する
ない。
配当政策
私たちは現在、2012年12月に特別非配当分配(普通株1株0.75ドル、合計3,400万ドル)と2010年12月(普通株1株2ドル、合計8,570万ドル)を行ったが、予測可能な未来には現金配当金は支払われないと予想される将来の収益(あれば)を私たちの業務運営と拡張に維持する予定だ。
株式表現グラフ
次の図はナスダック総合指数とナスダック生物技術指数に対する私たちの普通株の累積株主リターンの累積総リターンを比較した。2019年1月1日に我々の普通株式と1指数あたり100ドルの投資が行われたと仮定し、その相対表現を2023年12月31日まで追跡した。米国証券取引委員会が適用する規則によると、すべての価値はすべての配当金に全額再投資すると仮定しているが、これまで私たちの普通株は現金配当を発表していない。以下のグラフに示す株主リターンは歴史的結果に基づいており、必ずしも未来の業績を代表するとは限らず、将来の株主リターンについては何の予測も認めません。
本業績グラフは、募集材料とみなされてはならず、又は取引法第18節の目的について米国証券取引委員会に届出されているか、又は他の方法で同節に規定された責任の制約を受けているものとみなされてはならず、参照により会社に組み込まれたいかなる内容ともみなされてはならない’Sは“証券法”又は“取引法”に基づく出願。
プロジェクト6.パートナーシップ[保留されている]
プロジェクト7.パートナーシップ管理する’財務状況と経営成果に関する検討と分析
本議論と分析 私たちの財務状況および経営結果は、本年度報告の他の場所にあるForm 10-Kを含む当社の連結財務諸表および付記と共に読まなければなりません。本議論には、我々の経営陣の信念に基づいた私たちの計画、目標、期待、および意図の陳述など、リスクおよび不確実性に関する前向きな陳述が含まれている。経営業績は必ずしも未来の期間に起こりうる結果を代表するとは限らない。このような違いを引き起こす可能性がある要素は含まれていますが、これらに限定されません“リスク要因”本年度報告の表格10−K部分。
概要
私たちは臨床段階のバイオテクノロジー会社で、テキサス州オースティンに本部を置いています。私たちの使命はアルツハイマー病のような神経変性疾患を検出して治療することだ。私たちの新しい科学は安定に基づいていますが脳の重要なタンパク質を除去するのではありませんわれわれの主要な候補治療薬Simufilamは全面的に登録された第三段階臨床研究を行っており,アルツハイマー病痴呆の治療に用いられる薬剤の評価を行っている。
過去12年間に、著者らは最先端の技術と神経生物学の新しい知見を結合し、アルツハイマー病と他の神経変性疾患のために新しい解決策を開発した。私たちの戦略は、私たちの独特な科学/臨床プラットフォームを利用して、アルツハイマー病のような神経変性疾患を治療する一流の計画を開発することです。
現在2つのバイオ製薬資産が開発されています
| ● |
私たちの主要な候補治療製品はSimufilamと呼ばれ、アルツハイマー病認知症を治療する新しい経口療法である |
| ● |
著者らの先行研究による製品候補製品SavaDxの診断は小サンプルの血液中にアルツハイマー病の存在を測定する新しい方法である。 |
アルツハイマー病を治療する科学的な方法は同時に抑制を求めていますどちらもある神経変性と神経炎症です脳の多くの重要な機能を改善する能力はアルツハイマー病を解決する新しい異なる方法と重要な方法を表していると信じています
シまさか蘭は改変したFLNAをその天然,健康なコンホメーションに戻すことで脳健康を改善し,改変したFLNAの下流毒性効果を相殺すると考えられる。Simufilamを用いて脳の健康を改善する実験や臨床的証拠が生成され発表された。重要なのは,シモフィランは脳中のアミロイド除去に依存しないことである。シトロランは独自の薬物作用機序を有していることから,その潜在的な治療効果は,神経変性を治療するための他の候補治療薬と相加あるいは協同作用している可能性が考えられる。
著者らは現在、2つの無作為プラセボ対照のシモフィラン内服によるアルツハイマー病痴呆患者の3期臨床試験を行っている。この2つの試験はすべて完全に組み込まれている。これらの実験は合計約1900名の軽中度アルツハイマー病患者をベースラインとしてランダムに選択した。私たちの第三段階計画のすべての治療効果データは依然として盲目だ。現在のところ治療効果結果に関する中期的な分析はない。
我々の最初の第3段階研究名はReThink-ALZであり、Simufilam 100 mg錠剤とプラセボの52週間以内の安全性と有効性を評価することを目的としている(NCT 04994483)。我々の52週の第3段階研究の主な結果は2024年末頃を予定している。
著者らの第二段階3研究名はREFOCUS-ALZであり、シモフェラン100 mgと50 mg錠剤とプラセボの76週間以内の安全性と有効性を評価することを目的とした(NCT 05026177)。我々の76週間の第3段階研究の主な結果は2025年頃に予定されている。
私たちの研究的診断製品候補製品名はSavaDxであり、初期プロジェクトであり、一部の血液サンプルからアルツハイマー病の存在を検出することに集中している。アルツハイマー病の検査を血液検査のように簡単にすることを目標としています
財務概要
私たちはまだ製品販売から何の収入も得ていません。2023年12月31日現在、私たちの累計赤字は380.8ドルです。これらの損失は,主に研究や開発活動に関する費用,給料,その他の人員に関する費用,一般会社費用によるものである。研究·開発活動には,臨床前と臨床研究および我々の候補製品に関連する臨床用品のコストが含まれている。賃金及び他の人事関連費用は、従業員及び非従業員に付与されたオプション及び他の持分報酬に関連する株式ベースの報酬を含む。私たちの経営結果は臨床前活動のスケジュール、私たちの候補製品の臨床研究登録率及び私たちの臨床用品に対する需要によって異なる時期の間に大きく変動する可能性がある。
私たちは2023年12月31日の現金と現金等価物が、少なくとも今後12ヶ月の運営費用に資金を提供できると信じている。さらに、私たちは将来、より多くの公共またはプライベートエクイティまたは債務融資または他のソースを通じて私たちの業務に資金を提供することを求めるかもしれない。しかし、私たちは必要に応じて優遇条件で、または追加資金を調達できないか、またはそのような他の計画を達成することができないかもしれない。もし私たちが資金調達や利益を達成できなければ、関連する流動性の不足は私たちの運営と将来の見通しに実質的な悪影響を及ぼすだろうし、私たちは私たちの主要な候補薬Simufilamの開発と商業化を大幅に延期、削減、または停止しなければならないかもしれないし、私たちの製品ラインを拡大する努力を延期しなければならないかもしれない。
私たちは今後数年間私たちの業務で大量の現金資源を使用し続けると予想している。私たちは将来運営活動と資本支出に対する現金需要が増加するかもしれない
| ● |
私たちが行っているSIMUFIAM第3段階計画を続けて |
| ● |
大型シムフェラムの消耗品を生産し |
| ● |
私たちの候補製品のために他の臨床前と臨床研究を行います |
| ● |
私たちの候補製品のために規制部門の承認を求めます |
| ● |
私たちの候補製品を開発し製造し商業化します |
| ● |
より多くの内部システムを実施し、新しいインフラを開発する |
| ● |
他の製品や技術を手に入れたり、私たちの技術の使用を拡大したりすることができます |
| ● |
私たちの知的財産権の範囲を維持し、保護し、拡大する |
| ● |
アメリカ政府の調査を含めて法的手続きやクレームに関連する資源がかかる |
| ● |
より多くの人員を雇う。 |
製品収入は私たちが規制部門の承認を得て私たちの候補製品を成功的にマーケティングする能力にかかっているだろう。私たちの開発作業が規制機関の承認を得て候補製品の商業化に成功した場合、私たちの薬物を直接販売することで、および/または将来のパートナーに薬物を許可すれば、許可料や販売許可製品を得る印税から収入を得ることが予想される。我々は,内部と連携計画を組み合わせた方式で我々の研究と開発計画を行った.著者らの大部分の製品開発は大学、ある協力者、CDMO、CROと臨床研究サイトとの手配に依存している。
経営成果の構成部分
運営費
研究と開発費
我々のほとんどの研究や開発努力はSIMUFIAMの開発に集中している.我々の研究診断製品候補製品SavaDxの研究開発費は,本報告で述べた時期の総研究開発費の1%未満である。以下の表は,研究·開発作業のための費用(単位:千):をカテゴリ別にまとめたものである
| 十二月三十一日までの年度 |
||||||||||||
| 2023 |
2022 |
2021 |
||||||||||
| 2期および3期の臨床試験 |
$ | 71,087 | $ | 54,149 | $ | 12,322 | ||||||
| 臨床前と第1段階の研究 |
6,425 | 2,966 | 927 | |||||||||
| 化学、製造、制御コスト(“CMCコスト”) |
2,910 | 2,573 | 4,606 | |||||||||
| 関係者 |
5,723 | 5,631 | 4,633 | |||||||||
| 株に基づく報酬 |
2,050 | 1,631 | 1,302 | |||||||||
| 他にも |
1,228 | 1,082 | 1,023 | |||||||||
| $ | 89,423 | $ | 68,032 | $ | 24,813 | |||||||
臨床試験費用には私たちCROの費用が含まれている。CMCコストは、私たちの契約開発と製造組織に関連するコストを含む。研究および開発費用には、補償、請負業者費用および用品、施設のような分配された公共費用が含まれる。
2023年12月31日までの1年間、NIH研究支出の精算を受けていません。2022年と2021年12月31日までの数年間に,米国国立衛生研究院からそれぞれ90万ドルと390万ドルの研究支出を得た。適用されれば、贈与収益は減少し、私たちの研究開発費を減らすために記録されるだろう。
私たちの技術は私たちのいくつかの候補製品の組み合わせに適用された。データ,ノウハウ,人員,臨床結果,研究結果,および我々のいずれかの候補製品の研究や開発に関する他の事項も我々の他の候補製品の開発に関連している。したがって,前述した所定のクロスアプリケーションにより,特定の候補製品に割り当てられるコストは,必ずしもその候補製品開発の実際のコストを反映するとは限らない可能性がある.
我々の候補製品の臨床開発完了日と開発完了のコストは高度な投機性と主観的であると予想される。医薬製品の研究、開発、商業化には多くの時間がかかる。1種の新薬のみを開発する臨床研究部分は通常数年を要する。著者らは、第三段階計画の支出が減少したため、著者らの研究開発費用は2024年頃にやや低下すると予想している。第三段階の臨床研究の患者スクリーニングと登録は現在完成したからである。第3段階プロジェクトコストの低下は、オープンラベル研究のより多くの登録者数と、より高い株式ベースの報酬支出部分によって相殺されると予想される。我々は,現在の研究開発活動で得られたデータの審査に基づいて,我々の将来の研究開発計画を再評価する予定である.私たちの将来の研究開発活動のコストと速度は相互に関連しており、変化する可能性がある。
肝心な会計見積もり
アメリカ公認会計原則に基づいて私たちの連結財務諸表を作成する際には、連結財務諸表と付記報告書に報告されている資産、負債、収入、費用、利息収入金額に影響を与える推定と仮定を行う必要があります。私たちは合意と研究協力に関する評価を含む私たちの評価を継続的に評価する。過去の経験や当時の状況で合理的な様々な他の仮定から推定した結果,資産や負債の帳簿価値を判断する基礎となっているが,そのような資産や負債の帳簿価値は他の出所から容易に見られるわけではないと考えられる。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。
我々の重要な会計政策は、本年度報告書10-K表の他の部分の総合財務諸表付記2に記載されており、以下で議論する会計政策は、最大限の複雑性に関連しており、我々の経営陣が重大な判断と推定を行うと信じている。我々が我々の会計政策を適用する際に用いる方法,見積もり,判断は我々の経営結果に大きな影響を与えるため,以下の政策は我々の財務状況や経営結果を理解し評価するために最も重要であると考えられる。
| ● |
契約書、前払い費用、計算費用を検討します。私たちはすでに研究機関や他の第三者サプライヤーと様々な研究開発契約を締結した。このような合意は一般的にキャンセル可能だ。関連支払いは発生時に研究と開発費用を計上する。我々は,進行中の研究コストを見積もるために前払いと課税費用を記録した.前払い費用および計算すべき負債の十分性を評価する際に、イベントの段階または完了状況、受信された請求書および契約コストを含む研究の進行状況を分析する。いずれの報告期間終了時の前払い残高と計上残高を決定する際には,重大な判断と見積もりを行う。実際の結果は私たちの推定とは違うかもしれない。私たちの歴史的前払いと計算された見積もりは実際のコストと実質的な差がない。 |
| ● |
法律と他の事項があります。同社はSimufilamとSavaDxに関する訴訟、クレーム、告発、調査に直面している。その会社はこのような告発に根拠がないと考え、このような訴訟に積極的に抗弁しようとしている。当社はこれらの訴訟に関する可能な損失や損失範囲を見積もることができません(あれば)。しかし、訴訟は内在的な不確実性の影響を受け、不利な判決が発生する可能性がある。不利な裁決が発生した場合、裁決発生期間または将来の期間の運営結果、キャッシュフローまたは財務状況に重大な悪影響を及ぼす可能性がある。関連または事項のさらなる資料は、連結財務諸表付記12を参照されたい。 |
| ● |
2020年現金奨励金計画。2020年には、計画参加者を激励するための2020年現金インセンティブボーナス計画(以下、計画)を策定した。この計画下の賠償は会計基準編纂(ASC)718“株に基づく報酬”における責任賠償として入金される。各潜在的計画報酬の公正価値は、付与日が決定された後に決定され、各報告期間において再計量されるであろう。パフォーマンス条件が満たされる可能性があると考えられた場合、計画に関連する報酬費用は、各計画報酬の期待実現中に確認される。 |
この計画の設立は、会社の長期成功を促進するためのものであり、“リスクのある”現金ボーナス計画を作成することであり、我々の時価が大幅に増加するとともに、計画参加者に追加の現金補償を提供することである。この計画は、我々の時価が大幅に増加しない限り、計画参加者が現金配当を得ないため“リスクがある”と考えられ、(1)売却会社またはその資産所有権を構成する重大な合併または買収取引(合併取引)を完了したか、または(2)取締役会報酬委員会(報酬委員会)が、会社の手元に十分な現金支払い(それぞれ、“業績条件”)があると判断した場合は、いずれも決して起こらない可能性がある。これらの要求自体の裁量権と不確実性から,2023年12月31日現在,新計画の付与日は発生していないと結論した。2023年12月31日現在、この計画によると、許可されていないか、または参加者に実際の現金を支払うことができない。
| ● |
株の報酬に基づく。私たちはすべての株式オプションと他の株式の奨励に基づく公正価値の非現金支出を確認した。本文はBlack-Scholesオプション定価モデルを用いて株式オプションの公正価値を計算し、それぞれ単一オプション奨励法と直線帰因法を採用した。ブラック·スコアーズオプション評価モデルの投入を決定する際には,重要な判断と見積りが行われる。株式に基づく報酬の重大な仮定については、当社の連結財務諸表付記7を参照されたい。 |
最近の会計公告
本年度報告表格10-K第II部分第8項連結財務諸表付記中の重要会計政策の概要を参照。
業務成果−2023年12月31日までと2022年12月31日までの年度比較
研究開発費
研究と開発費用には、主に私たちの候補製品に関する薬物開発作業コストが含まれている
| ● |
臨床研究は |
| ● |
臨床前テストは |
| ● |
臨床用品や関連処方や設計費用 |
| ● |
給与と他の人員に関する費用。 |
研究開発費は2022年の6800万ドルから2023年末の8940万ドルに増加し、31%増加した。この増加は,主にSIMUFILAMが行われている第3段階臨床計画に関するコスト,認知維持研究,進行中のSIMUFILAMオープンタグ研究のコストによるものである。比較的に高い臨床前研究コストもこの増加の原因の一つである。
著者らは、著者らの第三段階の臨床計画の患者スクリーニングと登録の完成に伴い、未来の研究開発費用は少し低下すると予想している。第3段階計画コストの低下は、オープンラベル研究のより多くの登録者数と、2023年の新たな支出による株式ベースの報酬支出の増加によって部分的に相殺されることが予想される。
一般と行政費用
一般費用および行政費用には、人件費、分配された費用、外部専門サービスの他の費用が含まれ、法律、人的資源、監査、会計サービスが含まれる。人員費用には賃金、ボーナス、福祉、株式給与が含まれる。分配された費用は主に既存の施設費用で構成されている。上場企業としては、米国証券取引委員会やナスダック規制の遵守に関する費用を含む保険、監査、投資家関係、SOXコンプライアンス、その他の行政や専門サービス費用が発生します。一般·行政費は2022年の1200万ドルから2023年の1650万ドルに増加する。38%の増加は、主に前年と比較して、法的費用、新たな贈与奨励による株式ベースの補償、および人員コストの増加によるものである。
利子収入
2023年、利息とその他の収入の純額は780万ドルだったが、2022年は280万ドルだった。利息収入の増加は、2023年の金利が前年より向上したためだ。
私たちは運営に大量の現金残高を使っているので、2024年末の利息収入は2023年末より低下すると予想されています。
その他の収入、純額
私たちが所有している建物の中のオフィススペースの第三者へのレンタルに関する活動を他の収入純額として記録します。レンタルは会社運営の核心ではないからです。2023年12月31日までの1年間で、他の収入純額は90万ドルだったのに対し、2022年は100万ドルだった。より高い空き率が賃貸料収入を低下させることが予想されるため、2024年には他の純収入が減少すると予想される。
オフィスビルの減価償却や償却は一般や行政および研究開発費に含まれているため,他の収入純額には反映されていない。
2022年12月31日までと2021年12月31日までの年次比較
2022年12月31日までの年度と2021年12月31日までの年度の経営結果の検討については、我々の2022年年報10−K表の項目7.経営陣の財務状況と経営結果の検討と分析−経営結果を参照されたい。
流動性と資本資源
設立以来、私たちは主に株式の公開と非公開発行、協力協定に従って受け取った支払い、そして私たちの現金と現金等価物残高から稼いだ利息によって、私たちの運営に資金を提供してきました。我々は引き続き我々の資本資源を利用して研究開発活動,資本支出,運営資本要求,その他の一般企業用途に資金を提供する予定である。2023年12月31日現在、現金と現金等価物は合計121.1ドル。
2024年普通株式承認株式証の分配と継続発行
2024年1月3日、2023年12月22日現在の終値時の私たち普通株の登録所有者に、私たちの普通株の株式を購入するために、約1690万部の株式承認証の分配を完了しました。
2024年1月3日から2024年2月26日まで、会社は合計1株33.00ドルの行使価格で約659,000株の株式承認証を行使し、会社に約2,180万ドルの毛収入をもたらし、赤株部分を含む約989,000株の普通株を発行した。前2000万ドルの毛収入を得た後、当社は私たちの首席財務顧問に売却普通株で得られた毛収入の約2.5%を手数料として支払い、株式承認証の分配に用いることが義務付けられている。
株式満期日(以下に述べる)の前に、引受権証を行使する所有者は、引受権証を行使する毎に、追加の行使価格を支払うことなく、追加0.5株普通株式を取得する。配当株式を受け取る権利は、(I)最初の30取引日期間(2024年1月3日以降)の最終取引日以降の最初の営業日(普通株の1日当たり出来高加重平均価格(“VWAP”)が、その時点で適用されたトリガ価格(最初は26.40ドル)の少なくとも20取引日(“紅価格条件”)および(Ii)当社の20営業日以上の公告(両条件とも“紅株満期日”)で指定された日(早い者を基準とする)に失効する。いずれの行使日も紅株満期日以降の引受権証は、紅株部分を獲得する権利がない。当社は、(I)当社が紅株満期日を設定していれば、その日の少なくとも20営業日前に公表し、及び(Ii)紅株条件に属する場合は、紅株満期日の開市前に公表する。
事前償還しない限り、株式承認証は2024年11月15日に満期になり、行使を停止する。この等株式承認証は2024年4月15日以降に当社の唯一の選択権で随時償還することができる。私たちはプレスリリースを通じて少なくとも20日前に選択された償還日(あれば)を通知します。本年度報告が10−K表で提出された日から,株式承認証の発売が行われている
2022登録直売製品
2022年11月22日、私たちは普通株式発行を完了し、これにより、一部の投資家は1株30.00ドルで1,666,667株普通株を購入した。発売費用を差し引くと、今回発売された純収益は約4730万ドル。
2021年の登録直売製品
2021年2月12日、私たちは普通株発行を完了し、これにより、ある投資家は1株49.00ドルで4,081,633株の普通株を購入した。発売費用を差し引くと、今回発売された純収益は約189.7ドル。
市場(ATM)で普通株を発行する
2023年5月1日、私たちは場外市場発売計画に入り、2023年5月1日にアメリカ証券取引委員会に提出された棚上げ登録声明によると、私たちは時々私たちの普通株を売却し、その普通株の総発行価格は最高2億ドルに達し、この声明は届出次第発効する。ATM機が普通株を売って得た毛収入の三%の手数料を支払う義務があります。私たちは今回の発行でどんな株式も売る義務がありません。
ATM機では2023年12月31日までの年間で普通株販売はほとんどない。
2020年3月には、米証券取引委員会が2020年5月5日に発効を発表した棚上げ登録声明に基づき、取引総発行価格が1億ドルに達する普通株を時おり売却する市場発売計画(“2020計画”)を締結した。私たちは2023年4月26日に2023年5月1日に施行される2020計画を終了する通知を出した。2020計画が終了するまで、普通株は販売されていない。
アメリカ国立衛生研究院研究補助金賞
私たちの研究は以前アメリカ国立衛生研究院の多くの研究支出の支持を得ました。NIHからの強力な歴史的支援は,我々の2つの主要候補製品SimufilamとSavaDxを臨床開発に進めることができる。
2021年5月,SIMUFILAM第3段階計画の臨床準備活動を支援するためにNIHから270万ドルまでの新しい研究支出を獲得した。この新しい非希釈性研究資金はアルツハイマー病治療の研究薬Simufilamの臨床計画を強化することを目的としている。我々のすべてのNIH研究助成は精算に基づいて支払われており,マイルストーンに基づく技術進歩が必要である。NIH支出は2023年12月31日まで余剰資金がない。
2020年現金奨励金計画義務
2020年8月に取締役会が承認しました2020年現金奨励金計画(“計画”)。この計画の設立は、会社の長期成功を促進するためのものであり、会社の時価が大幅に増加するとともに、計画参加者に追加の現金補償を提供する“リスクのある”現金ボーナス計画を作成する方法である。この計画は、会社の時価が大幅に増加し、計画に規定されているいくつかの他の条件を満たさない限り、計画参加者が現金配当を得ないため“リスクあり”とみなされる。具体的には、(1)会社が売却会社またはその資産所有権を構成する重大な合併または買収取引(合併取引)を完了しない限り、(2)報酬委員会は、計画が定義したように、会社の手元に十分な現金を持っていると判断しないであろう。合併取引が発生した場合、計画参加者はすべての稼いだ現金ボーナスを得るだろう。
当社の独立取締役は2022年12月31日現在、同計画の参加者である。しかし、2023年3月16日から取締役会は計画を修正し、計画参加者であるすべての独立取締役を罷免し、独立取締役はこれに同意した。独立取締役のこの計画下での潜在的利益シェアは、当社の所有に完全に没収され、その計画下の他の参加者には割り当てられません。当社のすべての独立取締役は受け取っておらず、当該等の改訂により当該計画下のいかなる金も受け取っていません。
2020年8月の同計画開始時には、同社の時価総額(すべての未返済株式オプションを含む)は8940万ドルだった。会社が20取引日連続で50億ドルを超え、上記の支払い条件を満たしている場合、すべての計画マイルストーンが実現されたとみなされ、この場合、現金ボーナス総額は最低111.4ドルから仮定最高289.7ドルまで様々になる。いずれの未返済権証も時価の決定外に含まれていない。
2020年に会社の時価総額がOne Planマイルストーンに達したことをもとに、2023年12月31日現在、計画参加者に対する潜在財務義務は合計650万ドル(2023年3月計画改正後)となっている。会社はその計画に基づいて金額を支払うために必要なすべての条件を満たしていないので、実際の現金ボーナスはどの計画参加者にも支払われていない。2021年12月31日までの年間で、会社の時価は大幅に増加した。このような成長は11個の追加計画マイルストーンの達成を触発する。全体的に、これらのマイルストーンの実現は、最低7,490万ドルから仮定の最高202.3ドルまで、計画参加者に対する会社の潜在的な義務を引き起こす可能性があり、具体的な金額は報酬委員会によって決定され、将来の業績条件に対する満足度に依存する。
2023年12月31日や2022年12月31日までの年間では、推定マイルストーンは実現されていない。
2023年12月31日現在、または本年度報告10-Kフォームの提出日まで、計画に従って許可されているか、または参加者に実際の現金は支払われていない。
現金の使用
次の表は、以下の各期間の主要な現金源と用途(千計)をまとめています
| 十二月三十一日までの年度 |
||||||||||||
| 2023 |
2022 |
2021 |
||||||||||
| 経営活動のための現金純額 |
$ | (82,025 | ) | $ | (77,514 | ) | $ | (30,196 | ) | |||
| 投資活動のための現金純額 |
(414 | ) | (2,712 | ) | (22,214 | ) | ||||||
| 融資活動が提供する現金純額 |
2,560 | 47,804 | 192,341 | |||||||||
| 現金および現金等価物の純増加 |
$ | (79,879 | ) | $ | (32,422 | ) | $ | 139,931 | ||||
2023年12月31日現在の年度、経営活動で使用されている現金純額は8200万ドルであり、主な原因は報告された純損失9720万ドルであり、一部は売掛金690万ドルの増加と売上高80万ドルの増加、前払いやその他の資産の170万ドルの減少、株による給与支出460万ドルおよび減価償却と100万ドルの償却によって相殺されている。
2022年12月31日までの1年間で、経営活動に用いられた現金純額は7750万ドルであり、主な原因は報告された純損失7620万ドル、売掛金340万ドルの減少、給与と福祉170万ドルの削減、発展支出50万ドルの削減に計上されるべきであるが、前払い資産やその他の資産によって120万ドル減少し、株式ベースの給与支出210万ドル分で相殺されている。
2023年12月31日までの年間で、投資活動のための現金純額は40万ドルで、わが社本社更生·固定施設の最終支払いとなった。
2022年12月31日までの年間で、投資活動のための現金純額は270万ドルで、会社本部の改修や固定施設に使われている。
融資活動が株式オプションを行使することで提供した現金純額は2023年12月31日までの年間で260万ドル。
2022年12月31日までの年間で、融資活動が提供する現金純額は4780万ドルで、2022年11月に普通株を直接発行する4730万ドルの収益と株式オプションを行使する50万ドルの収益が含まれている。
現金の使用– 2022年と2021年12月31日終了年度比較
2022年12月31日までの年度と2021年12月31日までの年度の現金使用状況の検討については、我々の2022年年報10−K表の項目7.経営陣の財務状況と運営結果の検討と分析−運営結果を参照されたい。
物件および賃貸借契約
テキサス州オースチンにオフィスビルを持っています。その一部は私たちの会社本部です。この物件は私たちが今後数年間期待している事業の成長と拡張を満たすことを目的としている。メンテナンス、実物施設、賃貸、物件管理、その他の物件所有権に関する重要な職責は専門の不動産マネージャーにアウトソーシングされる。オフィス総合体の面積は約9万平方フィート。2023年12月31日現在、私たちはこの物件の約25%の面積を占めており、残りの部分は賃貸するか、第三者にレンタルすることができます。ほとんどの既存のテナント賃貸契約は2024年に満期になります。2024年満期のテナント賃貸契約は、満期日後に延期、更新、再レンタルが得られない可能性があると考えられ、この場合、賃貸料支払いやこのようなオフィススペースの分担費用精算を受けなくなると考えられる。
テキサス州オースティンの取消できない運営賃貸契約によると、約6,000平方フィートのオフィススペースを借りました。レンタル契約は2024年4月に満期になります。私たちは2023年2月22日に賃貸契約を終了し、持続的な義務はありません。
将来の資金需要
2023年12月31日現在、私たちの累計赤字は380.8ドルです。私たちは未来に私たちの現金需要が大きくなると予想する。私たちの将来の現金需要の額と時間は、規制機関と市場が私たちの候補製品に対する受け入れの程度に依存し、私たちは研究と開発、調合、製造、商業化、そして私たちの製品を支持する資源に投入するだろう。私たちは私たちの現在の資源が私たちの業務に少なくとも今後12ヶ月の資金を提供するのに十分でなければならないと思う。私たちは将来的に公共資金や個人融資を通じて追加的な資金を求めるかもしれないが、もしこのような資金が利用可能であれば、私たちが受け入れられる条件だ。
もし私たちが株や株に関連した証券を発行することでより多くの資金を調達すれば、私たちの株主は希釈され、これは巨大かもしれない。もし私たちが優先株証券を発行したり、債務融資によって追加資金を調達したりすれば、私たちが加入しているこのような未来の優先株または債務の条項は、私たちに追加的な契約を適用し、私たちの業務を制限し、私たちの保有権または追加債務の発生を制限すること、配当金の支払い、私たちの普通株の買い戻し、特定の投資、およびいくつかの合併、合併、または資産売却取引を行う能力を含むかもしれない。私たちが調達した任意の債務融資または追加株式には、私たちまたは私たちの株主に不利な条項が含まれているかもしれない。もし私たちが必要な時に追加資金を集めることができなければ、私たちは私たちの開発計画と臨床試験の一部または全部を延期、減少または終了することを要求されるかもしれない。私たちはまた、他の人がいくつかの地域で私たちの候補薬または私たちが自分の適応を開発し、商業化することを望んでいるかもしれない権利を提供することができるかもしれないと要求されるかもしれない。
項目7 A.回答:市場リスクの定量的·定性的開示について
私たちは正常な業務過程で市場リスクに直面しており、主に金利敏感性と関係があり、次いで米国以外の臨床業務に関する為替レート変動である。
金利感度
私たちは金利の変化と関連した市場リスクに直面している。2023年12月31日現在、私たちは121.1ドルの現金と現金等価物を持っており、主にアメリカ国債と通貨市場口座から構成されている。
私たちの投資活動の主な目標は資本を保存し、私たちの運営に資金を提供することだ。私たちはまた大きなリスクを負うことなく投資から最大の収益を得ることを求めている。我々の目標を達成するために、取締役会が承認した投資政策に基づいて、高信用品質と短期持続時間を維持するための投資ツールを提供する。このような利息を稼ぐ道具はある程度の金利リスクを持っている。しかしながら、我々の現金等価物の納期は一般に短く、リスク状況は低いため、任意の時期に直ちに利上げまたは100ベーシスポイント低下することは、簡明総合財務諸表における年間純損失を200万ドル未満に増加または減少させるであろう。
プロジェクト8.パートナーシップ連結財務諸表と補足データ
連結財務諸表索引
| ページ | |
| 独立公認会計士事務所レポート(PCAOB ID: | 90 |
| 合併貸借対照表 | 92 |
| 連結業務報告書 | 93 |
| 株主合併報告書’*公平 | 94 |
| 統合現金フロー表 | 95 |
| 連結財務諸表付記 | 96 |
独立公認会計士事務所報告
タピオカ科学会社の株主と取締役会へ。
財務諸表のいくつかの見方
当社は、添付タピオカ科学会社(当社)が2023年12月31日及び2022年12月31日までの総合貸借対照表、2023年12月31日までの各年度の関連総合経営報告書、株主権益及び現金流量及び関連付記(総称して“総合財務諸表”と呼ぶ)を監査している。総合財務諸表は、すべての重要な点で、2023年12月31日、2023年12月31日、2022年12月31日までの会社の財務状況、および2023年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に基づき、テレデビル委員会協賛組織委員会が発表した“内部統制-総合枠組み(2013枠組み)”で確立された基準に基づいて、2023年12月31日までの財務報告内部統制を監査し、2024年2月28日に発表した報告書に対して保留意見を発表した。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要な監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することもない。
| 関係事項の記述 | CROに関する前払いと対策開発費用臨床試験転嫁コスト
総合財務諸表付記2で述べたように,当社は契約研究機関(CRO)と契約を締結し,当社の臨床試験に協力し,そのコストは発生した研究開発費に計上している。これらのコストの一部は,転嫁コスト,すなわちCRO契約の第三者が何らかの臨床試験サービスを実行するために発生するコストである。このような費用はCROによって会社に転嫁される。CRO支払いの時間によると、会社はこれらのコストを前払いまたは開発費用として記録している。これらの前払いまたは計算すべき開発費用は,経営陣が臨床試験の状態に基づいて第三者に発生する伝達コストを決定することに基づいている。2023年12月31日に、領収書発行時間および発生コストに基づいて、CRO伝達コストの前払いおよび課税開発費用はそれぞれ31.7万元および18.2万元であった
監査同社のCRO臨床試験伝達コストに関連する前払いおよび計算すべき開発費用は挑戦的であり、記録された金額は、管理層が提供されているがCROの第三者によって請求書を発行していないサービスによって発生するコストの完全性および正確性の検証に関するものであるからである。
|
| 私たちが監査でどのようにこの問題を解決したのか | 設計を評価し,CRO臨床試験伝達コストに関連する前払いと計算すべき開発費用の会計処理過程の制御に対する会社の操作有効性をテストし,管理層がCROから受け取った予算や領収書と比較した臨床試験活動の進展の審査を行った
CRO臨床試験移行コストに関連する会社の前払いおよび計算すべき開発費用の十分性を評価するために、我々の監査プログラムは、前払いおよび計算すべき開発費用の基礎データの完全性および正確性を決定するためのテスト管理層を含む。データの完全性と正確性を評価するために、著者らはサンプリングに基づいて、(I)CROからキー臨床試験契約条項および条件およびその任意の改訂の確認を直接取得し、およびこれまでに生じた転嫁コスト、(Ii)CROとの契約およびその任意の改訂時に使用された合意データ、および/またはCROから得られたデータを計算し、(Iii)会社に臨床試験を監督する者に問い合わせることによって臨床試験の進展を確認し、(Iv)CROから取得し、その後CROから受信した請求書を検討して、報告期間終了時の前払いおよび対応する開発費用を確認する。
|
| 関係事項の記述 | 損失があったりします 同社はSimufilamとSavaDxに関する訴訟、クレーム、告発、調査に直面している。総合財務諸表付記12に記載されているように、このような疑惑およびクレームは、不良な結果をもたらす可能性がある。当社は2023年12月31日現在、これらの訴訟や調査に関する損失の可能性(あれば)を特定できないため、損失や損失範囲を合理的に見積もることができません。
監査管理層は、経営陣が損失の可能性を評価するために判断する必要があるため、訴訟や調査に関連するまたは損失のある計算および開示を挑戦的に行う。
|
| 私たちが監査でどのようにこの問題を解決したのか | 私たちは設計を理解、評価し、会社が会計を評価し、これらの事項を開示する過程の制御に対する操作有効性をテストした。これには、損失が発生する可能性および損失または損失範囲が合理的に推定できるかどうかの管理層の評価の制御、および関連開示の発展が含まれる。
我々の監査手続は、進行中の訴訟及び調査の状況を把握し、取締役会及び取締役会委員会の議事録を読み、訴訟要約及び関連通信を読み、内部及び外部法律顧問に書簡を発行し、内部及び外部法律顧問と面会し、我々の法医学専門家と訴訟及び調査に関連する事態の進展を検討し、これらの事項について会社の書面陳述を得ることを含む。私たちはまたこのような事項に関する同社の開示状況を評価した。 |
/s/
2002年以来、私たちは同社の監査役を務めてきた。
2024年2月28日
タピオカ科学会社
合併貸借対照表
(千単位、株式及び額面データを除く)
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金と現金等価物 | $ | $ | ||||||
| 前払い費用と他の流動資産 | ||||||||
| 流動資産総額 | ||||||||
| 経営的リース使用権資産 | ||||||||
| 財産と設備、純額 | ||||||||
| 無形資産、純額 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 流動負債: | ||||||||
| 売掛金とその他の売掛金 | $ | $ | ||||||
| 発展費用を計算すべきである | ||||||||
| 報酬と福祉に計上すべきである | ||||||||
| 賃貸負債を経営し、流動 | ||||||||
| その他流動負債 | ||||||||
| 流動負債総額 | ||||||||
| 非流動経営賃貸負債 | ||||||||
| 他の非流動負債 | ||||||||
| 総負債 | ||||||||
| 引受金及び又は事項(付記10、11及び12) | ||||||||
| 株主権益: | ||||||||
| 優先株、$額面価値株式を許可して発行済みと未償還 | ||||||||
| 普通株、$額面価値ライセンス株;そしてそれぞれ2023年12月31日および2022年12月31日に発行および発行された株式 | ||||||||
| 追加実収資本 | ||||||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益総額 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
連結財務諸表の付記を参照。
タピオカ科学会社
連結業務報告書
(単位は千、1株当たりのデータは除く)
| 十二月三十一日までの年度 |
||||||||||||
| 2023 |
2022 |
2021 |
||||||||||
| 運営費用: |
||||||||||||
| 研究と開発,贈与金を差し引いて純額を清算する |
$ | $ | $ | |||||||||
| 一般と行政 |
||||||||||||
| 総運営費 |
||||||||||||
| 営業損失 |
( |
) | ( |
) | ( |
) | ||||||
| 利子収入 |
||||||||||||
| その他の収入、純額 |
||||||||||||
| 純損失 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | |||
| 1株当たり基本と希釈して純損失 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | |||
| 1株当たり純損失を計算するための基本株式と償却株式 |
||||||||||||
連結財務諸表の付記を参照。
タピオカ科学会社
合併株主権益報告書
(単位:千、共有データを除く)
| 合計する |
||||||||||||||||||||
| 普通株 |
その他の内容 |
積算 |
株主の |
|||||||||||||||||
| 株 |
額面.額面 |
実収資本 |
赤字.赤字 |
株権 |
||||||||||||||||
| 2020年12月31日残高 |
( |
) | ||||||||||||||||||
| 株式ベースの報酬: |
||||||||||||||||||||
| 従業員の株式オプション |
— | |||||||||||||||||||
| 非従業員株式オプション |
— | |||||||||||||||||||
| 株式オプションの行使により普通株を発行する |
||||||||||||||||||||
| 株式承認証の行使により普通株を発行する |
||||||||||||||||||||
| 登録直接発行とともに発行される普通株は、発行コストを差し引く |
||||||||||||||||||||
| 純損失 |
— | ( |
) | ( |
) | |||||||||||||||
| 2021年12月31日の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
| 株式ベースの報酬: |
||||||||||||||||||||
| 従業員の株式オプション |
— | |||||||||||||||||||
| 非従業員株式オプション |
— | |||||||||||||||||||
| 制限株式業績奨励満期 |
( |
) | ||||||||||||||||||
| 株式オプションの行使により普通株を発行する |
||||||||||||||||||||
| 登録直接発行とともに発行される普通株は、発行コストを差し引く |
||||||||||||||||||||
| 純損失 |
— | ( |
) | ( |
) | |||||||||||||||
| 2022年12月31日の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
| 株式ベースの報酬: |
||||||||||||||||||||
| 従業員の株式オプション |
— | |||||||||||||||||||
| 非従業員株式オプション |
— | |||||||||||||||||||
| 株式オプションの行使により普通株を発行する |
||||||||||||||||||||
| 純損失 |
— | ( |
) | ( |
) | |||||||||||||||
| 2023年12月31日の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
連結財務諸表の付記を参照。
タピオカ科学会社
統合現金フロー表
(単位:千)
| 十二月三十一日までの年度 |
||||||||||||
| 2023 |
2022 |
2021 |
||||||||||
| 経営活動のキャッシュフロー: |
||||||||||||
| 純損失 |
$ | ( |
) | $ | ( |
) | $ | ( |
) | |||
| 純損失と経営活動で使用される現金純額の調整: |
||||||||||||
| 株に基づく報酬 |
||||||||||||
| 減価償却 |
||||||||||||
| 無形資産の償却 |
||||||||||||
| 経営性資産と負債変動状況: |
||||||||||||
| 前払い資産とその他の資産 |
( |
) | ||||||||||
| 経営的リース使用権資産負債 |
( |
) | ( |
) | ||||||||
| 売掛金とその他の売掛金 |
( |
) | ||||||||||
| 発展費用を計算すべきである |
( |
) | ||||||||||
| 報酬と福祉に計上すべきである |
( |
) | ||||||||||
| その他負債 |
( |
) | ( |
) | ||||||||
| 経営活動のための現金純額 |
( |
) | ( |
) | ( |
) | ||||||
| 投資活動によるキャッシュフロー: |
||||||||||||
| 財産と設備を購入する |
( |
) | ( |
) | ( |
) | ||||||
| 投資活動のための現金純額 |
( |
) | ( |
) | ( |
) | ||||||
| 資金調達活動のキャッシュフロー: |
||||||||||||
| 株式オプション行使時に普通株で得られた金を発行する |
||||||||||||
| 2018年株式承認証行使時に普通株式取得金を発行する |
||||||||||||
| 普通株発行収益は,発行コストを差し引く |
||||||||||||
| 融資活動が提供する現金純額 |
||||||||||||
| 現金および現金等価物の純増加 |
( |
) | ( |
) | ||||||||
| 期初現金及び現金等価物 |
||||||||||||
| 期末現金および現金等価物 |
$ | $ | $ | |||||||||
| キャッシュフロー情報の追加: |
||||||||||||
| 非現金投資活動 |
||||||||||||
| 売掛金に掲げる財産と設備の購入 |
$ | $ | $ | |||||||||
連結財務諸表の付記を参照
タピオカ科学会社
連結財務諸表付記
1.概要、流動資金、列報基礎
タピオカ科学会社とその完全子会社(総称して“会社”と呼ぶ)は、以下の特徴を持つ候補特許薬品を発見·開発した5月.患者と医療専門家に著しい改善を提供する。同社は通常、その製品の発見と開発の重点を神経系疾患に重点を置いている。
強固な基礎
連結財務諸表には、当社及びその完全子会社の勘定が含まれている。すべての会社間取引は合併でキャンセルされた。
流動性
当社は設立以来重大な純損失とマイナスキャッシュフローを示しているため、累計損失#ドルを計上しています
2.重要会計政策の概要
予算の使用
当社は総合財務諸表を作成する際に米国公認の会計原則に基づいて見積もりと仮定を行っています。これらの推定及び仮定は、連結財務諸表の日に報告された資産及び負債額並びに又は有資産及び負債の開示、並びに報告期間内に報告された収入及び発生に影響を及ぼす費用である。同社は臨床試験や製造プロトコルに関する推定を含む推定を継続的に評価している。実際の結果は,これらの推定や仮定とは異なる可能性がある.
補助金の収益
.の間に2023,いくつありますか米国国立衛生研究院(“NIH”)によると補助金の精算を検討している。はい2022,そして2021,同社は$を受け取りました
現金および現金等価物と信用リスク集中
同社は現金と現金等価物で投資を行っている。会社は高流動性金融商品を考慮して、原始期限は三つ数ヶ月以下の時間を現金等価物とする。現金等価物とされる高流動性投資には、通貨市場口座と基金、預金証書、米国債が含まれる。当社の現金及び現金等価物は1つは金融機関です。
公正価値計量
当社は金融資産及び負債の公正価値計量及び開示に関する権威的な指針に基づいて金融商品を確認します。本指針は公正価値を定義し、公認会計原則に従って公正価値を計量する枠組みを構築し、公正価値計量に関する開示を拡大した。指導意見はまた一つ確立した三つ--公正価値レベルは、公正価値を計量する際に使用される投入を優先順位付けします。これらの階層には
| ● | 水平1活発な市場の見積もりも含まれています。 |
| ● | 水平2同じまたは同様の証券のオファーのような重要な観察可能な入力、または同様の証券の観察可能な市場データによって確認され得る他の入力を含む。同社は市場定価と以下のルートから得られた他の観察可能な市場投入を使用している第三に-党の提供者。これは,入札価格を用いて入札価格を得ることができる公正価値を決定する.その会社はやった注釈公平な価値を基礎とした金融商品があるかどうか2投入する。 |
| ● | 水平3少数またはサポートされている観察不可能な入力を含む違います。市場の活発度。その会社はやった注釈公平な価値を基礎とした金融商品があるかどうか3投入する。 |
金融商品が使用する投入が階層構造の異なるレベルに属する場合、そのツールは、公正価値計算に重要な最低投入レベルに基づいて分類される。現金と現金同等物の公正価値はレベルに基づいている1以下の位置で入力する2023年12月31日そして2022.
業務の細分化
同社は、その内部に基づいてその業務部門又は部門の経営業績を評価する方法で部門情報を報告する。その会社の業務は
株に基づく報酬
会社はすべての株式オプションと他の株の奨励に基づく公正価値で非現金支出を確認します。当社はブラック−スコアーズオプション評価モデル(略称ブラック−スコールモデル)を用いて株式オプションの公正価値を計算し,単一オプション奨励法と直線帰因法を採用した。このモデルは、予想株価変動、期待寿命、および各報酬の推定没収を含む主観的仮説の入力を要求する。これらの仮定には,将来の市場状況の推定が含まれており,これらの推定自体は不確実であるため,経営陣の判断を受けている.付与されたすべてのオプションについて、直線に基づいて生成された公正価値を各株式オプション帰属期間の費用として確認するのが一般的であるあるいは…何年もです。
会社は、ある業績基準に達したときに付与された株式ベースの奨励(“業績奨励”)を付与している。同社は業績奨励の数量に授与日の普通株の公正価値を乗じて、各奨励の公正価値を計算した。それは各賞の業績基準を達成するための暗黙的なサービス期間を推定した。会社が業績基準を達成する可能性があると結論した場合には,それによる公正価値を暗黙的なサービス期間内の費用として確認する。それは定期的に審査し、その隠れたサービス期間に対する見積もり数と業績標準の実現に関する結論を適宜更新する。パフォーマンス報酬ベストと普通株式は、パフォーマンス基準に達したときに発行されます。
1株当たり純損失
当社は報告期間中に発行された普通株の加重平均に基づいて1株当たり基本純損失を計算します。1株当たり純損失を希釈するのは,発行済み普通株の加重平均に潜在希釈性既発行普通株の加重平均を加え,在庫株方法を用いて計算した。潜在希釈性普通株は発行済み普通株式オプションと引受権証からなる。1種類あります違います。会社の純損失と全面赤字の差額です。基本と希釈後の1株当たり純損失を計算する分子と分母は以下のとおりである(単位:千、1株当たり純損失データは含まれていない)
| 十二月三十一日までの年度 | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| 分子: | ||||||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | |||
| 分母: | ||||||||||||
| 1株当たり純損失を計算するための基本株式と償却株式 | ||||||||||||
| 1株当たり基本と希釈して純損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | |||
| 普通株オプションを希釈して1株当たりの純損失を計上せず,希釈した後 | ||||||||||||
同社には普通株式オプションおよび未償還引受権証は含まれていない
金融商品の公正価値
金融商品には売掛金、課税費用、そして他の負債が含まれている。特定の金融商品の見積もり公正価値5月.既存の市場情報または他の適切な推定方法を使用して決定される。しかし,市場データを解釈して公正な価値推定を作成する際には,かなりの判断力が必要となるため,推定は注釈現在の市場取引で現金化または支払うことができる金額を表示しなければならない。異なる市場仮説および/または推定方法を用いた効果5月.公正価値金額を見積もることに大きな意味を持っている。支払すべき帳簿、売掛金、その他の負債の帳簿金額はコストで計算され、これらのツールの納期が短いため、これは公正価値に近い。
契約·前払い·課税項目を検討する
当社は研究機関やその他の機関と各種研究開発契約を締結した第三に-パーティーサプライヤー。このような合意は一般的にキャンセル可能だ。関連支払いは発生時に研究と開発費用を計上する。当社は見積もりの継続研究コストの前払いと計上費用を記録しています。前払い費用および計算すべき負債の十分性を評価する際に、会社は、イベントの段階または完了状況、受信された請求書および契約コストを含む研究進展を分析する。いずれの報告期間終了時の前払い残高と計上残高を決定する際には,重大な判断と見積もりを行う。実際の結果は会社の見積もりとは違うかもしれません。その会社の歴史前払いと計算には注釈実際のコストとは大きく異なる。
インセンティブ·ボーナス計画
はい2020,当社は設立された2020現金奨励計画(以下、“計画”と略す)は、計画参加者を激励するためのものである。この計画下の報酬はASC下の責任報酬として記録される718 “株に基づく報酬各潜在的計画報酬の公正価値は、各潜在的計画報酬の日付が発生した後に決定され、各報告期間において再計量される。1つの業績条件(以下の定義)が満たされる可能性があると考えられる場合には、各潜在的計画報酬の予期される達成中に、計画に関連する補償費用が確認される。備考をご参照ください11この計画をさらに議論するために。
賃貸借証書
会社はリースによる資産と負債を確認します。経営的賃貸については、会社は総合貸借対照表で使用権資産と賃貸負債を確認し、最初にレンタル期間内にレンタル支払いの現在価値を計量しなければなりません。会社はすべての条件に合った賃貸について短期賃貸確認免除を選択しました。つまり条件に合った賃貸契約に対して会社は注釈使用権資産や賃貸負債を確認します。会社のレンタルのように注釈暗黙的な金利を提供する場合、レンタル支払いの現在値を決定する際に、開始日利用可能な情報に基づく増分借入金金利を使用する。レンタル支払いのレンタル料金はレンタル期間内に直線法で確認します。
財産と設備
財産と設備は減価償却累計を差し引いたコストで入金されます。減価償却は資産の推定耐用年数内に直線方法で記録される。所有している建物と関連する改善により使用寿命を推定した
イベントや環境変化が資産の帳簿価値を示す場合,財産と設備の減価審査を行う5月.注釈取り戻すことができます。財産およびデバイスが減値されたとみなされた場合、減価損失が確認される。
無形資産
買収した無形資産は買収の日に公正価値で入金され、主に現地賃貸契約とレンタル手数料からなる。無形資産はその場で賃貸契約の推定寿命内に償却されています
無形資産は年次別およびその価値が減値されたと信じる理由がある場合や減値審査を行う。無形資産が減値とみなされれば,減価損失を確認する.
所得税
当社は貸借対照法で所得税に入金されています。繰延税金資産及び負債は既存資産及び負債の帳簿金額とそのそれぞれの税ベースとの差額による将来の税収結果を推定して確認します。繰延税項残高は、税率を反映するために現在公布されている税法に基づいて調整され、一時的な差が逆転すると予想される年に発効する。*会社は大量の繰延税金資産を蓄積し、純営業損失および税収控除の税収の影響を反映し、財務報告目的のための資産と負債の帳簿金額と所得税目的の金額との間の一時的な差を反映する。いくつかの繰延税金資産の現金化は未来の収益にかかっている。その会社は未来のどんな収益の時間と金額も確定しない。そこで、当社はこのような繰延税金資産を推定手当で相殺します。
当社はASCにより不確定税務頭寸を会計処理している740,“所得税”は、税収状況の不確実性を明らかにした会計処理である。これらの規定は会社の財務諸表で税務頭寸の影響を確認することを要求して、その頭寸比しかありません注釈税務機関の審査を経た後、そのポストの技術的価値に基づいて維持される。不確定な税収状況に関連する任意の利息および罰金は、所得税費用の構成要素として反映される。
3.前払い費用と他の流動資産
前払いや他の流動資産です2023年12月31日そして2022以下を含む(千単位):
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 前払い保険 | $ | $ | ||||||
| 契約研究機関とその他の保証金 | ||||||||
| 受取利息 | ||||||||
| 他にも | ||||||||
| 前払い費用とその他の流動資産総額 | $ | $ | ||||||
契約研究組織および他の保証金は、供給者に支払われた現金が発生した費用を超えることを指す。
4.不動産やその他の収入·支出
会社は1つを持っている二つテキサス州オースティンにオフィスビル統合体が建設され、その一部がその会社本部として建設された。この物件は今後数年間の会社の予想成長と業務拡張を満たすことを目的としている。メンテナンス、実体施設、賃貸、物件管理、その他の物件所有権に関連する重要な職責は専門不動産マネージャーにアウトソーシングされている。オフィスビルの面積は約
当社は建築業務と賃貸の純収入を他の収入、純額を賃貸としています注釈会社運営の中心です。建物減価償却と空間償却注釈当社が占用し、一般と行政費用を計上します。会社敷地面積の建物減価償却と償却は一般と行政費用および研究開発費の間で分配される。本報告で述べた期間の他の収入純額は以下のように構成されている(千計)
| 十二月三十一日までの年度 | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| 賃貸収入 | $ | $ | $ | |||||||||
| 物件運営費 | ( | ) | ( | ) | ( | ) | ||||||
| その他の収入、純額 | $ | $ | $ | |||||||||
同社は同ビルに関する財産税を累計して計#ドルを納めている
5.財産と設備
財産と設備の構成要素、純額、現在#年2023年12月31日そして2022具体的な数字は以下の通り(千計)
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 土地 | $ | $ | ||||||
| 建物.建物 | ||||||||
| 工事現場が改善する | ||||||||
| テナント状況を改善する | ||||||||
| 家具と設備 | ||||||||
| 建設中の工事 | ||||||||
| 総財産と設備 | $ | $ | ||||||
| 減価償却累計 | ( | ) | ( | ) | ||||
| 財産と設備、純額 | $ | $ | ||||||
財産と設備の減価償却費用はドルです
6.無形資産
無形資産の構成要素、2008年現在の純額2023年12月31日そして2022具体的な数字は以下の通り(千計)
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 原位置賃貸契約 | $ | $ | ||||||
| レンタル手数料とその他 | ||||||||
| 無形資産総額 | $ | $ | ||||||
| 累計償却する | ( | ) | ( | ) | ||||
| 無形資産、純額 | $ | $ | ||||||
無形資産の償却費用は#ドルです
有限寿命無形資産の償却費用は以下のように予想される(千単位)
| 12月31日までの年度 | ||||
| 2024 | ||||
| 2025 | ||||
| 全額償却する | $ |
7.株主権益と株式報酬
優先株
会社取締役会(“取締役会”)は#年に優先株を発行する権利がある1つはまたは複数のシリーズが、任意のシリーズまたはシリーズの名前を構成する権利、選好、特権、制限、および株式数を決定する。
2022登録された直売製品
開ける11月-22, 2022,その会社は普通株の発行を完了し,その発行に応じて一部の投資家が購入した
2021登録された直売製品
開ける二月一日12, 2021,その会社は普通株の発行を完了し,その発行に応じて一部の投資家が購入した
市場(ATM)で普通株を発行する
開ける2023年5月1日会社は市場定価による発売計画(“ATM”)に参加し、総発行価格が1ドルに達する会社の普通株を時々販売する
何人いますか
はい2020年3月同社は市場で株式を発行する計画を締結した“2020計画“)会社の普通株を時々販売し、総発行価格は最高$に達する
2008持分激励計画
当社の2008株式インセンティブ計画や2008株式権計画は、その従業員、取締役と顧問が株式に基づく奨励を獲得し、株式オプションと業績奨励を含む。♪the the the2008株式計画は2017年12月株式ベースの奨励金は通常満期になる10個授与の日から数年。
2018持分激励計画
会社の取締役会または取締役会が指定した委員会が会社の管理を担当する2018総合奨励計画(2018計画)と、付与された各オプションの条項及び条件を決定し、2018計画してみます。会社の従業員、役員、コンサルタントには根拠があります2018株式オプションの付与と業績奨励を含む計画。株式ベースの奨励金は通常満期になる授与の日から数年。♪the the the2018改訂された図則2022年5月5日最高可達発行を規定する
株式オプションまたは業績奨励が行使された場合には、行使価格および税収を差し引いて、発行された株式数は、奨励受給者が納付すべき税金に相当する株式数を減算し、その数の株式は抹消される。会社(The Company)5月.そしてその現金で税務機関に受賞者とその代表が支払うべき法定税金を納めます。
株式オプション
以下に株式オプション活動に関する情報をまとめる2023:
| 加重平均 | 加重平均 | |||||||||||||||
| 量 | 加重平均 | 余剰契約 | 内在的価値を集める | |||||||||||||
| オプション | 行権価格 | 年単位の期限 | 百万の計 | |||||||||||||
| 2022年12月31日現在の未返済債務 | $ | $ | ||||||||||||||
| 付与したオプション | ||||||||||||||||
| 行使のオプション | ( | ) | ||||||||||||||
| オプションは没収/キャンセルされます | ( | ) | ||||||||||||||
| 2023年12月31日現在の未返済債務 | — | $ | — | |||||||||||||
| すでに帰属しており、2023年12月31日に帰属する予定です | $ | |||||||||||||||
| 2023年12月31日に行使できます | $ | $ | ||||||||||||||
今年度中に行使する株式オプション2023年12月31日
以下は株式オプションに関する情報の要約であり,サイトは2023年12月31日一連の行使で価格:
| 未償還オプション | 行使可能なオプション | |||||||||||||||||||||||||
| 重みをつける | ||||||||||||||||||||||||||
| 平均値 | 重みをつける | 重みをつける | ||||||||||||||||||||||||
| 量 | 残り | 平均値 | 量 | 平均値 | ||||||||||||||||||||||
| 行権価格区間 | 卓越した | 契約書 | トレーニングをする | 既得 | トレーニングをする | |||||||||||||||||||||
| 自自 | 至れり尽くせり | オプション | 寿命(年単位) | 値段 | オプション | 値段 | ||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | |||||||||||||||||||||||||
同社はブラック·スコイルズ法を用いて付与されたオプションの公正価値を推定している。ブラック·スコアーズは会社の普通株の市場価格を含む多くの要素を考慮した。ブラック·スコアーズは、付与された各株式オプションの要因と、年末までの年間に付与されたオプションの加重平均公正価値を評価するために使用される2023年12月31日2022そして2021具体的には以下のとおりである
| 2023 | 2022 | 2021 | ||||||||||
| 波動率 | ||||||||||||
| 無リスク金利 | ||||||||||||
| オプションの期待寿命 | ||||||||||||
| 配当率 |
|
|
| |||||||||
| 罰金率 |
|
|
| |||||||||
| 株式オプションが付与された加重平均公正価値 | $ | $ | $ | |||||||||
波動性は,同社の普通株式歴史変動性の審査に基づいている。無リスク金利は、付与された日に発効する米国債収益率に基づいている。オプションの期待寿命は実際の歴史的オプションに基づいている。配当率は
自分から2023年12月31日会社は補償費用#ドルを確認する予定です
演技賞
以下に業績奨励活動に関する情報の概要を示す2023:
| 表現賞の数 | ||||
| 2022年12月31日現在の未返済債務 | ||||
| 授与する | ||||
| 既得 | ||||
| 没収/キャンセルされる | ||||
| 2023年12月31日現在の未返済債務 | ||||
年末までに年度を終える2022年12月31日全部である
優秀なパフォーマンス賞が授与されれば、会社は$を確認します
株に基づく報酬費用
以下に、株式ベースの報酬費用に関する情報(千単位)についてまとめた
| 十二月三十一日までの年度 | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| 研究開発 | $ | $ | $ | |||||||||
| 一般と行政 | ||||||||||||
| 株式に基づく報酬総支出 | $ | $ | $ | |||||||||
8.従業員401(K)福祉計画
会社には固定支払貯蓄計画があり,第1に401(K)“国税法”。その計画は基本的にすべての従業員たちを扱っている。従業員はこの計画に参加する資格がある1つ目は借りて毎月何日目か5月.納付は最高国税局条例で規定されている現行の法定限度額に達することができる。♪the the the401(K)計画は、会社がすべての従業員を代表して追加的な全額出資を行うことを可能にする。通り抜ける2023年12月31日その会社は所有している注釈一致した貢献をしました401(K)計画。
9.所得税
“会社”ができた注釈列報期間に所得税を計上したのは、同社がこれらの年度に帳簿と連邦課税損失があったため、税前損失による税収割引は完全に推定免税額の変化によって相殺された。
報告期間中の法定連邦所得税税率と会社の有効税率の入金は以下の通りである
| 十二月三十一日までの年度 | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| 連邦法定税率で課税する | % | % | % | |||||||||
| 連邦福祉を差し引いた州税 | ||||||||||||
| 株式ベースの報酬 | ( | ) | ||||||||||
| 研究開発単位 | ||||||||||||
| 第百六十六条の制限 | ( | ) | ( | ) | ||||||||
| 他にも | ( | ) | ( | ) | ( | ) | ||||||
| 評価免除額を変更する | ( | ) | ( | ) | ( | ) | ||||||
| 有効所得税率 | % | % | % | |||||||||
繰延税金資産と評価準備
繰延税項資産は、純営業損失と税額控除繰越の税務影響、および財務報告目的のための資産と負債の帳簿金額と所得税目的の金額との間の一時的な差を反映する。当社の繰延税金資産2023年12月31日そして2022会社の税率で計算する
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 繰延税金資産: | ||||||||
| 純営業損失が繰り越す | $ | $ | ||||||
| 株式ベースの報酬 | ||||||||
| 研究開発信用繰り越し | ||||||||
| 資本化研究と開発費 | ||||||||
| 他にも | ||||||||
| 繰延税金資産総額 | ||||||||
| 推定免税額 | ( | ) | ( | ) | ||||
| 繰延税項目純資産 | ||||||||
| 繰延税金負債: | ||||||||
| 経営的リース使用権資産 | ( | ) | ||||||
| 繰延税金負債総額 | ( | ) | ||||||
| 繰延税項目純資産(負債) | $ | $ | ||||||
推定免税額は#ドル増加した
同社の純営業損失は繰り越した$
未確認税収割引
自分から2023年12月31日2022そして2021,同社には未確認の税収割引があり、税金控除#ドルに関連している
| 十二月三十一日までの年度 | ||||||||||||
| 2023 | 2022 | 2021 | ||||||||||
| 期初残高 | $ | $ | $ | |||||||||
| 期限切れの研究開発税控除 | $ | ( | ) | $ | $ | |||||||
| 本年度に関連する納税状況に基づいて計算される増加額 | ||||||||||||
| 期末残高 | $ | $ | $ | |||||||||
自分から2023年12月31日いくつありますか違います。未確認の税金優遇は、次の年に大きな変化が起こると予想しています12何ヶ月になりますか。
同社はアメリカとテキサス州の所得税申告書を提出した。米国では,納税年度後の連邦所得税申告書に関する訴訟時効しかし,当社は純営業損失があるため,税務機関は審査する権利がある2020これらの純営業損失を調整して繰り越します。私たちは注釈現在、どんな課税司法管轄区でも監査を受けている。
10.賃貸借契約と承諾額
使用権資産と負債
同社の経営賃貸借契約は
レンタル負債を経営するために支払われた現金総額は#ドルです
他の約束
同社は,大学,契約研究組織,臨床研究地点との手配など,内部と協力計画を組み合わせた方式で製品研究や開発計画を行っている。それはこのような組織と契約的な手配があり、このような計画は一般的にキャンセルできる。このような契約の下での同社の義務は主に提供されたサービスに基づいている。
同社は契約開発と製造組織に依存して私たちの臨床研究のためのすべての材料を製造しています。
注意事項11. 2020現金奨励金計画
はい2020年8月取締役会はその計画を承認した。この計画の設立は、会社の長期成功を促進するためのものであり、会社の時価が大幅に増加するとともに、計画参加者に追加の現金補償を提供する“リスクのある”現金ボーナス計画を作成する方法である。この計画は“リスクがある”とされていますなぜなら計画参加者は注釈会社の時価が大幅に増加し、本計画で規定されている他の条件を満たしていない限り、現金配当が得られる。具体的には、計画参加者は現金配当を受ける注釈現金やボーナスは支払われません1)会社が合併又は買収取引を完了し、売却会社又はその資産の所有権(合併取引)を構成するか又は(2)取締役会報酬委員会(報酬委員会)は、計画によって定義されたように、会社の手元に十分な現金を持っていると判断した。これらの要求に関する固有の裁量権と不確実性のため,当社は新計画の付与日と結論を出した注釈発生日は2023年12月31日
合併取引が発生した場合、計画参加者はすべての稼いだ現金ボーナスを得るだろう。
自分から2022年12月31日その会社の独立役員はその計画の参加者です。しかし効果的なのは2023年3月16日取締役会は計画を改訂し、計画参加者であるすべての独立取締役を罷免し、独立取締役はこのようにすることに同意した。この計画の下での独立役員の潜在的利益シェアは完全に失われ、注釈この計画の下の任意の他の参加者に割り当てられる。当社の独立取締役注釈受信され、このような修正のため、この計画の下でのいかなる支払いも決して受信されないだろう。
本計画については、当社の時価は根拠ではありません1)会社の終値は1つはナスダック資本市場の株式総額に、発行済み株式及び発行済み株式総数を乗じて自社株式を購入するオプション、又は(2)合併取引において、当社の証券保有者への総代償に対処する。発行されていないいかなる権利証も時価の確定範囲に含まれていない。これは会計指針を適用した市場状況を構成する
会社の時価が大幅に増加した場合、この計画は毎回潜在的な現金配当をトリガし、最高でドルに達する$515億ドルの時価です“計画”規定
もしその会社が$を超えたら
本計画は責任報酬として入金されます。各計画の推定値とマイルストーン報酬の公正価値は、付与日が発生した後に決定され、各報告期間に再計量されます。計画に関連する補償費用は、毎年の予想達成期間内に再確認されます
はい2020年10月会社は次のような成果をあげた1つ目は彼の評価は一里塚的な意味を持っている2020,給与委員会はドルの潜在的な現金ボーナスと奨励金を承認した
年末までに年度を終える2021年12月31日会社は実現した
違います。次の年度までの年度中に推定マイルストーンを取得する2023年12月31日そして2022.
12.事件があったり
当社は、時々、当社は5月.FDAに提出された米国政府調査、調査、および市民請願書を含む訴訟または他の法的手続きおよびクレームに参加する。また会社は受け取って時々受け取りました5月.正常業務過程で発生した事項に関する政府当局の問い合わせを受ける。これらの手続の結果自体は不確定である。結果にかかわらず、弁護と和解コスト、管理資源の移転、その他の要因により、法的訴訟は会社に悪影響を及ぼす可能性がある。この時には違います。その可能な結果や結果が会社に大きな影響を与えるかどうかを評価することができる。同社は、現在把握している情報に基づいて、その法律事項の総額を準備するのに十分であると信じている。
政府調査
開ける2021年11月15日同社は、ある政府機関が同社に会社の情報や文書の提供を要求していたことを明らかにした。これらはすべて秘密の要求です。当社は自発的に協力しており、これらの問い合わせに引き続き協力する予定です違います。政府機関は当社に通知し、当社又はその高級管理者、従業員又は取締役に研究不正又は不当行為の証拠が存在することを発見した違います。政府機関はこのような調査に関連した任意のクレームや告発を提起した。政府機関が行っていることの結果や影響を予測することはできません5月.当社や他の会社に対して法執行行動をとる。
証券集団訴訟と株主派生訴訟
中間にある2021年8月27日そして2021年10月26日提起される可能性のある集団訴訟は、同社と特定の指名された官僚たちが連邦証券法に違反したと告発した。これらの訴えはFDAに提出された市民請願書に記載されている告発に依存し、Simufilamに関する被告の様々な陳述が実質的な虚偽と誤解されていると主張している。市民請願書はその後FDAによって拒否された。このような訴訟はアメリカテキサス州西区地域裁判所で提起された。これらの訴えはいわゆる1種類の購入者が指定されていない補償性損害賠償と他の救済を求めることを代表する。
開ける2022年6月30日連邦裁判官が合併しました集団訴訟が入る事件は、首席原告と首席弁護士を任命した。首席原告は合併の改正起訴状を提出した2022年8月18日当社の証券を代表する1つの想定カテゴリの購入者2020年9月14日そして2022年7月26日開ける2023年5月11日裁判所は原告のナダフ·フリードマン博士,我々の元首席医療官,現在亡くなった取締役会社に対する原告のクレームを偏見で却下したが,他の面では被告の却下動議を却下した。被告は#年に改訂された合併訴えに対する回答を提出した2023年7月3日開ける2024年2月22日原告は彼らの訴えを補完し,推定された授業時間を延長する動議を提出した2023年10月12日。
開ける2021年11月4日会社を代表して米国テキサス州西区地区裁判所に関連する株主派生訴訟を提起し、米国証券法と州受託責任法に基づいて特定の指名された幹部と会社の取締役会メンバーにクレームを出したと主張したという。この苦情は市民請願書で提起された告発に依存し、これらの請願書はFDAに提出された(その後FDAによって否定された)。起訴状によると、他の事項を除いて、個別の被告は会社に重大な虚偽と誤った陳述を招き、アメリカ証券法に違反し、彼らの会社に対する受託責任に違反し、会社を指定されていない損害賠償と証券法の責任に直面させる。その他の事項を除いて、デリバティブ事件は、個別被告が告発された不当行為による不特定の補償性損害賠償を会社を代表して追及することを求めている。このデリバティブ事件の原告は注釈当社の救済を求め、当社は個別被告に対して一定の賠償義務を負っています。中間にある2021年11月4日そして2023年6月20日
開ける2024年2月2日その会社と特定の指名された官僚たちが連邦証券法に違反したことを告発する可能性のある集団訴訟が提起された。起訴状の根拠は2023年10月12日ニューヨークシティ大学の同社の高級科学協力者が科学的不正行為の疑いで漏洩したとされる報告を描いた定期刊行物記事。起訴状によると、被告はSimufilamが行った様々な陳述について、この条のために重大な虚偽と誤解性を持っているという。この訴訟はアメリカイリノイ州北区地域裁判所に提起された。起訴状代表はその会社の証券を購入したと言われている種類の人が指定されていない補償性損害賠償とその他の救済を求めています2022年8月18日そして2023年10月12日。
当社は上記の告発に根拠がないと考え、これらの訴訟に積極的に抗弁しようとしている。当社はこれらの訴訟に関する可能な損失や損失範囲を見積もることができません(あれば)。
開ける2022年8月19日当社を代表してデラウェア州衡平裁判所に株主派生訴訟を提起し、州受託責任法に基づいて当社のいくつかの指名された高級社員や取締役会メンバーにクレームを出したという。起訴状によると,他の事項を除いて,個別の被告は彼らの受託責任に違反して承認した2020現金奨励金計画2020年8月このような不満は指定されていない補償損害賠償と他の救済を求めている。開ける2023年1月6日原告は修正された起訴状を提出した。被告は修正された訴えに対して一部の回答を提出した2023年3月10日修正された訴えを部分的に却下するよう動議した2023年3月14日開ける2024年1月25日双方はこの訴訟について拘束力のある和解条項の説明書を締結した。和解は和解を提案する規定と裁判所の最終承認を含むいくつかの条件にかかっている。提案された和解は会社と個別被告に対するクレームを解決し,和解の規定を含むことになる注釈任意の被告の任意の過ち、責任または不当行為に対する承認、譲歩または裁定を構成する。あるかもしれない違います。最終的な和解協定が実行されるか、またはその協定が裁判所の承認を受けることを保証する
13.後続事項-株式証配当金分配を承認
開ける2024年1月3日当社は株式承認証形式で当社の普通株式登録所有者への普通株式の分配を完了しました。会社の普通株の所有者は2023年12月22日了解です1部1部の持分証明書
各株式承認証は所有者に#ドルの使用価格で購入する権利を持たせ、費用は所有者が独自に負担し、所有者が独占的に選択する
配当金分は保有者に追加の権利を持たせる
事前償還しない限り,株式承認証は以下の日に満期になり,行使を停止する2024年11月15日(“失効日”)。当該等株式証は、いつでも当社の唯一の選択権で償還することができ、償還日は当日又は後とすることができる2024年4月15日その会社は少なくとも20償還日(以下、“償還日”と呼ぶ)を選択してプレスリリース通知を出す暦の日。どんな償還時の償還価格も同じでなければならない共$
行使時に発行可能な普通株の数量は株式配当、分割、分割、合併、再分類、合併、非現金分配と現金配当を含むいくつかの逆希釈調整の影響を受ける。株式証明書の条項は株式承認証の行使による所有を禁止する9.9%会社の事前書面による同意を得ていない場合は、単一株主又は関連株主団体が会社普通株又はそれ以上の普通株を保有する。
条件付きでは,権利証の行使権は自動的に中止される違います。株式承認証の行使時に発行可能な普通株式の有効登録声明。この登録声明は2023年5月1日株式証明書の満期日または償還日(場合によって決まる)5月.一時停止時の日数で延長しなければなりません。
会社(The Company)5月.時々、その全権を適宜決定して捜査令状を修正します1つは(I)任意の曖昧、漏れ、欠陥または不一致を是正する;(Ii)任意の業務合併中の後任会社の負担について規定する;(Iii)満期日を延期する;(Iv)株式承認証の権益を低下させるか、または基本的な株式承認証の使用率または紅株比率を向上させる;(V)紅株満期後の配当期間を回復する;(Vi)株式承認証を行使する際の株式純額を規定する;(Vii)任意の変更を行う注釈任意の重要な態様では、任意の権証所有者の権利に悪影響を及ぼす。(Viii)後任権証代理人または計算代理人を規定する。(Ix)任意の業務合併について、当該権利証が適切な対価で行使できることを規定するか、または()x)その他の適合性変更。
これらの株式承認証はナスダック資本市場で会社の普通株と分離して上場と取引され、株式コードは“SAVAW”である。
自自2024年1月3日至れり尽くせり2024年2月26日全部で約あります引受権証を行使した後,会社の総収益は約$である
プロジェクト9.パートナーシップ会計と財務情報開示の変更と相違
ない。
項目9 A.回答:制御とプログラム
開示制御と手続きの評価。
我々の経営陣は,最高経営責任者と財務責任者の参加のもと,本年度報告Form 10−Kがカバーする期間終了までの開示制御とプログラムの有効性を評価した。この評価に基づき、我々のCEOおよび最高財務官は、取引法に基づいて提出または提出された報告書で開示を要求した情報が、米国証券取引委員会または米国証券取引委員会規則および表が指定された期間内に記録、処理、集約および報告され、これらの情報が蓄積され、適切なときに管理層に伝達され、必要な開示に関する決定をタイムリーに行うことを保証するために、開示制御および手続きが有効であると結論した。
管理する’S財務報告内部統制に関する年次報告。私たちの経営陣は私たちの財務報告書に対する十分な内部統制を確立して維持する責任がある。私たちの経営陣は2023年12月31日までの財務報告の内部統制の有効性を評価した。私たちの評価は、テレデビル委員会後援組織委員会(COSO)が“内部統制-総合枠組み(2013年枠組み)”で提案した基準に基づいている。
財務報告の内部統制は、財務報告の信頼性を合理的に保証することを目的としたプログラムであり、公認された会計原則に基づいて外部目的の総合財務諸表を作成する。私たちの財務報告書に対する内部統制は以下の政策と手続きを含む
| (1) |
私たちの資産に対する私たちの取引と処置を合理的で詳細かつ正確に反映した記録を保存することと関連がある |
| (2) |
一般的に受け入れられている会計原則に基づいて総合財務諸表を作成するために、必要に応じて取引を記録することを確保するための合理的な保証を提供し、私たちの収支は私たちの経営陣と取締役会の許可のみに基づいて行われる |
| (3) |
連結財務諸表に重大な影響を及ぼす可能性のある不正な取得、使用、または処理を防止またはタイムリーに発見することができる合理的な保証を提供する。 |
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
COSOの枠組みでの評価によると、経営陣は、2023年12月31日現在、財務報告書の内部統制に有効であると結論している。
財務報告書の内部統制の変化。
2023年12月31日までの四半期内に、財務報告の内部統制には何の変化もなく、財務報告の内部統制に大きな影響を与えたり、合理的な可能性が重大な影響を与えたりしている。
本稿で述べたように、財務報告の内部統制に対する我々の有効性は、2023年12月31日現在、独立公認会計士事務所安永会計士事務所によって監査されている。
独立公認会計士事務所報告
タピオカ科学会社の株主と取締役会へ。
財務報告の内部統制については
私たちは、テレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み(2013年枠組み)”(COSO基準)で確立された基準に基づき、タピオカ科学株式会社の2023年12月31日までの財務報告内部統制を監査した。我々の考えでは,タピオカ科学社(当社)はCOSO基準に基づき,2023年12月31日現在,すべての重要な面で財務報告を効果的に内部統制している。
我々はまた、米国上場会社会計監督委員会(PCAOB)の基準に従って、会社が2023年12月31日、2023年12月31日と2022年12月31日までの総合貸借対照表、2023年12月31日までの各年度の関連総合経営報告書、株主権益と現金流量、および関連付記と2024年2月28日までの報告を監査し、これについて保留意見を発表した。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、添付された経営陣の年間財務報告内部統制の財務報告内部統制の有効性を評価する責任がある。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、すべての実質的な側面で財務報告に対する有効な内部統制が維持されているかどうかを決定するために、合理的な保証を得るために、監査を計画し、実行することを要求する。
我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他の手順を実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/S/安永法律事務所
テキサス州オースティン
2024年2月28日
プロジェクト9B. その他の情報
現在までに2023年12月31日我々の役員や上級管理職(規則で定義されているように)16a-1(F)取引法)“ルール”の通過または終了を通知する10b5-1“取引スケジュール”または“非ルール”10b5-1S-K条例第1項のような“取引手配”408.
プロジェクト9 Cです検査妨害に関する外国司法管区の開示
ない。
第三部
プロジェクト10.パートナーシップ役員と役員と会社の管理
我々の取締役(以下の概要を除く)、役員、取締役指名過程、取締役会監査委員会に関する情報は、2024年株主総会の依頼書に盛り込まれた“取締役·役員”を引用することにより。
役員および行政員の伝記
レミー·バビル1998年の会社設立以来、会社の創業者総裁は会社の最高経営責任者兼取締役会長を務めてきた。これまで、バビルは上場薬物開発会社Exelixis Inc.,メルク社に買収された薬物開発会社ArQule、オルバニ分子研究会社に買収された化学会社EnzyMed,Inc.の設立を支援してきた。バビルはワシントンカーネギー研究所、サンタフェ研究所、カリフォルニア大学定量生物科学研究所顧問委員会、アーカンソー大学医学科学生命科学孵化器の栄誉理事である。バービルさんは、オバーリン大学で学士号、シカゴ大学で工商管理修士号を取得した。
クリストファー·クック2022年10月から上級副総裁兼総法律顧問を務める。2017年以降、上場医療機器や製薬会社エルコンの訴訟や政府調査のグローバル主管、コスタリカサンホセにあるウォルマート中米副総裁や部門総法律顧問を務めてきた。クックはJones Dayで17年間働いていたが、そこでは同社のワシントンD.C.とシカゴ事務所の訴訟パートナーだった。彼はシカゴでアメリカの検事補佐を務め、ハーバード法学部を卒業した。
ジェームズ·W·クピーチ医学博士2021年1月に入社して首席臨床開発官を務め,2022年12月以来我々の首席医療官を務めてきた。Kupiec博士はファイザー,サイノフィ,Ciba−Geigyに30年間の薬物開発経験を有した後に同社に入社した。クピーチ博士は以前パーキンソン病全世界の臨床責任者、マサチューセッツ州ケンブリッジに位置するファイザー社神経科学研究部門の臨床担当者総裁副主任を務めたことがある。2000年にファイザーに入社し、これまでセノフィで7年間、Ciba-Geigy製薬会社で2年間働いていた。彼の17年間のファイザーキャリアの中で、クピーチ博士は広範な管理、業務開発、連合と指導職責を担った。クピーチ博士は優秀な成績で石渓大学で生化学学士号を取得し、アルバート·アインシュタイン医学院で医学博士号を取得した。彼はロチェスター大学医学院ストロング記念病院で入院医師研修を完了し、アメリカ内科委員会の認証を受けた。製薬業に移行する前に、多くの臨床試験で研究員を務めていた。
エリック·シェーン2018年以来最高財務官を務めてきた。シェンさんは、当社に入社する前に複数の財務指導者を務めていました。最近では、2011年から2017年にかけて上場女性健康会社アスピラ女性健康会社(元フェルメール社)の副社長、上級副総裁、財務兼首席会計官を務めた。シュンさんはまた、9年間の会計監査、担保、取引サービス、世界的な資本市場の業務を担当するため、普華永道会計士事務所でキャリアを開始しました。シェン·さんはサンクララ大学で金融学士号を取得した。
ロバート·アンダーソンアンダーソンさんは、2023年12月から取締役を務め、サイバーセキュリティ、反スパイ、経済スパイ、重大な事件の応答と管理において、数十年間の運用経験を持っています。アンダーソンはこれまで連邦捜査局20,000人以上の従業員を指導し、刑事、ネットワーク、対応、サービス部門の取締役執行アシスタントを務めており、これは同機関の第3号のポストである。アンダーソンさんは、現在、サイバーセキュリティのコンサルティング会社Cyber Defense Labsの取締役会長兼CEOに専念しており、2019年3月から同社のCEOを務めており、2022年1月から代表取締役社長を務めています。アンダーソンさんは、ウィルミントン大学で理学学士号、公共管理修士号を取得しています。
リチャード·J·バリー2021年6月から取締役として使用されてきた。バリーさんは、2015年6月以降、会社役員(Sarepta Treateutics,Inc.)(ナスダック·コード:SRPT)のパートナーも務めている。バリーさんは、投資管理ビジネスにおいて豊富な経験を持っています。彼はイーストベンキャピタル管理有限責任会社の創設メンバーの一人で、1999年から2010年まで取締役社長、一般パートナー、ポートフォリオマネージャーを務めた。イーストベンに入る前に、バリーさんはロバートソン·ステファンス投資管理会社のポートフォリオマネージャーと役員管理人です。バリーさんはペンシルバニア州立大学で文学学士号を持っている
ピエール·グレビル2023年12月以来、取締役の役割を果たしてきた。2023年7月以来、グレビルは上場バイオテクノロジー会社PTC Treateutics,Inc.の首席財務官を務めてきた。Gravierさんは2013年から2023年7月まで、Perella Weinberg Partnersヘルスケアグループの経営責任者であり、Perella Weinberg Partnersは合併、買収、その他の企業戦略に関連する戦略、財務、戦術アドバイスを提供する世界をリードする独立コンサルティング会社です。GravierさんはESCPビジネススクールで金融学の修士号、コンビーニュ科学技術大学の生物工学理学修士号を取得しています。
ロバート·Z·グシン博士それは.2003年以来取締役の役割を果たしてきた。古森博士はジョンソンで26年間働いており、最近は1986年から2000年まで退職し、科学技術部首席科学官兼会社副総裁を務めている。グソン博士はデュケン大学取締役会、デュケン大学薬学院、ミシガン大学医学院薬学系顧問委員会に勤めていた。グシン博士は理学士、理科修士号、理学博士号を取得した。デュクイン大学で栄誉を得、ミシガン大学アナブルク校で薬理学博士号を取得した。
クロード·ニケス医学博士ニケス博士は2023年12月以来、取締役を務めてきた。ニケス博士は2015年6月以来、セレプタ治療会社(ナスダックコード:SRPT)のナスダックを務めている。ニケス博士は2021年1月以来、Gain治療会社の取締役会メンバーを務めてきた。2021年3月以来、Nicaise博士はChemomab治療有限会社の取締役会のメンバーを務めてきた。Nicaise博士は臨床/監督管理指導職を務め、神経科学を含む各種疾病領域で14件の新薬の承認を得た。ニケス博士は臨床監督サービス会社の創始者であり、同社はバイオテクノロジー会社に臨床と監督管理の提案を提供している。ニケス博士は2015年から2023年3月までオヴィッド治療会社の監督執行副総裁を務め、同社は脳孤児疾患薬を開発する会社である。ニケス博士は2008年から2014年までアレクソン製薬会社の戦略発展と全世界監督管理事務上級副総裁を務めた。1983年から2008年まで、Nicaise博士は百時に美施貴宝は世界発展副総裁と全世界監督科学と戦略副総裁などの高級職を含み、ベルギーブルックセル自由大学で医学博士学位を獲得した多数の職責を日々増加したポストを務めた。
マイケル·J·O’ドナールEsqそれは.1998年以来取締役の役割を果たしてきた。オドネさんは、2021年6月以来、Orrick,Herrington&Sutcliffe LLP法律事務所のパートナーとなっている。Orrick,Herrington&Sutcliffe LLPは会社に法的サービスを提供している。これまで、オドネは2011年から2021年までモリソン·フォスター法律事務所のメンバーだった。O‘Donnellさんは、多くの公共およびプライベートバイオ製薬·生命科学会社の企業の法律コンサルタントです。オドネはこれまで、ウィルソン·サンシーニ·グドリッチとロサティ法律事務所のメンバーだった。さん·オドナイはハーバード大学で法学博士号を取得し、バークネル大学で優秀な成績で学士号を取得した。
サンフォード·R·ロバートソン1998年以来取締役の役割を果たしてきた。1999年以来、ロバートソンは科学技術買収基金Francisco Partnersのパートナーだった。Francisco Partnersを設立する前に,RobertsonさんはRobertson,Stephens&Companyの創始者と理事長であり,1998年にBankBostonに売却された。ロバートソンは以前、上場していた企業クラウドコンピューティング·アプリケーション·プロバイダSalesforce.comの取締役CEOだった。ロバートソンはミシガン大学から学士と工商管理修士号を優秀な成績で取得した。
パトリック·J·スカンノン医学博士2007年以来取締役の役割を果たしてきた。シュカンノン博士はXOMAの創始者の一人です。2006年から2016年まで、スカンノン博士はXOMA執行副総裁総裁首席生物技術官を務めた。1993年から2006年まで、スカンノン博士はXOMA首席科学と医療官を務めた。スカンノン博士はXOMAを退職し、2016年にXOMA取締役会を辞任した。スカンノン博士はカリフォルニア大学バークレー校で有機化学博士号を取得し、ジョージア医学院で医学博士号を取得した。
第十六条第十四節実益所有権報告適合性
取引法第16条(A)条は,我々の役員及び取締役,並びに我々の登録カテゴリの株式証券の10%(10%)を超える者が,米国証券取引委員会に所有権報告及び所有権変更報告書を提出することを要求する。執行者、役員、および10%(10%)を超える株主は、彼らが提出したすべての第16(A)条の表のコピーを私たちに提供しなければならない。私たちは私たちのすべての幹部と役員が2023年にすべての適用された届出要求を遵守したと信じている。
道徳的規則
私たちは、私たちの最高経営責任者と最高財務責任者を含む、私たちのすべての役員、高級管理者、従業員に適用される道徳的基準を採択しました。私たちはウェブサイトに政策を掲示することで道徳基準を宣伝しHttp://www.Casavasciences.comそれは.私たちは私たちのウェブサイトで私たちの道徳基準に対するどんな免除や改正も開示するつもりだ。
プロジェクト11.パートナーシップ役員報酬
本条項によって要求される情報は、上記第10条で言及された我々の最終委託書に参照されて組み込まれ、この声明は、タイトル“役員報酬および他の事項”の下に現れる
第十二項。特定の実益所有者の担保所有権及び経営陣及び関連株主の事項
本条項によって要求されるいくつかの利益を有するすべての人および管理職の保証所有権に関する情報は、上述した第10項に記載された我々の最終委託書を参照して、“特定の利益を受けるすべての人および管理職の保証所有権”というタイトルの下に現れる
次の表は、2023年12月31日現在、私たちの株式補償計画に基づいて発行された証券をまとめています
| 量 |
|||||||||||||||
| 証券は |
加重平均 |
証券数量 |
|||||||||||||
| 発表日 |
行権価格 |
使えるようにする |
|||||||||||||
| 演習をする |
卓越した |
未来発行の |
|||||||||||||
| 卓越した |
選択肢、 |
持分下の |
|||||||||||||
| オプション·株式承認証 |
株式承認証 |
報酬.報酬 |
|||||||||||||
| 権利があります |
権利があります |
もくろみ |
|||||||||||||
| 株主承認持分補償計画 |
3,046,171 | (1) | $ | 15.10 | (2) | 2,966,705 | (3) | ||||||||
| 株主の承認を得ない持分補償計画 |
— | — | — | ||||||||||||
| 3,046,171 | $ | 15.10 | 2,966,705 | ||||||||||||
| (1) |
2008年計画下の1,131,382,000株の普通株式および1,914,793株の未償還株式オプションおよび奨励を含む 2018年計画に基づいて私たちの普通株の株式を購入します。 |
| (2) |
2008年計画で未返済株式オプションを含む加重平均株価は11.18億ドル、2018年計画では17.45億ドルだった。 |
| (3) |
2018年計画の2,908,688株と従業員株購入計画を代表する58,017株。2008年の計画によると、今後は何の報酬もないだろう。 |
プロジェクト13.パートナーシップ特定の関係や関連取引と取締役の独立性
本条項によって要求される情報は、上記第10条に記載された我々の最終委託書に参照されて組み込まれ、この声明は、タイトル“いくつかの関係および関連取引”の下に現れる
プロジェクト14.パートナーシップチーフ会計士費用とサービス
本プロジェクトに要求される情報は、上記10項で説明した我々の最終依頼書に参照されて組み込まれ、この情報は、タイトル“主要会計士費用およびサービス”の下に現れる
第4部
プロジェクト15.パートナーシップ展示品と財務諸表の付表
(A)以下のファイルを本テーブル10-Kの一部として提出する:
| (1) |
連結財務諸表(本報告書の第2部に掲載): |
|
|
独立公認会計士事務所報告 |
|
|
合併貸借対照表 |
|
|
連結業務報告書 |
|
|
株主権益合併報告書 |
|
|
統合現金フロー表 |
|
|
連結財務諸表付記 |
| (2) |
連結財務諸表のスケジュール: |
|
|
これらの情報は、これらの情報が適用されないか、または連結財務諸表の付記に記載されているので、すべての連結財務諸表の付表は省略される。 |
| (3) |
契約、補償計画、手配を管理する. |
|
|
管理契約、補償計画及び手配は、以下第15(B)項に掲げる適用証拠に“*”号で表記される。 |
(b) 陳列品
以下に示す証拠品は本10-K表の一部としてアーカイブされているが,表32.1を除いて提供されていると見なす.
| 引用で編入する |
||||||||||
| 展示品.違います。 | 説明する | 表 | 記録を準備する.日取り | 展示品.違います。 | 保存済みのここから声明する | |||||
| 3.1 |
会社登録証明書の改訂と再予約。 |
10-Q |
7/29/2005 |
3.1 |
||||||
| 3.2 |
証明書の改訂証明書を再登録します。 |
8-K |
5/8/2017 |
3.1 |
||||||
| 3.3 |
証明書の改訂証明書を再登録します。 |
10-K |
3/29/2019 |
3.3 |
||||||
| 3.4 |
タピオカ科学会社の定款を改正して再制定する。 |
8-K | 9/13/23 | 3.4 |
|
|||||
| 4.1 |
普通株式証明書サンプル。 |
10-Q |
8/12/2019 |
4.1 |
||||||
| 4.2 |
登録者証券説明。 |
|
|
|
X | |||||
| 4.3 | 株式認証プロトコル(株式承認証の形式を含む)は,期日は2024年1月3日であり,会社,デラウェア州のComputerShare Inc.とComputerShare Trust Company,N.A.を株式承認証エージェントとしている. | 8-K | 1/3/24 | 4.1 | ||||||
| 10.1 |
登録者とその各役員と上級職員との間の賠償協定フォーマット。 |
10-K |
3/1/2022 |
10.1 |
||||||
| 10.5* |
* |
雇用協定、期日は7月1998年1月1日および改正された12月 2008年17日、登録者とレミー·バビルの間。 |
10-K |
2/13/2009 |
10.12 |
|||||
| 10.6 |
* |
2000年従業員の株購入計画は、改訂され、再説明された。 |
10-Q |
7/29/2010 |
10.1 |
|||||
| 10.7 |
* |
2008年株式インセンティブ計画。 |
8-K |
5/29/2008 |
10.1 |
|||||
| 10.8 |
* |
2008年株式インセンティブ計画第1号修正案。 |
10-Q |
8/1/2013 |
10.1 |
|||||
| 10.9 |
* |
登録者とRemi Barbierとの間の雇用協定の第2号改正案。 |
10-Q |
8/1/2013 |
10.2 |
|||||
| 10.10 |
* |
2018年度包括インセンティブ計画。 |
8-K |
5/11/2018 |
10.1 |
|||||
| 10.11 |
必要に応じて資本に対応するTMタピオカ科学会社とジョーンズ取引機関サービス有限責任会社との販売契約は、2023年5月1日となっています | 8-K |
5/1/2023 |
1.1 |
||||||
| 10.12 |
* |
タピオカ科学会社2020現金奨励金計画(2023年3月16日改訂)。 |
10-Q |
8/3/2023 |
10.2 |
|||||
| 10.13 |
* |
“雇用協定”は、10月1日に署名された2018年9月9日、登録者とEric Schoenの間。 |
8-K |
10/11/2018 |
10.1 |
|||||
| 10.14 |
* |
“雇用協定”は、1月1日に署名された2021年1月1日、登録者とジェームズ·クーピーチ博士の間。 |
8-K |
1/6/2021 |
10.1 |
|||||
| 10.15+ |
タピオカ科学社とEvonik社が2021年2月22日に締結したメインサービス協定。 |
8-K |
3/11/2021 |
10.1 |
||||||
| 10.16+ |
タピオカ科学会社とPremier Research International LLC間の主サービス協定は,2021年6月11日である |
10-Q |
8/4/2021 |
10.3 |
||||||
| 10.17+ |
DWF IV Lakewood,LPとCassava Sciences,Inc.が2021年7月2日に署名した売買協定 |
10-Q |
11/15/2021 |
10.4 |
||||||
| 10.18* |
2018年総合インセンティブ計画修正案1 |
10-Q |
8/4/2022 |
10.1 |
||||||
| 10.19* |
2022年10月13日に登録者とR·クリストファー·クックが署名した雇用契約 |
8-K |
10/27/2022 |
10.1 |
||||||
| 10.19* | タピオカ科学非従業員役員報酬計画 | 10-Q | 8/3/2023 | 10.3 | ||||||
| 21.1 |
登録者の子会社。 |
X |
||||||||
| 23.1 |
独立公認会計士事務所が同意します。 |
X |
||||||||
| 31.1 |
2002年“サバンズ-オキシリー法案”302節で発行された特等執行幹事証明書による |
X |
||||||||
| 31.2 |
2002年サバンズ-オキシリー法第302条に基づいて財務首席幹事を認証する |
X |
||||||||
| 32.1 |
2002年の“サバンズ·オックススリー法案”906節で可決された“米国法典”第18編1350条による最高経営責任者と最高財務官の証明。 |
X |
||||||||
| 97 | 誤った判決を取り戻すための賠償に関する政策 | X | ||||||||
| 101.INS |
XBRLインスタンスドキュメントを連結する. |
X |
||||||||
| 101.書院 |
インラインXBRL分類拡張アーキテクチャ文書. |
X |
||||||||
| 101.カール |
インラインXBRL分類拡張はリンクベース文書を計算する. |
X |
||||||||
| 101.def |
XBRLソート拡張を連結してLinkbase文書を定義する. |
X |
||||||||
| 101.介護会 |
XBRL分類拡張ラベルLinkbase文書を連結する. |
X |
||||||||
| 101.Pre |
XBRL分類拡張プレゼンテーションLinkbaseドキュメントを内部接続する. |
X |
||||||||
| 104 | 会社が2023年12月31日までの財政年度Form 10-K年度報告の表紙は、イントラネットXBRL(添付ファイル101に含まれる)である。 | X |
*契約、補償計画、またはスケジュールを管理します。
+本文書の機密部分は、規制が適用可能な場合に編集されました。
(c)
これらの情報は、これらの情報が適用されないか、または連結財務諸表の付記に記載されているので、すべての連結財務諸表の付表は省略される。
プロジェクト16.パートナーシップ表格10-Kの概要
その会社は要約情報を含まないことを選択した。
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、次の署名者が代表して本報告書に署名することを正式に許可した。
| (主要行政官) |
||
| タピオカ科学会社 |
||
| (登録者) |
||
| 寄稿S/レミー·バビル |
||
| レミー·バビル |
||
| 尊敬する取締役会の議長は |
||
| 社長と最高経営責任者 |
||
日付:2024年2月28日
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
| サイン: |
タイトル |
日取り |
||
| 寄稿S/レミー·バビル |
CEOの社長と |
2024年2月28日 | ||
| レミー·バビル |
取締役会議長 |
|||
| (首席行政主任) |
||||
| /S/エリック·J·シェーン |
首席財務官 |
2024年2月28日 | ||
| エリック·J·シェーン |
(首席財務官と首席会計官) |
|||
| /S/ロバート·アンダーソン |
役員.取締役 |
2024年2月28日 | ||
| ロバート·アンダーソン |
||||
| /S/リチャード·J·バリー |
役員.取締役 |
2024年2月28日 | ||
| リチャード·J·バリー |
||||
| /S/ピエール·グレビル |
役員.取締役 |
2024年2月28日 | ||
| ピエール·グレビル |
||||
| /S/ロバート·Z·グシン博士 |
役員.取締役 |
2024年2月28日 | ||
| ロバート·Z·グシン博士 |
||||
| /S/クロード·ニケス医学博士 |
役員.取締役 |
2024年2月28日 | ||
| クロード·ニケス医学博士 |
||||
| /S/マイケル·J·オドネ、Esq。 |
役員.取締役 |
2024年2月28日 | ||
| マイケル·J·オドネEsq |
||||
| /S/サンフォード·R·ロバートソン |
役員.取締役 |
2024年2月28日 | ||
| サンフォード·R·ロバートソン |
||||
| /S/パトリック·スカンノン医学博士 |
役員.取締役 |
2024年2月28日 | ||
| パトリック·スカンノン医学博士 |