
別紙99.1

1 © 2024、アイオバンス・バイオセラピューティクス株式会社 © 2024、イオバンス・バイオセラピューティクス株式会社企業概要 2024年1月25日 1

2 © 2024、Iovance Biotherapeutics, Inc.の将来の見通しに関する記述このプレスリリースで議論されている特定の事項は、1995年の民間証券訴訟改革法 (「PSLRA」) の意味におけるIovance Biotherapeutics, Inc. (以下「当社」、「当社」) の「将来の見通しに関する記述」です。歴史的事実の記述を除き、このプレスリリースに記載されているそのような書面または口頭による記述はすべて将来の見通しに関する記述であり、PSLRAが提供する将来の見通しに関する記述のセーフハーバーの対象となることを意図しています。上記を制限することなく、場合によっては「予測」、「信じる」、「可能性」、「継続」、「見積もり」、「期待する」、「計画」、「意図」、「予測」、「ガイダンス」、「見通し」、「かもしれない」、「できる」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない将来の出来事や予期せぬ出来事の不確実性を伝え、将来の見通しに関する記述を識別することを目的としています。将来の見通しに関する記述は、経営陣の経験と、過去の傾向、現在の状況、予想される将来の発展、および適切と思われるその他の要因を考慮した仮定と評価に基づいています。このプレスリリースの将来の見通しに関する記述は、このプレスリリースの日付の時点で作成されたものであり、新しい情報、将来の出来事、その他の結果であるかどうかにかかわらず、そのような記述を更新または改訂する義務は負いません。将来の見通しに関する記述は、将来の業績を保証するものではなく、リスク、不確実性、その他の要因の影響を受けます。その多くは当社の管理外であり、実際の結果、活動レベル、業績、業績、業績、進展が、これらの見通しに関する記述で表明または暗示されているものと大きく異なる可能性があります。実際の業績、動向、ビジネス上の意思決定が将来のものと大きく異なる原因となる可能性のある重要な要因-見通しに関する記述は、最新のフォーム10-Kの年次報告書やフォーム10-Qの四半期報告書など、証券取引委員会への提出書類の「リスク要因」というタイトルのセクションに記載されています。これには、当社の事業に内在する以下の重要な既知および未知のリスクと不確実性が含まれますが、これらに限定されません。COV ID-19パンデミックの影響、発生時期と当社の能力に関連するリスク当社の製品候補に対する米国食品医薬品局(「FDA」)、欧州医薬品局(「EMA」)、またはその他の規制当局の承認またはその他の措置を成功裏に開発、提出、取得、または維持し、FDA、EMA、またはその他の規制当局の承認を得た製品候補の商品化を成功させる能力、および臨床試験が当社の重要な研究とコホートから生まれたかどうか、FDA、E MA、またはその他の規制当局との会合は、登録調査とその後の承認の助けとなる場合があります。FDA、EMA、またはその他の規制当局(計画中のシングルアームの第2相IOV-LUN-202試験が登録をサポートしないリスクを含む)。進行中の臨床試験またはコホートから得られた、有効性と安全性の結果を含む可能性のある暫定的および中間的な臨床結果は、進行中の臨床試験またはこれらの試験内のサブグループ、または他の以前の試験またはコホートの最終分析に反映されない場合があります。リスク FDAやその他の規制機関に基づいて、当社の試験やそれらの試験内のコホートに合わせて試験を調整する必要があるかもしれませんインプット、子宮頸がん患者の治療環境の変化が、この適応症における当社の臨床試験に影響を与える可能性があるリスク、追加の臨床試験を実施したり、進行中または将来の臨床試験を変更したりする必要があるリスクは、FDA、EMA、またはその他の規制当局からのフィードバックに基づいています。臨床試験の結果に対する当社の解釈またはFDA、EMA、または規制当局とのコミュニケーションが、これと異なる場合があるそのような結果の解釈、またはそのような規制当局によるコミュニケーション(前回のBLA前にFDAと行った会合(および/または当社のNSCLC臨床試験に関するFDAとの以前の会合を含む)、転移性黒色腫におけるライフロイセルのBLA申請について、FDA、EMA、またはその他の規制当局が承認しない、または承認を遅らせる可能性があるリスク、当社の製品候補の市場による承認と支払者による潜在的な償還の可能性(もしあれば)米国およびその他の国際市場で承認されています。第三者の製造元または自社施設を使用して治療薬を製造できるかどうか多くの悪影響が当社の潜在的な商業的立ち上げに影響を与えます。異なる製造プロセスを用いた共同研究者を対象とした臨床試験の結果は、当社が後援する試験に反映されない可能性があります。最近のProleukin買収の統合の成功に関するリスク、当社製品の開発または商品化が成功しても製品販売から十分な収益が得られず、短期的またはまったく利益を上げられない可能性があるリスク、予期せぬ出費のリスク私たちの推定現金残高と予測が減少する可能性があり、推定資本要件、および一般的な経済状況や規制の進展など、私たちの制御が及ばないその他の要因を増やします。

3 © 2024、Iovance Biotherapeutics, Inc. がん患者へのTIL療法の革新、開発、提供におけるグローバルリーダープラットフォームパイプライン人材・資産パートナーと協力者略語:BLA=生物製剤ライセンス申請; BTD=画期的治療指定; LCM=米国食品医薬品局との後期サイクルミーティング; RMAT =再生医療先端治療指定 22日間の独自製造プロセス 90% + 製造成功率 700人以上の患者 Iovance TILで治療された患者 TIL〜4億2800万ドルのキャッシュポジション(23年9月30日現在)、60人以上の米国と国際特許 500人以上の従業員テキサス大学MDアンダーソンがんセンター 3 © 2024、Iovance BioTherapeutics, Inc. 3 1 1 指定実施中の臨床試験 7 種類の臨床試験 5 BLA レビュー:最終ラベルディスカッション進行中のファストトラック BTD RMAT 1
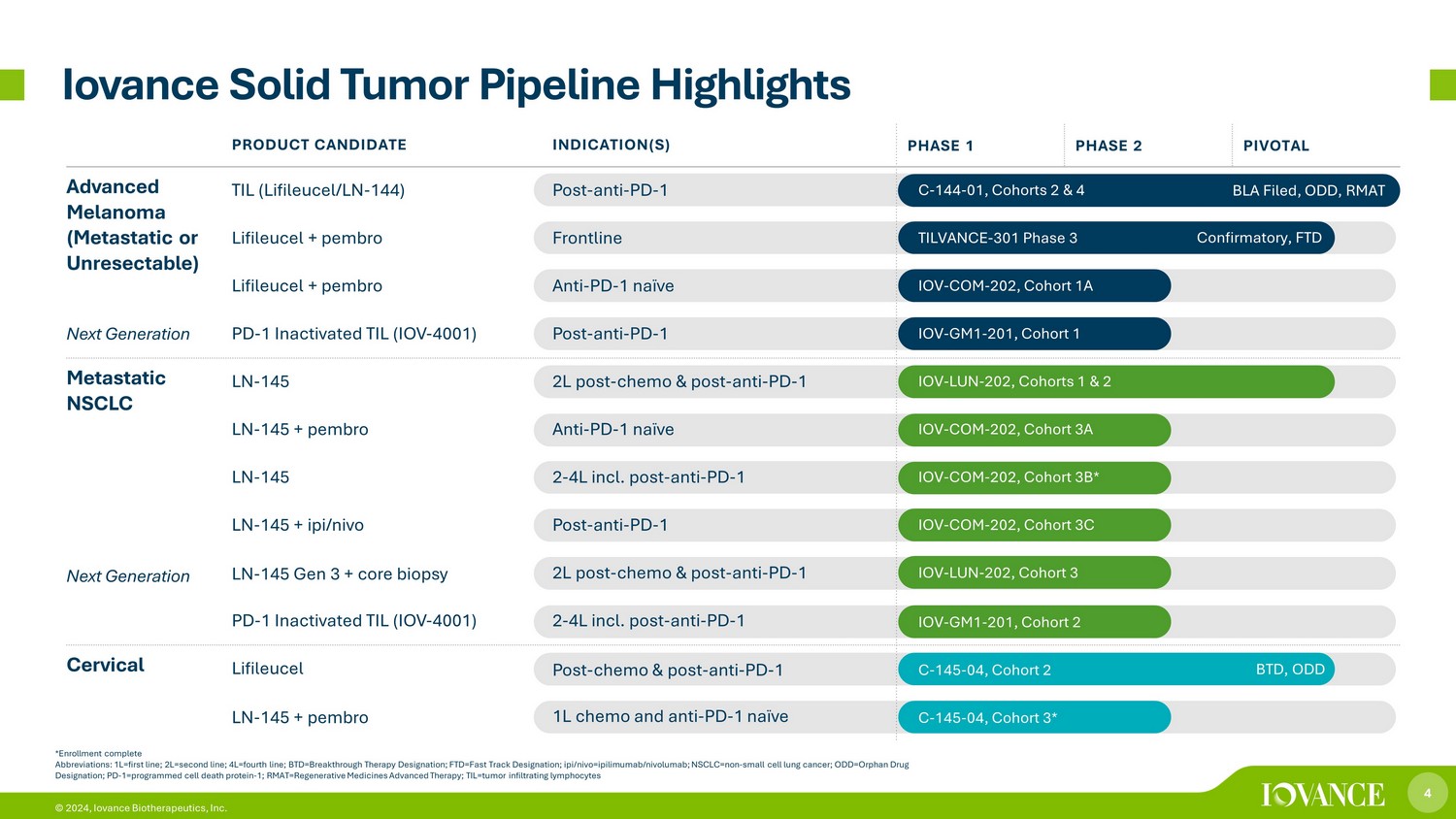
4 © 2024、Iovance Biotherapeutics, Inc. *登録完了略語:1L=ファーストライン; 2L=セカンドライン; 4L=4行目; BTD=ブレークスルーセラピー指定; FTD=ファストトラック指定; ipi/nivo=イピリムマブ/ニボルマブ; NSCLC=NON-小細胞肺がん; odd=orphe 医薬品指定; PD-1=プログラム細胞死タンパク質-1; RMAT =再生医療高度治療; TIL=腫瘍浸潤リンパ球検査、Iovance固形腫瘍パイプラインのハイライト確認、FTD BLAフィールド、ODD、RMAT BTD、ODD製品候補適応症(S)フェーズ1フェーズ2 PIVOTAL Advanced黒色腫(転移性または切除不能)次世代TIL(LifeLeucel/LN-144)ポスト-抗PD-1 C-144-01、コホート2および4ライフルーセル + Pembro Frontline TILVANCE-301フェーズ3ライフルーセル+ペンブロ抗PD-1ナイーブ IOV-COM-202、コホート1A PD-1個の不活化TIL(IOV-4001)ポスト-アンチ-PD-1 IOV-GM1-201、コホート1転移性NSCLC次世代 LN-145 2L ポスト-化学療法&ポスト-抗PD-1 IOV-LUN-202、コホート1と2 LN-15+ ペンブロアンチ-PD-1 ナイーブ IOV-COM-202 3A LN-145 2-4L ポスト-アンチPD-1 IOV-COM-202、コホート3B* LN-145+ ipi/nivoポスト-抗PD-1 IOV-COM-202、コホート3C LN-145Gen 3 + コア生検 2L 事後-化学療法&事後-抗PD-1 IOV-LUN-202、コホート3 PD-1 不活化TIL(IOV-4001)2-4L ポスト-アンチ-PD-1 IOV-GM1-201、コホート2子宮頸部ライフオイルポスト-化学療法&ポスト-抗PD-1 C-145-04、コホート2 LN-145-04、コホート2 LN-145 + ペンブロ 1L 化学療法と抗PD-1 ナイーブ C-145-04、コホート3*

5 © 2024、イオバンス・バイオセラピューティクス株式会社 1.国立がん研究所のサーベイランス、疫学および最終結果(SEER)プログラム。2023年の推定値。https://seer.cancer.gov 2023年5月2日にアクセス。世界保健機関国際がん研究機関(IARC)。GLOBOCAN 2020 米国での死亡者数 1 世界死亡 2 黒色腫 8K 57K 子宮頸部 4K 342K 肺と気管支がん 127K 180万件全がん症例の91%が固形腫瘍 1.8万米国での固形腫瘍の新規症例 1 他の適応症への拡大早期治療への進出固形腫瘍と当社の主要プログラムにおける大きな市場ポテンシャル
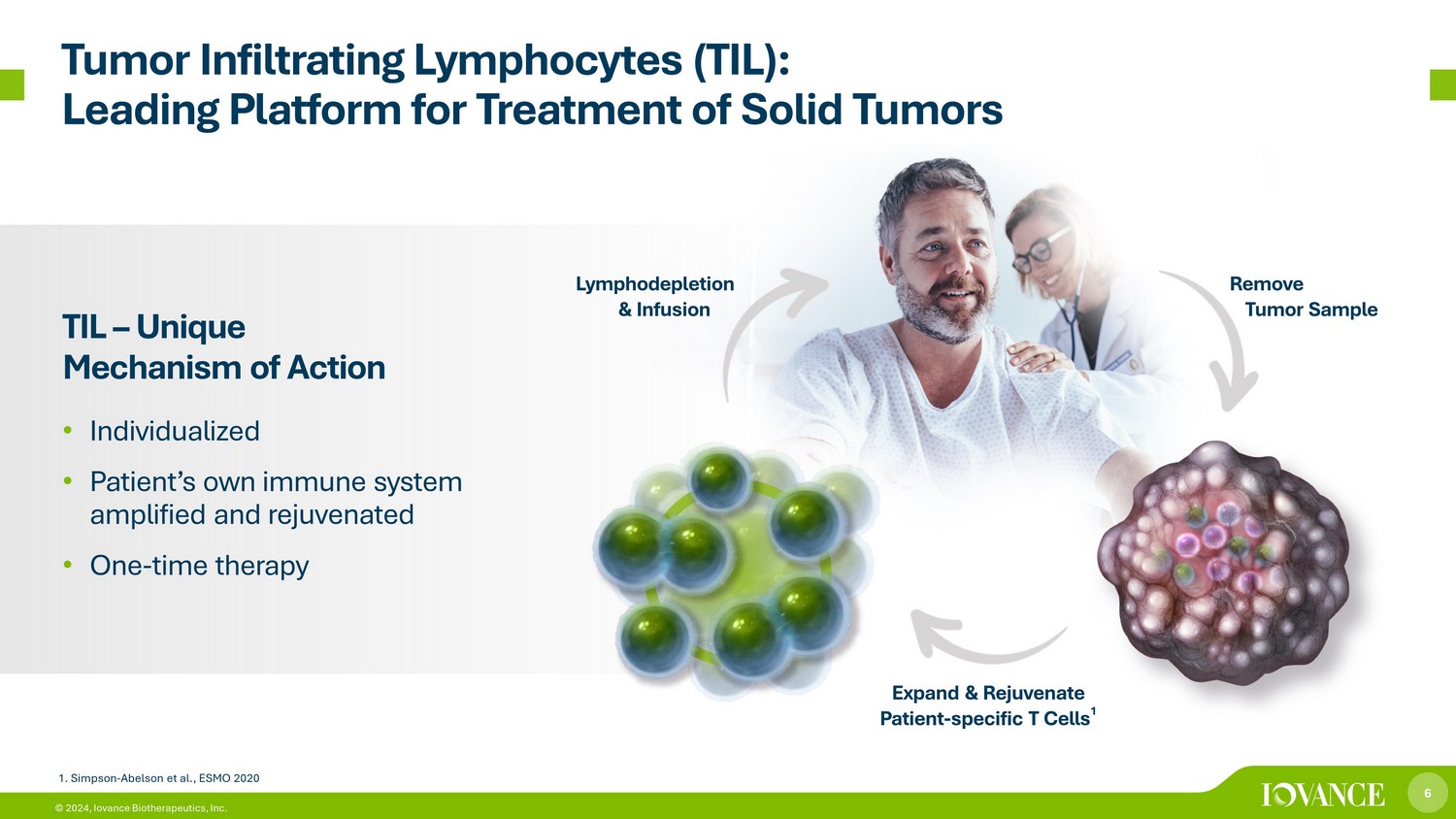
6 © 2024、Iovance Biotherapeutics, Inc. 腫瘍浸潤リンパ球(TIL):固形腫瘍治療のリーディングプラットフォームTIL — 独自の作用機序 • 個別化 • 患者自身の免疫システムの増幅と若返り • 1回限りの治療-腫瘍サンプルの除去と患者の拡大と若返り-特異的T細胞 1. リンパ球減少と点滴 1.シンプソン-アベルソンら、ESMO 2020年
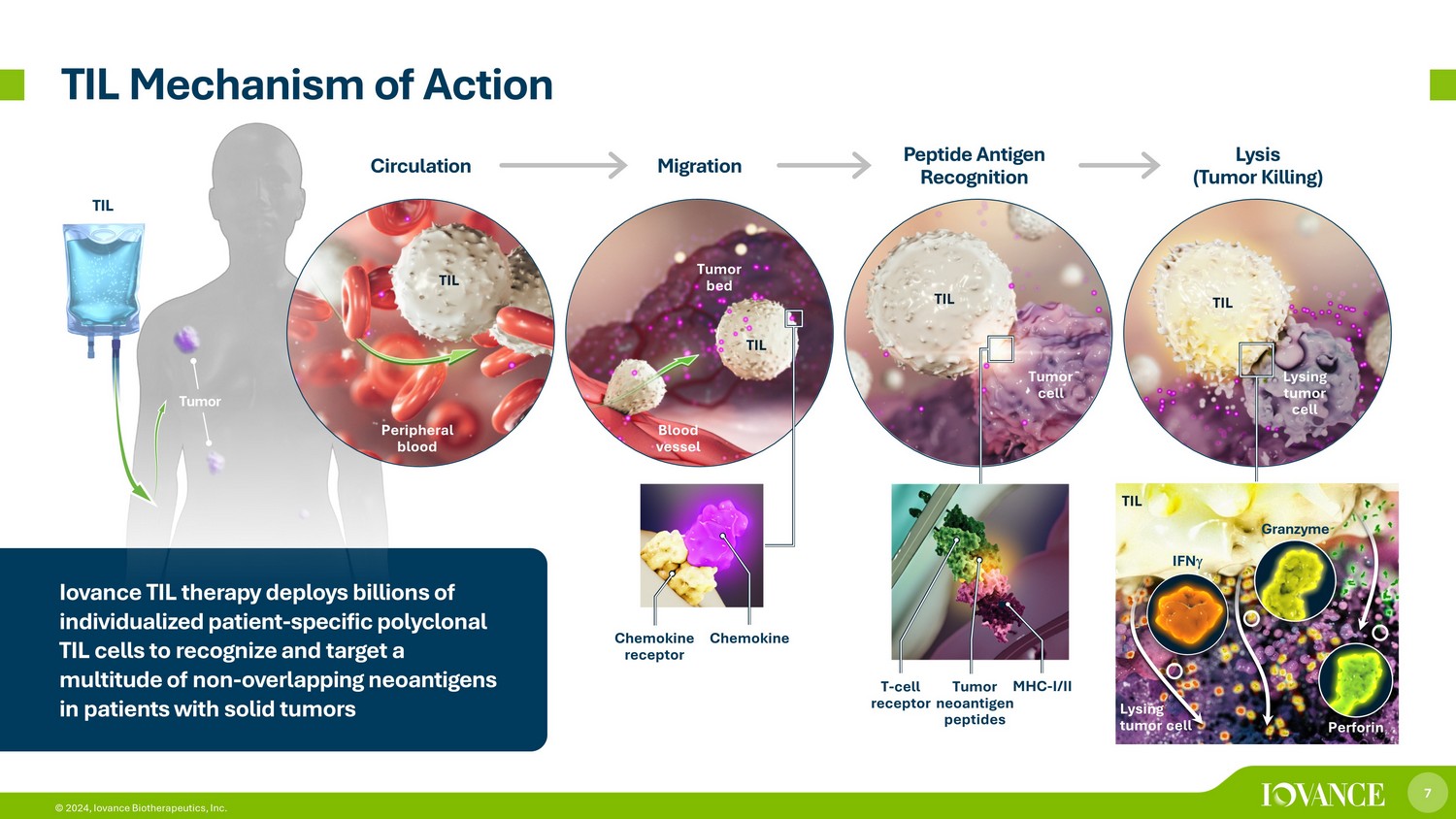
7 © 2024、Iovance Biotherapeutics, Inc. 腫瘍 TIL 作用機序 TIL 末梢血管腫瘍床 TIL 溶解腫瘍細胞 T 細胞受容体腫瘍ネオ抗原ペプチド MHC-I/II ケモカイン受容体循環遊走ペプチド抗原認識溶解 (腫瘍殺害) ケモカイン TIL IFN グランザイムパーフォリン TIL Iovance TIL療法は数十億ドルを費やしています固形腫瘍患者さんの重複しない多数の新抗原を認識して標的にする、患者固有のポリクローナルTIL細胞を個別化しています
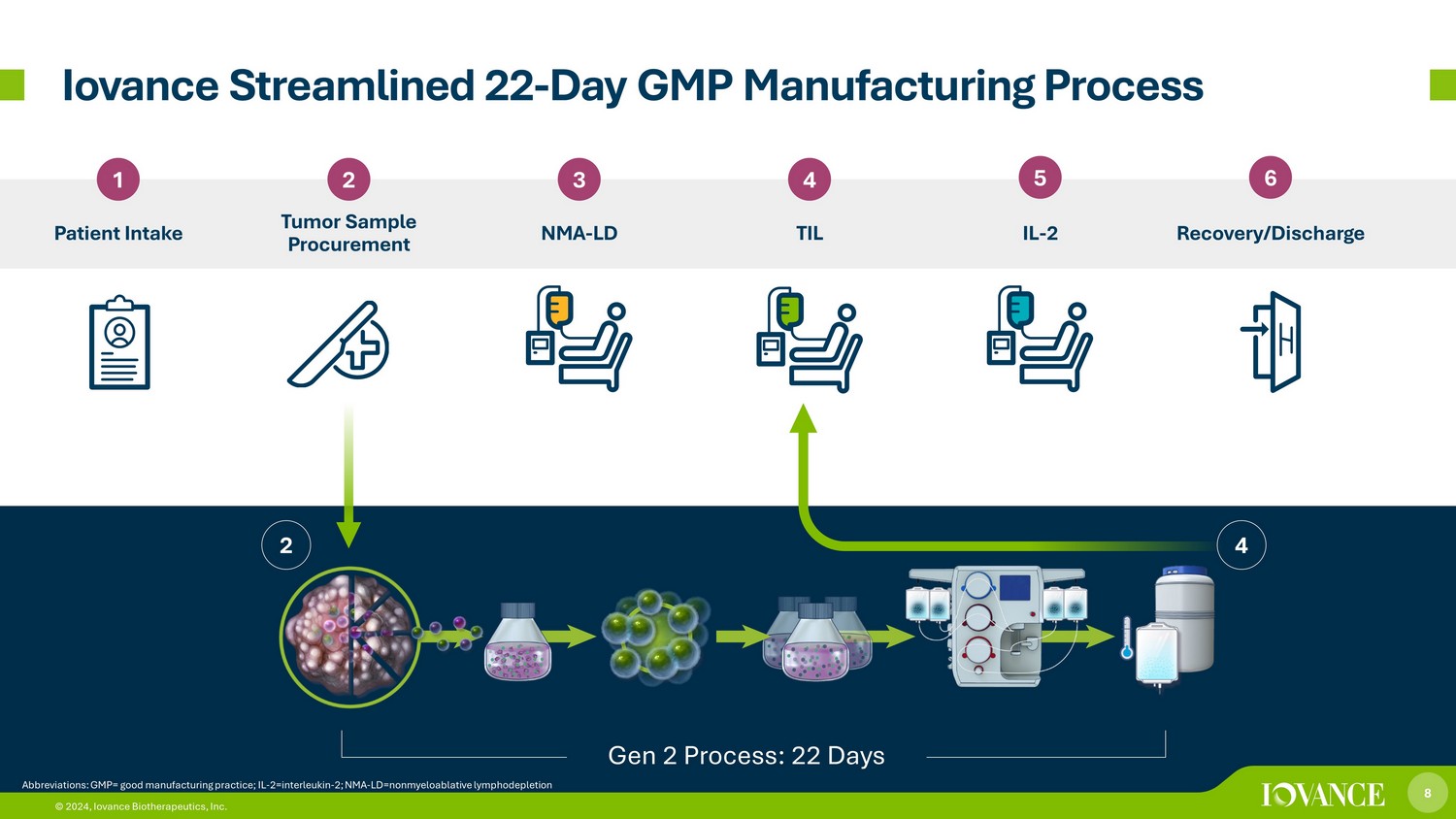
8 © 2024、Iovance Biotherapeutics, Inc. Iovanceは22日間のGMP製造プロセスを合理化しました 1 2 患者摂取腫瘍サンプルの調達 3 4 NMA-LD TIL 5 6 IL-2 回収/放電 4 2 Gen 2プロセス:22日 8 © 2024、Iovance Biotherapeutics, Inc.略語:GMP= 優良製造基準; Il-2=インターロイキン-2; NMA-ld=非骨髄破壊性リンパ枯渇

9 © 2024、Iovance Biotherapeutics, Inc. Iovance Cell Therapeutics, Inc. フィラデルフィアのネイビーヤードのカスタム施設に合わせて建設 136,000フィート2、8500万ドルの投資、コアおよびシェルビルディングのLEEDゴールド認定臨床供給開始 21年第3四半期にFDAのプレライセンス検査を無事に完了しました。BLAの承認を得て商業製造を予定しています。生産能力、品質、COGSの主要な細胞療法製造施設を最適化するための管理

10 © 2024、Iovance Biotherapeutics, Inc. Iovance細胞治療センター(i CTC):数千人のがん患者のための年間キャパシティ構築フェーズ1 iCTC 今日では数百人の患者/年商用向けのコアスイートでの立ち上げ準備臨床フェーズ2 iCTC用の4つの独立したフレックススイート継続的な人員配置臨床フェーズ2 iCTC用の4つの独立したフレックススイート継続的な人員配置商用用のコアスイート12つ(臨床フェーズ3 iCTC)拡張用の4つの独立したフレックススイート 15,000人以上年間、商業用 24 コアスイート、臨床フェーズ 4 i CTC+ 用の 4 つの独立したフレックススイート。追加サイト。CTC 隣接サイトと新規サイト。年間10,000人以上の患者2 オートメーション 10 © 2024、イオヴァンス・バイオセラピューティクス株式会社 1.既存のシェル内での拡張 2.隣接する区画の上に建てるオプション
11 © 2024、イオバンス・バイオセラピューティクス社、11 進行性黒色腫におけるイオバンスTIL療法

12 © 2024、Iovance Biotherapeutics, Inc. 転移性黒色腫治療に対する米国の満たされていない医療ニーズICI(抗PD-1)療法とBRAF/MEK阻害薬 BRAF/MEK阻害薬 BRAF/MEK阻害薬の進行後、FDA承認の治療選択肢はありません BRAF変異+化学療法 ORR 4-10% 5 MOS ~7-8か月 6 抗PD-1 免疫療法 21%-33% ORR 4利用可能なケア:9.9K 6.3K 4.8K 1L 2L 3L-4Lメラノーマ薬-2021年に治療を受けた集団 3切除不能/転移性(米国)1L 2L+ 略語:1L=第一選択療法、2L=セカンドライン療法、3L=サードライン療法、4L=第四ライン療法。ICI=免疫チェックポイント阻害薬、ORR=客観的奏効率、MOS=全生存期間中央値、PD-1=プログラムされた細胞死タンパク質-1, 5万人、米国における進行性黒色腫の年間新規症例 1, 8万人。米国では年間死亡者数18万人 2 1.二次および一次市場調査に基づく切除不能または転移性黒色腫の米国での発生率(2021年)の推定 2.国立がん研究所のサーベイランス、疫学および最終結果(SEER)プログラム。2023年の推定値。https://seer.cancer.gov 2023年5月アクセス 3.クラリベイトDRG疾病ランドスケープ(2021)4.キートルーダ USPI 5.キートルーダUSPI(4%)とウェーバーら、ランセット・オンコル2015(ICC 10%)6です。キルヒブルガーら、Eur J Cancer 2016、ゴールディンガーら、J Clin Oncol 2018
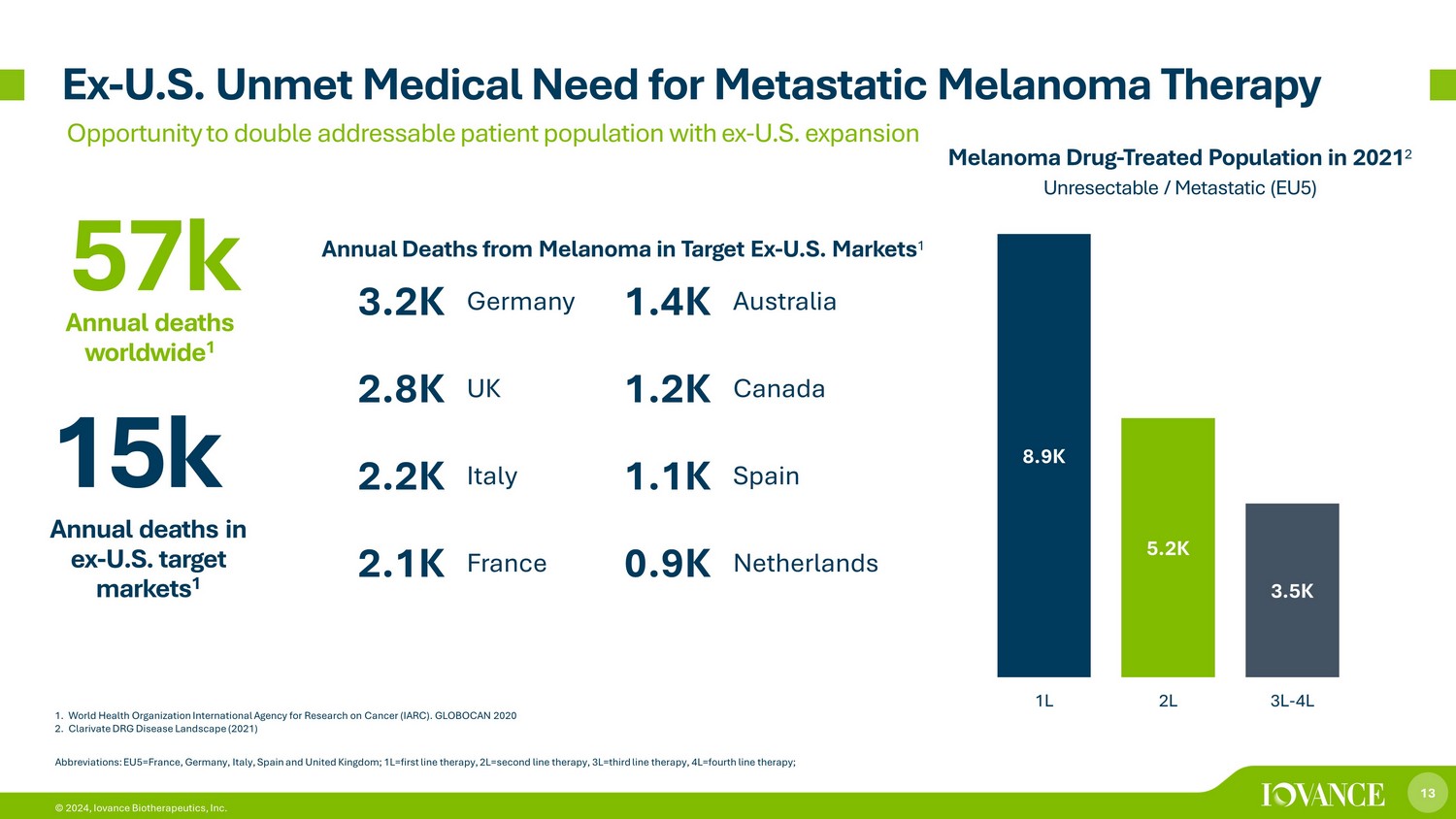
13 © 2024、イオバンス・バイオセラピューティクス株式会社 1.世界保健機関国際がん研究機関(IARC)。グロボカン 2020 2.DRG疾患状況の明確化(2021年)例-米国の転移性黒色腫治療に対する満たされていない医療ニーズは、元米国での拡大により対応可能な患者集団を倍増させる機会 8.9K 5.2K 3.5K 1L 2L 3L-4L メラノーマ治療薬-2021年に治療を受けた集団 2切除不能/転移性(EU5)略語:EU5=フランス、ドイツ、イタリア、スペイン、英国; 1L=第一選択療法、2L=セカンドライン療法、3L=サードライン療法、4L=第四ライン療法、元-米国のターゲット市場での年間死亡者数15万人 1 3.2K ドイツ 1.4K オーストラリア 2.8K 英国 1.2K カナダ 2.2K イタリア 1.1K スペイン 2.1Kフランス 0.9K オランダ 57,000 全世界の年間死亡数 1 ターゲットExの黒色腫による年間死亡数-米国市場 1
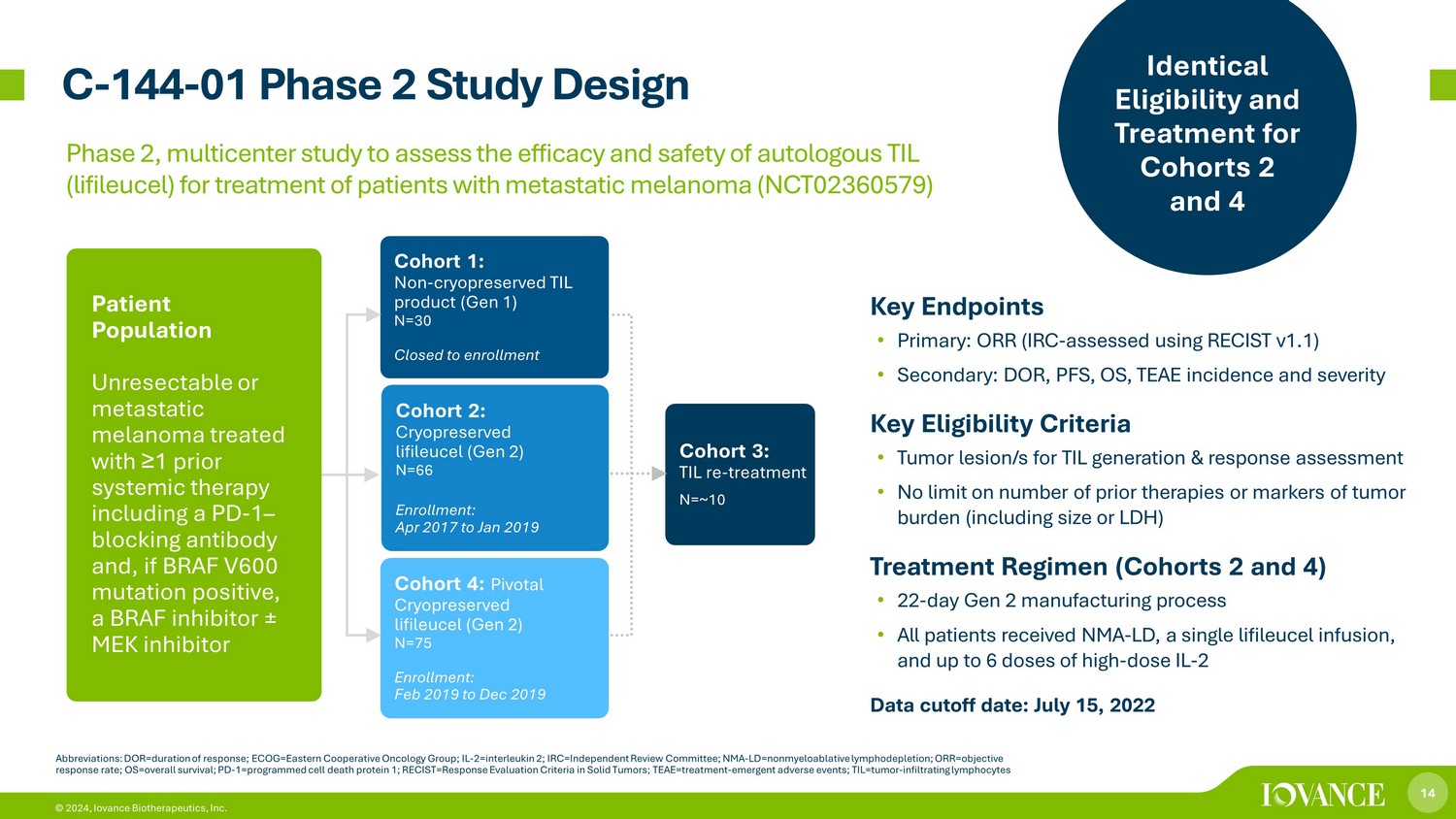
14 © 2024、Iovance Biotherapeutics, Inc. C-144-01 第2相試験デザインの略語:DOR=奏効期間、ECOG=東部協同組合腫瘍学グループ、IL-2=インターロイキン2、IRC=独立審査委員会、NMA-LD= 非骨髄破壊性リンパ枯渇、ORR=客観的奏効率、OS=全生存率、PD-1=プログラム細胞死タンパク質1; RECIST=固形腫瘍における反応評価基準; T EAE=治療-新たな有害事象; TIL=腫瘍-浸潤性リンパ球コホート1: 非凍結保存TIL産物(第1世代)N=30登録受付終了コホート2:凍結保存リフィルセル(第2世代)N=66登録:2017年4月から2019年1月コホート3:TIL再治療 N=~10人の患者集PD-1遮断抗体を含む以前の全身療法と、BRAF V600変異陽性の場合はBRAF阻害剤±MEK阻害薬±MEK阻害剤を含む以前の全身療法で治療された切除不能または転移性黒色腫コホート4:重要な凍結保存リフィルセル(第2世代)N=75登録:2019年2月から2019年12月までの主要エンドポイント • プライマリ:ORR(IRC-RECIST v1.1を使用して評価)• 二次:DOR、PFS、OS、TEAEの発生率と重症度主な適格基準 • TILの腫瘍病変生成と反応の評価 • 以前の治療法の数や腫瘍負荷のマーカー(サイズやLDHを含む)に制限はありません(コホート2と4)治療計画(コホート2と4)• 22日間の第2世代製造プロセス •すべての患者がNMA-LD、単回リフィルルーセル注入、最大6回の高用量ILの投与を受けました-2データ締め切り日:2022年7月15日転移性黒色腫患者の治療における自家TIL(リフィルユーセル)の有効性と安全性を評価するための第2相および第4相第2相多施設共同研究(NCT02360579)
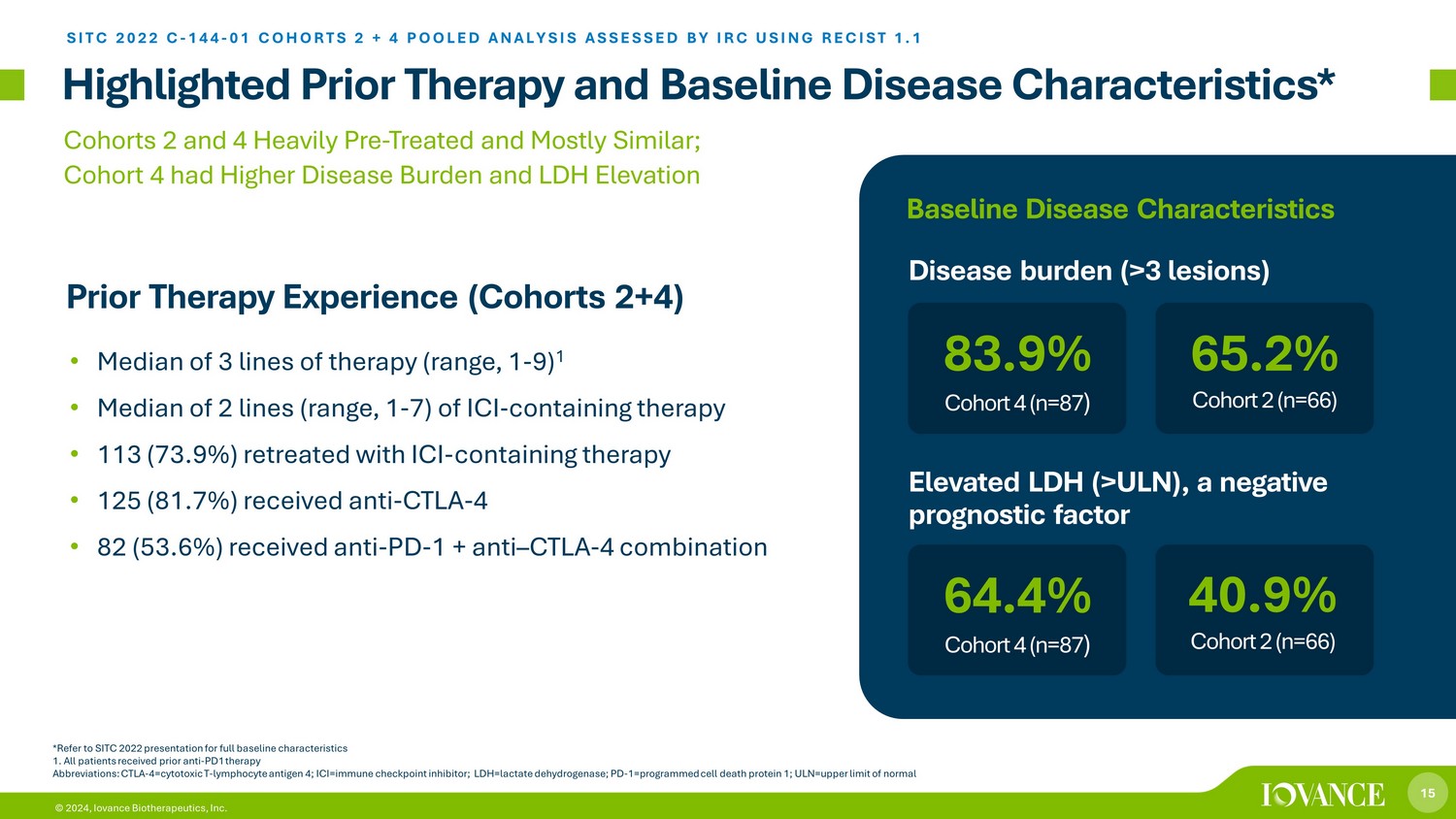
15 © 2024、Iovance Biotherapeutics, Inc. は、以前の治療法とベースライン疾患の特徴を強調しています* *完全なベースライン特性については、SITC 2022のプレゼンテーションを参照してください 1.すべての患者が以前に抗PD1療法を受けていました。略語:CTLA-4=細胞毒性T-リンパ球抗原4; ICI=免疫チェックポイント阻害薬; LDH=乳酸デヒドロゲナーゼ; PD-1=prola mmed細胞死タンパク質1; ULN=正常値の上限 • 3系統の中央値 (範囲、1~9) 1• 2系統の中央値 (範囲、ICIを含む治療の1〜7)• 113人(73.9%)がICIを含む療法で後退しました • 125人(81.7%)が抗CTLAを受けました-4・82人(53.6%)が抗PD-1+抗CTLA-4つの組み合わせコホート2と4の組み合わせで十分に前処理され、ほぼ類似しています。以前の治療経験は疾患負担とLDH上昇の方が高かった(コホート2+4)SITC 2022 C-144-10コホート2+4プール分析はRECIST 1.1 64.4%コホート4(n=87)疾患負荷(3以上の病変)40.9%コホート2(n=66)83.9%コホート4(n=87)65.2%コホート2(n=87)n=66)負の予後因子であるLDHの上昇(>ULN)、ベースライン疾患の特徴
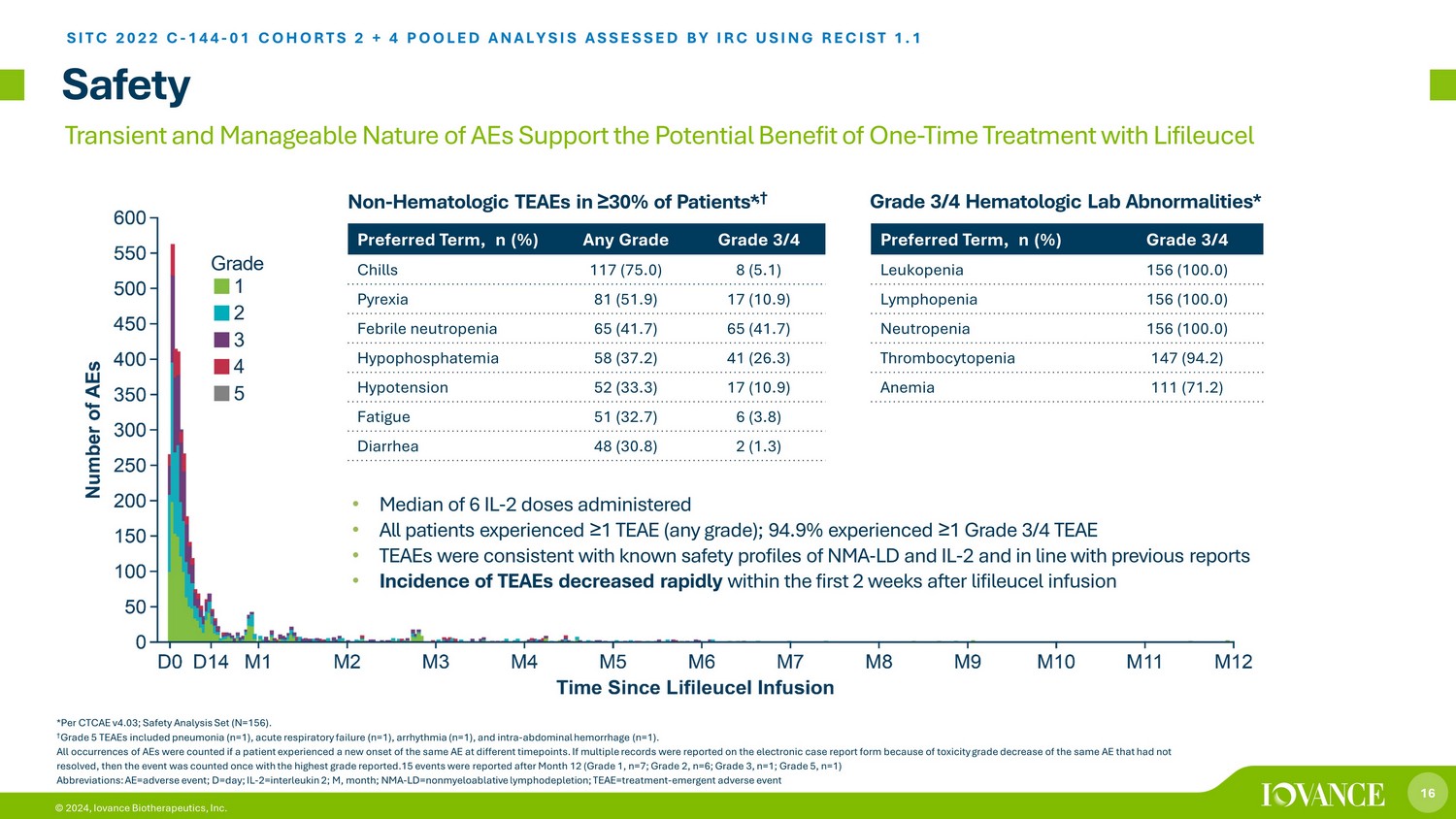
16 © 2024、Iovance Biotherapeutics, Inc.の患者の 30% 以上に安全な非血液学的TEAE*、†*CTCAE v4.03準拠; 安全分析セット (N=156)。† グレード5のTEAEには、肺炎 (n=1)、急性呼吸不全 (n=1)、不整脈 (n=1)、腹腔内出血が含まれていました年齢 (n=1)。ある患者が異なる時点で同じAEが新たに発症した場合、AEのすべての発生がカウントされました。同じAEの毒性グレードの低下が解決されなかったために電子症例報告フォームに複数の記録が報告された場合、その事象は最も高い悪性度から1回カウントされました。12か月目以降に15件のイベントが報告されました(グレード1、n= 7、グレード2、n=6、グレード3、n=1、グレード5、n=1)略語:AE=有害事象; D=day; IL-2=インターロイキン2; M、月、NMA-LD=非骨髄除去性リンパ枯渇、TEAE=治療-緊急の有害事象 • 中央値6IL-2回投与 • すべての患者がTEAEを1回以上(グレードを問わず)、94.9%が1回以上を経験しましたグレード3/4のTEAE • TEAEは、NMA-LDおよびIL-2の既知の安全性プロファイルと一致し、以前の報告と一致していました • TEAEの発生率は、リフィルルーセル注入優先期間後の最初の2週間以内に急速に減少しました、n(%)グレード3/4の悪寒 117(75.0)8(5.1)発熱 81(51.9)17(10.9)熱性好中球減少症 65(41.7) 65 (41.7) 低リン血症 58 (37.2) 41 (26.3) 低血圧 52 (33.3) 17 (10.9) 疲労 51 (32.7) 6 (3.8) 下痢 48 (30.8) 2 (1.3) 優先期間、n (%) グレード 3/4 白血球減少 156 (100.0) リンパ球減少症 156 (100.0) 好中球減少症 156 (100.0) (100).0)血小板減少症147(94.2)貧血111(71.2)グレード3/4の血液検査異常* *UDGH SITC 2022 C-144-10コホート2 + 4プール分析は、RECIST 1.1を使用してIRCによって評価されました。AEの一過性で管理しやすい性質は、リフィルセルによる1回限りの治療の潜在的な利点を裏付けています
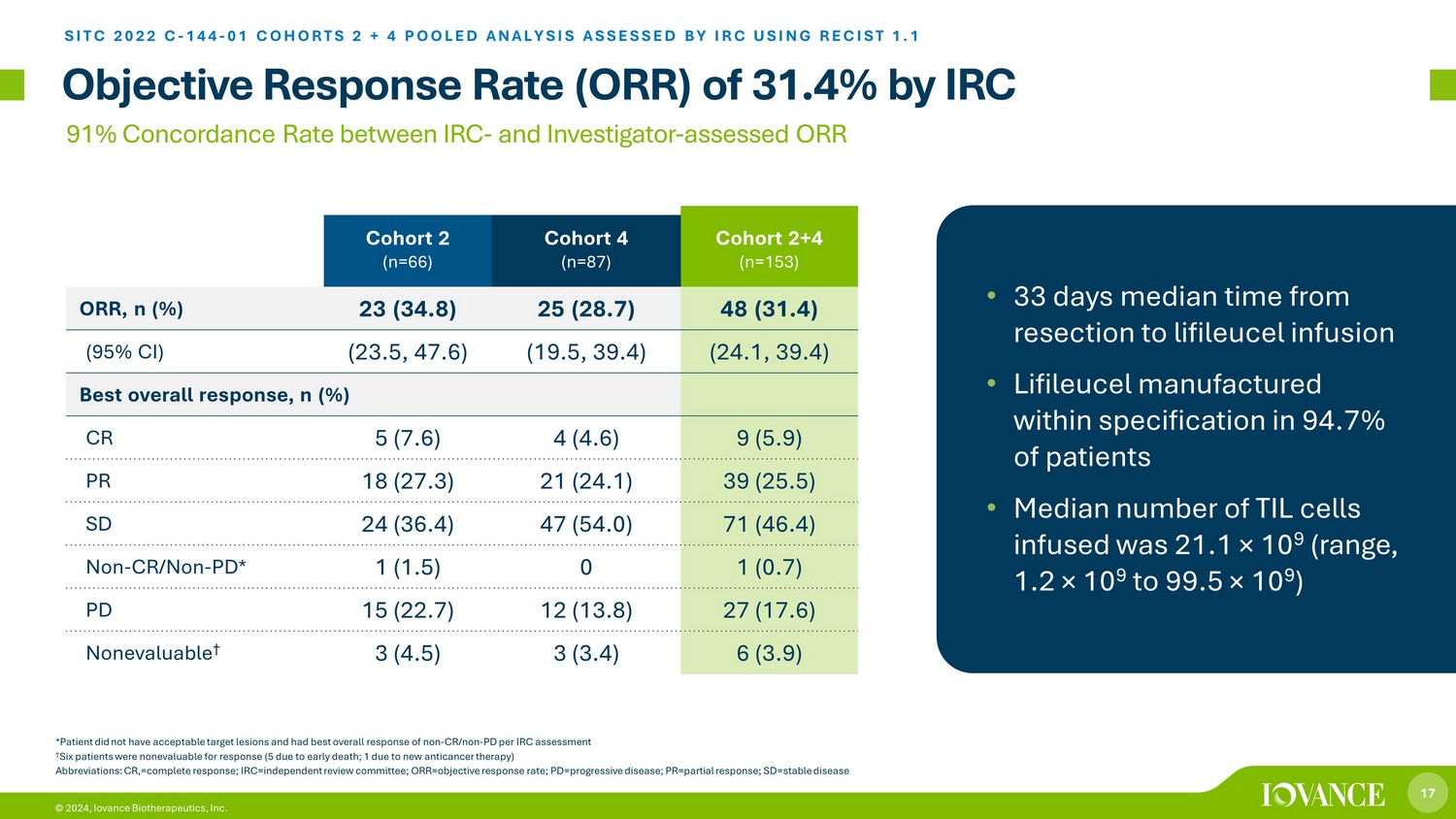
17 © 2024、IRC SITCによるIovance Biotherapeutics社の客観的奏効率(ORR)31.4% C-144-01コホート2+4プール分析RECISTを使用してIRCが評価した2 + 4プール分析 IRCと治験責任医師評価との間の一致率 1.1 91% *患者は許容できる標的病変がなく、全体的に非CR/非PDの奏効が最も良かった IRC評価† 6人の患者は奏効評価の対象外でした(5人は早期死亡のため、1人は新しい抗がん療法のため)略語:CR、=完全奏効、IRC=独立審査委員会、ORR=客観的奏効率、PD=進行性疾患; PR= 部分奏効; SD=安定疾患コホート2 (n=66) コホート4 (n=87) コホート2+4 (n=153) ORR, n (%) 23 (34.8) 25 (28.7) 48 (31.4) (95% CI) (23.5, 47.6) (19.5, 39.4) (24.1, 39.4) 全体的に最も良い反応、n (%) CR 5 (7.6) 4 (4.6) 9 (5.9) PR 18 (27.3) 21 (24.1) 39 (25.5) SD 24 (36.4) 47 (54.0) 71 (46.4) 非-CR/非-PD* 1 (1.5) 1 (0.7) PD 15 (22.7) 12 (13.8) 27 (17.6) 評価できない† 3 (4.5))3(3.4)6(3.9)• 切除からリフィルルーセル注入までの期間の中央値は33日 • 患者の 94.7% で仕様の範囲内で製造されたライフィルユーセル • 中央値注入されたTILセルの数は21.1×10 9(範囲、1.2×10 9から99.5×10 9)でした
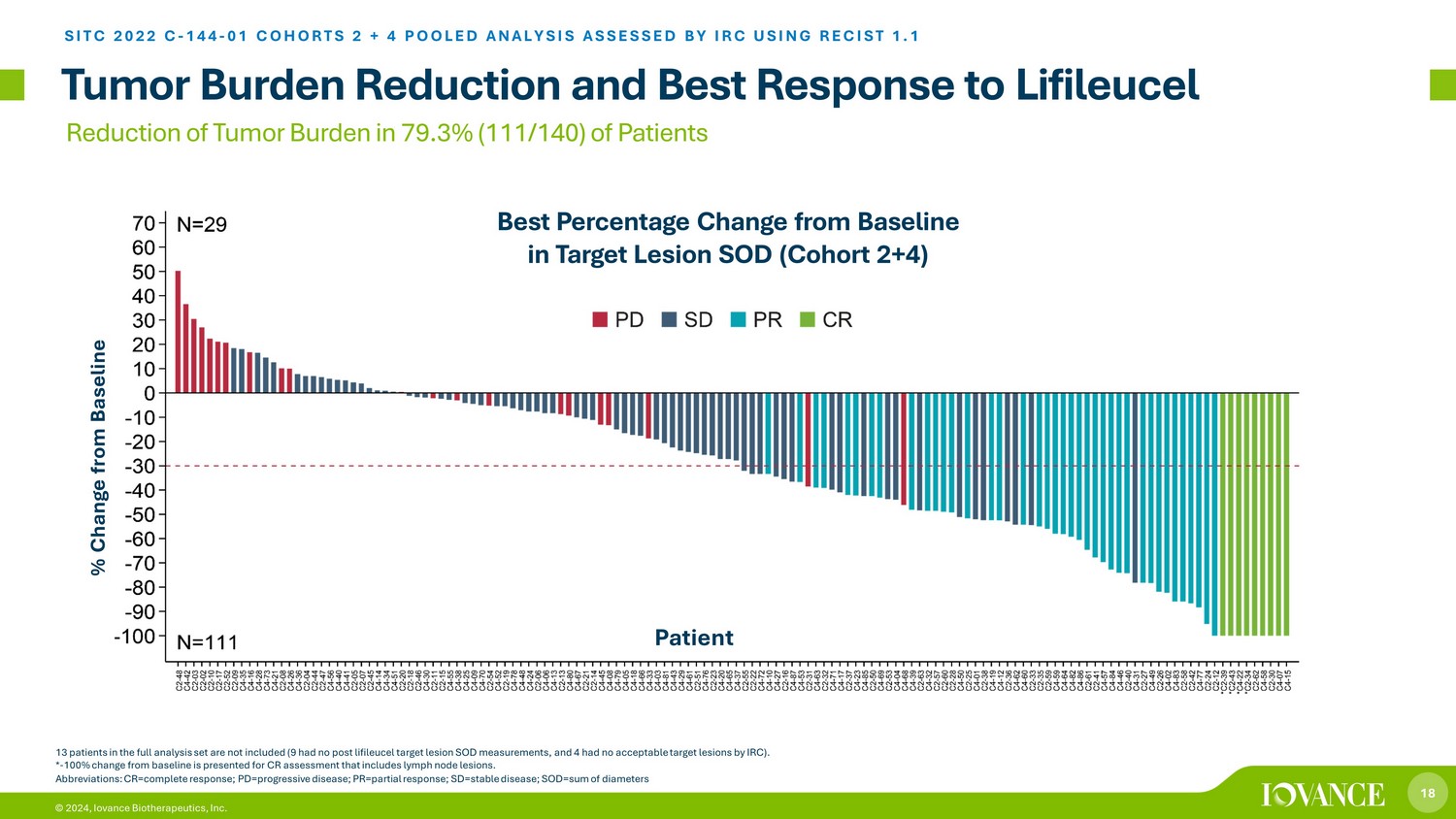
18 © 2024、Iovance Biotherapeutics, Inc. 腫瘍負荷軽減とライフィルルーセルSITCへの最善反応 2022 C-144-01 コホート 2 + 4 プール分析 IRCがRECIST 1.1を使用して評価した2+4のプール分析。すべての分析セットの13人の患者は含まれていません(9人はリフィルセル標的病変後のSOD測定がなく、4人はIRCによるACC epテーブルの標的病変はありませんでした)*。-リンパ節病変を含むCR評価では、ベースラインからの 100% の変化が示されます。ターゲット病変におけるベースラインからの最高の変化率 SOD(コホート2+4)の79.3%(111/140)の患者における腫瘍負荷の軽減略語:CR=完全奏効、PD=進行性疾患、PR=部分奏効、SD=安定疾患、SOD=直径の合計、ベースラインの患者からの変化%
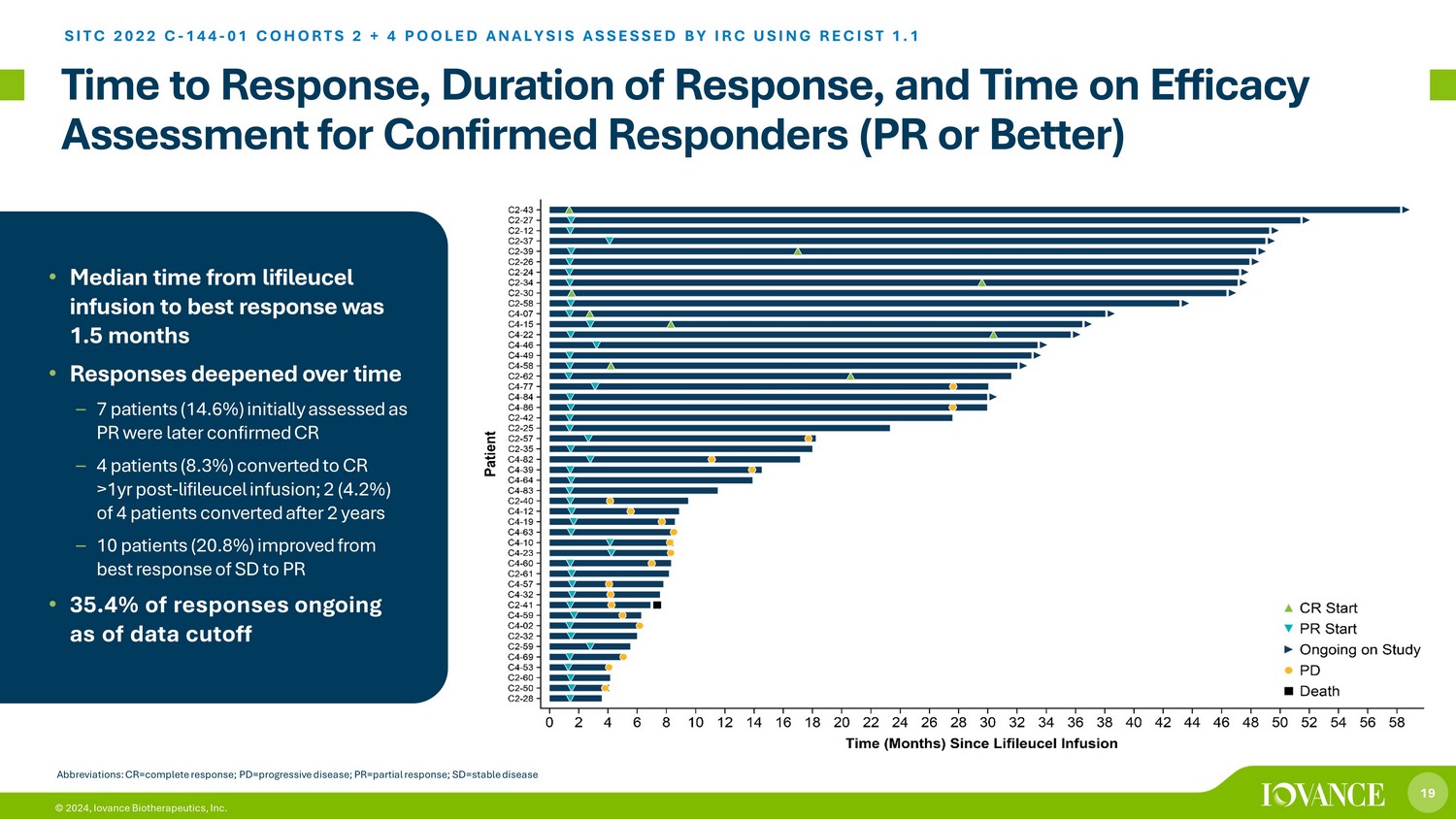
19 © 2024、Iovance Biotherapeutics, Inc. 回答までの時間、応答時間、確認奏効者の有効性評価までの時間(PR以上)SITC 2022 C-144-01コホート2 + 4コホートIRCがRECIST 1.1を使用して評価した2+4プール分析 • リフィルルーセル注入から最良の反応までの期間の中央値は1.5か月でした •時間の経過とともに反応が深まりました — 7人の患者(14.6%)最初にPRと評価されたが、後にCRが確認されました — リフィルルーセル注入の1年後に4人の患者(8.3%)がCRに転向しました。4人の患者のうち2人(4.2%)が2年後に転向しました。10人の患者(20.8%)が最高の状態から改善しましたSDのPRへの反応 • 回答の 35.4% がデータカットオフ時点で継続中。略語:CR=完全奏効、PD=進行性疾患、PR=部分奏効、SD=安定病
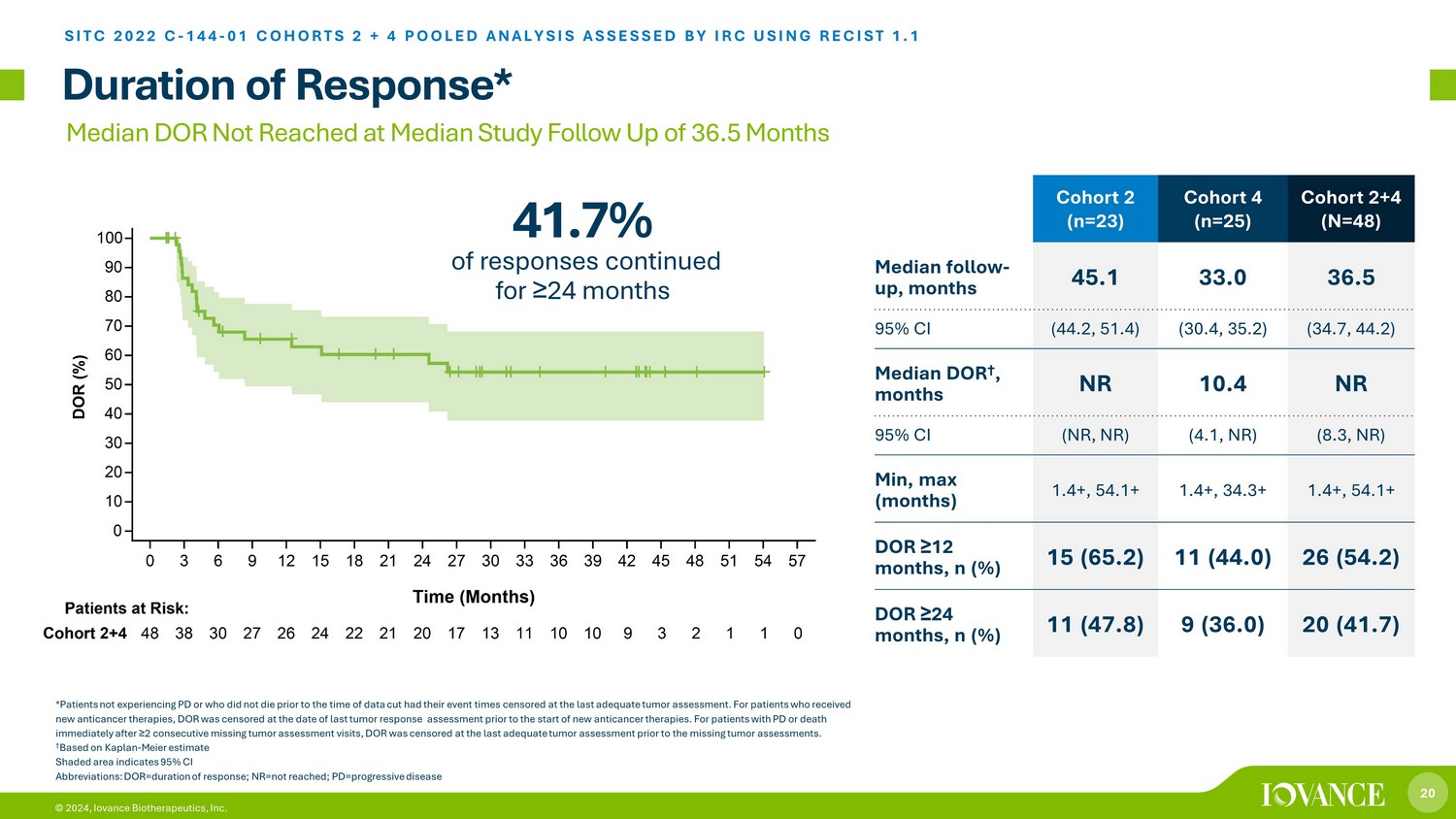
20 © 2024、Iovance Biotherapeutics社コホート2(n=23)コホート4(n=25)コホート2+4(N=48)フォローアップの中央値、45.1か月 33.0 36.5 95%CI(44.2、51.4)(30.4、35.2)(34.7、44.2)DOR †の中央値 †、月 NR 10.4 NR 95% CI(NR、NR)(4.1、NR)(8.3、NR)最小、最大(月)1.4+、54.1+ 1.4+、34.3+ 1.4+、54.1+ 12か月以上、n(%)15(65.2)11(44.0)26(54.2)DOR ≥ 24か月、n(%)11(47.8)9(36.0)20(41.7)期間の反応* SITC 2022 C-144-01 コホート 2 + 4 プール分析 IRC が RECIST 1.1 を使用して評価しました。*パーキンソン病を経験していない、または以前に死亡したことがない患者データカットの時点では、最後に腫瘍評価が行われた時点で、イベント時間が検閲されました。新しい抗がん療法を受けた患者さんについては、新しい抗がん剤または治療法の開始前の最後の腫瘍反応評価の日に、DORは検閲されました。パーキンソン病患者、または腫瘍評価を2回以上欠席した直後に死亡した患者の場合、DORは前回の適切な腫瘍評価で検閲されました。† カプラン-マイヤーの推定に基づくと、影付きの領域は95%CIを示します。DOR=奏効期間、NR=到達なし、PD=進行性疾患研究中央値36.5か月でDOR中央値に達しなかったフォローアップの41.7%が24か月以上続きました
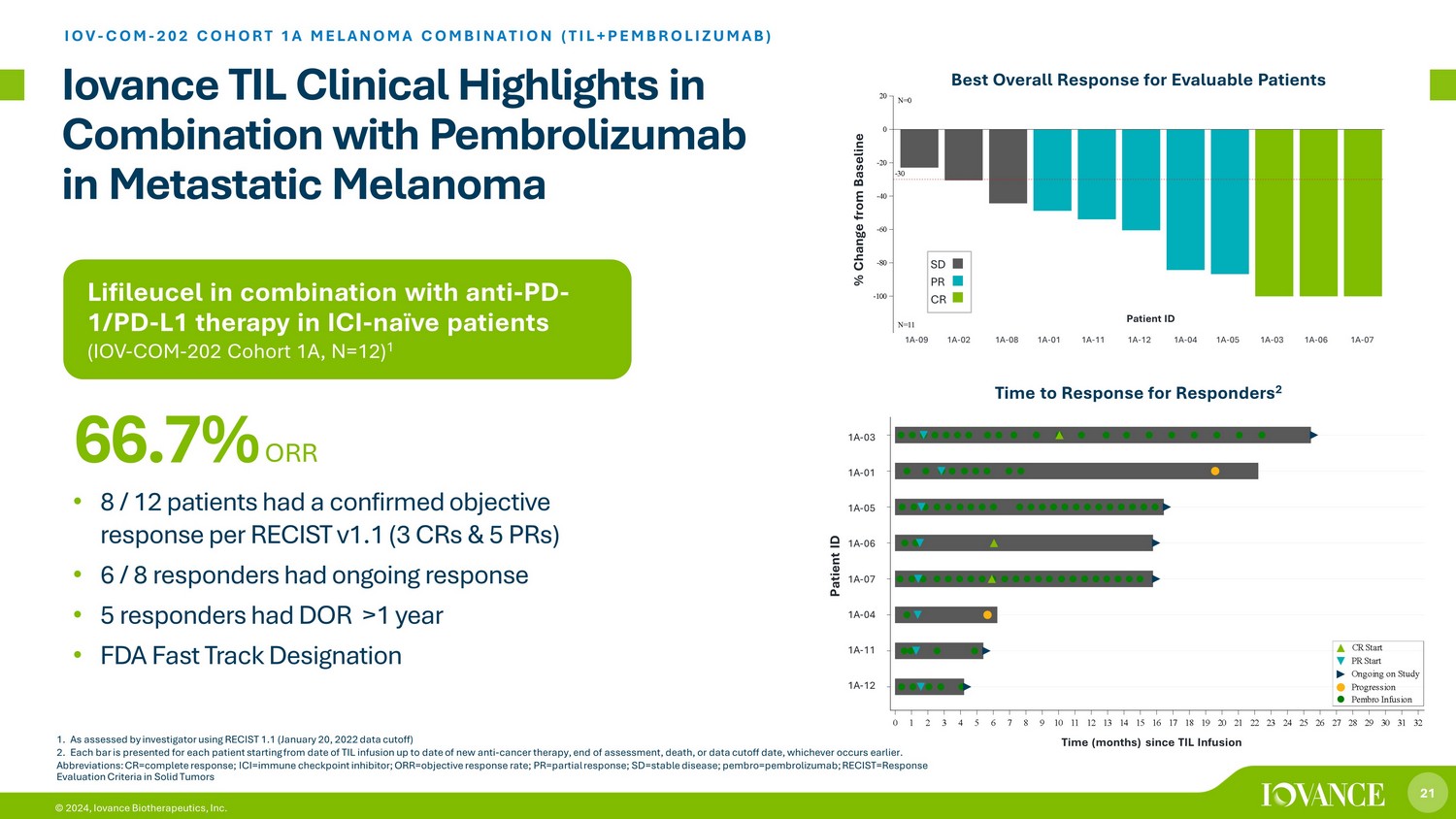
21 © 2024、Iovance Biotherapeutics, Inc. LifileucelとICIナイーブ患者(IOV-COM-202 コホート1A、N=12)1 転移性黒色腫におけるペムブロリズマブとの併用 IOV-COM-202 コホート1Aメラノーマの併用(TIL+ペムブロリズマブ)• RECIST v1.1に従って、8/12人の患者が客観的奏効を確認しました(3つのCRと5つのPR)• 6/8人の回答者が継続的な奏効を示しました •5人の回答者が1年以上DORを患っていました • FDAファストトラック指定 66.7% ORR 1.RECIST 1.1(2022年1月20日のデータカットオフ)を使用して調査員によって評価されたとおりです。2.各バーは、TIL注入日から新しい抗がん療法の日まで、評価終了日、死亡日、またはデータ締め切り日のいずれか早い方まで、各患者について表示されます。略語:CR=完全奏効、ICI=免疫チェックポイント阻害薬、ORR=客観的奏効率、PR=部分奏効、SD=セントエーブル病、ペムブロ=ペムブロリズマブ、RECIST=固形腫瘍の反応評価基準 TIL注入1A-12 1A-11 1A-04 1A-07 1A-06 1A-05 1A-01 1A-03 S u b j e c t s 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 TIL注入からの時間 (ヶ月) ペンブロ注入進行が治験中で進行中 TIL注入1A-03 1A-01 1A-01 1A-05 1A-06 1A-071A-04 1A-11 1A-12 患者ID 回答者の応答までの時間 2 患者ID CRPRSD 最良総合反応 -30 1A-09 1A-02 1A-08 1A-01 1A-11 1A-12 1A-04 1A-05 1A-03 1A-06 1A-07 -100 -80 -60 -40 -20% C h n g e f r o m b a s e l i n e N=0 N=11 コホート 1A% ベースラインからの変化 SD PR CR 1A-09 1A-02 1A-08 1A-01 1A-11 1A-12 1A-04 1A-05 1A-03 1A-06 1A-07 患者ID 評価可能な患者にとって最良の総合的対応
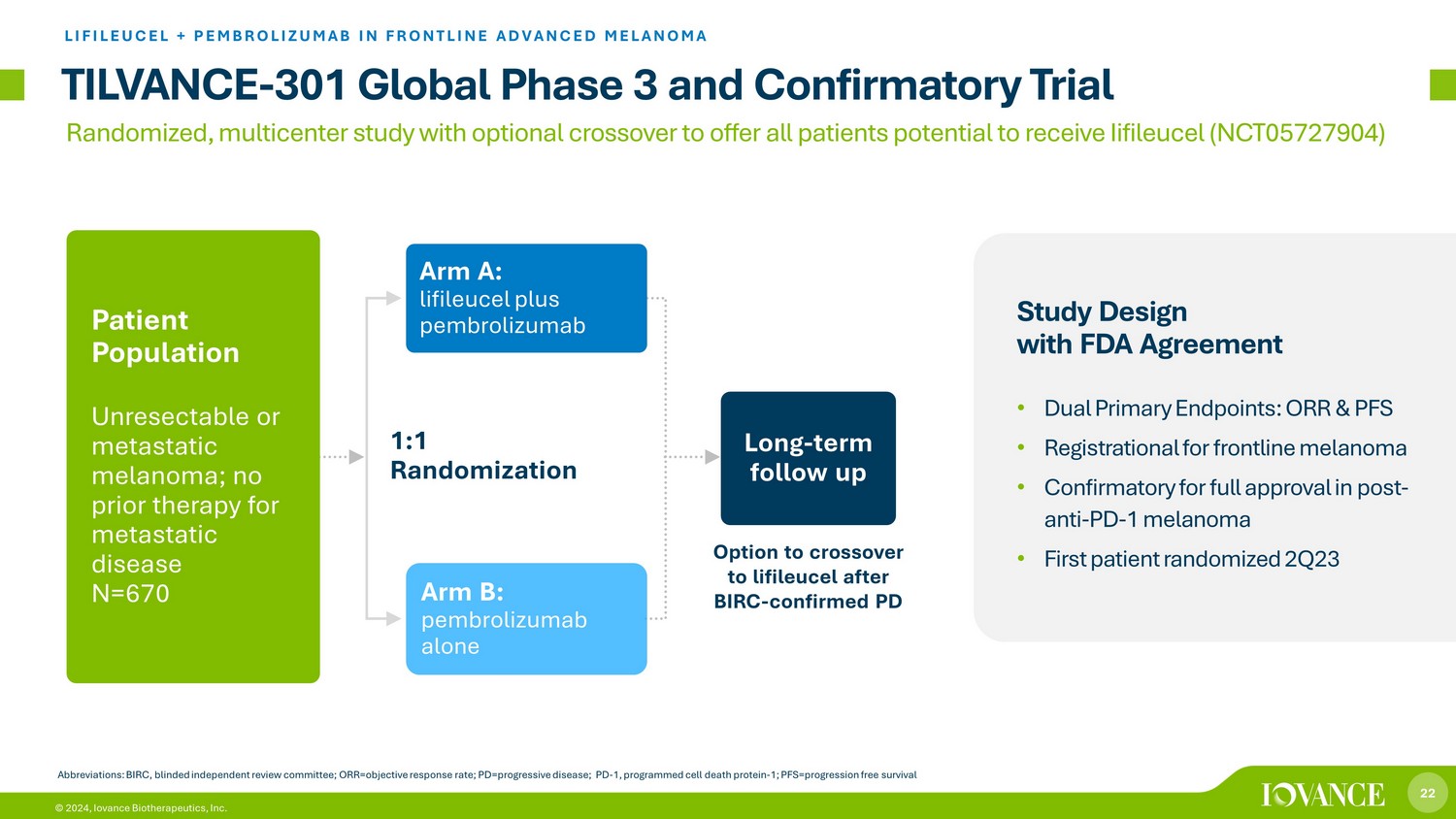
22 © 2024、Iovance Biotherapeutics, Inc. 1:1 ランダム化 TILVANCE-301グローバル第3相および最前線の進行性黒色腫におけるLIFILEUCEL+ペムブロリズマブ確認試験略語:BIRC、盲検独立審査委員会、ORR=客観的奏効率、PD=進行性疾患、PD=進行性疾患、PD-1、プログラム d 細胞死タンパク質-1; PFS=プログレス自由生存群A:リフィルイセル+ペムブロリズマブ長期フォローアップ患者集団切除不能または転移性黒色腫、転移性疾患に対する事前治療なし N=670 群B:ペムブロリズマブ単独のFDAによる研究デザイン契約 • 二重主要評価項目:ORRとPFS • 最前線の黒色腫の登録 • 抗PD-1型黒色腫後の完全承認を確認 • 23年第2四半期の最初の患者、BIRC後にリフィルーセルへのクロスオーバーの選択肢をランダム化-PDランダム化、多施設共同研究、オプションでイイフィロイセルを投与される可能性のあるすべての患者に提供する(NCT05727)904)

23 © 2024、Iovance Biotherapeutics, Inc. Proleukin® の取引の戦略的利益 • Proleukin®(アルデスロイキン、ヒト組換えIL-2)および関連する収益に対するグローバルな権利• リフィルルーセルレジメンのIL-2サプライチェーンの確保 • 臨床試験費用と将来のCOGSの削減 • TILの商品化による大幅な追加収益の見込み 1億6,770万ポンドの先行投資既存の現金キー数値で資金調達ライフルーセルの最初の承認後、4,170万ポンド 2023年5月18日に買収が完了しました
24 © 2024、アイオバンス・バイオセラピューティクス社、24 非小細胞肺がんにおけるイオバンスTIL療法
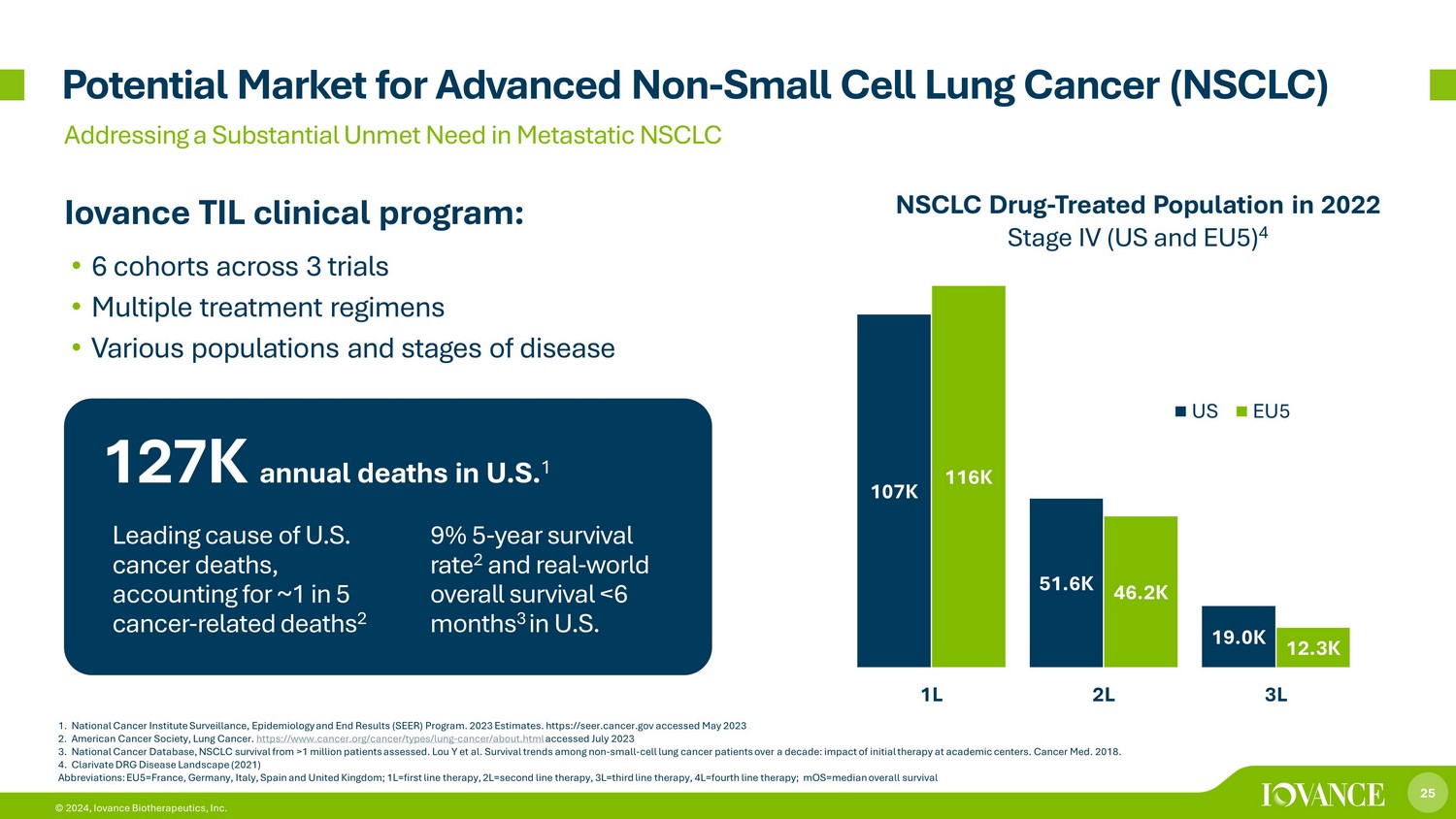
25 © 2024、イオバンス・バイオセラピューティクス株式会社 1.国立がん研究所のサーベイランス、疫学および最終結果(SEER)プログラム。2023年の推定値。https://seer.cancer.gov 2023年5月2日にアクセス。米国がん協会、肺がん。https://www.cancer.org/cancer/types/lung-cancer/about.html 2023年7月にアクセス 3.全国がんデータベース、100万人以上の患者のNSCLC生存率を評価しました。Lou Yら。10年以上にわたる非小細胞がん患者の生存傾向:学術センターでの初期治療の影響。がん医学部 2018年。4.Clarivate DRG疾患ランドスケープ(2021)略語:EU5=フランス、ドイツ、イタリア、スペイン、英国; 1L=第一選択療法、2L=第二選択療法、3L=第三選択療法、4L=第四選択療法; MOS=転移性NSCLCバイオバンス TILにおける実質的に満たされていないニーズに対応する進行した非小細胞肺がん(NSCLC)の全生存率の中央値市場臨床プログラム:• 3件の試験にわたる6つのコホート • 複数の治療レジメン • さまざまな集団と病期 • 米国での年間死亡者数 2,17万人 51.6K 19.0K 116K 46.2K 12.3K 1L 2L 3L 米国EU5 NSCLC薬-2022年のIV期の治療対象集団(米国およびEU5)4米国のがんによる死亡の主な原因、がん関連死亡者の約5人に1人を占める、がん関連死亡者の約2% 5年生存率2と実世界全生存率

26 © 2024、Iovance Biotherapeutics, Inc. IOV-LUN-202 NSCLC(NCT04614103)後の患者さんを対象としたLN-15†の試験デザインフェーズ2多施設共同研究-抗PD-1 NSCLC(NCT04614103)* エンドポイント • プライマリ:IRCによるORR • 二次:安全性 * 米国食品医薬品局は、2023年12月22日にIOV-LUN-202試験を臨床保留にしました。新しい患者の登録は一時停止されています。以前に治療を受けた患者は、引き続き監視され、追跡されます。すでに腫瘍切除を受けた患者は、追加の予防措置とリスク軽減策を講じたLN-145TIL治療レジメンを引き続き受けます。† 第2世代TIL製品††コホート3の患者さんが外科的採取を受けることができず、コア生検から成長したTIL略語:Anti-PD-1、抗プログラム細胞死阻害薬、IRC、独立審査委員会、NSCLC、非小規模-細胞肺がん、ORR、客観的奏効率、TPS、腫瘍比率スコア、Iovance TIL Therapy LN-145in NSCLC IOV-LUN-202は、進行した患者を登録するように設計されています。満たされていない医療ニーズは高いが、抗PD-1治療後の以前の治療ラインが限られているNSCLC患者集団切除不能または転移性NSCLCで、以前の抗PD-1治療と化学療法の後に進行し、約40か所で進行し、米国、カナダ、ヨーロッパで拡大しています。コホート1: のNSCLC患者
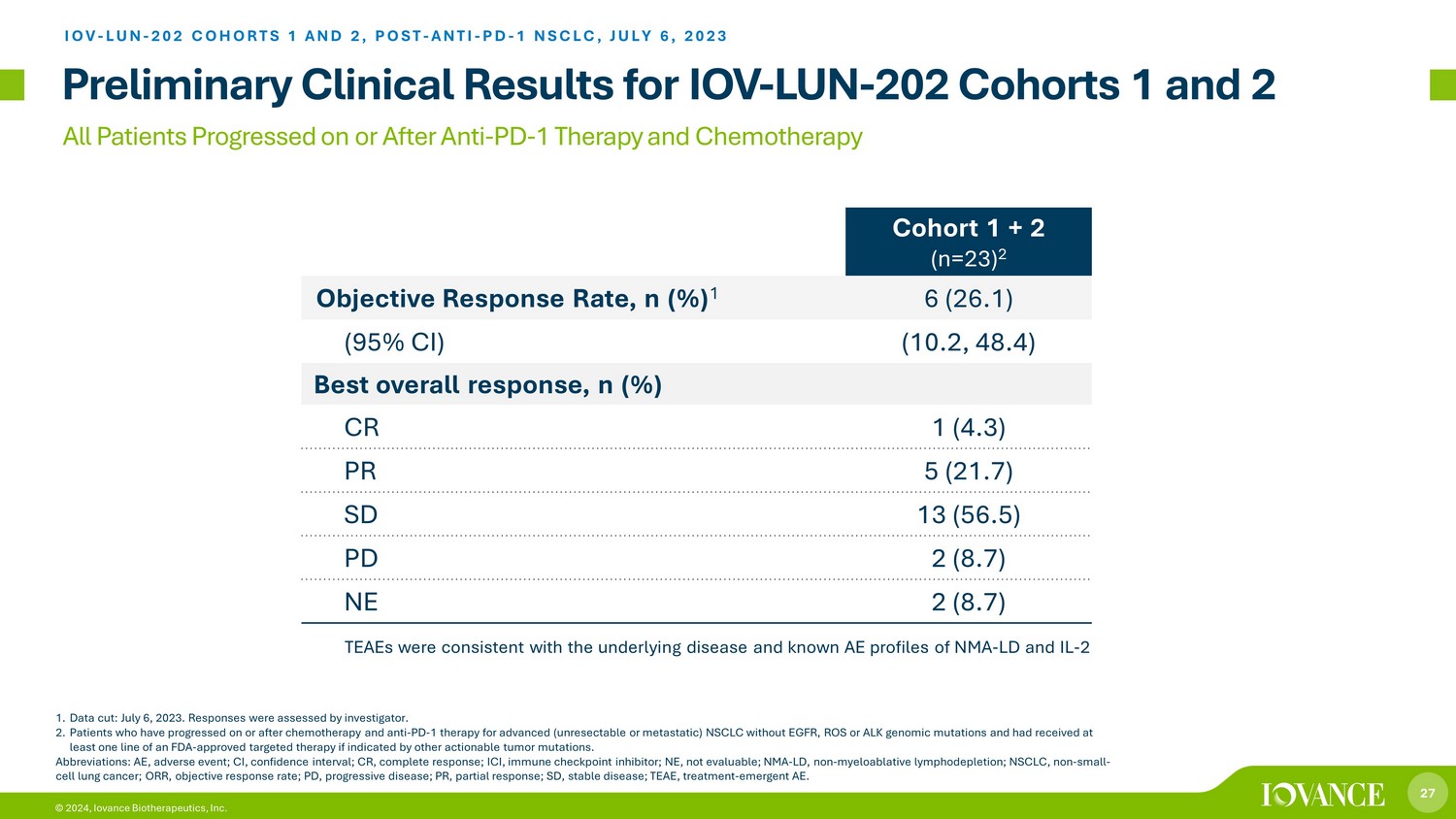
27 © 2024、Iovance Biotherapeutics, Inc. 抗PD-1療法と化学療法の実施中または後に進行したすべての患者 IOV-LUN-202コホート1および2 1に関する予備臨床結果データカット:2023年7月6日。回答は調査員によって評価されました。2.EGFR、ROS、またはALKのゲノム変異を伴わずに進行した(切除不能または転移性の)NSCLCに対する化学療法および抗PD-1療法の施行中または後に進行し、FDAの少なくとも1系統を受けた患者は、他の治療可能な腫瘍変異によって示された場合、標的療法を承認しました。略語:AE、有害事象、CI、信頼区間、CR、完全奏効、ICI、免疫チェックポイント阻害薬、NMA-LD、非骨髄破壊性リンパ減少症、NSCLC、非小細胞肺がん、ORR、客観的奏効率、PD、進行性疾患、PR、部分奏効、SD、安定疾患、TEAE、治療時間ではなく-創発的なAES。バイオバンスTILセラピーLN-NSCLCコホート1+2(n=23)2の145客観的回答率、n(%)1 6(26.1)(95%CI)(10.2、48.4)最高の総合反応、n(%)CR 1(4.3)PR 5(21.7)SD 13(56.5)PD 2(8.7)NE2(8.7)IOV-LUN-202 コホート1と2、ポスト-抗PD-1 NSCLC、2023年7月6日、TEAEは、基礎疾患とNMA(LDとIL)の既知のAEプロファイルと一致していました-2
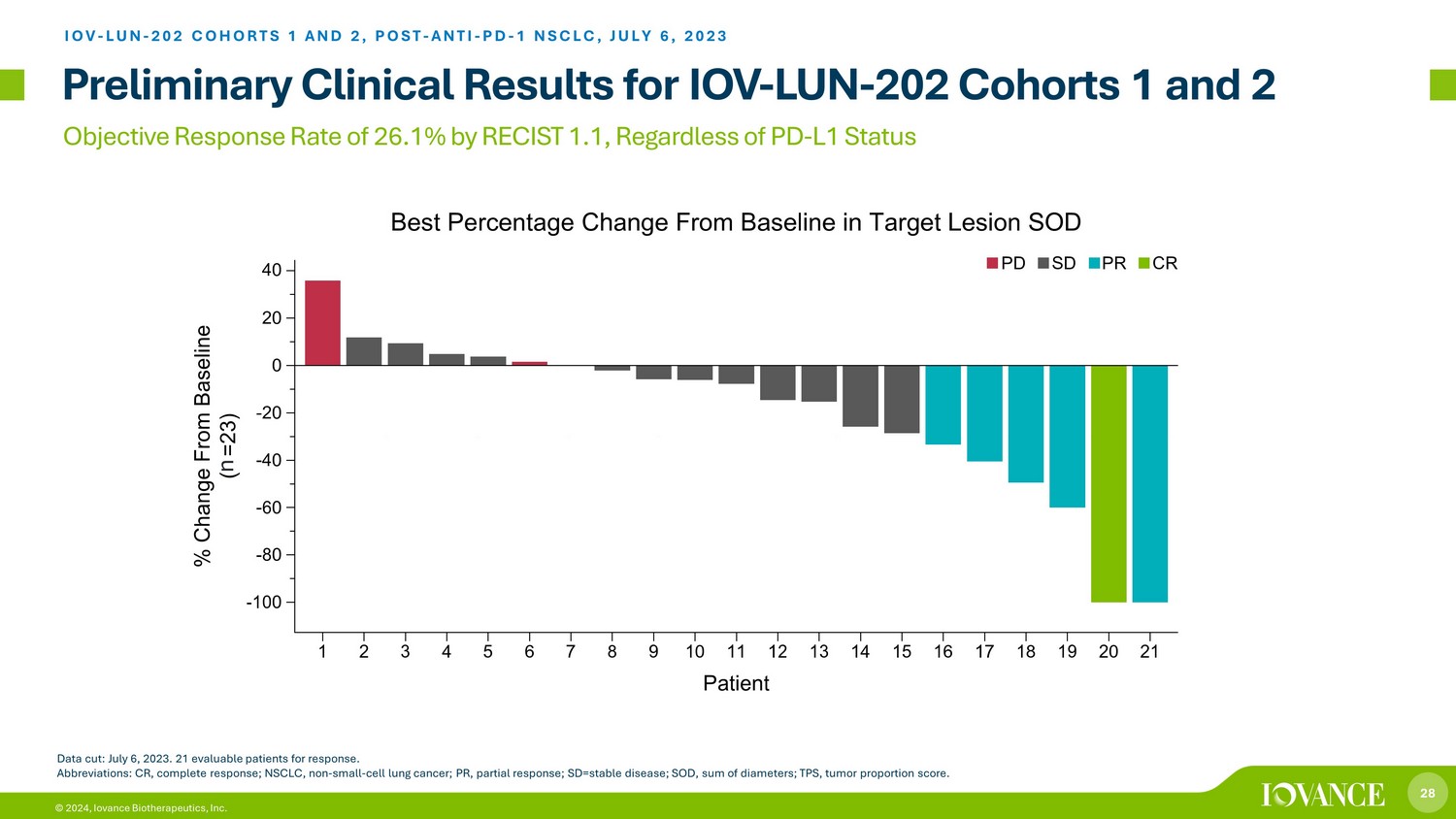
28 © 2024、アイオバンス・バイオセラピューティクス社の客観的奏効率 RECIST 1.1、RECIST 1.1による客観的奏効率は 26.1% です。IOV-LUN-202コホート1と2 IOV-LUN-202コホート1と2、POST-抗PD-1 NSCLC、2023年7月6日データカット:2023年7月6日。奏効評価可能な患者21人略語:CR、完全奏効、NSCLC、非小細胞肺がん、PR、部分奏効、SD=安定疾患、SOD、直径の合計、TPS、腫瘍割合スコア。n
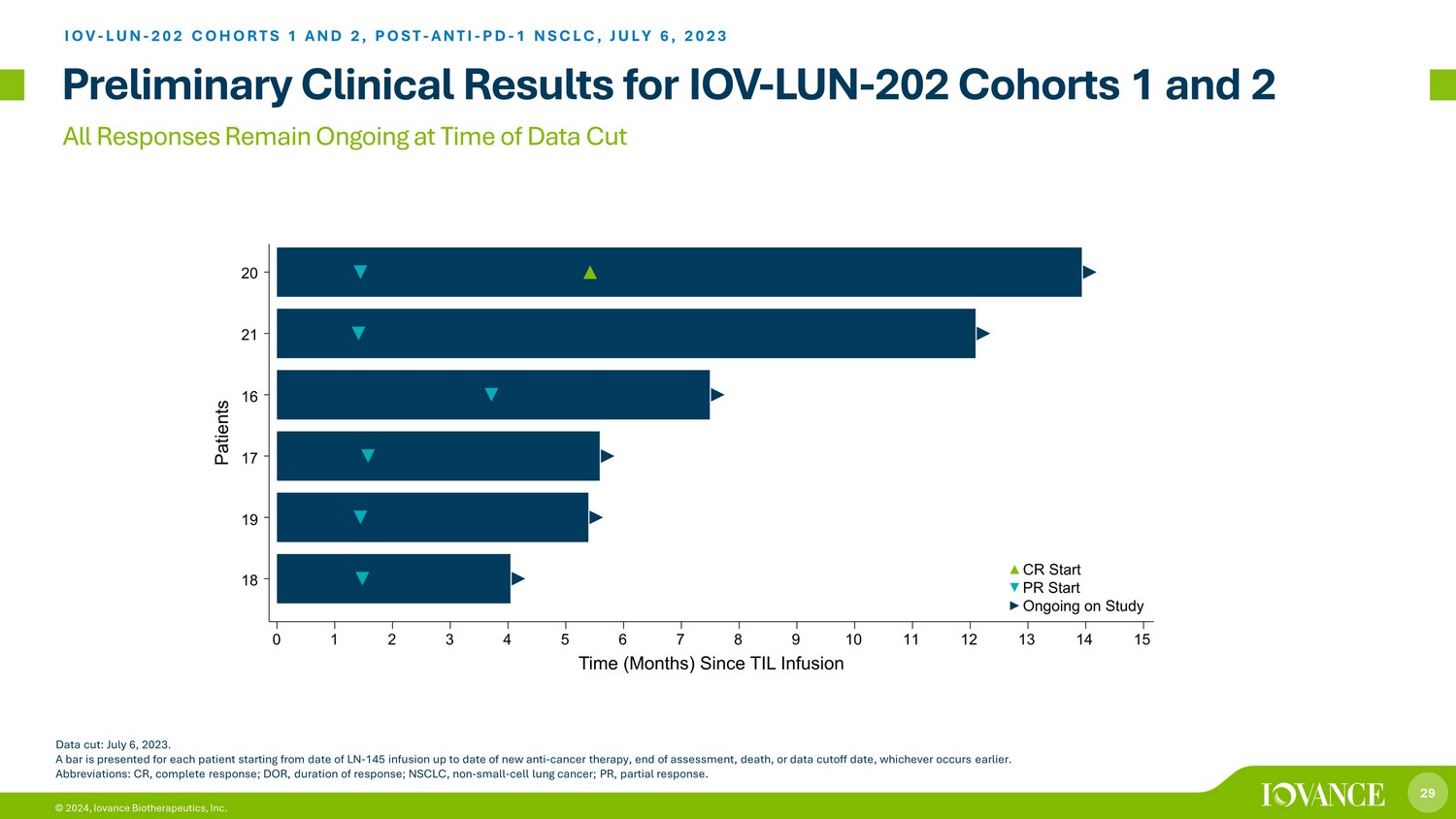
29 © 2024、Iovance Biotherapeutics, Inc. 2023年7月6日のデータカット時点では、すべての回答は継続中です。各患者には、LN-145回の注入日から新しい抗がん療法の日付、評価終了日、死亡日、またはデータ締め切り日のいずれか早い方まで、バーが表示されます。略語:CR、完全奏効、DOR、奏効期間、NSCLC、非小細胞肺がん、PR、部分奏効。IOV-LUN-202コホート1と2、ポスト-抗PD-1 NSCLC、2023年7月6日 IOV-LUN-202コホート1と2についての暫定臨床結果

30 © 2024、Iovance Biotherapeutics, Inc. ICIにおけるTILの概念実証-PDに関係なくナイーブNSCLC-L1ステータス、コホート3A要約 IOV-COM-20 コホート3A NSCLC併用(TIL+ペムブロリズマブ)、WCLC口頭発表(2023年6月26日データカット)コホート3A結果サポート TIL追加最前線のペムブロリズマブ+化学療法併用レジメンへの治療 18.2か月のフォローアップでの臨床活動 1 • ICIナイーブなサブグループでの活動とTPSスコア • EGFR WT病のNSCLC患者における58.3%(12年7月)のORRと3件の継続的な奏効• 以下と一致する安全性Iovance TIL併用研究 • 最前線のEGFR WT病患者を対象とした登録試験デザインの提案をサポートします。スクリーニングペムブロリズマブ投与(単回投与)NMA-LD Cy/Flu Lifileucel/LN-145輸液 IL-2≤6回投与ペムブロリズマブ Q3WまたはQ6W有効性フォローアップ登録/外科的切除評価期間:EOA GMP製造EOAプログレッションまたは新治療薬EOS EOT長期フォローアップまでの0日目 1.シェーンフェルドら。WCLC 2023略語:cy/flu、シタラビン/フルダラビン、EGFR、上皮成長因子受容体、ICI、免疫チェックポイント阻害薬、IL-2、インターロイキン-2、NMA-LD、非骨髄破壊性リンパ枯渇、TPS、腫瘍割合スコア、WT、野生型

31 © 2024、Iovance Biotherapeutics, Inc.のICIナイーブサブグループにわたるTIL活性とTPSスコア(EGFR WT病変の患者における58.3%のORRを含む)、ベストレスポンスと標的病変の変化率 SOD IOV-COM-202コホート3A NSCLC併用(TIL+ペムブロリズマブ)、WCLC口頭発表(2023年6月26日データカット)1。KEYTRUDA USPI; OPDIVO USPI略語:CR、完全奏効、DCR、疾病制御率、EGFR、上皮成長因子受容体、ICI、免疫チェックポイント阻害薬、NE、非評価可能、NSCLC、非小細胞肺がん、ORR、客観的奏効率、PD、進行性疾患、PR、部分奏効、SD、安定病、SOD、直径の合計、TPS、腫瘍の割合 score、WT、野生型-最良総合反応コホート 3A EGFR WT 患者 (N=12) N/n% (95% CI) ORR 7 58.3 (27.7、84.8) DCR 9 75.0 (42.8、94.5) CR 1 8.3 PR 6 50.0 SD 2 16.7 PD 2 16.7 NE 1 8.3 • コホート3A以前の治療によるORR:• 治療-ナイーブ:80%(4/5)• 化学療法後:42.9%(3/7)•抗PD-1単剤療法ベンチマーク1:•治療-ナイーブ:27%(TPS≥1%); 39-45%(TPS≥50%)•化学療法後:18-20% 60 40 20-40-60-80 3A-03 3A-16 3A-08 3A-15 3A-09 3A-04 3A-02 3A-10 3A-17 3A-13 -100 -80 -60 -40 -20 0 20 40 60 80 100% C h a n g e f r o m B a s e l i n e N=2 N=9 CRPRSDPD 最良総合対応患者 ID 03 16 08 15 09 04 02 10 17 11 13-100--60-40-20 0 20 40 60 80 100% ベースラインからの変更 N=9 N=2 全体的に最高です回答:PD SD または CR
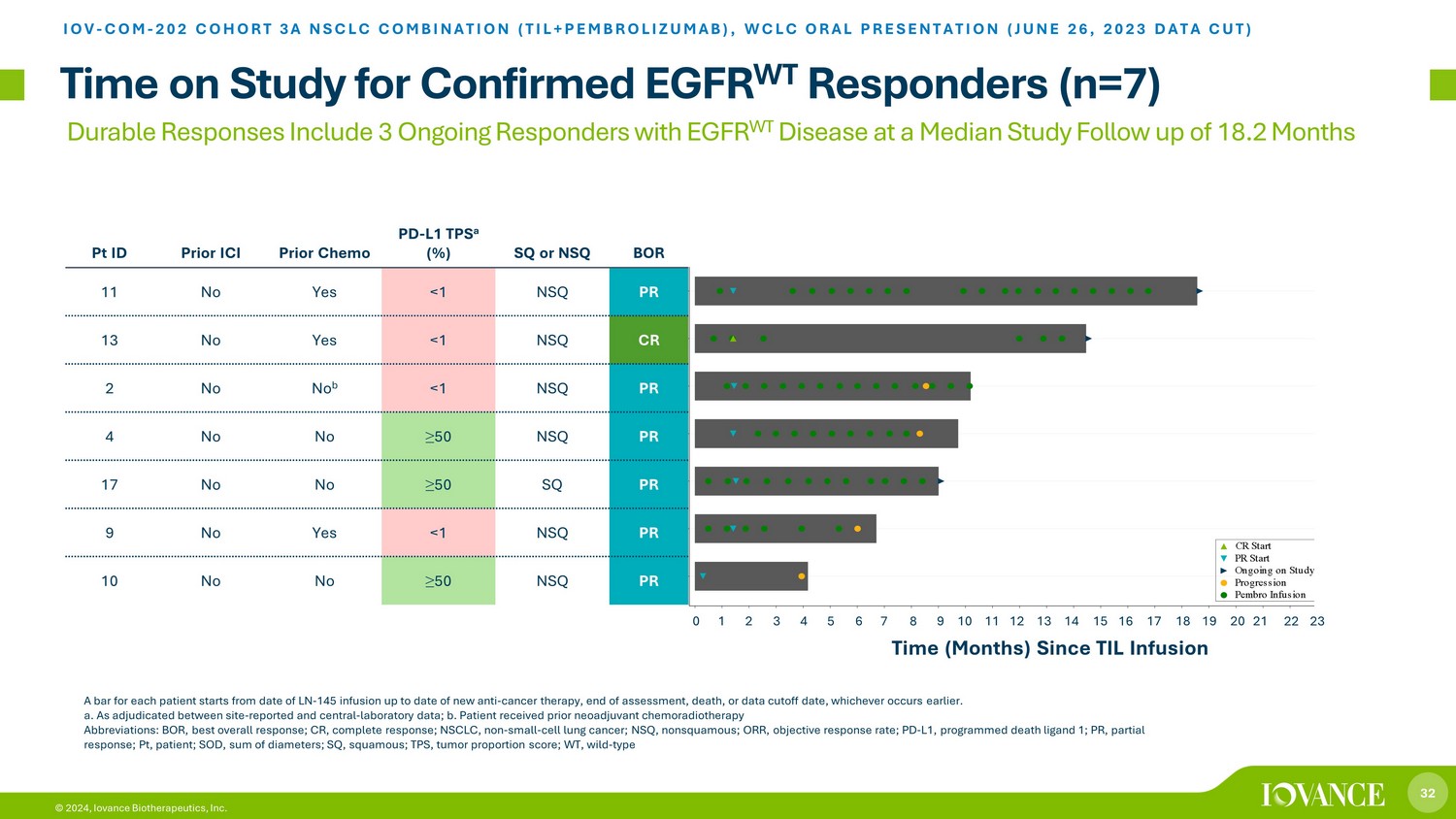
32 © 2024、Iovance Biotherapeutics, Inc. 確認されたEGFR WT奏効者 (n=7) の試験時間 IOV-COM-202 コホート3A NSCLCの併用 (TIL+ペムブロリズマブ)、WCLC口頭発表 (2023年6月26日データカット) 持続的な反応には、中央値研究で継続的に奏効したEGFR WT疾患患者3人が含まれます。1バーあたり18.2か月のフォローアップです。各患者について、LN-145回の注入日から新しい抗がん療法の最新、評価終了、死亡、またはdデータの締め切り日のいずれか早い方の日付まで。a. 施設報告データと中央検査データのどちらかを判断したもの。b.以前にネオアジュバント化学放射線療法を受けた患者の略語:BOR、ベストオーバーレスポンス、CR、完全奏効、NSCLC、非小細胞肺がん、NSQ、非扁平上皮性、ORR、客観的奏効率、PD-L1、プログラムデスリガンド1、PR、部分奏効、Pt、患者、SOD、直径の合計、SQ、スコーマ TPS、腫瘍割合スコア; WT、野生型-3A-10 3A-09 3A-17 3A-04 3A-02 3A-11 S u b j e c t s 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 TIL注入ペンブロ点滴の進行研究から進行中 PR 開始 CRスタートポイント ID 前 ICI 事前化学療法-L1 TPS a (%) SQ または NSQ BOR 11 いいえはい
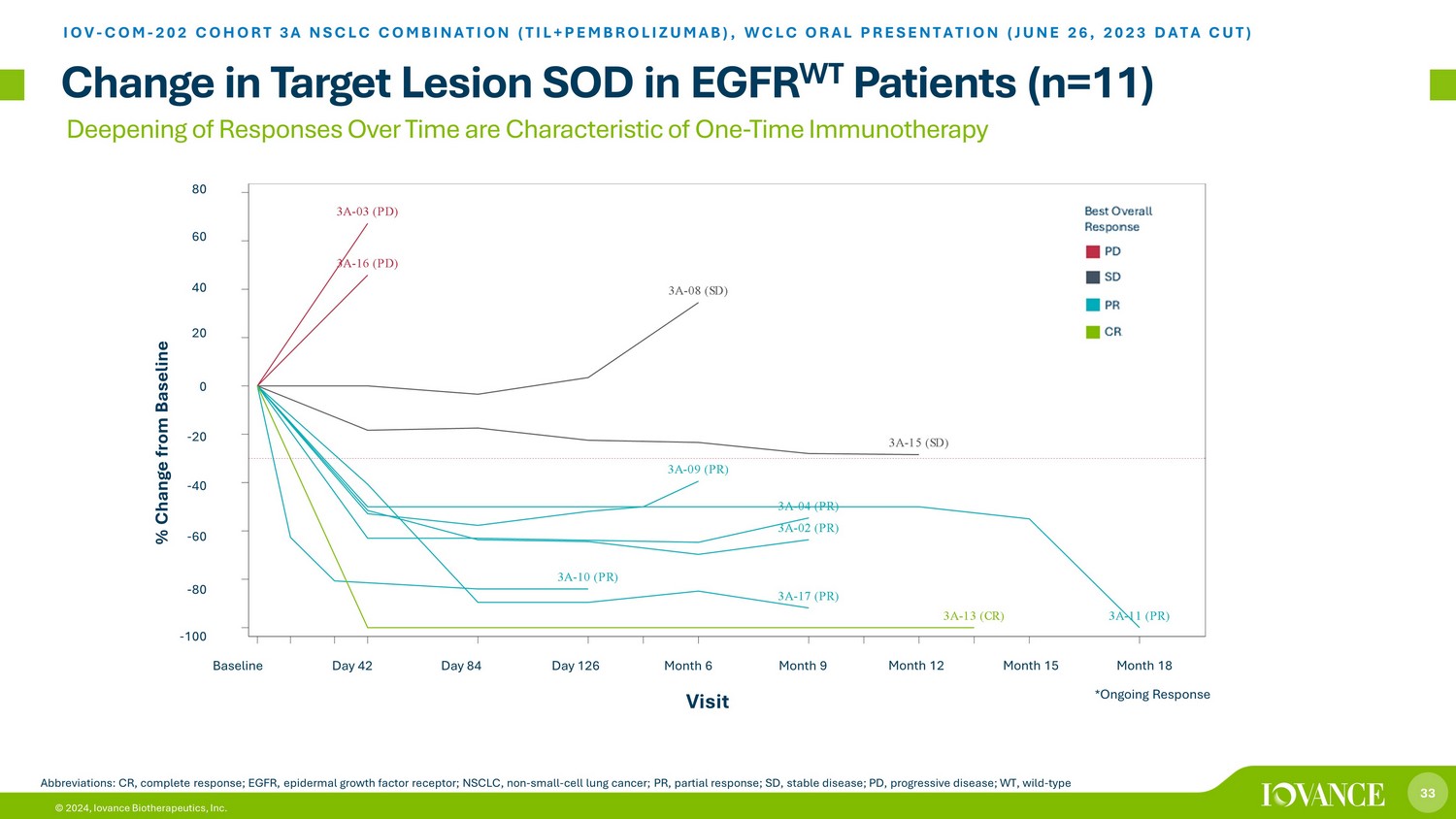
33 © 2024、Iovance Biotherapeutics, Inc. 時間の経過に伴う反応の深化は、EGFR WT患者(n=11)の標的病変SODにおける1回限りの免疫療法変化の特徴です IOV-COM-202 コホート3A NSCLC併用(TIL+ペムブロリズマブ)、WCLC口頭発表(2023年6月26日データカット)略語:CR、完全奏効; EGFR、上皮成長因子受容体、NSCLC、非小細胞肺がん、PR、部分難発、SD、安定疾患、PD、進行性疾患、WT、野生型ベスト総合反応 PD SD PR CR 訪問60 40-100-80-60-40-20 0 4060 80 ベースラインからの変化率 42 日 84 日 126 月 6 月 9 月 12 月 15 月 18 日 3 (PD) パート 8 (SD) パート 15 (SD) ポイント 9 (PR) ポイント 10 (PR) ポイント 17 (PR*) パート 13 (CR*) ポイント 11 (PR*) ポイント 11 (PR*) ポイント 4 (PR) *継続的な回答 Pt 16 (PD) Pt 2 (PR) 3A-16 (PR) 3A--16 (PR) 03 (PD) 3A-15 (SD) 3A-08 (SD) 3A-04 (PR) 3A-11 (PR) 3A-17 (PR) 3A-02 (PR) 3A-10 (PR) 3A-09 (PR) 3A-13 (CR) ベースライン日 42日 84日 126 月 6 月 9 月 12 月 15 か月 18 訪問 -100 -80 -60 -40 -20 40 60 80 p e r c e n t C h a n g e CRPRSDPD ベストレスポンス
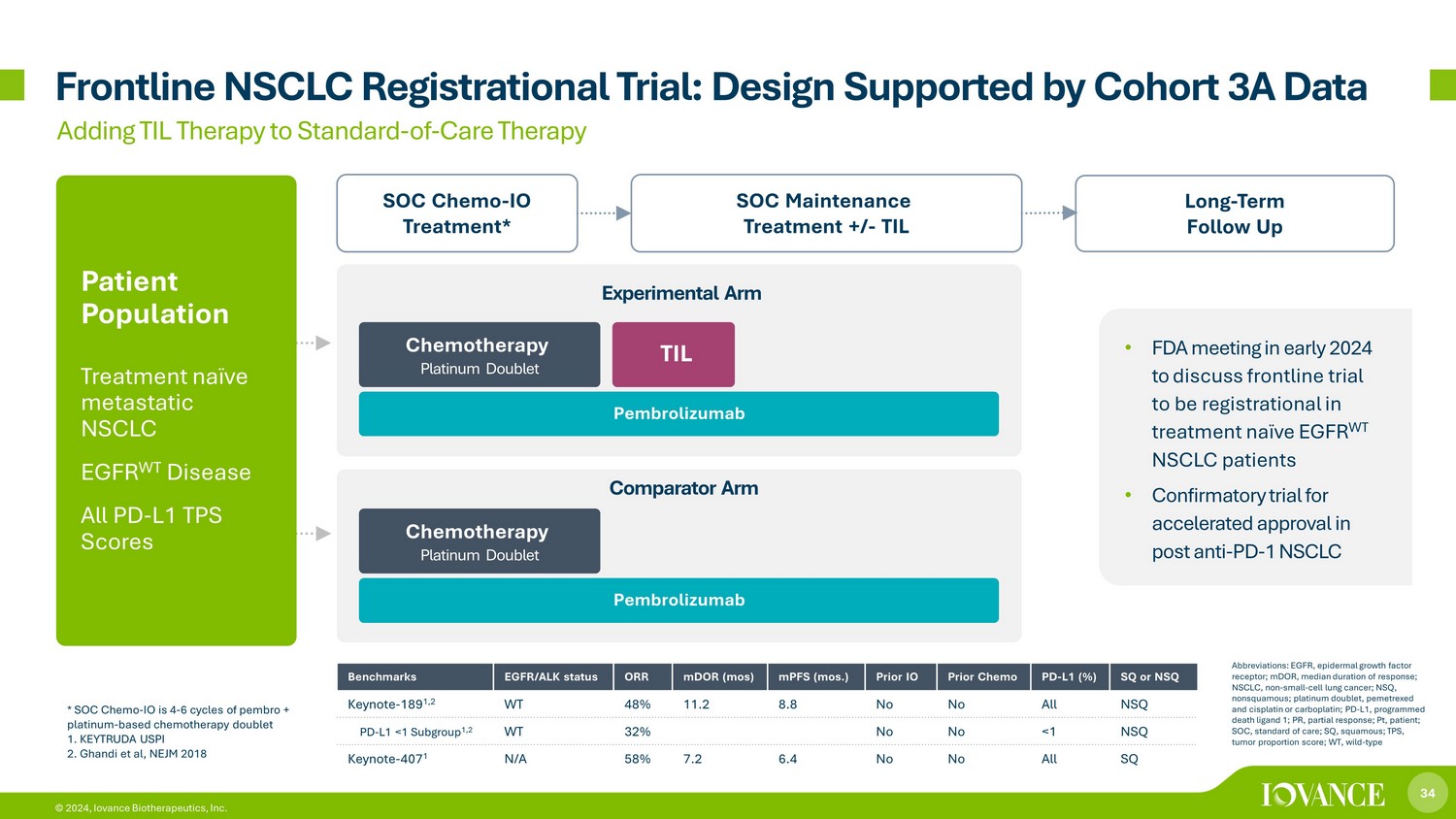
34 © 2024、Iovance Biotherapeutics, Inc. 最前線のNSCLC登録試験:コホート3Aデータに裏付けられた設計長期フォローアップ SOC維持療法 +/-TIL SOC維持治療 +/-TIL SOC化学療法-IO治療* 標準治療へのTIL療法の追加 TIL患者集団治療ナイーブ転移性NSCLC EGFR WT疾患全PD-L1 TPSスコア化学療法プラチナダブレット* SOCケモ-IOは、ペンブロ+プラチナベースの化学療法ダブレット1の4〜6サイクルです。キートルーダ・ウスピー 2.ガンディら、NEJM 2018ベンチマーク EGFR/ALKステータス、またはMDまたは(ほとんど)MPF(ほとんど)以前のIO 事前化学療法医-L1 (%) SQまたはNSQ基調講演-189 1,2 WT 48% 11.2 8.8 いいえすべてNSQ PD-L1
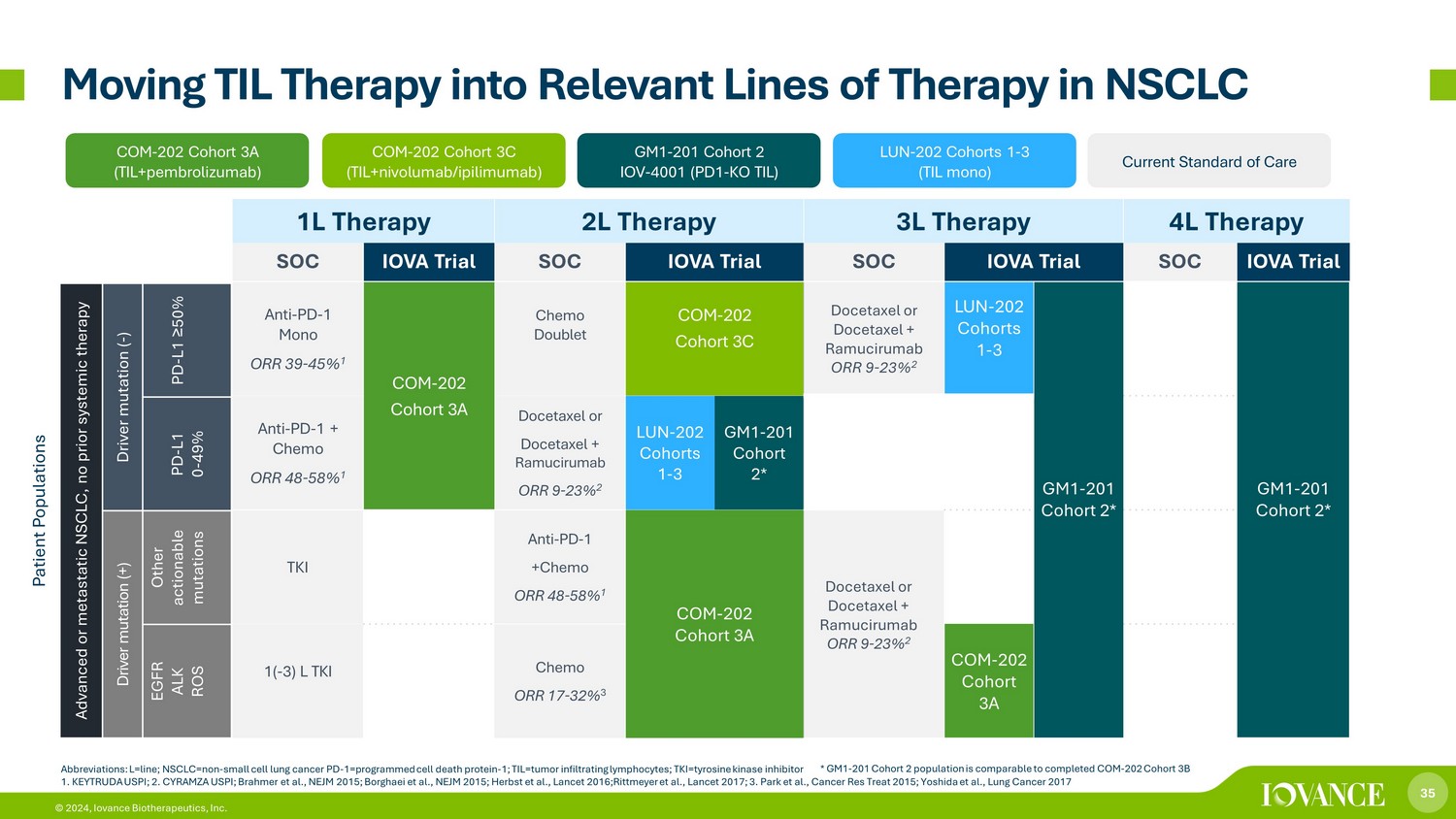
35 © 2024、アイオバンス・バイオセラピューティクス社 1L療法 2L療法 4L療法 SOC IOVA試験 SOC IOVA試験 SOC IOVA試験 SOC IOVA試験 SOC IOVA試験抗PD-1 モノORR 39-45% 1 COM-202 コホート 3A ケモダブレットCOM-20 コホート 3C ドセタキセルまたはドセタキセル + ラムシルシルです CORR 9-23% 2 LUN-202 コホート 1-3 GM1-201 コホート 2* GM1-201 コホート 2* 抗PD-1 + Chemo ORR 48-58% 1 ドセタキセルまたはドセタキセル + ラムシルマブ ORR 9-23% 2 LUN-202 コホート 1-3 GM1-201 コホート 2* TKI 抗PD-1 +化学療法 48-58% 1 COM-202 コホート 3A ドセタキセルまたはドセタキセル +ラムシルマブ ORR 9-23% 2 (1-3) TKI 化学療法 ORR 17-32% 3 COM-20 2コホート3A* GM1-201コホート2の集団は、完了したCOMと同等です-202 コホート3B TIL療法をNSCLC COMの関連する治療分野に移行-202 コホート3A (TIL+ペムブロリズマブ) LUN-202 コホート 1-3 (TIL モノラル) COM-202 コホート 3C (TIL+ ニボルマブ/i ピリムマブ) GM1-201 コホート2 IOV-4001 (PD1-KO TIL) 現在の標準治療標準治療では、進行性または転移性NSCLCの患者集団、以前に全身療法を受けていないドライバー変異 (-) PD-L1 ≥ 50% PD-L1 0-49% ドライバーの突然変異(+)その他実用的な突然変異 EGFR ALK ROS 略語:L=line; NSCLC=non-小細胞肺がん PD-1=プログラムされた細胞死タンパク質-1; TIL=腫瘍浸潤リンパ球; TKI=チロシンキナーゼ阻害剤 1.キートルーダ・ウスピー; 2.CYRAMZA U S PI; Brahmerら、NEJM 2015; Borghaeiら、NEJM 2015; Herbstら、Lancet 2016; Rittmeyerら、Lancet 2017; 3.パークら、キャンサー・レス・トリート2015; 吉田ら、肺がん2017

36 © 2024、イオバンス・バイオセラピューティクス社 36 発売準備

37 © 2024、Iovance Biotherapeutics, Inc.i CTC は、大量のTIL製造と柔軟性を実現するために設計されています • コアスイート:TIL商業製造 • フレキシブルスイート:臨床供給、パイプラインの拡張、高度な製造 • 統合された品質管理、サプライチェーン、ITシステム • 100人以上の従業員、立ち上げ時およびそれ以降も人員を増やしています • iCTCは外部のCDMO製造能力を補助 37 © 2024、Iovance Biotherapeutics, Inc.
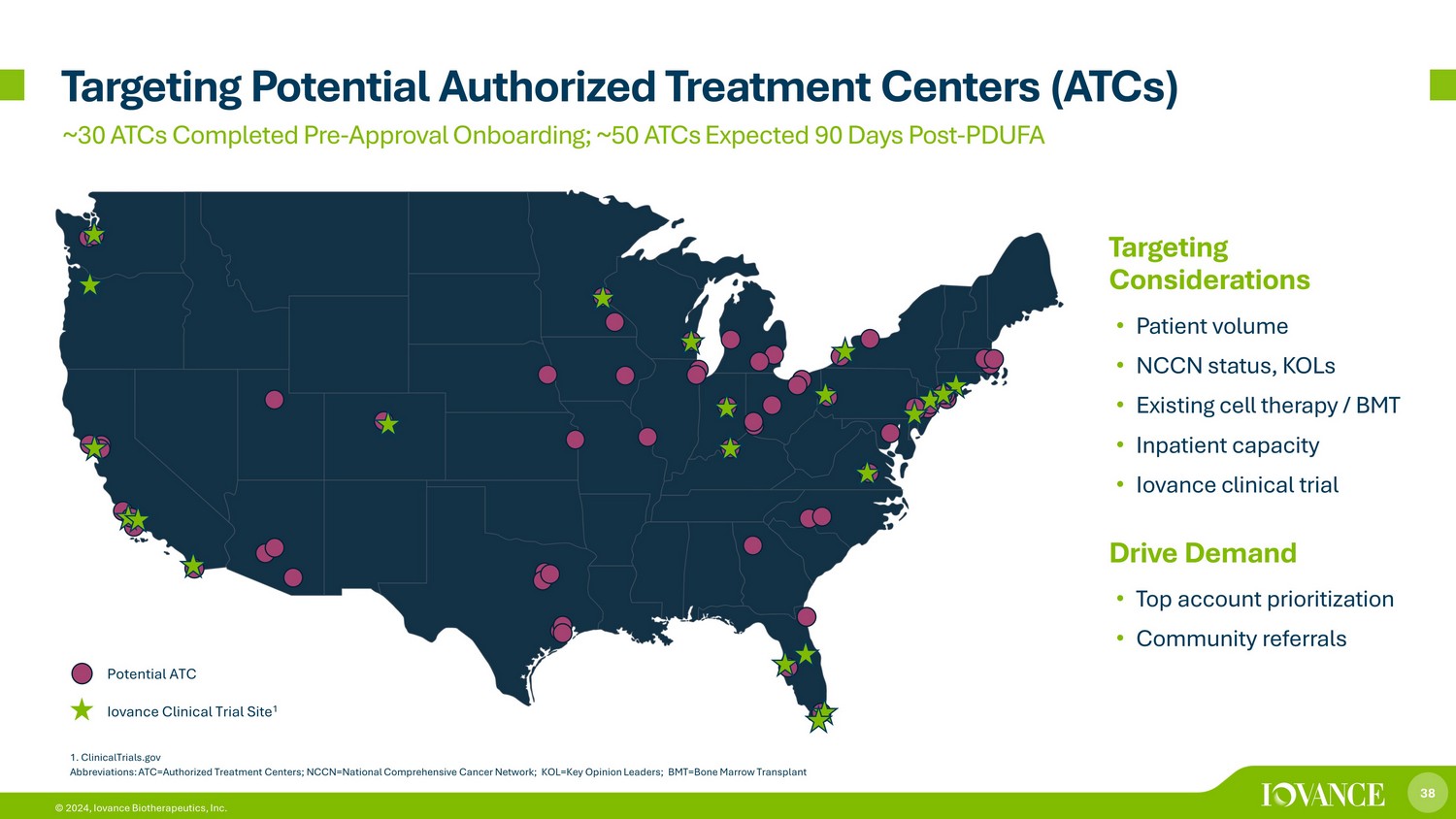
38 © 2024、Iovance Biotherapeutics社は潜在的な認定治療センター(ATC)を対象としています。潜在的なATC Iovance臨床試験サイト 1 1.ClinicalTrials.gov 略語:ATC=認定治療センター; NCCN=全国総合がんネットワーク; KOL=主要オピニオンリーダー; BMT=骨髄移植ターゲティングに関する考慮事項 • 患者数 • NCCNステータス、KOL • 既存の細胞療法/BMT • 入院患者のキャパシティ • Iovance臨床試験の需要促進 • アカウントの最優先 • コミュニティ紹介 ~30件のATCが事前承認済みオンボーディング。約50台のATCが90日後に予定されています-PDUFA
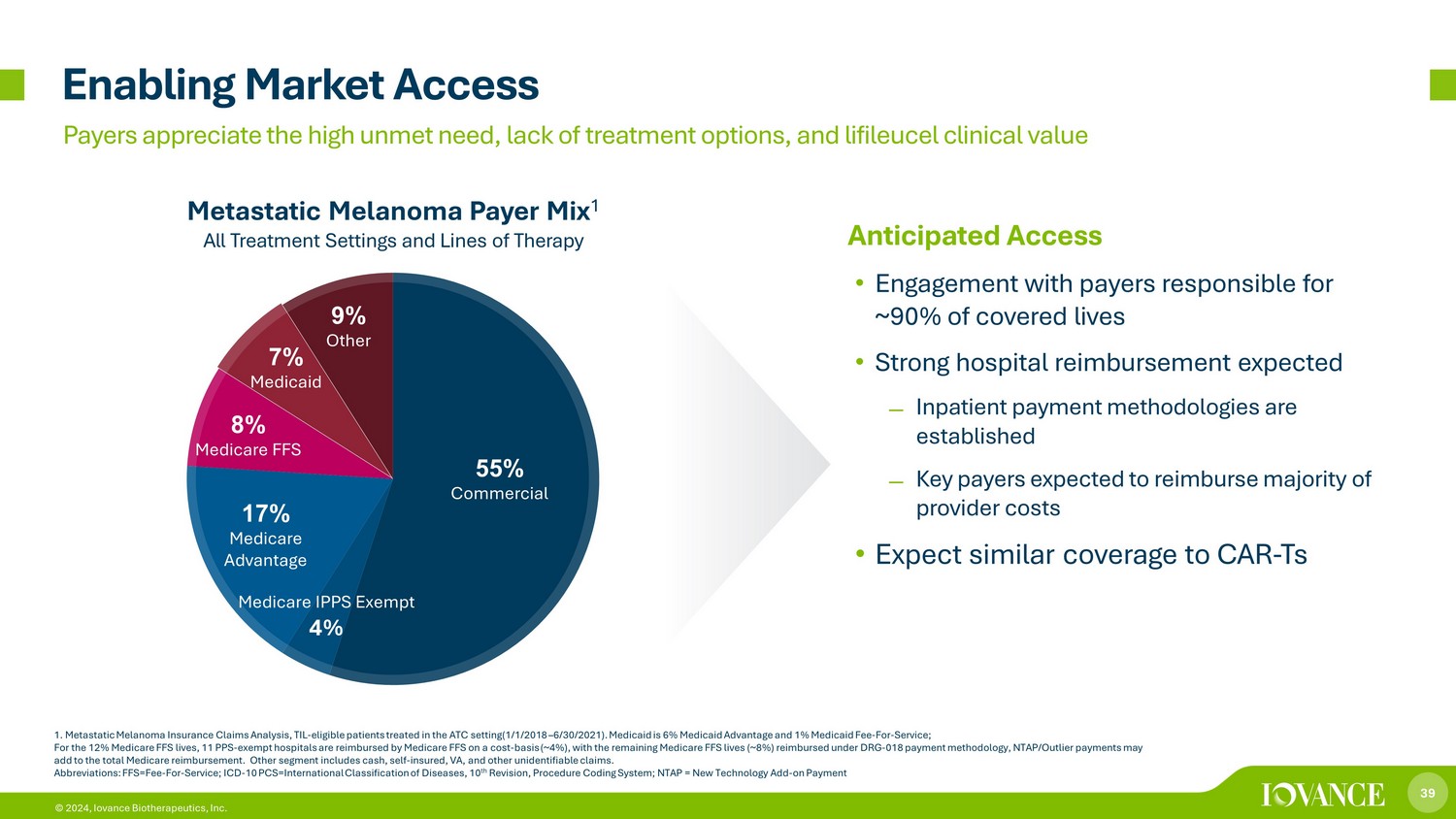
39 © 2024、Iovance Biotherapeutics, Inc. 55% 商用メディケア IPPS 免除 4% 17% メディケアアドバンテージ 8% メディケア FFS 7% メディケイド 9% その他の市場アクセスを可能にする転移性黒色腫支払者ミックス 1 すべての治療設定と治療ライン 1.転移性黒色腫保険金請求分析、TIL-ATC設定で治療を受けた適格患者(2018年1月1日〜2021年6月30日)。メディケイドは 6% のメディケイド・アドバンテージと 1% のメディケイド・フォー・サービス料です。12% のメディケアFFS生命の場合、11のPPS(免除病院)が費用ベース(~ 4%)でメディケアFFSから払い戻され、残りのメディケアFFS生命(約8%)はDRG-018支払い方法で払い戻されます。NTAP/外れ値による支払いは、メディケア償還総額に加算される場合がありますセグメント。その他のセグメントには、現金、自己保険、VA、およびその他の身元不明の請求が含まれます。略語:FFS=Fe-For-Service; ICD-10PCS=国際疾病分類、第10改訂、手続きコーディングシステム、NTAP = 新技術追加支払い支払者は、満たされていない高いニーズ、治療オプションの欠如、およびライフルーセルの臨床的価値を高く評価しています。期待されるアクセス •対象生命の約90%を担当する支払者との関わり •強力な病院への償還が期待されます入院患者の支払い方法すでに確立されている、主要な支払者はプロバイダーの費用の大部分を払い戻すと予想されている • CAR-Tsと同様の補償範囲を期待している
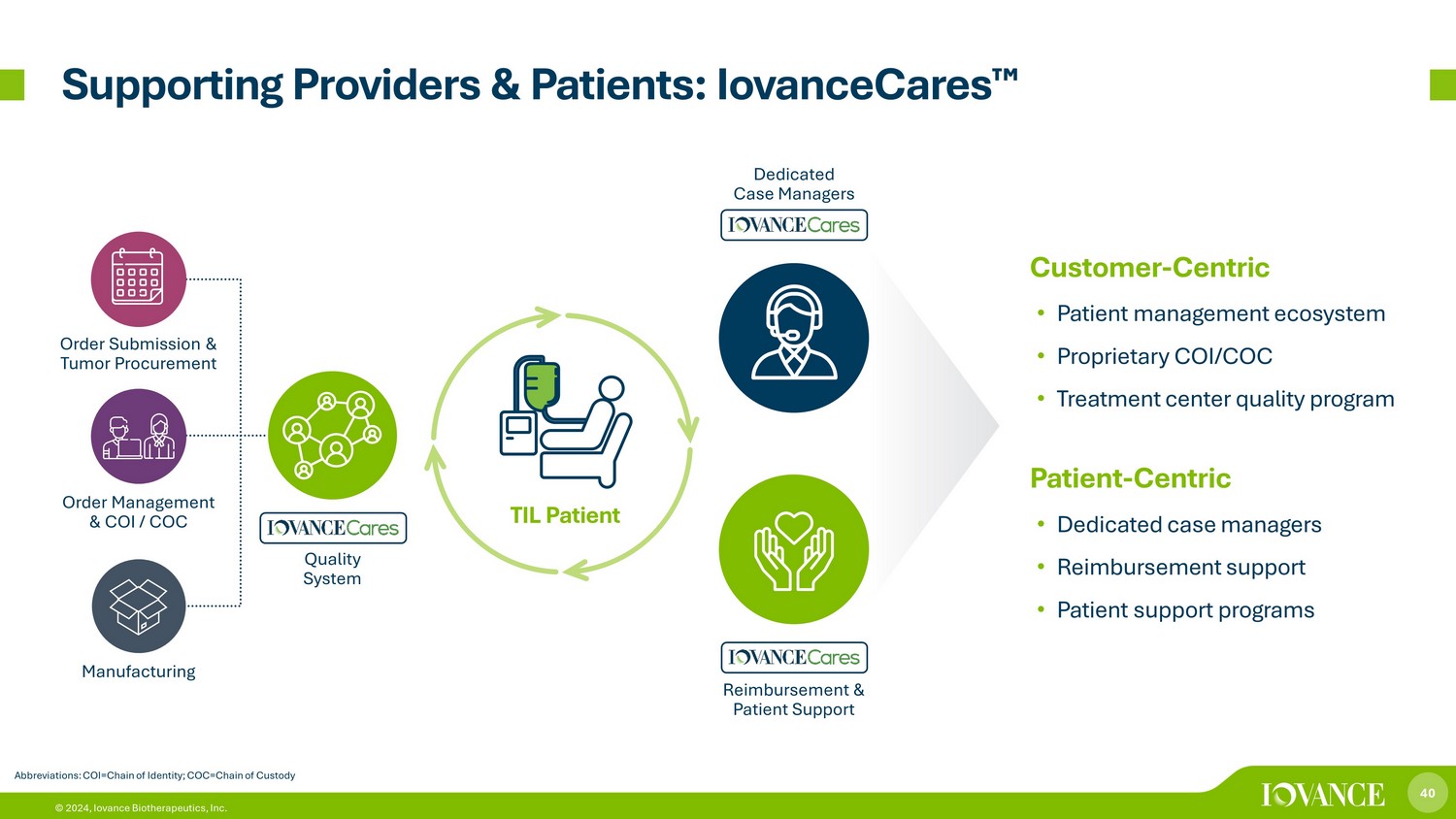
40 © 2024、Iovance Biotherapeutics, Inc. サポートプロバイダーと患者:iovanceCares™ 略語:COI=チェーン・オブ・アイデンティティ; COC=チェーン・オブ・カスタマー-Centric • 患者管理エコシステム • 独自のCOI/COC • 治療センター品質プログラム Patient-Centric • 専任ケースマネージャー • 償還サポート • 患者サポートプログラム • 品質システム • 専任ケースマネージャー • 償還サポート • 患者サポートプログラム品質システム専任ケースマネージャー償還& 患者サポート注文の提出と腫瘍調達注文の管理、COI/COCの製造 TIL 患者
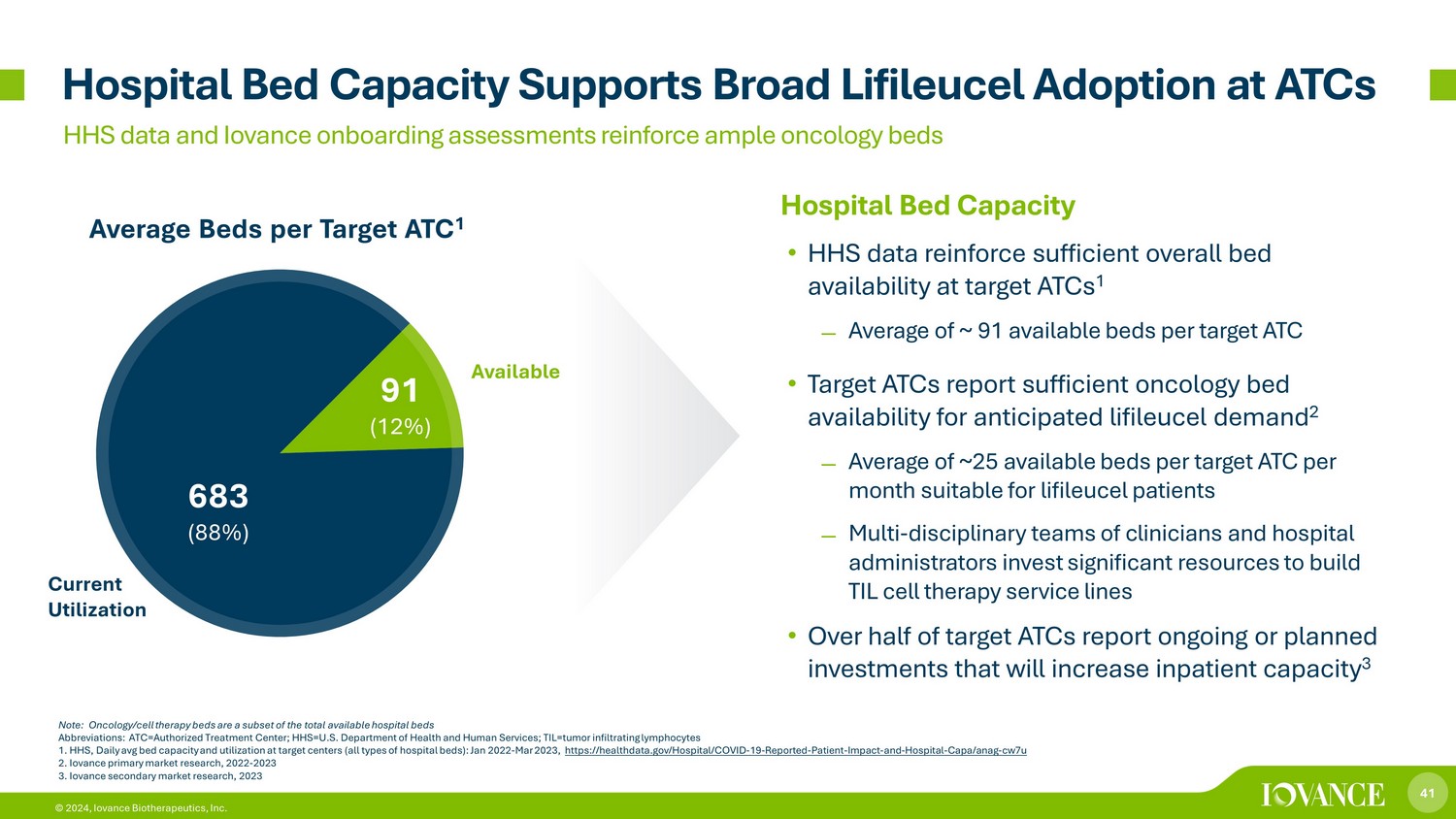
41 © 2024、Iovance Biotherapeutics, Inc.の病院のベッド容量 • HHSのデータから、対象ATCの総ベッド数は十分であることが裏付けられています。1 ターゲットATCあたり平均約91台の利用可能なベッド数• ターゲットATCは、予想されるライフィルセルの需要に対応できる十分な腫瘍病床の可用性を報告しています 2 ターゲットATCあたり月平均約25床のリフィルルーセル患者に適した利用可能なベッド数は月平均約25です病院管理者はTIL細胞治療サービスラインの構築に多大なリソースを費やしています • 対象ATCの半数以上が、継続的または計画的であると報告しています入院患者の収容能力を高める投資ターゲットあたり平均ベッド数ATCあたり3床 ATC 1病院のベッド容量はATCでの幅広いLifileucelの採用をサポートしますHHSデータとIovanceのオンボーディング評価により、十分なオンコロジーベッドが確認されています。注意:腫瘍/細胞療法用ベッドは、利用可能な全病床のサブセットです。略語:ATC=認定治療センター; HHS=米国保健社会福祉省; TIL=腫瘍浸潤リンパ球 1.HHS、対象センターでの1日の平均ベッド容量と利用率(すべてのタイプの病院用ベッド):2022年1月〜2023年3月、https://healthdata.gov/Hospital/COVID -19-報告-患者-影響-および-病院-CAPA/ANAG-cw7u 2.アイオヴァンスのプライマリーマーケットリサーチ、2022年から2023年 3.Iovanceの流通市場調査、2023 683(88%)91(12%)現在の稼働率が利用可能です

42 © 2024、アイオヴァンス・バイオセラピューティクス社 42 その他のTIL療法臨床プログラムのハイライト

43 © 2024、Iovance Biotherapeutics, Inc. フェーズ 1/2 オープン-ラベルファーストインヒューマンスタディ:IOV-GM1-201 エンドポイント • フェーズ 1: 安全性 • フェーズ 2: 治験責任医師が評価したRECIST v1.1に基づく客観的奏効率 (ORR) • 副次的評価項目には、完全奏効 (CR) 率、奏効期間 (DOR)、疾病コントロール率 (DCR)、進行などがあります。自由生存(PFS)、全生存(OS)、安全性と忍容性、フィージビリティスタディの最新情報 • 3Q22:初めて治療した患者さんコホート1:切除不能または転移性黒色腫ポスト-抗PD-1/L1、BRAF/MEK後BRAF変異患者の阻害薬コホート2:III期またはIV期のNSCLC抗PD-1/L1後または標的療法後、化学療法または抗PD-1/L1の患者集団切除不能または転移性黒色腫または進行性NSCLC N=53の成人遺伝子組み換え、PD-1不活化TIL療法、以前に治療を受けた転移性黒色腫におけるIOV-4001 とNSCLC(NCT05361174)次世代TILセラピー IOV-4001 NSCLC=非小細胞肺がん

44 © 2024、イオバンス・バイオセラピューティクス社子宮頸がんの潜在市場 1.2020年世界のがん統計:GLOBOCANによる185か国の36のがんの世界的な発生率と死亡率の推定、カリフォルニアがんJクリニック、2021年5月; 2.国立がん研究所のサーベイランス、疫学および最終結果(SEER)プログラム。2023年の推定値。https://seer.cancer.gov 2023年5月アクセス; 3.テワリら、ネム 2014; 4.コロンボら、ネム 2021; 5.キートルーダ米国のIP; 6.コールマンら、ランセット・オンコール 2021; 7.マクラクランら、クリン・オンコール 2017; 8.Millerら、Gynecol Oncol 2008新規症例 WW 毎年米国で1件604万4,000件の診断 WW 毎年2件342万4,000件の死亡 WW 1件米国での死亡者数毎年2件利用可能な治療法 ORR DOR最前線:併用化学療法+ベバシズマブ 3 48% 未報告ペムブロリズマブ + 化学療法+ベバシズマブ(PD-L1+患者)4 68.1% 18か月セカンドライン/サードライン:ペムブロリズマブポスト-化学療法(PD-L1+患者)5 14.3%チソツマブベドチンに届かなかった-tftvポスト-化学療法 6 24% 8.3か月セカンドライン/サードラインでの化学療法 7,8 3.4% — 15% 4.4か月 8特定のアンメットへの対処化学療法と抗PD療法後の子宮頸がんの必要性-1
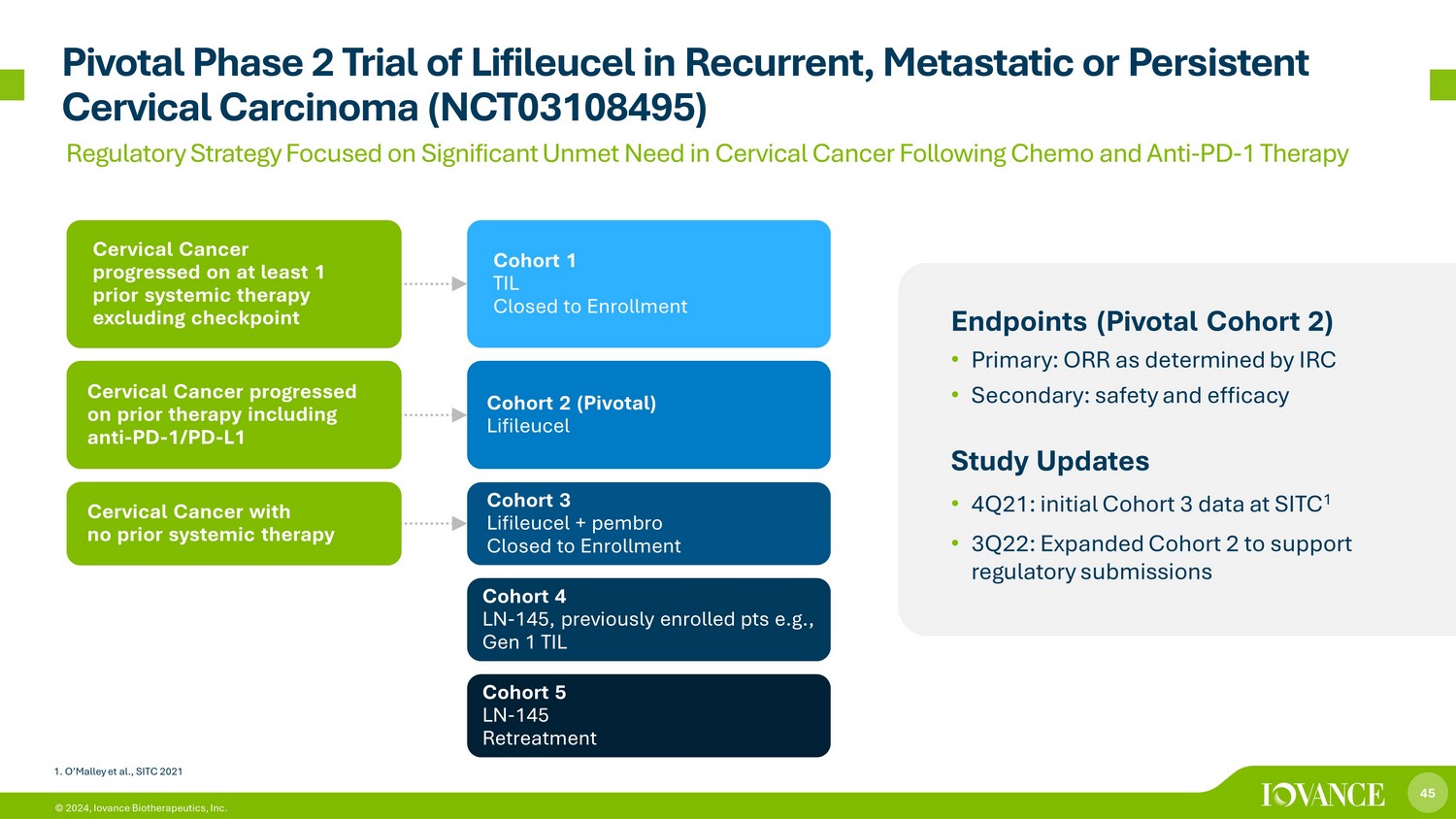
45 © 2024、Iovance Biotherapeutics, Inc. 再発、転移性、または持続性の子宮頸がんを対象としたリフィルセルのピボタル第2相試験(NCT03108495)エンドポイント(ピボタルコホート2)• 原発:IRCが決定したORR • 二次:安全性と有効性に関する研究の最新情報 • 4Q21:SITC 1の初期コホート3データ • 3Q22:規制当局への提出をサポートするためにコホート2を拡張しました。コホート1 TILは登録を終了しました。コホート2(ピボタル)ライフルーセルコホート3 Lifileucel+pembro登録受付終了コホート4 LN-145です。以前に登録したポイント(例:第1世代 TILコホート5 LN-145再治療)子宮頸がんは、チェックポイントを除く少なくとも1回の全身療法で進行しました。子宮頸がんは、抗PD-1/PD-L1子宮頸がんを含む以前の治療で進行し、全身療法は受けていませんでした 1.O'Malleyら、化学療法と抗PD-1療法後の子宮頸がんにおける満たされていない重大なニーズに焦点を当てたSITC 2021規制戦略

46 © 2024、アイオヴァンス・バイオセラピューティクス社 46 次世代研究プログラム
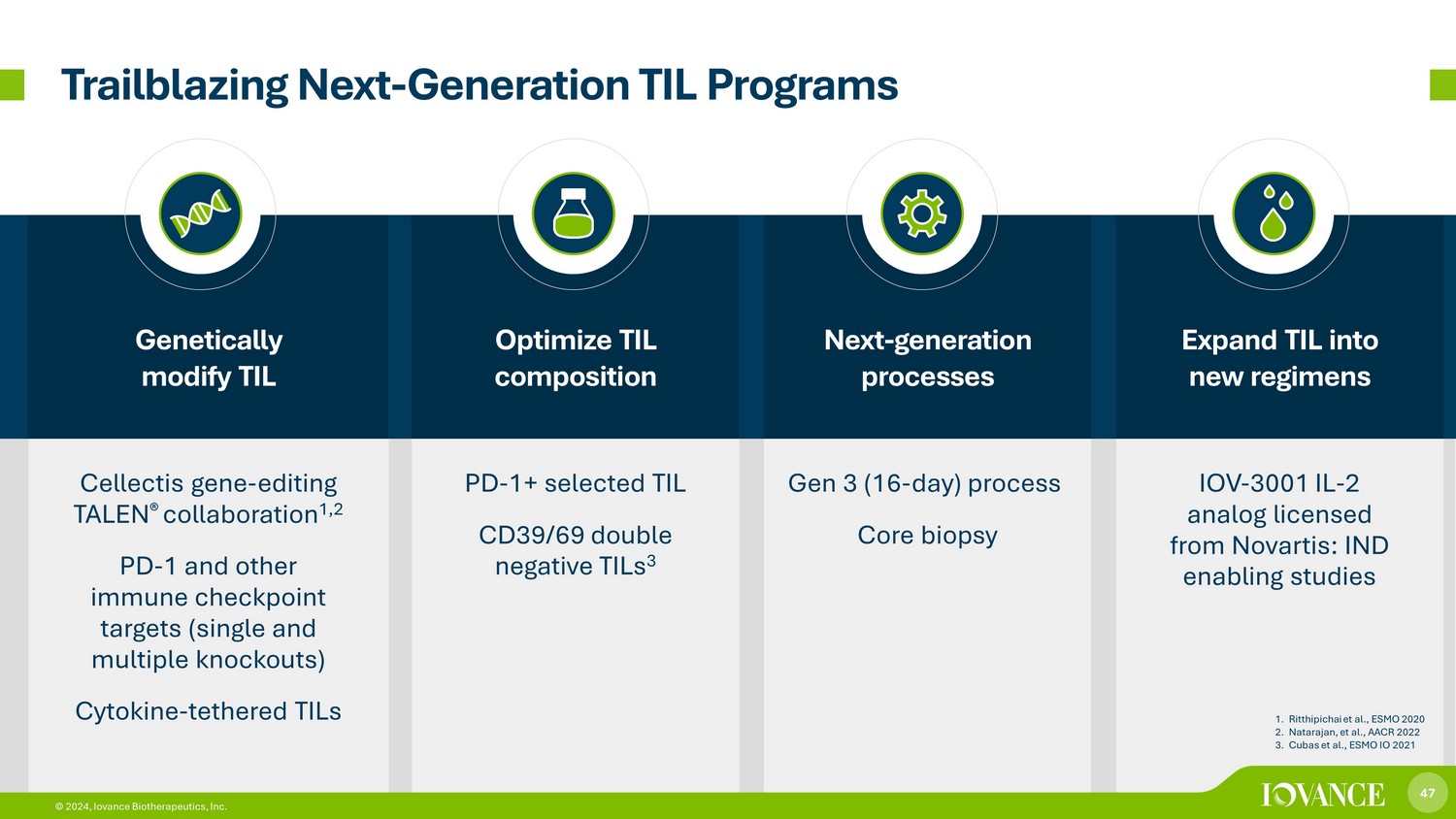
47 © 2024、Iovance Biotherapeutics, Inc. TILの遺伝子組み換え TIL組成の最適化次世代プロセス Cellectis遺伝子の編集-TALEN® コラボレーション 1,2 PD-1およびその他の免疫チェックポイントターゲット(シングルノックアウトおよびマルチノックアウト)サイトカイン-テザーTIL PD-1+選択TIL CD39/69 ダブルnネガティブTIL 3 Gen 3(16日)プロセス:コア生検 IOV-3001 IL-2アナログ、ノバルティスからライセンスを受けています。INDにより、次世代のTILプログラムの先駆的な研究が可能になりました。1.リッティピチャイら、ESMO 2020 2.ナタラジャンら、AACR 2022 3.キューバスら、ESMO IO 2021 47 © 2024、イオバンス・バイオセラピューティクス株式会社

48 © 2024、イオバンス・バイオセラピューティクス株式会社 48社の概要とマイルストーン

49 © 2024、Iovance Biotherapeutics, Inc. 2023年9月30日 (百万単位) 現金、現金同等物、投資、制限付現金 427.8ドル 1 発行済普通株式 255.8 発行済優先株式 2.9 2 発行済ストックオプションおよび制限付株式ユニット 23.1 1.2023年9月30日現在の6,640万ドルの制限付現金を含みます。2.優先株は転換ベースで表示されます。まあ、TILの商業化を追求して資本化キャッシュランウェイは2025年まで十分です* * 2024年にライフルーセルとプロロイキン® から得られる2024年の予想収益を含みます
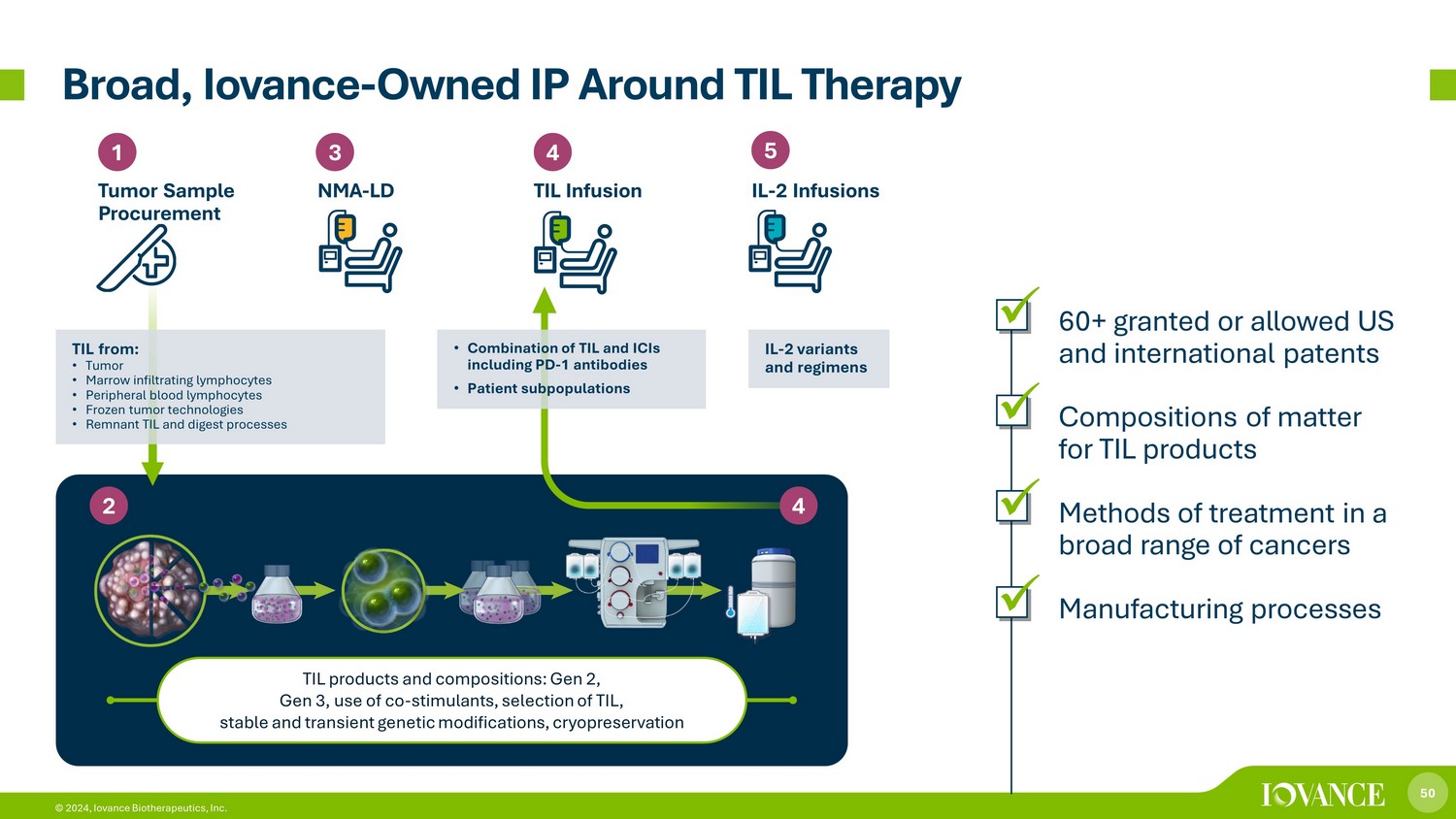
50 © 2024、Iovance Biotherapeutics, Inc. Broad/TILセラピーTIL製品および組成に関する知的財産権:第2世代、第3世代、共刺激剤の使用、TILの選択、安定かつ一過性の遺伝子組み換え、凍結保存 1 腫瘍サンプルの調達 3 4 NMA-LD TIL注入 5 IL-2 輸液 4 2 TIL から:• 腫瘍 • 骨髄浸潤リンパ球から細胞 • 末梢血リンパ球 • 凍結腫瘍技術 • レムナントTILと消化プロセス • TILとPDを含むICIの組み合わせ-1抗体 • 患者亜集団 IL-2バリアントとレジメン x60件以上の米国および国際特許 x TIL製品の物質組成 x 幅広いがんの治療法 x 製造プロセス

51 © 2024、Iovance Biotherapeutics, Inc. の企業ハイライト未だ満たされていないニーズの高いがんの可能性が高い中での大規模な市場機会固形腫瘍の承認商業的成功のための効率的でスケーラブルな独自の製造施設インフラストラクチャ • ICI後の固形腫瘍に最初に重点を置いた • 併用療法への拡大、初期の治療ラインと遺伝子組み換えへの拡大 • メラノーマ、NSCLC、セラピーにおける重要な後期臨床試験がん • 遺伝子組み換えTILの人体初試験PD-1種不活化 • BLAが進行性黒色腫におけるリフィルルーセルを優先審査とRMATで申請 • TILVANCE-301件のFTDによる第3相最前線の進行性黒色腫確認試験 • NSCLCと子宮頸がん(BTD)における明確な登録戦略 • 自社製造におけるアイオバンス細胞治療センター(i CTC)• 委託製造業者による生産能力の増強 • 22日間迅速第2世代成功率が90%以上の製造業 • 700人以上の患者をIovance独自のプロセスで治療 • 完全に統合された企業 • 経験豊富なクロスファンクショナル細胞療法チーム • パートナーシップ米国の主要がんセンターと共同でTILサービスライン機能を開発しています • iovanceCares独自のプラットフォーム • Proleukin® 統合 51 © 2024、Iovance Biotherapeutics, Inc. 略語:BLA、生物製剤ライセンス申請、BTD、画期的治療法の指定、FTD、ファストトラック指定、ICI、i mmu neチェックポイント阻害剤、NSCLC、非小細胞肺がん、PD-1、プログラム細胞死タンパク質-1、RMAT、再生医療高度治療、TIL、腫瘍情報浸潤リンパ球。

52 © 2024、Iovance Biotherapeutics, Inc. 規制 □ BLA:2023年第1四半期にリフィルルーセルの抗PD-1進行性黒色腫のローリングBLA申請を完了し、後期サイクル会議が完了し、BLAはPDUFA期に向けて順調に進んでいます □ 例-米国規制当局への提出:米国外の市場での申請の準備を開始パイプライン □ 黒色腫:最前線の進行患者の登録黒色腫第3相確認試験 □ NSCLC:データを報告し、引き続きIOV-LUN-202、IOV-COM-202、IOV-GM1-201試験 □ 子宮頸部:追加の患者を登録しますコホート2 □研究:遺伝子組み換えTIL療法の追加製造を含む、新製品を臨床に向けて開発する □ PLI検査の合格を含む、BLAの承認を支援するGMPの商業準備活動を実施する □ 発売時にライフィルセルを供給:商業的立ち上げに備えてiCTCとCDMOの生産能力を増強する □ 商業的立ち上げの準備をする □ 取引を成立させ、Proleukin® 事業をうまく統合する 2023年のマイルストーン

53 © 2024、Iovance Biotherapeutics, Inc. 規制 □ 進行性黒色腫におけるリフィルセルのFDA承認を取得 (PDUFA日付:2024年2月24日) □ 2024年の前半にEMA規制当局への提出□ 2024年の後半に米国外の追加申請書を提出□ FDAと会ってNSCLCの登録経路/最前線の研究パイプラインについて話し合う □ 臨床および事前の報告をしてください-臨床データ □ IOV-LUN-202 □ 子宮内膜がんの第2相試験を開始 □ 進行性黒色腫、NSCLC、婦人科がんの臨床試験に引き続き患者を登録してください□追加の遺伝子組み換えTIL療法を含む、臨床に向けた新製品の開発、製造 □ 商業上市や臨床試験に対する患者の需要に応える □ 米国および米国外の商業需要を満たすために生産能力をさらに拡大する □ 商業上市開始(24年第1四半期)を実行□ PDUFA日から90日以内に50台のATCに搭載(2024年予定)

54 © 2024、イオバンス・バイオセラピューティクス株式会社 © 2024、イオバンス・バイオセラピューティクス株式会社。ありがとうございます