目次
IGNYTE-ESOの中間分析による独立審査による回答
| ● | SURPASS-3とのフェーズ2トライアル ADP-A2M4CD8 はイメージA4をターゲットにしています。 プラチナ耐性卵巣がん患者を対象とした第2相試験が開始されました。この適応症の治療のためのADP-A2M4CD8のRMAT指定(再生医療先進療法指定)をFDAから受けました。第1相SURPASS試験では、2023年10月に欧州医学腫瘍学会(「ESMO」)で卵巣がんの40%のORR(治療を受けた人の6人分)が報告され、1人が完全奏効、5人が部分奏効しました。第2相試験では、プラチナ耐性卵巣がんを対象に、単剤療法とチェックポイント阻害剤であるニボルマブとの併用の両方でADP-A2M4CD8を評価します。 |
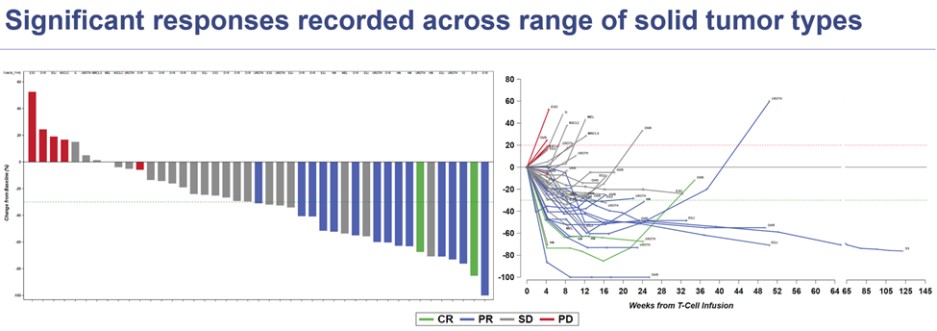
私たちのMAGE-A4を標的としたTCR-T細胞療法(ADP-A2M4CD8)の初期段階の臨床試験が進行中です。
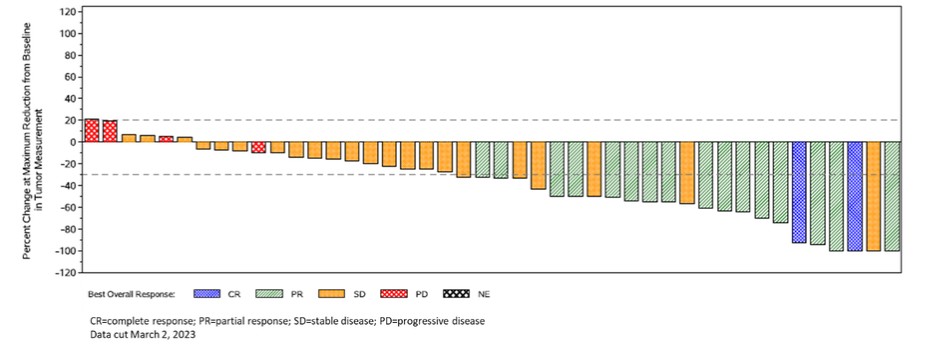
| ● | ADPによる第1相試験を上回ってください-A2M4CD8: ADP-A2M4CD8の第1相試験への登録が進行中です。MAGE-A4抗原が発現する頭頸部がんと尿路上皮がんの患者の治療に焦点を当て、早期に選択治療を行っています。試験の最新データは、2023年10月にESMOで発表されました。すべての適応症で、この試験では全体の回答率が35%と報告されました。卵巣がん、尿路上皮がん、頭頸部がんの26人の患者の奏効率は50%で、以前に3回以下の治療を受けた患者では、奏効率は75%に増加します。この試験には、参加者にADP-A2M4CD8とチェックポイント阻害薬(ニボルマブ)の組み合わせを投与する併用コホートが含まれています。コンビネーションコホートの初期データは、2023年10月にESMOで発表されましたが、現在も進化を続けています。2023年8月14日の時点で、併用コホートの1人の患者の奏効が確認されました。データが遮断された後、確認された回答がもう1つあります。 |
CR=完全奏効、PR=部分奏効、SD=安定性疾患、PD=進行性疾患、ESMO 2023のデータは8月1日に廃止されました4, 2023
27