lyel-2022123100018069522022会計年度誤りP 3 YHttp://Fasb.org/us-GAAP/2022#その他の非運用収入支出Http://Fasb.org/us-GAAP/2022#その他の非運用収入支出Http://Fasb.org/us-GAAP/2022#ResearchAndDevelopmentExpenseHttp://Fasb.org/us-GAAP/2022#ResearchAndDevelopmentExpenseHttp://Fasb.org/us-GAAP/2022#AcruedLiabilitiesAndOtherLiabilityHttp://Fasb.org/us-GAAP/2022#AcruedLiabilitiesAndOtherLiability00018069522022-01-012022-12-3100018069522022-06-30ISO 4217:ドル00018069522023-02-24Xbrli:共有00018069522022-12-3100018069522021-12-31ISO 4217:ドルXbrli:共有00018069522021-01-012021-12-3100018069522020-01-012020-12-3100018069522019-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2019-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2019-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2019-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2019-12-310001806952Lyel:SeriesCConvertiblePferredStockMember2020-01-012020-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2020-01-012020-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2020-01-012020-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2020-01-012020-12-3100018069522020-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001806952アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001806952US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001806952アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001806952アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001806952米国-GAAP:IPOメンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-06-012021-06-300001806952米国-GAAP:IPOメンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-06-300001806952米国-GAAP:転換可能な第一選択株メンバー2021-06-012021-06-300001806952米国-米国公認会計基準:公共株には付加資産資本メンバーが含まれている米国-GAAP:IPOメンバー2021-06-012021-06-300001806952ライル:収入関連に調整して推定メンバーに変更ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-310001806952Lyel:株式保証投資メンバー2022-12-310001806952SRT:最小メンバ数2022-01-012022-12-310001806952SRT:最大メンバ数2022-01-012022-12-310001806952Lyel:SeriesAConvertiblePferredStockMember2020-03-012020-03-310001806952Lyel:SeriesAConvertiblePferredStockMember2020-03-310001806952Lyel:SeriesAConvertiblePferredStockMember2020-01-012020-12-31ライル:細分化市場0001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2018-12-310001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-310001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-01-012021-12-310001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-01-012020-12-310001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembersSRT:最小メンバ数2018-12-31Xbrli:純0001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembersSRT:最大メンバ数2018-12-310001806952Lyel:SeriesAConvertiblePferredStockMember2018-12-310001806952ライル:Tentime Membersレ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952レ:フレッド·ハッジのメンバーLyel:TwentyTimesメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952ライル:30回会員レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952レ:フレッド·ハッジのメンバーライル:40回メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952ライル:50回会員レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952ライル:Tentime Membersレ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2018-12-310001806952レ:フレッド·ハッジのメンバーLyel:TwentyTimesメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2018-12-310001806952ライル:30回会員レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2018-12-310001806952レ:フレッド·ハッジのメンバーライル:40回メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2018-12-310001806952ライル:50回会員レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2018-12-310001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-12-310001806952レ:フレッド·ハッジのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-12-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952ライル:スタンフォードのメンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembersSRT:最大メンバ数2019-12-310001806952ライル:スタンフォードのメンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-10-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-01-012021-12-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-01-012020-12-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembersSRT:最小メンバ数2020-10-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembersSRT:最大メンバ数2020-10-310001806952Lyel:SeriesAConvertiblePferredStockMember2020-10-310001806952ライル:スタンフォードのメンバーライル:Tentime MembersUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-10-310001806952ライル:スタンフォードのメンバーLyel:TwentyTimesメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-10-310001806952ライル:30回会員ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-10-310001806952ライル:スタンフォードのメンバーライル:40回メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-10-310001806952ライル:スタンフォードのメンバーライル:50回会員US-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-10-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-12-310001806952ライル:スタンフォードのメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーLyel:SeriesAAConvertiblePferredStockMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-05-012019-05-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーLyel:SeriesAAConvertiblePferredStockMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-05-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2019-05-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-05-190001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-01-012021-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-01-012020-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2021-12-310001806952ライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーアメリカ公認会計基準:ライセンスメンバーUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-12-310001806952ライル:PACTPharmaIncMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-06-012020-06-300001806952ライル:PACTPharmaIncMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-06-300001806952Lyel:OtherInvestmentMembersライル:PACTPharmaIncMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2020-06-300001806952ライル:PACTPharmaIncMember2021-10-012021-12-310001806952LYEL:PACT委託プロトコルとPACT株式調達プロトコルを破棄するメンバUS-GAAP:SettledLitigationMembers2022-10-010001806952ライル:PACTPharmaIncMember2022-10-012022-10-010001806952アメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001806952アメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001806952アメリカ-公認会計基準:アメリカ政府機関債務証券メンバー2022-12-310001806952アメリカ-公認会計基準:会社債務証券メンバー2022-12-310001806952アメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001806952アメリカ-公認会計基準:アメリカ証券メンバー2021-12-310001806952アメリカ-公認会計基準:アメリカ政府機関債務証券メンバー2021-12-310001806952アメリカ-公認会計基準:会社債務証券メンバー2021-12-310001806952SRT:最大メンバ数2021-12-310001806952SRT:最大メンバ数2022-12-310001806952Lyel:OtherInvestmentMembers2022-12-310001806952Lyel:OtherInvestmentMembers2022-01-012022-12-310001806952ライル:PACTPharmaIncMember2022-10-010001806952ライル:PACTPharmaIncMember2021-12-310001806952アメリカ公認会計基準:可変利益実体は主要な利益メンバーではないライル:OutpaceBioIncMember2020-11-300001806952アメリカ公認会計基準:可変利益実体は主要な利益メンバーではないライル:OutpaceBioIncMember2021-12-310001806952アメリカ公認会計基準:可変利益実体は主要な利益メンバーではないライル:OutpaceBioIncMember2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001806952アメリカ公認会計基準:MoneyMarketFundsMembersアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001806952アメリカ-公認会計基準:アメリカ証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ政府機関債務証券メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ政府機関債務証券メンバー2022-12-310001806952アメリカ-公認会計基準:アメリカ政府機関債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001806952アメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001806952アメリカ公認会計基準:MoneyMarketFundsMembersアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ証券メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ証券メンバー2021-12-310001806952アメリカ-公認会計基準:アメリカ証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ政府機関債務証券メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ政府機関債務証券メンバー2021-12-310001806952アメリカ-公認会計基準:アメリカ政府機関債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:会社債務証券メンバー2021-12-310001806952アメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル1メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001806952アメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952Lyel:株式保証投資メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952Lyel:株式保証投資メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952ライル:FredHutchSuccessPaymentLibilityMember2022-12-310001806952ライル:FredHutchSuccessPaymentLibilityMember2021-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:FredHutchSuccessPaymentLibilityMemberSRT:最小メンバ数2022-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:FredHutchSuccessPaymentLibilityMemberSRT:最大メンバ数2022-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:FredHutchSuccessPaymentLibilityMemberSRT:最小メンバ数2021-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:FredHutchSuccessPaymentLibilityMemberSRT:最大メンバ数2021-12-310001806952アメリカ公認会計原則:投入価格を測るメンバーライル:FredHutchSuccessPaymentLibilityMember2022-12-310001806952アメリカ公認会計原則:投入価格を測るメンバーライル:FredHutchSuccessPaymentLibilityMember2021-12-310001806952US-GAAP:入力期待タームメンバーの測定ライル:FredHutchSuccessPaymentLibilityMemberSRT:最小メンバ数2022-12-31Utr:はい0001806952US-GAAP:入力期待タームメンバーの測定ライル:FredHutchSuccessPaymentLibilityMemberSRT:最大メンバ数2022-12-310001806952US-GAAP:入力期待タームメンバーの測定ライル:FredHutchSuccessPaymentLibilityMemberSRT:最小メンバ数2021-12-310001806952US-GAAP:入力期待タームメンバーの測定ライル:FredHutchSuccessPaymentLibilityMemberSRT:最大メンバ数2021-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバー2022-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバー2021-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:StanfordSuccessPaymentLiabilityのメンバーSRT:最小メンバ数2022-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:StanfordSuccessPaymentLiabilityのメンバーSRT:最大メンバ数2022-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:StanfordSuccessPaymentLiabilityのメンバーSRT:最小メンバ数2021-12-310001806952アメリカ-公認会計基準:投入リスクを測定する自由金利メンバーライル:StanfordSuccessPaymentLiabilityのメンバーSRT:最大メンバ数2021-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバーアメリカ公認会計原則:投入価格を測るメンバー2022-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバーアメリカ公認会計原則:投入価格を測るメンバー2021-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバーUS-GAAP:入力期待タームメンバーの測定SRT:最小メンバ数2022-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバーUS-GAAP:入力期待タームメンバーの測定SRT:最大メンバ数2022-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバーUS-GAAP:入力期待タームメンバーの測定SRT:最小メンバ数2021-12-310001806952ライル:StanfordSuccessPaymentLiabilityのメンバーUS-GAAP:入力期待タームメンバーの測定SRT:最大メンバ数2021-12-310001806952Lyel:株式保証投資メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2020-12-310001806952Lyel:SuccessPaymentLibilityMemberアメリカ-公認会計基準:公正価値投入レベル3メンバー2020-12-310001806952Lyel:株式保証投資メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-01-012021-12-310001806952Lyel:SuccessPaymentLibilityMemberアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-01-012021-12-310001806952Lyel:SuccessPaymentLibilityMemberアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001806952Lyel:株式保証投資メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-01-012022-12-310001806952Lyel:SuccessPaymentLibilityMemberアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-01-012022-12-310001806952Lyel:SuccessPaymentLibilityMemberアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001806952ライル:PACTPharmaIncMember2022-10-010001806952アメリカ-公認会計基準:リース改善メンバー2022-12-310001806952アメリカ-公認会計基準:リース改善メンバー2021-12-310001806952米国-GAAP:デバイス構成員2022-12-310001806952米国-GAAP:デバイス構成員2021-12-310001806952Lyel:ComputerEquipmentandSoftwareMembers2022-12-310001806952Lyel:ComputerEquipmentandSoftwareMembers2021-12-310001806952アメリカ-GAAP:家具と固定機器のメンバー2022-12-310001806952アメリカ-GAAP:家具と固定機器のメンバー2021-12-310001806952アメリカ-アメリカ公認会計基準:建設中のメンバー2022-12-310001806952アメリカ-アメリカ公認会計基準:建設中のメンバー2021-12-310001806952ライル:2028年12月満期アメリカ-GAAP:BuildingMembers2018-12-31Utr:SQFTライル:オプションの更新0001806952アメリカ-GAAP:BuildingMembersライル:2029年8月満期2019-12-310001806952アメリカ-GAAP:BuildingMembersライル:2029年8月満期2020-12-012020-12-310001806952アメリカ-GAAP:BuildingMembersライル:2029年8月満期2021-10-312021-10-310001806952アメリカ-GAAP:BuildingMembersライル:2029年8月満期2021-01-012021-12-310001806952アメリカ-GAAP:BuildingMembersライル:2030年5月満期2019-01-012019-12-31ライル:契約0001806952アメリカ-GAAP:BuildingMembersライル:2030年5月満期2019-12-310001806952ライル:2031年1月満期アメリカ-GAAP:BuildingMembers2019-12-310001806952ライル:2031年1月満期アメリカ-GAAP:BuildingMembers2021-01-012021-01-310001806952ライル:南サンフランシスコカリフォルニア州のメンバー2021-05-310001806952ライル:南サンフランシスコカリフォルニア州のメンバー2022-01-012022-12-310001806952ライル:南サンフランシスコカリフォルニア州のメンバー2021-01-012021-12-310001806952SRT:関連エンティティメンバLyel:SubleaseWithSonoma Members2021-09-300001806952SRT:関連エンティティメンバLyel:SubleaseWithSonoma Members2022-01-012022-12-310001806952SRT:関連エンティティメンバLyel:SubleaseWithSonoma Members2021-01-012021-12-310001806952Lyel:SeriesCConvertiblePferredStockMember2020-03-012020-03-310001806952Lyel:SeriesCConvertiblePferredStockMember2020-03-3100018069522021-06-170001806952米国-公認会計基準:制限された株式メンバー2022-12-310001806952米国-公認会計基準:制限された株式メンバー2021-12-310001806952SRT:関連エンティティメンバLyel:株の買い戻しはRelatedPartyMemberから2020-03-012020-03-310001806952ライル:At TheMarketOfferingMemberライル:EquityDistributionAgreementメンバーライル:金人SachsAndBofAMembers2022-08-042022-08-040001806952ライル:22201持分インセンティブ計画メンバー2021-06-300001806952ライル:22201持分インセンティブ計画メンバー2021-06-012021-06-300001806952ライル:22201持分インセンティブ計画メンバー2022-01-012022-01-010001806952ライル:22201持分インセンティブ計画メンバーSRT:最大メンバ数2021-06-012021-06-300001806952ライル:22201持分インセンティブ計画メンバー2022-12-310001806952ライル:従業員2,200人株式購入計画メンバー2021-06-300001806952ライル:従業員2,200人株式購入計画メンバー2021-06-012021-06-300001806952ライル:従業員2,200人株式購入計画メンバー2022-01-012022-01-010001806952ライル:従業員2,200人株式購入計画メンバー2022-01-012022-12-310001806952ライル:従業員2,200人株式購入計画メンバー2021-01-012021-12-310001806952ライル:従業員2,200人株式購入計画メンバー2022-12-310001806952ライル:2800株インセンティブ計画のメンバー2018-01-012018-12-310001806952ライル:2800株インセンティブ計画のメンバー2018-12-310001806952米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001806952米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001806952米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310001806952アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001806952アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-12-310001806952アメリカ-公認会計基準:一般と行政費用メンバー2020-01-012020-12-310001806952米国-GAAP:IPOメンバー2021-01-012021-12-310001806952ライル:元CEO執行役員のメンバー米国-公認会計基準:従業員株式オプションメンバーライル:A 2022メンバー2022-10-012022-12-310001806952ライル:元CEO執行役員のメンバー米国-公認会計基準:従業員株式オプションメンバーライル:A 2022メンバー2022-01-012022-12-310001806952ライル:元CEO執行役員のメンバー米国-公認会計基準:従業員株式オプションメンバーライル:A 2022メンバー2021-01-012021-12-310001806952ライル:元CEO執行役員のメンバー米国-公認会計基準:従業員株式オプションメンバーライル:A 2022メンバー2020-01-012020-12-310001806952ライル:元CEO執行役員のメンバーライル:A 2021と2020メンバー米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001806952ライル:元CEO執行役員のメンバーライル:A 2021と2020メンバー米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001806952ライル:元CEO執行役員のメンバーライル:A 2021と2020メンバー米国-公認会計基準:従業員株式オプションメンバー2020-01-012020-12-310001806952ライル:A 2021と2020メンバー米国-公認会計基準:従業員株式オプションメンバーライル:他の従業員は2022-01-012022-12-310001806952ライル:A 2021と2020メンバー米国-公認会計基準:従業員株式オプションメンバーライル:他の従業員は2021-01-012021-12-310001806952ライル:A 2021と2020メンバー米国-公認会計基準:従業員株式オプションメンバーライル:他の従業員は2020-01-012020-12-310001806952ライル:元CEO執行役員のメンバーライル:A 2021と2020メンバー米国-公認会計基準:制限された株式メンバー2022-01-012022-12-310001806952ライル:元CEO執行役員のメンバーライル:A 2021と2020メンバー米国-公認会計基準:制限された株式メンバー2021-01-012021-12-310001806952ライル:元CEO執行役員のメンバーライル:A 2021と2020メンバー米国-公認会計基準:制限された株式メンバー2020-01-012020-12-310001806952ライル:A 2020メンバーライル:他の従業員は米国-公認会計基準:制限された株式メンバー2022-01-012022-12-310001806952ライル:A 2020メンバーライル:他の従業員は米国-公認会計基準:制限された株式メンバー2021-01-012021-12-310001806952ライル:A 2020メンバーライル:他の従業員は米国-公認会計基準:制限された株式メンバー2020-01-012020-12-310001806952Lyel:ShareBasedPaymentArrangementOptionAndRestratedStockMember2022-01-012022-12-310001806952Lyel:ShareBasedPaymentArrangementOptionAndRestratedStockMember2021-01-012021-12-310001806952Lyel:ShareBasedPaymentArrangementOptionAndRestratedStockMember2020-01-012020-12-310001806952米国-公認会計基準:制限された株式メンバー2022-01-012022-12-310001806952米国-公認会計基準:制限された株式メンバー2021-01-012021-12-310001806952米国-公認会計基準:制限された株式メンバー2020-01-012020-12-310001806952米国-GAAP:制限株式単位RSUメンバー2021-12-310001806952米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001806952米国-GAAP:制限株式単位RSUメンバー2022-12-310001806952米国-GAAP:制限株式単位RSUメンバー2020-01-012020-12-310001806952米国-GAAP:制限株式単位RSUメンバー2021-01-012021-12-310001806952米国-GAAP:国内/地域メンバー2022-12-310001806952米国-GAAP:国内/地域メンバー2021-12-310001806952アメリカ-公認会計基準:州と地方法律法規のメンバー2022-12-310001806952Lyel:DomesticTaxAuthorityAndStateAndLocalJurisdictionMembers2022-12-310001806952Lyel:DomesticTaxAuthorityAndStateAndLocalJurisdictionMembers2021-12-310001806952SRT:関連エンティティメンバLyel:SubleaseWithSonoma Members2022-12-310001806952SRT:関連エンティティメンバLyel:SubleaseWithSonoma Members2021-12-310001806952アメリカ-GAAP:投資家のメンバーライル:グラクソ·スミスクライン·スマート財産番号5制限およびグラクソ·スミスクライングループ制限メンバーSRT:最小メンバ数ライル:GSKプロトコルのメンバーライル:ライル免疫系のメンバーは2022-12-310001806952アメリカ-GAAP:投資家のメンバーライル:GSKプロトコルのメンバー2022-12-310001806952アメリカ-GAAP:投資家のメンバーライル:GSKプロトコルのメンバー2021-12-310001806952アメリカ-GAAP:投資家のメンバーライル:GSKプロトコルのメンバー2022-01-012022-12-310001806952アメリカ-GAAP:投資家のメンバーライル:GSKプロトコルのメンバー2021-01-012021-12-310001806952アメリカ-GAAP:投資家のメンバーライル:GSKプロトコルのメンバー2020-01-012020-12-310001806952SRT:関連エンティティメンバLyel:株の買い戻しはRelatedPartyMemberからLyel:SeriesAConvertiblePferredStockMember2020-03-012020-03-310001806952SRT:関連エンティティメンバLyel:株の買い戻しはRelatedPartyMemberからアメリカ-アメリカ公認会計基準:普通株式メンバー2020-03-012020-03-310001806952ライル:Immulus IncMember2020-05-310001806952ライル:Immulus IncMember2020-05-012020-05-310001806952Lyel:マイルストーン支払いメンバーライル:Immulus IncMemberSRT:最大メンバ数2020-05-310001806952Lyel:マイルストーン支払いメンバーライル:Immulus IncMember2021-01-012021-12-310001806952Lyel:マイルストーン支払いメンバーライル:Immulus IncMember2022-01-012022-12-310001806952Lyel:マイルストーン支払いメンバーライル:Immulus IncMember2020-01-012020-12-31 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
_________________________________
表10-K
_________________________________
(マーク1)
| | | | | |
| x | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2022
あるいは…。
| | | | | |
| o | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
そこからの過渡期について
手数料書類番号001-40502
_________________________________
ライル免疫会社です。
_________________________________
(登録者の正確な氏名はその定款に記載) | | | | | |
デラウェア州 | 83-1300510 |
(登録設立又は組織の国又はその他の管轄区域) | (国際税務局雇用主身分証明書番号) |
| ハスキン路二零一号 | |
南サンフランシスコ, カリフォルニア州 | 94080 |
(主な行政事務室住所) | (郵便番号) |
(650) 695-0677
登録者の電話番号は市外局番を含んでいます
同法第12条(B)に基づいて登録された証券:
| | | | | | | | | | | | | | |
クラスごとのタイトル | | 取引コード | | 登録された各取引所の名称 |
普通株、1株当たり0.0001ドル | | ライル | | ナスダック世界ベスト市場 |
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください
はい、そうですx違いますo
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、そうですo 違います。x
登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)条が提出を要求したすべての報告書を再選択マークで示すかどうか、および(2)このような提出要求を過去90日以内に遵守してきたはい、そうですx違いますo
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す。はい、そうですx違いますo
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
| | | | | | | | | | | |
大型加速ファイルサーバ | x | ファイルマネージャを加速する | o |
非加速ファイルサーバ | o | 規模の小さい報告会社 | o |
| | 新興成長型会社 | o |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守するo
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるx
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用するo
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示すo
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、そうですo違いますx
2022年6月30日、すなわち登録者が最近完成した第2財期の最終営業日において、登録者の非関連会社が保有する普通株の総時価は約$である1.110億ドル、ナスダック世界ベスト市場報告書に基づくこの日の終値
登録者には際立った表現がある249,609,2472023年2月24日までの普通株。
引用で編入された書類
登録者は、2023年株主総会における委託書の一部の内容を、本年度報告の第III部分に参照して組み込む。表10−Kは、本明細書に記載された範囲内である。このような依頼書は,登録者が2022年12月31日までの財政年度の120日以内に米国証券取引委員会に提出される。
ライル免疫会社です。
表格10-Kの2022年年報
カタログ表
| | | | | | | | |
| | ページ |
前向き陳述に関する特別説明 | 1 |
リスク要因の概要 | 2 |
| 第1部 | |
第1項。 | 業務.業務 | 5 |
第1 A項。 | リスク要因 | 35 |
項目1 B。 | 未解決従業員意見 | 70 |
第二項です。 | 属性 | 70 |
第三項です。 | 法律訴訟 | 70 |
第四項です。 | 炭鉱安全情報開示 | 70 |
| 第II部 | |
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 71 |
第六項です。 | [保留されている] | 72 |
第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 73 |
第七A項。 | 市場リスクの定量的·定性的開示について | 83 |
プロジェクト8. | 財務諸表と補足データ | 85 |
第九項です。 | 会計と財務情報開示の変更と相違 | 115 |
第9条。 | 制御とプログラム | 115 |
プロジェクト9 B。 | その他の情報 | 117 |
プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 117 |
| 第三部 | |
第10項。 | 役員·幹部と会社の管理 | 118 |
第十一項。 | 役員報酬 | 118 |
第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 118 |
十三項。 | 特定の関係や関連取引、取締役の独立性 | 118 |
14項です。 | チーフ会計士費用とサービス | 118 |
| 第4部 | |
プロジェクト15. | 展示と財務諸表明細書 | 119 |
プロジェクト16. | 表格10-Kの概要 | 121 |
| | |
サイン | 122 |
前向き陳述に関する特別説明
このForm 10-K年間報告書は前向きな陳述を含んでいる。本Form 10-K年度報告に含まれる歴史的事実の声明を除いて、本プレスリリースに含まれる他のすべての声明は、私たちの将来の運営結果と財務状況、業務戦略、候補製品、計画中の非臨床研究と臨床試験、非臨床研究と臨床試験の結果、研究開発コスト、計画中の監督提出、規制承認と成功の時間と可能性、将来の運営の管理計画と目標に関する声明を含み、すべて前向き声明に属する。これらの表現は、既知および未知のリスク、不確実性および他の重要な要素に関連しており、これらの要素は、場合によっては私たちが制御できず、私たちの実際の結果、業績または業績が展望性表現に明示または暗示されている任意の未来の結果、業績、または業績と大きく異なることをもたらす可能性がある。
場合によっては、“可能”、“会議”、“はず”、“予想”、“計画”、“予想”、“可能”、“意図”、“目標”、“プロジェクト”、“信じ”、“推定”、“予測”、“潜在的”または“継続”などの用語、またはこれらの用語の否定または他の同様の表現によって、前向きな陳述を識別することができる。本年度報告におけるForm 10−Kに関する前向きな陳述は、以下に限定されるものではない
•現在の現金は将来の運営費と資本支出需要を支払うのに十分であるかどうか
•費用、収入機会、資本要件、および追加融資需要の推定の正確性とタイミング
•LYL 797、LYL 845、LYL 119、または私たちが開発可能な任意の他の候補製品を開発し、非臨床研究および臨床試験(LYL 797、LYL 845およびLYL 119を含む)を行う範囲、進捗、結果、およびコスト;
•LYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある任意の他の候補製品の規制承認に関連する時間およびコスト、ならびに様々な疾患のための特定の指定を求める任意の予想を含む、我々の製品候補のための様々な疾患のための特別な指定を求めることを含む、LYL 797、LYL 845、LYL 119、または私たちが開発可能な任意の他の候補製品の規制承認に関連する時間およびコストを取得および維持すること;
•私たちは、LYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある他の候補製品の商業化計画(承認されれば)について、重点的に注目されている地理的地域と私たちの販売チームを発展させる能力を含む
•LYL 797、LYL 845、LYL 119、または各疾患のために開発され得る任意の他の候補製品の市場機会の大きさ;
•私たちは第三者に依存してLYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある他の任意の候補製品の非臨床研究活動を行う
•LYL 797、LYL 845、LYL 119、または私たちが開発可能な任意の他の候補製品の特徴、安全性、治療効果、および治療効果;
•私たちはアメリカで目標疾患を患っている患者数と臨床試験に組み込まれる被験者数の推定をしています
•現在と計画されている候補製品の臨床試験の進展と重点、およびこれらの試験のデータ報告は、スケジュールを含む
•我々の臨床試験は、LYL 797、LYL 845、LYL 119、または私たちが開発可能な任意の他の候補製品の安全性および有効性、および他の積極的な結果を証明することができる
•競争療法の成功や可能性があります
•既存または将来の競争の候補製品および療法を含む、私たちの競争相手および私たちの業界に関連する発展
•我々は、LYL 797、LYL 845、LYL 119、または私たちが開発可能な任意の他の候補製品のさらなる開発および製造に関する計画について、私たちが追求する可能性のある他の指標を含む
•アメリカと他の管轄区域の既存の法規と規制の発展
•私たちは、LYL 797、LYL 845、LYL 119、または臨床試験および商業用途のために開発可能な任意の他の候補製品(承認された場合)の潜在力および能力の製造および供給に成功した
•LYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある任意の他の候補製品の市場受入率および程度、ならびにLYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある任意の他の候補製品の価格設定および精算(承認された場合);
•私たちは引き続き、LYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある他の任意の候補製品に対して追加の臨床試験を行い、私たちの候補製品を生産するために第三者に依存し続けている
•LYL 797、LYL 845、LYL 119、または私たちが開発する可能性のある任意の他の候補製品を含む知的財産権保護範囲を確立し、維持することができる
•私たちは私たちのキーパーソンの継続サービスを維持し、より多くの合格者を決定、採用、保留することができます
•著者らは臨床試験、製造サプライヤー、協力者、契約研究機関(CRO)と従業員の使用を含む新冠肺炎疫病が著者らの業務と運営に与える影響に対する期待
•私たちの製造サプライヤー、協力者、CRO、および従業員への影響を含む、インフレ、マクロ経済状況、および地政学的衝突が私たちの業務および運営に与える影響への期待
•私たちは既存の現金、現金等価物、そして有価証券の期待された使用をする。
これらの展望的な陳述は主に、私たちの現在の私たちの業務、私たちが経営している業界、および私たちの業務、財務状況、経営結果、および見通しの財務傾向の期待と予測に基づいており、これらの展望的な陳述は未来の業績や発展の保証ではない。これらの前向き陳述は,本10−K表年次報告発表の日にのみ発表され,本10−K表年次報告第I部第1 A項“リスク要因”で後述する一連のリスク,不確定要因,仮説の影響を受ける可能性がある。展望性陳述は、リスクおよび不確実性の影響を固有に受けているので、いくつかのリスクおよび不確実性は予測または定量化できないので、未来のイベントの予測として、これらの前向き陳述に依存してはならない。我々の展望性陳述に反映された事件と状況は実現できない或いは発生できない可能性があり、実際の結果はこれらの展望性陳述中の予測結果と大きく異なる可能性がある。法的要件が適用されない限り、私たちは、未来に新しい情報があっても、これらの前向き陳述で予測された結果と大きく異なる理由で、任意の前向き陳述を更新または追加する義務がない、または実際の結果を更新または補足する義務がない。
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。これらの陳述は,本年度報告10-K表までの日に我々に提供された情報に基づいており,これらの情報はこのような陳述の合理的な基礎を構成していると考えられるが,このような情報は限られているか不完全である可能性があり,我々の陳述は,入手可能なすべての関連情報について詳細な調査や検討が行われていることを示していると解釈されてはならない.このような陳述は本質的に不確実であり、あなたにこのような陳述に過度に依存しないように想起させる。
リスク要因の概要
以下は,我々の証券投資に投機的あるいはリスクを持たせる要因の概要である.重要なのは、この要約が私たちが直面しているすべての危険と不確実な要素に関連していないということだ。本リスク要因要約で概説されたリスクおよび不確実性要因、ならびに我々が直面している他のリスクおよび不確定要因に関するより多くの議論は、本年度報告シート10−K第1部1 A項の“リスク要因”の項で見つけることができる。このようなリスクや不確実性についてより網羅的に議論されているため,本要約の全体的な内容は制限されている私たちの普通株への投資を評価する際には、本年度報告(Form 10-K)第I部第1 A項の“リスク要因”項に記載されているリスクおよび不確実性を慎重に考慮しなければならない。
•われわれは早期臨床段階の生物製薬会社であり,設立以来大量の損失が発生しており,予想される将来,大量かつ増加していく純損失を受け続けると予想される。
•私たちは急速に発展した分野で運営されており、運営の歴史が限られており、私たちの業務のこれまでの成功を評価し、私たちの将来の生存能力を評価することは難しいかもしれない。
•私たちは現在販売されている製品を承認していないし、製品販売から収入を得たこともない。私たちは製品販売から収入を得ないかもしれないし、利益を達成しないかもしれない。
•私たちは私たちの目標を達成するために大量の追加資本が必要になり、必要な時に必要な資本を得ることができなければ、私たちの製品開発や商業化努力を延期、制限、減少、または中止させる可能性があります
•Success支払契約におけるSuccess支払い義務は、私たちの株主への希釈を招くか、または私たちの支払い義務を履行する現金資源を枯渇させる可能性がある。
•私たちの研究と開発はまだ初期段階にあり、私たちの候補製品はまだ臨床開発を始めたばかりです。もし私たちが候補製品の開発と商業化に成功しなかった場合、あるいはそうする過程で重大な遅延に遭遇すれば、私たちの業務は損害を受ける可能性がある。
•私たちの候補製品と技術プラットフォームは、検証されていない新しい技術に基づいて、承認可能または適切な製品を生成しない可能性があり、これは私たちを予見できないリスクに直面させ、製品開発の時間とコストおよび規制承認の潜在力を予測することを困難にし、私たちの技術プラットフォームを使用して拡張して候補製品パイプラインを構築する努力は成功しないかもしれない。
•私たちは現在マーケティング、販売、流通インフラを持っていません。販売とマーケティングインフラを構築するか、この機能を第三者にアウトソーシングするつもりです。この二つの商業化戦略は私たちに大きな危険をもたらす。
•私たちまたは私たちが依存している第三者が重要な製造施設、潜在的な臨床試験地点が集中あるいは他の業務を運営している地域では、私たちの業務は引き続き新冠肺炎の大流行を含む衛生流行病の影響を受ける可能性がある。
•私たちは候補製品の少なくとも一部を自分で作るつもりだ。私たちの製造施設や候補製品のさらなる資格認証を遅延させたり、規制承認を得たりすることは、私たちの開発計画を延期し、製品収入を創出する能力を制限する可能性があります。
•細胞療法の製造は非常に複雑である。私たちは、患者材料に関連するサプライチェーンの複雑さに関するリスクを含む大量の製造リスクに直面しており、いずれのリスクも、私たちのコストを大幅に増加させ、私たちの計画を延期したり、候補製品の供給を制限したりする可能性があります。
•もし私たちの唯一の臨床または商業製造施設または私たちの契約製造組織が破損または破壊された場合、またはこれらの施設の生産が他の理由で中断されれば、私たちの業務は負の影響を受けるだろう。
•もし私たちが私たち自身の製造を開発または拡大できなければ、私たちは第三者に依存して私たちの候補製品を製造しなければならないかもしれません。これは私たちをリスクに直面させ、私たちの候補製品の開発および/または商業化を遅延または阻止する可能性があります(承認されれば)。
•細胞による治療は特殊な原材料の利用可能性に依存し,これらの原材料は許容可能な条件で提供できないか,あるいは全く得られない可能性がある。
•私たちは、第三者が私たちの候補製品のために、私たちの研究、非臨床研究、臨床試験の大部分を監督、監視、監督することに依存するつもりであり、これらの第三者がその契約義務の履行に成功していない場合、法規の要求を遵守し、または他の方法で満足できるように実行されなければ、規制の承認を得ることができないかもしれないし、候補製品を商業化することができないかもしれないし、このような承認または商業化が遅れる可能性があり、私たちの業務は実質的な損害を受ける可能性がある。
•私たちは過去に、将来的に協力や戦略的同盟を設立したり、あるいは将来的に追加的な許可計画を達成したりする可能性があり、私たちはこのような連合や許可手配の利点を意識していないかもしれない。
•私たちの候補製品について、私たちは現在と計画された臨床試験における患者の登録と保留状況に依存する。もし著者らが臨床試験中に患者を募集或いは保留する時に遅延或いは困難に遭遇すれば、著者らの研究開発仕事及び業務、財務状況と運営結果は重大な不利な影響を受ける可能性がある。
•私たちは激しい競争に直面しており、これは他の人たちが私たちよりも製品の発見、開発、商業化に成功する可能性がある
•私たちの細胞治療候補製品は新しい治療方法を代表し、監督管理審査の強化、臨床開発の遅延或いは私たちは監督管理の承認、商業化或いは支払人が私たちの候補製品をカバーすることを実現できない可能性がある。
•研究、非臨床研究或いは早期臨床試験の結果は必ずしも未来の結果を予測できるとは限らない。私たちが臨床試験に入ったすべての候補製品は後の臨床試験で有利な結果がないかもしれないし、監督部門の承認も得られないかもしれない。
•臨床開発は長くて高価な過程に関連しており、結果は不確定である。
•私たちが時々発表或いは公表した臨床試験の中期、バックライン或いは初歩データはより多くの患者データの出現或いは著者らの生産プロセスの変更に従って変化する可能性があり、そして最終データの重大な変化を招く可能性のある監査と検証プログラムの制約を受ける。
•不安定な市場や経済状況は、私たちの業務、財務状況、株価に深刻な悪影響を及ぼす可能性がある。
•もし私たちが候補製品のために十分な知的財産権保護を得ることができなければ、あるいは知的財産権保護の範囲が十分でなければ、私たちの候補製品の商業化と効果的な競争に成功する能力は不利な影響を受ける可能性がある。
•私たちは私たちのパートナーから知的財産権のかなりの部分の許可を得た。もし私たちがこれらのパートナーとの任意の許可協定に違反すれば、私たちは私たちの1つまたは複数の候補製品を開発し、潜在的に商業化し続ける能力を失うかもしれない。
第1部
プロジェクト1.ビジネス
概要
私たちは臨床段階の細胞治療会社で、私たちの特許を利用して固形腫瘍患者のために一連の候補製品を開発しています離体する遺伝とエピジェネティックT細胞再プログラミング技術。著者らの研究療法は患者自身の細胞を起点として、高度な腫瘍反応、持続時間のより長い機能T細胞を産生し、それによって固形腫瘍に打ち勝つ能力を増強する。著者らの革新的な再プログラミング技術は固形腫瘍T細胞の治療持続と持続的な反応を制限する主要な障害を解決した:T細胞枯渇と持続性幹細胞の欠乏。我々の技術は,持続的かつ自己更新能を有するT細胞を生成し,持続的な腫瘍細胞毒性を駆動することを目指しており,免疫抑制された腫瘍微小環境においても同様である。持続的な抗腫瘍反応を実現するために、患者に十分な強力かつ持続的なT細胞を提供することを目標としている。 また,われわれの技術はキメラ抗原受容体(CAR),腫瘍浸潤性リンパ球(TIL),T細胞受容体(TCR)治療を含む標的不明の方法で多くのT細胞パターンに応用できる
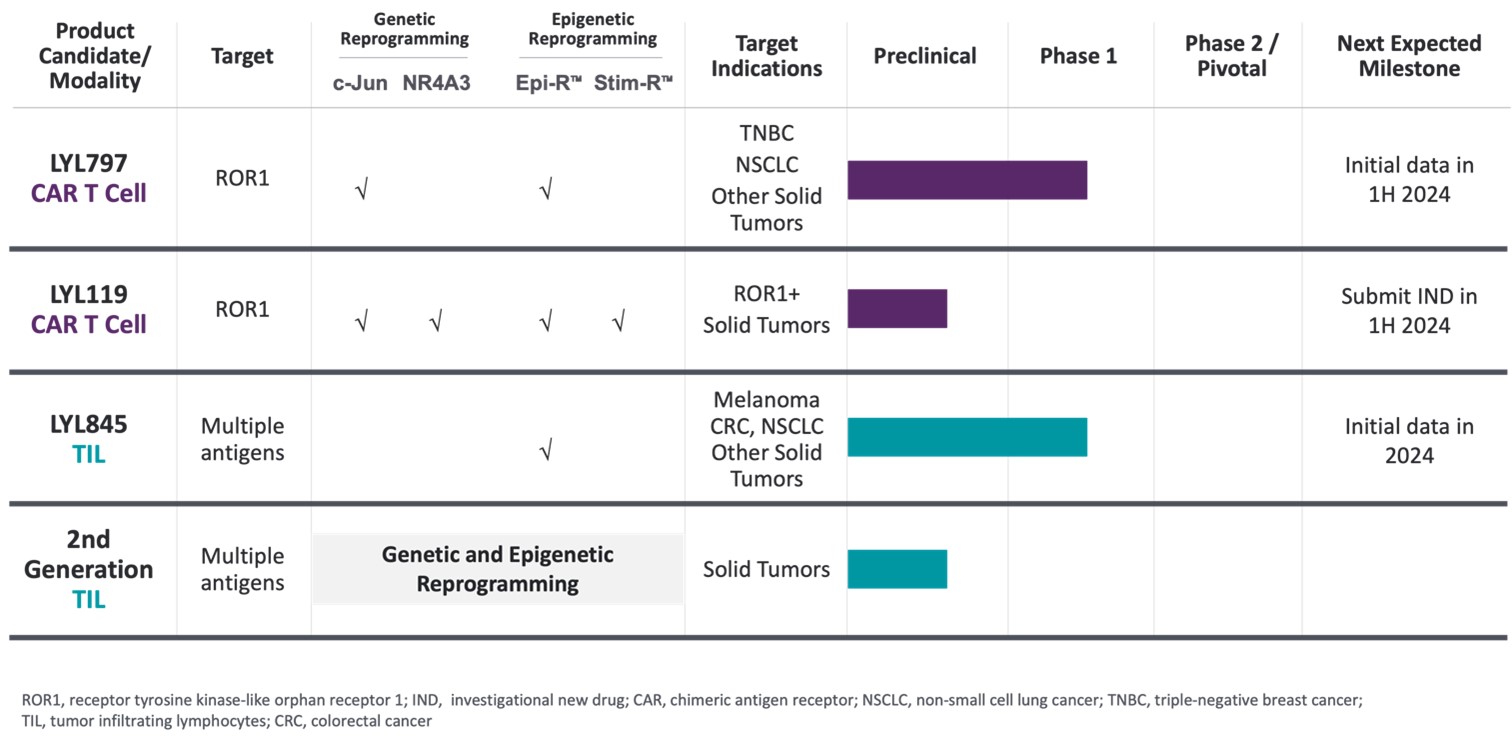
我々は我々の技術を応用して,より良い持続的な臨床結果を有するT細胞療法の開発を目指している。我々が増加している有望な候補細胞製品は,多くの満たされていない需要を有する固形腫瘍適応を目指しており,これらの需要は米国で年間約180,000人の死亡を招いている。我々の各計画は,われわれの最初の目標を超えた患者群のより多くの適応に拡大する機会を提供している。我々の候補製品を次の表1にまとめる
表1:ライルのパイプ
私たちの戦略
著者らの目標は、著者らの独自のT細胞再プログラミング技術に基づいて、固形腫瘍患者のための革新的な治療方法を開発することであり、これらの技術は腫瘍と反応する持続的な機能性T細胞を産生することができ、これらのT細胞は不全に抵抗し、自己更新と持続的な腫瘍細胞毒性を持続的に駆動する能力を維持することができる。
この目標を達成するためのビジネス戦略の重要な構成要素は
•私たちの多様な候補製品ラインを効果的に推進します−我々の自己T細胞療法は、固形腫瘍患者により良い、より持続的な臨床結果をもたらすと信じている。我々は2種類の全額保有候補製品,2種類の異なるT細胞形式,CAR T細胞とTILがあり,現在第1段階で開発されており,巨大なビジネス機会の中で満たされていない医療需要を満たす適応を目指している。私たちは2024年にこの2つのプロジェクトの初歩的な臨床データを獲得し、新しい研究新薬(IND)の申請を提出する予定です 2024年上半期に私たちの3番目の完全候補製品。
•我々の独自の細胞再プログラミング技術プラットフォームを利用して、高度な腫瘍反応性、持続時間のより長い機能性T細胞を創造し、固形腫瘍に打ち勝つ能力を増強する固形腫瘍細胞の治療に成功した主要な障害を解決することによって、T細胞の枯渇を克服し、持続的な幹細胞特性を有するT細胞集団を作成することを含む固形腫瘍を打破するT細胞療法の開発を求める。私たちの候補治療方案は、私たちの独自の、積層可能な遺伝学的およびエピジェネティクスT細胞再プログラミング技術を利用して固形腫瘍を延長および根絶することを目的とした計画を含む:C-Jun過剰発現、NR 4 A 3ノックアウト、Epi-RTMSTIM-RとTM.
•細胞治療の新しい画期的な技術を開発し推進しています我々は、細胞療法を完全に変化させ、固形腫瘍患者の生活を改善することを約束する可能性がある破壊的技術の継続、開発、および推進に取り組んでいる。例えば、我々の新しいNR 4 A 3ノックアウトおよびSTIM−R再プログラミング技術は、T細胞の効力および持続性をさらに向上させることを目的としている。C−junの過剰発現とEpi−Rに加えて、我々の新しいCAR候補T細胞製品LYL 119は、これらの新しい技術を使用しており、癌患者のためのより大きなメリットを創出することを目標としている
•独自の最先端のインフラと能力を維持し、電池製品製造の様々な側面を制御する−我々は、患者のために最高品質の細胞治療製品を確実に製造することを目標とし、製造に引き続き投資する。これは,一貫したプロセスの実施とリスク低減により実現され,生産,サプライチェーン,患者標本保管チェーン,品質管理の挑戦によるリスクを含む。プラスミド,レンチウイルスベクター,細胞製品を生産できる多製品製造センターである全資本製造施設LYFEを設立·運営している。LYFEはすでに依頼され、アメリカ食品と薬物管理局の現在の良好な製造規範(CGMP)に符合し、著者らの臨床試験のために細胞製品を生産している。私たちは私たち自身の製造施設を維持し、私たちが一致したプロセスとリスク管理を実施することができるだけでなく、私たちの再プログラミング技術の独自の側面を保護し、研究開発と製造過程におけるシームレスな協力を支持し、より詳細かつタイムリーな製品特性情報を獲得し、迅速に新しい革新に組み込むことができることを望んでいる。我々の技術インフラは,我々の製造過程をリアルタイムで監視することができ,洞察力を我々の研究,製造,臨床開発に組み込むことができる
•私たちの差別化技術プラットフォームと候補製品で知的財産権を生成、保護、保護します-我々は、内部研究作業、ライセンス契約、および協力によって、ノウハウを含む知的財産権を開発し、保護しました。私たちは私たちの知的財産権を持続的に厳格に分析し、保存し、保護する
私たちの再プログラミング技術は
細胞治療はいくつかの血液系悪性腫瘍を有する患者において深い効果を得たが、固形腫瘍は更に複雑であり、そして多種の機序を進化して逃避し、最終的に免疫システムの除去に抵抗する。これは固形腫瘍における細胞療法の応用を制限している。臨床データや他の科学的証拠によるとT細胞を使い果たすそして耐久性のある茎に乏しいT細胞の持続と自己更新能力を含み、持続的な腫瘍細胞毒作用を駆動することは、固形腫瘍細胞の治療効果を制限する2つの先端障害である
我々は、この2つの主要な障害を解決するために、独自の積層可能な遺伝的およびエピジェネティック再プログラミング技術を開発した。われわれの再プログラミング技術は,持続的な細胞毒性機能を有する強力なT細胞の生成を目指しており,CAR,TIL,TCR療法の形で提供されても,目標が何であっても,CAR,TILとしてもTCR療法としても提供されている。我々はすでにT細胞を産生しており,これらのT細胞は非臨床研究において固形腫瘍のマウスモデルにおいて癌細胞殺傷能を維持し,幹細胞を維持する能力を増強し,より持続的な腫瘍細胞毒を駆動することを証明している。
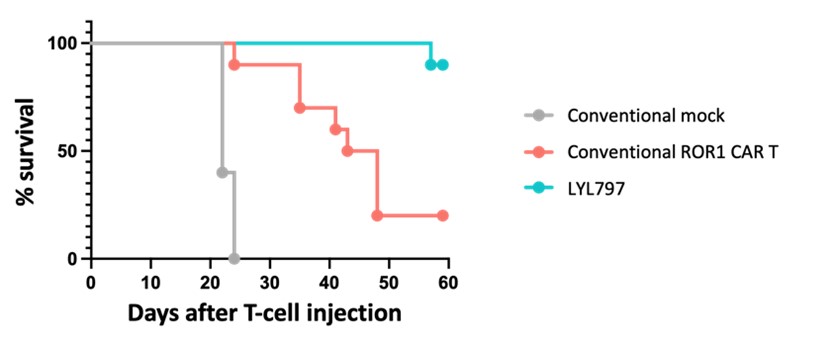
T細胞を使い果たすPD-1、TIM-3およびLAG-3などの細胞表面マーカーの発現が増加し、標的細胞に機能的に反応し、標的細胞を除去することができないことが重要である、機能不全細胞状態を記載する。著者らの創始者の一人、医学博士、Burke O‘Reillyファミリー免疫治療寄贈主席Fred Hutchinson癌センター免疫学教授Stanley Riddell前に行った臨床研究は固形腫瘍と血液系悪性腫瘍におけるCAR T細胞の異なる運命を解明し、そしてT細胞枯渇は固形腫瘍微小環境中で細胞治療に成功する肝心な障害であることを確定した。この研究において、概念上図1に示すように、慢性リンパ球性白血病患者体内に注入された自己ROR 1標的CAR T細胞は迅速な増幅を経験し、そしてT細胞効果機能を保留し、腫瘍細胞の除去と臨床反応を招く。しかしながら、同じ方法で産生されたCAR T細胞が三陰性乳癌(TNBC)または非小細胞肺癌(NSCLC)などの固形腫瘍の患者に注入されると、これらのT細胞はしばしば十分に、迅速に拡張および発育できないことが多い
細胞表面マーカーのT細胞は枯渇し,機能失調状態を呈した。これらの研究の結果、T細胞枯渇は固形腫瘍細胞の治療成功の主要な障害であることが明らかになった。
図1:固形腫瘍はT細胞を枯渇の道に進ませる。
長持ちする茎持続的な腫瘍細胞毒性を提供するために、自己更新、および分化エフェクター細胞子孫を産生するために、T細胞集団の品質を記載した。新しい研究により、有効な免疫治療は幹細胞様特徴を有するT細胞群が臨床反応を産生する必要があり、その中の幹細胞様T細胞の存在は固形腫瘍免疫治療の固形腫瘍反応と関係があり、TILと免疫チェックポイント遮断治療(Sade-Feldmanらを含む細胞.細胞2018年11月Krishnaらは科学, Dec. 2020)
遺伝再プログラミング技術:私たちの2つの独自会社は離体する遺伝子再プログラミング技術はc−jun過剰発現とNR 4 A 3ノックアウトである。C-junとNR 4 A 3は活性化蛋白1(AP-1)転写因子経路の調節に参与し、この経路はT細胞効果機能において重要な役割を果たしている。これらの相補的な再プログラミング技術はこの重要な生物経路に作用し,T細胞の枯渇に対する抵抗力を与える。
C-junの過剰発現はライル共同創業者、スタンフォード大学アーネストとアーミリア·ガロファミリー小児科学と医学教授、スタンフォード大学癌細胞治療センターの取締役創始者クリストファー·マッコール医学博士の仕事に基づいている。マッコール博士は、疲れ果てたT細胞はAP-1転写因子ファミリーに不均衡が存在し、c-junを過剰発現することによってこのアンバランスを是正し、T細胞を抵抗疲れ、固形腫瘍に浸透させ、そしてその機能と効力を維持することができることを発見した。 この仕事は1編にある自然界2019年出版(Lynnら)自然界, Dec. 2019).
著者らの第二の遺伝再プログラミング技術、NR 4 A 3遺伝子ノックアウトは、AP-1転写因子経路の再プログラミングの方法に確立し、疲労遅延と抗腫瘍機能を改善する。我々と他の人は以前、NR 4 A転写因子ファミリーが枯渇したT細胞で上昇し、一部はAP-1の活性を制限することによってT細胞を枯渇させる可能性があることを観察した。NR 4 A 3の発現,およびc-junの過剰発現を破壊し,c-junの最大活性をさらに放出し,より大きな枯渇機能を与えることができると仮定する.われわれの非臨床データは,NR 4 A 3ノックアウトとc−jun過剰発現という2つの技術の結合が相補的な方式で作用し,我々の自動車療法の効力と持続性をさらに向上させる可能性があることを示している
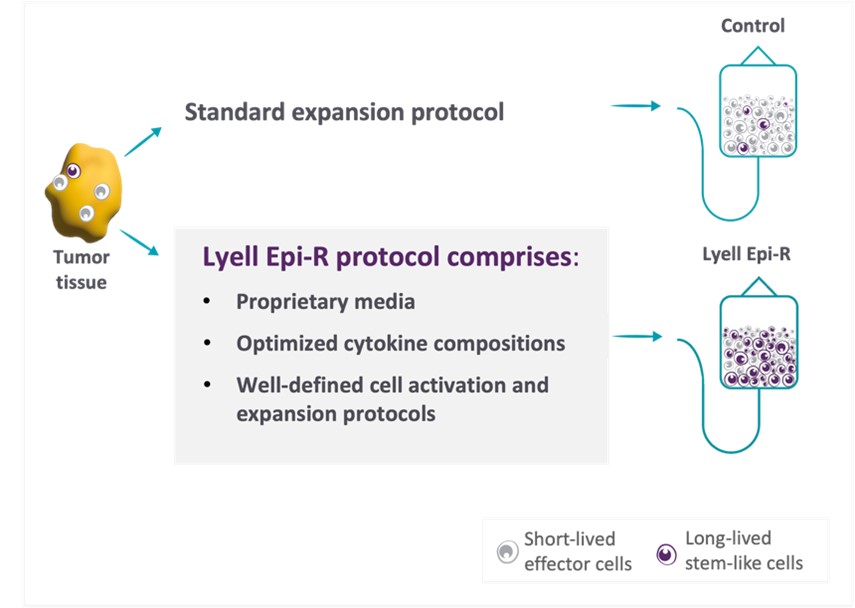
エピジェネティック再プログラミング技術: 私たちの2つの独自会社は離体するエピジェネティック再プログラミング技術としては,Epi-RとSTIM-Rがある. これらの新しい製造技術はより多くの幹細胞様細胞を持つ候補製品を生産し離体するT細胞増幅。
EPI-Rは私たちの特許です離体するエピジェネティック再プログラミング技術は,目的地を有し,持続的な乾性を有するT細胞集団を繰り返し産生することができる。持続性幹細胞特性を有するT細胞はより強い自己更新能力を有し、持続的な腫瘍細胞毒作用を持続的に駆動する。この技術は国立癌研究所(NCI)が行った先駆的な科学に基づいており,そこでは細胞の増幅過程における代謝状態を変化させることで,より多くの幹細胞様と機能を有するT細胞の製品が得られることを証明した
(Vodnalaらは科学2019年3月)。この研究を行ったNCIキー科学者はその後ライル社に参加し、そこで彼らはこの研究を大幅に推進し、Epi-R製造方案を作成し、この方案は理想的な幹細胞様特性を有するT細胞群を意図的に生産し、これらの特性は表現型と機能的に測定することができる。この新規なEpi−Rプロトコルは、特許媒体、明確に定義された細胞活性化および拡張プロセス、およびカスタマイズされたサイトカインの組み合わせを含む。LyellのEpi−RレジメンはT細胞治療候補製品の製造を可能にし,これらの製品は癌細胞に対して高い効力を有するが,幹細胞特性も保持しており,臨床的に有効な抗腫瘍免疫療法に関与している(図2)。また、TILと特に関連するのは、Epi-Rの応用は高度な多クローン性のT細胞群を産生し、即ち広範なTCRクローン型を保留し、より広範な腫瘍抗原に反応することができ、それによって著者らのTIL治療の潜在力を高め、固形腫瘍の異質性を相殺する。さらに、我々は、検査点難治性悪性黒色腫、非小細胞肺癌、および結腸直腸癌(CRC)などの伝統的に製造が困難な腫瘍を含む、様々な固形腫瘍から我々のTIL製品を確実かつ反復的に生産することができる。
図2:ライル社独自のEpi-Rプロトコルは、長寿命幹細胞様特徴を有するT細胞集団を産生する。この方案は私たちのLYL 797自動車T細胞候補製品と私たちのLYL 845 TIL製品候補製品に使用され、以下に示す。
私たちの第2のエピジェネティック再プログラミング技術、STIM-Rは、製造過程においてより正確かつ自然なT細胞活性化を調節する特許の合成細胞模倣体である。現在の製造プラットフォームは通常数十年前に開発された抗体共役ビーズを用いてT細胞を増幅する。この標準的な方法ではT細胞増幅を駆動するシグナル強度や持続時間を正確に制御することはできない離体するそれは.我々のSTIM-Rプラットフォームは、T細胞活性化中のシグナルパラメータを最適化するために分解性脂質コーティングシリコンロッドを使用し、このシリコンロッドは、細胞活性化を調節するために自然なT細胞刺激をより近くシミュレートすることができる。この技術は、細胞増幅と製造過程で伝達されるシグナルの持続時間、強度、およびタイプをよりよく制御することができ、それによってより強力なT細胞製品を産生することができる。
T細胞若年化技術: 老化がT細胞機能に及ぼす影響を他の人と記録し,T細胞機能は思春期後に低下し始め,65歳後にはますます速い速度で低下した。癌の発症率と死亡率も加齢とともに増加する。そこで,我々は抗腫瘍T細胞の復興に専念する別の新しい再プログラミング技術を推進しようと努力している。我々は,T細胞特性を保ちながら細胞のエピジェネティック年齢を低下させる方法を開発している。この技術は現在まだ研究段階にある。我々が生成したデータは,細胞復興と呼ばれる過程で,T細胞のアイデンティティを変えることなく,多能性幹細胞由来のT細胞を誘導する設定で発生するように,エピジェネティック時計を反転させることができることを示している。
私たちの臨床プロジェクトは
我々はCAR T細胞とTIL候補製品の多様なパイプラインを進めており,その中に我々の積層再プログラミング技術を組み合わせて,CAR T,TILとしてもTCR T療法としても持続的な細胞毒性機能を有する強力なT細胞を生成することを目的としている。私たちのプロジェクトの現在の目標は
癌は満たされていないニーズが多く,より多くの適応に拡大する機会を提供している。私たちは、迅速な臨床概念検証を提供するために、以下のように私たちの技術をパイプラインに配置しました(表1)
•LYL 797は我々のc−JunとEpi−R技術を組み合わせて第1段階臨床試験を行い,再発/難治性TNBCあるいは非小細胞肺癌患者を募集している。
•LYL 119は著者らのc-Jun、NR 4 A 3、Epi-RとSTIM-R技術を結合し、現在臨床前開発段階にある
•LYL 845は著者らのEpi-R技術を採用し、現在末期黒色腫、再発/難治性非小細胞肺癌或いは結腸直腸癌患者を含む一期臨床試験を行っている。
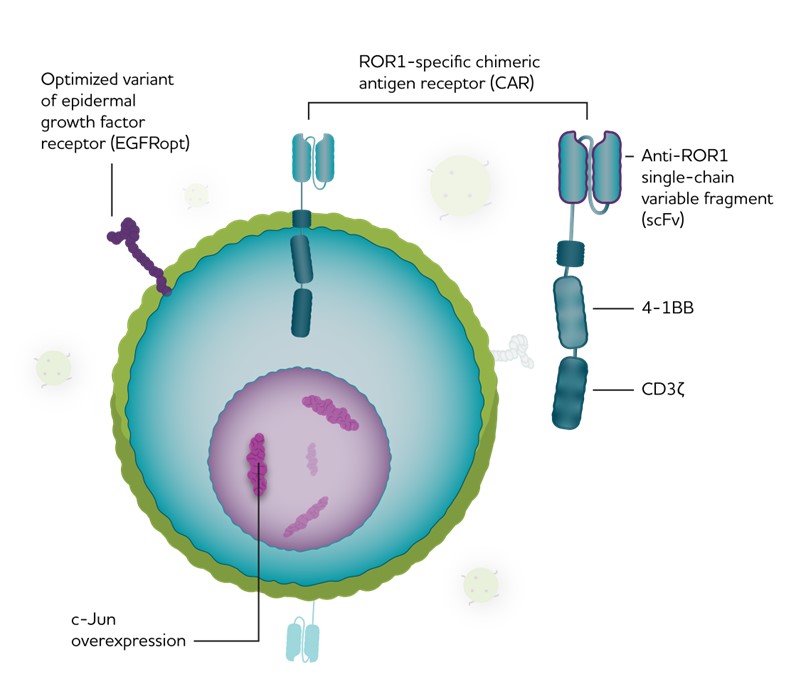
LYL 797:遺伝子とエピジェネティック再プログラミングを経たROR 1自動車T細胞候補製品であり、多種の固形腫瘍適応に対して差別化された効力と耐久性を提供することを目的としている。
我々は我々のc−JunとEpi−R技術を我々の主要なCAR T細胞製品候補LYL 797に応用しており,受容体チロシンキナーゼ様孤児受容体1(ROR 1)タンパク質を標的とした静脈内投与されたCAR T細胞製品であることが予想される。ROR 1は胚胎発育過程に発現する胎児蛋白であり、細胞遷移、極性と生存に重要な役割を果たしていると考えられている。それはいくつかの癌タイプに発現し、TNBC、NSCLC、卵巣癌と慢性リンパ球性白血病を含み、通常予後不良と関係がある。LYL 797(図3)は、4-1 BB/CD 3 ROR 1細胞内領域、膜貫通領域、最適化スペーサ領域、およびR 12ウサギモノクロナル抗体からの一本鎖可変領域(ScFv)を含むCARを含み、この一本鎖可変領域は、高特異性のヒトζを識別および結合することができる。LYL 797はまた、c-junとヒトEGFR(EGFR)の独自最適化切断バージョンを統合しているオプション)治療後の末梢血中のCAR T細胞を追跡するために、必要に応じてセツキシマブと共に安全対策として使用することもできる。LYL 797は我々の特許EPI−R技術を用いて製造された。
図3:LYL 797構築.
第一段階臨床試験
著者らの1期臨床試験(NCT 05274451)はROR 1陽性TNBCまたはNSCLC患者におけるLYL 797の安全性と抗腫瘍活性を評価することを目的としている
この試験は、少なくとも2つの治療失敗の再発/難治性TNBC患者および少なくとも1つの治療失敗の再発/難治性非小細胞肺癌患者に適した開放ラベル、用量増加および拡大試験として設計されている。レジメンによれば、少なくとも15人のTNBC患者および15人の非小細胞肺癌患者は、用量増加中に推奨用量に従って用量拡張を行うと予想される。主要な結果指標はLYL 797の安全性と耐性を評価した。患者はサイトカイン放出症候群(CRS)と免疫効果細胞関連神経毒性症候群のモニタリング、及びROR 1発現器官の組織特異的毒性を受ける。副次的な結果指標は固形腫瘍反応評価標準(RECIST)標準によって評価された抗腫瘍活性の臨床活性、及びLYL 797の薬物動態学的特徴を含む。T細胞機能の探索的バイオマーカーである枯渇と乾性も評価される
かなりの数の患者と臨床効果の兆候がある場合に試験の予備データを共有する予定であり,2024年上半期に発生すると予想される。
標的適応症
われわれは当初,ROR 1陽性のTNBCと非小細胞肺癌の治療にLYL 797を開発していた。よく見られる癌患者の中にかなりの部分にROR 1が発現し、TNBC(~60%)とNSCLC(~40%)を含み、これは2種類のROR 1発現が最も高い固形腫瘍指標である。成功すれば、潜在的ホルモン受容体陽性乳癌、卵巣癌、および他の固形腫瘍を含む他のROR 1発現の低い陽性癌に拡張する可能性がある
乳がんはアメリカ人女性の2番目によく見られる癌だ。現在,米国女性の乳癌の平均リスクは約13%である。エストロゲン受容体とプロゲステロン受容体欠損およびHER 2が発現する乳癌をTNBCと呼ぶ。約10%~15%の乳癌患者はTNBCを有し、三重陰性状態は40歳以下のアフリカ系アメリカ人またはBRCA 1変異の女性によりよく見られる。TNBCsは高い転移傾向を示し,他の分子型に比べて再発のリスクが高い。TNBCsが他のタイプの浸潤性乳癌と異なる点は、TNBC腫瘍の成長と拡散がもっと速く、治療選択が限られ、予後がもっと悪いことである。米国では毎年約40,000例の新たなTNBC症例があり,約22%の乳癌死亡がTNBC由来である。TNBCが身体の遠くに拡散すると、現在治療方案が選択可能であるにもかかわらず、5年生存率はわずか11.5%である。利用可能な治療方法は、カペタビンまたはゲムシタビン、タキサン、アントラサイクリンおよびエブリンなどの手術、新しい補助および補助化学療法、pembrolizumabなどの検査点阻害剤、ならびにolaparibおよびtalazoparibのようなポリADPリボポリメラーゼまたはPARP阻害剤を含む。再発時には抗体−薬物結合体Sacituzumab Gregitecan−hziyが開存する。
肺癌は二番目によく見られる癌であり、全世界の癌死亡の主要な原因でもある。非小細胞肺癌は小細胞肺癌以外の任意のタイプの上皮性肺癌であり、すべての肺癌の約84%を占める。2016年、非小細胞肺癌の発病率の差は大きく、アフリカと北米ではそれぞれ3/10万から57/10万であり、全世界の確定診断例は約200万例であった。2022年に米国では11万人がこの病気で死亡したと推定されている。限局型非小細胞肺癌患者では,総5年生存率は約61%であった。地域性非小細胞肺癌では,5年生存率は約35%であった。現在のデータによると、癌転移時、手術、放射線治療と現在承認されている多種の治療方法が行われているにもかかわらず、化学療法、免疫治療と標的薬物治療を含むが、5年生存率は依然として6%である。
非臨床データ
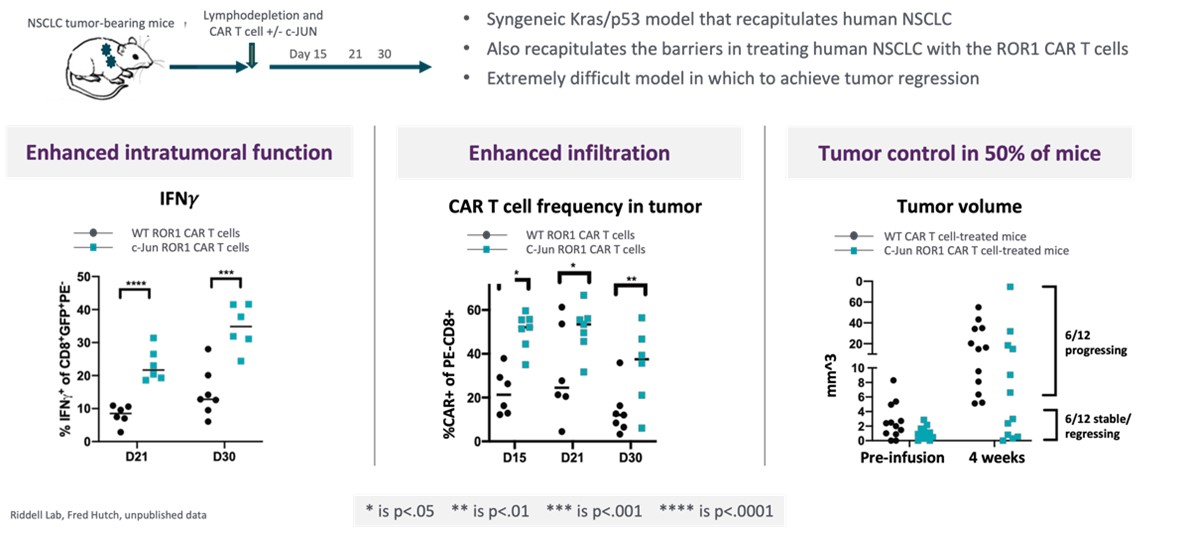
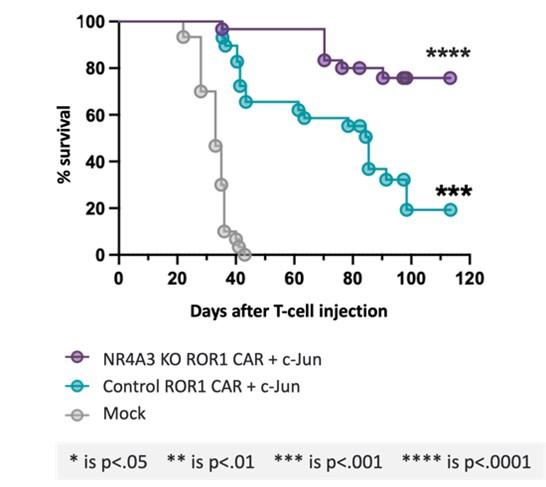
私たちは広く非臨床的に行われています体外培養そして体内にあるLYL 797の開発を支援する研究.C−junを過剰発現するROR 1 CAR T細胞の非臨床研究により,侵襲性のNSCLC同遺伝子動物モデルでは,腫瘍減少,サイトカイン産生増加と腫瘍浸潤が示唆された(図4)。我々のEpi−R作製レジメンを用いて生成したCAR T細胞は,より強い耐久性と細胞毒性を示した(図5)。また,非臨床異種移植腫瘍モデルでは,c−jun過剰発現とEpi−Rを組み合わせて,LYL 797は異種移植NSCLC動物モデルで生存時間の延長を示した(図6)。過去1年間、私たちは4月の米国癌研究協会年次総会を含むこれらと他の非臨床的発見を科学·医学会議で公表した。
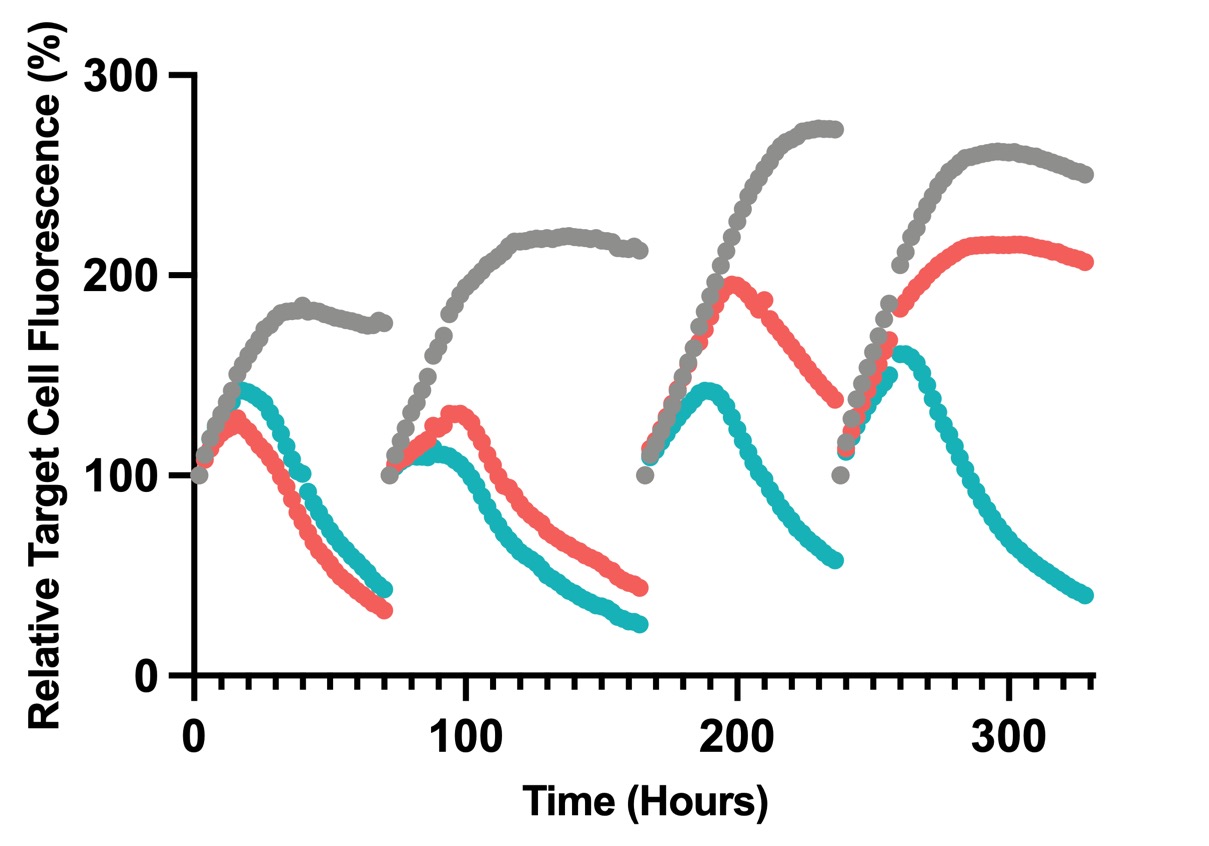
著者らの科学連合創始者、医学博士Stanley Riddellは、まずNSCLCの厳格実体腫瘍モデルにおいてc-junの発現がT細胞機能を改善できるという仮説をテストした(図4)。Riddellと彼の同僚は、誘導可能な発癌遺伝子変異KrasG 12 Dとp 53欠失を有するトランスジェニックマウスモデルを利用した。触発されるとマウスは腫瘍になります初めからやり直すこれはヒト非小細胞肺癌と類似した免疫抑制腫瘍微小環境を要約した。これまでの研究では,この侵襲性腫瘍モデルは化学療法やPD−L 1免疫治療に反応しないことが示唆されている。われわれの研究では,ROR 1 CAR T細胞でヒトNSCLCを治療するように,この侵襲性腫瘍モデルもROR 1 CAR T細胞の治療に抵抗していることが観察された。これに対し,c−junを発現するROR 1 car T細胞治療を受けた腫瘍マウスは,より多くのT細胞の腫瘍への浸透を示し,これらのT細胞の機能は増強し,50%のマウス腫瘍は消退または安定していたが,c−junを発現するROR 1 car治療を受けたマウスの腫瘍進展は100%であった。
図4:侵襲性NSCLCモデルでは、c-jun過剰発現ROR 1 CAR T細胞は非臨床治療効果を示した。
Epi−Rから産生されたCAR T細胞が時間の経過とともに腫瘍細胞を死滅させることが証明された実験では,CAR T細胞は多輪で腫瘍細胞を死滅させるための挑戦を繰り返した(図5)。本実験では,CAR T細胞をROR 1陽性の腫瘍細胞と共培養し,蛍光減弱の測定により腫瘍細胞の殺傷を評価·定量することができた。CAR T細胞と腫瘍細胞は多重反復攻撃を行い、腫瘍細胞殺傷の持続性を評価する。標準増幅方案によって産生された細胞は3回目の時に次第に機能を失い、そして第4回の腫瘍細胞殺傷において腫瘍細胞を殺す効率を著しく低下させた。対照的に、Epi-Rレジメンを使用して産生された細胞は腫瘍細胞を殺し続けた。重要なことは,Epi−R細胞がEpi−Rレジメンに存在しなくなり,エピジェネティック再プログラミングに由来する幹細胞属性が製造レジメン後と実験中に不変であることを示している。
図5:Epi-Rレジメンは持続的な細胞毒性を有するT細胞集団を産生する。
今年5月にアメリカ遺伝子·細胞治療学会年次総会で研究を提出し評価しました体内にある樹立したヒトROR 1陽性H 1975マウス異種移植モデルにおいて,LYL 797(c−junとEpi−Rを有するROR 1 CAR T細胞)と従来のROR 1 CAR細胞の機能活性を比較した。この研究では,LYL 797は腫瘍動物の末梢血液中でより良い拡張性を示し,腫瘍の成長を制御し,生存期間を延長した(図6)
以上より,これらの非臨床データはLYL 797の特徴を記述しており,ROR 1を標的としたCAR細胞をc−junとEpi−Rで再プログラミングすることは,T細胞枯渇や持続性幹細胞の欠乏の障害を克服できることを示している。
図6:LYL 797は、NSCLC(H 1975)異種移植モデルの生存時間を延長する。
LYL 845:新しいエピジェネティクス再プログラミングのTIL候補製品であり、特に多種の固形腫瘍適応に対する差別化効果と持続性のために設計されている
われわれは我々のエピジェネティック再プログラミング技術Epi−Rを応用してLYL 845を開発しており,多発性固形腫瘍の治療に静注された自己TIL療法となることが期待される。我々のEPI-Rプロトコルは、特許媒体、最適化サイトカイン組成、および我々の製造過程で使用される明確に定義された細胞活性化および拡張プロトコルを含む。
TILは以前に末期黒色腫と他の高い突然変異負担を有する固形腫瘍患者において臨床的利益を示した。第三者TIL試験からの公表データは、TILによる転移性黒色腫患者の治療は完全かつ持続的な反応を産生できることを示した。末期黒色腫患者と比べ、肺癌、結腸直腸腫瘍と乳腺などの他の末期固形腫瘍患者のTIL治療に対する応答率ははるかに低い。 広範なTIL治療効果は腫瘍反応性T細胞の欠乏と増幅したT細胞の品質差と成長潜在力の限られた制限を受けている。固形腫瘍固有の異質性により、生産過程でTILの多クローン性を維持できなかったことも癌細胞を根絶する能力を制限する可能性がある。LYL 845は我々のEpi-R技術を採用し、この技術は非臨床実験においてT細胞の潜在能力の増強、抗腫瘍活性の増強、TILの多クローン性の増加に有望な改善を示した
第一段階臨床試験
著者らの第一段階臨床試験(NCT 05573035)は、末期黒色腫、非小細胞肺癌および結腸直腸癌患者におけるLYL 845の安全性と抗腫瘍活性を評価することを目的としている。成功すれば、私たちはより多くの適応に拡大することが予想される。
この試験は再発および/または難治性転移或いは局部末期固形腫瘍患者に対する開放ラベル、投与量の増加と拡大試験として設計された。スキームによれば、少なくとも15人の末期黒色腫患者、15人の非小細胞肺癌患者、および15人の結腸直腸癌患者は、用量増加中に決定された推奨用量で用量拡張を行う。主要な結果指標はLYL 845の安全性と耐性を評価した。二次結果指標はRECIST標準によって評価された抗腫瘍活性の臨床活性とLYL 845の薬物動態学的特徴を含む。T細胞の増幅、表現型、クローン多様性と持続性も評価する。患者はCRSと自己免疫モニタリングを受ける
十分な患者や臨床効果の兆候がある場合には,試験の初期データを共有する予定であり,2024年に発生すると予想される。
標的適応症
我々は当初,末期黒色腫,非小細胞肺癌,結腸直腸癌の治療のためのLYL 845を開発していた。これらの方面での私たちの成功に基づいて、私たちは頭頚部癌、子宮頸癌、乳癌と膵臓癌を含む可能性がある他の固形腫瘍の患者に組み込む予定である。これらの癌患者は最初に放射線治療、化学療法、手術、およびチェックポイント治療、免疫治療または標的治療などのより先進的な代替案から利益を得る可能性があるが、大多数のこれらのタイプの癌患者は最終的に再発する。最初の治療経路に抵抗力を生じた後,患者は緩和ケア,臨床試験における実験的療法あるいは毒性が高く,基本的に無効な化学療法のみを受けることができる。全体的には,最近治療開発が進んでいるにもかかわらず,晩期固形腫瘍と診断された多くの患者では長期生存率は低い
皮膚黒色腫はアメリカで最もよく見られる癌の一つであり、乳癌、前立腺癌、肺癌と結腸直腸癌に次ぐ。それは若者、特に若い女性に最もよく見られる癌の一つだ。米国で毎年新たに診断される黒色腫症例は10万例を超えると推定されている。黒色腫はメラニン細胞の遺伝子変異によるものであり,メラニン細胞は色素を産生する細胞であり,皮膚,眼,内耳,軟脳膜に発見され,代表される
最も侵襲的で致命的な皮膚癌です黒色腫はすべての皮膚科癌の1%しか占めていないにもかかわらず、それは皮膚癌死亡の80%を招いた。末期黒色腫患者の約14%のみが5年間生存することができる。利用可能な治療選択は、手術、放射線治療、免疫治療(PD-1阻害剤)、化学療法および標的治療(MEKおよびBRAF阻害剤)を含む
非小細胞肺癌の説明は、LYL 797について上述した第1段階臨床試験の章で見つけることができる。
米国では結腸直腸癌が男性と女性の癌関連死を引き起こす第三の原因である。結腸直腸癌の多くは腺癌と呼ばれる腫瘍であり,結腸や直腸内部組織に配列された細胞癌である。2022年には,米国では年間約150,000例の新たなCRC症例が推定され,死亡原因は約53,000人と推定されている。転移性疾患と診断された患者では,5年生存率は14%であった。約25%の患者は確定診断時に転移性疾患であり、約50%の結腸直腸癌患者は最終的に転移に発展する。35%以上の新たに結腸直腸癌と診断された患者は5年以内に死亡する。現在利用可能な治療方法は手術、放射線治療、化学療法、免疫治療と標的治療(血管内皮増殖因子、表皮増殖因子受容体、BRAF、NTRK、HER 2とキナーゼ阻害剤)を含む。
非臨床データ
我々はすでにLYL 845の開発を支援する非臨床研究を行っている。これらの研究は,すでに発表されている文献と保存されているポリクローナル腫瘍反応細胞において,われわれのEpi−R技術を用いて産生されたTILが臨床反応に関連する表現型(幹細胞マーカーと細胞毒性T細胞)を有することを示唆している。そのほか、Epi-Rを利用して、著者らはTILを免疫焦点の腫瘍、例えば黒色腫に拡大できるだけでなく、非小細胞肺癌と結腸直腸癌のような免疫冷腫瘍を拡大することもできる。この1年間、私たちは科学と医学会議でこのような発見を発表した。これらのプレゼンテーションの概要は以下のとおりである
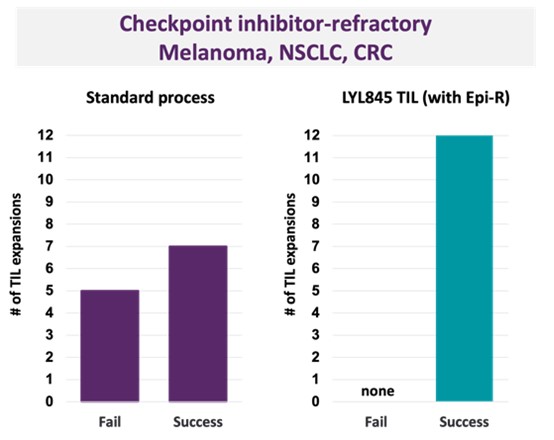
11月、癌免疫治療学会(SITC)2022年年会で、著者らはデータを提出し、標準(対照)過程と比較して、著者らのEpi-R技術はTILを3種類の腫瘍タイプに拡張することに成功かつ確実に拡張できることを証明した。この研究では、Epi-R技術を用いてTILを拡張する成功率は100%(少なくとも10 B細胞)であり、対照群は58%であり、チェックポイント阻害難治性黒色腫、非小細胞肺癌、および結腸直腸癌患者から収集した12個の拡張困難な腫瘍サンプルを含む(図7)。また,この研究では,Epi−R技術は,より高い割合のCD 8+細胞毒性T細胞と幹細胞の特徴を有するT細胞の濃縮(図8),対照TILと比較してより良い代謝適応性を含む抗腫瘍機能と以前のTIL臨床試験で改善された結果に関連する製品(LYL 845)を産生した。
図7:我々のEpi-Rレジメンは標準的な増幅過程と比較して、免疫寒冷固形腫瘍からTILを増幅することに成功した。
図8:LYL 845は、臨床結果の改善に関連する特徴を有する細胞(Krishnaら)に富む科学は Dec. 2020).
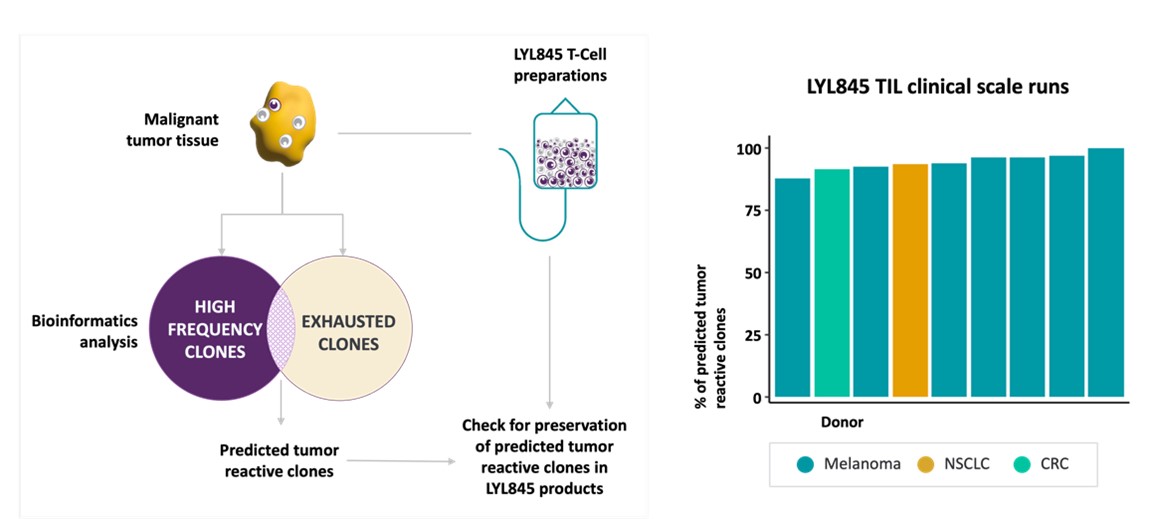
著者らはまた2022年のSITC会議で著者らのLYL 845候補製品中の転写マップ、ポリクローナルと腫瘍反応性T細胞クローンの予測の全面的な分析を紹介した。特に,われわれのバイオインフォマティクス分析では,臨床規模でEpi−R技術を用いて拡張したLYL 845製品は高度にポリクローナルであり,約94%の予測腫瘍反応クローンを保持していることが示唆された(図9)。また,LYL 845製品に保持されている仮定した腫瘍反応性クローンは,標準プロセスからのTIL製品と比較して茎幹を増加させ,不全に関連する遺伝子を減少させた。また,腫瘍細胞特異的共培養実験では,LYL 845の抗腫瘍細胞傷害活性とサイトカインの分泌が腫瘍特異的反応性であることが確認された。
図9:LYL 845 TILは、異質な固形腫瘍の標的化を達成するために、約94%の予測腫瘍反応性クローンを保持した。
LYL 119:細胞毒性を増強するための革新的なROR 1自動車T細胞候補製品。
著者らの戦略の重要な柱は絶えず革新し、新しい、突破的な技術を開発と推進し、固形腫瘍細胞の治療成功の肝心な障害を解決することである。私たちは新しい遺伝子再プログラミングを提案しました
NR 4 A 3ノックアウト技術および新しいエピジェネティック再プログラミング技術STIM-Rは、我々の新しい自動車T細胞候補製品LYL 119に適用されている。これらの技術はc-junとEpi-Rの積層と補充であり、T細胞の抗腫瘍効果と持続性をさらに向上させることを目的としている。LYL 119は、ROR 1陽性固形腫瘍患者のためのより大きな利点を創出することを目標とする改善されている。2024年上半期にLYL 119のIND申請を提出する予定だ。
非臨床データ
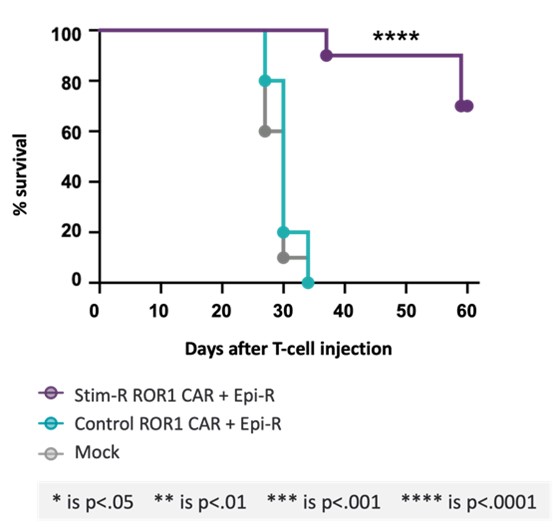
11月のSITC 2022会議で非臨床データを提出し,NR 4 A 3ノックアウトとSTIM−R技術がさらに生存率を向上させたことを示した体内にあるCAR T細胞用量を低下させたH 1975マウス異種移植腫瘍モデルにおいて。我々が提供したデータは、著者らの2種類の遺伝子再プログラミング技術NR 4 A 3ノックアウトとc-jun過剰発現を結合し、ROR 1 CAR T細胞の機能活性を増強し、より高いレベルのサイトカイン産生を示し、CAR T細胞の持続性を増加させ、抗原刺激を繰り返した後に受容体表面発現の減少を抑制し、腫瘍制御における著しい改善を示した体内にある(図10).別の単独の要約では、STIM-Rが強力なCAR T細胞産物を産生し、細胞の増殖と持続性を増加させることを証明する非臨床データも提供されている体内にある腫瘍制御を改善しています(図11)。
図10:C−jun過剰発現とNR 4 A 3ノックアウトを結合し,T細胞はさらに疲労に抵抗し,生存時間を延長することができる。
図11:STIM-R ROR 1 CAR CAR T細胞は、より高い効力を示し、生存時間を延長する。
私たちの製造能力は
細胞療法製造過程のすべての面を所有,制御,継続的に監視し,生産,サプライチェーン,患者標本保管チェーン,品質管理の管理への挑戦を含めてリスクを低減することが重要であると考えられる。我々は自分の製造施設の建設に投資する戦略決定を行い、私たちのサプライチェーンを制御し、電池製品の生産時間の効率を最大限に高め、コストと品質を最適化し、破壊性の進歩と新しい革新を迅速に統合する能力がある。制御製造はまた私たちが私たちの再プログラミング技術の独自の側面を保護することができるようにする。私たちは私たちの製造チームと能力を重要な競争優位だと思っている。
私たちのLYFE製造センターはワシントン州Bothellにあり、敷地は約73,000平方フィートで、製造スイートルーム、実験室とオフィスから構成されています。LYFEの委託と設計はアメリカとEUのcGMP標準に符合し、そして柔軟かつモジュール化の設計を持ち、CAR T細胞、TIL、TCR T細胞とGMPウイルスベクターの生産がサプライチェーンの主要なコンポーネントの製造順序と時間を制御と低減できるようにした。我々自身の施設を持ち,研究,プロセス開発,製造におけるシームレスな連携を奨励し,生産規模の高品質再現性を実現している。
私たちは現在LYFEでの第1段階試験のために臨床用品を生産している。全員配備と生産能力の場合,候補品の組み合わせにより年間約500本の輸液器を生産できると予想される。現在、この能力は、私たちのパイプラインプロジェクトが重要な試験に入ることを支持するのに十分であり、承認されれば、早期に商業化されることができると信じている。
競争
技術の急速な進歩により、製薬業の競争は激しく、活力に満ちている。私たちは主要な製薬、専門製薬と生物技術会社、学術機関、政府機関及び公共と個人研究機関を含む多くの異なる源からの潜在的な競争に直面している。我々が開発と商業化に成功した任意の候補製品は,既存の治療法や将来出現する可能性のある新しい治療法と競合するであろう。さらに、開発期間中、私たちの候補製品は、細胞療法でも他の方法でも、いくつかの組織学的患者またはいくつかの興味のある抗原標的を発現する腫瘍患者のために、他の実験療法と競合する可能性がある。
多くの会社が使っていることを知っています離体する固形腫瘍を治療する細胞療法ですその中のいくつかの会社は、より多くの研究開発者および成熟したマーケティングおよび販売チームのような、私たちよりも多くの財政および他の資源を持っているかもしれないし、製品を市場に出す証拠基準では、より低い司法管轄区域で運営されている可能性がある。
Adaptimmune Treateutics Plc、ArsenalBio、アスリコン、百時美施貴宝社など、固形腫瘍治療のためのT細胞療法が開発されているが、
ジリッド科学、免疫コアホールディングス有限会社、エバンズ生物治療会社、ジョンソン、南京伝奇生物、ノワ製薬のヤンソン製薬会社、ニューレックス治療会社、普睿司登会社とテストン生物会社。ROR 1を発現する癌に対するモノクロナル抗体および抗体薬物結合体、例えばメルク社のような治療法が他の会社でも開発されていることが知られている。
固形腫瘍のための細胞療法を開発した会社の中で、私たちは私たちの再プログラミング技術、知識、経験、科学者と強力な知的財産権の組み合わせが私たちを目立たせると信じている。私たちのすべての候補製品の成功に影響を与える重要な競争要素は効果、安全性、獲得性、価格と製造コストを含むと信じている。
許可、協力、成功支払協定
フレッド·ハッジ許可契約と成功裏の支払い契約
2018年12月、フレッド·ハッチンソンがんセンター(Fred Hutch)とライセンス契約(2019年6月、2019年9月、2020年1月、2020年8月改正)を締結し、自動車および/またはTCRを利用したすべての分野の製品およびプロセスを研究、開発および商業化するために、特定の特許権(独占)および特定の技術(非独占)下のグローバル再許可許可を付与した。私たちはフレッド·ハッジに15万ドルの前金を支払った。許可協定について、私たちはFred Hutchと書面協定を締結し、この合意に基づいて、私たちはFred Hutchに私たちの普通株式1,075,000株を発行した。
ライセンス契約は、個々の製品および国/地域に基づいて、(A)当該製品をカバーする特許権の当該国/地域における有効な権利主張が最後に満了した日と、(B)当該製品が当該国/地域で初めて商業販売された日の10(10)年後に満了する。私たちは合意のすべての内容または任意の特許を自由に終わらせることができる。もし私たちの違約が修正されなければ、フレッド·ハッジは合意を終わらせる権利がある。
私たちはまた2018年12月にFred Hutchと書面合意に達し、この合意に基づいて、Fred Hutchへの支払い成功支払い、支払い方法が現金または公開取引持分であることに同意し、私たちが適宜決定します。これらの成功支払いは、成功支払い期間中の普通株1株当たりの公正時価の増加に基づいており(私たちのすべてのAシリーズ転換可能優先株が最初の公募終了時にかなりの数の普通株に変換されるので)、成功支払い期間はFred Hutchとの書簡合意日から始まり、以下の2つの日付のうち早い日に終了する:(A)その日の9周年と(B)(I)販売、レンタル、私たちのすべてまたはほとんどの資産を別の会社に譲渡または独占的に許可し、(Ii)私たちが他のエンティティと合併または他のエンティティに合併する日(合併前に私たちの株主が既存のエンティティの株式の大部分を所有する合併を除く)。Success Payment期間中、以下の推定日に基づいて私たちの普通株の価値を計量した後、延滞されます:(1)私たちが株式1周年を初めて公開した日、(2)その日の2周年、(3)その後2年ごと(すなわち、この日付の4周年、6周年など)、(4)私たちのすべてまたは実質的なすべての資産を売却、レンタル、譲渡、または独占的に許可した日。(5)他の実体との合併又は合併の日(合併前にわれわれの株主が既存実体の多数の株式を保有している合併を除く);及び(6)9年間の最終日。すべての成功的な支払いは一般的に適用された推定日の45日以内に支払われる, しかし、当社のすべての資産を合併または売却した場合、成功支払いは90年代の早い者に支払うことになりますこれは…。取引の翌日または取引収益は私たちの任意の株主の初日に支払われます。(1)、(2)および(3)の場合、私たちの普通株の価値は、私たちの普通株の成功支払日まで90日間連続した平均取引価格によって決定され、合併または株式販売である場合、価値は、取引中に私たちの株式または買収実体(またはその親会社または付属会社)の株式のために支払われる対価格によって決定される。支払いに成功した金額は、私たちの普通株の価値がいくつかの特定のしきい値に達したかどうかによって決定され、これらのしきい値は、1株18.29ドルから1株91.44ドルに上昇し、いずれの場合も、任意の株式配当金、株式分割、株式組み合わせ、または他の類似イベントに応じて調整されなければならない。いずれのハードルも成功裏な支払いに関連しており、1株18.29ドルの1,000万ドルから1株91.44ドルの累計2億ドルに増加し、このようなハードルに達していれば支払うことができる。Fred Hutchに以前に支払われたどのSuccess支払いも、任意の推定日までに不足したSuccess支払いに計上されるので、Fred Hutchは、同じ閾値に関連する複数のSuccess支払いを受信しない。フレッド?ハッジへの支払い成功総額は2億ドルを超えず、普通株価値が1株91.44ドルに達したときにのみ借りがある。今まで、私たちの普通株の1株当たりの公正価値は支払いに必要な価格より低いため、何の成功的な支払いも生じませんでした。
スタンフォード許可協定と成功支払協定
2019年1月、私たちは、自動車および/またはTCRのすべての使用分野の製品およびプロセスを研究、開発および商業化するために、いくつかの特許権(独占)およびいくつかの他の特許権および技術(非独占)下のグローバル再許可許可を付与するライセンス契約をリリー·スタンフォード初級大学(Stanford)取締役会と締結した。我々はまた、特定の発明をカバーするスタンフォード大学のいくつかの特許出願を増加させる権利があり、これらの発明は、既存の特許および特許出願の改善、および他の特許出願の最初の交渉権であり、これらの特許出願は、主要な研究者の実験室が自動車および/またはTCRを使用することに関連して必要または有用な発明に関するものである。
私たちはスタンフォード大学に40万ドルの前金を支払った。ライセンス契約について、私たちは2019年1月にスタンフォード大学と書面で合意し、この合意に基づき、スタンフォード大学に910,000株の普通株式を発行しました。私たちは本協定の締結2周年にスタンフォード大学に年間数万ドルの維持費を支払うことを要求され、その後、ライセンス製品の最初の商業販売日まで毎年スタンフォード大学に維持費を支払うことが求められている。特定の臨床と規制のマイルストーンを達成する際に、スタンフォード大学に各目標の最高370万ドルを支払う義務があります。私たちは特定のビジネスマイルストーンを達成した後、すべてのライセンス製品に250万ドルをスタンフォード大学に共同で支払う義務があります。また、ライセンス契約では、私たちと私たちの分ライセンシー許可製品の年間純売上高に応じてスタンフォード大学に低い1桁分の等級版税を支払う必要があります。もし私たちがいかなるライセンス特許の有効性に挑戦しようとすれば、この訴訟が未解決の間、私たちの使用料料率は増加し、このような挑戦の結果、特許が有効で侵害されていることが発見されれば、私たちの使用料料率はさらに増加するだろう。私たちはまた、Stanfordに(A)私たちがStanfordから独占的に許可してくれた権利の再許可者から受け取った支払いの15分の1程度の使用料、または(B)再許可料を支払い、他の知的財産権と一緒に等級付けすれば、最高300,000ドルに達することを要求された。
ライセンス契約は、各ライセンス製品及び各国·地域のライセンス製品に基づいて、当該国·地域の当該ライセンス製品のライセンス特許権の有効主張が最後の満了時に満了する。私たちは合意のすべての内容または任意の許可された特許を勝手に終わらせることができる。スタンフォード大学は私たちの違約が修正されなければ合意を終わらせる権利がある。
私たちはまた2020年10月にスタンフォード大学と書面で合意し、合意に基づいて、スタンフォード大学にSuccess支払い、支払い方法が現金または公開取引の株式であることに同意し、私たちが自分で決定することに同意した。これらの成功支払いは、成功支払い期間中の普通株式1株当たりの公正時価の増加に基づいており(私たちのすべてのAシリーズ転換可能優先株が最初の公募終了時にかなりの数の普通株に変換できるので)、成功支払い期間はスタンフォードと書面で合意した日から始まり、以下の日付の中で早い日に終了します:(A)その日の9周年と(B)(I)私たちは販売、レンタル、私たちのすべてまたはほとんどの資産を別の会社に譲渡または独占的に許可し、(Ii)私たちが他のエンティティと合併または他のエンティティに合併する日(合併前に私たちの株主が既存のエンティティの株式の大部分を所有する合併を除く)。Success Payment期間中、以下の推定日に基づいて私たちの普通株の価値を計量した後、延滞されます:(1)私たちが株式1周年を初めて公開した日、(2)その日の2周年、(3)その後2年ごと(すなわち、この日付の4周年、6周年など)、(4)私たちのすべてまたは実質的なすべての資産を売却、レンタル、譲渡、または独占的に許可した日。(5)他の実体との合併又は合併の日(合併前にわれわれの株主が既存実体の多数の株式を保有している合併を除く);及び(6)9年間の最終日。すべての成功的な支払いは一般的に適用された推定日の45日以内に支払われる, しかし、当社のすべての資産を合併または売却した場合、成功支払いは90年代の早い者に支払うことになりますこれは…。取引の翌日または取引収益は私たちの任意の株主の初日に支払われます。(1)、(2)および(3)の場合、私たちの普通株の価値は、私たちの普通株の成功支払日まで90日間連続した平均取引価格によって決定され、合併または株式販売である場合、価値は、取引中に私たちの株式または買収実体(またはその親会社または付属会社)の株式のために支払われる対価格によって決定される。支払いに成功した金額は、私たちの普通株の価値がいくつかの特定のしきい値に達したかどうかによって決定され、これらのしきい値は、1株18.29ドルから1株91.44ドルに上昇し、いずれの場合も、任意の株式配当金、株式分割、株式組み合わせ、または他の類似イベントに応じて調整されなければならない。いずれのハードルも成功裏な支払いに関連しており、1株18.29ドルの1,000万ドルから1株91.44ドルの累計2億ドルに増加し、このようなハードルに達していれば支払うことができる。以前スタンフォード大学に支払われたいかなる成功した支払いも、どの推定日までの成功支払いに計上されるため、スタンフォード大学は同じハードルに関連した複数の成功支払いを受けない。スタンフォード大学に支払われたSuccess支払総額は2億ドル以下で、普通株価値が1株91.44ドルに達したときにのみこのお金を借りている。今まで、私たちの普通株の1株当たりの公正価値は支払いに必要な価格より低いため、何の成功的な支払いも生じませんでした。
グラクソ·スミスクラインの協力と許可協定
2019年、私たちはグラクソ·スミスクライン(GSK)と協力および許可協定を締結し、2019年7月7日に施行され、2020年6月と2021年12月に改訂(GSKプロトコル)され、これらのT細胞療法は、異なる協力計画の下で私たちのプラットフォーム技術とT細胞受容体(TCR)またはキメラ抗原受容体(CARS)の細胞治療革新を応用した。グラクソ·スミスクライン協定は、2つの初歩的な協力目標CD 19とNY-ESO-1を定義し、グラクソ·スミスクラインが2024年7月までに7つの追加目標を指名することを可能にする。これらの目標の計画について合意した後,指定された時点(GSK Option Point)まで,合意された計画ごとに開発サービスを提供し,GSKが選択権を行使するかどうかを決定し,我々から許可(許可選択権)を取得し,将来の開発と商業化を引き継ぐ.LYL 331プログラム(c-jun付きNY-ESO-1 TCR)については、グラクソ·スミスクラインは2021年4月にライセンス選択権を行使し、この計画の将来の開発と商業化の全責任を自費で担った。LYL 331のINDは米国食品医薬品局(FDA)に提出されていない。LYL 132計画(NY−ESO−1 TCRとEpi−R)については,患者が治療を受けていないにもかかわらず2022年1月に承認されたIND申請を提出した。CD 19に対する計画は研究の仕事だ。グラクソ·スミスクライン協定の期間内に、追加的な目標は指定されていないグラクソ·スミスクラインは2022年12月24日にグラクソ·スミスクラインとの合意を終了したライルはこのようなプロジェクトの追加的な仕事を中断した。
GSK協定によると、私たちは払い戻しできない4500万ドルの前金を受け取ったGSKプロトコルについては、2019年5月に、吾らもGSKと株購入協定を締結し、これにより、吾らは1株6.78ドルで30,253,189株のAAシリーズ転換可能優先株を売却することに同意し、発行日に推定された1株4.84ドルの公正価値を上回った。1株当たりの差額は、GSKプロトコルの前金総額が1.036億ドルになるように、追加の5860万ドルの対価格とみなされる。
知的財産権
我々は、内部開発であっても、著者らの協力者や他の第三者から許可を得ても、特許権を求め、維持し、擁護することを含む、当社の業務に重要なビジネス的意義を有するノウハウ、発明、および改善を保護し、強化するために努力している。私たちの政策は、私たちのノウハウ、発明、改善、および候補製品に関する特許出願を米国および米国以外の管轄地域で提出することを含む、私たちの独自の地位の保護を求めることであり、これらは私たちの業務の発展と実施に非常に重要です。私たちはまた、私たちの特許技術と製品候補に関連する商業秘密と技術ノウハウ、持続的な革新と許可機会に依存して、細胞および遺伝子治療分野における私たちの特許地位を発展、強化し、維持している。また,データ独占性,市場独占性,特許期間延長(利用可能であれば)に依存し,適切であれば孤児薬物指定による規制保護を求め,依存する可能性も計画している。私たちのビジネス成功は、私たちの技術、発明、および改善のために特許および他の固有保護を取得し、維持する能力があるかどうか、私たちの商業秘密を秘密にすること、第三者が所有する知的財産権を使用する私たちのライセンスを維持すること、私たちの特許を含む私たちの固有の権利を擁護し実行すること、および効果的かつ実行可能な特許および第三者の他の独自の権利を侵害することなく運営される可能性がある。
私たちは、成分、使用方法、プロセス、用量、および処方のための請求項を含み、関連する製造プロセスおよび合意を含む、私たちの細胞工学技術プラットフォームおよび関連製品候補製品の開発および商業化に関連する多くの技術的ノウハウおよび商業秘密を有する大量の特許出願を許可、調達、および提出している。我々の知的財産権戦略は、c-Jun、NR 4 A 3、Epi-RおよびSTIM-R、および我々の候補製品の様々な側面を含むが、これらに限定されない、我々のT-cell再プログラミング技術に多層保護を提供することを目的としている。すべての特許出願について、私たちは具体的な状況に基づいて特許請求戦略を決定するつもりだ。私たちは、私たちの独自技術プラットフォームおよび任意の製品のすべての有用なアプリケーション、および既存技術プラットフォームおよび製品のために発見された新しいアプリケーションおよび/または使用を保護することを要求する特許出願を提出することができる。私たちは、私たちのプロセスおよび成分が最大のカバー範囲および価値を得ることを確実にするために、特許出願の数およびタイプ、ならびに係属中および発表された特許請求の範囲を絶えず再評価する。また、特許訴訟中には、私たちの知的財産権および業務ニーズを満たすためにクレームが修正される可能性がある。私たちはこれらの努力をしたにもかかわらず、私たちが許可または提出した任意の特許出願または将来可能な許可または提出された任意の特許が任意の特許が付与されることを保証することはできず、私たちが許可した任意の特許または将来許可または付与される可能性のある特許が挑戦されないか、無効または回避されないか、またはこれらの特許が商業的に私たちの技術を保護するために使用されることを保証することはできない。
2023年2月1日現在、私たちのライセンスおよび所有特許の組み合わせは、40以上の認可された特許と135個以上の承認すべき特許出願と、私たちが所有する100件以上の保留特許出願とを含む。私たちのポートフォリオは
C-Jun、NR 4 A 3、Epi-RおよびSTIM-R、および私たちの候補製品を含む、T細胞再プログラミング技術の様々な態様をカバーする。私たちの製品の組み合わせの特許と特許出願は主にアメリカ、ヨーロッパ、カナダ、日本とオーストラリアにあります。当社のライセンス内知的財産権に関する情報は、“-ライセンス、連携、および成功支払いプロトコル”の次の節を参照されたい
個別特許の展示期間が異なり、特許出願の提出日、特許発行日及び特許を取得した国の特許の法的期限に依存する。一般に、米国で出願された特許は、最初の非仮出願日から20年以内に有効である。米国では,特許有効期間は特許期限調整(PTA)によって延長することができ,特許期限調整(PTA)は特許権者の特許審査·承認時の行政遅延を補償することができ,または以前に提出された特許によって特許が最終的に放棄された場合には短縮することができる。さらに、場合によっては、FDA承認された薬物をカバーする米国特許の特許期限が、臨床試験およびFDA規制審査期間によって実際に失われた期間の一部を再獲得する資格が延長される可能性もあり、この延長は、特許期間延長と呼ばれる。回復期は5年を超えてはならず,回復期を含む総特許期はFDA承認後14年を超えてはならない。ヨーロッパおよび他のいくつかの外国司法管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。しかし,米国FDAを含む適用当局が,このような延期を承認すべきかどうか,このような延期が承認された場合の期限の評価に同意する保証はない.米国以外の特許の期限は適用される現地法の規定によって異なるが,通常は最も早い非仮出願日から20年である。特許によって提供される実際の保護は製品によって異なり、国によって異なり、特許のタイプ、カバー範囲を含む多くの要素に依存する, 規制に関連する延期の可用性、特定国の法的救済措置の可用性、および特許の有効性と実行可能性。
2023年2月1日現在、私たちの登録商標組み合わせには、米国における約9つの未決商標出願と、アルゼンチン、ブラジル、カナダ、中国、香港、インド、イスラエル、メキシコ、オマーン、韓国、ロシア、シンガポール、南アフリカ、アラブ首長国連邦、ベネズエラにおける80以上の外国未解決商標出願が含まれている165を超える登録商標および未決商標出願が含まれている。以下の国と地域では、国家届出により75件以上の商標登録が得られている:オーストラリア、ブラジル、中国、コロンビア、コスタリカ、EU、香港、インド、イスラエル、日本、メキシコ、ニュージーランド、オマーン、ロシア、韓国、スイス、アラブ首長国連邦、イギリス、ベネズエラ。
場合によっては、私たちはまた商業秘密に依存して私たちの技術を保護することができる。しかし、商業秘密は保護することが難しい。私たちは私たちの技術と候補製品を保護することを求めています。部分的には、私たちの機密情報にアクセスできる人と秘密協定を締結することによって、私たちの従業員、請負業者、コンサルタント、協力者、コンサルタントを含みます。私たちはまた、私たちのノウハウとプログラムの完全性とセキュリティ、私たちの住宅地の実体セキュリティ、そして私たちの情報技術システムの実体と電子セキュリティを維持するために努力しています。私たちはこのような個人、組織、そしてシステムに自信があるにもかかわらず、合意や安全措置が違反される可能性があり、私たちはどんな違反にも対応する十分な救済措置がないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立したりするかもしれない。私たちの従業員、請負業者、コンサルタント、協力者、およびコンサルタントが、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利に関する紛争が生じる可能性がある。当社のノウハウ、発明、改善、および候補製品に関連するこのリスクおよびより包括的なリスクについては、“リスク要因--私たちの知的財産権に関連するリスク”というタイトルのセクションを参照されたい
販売とマーケティング
私たちの発展段階を考慮して、私たちはまだ商業組織や流通能力を確立していない。私たちは、任意の承認された製品の販売を支援するための商業インフラを構築したり、この機能を第三者にアウトソーシングしたりするつもりです。私たちは、LYL 797、LYL 845、LYL 119、および私たちが開発する可能性のある他の候補製品の開発および商業化における私たちの能力を強化するために、パートナーと協力する機会を評価するつもりだ。また、私たちの候補製品が承認されれば、私たちが計画している世界的なビジネス潜在力を最大限に拡大するために、単独またはパートナーとキー市場でそれを商業化するつもりです。
政府の監督管理
FDAとその他の連邦、州と地方及び外国の監督管理機関は、他を除いて、私たちが開発している生物製品の研究、開発、テスト、製造、品質管理、輸出入、安全、有効性、ラベル、包装、貯蔵、流通、記録保存、承認、広告、販売促進、マーケティング、承認後の監視と承認後報告などの方面に対して広範な監督管理を行った。私たち、一緒に
第三者請負業者と協力して、私たちが試験を行いたい、または承認を求めることができるかもしれない国/地域規制機関の様々な非臨床、臨床、および商業承認要件を満たすことが求められる。規制の承認を得て、その後、適用される連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。
アメリカの生物製品法規
アメリカでは、生物製品は“連邦食品、薬品と化粧品法”、“公衆衛生サービス法”及びその他の連邦、州、地方と外国法規の規制を受けている。FDAが生物製品が米国で発売される前に必要とされるプログラムは、一般に以下のような態様を含む
•FDAの良好な実験室実践要求(GLP)に基づいて非臨床実験室テストと動物研究を完成する
•臨床試験の開始前に発効しなければならないIND出願をFDAに提出する
•試験開始前に、各臨床場所の機関審査委員会(IRB)または倫理委員会の承認
•FDAの法規(一般にGCPと呼ばれる)、法規と人体研究対象及びその健康情報を保護する任意の追加要求に基づいて、十分かつ制御された人体臨床試験を行い、提案された生物製品候補製品の安全性、純度と効力を決定し、その期待目的を達成する
•すべての重要な臨床試験を完了した後、生物製品ライセンス申請(BLA)をFDAに提出する準備ができている
•適用されれば、FDA諮問委員会の審査が満足的に完了する
•FDAはBLAを受信してから60日以内に再審申請を提出することを決定した
•CGMPのコンプライアンスを評価し、生物製品の持続的な安全性、純度および効力を維持するのに十分な施設、方法および制御を確保し、適用されれば、FDAが現在ヒト細胞および組織製品を使用している良好な組織実践(CGTP)要求のコンプライアンスを評価し、GCPのコンプライアンスを評価するために、FDAの生産推奨製品の1つまたは複数の製造施設の承認前検査を満足的に完了させる
•FDAは、BLAを支持するデータを生成する非臨床試験場所および臨床試験場所を監査することができる
•FDAは、米国で使用される特定の適応の製品の商業マーケティングを可能にするためにBLAを審査および承認する。
人体で任意の候補生物製品をテストする前に、候補製品は非臨床試験段階に入る。非臨床試験は、臨床前研究とも呼ばれ、製品の化学、毒性と調合の実験室評価、及び候補製品の潜在的安全性と活性を評価する動物研究を含む。非臨床試験の進行はGLPを含む連邦法規と要求に適合しなければならない。
米国で最初の候補製品の臨床試験が開始される前に、INDをFDAに提出しなければならない。INDはFDAがヒトの研究を許可する新薬の要請である。IND提出の中心焦点は臨床試験の全体的な研究計画と方案である。INDには動物や体外培養製品の毒理学、薬物動態学、薬理学と薬効学特徴を評価する研究;化学、製造と制御情報;及び任意の利用可能なヒトデータ或いは文献を用いて研究製品の使用を支持する。INDはヒト臨床試験が始まる前に発効しなければならない。INDはFDAが30日以内に提案された臨床試験に対して安全懸念または問題を提起しない限り、FDA受信後30日以内に自動的に発効する。この場合,INDは臨床的に放置される可能性があり,INDスポンサーやFDAは臨床試験が開始される前に未解決の問題や問題を解決しなければならない。したがって,INDの提出はFDA認可による臨床試験の開始につながる可能性があり,そうでない可能性もある。
米国で臨床試験を開始する前にFDAにINDを提出するほか,組換えや核酸分子を合成するヒト臨床試験に関連する機関生物安全委員会(IBC)の監督を受けなければならないことは,米国国立衛生研究院(NIH)の組換えDNA分子に関する研究ガイドライン(NIHガイドライン)に適合している。具体的には,米国国立衛生研究院のガイドラインによると,ヒト遺伝子転移試験の監督にはIBCによる評価と評価が含まれており,IBCは地方機関委員会であり,審査と監督を担当している
この機構では組換えや合成核酸分子を用いた研究が行われている。IBCは、研究の安全性を評価し、公衆の健康または環境に対する任意の潜在的リスクを決定し、このような審査は、臨床試験開始前のいくつかの遅延をもたらす可能性がある。NIHガイドラインは強制的ではないが,関連研究がNIH組換えや合成核酸分子研究助成を受けた機関で行われているか,あるいはその助成によって行われていない限り,多くの会社や他のNIHガイドラインに拘束されていない機関は自発的にこれらのガイドラインに従っている。
臨床試験は、GCPに従って合格した研究者の監督の下でヒト被験者に研究製品を服用することを含み、すべての研究被験者に任意の臨床試験への参加についてインフォームドコンセントを提供することを含む。臨床試験は,研究目標を詳細に説明し,安全性をモニタリングするためのパラメータと評価する有効性基準のシナリオで行った。製品開発中に行われる各後続の臨床試験および後続の任意のレジメン修正は、既存のINDに個別に提出されなければならない。また,臨床試験を推奨する各地点のIRBは,その地点で臨床試験を開始する前に任意の臨床試験の計画およびそのインフォームドコンセントを審査·承認しなければならず,完成まで研究を監視しなければならない。規制当局、IRB、またはスポンサーは、対象が受け入れられない健康リスクに直面していることを発見すること、または試験がその目標を達成する可能性が低いことを含む、様々な理由で臨床試験を随時一時停止することができる。いくつかの研究は、データ安全監視委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループの監視をさらに含み、委員会は、研究のいくつかのデータへのアクセスに基づいて、研究が指定されたチェックポイントで行うことができるかどうかを許可し、被験者に受け入れられない安全リスクまたは他の理由があると判定された場合、治療効果を示さない場合、臨床試験を停止する可能性がある。行っている臨床試験や臨床試験結果を公的登録機関に報告することも求められている。
BLAを承認するために、ヒト臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複または合併する可能性がある:
•段階1-研究製品は、健康なヒト対象または標的疾患または状態を有する患者に最初に導入される。これらの試験は、人体内での製品の安全性、用量耐性、吸収、新陳代謝と排泄、および用量増加に関連する副作用をテストし、可能な場合に有効性の早期証拠を得ることを目的としている。
•第二段階-初期治療効果、最適用量および用量計画を評価し、可能な不良副作用および安全リスクを決定するために、特定の疾患または状態の限られた患者集団のための製品を研究する。より大規模かつより高価な3期臨床試験を開始する前に、複数の2期臨床試験を行って情報を得ることができる。
•第三段階-製品を拡大した患者群に研究し、用量を更に評価し、臨床治療効果の統計的に意義のある証拠を提供し、そして更に安全性をテストし、通常複数の地理的に分散した臨床試験地点で行われる。これらの臨床試験は研究製品の全体的なリスク/収益比率を確定し、製品の承認に十分な基礎を提供することを目的としている。
場合によっては、FDAは、所望の治療適応に関する製品のより多くの情報、特に長期安全フォローアップのために、自発的に製品が承認された後に追加の臨床試験を行うことを要求する可能性がある。これらのいわゆる第4段階実験もBLAを承認する1つの条件となる可能性がある。
臨床試験と同時に、会社は追加の動物研究を完成させ、候補製品の生物学的特徴に関する追加情報を開発することができ、cGMP要求に基づいて商業量産製品の過程を最終的に決定しなければならない。製造過程は一貫して高品質の候補製品ロットを生産することができなければならず、特に最終製品の特性、強度、品質と純度をテストする方法を開発しなければならない。また,適切な包装を選択·テストし,候補製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
アメリカ食品医薬品局が提出し審査したBLA
すべての適用された法規要件に基づいて必要なすべてのテストが成功したと仮定すると,製品開発,非臨床研究,臨床試験の結果はBLAの一部としてFDAに提出され,その製品を1つまたは複数の適応の市場に使用することの承認が求められる。BLAは,否定や曖昧な結果や積極的な発見,製品の化学,製造,制御,提案されたラベルなどに関する詳細な情報を含む非臨床·臨床試験から得られたすべての関連データを含まなければならない。データは、製品の安全性および有効性を試験することを目的とした会社のスポンサーからの臨床試験から来ることができ、独立した調査者による試験を含む多くの代替源からのものであってもよい。BLAを提出するには、免除または免除が適用されない限り、FDAに相当な申請使用料を支払う必要がある。
出願が提出されてから60日以内に、FDAは、FDAが提出を受け入れる前に実質的に完了したかどうかを決定するために、提出されたBLAを審査する。FDAは、それが不完全であるか、または提出時に適切に審査できないと考えられる任意のBLAの提出を拒否することができ、より多くの情報の提供を要求することができる。この場合,BLAおよび付加情報を再提出しなければならない.BLAが提出を受けると、FDAの目標は、提出日から10ヶ月以内に標準出願を審査すること、または、申請に資格優先審査がある場合、FDAが提出申請を受けてから6ヶ月以内に審査することである。標準審査および優先審査では、FDAは、より多くの情報の提供または明確化を要求し、審査プロセスを延長することもできる。FDAは、製品が安全で、純粋かつ有効であるかどうか、およびその製造、加工、包装、または保持されている施設が、製品の持続的な安全、純度および効力を保証するための基準に適合しているかどうかを決定するためにBLAを審査する。FDAは諮問委員会を招集し,審査申請について臨床的知見を提供することも可能である。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
BLAを承認する前に、FDAは通常、製品を生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMPに適合していることを決定し、要求された仕様で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。ヒト細胞や組織製品でもある候補製品については,メーカーがcGTPSに適合していなければ,FDAもこの申請を承認しない。これらは、ヒト細胞、組織、および細胞および組織製品(HCT/Ps)を製造するための方法および使用のための施設および制御措置を管理するFDAの法規であり、これらの製品は、ヒト細胞または組織であり、ヒトレシピエントへの移植、移植、注入または転移を目的としている。GTP要求の主な目的は,細胞や組織に基づく製品の製造方式の確保であり,感染症の導入,伝播,伝播を防止することを目的としている。FDAの規定はまた、組織機関がFDAに彼らのHCT/Pを登録し、適用した場合にスクリーニングとテストを通じてドナーを評価することを要求する。さらに、BLAを承認する前に、FDAは、GCPに適合することを確実にするために、通常、1つまたは複数の臨床場所を検査する。FDAが、臨床試験場所から収集されたアプリケーション、製造プロセス、または製造施設またはデータが受け入れられないと判断した場合、不足点を提出文書に列挙し、追加の試験または情報の提供をしばしば要求するであろう。任意の要求された補足情報が提出されたにもかかわらず、FDAは最終的に、その申請が承認された規制基準を満たしていないと決定する可能性がある。
FDAがBLAを評価し、研究製品および/またはその薬剤を生産する製造施設を検査した後、FDAは承認書または完全な返信(CRL)を発行する可能性がある。承認書は、製品の商業マーケティングを許可し、特定の適応に関する具体的な処方情報を提供する。CRLは、FDAがBLAで発見したすべての欠陥を記述するが、FDAが申請をサポートするデータが承認をサポートするのに不十分であると判断した場合、FDAは、最初に必要な検査、提出された製品ロットをテストすることなく、および/または提案されたラベルを審査することなくCRLを発行することができる。CRLを発行する際に、FDAは、BLAがより多くの情報を提供することを要求すること、または明確にすることを含む、BLAが承認された条件であるように、申請者がとる可能性のある行動を提案することができる。適用される規制基準を満たしていない場合、FDAは、製品の安全性または有効性を監視するために、追加の試験または情報を要求し、および/または上場後の試験および監視を要求するBLAの承認を延期または拒否することができる。
1つの製品が規制部門の承認を受けた場合、このような承認は特定の適応が付与され、製品が発売される可能性のある指定用途の制限をもたらす可能性がある。例えば、FDAは、製品の利点がそのリスクよりも大きいことを保証するために、REMSを使用してBLAを承認することができ、または他の方法で任意の承認範囲を制限することができる。REMSは、製品に関連する既知または潜在的な深刻なリスクを管理し、そのような薬剤の安全な使用を管理することによって、患者がこれらの薬剤を継続的に得ることを可能にするための実装されたセキュリティ戦略であり、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全使用を確保する要素を含むことができる。FDAはまた,提案されたラベルを変更したり,適切な制御や仕様を作成したりすることを条件に承認することも可能である.承認されると、発売前と上場後の要求に対する遵守が保たれていない場合、あるいは製品が市場に進出した後に問題が発生した場合、FDAは製品承認を撤回する可能性がある。FDAは、製品の商業化後の安全性と有効性をさらに評価し、監視するために、1つまたは複数の第4段階上場後の試験およびモニタリングを要求する可能性があり、これらの発売後の研究結果に基づいて製品のさらなる販売を制限する可能性がある。
開発と審査計画を加速する
FDAは合格した候補製品に一連の迅速な開発と審査計画を提供した。例えば、迅速チャネル計画は、深刻または生命に危険な疾患または状態を治療することを目的とした新製品の審査プロセスを加速または促進し、疾患または状態を解決する満たされていない医療需要の潜在力を示すことを意図している。具体的には、新しい生物製品が、深刻または生命に危険な疾患または状態を治療することを意図し、その疾患または状態を解決する満たされていない医療需要の潜在力を示す場合、迅速なチャネル指定を得る資格がある。高速チャネル指定は,製品と研究中の特定の適応の組合せに適している.新しい生物のスポンサーはFDAに生物を指定することを要求することができます
臨床開発中の製品のいつでも迅速に製品を追跡する。高速チャネル製品のスポンサーは,製品開発期間中に適用されるFDA審査チームとより頻繁なインタラクションを行う機会があり,BLAを提出すると,候補製品が優先審査を受ける資格がある可能性がある。高速チャネル製品もスクロール審査を行う資格がある可能性があり、この場合、FDAは、完全な出願を提出する前にBLAの審査部分をスクロールして考慮することができ、スポンサーがBLA部分を提出するスケジュールを提供した場合、FDAはBLAの部分を受け入れることに同意し、スケジュールが許容可能であると判断し、スポンサーはBLAの第1の部分を提出する際に任意の必要な使用料を支払うことができる。
重篤または生命に危険な疾患や状況を治療しようとする候補品も,その開発や審査を加速するための画期的な療法指定を受ける資格がある可能性がある。予備臨床証拠が、候補製品が単独で、または1つまたは複数の他の薬物または生物学的製品と組み合わせて使用されることを示す場合、候補製品は、1つまたは複数の臨床的重要終点において、例えば、臨床開発早期に観察される実質的な治療効果を示す可能性がある場合、候補製品は、画期的な治療指定を得ることができる。この指定は、高速チャネル計画のすべての機能と、第1段階で開始されたより密集したFDA相互作用および指導と、高度管理者の参加を含む候補製品開発および審査を加速する組織約束とを含む。
迅速なチャネル指定および/または画期的な治療指定を有する候補製品を含むFDA承認を提出する任意の医薬またはバイオマーケティング出願は、優先的な審査および承認の加速など、FDAが開発および審査を加速することを意図している他のタイプの計画の資格に適合する可能性がある。候補製品が満足できる代替療法なしに安全かつ有効な治療を提供する可能性がある場合、または市販されている製品と比較して、治療、診断または疾患予防において有意に改善されている可能性がある場合、候補製品は優先審査する資格がある。FDAは、優先審査として指定された新しい生物製品の申請を評価するために追加の資源を使用することを試み、審査を促進するために努力する。最初のBLASについて、優先審査指定は、FDAの目標が、60日の申請日後6ヶ月以内にマーケティング申請に行動することであることを意味する(標準審査下の10ヶ月と比較)。
さらに、深刻または生命に危険な疾患または状態の治療における安全性および有効性を研究する候補製品については、臨床利益を合理的に予測することができる代替終点、または不可逆的な発病率または死亡率の前に測定可能な臨床終点、不可逆的な発病率または死亡率または他の臨床的利益を合理的に予測することができる臨床終点に対して有効であることを決定する際に、病状の重症度、希少性または流行度、および代替治療を利用可能または不足することを考慮しながら、承認を加速することができる。承認を加速する条件として、FDAは通常スポンサーに十分かつ良好な制御を行う上場後の臨床試験を要求し、不可逆的な発病率或いは死亡率或いは他の臨床利益に対する期待影響を検証し、記述する。スポンサーが必要な上場後研究やこのような研究が予測の臨床的利益を検証できなかった場合、加速的な承認を得た製品は迅速な脱退プログラムの影響を受ける可能性がある。また、FDAは現在、承認を加速させる条件として宣伝材料を事前承認することを求めており、製品商業発売の時期に悪影響を及ぼす可能性がある。
2017年、FDAは、以下の基準に適合する任意の薬物または生物の有効な開発計画を促進し、審査を加速するための新しい再生医学高度療法(RMAT)の称号を設立し、(I)この薬物または生物は、細胞療法、治療用組織工学製品、ヒト細胞および組織製品、またはそのような治療または製品を使用する任意の組み合わせ製品として定義されているが、限られた例外的な状況である;(Ii)この薬物または生物は、深刻なまたは生命に危険な疾患または状態の治療、修正、修正または治癒を目的としている;および(Iii)の初歩的な臨床証拠は、このような薬物または生物学的製剤が、このような疾患または状態が満たされていない医療需要を解決する可能性があることを示している。RMAT指定は、FDAとより頻繁に会議を行い、候補製品の開発計画およびスクロール審査および優先審査の資格を検討することを含む画期的な治療指定のすべての利点を提供する。RMAT資格が付与された候補製品は、合理的に長期的な臨床的利益を予測する可能性のある代替物または中間終点に基づいて、または試験をより多くの場所に拡張することによって加速承認を得ることを含む、大量の臨床試験地点から得られるデータに依存する資格がある可能性もある。加速的承認を得たRMAT指定製品は、臨床証拠、臨床試験、患者登録または他の真の証拠源(例えば、電子健康記録)を提出することによって、より大きな検証性データセットを収集することによって、または治療を承認する前に、そのような治療を受けたすべての患者を承認後に監視することによって、その承認後の要求を満たすことができる。迅速チャネル指定、画期的な治療指定、優先審査, 承認の加速やRMAT指定は承認基準を変更することはないが,開発や承認過程を加速させる可能性がある.製品候補が1つまたは複数の計画の条件に適合していても、FDAは、その製品がもはや資格条件を満たしていないと後で決定するか、またはFDAの審査または承認を決定する期間が短縮されない可能性がある。
孤児薬の指定と排他性
孤児医薬品法によれば、FDAは、米国での患者数が20万人未満であるか、または米国での患者数が20万人を超えることが定義されており、米国での薬剤または生物学的薬剤の開発および提供のコストが、米国での薬剤または生物学的薬剤または生物学的薬剤の販売から回収されることが合理的に予想されていない、まれな疾患または疾患の治療のための薬剤または生物学的指定を孤児として指定することができる。BLAを提出する前に,指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、治療薬の模倣薬識別情報およびその潜在的孤児の使用を開示する。指定孤児薬は、規制審査と承認過程でいかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
米国では,孤児薬を指定することで一方が臨床試験費用,税収割引,ユーザ費用減免のために贈与資金を提供する機会などの財政的インセンティブを得る権利がある。さらに、孤児薬物指定を有する製品がその後、そのような指定された疾患を有する特定の薬剤または生物学的製剤に対するFDAの最初の承認を得た場合、この製品は、孤児製品の排他性を得る権利があり、これは、FDAが完全なBLAを含む他の出願を承認しない可能性があり、限られた場合を除いて、同じ適応の同じ生物学的製剤が7年以内に販売される可能性があることを意味する。例えば、孤児薬物排他性を有する製品に対する臨床的優位性を示すか、またはFDAは、指定された薬物の疾患または状態を有する患者の需要を満たすために十分な数の孤児薬を得ることができることを証明していないことを発見する。孤児薬物の排他性は、FDAが同じ疾患または条件のために異なる薬剤または生物学的薬剤を承認することを阻止しないか、または異なる疾患または条件のための同じ薬剤または生物学的薬剤を使用することを阻止しない。もし競争相手がFDAで定義された同じ生物製品の承認を得た場合、または私たちの候補製品が競争相手の製品に含まれると決定された場合、同じ適応または疾患のために、孤立した製品排他性も7年以内に私たちの製品が承認されることを阻止する可能性がある。
指定された孤児薬物が孤児が指定された適応よりも広い用途で承認された場合,孤児薬物の排他性を得ることはできない。さらに、FDAが後に指定要求に重大な欠陥があると判断した場合、または上述したように、第2の出願人が、その製品が孤児排他性を有する承認製品よりも臨床的に優れていることを証明する場合、または製品を承認する製造業者が、まれな疾患または疾患患者の需要を満たすのに十分な数の製品を保証できない場合、米国における孤児薬の独占営業権を失う可能性がある。
承認後に要求する
生物製品はFDAの普遍的かつ持続的な規制を受けており、その中には記録保存、副作用報告、定期報告、製品サンプリングと流通、および製品の広告と販売促進に関連する要求が含まれている。承認後、承認された製品の大多数の変更は、新たな適応または他のラベル宣言を追加するなど、FDAの事前審査および承認を経なければならない。どんな発売された製品についても、継続的な年間計画費用があります。承認された生物製品の生産および流通に関連する生物製造業者および他のエンティティは、FDAおよびいくつかの州機関にその機関を登録し、cGMP要求および他の法律に遵守することを確実にするために、FDAおよび特定の州機関の定期的な抜き打ち検査を受けなければならない。そのため、メーカーはGMPコンプライアンスを維持するために、生産と品質管理に時間、お金、労力をかけ続けなければならない。製造プロセスや施設の変更は厳しく規制されており,変更の重要性により,FDAが事前に承認して実施する必要がある可能性がある。FDAの規定では,cGMPから外れた状況を調査·是正し,報告要求を行うことも求められている。そのため、メーカーは生産と品質管理の分野で時間、お金、精力をかけ続け、cGMPやその他の法規遵守性を維持しなければならない。
規制要件や基準が守られていない場合、あるいは製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの改訂を招く可能性がある;新しい安全リスクを評価するために発売後研究または臨床試験を実施すること、またはREMS計画に従って流通制限または他の制限を実施することが可能である。他の他の潜在的な結果には
•製品の販売や製造を制限し、市場から製品を完全に撤回したり、製品をリコールしたりする
•罰金、警告状、見出しなしの手紙
•臨床試験を堅持する
•FDAは、承認されるべき出願または承認された出願の追加申請を拒否するか、または製品ライセンスの承認を一時停止または撤回する
•製品の差し押さえ、差し押さえ、あるいは製品の輸出入を許可しないことを拒否した
•法令に同意し、会社の誠実な合意に同意し、連邦医療計画の資格を取り消したり、除外したりする
•宣伝材料とラベルを強制的に修正し、訂正情報を発表する
•セキュリティ警報、親愛なるヘルスケア提供者への手紙、プレスリリース、および製品に関する警告または他のセキュリティ情報を含む他の通信;または
•民事または刑事処罰を禁令または適用する。
FDAは生物製品のマーケティング、ラベル、広告、販売促進を厳格に規制している。1社はFDAが承認したラベルの規定に基づいて、安全性と有効性、純度、効力に関する声明しか提出できない。FDAと他の機関は非ラベル用途の普及を禁止する法律法規を積極的に施行している。これらの要求を守らないことは、否定的な宣伝、警告状、改正広告、および潜在的な民事と刑事罰を招く可能性がある。FDAの制裁には、承認保留申請の拒否、承認撤回、臨床封印、警告または無タイトル手紙、製品リコール、製品差し押さえ、生産または流通の完全または部分的停止、禁止、罰金、政府契約の拒否、強制要求の是正広告、または医師とのコミュニケーション、取り締まり、原状回復、利益の返還または民事または刑事罰が含まれる可能性がある。医師は、合法的に得られた製品のための処方、製品ラベルに記載されていない使用、およびFDA試験および承認とは異なる使用のために処方することができる。このようなラベル外の使用は医学専門科でよく見られる。彼らの独立した医学的判断では、医師たちは、異なる場合、このような非ラベル使用は多くの患者の最適な治療法であると信じているかもしれない。FDAは医者が治療を選択する時の行動を規範化しない。しかし、FDAは製品ラベルの外使用問題に対する製造業者のコミュニケーションを制限した。
生体模倣薬と参考製品の排他性
2010年の患者保護および平価医療法案は、2010年に医療保健および教育調整法案(総称してACAと呼ばれる)によって改正され、生物製品価格競争および革新法案(BPCIA)と呼ばれる副題を含み、この法案は、FDA許可の参考生物製品生物と類似または交換可能な生物製品のための短い承認経路を作成する。FDAはすでにいくつかの指導文書を発表し,生体模倣薬の審査·承認方法について概説した。
生物類似性は生物製品と参照製品が安全性、純度と効力の面で臨床的に意義のある差がないことが要求され、これは分析研究、動物研究と臨床試験によって証明できる。互換性は、製品が基準製品生物と類似していることを必要とし、この製品は、任意の所与の患者において、参照製品と同じ臨床結果を生成することが期待できることを証明しなければならず、複数回投与された製品の場合、以前の投与後、生物および参照生物は、安全リスクを増加させることなく、または参照生物の独占的使用と比較して治療効果のリスクを低下させることなく、交互にまたは交換することができる。しかし、生物製品がもっと大きく、よくもっと複雑な構造及びこのような製品を製造する技術に関連する複雑性は、FDAがまだ制定している簡略化審査経路の実施に重大な障害を構成した。
BPCIAによると,生物類似製品の申請は,参考製品が初めてFDA許可を得た4年後にFDAに提出されなければならない。また、参考製品が初めて許可を得た日から12(12)年後、FDAは生物類似製品を承認することができる。この12年間の独占期間内に、FDAが競合製品の完全なBLAを承認した場合、競合製品は、その製品の安全性、純度、および有効性を証明するために、出願人自身の非臨床データと、十分かつ良好に制御された臨床試験からのデータとを含む場合、別の会社は、参照製品の競合バージョンを販売する可能性がある。BPCIAはまた、交換可能な製品として承認された生物模倣薬のためのいくつかの排他的期限を設けている。この節では,FDAが“交換可能”と考えている製品が本当に州薬剤法に管轄されている薬局に取って代わられるかどうかは不明である。
生物製品は米国でも小児科市場の排他性を得ることができる。小児科専有権が付与された場合、既存の専有期間と特許条項を6ヶ月増加させる。この6カ月間の排他性は,他の排他的保護や特許期間終了時から,FDAが発表したこのような研究の“書面請求”によって小児科研究を自発的に完成させることができる。BPCIAは複雑で説明され続けています
FDAが実施していますまた、政府の提案は12年間の参考製品専門期間を短縮しようとしている。BPCIAの他の面では,そのいくつかがBPCIAの排他的条項に影響を与える可能性があり,最近の訴訟のテーマでもある.したがって,BPCIAの最終的な影響,実行,影響は重大な不確実性の影響を受ける。
アメリカ以外の政府規制
アメリカの法規のほかに、臨床試験と私たちの製品の任意の商業販売と流通を含む他の管轄区の様々な法規の制約を受けます。生物由来の原材料は独特の汚染リスクに直面しているため、それらの使用はいくつかの国で制限される可能性がある。私たちの製品がFDAの承認を得ているかどうかにかかわらず、私たちは臨床試験を開始する前に、またはこれらの国でその製品を販売する前に、外国の規制機関の必要な承認を得なければならない。米国以外のある国にも類似したプログラムがあり,ヒト臨床試験開始前に臨床試験申請を提出することが求められており,INDに似ている。
例えば,EUでは,臨床試験申請(CTA)は各国の国家衛生当局と独立した倫理委員会に提出されなければならず,FDAやIRBのようなものである。CTAが適用の要求に応じて承認されれば,臨床試験開発は継続可能である。臨床試験を指導する要求や手順は欧州連合レベルで大きく統一されているが,国によって異なる可能性がある。いずれの場合も,臨床試験はGCPおよび“ヘルシンキ宣言”からの適用法規要求と倫理原則に基づいて行われた。臨床試験条例(EU)536/2014が2022年1月に発効した時、EUの臨床試験の方式は重大な変化が発生した。この条例は臨床試験情報システムを通じてEU全体の臨床試験評価と監視プログラムを調整し、このシステムは集中したEU門戸とデータベースを含む。
EUの監督管理制度の下で監督管理機関の研究用生物製品に対する承認を得るためには、マーケティング許可申請を提出しなければならない。米国では“BLA”を提出するための申請は欧州連合での要求と類似しているが、他を除いて具体的な国に対する文書要求である。満たされていない医療需要に対する革新製品は、EUにおいて、米国の画期的な療法指定と同様のインセンティブを提供するPrime計画のようないくつかの加速開発および審査計画を得る資格がある可能性がある。このような製品は、一般に、加速的な評価を行う資格があり、条件付き上場許可のような異なるタイプの迅速な承認から利益を得ることも可能であり、または特別な場合には、不完全な臨床データに従って付与された上場許可(それぞれ、スポンサーが合意された時間範囲内でそのようなデータを提供する可能性がある場合、または許可後も全面的なデータを得ることができない場合)である。
連合はまた市場排他性に機会を提供する。例えば、EUでは、マーケティング許可を得た後、新しい化学品実体は通常、8年間のデータ独占権と他の2年間の市場独占権を獲得する。承認された場合、データ排他性は、EUの規制機関がイノベーターのデータを参照して模倣薬または生物学的類似応用を評価することを阻止する。追加の2年間の市場独占期間内に、模倣薬或いは生物類似製品の発売許可を提出することができ、革新者のデータを参考にすることができるが、市場独占経営権が満期になる前に、いかなる模倣薬或いは生物類似製品も発売できない。しかし、一つの製品がEU規制機関によって新しい化学実体とみなされることは保証されず、製品はデータ排他性を得る資格がない可能性がある。EUで孤児に指定された製品は10年間の市場排他性を得ることができ,その間,同じ適応の類似医薬製品は市場に投入されてはならない。孤児製品はまたEUの小児科試験で追加的な2年間の市場排他性を得ることができる。いかなる補充保護証明書の延期も孤児症状の小児科試験を基礎としてはならない。
EUの“孤児薬品”の認定基準は原則的にアメリカと似ている。(EC)条例第141/2000条によれば、以下の場合、(1)生命又は長期衰弱に危険な疾患の診断、予防又は治療を目的としている場合、(2)又は(A)申請時に、EU内の影響が10,000人中5人以下である場合、又は(B)孤児の地位のメリットがなければ、EUで十分な見返りが生じず、投資が合理的であることを証明するのに十分ではない。および(3)このような疾患を満足できる診断、予防または治療する方法がEU市場で販売されていないこと、またはそのような方法が存在する場合、製品は、(EC)847/2000条例で定義されているこのような疾患の影響を受けている人に大きな利点を有するであろう。孤児医薬製品は費用を下げたり、費用を免除したり、マーケティングを許可する際に経済的奨励を受ける資格があります
許可され、承認された治療適応の10年間市場独占経営権を得る権利がある。発売許可を申請する前に、孤児薬物指定申請を提出しなければならない。孤児薬物指定が承認された場合、出願人は、上場許可申請の費用減免を受けるが、上場許可を提出したときにその指定が待っている場合は、そうではない。孤児薬物の指定は、監督審査と承認過程においていかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
5年目の終了時に、製品が指定された孤児の基準を満たしていないと判定された場合、例えば、製品の利益が十分に高く、市場排他性を維持するのが合理的であることを証明するのに十分でない場合、10年間の市場排他性は6年に減少することができる。さらに、以下の場合、同じ適応の類似製品にマーケティング許可を随時付与することができる
•第2の出願人は、その製品は類似しているが、より安全で、より効果的であり、または臨床的に優れていることを証明することができる
•出願人は,孤児の薬品の第2次出願に同意する
•申請者たちは十分な孤児薬を提供することができない。
我々が開発している遺伝子,細胞あるいは組織に基づく薬物製品は,高度治療薬製品(ATMP)を定義する科学的基準に適合すれば,EUでは高度治療薬製品(ATMP)とみなされる可能性がある。上記の薬品立法の原則は非特許薬品に適用される。すべてのATMPは、EMAのマーケティング許可を取得し、集中許可手順によって規制されなければならない。(EC)1394/2007号条例(ATMP条例)は、科学的相談費用の低減、ATMP分類プログラム(すべての開発者に適用される)、および品質および非臨床データの認証手順(中小企業のみに適用)を含む、このような製品の開発を加速させるための具体的なインセンティブを提供する。
組織および細胞が医薬製品の原料として使用される場合、私たちはまた、ヒト組織および細胞の寄贈、調達および試験、加工、保存、貯蔵および分配の基準、およびその技術実施命令、ならびに輸入組織および細胞の同等の品質および安全基準を検証するためのプログラムに関する命令2004/23/EC(ヨーロッパ組織および細胞命令)の要件を遵守する必要があるかもしれない。
EUでは、革新薬物の早期獲得メカニズム(例えばTシャツ使用計画と指定された患者用品)、定価と精算及び販売促進と広告はすべて国家法規と国家主管当局の監督を受けているため、各国の間に大きな差がある。
上記の要求を遵守しない制裁には、行政及び刑事罰が含まれる可能性があり、一般に国家レベルで確定·実行される。しかし、EUの金融処罰制度によると、EMAは中央許可医薬製品のマーケティング許可所持者がEUの薬品規則に違反した疑いがある行為を調査し、報告することができ、欧州委員会は決定を通じて、権利侵害のマーケティング許可者に重大な罰金を科すことができる。
イギリスは2020年1月31日にEUから離脱した。2020年12月31日に終了した過渡期の後、イギリスの離脱は、今後数年間、イギリスの開発、製造、輸入、承認、商業化における私たちの候補製品の規制制度に大きな影響を与える可能性がある。
EU以外の他の国,例えば東欧,ラテンアメリカ,アジアの国では,臨床試験,製品許可,定価,精算を行う要求は国によって異なる。繰り返しますが,すべての場合,臨床試験はGCPおよび“ヘルシンキ宣言”からの適用法規要求と倫理原則に基づいて行われています。
もし私たちが適用される外国監督管理要求を遵守できない場合、私たちは罰金、規制許可の一時停止または撤回、製品のリコール、製品の差し押さえ、経営制限、刑事起訴などに直面する可能性がある。
他の医療保険法
製薬会社は連邦政府およびそれらが業務を展開する州と外国の管轄区域当局の追加医療法規と法執行の制約を受け、可能性がある
財務の手配と関係を制約して、私たちはこれらの手配と関係を通じて、私たちが市場の許可を得た任意の製品を研究、販売、マーケティング、流通します。このような法律には、連邦および州のリベート、詐欺および乱用、虚偽声明、データプライバシーおよび安全、価格報告、ならびに医師および他のヘルスケア提供者の透明性に関する法律および法規が含まれているが、これらに限定されない。もし私たちの業務がこのような法律または任意の他の適用可能な政府法規に違反していることが発見された場合、私たちは行政、民事と刑事処罰、損害賠償、罰金、返還、削減または再構成業務、誠実な監督と報告義務、連邦および州医療計画から除外され、監禁されることを含む罰を受ける可能性がある。
他の事項に加えて、連邦反リベート法規は、任意の個人またはエンティティが、購入、レンタル、注文または購入の手配、レンタルまたは購入の手配、レンタルまたは注文として、Medicare、Medicaid、または他の連邦医療計画に従って精算可能な任意の物品またはサービスの見返りとして、故意に、または故意に現金または実物で直接または間接的に、公開または隠蔽的に提供、支払い、請求または任意の報酬を受けることを禁止する。報酬という単語は価値のあるものを含むと広く解釈されている。逆リベート法規は、医薬品メーカーと処方者、購入者、および処方管理人との間の手配に適用されると解釈される。いくつかの法的例外と規制避難所がいくつかの一般的な活動を保護することは起訴されない。例外および安全港は狭義であり、処方、購入または推奨される報酬を誘導するために告発される可能性があるやり方に関連し、例外または安全港の資格を満たしていない場合は審査される可能性があるが、例外および安全港は狭義であり、保護を提供するために厳格に遵守する必要がある。特定の適用された法定例外や安全港を規制するすべての要求を満たしていないことは、このような行為自体が“反リベート条例”に規定された不法行為であることを意味するわけではない。代わりに、そのすべての事実と状況の累積審査に基づいて、この手配の合法性を逐案的に評価する。
そのほか、ACAは“反リベート法規”下の意図標準と連邦“1996年健康保険携帯性と責任法案”(HIPAA)下の医療詐欺刑事法規を改正し、更に厳格な標準に達し、個人或いは実体が実際に法規或いは法規違反の具体的な意図を理解する必要がなく、違反を実施できるようにした。また,ACAは連邦虚偽申告法(FCA)(以下議論)に基づいて,連邦反リベート法規違反による物品やサービスのクレーム構成虚偽や詐欺的クレームを含む判例法を編纂している.
他の事項に加えて、FCAは、任意の個人またはエンティティが連邦政府に虚偽支払いまたは承認をもたらす虚偽クレームを意図的に提出するか、または連邦政府に虚偽または詐欺的クレームを提出するために、虚偽記録または陳述の作成、使用、または作成または使用を引き起こすことを禁止する。2009年の“詐欺法執行·回収法案”の改正により、クレームには、米国政府に提出された金銭又は財産に対する“任意の請求又は要求”が含まれている。これらの法律によると、製薬や他の医療保険会社は、顧客に製品を無料で提供するように制御されており、顧客が製品のために連邦計画に請求書を発行することを期待し、会社が製品を未承認のために販売しているため、含まれていない用途のために虚偽の声明を提出している。
HIPAAはまた、計画を故意に実行または実行しようとすることを禁止する新しい連邦刑法を制定し、虚偽または詐欺的な口実、陳述または承諾の方法で任意の医療福祉計画(個人第三者支払者を含む)が所有または制御または保管している任意の金銭または財産を詐欺または取得し、悪巧み、計画または装置によって重大な事実を偽造、隠蔽または隠蔽すること、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の重大な虚偽、架空、または詐欺的な陳述を故意に行うことを禁止する。また、多くの州で同様の詐欺や法律や法規の乱用があり、医療補助や他の州が計画して精算するプロジェクトやサービスに適用されたり、いくつかの州では支払者にかかわらず適用されている。
さらに、ACAの範囲内の連邦医師支払い陽光法案およびその実施条例は、Medicare、Medicaidまたは児童健康保険計画(いくつかの例外)に従って支払うことができる薬品、器具、生物および医療用品を定義するいくつかの製造業者に、医師(医師、歯科医、検眼師、足科医および脊椎マッサージ師を含む)、他の保健専門家(例えば、医師アシスタントおよび看護師従業員)、教育病院、およびこれらの医師およびその直系親族が所有するいくつかの所有権および投資権益を含むいくつかの支払いまたは他の価値移転に関する情報を毎年報告することを要求する
私たちはまた連邦政府と私たちが業務を展開している州のデータプライバシーと安全規制の制約を受ける可能性がある。HIPAAは“経済と臨床健康を促進する衛生情報技術法案”(HITECH)及びその実施条例の改正後、保険実体に対して要求を提出し、ある医療保健提供者、健康計画、医療情報交換所及びそのそれぞれの業務パートナー、これらの実体の作成、受信、
個人が健康情報を識別することができるプライバシー、セキュリティ、および送信に関連する個人識別可能な健康情報を維持または送信するために、またはその保証エンティティおよびその保証下請け業者を代表する。他の事項に加えて、HITECHは、保護された健康情報を受信または取得するために、カバーエンティティに代わってサービスを提供する商業パートナー、独立請負業者、またはエージェントに、HIPAAのプライバシーおよびセキュリティ基準を直接適用させる。HITECHはまた4つの新しい民事罰金等級を作成し、HIPAAを改訂し、民事と刑事処罰を商業パートナーに直接適用し、州総検察長に新しい権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償または禁止令を要求して連邦HIPAA法を執行し、連邦民事訴訟に関連する弁護士費と費用を求めることができる。また,州法は特定の場合に健康情報のプライバシーやセキュリティを管理しており,その多くの法律は互いに大きく異なり,同様の効果が生じず,コンプライアンス作業を複雑にする可能性がある。
製品を商業的に流通させるためには、州の法律を遵守し、州の薬品メーカーと卸売業者に登録を要求しなければならない。いくつかの州では、これらのメーカーまたはディーラーがその州に営業場所がなくても、製品をその州のメーカーおよびディーラーに輸送することを含む。一部の州はまた、メーカーと流通業者が流通チェーン中で製品の系統を確立することを要求しており、いくつかの州はメーカーと他の州に流通チェーン中の製品の流れを追跡し追跡できる新しい技術を採用することを要求している。いくつかの州はすでに立法を公布し、製薬会社にマーケティングコンプライアンス計画を確立し、州政府に定期報告を提出し、医師および他の医療保健提供者に支払う販売、マーケティング、定価、追跡および報告プレゼント、報酬および他の報酬、臨床試験および他の活動を定期的に公開開示し、および/またはその販売代表を登録し、薬局および他の保健実体が製薬会社に販売およびマーケティングのためのいくつかの医師処方データを提供することを禁止し、いくつかの他の販売およびマーケティング行為を禁止する。私たちのすべての活動は連邦と州消費者保護と不正競争法によって制限されるかもしれない。
私たちの業務が上記の任意の連邦および州医療保健法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは、MedicareとMedicaid、禁止、個人通報者が政府の名義で提起した個人訴訟、または政府契約、契約損害、名声損害、行政負担、利益減少および将来の収入減少、ならびに私たちの業務の削減または再編を含む、民事、刑事および/または行政処罰、損害賠償、罰金、返還、監禁、MedicareおよびMedicaid、禁止、個人通報者の政府名義での個人訴訟を含む重大な処罰を受ける可能性があります。いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります
保証と精算を請け負う
任意の製品の販売は、連邦、州と外国政府医療保健計画、商業保険とホスト医療組織、および第三者支払人のこの製品に対する清算レベルなど、第三者支払者のこの製品に対する保証程度にある程度依存する。提供されるべき補償範囲と金額に関する決定は個々の計画に基づいて行われる。第三者支払人の精算は多くの要素に依存する可能性があり、第三者支払人が1種の製品が安全、有効と医学上必要であることを決定すること;特定の患者に適している;コスト効果がある;同業者が審査した医学定期刊行物の支持を得ること;臨床実践ガイドラインに含まれる;及び美容製品でもなく、実験製品でもなく、研究製品でもない。第三者支払者はまた、私たちの治療を清算する前に、いくつかの一連の治療を完了または失敗することを要求することができる。新薬精算に関する主な決定は通常医療保険と医療補助サービスセンター(CMS)によって行われ,このセンターは米国衛生·公衆サービス部(HHS)の一機関である。CMSは製品がどの程度連邦医療保険の下でカバーと精算されるかを決定し、個人支払者はしばしばCMSに大きく従う。第三者支払者は、彼らがどの製品と手続きをカバーし、精算レベルを確立するかを決定する。第三者支払者が特定の製品やプログラムをカバーしても、それによる精算支払率が十分高くない可能性がある。これらの第三者決済者は医療製品、薬品、サービスの保証と精算をますます減少させている。また、米国政府、州立法機関、外国政府は価格制御を含むコスト制御計画を実施し続けている, カバー範囲と精算の制限、及び後発薬の代替に対する要求。価格制御及びコスト制御措置、並びに既存の制御及び措置を講じている司法管区において、より限定的な政策をとることにより、任意の製品の販売をさらに制限することが可能となる。いかなる製品の第三者精算または第三者支払者が製品を保証しないことを決定することは、医師の使用量や患者の製品に対する需要を減少させ、販売に実質的な悪影響を及ぼす可能性がある。
医療改革
米国では,ACAは2010年3月に公布され,政府と民間保険会社が医療保健に資金を提供する方式を大きく変更し,製薬業に重大な影響を与えた。ACAには、連邦医療計画の登録、補償調整、および詐欺および乱用の法律の改正を含むいくつかの条項が含まれている。例えば、ACA:
•ブランド医薬品メーカーが支払うべき医療補助税還付の最低水準を平均メーカー価格の15.1%から23.1%に引き上げた
•医療補助管理保健機関が支払った薬品の要求に対してリベートを請求する
•メーカーに保険ギャップ割引計画に参加することを要求し、この計画によると、彼らは保険ギャップ中に条件を満たす受益者に適用ブランド薬品交渉価格の70%の販売時点割引を提供することに同意しなければならず、メーカーの外来薬が連邦医療保険Dで部分的にカバーされる条件として同意しなければならない
•指定された連邦政府プロジェクトで“ブランド処方薬”を販売する薬品メーカーまたは輸入業者に差し引かれない年会費を徴収する
•公共衛生サービス薬品の価格設定計画の下で割引を受ける資格のある実体を拡大する
•新しい患者を中心とした結果研究所を創立し、監督、優先事項を確定し、臨床治療効果の比較研究を行い、そしてこのような研究に資金を提供する。
ACAのいくつかの側面は行政、司法、そして国会の挑戦を受けている。例えば、2019年1月1日からACAが1年の全部または一部の期間に合格健康保険を維持できなかった個人に対する税金ベースの分担責任支払いを廃止する条項を含む税法が公布され、これは一般に“個人強制”と呼ばれる。2021年6月17日、米国最高裁は、ACAは全体的に違憲であり、“個人権限”が国会で廃止されたため、プログラム理由に基づく挑戦を却下した。総裁·バイデンは,ACA市場による医療保険の獲得を目的とした2021年2月15日から2021年8月15日までの特殊保険期間を開始する行政命令を発表した。行政命令はまた、特定の政府機関に、医療補助モデルプロジェクトおよび免除計画の再審査、および医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策を含む医療補助モデルプロジェクトおよび免除計画の再審査および見直し、医療補助またはACAによる医療保険のカバー範囲を制限する既存の政策およびルールを再検討するように指示する。また、2022年8月16日、総裁·バイデンは2022年インフレ削減法案(アイルランド共和軍)に署名し、法律にした, ACA市場で医療保険を購入した個人への増強補助金を2025年に延長する。2025年からアイルランド共和軍は新たに設立されたメーカー割引計画により、受益者の最大自己負担コストを著しく低減し、連邦医療保険D部分計画下の“ドーナツの抜け穴”を解消した。ACAは未来に司法や国会で挑戦される可能性がある。バイデン政府のこのような追加的な挑戦や医療改革措置がACAと我々の業務にどのように影響するかはまだ不明である。
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。2011年8月2日、2011年予算制御法などには、2013年から会計年度ごとに提供者に支払われる連邦医療保険総額が2%減少し、2031年まで有効になることが含まれている。しかし,新冠肺炎の救済立法は2020年5月1日から2022年3月31日までの2%の連邦医療保険自動減額を一時停止した。現在の立法によると、医療保険支出の実際の減少幅は2022年の1%から本自動減額の最終年度の4%まで様々になる。2013年1月、“2012年米国納税者救済法”が署名され、病院、画像形成センター、がん治療センターを含むいくつかの医療サービス提供者に支払う医療保険をさらに減少させ、医療サービス提供者への多額の支払いを政府が取り戻す訴訟時効を3年から5年に延長した。
最近、政府は製薬会社がその上場製品の価格設定の方式をより厳格に審査し、いくつかの国会調査と提案された連邦立法、および州政府の努力を招き、これらの努力は製品定価の透明性の向上、連邦医療保険制度下の処方薬のコストの低減、定価とメーカー患者計画との関係の審査、政府計画の薬品の精算方法の改革を目指している。また,アイルランド共和軍(IRA)は他の事項を除いて,(1)HHSに連邦医療保険(Medicare)で覆われたある単一由来薬物と生物製品の価格について交渉するよう指示し,(2)連邦医療保険B部分とD部分にリベートを徴収し,インフレを超える価格上昇を懲罰するよう指示した。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。アイルランド共和軍がどのように実施されるかは不明だが、製薬業に大きな影響を及ぼす可能性がある
また、バイデン政府は2022年10月14日に追加の行政命令を発表し、HHSに90(90)日以内に報告書を提出するよう指示し、連邦医療保険と医療補助革新センターをさらに利用して連邦医療保険と医療補助受益者の薬品コストを下げる新しいモデルをテストすることを説明した。この行政命令や同様の政策措置が将来的に実施されるかどうかは不明である。州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入の制限、マーケティングコスト開示および透明性措置を含む、医薬品および生物製品の価格設定を制御するための法規を立法および実施することが増えており、場合によっては、他の国からの輸入および大量購入を奨励することを目的としている。
これらの新しい法律は、私たちが承認された任意の製品のカバー範囲と価格を追加の下振れ圧力に直面させ、私たちの業務を深刻に損なう可能性があると予想しています。医療保険や他の政府が計画している精算のどの減少も、個人支払者の支払いのような減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、または私たちの製品を商業化することを阻止するかもしれません(承認されれば)。さらに、さらなる立法や規制がある可能性があり、私たちの業務、財務状況、運営結果を損なう可能性があります。例えば、政府は新冠肺炎の流行に対応するためにより多くの行動をとる可能性がある。
その他のプライバシーとセキュリティ法
私たちが設立した司法管轄区で、私たちの製品を販売したり、販売したり、臨床試験を行ったりする司法管轄区は、プライバシー法の制約を受けるかもしれません。例えば、ヨーロッパでは、個人データ(すなわち、識別可能な生きている個人に関連するデータ)を収集、制御、処理、および他の方法で使用することにおいて、(EU)2016/679号条例、すなわち一般データ保護条例(GDPR)を遵守する必要がある可能性がある。GDPRは各EU加盟国に直接適用されるが、EU加盟国は、個人データ(健康および医療情報を含む)を収集、使用、共有する能力を制限することができる制限、またはコンプライアンスコストの増加をもたらす可能性があり、最終的には私たちの業務に悪影響を及ぼす可能性があることをさらに導入することができると規定している。
GDPRは重い問責義務を規定し,データ管理者と処理者にそのデータ処理の記録を保持し,その権限のプライバシー管理枠組みの一部として政策を実施することを求めている.また、データ制御者に透明性を要求し、データ当事者に(簡潔で分かりやすく、入手しやすい形式で)彼らの個人情報をどのように使用し、個人データの保持に制限を加えること、仮名(すなわちキーコード)データを定義すること、強制的なデータ漏洩通知要求を導入すること、およびデータ制御者のためにより高い基準を設定して、彼らがいくつかのデータ処理活動について有効な同意を得たことを証明することを要求する。私たちが設立したりGDPRに拘束されているEU司法管轄区では、私たちは現地のデータ保護当局によって監視されている。GDPR違反のいくつかの行為に対する罰金額は大きい:最大2000万ユーロまたは世界の年商総額の4%に達する。また、連合王国が2020年1月31日にEUを離脱した後、連合王国とEUとの間で合意された移行計画によると、GDPRと連合王国で実施されたGDPRを遵守しなければならず、各制度は最高2000万ユーロ/GB 1700万ユーロまたは世界売上高の4%の罰金を科すことができる。データ保護法のいくつかの点で連合王国とEUの関係はまだ不明であり、EU加盟国と連合王国との間のデータ転送をどのように扱うかを含む。このような変化は追加的なコンプライアンス費用をもたらす可能性があり、私たちの全体的なリスクを増加させるかもしれない。上記に加えて、GDPRまたは他の適用可能なプライバシーおよびデータ保護法律および法規の違反は、規制調査につながる可能性があります, 名誉損害、停止/変更データを使用する私たちの命令、執行通知、または潜在的な民事クレームは、集団訴訟タイプの訴訟を含む。
さらに、GDPRは、国境を越えたデータ転送の制限を含む。EUの法的手続きのため、GDPR下の国境を越えたデータ転送のいくつかの態様は不確定であり、EU-米国プライバシー盾の無効を宣言し、標準契約条項の有効性と合法性をある程度疑問視するEU裁判所の最近の裁決を含む。これは国境を越えた個人データの移動の複雑さを増加させるかもしれない。GDPRは、GDPRに拘束された個人データの処理における私たちの責任と責任を増加させ、個別の国で実施されるメカニズムを含むGDPRの遵守を確保するための追加的なメカニズムを確立する必要があるかもしれません。私たちはまた、個人データをEUと欧州経済地域(EEA)に国境を越えて移転することに関するEUの規則に制約されている。EUの最近の法律発展は、個人データをヨーロッパ経済圏から米国に移す複雑性と不確実性をもたらした。2020年7月16日,欧州連合(CJEU)裁判所はEU·米国プライバシー盾枠組み(Privacy Shield)の無効を宣言し,この枠組みにより,個人データは欧州経済局からプライバシー盾計画に基づいて自己認証された米国実体に移行することができる。CJEUは、いくつかの条件下での標準契約条項(欧州委員会によって適切な個人データ伝送機構として承認された標準契約形態)の十分性を主張しているが、将来の規制指導は、標準契約条項の使用を変化させる可能性がある。監督部門がさらなる個人指導意見を発表するにつれて
標準契約条項を使用することができず、および/または法執行行動を開始できない場合を含むデータ出力機構は、追加コスト、クレームおよび/または規制調査または罰金を受ける可能性があり、および/または、私たちが業務を展開している国と地域との間で個人データを転送することができない場合、サービスを提供する方法、地理的位置、または私たちの関連システムおよび業務の分離に影響を与え、私たちの財務業績に悪影響を及ぼす可能性がある。
また、イギリスはEU離脱、つまりイギリスの離脱に賛成票を投じ、イギリスのデータ保護規制に不確実性をもたらした。具体的には、2018年データ保護法は2018年5月23日に王立で承認され、イギリスで施行されているが、イギリスのデータ保護では、欧州経済区からイギリスにデータを移すなど、まだ確定していない。“移行期間”期間(すなわち2020年12月31日まで)には、EU法はGDPRを含む連合王国に適用され続け、その後GDPRは連合王国法に変換される。2021年からイギリスはGDPRの枠組みの下で3番目の国になる。
さらに、カリフォルニアは“カリフォルニア消費者プライバシー法”(CCPA)を公布し、カリフォルニアの消費者のために新しいプライバシー権(法律で定義されているような)を創造し、消費者または家庭のある個人データを処理するエンティティにより多くのプライバシーと安全義務を加えた。CCPAは、カバーする会社が、そのような会社がデータを収集、使用、および共有する方法に関する新しい開示を消費者に提供し、これらの消費者に、特定の販売からの撤退または個人情報の移転を選択する新しい方法を提供し、消費者に追加の訴訟理由を提供することを要求する。CCPAは、違反行為に対する民事処罰と、いくつかの個人情報損失を招くデータ漏洩行為に対する個人訴権を規定している。このような個人的な訴権はデータ流出訴訟の可能性と関連リスクを増加させるかもしれない。CCPAは2020年1月1日に施行され、(I)カリフォルニア総検察長の執行を許可し、各違反(すなわち、1人当たり)に2500ドルの罰金、または毎回故意に違反して7500ドルの罰金を科し、(Ii)特定のデータ漏洩の法定損害賠償を取り戻すために個人訴訟を許可する。また,米国の全50州の法律は,個人情報がデータ漏洩により漏洩した消費者に企業に通知を要求している.州法は急速に変化しており,米国議会は新たな包括的な連邦データプライバシー法を検討しており,それが可決されればこの法の制約を受けることになる。CCPAは我々の業務活動に影響を与える可能性があり,個人データや保護された健康情報に関する変化する規制環境における我々の業務の脆弱性を示している。また、カリフォルニア州は最近“カリフォルニアプライバシー権法案”(CPRA)を可決した。CPRAは、追加の消費者権利プログラムを含む、カバーされた企業に追加のデータ保護義務を課す, データ使用の制限、高リスクデータに対する新しい監査要求、および敏感なデータを選択するためのいくつかの用途。また、新たなカリフォルニア州データ保護機関を作成し、実質的な法規の発行を許可し、プライバシーや情報セキュリティ法執行の強化につながる可能性がある。大部分の条項は2023年1月1日に施行され、追加のコンプライアンス投資と潜在的なビジネスプロセスの変化が必要になる可能性があります。
アメリカの“海外腐敗防止法”
米国の1977年の“反海外腐敗法”(FCPA)は、いかなる米国の個人または企業がいかなる外国人官僚、政党または候補者に任意の価値のあるものを支払い、提供または許可するか、または任意の価値のあるものを提供することを禁止し、個人または企業が業務を獲得または保留するのを助けるために、外国実体の任意の行為または決定に影響を与えることを目的としている。“海外腐敗防止法”はまた、米国に上場する証券会社に会計条項を遵守することを要求し、企業(国際子会社を含む)のすべての取引を正確かつ公平に反映した帳簿や記録を保存し、国際業務のために適切な内部会計制御システムを設計·維持することを要求している。
従業員と人的資本管理
私たちの使命は
我々は臨床段階T細胞再プログラミング会社であり,固形腫瘍癌患者の生活を改善するための新たな細胞療法の開発に取り組んでいる。私たちは、すべての人が自分の仕事をして、自分をしっかりして、個人や職業ですくすくと成長できるような環境を作るために努力しています。私たちの文化は革新的な科学に根ざし、卓越を要求している。患者はより良い治療法を待っており,このようなニーズが重要な使命を実現させる緊迫感を駆り立てている
我々の価値観は
私たちと私たちの従業員が私たちの核心価値観を私たちの使命と一致させると、成功が来ると信じています。私たちの使命は私たちの画期的な科学を患者の生活を変える可能性のある薬に変えることです。私たちの核心的価値観は
• 科学:私たちは最も重要な努力に集中して実行する。
• 勇気!勇気:私たちは大胆で違う方法で考えて行動したい。
• 尊敬する:私たちは直接的で透明で正直な理解とコミュニケーションを求めている。
• 協力する:私たちはチームを越えて協力して、私たちの最も挑戦的な問題を解決して、絶えず改善して勉強します。
私たちの従業員
私たちは職員たちを使命を履行する貴重な資産と見なしている。私たちは競争の激しいバイオテクノロジー業界で競争し、才能のある従業員を誘致、維持、育成することは、私たちの戦略と私たちの効果的な競争の能力に重要である。現在の研究、製品開発、製造努力を支援し、将来的に候補製品を商業化する計画(承認されれば)を支援するために、私たちの組織の規模を拡大する必要があります。この成長は私たちの成功に必須的だ。現在,細胞療法薬を発見·開発·製造する豊富な経験を持つ熟練者が不足しており,この状況が続く可能性がある。データキャプチャや分析,機械学習,人工知能などの分野でも業務を行っている.そのため、人材に対する競争は非常に激しく、離職率が高い可能性がある。我々は多くの生物製薬会社と学術機関や技術会社との間でこれらのスキルを持つ個人を争う激しい競争に直面している
2022年12月31日現在、私たちは274人の従業員を持っており、そのうちの75%以上が研究開発活動、技術運営と過程科学に従事している。私たちの従業員はスキルが高く、多くの人が高度な学位を持っている。私たちの多くの従業員は細胞療法を開発した経験がある。私たちのほとんどの職員たちはカリフォルニア州とワシントン州にいる。私たちの従業員たちは集団交渉協定の制約を受けないし、労働組合の代表者たちにも影響を受けない。私たちは私たちが従業員と仲がいいと思う。
職員たちを発展させることは重要で、私たちは訓練と発展と昇進の機会を提供することに集中している。学習と発展、訓練と職業発展は従業員を維持するために不可欠な一部である。私たちは定期的に人材討論を行い、その中には職能と役割レベルにまたがる昇進周期が含まれている。2022年、私たちは役割の位置づけ、能力、キャラクターのレベルと能力によって育成及び発展計画を含む全面的な人材管理枠組みを作成した。
設立以来、私たちの従業員流動率はアメリカ生命科学業界とカリフォルニア州北部と太平洋北西部に位置する生命科学会社の平均水準を下回ってきた。私たちが拡大している業務と、私たちの業務を支援するために従業員数をさらに増加させることを考慮して、従業員の流動率、募集計画、報酬と福祉計画、重要な実験室の仕事を実行する安全性、多様性、その他の人的資本管理に関する事項を評価し、定期的に取締役会と一緒に結果を審査します。
私たちの報酬と福祉は
私たちの業界の高度な競争性と従業員の採用と維持の成功に対する重要性を考慮して、私たちは私たちの従業員に競争力があると考えられる包括的な報酬、福祉、サービスの一括奨励案を提供するように努力しています。このパッケージには、競争力のある市場報酬、従業員と家族の医療福祉、柔軟な支出口座、有給休暇福祉、帰省休暇、柔軟な勤務時間、柔軟な勤務先、401(K)マッチング、従業員支援計画、および新しい健康計画が含まれている。また、私たちは株式オプションと制限株式単位を付与することで従業員に会社の持分所有権のメリットを提供します。私たちの従業員は従業員の株式購入計画に参加する資格があり、この計画は15%の割引で私たちの普通株を購入する機会を提供します。
多様性、帰属感、包括性、公平に対する私たちの約束
私たちは多様な職場で、すべての従業員が差別、嫌がらせ、偏見、偏見のない包容環境ですくすくと成長できると信じている。私たちの目標はすべての人を尊重して尊重し、すべての従業員に平等な機会と公平な待遇を提供することだ。多様性と包括性を抱擁することで、私たちの価値観に合った革新的な解決策を協力開発し、私たちの使命を達成することを支援する組織を作ることを求めています。多様化、公平と包容の心理状態と文化は積極的に参加し、責任を果たす職場に重要であるだけでなく、著者らが助けを求める患者の薬物需要を理解し、満足させるためにも重要である。
我々の行政指導チームの支持の下で、著者らは2020年に多元化、帰属感、包容性と公平性(DBIE)ワーキンググループを招集し、異なる従業員から構成され、ライルのより大きな多様性、帰属感、包容性と公平性を促進するために、具体的な計画の設計と実施を担当した。また、経験豊富なDBIEコンサルタントを招聘し、専門知識と外部基準に基づいて、DBIEの新しい措置の設計と計画についてアドバイスを提供した。DBIEワーキンググループはDBIEの宣言,枠組み,戦術計画を正式に決定し,DBIEの重要性へのコミットメントを進めた.2022年には,いくつかのDBIE講演者活動を提供し,包摂性@Lyellを導入した
また,同センターでは研修コースを開催し,Textioを利用して役割説明やポスト発表における性別偏見を減少させ,いくつかの新たな招聘源を試み,応募者人材バンクをさらに多様化している。これまでの進展を誇りに思っているにもかかわらず、関連研修を継続し、同様の状況の会社のベストプラクティスについて指導していきます
2022年12月31日現在、私たちの従業員自己報告は約49.3%が女性であり、47.4%の従業員が自己報告は人種または人種多様性であり、その中の33.6%はアジア系、4.0%は黒人またはアフリカ系アメリカ人、6.2%はスペイン系またはラテン系、3.6%は他の少数集団または2つ以上の人種である。
私たちは公正な給与慣行、私たちの給与慣行と理念も定期的に検討されると信じている。私たちは市場と基準データに基づいて報酬の構成要素と範囲を決定する。このような背景から、私たちは、すべての従業員の報酬を合理的な範囲で公平に支払うように努力し、役割、市場データ、内部公平、勤務先、関連経験、個人および会社の業績などを考慮する。私たちは少なくとも毎年個別従業員と全従業員に対する私たちの給与決定を検討して分析する。2022年には、独立した外部会社を招いて報酬公平分析を行い、分析結果は、私たちの報酬やり方と構造が公平であることを示していると考えられます。もし私たちが不合理な報酬格差が私たちの給与理念と一致しないことを発見したら、私たちは私たちが述べた理念と行動の間の忠誠度を保証するために適切な行動を取るつもりだ
従業員の安全と新冠肺炎
従業員の安全と福祉はどの年も私たちにとって重要であり、新冠肺炎疫病の絶えずの変化と持続的な影響を考慮して、2020年以来ずっと私たちが特に注目している問題である。疫病に対応するために、私たちは安全、コミュニケーションと投資を通じて私たちの従業員と政府が新冠肺炎の疫病を抑制するための努力を支持した。
私たちの最優先順位の中の一つは私たちの従業員、パートナー、そして地域社会の健康と福祉を保護することだ。私たちの従業員は柔軟な方法で私たちのオフィスに戻ってきましたが、すべての従業員とほとんどの他の現場に来た第三者はワクチンの全面接種を要求されました。我々は,高接触域の清掃を増加させ,手消毒ステーションを提供し,必要に応じて限られた現場契約追跡を行うなど,実際と新冠肺炎が疑われる症例や潜在的なリスク曝露に対応するための厳しい手順を継続し,近い将来このような対策を継続する予定である。
われわれは引き続き新冠肺炎の疫病を密接に監視し、世界保健機関を含む提案された抑制と緩和措置に従うよう努力している疾病管理·予防センター(アメリカ疾病コントロールと予防センター)、職業安全と健康管理局(OSHA)、カリフォルニア州とワシントン州(その州OSHA計画を含む)と適用される県
利用可能な情報
私たちのサイトの住所はwww.lyell.comです。我々は,Form 10−Kの年次報告,Form 10−Qの四半期報告,Form 8−Kの現在の報告,および取引法第13(A)および15(D)条に基づいて提出または提出された報告の修正案を提出する。米国証券取引委員会は、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の情報を含むウェブサイトをwww.sec.govに掲載している。私たちはまた、米国証券取引委員会にこのような資料を提出または提供した後、合理的に実行可能な場合に、できるだけ早く私たちのサイト上の投資家関係ページを介して、Form 10-K、Form 10-Q、Form 8-Kに関する報告書およびこれらの報告書の修正を無料で取得することができます。
また、当社のサイト上の投資家関係ページを重要な会社情報を配信するルートとして使用しています。重要な情報は、プレスリリース、アナリストプレゼンテーション、当社の財務情報、およびコーポレートガバナンス情報を含み、当社のサイトの投資家関係ページに定期的に公開され、アクセスすることができます。私たちのサイト上の情報や私たちのサイトを介してアクセスできる情報は、本10-Kフォーム年次報告の一部ではなく、私たちのサイトアドレスを含めて非能動的なテキスト参照にすぎません。
第1 A項。リスク要因
私たちの業務は重大な危険と関連があり、その中のいくつかの危険は以下のように説明される。以下に説明するリスクおよび本Form 10-K年度報告書に含まれる他の情報は、我々が監査した総合財務諸表および監査されていない総合財務諸表および関連する説明および“経営層の財務状況および経営結果の検討および分析”と題する節をよく考慮しなければならない。次のいずれの事件や事態が発生しても、私たちの業務、財務状況、経営結果、成長の見通しを損なう可能性があります。この場合、私たちの普通株の市場価格は下落する可能性があり、あなたは投資の全部または一部を失うかもしれない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務運営を損なう可能性がある。
私たちの財務状況、限られた経営歴史、追加資本需要に関連するリスク
われわれは早期臨床段階の生物製薬会社であり,設立以来大量の損失が発生しており,予想される将来,大量かつ増加していく純損失を受け続けると予想される。
生物製薬製品開発への投資は非常に高い投機性があり、それは大量の前期資本支出を必要とし、及び候補製品は有効であることを証明できず、監督管理の許可を得られない或いは商業上実行可能な重大なリスクがないからである。私たちは初期臨床段階の生物製薬会社であり、規制部門の承認を得る製品は何もなく、私たちの持続的な運営に関する巨額の研究、開発、その他の費用が発生しており、このような費用が引き続き発生すると予想されている。設立以来、私たちは製品販売から何の収入も得られず、重大な純損失が発生した。成立以来,我々のほとんどの純損失は,我々の研究開発計画と我々の運営に関する一般的かつ行政コストによるものである。2022年12月31日までの累計赤字は7億675億ドル。
予測可能な未来に、私たちは製品販売から収入を得られないことが予想されます。もしあれば。私たちは予測可能な未来に巨額の費用と運営損失が続くと予想している。我々が引き続き研究,開発,我々の候補製品に対する規制機関の承認を求め,我々の製造能力を拡大し,許可を得たり,より多くの技術を獲得したりし,規制機関の承認を得る可能性のある候補製品の商業化を開始する可能性があり,これらの損失が増加すると予想される。私たちは予測できない費用、困難、合併症、遅延、および私たちの業務に悪影響を及ぼす可能性のある他の未知の要素に直面するかもしれない。私たちの将来の純損失の規模は私たちの未来の支出の成長率と私たちの収入を創出する能力にある程度依存するだろう。また、私たちの純損失は四半期ごとや毎年大きく変動する可能性があるため、私たちの運営結果を期間比較することは、私たちの将来の業績の良い指示ではないかもしれません。もし私たちの候補製品が研究開発や臨床試験で失敗した場合、あるいは規制部門の承認を得なかった場合、あるいは承認され、市場の承認を得られなかった場合、私たちは決して利益を上げないかもしれない。私たちが未来に利益を達成しても、私たちはその後の時期に利益を維持できないかもしれない。
私たちは予測可能な未来に、私たちの費用と運営損失が大幅に増加すると予想する。費用の予想増加は私たちが行っている活動によって大きく推進されるだろう
•現在と未来の候補製品の非臨床開発を継続し、他の非臨床研究を開始する
•私たちの現在と未来の候補製品の臨床試験を始め続けています
•私たちの遺伝とエピジェネティック再プログラミング技術や他の研究と開発努力を進めています
•人材を誘致し、採用し、引き留める
•私たちの現在と未来の候補製品に対する規制部門の承認を求める
•私たちの製造と技術開発能力を拡大し
•私たちの運営、財務、管理システムを拡大し、
•技術や技術プラットフォームを買収し許可することです
•私たちの知的財産権の組み合わせを発展させ、保護し、守っていく
•当社の業務を運営する際には、上場企業の運営に関連する追加コストを含む追加の法律、会計、または他の費用が発生します。
私たちは急速に発展した分野で運営されており、運営の歴史が限られており、私たちの業務のこれまでの成功を評価し、私たちの将来の生存能力を評価することは難しいかもしれない。
私たちは急速に発展している分野で運営しており、2018年6月に運営を開始して以来、運営履歴が限られており、私たちの業務や将来性の評価が困難になっています。これまで、私たちの主な活動は、T細胞療法の開発、研究と開発、技術の獲得、戦略的協力と許可合意の達成、私たちの候補製品開発を支援する製造活動の支援と実行、会社員の組織と配備、業務計画、私たちの知的財産権の組み合わせの構築、規制書類やその他の準備作業を提出し、臨床試験を開始し、資金を調達し、これらの活動に一般的かつ行政的な支援を提供してきた。私たちの将来の成功、業績、生存能力のどのような予測も、私たちがより長い運営歴史や市場で承認された製品を持っているほど正確ではないかもしれない。
また、私たちは予見できない費用、困難、合併症、遅延などの既知と未知の要素に直面する可能性がある。私たちはある時点で研究開発に集中している会社からビジネス活動を支援できる会社に転換する必要があります。そのような移行で、私たちは成功しないかもしれない。私たちは期待しています
様々な要因により、財務状況や経営業績は四半期間や年度間に大幅に変動し続け、その多くの要因は制御できない。したがって、私たちのどの四半期や年間業績も未来の経営業績を予測することはできません。
私たちは現在販売されている製品を承認していないし、製品販売から収入を得たこともない。私たちは製品販売から収入を得ないかもしれないし、利益を達成しないかもしれない。
今まで、私たちは製品販売から何の収入も得ていません。私たちが製品販売から収入を得て利益を達成する能力は、私たちが候補製品の開発に成功し、その後規制部門の承認を得て商業化する能力にかかっています。私たちが収入を創出し利益を達成する能力は他の多くの要素にも依存しています
•臨床試験でさらに研究できる技術と製品を決定するために、私たちの研究活動を成功させた
•必要な臨床試験を含めて開発活動に成功した
•FDA、欧州薬品管理局(EMA)あるいは他の機関に監督意見書を提出し、監督管理部門の商業市場への適応の許可を得た
•政府と個人支払者を含む第三者から保険と適切な補償を受ける
•私たちの製品のために商業的に可能な価格を設定します
•私たちの候補製品のための製造と流通プロセスを開発し
•受け入れ可能なコストレベルで私たちの製品を大量に生産します
•所望の出発材料および試薬を含む十分な候補製品供給を維持すること;
•世界の法律の要求に適合する方法で、または必要な程度に私たちの候補製品の供給を維持する
•信頼できる第三者と生産関係を構築し維持します
•私たちの製品を市場に認めてくれます
•人材を誘致し、採用し、引き留める
•知的財産権の組み合わせにおける私たちの権利を保護します
•私たち自身が商業化された市場で販売する任意の製品を選択することができるビジネス組織を構築し
•適切な流通パートナーを探して、私たちが承認した製品を他の市場でマーケティング、販売、流通するのを助けてくれます。
私たちが規制の承認を受けた任意の製品の収入は、私たちが規制の承認を受けた地域の市場規模、製品の受け入れ可能な価格、任意の価格で補償を受ける能力、および私たちがその地域の商業権を持っているかどうかに部分的に依存するだろう。しかも、私たちはどんな承認された製品の商業化に関連したコストが高いと予想する。そのため、製品販売から収入を得ても、利益が得られない可能性があり、運営を継続するために追加資金が必要かもしれません。もし私たちが利益を上げることができない場合、あるいは持続的に利益を上げることができなければ、計画通りに運営を続けることができず、運営を減らすことを余儀なくされる可能性がある。
私たちは私たちの目標を達成するために大量の追加資本が必要になり、必要な時に必要な資本を得ることができなければ、私たちの製品開発や商業化努力を延期、制限、減少、または中止させる可能性があります。
著者らは予測可能な未来に大量の資源を費やして、著者らの研究ルートを推進と拡大し、非臨床研究を行い、そして著者らの候補製品の臨床開発と製造に力を入れることを望んでいる。私たちはまた私たちの技術プラットフォームの発展に資源を投入し続ける予定だ。これらの支出には,研究開発に関連するコスト,可能な新技術を得ることが可能であり,非臨床研究や臨床試験を行うこと,規制部門の承認や製品の製造,販売が許可されている製品(あれば)を得ることが可能である。私たちはまた、どんな製品を販売、マーケティング、流通できるビジネス組織を発展させるために大量の資金を投入する必要があります。もしあれば、私たちは商業化された市場で自分自身を販売することを選択するつもりです。さらに、私たちの許可および協力協定によると、私たちは私たちのSuccess支払いプロトコルおよび他のまたは対価格支払いに関連する多くのお金を支払う必要があるかもしれない。私たちの計画と期待される臨床試験の設計と結果は高度に不確定であるため、私たちは合理的に
我々の潜在候補製品の発見,開発,商業化に必要な実際の金額を成功させることは,他の予期しないコストが生じる可能性があると予想される。
2022年12月31日現在、私たちは約7.103億ドルの現金、現金等価物、有価証券を持っている。支出タイミングおよび勤勉な支出管理の結果として、私たちの既存の現金、現金等価物、および有価証券は、2026年までの運営資本と資本支出需要を満たすのに十分であると信じている。しかし、私たちの将来の資本需要と私たちの既存資源が私たちの運営を支持する時間は、私たちが予想しているのとは大きく異なるかもしれませんが、いずれにしても、私たちは現在の任意のプロジェクトの臨床開発を完成させるための追加の資本が必要になります。
私たちは約束された外部資金源を持っていない。私たちが追加資金を必要とする場合、私たちは私たちが受け入れられる条項、または追加資金を全く持っていないかもしれないし、私たちが追加資金を調達する能力は、潜在的に悪化したグローバル経済状況や市場バイオテクノロジー分野の条件の悪影響を受ける可能性があり、これらの条件は、“新冠肺炎”の大流行とその影響による米国と世界の信用と金融市場の中断または変動、金利および経済インフレの実際または予想される変化、および現在または予想される地政学的不安定の影響を含む。もし私たちが株式分配協定に基づいて、私たちの候補製品の非臨床研究、臨床試験または他の開発活動を延期、制限、減少または終了することを含む十分な資金を得ることができない場合、または私たちの候補製品を商業化するために必要な活動の確立、マーケティング、および流通能力の確立、制限、減少または終了を要求される可能性がある。
Success支払契約におけるSuccess支払い義務は、私たちの株主への希釈を招くか、または私たちの支払い義務を履行する現金資源を枯渇させる可能性がある。
フレッド·ハッジとスタンフォードとの支払い成功協定によると、私たちは現金または普通株公開取引株の形でSuccess支払いを支払うことに同意する。各契約によって規定された計量日に、私たちは普通株の1株当たりの公正価値の増加に応じて支払い成功支払いを要求されるかもしれない。私たちが支払い義務があるかもしれないSuccess支払い総額は現在4.0億ドルです。私たちの既存のSuccess支払いプロトコルの修正により、将来増加するかもしれません。私たちの支払い成功義務に関する情報は、付記3を参照されたい許可、協力、成功支払協定本年度報告表格10-K第II部第8項に記載されている監査済み総合財務諸表を付記する。
私たちがこれらの成功支払いを支払う義務を履行するために、トリガすれば、株式または転換可能な債務証券を発行する可能性があり、私たちの株主に希釈される可能性があり、あるいは既存の現金を使用して現金で成功裏に支払い義務を支払うことができ、これは私たちの財務状況に悪影響を及ぼす可能性がある。また、これらの成功裏な支払いは、将来的に債券や株式証券を公開したり、第三者の信用限度額を取得したりする際の資金調達能力を阻害する可能性がある。
Success支払協定は、四半期ごとに経営業績が大幅に変動する可能性があり、連結財務諸表の有用性を低下させる可能性があります。
私たちの成功的な支払い義務は私たちの総合貸借対照表に負債として記録されている。アメリカ公認会計原則(GAAP)によると、私たちはこれらの負債の四半期末の公正価値を推定し、公正価値の変化を推定して協力協定サービス期間内の研究開発費用を計上する必要がある。この負債の推定公正価値の増加または減少をもたらす可能性のある要素は、普通株式価値の変化、変動性の変化、および無リスク金利の変化を含む。したがって、我々の経営業績やGAAP報告の財務状況は四半期ごとに大幅に変動する可能性があり、我々のGAAP合併財務諸表の有用性を低下させる可能性がある。注3を参照許可、協力、成功支払協定なお、本年度報告シートの第10-K第2部第8項に記載されている監査された総合財務諸表を参照して、より多くの資料を取得します。
私たちのビジネスや産業に関するリスクは
私たちの研究と開発はまだ初期段階にあり、私たちの候補製品はまだ臨床開発を始めたばかりです。もし私たちが候補製品の開発と商業化に成功しなかった場合、あるいはそうする過程で重大な遅延に遭遇すれば、私たちの業務は損害を受ける可能性がある。
私たちの研究と開発はまだ初期段階にあり、私たちの候補製品はまだ臨床開発を始めたばかりです。第一段階の臨床開発にあるLYL 797とLYL 845を除いて、著者らの他の候補特許製品は現在非臨床開発段階にある。どんな臨床試験(任意の3期臨床試験または他の重要な臨床試験を含む)を成功させ、監督部門の許可を得て、商業を製造することができることはまだ証明されていません
製品の規模を拡大したり、第三者代表を配置したりしたり、製品の商業化に成功するために必要な販売やマーケティング活動を行ったりする。私たちは大量の資源を投入して、私たちの技術プラットフォームと候補製品を開発し、非臨床研究を行い、臨床試験を開始し、そして私たちの製造施設と能力を確立し、すべての項目はいかなる監督管理の承認と商業化の前に必要である。私たちが製品販売から収入を得る能力は、1つ以上の候補製品の成功した研究開発と最終的な商業化に大きく依存するだろう。このようなことは数年以内には起こらないと予想される。私たちが候補製品を決定し、開発する努力が成功するかどうかは、以下の要素を含む多くの要素に依存する
•臨床試験のための候補製品を決定し、開発するために、著者らの非臨床研究と研究活動を適時かつ成功的に完成させる
•臨床試験を行うためにFDAにINDを提出するか、または外国の監督機関に同様の申請を提出して、私たちが計画している候補製品の臨床試験を開始する
•GCP要求に適合した臨床試験の成功登録と完成、結果は陽性であった
•私たちの候補製品と一緒に観察された効果レベルは
•私たちの候補製品が経験している有害事象の流行率と深刻さは
•私たちの候補製品の開発に成功したか、または第三者と製造と流通プロセスを手配し、規制の承認を得た任意の私たちの候補製品のための商業製造と流通を行う
•私たちの製品候補製品に対する適用当局の予想される用途に対する規制の承認をタイムリーに受ける
•特許および商業秘密保護および候補製品の規制排他性を取得して維持することによって、私たちの知的財産権の組み合わせで私たちの権利を保護すること
•開発に必要な腫瘍組織を獲得するための能力とインフラを確立し、成功すれば承認された製品を商業化する
•私たちの候補製品を受け入れられるコストで製造します
•単独でまたは他人と協力して、規制当局の許可を得たら、私たちの製品の商業販売を展開します
•関連する規制部門の承認を得られれば、患者と医学界は私たちの製品を受け入れることができる
•(政府支払者を含む)第三者支払者のわが製品に対する保証と適切な補償を得て維持する(適用規制機関の承認が得られた場合)
•他の市場の治療法と効果的に競争しています
•CGMP要件を含む法規制要件を維持する;
•承認後に製品の持続的に許容可能な利益/リスクプロファイルを維持すること;および
•科学者と機能専門家からなる組織を維持·発展させ、彼らは私たちの製品や技術を開発して商業化することができる。
もし私たちがこれらの要素のうちの1つまたは複数をタイムリーにまたは根本的に達成できなければ、私たちは重大な遅延に遭遇したり、私たちの候補製品を開発して商業化できなかったりする可能性があり、これは私たちの業務を損なう可能性がある。もし私たちが開発したどの候補製品もマーケティングの承認を得なければ、私たちは運営を続けることができないかもしれない。
私たちの候補製品と技術プラットフォームは、検証されていない新しい技術に基づいて、承認可能または適切な製品を生成しない可能性があり、これは私たちを予見できないリスクに直面させ、製品開発の時間とコストおよび規制承認の潜在力を予測することを困難にし、私たちの技術プラットフォームを使用して拡張して候補製品パイプラインを構築する努力は成功しないかもしれない。
私たちは私たちの独自技術プラットフォームを利用して一連の幅広い候補製品を決定し、開発することを求めている。我々が我々の技術プラットフォームを用いて候補製品を開発する基礎を構成する科学研究が行われている.私たちはFDAによって承認された似たような技術を使用したどんな治療法も知らない。また、著者らの技術プラットフォームに基づいて治療方法を開発する可能性を支持する科学的証拠は初歩的であり、限られている。また,LYL 797とLYL 845は一期臨床開発段階にあるにもかかわらず,我々の現在の
臨床データは限られていますマウス腫瘍モデルと体外培養腫瘍細胞株を用いた実験はヒトに変換されない可能性があり,あるいは我々の候補製品のヒトにおける安全性と有効性を正確に予測できない可能性がある。そのため、私たちは多くの予見できないリスクに直面しており、私たちが候補製品を開発する間に遭遇する可能性のある挑戦とリスクのタイプを予測することは難しい。
我々の技術プラットフォームの新規性を考慮して、私たちはFDAと比較可能な外国の監督管理機関と密接に協力し、私たちの方法に対して必要な科学的分析と評価を行い、私たちの候補製品の監督管理許可を得るつもりである;しかし、関連経験が不足しているため、FDAと比較可能な監督管理機関との監督方法は他のより有名な治療法よりも複雑で時間がかかる可能性がある。我々が我々の候補製品を支援するために人間データを取得しても、FDAなどの外国規制機関は、我々の技術プラットフォームを用いて開発された候補製品の安全性と有効性を評価する経験が不足している可能性があり、これは、規制審査過程が予想以上に長くなり、予想される開発コストを増加させ、候補製品の商業化を延期または阻止する可能性がある。検証プロセスには時間と資源が必要であり、独立した第三者分析が必要となる可能性があり、FDAおよび同様の外国規制機関によって受け入れまたは承認されない可能性がある。臨床開発の時間の長さを保証することができず、FDAは臨床試験に参加する患者の数を要求し、著者らの候補製品の安全性、純度と有効性、あるいはFDAがこれらの臨床試験で産生した上場承認を支持するデータに対する受容度を確定することができるかもしれない。私たちは私たちの方法が単独または他の治療法と組み合わせて承認可能または販売可能な製品の開発につながると確信できない。
私たちは私たちのキーパーソンに高度に依存していて、私たちが高い素質の人材を誘致し、維持することに成功できなければ、私たちの業務戦略を成功的に実施することができないかもしれません。
私たちが競争の激しい生物技術と製薬業界の中で競争できるかどうかは、私たちが高い素質の管理、科学と医療人員を引き付けることができるかどうかにかかっている。私たちは私たちの管理、製造、科学、そして医療者たちに非常に依存している。私たちの役員、他の重要な従業員、他の科学や医療コンサルタントのサービスを失うこと、そして適切な代替者を見つけることができず、製品開発の遅延を招き、私たちの業務を損なう可能性があります。私たちのほとんどの業務はサンフランシスコ、シアトル、ボゼルメトロポリタン地域の施設で行われています。これらの地域は多くの他の生物製薬会社と多くの学術·研究機関の本部である。これらの市場は技術者に対する競争が非常に激しく、私たちが受け入れられる条件で高い素質の人員を採用し、維持する能力を制限する可能性があり、甚だしきに至っては根本的にはできない。例えば、2022年、私たちの元最高経営責任者が個人的な理由で辞任し、私たちの前総法律顧問が辞任し、他の場所に機会を探しに行きます。バイオテクノロジー業界の人材に対する激しい競争を考慮すると、特にサンフランシスコとシアトルの大都市地域では、将来的にはより多くの他の幹部や従業員の辞任に出会う可能性がある。
価値のある従業員をわが社に引き付けるために、給料や現金激励のほか、時間とともに付与された株式を提供しています。時間が経つにつれて、従業員に対する持分インセンティブの価値は、私たちがコントロールできない要素の著しい影響を受ける可能性があり、他社が提供するより利益のある見積もりを相殺するのにいつでも十分ではないかもしれない。私たちは価値のある従業員を引き留めるために努力しているにもかかわらず、私たちの管理、科学、開発チームのメンバーは短時間で私たちとの雇用関係を終了するかもしれない。私たちは私たちの重要な従業員と雇用協定を持っていますが、これらの雇用協定は自由に雇用できることを規定しています。これは、私たちのどの従業員も通知するかどうかにかかわらず、いつでも私たちの仕事を離れることができることを意味します。私たちはこのような個人や私たちの他のどんな従業員のためにも“キーパーソン”保険証書を維持しない。私たちの成功はまた私たちが引き続き高技能の初級、中級と高級管理者及び初級、中級と高級科学と医療人員を吸引、維持、激励できるかどうかにかかっている。
どんな訴訟や対抗訴訟の弁護も高価で時間がかかるかもしれない。
私たちは、現在または前任者が提起した商業紛争または雇用クレームについてのような、我々または第三者が現在または前任者から提起した商業紛争または雇用クレームのような、正常な業務プロセス中に生じる法的手続きおよびクレームの影響を受ける可能性がある。訴訟や対抗訴訟は、巨額の費用を招く可能性があり、経営陣の注意や資源を分散させる可能性があり、これは、私たちの業務、名声、全体の財務状況、および経営業績を深刻に損なう可能性があります。例えば、2021年2月には、PACT Pharma,Inc.(PACT)と締結された共同開発プロトコル(PACTコミットメントプロトコル)および株式購入プロトコル(PACT SPA)の撤回を要求し、そのプロトコルに従って支払われた対価格を返す仲裁要求を提出する。2022年10月、未解決の法的紛争を解決するためにPACTと和解合意に達しました。第1項第3項を参照して法律訴訟PACTとの仲裁結果の詳細については、本年度報告10-K表を参照されたい。保険は、そのようなクレームを含まない可能性があり、1つ以上のそのようなクレームを解決するためのすべての費用を支払うのに十分なお金を提供できない可能性があり、私たちが受け入れられる条項で保険を提供し続けることができない可能性がある。私たちまたは私たちによって提出された未保険または保険加入不足のクレームは、予期せぬコストを招き、私たちの業務を損なう可能性があります。
もし私たちが成長過程で私たちの会社文化を維持できなければ、私たちの成功と私たちの業務は損なわれるかもしれない。
私たちは今まで、私たちの文化が私たちの成功の重要な要素だったと信じている。私たちを保護できなかった文化は、私たちが人員を維持し、募集する能力にマイナスの影響を与える可能性があり、これは私たちの発展に重要であり、私たちの目標に効果的に集中し、追求する。私たちが成長し、より複雑な組織管理構造を実施することが要求されるにつれて、私たちの文化の有益な面を維持することはますます困難になっていることが分かるかもしれない。もし私たちが私たちの会社の文化を維持できなければ、私たちの業務は不利な影響を受けるかもしれない。
私たちは現在マーケティング、販売、流通インフラを持っていません。販売とマーケティングインフラを構築するか、この機能を第三者にアウトソーシングするつもりです。この二つの商業化戦略は私たちに大きな危険をもたらす。
私たちは現在マーケティング、販売、そして流通能力を持っていない。臨床開発を完了し、承認された候補製品の商業マーケティングおよび流通を支援するために、技術的専門性と流通能力を有する販売およびマーケティング組織を構築し、私たちの候補製品を合法的にコンプライアンスで商業化するか、またはこの機能を第三者にアウトソーシングする。私たちが自分の販売やマーケティング能力を確立したり、第三者と手配してこれらのサービスを提供することを決定すれば、リスクに関連します。私たちがマーケティング、販売、または流通について達成した協力合意について、私たちの製品収入は、私たちが直接マーケティングしたり、許可された製品を販売したりするよりも低いかもしれません。パートナーとのこのような協力は、私たちの製品の商業化を私たちの統制されていないようにし、私たちのパートナーが私たちの製品に投入する資源の数や時間を制御できない可能性があること、または私たちの協力者がその義務を履行する意志または能力、および私たちの手配の下での義務が、業務合併や私たちの協力者の業務戦略の大きな変化によって悪影響を受ける可能性があることを含む多くのリスクに直面する可能性があります。
もし私たちが受け入れ可能な条件やこれらの計画を根本的に達成できなければ、私たちはどんな承認された製品も商業化することに成功できないかもしれない。もし私たちがいかなる承認された製品を商業化することに成功できなければ、私たち自身も1つ以上の第三者と協力することで、私たちの将来の製品収入は影響を受け、私たちは重大な追加損失を生じる可能性があり、これは私たちの業務、財務状況、運営結果に大きな悪影響を及ぼすだろう。
私たちまたは私たちが依存している第三者が重要な製造施設、潜在的な臨床試験地点が集中あるいは他の業務を運営している地域では、私たちの業務は引き続き新冠肺炎の大流行を含む衛生流行病の影響を受ける可能性がある。
私たちまたは私たちが依存している第三者が重要な製造施設、潜在的な臨床試験場所あるいは他の業務を集中的に運営している地域では、私たちの業務は新冠肺炎の大流行とその影響を含む衛生流行病の悪影響を受け続ける可能性がある。例えば、新冠肺炎の大流行は世界各地で巨大な公衆衛生と経済挑戦を構成し、従業員、患者、コミュニティと企業運営、そしてアメリカと国際経済と金融市場に影響を与えている。この点で、新冠肺炎疫病と政府が取った対応措置は商業と商業に直接と間接的な重大な影響を与え、商業に関連する活動が大幅に減少し、サプライチェーンが中断し、製造と臨床開発活動が影響を受けた。
新冠肺炎疫病に関連する遠隔作業政策、隔離、現地避難と類似の政府命令、閉鎖或いはその他の業務運営に対する制限は私たちの運営に実質的な悪影響を与える可能性がある。連邦、州、地方当局の指導によると、私たちはこれまで現場で働くことができる従業員の数や性質を制限する政策を実施しており、将来的にはこのような政策を再検討する可能性がある。私たちはまた、施設に入るすべての従業員や請負業者にワクチン接種を要求することを含め、私たちの施設で予防措置を実施した。また、私たちは現場のすべての人たちが常に手洗いと他の予防措置の提案を遵守することを奨励する。これらと未来に取られる可能性のある措置について、私たちは、私たちがすでに私たちと未来に私たちの現場運営について下した任意の決定を含む、新しい冠肺炎の疫病発生に関連したクレームとそれに対する私たちの行動と対応措置に基づいて影響を受ける可能性がある。さらに、現在および将来の政府制限および私たちの遠隔作業政策は、生産性に実質的な悪影響を与え、私たちの業務を混乱させ、私たちの非臨床研究および臨床試験計画を延期する可能性があり、その重症度は、これらの制限の長さおよび重症度、および正常な過程で業務を展開する能力の他の制限に部分的に依存するであろう。私たちは引き続き新冠肺炎の疫病が私たちの計画通りに有効に業務運営を展開する能力に与える影響を評価し続ける。 しかし、私たちが新冠肺炎の大流行が絶えず変化している影響による実質的な悪影響を避けることができる保証はない。新冠肺炎の大流行は引き続き医療保健と病院資源に負の影響を与える可能性があり、第一線と行政人員を含め、これは著者らの現在と計画中の臨床試験の登録を延期する可能性がある。一部の患者は臨床試験案を守れないかもしれません
潜在的な隔離,医療支援の欠如や医療サービスが中断する可能性があるため,血液試料を取得して検出できない可能性がある
新冠肺炎疫病が著者らの業務、運営と発展スケジュール及び計画に与える影響程度はまだ不確定であり、現在予測できない未来の事態の発展に依存する。これらの動態には,米国や他の国や地域におけるオミック変種や亜変種の持続的伝播,特に感染性や毒性が証明される可能性のあるSARS−CoV−2変種,大流行の最終持続時間,それによる我々の臨床試験計画,CRO,契約製造組織および他の我々と業務を往来している第三者への影響,および規制機関や我々の鍵となる科学·管理者への影響,ワクチンや補強剤の提供を含む世界的な制御および治療行動の有効性が含まれている。ワクチンを接種するか、または免疫を強化する人口パーセンテージおよびオミック、その亜変種または他のSARS-CoV-2変種に対するワクチンまたは増強剤の有効性。私たちの業務、私たちが計画している非臨床研究や臨床試験、医療システム、あるいは世界経済への潜在的な遅延や影響のすべての程度はまだわかりません。上述の状況及び新冠肺炎疫病の絶えず変化する影響は著者らの業務に与える他の持続的な妨害は、私たちの業務、運営業績、財務状況とキャッシュフローに実質的な不利な影響を与える可能性がある。そのほか、新冠肺炎の大流行の影響は本文で述べたいくつかの他のリスク要素のリスクを増加させる可能性がある。
不安定な市場や経済状況は、私たちの業務、財務状況、株価に深刻な悪影響を及ぼす可能性がある。
世界の信用と金融市場は、流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の減速、高インフレ、経済安定性の不確定性、失業率の変動を含む極端な変動と中断(新冠肺炎の疫病および金利と経済インフレの実際または予想の変化を含む)を経験した。現在または予想されている軍事衝突、テロ行為、または他の地政学的事件の影響も金融市場や世界経済に悪影響を及ぼす可能性がある。米国や他の国がウクライナ紛争を含むこのような紛争に対応するために実施している制裁は、金融市場や世界経済に悪影響を与え続ける可能性もあり、影響を受けた国や他の国のいかなる経済対策も市場や経済の不安定を悪化させる可能性がある。信用と金融市場のさらなる悪化と経済状況への自信が起こらない保証はない。我々の全体的な業務戦略は、我々が行っている試験における登録中断、および必要な供給を許容可能な条件で購入する能力を含む、このような経済低迷、動揺したビジネス環境、または持続的な予測不可能かつ不安定な市場状況のいずれかの悪影響を受ける可能性がある。現在の株式と信用市場が悪化すれば、任意の必要な債務や株式融資をより困難にし、コストがより高く、希釈程度をより高くする可能性がある。適時に有利な条件で任意の必要な融資を得ることができなければ、私たちの成長戦略、財務業績、株価に実質的な悪影響を与える可能性があり、臨床開発計画の延期または放棄を要求する可能性がある。さらに私たちの現在の1つ以上のサービスプロバイダは, メーカーや他のパートナーは経済低迷の中で生き残ることができない可能性があり、これは私たちの時間通りと予算で運営目標を達成する能力に直接影響する可能性がある。
製造業に関するリスク
私たちはすべての候補製品の大部分を自分で作るつもりだ。私たちの製造施設や候補製品の資格を遅延させたり、規制部門の承認を得たりすることは、私たちの開発計画を延期し、製品収入を創出する能力を制限するかもしれません。
私たちはワシントン州のボゼルに自分の製造工場を設立した。この施設は,非臨床開発候補製品の生産·製品の早期商業化を支援することを目的としており,臨床生産を支援するための持続的な施設や設備資格が必要である。もし私たちが工場の資格を得ることができない場合、あるいは工場の適切な規制承認が延期されたら、私たちは十分な数の候補製品を生産できないかもしれません。これは私たちの開発活動と成長機会を制限します。
また、我々の製造施設は、cGMPおよびcGTPに適合することを確保するために、FDA、EMAまたは他の適用規制機関の持続的な定期検査を受ける。私たちはこれらの法規或いは他の法規に対する要求に対する私たちの遵守状況を遵守し、記録することができず、臨床或いは将来の商業用途のための製品供給に重大な遅延を招く可能性がある。これは、臨床試験の終了または一時停止をもたらす可能性があり、または候補製品の商業マーケティング申請の提出または承認を遅延または阻止する可能性がある。私たちはまた次のような点で問題に直面するかもしれない
•規制機関の基準または規範に適合する十分または臨床レベルの材料を一貫かつ許容可能な生産生産量およびコストで得ること
•製造業に関連する主要な電子システムの一貫性を維持する
•合格者、原材料、または主要請負業者の不足;
•CGMP規制およびFDA、EMA、または他の同様の規制機関の他の要件を継続的に遵守する。
適用される法規を遵守しないことは、罰金、禁止、民事処罰、私たちの1つ以上の臨床試験の一時停止または棚上げを要求すること、規制機関が私たちの候補製品の上場を承認できなかったこと、遅延、一時停止または承認の撤回、許可証の取り消し、候補製品の差し押さえまたはリコール、運営制限、刑事起訴を含む私たちに制裁を加える可能性があり、これらはすべて私たちの業務を損なう可能性がある。
我々の施設を活用するためには,先進的な製造技術とプロセス制御を開発する必要がある。これ以上の投資がなければ、製造技術の進歩は私たちの施設や設備を不足させたり時代遅れにしたりするかもしれない。私たちはまた、より多くの製造施設を建設したり、既存施設の生産能力を拡大するためにさらに投資する必要があるかもしれない。
細胞療法の製造は非常に複雑である。私たちは大量の製造リスクに直面しています。その中のどれも私たちのコストを大幅に増加させ、私たちの計画を延期したり、候補製品の供給を制限したりする可能性があります。
細胞療法のために商業上実行可能な製造技術を開発することは困難と不確定な任務であり、大量の専門知識と資本投資が必要である。私たちは私たちの候補製品のために製造プロセスを開発して実施している。特に,自家細胞療法では,出発材料が患者自身の細胞であり,製造過程の複雑さや変異性が固有に増加している。そのほか、私たちの候補細胞療法製品を確実に生産する能力は私たちの成功に重要であり、しかもコスト超過、プロセス拡大の潜在的な問題、プロセスの再現性、安定性の問題、試薬或いは原材料の一致性と即時性を含む高度な臨床試験あるいは商業化に必要なレベルへの拡張に関連するリスクである。しかも、私たちの製造プロセスは第三者に深刻に依存する可能性があり、これは私たちの製造能力に追加的なリスクをもたらすだろう。また、候補製品の商業製造と加工コストを確実に推定するための十分な情報はありませんが、候補製品の製造と加工の実際のコストは私たちの候補製品の商業実行可能性に大きな悪影響を与える可能性があります。したがって、私たちは商業的に実行可能な製品を開発することができないかもしれない。
上述の要素以外に、細胞療法の全製造過程は細胞生存率が低く、汚染、設備故障或いは設備設置或いは操作が不適切、サプライヤー或いはオペレータのミスにより製品損失を招きやすい。私たちの任意の候補製品に対して、正常な製造と流通プロセスとの微小な偏差があっても、生産良率の低下、肝心な製品の品質属性への影響、その他の供給中断を招く可能性がある。製品の欠陥も意外に起こる可能性がある。このような偏差と中断は私たちの計画を延期するかもしれない。もし私たちがこのような複雑さと変異性をうまく管理できなければ、私たちが患者に私たちの候補製品をタイムリーかつ成功的に提供する能力が延期されるかもしれない。さらに、患者自身の細胞を出発材料として利用する複雑さは、適切な細胞が実行可能な細胞治療製品を産生することが要求され、これは、免疫が深刻に損傷したか、または深刻な前治療を受けた患者にとって不可能である可能性がある。
臨床試験および商業化のための製品の製造に成功するプロセスは、これらの製品が他の面で安全かつ有効であることが証明されても、特に挑戦的である可能性がある。このような候補製品の製造は複雑なプロセスと関連がある。その中のいくつかの過程は専門的な設備と高い技術と訓練された人員を必要とする。これらの候補製品の製造過程は,製造過程全体で無菌条件を維持する必要があることを考慮すると,余分なリスクの影響を受けやすい。ドナー材料または製造中に使用される材料中の微生物、ウイルスまたは他の病原体の汚染、または微生物材料がプロセス中の任意の時点で入ると、汚染された使用できない製品を引き起こす可能性があり、または汚染を調査および修復することができるように、製造施設を長い間閉鎖する必要がある。これらのタイプの汚染は製品製造の遅延を招く可能性があり、これは私たちの候補製品の開発遅延を招く可能性がある。このような汚染物質はまた副作用の危険を増加させる可能性がある。
私たちの候補製品の生産運営に影響を与える不利な発展は、ロット故障、在庫不足、出荷遅延、製品の撤回やリコール、あるいはその他の私たちの候補製品開発の供給中断を遅延させる可能性があります。もし私たちが十分な候補製品供給を得ることができなければ、生産不足であっても、新冠肺炎疫病の持続的な影響やその他の原因による他の供給中断であっても、私たちの臨床試験や監督管理の承認は延期される可能性がある。また、規格に適合しない製品の供給によって他の費用や支出が発生し、コストの高い救済措置を講じたり、よりコストの高い製造代替案を求めたりしなければならない可能性がある。さらに、サプライチェーンの一部は長い納期があるかもしれないし、少数のサプライヤーから来ている可能性がある。私たちのサプライチェーンを適切に管理できなければ、私たちは能力があります
私たちの候補製品の生産に成功したことは延期されたり、損害を受ける可能性がある。私たちの候補製品に対する需要を満たすことができないことは、私たちの名声を損なう可能性があり、医師、医療支払者、患者、あるいは私たちの製品開発努力を支持する医療コミュニティ(病院や外来診療所を含む)におけるわが製品の名声を損なう可能性があります。
また、私たちの候補製品の製造施設は地震と他の自然災害、設備故障、労働力不足、電力故障、衛生流行病、多くの他の要素の悪影響を受ける可能性がある。もしこれらの事件のいずれかが発生して私たちの製造施設に影響を与えたら、私たちの業務は実質的で不利な影響を受けるだろう。
もし私たちの唯一の臨床または商業製造施設または私たちの契約製造組織が破損または破壊された場合、またはこれらの施設の生産が他の理由で中断されれば、私たちの業務は負の影響を受けるだろう。
もし私たちの製造ネットワーク内の任意の製造施設やこれらの施設の設備が破損したり破壊されたりすれば、私たちはそれを交換することができれば、私たちの製造能力を迅速かつ安価に交換することができないかもしれない。施設やその設備に一時的または長期的な損失が発生した場合、供給を維持するのに必要な時間内に生産を第三者に移すことができない可能性がある。生産を第三者に移転することができても、移転は高価で時間がかかる可能性があり、特に新工場は必要な規制要求を遵守する必要があるため、あるいはその工場で生産された任意の製品を販売する前に規制部門の承認が必要となる可能性がある。このような活動は私たちの臨床試験や私たちの候補製品の商業化を大幅に延期するかもしれない。
現在、私たちは私たちの財産損失に保険を提供し、業務中断と研究開発回復費用を支払います。しかし、私たちの保険カバー範囲は私たちを清算しないかもしれないし、私たちが受ける可能性のある費用や損失を清算するのに十分ではないかもしれない。もし私たちの現在の製造施設やプロセスに悲劇的な事件や故障が発生したら、私たちは候補製品に対する要求を満たすことができないかもしれません。
もし私たちが私たち自身の製造を開発または拡大できなければ、私たちは第三者に依存して私たちの候補製品を製造しなければならないかもしれません。これは私たちをリスクに直面させ、私たちの候補製品の開発および/または商業化を遅延または阻止する可能性があります(承認されれば)。
もし私たちが候補製品のために自分たちの製造能力を開発したり拡張することができなければ、私たちは第三者に依存して私たちの候補製品を生産するだろう。私たちは、私たちの候補製品や許容可能な条件で細胞療法を開発するために必要な材料の製造業者を決定することができないかもしれないし、潜在的なメーカーの数が限られているので、全く決定できないかもしれない。第三者メーカーを招聘するには、テストと監督の相互作用が必要となり、新しいメーカーはFDAの問題を受けた後に私たちの製品の生産に関する訓練を受けたり、基本的に同じプロセスを開発したりしなければならない。これらの潜在的な第三者製造業者は、もしあれば、私たちの製品または生産に必要な数量と品質をタイムリーに制定して製造することができないかもしれない。
また,メーカーが使用する施設は,政府法規や外国基準の厳格な遵守を確保するためにFDAと州機関の継続的な定期抜き打ち検査を受けており,第三者メーカーが我々の候補製品を生産する際にcGMPを遵守するかどうかを制御することはできない。もし私たちの契約メーカーが私たちの規格やFDAや他の機関の厳格な規制要件に合った材料を生産することに成功しなければ、私たちはこれらの工場で生産された私たちの候補製品を獲得および/または維持することができず、規制部門の承認を得ることができないだろう。また、私たちの第三者メーカーが私たちの臨床と商業需要を満たすために、十分な制御、品質保証、合格者を維持する能力があるかどうかを制御することはできません。FDAや同様の外国規制機関がこれらの工場で私たちの候補製品を生産することを承認しない場合、または将来的にそのような承認を撤回すれば、代替製造施設を探す必要があるかもしれません。これは、私たちが規制承認を得たり、私たちの候補製品をマーケティングしたりする能力に深刻な影響を与えます。さらに、これらの法律、法規、基準を達成し、維持できなかった場合は、私たちの候補製品の生産を一時停止しなければならないかもしれない、または私たちが得た任意の承認が撤回される可能性があり、これは私たちの業務や名声に悪影響を及ぼす可能性があるというリスクに直面する可能性がある。
私たちは、私たちの製品の製造過程で第三者メーカーがしたいかなる改善された知的財産権も共有しなければならないかもしれないし、共有しなければならないかもしれない。さらに、私たちの第三者製造業者は、彼ら自身の財務的困難またはビジネス優先事項のために、私たちとの合意を違反または終了するかもしれませんが、この場合、私たちにとってコストが高いか不便です。もし私たちが十分な代替品や他の許容可能な解決策を見つけることができなければ、私たちの臨床試験は延期されるかもしれないし、私たちの商業活動は損害を受ける可能性がある。
また、上述したように、我々の第三者メーカーは、私たち自身の製造能力を発展させる際にも同様のリスクに直面するであろう。これらのリスクの各々は、私たちの臨床試験、FDAによる私たちの候補製品の承認、または私たちの候補製品の商業化を延期するか、またはより高いコストをもたらし、または私たちの潜在的な製品収入を奪う可能性がある。
細胞による治療は特殊な原材料の利用可能性に依存し,これらの原材料は許容可能な条件で提供できないか,あるいは全く得られない可能性がある。
私たちの候補製品は多くの特別な原材料が必要だ。したがって、私たちは製造業サプライチェーンの様々な側面をアウトソーシングする必要があるかもしれない。多くの特殊な原材料は資源や経験の限られた小さな会社によって製造されている可能性があり、商業製品をサポートすることができず、サプライヤーは私たちの規格に合った原材料を提供できないかもしれない。この場合、代替サプライヤーまたは製造業者を探して採用することは遅延を招く可能性があり、私たちは許容可能な条件で他の許容可能なサプライヤーまたは製造業者を見つけることができないかもしれない、または全く見つからないかもしれない。サプライヤーまたは製造業者の交換は、大量のコストを伴う可能性があり、私たちに必要な臨床およびビジネススケジュールの遅延をもたらす可能性があります。もし私たちが商業生産のためにサプライヤーやメーカーを交換すれば、適用される規制機関は追加の研究や試験を要求するかもしれません。重要な供給者や製造業者を失った場合、または材料供給が減少または供給を停止した場合、私たちはタイムリーで競争力のある方法で私たちの候補製品を開発、製造、販売することができず、甚だしきに至っては全くできない可能性がある。これらのサプライヤーのうちのいずれかから製品を調達し続けることができないのは、サプライヤーの規制行動または要求、サプライヤーが経験した不利な財務または他の戦略的発展、労使紛争または不足、意外な需要または品質の問題を含む多くの問題が、候補製品の需要を満たす能力に悪影響を及ぼす可能性があり、これは、私たちの製品販売および運営結果、または私たちの臨床試験を行う能力に悪影響および実質的な影響を与える可能性があり、いずれも私たちの業務を深刻に損なう可能性があるからである。
しかも、このような供給者たちは生物製薬会社が生産した商業製品を支援する能力がないかもしれない。サプライヤーは、特にFDAの検査のような非従来の場合、または広範な汚染のような医療危機を支援するための十分な装備を持っていないかもしれない。私たちは受け入れ可能な条項やこの会社たちと契約を結ぶことができないかもしれない。したがって、私たちは臨床や商業生産を支持する重要な原材料を受け入れることに遅延があるかもしれない。しかも、いくつかの原材料は現在単一サプライヤーまたは少数のサプライヤーから得ることができる。私たちは、これらのサプライヤーが経営を続けるかどうか、あるいは私たちの競争相手のうちの1つまたは他の私たちの予想された目的のためにこれらの材料を生産し続けることに興味のある会社によって購入されないかどうかを確認することができません。これらの要因は、私たちが開発した候補製品の研究や試験、規制提出、必要な承認または商業化の遅延を招き、より高いコストを招き、私たちの候補製品の商業化に成功することを阻止するかもしれない。
私たちの第三者への依存に関するリスク
私たちは、第三者が私たちの候補製品のために、私たちの研究、非臨床研究、臨床試験の大部分を監督、監視、監督することに依存するつもりであり、これらの第三者がその契約義務の履行に成功していない場合、法規の要求を遵守し、または他の方法で満足できるように実行されなければ、規制の承認を得ることができないかもしれないし、候補製品を商業化することができないかもしれないし、このような承認または商業化が遅れる可能性があり、私たちの業務は実質的な損害を受ける可能性がある。
著者らは医療機関、臨床研究者、契約実験室とその他の第三者、例えばCROに依存して、正確かつ適時に著者らの候補製品に対してGCPに符合する臨床試験を行うつもりである。例えば,われわれはCROによるLYL 797第一段階臨床試験の重要な部分に依存している。CROや研究サイトとの予算や契約の交渉は、我々の開発スケジュールを遅延させ、コストを増加させる可能性があります。CROの交換または増加は多くのコストに関連し、管理時間と重点を必要とする。しかも、新しいCROが仕事を始める時、自然な過渡期がある。したがって,遅延が生じ,期待される臨床開発スケジュールを満たす能力に実質的な影響を与える可能性がある。私たちはCROとの関係を慎重に管理しようとしているが、私たちが未来に挑戦や遅延に遭遇しないことを保証することはできず、これらの遅延や挑戦が私たちの業務、財務状況、および見通しに実質的な悪影響を与えないことを保証することはできない。また、我々が試験を行ったCROおよび他の第三者の性能も、CRO、臨床サイトまたは他のサプライヤーの人員不足や大流行による資源再分配を含む、新冠肺炎の大流行の持続的な影響によって中断または遅延する可能性がある。
また、私たちの臨床試験や非臨床研究を行ういかなる第三者も私たちの従業員ではなく、私たちとこのような第三者との合意によって私たちに提供された救済措置を除いて、彼らが私たちの計画に十分な時間と資源を投入しているかどうかを制御することができません。もしこれらの第三者がその契約の義務または義務を成功裏に履行できなかった場合、または予想された期限内に達成できなかった場合、もし彼らが交換する必要がある場合、または彼らが得た臨床データの品質または正確性が私たちの臨床規程、法規の要求または他の原因を遵守できなかったために影響を受けた場合、私たちの臨床試験または非臨床研究は延長、延期または終了される可能性があり、私たちは監督部門の承認を得ることができないか、あるいは私たちの候補製品を商業化に成功させることができないかもしれない。したがって、私たちの運営結果と私たちの候補製品のビジネス見通しは損なわれ、私たちのコストは大幅に増加する可能性があり、私たちの収入を創出する能力は著しく遅れる可能性がある。
私たちはこれらの方に依存して私たちの非臨床研究や臨床試験を実行し、通常彼らの活動をコントロールしません。私たちのこれらの第三者の研究開発活動への依存は、これらの活動に対する私たちの統制を減少させるだろうが、私たちの責任を軽減することはない。例えば,我々のすべての臨床試験が試験の全体的な調査計画や案に沿って行われることを確保していきたい。さらに、FDAは、データおよび報告の結果が信頼性および正確であることを保証し、試験参加者の権利、完全性、およびセキュリティを保護するために、臨床試験結果を進行、記録、および報告する基準を遵守することを要求する。私たちまたは私たちの任意のCROまたは他の第三者が、試験場所を含めて、適用されたGCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれませんが、FDAまたは同様の外国の規制機関は、私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。特定の規制機関が検査を行った後、この監督機関は私たちのいかなる臨床試験がGCP規定に適合しているかどうかを確認することを保証することはできません。また,われわれの臨床試験ではcGMP条件下で生産された製品を使用しなければならない。私たちがこれらの規定を守らないことは、私たちが患者を増加させたり、臨床試験を繰り返したりする必要があるかもしれないが、これは規制承認過程を遅らせるだろう。さらに、その中のいずれかの第三者が連邦または州詐欺および乱用または虚偽クレーム法律法規または医療プライバシー·セキュリティ法に違反した場合、私たちの業務は巻き込まれる可能性がある。
もし私たちが現在使用しているか、または将来使用する可能性のある第三者とのいかなる関係も終了すれば、私たちは商業的に合理的な条項で他の第三者と合意できないかもしれない。したがって,遅延が生じ,期待される研究や臨床開発スケジュールを満たす能力に実質的な影響を与える可能性がある。
著者らは引き続き或いは外部科学者と臨床試験研究者及びその第三者研究機関に依存して著者らの候補製品の研究開発と早期臨床テストを行う予定である。これらの科学者、調査者、そして機関には他の約束や利益の衝突がある可能性があり、これは私たちが彼らの専門知識を得ることを制限し、私たちの技術プラットフォームを利用する能力を損なうかもしれない。
私たちのいくつかの研究能力は私たちの第三者研究機関の協力者に依存している。しかし、私たちが援助した研究はすべての研究機関全体の研究の一部だけを占めている。このような機関が行っている他の研究は時々私たちが援助しているプロジェクトの研究よりも高い優先順位を得るかもしれない。従業員の指導活動と比べ、著者らは通常研究、臨床試験方案と患者募集に対するコントロールは比較的に少ない。
研究と開発を行う外部科学者や臨床試験研究者は私たちの従業員ではなく、逆に、彼らは独立した請負業者であるか、私たちが彼らが後援する学術または研究機関と締結した研究協力協定の下の主要な研究者である。そのような科学者と協力者たちは他の約束を持っているかもしれないが、これは私たちが彼らを得る機会を制限するだろう。私たちの科学コンサルタントは通常、相互競争の仕事をしないことに同意しているが、もし彼らが私たちのためにしてくれた仕事と、彼らが別の実体のためにした仕事との間に実際的または潜在的な利益の衝突が生じたら、私たちは彼らのサービスを失うかもしれない。これらの要因は,臨床試験の時間,臨床データの受信と報告時間,われわれがINDを提出した時間,および現在および計画中の臨床試験を行う能力に悪影響を及ぼす可能性がある。もしこれらの科学コンサルタントが私たちとの秘密協定に違反した場合、私たちのいくつかの価値のある専門知識もまた、これらの科学コンサルタントを通じて公開される可能性があり、これは私たちの業務に競争損害を与え、悪影響を及ぼすだろう。
私たちは過去に、将来的に協力や戦略的同盟を設立したり、あるいは将来的に追加的な許可計画を達成したりする可能性があり、私たちはこのような連合や許可手配の利点を意識していないかもしれない
私たちは過去に研究開発協力を達成しており、未来には追加の許可と協力計画が達成されるかもしれない。私たちが達成したどの協力計画も多くのリスクに直面しており、その中には以下のリスクが含まれている可能性がある
•協力者は、彼らが協力下の計画または製品候補の仕事および資源に適用されることを決定する上で大きな裁量を持っている
•パートナーは、私たちの候補製品の開発および商業化を行わない可能性があり、臨床試験結果、競争製品の買収による戦略的重点の変化、資金の利用可能性、または他の外部要因(例えば、資源の移転または競争優先権を創出する業務統合)に基づいて、開発または商業化計画を継続しないか、または継続しないか、または商業化計画を選択する可能性がある
•協力者は臨床試験を延期または一時停止し、臨床試験に十分な資金を提供し、患者を優先的に著者らの候補製品をテストしない臨床試験の一部に参加し、臨床試験を停止し、候補製品を放棄し、新しい臨床試験を繰り返しあるいは行うことができ、あるいは新しい候補製品の調合を要求して臨床試験を行うことができる
•協力者は、第三者開発と直接または間接的に我々の製品または候補製品と競合する製品を独立して開発するか、または第三者開発と直接または間接的に競合することができる
•協力者は私たちの製品をマーケティングして流通するのに十分な資源を投入していないかもしれない
•協力者は、私たちの知的財産権を正確に維持したり守ったりしていないかもしれないし、何らかの方法で私たちの知的財産権または独自の情報を使用して、それによって実際または脅威の訴訟を引き起こし、それによって、私たちの知的財産権または固有の情報を無効にしたり、私たちを潜在的な責任に直面させたりすることができる
•私たちと協力者の間で紛争が発生する可能性があり、私たちの候補製品の研究、開発または商業化の遅延または終了、または高価な訴訟や仲裁を招き、管理職の注意と資源を分散させる
•協力は終了することができ、終了すれば、適用可能な候補製品をさらに開発するために追加の資金が必要になるか、または商業化される可能性がある
•協力者は、私たちが協力して生成した製品候補製品の知的財産権を所有または共同で所有することができ、この場合、私たちはこのような知的財産権を商業化する独占的な権利を持っていない。
特に、いずれの協力者も、私たちの連携協定の下での義務を履行できなかったり、連携製品の開発や商業化に十分な努力をしたりすることができず、私たちの業務、財務状況、および私たちの運営結果に悪影響を及ぼす可能性があります
例えば,我々は以前,我々のNY-ESO-1計画や他の潜在的な製品機会についてのグラクソ·スミスクラインとの研究開発協力に参加し,2022年12月からGSKは合意を終了し,我々の遺伝的およびエピジェネティック再プログラミング技術(LYL 132とLYL 331)を採用した第2世代候補製品を含むNY-ESO-1に対する候補製品の開発を停止した
我々は、合弁企業や協力を構築したり、第三者と追加の許可手配を達成したりするためのさらなる戦略同盟を構成したり、求めたりすることが可能であり、これらの手配は、候補製品、研究、および任意の将来の候補製品の開発および商業化に関する私たちの努力を補完または強化すると信じている。そのような連合は上述した多くの危険に直面するだろう。さらに、これらの関係のいずれも、非日常的な費用や他の費用を発生させ、私たちの短期的および長期的な支出を増加させ、既存の株主を希釈した証券を発行したり、私たちの管理や業務を混乱させたりすることを要求することができる。また、適切な戦略的パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑である。
これらのリスクのため、私たちは既存の協力や任意の未来の協力、または私たちが締結する可能性のある許可協定の利点を達成できないかもしれない。私たちの候補製品に関連する新しい協力または戦略的パートナーシップ協定の任意の遅延は、いくつかの地域での候補製品の開発および商業化を延期する可能性があり、これは、私たちの業務の将来性、財務状況、および運営結果を損なうことになる。
私たちは将来の潜在的な協力、許可、製品買収、または他の戦略取引のメリットを認識していないかもしれない。
私たちは達成し、将来的に製品またはビジネスの機会を得るために協力、許可、または他の戦略的取引を達成することを望んでいるかもしれませんが、すべての場合、そのような計画は私たちの既存の業務を補完または拡大すると信じています。これらの関係や取引、または同様に、非日常的な費用や他の費用を発生させ、短期的および長期的な支出を増加させ、既存の株主を希釈した証券を発行し、関係の対象となる製品の潜在的な収益性を低下させたり、私たちの管理や業務を混乱させたりする必要があるかもしれない。たとえば,我々は2020年6月にPACTと連携協定と株式購入協定を締結し,2021年2月に仲裁要求を提出し,PACTとの合意を撤回し,合意による支払いの対価を回収することを求めた.2022年10月、未解決の法的紛争を解決するためにPACTと和解合意に達しました。第1項第3項を参照して法律訴訟PACTアービトレーションと和解プロトコルに関するより多くの情報を取得する.また、適切な戦略同盟と取引を求める上で激しい競争に直面しており、交渉過程は時間も複雑であり、そうしたいとしても、どの取引も達成できる保証はない。また、将来の候補製品および計画のための戦略同盟または他の代替手配を確立する努力は成功しない可能性があり、私たちの研究開発ルートが不足している可能性があるため、私たちの候補製品や計画は協力努力の早期開発段階にあると考えられる可能性があり、第三者は私たちの候補製品および計画が積極的な収益/リスクプロファイルを示すために必要な潜在力を持っているとは思わないかもしれない。私たちの候補製品に関連する新しい戦略連合協定のいかなる遅延も可能です
私たちの候補製品の開発と商業化を延期し、市場に進出しても競争力を低下させるだろう。
もし私たちが製品や買収業務を許可すれば、これらの取引を私たちの既存の運営や会社文化と組み合わせることに成功できなければ、これらの取引のメリットを実現できないかもしれません。これらの取引はまた、買収された知的財産権、製品または会社に関連する意外な責任、およびそのような取引が協力者またはサプライヤーとの関係を中断させることを含む他のリスクおよび不確実性にも関連する。買収が可能かもしれない後、私たちがこの取引の合理的な財務や戦略的結果を証明することが達成されるかどうかは確信できない。
私たちの候補製品について、私たちは現在と計画された臨床試験における患者の登録と保留状況に依存する。もし著者らが臨床試験中に患者を募集或いは保留する時に遅延或いは困難に遭遇すれば、著者らの研究開発仕事及び業務、財務状況と運営結果は実質的な不利な影響を受ける可能性がある。
臨床試験の成功と適時な完成は著者らが十分な数量の候補患者を募集と保留する必要がある。著者らが行ったいかなる臨床試験はすべて各種の原因で遅延する可能性があり、患者の登録時間が予想より長く、生産失敗による患者は治療を受けられない、患者の撤回或いは不良事件を含む。 このような種類の開発は私たちが実験を延期したり、さらなる開発を中断させることを招くかもしれない。例えば,LYL 797の第1段階試験の登録速度は予想よりも遅く,現在われわれの最初のLYL 797臨床データは2024年上半期に提出されると予想されている。
私たちの臨床試験は、私たちの候補製品と同じ治療分野での他の臨床試験と競合し、このような競争は、私たちの試験に参加することを選択する可能性のある患者の中には、私たちの競争相手のうちの1つによる試験に参加することを選択する可能性があるので、利用可能な患者の数およびタイプを減少させる。また,患者を承認された看護基準を有する疾患の臨床試験に組み込むことは挑戦的であり,患者がまず適用される看護基準を受けるからである。看護基準に積極的に反応する多くの患者は臨床試験に参加していない。これは,我々の臨床試験に参加することができる合格者の数を制限する可能性があり,これらの患者は我々の候補製品から利益を得る可能性があり,開発スケジュールを延長したり,これらの計画のコストを増加させたりする可能性がある。看護治療標準反応が悪い患者には未承認候補薬物の臨床試験を行う資格がある。しかし,これらの先行治療法はわれわれの治療法を臨床試験では効果が悪い可能性がある。
合格した臨床研究者と臨床試験地点の数が限られているため、著者らはいくつかの競争相手が使用している同じ臨床試験地点で著者らのいくつかの臨床試験を行い、これらの臨床試験地点で臨床試験を行うことができる患者数を減少させることが予想される。
患者の入選は多くの要素に依存しています
•患者群の大きさと性質;
•調査中の病気の重症度は
•試験の資格基準
•患者と臨床場所の距離
•臨床プログラムの設計
•患者の同意を得て維持する能力
•遺伝子組換え候補製品に関連する任意の知覚的リスクを含む、評価された候補製品の知覚されたリスクおよび収益;
•適切な能力と経験を持つ臨床試験研究者を募集する能力
•臨床試験に参加した患者は、私たちの製品候補薬または試験が完了する前に試験から退出するリスク;
•競争的臨床試験の有用性
•新冠肺炎の大流行期間中にこのような患者の獲得可能性;
•臨床試験で調査中の適応に基づいて承認された新薬の供給状況,および
•臨床医や患者は,研究中の薬物の他の既存療法に対する潜在的優位性に対する見方を示している。
これらの要素は私たちが十分な患者を募集して、適時かつ費用効果的に著者らの臨床試験を完成させることを困難にするかもしれない。候補品の完成を遅らせるとどんな臨床試験でもコストがかかり緩和されます
私たちの候補製品開発と承認の流れを下げ、製品販売を開始し、収入を創出する能力を遅延または潜在的に危険にさらします。さらに、臨床試験の開始または完了遅延をもたらすいくつかの要因は、最終的には、私たちの候補製品が規制部門の承認を拒否される可能性もある。
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも製品の発見、開発、商業化に成功する可能性がある。
私たちは多くの製薬やバイオテクノロジー企業からの競争と、学術機関、政府機関、民間、公共研究機関からの競争に直面している。もし私たちの競争相手が私たちが開発する可能性のある任意の製品よりも安全で、より効果的で、副作用が少ない、またはより安い製品を開発し、商業化すれば、私たちが臨床試験を登録する能力や私たちのビジネス機会は減少または消失するだろう。さらに、新しい上流製品または治療レジメンの変化が、現在または将来の目標疾患の全体的な発病率または流行率を低下させる場合、私たちのビジネス機会は減少または消失するであろう。関連する規制機関の承認を得られれば、競争は私たちの候補製品の販売と定価圧力を減少させるかもしれない。また、私たちの候補製品開発の重大な遅延は、私たちの競争相手が私たちより先に製品を市場に出し、私たちの候補製品のいかなる商業化能力を弱めるかもしれません。
規制と法律コンプライアンスに関連するリスク
私たちの候補製品の臨床開発は始まったばかりで、私たちの未来の成功は私たちの候補製品の成功開発と規制承認にかかっています。
私たちはまだ商業的に販売されている製品が承認されていません。私たちの候補製品の臨床開発は始まったばかりです。第一段階の臨床開発にあるLYL 797とLYL 845を除いて、著者らの他の候補特許製品は現在非臨床開発段階にある。私たちの業務の将来の成功は、私たちが求めている適応が規制機関の私たちの候補製品の承認を得ることができるかどうか、そして承認されれば、1つ以上の候補製品をタイムリーに商業化することに成功するかどうかに大きく依存する。私たちが製品販売から任意の収入を得る前に、私たちの各プロジェクトと候補製品は臨床開発、監督管理の承認、製造供給、能力と専門知識の獲得、商業組織の構築または商業化、大量投資、重大なマーケティング努力を成功させる必要がある。私たちは商業販売のために許可された製品は何もありません。私たちは決して適切な製品を開発したり商業化することができないかもしれません。
私たちは米国で候補製品を商業化することはできません。最初にFDAの規制承認を得なければなりません。同様に、比較可能な外国規制機関の規制承認が得られなければ、私たちは米国以外で候補製品を商業化することもできません。目標適応のための任意の候補製品の商業販売の規制承認を得る前に、私たちは、候補製品が安全で純粋かつ有効であり、目標適応に使用することができ、候補製品に関連する製造施設、プロセス、および制御が安全性、純度、および効力を確保するのに十分であることを、FDAおよび外国の規制当局によって提供され、満足できる大量の証拠を提供しなければならない。
FDAと類似の外国規制機関の承認を得るのに要する時間は予測不可能であるが、通常は非臨床研究と臨床試験開始後数年後に必要であり、監督機関のかなり大きな裁量権を含む多くの要素に依存する。また、承認政策、法規、あるいは承認を得るために必要な臨床データのタイプと数量は候補製品の臨床開発過程で変化する可能性があり、司法管轄区域によって異なる可能性がある。私たちはまだ候補製品の規制承認を得ていません。私たちの既存の候補製品や未来の候補製品は決して規制承認を受けないかもしれません。さらに、T細胞候補製品や次世代T細胞計画のような新製品候補の規制承認プロセスは、他のより有名またはより広く研究されている候補薬物または他の製品よりも複雑である可能性があるため、より高価で、所要時間が長い。
候補製品がFDAおよび同様の外国規制機関の承認を得ることに成功したとしても、どの承認も、特定の年齢層の使用制限、警告、予防措置または禁忌症に関連する重大な制限を含むことができ、または重い承認後の研究またはリスク管理要件の影響を受ける可能性がある。私たちが1つ以上の司法管轄区域で私たちの候補製品のうちの1つに対する規制承認を得ることができない場合、または任意の承認に重大な制限が含まれている場合、私たちは製品を開発し続けたり、候補製品に起因することができる収入を生成するのに十分な資金を得ることができないかもしれない。さらに、私たちの現在または未来の候補製品に対するいかなる規制承認も、一度承認されると、撤回されるかもしれない。
私たちの細胞治療候補製品は新しい治療方法を代表し、監督管理審査の強化、臨床開発の遅延或いは私たちは監督管理の承認、商業化或いは支払人が私たちの候補製品をカバーすることを実現できない可能性がある。
私たちの将来の成功は私たちの細胞療法の成功開発、特に私たちの開発製品候補にかかっている。これらの計画は癌を治療する新しい方法を代表しているため、私たちの候補製品を開発し、承認された後に商業化し、私たちは多くの挑戦に直面している。さらに、私たちは、私たちの細胞治療候補製品に関連する製造プロセスが、十分な安全、純粋かつ効果的、拡張可能、または有利な満足できる製品供給を生成することを保証することはできない。
FDAとIRBsがNIHが公布したガイドラインに基づいて監督するほか、遺伝子治療臨床試験はIBCの審査と監督を受け、IBCは地方機関委員会であり、この機構の組換え或いは合成核酸分子を用いた研究の審査と監督を担当している。IBCはこの研究の安全性を評価し、公衆の健康または環境に対する任意の潜在的リスクを決定する。NIHガイドラインは強制的ではないが,関連研究がNIH組換えや合成核酸分子研究助成を受けた機関で行われているか,あるいはその助成によって行われていない限り,多くの会社や他のNIHガイドラインに拘束されていない機関は自発的にこれらのガイドラインに従っている。FDAは遺伝子工学に係る細胞療法の試験を継続できるかどうかを決定しているにもかかわらず,他の審査機関の審査過程や決定は臨床試験の開始を阻害または延期する可能性があり,たとえFDAがこの試験を審査して起動を許可したとしても。
実際または知覚される安全問題は、新しい治療方法または新しい治療方法を採用することを含み、被験者の臨床試験への参加意欲に悪影響を及ぼす可能性があり、または適用される規制機関の承認を得た場合、医師は新しい治療機序を採用する意思に悪影響を及ぼす可能性がある。FDAまたは他の適用可能な規制機関は、規制承認前または後のいつでも、私たちの製品の利益またはリスクを知らせる他の情報が発生する可能性がある具体的な上場後要求を要求することができる。
医師、病院と第三者支払人は追加の前期コストと訓練を必要とする新製品、技術と治療実践を採用する上でよく行動が遅い。医師はこのような新しい療法を用いた訓練を受けたくない可能性があり,複雑すぎて,適切な訓練なしには採用できない,あるいは費用対効果に合わないと考え,施行しないことを選択する可能性がある。これらや他の要因から,病院や支払者はこのような新しい療法の利点を決定する可能性があり,そのコストを超えないか,あるいはそれを超えない可能性がある。
研究の結果、非臨床 研究あるいは早期の臨床試験は必ずしも未来の結果を予測できるとは限らない。私たちが臨床試験に入ったすべての候補製品は後の臨床試験で有利な結果がないかもしれないし、監督部門の承認も得られないかもしれない。
研究、非臨床研究と早期臨床試験の成功は今後の臨床試験が類似した結果を生むことを確保することができず、研究製品の有効性と安全性を証明するのに十分なデータを提供することができない。同様に,製薬やバイオテクノロジー業界のいくつかの会社は,我々よりも多くの資源や経験を持つ会社を含め,後期臨床試験で大きな挫折を経験し,早期の非臨床研究や臨床試験でも有望な結果を見ている。したがって、私たちの最初の研究と非臨床活動の結果が積極的に見えても、私たちが行う可能性のある後続の後期臨床試験が十分な有効性と安全性を証明するかどうかは不明であり、それによって監督部門が任意の候補製品の発売を許可することを招く。
また,最終的な研究結果は中期研究結果と一致しない可能性がある。後期臨床試験に有利な結果が生じなければ、任意の候補製品のための規制承認を得る能力は不利な影響を受ける可能性がある。私たちが規制承認申請が私たちの候補製品を市場に出すのに十分なデータがあると思っても、FDAや他の規制機関は同意しない可能性があり、追加の臨床試験を要求するかもしれません。
臨床開発は長くて高価な過程に関連しており、結果は不確定である。
私たちの候補製品はまだ臨床開発を始めたばかりです。第一段階の臨床開発にあるLYL 797とLYL 845を除いて、著者らの他の候補特許製品は現在非臨床開発段階にある。私たちの候補製品は失敗する危険が高い。私たちの候補製品の臨床試験と製造、そして私たちの製品の製造とマーケティングは、承認されれば、アメリカと私たちが候補製品をテストし、マーケティングしようとしている他の国と地域の多くの政府機関の広範かつ厳格な審査と監督を受けるだろう。私たちの任意の候補製品の商業販売が規制される前に、私たちは長い、複雑で高価な非臨床試験と臨床試験を通じて、私たちの候補製品が各目標適応において安全で効果的であることを証明しなければならない。特に,我々の候補製品は生物製品として規制されているため,安全,純粋かつ有効であり,その目標適応に利用できることを証明する必要がある。各候補製品は、その目標患者集団およびその目標用途において十分なリスクおよび収益状況を証明しなければならない。
我々が進めているどの候補製品を選択するのに必要な臨床試験も高価であり,完成には数年かかる可能性があり,その結果自体は不確定である。もしあれば、どんな臨床試験も計画通りに行われるか、予定通りに完成することは保証できません。臨床試験では,いつでも失敗する可能性がある。現在および計画中の臨床試験が計画通りに完了しても,それらの結果が候補製品の安全性や有効性を支持するか,あるいはそのような候補製品の継続的な臨床開発を支援するかは決定できない。非臨床と臨床試験で進展が得られたにもかかわらず、臨床試験後期段階の候補製品は期待される安全性と有効性特徴を示すことができないかもしれない。
また、これらの試験が成功しても、FDAや外国規制機関が私たちのように結果を解読する保証はなく、私たちが承認のために候補製品を提出する前に、より多くの試験を行う必要があるかもしれません。さらに、一方の法域が許容可能な支持承認の結果は、別の規制機関によって、別の法域の規制承認を支持するのに十分ではないと考えられる可能性がある。試験結果がFDAまたは外国規制機関を満足させてマーケティング申請を支援することができない場合、私たちは、候補製品の潜在的な承認を支援するために、追加の試験を行うために、入手できない可能性のある大量の資源を費やして、追加の試験を行う必要があるかもしれない。
今まで、私たちは私たちの候補製品を承認するために、どんな臨床試験も完全に募集または完成していません。開始,登録あるいは現在と計画中の臨床試験の進行に遅延が生じる可能性があり,臨床試験が時間どおりに開始あるいは登録されるかどうか,再設計が必要かどうか,期待される登録率に達するかどうか,あるいは予定通りに完成するかどうかは分からない。例えば、LYL 797第1段階試験の登録速度は、予想よりも遅い。また,われわれが計画したLYL 845多固形腫瘍適応の第一段階臨床試験では,十分かつ特定の腫瘍組織を得る必要がある。私たちは特定の腫瘍組織或いは十分な数の腫瘍組織を迅速に或いは根本的に得ることができず、計画中の臨床試験を開始する能力を延期或いは排除する可能性がある。FDAや同様の外国の規制機関が将来的に私たちの候補製品の臨床試験を一時停止しないことは保証されない。臨床試験は、様々な理由で遅延、一時停止または終了することができる
•十分な非臨床的、毒理学的、あるいは他のものを作ることはできません体内にあるあるいは…体外培養臨床試験を開始するデータをサポートします
•高度臨床試験に適用される製造技術の十分な開発、表現或いは制御に遅延が発生した
•FDAや他の規制機関との臨床試験の設計や実施について合意しました
•臨床試験開始の規制を受けています
•臨床試験場所あるいは未来のCROと受け入れ可能な条項について合意し、その条項は広範な交渉を行うことができ、異なる臨床試験地点の間に有意差がある可能性がある
•各試験地点でIRBまたは道徳委員会の承認を得た
•適切な患者を臨床試験に参加させる
•患者に臨床試験を完成させ、或いは治療後のフォローアップを行った
•適用された監督機関が臨床試験場所或いは操作を検査し、或いは臨床一時停止を実施する
•臨床サイト、CRO、または他の試験レジメンから外れているか、または試験を終了する第三者;
•FDAのGCP要件、または他の国/地域の適用法規要件を含む適用される法規要件に適合しない
•試験過程中に出現した患者の安全問題を解決し、候補製品に関連する不良事件の発生を含み、これらの不良事件はその潜在的なメリットを超えていると考えられている
•十分な数の臨床試験点を増やし
•臨床試験のために十分な数の候補製品を生産する;または
•上述した要因を含む一連の要因により、IRBsは、そのような試験を行っている機関、データ安全監視委員会、またはFDA、または他の規制機関がこのような試験を一時停止または終了する。
さらに、多くの要因により、規制要件または我々の臨床規程に従って臨床試験が行われていないこと、FDAまたは他の規制機関が臨床試験操作または試験場所を検査することにより、臨床試験の強制実施、予見不可能な安全問題または副作用、候補製品の使用のメリットを証明できなかったこと、政府法規または行政措置の変化、または臨床試験を継続するのに十分な資金が不足していることが含まれているため、臨床試験は、私たち、そのような試験を行っている機関の機関審査委員会、そのような試験のデータ監視委員会またはFDAまたは他の規制機関によって一時停止または終了される可能性がある。
もし可能であれば、私たちが所与の臨床試験を完了するかどうかを確実に予測することはできない。もし私たちが候補製品の任意の臨床試験を行い、完成または終了する時に遅延または品質の問題に遭遇した場合、候補製品の承認および商業見通しは損なわれ、候補製品から製品収入を得る能力は延期されるだろう。また、臨床試験を完成するいかなる遅延も私たちのコストを増加させ、私たちの候補製品の開発と承認過程を緩和し、そして私たちの製品販売と収入を創造する能力を危険にさらす。臨床試験の開始または完了遅延をもたらす多くの要因は、最終的に私たちの候補製品が規制部門の承認を拒否される可能性がある。
私たちの候補製品は、不良な副作用や、その規制承認を遅延または阻止し、承認ラベルを制限すること、または任意の規制承認後に重大な負の結果をもたらす可能性のある他の特性を引き起こす可能性がある。また、私たちの候補製品が承認されれば、ラベルや他の制限や市場撤退を受ける可能性があり、規制要求を遵守していない場合や私たちの製品が予期せぬ問題に遭遇した場合、私たちは罰を受けるかもしれません。
私たちの候補製品による副作用は、私たちまたは規制機関の臨床試験の中断、延期、または停止を招く可能性があり、より厳しいラベルをもたらすか、またはFDAまたは他の同様の外国の規制機関の規制承認を延期または拒否する可能性がある。私たちが臨床試験で遭遇する可能性のある安全や毒性の問題のため、私たちはいかなる候補製品の開発も継続しないかもしれませんし、いかなる候補製品の販売の承認も得られないかもしれません。これは私たちが製品の収入を作ったり、利益を達成することを阻止するかもしれません。例えば,従来のCAR T細胞を用いた血液腫瘍治療の臨床試験では,サイトカイン放出症候群や免疫効果細胞関連神経毒性症候群のリスクが増加することが示唆されている。有害事象は細胞療法で使用されているリンパろ過レジメンにも関与している可能性がある。また,ROR 1は多くの正常組織に発現している.したがって,ROR 1は標的上,腫瘍外の毒性を引き起こすことができる。C-junも潜在的な癌遺伝子であり、健康な細胞を悪性細胞に変換する可能性がある。我々の実験結果は,許容できない重症度や副作用発生率,あるいは副作用が候補製品のメリットを超えている可能性がある。この場合、私たちの実験は一時停止または終了される可能性があり、FDAまたは同様の外国規制機関は、私たちの任意またはすべての目標適応を承認する候補製品の開発を停止または拒否するように命令することができます。経験された副作用は、患者募集または被験者が試験を完了する能力に影響を与えるか、または潜在的な製品責任クレームをもたらす可能性がある。
もし私たちの候補製品が規制機関の承認を得て、私たちまたは他の人が後にこのような製品による不良または受け入れられない副作用を発見すれば、多くの潜在的な重大な負の結果を招く可能性がある
•規制部門は、このような製品の承認を撤回または制限し、承認された製品を市場から撤退させることを要求するかもしれない
•規制当局は、医師および薬局にラベル宣言、具体的な警告、禁忌症または現場警報を追加すること、または警告または他の製品セキュリティ情報を含む他の通信を発行することを要求することができる
•規制当局は、患者に配布するために、このような副作用のリスクを概説するための薬物ガイドラインを必要とするか、または製品の利点がそのリスクよりも大きいことを確実にするために、リスク評価および緩和戦略(REMS)計画を実施することができる
•私たちは製品の投与量や投与方法を変更し、追加の臨床試験を行うか、製品のラベルを変更することを要求されるかもしれない
•私たちは製品をどのように普及させたり製造したりするかについて制限されるかもしれません
•この製品の販売台数は大幅に減少する可能性がある
•私たちは訴訟や製品責任クレームの影響を受ける可能性があります
•私たちの名声は損なわれるかもしれない。
これらの事件のいずれも、私たちまたは潜在的な未来のパートナーが影響を受けた製品に対する市場の受容度を達成または維持することを阻止するか、または商業化コストおよび費用を大幅に増加させる可能性があり、さらに、任意の製品の販売から大量の収入を得ることを延期または阻止する可能性がある。
私たちが時々発表或いは公表した臨床試験の中期、バックライン或いは初歩データはより多くの患者データの出現或いは著者らの生産プロセスの変更に従って変化する可能性があり、そして監査と検証プログラムの制限を受け、これは最終データの重大な変化を招く可能性がある。
著者らは時々著者らの非臨床研究と臨床試験の中期、主要或いは初歩的なデータを公開開示する可能性があり、これらのデータは当時使用可能なデータの初歩的な分析に基づいて、特定の研究或いは試験に関連するデータに対してより全面的な審査を行った後、結果及び関連する発見と結論は変化する可能性がある。私たちはまた、私たちのデータ分析の一部として、すべてのデータを全面的かつ詳細に評価する機会がないか、または受け取る機会がないかもしれないという仮説、推定、計算、および結論を出した。また,我々が治療に用いた製造プロセスの修正や改善は,候補製品の特性や挙動を変化させる可能性があり,候補製品の表現が異なり,我々が行っている臨床試験の結果に影響を与える可能性がある。したがって,我々が報告したバックライン結果は,同じ研究の将来の結果とは異なる可能性があり,あるいはより多くのデータを受信して十分な評価を行うと,異なる結論や考慮要因がこれらの結果を合格させる可能性がある。バックラインデータはまだ監査と確認手続きを受ける必要があり、これは最終データが私たちが以前に発表した予備データと大きく異なる可能性がある。したがって、最終データが利用可能になる前に、バックラインデータは慎重に表示されなければならない。
時々、私たちはまた、私たちの非臨床研究と臨床試験の初歩的または中期的なデータを開示するかもしれない。臨床試験の初歩或いは中期データは患者登録の継続とより多くの患者データの獲得に伴い、1つ或いは複数の臨床結果は実質的に変化する可能性があるというリスクに直面している。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。さらに、私たちまたは私たちの競争相手が予備または中間データを開示することは、私たちの普通株の価格変動を招くかもしれない。
さらに、他の人は、規制機関を含み、私たちの仮説、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の価値、特定の候補製品の承認または商業化、およびわが社の全体的な状況に影響を与える可能性がある。もし私たちが報告した中期、バックライン、または予備データが実際の結果と異なる場合、または規制機関を含む他の人が結論に同意しない場合、私たちは任意の潜在的候補製品を獲得し、それを商業化する能力が損なわれる可能性があり、これは私たちの業務、経営業績、将来性、または財務状況を損なう可能性がある。
FDAの規制承認過程は長く、時間がかかり、本質的に予測できない。もし私たちが必要な規制部門の私たちの候補製品の承認を得ることができなければ、私たちの業務は深刻な損害を受けるだろう。
私たちは私たちの候補製品の新規性が規制部門の承認を得ることに挑戦すると予想している。例えば,FDAは癌T細胞療法のビジネス開発における経験が限られている。したがって、私たちの候補製品の規制承認経路は不確実で複雑で高価で長く、承認されないかもしれない。
米国または海外で任意の候補薬物製品を商業化することが承認される前に、私たちは厳格に制御された臨床試験を通じて大量の証拠を提供し、FDAまたは外国の監督管理機関に満足させなければならない。これらの候補薬物はその期待用途に対して安全、純粋かつ有効である。非臨床研究と臨床試験の結果は異なる方法で解釈できる。私たちの候補製品の非臨床的または臨床的データが有望だと信じていても、これらのデータはFDAおよび他の規制機関の承認を支持するのに十分ではないかもしれない。FDAはまた、承認前または後に私たちの候補製品に対して追加の非臨床研究または臨床試験を行うことを要求するか、または私たちの臨床開発計画の要素に反対する可能性がある。
私たちの候補製品は多くの理由で規制部門の承認を得ることができないかもしれません
•FDAまたは同様の外国の規制機関は、私たちの臨床試験の設計または実施に同意しないかもしれない
•私たちは、候補製品がその提案に対する適応が安全で有効であることをFDAまたは同様の外国の規制機関に証明することができないかもしれない
•臨床試験結果はアメリカ食品薬品監督管理局或いは類似の外国監督管理機関が許可した統計的意義レベルに符合しない可能性がある
•候補製品の臨床的および他の利益がその安全リスクよりも大きいことは証明できないかもしれない
•FDAまたは同様の外国の規制機関は、臨床および商業用品契約を締結する第三者メーカーの製造プロセスまたは施設を承認できない可能性がある
•FDAや同様の外国機関の承認政策や法規は大きく変化する可能性があり、私たちの臨床データは承認を得るのに十分ではない。
大量に開発されている製品のうち、一部のみがFDAや外国規制機関の承認手続きに成功し、商業化されている。長い承認とマーケティング許可プロセスおよび臨床試験結果の予測不可能性は、私たちの業務、財務状況、運営結果、および将来性を深刻に損なう規制部門の承認およびマーケティング許可を得ることができない可能性があります。
もし医師が患者を募集して私たちの候補製品の臨床試験に参加して、安全性と有効性のファイルを確立した既存の治療方案を処方した場合、解決されていない倫理的問題に遭遇し、私たちも遅延に遭遇する可能性がある。さらに、多くの要因により、規制要件または我々の臨床規程に従って臨床試験が行われていないこと、FDAまたは他の規制機関が臨床試験操作または試験場所を検査することにより、臨床試験の強制実施、予見不可能な安全問題または副作用、候補製品の使用のメリットを証明できなかったこと、政府法規または行政措置の変化、または臨床試験を継続するのに十分な資金が不足していることが含まれているため、臨床試験は、私たち、そのような試験を行っている機関の機関審査委員会、そのような試験のデータ監視委員会またはFDAまたは他の規制機関によって一時停止または終了される可能性がある。
また、私たちの臨床試験の首席研究員は時々私たちの科学顧問や顧問を担当し、このようなサービスに関連する現金または株式補償を得るかもしれない。これらの関係と任意の関連賠償が感知または実際の利益の衝突をもたらし、または監督機関が財務関係が試験の解釈に影響を及ぼす可能性があると結論した場合、適用される臨床試験サイトで生成されたデータの完全性が疑問視される可能性があり、臨床試験自体の効用が脅かされる可能性があり、これにより、私たちが提出したマーケティング申請が遅延または拒否される可能性がある。このような遅延や拒否のいずれも、私たちの現在または未来の候補製品の商業化を阻止または遅延させることができる。
もし私たちが任意の候補製品の臨床試験が終了したり、完成が遅れたりする場合、私たちの候補製品のビジネスの将来性は損なわれ、私たちが製品収入を作る能力は延期されるだろう。また、臨床試験を完成するいかなる遅延も私たちのコストを増加させ、私たちの製品開発と審査過程を緩和し、そして私たちの製品販売と収入を創造する能力を危険にさらす。臨床試験の開始または完了遅延をもたらす多くの要因は、最終的に私たちの候補製品が規制部門の承認を拒否される可能性がある。
私たちの候補製品が規制部門の承認を得ても、私たちは持続的な義務と持続的な規制審査の制約を受けることになり、これは多くの追加費用を招く可能性がある。また、私たちの候補製品が承認されれば、ラベルや他の制限や市場撤退を受ける可能性があり、規制要求を遵守していない場合や私たちの製品が予期せぬ問題に遭遇した場合、私たちは罰を受けるかもしれません。
FDAまたは同様の外国規制機関が私たちの任意の候補製品を承認する場合、製品の製造プロセス、テスト、ラベル、包装、流通、輸入、輸出、有害事象報告、貯蔵、広告、販売促進、および記録は、広範で持続的な規制要件を受けるだろう。これらの要件には,安全性や他の上場後の情報や報告書の提出,登録,および承認後に行われた任意の臨床試験がcGMPを遵守し続けることが含まれており,これらは巨額の費用を招き,このような製品を商業化する能力を制限している。さらに、候補製品のために得られた任意の規制承認は、製品上場の承認指示用途の制限または承認条件によって制限される可能性があり、または第4段階臨床試験、および候補製品の安全性および有効性を監視するモニタリングを含む可能性の高い上場後試験要件を含む可能性がある。
製造業者および製造業者の施設は、品質管理および製造手順がcGMP法規に適合することを保証すること、および我々のいくつかの候補製品の生産のために、ヒト細胞および組織製品を使用して感染症の導入、伝播または伝播を防止するためのcGTPを含むFDAおよび同様の外国規制機関の広範な要求に適合しなければならない。したがって、私たちと私たちの契約製造業者は、cGMP、cGTPの遵守状況、および任意の承認されたマーケティング申請に対する約束の遵守状況を評価するために、持続的な審査および検査を受ける。したがって、私たちと私たちと協力している他の人たちは、製造、品質管理、流通を含むすべての規制コンプライアンス分野に時間、お金、エネルギーを投入し続けなければならない。
法律または法規政策の適用が変化した場合、または製品または私たちの製品製造に問題があることが発見された場合、または私たちまたは私たちの流通業者、ライセンシーまたは協力営業者のうちの1つが遵守できなかった場合
規制要件、規制機関は様々な行動を取ることができる。これらの措置には、警告状または無見出し状を発行し、罰金を科し、製品またはその製造に制限を加え、市場からその製品をリコールまたは下積みすることを要求することが含まれている。規制当局はまた、私たちのマーケティング許可を一時停止または撤回し、より多くの臨床試験を行うこと、私たちの製品ラベルを変更すること、またはより多くのマーケティング許可申請を提出することを要求することができる。このような事件が発生した場合、私たちがこのような製品を販売する能力が損なわれる可能性があり、規制要求を遵守するために多くの追加費用が発生する可能性があり、これは私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性がある。
また、もし私たちが承認された候補製品があれば、私たちの製品ラベル、広告、販売促進は規制要求と持続的な規制審査を受けるだろう。アメリカでは、FDAと連邦貿易委員会(FTC)は薬品に関する販売促進声明を厳格に監督し、このような製品に関するいかなる声明も監督管理部門の承認と一致することを保証し、いかなる特定の方法で誤解或いは虚偽でもなく、臨床データによって十分に実証されている。虚偽、誤解、実証されていない、または未承認(またはラベル外)用途のための方法で薬品を宣伝することは、FDA、FTCおよび他の規制機関が実行書を発行し、問い合わせおよび調査を行い、民事および刑事制裁を実施する可能性がある。特に、製品は、当該製品が承認されたラベルに反映されるように、FDA承認されていない用途に使用されてはならない。もし私たちが候補製品のマーケティング承認を得たら、医者は承認されたラベルと一致しない方法で患者に処方するかもしれない。もし私たちがこのようなラベル外の使用を普及させることを発見されたら、私たちは重大な責任を負うかもしれない。FDAおよび他の機関は、非ラベル用途を促進することを禁止する法律および法規を積極的に実行し、非ラベル用途を促進していないことが発見された会社は、重大な制裁を受ける可能性があり、連邦および州法規に基づいて虚偽のクレーム訴訟を引き起こす可能性があり、これは、法令、民事罰金、原状回復、刑事罰金、監禁、連邦医療保険加入から除外される可能性がある, 医療補助金と他の連邦と州医療計画。連邦政府は不正販売促進の疑いのある会社に巨額の民事と刑事罰金を科し、いくつかの会社がラベル外販売促進に従事することを禁止している。政府はまた、企業に同意法令および/または永久禁止令を締結し、これらの禁止に基づいて特定の販売促進行為を変更または制限することを要求する。
規制当局が、予期せぬ深刻度または頻度の不良事象など、製品に以前に未知の問題があることを発見した場合、または製品の製造施設に問題がある場合、または製品の販売促進、マーケティング、またはラベルに同意しない場合、規制機関は、製品の市場からの撤退を要求することを含む、製品または私たちに制限を加えることができる。もし私たちが適用される規制要求を遵守できなければ、規制機関や法執行当局は他の措置を取るかもしれない
•警告状を出す
•安全警報、現場警報、医療専門家への“尊敬する医師”の手紙、または警報の入力など、安全に関連する通信を発行または発行することが求められている
•民事または刑事罰を加える者
•規制承認の一時停止、制限、または撤回
•私たちの非臨床研究や臨床試験を中断します
•私たちが提出した保留申請または承認された申請を承認する補充申請を拒否する;
•私たちと私たちの契約メーカーの工場を閉鎖することを含む、私たちの業務に制限を加える;または
•製品を差し押さえたり差し押さえたりして、製品の輸出入を許可することを拒否したり、製品のリコールを要求したりします。
政府は違法の疑いのあるいかなる調査にも対応するために多くの時間と資源を必要とする可能性があり、否定的な宣伝が生じる可能性がある。現行法規の要求を守らないいかなる行為も、承認されれば、私たちの製品の商業化と創造能力に重大な悪影響を及ぼす可能性がある。規制制裁を実施したり、規制承認を撤回したりすれば、わが社の価値と私たちの経営業績は悪影響を受けるだろう。
さらに、FDAや同様の外国規制機関の政策が変わる可能性があり、私たちの候補製品に対する規制承認を阻止、制限、または延期するための追加の政府法規が公布される可能性がある。米国や海外の将来の立法や行政または行政行動によって生じる可能性のある政府規制の可能性、性質、程度を予測することはできない。例えば、トランプ政権中、いくつかの行政命令の発行を含むいくつかの行政行動がとられており、これらの行政命令は、FDAが通常の監督活動に参加する能力に大きな負担をかけたり、規則の制定、指導意見の発表、マーケティング申請の審査および承認によって法規を実行するなど、他の方法でこの能力を延期している。どうなるか予測するのは難しいです
同様の命令は将来的に実施され、それらはFDAがその規制権力を行使する能力にどの程度影響を与えるだろうか。行政行動をとると、FDAが正常な過程で活動を監督·実行する能力を制限することができ、私たちの業務はマイナスの影響を受ける可能性がある。さらに、私たちが既存の要求の変化に緩やかに適応できない場合や、新しい要求や政策を採用することができない場合、または規制適合性を維持できなければ、私たちが得る可能性のあるマーケティング承認を失う可能性があり、利益を達成したり維持したりすることができないかもしれません。
私たちはリベートと虚偽の声明、透明性、健康情報のプライバシーと安全、および他の医療法を含む適用される詐欺と乱用を受けるかもしれない。このような法律を守らなければ、重大な処罰を受けるかもしれない。
私たちは広く適用される医療法律と法規の制約を受けるかもしれません。これらの法律と法規は、私たちが研究、マーケティング、販売、流通を行うことを制限するかもしれません。私たちがマーケティングの承認を得た任意の候補製品の業務または財務配置と関係を制限します。私たちに影響を与える可能性のある医療保険法には、連邦詐欺と乱用法、連邦反ダンピング法、虚偽クレームと民事罰金法、経済·臨床健康情報技術法案によって改正された“健康保険携帯性と責任法”を含む連邦データプライバシーと安全法がある。所有権および投資権益、ならびに医師(医師、歯科医師、検眼師、足科医および脊椎マッサージ師を含む)、他の医療専門家(例えば、医師アシスタントおよび看護師)および教育病院への支払いまたは保有の他の価値移転に関する連邦透明性法律、ならびに医師およびその直系親族が所有する所有権および投資権益に関する情報。また,多くの州には類似した法律法規があり,他の州や連邦法律とは大きく異なり,コンプライアンス作業を複雑化させている可能性がある。また、いくつかの州は生物製薬会社に生物製薬業界の自発的コンプライアンスガイドラインと連邦政府が公布した関連コンプライアンスガイドラインを遵守することを要求し、医師および他の医療保健提供者への支払いと他の価値移転またはマーケティング支出に関する情報を報告するように製薬業者に要求する可能性がある。また、いくつかの州と地方の法律はこの司法管轄区に生物薬品販売代表を登録することを要求している。
我々の運営と将来の第三者の業務配置が適用される医療法律や法規に適合することを確保することは、多くのコストに及ぶ。政府当局は、私たちの商業行為は、私たちと医師および他の医療保健提供者との関係を含む可能性があり、その中の一部の人は、コンサルティングサービスを提供することによって株式オプションの形で補償され、現在または未来に適用される詐欺および乱用または他の医療に関する法律および法規に関連する現在または将来の法律、法規、機関指導または判例法に適合しない可能性があると結論するかもしれない。私たちの運営が、上記の任意の法律または任意の他の私たちに適用される可能性のある政府の法律および法規に違反していることが発見された場合、私たちは、重大な民事、刑事および行政処罰、損害賠償、返還、罰金、監禁、医療計画(MedicareおよびMedicaidのような)から製品を排除すること、追加の報告要件および/または監督に直面する可能性があります(これらの法律違反に関する告発および削減または再編業務を解決するために会社の誠実な合意または同様の合意に署名した場合)。しかも、違反はまた名声の損傷、利益の減少、そして未来の収入の低下を招く可能性がある。われわれの業務に影響を及ぼす可能性のある医療保健法のより詳細な情報については,2022年12月31日現在の今年度報告10−K表の商業部分の“他医療保健法”を参照されたい。
医療政策、法律、法規の変化は、私たちが承認されたり、私たちの候補製品を商業化したりする能力に影響を与える可能性がある。
アメリカと一部の外国司法管轄区では、すでに医療保健制度に対して数回の立法と監督管理改革を行い、コストをコントロールし、質を高め、医療サービスを獲得する機会を拡大するために改革提案を提出する。米国では,医療に関する多くの立法イニシアティブや,既存の医療法の行政,司法,国会への挑戦が継続されており,これらの法律は医療業界に著しく影響を与え続けている可能性がある。例えば、2010年に“医療·教育和解法案”(総称して“平価医療法案”)が改正され、いくつかの条項が成功した2010年の“患者保護·平価医療法案”の一部または全部の条項の廃止、大幅な改正、または廃止に努めている。米国最高裁は2021年6月にACAが“個人権限”を廃止し、ACAが現在の形で有効であることを許可したため、ACAが完全に違憲と弁明した手続き理由に基づく挑戦を却下したにもかかわらず、このような努力は継続される可能性がある
また、政府はメーカーが製品の価格を販売する方法の審査を強化し続けており、これは、いくつかの米国大統領行政命令、国会調査、および薬品価格の透明性の向上、政府支払者計画下の処方薬コストの低減、および価格設定とメーカー患者計画との関係を審査するための連邦と州立法を招いている。例えば、総裁·バイデンは2021年7月に行政命令を発表し、立法による薬品定価改革の実施を支持し、それに応えて、アメリカ衛生と公衆サービス部は
アメリカ衛生·公衆サービス部(HHS)は2021年9月に高い薬価に対応する総合計画を発表し、その中には国会が制定できる具体的な立法と行政政策を含み、処方薬の負担性と獲得性の向上を助ける。また、2022年8月16日、総裁·バイデンは、(I)連邦医療保険がカバーするいくつかの高支出、単一由来の薬物および生物製品の価格についてHHSに指示し、法律で定められた協議以下の“最高公平価格”の価格を提供することにより、医薬品メーカーに対して民事罰金と潜在的消費税を行うよう指示し、(Ii)連邦医療保険B部分およびD部分に基づいてリベートを実施し、インフレを超える価格上昇を処罰する2022年“インフレ率低減法案”(IRA)に署名した。また、アイルランド共和軍はACA市場で医療保険を購入した個人への増強補助金を2025年まで延長する。2025年からアイルランド共和軍は新たに設立されたメーカー割引計画により、受益者の最大自己負担コストを著しく低減し、連邦医療保険D部分計画下の“ドーナツの抜け穴”を解消した。アイルランド共和軍は衛生と公共サービス部が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。アイルランド共和軍がどのように実施されるかは不明であるが,製薬業に大きな影響を与える可能性がある。さらにバイデン政府は2022年10月14日に追加の行政命令を発表しました, HHSに90(90)日以内に報告書を提出するよう指示し,連邦医療保険と医療補助革新センターをさらに利用して連邦医療保険と医療補助受益者の薬品コストを低減する新しいモデルをテストする方法を説明した。この行政命令や同様の政策措置が将来的に実施されるかどうかは不明である。私たちは将来的により多くのアメリカ連邦医療改革措置を取ることが予想され、そのいずれも米国連邦政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの候補製品に対する需要の減少や追加の価格設定圧力を招く可能性がある。われわれの業務に影響を及ぼす可能性のある医療改革の詳細については,2022年12月31日までの年次報告Form 10−Kにおける業務部分の“医療改革”を参照されたい。
私たちの候補製品の商業化の成功は、政府当局と健康保険会社が十分な保険範囲、精算レベル、価格設定政策を確立する程度にある程度依存する。もし私たちの候補製品がカバー範囲を獲得または維持し、十分な精算を得ることができなければ、承認されれば、これらの製品をマーケティングする能力を制限し、収入を創出する能力を低下させる可能性がある。
FDAが承認した場合、政府医療計画(例えば、MedicareおよびMedicaid)、個人健康保険会社および他の第三者支払者が提供する保険および精算の可用性および十分性は、多くの患者が私たちの候補製品などの処方薬を負担することができるために重要である。政府当局、個人健康保険会社、その他の組織の製品に対する保険と精算レベルを実現できるかどうかは、私たちの候補製品を商業化する能力に影響を与えるだろう。第三者支払者が自己の保険·精算政策を設定する際には,通常連邦医療保険引受政策と支払制限に依存する。しかしながら、提供されるべき補償範囲および金額に関する決定は、支払者毎に基づいて行われる。第三者支払者の精算は、第三者支払人が安全、有効かつ医学的に必要であることを決定すること、特定の患者に適していること、費用効果があること、同業者によって審査された医学雑誌の支持を得ること、臨床実践ガイドラインに含まれること、および美容的、実験的でもなく、研究的でもないことを含む多くの要素に依存する可能性がある。第三者支払者が候補商品のために保険を受けていると仮定すると,それによる精算支払率が十分に高くない可能性があり,あるいは患者が受け入れられないと考えて受け入れられないほど高い共同支払いが必要となる可能性がある。私たちの候補製品や私たちが開発する可能性のある任意の製品がアメリカ、EU、あるいは他の場所で保険と精算を受けることができるかどうかを確認することはできません。将来的には入手可能な精算を減らしたりキャンセルしたりする可能性があります。また…, 私たちまたは私たちの協力者は、私たちの候補製品と一緒に使用するセット診断テストを開発するかもしれません。私たちまたは私たちの協力者は、私たちの製品候補者のために求められるかもしれない保険と精算を除いて、これらのテストのために単独で保険と精算を受けることを要求されるだろう。
同じように、医療産業の重要な傾向は費用統制だ。第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。したがって、費用統制改革努力は私たちの運営に悪影響を及ぼすかもしれない。医師の監督下で投与される価格が高いため、私たちの候補製品のために保険と十分な補償を得ることは特に難しいかもしれない。同様に,我々の候補製品は医師が管理するため,製品自体の単独精算もできない可能性がある。逆に、管理医は、私たちの製品を使った治療やプログラムを提供することで精算されないかもしれません。
資金不足や世界的な健康問題によるFDAや他の政府機関の中断は、重要な指導部や他の人員の採用、保留、配置の能力を阻害する可能性があり、あるいは新製品や修正された製品のタイムリーまたは開発、承認、商業化を他の方法で阻止することは、私たちの業務にマイナスの影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、法律、法規と政策の変化、FDA雇用と保留の鍵を含む様々な要素の影響を受ける可能性がある
FDAが日常的な機能を果たす能力に影響を与える可能性のある使用料や他のイベントの支払いを受ける。したがって、その機関の平均検討時間は近年変動している。また,他の研究開発活動を援助する政府機関への政府の援助は政治過程の影響を受けており,この過程は本質的に不安定で予測不可能である。FDAおよび他の機関の中断もまた、新しい生物製品が承認されたり、許可されたり、生物製品が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。例えば、ここ数年間、米国政府は何度か閉鎖されており、FDAのようないくつかの規制機関は、FDAの従業員を休暇にし、重要な活動を停止しなければならない。
また,新冠肺炎に対応するため,2020年3月,米国食品薬品監督管理局は外国製造施設の大部分の検査を延期しようと発表し,米国食品·薬物管理局も国内製造施設の定例監督検査を一時的に延期した。FDAは2022年2月に国内製造施設の現場検査を再開し,リスクに基づく優先制度を遵守した。FDAは、このリスクに基づく評価システムを使用して、特定の地理的地域内で発生する可能性のある規制活動種別を決定し、重要な任務検査からすべての規制活動を回復することを意図している。さらに、FDAは、2021年4月に、ある薬物製造施設および臨床研究場所の自発的な遠隔インタラクション評価を行う計画を記述した指導文書を発表した。ガイドラインによれば,FDAは対面検査が優先されない場合や重要なタスクとされている場合や,直接検査が旅行によって制限されている場合には,FDAが遠隔評価が適切であると判断した場合には,このような遠隔インタラクション評価を要求する予定である.新冠肺炎疫病に対して、アメリカ以外の規制機関は類似した制限或いは他の政策措置をとる可能性がある。政府が長期的に停止している場合、または世界的な健康問題がFDAまたは他の規制機関の定期検査、審査または他の規制活動を阻害し続けている場合、FDAまたは他の監督管理機関が私たちの規制提出を適時に審査し、処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。
私たちの知的財産権に関するリスクは
もし私たちが候補製品のために十分な知的財産権保護を得ることができなければ、あるいは知的財産権保護の範囲が十分でなければ、私たちの候補製品の商業化と効果的な競争に成功する能力は不利な影響を受ける可能性がある。
私たちは特許、商標、商業秘密、秘密協定の組み合わせによって、私たちの技術および候補製品に関連する知的財産権を保護します。私たちはいくつかの知的財産権を持っているか、または持っていて、他の知的財産権は私たちのパートナーが所有したり所有したりして、私たちに許可されている。私たちが私たちの技術、発明、特許、特許出願または他の知的財産権に言及すると、私たちは私たちの知的財産権保護と私たちの業務に重要な私たちの知的財産権保護および私たちの業務に重要な私たちの所有または所有する権利と私たちの許可の権利を意味する。もし私たちが依存している知的財産権が十分に保護されていなければ、競争相手は私たちの技術を使用して、私たちが持つ可能性のあるいかなる競争優位性を侵食または否定するかもしれない。
発明の特許性およびバイオテクノロジー分野特許の有効性,実行可能性,範囲は不確定であり,複雑な法律,科学的,事実的考慮に関連しており,近年重大な訴訟のテーマとなってきた。また、米国特許商標局(USPTO)および非米国特許庁が特許を付与する際に適用される基準は、常に統一的または予測可能ではない。私たちの特許および特許出願に関連するすべての潜在的に関連する以前の技術が私たちに知られているか、または検索の場合に発見されたことも保証されない。私たちは、既存技術が、発行された特許を無効にするために使用されるか、または係属中の特許出願を特許発行として阻止するために使用されることができることを知らないかもしれない。私たちが知っているかもしれませんが、私たちは、私たちの特許または特許出願の権利要件の有効性、実行可能性、または特許性に影響を与えるとは考えられませんが、最終的には、その特許請求の有効性、実行可能性、または特許性に影響を及ぼすことが発見される可能性があります。これらおよび他の要因のため、私たちの特許出願は、発行された特許が、米国または他の国/地域における私たちの候補製品をカバーすることを招くことができないかもしれない。
特許が特許出願から成功裏に発表されたとしても、これらの特許が私たちの候補製品をカバーしていても、第三者は、その有効性、実行可能性、または範囲に疑問を提起する可能性があり、これは、これらの特許が縮小され、無効にされ、または実行不可能と認定される可能性がある。もし挑戦されたら、私たちの特許は裁判所によって効果的または強制的に執行可能だと宣言される保証はない。挑戦されていなくても、私たちの特許や特許出願や他の知的財産権は、私たちの知的財産権を十分に保護できず、私たちの候補製品に排他性を提供したり、他の人が私たちの声明を中心に設計することを阻止したりすることができない可能性がある。他の人は、私たちの候補製品と同じ効果を有し、私たちの特許または他の知的財産権を侵害しない製品を独立して開発するか、または他の人は、私たちが発表した候補製品をカバーする特許の権利要件を中心に設計される可能性がある。もし私たちの特許及び特許出願が以下の態様で保護の広さ又は強度を提供する場合
もし私たちの候補製品が脅かされたら、候補製品を商業化する能力を危険にさらすかもしれませんし、会社が私たちと協力することを勧めます。
私たちはまた、私たちの候補製品の排他性を提供すること、または制限されない方法で候補製品を開発し、それを商業化する能力を提供することに役立つ可能性がある知的財産権を有する第三者に許可を求めることを望むことができる。私たちが商業的に合理的な条項で第三者からこのような許可を得ることができる保証はない、あるいは全く保証できない。
さらに、米国特許商標局および様々な外国政府または政府間特許機関は、特許出願中および後に、いくつかのプログラム、文書、費用支払い、および他の同様の規定を遵守することを要求する。多くの場合、適用された規則に従って滞納金を支払うことによって、または他の方法で不注意を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効を招き、関連する法域特許権の一部または全部、不可逆的な喪失をもたらす可能性がある。この場合、私たちの競争相手が市場に参入する可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。
2013年3月16日までに優先権日を有する権利を有していない権利を含むか、または任意の時間に含まれる米国特許出願は、“米国発明法”(2011)によって実施される“最初に提出する”制度の制約を受けなければならない。まず出願制度であり,発明から特許出願までの時間を認識することが求められる。米国およびほとんどの他の国の特許出願は出願後しばらくは秘密であり、一部の特許出願は発行前に依然として秘密であるため、候補製品に関連する特許出願を最初に提出した会社であるか、私たちまたはパートナーが初めてであることを確認することはできない。
さらに、我々の登録または未登録商標または商号は、挑戦、侵害または汎用商標として宣言されるか、または他の商標を侵害していると認定される可能性がある。私たちはこれらの商標や商品名に対する私たちの権利を保護できないかもしれませんが、これらの商標と商品名は、私たちが関心のある市場で潜在的なパートナーや顧客の知名度を確立するために価値があると思います。時々、競争相手または他の第三者が、私たちと同様の商品名または商標を採用するか、または採用することができ、それによって、ブランド識別を確立する能力を阻害し、市場混乱および/または訴訟を引き起こす可能性がある。さらに、他の登録商標または商標の所有者は、我々の登録または未登録商標または商号の変異体を含む商号または商標侵害クレームを提出することができる。長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。私たちが商標に関連する固有の権利を実行、保護、または擁護する努力は無効である可能性があり、巨額のコストおよび資源移転をもたらす可能性があり、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性がある。
私たちの特許の生命期は私たちの製品と業務を効果的に保護するのに十分ではないかもしれない。
特許の寿命は限られている。米国では、特許の自然失効時間は、通常、その最初の非一時的有効出願日から20年後である。様々な延期がある可能性があるにもかかわらず、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許を取得しても、製品の特許有効期限が切れると、私たちは生物類似薬や模倣薬からの競争に直面する可能性がある。さらに、米国で特許が発行された場合、USPTOによるいくつかの遅延により、特許の寿命を延長することができるが、特許出願人の特許訴訟中に生じるいくつかの遅延により、このような増加は、減少または除去することができる。いくつかの特許の特許期間は、臨床試験およびFDA規制審査において損失した時間を取り戻すために特定の製品に対して延長されてもよいが、特許の寿命は、以前に提出された特許または特許出願の終了免責宣言によって短縮されてもよい。もし私たちが私たちの製品を保護するのに十分な特許期間がなければ、私たちの業務と経営結果は悪影響を受けるだろう。
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
世界各国での私たちのすべての候補製品申請、起訴、強制執行、特許保護の費用は目を引くほど高いだろう。アメリカ以外の特定の国での私たちの知的財産権はアメリカの知的財産権の広範さを持っていないかもしれない。しかも、ある国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。したがって、私たちと私たちのパートナーは、米国以外の国で第三者が私たちの発明を実施したり、他の管轄区域で私たちの発明を使用して製造した侵害製品を販売したり、輸入したりすることを阻止できないかもしれない。競争相手は、私たちがまだ特許保護を受けていないか、または関連特許の下で独占的な権利を持っていない司法管轄区で私たちの技術を使用して自分の製品を開発することができ、私たちと私たちのパートナーに特許保護を持っているかもしれませんが、法執行力はアメリカの地域に比べて他の侵害製品を輸出することができません。これらの侵害製品は、私たちまたは私たちのパートナーが特許を発行していないか、または関連特許の下で独占的な権利を持っていない私たちの司法管轄区域で私たちの候補製品と競争することができないかもしれません。あるいは私たちの特許主張と他の知的財産権は彼らの競争を効果的に阻止できないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許や他の知的財産権保護の実行、特に生物製薬に関連する特許保護を支持しておらず、これは、私たちと私たちのパートナーが、私たちの特許の侵害を阻止したり、私たちの知的財産権に違反する競争製品を販売したりすることを困難にする可能性がある。外国の管轄区域で私たちの特許権を強制的に執行する訴訟手続きは巨額のコストを招く可能性があり、私たちの業務の他の方面への注意を移すことは、私たちの特許が無効または偏狭に解釈されるリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちまたは私たちのパートナーにクレームを提起する可能性がある。私たちまたは私たちのパートナーは、私たちまたは私たちの許可者が起こしたいかなる訴訟でも勝利しないかもしれません。私たちまたは私たちのライセンシーが勝訴しても、判決された損害賠償または他の救済措置(もしあれば)は商業的な意味がないかもしれません。
多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では、私たちまたは私たちのパートナーは限られた救済措置を持っている可能性があり、これはこのような特許の価値を大幅に低下させるかもしれない。もし私たちまたは私たちのパートナーが私たちの業務に関連する任意の特許の許可を第三者に付与することを余儀なくされた場合、私たちの競争地位は損なわれる可能性があり、私たちの業務、財務状況、運営結果、および見通しは不利な影響を受ける可能性があります。
もし私たちが第三者の知的財産権の侵害や流用で起訴されれば、それによる訴訟は費用が高く時間がかかる可能性があり、私たちの開発と商業化努力を阻害または延期する可能性があります。
私たちのビジネスの成功は、私たちと私たちのパートナーが第三者の特許と独自の権利を侵害しないことにある程度かかっている。米国国内外では,バイオテクノロジーや製薬業界に関連する特許や他の知的財産権に関する訴訟や他の対抗性訴訟の数が大きく,特許侵害訴訟,妨害または派生訴訟,異議,および米国特許商標局と非米国特許庁で行われている当事者間および認可後審査手続きが含まれている。我々が開発·開発可能な候補製品分野には,米国や非米国から発行された特許や第三者が所有する未解決特許出願が多く存在する.バイオテクノロジーおよび製薬業界の拡張および特許の発行に伴い、私たちの候補製品は、私たちを含む業界参加者が、どの特許が様々なタイプの製品、製造方法、または使用方法をカバーしているかを常に明らかにしていない可能性があるので、第三者特許権侵害のクレームのリスクが増加する可能性がある。特許のカバー面は裁判所の解釈に依存し、解釈は常に統一的または予測可能ではない。
第三者は、既存または未来の知的財産権に基づいて、私たちが彼らのノウハウを不正に使用していると主張する権利侵害または流用クレームを私たちに提起するかもしれない。我々の候補製品の使用または製造に関連する第三者特許または特許出願が存在する可能性があり、これらの特許または特許出願は、材料、配合、製造方法または治療方法を必要とするが、これらの特許または特許出願を識別することができない。例えば、これらの出願は、通常、提出日後の一定期間秘密に維持されているので、私たちの候補製品に関する特許出願は、私たちが知らずに他の人によって提出される可能性がある。すでに公表されている係属中の特許出願であっても、私たちが知っているいくつかの特許出願を含めて、私たちの候補製品またはその使用または製造をカバーするために、後で修正されることができる。さらに、私たちは、私たちの活動に関連していると考えられる第三者特許または特許出願を分析し、私たちの任意の候補製品に対して自由に運営できると考えているかもしれませんが、私たちの競争相手は、私たちが関係ないと思う特許を含む、発表されたクレームを得るかもしれません。これは、私たちの努力を阻害したり、私たちの任意の候補製品や私たちの活動が彼らのクレームを侵害する可能性があります。
もし私たちまたは私たちのパートナーが特許侵害によって起訴された場合、私たちは私たちの候補製品、製品、および方法が関連特許の特許主張を侵害していないか、または特許主張が無効または実行不可能であることを証明する必要があり、私たちはそれができないかもしれない。特許が無効であることを証明することは困難であり、関連訴訟で勝訴しても、私たちは巨額のコストを招く可能性があり、私たちの管理者や科学者の時間と注意力は他の活動から移行する可能性がある。管轄権のある裁判所が、私たちの材料、処方、製造方法、または治療方法の様々な態様をカバーするために、発行された第三者特許のいずれかの特許の1つまたは複数の特許要件を持っている場合、関連特許が満了するまで、(裁判所命令を含む)関連候補製品の開発、製造、または商業化を停止させることを余儀なくされる可能性がある。代替的に、私たちは、権利侵害技術を使用し、侵害候補製品の開発、製造、またはマーケティングを継続するために、第三者の許可を得ることを望むか、または要求される可能性がある。しかし、私たちは商業的に合理的な条項で必要な許可証を得ることができないかもしれないし、全く得られないかもしれない。たとえ我々が許可を得ることができても,これらの権利は非排他的である可能性があり,これは我々の競争相手が許可を得た同じ知的財産権へのアクセス権をもたらす可能性がある.もし私たちが商業的に合理的な条項で必要な許可を得ることができない場合、あるいは根本的にできなければ、候補製品を商業化する能力は損害や遅延を受ける可能性があり、これは逆に私たちの業務を深刻に損なう可能性がある。
私たちは第三者の機密情報や商業秘密を流用する疑いに直面するかもしれない。もし私たちが第三者の商業秘密を盗用したことが発見されたら、私たちはこれらの商業秘密のさらなる使用を阻止されるかもしれません。これは私たちの候補製品を開発する能力を制限するかもしれません。
知的財産権の主張を弁護し、その是非曲直にかかわらず、結果がどうであっても、費用が高く、時間がかかる可能性がある。したがって、私たちが最終的に勝訴したり、最終判決の前に和解が成立したりしても、どの訴訟も思わぬ費用を私たちにもたらす可能性がある。また,訴訟や脅威訴訟は,我々の管理チームの時間や注意力に大きな要求を与え,会社の他の業務への追求を分散させる可能性がある.任意の知的財産権訴訟において、聴聞結果、動議裁決、および訴訟における他の一時的手続きが公開される可能性があり、これらの発表は、私たちの候補製品、手続き、または知的財産権の知覚的価値に悪影響を及ぼす可能性がある。もし私たちの知的財産権に対するクレームが成功すれば、私たちは3倍の損害賠償と弁護士費を含めて巨額の損害賠償を支払わなければならないかもしれない(もし私たちが故意に特許侵害が発見された場合)、あるいは私たちの侵害製品候補製品を再設計することは不可能かもしれないし、多くの時間とお金の支出が必要かもしれない。金銭賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性があり、私たちにクレームをつけた当事者は禁止令や他の衡平法の救済を受ける可能性があり、これは私たちの業務行為に制限を加えるかもしれない。私たちはまた、訴訟前に特許侵害クレームを解決するためにライセンス契約を締結することを選択することができ、これらのライセンス契約のいずれも、印税および他の可能性のある高額な費用の支払いを要求する可能性がある。上記のすべての理由により、実際または脅かされた知的財産権クレームは、私たちが候補製品を開発または商業化することを阻止したり、いくつかの態様の業務運営を停止させたりする可能性がある。
私たちは私たちのパートナーから知的財産権のかなりの部分の許可を得た。もし私たちがこれらのパートナーとの任意の許可協定に違反すれば、私たちは私たちの1つまたは複数の候補製品を開発し、潜在的に商業化し続ける能力を失うかもしれない。
パートナーとの許可協定によると、私たちは権利を持っている。我々の発見と開発技術プラットフォームは,我々がパートナーから許可を得た知的財産権を中心にある程度構築されている.私たちの既存のライセンス契約によると、開発や商業化活動に関連する職務義務、いくつかのマイルストーンを実現する際の支払い義務、製品販売の印税が含まれている可能性があります。もし私たちと私たちの取引相手との間に、これらの許可協定の下での私たちの権利または義務について、私たちが職務調査や支払い義務を履行できなかったことによるいかなる衝突、論争、または分岐を含む紛争、論争、分岐、または不履行の問題が存在すれば、私たちは損害賠償金を支払う必要があり、私たちの取引相手は影響を受けた許可を終了する権利があるかもしれない。私たちのパートナーの1人との任意のライセンス合意を終了することは、ライセンス契約によって制約された知的財産権を発見および開発作業において使用する能力、影響を受けた1つまたは複数の候補製品に対して将来の協力、許可および/またはマーケティング協定を達成する能力、および影響を受ける候補製品を商業化する能力に悪影響を及ぼす可能性がある。さらに、これらのライセンスプロトコルのいずれにおいても、以下に関連するものを含む分岐が生じる可能性がある
•ライセンス契約に従って付与された権利範囲および解釈に関連する他の問題;
•私たちの技術およびプロセスが、ライセンス契約に拘束されていないライセンス側の知的財産権をどの程度侵害する可能性があるかどうか
•我々は、協力開発関係に基づいて特許及び他の権利を第三者に再許可する権利;及び
•私たちの許可者、私たちと私たちのパートナーが共同で知的財産権を創造または使用することによって生成された発明およびノウハウの所有権。
このような相違は私たちとパートナーとの関係を損なう可能性があり、これは私たちの業務の他の側面に否定的な影響を及ぼすかもしれない。
私たちは、買収およびライセンス内の許可によって、私たちの開発プロセスにおける製品コンポーネントおよびプロセスの必要な権利を取得または維持することに成功できないかもしれません。
現在、私たちは知的財産権を持っており、第三者からのライセンスと、私たちが所有または所有する特許出願によって、私たちの候補製品を開発しています。私たちの計画は他の候補製品に関連する可能性があり、第三者が保有する独占権を使用する必要があるかもしれないので、私たちの業務の成長は、私たちがこれらの独占権を取得、許可、または使用する能力にある程度依存するかもしれない。
私たちの候補製品はまた、効率的かつ効率的に動作するために特定の配合物、製造方法、または技術を必要とする可能性があり、これらの権利は他の人によって保持されている可能性がある。私たちは、私たちが決定した第三者から、任意の成分、使用方法、プロセス、または他の第三者知的財産権を得ることができるかもしれない。私たちは合理的な費用または合理的な条項でこのようなライセンスのいずれかを得ることができないかもしれない;このような失敗は私たちの業務を損なうだろう。たとえ我々が許可を得ることができても,それは非排他的である可能性があり,我々の競争相手がアクセスできるようにする
同じ技術が私たちに許可された。この場合、私たちは代替技術を開発または許可するために多くの時間と資源を必要とするかもしれない。私たちはこのような第三者知的財産権によってカバーされている成分や方法の使用を止める必要があるかもしれない。
第三者知的財産権の許可や買収は競争分野であり、私たちよりも成熟しているかもしれないし、より多くの資源を持っている会社も、私たちの候補製品を商業化するために必要または魅力的だと思う第三者知的財産権許可または買収戦略を実施しているかもしれません。より成熟した会社は私たちより競争優位にあるかもしれません。それらの規模、現金資源、そしてより強い臨床開発と商業化能力のためです。
政府が援助したプロジェクトによって発見された知的財産権は、“進行権”、いくつかの報告要件、および米国会社の選好のような連邦法規の制約を受ける可能性がある。これらの規定を遵守することは、私たちの独占権を制限し、非アメリカメーカーと契約を締結する能力を制限するかもしれない。
私たちはすでに許可を得たり、あるいは将来的には米国政府の資金や贈与を使用することで生じる知的財産権が必要になるかもしれない。1980年の“ベハ·ドール法案”によると、米国政府は政府が援助して開発した発明に対して何らかの権利を持っている。米国政府のこれらの権利は、任意の政府の目的のために発明を使用する非排他的、譲渡不可能、撤回不可能な世界的許可を含む。さらに、いくつかの限られた場合、米国政府は、(I)発明を商業化するのに十分なステップを取っていない場合、(Ii)政府は、公衆衛生または安全需要を満たすために行動しなければならない、または(Iii)政府は、公共使用に対する連邦法規の要求(“デモ権利”とも呼ばれる)を満たすように行動しなければならない、上述した任意の発明の独占的、部分的、または非独占的許可を第三者に付与することを要求する権利がある。付与者が政府に発明を開示していない場合、又は所定の期限内に知的財産権登録申請を提出していない場合、米国政府もこれらの発明の所有権を取得する権利がある。政府援助の計画の下で生成された知的財産権もいくつかの報告要求によって制約されており、この要求を守るには大量の資源が必要かもしれない。また、, 米国政府は、上記のいずれかの発明を含む製品、またはこれらのいずれかの発明を使用して製造された製品は、実質的に米国で製造されなければならないことを要求している。知的財産権の所有者または譲受人が、合理的ではあるが成功しない努力をしたことを証明することができ、同様の条項で潜在的な被許可者に許可を付与することができ、これらの許可が米国で大量生産される可能性があり、またはこの場合、国内製造が商業的に不可能である場合、資金を提供する連邦機関は、米国工業のこのような選好を放棄する可能性がある。このような米国工業への偏愛は、このような知的財産権がカバーする製品について非米国製品メーカーと契約する能力を制限するかもしれない。
私たちは私たちの知的財産権を保護または強制的に執行する訴訟に巻き込まれるかもしれないが、これは高価で時間がかかり、成功しない可能性があり、私たちの業務の成功に悪影響を及ぼすかもしれない。
第三者は私たちの特許を侵害したり、流用したり、他の方法で私たちの知的財産権を侵害する可能性がある。我々の特許出願は、特許が出願から発行されるまで、および発行されるまで、発行された特許要件が技術の範囲をカバーする限り、これらの出願に要求される技術を実施する第三者に対して実行することはできない。将来的に、私たちまたは私たちのパートナーは、私たちまたは私たちのパートナーの知的財産権を強制または保護し、私たちまたは私たちのパートナーの商業秘密を保護し、または私たちの知的財産権の有効性または範囲を決定するために、法的手続きを開始することを選択することができる。私たちまたは私たちのパートナーは、侵害者が提起したと思われる任意のクレームに対して、これらの当事者が私たちまたは私たちのパートナーに反訴し、私たちまたは私たちのパートナーが彼らの知的財産権を侵害したり、私たちの知的財産権を無効にしたと主張することを促進するかもしれません。米国の特許訴訟では、被告が特許不侵害、無効、および/または強制執行不可能と主張する反訴はありふれており、第三者は様々な理由に基づいて特許不侵害、無効、または強制執行が不可能であると断言することができる。不侵害、特許不可、無効及び実行不可能な法律主張によれば、結果は予測不可能である。例えば、特許権の有効性については、無効な以前の技術がないとは判断できませんが、私たち、私たちの特許弁護士、特許審査員は起訴中にそれを知りません。被告が非特許性、無効性、および/または実行不可能な法的主張に勝った場合、私たちは候補製品の少なくとも一部またはすべての特許保護を失うだろう。このような特許保護の喪失は私たちの業務に実質的な悪影響を及ぼすかもしれない。
第三者によって引き起こされる、我々または我々のパートナーによって提起される、または米国特許商標局または任意の非米国特許機関によって提起される干渉、派生または反対手続きは、私たちの特許または特許出願に関連する発明または在庫事項の優先権を決定するために必要である可能性がある。私たちまたは私たちのパートナーはまた、再審または異議手続き、当事者間の審査、認可後審査、または他の許可前または許可後手続きのような、米国特許商標局またはその外国同業者における私たちの知的財産権または他人の知的財産権に関連する他の手続きに参加することができる。このような訴訟は、私たちの候補製品をカバーして保護しないように、私たちの特許が撤回または修正される可能性がある。これらの訴訟のいずれの不利な結果も、私たちまたは私たちのパートナーに関連技術の使用を停止し、私たちの候補製品を商業化することを要求するか、または勝利者から許可権利を得ようと試みるかもしれない。勝利者が私たちや私たちの製品を提供しなければ、私たちの業務は損害を受けるかもしれません
もしどんな許可が提供されれば、パートナーは商業的に合理的な条項で許可を得るだろう。たとえ我々または我々の許可者が許可を得ても,我々の競争相手が許可または我々の許可側の同じ技術にアクセスできるように非排他的である可能性がある.さらに、私たちの特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、会社が私たちと協力し、現在または将来の候補製品を許可、開発、または商業化することを阻止するかもしれない。
どんな知的財産権訴訟も費用が高くて時間がかかるかもしれない。私たちまたは私たちのパートナーと比較して、私たちまたは私たちのパートナーは、このような訴訟における相手が、このような法的行動を起訴するためにより多くの資源を投入する能力があるかもしれない。したがって、私たちまたは私たちのパートナーは努力しているにもかかわらず、私たちまたは私たちのパートナーは、第三者が私たちの知的財産権を侵害したり、流用したりすることを阻止できないかもしれません。特に法律ではアメリカのように私たちの権利を十分に保護する国がないかもしれません。関連訴訟で勝訴しても、私たちは巨額のコストを招く可能性があり、私たちの管理者や科学者の時間と注意力は他の活動から分流する可能性があります。さらに、侵害訴訟では、裁判所は、私たちの1つまたは複数の特許の全部または一部が無効または強制的に実行できないと判断することができ、私たちの特許が関連技術をカバーしていないこと、および/または相手の弁護士費の支払いを要求することが可能であることを理由に、他方の論争のある技術の使用を阻止することを拒否することができる。どんな訴訟手続きの不利な結果も、私たちの1つ以上の特許を無効が宣言されるか、強制的に実行できないか、または狭い解釈される危険性に直面させる可能性がある。
さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。さらに、公聴会、動議、または他の一時的な手続き、または事態の発展の結果が発表される可能性がある。
私たちは私たちの特許と他の知的財産権発明権のクレームに疑問を受けるかもしれない。
私たちは将来、元従業員、協力者、または他の第三者が発明者または共同発明者として私たちの特許または他の知的財産権で権益を持っているというクレームを受けるかもしれない。例えば、私たちの候補製品開発に参加するコンサルタントや他の人の義務衝突によって在庫紛争が生じる可能性があります。訴訟はこれらと他の挑戦在庫のクレームに対抗するために必要かもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭損害賠償を支払うことに加えて、知的財産権の独占所有権や使用権のような貴重な知的財産権を失う可能性がある。このような結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
もし私たちが私たちの商業秘密と他の固有情報の機密性を保護できなければ、私たちの技術的価値は不利な影響を受ける可能性があり、私たちの業務は損害を受けるかもしれない。
特許提供の保護を求めることに加えて、我々は、特許を出願できない独自技術、特許を実施することが困難な方法、および我々の技術、発見および開発中に特許に含まれないノウハウ、情報または技術に関する他の要素を選択するために、商業秘密保護および秘密保護プロトコルに依存して保護する。第三者による私たちの機密固有情報の開示または流用は、我々の候補製品と実質的に類似したまたは競争力のある製品を開発し、それを商業化し、市場における私たちの競争的地位を侵食することを含む、競争相手に当社の技術成果を迅速に複製または超えることを可能にする可能性がある。
商業秘密は保護するのが難しいかもしれない。私たちは、従業員、コンサルタント、外部科学コンサルタント、請負業者、協力者と秘密協定および発明譲渡協定を締結することによって、私たちの独自、秘密保持の技術およびプロセスを保護することを求めています。このような協定は私たちの固有の情報を保護することを目的としている。私たちは合理的な措置を取って私たちの商業秘密を保護しているにもかかわらず、私たちの従業員、コンサルタント、請負業者、または外部科学コンサルタントは、私たちの商業秘密または機密、独自の情報を競争相手に意図的にまたは意図的に漏らしてしまう可能性がある。また,競争相手は我々のビジネス秘密を他の方法で取得したり,基本的に同じ情報や技術を独立して開発したりする可能性がある.もし私たちの任意の機密固有情報が競争相手によって合法的に取得または独立して開発された場合、私たちはその競争相手がその技術または情報を使用して私たちと競争することを阻止する権利がなく、これは私たちの競争地位を損なう可能性がある。
第三者が私たちのいかなる商業秘密を不法に取得して使用することを強要するかは高価で時間がかかり、結果は予測できない。さらに、ある国/地域の法律は、ビジネス秘密などの独自の権利の保護の程度や方法が米国の法律とは異なる。私たちのビジネス秘密を第三者に開示することは、市場での競争優位性を損なう可能性があり、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性がある。
私たちは、当社の従業員、コンサルタント、または独立請負業者が、競合禁止または非募集義務に違反し、および/または第三者の機密情報を誤って使用または開示することに関するクレームを受ける可能性があります。
私たちは第三者から機密と固有の情報を受け取った。しかも、私たちは他のバイオテクノロジーや製薬会社に以前雇われていた個人を雇っている。私たちは、私たちまたは私たちの従業員、コンサルタント、または独立請負業者が無意識に、または他の方法で、これらの個人の前の雇用主に関連する競業禁止または非募集義務に違反しているか、またはこれらの第三者またはこれらの個人の前の雇用主の機密情報を使用または開示していると非難される可能性がある。このようなクレームを処理し、潜在的なクレーム者と交渉することは、巨額のコストを招き、私たちの経営陣と従業員の注意を分散させる可能性がある。また、これらのクレームに対抗するための訴訟が必要となる可能性があり、これらのクレームに成功しても、このような訴訟はさらなるコストをもたらし、経営陣や従業員の注意を分散させる可能性がある。
私たちの普通株式所有権に関連するリスク
デラウェア州の法律と私たちが改正して再説明した会社の登録証明書と定款の条項は、わが社の支配権の変更や私たちの経営陣の変更を阻止、延期、阻止する可能性がありますので、私たちの普通株の取引価格を低くします。
私たちが改正して再記述した会社の登録証明書および定款の条項は、株主が有利と思うかもしれない合併、買収、または他の支配権の変化を阻止、延期、または阻止する可能性があり、私たちの普通株を保有することによって割増取引を得ることができる可能性があります。このような規定はまた私たちの株主が私たちの経営陣を交代または更迭しようとしていることを阻止したり挫折させたりする可能性がある。したがって、このような規定は私たちの普通株の価格に悪影響を及ぼすかもしれない。他の事項を除いて、私たちの組織ファイル:
•私たちの取締役会は3級、I級、II級、III級に分けられ、各級は3年間交互に在任していることを確認した
•私たちの役員は理由がある場合にのみ免職されることになっています
•私たちの取締役会の空きは、当時在任していた取締役の大多数が埋めることしかできないことになっていた
•役員選挙での累積投票権を廃止する
•私たちの取締役会に優先株を発行することを許可し、株主の承認なしに優先株や投票権を含むこれらの株式の価格やその他の条項を決定する
•株主が正式に開催される年次会議や特別会議で行動することのみを許可し、一致した書面同意を得るのではなく、
•株主による株主特別会議の開催を禁止する
•株主が株主総会の審議のために取締役の指名を事前に通知するか、または株主総会の審議のために提案を提出するよう要求する
•当社の取締役会が附例のいくつかの条項を修正することを多数の票で許可し、
•上記の多くの条項を修正するためには、少なくとも66 2/3%以上の普通株式流通株の賛成票が必要である。
また、デラウェア州一般会社法(DGCL)第203条は、当該業務合併が所定の方法で承認されない限り、デラウェア州上場企業が取引日後3年以内に利害関係のある株主と業務合併を行うことを禁止しており、当該株主は、通常、その関連会社と所有しているか、または過去3年以内に議決権を有する株を所有している者である。
当社の会社登録証明書の改訂と再記載、改訂と再記載の会社定款やデラウェア州法律の遅延または制御権の変更を防止する条項は、私たちの株主が彼らが保有する私たちの株式の株式から割増の機会を得ることを制限する可能性があり、一部の投資家が私たちの普通株に支払う価格に影響を与える可能性もあります。
我々の会社登録証明書の改正と再記述は、デラウェア州衡平裁判所は、私たちと私たちの株主とのほとんどの紛争の独占法廷となり、これは、私たちの株主が有利な司法法廷を得ることを制限することができ、私たちまたは私たちの役員、上級管理者、または従業員との紛争を処理する能力を制限することができる。
私たちが書面で代替裁判所を選択することに同意しなければ、デラウェア州衡平裁判所はデラウェア州成文法または一般法の下で次のタイプの訴訟または手続きの独占裁判所となることが規定されている
•私たちが提起した任意の派生訴訟や法的手続きを代表する
•当社または当社の株主に対する当社の取締役、上級管理者または他の従業員または株主の受託責任に違反すると主張するいかなる訴訟も;
•当社又は当社が改訂及び再記載された会社の登録証明書及び付例のいずれかの条文に基づいて提出された任意の訴訟;及び
•内政原則に支配されているという主張を主張するいかなる行為も。
また、複数の司法管区でクレームを提訴せざるを得ないことや、異なる裁判所が不一致や逆裁決を行う脅威などの考慮要因を回避するために、我々が書面で代替裁判所を選択することに書面で同意しない限り、改正された1933年の証券法(証券法)に基づいて提出された任意の訴因を解決する独自のフォーラムとなることも規定されている。しかし、これらの規定は、取引法で規定された義務や責任を執行するための訴訟には適用されず、連邦裁判所が排他的管轄権を有する他のクレームにも適用されない。当社の株式株式の任意の権益を購入または保有するいかなる方法であっても、上記条文の通知を受け、上記条文に同意したとみなされる。これらの裁判所条項の選択は、私たちまたは私たちの役員、上級管理者、他の従業員または代理人、または私たちの他の株主との紛争をより有利にすると考える株主のクレームを司法裁判所で提起する能力を制限する可能性があり、これは、私たちおよびこれらの他の人に対するこのような訴訟を阻止するか、または私たちにクレームを提起する株主の追加費用を求めることにつながる可能性がある。代替的に、裁判所がこの選択された裁判所条項が1つまたは複数の特定のタイプの訴訟または訴訟手続きに適用されないことを発見した場合、私たちは、他の管轄区域でそのような事項を解決することに関連する追加費用を生じる可能性があり、これは、私たちの業務、運営結果、および財務状態に悪影響を及ぼす可能性がある。
私たちは過去に、私たちが財務報告書の内部統制に重大な弱点を持っているということを発見した。もし私たちが将来的により多くの重大な弱点を発見したり、財務報告に対する有効な内部統制を維持できなかったりすれば、私たちの財務状況や運営結果を正確かつタイムリーに報告することができない可能性があり、これは私たちの業務と私たちの普通株の価値を深刻に損なう可能性がある。
上場企業として、財務報告書の内部統制を維持し、このような内部統制におけるいかなる重大な弱点も報告することが求められている。“サバンズ-オキシリー法”(Sarbanes-Oxley Act)404節(404節)は、財務報告書の内部統制に対する私たちの有効性を評価し、決定することを要求する。この評価はこのような内部統制のすべての重要な弱点を開示することを含む必要がある。重大な欠陥とは、財務報告の内部制御に欠陥或いは欠陥の組み合わせが存在し、著者らの連結財務諸表の重大なミス報告が合理的な可能性があり、適時に防止或いは発見できないようにすることである。
2019年12月31日現在および本年度までの総合財務諸表の最終定稿について、我々と独立監査人は、財務報告の内部統制に重大な弱点があり、一部の負債の決済のための技術会計の審査に関連していると結論した。具体的には、2019年のAシリーズ優先株融資に関連して、Aシリーズ優先株負債の金額を最初に配当として記録した後、Aシリーズ優先株負債の公正価値が変化する他の営業外費用を増加させるための訂正調整を記録しました。この負債が2019年2月に決算された後、他の部分負債も存在しない。
私たちは、より多くの会計·財務報告者を招聘することでこの重大な弱点を補っており、2022年12月31日までの年度の連結財務諸表定稿に関する重大な弱点は発見されていないと信じていますが、将来的に他の重大な弱点が発見されないことを保証することはできません。
また、私たちはすべての重大な弱点を発見していないかもしれませんが、私たちの現在の制御と私たちが開発したどんな新しい制御も、人員や業務条件の変化や他の理由で十分ではないかもしれません。したがって、将来のいかなる重大な欠陥も、私たちの総合財務諸表の重大なミス報告および/または私たちの公開報告義務を履行できなかったことを保証することはできません。また、私たち及び/又は私たちの独立公認会計士事務所が結論を出すことができない場合、財務報告に対する内部統制は
将来的には、連結財務諸表の正確性と完全性に対する投資家の信頼が悪影響を受けることになり、これは私たちの業務と私たちの普通株の価値を深刻に損なう可能性がある。
一般リスク因子
財務報告書を適切かつ効果的な内部統制を維持することができなければ、正確かつタイムリーな総合財務諸表を作成する能力が損なわれる可能性がある。
第404条によれば、米国証券取引委員会にForm 10−K年次報告書を提出してから、我々の経営陣は、財務報告の内部統制の有効性を報告することを要求され、独立公認会計士事務所は、我々の財務報告内部統制の有効性を証明することを要求される。管理管理層が財務報告内部統制を評価するために達成しなければならない基準の規則は複雑であり、大量の文書、テスト、可能な救済措置が必要である。取引法における報告会社としての要求に適合するためには、追加の財務·管理制御、報告システム、およびプログラムを実施し、追加の会計および財務者を招聘する必要がある。
私たちはあなたに未来の私たちの財務報告書に対する内部統制に重大な欠陥や重大な欠陥が発生しないということを保証することはできません。財務報告を内部統制できなかったいかなる行為も、財務状況、運営結果、またはキャッシュフローを正確に報告する能力を深刻に抑制する可能性がある。もし私たちが財務報告の内部統制に有効であるという結論を出すことができない場合、あるいは私たちの独立公認会計士事務所が私たちの財務報告の内部統制に重大な弱点や重大な欠陥があると判断した場合、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの普通株の市場価格は下落する可能性があり、私たちはナスダック株式市場、アメリカ証券取引委員会、または他の規制機関の制裁や調査を受ける可能性がある。財務報告の内部統制のいかなる重大な欠陥を補うことができなかったり、上場企業に必要な他の効果的な制御システムを実施または維持できなかったりすることは、将来的に資本市場に参入する機会を制限する可能性もある。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
我々は、取引所法案の定期報告要件を遵守しなければならず、取引所法案に基づいて提出または提出された報告書に開示された情報が蓄積されて管理層に伝達され、米国証券取引委員会の規則および表に指定された期間内に記録、処理、まとめ、報告されなければならないことを合理的に保証するために、開示制御および手続きを維持しなければならない。任意の開示制御およびプログラムまたは内部制御およびプログラムは、発想および動作がどのように完全であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを確保することしかできないと信じている。これらの固有の限界は,意思決定過程における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実を含む.例えば、私たちの役員または役員は、意図せずに新しい関係または配置を開示することができず、関連取引の開示を要求することによって、または潜在的な利益衝突を発見することができない可能性がある。さらに、ある人の個人的な行動、2人以上の結託、または無許可超越制御は、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤り陳述が発生し,発見されない可能性がある.
私たちの普通株の市場価格は変動する可能性があり、これは投資家に大きな損失をもたらすかもしれない。
私たちの普通株の市場価格は変動する可能性があり、様々な要素によって大幅に変動するかもしれません。その中の多くの要素はコントロールできません。以下に、私たちの普通株式市場の価格変動を引き起こす可能性のあるいくつかの要因と、この“リスク要因”の部分的に説明されている他の要因を示す
•私たちの候補製品の非臨床研究と臨床試験の時間と結果
•私たちの製品開発や研究計画は失敗したり中断したりします
•既存または新しい競争力のある候補製品または技術の成功;
•私たちの競争相手の臨床試験結果や規制承認
•私たちの製品開発と研究プロジェクトの協力を始めたり中止したりします
•アメリカや他の国の法規や法律の発展
•キーパーソンの採用や退職
•特許出願、発行された特許、または他の固有の権利に関する開発または紛争を含む開発または紛争;
•新冠肺炎の流行が私たちの業務と世界の経済状況に及ぼす影響
•労働不和または中断、地政学的事件、社会的動揺、戦争、最近のロシアとウクライナ間の軍事衝突の影響、米国と中国の関係の緊張、テロ、政治的不安定、公共暴力行為、ボイコット、敵対行動と社会不安、その他の衛生流行病
•私たちの研究計画や臨床開発計画に関連する費用レベルは
•私たちの財務結果または開発スケジュールの推定に関する実際または予想される変化
•私たちの財務業績、予測、発展スケジュールは証券アナリストや投資家の予想に合っているかどうか
•追加的な資金調達努力が発表されるか、または予想される
•私たち、私たちの内部人、または他の株主は私たちの普通株を売却します
•証券アナリストの見積もりや提案(ある場合)の変化は、私たちの株をカバーしています
•医療部門の市場状況は
•インフレ圧力、他のマクロ経済要素、および関連する景気後退のような、私たちがコントロールできる一般的な経済、工業、および市場状況ではない
•“リスク要因”の節で述べた他の要因。
近年、株式市場、特にバイオテクノロジー会社の市場は、重大な価格や出来高変動を経験しており、これらの変動は、その株式がこれらの価格や出来高変動を経験している会社の経営業績の変化に関係なく、あるいは比例しないことが多い。私たちの実際の経営業績にかかわらず、広範な市場と業界要素はすでに私たちの普通株の市場価格に深刻な影響を与える可能性がある。ある会社の証券市場価格にこのような変動が生じた後、同社に対して証券集団訴訟が提起されることが多い。私たちの株価の潜在的な変動性のため、私たちは未来に証券訴訟の目標になるかもしれない。証券訴訟は巨額のコストを招き、経営陣の注意と資源を私たちの業務から移す可能性がある。
もし証券や業界アナリストが私たちの業務に関する研究や報告を発表しない場合、または彼らが私たちの株式に対して否定的または中性的な評価を発表すれば、私たちの株価は下落する可能性がある。
私たちの普通株の取引市場は、業界や証券アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存している。私たちの業務を追跡している1人以上のアナリストが中性格付けや格付けで報道を始めたり、私たちの株に対する彼らの評価を下げたりすれば、私たちの株価は下落するかもしれない。もしこのようなアナリストの一人以上が私たちの株を追跡しなければ、私たちは市場での私たちの株の可視性を失うかもしれないし、これは逆に私たちの株価を下落させるかもしれない。
既存の株主が相当数の普通株を売却することは私たちの普通株の価格を低下させる可能性がある。
いつでも、私たちの普通株は公開市場で販売される可能性があり、あるいは市場では、大量の普通株を持っている人が株を売却しようとしているとの見方があるかもしれないが、このような事件はいずれも私たちの普通株の市場価格を下げる可能性がある。2022年12月31日現在、249,567,343株の発行済み普通株があり、帰属要求に制約されていない発行制限株奨励がある。我々の持分インセンティブ計画によれば、我々の持分インセンティブ計画によれば、証券法の制限が適用された場合、我々が発行した普通株と、発行された株式オプションを行使することにより発行された株式(まだ帰属していない制限株を含まない)とは、基本的に公開市場で販売されることができる
また、私たち普通株の保有者は、条件付きで、その株式の登録声明をアメリカ証券取引委員会に提出する権利があり、またはその株式を、自分または他の株主のために提出する可能性のある登録声明に含める権利があります。これらの追加株のいずれかが公開市場で販売されている場合、またはそれらが売却されると考えられている場合、私たちの普通株の市場価格は低下する可能性がある。
追加資本の調達は、私たちの既存の株主を希釈し、私たちの運営を制限したり、私たちの技術や製品に対する権利を放棄することを要求するかもしれません。
私たちは公共とプライベート·エクイティ発行、債務融資、戦略的パートナーシップと連合、および許可手配を組み合わせた方法で追加資本を求めるかもしれない。私たち、そして間接的に、私たちの株主は、任意のこのような取引で証券を発行して返済する費用を負担します。私たちがどのような未来の発行で債券や株式証券を発行するかの決定は市場状況と他の私たちがコントロールできない要素に依存するため、私たちは任意の未来に発行される金額、時間、または性質を予測または推定することができない。2022年8月、私たちは最大2.0億ドルの普通株を時々発行して販売することができる株式分配協定に合意した。送られます
もし私たちが持分または債務証券を売却することによって追加資本を調達する場合、株式分配プロトコルに従って、あなたの所有権資本は希釈され、条項は清算または株主としての権利に悪影響を及ぼす他の特典を含む可能性があります。債務の発生は、固定支払義務の増加を招き、例えば、追加債務を発生させる能力の制限、知的財産権を得ることができるかもしれない能力の制限、および業務を展開する能力に悪影響を及ぼす可能性のある他の運営制限など、限定的な契約に関連する可能性がある。さらに、私たちが第三者と達成した任意の未来の協力は短期的に資金を提供する可能性があるが、私たちの未来の潜在的なキャッシュフローと収入を制限するだろう。もし私たちが戦略的パートナーシップ、連合、または第三者との許可手配を通じてより多くの資金を調達すれば、私たちは私たちの技術や製品に対する貴重な権利を放棄したり、私たちに不利な条項で許可を与えなければならないかもしれない。上記のいくつかの取引は私たちが株主の承認を得る必要があるかもしれないし、私たちは承認を得ることができないかもしれない。
我々はもはや“新興成長型企業”ではなく、“新興成長型企業”に適用される低減報告要件は適用されなくなり、上場企業としてのコストや管理への要求が増加する。
2022年12月31日から、“雇用法案”で定義されている“新興成長型企業”に分類されなくなった。したがって、私たちは以前サバンズ-オキシリー法案とアメリカ証券取引委員会が施行した規則を守っていた時に起きなかった多くの追加費用を発生させるだろう。例えば、第404条を遵守するコストは、追加のコーポレートガバナンス実践を実施し、報告要件を遵守する際に多くの会計費用を発生させることを要求し続け、コンプライアンスに関連する問題に多くの管理時間をかけることは、経営陣の注意を分散させ、私たちの業務、運営実績、財務状況に悪影響を及ぼす可能性がある。また、我々または我々の独立公認会計士事務所が、我々の財務報告内部統制に重大な弱点と考えられる欠陥があることを発見した場合、米国証券取引委員会や他の規制機関の制裁や調査を受ける可能性があり、追加の財務·管理資源が必要となる。
また、将来的に重大な弱点が発見されれば、投資家のわが社に対する見方が影響を受ける可能性があり、これがわが株の市場価格を低下させる可能性がある。第404条を遵守するか否かにかかわらず、財務報告のどの内部統制の失敗も、我々が公表した経営業績に実質的な影響を与える可能性がある。これらの変化を効果的または効率的に実施できなければ、私たちの運営、財務報告、あるいは財務結果を損なう可能性があり、私たちの独立公認会計士事務所が内部統制に否定的な見方をする可能性があります。
また、“大規模加速申告機関”として、2023年年度株主総会で報酬発言権投票と頻度発言権投票を行うことが求められる。したがって、経営陣に、より多くの関心を寄せ、より多くのコストを発生させることが予想され、より高い法的費用、課金、相談料、投資家関係活動に関連する費用などが含まれる可能性があり、そのため、私たちの業務、経営業績、財務状況は悪影響を受ける可能性があります。
将来の買収、戦略投資、協力、または連合は識別と統合が困難であり、経営陣の注意を移し、私たちの業務を混乱させ、株主価値を希釈し、私たちの経営業績や財務状況に悪影響を及ぼす可能性がある。
私たちは将来、私たちの技術プラットフォームを補完または拡大し、私たちの技術能力を強化し、または成長機会を提供することができると考えられる業務、製品、または技術に買収または投資を求めることができるかもしれない。潜在的な買収や戦略投資を追求することは、経営陣の注意をそらす可能性があり、適切な買収や投資を決定、調査、求める際には、このような取引が完了しているかどうかにかかわらず、様々な費用が発生する可能性がある。また、他の事業の買収や投資における経験が限られており、理想的な目標を決定することができない場合や、より多くの事業を買収する場合には、買収後にこれらの業務を効率的に統合することができない可能性があります。買収はまた、株式証券の希釈発行や債務の発生、および知的財産権クレームを含む不利な会計処理や第三者クレームや紛争のリスクを招く可能性がある。私たちはまたどんな買収に関連した費用と支出を相殺するのに十分な財政的見返りを作ることができないかもしれない。また、買収された企業が私たちの期待に達しなければ、私たちの業務、経営業績、財務状況が影響を受ける可能性があります。
上場企業の要求として、コンプライアンスイニシアティブやコーポレートガバナンス実践に多くの時間を投入することが求められており、経営陣の注意を分散させ、リソースを緊張させる可能性があります。
上場企業として、私たちは大量の法律、会計、その他の費用を招き続け、これらの費用は私たちが民間会社として招いていない。第404節、ドッド·フランクウォール街改革と消費者保護法、ナスダック株式市場有限責任会社の上場要求と規則(ナスダック上場規則)、その他の適用される米国規則と法規は、有効な開示、財務制御、会社管理やり方の確立と維持を含む上場企業に対して様々な要求を提出した。私たちは追加の会計員を雇用する必要があります
財務その他の人員は、上場企業の要求を遵守しようと努力していることに関係しており、私たちの経営陣や他の人たちは、これらの要求の遵守を維持するために多くの時間を投入し続ける必要があります。このような要求はすでに私たちの法律と財政的コンプライアンス費用を増加させ、いくつかの活動をもっと時間的で高価にするだろう。例えば、上場企業としての私たちの規制に適用することで、取締役や上級管理職責任保険を獲得するコストが高くなります。私たちは私たちが発生する可能性のある追加費用の金額やそのような費用の時間を予測したり推定することができない。これらの規則や条例は往々にして異なる解釈を持ち,多くの場合特殊性に欠けるため,規制機関や理事機関が新たな指導意見を提供するにつれて,実践における適用は時間とともに変化する可能性がある。これは遵守事項に関する持続的な不確実性と、開示と統治慣行を絶えず修正するために必要なより高いコストをもたらす可能性がある。
私たちの純営業損失の繰越と他の税務属性を使用する能力は限られているかもしれません。
コロナウイルス援助、救済、経済安全法案(CARE法案)改正された2017年減税·雇用法案(税法)によると、2017年12月31日以降の納税年度に生じる純営業損失(NOL)は無期限に繰り越すことができるが、このような連邦NOLの2020年12月31日以降の納税年度の控除額は課税収入の80%に制限されている。各州がどの程度税法やCARE法を遵守しているかは不明である。また、改正された“1986年米国国税法”(“国税法”と略す)第382条及び383条によると、ある会社が“所有権変更”を経験した場合、通常、ある株主の3年間の持分所有権の変化が50ポイント(価値で計算)を超えると定義されていれば、同社は変更前のNOLや他の変更前の税収属性(例えば、研究開発税収控除)を用いて変更後の収入や税収を相殺する能力が制限される可能性がある。私たちは過去に最初の公募の結果を含む所有権の変化を経験したことがあり、将来は私たちの株式所有権の変化のために未来の所有権の変化を経験するかもしれない(その中のいくつかは私たちの制御範囲内ではない可能性がある)。したがって,変動前のNOLと税収控除を用いて変動後の課税収入(あれば)を相殺する能力が制限される可能性がある。州税法の似たような規定も適用される可能性がある。さらに、州レベルでは、NOLの使用を一時停止または制限する時期がある可能性があり、これは州の課税税を加速または永久的に増加させる可能性がある。例えば、カリフォルニア州は最近、カリフォルニア州NOLの利用可能性および税控除に制限を加え、2019年12月31日以降から2022年1月1日までの納税年度でカリフォルニア州の課税収入を相殺する。私たちが利益を得ても, 私たちは私たちのNOLと税金免除の大部分を使用できないかもしれない。
コンピュータシステムの故障やセキュリティホールが発生した場合、私たちの業務と運営は影響を受けるだろう。
我々の内部コンピュータシステムおよび我々のパートナーのコンピュータシステムは、コンピュータウイルス、不正アクセス、自然災害、火災、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。私たちがこれらの第三者をほとんどコントロールしていないか、それは彼らのシステムに問題が発生した時の私たちの脆弱性を増加させる。もしどんな中断やセキュリティホールが私たちのデータやアプリケーションを紛失したり破損したり、あるいは機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの候補製品のさらなる開発は延期される可能性があり、私たちの業務は他の不利な影響を受ける可能性があります。
私たちはこれまで重大なシステム障害、事故、セキュリティホールを経験していませんが、私たちのデータ保護努力と情報技術への私たちの投資は、私たちのシステムの重大な故障、データ漏洩、侵入、または私たちの名声、業務、運営、または財務状況に重大な悪影響を及ぼす可能性のあるネットワークイベントを防止することを保証することはできません。例えば、このような事件が発生して私たちの運営が中断されると、私たちの計画が実質的に中断される可能性があり、私たちの候補製品の開発が延期される可能性があります。また、候補製品の臨床試験データの紛失は、マーケティング承認作業を遅延させる可能性があり、データを回復または複製するコストを著しく増加させる可能性があります。さらに、我々の内部情報技術システムの重大な中断またはセキュリティホールは、機密情報(商業秘密または他の知的財産権、独自の商業情報および個人情報を含む)の損失、流用および/または不正アクセス、使用または開示、またはアクセスを阻止する可能性があり、これは、財務、法律、商業および名声を損なう可能性がある。例えば、不正アクセス、使用または個人情報(私たちの臨床試験対象または従業員に関連する個人情報を含む)をもたらすいかなる事件も、私たちの名声を直接損なう可能性があり、連邦および/または州の違反通知法および外国と同等の法律を遵守させ、強制的な是正措置を取らせる可能性があり、そうでなければ、私たちは個人情報のプライバシーおよび安全を保護する法律および法規に従って責任を負うことになり、これは重大な法律および財務リスクおよび名声の損害を招き、私たちの業務に悪影響を及ぼす可能性がある。
様々な協定の賠償条項は私たちを知的財産権侵害、データ保護、その他の損失の重大な責任に直面させるかもしれない。
私たちと第三者との合意には賠償条項が含まれている可能性があります。これらの条項によると、知的財産権侵害クレームまたは以下に関連する他の責任によって受けたまたは発生した損失を賠償することに同意します
私たちの契約義務から生まれています巨額の賠償は私たちの業務と財政状況を損なうかもしれない。私たちは一般的にこのような義務に対する私たちの責任を契約的に制限しているが、私たちは依然として重大な責任を招く可能性がある。このような義務について第三者とのいかなるトラブルも、当社とその第三者との関係や、他の既存または新たなパートナーとの関係に悪影響を与え、当社の業務を損なう可能性があります。
項目1 B。未解決従業員意見
ない。
項目2.財産
カリフォルニア州
私たちの現在の会社の本社はカリフォルニア州サンフランシスコ南部にあり、2020年2月から2031年3月までのレンタル契約に基づいて、私たちはそこで約108,000平方フィートのオフィスと実験室空間を借りました。
ワシントン
2019年1月から2028年12月までの間に満了した賃貸契約によると、ワシントン州シアトルで約34,000平方フィートのオフィスと実験室スペースをレンタルしました。2020年2月から2030年5月までのレンタル契約に基づき、ワシントン州ボゼルで約73,000平方フィートの製造、オフィス、実験室スペースをレンタルしました。
私たちはこのような既存の施設が私たちの最近の必要性を満たすのに十分だと信じている。必要があれば、私たちは後日商業的に合理的な条項で、適切な追加または別の用地を提供すると信じています。
項目3.法的訴訟
時々、私たちは重大な法的手続きに巻き込まれたり、私たちの正常な業務過程でクレームを受けたりする可能性がある。例えば、私たちの業務には実質的ではありませんが、2020年6月にPACTと合意した合意を廃止し、その合意に基づいて支払われた対価格を回収することを含む2021年2月に仲裁要求を提出しました。仲裁公聴会は2022年3月と2022年4月に行われた。2022年10月には、未解決の法的紛争を解決するためにPACTと和解協定を締結し、PACTを発行したD系列転換可能優先株について株式購入協定を締結し、これまでに買収したPACT C-1シリーズ転換可能優先株の入札と仲裁の解決と交換した。PACTを買収したDシリーズ転換可能優先株は無投票権であり,限られた転換権と董事委任権がなく,我々の持ち株を約80%のPACTに増加させた完全希釈流通株である。和解プロトコルはPact承諾プロトコルを中止し、固形腫瘍に対する次世代抗癌T細胞療法を共同開発することも含む
私たちは現在、私たちの業務に大きな影響を与える法的手続きや、私たちのいかなる財産を標的とした法的手続きにも関与しておらず、政府当局がこのような手続きを検討していることも知りません。
結果にかかわらず、このような訴訟またはクレームは、内在的不確実性の影響を受け、弁護および和解コスト、資源移転、および他の要因によって私たちに悪影響を及ぼす可能性があり、有利な結果が得られる保証はない。
プロジェクト4.鉱山安全情報開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
我々の普通株は2021年6月17日からナスダック世界精選市場でLYELをコードとして取引されている。これまで、私たちの普通株は公開取引市場を持っていなかった。
所持者
2023年2月24日、63名の普通株式保有者が登録された。記録所有者の数は、その日に我々の帳簿に登録されている実際の所有者数に基づいて計算され、“町内名”株の保有者や預託信託会社が維持する証券頭書リストから決定された個人、組合、協会、会社またはその他の実体は含まれていない。
配当をする
設立以来、私たちは普通株の配当金を支払わなかった。私たちは現在、すべての未来の収益を保留するつもりです。もしあれば、私たちの業務のために、今のところ予測可能な未来に現金配当金を支払うつもりはありません。未来に配当金を送るかどうかは私たちの取締役会が自ら決定するだろう。
株式表現グラフ
以下の株表現グラフは、2021年6月17日(我々の普通株がナスダック全世界ベスト市場で取引を開始した日)から2022年12月31日までの(I)我々の普通株、(Ii)ナスダック総合指数、および(Iii)ナスダックバイオテクノロジー指数の投資価値を比較したものである。以下の数字は、2021年6月17日の終値で我々の普通株100ドルと、2021年6月17日のナスダック総合指数およびナスダックバイオテクノロジー指数に投資し、任意の配当を普通株に再投資すると仮定する。しかし、今まで、私たちの普通株式は配当を発表していない。表中の比較は米国証券取引委員会が要求したものであり,我々の普通株の将来可能性を予測するための表現でもなく,これを示すためでもない.
上記の株式表現グラフや関連情報は“募集材料”とみなされてはならず、米国証券取引委員会への“届出”ともみなされてはならず、引用によってこのような情報をいかなるものにも組み入れてはならない
将来的に証券法または取引法(いずれも改正された)に基づいて提出される文書は、参照によってこのような文書に明示的に組み込まれない限り、提出される。
株式証券の未登録販売
ない。
株式証券の買い戻し
ない。
われわれは普通株で得られた金の使用を初めて公開発行した
2021年6月、私たちは初公募株式(IPO)を完成し、IPOに基づいて、1株17.00ドルで25,000,000株の普通株を公開·販売した。これらの株式は、2021年6月16日に発効を宣言したS-1表(第333-256470号文書)の登録声明に基づいて登録されている。IPOの結果として、2980万ドルの引受割引と手数料、340万ドルの発売費用を差し引いて、合計約3億918億ドルの純収益を集めた。ゴールドマン·サックス、米銀行証券、モルガン·チェース、モルガン·スタンレーが今回のIPOの共同簿記管理人を務めた。受け取った後、私たちは初めて公募株の純収益を現金、現金等価物、投資の形で持っています。正常業務過程において高級職員及び非従業員取締役に賃金を支払い、非従業員取締役に報酬を支払う以外に、吾等は直接又は間接的に高級職員又は取締役、当社の任意の種類の持分証券の10%以上を有する者又は任意の連合会社に任意の金を支払うことはない。私たちは今回の発行純収益の大きな部分を通貨市場基金と短期投資の形で持っています。
初公募株で得られた資金は,我々の候補製品の開発や臨床試験や研究計画,運営資金や一般企業用途のための持続的な運営に用いられている。2021年6月21日に証券法第424(B)(4)条に基づいて米国証券取引委員会に提出された目論見書(目論見書)に記載されている用途と比較して、初公募で得られた資金の計画用途に大きな変化はない。IPOで得られた純利益のすべての特定用途,あるいは目論見書および上記の用途に実際に支出される金額を確実に予測することはできない。私たちが実際に純収益を使用する金額と時間は、私たちが追加融資を得る能力、私たちの研究、非臨床と臨床開発計画の相対的な成功とコスト、そして私たちが未来の協力と許可手配を達成できるかどうかを含む多くの要素に依存するだろう。したがって,我々の経営陣は純収益の応用に広範な情動権を持ち続け,投資家は初公募株純収益の応用の判断に依存するであろう。
第六項です[保留されている]
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
私たちの財務状況と経営結果の以下の議論と分析、および私たちが監査した総合財務諸表と本年度報告書の他の場所に関する付記(Form 10-K)を読むべきです。本議論および分析および本Form 10−K年次報告の他の部分は、将来のイベントおよび私たちの将来の財務パフォーマンスに関連する現在の信念、計画および予想に基づいて、リスク、不確実性および仮定、例えば、業務に対する私たちの意図、計画、目標、および予想に関する陳述を含む前向きな陳述を含む。いくつかの要因のため、我々の実際の結果および選択されたイベントの時間は、これらの前向き陳述に記載または示唆された場合とは大きく異なる可能性があり、これらの要因は、本年度報告10-K表第I項第1 A項の“リスク要因”の節で述べた要因を含む。また、“前向きな陳述に関する特別な説明”というタイトルの節を参照する
この部分は経営陣の財務問題の討論と分析です“業務状況と結果”は,2022年と2021年の項目,および2022年と2021年の同比比較を一般的に検討している。2021年12月31日までの財政年度のForm 10−K年度報告では,“経営陣の財務状況と経営結果の検討と分析”と題する章では,本年度報告に含まれていない2020年プロジェクトの検討および2021年と2020年との年間比較を見つけることができる。
概要
私たちは臨床段階の細胞治療会社で、私たちの特許を利用して固形腫瘍患者のために一連の候補製品を開発しています離体する遺伝とエピジェネティックT細胞再プログラミング技術。著者らの研究療法は患者自身の細胞を起点として、高度な腫瘍反応、持続時間のより長い機能T細胞を産生し、それによって固形腫瘍に打ち勝つ能力を増強する。著者らの革新的な再プログラミング技術は固形腫瘍T細胞の治療持続と持続的な反応を制限する主要な障害を解決した:T細胞枯渇と持続性幹細胞の欠乏。我々の技術は,持続的かつ自己更新能を有するT細胞を生成し,持続的な腫瘍細胞毒性を駆動することを目指しており,免疫抑制された腫瘍微小環境においても同様である。持続的な抗腫瘍反応を実現するために、患者に十分な強力かつ持続的なT細胞を提供することを目標としている。 また,われわれの技術はキメラ抗原受容体(CAR),腫瘍浸潤性リンパ球(TIL),T細胞受容体(TCR)治療を含む標的不明の方法で多くのT細胞パターンに応用できる
我々は我々の技術を応用して,より良い持続的な臨床結果を有するT細胞療法の開発を目指している。我々が増加している有望な候補細胞製品は,多くの満たされていない需要を有する固形腫瘍適応を目指しており,これらの需要は米国で年間約180,000人の死亡を招いている。我々の各計画は,われわれの最初の目標を超えた患者群のより多くの適応に拡大する機会を提供している。
当社業務のその他の資料については、本年度報告表格10-K第I部分第1項の“業務”を参照されたい。
パイプライン計画と運営更新
我々は4つの全額所有候補製品を推進している;2つの候補製品LYL 797とLYL 845は第1段階の臨床開発にあり、他の2つの候補製品LYL 119と新しい遺伝とエピジェネティック再プログラミング技術を融合したTIL候補製品は臨床前開発段階にある
LYL 797-A ROR 1自動車候補T細胞製品は、c-junを用いて遺伝的再プログラミングを行い、我々独自のEpi−R製造プロトコルを用いて見かけ再プログラミングを行い、差別化された効力と耐久性を実現することを目的としている
•LYL 797の1期臨床試験の登録が行われている。LYL 797第一段階試験の初歩的な臨床データは2024年上半期に発表される予定である。
•アメリカ癌研究協会2022年年次総会で提出された非臨床データはLYL 797を表現し、著者らのc-jun過剰発現とEpi-R再プログラミング技術はT細胞枯渇と持続性幹細胞不足の障害を克服し、1組を使用することができることを示した体外培養そして体内にある侵襲性同遺伝子マウス腫瘍モデルと異種移植肺癌モデルを含むモデル。
•アメリカ遺伝子と細胞治療学会年会で公表された非臨床データにより、すでに樹立したヒトROR 1陽性H 1975マウス異種移植モデルにおいて、LYL 797は伝統的なROR 1自動車T細胞よりもっと良い増幅と抗腫瘍活性を示し、そして生存時間を延長した。
LYL 119-細胞毒性を増強するための革新的なROR 1自動車T細胞製品
•LYL 119は、NR 4 A 3およびSTIM−Rのノックアウトを含む2つの新しい技術を含む、我々の4つの積層可能な再プログラミング技術を採用している。これらの技術はc-junとEpi-Rの補充であり、T細胞の抗腫瘍効果と持続性を更に高めることを目的としている。
•LYL 119のINDは2024年上半期に提出される予定だ。
•提供した非臨床データにより、NR 4 A 3ノックアウトとc-jun過剰発現という2種類の遺伝子再プログラミング技術の結合は、ROR 1 CAR T細胞の機能活性を増強し、より高いレベルのサイトカイン産生を示し、CAR T細胞の持続性を増加させ、抗原刺激を繰り返した後に受容体表面発現の減少を抑制し、腫瘍制御における著しい改善を示した体内にある癌免疫治療学会2022年年次総会(SITC 2022)で。
•SITC 2022に示された非臨床データは、我々の独自のSTIM-Rエピジェネティック再プログラミング技術が、T細胞の生産過程において活性化分子の伝達を正確に制御および最適化し、細胞増殖と持続性を増強し、腫瘍制御を改善する強力なCAR T細胞候補製品を産生することができることを示している体内にある.
LYL 845--差別化効力と耐久性を実現するための新しいエピジェネティック組換えTIL候補製品
•2022年10月にLYL 845のIND承認が発表された;LYL 845の第1段階臨床試験が行われている。LYL 845の第1段階試験の予備臨床データは2024年に発表される予定である。
•SITC 2022で公表された非臨床データは、ライルのEpi-R技術がTILを冷熱腫瘍に拡張することに成功し、抗腫瘍機能に関連する品質を保持し、これまでのTIL臨床試験で結果を改善することができることを示した。対照TILと比較して、我々のEpi-R TILはより高い割合のCD 8+T細胞、豊富な幹細胞様T細胞、より良い新陳代謝適応性と保存されたポリクローナル特性を有する。
•SITC 2022上で著者らのLYL 845候補製品に対する転写マップ、ポリクローナルと腫瘍反応性T細胞クローンの全面的な分析を含むバイオインフォマティクス分析を紹介した。これらの分析は,Epi−R技術を用いて臨床規模に拡張したLYL 845が高度なポリクローナルを保持し,約94%の予測腫瘍反応クローンを保持していることを示している。また,LYL 845に保存されている予測腫瘍反応クローンは,標準プロセスからのTIL製品と比較して茎幹を増加させ,不全に関連する遺伝子を減少させた。
会社と運営の最新状況
•昨年12月、リン·シリー医学博士が総裁兼CEOに任命された。西利は2021年5月から取締役会のメンバーを務め、総裁とMyovant Sciencesの最高経営責任者を務めた。Seely博士は豊富な生物製薬リーダー経験を持ち,腫瘍学や女性健康分野で会社の設立と新薬開発に成功した。
•9月、ラフサン·W·トンプソン(Rahsaan W.Thompson)が首席法律官に任命された。トンプソンさんは、開発段階とビジネス会社の側面で20年以上の経験を持っているバイオ製薬業界のベテランです。
•今年1月、ゲイリー·リー博士が首席科学官に任命された。李博士は経験豊富な生物技術指導者であり、10年以上の形質転換細胞と遺伝子治療プロジェクトを指導した経験を持っている。
マクロ経済環境
私たちの業務と運営は世界の経済状況の影響を受ける可能性があり、世界のマクロ経済挑戦は引き続き影響を受ける可能性があり、例えばウクライナの持続的な地政学的衝突、アメリカと中国関係の緊張情勢、新冠肺炎の疫病、市場の不確定性、インフレ傾向の影響を受ける可能性がある。2022年度市場は重大な不確定性が存在し、インフレ圧力が増大し、供給が制限され、及び新冠肺炎疫病の持続的な影響が存在する。これらの市場動態は2023年まで続く可能性があり、これらと類似した不利な市場状況は私たちの業務に負の影響を与える可能性がある。
特に、全世界の新冠肺炎疫病及びその影響の持続的な発展に伴い、新冠肺炎の大流行が著者らの業務、運営と発展スケジュール及び計画に対する影響の程度は依然として不確定であり、しかも疫病の持続時間と蔓延、その他の次の影響、私たちのCRO、代理工組織、臨床サイトとその他の私たちと業務往来のある第三者への影響、及び監督機関と著者らの肝心な科学と管理者への影響を含む一定の事態の発展に依存する。
私たちは私たちが新冠肺炎の大流行の影響による実質的な悪影響を避けることができるという保証はない。新冠肺炎の大流行の影響は引き続き医療保健と病院資源に負の影響を与える可能性があり、一線と行政人員を含み、これは私たちの現在と計画中の臨床試験の登録を延期する可能性がある。潜在的な隔離、医療支持の不足或いは医療サービスが中断する可能性があるため、一部の患者は臨床試験方案を遵守できない可能性があり、著者らは血液サンプルを入手して検査を行うことができないかもしれない。例えば、協力機関による腫瘍患者の手術スケジュールの制限または修正は、私たちが研究で使用している患者の腫瘍サンプルの供給を制限し続ける可能性がある。
我々の経営業績に影響を及ぼす可能性のある傾向,不確実性,その他の要因のさらなる検討については,本年度報告第I部の表格10−K第1 A項で“リスク要因”と題する章を参照されたい。
許可、協力、成功支払協定
私たちの許可、協力、成功支払契約の詳細については、タイトルを参照してくださいビジネス-ライセンス、連携、および成功した支払いプロトコル“本年度報告の第I部、表10−Kの第1項、及び当社が監査した総合財務諸表の付記2及び3は、本年度報告の表格10−Kの第II部分、第8項に記載されている。
経営成果の構成部分
収入.収入
私たちは販売された製品を承認していないし、製品販売から何の収入も得られなかった。
私たちの収入は、主に2019年に締結され、2020年6月と2021年12月にGSKと改訂されたGSKプロトコルでの前払いを確認することに由来しています。グラクソ·スミスクラインは2022年12月からグラクソ·スミスクラインとの合意を終了し、協力はこれ以上の収入をもたらさないと予想している。注3を参照許可、協力、成功支払協定添付の付記には本年度報告表格10-K第II部第8項に記載されている監査された総合財務諸表グラクソ·スミスクライン協定を終わらせる他の詳細について。
将来、私たちは他の協力、戦略連合、許可協定、製品販売、またはこれらの組み合わせから追加の収入を得ることができるかもしれない。
運営費
研究と開発
これまで、研究開発費には、私たちの技術プラットフォームや候補製品を発見し開発するために発生したコストが含まれており、戦略協力に関連するコスト、技術許可コスト、人員関連コスト(株式給与支出を含む)、施設および技術関連コスト、研究および実験室費用、相談費およびその他のコストを含む他の費用が含まれています。技術プラットフォームに関連する第三者に支払われる前払いおよびマイルストーンは、技術的実行可能性が達成されておらず、将来的に代替用途がない場合には、発生した費用を計上する。
研究開発費には見積もり変動に関する非現金費用も含まれています私たちの支払い成功に関連した負債の対公正価値フレッド·ハッジとスタンフォード大学はそれは.“重要な会計政策と見積もり”というタイトルの小節を参照支払いに成功する“下だ。我々の支払成功負債に関する研究や開発費用は予測不可能であり,計算に用いる仮定が変化するため,これらの費用は四半期間と年度間の変化によって大きく異なる可能性がある.
我々は、複数の研究開発プロジェクトに従業員やインフラ資源を配置し、候補製品を決定し、開発し、製造能力を確立する。開発段階や進行中の計画の数,および我々が複数の計画に資源を使用する能力により,我々の研究開発コストの大部分は計画通りに記録されない.これらの費用には人員、実験室、その他の間接施設の費用と運営費用が含まれている。
研究開発活動は私たちの運営費用の大きな部分を占めている。私たちは予測可能な未来に、私たちの研究開発努力の拡大に伴い、非臨床研究を完成し、計画の臨床試験を開始し、現在と計画の臨床試験を行い、完成し、監督管理機関が私たちの候補製品を承認することを求め、新しい候補製品を決定し、技術プラットフォームを獲得と許可するコストを含み、私たちの研究開発費用は増加すると予想される。これらの変数のいずれの結果の変化も,我々の製品開発に関連するコストと時間の大きな変化を意味する可能性がある
候補者です。私たちの研究と開発はまだ初期段階にあり、私たちの候補製品の臨床開発を開始し、これらの努力の結果はまだ確定していないため、候補製品の非臨床開発、臨床開発と商業化に成功するのに必要な実際の金額を見積もることができず、私たちがいつ利益を達成できるかどうかを推定することもできない。
以下の要因により、私たちの研究開発費は大きく異なる可能性があります
•非臨床的でINDを支持する研究の数と範囲;
•患者1人当たりの試験コストは
•承認に必要な試験回数
•実験に含まれる場所の数
•どの国で実験を行っていますか
•条件に適合する患者を登録するのに要する時間長;
•実験に参加した患者数
•患者の中退率や中途停止率
•規制当局が要求する潜在的な追加的な安全監視;
•患者が試験とフォローアップの持続時間に参加した
•私たちの候補製品を作るコストとタイミング
•私たちの製品候補開発段階は
•私たちの候補製品の有効性と安全性
•私たちは追加的な協力や許可協定の程度を確立します
•私たちは私たちの任意の候補製品と協力して、このような協力関係の条項を選択するかどうか。
我々の任意の候補製品の開発に関連するこれらの変数のいずれかの結果が変化し、候補製品開発に関連するコストおよび時間を著しく変化させることが可能である。私たちのどんな候補製品も規制部門の承認を得ることができないかもしれない。私たちは私たちの非臨床研究や臨床試験から予期しない結果を得るかもしれない。
一般と行政
一般および行政費用には、行政、法律、財務および他の行政機能者の株式報酬費用、法律費用、協力および許可協定に関連する取引費用、支払いされた会計および税務サービス費用、相談費、研究開発費に含まれていない施設費用が含まれる人事関連費用が含まれる。法的費用には会社、紛争、特許に関する費用が含まれている。
予測可能な将来において、我々の持続的な研究開発活動、全体的な運営、将来の業務発展機会、相談費、および上場企業としての運営コストの増加を支援するために、取引所上場および米国証券取引委員会が要求する会計、監査、法律、規制および税務関連サービスの維持に関連するコスト、取締役および役員保険コスト、投資家および広報コストを含むコストおよび行政費用が増加すると予想される。
その他の営業収入、純額
その他の営業収入、純額は主に転貸に関するサービス料と占有費、そして財産と設備の退役。
利子収入,純額
利子収入は,純額は主に現金,現金等価物,有価証券による利息からなる残高。
その他の収入,純額
その他の収入(支出),純額は主にPACT D系列転換可能優先株の収益を記録することと,保有権証投資の公正価値変化を含む。
その他投資減価準備
他の投資の減少はいくつかの他の投資価値の減少を含む。
転換可能な優先株を買い戻す場合は配当金とする
転換可能優先株を買い戻す際の配当金には、転換可能な優先株を買い戻して支払う現金がその転換可能な優先株の帳簿価値を超える金額が含まれる。IPOが終わった時、私たちのすべての転換可能な優先株は私たちの普通株に変換します。
経営成果
2022年、2021年、2020年12月31日までの年度
以下の表は、本報告に記載した期間の業務結果(千計)をまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| | 2022 | | 2021 | | 2020 | | 2022 vs 2021 | | 2021 vs 2020 |
収入.収入 | $ | 84,683 | | | $ | 10,650 | | | $ | 7,756 | | | $ | 74,033 | | | $ | 2,894 | |
運営費用: | | | | | | | | | |
研究開発 | 159,188 | | | 138,693 | | | 182,243 | | | 20,495 | | | (43,550) | |
一般と行政 | 117,307 | | | 89,057 | | | 46,881 | | | 28,250 | | | 42,176 | |
その他の営業収入、純額 | (4,754) | | | (2,324) | | | (9,431) | | | (2,430) | | | 7,107 | |
総運営費 | 271,741 | | | 225,426 | | | 219,693 | | | 46,315 | | | 5,733 | |
運営損失 | (187,058) | | | (214,776) | | | (211,937) | | | 27,718 | | | (2,839) | |
利子収入,純額 | 7,053 | | | 1,165 | | | 5,939 | | | 5,888 | | | (4,774) | |
その他の収入,純額 | 1,887 | | | (161) | | | 1,526 | | | 2,048 | | | (1,687) | |
| その他の投資減価 | (5,000) | | | (36,447) | | | — | | | 31,447 | | | (36,447) | |
| その他の収入(赤字)を合計して純額 | 3,940 | | | (35,443) | | | 7,465 | | | 39,383 | | | (42,908) | |
純損失 | (183,118) | | | (250,219) | | | (204,472) | | | 67,101 | | | (45,747) | |
転換可能な優先株を買い戻す際の配当金とする | — | | | — | | | (3,582) | | | — | | | 3,582 | |
普通株主に帰属する純損失 | $ | (183,118) | | | $ | (250,219) | | | $ | (208,054) | | | $ | 67,101 | | | $ | (42,165) | |
収入.収入
レヴィン2022年および2021年12月31日までの年間総使用料はそれぞれ8,470万ドルおよび1,070万ドルであり,主にグラクソ·スミスクライン協定による前払い許可料の確認部分に関係している。7,400万ドルの増加は主にグラクソ·スミスクラインとの合意が2022年6月にいくつかの研究活動を完成し、グラクソ·スミスクラインがその後“グラクソ·スミスクライン協定”(2022年12月から発効)を終了したことによる収入調整8,360万ドルであり、両者とも比例累積業績測定基準の変化を招いた。収入増加が960万ドル減少したのは,主にGSKプロトコルの下での研究と開発活動の減少によるものである2022年12月31日までの年度それは.注3を参照許可、協力、成功支払協定グラクソ·スミスクライン協定の終了に関する他の資料は、本年度報告書10-K表第II部第8項に記載されているレビュー総合財務諸表付記を参照されたい。
研究と開発費
以下の表は、列挙期間中の我々の研究開発費の構成要素(千単位)をまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 | | 変わる |
| | 2022 | | 2021 | | 2020 | | 2022 vs 2021 | | 2021 vs 2020 |
人員 | $ | 70,483 | | | $ | 60,499 | | | $ | 54,112 | | | $ | 9,984 | | | $ | 6,387 | |
施設と技術 | 52,153 | | | 39,092 | | | 24,560 | | | 13,061 | | | 14,532 | |
協力、研究活動、外部サービス | 41,682 | | | 35,389 | | | 98,234 | | | 6,293 | | | (62,845) | |
支払いに成功する | (5,130) | | | 3,713 | | | 5,337 | | | (8,843) | | | (1,624) | |
研究開発費総額 | $ | 159,188 | | | $ | 138,693 | | | $ | 182,243 | | | $ | 20,495 | | | $ | (43,550) | |
研究と開発2022年12月31日と2021年12月31日までの年間ENT支出はそれぞれ1.592億ドルと1兆387億ドルだった。2,050万ドル増加した主な理由は1,310万ドル増加ですN施設と技術コストは、主に研究開発、製造能力、および関連従業員の拡張を支援するためにインフラを増加させることに関連している1,000万ドル増加するN人事に関する費用,すなわち主に、私たちの研究開発と製造能力を拡大するために従業員数を増加させたこと、協力、研究活動、外部サービスが630万ドル増加したこと、主に臨床試験が510万ドルの研究と実験室コストを増加させたこと、専門サービスが330万ドル増加したが、220万ドルの協力と許可費が減少したこと、フレッド·ハッジとスタンフォード関連の成功支払い費用が880万ドル減少したこと、この増加を部分的に相殺したためである研究開発が成功して負債を支払うのは、主に私たちの普通株の1株当たりの公正価値の低下によるものである。
一般と行政費用
一般と行政費用w2022年12月31日と2021年12月31日までの年度はそれぞれ1兆173億ドルと8910万ドルだった。2,830万ドル増加した主な理由は1,830万ドルの増加です株式ベースの報酬支出では、主に奨励改正と新たに付与された奨励が関連している。 A一方、外部サービスは510万ドル増加し、主な原因は法的費用の増加と会社費用の増加だ390万ドルは主に上場企業の運営に関するコスト。
その他の営業収入、純額
2022年12月31日と2021年12月31日までの年間営業収入純額はそれぞれ480万ドルと230万ドル。240万ドル増えました主に私たちの転貸収入と転貸に関する運営費用のせいです。
利子収入,純額
2022年12月31日と2021年12月31日までの年間の純利息収入はそれぞれ710万ドルと120万ドル。590万ドル増加した主な原因は2022年に金利が上昇したことだ。
その他の収入,純額
2022年12月31日と2021年12月31日までの年度の他の収入(支出)純額はそれぞれ190万ドルと20万ドルだった。200万ドル増えました含まれています主に買収を記録するためのPACT系列D変換可能優先株の推定公正価値の290万ドルの収益であるが,保有する権利証投資の公正価値は110万ドルだ
その他投資減価準備
2022年12月31日までの年間で、他の投資の500万ドルの減値には、私たちの他の投資のすべての減値が含まれています2021年12月31日までの年間で、他の投資の3640万ドルの減値には、PACTシリーズC-1転換可能優先株投資に対するすべての減値が含まれています注5を参照その他の投資なお、本年度報告(表格10-K)第2部第8項に記載されている監査総合財務諸表の付記を参照して、より多くの資料を取得してください。
流動性と資本資源
流動資金源
私たちの設立以来、私たちは主に転換可能な優先株の売却と発行、当社のIPOや業務発展活動に関連する普通株の売却を通じて、私たちの運営に資金を提供してきました。2022年12月31日までにD$7.103億円の核証明機関現金等価物と有価証券。設立以来、私たちは重大な運営損失を受けた。私たちはまだ候補製品を商業化していません。もしあれば、今後数年以内にどの候補製品の販売からも収入を得られないと予想しています。私たちには累積赤字があります7億675億ドル2022年12月31日まで。2018年6月29日から2022年12月31日までの合計で調達しました14.057億ドル私たちの転換可能な優先株と初公募株を売却する総収益。
2022年8月4日、我々はゴールドマン·サックス有限責任会社(Goldman Sachs&Co.LLC)と米銀行証券会社(BofA Securities,Inc.)(およびゴールドマンの代理人)と市場での発行計画について株式分配協定(株式分配協定)を達成した。株式割当契約の条項によると、吾らは時々代理人を介して合計2億ドルまでの普通株式(配給株式)を発売·売却することができる。配給株式(ある場合)は、売却時のナスダック上の現行市価または代理人との他の合意に従って、証券法第415条に規定されている“市場発売”とみなされる法律で許可されているいずれかの方法で行われる。株式割当契約に基づいて株式を売却して得られた毛収入の最高3.0%の手数料を代理人に支払い、何らかの費用を代理人に精算する。吾らとその代理人はいかなる株式も売却する責任はないが、これまで、吾らは株式割当契約に基づいて何の売却もしていなかった。
将来の資金需要
私たちは予測可能な未来に、非臨床研究と臨床試験を行い、新しい候補製品を開発し、内部製造能力を確立し、私たちの運営に資金を提供することを含め、私たちの研究と開発努力を拡大することに伴い、私たちはより多くの損失を受けることになると予想される。私たちの現在の運営計画によると、私たちは私たちの既存の現金、現金等価物、および有価証券が2026年までの運営資本と資本支出需要を満たすのに十分だと信じている。しかし、私たちは将来、私たちの候補製品のさらなる開発と、任意の承認された候補製品の商業化を含む、私たちの運営を支援するためにより多くの資金を調達する必要があると予想していますまた、定期的に資金集め機会を考慮し、市場状況や私たちの運営計画を含む様々な要因に基づいて、株式割当協議による追加資本の調達を時々決定することが可能である私たちは通常新製品開発に関連するリスクを受けています。私たちは予見できない費用、困難、複雑な状況、遅延、その他私たちの業務に悪影響を及ぼす可能性のある未知の要素に遭遇する可能性があります。
私たちの将来の資本需要は多くの要素に依存します
•現在と未来の候補製品の発見、非臨床開発と臨床試験の範囲、時間、進捗、コストと結果
•規制当局は私たちの現在と未来の候補製品に必要な臨床試験の数を承認した
•私たちの現在および未来の任意の候補製品に対する規制審査のコスト、時間、および結果
•私たちの現在と未来の候補製品を生産する臨床および商業用品のコスト
•将来の商業化活動のコストと時間は、製造、マーケティング、販売、流通を含み、私たちが市場の承認を得た任意の候補製品について
•より多くの製造施設の建設や既存施設の生産能力の拡大にさらに投資する
•特許出願を準備し、提出し、起訴し、私たちの知的財産権を維持し、実行し、知的財産権に関する任意のクレームを弁護するコストと時間;
•私たちは、既存の、新しい協力、許可、製品買収、または他の戦略的取引を維持し、確立し、任意のそのような合意に従って支払われるべき任意の成功的な支払い、未来または支払い、マイルストーン支払い、特許権使用料、または他の支払いの時間および金額を含む、任意のこのような合意の下での私たちの財務義務を履行することができます
•私たちが発売許可を得た候補製品の商業販売収入(もしあれば)
•技術者を引き付け、採用し、維持する費用
•上場企業としての運営コストは
•新冠肺炎の大流行に関連する要素に対応することによる可能性のある任意の中断または遅延
•潜在的な紛争や訴訟を処理または応答すること;および
•私たちは企業、製品、そして技術プラットフォームの程度を買収または投資する。
我々が非臨床開発と臨床開発を完了し、規制機関の候補製品の承認を得て、製品販売から大量の収入を得ることができる前に、追加の株式や債務融資、または戦略的協力、許可、または他の手配の形で提供される他の資本を売却することで、私たちの運営に資金を提供することが予想される。追加的な資本が必要なら、私たちは私たちが受け入れられる条件で資金を調達できないかもしれないし、資金を調達できないかもしれない。もし私たちが株式または転換可能な債務証券(株式分配協定による追加資金を含む)を発行することで追加資金を調達すれば、私たちの既存の株主の権益を希釈する可能性がある。債務融資又は優先株式融資は、実行可能であれば、固定支払義務の増加、及び我々普通株よりも優先する権利を有する証券の存在を招く可能性がある。もし私たちが借金を抱えていたら、私たちは私たちの業務を制限する契約によって制限されるかもしれない。もし私たちが戦略的協力、許可、または他の計画を通じて資金を調達すれば、私たちは重大な権利を放棄したり、私たちに不利な条項に許可を与えるかもしれない。私たちが追加資金を調達する能力は、潜在的な世界経済状況の悪化と、最近の米国と世界的な信用と金融市場が新冠肺炎の流行によって受けた妨害と変動、金利と経済インフレの実際または予想変化、その他の要素の悪影響を受ける可能性がある。もし私たちが要求通りに追加資本を調達できなければ、私たちの業務、経営業績、財務状況は不利な影響を受けるだろう。
材料現金需要
私たちは私たちの運営に十分かつ効果的に資金を提供できることを確実にするために、私たちの流動性と資本資源を評価し続けている。自分から2022年12月31日私たちの主な現金需要は、主に給料と福祉の支払い、臨床試験の管理、研究、私たちの製造能力の向上、私たちの運営を支援するために必要な技術と施設の提供、運営賃貸義務の提供資金、私たちの協力協定に関連する他の支払いを含む。注3を参照許可、協力、成功支払協定注9と、賃貸借証書なお、本年度報告(表格10-K)第2部第8項に記載されている監査総合財務諸表の付記を参照して、より多くの資料を取得してください。
キャッシュフロー
次の表は、示す期間のキャッシュフロー(千単位)をまとめた
| | | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 | | |
| | 2022 | | 2021 | | 2020 | | | | |
提供された現金純額(使用): | | | | | | | | | |
経営活動 | $ | (169,555) | | | $ | (126,249) | | | $ | (160,874) | | | | | |
投資活動 | (11,540) | | | (121,573) | | | (273,516) | | | | | |
融資活動 | 10,635 | | | 401,244 | | | 476,790 | | | | | |
現金、現金等価物、および制限的現金純増加 | $ | (170,460) | | | $ | 153,422 | | | $ | 42,400 | | | | | |
経営活動
2022年12月31日までの年度における経営活動のための現金純額は1.696億元は、主に当社の純損失1.831億ドル、運営資産および負債純額が82,000,000ドル減少したことを反映しており、主な原因は、非現金収入による繰延収入の8,470万ドルの減少と、前払い支出、その他の流動資産およびその他の資産の2,000,000ドルの減少が確認されたが、主にテナント改善手当の徴収による経営賃貸負債の4,900,000ドルの相殺である。これらの減少額は非現金支出9560万ドルによって部分的に相殺され、非現金支出は主に8190万ドルの株式ベースの給与、1800万ドルの減価償却と償却、500万ドルの他の投資減価と関係がある。また,支払成功負債公正価値変動が510万ドル減少し,他の投資収益の非現金調整が290万ドル減少したことを確認した。
夜の中でAR 2021年12月31日現在、経営活動で使用されている現金純額は1億262億ドル主に私たちの純損失を含めて2.502億ドル株式ベースの報酬費用のような非現金プロジェクトによって部分的に相殺されます6220万ドルその他の投資は3,640万ドルの減価償却と償却費用です1,360万ドル支払いに成功した負債の公正価値変動370万ドルそれは.また、純営業資産
借金も増えた400万ドルその中には、テナント改善手当を受けて増加した経営賃貸負債が含まれている1,330万ドル確認されたのは1050万ドル以前は繰延収入の収入と記録されていた。
積極的な投資都市.都市
2022年12月31日までの年間で、投資活動のための現金は1,150万ドルで、財産と設備の購入を含めて2,430万ドルで、純満期日、有価証券1,270万ドルの販売と購入によって相殺される。2021年12月31日までの年間投資活動用現金は1億216億ドル以下の有価証券の純購入を含む5610万ドル資本支出と6550万ドル.
融資活動
2022年12月31日までの1年間に、融資活動が提供する現金は1060万ドルで、株式オプションを行使する960万ドルの収益と従業員の株式購入計画の150万ドルの収益を含み、一部は株式奨励の株式純決済に関する50万ドルの税金で相殺された。2021年12月31日までの年間で、融資活動が提供する現金は4.012億ドルで、初公募株で我々の普通株を売却した3.918億ドルの純収益と株式オプションを行使する940万ドルの収益が含まれている。
重要な会計政策と重大な判断と見積もり
私たちが監査した総合財務諸表はアメリカ公認会計基準に基づいて作成された。これらの総合財務諸表を作成する際には、監査された総合財務諸表の日付の報告済み資産および負債額、または有資産および負債の開示、および報告期間内に発生した報告された収入および費用に影響を与える推定および仮定を行う必要がある。我々の見積もりは,我々の歴史的経験と,当時の状況では合理的な様々な他の要因に基づいており,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。我々の重要な会計政策は、本年度報告書10-K表第II部第8項の審査総合財務諸表付記により詳細に記載されているが、これらの政策は、経営陣の判断と推定のより重要な分野に関連しているため、以下の会計政策は、経営陣の判断と推定のより重要な分野に関連しているため、以下の会計政策は、我々の歴史と将来の業績を知るために重要であると考えられる。
収入確認
我々は,サービス提供時に研究サービスの収入を確認するのが一般的であるが,払い戻し不可能な前払い費用の収入は,投入方法を用いて関連履行義務履行の進捗状況(すなわち総見積りコストに対する累積実コスト)の時間経過を測定することで確認する.
推定進捗状況は複雑であり、重大な判断に関連し、発生する内部人員費用及び外部費用総額を含む義務履行に要する総費用の推定値の影響を受ける。このような推定値の変化は私たちの収入確認に実質的な影響を及ぼすかもしれない。
私たちの収入確認のさらなる説明については、付記2を参照されたい基礎と重要な会計政策を列記し本年度報告“Form 10−K”第2部第8項に記載されている監査総合財務諸表に付記されている。
支払いに成功する
私たちは普通株の1株当たりの時価の増加に基づいてフレッド·ハッジとスタンフォードにSuccess支払い、普通株は現金または現金等価物で支払うか、または私たちの判断に基づいて普通株の公開取引株で支払うことを要求された。成功した支払いは会計基準コード(ASC)718項目で課金され、報酬--株式報酬そして、初歩的に公正価値によって記録し、相応の研究開発費用を計上した。負債は貸借対照表ごとに市価で計算され,すべての価値変動は総合経営報告書と全面損失表で確認された研究開発費で確認された彼らのサービス期間が終わったら成功した支払いはASC 815項目に記入されます派生ツールおよびヘッジまた,公正価値変動は他の収入(費用),純額に計上される.支払い義務の達成または満期の早い者まで、価値変動を公正に許可する負債を調整し続ける。成功した支払いの推定公正価値を決定するために、必要に応じて判断されたいくつかの重要な変数に基づいて負債価値をモデル化するモンテカルロシミュレーションモデルを使用し、これらの変数は、私たちの普通株式の予想公平価値および変動性、推定期限および推定計量日の数を含む。
株に基づく報酬
株式ベースの報酬コスト確認は、限定株式奨励(“RSA”)、制限株式単位(“RSU”)、従業員株購入計画に関する従業員株式購入と株式オプションとする。株式の報酬コストに基づいて付与日に奨励の公正価値をもとに計量する。株式報酬の公正価値は,必要なサービス期間中に直線ベースの費用として確認され,没収が発生した場合に確認される.
私たちはオプションの公正価値を決定するためにブラック-スコアモデルを使用した。ブラック·スコアーズオプション定価モデルは、株価変動性、株式オプションの期待寿命、無リスク金利、および日標に付与された普通株の公正価値を含む仮説の使用を要求する。我々の制限株式奨励と制限株式単位は、付与日奨励の公平な市場価値に基づいて推定される。
私たちの初公募株が終了する前に、私たちの取締役会は各授与日に重大な判断を使用して、私たちの発展段階を考慮することを含む、私たちの普通株の公正価値を推定する;私たちの研究開発の進展;私たちの転換可能な優先株の私たちの普通株に対する権利、優先と特権;上場企業の株式市場状況に影響することができ、そして私たちの普通株は販売可能性が不足している
他の投資の評価
私たちは計量代替案を使用して入金された非流通株投資を持っている。計量代替案によれば、額面はコストから任意の減値を減算し、同一発行者の同じまたは類似した投資の順序取引に見られる価格変動による変動を加算または減算して計量する。観察された取引が我々のポートフォリオの証券に類似しているかどうかを決定するためには,投資の権利と義務に基づいて判断する必要がある。観察可能な価格変化により、私たちの株式投資の帳簿価値を上方と下方に調整し、各種の推定方法を用いて私たちの投資の公正価値を定量的に評価し、使用推定に関連する必要がある。
私たちは各手配の開始時に1つの投資または他の権益が可変利益エンティティ(VIE)とみなされるかどうかを決定する。もし投資や他の利益がVIEとして決定された場合、私たちは私たちが主な受益者とみなされているかどうかを評価するつもりだ。VIEの主な受益者は,(I)VIEの経済表現に最も影響を与える活動を指導する権利がある,(Ii)VIEの損失を負担する義務があるか,またはVIEから利益を得る権利がある,の2つの基準を満たす側である。VIEの資産、負債、および経営結果は、私たちが主な受益者とされているVIEの任意の投資について、私たちの連結財務諸表に含まれます。2022年と2021年12月31日までにVIEはない私たちはその主な受益者だ。
非流通株投資も定期減値審査を受けなければならない。我々の四半期減価分析は同時に投資公正価値に重大な影響を与える可能性のある定性と定量要素を考慮した。考慮した定性的要素は、会社の財務と流動資金状況、資本資源を獲得するルート、前回の公正価値の調整からの時間などを含む。減価指標が存在する場合、市場と収益方法を用いて、私たちの株式投資の公正価値を数量化評価し、割引率、被投資会社の収入とコスト、合理的に利用可能なプライベートと上場会社の比較可能な市場データなどを含む判断と使用推定が必要である。私たちの評価が減値があることを示した時、私たちは投資をその公正な価値と減記する。
我々は2022年の潜在的減値指標を定性的に評価し,我々の帳簿金額500万ドルの他の投資の指標を決定した。単一のイベントや要因はないが,対象会社の来年度の運営キャッシュフロー需要と,これらの需要に資金を提供する流動資産残高,および減価指標である対象会社の資金調達能力の不確実性を考慮した。これらの指標のため、私たちは投資の推定値を評価し、公正な価値が取るに足らないことを決定し、減値は一時的ではない。そこで、我々は、2022年12月31日までの年度の投資で500万ドルの減値支出を記録し、この減値支出は、総合経営業績表及び全面損失表における他の投資の減値及び総合貸借対照表における他の投資の減値を計上している。
2021年の財務諸表を作成する際に,潜在的な減値指標を定性的に評価し,PACT系C−1転換可能優先株3640万ドルへの投資指標を決定した。単一のイベントや要因はないが,PACTの来年度の運営キャッシュフロー要求と,これらの要求に資金を提供する流動資産残高と,減値指標として資金を調達できないことを考慮した.これらの指標のためにPACTでの投資推定値を評価しました
2021年12月31日公正価値は無視でき、減値は一時的ではないことを決定した。したがって、私たちは2021年第4四半期に私たちの合意投資に対して3640万ドルの減値を記録した。減価費用は総合経営及び全面赤字表内の他の投資の減値に計上し、総合貸借対照表内の他の投資の減値に計上する。
最近採用された会計公告
注2を参照基礎と重要な会計政策を列記し 同封の付記に本年度報告は、最近の会計声明に関する資料、これらの声明を採用した時間、および当社の財務状況または経営業績に対する潜在的な影響の評価を得るために、10-K表形式で当社の総合財務諸表第2部第8項に記載されている。
第七A項。市場リスクの定量的·定性的開示について
私たちは正常な業務過程で市場リスクに直面している。私たちの主な危険は金利感受性を含む。
金利リスク
現金等価物があります年間1.078億ドルS,2022年12月31日は、通貨市場基金と購入した高流動性投資からなり、原始満期日は購入日から3ヶ月以下である。私たちは適切な証券を持っています5億867億元です2022年12月31日。私たちの投資活動の主な目標は資本を保存し、私たちの運営に資金を提供することで、現在私たちは金利リスクを開放しません。我々の有価証券は存続期間において主に短期的であるため,金利リスクに対するリスクの開放は大きくないと考えられ,金利のどの期間の相対変動10%も我々の監査総合財務諸表に実質的な影響を与えないと仮定しており,これらの財務諸表は本年度報告Form 10−K第II部第8項に含まれている。2022年12月31日まで、私たちは未済債務を持っていない。
外貨両替リスク
私たちのすべての従業員と業務は現在アメリカにあります。私たちの費用は通常ドルで計算されます。そのため、私たちは現在、外貨為替レートの変化に関連する重大な市場リスクの影響を受けていない。しかし、私たちはすでに非アメリカサプライヤーと契約を締結し続ける可能性があり、私たちは彼らの現地通貨で支払うかもしれない。私たちの業務は将来外貨為替レートの変動の影響を受けるかもしれません。これまで、外貨取引損益は私たちの連結財務諸表にとって重要ではなく、私たちも正式な外貨ヘッジ計画はありませんでした。いずれの期間においても,仮定した1%の為替変動は,本年度報告(Form 10−K)第2部第8項に記載された総合財務諸表に実質的な影響を与えないと信じている。
インフレの影響
インフレは一般的に労働コストと臨床試験費用を増加させることで私たちに影響を及ぼす。インフレは、本年度報告10-K表第2部第8項に記載された監査された総合財務諸表に実質的な影響を与えていないと考えられる。
項目8.財務諸表と補足データ
ライルIMMUN PHARMA,Inc.
連結財務諸表索引
2022年、2021年、2020年12月31日までの年度
カタログ
| | | | | |
独立公認会計士事務所レポート(PCAOB ID:42) | 86 |
| 監査された連結財務諸表: | |
合併貸借対照表 | 88 |
合併経営報告書と全面赤字 | 89 |
転換可能優先株と株主権益連結報告書(損失) | 90 |
統合現金フロー表 | 91 |
連結財務諸表付記 | 92 |
独立公認会計士事務所報告
ライル免疫会社の株主と取締役会に行きます。
財務諸表のいくつかの見方
添付されているライヤー免疫会社(当社)の2022年12月31日と2021年12月31日までの総合貸借対照表、2022年12月31日までの3年度の関連総合経営表と全面赤字、転換可能優先株と株主権益(赤字)と現金流量および関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は、すべての重要な面で、2022年12月31日、2022年12月31日、2021年12月31日までの会社の財務状況、および2022年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に基づき、テレデビル委員会協賛組織委員会が発表した“内部統制-総合枠組み(2013枠組み)”で確立された基準と、私たち#年の報告に基づいて、2022年12月31日までの会社の財務報告内部統制を監査した2023年2月28日これについて余すところのない意見を発表した
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要な監査事項を伝達することはいかなる方法でも吾などの総合財務諸表全体に対する意見を変えることはなく、吾らも下記の重要な監査事項を伝達することなく、肝心な監査事項或いはそれに関連する勘定或いは開示について独立した意見を提供する。
PACT取引のVIE会計考慮
| | | | | |
関係事項の記述 | 統合財務諸表付記2、3、5および6に記載されているように、2022年10月、当社はPACT Pharma,Inc.(PACT)と和解合意に達し、彼らの未解決の法的紛争を解決する。和解協定については,双方がPACTのD系列転換可能優先株を会社に発行し,PACTの完全希釈株式の約80%を占め,会社がそのPACT C−1系列転換可能優先株を入札して仲裁を解決する株式購入プロトコルを締結した。
当社は可変利益を有し、主な受益者である場合には可変利益エンティティ(VIE)を合併する。VIEの主な受益者には,(I)VIE活動を指導する権限があり,これらの活動はVIEの経済表現に最も重大な影響を与える,(Ii)VIEはVIEに潜在的に重大な影響を与える可能性のある損失を吸収する義務がある,あるいはVIEからVIEに重大な影響を与える可能性のある利益を得る権利がある。もし当社がVIEの主要な受益者でなければ、投資の性質に基づいて、他の適用されるGAAPに基づいてその権益を計算する。
当社が主要な受益者であるかどうかを評価する際に、経営陣に重大な複雑性と判断力があるため、PACT Dシリーズ転換可能優先株の初期会計を重要な監査事項として決定した。これは逆に、監査人がプログラムの実行とこの評価に関連する監査証拠を評価する上で高度な判断力、主観性と努力を持っていることを招く。 |
私たちが監査でどのようにこの問題を解決したのか | PACTにおける当社の権益をテストするために、PACTのガバナンスについて管理層と議論し、和解協定、優先株購入協定、改訂と再記述された投票権協定、PACTの改訂と再記載された会社証明書を含む取引文書をチェックし、主要な受益者決定に関する管理層の判断と結論を評価し、管理層評価に関連する制御の有効性を評価した。 |
/s/ 安永法律事務所
2019年以来、当社の監査役を務めてきました。
カリフォルニア州サンマテオ
2023年2月28日
ライル免疫会社です。
合併貸借対照表
(千単位で、1株当たりを除く)
| | | | | | | | | | | |
| 12月31日まで |
| 2022 | | 2021 |
資産 | | | |
流動資産: | | | |
現金と現金等価物 | $ | 123,554 | | | $ | 293,828 | |
有価証券 | 516,598 | | | 320,966 | |
前払い費用と他の流動資産 | 11,143 | | | 11,492 | |
流動資産総額 | 651,295 | | | 626,286 | |
制限現金 | 280 | | | 466 | |
非流通有価証券 | 70,117 | | | 283,531 | |
その他の投資 | 44,924 | | | 47,001 | |
財産と設備、純額 | 123,023 | | | 120,098 | |
経営的リース使用権資産 | 43,242 | | | 46,541 | |
他の非流動資産 | 4,680 | | | 3,483 | |
総資産 | $ | 937,561 | | | $ | 1,127,406 | |
| | | |
負債と株主権益 | | | |
流動負債: | | | |
売掛金 | $ | 3,917 | | | $ | 3,207 | |
負債その他流動負債を計上しなければならない | 28,755 | | | 29,057 | |
支払成功負債 | 4,356 | | | 9,486 | |
収入を繰り越す(1) | — | | | 4,988 | |
流動負債総額 | 37,028 | | | 46,738 | |
非流動経営賃貸負債 | 63,168 | | | 66,650 | |
収入を繰延し、流動ではない(2) | — | | | 79,665 | |
他の非流動負債 | 4,113 | | | 4,566 | |
総負債 | 104,309 | | | 197,619 | |
引受金及び又は事項(付記16) | | | |
株主権益: | | | |
優先株、$0.0001額面価値10,0002022年12月31日と2021年12月31日にそれぞれ認可された株ゼロ2022年12月31日及び2021年12月31日に発行及び発行された株式 | — | | | — | |
普通株、$0.0001額面価値500,0002022年12月31日と2021年12月31日にそれぞれ認可された株249,567そして242,738それぞれ2022年12月31日及び2021年12月31日に発行及び発行された株式 | 25 | | | 24 | |
追加実収資本 | 1,608,306 | | | 1,515,748 | |
その他の総合損失を累計する | (7,599) | | | (1,623) | |
赤字を累計する | (767,480) | | | (584,362) | |
株主権益総額 | 833,252 | | | 929,787 | |
総負債と株主権益 | $ | 937,561 | | | $ | 1,127,406 | |
(1) 以下の関係者からの金額を含めてゼロそして$4,988それぞれ2022年12月31日と2021年12月31日まで。
(2) 以下の関係者からの金額を含めてゼロそして$79,665それぞれ2022年12月31日と2021年12月31日まで。
付記はこれらの連結財務諸表の構成要素である。
ライル免疫会社です。
合併経営報告書と全面赤字
(千単位で、1株当たりを除く)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
収入.収入(1) | $ | 84,683 | | | $ | 10,650 | | | $ | 7,756 | |
運営費用: | | | | | |
研究開発 | 159,188 | | | 138,693 | | | 182,243 | |
一般と行政 | 117,307 | | | 89,057 | | | 46,881 | |
その他の営業収入、純額 | (4,754) | | | (2,324) | | | (9,431) | |
総運営費 | 271,741 | | | 225,426 | | | 219,693 | |
運営損失 | (187,058) | | | (214,776) | | | (211,937) | |
利子収入,純額 | 7,053 | | | 1,165 | | | 5,939 | |
その他の収入,純額 | 1,887 | | | (161) | | | 1,526 | |
| その他の投資減価 | (5,000) | | | (36,447) | | | — | |
| その他の収入(赤字)を合計して純額 | 3,940 | | | (35,443) | | | 7,465 | |
純損失 | (183,118) | | | (250,219) | | | (204,472) | |
その他の全面的な損失: | | | | | |
有価証券は純損失を実現していない | (5,976) | | | (1,879) | | | (198) | |
総合損失 | $ | (189,094) | | | $ | (252,098) | | | $ | (204,670) | |
普通株主の純損失: | | | | | |
純損失 | $ | (183,118) | | | $ | (250,219) | | | $ | (204,472) | |
転換可能な優先株を買い戻す際の配当金とする | — | | | — | | | (3,582) | |
普通株主に帰属する純損失 | $ | (183,118) | | | $ | (250,219) | | | $ | (208,054) | |
| | | | | |
普通株1株当たりの基本損失と償却後の純損失 | $ | (0.74) | | | $ | (1.84) | | | $ | (15.69) | |
基本と希釈後の普通株1株当たり純損失を計算するための加重平均株式数 | 247,080 | | | 135,918 | | | 13,258 | |
(1) 関係者の収入$も含めて84,653, $10,509そして$7,7562022年12月31日まで、2021年12月31日および2020年12月31日まで。
付記はこれらの連結財務諸表の構成要素である。
ライル免疫会社です。
転換可能優先株と株主権益連結報告書(損失)
(単位:千)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 転換可能優先株 | | | 普通株 | | その他の内容 支払い済み 資本 | | 積算 他にも 全面的に 収入(損) | | 積算 赤字.赤字 | | 株主合計 (赤字)権益 |
| 株 | | 金額 | | | 株 | | 金額 | | | | |
2019年12月31日現在の残高 | 152,116 | | | $ | 519,163 | | | | 11,181 | | | $ | 1 | | | $ | 18,108 | | | $ | 454 | | | $ | (129,671) | | | $ | (111,108) | |
Cシリーズ転換優先株を発行し,純額は$533発行コストの面で | 42,905 | | | 492,467 | | | | — | | | — | | | — | | | — | | | — | | | — | |
| 戦略パートナーに普通株式を発行する | — | | | — | | | | 275 | | | — | | | 1,004 | | | — | | | — | | | 1,004 | |
| 普通株を発行して資産買収に用いる | — | | | — | | | | 688 | | | — | | | 4,000 | | | — | | | — | | | 4,000 | |
| 株式オプション行使時に普通株を発行する | — | | | — | | | | 113 | | | — | | | 373 | | | — | | | — | | | 373 | |
| 株に基づく報酬 | — | | | — | | | | 5,345 | | | 1 | | | 33,260 | | | — | | | — | | | 33,261 | |
| 転換可能優先株を買い戻す | (547) | | | (662) | | | | — | | | — | | | (3,582) | | | — | | | — | | | (3,582) | |
| 普通株買い戻し | — | | | — | | | | (2,032) | | | — | | | (11,806) | | | — | | | — | | | (11,806) | |
| その他総合損失 | — | | | — | | | | — | | | — | | | — | | | (198) | | | — | | | (198) | |
| 純損失 | — | | | — | | | | — | | | — | | | — | | | — | | | (204,472) | | | (204,472) | |
2020年12月31日の残高 | 194,474 | | | $ | 1,010,968 | | | | 15,570 | | | $ | 2 | | | $ | 41,357 | | | $ | 256 | | | $ | (334,143) | | | $ | (292,528) | |
初公開の収益、純額は$33,198発行コストの面で | — | | | — | | | | 25,000 | | | 2 | | | 391,800 | | | — | | | — | | | 391,802 | |
| 転換可能優先株を普通株に変換する | (194,474) | | | (1,010,968) | | | | 194,474 | | | 20 | | | 1,010,948 | | | — | | | — | | | 1,010,968 | |
| 株式オプション行使時に普通株を発行する | — | | | — | | | | 2,750 | | | — | | | 9,442 | | | — | | | — | | | 9,442 | |
| 株に基づく報酬 | — | | | — | | | | 4,944 | | | — | | | 62,201 | | | — | | | — | | | 62,201 | |
| その他総合損失 | — | | | — | | | | — | | | — | | | — | | | (1,879) | | | — | | | (1,879) | |
| 純損失 | — | | | — | | | | — | | | — | | | — | | | — | | | (250,219) | | | (250,219) | |
2021年12月31日現在の残高 | — | | | $ | — | | | | 242,738 | | | $ | 24 | | | $ | 1,515,748 | | | $ | (1,623) | | | $ | (584,362) | | | $ | 929,787 | |
株式オプション行使時に普通株を発行する | — | | | — | | | | 3,601 | | | 1 | | | 9,576 | | | — | | | — | | | 9,577 | |
| 従業員株購入計画による普通株の発行 | — | | | — | | | | 475 | | | — | | | 1,519 | | | — | | | — | | | 1,519 | |
| 制限株式単位に関する普通株を発行し,税後純額 | — | | | — | | | — | | 153 | | | — | | | (461) | | | — | | | — | | | (461) | |
株に基づく報酬 | — | | | — | | | | 2,600 | | | — | | | 81,924 | | | — | | | — | | | 81,924 | |
その他総合損失 | — | | | — | | | | — | | | — | | | — | | | (5,976) | | | — | | | (5,976) | |
純損失 | — | | | — | | | | — | | | — | | | — | | | — | | | (183,118) | | | (183,118) | |
2022年12月31日現在の残高 | — | | | $ | — | | | | 249,567 | | | $ | 25 | | | $ | 1,608,306 | | | $ | (7,599) | | | $ | (767,480) | | | $ | 833,252 | |
付記はこれらの連結財務諸表の構成要素である。
ライル免疫会社です。
統合現金フロー表
(単位:千)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
経営活動のキャッシュフロー | | | | | |
純損失 | $ | (183,118) | | | $ | (250,219) | | | $ | (204,472) | |
純損失と経営活動で使用される現金純額の調整: | | | | | |
株に基づく報酬費用 | 81,924 | | | 62,201 | | | 33,261 | |
減価償却および償却費用 | 18,020 | | | 13,624 | | | 4,294 | |
| その他の投資減価 | 5,000 | | | 36,447 | | | — | |
成功支払負債の公正価値変動 | (5,130) | | | 3,713 | | | 5,337 | |
| 他の投資から収益を得る | (2,923) | | | — | | | — | |
レンタル料金は、レンタル再計量収益を差し引いた純額です | (1,553) | | | 911 | | | 3,181 | |
権証公正価値変動を承諾する | 1,067 | | | 256 | | | (1,323) | |
有価証券の純償却と付加価値 | (930) | | | 1,901 | | | 539 | |
| 財産·設備処分損失(収益)純額 | 103 | | | 1,210 | | | (4,884) | |
資産購入に関する費用 | — | | | — | | | 3,529 | |
| 純営業賃貸負債処分収益 | — | | | (308) | | | — | |
経営性資産と負債変動状況: | | | | | |
前払い費用、その他の流動資産、その他の資産 | (1,968) | | | (6,987) | | | (1,388) | |
売掛金 | 667 | | | 91 | | | (278) | |
負債その他流動負債を計上しなければならない | (463) | | | 4,542 | | | 6,120 | |
収入を繰り越す | (84,653) | | | (10,508) | | | (7,756) | |
| 非流動経営賃貸負債 | 4,855 | | | 13,202 | | | 2,966 | |
| 他の非流動負債 | (453) | | | 3,675 | | | — | |
経営活動のための現金純額 | (169,555) | | | (126,249) | | | (160,874) | |
投資活動によるキャッシュフロー | | | | | |
財産と設備を購入する | (24,276) | | | (65,504) | | | (51,481) | |
有価証券を購入する | (406,316) | | | (673,465) | | | (864,909) | |
有価証券の売却と満期日 | 419,052 | | | 617,396 | | | 686,322 | |
他の投資を購入する | — | | | — | | | (43,448) | |
投資活動のための現金純額 | (11,540) | | | (121,573) | | | (273,516) | |
融資活動によるキャッシュフロー | | | | | |
株式オプションを行使して得られる収益 | 9,577 | | | 9,442 | | | 373 | |
| 従業員の株購入計画の収益 | 1,519 | | | — | | | — | |
| 配当金の株式純額決済に関する支払済み税 | (461) | | | — | | | — | |
| 初公募株の収益は、発行コストを差し引く | — | | | 391,802 | | | — | |
転換優先株を発行して得られた金は,発行コストを差し引く | — | | | — | | | 492,467 | |
普通株買い戻し払い | — | | | — | | | (11,806) | |
転換優先株の買い戻し支払い | — | | | — | | | (4,244) | |
融資活動が提供する現金純額 | 10,635 | | | 401,244 | | | 476,790 | |
現金、現金等価物、および制限的現金純増加 | (170,460) | | | 153,422 | | | 42,400 | |
期初現金、現金等価物、および限定現金 | 294,294 | | | 140,872 | | | 98,472 | |
期末現金、現金等価物、および制限現金 | $ | 123,834 | | | $ | 294,294 | | | $ | 140,872 | |
| 以下の者が代表する | | | | | |
| 現金と現金等価物 | $ | 123,554 | | | $ | 293,828 | | | $ | 140,406 | |
| 制限現金 | 280 | | | 466 | | | 466 | |
| 合計する | $ | 123,834 | | | $ | 294,294 | | | $ | 140,872 | |
キャッシュフロー情報を補充する | | | | | |
テナント改善手当に関する現金を受け取る | $ | 4,761 | | | $ | 13,295 | | | $ | 2,966 | |
賃貸負債の金額を計上するための現金 | $ | 10,870 | | | $ | 8,546 | | | $ | 5,147 | |
| 非現金投資と融資活動: | | | | | |
売掛金及び売掛金に掲げる財産及び設備の購入 | $ | 1,325 | | | $ | 4,605 | | | $ | 12,740 | |
リース変更経営性リース使用権資産の再計量 | $ | 31 | | | $ | 3,873 | | | $ | (8,958) | |
| PACT Dシリーズ転換優先株を買収する | $ | 2,923 | | | $ | — | | | $ | — | |
| 初公開終了時に優先株を普通株に変換することができます | $ | — | | | $ | 1,010,968 | | | $ | — | |
経営性賃貸賃貸義務と引き換えに使用権資産 | $ | — | | | $ | — | | | $ | 30,475 | |
資産売却のために受け取った他の投資 | $ | — | | | $ | — | | | $ | 6,000 | |
付記はこれらの連結財務諸表の構成要素である。
1. 組織する
ライル免疫会社(“会社”)は2018年6月にデラウェア州に登録設立された。この会社は臨床段階の細胞治療会社で、私たちの特許を利用して固形腫瘍患者のために一連の治療方案を推進します離体する遺伝とエピジェネティックT細胞再プログラミング技術。会社設立以来、会社の主な活動はT細胞療法の開発、研究と開発、戦略協力と許可手配の達成、製造能力の確立、その製品候補開発努力を支持する製造活動、技術獲得、会社を組織し、会社に従業員を配備し、業務計画を行い、知的財産権の組み合わせを構築し、資本を調達し、これらの活動に一般と行政支持を提供することである。
初公募株
2021年6月、会社は普通株の初公募株(IPO)に成功した。初公募株について同社は発行·売却した25,000,000普通株、IPO価格は$17.00一株ずつです。同社は$を受け取りました391.8引受割引と手数料#ドルを差し引いた純収益29.8100万ドルで$を提供します3.4百万ドルです。初公募が終わった後、194,474,431優先株の株式を転換し、同数の普通株に変換することができる。変換された優先株の関連帳簿価値は$1.010億ドルは普通株式と追加の実収資本に再分類される。
2. 列報根拠と重大な会計政策
陳述の基礎
添付されている総合財務諸表は、米国公認会計原則(“GAAP”)に基づいて作成された。連結財務諸表には、当社及びその完全子会社の勘定が含まれている。すべての重大な会社間取引と残高は合併で流されるだろう。連結財務諸表と付記中のいくつかの前期金額はすでに今期の列報方式に適合するように再分類された。
流動性と管理計画
同社は現在、実験技術に関する長期候補製品を開発している。候補製品は完成するために数年と多くの支出がかかるかもしれないし、最終的には成功しないかもしれない。同社は利用可能な現金資源を用いたり、株式や債務証券の発行により業務に資金を提供することを計画している。同社は、2022年12月31日まで、現金、現金等価物、および有価証券を使用することができ、少なくともこれらの連結財務諸表の発行日から今後12ヶ月以内に、その運営に資金を提供するのに十分であると信じている。
重要会計政策の概要
予算の使用
公認会計原則に従って会社の総合財務諸表を作成し、管理層に報告金額と関連開示に影響する判断、推定と仮定を要求する。管理職が推定する必要がある具体的な口座には、株式に基づく報酬、成功報酬の推定値、他の投資の推定値、収入確認、計上費用が含まれているが、これらに限定されない。管理職は過去の経験や他の様々な当時の状況で部下が合理的と考えている仮説に基づいて推定されているが,これらの仮定の結果は資産や負債の帳簿価値を判断する基礎となっており,そのような資産や負債の帳簿価値は他の出所から容易に見られるわけではない。実際の結果はこのような推定とは大きく異なるかもしれない。
2022年6月、当社はグラクソ·スミスクライン知的財産権(第5号)有限会社及びグラクソ·スミスクライン集団有限公司(“GSK”と総称)が2019年に締結し、2020年6月及び2021年12月に改訂された協力及び許可協定(“GSK協定”)の推定変動に関する収入調整を収録した。これらの推定の変化は,双方が2022年6月に何らかの研究活動を完了することに同意したことと,グラクソ·スミスクラインが2022年12月24日に発効したGSK協定を終了したことにより,いずれも比例累積業績測定基準の変化を招いたためである。このような調整は収入をドル増加させた83.6百万ドル純損失が減少しました83.6百万ドルで$が生まれました0.34当社の年度までの普通株1株当たりの基本および償却純損失は減少しました2022年12月31日.
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
総合損失
総合損失には純損失と純損失以外に含まれない株主権益の何らかの変動が含まれる。2022年まで、2021年および2020年12月31日まで年度これには同社の有価証券の未実現純収益と純損失が含まれている。
現金、現金等価物、および限定現金
当社は購入日から三ヶ月以下の原始満期日に購入したすべての高流動性投資を現金等価物と見なしています。現金等価物は、主に商業手形および通貨市場口座に投資される金額を含む。
限定現金は,銀行口座に所持している現金であり,会社賃貸契約とともに発行された信用状の担保,および会社の会社クレジットカード計画に関する担保として用いられる。
有価証券
同社は通常、その余分な現金を投資レベルの短期から中期固定収益証券に投資する。このような投資は売ることができるように分類され、公正な価値で勘定され、実現されていない収益と損失を持って買い戻す総合損失の構成要素としての課税費用。売却可能な証券の実現損益は他の収入(費用)、純額に計上されている。投資を売る費用は特定の識別方法に基づいている。同社は以下の条件を満たす投資を分類している現在の業務で使用する必要はなく、付属の総合貸借対照表における非流動有価証券として、12ヶ月後に満期となる。
各報告期間内に、会社は、予想される信用損失による公正価値の低下が予想される信用損失によるかどうか、および予想される回復が生じるまで、会社が投資の能力と意図を持っているかどうかを評価する。予想された信用損失は再計上される他の収入(費用)による手当として、純額。
他の投資の評価
当社は、各手配開始時に1つの投資または他の権益が可変権益エンティティ(“VIE”)とみなされるかどうかを決定する。投資または他の権益がVIEとして決定された場合、会社はそれが主要な受益者とみなされているかどうかを評価する。VIEの主な受益者は,(I)VIEの経済表現に最も影響を与える活動を指導する権利がある,(Ii)VIEの損失を負担する義務があるか,またはVIEから利益を得る権利がある,の2つの基準を満たす側である。VIEの資産、負債、経営実績は、当社が主な受益者とされているVIEの任意の投資について、その総合財務諸表に含まれる。2022年と2021年12月31日までにVIEはないその会社は同社の主な受益者だ。
当社の戦略持分は普通株式と-スー!会計基準編纂(“ASC”)321によると、それに大きな影響を与えることができない非上場企業の普通株投資--株式証券(“ASC 321”)。買収時、これらの投資はコストによって計量され、コストは当時の公正な価値を代表する。米国会計基準第321条によれば、当社は、その後、初期コストから減値および同一発行者が同じまたは類似した投資の順序取引に見られる価格変動によって生じる任意の変動(“計量代替案”)計量投資を選択することができる。この選択はすべての投資のために個別的に行われなければならない。当社はこのカテゴリのすべての投資を選択し、この方法で計量された資格に適合しなくなるまで、この方法を用いてこれらの投資を計量し続ける。その他の投資の帳簿価値変動は純損失で確認した。各報告期間内に、会社は投資が減値するかどうかを評価するための定性的な評価を行う。同社の評価には,最近の経営結果や傾向,最近の被投資会社証券の売却/買収,その他被投資会社が経営を継続できるかどうかの懸念を引き起こす要因の審査が含まれている。投資が減値すると、投資帳簿金額が投資見積公正価値を超えた金額で減値費用が確認され、減値費用は純損失で確認される。注5を参照その他の投資2022年12月31日と2021年12月31日までに年度確認された投資減価の詳細が分かった。
また、同社は非上場企業の株を買収する権利を持たせる株式証投資を持っている。権証投資は見積公正価値に応じて他の資産に計上し、損益を確認する他の収入(費用)では、純額。 2022年12月31日まで、当社の他の投資の減価と併せて、株式証投資に関する公正価値は
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
取るに足らないものと認定される。会社は権利証投資の公正価値をゼロ2022年12月31日までの年度。付記6を参照公正価値計量権利証投資に関するより多くの細部事項を理解する。
財産と設備、純額
財産と設備は主に実験室設備、コンピュータ設備とソフトウェア、家具と固定装置、レンタル改善を含む。財産と設備はコストから減価償却累計と償却を差し引く。捨てて使う減価償却は関連資産の推定耐用年数をもとに直線法を用いて計算され、一般的には三つ至れり尽くせり5年. Fあるいはリースが改善された場合、償却は使用年数やレンタル期間の短いものを基準に、直線法で計算する。資産が廃棄または他の方法で処分された場合、コストおよび関連する減価償却·償却累計は貸借対照表から差し引かれ、それによって生じた収益又は損失は他の収入(費用)に計上され、純額彼はその時期に気づいた。維持費と修理費は発生時に計上される。事件や状況の変化がある資産の帳簿金額が回収できない可能性があることを示すたびに、当社はその物件や設備の減価状況を審査します。
長寿資産の評価
長寿資産は各報告期間内に、あるいはイベントや環境変化が資産の帳簿価値を回収できない可能性がある場合に審査を行い、これは帳簿価値或いは推定利用可能年限を調整する必要があるかもしれない。回収能力は,資産グループの帳簿価値と資産予想による将来の未割引キャッシュフローを比較することで測定した。ある資産グループの帳票金額がその推定された将来のキャッシュフローを超えていれば、その資産グループの帳票金額がその資産グループの公正価値を超えた金額の中で減価費用を確認する。当該等の資産は減値とみなされ、確認すべき減値は、当該資産の帳簿金額が当該資産による予想割引将来のキャッシュフロー純額の金額を超えて計量される。もうあります違います。新聞に掲載された任意の期間の長期資産減価。
買収する
当社は、買収資産および他の同様の取引を評価して、取引が業務合併または資産買収に計上されるべきかどうかを評価する方法であって、まず、買収された総資産の公正価値が実質的にすべて単一の識別可能な資産または同様の識別可能な資産のセットに集中しているかどうかを決定するためにスクリーニングを適用することである。条件を満たしていれば、この取引は資産買収として入金されるだろう。もし要求を満たすことができなかった場合、更に当社がすでに買収する能力があるかどうかを確定して、業務要求に符合する産出の投入と手続きを発生する必要があり、この場合、取引は買収会計方法を採用して入金しなければならず、その中で買収資産と負担する負債は買収日の推定公正価値によって確認しなければならず、買収無形資産の公正価値は貸借対照表に記入すべきである。取引コストは発生時に費用を計上する。買収価格が買収された純資産の分配公正価値を超えるどの部分も営業権に計上されている。もし当社が買収会計方法における企業合併の定義に適合していないと判断した場合、その取引は資産買収として入金される。
資産買収では、将来他に用途がないと判断された場合、進行中の研究·開発(“IPR&D”)に割り当てられた前金が研究·開発費用に記録され、製品の実行可能性に達していない技術が実現されていない場合には、後続のマイルストーン支払いが研究·開発費用に記録される。
賃貸借証書
その会社はあるオフィス、実験室、製造スペースを借りている。最低賃貸料のほか、賃貸契約には不動産税、保険、公共地域維持費、その他の実行費用が必要です。契約を締結する際には、当社は、当該手配に掲載されている独自の事実及び状況に基づいて、その手配がリース契約であるか否か又はテナントが含まれているか否かを決定する。すべてのレンタルについて、会社はレンタルの種別を経営性または融資性と決定した。2022年と2021年12月31日までにその会社のすべての賃貸借契約は経営賃貸契約に分類されている.
当社はリース開始日にレンタル期間内に将来の賃貸支払いの現在価値で使用権(“ROU”)資産および賃貸負債を確認します。当社の借款は暗黙的な金利を提供していないため、借入開始日ごとに逓増借款金利を採用して将来の借款支払いの現在値を決定します。逓増借款金利は当社が等値資金を借り入れて支払う金利です
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
レンタル開始日に担保方式で計算します。逓増借款金利を推定するために、当社には現在格付け機関の信用格付けがないため、総合信用格付け分析を用いて当社に適した信用格付けを推定している。ROU資産には、レンタル開始日前に支払われる任意のレンタル支払いが含まれており、当社に支払うべき任意のレンタルインセンティブを受信またはみなされることによって減少します。レンタル期間は、レンタル選択権を行使することを合理的に決定した場合に、レンタルを延長または終了する選択権を含むことができる。リース費用は、総合経営と全面赤字報告書の営業費用内でリース期間ごとに直線的に確認します。
当社はすでに実際の便宜策を選択しており、不動産賃貸の賃貸と非賃貸部分を分けない。また、当社はすべての短期賃貸のために短期賃貸を選択して免除を確認しているため、賃貸負債及び純資産は、初期期間が12ヶ月以下の賃貸の総合貸借対照表には含まれていない。
公正価値計量
当社は、報告された公正価値を決定する際に使用される投入を評価するために、公正価値報告の資産及び負債のすべての資料を開示しなければならない。公正価値階層構造は,これらの投入の観察可能な性質に基づいてこれらの投入の優先順位を決定する.公正価値等級は投資報告の公正価値を確定する時に使用する推定値投入にのみ適用され、投資信用の品質の評価基準ではない。この階層構造は、3つの評価入力レベルを定義する
第1レベル-活発な市場における同じ資産または負債の見積もり。
第2級-第1級における見積以外の直接又は間接的に観察可能な資産又は負債の投入。
第3レベル-観察できない入力は、資産または負債の価格設定の際に市場参加者自身が使用するという仮定を反映している。
当社の金融商品は、付記6に掲げる金融商品を除いて、公正価値計量現金、制限現金、その他の投資、売掛金および売掛金、およびその他の流動負債を含む。これらのツールの短期的な性質のため、現金、制限現金、売掛金および売掛金、および他の流動負債の帳簿価値は公正価値に近い。注5で述べたように、その他の投資他の投資は、コストから減値を減算し、同一発行者が同じまたは同様の投資の順序取引で観察可能な価格変化によって生じる任意の変化(正負)を計上する。
転換可能な優先株を買い戻す場合は配当金とする
2020年3月546,806会社は当時推定されていた公正価値$でAシリーズ転換可能優先株の株式を買い戻した7.761株当たり、これらの株の帳簿価値よりも高い。付記10を参照転換可能優先株それは.したがって、会社は配当金とみなされる#ドルを記録した3.62020年12月31日までの1年間でこの取引は転換可能優先株を#ドル減少させた0.7100万ドルで実収資本を削減しました3.6百万ドルです。配当金は普通株主の純損失を#ドル増加させたとされている3.6百万ドルです。
収入確認
その顧客が承諾した商品またはサービスの制御権を取得した場合、会社は収入を確認し、その額は、会社がこれらの商品またはサービスの交換から得られると予想される対価格を反映している。ASC 606の範囲内のスケジュールの収入確認を決定するために、取引先と契約した収入, (“ASC 606”)会社は、(I)顧客との契約を決定するステップと、(Ii)契約における履行義務を決定するステップと、(Iii)取引価格を決定するステップと、(Iv)契約に取引価格を割り当てる履行義務と、(V)契約義務が履行されたときに収入を確認するステップと、の5つのステップを実行する
ASC 606の枠組みを適用する際には、会社は、収入契約における承諾の性質、およびこれらの承諾が異なる履行義務を表すかどうかを決定するために判断を適用しなければならない。取引価格を決定する際には、当社には不確定要因の影響を受ける金額は含まれておらず、不確定要因が解決されない限り、累積収入が大きく逆転しない可能性が高い。当社が獲得可能なマイルストーンやその他の形式の可変対価格は研究開発に関する成果の重大な不確実性の影響を受けており,これらの成果は通常これらのマイルストーンが実際に実現されるまでは不可能であると考えられる.販売ベースの特許使用料を含む手配については、販売レベルに基づくマイルストーン支払いが含まれており、ライセンスはライセンスとみなされる
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
特許使用料に係る主要項目については、当社は、(I)関連販売が発生した場合又は(Ii)分配された特許権使用料の一部又は全部の履行義務が履行された(又は部分的に履行された)場合(遅い者を基準として)収入を確認する。また、会社は、契約で決定された契約義務ごとの独立販売価格を決定するために判断する必要があるという仮説を立てている。そして、当社は契約履行義務ごとの推定独立販売価格に基づいて総取引価格を契約義務ごとに割り当て、契約履行義務を履行する際に収入を確認します。その後の各報告期間が終了した時点で、当社は可変対価格および任意の関連制限を再評価し、必要に応じて全体の取引価格の推定値を調整する。どのような調整も累積追跡に基づいて記録されている.
会社のライセンス契約によると、会社は譲渡時に存在する許可を顧客に付与し、許可の性質は譲渡時に会社知的財産権を使用する権利である。会社の知的財産権の許可が合意で決定された他の履行義務とは異なると判定された場合、許可が顧客に譲渡され、顧客が許可を使用して利益を得ることができる場合、会社は、許可に割り当てられた払戻不可能な前払い費用の収入を確認する。他の承諾とバンドルされたライセンスについて、会社は、合併履行義務が時間の経過とともに履行されるか、ある時点で履行されるかを決定するために、合併履行義務の性質を評価するために判断を利用する。
研究開発費
当社は研究開発費を発生した費用に計上しています。研究開発費には、当社がその技術プラットフォームや候補製品を発見·開発するために発生するコストが含まれており、戦略協力に関するコスト、技術許可コスト、人員関連コスト(株式給与支出を含む)、施設および技術関連コスト、研究および実験室費用、相談費およびその他のコストを含む他の費用が含まれています。技術プラットフォームに関連する第三者に支払われる前払いおよびマイルストーンは、技術的実行可能性が達成されておらず、将来的に代替用途がない場合には、発生した費用を計上する。
一般と行政費用
一般及び行政費用は発生した時に計上され、人事に関する支出は、行政、法律、財務及びその他の行政職能者の株式給与支出、法律費用、協力及び許可協定に関連する取引費用、及び支払われた会計及び税務サービス費用、顧問費及びその他の研究及び発展費に計上されていない施設費用を含む。法的費用には会社、紛争、特許に関する費用が含まれている。
支払いに成功する
同社がフレッド·ハッチンソンがんセンター(“フレッド·ハッジ”)とランド·スタンフォード初級大学(“スタンフォード”)取締役会と締結した研究および協力協定条項によると、同社はSuccess支払いの権利を獲得したこれらの協定の条項によると、各契約に規定された計量日に、会社は、会社の普通株式の1株当たりの公正価値推定の増加に基づいて支払い成功支払いを要求される可能性がある。注3を参照許可、協力、成功支払協定それは.成功した支払いはA項に記入するSC 718, 報酬--株式報酬費用は研究開発費に記入します。サービスサイクルが終了すると、機器はASC 815で入金される派生ツールおよびヘッジそして、各報告期間において再計量を継続し、すべての価値変動を直ちに他の収入(費用)純額で確認する。
Success支払負債は、開始時およびその後の各報告期間に公平な価値で推定され、費用は、研究および協力協定のサービス期間内に累積される。Success支払いの推定公正価値を決定するために、同社は、いくつかのキー変数および株価行動を制御する過程の経験知識に基づいて、株価の将来の動向をモデル化するモンテカルロシミュレーション方法を使用する。以下の変数は、成功支払負債の推定公正価値:会社普通株の推定公正価値、期待変動率、無リスク金利、および支払いをトリガする可能性のある推定計量日の推定数量および時間に格納される。予想変動率の計算は、予想期限の仮定に合致した一定期間の上場企業株の履歴変動性に類似した既存情報に基づいて推定される。
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
信用リスクと表外リスクの集中度
同社は高品質で認可された金融機関とその現金、現金等価物、および限定的な現金を維持している。このような金額は時々連邦保険の限度額を超えるかもしれない。同社はまた、通貨市場基金、米国国債、米国政府機関証券、会社債務証券に短期投資を行い、これらの証券は一定の信用リスクを受ける可能性がある。しかし、当社は、ハイレベルツールへの投資、どの発行者または任意のタイプへの投資の開放を制限し、金融機関や発行者の持続的な信頼を監視することで、リスクを低減しています当社はこの等の口座に信用損失は何も発生していませんそれがこのような基金で重大な危険に直面しているとは思わない。当社には、外貨両替契約、オプション契約、その他のヘッジ手配など、貸借対照表外に集中する信用リスクはありません。
クレームと事項
当社は通常業務過程で発生したクレームに関する訴訟や法的手続きに時々巻き込まれる可能性があります。不利な結果の可能性が可能であり、金額が推定可能である場合は、会社は責任を負わなければならない。不利な結果の可能性が合理的にのみ可能である場合(可能ではなく)、または推定が確定できない場合、会社は重大なクレームまたは事項を開示するであろう。
株に基づく報酬
ASC 718によれば、会社は、付与日に付与された奨励の公正価値に基づいて制限株式奨励(“RSA”)、制限株式単位(“RSU”)、従業員株式購入計画に関する従業員株式購入及び従業員、取締役及びコンサルタントの株式オプションを付与する費用を計量及び確認する。株式オプションの公正価値はブラック·スコアーズオプション定価モデルを用いて推定される。ブラック·スコアーズオプション定価モデルは、株価変動性、株式オプションの期待期限、無リスク金利、期待配当金、および日標を付与する普通株の公正価値を含むいくつかの主観的仮定に基づく投入を必要とする。
予想変動率は、当社の予想期限の仮定に見合った期間における当社業界内の類似実体株の歴史的変動性に基づいている。株式オプション付与の期待期間代表オプションは、未償還期限を維持することが予想され、各オプションの帰属日と契約期限終了との間の中点である“簡略化”方法に基づく。当社は関連株式オプション行使活動履歴の限られた実体に適用する適用ガイドラインに規定されている簡略化方法を用いた。同社の無リスク金利は,付与時に有効な米国国庫券の対応金利をもとに,期限は想定した期待オプション期限に見合っている。予想配当率の仮定について言えば、当社は過去に配当金を派遣しておらず、将来見ても配当金を派遣しないことが予想される。
最初の公募が終了する前に、同社は財務報告目的の普通株の公正価値を決定する際に大量の推定と仮定を使用した。当社は、経営陣の意見と独立した第三者推定分析を考慮した後、米国公認会計士協会(AICPA)会計·推定ガイドラインに基づいて、取締役会が決定した普通株推定公正時価を下回らない価格でRSAと株式オプションの費用を記録する補償として発行された個人持株会社株式証券の推定値それは.初公開発売完了後、当社の普通株の公正価値は、授出日にナスダック世界ベスト市場で発表された市場価格をもとにしている。
RSA、RSU、および株式オプションの株式ベースの補償費用は、通常、対応する報酬の獲得期間である必要なサービス期間内に直線的に確認される。当社は発生した没収行為を計算します。
同社はまた、ある重要な従業員に株式オプションを付与し、これらのオプションはある業績条件と結合している。各報告日に、会社は業績条件を達成する可能性があるかどうかの評価を要求された。補償費用は会社の各業績規定の評価に基づいて、適切なサービス期間内に記録されている。
所得税
当社は、資産と負債の財務報告と課税基礎との差異に基づいて、繰延税金資産と負債を決定します。繰延税金資産及び負債が予想差額に振り戻されたときに発効した税率計量が制定された。推定免税額が超過している
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
繰延税金資産は回収できない可能性が高い。当社は財務諸表確認と計量納税申告書で採用されたまたは予想されている納税頭寸を決定する際に判断を適用します。当社は所得税支出で確認されていない税収割引に関するいかなる実質的な利息及び罰金も確認します。
細分化市場
経営分部は企業の構成要素として確認され、その独立した離散財務情報は、首席経営決定者が資源配分に関する決定と業績評価を行う際に評価することができる。会社は以下の点でその運営·管理業務を確認します1つは運営部門と1つは報告可能な部分。
最近の会計公告
ない。
3. 許可、協力、成功支払協定
フレッド·ハッジ
許可協定-2018年、同社はFred Hutchと、ヒト癌を治療するためのすべての治療用途のための製品およびプロセスを研究、開発および商業化するために、同社の特定の特許権(独占)および特定の技術(非独占)下のグローバル再許可許可を付与するライセンス契約を締結した。
同社は毎年#ドルのライセンス維持費をFred Hutchに支払うことも要求されています50,000発効日の二周年、その後の発効日の各周年には、許可製品の最初の商業販売まで。
協力する-2018年、会社はフレッド·ハッジと研究·協力協定(“フレッド·ハッジ協力協定”)を締結し、癌免疫治療製品の研究と開発に専念した。同社はフレッド·ハッジが行った全体的な研究に$を提供した12.0フレッド·ハッジ協力協定によると、この研究は双方が承認した研究計画と予算に基づいて行われている。フレッド·ハッジの協力協定には6年制学期です。2021年の間,Success Paymentサービス期限に基づく研究計画の1つは2022年1月31日から2022年12月31日に延長された。会社が招く$1.7百万人 $4.2百万ドルとドル4.1それぞれ2022年,2021年および2020年12月31日までの年度のフレッド·ハッジ協力協定に関する支出百万元である。
支払いに成功する-2018年、当社はフレッド·ハッジ協力協定の条項に基づき、フレッド·ハッジにいくつかの成功的な支払いを受ける権利を付与した。フレッド·ハッジが成功した支払いの潜在的な支払いは、増加した価値の倍数に基づいており、範囲は10Xから50Xは、その元のドルに対する会社普通株(Aシリーズ転換可能優先株のすべての株がIPO終了時に同数の普通株に変換された)の1株当たり公正時価の比較に基づく1.831株当たりの発行価格。フレッド·ハッジに払った成功した支払い総額は$を超えてはいけない200.0100万ドルというのは50倍数が増値する。すべての敷居は成功した支払いに関連して、$から増加します10.0百万ドル18.291株あたり$に減少する200.0百万ドル91.441株当たり,測定期間内にこのような閾値に達した場合は支払うべきである。以前に支払われた任意のSuccess支払いは、任意の推定日までのSuccess支払いに計上されるので、Fred Hutchは、同じ閾値に関連する複数のSuccess支払いを受信しない。成功支払い契約の期限は、以下の場合より早い場合に終了します9年制合意日の周年記念日と(2)統制権取引の変更。
次の表は、フレッド·ハッジに支払う会社の普通株式公開取引株を会社が適宜決定する現金または現金等価物での潜在的成功支払総額をまとめている
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
発行時の初期株式価値の倍数 | 10x | | 20x | | 30x | | 40x | | 50x |
支払に必要な普通株1株当たり価格 | $ | 18.29 | | | $ | 36.58 | | | $ | 54.86 | | | $ | 73.15 | | | $ | 91.44 | |
累計支払成功 | $ | 10 | | | $ | 40 | | | $ | 90 | | | $ | 140 | | | $ | 200 | |
成功した支払いは延滞されますもし1株当たり公平な価値があれば会社の成功裏支払契約期間内に、契約に規定された推定計量日の普通株式が同等又はそれを超える
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
以上に挙げた倍数。推定計量日は、以下のイベントによってトリガされる1年制会社周年記念’最初の公募株とそれぞれ2年制会社周年記念’初回公募後,制御権変更取引終了および支払合意期限の最終日には,その期限が制御権変更取引の完了により終了しない限り.自分から2022年12月31日違います。会社普通株の1株当たり公正価値が支払いに必要な価格より低いため、成功裏な支払いが生じた。
2022年12月31日と2021年12月31日までに,フレッド·ハッジに支払われた成功支払いの推定公正価値は$である2.5百万aND$8.5それぞれ100万ドルです成功した支払い負債は、開始時およびその後の各報告期間に公平な価値で推定され、費用は、フレッド·ハッジ共同のサービス期間内に累積される“合意”。支払成功負債は#ドルです2.5百万ドルとドル6.4それぞれ2022年12月31日と2021年12月31日まで。フレッド·ハッジ協力協定の成功支払い義務について、会社は#ドルの収益を確認した3.9百万2022年12月31日までの年度そして成功的な支払い費用$1.2百万ドルとドル4.82021年12月31日までと2020年12月31日までの年度はそれぞれ100万ドル。
史丹福
許可協定 -2019年、同社はスタンフォード大学と特定の特許権を許可するライセンス契約を締結した。同社はスタンフォード大学で毎年#ドルのライセンス維持費の支払いも要求されている50,000発効日から2周年、発効日からライセンス製品の初商業販売日までの各周年。
スタンフォード大学へのマイルストーンの支払いは最高$に達します3.7特定の臨床と規制のマイルストーンを達成する際には、目標ごとに100万ドルが支払われる。その会社にはスタンフォード大学に#ドルを支払う義務があります2.5あるビジネスマイルストーンに達したとき、すべてのライセンス製品の合計費用は100万ドルです。また、ライセンス製品の年間純売上高に基づいて計算された下位桁分級印税はスタンフォード大学に支払われなければならない。
協力協定 -2020年10月、当社はスタンフォード大学と研究·協力協定(“スタンフォード協力協定”)を締結し、細胞免疫療法製品の研究と開発に専念した。スタンフォード大学の協力協定には4年制学期です。スタンフォード大学で行われた合計#ドルの研究に力を入れています12.0スタンフォード大学の協力協定によると、この研究は双方が承認した研究計画と予算に基づいて行われる。会社が招く$3.0百万人$3.0百万ドルとドル0.82022年12月31日まで、2021年12月31日と2020年12月31日までの年間スタンフォード協力協定に関する支出はそれぞれ100万ポンド。
支払いに成功する-2020年10月、スタンフォード協力協定の条項に基づき、当社はスタンフォード大学に何らかの成功的な支払いを受ける権利を付与した。スタンフォード協力協定の成功した支払いの潜在的な支払いは増加価値の倍数に基づいています10Xから50Xは、その元のドルに対する会社普通株(Aシリーズ転換可能優先株のすべての株がIPO終了時に同数の普通株に変換された)の1株当たり公正時価の比較に基づく1.831株当たりの発行価格。スタンフォード大学に支払われた成功金の総額は$を超えてはならない200.0100万ドルというのは50倍数が増値する。すべての敷居は成功した支払いに関連して、$から増加します10.0百万ドル18.291株あたり$に減少する200.0百万ドル91.441株当たり,測定期間内にこのような閾値に達した場合は支払うべきである。以前に支払われたいかなる成功した支払いも、どの推定日までの成功支払いに計上されるため、スタンフォード大学は同じハードルに関連した複数の成功支払いを受けない。各成功支払プロトコルの期限は、以下の場合の早い者で終了する9年合意日の周年記念日と(2)統制権取引の変更。
次の表は、現金または現金等価物、または会社が会社の普通株公開取引株の形態でスタンフォード大学に支払う潜在的成功支払総額を適宜決定することをまとめている
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
発行時の初期株式価値の倍数 | 10x | | 20x | | 30x | | 40x | | 50x |
支払に必要な普通株1株当たり価格 | $ | 18.29 | | | $ | 36.58 | | | $ | 54.86 | | | $ | 73.15 | | | $ | 91.44 | |
累計支払成功 | $ | 10 | | | $ | 40 | | | $ | 90 | | | $ | 140 | | | $ | 200 | |
成功した支払いは延滞されますもし1株当たり公平な価値があれば会社の成功裏支払契約期間内に、契約に規定された推定値計量日に計算される普通株式は、上記の倍数以上である。推定計量日は、以下のイベントによってトリガされる1年制会社周年記念’最初の公募株とそれぞれ2年制会社周年記念’その後、支配権変更取引の完了及び成功裏の支払契約期間の最終日は、期限が原因でない限り
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
支配権変更取引を完了する。自分から2022年12月31日違います。会社普通株の1株当たり公正価値が支払いに必要な価格より低いため、成功裏な支払いが生じた。
2022年12月31日と2021年12月31日までのスタンフォード大学への支払い成功金の推定公正価値は $3.3百万そして$9.9それぞれ100万ドルですSuccess支払負債は、開始時およびその後の各報告期間の公正価値によって推定され、費用は、スタンフォード協力協定のサービス期間内に累積される。Success支払責任は$1.9百万そして$3.1それぞれ2022年12月31日と2021年12月31日まで。スタンフォード協力協定の支払い成功義務について、同社は収益を確認した共$1.2この年度までの百万2022年12月31日そして、成功した支払い費用$2.5百万ドルとドル0.6百万2021年12月31日および2020年12月31日までそれぞれ年度を終了した。
グラクソ·スミスクライン
2019年、同社はグラクソ·スミスクラインと潜在的なT細胞療法についてGSKプロトコルを締結し、異なる協力計画の下で、これらのT細胞療法は会社のプラットフォーム技術とT細胞受容体(TCR)あるいはキメラ抗原受容体(CARS)の細胞治療革新を応用する。GSKプロトコルは、2つの予備協力目標LYL 331およびLYL 132を定義し、GSKが2024年7月までに7つの追加目標を指名することを可能にし、GSKプロトコルの有効期間内に追加的な目標が指名されないことを示す。会社は指定された時点(“GSK選択点”)まで選定された目標ごとに研究·開発サービスを提供する予定であり、GSKは会社の許可(“許可選択権”)を得るために選択権を行使するかどうかを決定し、将来の開発と商業化を引き継ぐ2021年4月、グラクソ·スミスクラインはLYL 331(NY-ESO-1 TCRとc-Jun)でライセンス選択権を行使し、この計画の将来の開発と商業化の全責任を自費で負担した。LYL 132のIND申請は2022年1月に承認され,患者が治療されていないにもかかわらず,LYL 331のINDは米国食品·医薬品局に提出されていないグラクソ·スミスクラインは2022年12月24日にグラクソ·スミスクラインとの合意を終了したライルはこのようなプロジェクトの追加的な仕事を中断した。グラクソ·スミスクラインとの協定には未来の契約履行義務は存在しない。
会社は払い戻しできない前金を受け取りました#45.0グラクソ·スミスクライン協定によるとGSK協定についても、当社は2019年5月にGSKと株購入協定(“GSK株購入協定”)を締結し、これにより、当社は売却に同意しました30,253,189AAシリーズは優先株に変換可能で、価格は$です6.781株当たり、発行日よりも高く公正価値を見積もる$4.84一株ずつです。個々の価値の違いが$を招いています58.6追加は対価格とされ,GSKプロトコルの前払い対価格総額が$になる103.6百万ドルです。
グラクソ·スミスクライン協定は、グラクソ·スミスクラインが最初に同社に研究および開発サービスを提供するように依頼したので、ASC 606の範囲に属すると考えられ、これらのサービスは対価格と引き換えにその持続的な活動の成果である年末までに年度を終える2022年12月31日会社は,GSKプロトコルでの業績義務の達成に関する見積変化に関する収入調整を記録している。これらの推定数の変化は、双方が2022年6月にある研究活動を完成することに同意したことと、“グラクソ·スミスクライン協定”が2022年12月24日に発効したためであり、この2つの要素はいずれも比例累積業績測定基準の変化を招いた。このような調整は収入をドル増加させた83.6百万ドル純損失が減少しました83.6百万ドルで$が生まれました0.34当社の年度までの普通株1株当たりの基本および償却純損失は減少しました2022年12月31日.
同社は研究·開発サービスに関する収入を確認しており、この2つの初歩的な目標は$84.7百万, $10.5百万ドルとドル7.82022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル違います。2022年12月31日までの年度にライセンス収入を確認した。2022年12月31日と2021年12月31日まで、会社は収入を延期しましたゼロそして$84.7グラクソ·スミスクライン協定に関連した資金はそれぞれ100万ドルだった。2022年12月31日までに違います。ライセンス契約に関連する契約資産または契約負債
協定.協定
2020年6月,当社はPACTと承諾プロトコル(“PACTコミットメントプロトコル”)を締結し,固形腫瘍に対する次世代個性化抗癌T細胞療法を共同開発·試験した。会社はPactに払い戻しできない前金#ドルを支払った50.0協約約束協定を実行する時、100万ドルがあるだろう。2020年11月、双方は、双方間に生じる“協定承諾協定”に関する問題を解決するために、“協定承諾協定”下の研究·開発活動を一時停止することに同意し、双方の間に生じる“協定承諾協定”に関する問題を解決するために、いずれも開発計画の下でさらなる作業(製造開発を含む)を行う必要はなく、本来生じる可能性のある財政的義務(マイルストーン支払いを含む)も生じない。
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
2020年6月にPACTコミットメント協定を締結し,当社もPACTと株式購入プロトコル(“PACT SPA”)を締結し,これにより当社が購入した17,806,901PACT系C-1転換優先株の株,買い取り価格は$2.81一株ずつです。購入日までに、C-1シリーズ転換可能優先株の推定公正価値は#ドルである2.051株当たり、および優先株の買収日までの推定公正価値と買収価格$との差額13.6100万ドルは“協定承諾協定”の追加的な考慮要因とされ、研究·開発費として確認された。したがって、協定約束協定に関連した前払いの総費用は#ドルだ63.6100万ドルを研究開発費に計上しています残りの$36.4PACT系C−1転換可能優先株に関する100万株は他の投資に記録されている。2021年第4四半期、会社は余剰残高#ドルを全額減額36.4百万ドルです。注5を参照その他の投資協定投資減価に関するより多くの詳細を理解する。
2021年2月、当社は条約承諾協定の撤回と条約SPAの撤回を要求し、それに基づいて支払われた対価格を取り戻す仲裁要求を提出した。仲裁公聴会は2022年3月と4月に行われた。
2022年10月1日、当社はPACTと和解合意に達し、この合意により、懸案の法的紛争を解決することに同意した。和解協定については,双方はPACT C-1系列転換可能株を会社が入札して調停を解決するために,PACTが会社にPACTのD系列転換可能優先株を発行した株式購入プロトコルを締結した.PACTを発行したDシリーズは優先株を転換可能であり,投票権がなく,転換権が限られており,董事委員会の任権がなく,会社の所有権が約10%に増加している80パット社はすべて希釈した流通株の割合です。和解プロトコルはPact承諾プロトコルを中止し、固形腫瘍に対する次世代抗癌T細胞療法を共同開発することも含む。その会社は#ドルの収益を記録した2.92022年10月1日、和解協議の一部として受信したPACT Dシリーズ転換可能優先株の推定公正価値は100万ドルであった。PACT Dシリーズは優先株を決算日の見積公正価値で入金し,会社総合貸借対照表中の他の投資に計上することができる。
4. 現金等価物と有価証券
主要証券タイプ別に列化した現金等価物と有価証券の公正価値と剰余コストは以下の通り(単位:千):
| | | | | | | | | | | | | | | | | | | | | | | |
| 2022年12月31日 |
| 償却する
コスト | | 毛収入
実現していない
収益.収益 | | 毛収入
実現していない
損 | | 公正価値 |
貨幣市場基金 | $ | 67,970 | | | $ | — | | | $ | — | | | $ | 67,970 | |
アメリカ国債 | 277,056 | | | — | | | (5,257) | | | 271,799 | |
アメリカ政府機関証券 | 135,460 | | | 1 | | | (1,416) | | | 134,045 | |
会社債務証券 | 221,608 | | | 3 | | | (930) | | | 220,681 | |
現金等価物と有価証券総額 | $ | 702,094 | | | $ | 4 | | | $ | (7,603) | | | $ | 694,495 | |
| | | | | |
| 分類は: | 公正価値 |
現金等価物 | $ | 107,780 | |
有価証券 | 516,598 | |
非流通有価証券 | 70,117 | |
現金等価物と有価証券総額 | $ | 694,495 | |
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021年12月31日 |
| 償却する
コスト | | 毛収入
実現していない
収益.収益 | | 毛収入
実現していない
損 | | 公正価値 |
貨幣市場基金 | $ | 206,245 | | | $ | — | | | $ | — | | | $ | 206,245 | |
アメリカ国債 | 290,909 | | | 2 | | | (1,205) | | | 289,706 | |
アメリカ政府機関証券 | 93,864 | | | 2 | | | (240) | | | 93,626 | |
会社債務証券 | 285,338 | | | — | | | (182) | | | 285,156 | |
現金等価物と有価証券総額 | $ | 876,356 | | | $ | 4 | | | $ | (1,627) | | | $ | 874,733 | |
| | | | | |
| 分類は: | 公正価値 |
現金等価物 | $ | 270,236 | |
有価証券 | 320,966 | |
非流通有価証券 | 283,531 | |
現金等価物と有価証券総額 | $ | 874,733 | |
当社が保有する証券の公正価値未実現損失頭寸は12か月以下であるはい$287.8百万そして$602.9それぞれ2022年12月31日と2021年12月31日まで。当社が保有している未実現損失が12か月を超える証券の公正価値は$278.7百万そしてゼロそれぞれ2022年と2021年12月31日まで。2022年12月31日と2021年12月31日までのすべての有価証券の満期日は2年.またはそれ以下で、使用可能であり、販売可能に分類される。当社はこれらの証券を売却するつもりはなく、その償却コストを回収した上でこれらの証券を販売する必要があるとも思わない。当社は、上記投資が2022年12月31日および2021年12月31日までの年度の信用リスクに大きな変化はないと認定している。したがって、信用損失の準備は確認されなかった。実現した損益総額は極小の2022年12月31日と2021年12月31日までの年度であるため、累積された他の理解から再分類された金額VE損失は2022年12月31日までと2021年12月31日までの年度も極小のそれは.付記6を参照公正価値計量現金等価物および有価証券に関するより多くの情報が理解される。
5. その他の投資
会社は時々少数株式戦略投資を行っています。2022年12月31日と2021年12月31日までの会社の非上場企業への戦略投資の帳簿価値総額は$44.9百万ドルとドル47.0百万それぞれ,である.これらの投資は、初期コストから減値(あり)および同一発行者が同じまたは類似した投資の順序取引に見られる価格変化による正負の変化を減算して計測される
2022年財務諸表を作成する際に、会社は潜在的な減値指標を定性的に評価し、会社の帳簿金額が#ドルの他の投資の指標を決定した5.0百万ドルです。単一の事件や要因はないが,当社は対象会社の来年度の運営キャッシュフロー需要,当該等の需要に資金を提供する流動資産残高,および対象会社が減値指標として資金を調達できないことを考慮している。これらの指標のため、当社は投資の推定値を評価し、公正な価値が取るに足らないことを決定し、減値は一時的ではない。その会社は1ドルを記録しました5.0年度までの減価費用100万元を投資する2022年12月31日総合経営及び全面損益表の他の投資減額内に記録し、総合貸借対照表内の他の投資内の投資残高減値内に記録する。本年度までに他の投資減価はありません2022年12月31日.
2022年10月、当社はPACTとの和解合意に基づいて無投票権優先株を受け取った(付記3参照許可、協力、成功支払協定)である。同社は合意が十分なリスク株を持っていないため、この合意がVIEであると判断した。当社は、当社の持続的な権利と責任を含めて、PACTの主な受益者であるかどうかを評価し、当社がPACTの活動を指導する権利があるかどうかを評価する。同社がPACTに唯一参加しているのはそのDシリーズ転換可能優先株投資であり,これらの投資には投票権がなく,転換権が限られており,取締役を任命する権利もない。以上のことから,当社は主な受益者ではなく,PACTを合併せず,PACTの経済表現に最も大きな影響を与える活動を指導する権限がないためである。♪the the the
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
会社はできないPACTと代替案でのPACT優先株への投資を評価したことを示した。同社はPACT優先株への投資を確認し,公正価値を#ドルと推定している2.92022年10月1日、このお金は会社合併貸借対照表の他の投資に計上される。同社がPACTによる最大損失は,PACT優先株に投資する帳簿価値に限られている。
2021年の財務諸表を作成する際に、同社は潜在的な減値指標を定性的に評価し、その#ドルの指標を決定した36.4合意に百万ドルを投資するC-1シリーズ転換可能優先株. 単一のイベントや要因はないが,会社はPACTの来年度の運営キャッシュフロー需要と,これらの需要に資金を提供する流動資産残高,およびPACTでは資金を調達できないことを減値指標としている。これらの指標のため,当社は2021年12月31日までのPACT投資推定値を評価し,公正価値がわずかであり,減値は一時的ではないことを決定した。その会社は1ドルを記録しました36.4合意は2021年第4四半期の減価支出に投資し、総合経営および全面赤字表内の他の投資の減額、および総合貸借対照表内の他の投資内投資残高の減値に計上する。PACTへの投資を除いて、2021年12月31日までの年間で、他の投資は減損はなかった。
2020年11月に会社は戦略的株式投資を行いました13.0戦略投資では、少数株式を代表するプライベート持株会社OutPace Bio,Inc.(“OutPace”)が100万ドルの株式を保有している。OutPaceはタンパク質や細胞技術プラットフォームの研究·開発に従事し,優先株を発行することでその活動に資金を提供する。当社は、ExpaceはVIEであり、リスク持分所有者は1つのグループとして、持株権の特徴が乏しいと認定した。当社には多数の投票権がなく、OutPace取締役会には代表権もなく、その実体の活動を指導する権限もないため、主な受益者ではありませんカトリックの霊。2022年12月31日と2021年12月31日までのExPaceへの会社の投資の帳簿価値は$13.0100万ドル、このお金は他の投資に記録されている。
6. 公正価値計量
以下の表は、会社の金融資産と負債の公正価値を示し、これらの資産と負債は、公正価値で公正価値に応じて三級公正価値システムに基づいて日常的な計量を行う(千計)
| | | | | | | | | | | | | | | | | | | | | | | |
| 2022年12月31日 |
| レベル1 | | レベル2 | | レベル3 | | 合計する |
金融資産: | | | | | | | |
貨幣市場基金 | $ | 67,970 | | | $ | — | | | $ | — | | | $ | 67,970 | |
アメリカ国債 | — | | | 271,799 | | | — | | | 271,799 | |
アメリカ政府機関証券 | — | | | 134,045 | | | — | | | 134,045 | |
会社債務証券 | — | | | 220,681 | | | — | | | 220,681 | |
金融資産総額 | $ | 67,970 | | | $ | 626,525 | | | $ | — | | | $ | 694,495 | |
財務負債: | | | | | | | |
支払成功負債 | $ | — | | | $ | — | | | $ | 4,356 | | | $ | 4,356 | |
財務負債総額 | $ | — | | | $ | — | | | $ | 4,356 | | | $ | 4,356 | |
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021年12月31日 |
| レベル1 | | レベル2 | | レベル3 | | 合計する |
金融資産: | | | | | | | |
貨幣市場基金 | $ | 206,245 | | | $ | — | | | $ | — | | | $ | 206,245 | |
アメリカ国債 | — | | | 289,706 | | | — | | | 289,706 | |
アメリカ政府機関証券 | — | | | 93,626 | | | — | | | 93,626 | |
会社債務証券 | — | | | 285,156 | | | — | | | 285,156 | |
| 権証投資 | — | | | — | | | 1,067 | | | 1,067 | |
金融資産総額 | $ | 206,245 | | | $ | 668,488 | | | $ | 1,067 | | | $ | 875,800 | |
財務負債: | | | | | | | |
支払成功負債 | $ | — | | | $ | — | | | $ | 9,486 | | | $ | 9,486 | |
財務負債総額 | $ | — | | | $ | — | | | $ | 9,486 | | | $ | 9,486 | |
当社は、活発な市場における同じ資産または負債の見積もりに基づいて、通貨市場基金の公正価値を計量する。二級取引可能証券はアメリカ国債、アメリカ政府機関証券と会社債務証券を含む。同社の二級証券は第三者定価源を用いて評価を行っている。定価サービスは業界標準の評価モデルを採用した。使用される投入は、同じまたは同様の証券のリアルタイム取引データに基づく市場価格と、観察可能な市場データから、または観察可能な市場データによって確認される他の重要な投入とを含む。
レベル3金融商品には、権証投資と負債の成功裏の支払いが含まれています。2022年12月31日までの年度内に、当社の他の投資の減値とともに、関連株式証投資の公正価値は2022年12月31日に無視できるように決定された。会社は権利証投資の公正価値を1ドルから1ドルに引き下げた1.12021年12月31日までゼロ2022年12月31日まで。注5を参照その他の投資他の投資減価に関するより多くの詳細を理解する。会社の3級金融商品は、株式権証投資を評価するブラック·スコアーズモデルと、負債の支払い成功をモンテカルロシミュレーションするモデルを含む推定モデルを用いて推定されているSuccess Payment負債の見積り公正価値を決定するために,同社はモンテカルロシミュレーション手法を用いて,いくつかのキー変数および株価行動を制御する過程の経験知識に基づいて株価の将来動向をモデリングしている.以下の変数は、成功支払負債の推定公正価値に組み込まれている:会社の公正価値’予想変動率、無リスク金利、および推定計量日の推定数および時間は、支払いをトリガすることができる。予想変動率の計算は、予想期限の仮定に合致した一定期間の上場企業株の履歴変動性に類似した既存情報に基づいて推定される。
フレッド?ハッジの支払い成功負債の推定公正価値を計算する際には、以下の仮定が盛り込まれていた
| | | | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 | | |
普通株主公正価値 | $ | 3.47 | | $ | 7.74 | | |
無リスク金利 | 3.58% - 4.65% | | 0.19% - 1.88% | | |
予想変動率 | 80.0 | % | | 75.0 | % | | |
予想期限(年単位) | 0.46 - 4.97 | | 0.46 - 5.97 | | |
スタンフォードの支払成功負債の推定公正価値を計算する際には、以下の仮定が盛り込まれている
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
普通株主公正価値 | $ | 3.47 | | $ | 7.74 |
無リスク金利 | 3.58% - 4.65% | | 0.19% - 1.88% |
予想変動率 | 80.0 | % | | 75.0 | % |
予想期限(年単位) | 0.46 - 6.75 | | 0.46 - 7.75 |
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
当社は推定と仮定を利用して、推定された支払成功負債と関連費用を決定します。会社の普通株式推定値の小さな変化は、成功した支払い負債と関連費用の推定公正価値に相対的に大きな変化をもたらす可能性がある。
以下の表は、同社の第3レベル金融資産と負債の公正価値変化(千計)について概説する
| | | | | | | | | | | |
| 株式権証
投資する | | 支払いに成功する
負債.負債 |
2020年12月31日残高 | $ | 1,323 | | | $ | 5,773 | |
価値変動を公平に承諾する(1) | (256) | | | 3,713 | |
2021年12月31日の残高 | 1,067 | | | 9,486 | |
価値変動を公平に承諾する(1) | (1,067) | | | (5,130) | |
2022年12月31日の残高 | $ | — | | | $ | 4,356 | |
__________
(1)持株権証投資に関する公正価値変動記録はその他の収入(費用)純額、成功した支払負債に関する公正価値の変動は研究開発費.
2022年10月、当社はPACTとの和解合意に基づきDシリーズ無投票権優先株を受け取りました(付記3参照許可、協力、成功支払協定)である。同社は、PACTの公正価値は会社のPACT Dシリーズ優先株総清算優先株の一部にすぎないことを確定した。同社は,PACT優先株に投資する公正価値はPACT業務の公正価値とほぼ同じであることを決定しており,2022年10月1日現在,当社はPACT優先株Dシリーズに投資する唯一の方であり,PACT発行の最高級株式種別である。協定の公正な価値は#ドルと推定される2.92022年10月1日まで、コスト法を使用する。この方法では、1つの資産の公正価値は、資産を別の同様の効用の資産で再構成または置換するコストによって測定される。合意の公正価値は、合意無形資産に関連する些細な公正価値の推定を含む、重大な観察不可能な投入を使用することによって推定される。そこで,当社は2022年10月1日のPACT優先株の公正価値計量を公正価値レベルでの第3レベルに分類した。
7. 財産と設備、純額
財産と設備の純額は以下の部分からなる(千計)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
賃借権改善 | $ | 116,930 | | | $ | 95,001 | |
実験室装置 | 31,982 | | | 27,039 | |
コンピュータ装置及びソフトウェア | 1,630 | | | 1,610 | |
家具と固定装置 | 717 | | | 384 | |
建設中の工事 | 4,148 | | | 10,577 | |
原価で計算した財産と設備 | 155,407 | | | 134,611 | |
減算:減価償却累計と償却 | (32,384) | | | (14,513) | |
財産と設備の合計 | $ | 123,023 | | | $ | 120,098 | |
減価償却と償却費用は$18.0百万, $13.5百万ドルとドル4.22022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
8. 負債その他流動負債を計上しなければならない
負債およびその他の流動負債には、以下の内容が含まれる(千で計算)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 補償と関連福祉を計算しなければならない | $ | 15,447 | | | $ | 17,296 | |
| 課税財産と設備 | 732 | | | 4,055 | |
| 法律性を計算すべきである | 930 | | | 2,619 | |
| 研究と開発費用を計算すべきである | 4,760 | | | 2,449 | |
| 流動賃貸負債 | 4,534 | | | 1,169 | |
| 他にも | 2,352 | | | 1,469 | |
| 負債およびその他の流動負債総額を計算しなければならない | $ | 28,755 | | | $ | 29,057 | |
9. 賃貸借証書
同社のレンタル組合には、カリフォルニア州サンフランシスコ南部とワシントン州シアトルとボセルにある実験室、オフィス、製造施設の運営リースが含まれており、契約期間は2028年12月から2031年3月までの間に満了します。最低賃貸料のほか、賃貸契約には不動産税、保険、公共地域維持費、その他の実行費用が必要です。これらの追加料金は可変レンタル料金と考えられ、料金が発生している間に確認されます
2018年に当社は経営リース契約を締結しました34,000ワシントン州シアトルにあるオフィスと実験室空間は平方フィートで、初期レンタル期間は2028年12月に満期になります。その会社は所有している二つ5年制延長レンタルの選択ですが、合理的な保証はありません。
2000年に当社は経営賃貸契約を締結した34,000カリフォルニア州サンフランシスコ南部にある一平方フィートのオフィスと実験室空間です。2020年12月、会社は早期解約権を行使し、契約中の余剰対価格を再計量し、収益#ドルを獲得する2.9百万ドル、他の営業収入で確認し、純額。レンタル終了は2021年10月に施行され、収益#ドルが発生します0.32021年12月31日までの1年間に、他の営業収入で確認された純額は100万ポンド。また、同社は#ドルの損失を確認した0.6レンタル改善によりレンタルを終了した百万ドルは、カリフォルニア州サンフランシスコ南部にある新会社本社に移転できず、2021年12月31日現在の年間純営業収入で確認されている
2019年、当社は締結しました二つ合併後の運営リース契約約73,000敷地は2平方フィートで、ワシントン州ボゼルにある細胞治療製造施設を開発し、初歩的な契約は2030年5月に満期になる。その会社は所有している二つ90-賃貸契約の月オプションを延長することは、合理的に保証されていません。
2000年に当社は経営賃貸契約を締結した108,000カリフォルニア州サンフランシスコ南部にあるオフィスと実験室空間は平方フィートです。最初のレンタル期間は2031年1月に満了し、別のレンタル期間の延長を選択することができます10ここ数年、これは合理的に保証されていない。2021年1月、会社は賃貸契約期間を修正し、レンタル期間を2031年3月に延長し、使用権資産と賃貸負債を#ドル増加させた4.2百万ドルです
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
次の表は、予想される賃貸報酬(千単位)を含む、2022年12月31日までの会社の将来の最低経営賃貸約束をまとめています
| | | | | | | | |
12月31日までの年度: | | |
| 2023 | | $ | 10,101 | |
| 2024 | | 11,347 | |
| 2025 | | 11,859 | |
| 2026 | | 12,209 | |
| 2027 | | 12,569 | |
その後… | | 35,525 | |
未割引賃貸支払総額 | | 93,610 | |
差し引く:推定利息 | | (25,908) | |
リース負債総額を経営する | | $ | 67,702 | |
| | |
2022年12月31日までの記事: | | |
| 賃貸負債の短期部分(負債その他流動負債に計上する) | | $ | 4,534 | |
| 非流動経営賃貸負債 | | 63,168 | |
| 合計する | | $ | 67,702 | |
すべての経営リースの経営リースコストは $9.3百万、$9.4百万ドルとドル11.22022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。経営リースコストと短期賃貸の総承諾額は極小の2022年,2022年,2021年,2020年12月31日まで年度を終了する。レンタルを運営する可変レンタルコストは#ドルです5.1百万、$4.1百万ドルとドル2.12022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。運営リースの加重平均残存期間は7.8そして8.8年はそれぞれ2022年12月31日と2021年12月31日である。運営リースの加重平均割引率は8.5%和8.42022年と2021年12月31日までの割合。
2021年5月に当社は分譲契約を締結し、これにより、当社は分譲契約に同意しました11,000同社は現在カリフォルニア州サンフランシスコ南部で1平方フィートの空間をレンタルしている。転貸は経営賃貸に分類され、2031年3月に満期になる。当社は今回の転貸収入が#ドルであることを確認しました0.8百万ドルとドル0.42022年12月31日までと2021年12月31日までの年度はそれぞれ100万ドル。
2021年9月に当社は関連側Sonoma BioTreateutics,Inc.(“Sonoma”)と分譲契約を締結し,これにより,当社は分譲約に同意した18,000同社は現在カリフォルニア州サンフランシスコ南部で1平方フィートの空間をレンタルしている。付記17を参照関係者取引それは.転貸の一部として、当社は2021年9月に1ドルを受け取りました4.6百万借主は供給を改善し、分譲期間内に確認する。転貸は経営賃貸に分類され、2031年3月に満期になる。会社はソノマ転貸収入が#ドルであることを確認した1.9百万ドルとドル0.62022年12月31日までと2021年12月31日までの年度はそれぞれ100万ドル。
会社の転貸収入は他の営業収入で確認し、純額は総合経営報告書と全面赤字で確認した。
10. 転換可能優先株
2020年3月に同社は42,905,042その系列株C転換優先株、価格は$11.491株当たり収益$492.5100万ドル発行コストを差し引くと$0.5百万ドルです
2020年3月に会社が買い戻し546,806関連側からそのA系列を購入すると転換可能な優先株であり,買い取り価格はドルである4.2百万ドルです。
初公募が終わった後、194,474,431優先株の株式を転換し、同数の普通株に変換することができる。2022年12月31日までに違います。転換可能な優先株が発行された。
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
11. 株主権益
優先株
当社は発行を許可されている10.0額面百万株優先株$0.0001一株ずつです。2022年と2021年12月31日までに違います。優先株の株が発行された。
普通株
当社は発行を許可されている500.0百万株普通株、額面は$0.0001一株ずつです。2022年12月31日と2021年12月31日までにe 249,567,343株と242,738,350当社は普通株式の株式を発行しており、含まれていませんゼロそして2,600,002それぞれ,帰属要求によって制限された発行されたRSAの株式である.当時発行された任意の優先株に適用可能な優先株の優遇に基づいて、会社取締役会が適宜配当金の発行を決定し、かつ会社取締役会が決定した時間及び金額で配当金を発行することしかできない場合、会社普通株の保有者は合法的に利用可能な資金から配当を得る権利がある。
2020年3月に会社が買い戻し2,032,166関連先から得られた普通株の買い取り価格は$11.8百万.
2022年8月4日、当社はゴールドマン·サックス有限責任会社(“ゴールドマン·サックス”)と米銀行証券会社(“米国銀行”、およびゴールドマン·サックスとともに“代理店”と呼ぶ)と市場発売計画(“株式分配協定”)について株式分配協定を締結した。株式割当契約の条項によると、当社は時々代理人を介して当社の普通株式を発売·売却することができ、総発売金額は最高$に達する200.0百万株(“配給株”)。配給株の売却(あれば)は、売却時のナスダック上の現在の市場価格に応じて行われるか、または代理人と合意した他の合意に従って、法律により許可されたものは、1933年証券法(改正証券法)第415条に規定された“市場発行”とみなされる方法で行われる。当社は以下の代理店に手数料を支払います3.0持分割当契約により販売された配給株式の総収益の%を売却し、若干の支出を代理人に精算する。当社とその代理人はいかなる株式も売却する責任はありません。当社はこれまで株式割当契約に基づいて何の売却もしていません。
12. 株に基づく報酬
2021年株式インセンティブ計画
2021年6月、当社は自社IPOに関する引受協定の日から発効する“2021年株式インセンティブ計画”(以下、“2021年計画”と略す)を採択した26,662,087株式には、2018年株式インセンティブ計画(“2018計画”)によって付与された任意の奨励すべき株式に加えて、2021年計画の発効当日又は後に、行使又は受け渡し前に終了又は満了した場合には、報酬が現金で決済されることにより発行されず、帰属できなかったために没収されたり、源泉徴収義務又は購入又は行使価格を満たしていないために再買収又は差し押さえられたりすることはない(又は未発行)。また,2021年計画によると発行保留の株式数は毎年1月1日に自動的に増加し,期限は10年2022年1月1日から2031年1月1日まで続き、金額は(1)に等しい5前年12月31日までに発行された会社普通株式総数の割合、又は(2)前年12月31日までに会社取締役会が決定したより少ない数の普通株式である。2022年1月1日、会社は追加的に保留しました12,266,9172021年計画に基づいて発行される普通株式、代表52021年12月31日現在の発行済み普通株式総数の割合を占める。2021計画によると、会社は奨励株式オプション、非法定株式オプション、RSA、RSU、株式付加価値権、業績奨励、その他の株式ベースの奨励を付与することができる。株式奨励の条項は、帰属要求を含み、会社取締役会又は会社取締役会が許可する委員会によって決定され、2021年計画の規定に適合する。2021年計画により付与されたいかなる株式オプションの期限を超えてはならない10年それは.一般的に会社から与えられた報酬は4年しかし、異なる帰属条項を付与することができる。2021年計画を採択するとともに、当社は2018年計画における新株権奨励に関する規定を終了した。
2022年12月31日まで, 20,264,5232021年計画によると、株は未来に発行できる。
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
2021年従業員株購入計画
2021年6月、会社は2021年従業員株購入計画(“2021年従業員株購入計画”)を採択し、同社の初公募株に関する引受協定の調印直前に発効し、予備準備金は2,470,000株式です。2021年にESPPは条件を満たす従業員が賃金減額で会社の普通株を割引価格で購入することを許可し、最高で15彼らの収入の%は、計画によって制限されている。会社の取締役会が別途決定しない限り、従業員は以下の価格で株を購入することができます85会社普通株の発行初日または購入日の公正時価の低い者の割合。2021年の特別引出権留保により発行される会社の普通株式数は毎年1月1日に自動的に増加し、期間は10年2022年1月1日から2031年1月1日まで、(1)の比較的小さい者を基準とする1前年12月31日会社発行普通株式総数の割合;(2)4,940,000株式;しかし、会社の取締役会は、より少ない株式数を提供するために行動することができる。2022年1月1日、会社は追加的に保留しました2,453,3832021年ESPP発行による普通株式代表12021年12月31日現在の発行済み普通株式総数の割合を占める。会社が指定できる製品の持続時間は超えません273ヶ月で、各製品で短い購入期間を指定することができます。2021年のESPPによると475,363そしてゼロ2022年12月31日と2021年12月31日までの年度発行済み株
自分から2022年12月31日, 4,448,0202021年ESPPによると、株は未来に発行できる。
2018年株式インセンティブ計画
2018年、会社は2018年度計画を策定し、奨励的株式オプション、非法定株式オプション、RSA、RSU、株式付加価値権、その他の株式ベースの奨励を付与することを規定した。株式奨励の条項は、帰属要求を含み、取締役会又は会社取締役会が許可する委員会によって決定され、2018年計画の規定に適合する。2018年計画により付与されたいかなる株式オプションの期限を超えてはならない10年それは.一般的に会社から与えられた報酬は4年しかし、異なる帰属条項が付与されるかもしれない。2021年計画の条項によると、2018年計画に基づいて最初に付与された未償還オプション制限を受けた任意の株式は、何らかの理由で終了、満期または失効し、その所有者に株式を交付していない場合は、2021年計画で付与された奨励に基づいて発行することができる。そして当を受ける違います。2018年計画によると、株式は将来発行することができ、この計画は当該計画に基づいて付与された未償還持分奨励を継続的に管理する。
株に基づく報酬費用
総合経営報告書と全面損失表に分類された株式による補償費用は以下のとおりである(千で計算)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
研究開発 | $ | 16,721 | | | $ | 15,328 | | | $ | 14,977 | |
一般と行政 | 65,203 | | | 46,873 | | | 18,284 | |
株式に基づく報酬総支出 | $ | 81,924 | | | $ | 62,201 | | | $ | 33,261 | |
2021年12月31日現在の年度の株式ベース報酬支出には、会社初公募株に関する加速奨励の影響が含まれている$2.6百万ドルです
株式オプションとRSA修正
2022年12月、当社の元最高経営責任者(“CEO”)が辞任した。退職協定の条項によると、この元最高経営責任者は、2024年6月15日までに会社にコンサルティングサービスを提供することができ、その日までに既得オプションは引き続き行使可能であり、無帰属オプションは継続して付与される。同社は、コンサルティングサービスを提供する義務が実質的ではないため、彼らのサービスレベルが低下したため、彼らの選択が修正されたと結論している。彼らの残りのサービス期間は非実質的であると決定されたので、増加したすべての費用は#ドルである3.72022年第4四半期に修正に関する100万ドルを確認した。
2021年には、元最高経営責任者が2021年第4四半期に執行主席を辞任したサービスレベルの低下と、ある奨励金の退職後の行使期限が増加したため、当社は改正を行った。2020年には元最高経営責任者のサービス水準が低下したため、会社は改正された
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
特定の個人の付与スケジュールを変更し、特定の奨励金の終了後の行使期間を追加する。2021年と2020年の改正は既存の裁決にも影響を与え、未帰属裁決にも影響を与えている。既存の報酬に関連する費用は、修正中に確認され、非既存の報酬に関連する費用は、オプションまたはRSAの残りの使用期間内に確認される
次の表は,2022年12月31日,2021年と2020年12月31日,2022年,2021年,2020年に改正が発生した年と改正に関する増量在庫報酬費用総額(千単位)を示している
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 | | 2020 |
前CEO-オプション(1) | $ | 3,741 | | | $ | — | | | $ | — | |
前CEO-オプション(2) | — | | | 21,948 | | | 15,052 | |
その他-オプション(3) | — | | | 1,019 | | | 4,717 | |
前CEO-RSA(4) | — | | | 10,908 | | | 20,799 | |
その他-RSA(5) | — | | | — | | | 9,029 | |
合計する | $ | 3,741 | | | $ | 33,875 | | | $ | 49,597 | |
__________
(1)2022年前の最高経営責任者オプションの改正は、2022年12月に辞任したエリザベス·ホーマンスを対象とした
(2)2021年と2020年までのCEOオプションの修正は、2021年10月にCEOを辞任し、現在のライル取締役会長を務めたリチャード·クラウス博士に対するものだ。
(3)他の代替案の改正は2021年に1人の個人代表、2020年には4人の個人が代表される。
(4)2021年と2020年に前CEOであるRSAの修正はRichard Klausner博士に対するもので、2021年10月にCEOを辞任し、現在はLyell取締役会長となっている。
(5)他の地域協定の改正は2020年に3人の個人によって代表されるだろう。
2022年12月31日現在、未確認の未帰属報酬に関する株式報酬総コストは#ドル98.5残りの重み付き平均期間内に確認する予定である2.86何年もです。
制限株式賞
以下に会社RSA活動の概要を示す
| | | | | | | | | | | |
| 株式数 | | 加重平均
授与日の価値
1株当たり |
2021年12月31日現在の未帰属株式 | 2,600,002 | | | $ | 0.0001 | |
既得 | (2,600,002) | | | $ | 0.0001 | |
2022年12月31日現在の未帰属株式 | — | | | $ | — | |
2022年12月31日までの年間に帰属するRSAの公正価値 2021 and 2020 was $15.2百万人$57.1百万ドルとドル29.4それぞれ100万ドルです
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
限定株単位
同社のRSU活動の概要は以下の通り
| | | | | | | | | | | |
| 株式数 | | 加重平均
授与日の価値
1株当たり |
2021年12月31日までの無許可RSU | 0 | | $ | — | |
| 承認済みRSU | 1,330,962 | | | $ | 5.98 | |
| 帰属のRSU | (223,200) | | | $ | 5.98 | |
| 没収またはキャンセルされたRSU | (235,685) | | | $ | 5.98 | |
2022年12月31日までの無許可RSU | 872,077 | | | $ | 5.98 | |
2022年12月31日までの年度内帰属のRSUの公正価値は$として1.5百万. 違います。2021年12月31日まで年度内に帰属する買い戻し先 and 2020.
株式オプション
同社の株式オプション活動の概要は以下の通り
| | | | | | | | | | | | | | | | | | | | | | | |
| 量
在庫品
オプション | | 重み付けの- 平均値 トレーニングをする 値段 1株当たり | | 重み付けの-
平均値
残り
契約書
命
(単位:年) | | 骨材
固有の
価値(千) |
2021年12月31日現在の未返済オプション | 41,775,179 | | | $ | 5.05 | | | 7.84 | | $ | 142,076 | |
授与する | 18,399,530 | | | $ | 4.89 | | | | | |
鍛えられた | (3,600,478) | | | $ | 2.66 | | | | | |
キャンセルまたは没収 | (2,725,186) | | | $ | 6.28 | | | | | |
2022年12月31日までの未返済オプション | 53,849,045 | | | $ | 5.09 | | | 7.84 | | $ | 24,887 | |
2022年12月31日までに行使可能なオプション | 28,115,416 | | | $ | 4.43 | | | 6.78 | | $ | 23,462 | |
従業員、取締役、コンサルタントに付与された株式オプションの公正価値は、付与日にブラック·スコアーズオプション定価モデルを用いて推定され、以下の加重平均仮定を採用する
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 無リスク金利 | 2.93 | % | | 0.80 | % | | 0.79 | % |
| 予想変動率 | 87.3 | % | | 78.7 | % | | 75.0 | % |
| 予想期限(年単位) | 6.03 | | 6.10 | | 6.11 |
| 期待配当収益率 | 0 | % | | 0 | % | | 0 | % |
2022年,2022年,2021年,2020年12月31日終了年度付与オプションの加重平均付与日公正価値はい$です3.60一人一人がシェア、$6.591株あたり$3.36一人一人が別々に共有する。2022年,2021年および2020年12月31日までに年度内に行使されるオプションの内在的価値は13.9百万人$16.1百万ドルとドル0.3それぞれ100万ドルです
13. 所得税
同社はすべての列報期間の税引き前営業損失を報告した。当社の純損失は完全にアメリカ国内から来ています。当社は添付されている総合財務諸表に該当する税金項目の純営業損失繰越のいかなる利益も反映していません。繰延税金資産の現金化の不確定性のため、当社はすでにその繰延税金資産のために全額推定準備金を確立した。
2022年12月31日と2021年12月31日現在、会社の米国連邦純営業損失(NOL)の繰越約は$383.3百万そして$271.0それぞれ100万ドルで、将来の課税収入を減らすことができ、期限が切れない。同社はアメリカのNOL繰り越しも持っています$372.5百万それは 2038. その会社のアメリカ連邦と州での税収控除総額は$15.8百万そして$9.82022年と2021年12月31日までに
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
それぞれ未来の納税義務を相殺するために使用される。連邦NOL繰越期間は無期限であり、税収控除は#年から満期になる2039それは.重大株主の所有権権益に何らかの累積的な変化が生じた場合、帰属繰越は年次制限を受ける可能性がある。これは、将来の課税収入または納税義務を相殺するために毎年使用できる税金属性の数を制限することができるかもしれない。
米国連邦法定税率を用いて計算された所得税と業務に反映される所得税の台帳は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
連邦法定税種 | 21.00 | % | | 21.00 | % | | 21.00 | % |
連邦福祉を差し引いた州税 | 5.10 | | | 6.39 | | | 4.71 | |
推定免税額 | (28.89) | | | (22.43) | | | (24.60) | |
協力収入 | 6.72 | | | — | | | — | |
株に基づく報酬 | (6.11) | | | (5.92) | | | (1.77) | |
税金控除 | 2.33 | | | 0.99 | | | 0.95 | |
他にも | (0.15) | | | (0.03) | | | (0.29) | |
有効所得税率 | 0.00 | % | | 0.00 | % | | 0.00 | % |
同社の繰延税項目の純資産の主な構成要素は以下の通り(千計)
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 |
繰延税金資産: | | | |
純営業損失が繰り越す | $ | 106,530 | | | $ | 70,855 | |
税金の繰り越しを免除する | 14,317 | | | 8,338 | |
負債と免税額を計算しなければならない | 3,692 | | | 3,879 | |
収入を繰り越す | 904 | | | 8,224 | |
償却する | 4,585 | | | 15,961 | |
| 資本化研究と開発 | 26,199 | | | — | |
投資ベースの差 | 14,235 | | | 13,587 | |
リース責任 | 17,656 | | | 18,429 | |
株に基づく報酬 | 7,471 | | | 2,872 | |
他にも | 1,171 | | | 2,613 | |
繰延税項目総資産 | 196,760 | | | 144,758 | |
推定免税額 | (180,132) | | | (127,226) | |
繰延税金資産は,推定準備後の純額を差し引く | 16,628 | | | 17,532 | |
繰延税金負債: | | | |
経営的リース使用権資産 | (11,277) | | | (12,647) | |
財産と設備 | (5,351) | | | (4,885) | |
繰延税金負債 | (16,628) | | | (17,532) | |
繰延税項目純資産 | $ | — | | | $ | — | |
減税·雇用法案には、2022年1月1日以降に発生する第174条のコストの資本化を要求する条項が含まれている。第174項の費用とは、製品、プロセス、配合、発明、コンピュータソフトウェア又は技術の開発又は改善に関連する研究及び開発費用をいう。この規定は、第174条の費用に対する処理方式を変更し、これらの支出を直ちに差し引くことを許可するのではなく、5年以内に国内の研究·開発のため、15年以内に外国の研究·開発のための資本化と償却を行わなければならない。当社はこの準備金の影響を計上しており、これにより繰延税金資産は約$26.2百万時点で2022年12月31日。
同社はその米国繰延税項目純資産に対して全額推定手当を維持している。評価免除額の評価が必要かどうかについては,結論を出す際に積極的かつ消極的な証拠の評価を考慮した
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
繰延税金資産がもっと現金化される可能性があるかどうか。この評価を行う際には,客観的に確認できる証拠を大きく重視している.その評価では、同社は近年の累積損失と最近の予測損失を重大なマイナス証拠としている。ASC 740内で識別された4つの収入源のレビューに基づいて、所得税会計(“ASC 740”)、会社は、負の証拠が正の証拠を超えていると認定し、米国繰延税金純資産の全額推定値を維持する。評価準備は主にアメリカ繰延税金項目の資産純額に関連し、純営業損失の繰越、研究開発税収の繰越免除、研究開発費用の資本化と償却は税を計算するが、公認会計原則と株式給与によって差し引かれる。
当社は、その繰延税金資産の現金化能力を評価し続け、ASC 740の要求に応じて推定支出を調整する。見積もり免税額の増加は$52.9百万そして$56.12022年12月31日までと2021年12月31日までの年度はそれぞれ100万ドル。
当社がその不確定税務状況を評価する根拠は,その技術的利点や関係所得税機関の審査を経てすべての事実を知り,よりその状況を維持する可能性があるかどうかなどを決定することである。当社は、その総合財務諸表及び納税表に記録されている不確定税務状況を計測する際に判断を採用しています。2022年と2021年12月31日までに 違います。連結財務諸表に記録されている罰金または利息を計算しなければならない。
赤字繰越のあるすべての納税年度には、当社は米国連邦や地方所得税当局の審査を受けるのが一般的だ。当社は現在、いかなる納税年度にも米国国税局またはその他の管轄区の審査を受けていません。
以下のタブLeは、同社が確認していない税収割引の変化(千計)をまとめた
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 |
| 期初残高 | $ | 796 | | | $ | — | |
| 本年度に係る納税状況の増加に基づく | — | | | 396 | |
| 前年の納税状況に応じて調整する | (396) | | | 400 | |
| 期末残高 | $ | 400 | | | $ | 796 | |
14. 1株当たり純損失
普通株株主に帰属する1株当たり基本と希釈後の純損失の計算方法は,普通株株主に帰属する純損失を当期発行普通株の加重平均数で割ったものであり,普通株等価物は考慮しない。当社の潜在的希薄化株式は、優先株、未帰属RSA、未帰属RSU、および普通株購入のオプションを含み、普通株等価物とみなされ、その影響が希薄化効果を有する場合にのみ、1株当たりの純損失の計算に含まれる。普通株、優先株、未帰属RSA、未帰属RSUの選択権によって制限された株式は、その逆償却作用により、すべての列報期間の希釈1株当たり純損失を計算する際に考慮範囲に含まれない。
15. 従業員福祉計画
2019年1月、会社は全従業員をカバーする401(K)退職·貯蓄計画(略称401(K)計画)を採択した。401(K)計画は、従業員が税引前および税引後納付を可能にし、米国国税局が規定した最高許容額に達することができる。2022年から、会社は従業員の納付金額に応じて401(K)支払いにマッチする固定納付貯蓄計画を開始したが、いくつかの制限を受けている。会社は以下の参加者を代表して401(K)計画に相応の貢献をした$1.0百万2022年12月31日までの年度とありません2021年12月31日と2020年12月31日までの年度。
16. 引受金とその他の事項
協力と許可協定
当社は、付記3で決定された合意を含むいくつかの協力およびライセンス契約を締結しています許可、協力、成功支払協定第三者との協力には、特定の開発、製造、商業化努力に資金を提供することが含まれており、これらの努力は将来のマイルストーンと特許使用料になる可能性がある
カタログ表
ライル免疫会社です。
連結財務諸表付記−(続)
予め定められた開発、規制、および/または商業マイルストーンを達成した後。会社がこれらの努力のための資金を提供する義務があるかどうかは、そのような合意の終了を含む計画中断を招く可能性のある不利なイベントに参加し続けるかどうかに依存する。これらの合意の性質により、将来の潜在的な支払い自体は不確定であるため、2022年12月31日および2021年12月31日現在、これらの目標が将来達成可能な金額は記録されていない。
17. 関係者取引
2021年9月に当社はSonomaと転貸契約を締結し,当社はSonomaと取締役会席を持つ普通株主を所有しており,これにより当社は転貸契約に同意した18,000同社は現在カリフォルニア州サンフランシスコ南部で1平方フィートの空間をレンタルしている。クラウスナー博士は会社の取締役会長であり、ソノマ社の取締役会のメンバーでもある。転貸の一部として$4.6Sonomaは100万テナント改善入金を支払い,転貸期間内に確認された。2022年と2021年12月31日現在、負債その他流動負債$0.5百万そして$0.5百万ドルはそれぞれ他の非現在のLIAと価値$の能力3.5百万ドルとドル4.0それぞれ百万人ソノマの転貸と関係があります。国際電気通信連合E共$2.6百万ドルとドル1.8100万w他の営業収入で確認された場合、2022年12月31日現在2021年のドルです1.9百万ドルとドル0.6100万ドルは転貸収入によるものです2022年12月31日までの年度と2021年ですそれは.注9を参照賃貸借証書ソノマの転貸についてもっと詳しく知りたいです。
同社はGSKプロトコルの一方で,GSKは超過である10会社が発行した普通株の%を占める。注3を参照許可、協力、成功支払協定それは.収入を繰り越す ゼロそして$5.02022年と2021年12月31日までの百万ドル、繰延収入、非流動収入ゼロそして$79.72022年12月31日と2021年12月31日までに、それぞれ100万ドルがGSK協定に関連している。グラクソ·スミスクライン協定に関する確認収入は1ドル84.7百万、$10.5百万ドルとドル7.82022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。グラクソ·スミスクラインは2022年12月24日にグラクソ·スミスクライン協定を終了した。注3を参照許可、協力、成功的な支払い契約グラクソ·スミスクライン協定の終了に関するもっと多くの細部事項。
2020年3月に会社が買い戻し546,806そのAシリーズは優先株と2,032,166関連先から得られた普通株式。付記10を参照転換可能優先株そして付記11株主権益.
18. 資産買い入れ
2020年5月、当社は対を完成しました100IMMULUS,Inc.(“IMMULUS”)は,技術プラットフォームの開発に専念し,細胞療法の開発と生産を可能にする会社である。買収の掛け値として同社は$を支払った3.5百万ドルの現金と合計を発行しました688,463普通株で、公正価値は#ドルと推定されます4.0百万ドルです。同社は$を生み出しています0.5100万ドルの直接費用は$です8.0百万ドルです。
同社は、今回の買収は企業の会計定義に適合しておらず、買収により投入されたが、買収の流れや産出は何もないと結論した。そのため、同社はこの取引を資産買収として会計処理し、その価値は知的財産権研究開発分野に集中している次の表は,購入した資産の公正価値(単位:千):をまとめている
| | | | | |
その他の資産 | $ | 487 | |
現在行われている研究開発(IPR&D) | 7,528 | |
買収した総資産 | $ | 8,015 | |
知的財産権研究開発資産に割り当てられた金額は、買収取引時にこの資産に他の将来用途がないため、2020年12月31日までの年度の研究開発費に計上されている。
また、同社は#ドルまでのマイルストーン支払いを要求された37.0指定された開発マイルストーンの完成に成功した後、Immulusの前株主に100万ユーロを支払う。買収の日にこれらのマイルストーンの支払いを触発することは不可能だと考えられているそして違います。これらのマイルストーンの費用は、2022年、2021年、2020年12月31日までの年度に入金されている。
項目9.会計·財務開示面の変更と会計士との相違
ない。
第9条。制御とプログラム
情報開示制御とプログラムの評価
2022年12月31日現在、経営陣は、我々の最高経営責任者及び最高財務責任者の参加及び監督の下で、取引法第13 a-15(E)及び15 d-15(E)条に定義されている開示制御及びプログラムを評価している。我々の開示制御および手続きは、取引所法案に基づいて提出または提出された報告書において開示を要求する情報が、米国証券取引委員会規則および表で指定された期間内に記録、処理、集約および報告され、これらの情報が、必要な開示に関する決定をタイムリーに行うために、最高経営者および最高財務官を含む私たちの管理層に蓄積されて伝達されることを保証することを目的としている。
どのような制御やプログラムも,設計や操作がどんなに良好であっても,予想される制御目標を実現するために合理的な保証を提供することしかできないが,管理層は,可能な制御とプログラムのコスト-利得関係を評価する際にその判断を運用しなければならない.この評価に基づき、我々の最高経営責任者と最高財務責任者は、2022年12月31日まで、我々の開示制御及びプログラムの設計·運営が合理的な保証レベルで有効であると結論した。
制御やプログラムへの固有の制限
私たちの経営陣は、CEOやCEOを含め、私たちの開示統制や手続き、および財務報告に対する私たちの内部統制がすべてのミスやすべての詐欺を防ぐことを期待していません。制御システムの設計や動作がどんなに良くても,合理的な保証を提供し,制御システムの目標を実現することしかできない.制御システムの設計は資源の制限を反映しており,制御の利点はそのコストに対して考慮しなければならない.すべての制御システムには固有の限界があるため、どの制御評価もわが社のすべての制御問題や不正事件がすでにまたは検出されることを絶対に保証することはできません。これらの固有の制限は、開示および財務報告手続きの既知の特徴であるため、これらのリスクを除去するのではないにもかかわらず、保障措置を設計することが可能である。これらの固有の限界には,意思決定における判断が誤りである可能性があり,故障発生は簡単な誤りや誤りによる現実がある.制御はまた、ある人の個人的な行動、2人以上の結託、または制御の管理優先によって回避することができる。いずれの制御システムの設計も,将来のイベントの可能性に対する何らかの仮定にある程度基づいている.私たちの開示制御と手続き、および財務報告に対する私たちの内部統制は、その目標を達成するための合理的な保証を提供することを目的としているが、どの設計もすべての未来の条件でその目標を達成することに成功する保証はない。時間の経過とともに,条件の変化や政策やプログラムに対する遵守度の悪化により,制御が不十分になる可能性がある.費用対効果のある制御システムの固有の限界から, ミスや詐欺による誤った陳述は発生する可能性があり、発見されないだろう。
経営陣財務報告内部統制年次報告書
私たちの経営陣は、取引規制13 a-15(F)および15 d-15(F)で定義されている十分な財務報告内部統制を確立し、維持する責任があります。我々の経営陣は、最高経営責任者と最高財務官を含み、トレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み”(2013年枠組み)で提案された枠組みに基づいて、我々の財務報告の内部統制の有効性を評価した。この枠組みの下での評価によると、我々の経営陣は、2022年12月31日現在、財務報告の内部統制を合理的な保証水準で有効であると結論している。
我々は、2022年12月31日現在、財務報告の内部統制の有効性を独立公認会計士事務所安永会計士事務所が監査しており、その報告は本年度報告10−K表第2部第8項に記載されている。
財務報告の内部統制の変化
2022年12月31日までの四半期では、財務報告の内部統制には何の変化もなく、財務報告の内部統制に大きな影響を与えたり、合理的な可能性が重大な影響を与えたりしている。
独立公認会計士事務所報告
ライル免疫会社の株主と取締役会に行きます。
財務報告の内部統制については
我々は、トレデビル委員会後援組織委員会が発表した内部統制-総合枠組み(2013年枠組み)(COSO基準)で確立された基準に基づいて、ライル免疫会社の2022年12月31日までの財務報告内部統制を監査した。ライル免疫会社(当社)はCOSO基準に基づき,2022年12月31日からすべての重要な面で財務報告を有効に内部統制していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に従って、当社の2022年12月31日まで、2022年12月31日と2021年12月31日までの総合貸借対照表を監査し、2022年12月31日までの3年度の関連総合経営報告書と全面赤字、転換可能な優先株と株主権益(損失)と現金流量、および2023年2月28日の関連付記と我々の報告について無保留意見を発表した。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、添付されている“経営陣財務報告内部統制年次報告”における財務報告内部統制の有効性を評価する責任がある。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/S/安永法律事務所
カリフォルニア州サンマテオ
2023年2月28日
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
適用されません。
第三部
プロジェクト10.取締役、上級管理者、および企業管理
本プロジェクトに要求される情報は,2023年年次総会のために米国証券取引委員会に提出される我々の委託書を参考にして組み込まれており,この年度株主総会は会計年度までの120日以内に米国証券取引委員会に提出される2022年12月31日.
私たちの商業行為と道徳基準は私たちのすべての従業員、高級管理者、そして役員に適用される。これには、我々の最高経営責任者、最高財務官、および最高会計官または財務総監、または同様の機能を実行する者が含まれる。私たちのビジネス行動と道徳基準の全文は、私たちのサイトの投資家関係部分で見ることができます。サイトは、https://ir.lyell.com、“コーポレート·ガバナンス”の下での“ガバナンスポイント”部分です。我々は、米国証券取引委員会Form 8-K第5.05項のビジネス行為および道徳基準条項の改正または免除に関する開示要件を満たすために、我々のウェブサイト上で上記指定されたサイトアドレスおよび位置を発行することによって、これらの情報を配布する予定です。
プロジェクト11.役員報酬
本プロジェクトに要求される情報は,2023年年次総会のために米国証券取引委員会に提出される我々の委託書を参考にして組み込まれており,この年度株主総会は会計年度までの120日以内に米国証券取引委員会に提出される2022年12月31日.
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
本プロジェクトに要求される情報は,2023年年次総会のために米国証券取引委員会に提出される我々の委託書を参考にして組み込まれており,この年度株主総会は会計年度までの120日以内に米国証券取引委員会に提出される2022年12月31日.
第13項:特定の関係及び関連取引、並びに取締役独立性
本プロジェクトに要求される情報は,2023年年次総会のために米国証券取引委員会に提出される我々の委託書を参考にして組み込まれており,この年度株主総会は会計年度までの120日以内に米国証券取引委員会に提出される2022年12月31日.
プロジェクト14.チーフ会計士費用とサービス
本プロジェクトに要求される情報は,2023年年次総会のために米国証券取引委員会に提出される我々の委託書を参考にして組み込まれており,この年度株主総会は会計年度までの120日以内に米国証券取引委員会に提出される2022年12月31日.
第4部
プロジェクト15.証拠品および財務諸表の添付表
(a)以下の書類は、本報告の一部として提出された
(1)第二部第八項には、次の財務諸表及び独立公認会計士事務所の報告が含まれる
| | | | | | | | |
| | ページ |
独立公認会計士事務所報告 | | 86 |
合併貸借対照表 | | 88 |
合併経営報告書と全面赤字 | | 89 |
転換可能優先株と株主権益連結報告書(損失) | | 90 |
統合現金フロー表 | | 91 |
連結財務諸表付記 | | 92 |
(2)連結財務諸表付記中の情報は適用または列報されていないため、すべての財務諸表添付表は省略されている。
(3)以下の証拠は本報告書の一部として提出される。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 引用で法団として成立する | | |
展示品
番号をつける | | 展示品説明 | | 表 | | 書類番号 | | 展示品/
付録
参考までに | | 保存する
日取り | | 保存済み
ここから声明する |
| 3.1 | | 会社登録証明書の改訂と再予約。 | | S-8 | | 333-257249 | | 4.1 | | 6/21/2021 | | |
| 3.2 | | 添付例を改訂及び再編成する。 | | S-8 | | 333-257249 | | 4.2 | | 6/21/2021 | | |
| 4.1 | | 普通株式証明書フォーマット。 | | S-1/A | | 333-256470 | | 4.1 | | 6/9/2021 | | |
| 4.2 | | 登録者及びその特定の株主が2020年3月5日に改訂及び再署名した“投資家権利協定”。 | | S-1 | | 333-256470 | | 4.2 | | 5/25/2021 | | |
| 4.3 | | 証券説明書 | | | | | | | | | | X |
| 10.1 | | ライル免疫会社の2018年株式激励計画は、改訂された。 | | S-1 | | 333-256470 | | 10.1 | | 5/25/2021 | | |
| 10.2 | | ライル免疫会社の2018年株式インセンティブ計画下の株式オプション付与通知、株式オプション協定及び行使通知及び制限株式奨励プロトコルのフォーマット。 | | S-1 | | 333-256470 | | 10.2 | | 5/25/2021 | | |
| 10.3 | | ライル免疫会社の2021年株式インセンティブ計画。 | | S-1/A | | 333-256470 | | 10.3 | | 6/9/2021 | | |
| 10.4 | | 株式オプション付与通知、株式オプション協定及びライル免疫会社2021年株式インセンティブ計画の下での行使通知のフォーマット。 | | S-1/A | | 333-256470 | | 10.4 | | 6/9/2021 | | |
| 10.5 | | ライル免疫会社は2021年の株式インセンティブ計画の下で制限的な株式単位に通知と奨励協定のフォーマットを付与する。 | | S-1/A | | 333-256470 | | 10.5 | | 6/9/2021 | | |
| 10.6 | | ライル免疫会社。2021年従業員株購入計画。 | | S-1/A | | 333-256470 | | 10.6 | | 6/9/2021 | | |
| 10.7 | | ライル免疫会社は2021年の非従業員役員報酬政策。 | | S-1/A | | 333-256470 | | 10.7 | | 6/9/2021 | | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 引用で法団として成立する | | |
展示品
番号をつける | | 展示品説明 | | 表 | | 書類番号 | | 展示品/
付録
参考までに | | 保存する
日取り | | 保存済み
ここから声明する |
| 10.8 | | ライル免疫会社の役人サービス計画です。 | | 10-K | | 001-40502 | | 10.8 | | 3/29/2022 | | |
| 10.9 | | 登録者とその役員及び行政者との間の賠償協定フォーマット。 | | S-1 | | 333-256470 | | 10.9 | | 5/25/2021 | | |
| 10.10 | | 登録者とリチャード·クラウスナとの間の修正された招待状は,日付は2020年7月23日である。 | | S-1 | | 333-256470 | | 10.10 | | 5/25/2021 | | |
| 10.11 | | 登録者とリン·シーリーの間の招待状は、2022年12月14日となっています | | 8-K | | 001-40502 | | 10.2 | | 12/16/2022 | | |
| 10.12 | | 登録者とチャールズ·ニュートンの間の招待状は、2021年2月3日。 | | S-1 | | 333-256470 | | 10.12 | | 5/25/2021 | | |
| 10.13 | | 登録者とRahsaan W.Thompsonの間の招待状は,2022年9月12日である. | | 10-Q | | 001-40502 | | 10.2 | | 11/8/2022 | | |
| 10.14 | | 登録者とスティーヴン·ヒルの間の招待状は、日付が2019年5月9日です。 | | S-1 | | 333-256470 | | 10.14 | | 5/25/2021 | | |
| 10.15 | | 登録者とスティーヴン·ヒルとの間の解散料免除は,2022年4月19日である。 | | 10-Q | | 001-40502 | | 10.1 | | 5/10/2022 | | |
| 10.16 | | エリザベス·ホマンスとライル免疫会社が締結した“分離、移行と全面放出協定”は、2022年12月15日 | | 8-K | | 001-40502 | | 10.1 | | 12/16/2022 | | |
| 10.17 | | 登録者とメリーランド大学初級大学取締役会との間の許可協定は、日付が2019年1月29日である。 | | S-1 | | 333-256470 | | 10.16 | | 5/25/2021 | | |
| 10.18 | | 登録者とメリーランド·スタンフォード初級大学取締役会との間の成功裏な支払い協定は、日付が2020年10月1日である。 | | S-1 | | 333-256470 | | 10.17 | | 5/25/2021 | | |
| 10.19 | | 登録者とフレッド·ハッチンソン癌研究センターとの間の支払成功協定は,2018年12月19日である。 | | S-1 | | 333-256470 | | 10.18 | | 5/25/2021 | | |
| 10.20 | | 登録者とBre WA Office Owner LLCの間でC号棟の標準オフィスをレンタルし、日付は2019年8月28日です。 | | S-1 | | 333-256470 | | 10.19 | | 5/25/2021 | | |
| 10.21 | | 登録者とBre WA Office Owner LLCの間でE号棟の標準オフィスをレンタルし、日付は2019年8月28日です。 | | S-1 | | 333-256470 | | 10.20 | | 5/25/2021 | | |
| 10.22 | | 登録者とBMR-500錦刺繍大道有限責任会社との間の賃貸契約は、日付が2018年11月27日であり、改訂された。 | | S-1 | | 333-256470 | | 10.21 | | 5/25/2021 | | |
| 10.23 | | 登録者とAREの間の賃貸契約-サンフランシスコ第65号有限責任会社は、日付が2019年8月15日であり、改訂された。 | | S-1 | | 333-256470 | | 10.22 | | 5/25/2021 | | |
| 23.1 | | 独立公認会計士事務所の同意。 | | | | | | | | | | X |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 引用で法団として成立する | | |
展示品
番号をつける | | 展示品説明 | | 表 | | 書類番号 | | 展示品/
付録
参考までに | | 保存する
日取り | | 保存済み
ここから声明する |
| 24.1 | | 授権書(署名ページに含まれる)。 | | | | | | | | | | X |
| 31.1 | | 幹事は、第13 a−14(A)及び15 d−14(A)条に基づいて実行される。 | | | | | | | | | | X |
| 31.2 | | 細則13 a−14(A)及び15 d−14(A)によれば、財務幹事等が開示されている。 | | | | | | | | | | X |
| 32.1 | | 米国法典第18編第1350条に基づいて首席行政官及び首席財務官証明書を発行する。 | | | | | | | | | | X |
| 101.INS | | XBRLインスタンスドキュメント。 | | XBRLインスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルに表示されない。 |
| 101.書院 | | インラインXBRL分類拡張アーキテクチャ文書. | | | | | | | | | | X |
| 101.カール | | インラインXBRL分類拡張はリンクベース文書を計算する. | | | | | | | | | | X |
| 101.def | | XBRLソート拡張を連結してLinkbase文書を定義する. | | | | | | | | | | X |
| 101.介護会 | | XBRL分類拡張ラベルLinkbase文書を連結する. | | | | | | | | | | X |
| 101.Pre | | XBRL分類拡張プレゼンテーションLinkbaseドキュメントを内部接続する. | | | | | | | | | | X |
| 104 | | 表紙相互データファイル。 | | フォーマットは、アクセサリ101に含まれるイントラネットXBRLである。 |
*本展示品の一部(より)[*])は、登録者が情報が実質的でもなく、登録者が個人または機密とみなされるタイプでもないことが確認されたので省略される。
項目16.表格10-Kの概要
ない。
サイン
1934年証券法第13又は15(D)節の要求によると、登録者は、本10-K表年次報告を2023年2月28日にカリフォルニア州南サンフランシスコ市で次の正式に許可された署名者が代表して署名することを正式に促した。
| | | | | | | | |
| ライルIMMUN PHARMA,Inc. |
| | |
| 差出人: | /s/リンSeely |
| 名前: | リン·シリー医学博士 |
| タイトル: | 社長と最高経営責任者 |
授権依頼書
このような陳述により、以下の署名のすべての人が、Lynn Seely、Charles Newton、Rahsaan Thompson、およびそれらの各々を構成して任命し、その真の合法的な事実代理人および代理人として、十分な代替および再代理の権限を有し、その任意およびすべての身分で、彼または彼女の名義、場所、および代替で、本Form 10-K年次報告の任意およびすべての修正に署名し、その中のすべての証拠物および他の関連文書を証券取引委員会に提出し、上記の事実代理人および代理人を付与することを知っている。これに関連するすべての必要かつ必要な行為および事柄を完全に行い、実行する権利があり、完全に、彼または彼女自身が可能または自ら行うことができるすべての意図および目的から、上述したすべての事実代理人および代理人、または彼らのいずれか、または彼らの1人または複数の代替者を承認し、確認することができ、本条例によってなされたすべてのことを合法的に行うことができるか、または結果として、すべてのことを行うことができる。
1934年の証券法の要求によると、この表格10-Kの年次報告は、指定された日に登録者として以下の者代表登録者によって署名された
| | | | | | | | | | | | | | |
| サイン | | タイトル | | 日取り |
| | | | |
| /s/リンSeely | | 取締役最高経営責任者総裁 | | 2023年2月28日 |
| リン·シリー医学博士 | | (首席行政主任) | | |
| | | | |
| チャールズ·ニュートン | | 首席財務官 | | 2023年2月28日 |
| チャールズ·ニュートン | | (首席財務会計官) | | |
| | | | |
| /リチャード·D·クラウスナ | | 取締役会議長 | | 2023年2月28日 |
| リチャード·D·クラウスナー医学博士 | | | | |
| | | | |
| /s/ハンス·ビショップ | | 役員.取締役 | | 2023年2月28日 |
| ハンス·ビショップ | | | | |
| | | | |
| /s/オーティス·ブラリー | | 役員.取締役 | | 2023年2月28日 |
| オーティス·ブラリー医学博士 | | | | |
| | | | |
| キャサリン·フリードマン | | 役員.取締役 | | 2023年2月28日 |
| キャサリン·フリードマン | | | | |
| | | | |
| /s/エリザベス·ナベル | | 役員.取締役 | | 2023年2月28日 |
| エリザベス·ナベル医学博士 | | | | |
| | | | |
| /s/ロバート·ネルソン | | 役員.取締役 | | 2023年2月28日 |
| ロバート·ネルソン | | | | |
| | | | |
| /s/William Rieflin | | 役員.取締役 | | 2023年2月28日 |
| ウィリアム·リーフリン | | | | |