アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15(D)条に基づいて提出された |
依頼書類番号:
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
|
|
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引 記号 |
|
登録された各取引所の名称 |
|
|
同法第12条(G)に基づいて登録された証券: ありません
登録者が証券法第405条に規定する有名な経験豊富な発行者である場合は、再選択マークで表示してください
登録者がこの法第13又は15(D)条に従って報告書を提出する必要がないか否かを、再選択マークで示すはい、そうです ☐
登録者が(1)過去12ヶ月以内(または登録者がそのような報告を提出する必要があるより短い期間)に1934年の証券取引法第13条または15(D)条に提出されたすべての報告書を再選択マークで示すかどうか、および(2)このような提出要求を過去90日以内に遵守してきた
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
☒ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|
|
|
|
非加速ファイルサーバ |
|
☐ |
|
規模の小さい報告会社 |
|
|
|
|
|
|
|
|
|
|
|
|
|
新興成長型会社 |
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する☐
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意のエンタルピーCER幹部が相関回復期間内に§240.10 D−1(B)に基づいて受信したインセンティブベースの補償に基づいて回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)はい、そうです ☐ 違います。
2022年6月30日までに登録者が最近完成した第2財期の最終営業日には,登録者の非関連会社が保有する登録者普通株の総時価は$$であり,これは最終報告に基づく登録者普通株1株31.45ドルの販売価格である
引用で編入された書類
登録者は、2023年5月25日に開催される2023年株主総会の最終委託書の一部を、登録者が2022年12月31日の財政年度終了後120日以内に証券取引委員会に提出する予定であり、この最終委託書は、本10−K表の第2部及び第3部に引用により組み込まれる。
カタログ表
|
|
ページ |
第1部 |
|
|
第1項。 |
業務.業務 |
3 |
第1 A項。 |
リスク要因 |
26 |
項目1 B。 |
未解決従業員意見 |
58 |
第二項です。 |
属性 |
58 |
第三項です。 |
法律訴訟 |
58 |
第四項です。 |
炭鉱安全情報開示 |
58 |
|
|
|
第II部 |
|
|
五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
58 |
第六項です。 |
保留されている |
60 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
61 |
第七A項。 |
市場リスクの定量的·定性的開示について |
73 |
第八項です。 |
財務諸表と補足データ |
75 |
第九項です。 |
会計と財務情報開示の変更と相違 |
104 |
第9条。 |
制御とプログラム |
104 |
プロジェクト9 B。 |
その他の情報 |
105 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
105 |
|
|
|
第三部 |
|
|
第10項。 |
役員·幹部と会社の管理 |
106 |
第十一項。 |
役員報酬 |
106 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
106 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
106 |
14項です。 |
最高料金とサービス |
106 |
|
|
|
第4部 |
|
|
第十五項。 |
展示·財務諸表明細書 |
107 |
プロジェクト16 |
表格10-Kの概要 |
110 |
サイン |
111 |
|
i
前向きに陳述する
このForm 10-K年度報告書には前向きな陳述が含まれており、これらの陳述は現在の私たちの運営や財務業績などに対する私たちの見方を反映している。Form 10-K年度報告に含まれる歴史的事実に関する陳述を除いて、他のすべての陳述は、私たちの将来の経営結果と財務状況、業務戦略と計画、および私たちの将来の経営目標に関する陳述を含み、すべて前向きな陳述である。“信じる”、“可能”、“将”、“推定”、“継続”、“予想”、“意図”、“予想”、“すべき”、“可能”、“目標”、“予測”、“求める”および同様の表現は、前向き陳述を識別することを目的としている。これらの展望的な陳述は主に私たちの現在の未来の事件と財務傾向の予想と予測に基づいており、私たちはこれらの事件と財務傾向が私たちの財務状況、運営結果、業務戦略、短期と長期業務運営と目標、財務需要に影響を与える可能性があると考えている。これらの展望的陳述は、“項目1 A”に記載されたリスク、不確定要素、および仮説を含むいくつかのリスク、不確実性、および仮説の影響を受ける。リスク要因“は本年度報告の10−K表にある。また、私たちの運営環境は競争が激しく、変化が迅速で、新しいリスクが時々発生している。私たちの経営陣はすべてのリスクを予測することはできませんし、すべての要素が私たちの業務に与える影響を評価することもできません。あるいは任意の要素や要素の組み合わせは、実際の結果が私たちが行う可能性のある任意の前向きな陳述に含まれる結果と大きく異なる程度をもたらす可能性があります。これらのリスク、不確実性、仮説を考慮して, 本年度報告で議論された前向きイベントや状況は発生しない可能性があり,実際の結果は前向き陳述における期待や示唆の結果とは大きく異なる可能性がある。
本年度報告におけるForm 10−Kに含まれる前向きな陳述は,本報告の発表日にのみ行われた。あなたは未来の事件の予測として前向きな陳述に依存してはいけない。私たちは展望性陳述に反映された予想は合理的であると考えているが、私たちは展望性陳述に反映された未来の結果、活動レベル、業績或いは事件と状況が実現或いは発生することを保証することができない。しかも、私たちまたは他の誰も、展望的陳述の正確性と完全性に責任を負わない。本Form 10-K年次報告書の発表日後に、これらの陳述が実際の結果または予想される変化と一致するように、任意の理由で任意の前向き陳述を公開更新する義務はありません。
リスク要因の概要
私たちの普通株に投資するのは危険がある。あなたは“第1 A項”でより十分な議論がある以下のリスクを真剣に考慮しなければならない。リスク要因“と、本年度報告に含まれる10-K表に含まれる他のすべての情報を、我々の普通株に投資する前に。これらのリスクは以下のリスクを含むが、これらに限定されない
1
2
第1部
文脈に別の要求があるか、または別の説明があることに加えて、用語“TransMedics”、“当社”、“会社”および“私たちの業務”は、TransMedics Group、Inc.およびそれらの合併の子会社を意味する。
プロジェクト1.ビジネス
概要
我々は商業段階の医療技術会社であり,複数の疾患州にまたがる終末期臓器不全患者の臓器移植療法を転換している。われわれがOCSを開発したのは数十年来の看護基準に代わるためであり,この基準は世界数十万人の患者の救命を得る移植療法を大きく制限していると考えられる。著者らの革新したOCS技術は人体外器官の自然生活と機能環境の多くの方面を複製した。したがって、OCSは、移植臓器保存を静的から動的環境に変換し、それによって、臓器最適化と評価を含む新しい機能を実現する範式遷移を表す。我々はまた、アウトソーシング臓器検索およびOCS臓器管理を提供し、米国の移植計画により効率的なプロセスを提供し、OCSを介してドナー臓器を獲得する革新的な鍵解決策である我が国OCS計画、またはNOPを開発した。OCSとNOPの併用は,臓器移植の数を著しく増加させ,移植後の結果を改善する可能性があると信じている。
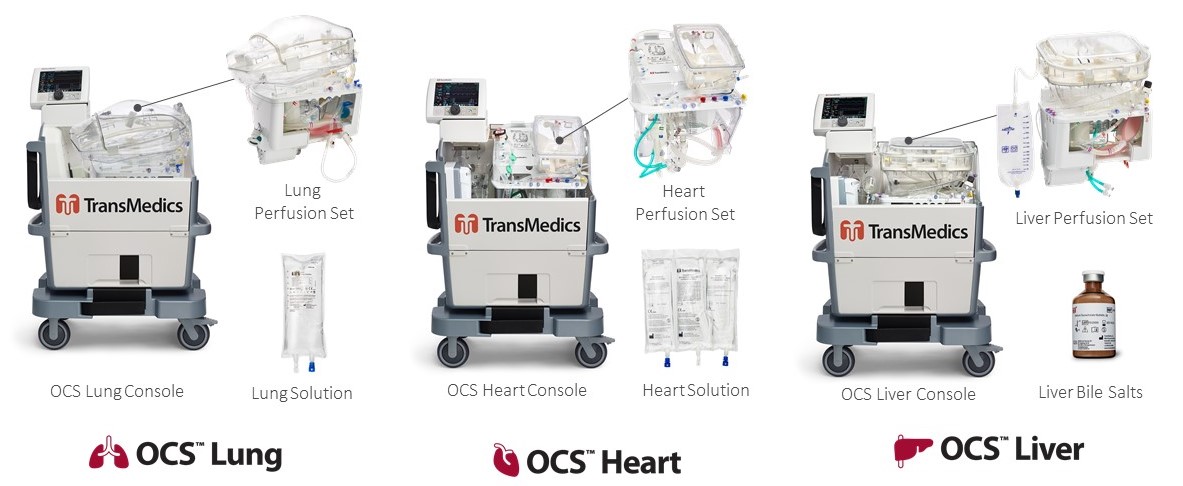
我々はOCSをプラットフォームとして設計し、複数の器官の製品にコア技術を利用することを可能にした。これまで、著者らは3種類のOCS製品を開発し、それぞれ心臓、肺と肝臓移植に使用し、OCSをFDAの許可を得た唯一の携帯型、多臓器、温血灌流技術プラットフォームとした。我々のすべての3つの製品、OCS心臓、OCS肺、およびOCS肝臓は、米国食品医薬品局(FDA)の発売前に承認された。さらに、我々の3つの製品OCS心、OCS肺、およびOCS肝は、脳死後ドナー臓器(DBD器官)および循環死後ドナー臓器(DCD器官)のために許可されている。
慢性病の人口傾向を招くため、末期臓器不全の発病率は全世界範囲内で迅速に上昇した。臓器移植は末期臓器不全を解決する第一選択の治療方法であり、それは積極的な臨床効果と良好な衛生経済学を有するためである。しかし、移植数量は固体臓器移植看護標準である冷蔵によって制限されている。冷蔵は基本的な臓器保存方法であり,ドナーの臓器を冷たい薬物溶液で洗浄し,氷面上のビニール袋に入れ,冷蔵箱に入れて輸送する。酸素供給や虚血が不足しているため、冷蔵は器官を深刻な損傷を受け、医者は器官の生存状況を評価できず、しかもドナーから器官を取り出すと、器官状況を最適化する能力が不足している。時間依存性の虚血損傷はすでに移植後の短期と長期の臨床合併症を招くことが証明され、それに加えて臓器を評価或いは最適化できず、ドナー器官の深刻な利用不足を招く。冷蔵使用に伴い,脳死後に寄付された肺や心臓の大部分は利用されておらず,循環死亡後に寄付された利用可能な肺や心臓はほとんど利用されていない。
私たちは冷蔵の主要な制限を全面的に解決するためにOCSを開発した。OCSは携帯型臓器灌流、最適化と監視システムであり、それは著者らの独自とカスタマイズ技術を利用して人体外ドナー器官の近生理条件を複製する。著者らはOCS技術プラットフォームを設計し、臓器に暖かく、酸素を豊富に含み、栄養豊富な血液を注入し、同時に器官が生きている、正常に動作している状態を維持した;肺は呼吸し、心臓は鼓動し、肝臓は胆汁を産生している。冷蔵と比べ、OCSはドナー器官の損傷性虚血時間を著しく減少させ、ドナー器官の最適化と評価を可能にしたため、冷蔵と比較して、それはすでにより良い臨床結果を示し、そしてドナー器官の利用率を著しく高める潜在力を提供した。
我々が開発したNOPは、移植センターに追加の能力を提供し、複雑な臓器調達過程に対応するためであり、これは往々にして移植センターの既存の能力と能力以外の資源と物流を必要とし、移植センターが回収できる可能性のある臓器数を制限する。著者らのNOPは訓練された臓器調達外科医、臨床専門家、および移植コーディネーターを提供し、我々のOCS技術を使用してエンドツーエンドの臨床解決策を提供する。これにより、移植センターは、自身のスタッフを増加させることなく、OCSを使用して患者のためにより多くの臓器を取得して移植することができる。
私たちはOCSとNOPが臓器移植分野のすべての利害関係者に大きな利益をもたらすと信じている。患者のために、私たちはOCSとNOPが命を救う移植に追加の方法を提供し、より速いことを可能にすると信じている
3
移植後の回復。病院にとって、OCSとNOPは移植数量を増加させ、より多くの患者を治療し、提供者の地位を高め、移植計画経済性を改善する手段を提供すると信じている。最後に、著者らはOCSとNOPが支払人にもっと費用効果のある末期臓器不全治療方法を提供し、移植後の重大な合併症コストと入院時間の延長を減少したと信じている。
私たちのOCS製品とNOPサービスはアメリカで既存の標準商業移植課金機構によって精算されます。連邦医療保険計画と個人支払者はアメリカのキー試験期間中ずっとOCS肺、OCS心臓とOCS肝臓に精算を提供し、FDAの承認後も引き続き私たちの製品とサービスに精算を提供した。私たちはアメリカ以外の製品のために長期補償を求めています。
私たちの会社の本部、製造、臨床訓練施設はマサチューセッツ州アンドーバーにあります。私たちはアメリカにも地理的に分布したチームを持っていて、私たちの国のOCS計画を支持します。私たちはヨーロッパにもっと多くの流通と商業業務がある。2022年12月31日現在、私たちは世界に212人の従業員を抱えており、その大部分がフルタイム社員です。2022年、2021年、2020年12月31日までの年間で、それぞれ9,350万ドル、3,030万ドル、2,560万ドルの総収入を創出し、2022年と2021年の前年比増加はそれぞれ208.8%と18.0%だった。私たちのビジネスモデルの特徴は高レベルの経常収入であり、これは主に私たちが一度に使用する臓器専用使い捨てセットの販売から来ており、これらのスーツはOCSを使用するたびに移植に必要なものであり、私たちNOPが移植センターに提供するサービスである。
私たちの競争優位は
私たちは会社の持続的な成長が次のような競争優位に推進されると信じている
我々の臓器ケアシステムはFDAが承認した市場で唯一の携帯型,多臓器,温灌流装置である。移植性は移植前の臓器に対する虚血損傷を減少させ、それによって移植後の合併症を減少させ、より多くの臓器の移植への応用を許可するキーポイントである。多臓器プラットフォームは移植計画間の標準化使用を可能にする。
我が国OCS計画は、OCSの臓器提供を得るためのより効果的なプログラムを提供するためのものである。移植数が増加し,回収距離が長くなることが予想されるため,この分野には現在のモデル,すなわちレシピエント移植センターがそのチームをドナー現場に派遣して回収する必要があると考えられる。我が国OCS計画は、OCSの技術的利点を利用し、リソースを著しく増加させることなく、移植センターにその移植片数を増加させるためのより効果的な方法を提供する交鍵解決策を提供する。
われわれのPMA製品に対するFDAの承認を得るために,大量の臨床試験が行われ,非常に多くの患者が関与しており,これらの試験の結果が先行する医学誌に発表されている。私たちはまた、私たちのすべての製品の発売後の登録を開始し、これらの登録の科学的結果を臨床ユーザーコミュニティに提供し続ける予定である。
移植コミュニティは世界各地をリードする学術医療センターに高度に集中している。われわれの臨床試験に参加することにより、著者らはこれらのセンターの多くのセンターと強固な臨床関係を構築した。また、著者らの臨床試験地点の多くの移植外科医はすでに新しいセンターに引っ越し、彼らのOCS経験をもたらし、私たちの関係がこれらの新しいセンターに発展することを許可したかもしれない。
4
臓器移植治療の利点と課題
臓器移植は臨床結果からも衛生経済学的にも終末期臓器不全治療に最も有効な方法であると考えられる。末期臓器不全を治療する他の方法と比較して、臓器移植は最も長い期待寿命と最も良い生活の質を提供する。例えば、末期心不全の治療選択は、薬物治療またはOMMの最適な医療管理、左心室補助装置(LVAD)の機械的支持、および心臓移植を含む。心臓移植はOMMやLVADに比べて長い生存率を有しており,この2つの薬剤は移植の架け橋として使用されるか,移植に代わる目的療法として用いられている。これらの向上した生存率は逆に品質調整の生命年に基づいて移植に有利な経済効果をもたらした。
しかし、臓器移植治療は二つの大きな挑戦に直面している。まず、全世界の臓器不全の発生率はますます高くなり、臓器移植は著しい臨床と経済効果があるにもかかわらず、移植前の伝統的な器官保存方法の局限性のため、移植の数量は需要より深刻に遅れている。次に,移植後の高い臨床合併症の発生率を減少させ,結果を改善し,コストを低減する必要がある。
冷却静的保存保存臓器を利用することは、3つの側面でこれらの課題を促進している
冷蔵は器官に酸素を失わせ,時間依存性損傷(虚血)を招く。この損傷は移植後の合併症に関連し,臓器購入と移植の実行可能時間を制限し,ドナーとレシピエントの間の可能な時間と距離を制限し,ドナープールの利用率を低くし,毎年行われる移植手術の数を制限している。
非生理環境を考慮すると、冷蔵はいかなる治療干与措置も許可せず、ドナー器官の状況を最適化する。これは,移植に利用可能なドナー臓器の利用をさらに制限し,移植後の結果に悪影響を及ぼす可能性がある。ドナー臓器は、ドナー提供中に著しく変化または使い切った基質、ホルモン、および電解質の枯渇レベルを補充するために、何らかの形態の最適化から利益を得ることがよく証明されている。
冷蔵期間中,臓器には生理活性も機能もないため,これらの臓器が移植に適しているかどうかを評価する方法はない。これは,世界各地のドナー人口が高齢化しており,リスク要因に伴い,これらの要因が複雑な診断評価能力から利益を得ており,ドナー臓器が適切かつ安全に移植されているかどうかを予測するために,利用可能な臓器の利用をさらに制限している。
私たちの技術と解決策は
私たちは冷蔵の主要な制限を全面的に解決するためにOCSを開発した。OCSは携帯型臓器灌流、最適化と監視システムであり、それは著者らの独自とカスタマイズ技術を利用して人体外ドナー器官の近生理条件を複製する。OCSの設計目的は臓器に暖かく、酸素と栄養豊富な血液を注入し、同時に器官が生きている、正常に動作する状態を維持することである;肺は呼吸し、心臓は鼓動し、肝臓は胆汁を産生する。したがって、OCSは、移植臓器保存を静的から動的環境に変換し、それによって、臓器最適化と評価を含む新しい機能を実現する範式遷移を表す。
5
OCS技術プラットフォーム
FDAによって承認された最初であり、複数の臓器間で独自のコア技術を利用するための携帯型、多臓器、温血灌流プラットフォームであるOCSを開発した。各OCS製品について、私たちは、臓器固有の、カスタマイズされた、および独自の技術を使用してプラットフォームを補完する。我々はこれまでに3種類のOCS製品を開発し,それぞれ肺,心臓,肝臓移植に用いてきた。より多くの臓器のためのOCS製品が開発されている。

各OCS製品は、各器官のためにカスタマイズされた3つの主要構成要素からなる
OCS技術プラットフォームは、冷蔵の制限を全面的に解決し、移植結果を改善するために、著者らが設計した以下のコア技術を備えている
6
OCSプラットフォームの主な利点
OCSプラットフォームは冷蔵と比較して顕著な利点を提供すると信じている
現在の臓器輸送の時間と距離制限を減少させ、同時に現在高品質の移植結果を確実に得ることができる限られた取り出し時間帯を増加させた。これは臓器利用率を最大限に向上させ,臓器移植の機会を増加させるとともに,移植後の結果を有意義に改善した。
臨床検証された安全方式の使用を許可し、脳損傷と循環システムが死亡した場合にドナー器官の治療を最適化し、ドナー器官の利用率と患者の予後を著しく高める。
現在受け入れ可能な臨床基準を用いてドナー臓器の診断性評価を行い,臓器が移植に適しているかどうかを評価し,移植後の結果を最大限に向上させることができる。
冷静的貯蔵の3つの制限を全面的に解決することにより,OCSの使用はドナー臓器の利用率の向上を可能にし,移植後の結果を改善すると考えられる。
OCSプラットフォームが主要な利害関係者にもたらすメリット
OCSプラットフォームは移植過程全体の重要な構成要素に顕著な利点を提供すると信じている。
患者に対する価値
OCSは患者が末期臓器不全と考えられる最適な治療選択の機会を獲得し、それによって生活の質を高め、期待寿命を延長したと信じている。さらに,OCSを用いた改善の臨床結果は,移植後に患者をより早く回復させると信じている。
提供者への価値
OCSは提供者に臨床結果を改善させ,臓器移植を受ける患者数を増加させることができると信じている。臨床結果の改善は提供者がCMS移植後の生存指標要求の精算範囲を満たすことができ、その移植計画の全体財務状況を改善することができる。さらに、OCSによる移植数の増加は、提供者が支払者の“卓越したセンター”の称号を得るのを助け、その移植計画の著しい収入増加を促進すると信じている。
支払人に対する価値
臓器移植は末期臓器不全を治療する経済的かつ効率的な治療法であり,機械的支持や薬物治療などの他の治療法と比較して,最も長い期待寿命とより良い生活の質を提供するためと考えられる。OCSは支払者がこれらの有利な衛生経済から利益を得ることを可能にし、深刻な移植後の合併症への曝露と入院期間の延長の高いコストを制限すると信じている。
私たちの戦略
著者らは著者らのOCSプラットフォームを通じて臓器移植転換の目標を実現し、OCSを実体臓器移植の看護標準として確立し、ドナー器官の利用率を高め、臨床結果を改善することに取り組んでいる。
私たちの戦略の主な内容は
7
商業化する
私たちは二つのルートで私たちの製品を商業化します:私たちのNOPと直接買収モデルです。私たちのNOPは、移植センターが私たちのOCS製品を使用して、回収と臓器管理過程を訓練された臓器調達外科医、臨床専門家、および移植コーディネーターにアウトソーシングすることを可能にする。我々のサービスは,移植センターがその内部資源を移植手術と患者看護に集中させることを可能にしている。我々のNOPを利用して,移植センターはより大容量かつより遠隔地の検索をサポートするために余分な資源を投入する必要はない.NOPが発売されて以来、私たちは主にNOP販売オーナー立案法団を通過した。
私たちの直接取得モードは、自分のチームをトレーニングすることに興味のあるチームがOCS上で検索および臓器管理を行う移植センターに提供される。顧客ユーザは私たちのトレーニング施設でOCSを使用した認証を取得した。直接購入チャネル内のクライアントは、OCS使い捨て用品の在庫を維持し、使用時に注文補充を行う。私たちのすべての国際顧客と一部のアメリカの顧客は直接買収モードで私たちのOCS製品を購入します。
精算する
医療保険は臓器移植手術の精算に有効であり、2種類の支払いメカニズムに関連している。1つ目は,移植病院が入院期間中に移植手術を行っている間に発生した運営費を補償する入院予想支払い制度である。この滞在の費用は,症例が属するMedicare重症度診断関連群(MS−DRG)によって決定された。第2の機構は、MS-DRGベースの支払いに加えて、臓器保存および輸送コストを含む臓器取得コストの個別支払いに関する。医療保険は合理的なコストに基づいて許可された臓器獲得費用を病院に精算する。第二のメカニズムによると、所有者立案法団は返済金を得ることができる。
医療補助移植を受けた者に対しては,移植病院にOCSの費用を精算することは適用される州医療補助計画に基づいて決定される。いくつかの州は移植と臓器取得コストの全世界支払いを確立し、いくつかの州はMS-DRGシステムによって入院費用と臓器取得コストを単独で支払った。民間保険会社は通常、移植費用と臓器取得コストをどのように返済するかについて合意しており、これは、この2つの費用を世界的に支払うことによって、あるいは移植費用と単独の臓器取得コストを支払うことによる支払いメカニズムである可能性がある。アメリカの肺、心臓と肝臓移植手術の半分近くは連邦医療保険と医療補助計画で覆われ、残りの部分は個人支払者で精算される。
連邦医療保険および個人支払者は、米国キー試験中にOCS肺、OCS心臓およびOCS肝臓に精算を提供し、FDA承認後にOCS肺、OCS心臓、およびOCS肝臓に精算を提供する。これは長年の請求書の前例を作った。これらの既定の方法は、OCS肺、OCS心臓、およびOCS肝臓の商業的精算を促進し続けると信じている。米国以外の精算は類似した全体構造に従っている;しかし、すべての国は清算決定を行う必要があり、国家衛生システムにOCSの各特定の器官製品の精算の審査と許可を要求する可能性がある。現在,国家ヘルスケアシステムはOCSを用いた費用を移植センターに精算していないが,国際市場の精算には追加の臨床研究が必要である可能性がある。しかし、現在は所有者立件法団の国際病院を使って
8
病院予算や慈善基金です私たちは私たちのOCS製品のためにいくつかの管轄区域で長期補償を求めている。
臨床証拠
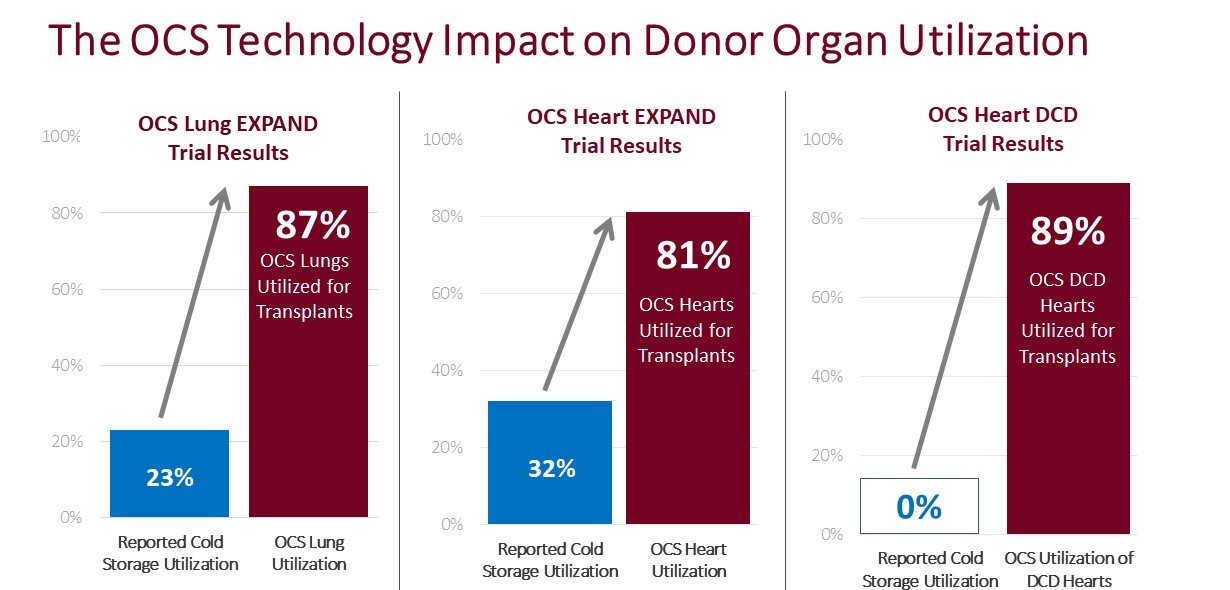
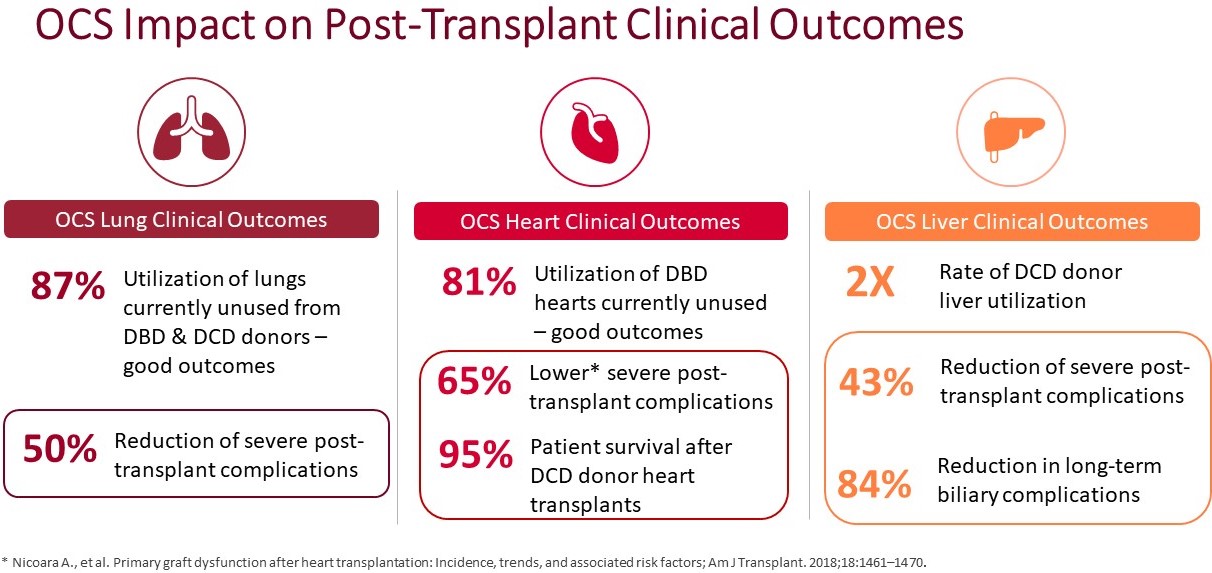
移植センターの首席移植外科医は臨床に集中し、主に臨床証拠に依存して彼らの臓器移植実践の変化を推進する。我々はすでに我々のFDA PMA承認とOCS肺、心臓および肝臓移植のPMA提出を支持するための大量の世界的な臨床証拠を開発した。その中の多くの臨床試験と研究は同業者が評議した臨床定期刊行物に発表された。われわれの臨床試験では,OCSが現在の臓器移植基準に適合する臓器を移植するためのものと,本来DBDやDCDドナーから使用できなかった臓器を評価した。我々の肺、心臓と肝臓移植における臨床試験結果は、臨床結果の改善と利用可能なドナー器官利用率の向上におけるOCSの潜在力を支持する可能性があると信じている。
われわれの臨床試験結果を以下の画像にまとめた。
.
9
OCS臨床試験総覧表

知的財産権
特許と商業秘密
私たちは特許、商標、著作権、商業秘密、および他の知的財産権法、守秘および発明譲渡協定、および他の措置によって私たちの知的財産権を保護します。私たちの特許の組み合わせには、私たちが所有しているか、または第三者から許可を得た特許と特許出願が含まれている。
2022年12月31日現在、我々が所有し許可している特許の組み合わせは、米国、オーストラリア、ヨーロッパ、カナダ、中国、イスラエル、ニュージーランド、日本を含む世界で約297件の発行された特許および係属中の特許出願を含む。我々が所有する製品の組み合わせは、OCS肺、OCS心臓、OCS肝臓、および解決策のうちの1つまたは複数に関連する特許およびアプリケーションを含む。アメリカでは、私たちが持っている特許の組み合わせは、約29個の発行された特許と10個の処理されるべき出願を含む。米国以外では、私たちが所有する特許の組み合わせは、約209件の発行された特許および49個の処理されるべき出願を含む。私たちの製品グループで発行された特許は、適用されれば、潜在的な追加特許期限調整または特許期間延長を含まない2025年から2036年の間に満了する予定です。承認されれば、我々のポートフォリオにおける未解決の米国および外国特許出願は、適用されれば、潜在的な特許期限調整や特許期間延長を含まない2025年から2036年の間に満了する予定である。
2022年12月31日現在、われわれのOCS肺に関連する特許の組み合わせは、通常、灌流および換気を使用して体外で肺を保存するためのいくつかの方法およびシステムのための一連の特許および特許出願を含む。このような特許は、米国、オーストラリア、ベルギー、カナダ、中国、デンマーク、ヨーロッパ、フランス、ドイツ、アイルランド、イスラエル、イタリア、日本、香港、オランダ、ニュージーランド、スペイン、スウェーデン、イギリスで発行され、米国、オーストラリア、カナダ、中国、欧州、香港、イスラエル、日本、ニュージーランドの特許出願が承認されている。これらの特許および係属中の特許出願によって発行される任意の特許は、適用される場合、潜在的な特許期限調整または特許期限延長を含まない2029年に満了する予定である。
2022年12月31日現在、われわれのOCS心臓に関連する特許の組み合わせは、通常、心臓をインビトロで保存するためのいくつかの方法およびシステムのための一連の特許および特許出願を含む。このような特許は、米国、オーストラリア、ベルギー、カナダ、中国、デンマーク、ヨーロッパ、フランス、ドイツ、香港、アイルランド、イスラエル、イタリア、日本、オランダ、ニュージーランド、スペイン、スウェーデン、イギリスで発行され、米国、オーストラリア、カナダ、中国、欧州、香港、イスラエル、日本、ニュージーランドの特許出願が承認されている。これらの特許および係属中の特許出願からの任意の特許は、適用される場合、潜在的な特許期限調整または特許期限延長を含まない2036年に満了する予定である。私たちは、承認された場合、2032年に満了する米国特許番号7,651,835であるOCS心臓に関連する特許の延長を請求した。
2022年12月31日現在、OCS肝臓に関連する私たちの特許の組み合わせは、一般に、インビトロ肝臓灌流のための灌流回路を含むいくつかのシステムのための一連の発行および係属中の特許出願を含む。このような特許はアメリカとオーストラリアで発行され、アメリカ、オーストラリア、カナダ、中国、ヨーロッパ、香港、イスラエル、日本、ニュージーランドで出願を待っています。本特許及び未決特許出願において発行された特許
10
2035年に満了する予定で、適用されれば、潜在的な特許期限調整や特許期限延長は含まれていない。私たちはOCS肝臓に関連する特許の特許期間の延長を請求しており、この特許は米国特許番号10076,112であり、承認された場合、2035年に満了する。
2022年12月31日まで、我々のOCS Solutionsに関連する特許の組み合わせは、通常、いくつかの灌流液のための組成物の一連の特許および特許出願を含む。このような特許は米国,オーストラリア,中国,イスラエル,日本,ニュージーランドで発行され,米国,カナダ,中国,ヨーロッパ,香港,ニュージーランドでの特許出願が承認されている。これらの特許および係属中の特許出願からの任意の特許は、適用される場合、潜在的な特許期限調整または特許期限延長を含まない2032年に満了する予定である。
個別特許の期限は,特許を付与した国の特許法的期限に依存する。米国を含む多くの国では,特許期間は一般に適用国の非臨時特許出願が最初に提出された日から20年である。私たちのいかなる保留出願にも特許が付与されることを保証することはできません。あるいは、特許が発行されれば、これらの特許は十分な範囲または実力を持ち、私たちの技術に意味のある保護を提供することができます。私たちは特許保護の範囲を得ることができるにもかかわらず、競争相手は私たちの特許に含まれていない方法や装置を開発することができる。また,我々が製品を開発している分野には,米国や外国から発行された特許や第三者が所有する特許出願が多く存在する.特許出願は、発行されるのに数年かかる可能性があるので、私たちが知らない出願がある可能性があり、これらの出願は、私たちの既存または未来の製品またはノウハウが侵害されたと告発される可能性のある発行された特許をもたらす可能性がある。
医療機器業界では、特許や他の知的財産権に関する多くの訴訟が発生している。将来的には、私たちに発行または許可された特許を強制的に執行し、私たちの商業秘密またはノウハウを保護し、他人の権利を侵害するクレームを弁護するか、または他人の固有の権利の範囲および有効性を決定するための訴訟を行う必要があるかもしれない。訴訟は費用が高いかもしれないし、他の機能と責任に対する私たちの関心を分散させるかもしれない。訴訟における不利な裁決は、私たちが第三者に重大な責任を負うことを可能にし、第三者にライセンスを求める必要があるかもしれないし、私たちがOCSを製造、販売、または使用することを阻止する可能性があり、これらはいずれも私たちの業務を深刻に損なう可能性がある。
より詳細を知る必要があれば、“第1 A項”を参照されたい。リスク要因−我々の知的財産権に関するリスク“は本年度報告表格10−Kにある。
競争
移植器官保存の競争は2つの主要な部分に分けられる:(1)冷蔵と冷灌流技術;(2)温灌流技術。冷蔵や冷灌流では,器官ともに作用しないか,代謝が活発ではない。これらの冷貯蔵と冷灌流の特徴はドナー臓器の利用を著しく制限し,移植後合併症の主要な駆動因子である。冷蔵と冷灌漑製品の供給は分散しており、多くの会社は主に無差別洗浄と灌流解決方案或いは温度制御冷蔵設備を提供する。
固体臓器移植の熱灌流保存は新興の代替方法であり、冷保存と冷灌流の局限性を解決することを目的としている。熱灌流では臓器機能は正常であり,代謝は活発であった。我々の知る限り,他の2社のみが温熱灌流システム,OrganOx LimitedとXVIVO Perfusion ABを提供しており,両社ともそれぞれ肝臓と肺に単臓器温熱灌流システムを提供している。
私たちの主な競争要因は
11
研究·開発·臨床試験操作
著者らの研究、開発と臨床試験運営機能は専門的な臨床試験チームから構成され、このチームは試験管理、データ収集と生物統計専門知識を持っている。私たちの製品工学機能は電気、機械、システムとソフトウェア工学の専門知識を持つ多学科工学チームから構成されている。私たちの監督機能は、アメリカと国際医療機器規制の専門知識を持つチームを含み、FDA上級監督顧問と外部法律顧問の支持を得ている。2022年,2021年,2020年12月31日現在,我々の研究,開発,臨床試験費用はそれぞれ2,680万ドル,2,230万ドル,1,880万ドルである。
このチームは以下の研究、開発、臨床試験活動に集中している
製造、供給、運営
私たちはマサチューセッツ州アンドーバーの工場でOCSコンソールと使い捨てOCS輸液器を設計して組み立てた。我々は最近,Andover工場における製造施設の規模を拡大し,近い将来FDAの認証を得る予定である。私たちはこの拡大された施設の能力が今後数年間の予測需要を満たすのに十分だと信じている。私たちはすでに既存のクリーンルームに二番目の便を追加して、私たちは新しい、拡大したクリーンルームに追加の便を追加して、生産能力を更に高めることができます。私たちは10,000級クリーンルームで無菌使い捨てOCS輸液器を生産した。我々は、我々の仕様に基づいてこれらのコンポーネントを製造およびテストする必要がある第三者プロバイダからOCSコンソールおよびOCS灌流器の多くのコンポーネントを調達する。私たちは、少数の場合、独占プロバイダから購入する単一ソースのプロバイダからOCSコンソールおよびOCS灌流器のいくつかのコンポーネントを購入する。私たちは第三者が私たちの製品を販売する前の消毒に依存している。
私たちは私たちの独自のレシピを使用して第三者サプライヤーからOCSソリューションを購入する。フィゼンユスは我々のOCS肺および心臓OCS解決策の単一ソース供給者である。著者らはフィゼンユスと締結したOCS肺液供給プロトコルは2022年4月まで予定されており、自動的に24ケ月から2024年4月まで延期した。合意が満了した後、いずれか一方が初期期限またはその時点の延期期限が終了する前に少なくとも12ヶ月前に終了しない限り、プロトコルは継続して延期され、毎回24ヶ月延期される。もし私たちがフィゼンユスに第2の製造工場または信頼性の良い第三者でOCS肺解決策を生産する資格があることを要求し、フィゼンユスがこの要求に答えなかったら、私たちは12ヶ月前に本プロトコルを終了することを通知することもできます。私たちとフィゼンユスとの合意には、本合意に基づいてフィゼンユスに提供されるロール注文予測に基づいて、ある年度最低調達承諾の義務を履行することが含まれています。私たちがフィゼンユスと締結したOCS心臓ソリューション供給プロトコルは1年間の常青期があり、いずれも現在の期限が終了する前に少なくとも12ヶ月前に終了することができる。
私たちの運営チームには生産とテスト従業員、製造エンジニア、現場サービス技術者が含まれています。
12
監督管理
私たちのOCS製品と私たちの運営はFDAとアメリカの他の連邦と州当局、そしてEUと他の国の類似当局によって広く規制されています。
我々の製品は医療機器としてFDAによって実施·施行されている連邦食品,薬物,化粧品法案(FDCA)によって規制されている。FDAは医療機器の開発、設計、非臨床と臨床研究、製造、安全性、有効性、ラベル、包装、貯蔵、設置、サービス、記録保存、発売前の承認或いは承認、不良事件報告、広告、販売促進、マーケティングと流通及び輸出入を監督し、国内流通の医療機器がその期待用途に対して安全かつ有効であることを確保し、その他の方法でFDCAの要求を満たす。
アメリカの法規以外に、私たちはEUと他の国の各種法規の制約を受けています。これらの法規は医療機器、臨床調査、そして私たちの製品の商業販売と流通に関連しています。FDAによる製品の承認または承認を受けなければならないかどうかにかかわらず、臨床試験/調査を開始する前に関連する許可/承認を得、米国以外の国の比較可能な規制機関の下で私たちの製品の必要な許可、承認または認証を得ることが求められ、その後、これらの国で臨床試験/調査を開始したり、私たちの製品を商業化することができます。EUでは、デバイス製造業者は、EUおよび欧州経済地域(EEA)の他の加盟国の市場でのデバイスの販売を可能にするために、基準を満たすヨーロッパマークまたはCEマークを貼らなければならない.,ノルウェーリヒテンシュタインアイスランド)ですEU CEマークもトルコで認められており、イギリスのEU離脱後の過渡期には、イギリスではイギリスの離脱と呼ばれている。
EU以外のデバイスの許可/承認手続きは国によって異なり、必要な時間はFDAの承認またはEU CEフラグの承認または承認に要する時間よりも長いか短い場合がある。
FDA上場前の承認要求
免除が適用されない限り、米国の商業流通の各医療機器は、FDAが510(K)の発売を許可する前に通知し、PMAを承認するか、または最初から分類命令を発行する必要がある。FDCAによると,医療機器は,I,IIまたはIIIの3つに分類され,各医療機器に関連するリスクの程度と,その安全性と有効性を確保するために必要な程度と規制制御に依存する。クラスIは、患者および/またはユーザに対して最もリスクの低いデバイスと、FDAによる医療デバイスの一般的な制御に準拠することによって、その安全性および有効性を合理的に保証することができるデバイスとを含み、これらの制御は、品質システム法規またはQSRの適用部分、施設登録および製品の発売、不良医療イベントおよびデバイス障害の報告、ならびに真および非誤解性のラベル、広告および宣伝材料を含む。第2のタイプのデバイスは、デバイスの安全性および有効性を保証するために、FDAの一般的な制御およびFDAによって必要とされる特別な制御を受ける。これらの特殊な制御は性能標準、発売後のモニタリング、患者登録とFDA指導文書を含むことができる。クラスIデバイスの多くは、510(K)上場前通知要求に制限されないが、クラスIIデバイスの多くの製造業者は、FDCAの510(K)節に従ってFDAに発売前通知を提出し、実質的な等価性決定を要求し、そのデバイスの商業販売を可能にしなければならない。FDAは、510(K)の発売前に通知によって制限された商業販売を可能にするデバイスは、一般に510(K)許可と呼ばれる。510(K)プロセスの下, 製造業者は、1976年5月28日(1976年の“医療機器改正案”が公布された日)前に合法的に発売された装置、またはクラスIIIからクラスIIまたはIに再分類された装置、または510(K)プログラムによって承認されたか、FDCA第513(F)(2)節に基づいて最初の分類プログラムによってマーケティング許可を得た別の商業装置“基本的に同じ”をFDAに提出しなければならない。我々は、2021年7月に肺のためのOCS肺液を冷間洗浄、貯蔵および輸送するための510(K)許可を取得し、2022年11月にOCS肺ドナー洗浄の510(K)許可を取得した。
FDAが最大のリスクを構成すると考えられるデバイス,例えば生命維持,生命維持,多くの埋め込み可能デバイス,あるいは合法的に販売されているクラスIやクラスII述語デバイスと実質的に同等でないことが発見されたデバイスは,クラスIIIに置かれ,PMAの承認を得る必要がある。
13
私たちのすべてのOCS温灌漑製品はクラスIIIデバイスです。以下のようなPMAを受け取った
PMAパス
III類デバイスは承認されたPMAが発売される必要がある。PMAプロセスは510(K)販売前通知プロセスよりも要求が高い.PMAでは,製造者はこの装置が安全かつ有効であることを証明しなければならず,PMAは臨床前研究やヒト臨床試験のデータを含む大量のデータ支援を必要とする。PMAはまた、装置およびその構成要素の完全な記述、製造のための方法、施設および制御のための完全な記述、および提案されたラベルを含む必要がある。FDAが審査申請を受ける場合、それはFDCAに従ってPMAの審査を完了する180日があるが、実際には、FDAの審査は通常1年、さらにはより長い時間を必要とし、PMA申請からFDAへの承認を得る。FDA以外の専門家からなる諮問委員会を招集して申請を審査·評価し、装置の承認についてFDAに提案を提供することができる。FDAは専門家グループの提案を受けるかもしれないし、そうではないかもしれない。さらに、FDAは、通常、QSRに適合することを保証するために、出願人またはその第三者製造業者の1つまたは複数の製造施設を承認前に検査し、場合によっては、その生物学的研究監視計画の一部として、申請者および臨床場所を監査する。
PMA審査中、FDAは、提案されたラベルから装置がその予期される用途に対して安全かつ有効であることを決定することを支援するために、PMA内のデータおよび情報が有効な科学的証拠を構成するかどうかを評価する。FDAは、ラベルの制限、普及、販売および配布、およびPMAをサポートする臨床研究における患者から長期フォローアップデータを収集すること、または承認後に追加の臨床研究を要求することを含む、装置の安全性および有効性を確保するために、承認後条件を有するPMAを承認することができる。FDAは、公衆の健康を保護するか、またはより大きな集団でまたはより長い時間使用中に装置に追加のセキュリティおよび有効性データを提供すると考えられるときに、何らかの形態の発売後監視を条件に、PMAを承認する可能性がある。承認条件を守らないことは承認を撤回することを含む実質的な不利な法執行行動につながる可能性がある。製造施設、方法または品質制御プログラムの変更、またはデバイスの安全性または有効性に影響を与えるような設計または性能仕様の変更、PMA補足材料の提出および承認が必要であることが承認されたデバイスのいくつかの変更。PMAサプリメントは、通常、PMAと同じタイプの情報を提出する必要があるが、サプリメントは、元のPMAがカバーするデバイスの任意の変更をサポートするために必要な情報に限定され、広範な臨床データを必要としない場合があり、または諮問委員会を開催する必要がある。例えば、設計変更が異なる予期される用途、動作モード、および動作技術ベースをもたらす場合、承認されたデバイスの他のいくつかの変更は、新しいPMAを提出および承認する必要がある, あるいは,設計変更がこのように重大であり,次世代デバイスが開発されることになり,オリジナルPMAとともに提出されたデータは,セキュリティや有効性を証明する合理的な保証における変更には適していない.
臨床試験
臨床試験はほとんど常にPMA応用をサポートする必要があり、より多くの適応または上場設備製品の修正バージョンを得るためにPMA補充剤をサポートする必要があるかもしれない。安全性および有効性を決定するためのすべての研究装置の臨床研究は、研究装置のラベルを管理し、研究装置の普及を禁止するFDAの研究装置免除またはIDEに従って行わなければならない
14
設備は、一連の研究審査と承認、インフォームドコンセント、記録保存、報告と研究発起人と研究調査者の監視責任を規定した。FDAの定義によれば、このデバイスは人間の健康に対して“重大なリスク”を構成し、FDAはデバイススポンサーにIDE申請を提出することを要求し、この申請は人体臨床試験を開始する前に発効しなければならない。承認を得るためには、IDEアプリケーションは、動物および実験室テスト結果のような適切なデータサポートを必要とし、人体上のテストデバイスが安全であり、テストプログラムが科学的に合理的であることを示している。FDAがIDEに欠陥または他の修正すべき問題があると判断した場合、FDAは臨床試験を条件付き承認の下で行うことを可能にする可能性がある。IDEの申請を受けてレビューを行うことは、FDAがIDEの発効を可能にする保証はありません。実際に発効した場合、FDAは、試験から取得されたデータが、上場承認または承認をサポートするために、または臨床試験の継続を保証するために、デバイスの安全性および有効性をサポートするかどうかを決定しない可能性があります。スポンサーまたは研究者が研究計画に対してその科学的合理性、研究計画またはヒト被験者の権利、安全または福祉に影響を与える可能性のある変更を行う前に、IDE補充材料はFDAに提出され、FDAの承認を得なければならない。非重大リスク·デバイス研究は、IDE申請をFDAに提出する必要はありません。
アメリカでは、この研究は機関審査委員会(IRB)の承認を得て、その監督の下で行われなければならない。審査委員会は研究の初歩的かつ持続的な審査を担当し、研究の進行に追加的な要求を提出する可能性がある。
研究中、スポンサーは、例えば、試験モニタリング、臨床研究者を選択し、研究計画を提供すること、IRB審査、有害事象報告、記録保存、および研究装置の普及を禁止すること、またはそれのための安全性または有効性宣言を提示することを含むFDAの適用要件を遵守することを要求される。試験開始後、著者ら、FDA或いはIRBは様々な原因でいつでも臨床試験を一時停止或いは中止することができ、研究対象のリスクが予想収益或いは違反方案を超えると考えることを含む。
発売後監督管理
一つの設備が承認されたり、発売されたりした後、多くの一般的な規制要求が引き続き適用される。これらの措置には
15
私たちの製造プロセスは、人間が使用する完成設備の設計、製造、テスト、生産、プロセス、制御、品質保証、ラベル、包装、流通、設置および修理の方法、施設、および制御を含むQSRの適用部分に適合しなければならない。QSRはまた,機器主記録,設備履歴ファイル,苦情ファイルなどの保守が要求される.メーカーとして、私たちの施設、記録、製造過程はFDA定期計画または非計画的検査を受けています。私たちはQSRや他の適用される規制要件を遵守できず、私たちの製造業務が閉鎖されたり、制限されたり、私たちの製品がリコールされたり、差し押さえられたりする可能性があります。我々の任意の製品が、予期せぬ有害事象またはますます深刻化するまたは頻度の高い有害事象を含む以前に未知の問題を発見した場合、医師がその許可範囲内でまたはラベルの外で装置を使用することによるものであっても、製品を市場から除去または自発的または強制的にリコールすることを含む装置の制限をもたらす可能性がある。
FDAは広範囲な規制コンプライアンスと法執行権力を持っている。FDAが適用される規制要件を遵守できないと判断した場合、様々なコンプライアンスまたは法執行行動をとることができ、これは以下のいずれかの処罰をもたらす可能性がある
EUの医療機器の規制
EUでは、私たちの製品は医療機器として規制されている。欧州連合は医療機器の規制を(EU)2017/745またはMDR条例で調整し,この条例は“医療機器指令”(93/42/EEC)の代わりに廃止され,2021年5月26日から施行された。
しかしながら、各加盟国の主管当局は、加盟国で医療機器を提供する関連経済経営者(メーカー、輸入業者、ライセンス代表および流通業者を含む)に対して、MDRに規定されている基準を実行する(MDRには、国の主管当局が他の主管当局、EU委員会、および通知機関に通知することができることが規定されているにもかかわらず)。
“一般安全と性能規定”によると,EU市場で販売されている医療機器は“一般安全と性能規定”添付ファイルに掲げる適用一般安全と性能要求に適合しなければならない。米国の制度と類似しており,医療機器はリスクによってI類,IIa類,IIb類,III類に分類され,その中でI類は最低リスク製品,III類は最高リスク製品を表す。最も基本的なGSPRの1つは,医療機器の設計や製造方式が患者の臨床条件や安全,あるいは使用者や他の人の安全や健康を損なわない必要があることである(利益と比較して構成されるいかなるリスクも受け入れられることが前提である)。さらに、GSPRは、限定される訳ではないが、デバイスは、製造者が予期する性能を達成しなければならず、適切な方法で設計、製造、およびパッケージされなければならず、製造業者は、リスク管理計画を確立、実施、記録、および維持しなければならない。欧州委員会は協調と呼ばれる医療機器に適した様々な基準を採択しました
16
標準です。強制的ではないが,これらの協調的な基準を遵守することは,GSPRの実問題を満たす最も簡単な方式とみなされることが多い.GSPRを実施するために策定された協調基準の遵守にも,この基本的な要求を満たすという覆すことのできる推定が生じている.現在、欧州委員会は比較的限られた数の基準しか統一されていない(例えば、消毒、生物評価、品質管理システム、待って。)しかし、委員会はより多くの基準を統合し続けるだろう。
GSPRに適合することを証明するためには,医療機器メーカーは合格評価プログラムを受けなければならず,このプログラムは医療機器のタイプとその分類によって異なる。適合性評価プログラムは既存の臨床証拠、製品の文献データ及びすでに発売された類似製品に関連する発売後の経験を評価することを要求する。
低リスク機器以外のすべての装置について(即第一の非無菌、非測定設備)であり、合格評価プログラムは機関の介入を通知する必要がある。通知された機関は,製品の技術アーカイブやメーカーの品質システムを監査·審査しなければならない。製品が関連するGSPRに適合していれば,通知機関から合格証明書が発行され,メーカーはそれ自身の合格宣言の根拠とする.次いで、製造業者は、CEマークをデバイスに貼り付けることができ、これにより、デバイスは、EU全体(およびヨーロッパ経済地域に拡張された)の市場で販売することができる。製品がEUに市場に投入されると,メーカーは医療機器に関する事故報告や現場安全是正措置の要求を守らなければならない。通知された機関は継続的な審査権を持ち,設備のすべての重大な変更をその機関に通知しなければならない.
MDRは現在適用されているため,市場に投入されたすべての新機器はMDRでCEとマークされなければならないが,MDRが付与した過渡期には,“医療機器指令”による医療機器通知機関が2021年5月26日まで発行された証明書は証明書に示された時間まで有効であるが,すべての証明書は2024年5月27日に失効する。したがって,これらの設備の設計や期待用途に大きな変化がない限り,医療機器指令証明書が失効する日まで市場投入を継続することができる。
MDRの要求はEU医療機器指示の要求よりはるかに重い。強化された規制には以下の内容が含まれる
我々が以前にEU医療機器命令に従って認証したすべての製品は、OCS心臓およびOCS肺システムを含み、これら2つのシステムは、OCSコンソール、OCS使い捨て製品、およびOCS溶液添加剤、ならびにOCS肝臓コンソールおよび使い捨て製品を含み、現在、MDRに従って認証を再取得した。我々はまたMDRに基づいてOCS肝臓のCEマーカーを申請し、今後12ヶ月以内にCEマーカーと私たちの溶液添加剤を得る予定である。
臨床調査
17
ほとんどの高リスク設備は臨床的証拠を必要とする。場合によっては、デバイスのCEマーカーをサポートするための臨床研究が必要となる場合がある。この装置に関わる臨床研究を希望するメーカーは,MDRの臨床研究要求,EU加盟国の要求および調整基準とガイドライン文書で定義されている現在の良好な臨床実践を遵守しなければならない。倫理委員会の積極的な意見や関係国の規制当局の承認や通知がなければ,医療機器の臨床調査は行うことができない。規制機関と道徳委員会はまた、研究中に深刻な有害事象報告書を提出することを要求し、最終的な研究報告書のコピーを提供することを要求する可能性がある。
発売後要求
EUでは、我々は現在、厳格な上場後義務を遵守することを要求されており、これらの義務は設備市場投入後に適用される。これらの措置には上場後の監視システムと警戒システムを構築する義務が含まれている。これらの要件には、製造業者が市場で提供される設備に関連する任意の深刻な事故を関係国の主管当局に報告しなければならないこと、および市場で提供される装置に関連する、または第三国で行われる市場で提供される装置に関連する任意の現場安全是正行動が含まれる。また,高リスク機器メーカーは定期的にその通知機関に安全更新報告を提出しなければならず,低リスク機器メーカーはその製品技術文書の一部として定期的な安全更新報告書を維持しなければならない。
EU当局はまた、設備会社が実施したマーケティング計画を密接に監視している。MDRは、宣伝製品がその意図された目的に属さないことを示唆するための使用を含む誤った宣言を行うことを禁止する。しかし,会社が履行しなければならない販促材料の発売前承認に関する義務はEU加盟国間で異なるが,この要求に加えて,EUの医療機器の広告と販売促進法は調和していないからである。
移植用途として予定されている臓器の搬送に適した規約
欧州連合では、第2010/53/EU指令は、移植に使用される臓器を調達、保存、輸送する上でEU加盟国が適用すべきいくつかの基準を規定している。私たちはこの指示の直接的な影響を受けていないが、私たちのEUの顧客は影響を受け、私たちの製品は彼らがその指示を遵守するのを助けたり阻害したりするかもしれない。
イギリスの医療機器の規制
医薬品とヘルスケア製品規制機関(MHRA)はイギリスの医療機器市場の規制を担当している。MHRAはイギリス市場の医療機器の市場モニタリングを行い,イギリス機器のマーケティングと供給を決定することができる。MHRAはまた、イギリスが承認した機関(EUから通知された機関に相当)の指定と監督を担当している。
2021年5月26日以降、EU医療機器条例(条例2017/745)またはEU MDRはEU加盟国と北アイルランドに適用されている。また、2022年5月26日から、“体外診断医療機器条例”(条例2017/746)またはEU IVDRはEU加盟国と北アイルランドに適用されている。これらのEU法規はイギリスのEU離脱後に発効し、2018年のEU(離脱)法案が自動的に保持されたEU法ではないため、英国(イングランド、ウェールズ、スコットランド)にも適用されない。
イギリスでは、医療機器は“2002年医療機器条例”(SI 2002年618号、改正)(イギリス“2002年医療機器条例”)によって規制されており、これらの条例はイギリスの法律で次のような指示を施行している(これらの指示は現在廃止され、EUではEUの“医療機器条例”とEUに置き換えられている)
これは、イギリスの市場進出路線が上述したEU立法の要求に基づいているため、欧州連合の市場進出路線とは異なることを意味する。
18
2021年1月1日(イギリス離脱移行期間終了)以来、二次立法により、イギリス(イングランド、ウェールズ、スコットランド)の医療機器の発売方式にいくつかの変化が発生した。これらの措置には
私たちはイギリスでの私たちの設備を担当するイギリスの責任者を任命した。
臨床調査
イギリスMDR 2002の基本的な要求とEU MDRの一般的な安全と性能要求に符合することを証明し、そしてUKCA/CE/CE UKNI標識の応用が合理的であることを証明するために、設備メーカーは時々臨床データを提供してこの装置に対するクレームをサポートする必要がある。これは専門的な設計が必要な臨床調査に関連しているかもしれません
このような調査が必要であれば,メーカーは調査開始前にMHRAに申請しなければならず,MHRAが法定審査期限内に反対理由を提示しない場合にのみ,このような臨床調査を行うことができる。MHRAは複数の専門家審査員の協力を得て決定する。メーカーはMHRAに通知し,MHRAにイギリスMDR 2002に要求された文書を提出する責任がある。臨床研究者は通常MHRAと直接接触しない。
発売後要求
医療機器が英国市場に投入されると,イギリスでその設備に関連する何らかの事件が発生した場合,メーカーはMHRAに警戒報告書の提出を要求される。彼らはまた必要な時に適切な安全行動を取らなければならない。製造業者はまた、彼らの設備が使用中に適切な安全と性能基準に適合することを確実にしなければならない。イギリスでは、医療機器の広告やマーケティングは立法と自律行動規則によって規制されている。
英国MHRAの医療機器規制の施行状況
19
イギリスで市場に投入され使用される医療機器が適用される法規制に適合することを確保するために、MHRAは以下の活動を実施している
MHRAが個人や会社が適用された法規や発表された通知の条件を守らずに深刻な罪を犯したと考えた場合,個人/会社は起訴される可能性がある。
移植しようとする臓器に適用されるイギリスの法律は
改正された“2012年に移植に使用される予定の臓器の品質と安全条例”を通じて、移植に供する器官の品質と安全基準はすでにイギリスの法律になっている。この条例は臓器移植を管理するための主管機関を設立することを許可する。イギリスでは,主管機関は人体組織管理局であり,“臓器移植の質と安全:文書枠組み”を出版し,強制的な要求とこれらの要求をどのように満たすかの指導意見を詳細に説明している。私たちはこの法規やガイドラインの影響を直接受けることはありませんが、私たちのイギリスのお客様は影響を受け、私たちの製品は彼らがこの法規を遵守するのを助けたり阻害したりするかもしれません。
他の国の規制
私たちは多くの国/地域で私たちの製品を販売する時、以下の側面を含む法規と製品登録要求を守らなければなりません
20
外国での承認に要する時間はFDA承認の時間よりも長いか短い可能性があり,外国での製品に対する許可要求はFDAの要求と大きく異なる可能性がある。
監督管理当局は不良事件と潜在的な不良事件を密接に監視する。例えば、製造ミスにより、私たちの製品の効果が添付の使用説明で主張されている基準を満たしていなければ、監督管理部門は私たちの製品の市場投入を阻止することができます。
国際的に、製品の欠陥を解決する方法は違うだろう。製品は一つの国でリコールすることができるが、他の国でリコールすることはできない。
連邦、州、外国の詐欺と乱用と医師の支払い透明法
FDAの薬品と設備のマーケティングと普及の制限に加え、他の連邦、州、国際法、および域外効力と市場慣行を持つ法律も私たちの商業行為を制限している。これらの法律は、詐欺、乱用、および賄賂をもたらす可能性のある活動を禁止または他の方法で規範化することを目的とした米国および外国の法律を含むが、これらに限定されない。
アメリカ法
アメリカ連邦医療詐欺と法律乱用は一般的に私たちの活動に適用されます。私たちの製品は連邦医療計画、例えば連邦医療保険と医療補助のような連邦医療計画に属しています。私たちと私たちの活動に適用される主なアメリカ連邦医療詐欺と乱用法律は、(1)“反リベート法規”を含み、連邦医療計画によって精算可能な業務を生成するために、故意に提供、勧誘、支払い、または受け取ることを禁止し、(2)“連邦援助された医療計画に虚偽または他の不正な支払いクレームを提出することを禁止する”こと、および(3)医療詐欺法規は、任意の第三者支払者に虚偽陳述および不当なクレームを提供することを禁止する。同様の州反リベートや虚偽申告法もあり,州政府助成に関わる医療補助や他の医療計画の活動,個人第三者支払者に適用されている。
“逆リベート規約”はその広範な適用性のため、特に重要な意義を持っている。具体的には、“逆控除条例”は、他人に個人を推薦させるか、または提供、手配、または推薦するために、他人に個人を推薦または誘導するために、直接的または間接的に故意に報酬を請求、提供、提供、または間接的に要求することを禁止し、連邦医療保険および医療補助計画のような連邦医療計画に従って全部または部分的に支払うことができる商品またはサービスを提供する。医療提供者、患者、または顧客との財務的相互作用のほとんどは反リベート法規に関連するだろう。特定の要求が満たされれば、法定例外と規制安全港はいくつかの相互作用を保護することができる。しかし、公平な市場価値取引所を代表する取引だけが一般的に例外または避難港によって保護されている。政府は保護されていない活動に行動する時に法執行自由裁量権を行使することができる。私たちが一般的に参加する多くの相互作用、例えば医療従事者に商業的礼儀を提供することは、反リベート法規に関連する可能性があり、例外や安全港によって保護されていないかもしれない。もし政府がこのような活動が虐待だと認定すれば、私たちは法執行行動の影響を受けるかもしれない。反リベート法規違反の処罰には,監禁などの刑事罰や罰金などの民事制裁が含まれる可能性があり,連邦医療保険,医療補助,他の連邦医療計画から除外される可能性がある。排除は私たちの製品が連邦医療計画によって精算される資格がないということを意味するだろう。
連邦政府と各州も法律と法規を公布し、医療機器と薬品メーカーの販売とマーケティングのやり方を規範化した。これらの法律および法規は、一般に、製造業者と医療保健提供者との間の財務的相互作用を制限する;製薬および医療機器会社は、業界協会によって発表された自発的コンプライアンス基準および米国連邦政府によって公布された関連コンプライアンスガイドラインを遵守することを要求し、および/または、いわゆる“陽光法律”の財務的相互作用を政府および/または公衆に開示することを要求する。
私たちに適用される医療法律と法規は、上記の法律と法規を含み、曖昧な要求を含み、絶えず変化する解釈と法執行の裁量権の制約を受けている。メーカーは合理的な説明をしなければならない
21
曖昧で、このような説明が疑問視される可能性がある場合の要求がある。もし政府当局が私たちが適用された法律や法規を遵守していないと判断した場合、私たちおよび私たちの官僚や従業員は、連邦医療保険または医療補助受益者から除外された製品サプライヤーを含む厳しい刑事および民事経済処罰を受ける可能性がある。清算および医療製品およびサービスに関連する法律法規を遵守しないいかなる行為も、私たちの名声、業務、財務状況、キャッシュフローに悪影響を及ぼす可能性がある。
国際法
多くの外国の国は医療詐欺と乱用に関する似たような法律を持っている。外国の法律法規は国によって異なるかもしれない。例えば、我々の製品の広告および販売促進は、誤解性および比較広告および不公平な商業行為に関するEUの指示、および医療機器広告および販売促進を管理する他のEU加盟国立法を遵守しなければならない。時々、関連規則は、立法で見つけるのではなく、業界指導で見つけることができる--例えば、イギリスの医療専門家との関係は、イギリスの医療業界協会(ABHI)の法規によって管轄されており、規則は、私たちの製品を一般大衆に宣伝し、普及させることを制限し、医療専門家との販売促進活動に制限を加える可能性がある。
欧州連合では、広告·販売促進法を遵守しない結果、名声損害、罰金、公開入札から除外され、不正競争により競争相手に損害賠償を求める訴訟を招く可能性がある。
域外効力を有する法律
私たちが業務を展開している多くの国には、それらが違反されている限り、域外効力を有する法律があります。これらの法律は、それらが違反されている限り、関連国以外の業務に適用されます。このような法律の例としては、“反海外腐敗法”(FCPA)、イギリスの“2010年反賄賂法”、“一般データ保護条例”(GDPR)がある。
これらの法律の域外影響は、多くの国では、医療専門家が国家官僚であるため、私たちの販売とマーケティング戦略に影響を与えている。賄賂犯罪の背景には、これは特に重要であり、イギリスとアメリカでは、これは外国の公職者への賄賂の罪を含む。
データプライバシーとセキュリティ法
我々は現在,将来的には様々な米国連邦,州,外国の法律によって制約される可能性があり,これらの法律はある患者の健康情報(患者の医療記録を含む)の機密性を保護し,医療提供者の患者の健康情報の使用や開示を制限している。
1996年の“健康保険携帯性と責任法案”(HIPAA)は、ある電子医療取引の進行を管理し、特定のエンティティ(カバーエンティティと呼ばれる)に、保護された健康情報(PHI)のプライバシーおよび安全を何らかの方法で処理して保護することを要求する。HIPAAはまた、商業パートナーがカバーエンティティと業務関連プロトコルを締結し、カバーエンティティのPHIを不適切な使用および開示から保護することを要求する。
HIPAAプライバシー規制は、商業パートナーを代表してPHIを作成、受信、維持、または送信する下請け業者を含む保証エンティティおよび商業パートナーがPHIを使用および開示する行為を含む。これらの条例はまた、医療保険の記録を含むいくつかの権利にアクセスまたは修正すること、または医療保険の使用を制限または開示する権利を要求することを含む、実体維持をカバーするその個人健康保険に対して個人が所有する可能性のあるいくつかの権利を規定する。HIPAAセキュリティ条例は、電子的に伝送または電子記憶された保護された健康情報の機密性、完全性、および利用可能性を保護する要求を規定する。“衛生情報技術促進経済と臨床衛生法案”などはある衛生情報安全違反通知要求を規定した。これらの法律により,保証エンティティは通知規則違反の要求に従ってそのPHIが違反された任意の個人に通知しなければならない.我々は現在,HIPAAの直接配下の“保証エンティティ”でも“業務パートナー”でもないと考えているが,実際の業務パートナー合意がない場合でも,事実や状況から業務パートナーシップを推定することができる.さらに、HIPAAは、保証エンティティまたはその事業パートナーの顧客との相互作用に影響を与える可能性がある。
HIPAAプライバシー·セキュリティ条例は、統一された連邦“下限”を確立し、より厳しい州法に代わることもなく、個人の健康や他の個人情報のプライバシーやセキュリティ、アクセスにおいて個人により大きな権利を提供することもない。各国では、金融情報や健康情報を含む個人識別可能な情報のプライバシーやセキュリティがますます管理されている。例えばカリフォルニアの消費者プライバシー法案や
22
CCPAは、収集された個人情報のタイプの開示および消費者の個人情報の削除を要求する権利をカバー会社に要求し、カバー会社がカリフォルニアの消費者にそのデータ処理活動に関する通知を提供すること、および会社が個人情報を販売する能力をカバーすることを要求する制限を含むカリフォルニア住民に特定の権利を与える。これらの保護は2020年にカリフォルニア州プライバシー権法案(CPRA)およびバージニア州、コロラド州、ユタ州、コネチカット州の新しいプライバシー法によって拡大され、2023年に大多数の重要な点で発効する。私たちは未来に消費者のプライバシーを規制するためにもっと多くの連邦と州立法と規制があると予想する。
ヨーロッパ経済地域およびイギリスまたはイギリスでは、イギリスの離脱後、私たちは、アイデンティティ識別または識別可能な生きている個人に関するデータのような、個人データの使用および他の使用に関する法律の制約を受ける可能性がある。イギリスの離脱後、イギリスはEU加盟国である場合と同じプライバシールールを基本的に保持している。私たちは私たちの業務に関連する個人データを処理する。私たちは健康と医療情報を含む従業員と顧客のデータを処理する。欧州経済圏のデータプライバシー制度には、2018年5月25日に施行された個人データ処理およびそのようなデータの自由な移動に関するGDPR、電子プライバシー命令2002/58/EC、およびこれらの命令を実施または補完する国の法律が含まれる。各EU加盟国は、“電子プライバシー指令”に規定されている要求を自分の国家データプライバシー制度に組み入れているため、法律は司法管轄区によって異なり、時には著しく異なる可能性がある。GDPRはイギリスの離脱後にイギリスGDPRとして保持されている。また、多くの欧州経済圏加盟国は、GDPRが加盟国の規制要件の欠陥を許容する分野を立法によって処理しており、GDPRが欧州経済圏全体のための統一的なプライバシー法を制定することを目標としているにもかかわらず、加盟国間の要求が異なることを招いている。イギリスも同じことをした。私たちは私たちが設立したすべての司法管轄区域が規則を遵守することを確実にしなければならない。ヨーロッパ経済地域(またはイギリス)でなくても、私たちはこれらの地域の現地プライバシー法の制約を受けるかもしれない。例えば、欧州経済地域(またはイギリス)に位置する個人に商品またはサービスを提供するか、または欧州経済地域(またはイギリス)に位置する個人の行動を監視することに関連する個人データを処理する場合であっても、GDPR(またはイギリスGDPR)の制約を受ける可能性がある。
GDPRの要求には,GDPRが規定する特定,明確,合法的な目的に応じて個人データしか収集できず,これらの目的と一致した方式でしか処理できないことがある.個人データの処理も,個人データを収集し保護する目的に関連するのではなく,十分な相関が必要である.個人資料の保存時間は収集に要する時間を超えてはならない.私たちが生きている個人に関連する敏感なデータ(例えば、患者の健康または医療情報、または識別目的のための遺伝データまたは生体認証データ、ならびにGDPRに記載されている他のタイプの“特殊カテゴリデータ”)を処理、制御、または他の方法で使用することについては、法的にデータの処理を許可され、欧州経済地域(イギリス)以外に移行することを制限するより厳しいルールが適用される可能性がある。特に、このようなデータを処理するためには、データ当事者(個人データに関連する人)が処理(任意の国境を越えた移動を含む)に明確に同意する必要がある可能性があるが、場合によっては、データ生成または処理の司法管轄区域に基づいて、医療診断、公衆衛生分野の公共利益(医療機器の安全性および有効性を含む)や科学的研究の目的で、明確な同意なしに処理することができる。イギリスGDPRによると、同じ規則は私たちイギリスにも適用される。
GDPRとイギリスGDPRはまた,データ制御者や処理者にそのデータ処理やプライバシーポリシー/通知の記録を保存することを要求する重い責任義務を規定している.これらは、データ制御者に透明性を要求し、プライバシー通知において、彼らの個人情報がどのように使用されるか(簡明、分かりやすく、入手しやすい形態であるが、同時に十分な粒度を有する)をデータ当事者に開示し、情報の保持に制限を加え、仮名技術(すなわち、鍵符号化)データの使用を奨励し、強制的なデータ漏洩通知要求を導入し、データ制御者のためにより高い基準を設定して、特定のデータ処理活動について有効な同意を得たことを証明する。GDPRとイギリスGDPRを守らない罰金は高いかもしれません。GDPRは、EEA加盟国が、遺伝子、生体認識または健康データ(および他の特殊クラスデータ)の処理にさらなる条件を導入することができ、これは、個人データを収集、使用、および共有する能力を制限することができ、またはコンプライアンスコストの増加をもたらし、最終的には私たちの業務に悪影響を及ぼす可能性があると規定している。
EU GDPR(または連合王国GDPR)保護データは、いくつかのステップが取られて適切な保護レベルを確保しない限り、欧州経済地域またはイギリス以外の国(すなわち、欧州委員会(EU GDPRについて保護されていないデータ)または国務大臣(連合王国のGDPR保護データについて)にそれぞれ移行してはならない国に転送されてはならない。実際には、これらの追加的なステップは、一般に、(I)EU標準契約条項(またはイギリス個人データの場合、EU標準契約条項のイギリス付録、または、代わりに、IDTA、すなわちICOの国際データ転送プロトコル)を締結するか、または別のデータ転送機構を確立し、(Ii)転送影響評価を行い、必要に応じてデータを保護するための追加措置を実施することを意味する。このようなデータ転送制限は免除されるが、このような制限は狭く解釈される。
23
2020年7月、EU裁判所は、欧州経済地域(および英国離脱後)から米国に個人データを合法化するためのメカニズムのうちの1つであるEU-米国プライバシー遮蔽フレームワークの無効を発表し、欧州経済地域(およびイギリス)から米国へのデータ移転のより厳しい審査を招き、EU標準契約条項(英国の個人データであればEU標準契約条項の英国付録またはIDTA)の締結と、上記の追加ステップにより、プライバシーデータ立法を遵守するコストが増加する可能性がある。それは.2022年12月、欧州委員会は、EU-米国の個人データの移転に関する十分性決定草案-新しいデータプライバシーの枠組み、またはEU-米国DPFを発表した。EU-米国のDPF制度によれば、EU裁判所でEUプライバシー擁護者の挑戦を受ける可能性があるにもかかわらず、EEAの個人データをEU-米国DPF制度に基づいて自己認証された米国受信者に自由に移行することができる。
私たちが設立した司法管轄区域内で、私たちは現地のデータ保護機関の監督を受けたり、適用された法律の制約を受けたりします。
私たちは第三者に依存して私たちのサービスを提供し、その中の何人かは私たちを代表して個人データを処理する。法的には、GDPR(およびイギリスGDPR)に列挙された最低条項が含まれているこのようなサプライヤーと契約を締結しなければなりません。彼らが私たちの指示だけに基づいて個人資料を処理することを保証し、彼らが十分な技術と組織保安措置を持っていることを保証しなければなりません。個人データがヨーロッパ経済地域(またはイギリス)以外の地域に移動された場合,適用されるデータ出力要求を遵守しなければならない.私たちまたは第三者が適用されるデータ法律を遵守できない場合、安全またはプライバシーが破壊され、規制の強制実行または規制、名声、または財務的損害をもたらす可能性があります。
アメリカの医療改革
米国や一部の外国司法管轄区域は、医療システムを変更するために、いくつかの立法および規制提案を検討または公布しており、その方法は、私たちの製品販売の収益性に影響を与える可能性がある。米国や他の地方の政策立案者や支払者の中では,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上や参入拡大を目指している。より多くの医療改革は新冠肺炎疫病に関連するいくつかの問題の解決を求めている。現在および将来的にヘルスケアをさらに改革したり,医療コストを低減したりする立法提案は,我々の製品の使用に関するプログラムのカバー範囲を制限したり,精算を低減したりする可能性がある。支払者や提供者が実施しているコスト制御措置や,将来実施されるどの医療改革措置の効果も,我々の製品販売の収入に影響を与える可能性がある。
私たちは将来、より多くの州と連邦医療改革措置を取ることが予想され、そのいずれも連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの製品に対する需要の減少や追加の価格設定圧力を招く可能性がある。しかし、いかなる医療改革立法や行動の最終的な内容、時間や効果、あるいはそれが私たちに与える影響を予測することはできず、医療改革はコンプライアンスコストを増加させ、私たちの将来の業務、運営、財務業績に悪影響を及ぼす可能性がある。
人的資本管理
私たちの人的資本戦略は全面的であり、私たちの仕事の実践と協力文化を利用している。2022年12月31日現在、私たちは212人のフルタイム従業員を持っており、ヨーロッパにいる従業員5人を除いて、すべての従業員がアメリカにいます。一部のヨーロッパ人従業員を除いて、私たちの従業員は労働組合代表もなく、集団交渉合意の主体もなく、私たちは従業員との間に強固な関係があると信じています。
私たちの文化は
私たちは従業員がここで自分のキャリアを発展させることを望んでいるように、包容的で魅力的で安全な労働環境を作るように努力している。私たちは様々な参加や職業発展計画を通じて、私たちの使命、ビジョン、価値観の理解を促進し、私たちの従業員と強固な関係を築いています。私たちは四半期ごとにすべての従業員と市役所会議を行い、彼らに問題を提起し、任意の懸念を表現する公開フォーラムを提供し、私たちの会社の目標と将来のビジョンについて意見を提供します。マサチューセッツ州アンドーバーの本社で対面イベントを開催し、世界中から従業員を招待しています。
多様性、公平、そして包容:私たちの多様性戦略の基盤は相互尊重である-私たちはすべての人が私たちの組織で歓迎されて快適であることを願う。私たちの労働力は世界各国からの個人で構成されており、彼らは多くの異なる信仰、言語、背景と文化を代表している。私たちは私たちの多様性が私たちの最大の利点の中の一つだと信じている。私たちはすべての従業員が機会を得るために包括的な職場を作って維持するために努力しています
24
企業の成功に貢献する。この約束は私たちの会社の政策と人的資本管理実践に根付いている。例えば、3日間の個人休暇を提供し、各従業員に休暇時間を提供し、彼らにとって意味のある休暇を遵守するなど、任意の目的に使用する。
健康と安全:私たちは従業員の健康と安全に関する法律法規を遵守し、私たちの運営においてベストプラクティスに従うように努力しています。私たちは、関連従業員が潜在的な健康被害に関連する任意の職責を履行する前に、危険化学品および生物学的危険材料を処理する従業員の訓練などの職場安全訓練を完了しなければならないことを要求する。
人材を誘致し、人材を引き留め、人材を発展させる
私たちは絶えず才能にあふれ、敬業に奉仕する人材を探して私たちのチームに参加して、私たちの未来と移植医学の未来を形作るのを助けます。近年、私たちの募集の重点はずっとNOP及び私たちの工事、製造とサプライチェーン業務のために人材を探すことである。私たちの目標は、適切なスキル、成長心理、職業道徳を持つ人を採用して業務成果を推進し、目標を達成するのを助けることです。
報酬と福祉:私たちはエキサイティングで要求が厳しく、テンポの速い労働環境で競争力のある報酬と福祉を提供します。私たちの従業員福祉には、401(K)退職計画と雇用主マッチング支払い、健康保険(医療、歯科と視力保険を含む)、生命保険、短期·長期障害保険、フィットネス会員精算、毎年15日間の休暇が含まれています。私たちは従業員が株式を広く保有することを促進するために従業員株購入計画を提供する。
職業発展:私たちは従業員の持続的な発展を促進する労働環境を持っていることを誇りに思う。すべての従業員たちは私たちの全体的な会社と財務目標から来た個人的な目標を割り当てられた。また、私たちは従業員と協力して、彼らの役割に応じてカスタマイズされた職業発展計画と一般的かつ的確な訓練コースを提供します。私たちはまた技能発展課程、マネージャー訓練を提供し、マネージャーと非マネージャー人員にその指導技能を発展させる機会を提供する。
会社情報と組織事務
TransMedics Group,Inc.は2018年10月にマサチューセッツ州連邦に登録設立され,我々の初公募株(IPO)を促進した.TransMedics社はTransMedicsグループ会社の運営会社と完全子会社であり、1998年8月にデラウェア州に登録設立された。私たちの主な実行事務所はマサチューセッツ州01810アンドフミントマン路200号にあります。私たちの電話番号は(978552-0900)。
利用可能な情報
私たちのインターネットアドレスはwww.TransMedics.comです。我々のウェブサイトやウェブサイトに含まれている,あるいはサイトを介してアクセス可能な情報は,参照によって本Form 10-K年次報告に組み込まれているとはみなされず,Form 10-K年次報告の一部ともみなされない.我々の10-Kフォーム年次報告、10-Qフォーム四半期報告、8-Kフォーム現在の報告は、証拠物、依頼書、情報声明、および1934年証券取引法(改正証券取引法)第13(A)、14および15(D)節に提出または提出された報告書の修正案を含み、電子的に米国証券取引委員会にアーカイブまたは米国証券取引委員会にこのような材料を提供した後、合理的で実行可能な範囲内でできるだけ早く私たちのサイトの“投資家”によって部分的に無料で取得することができる。また、米国証券取引委員会に提出された文書は、米国証券取引委員会の電子データ収集、分析、検索システムを介して取得することができ、サイトはHttp://www.sec.govそれは.私たちが任意の証券届出文書で下したすべての陳述は、すべての前向きな陳述または情報を含み、その陳述を含む文書の日付で行われ、法律が私たちにそうすることを要求されない限り、私たちはこれらの陳述または文書を更新するいかなる義務も負わない。
25
第1 A項。リスク要因です
私たちの普通株に投資するのは危険がある。私たちの普通株に投資する前に、以下のリスクと本10-K表年次報告に含まれる他のすべての情報をよく考慮しなければなりません。以下に説明する危険は私たちが直面している実質的な危険だと思う。もし実際に以下のいずれかのリスクが発生した場合、私たちの業務、見通し、経営業績と財務状況は重大な影響を受ける可能性があり、私たちの普通株の取引価格は下落する可能性があり、あなたはすべてまたは一部の投資を損失する可能性があります。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務に悪影響を及ぼすかもしれない。本年度報告のForm 10−Kにおける“前向き陳述”を参照されたい。
私たちの財務状況と追加資本需要に関連するリスク
私たちは設立以来大きな損失を被っており、今後も損失を被ることが予想される。
設立以来、私たちは重大な運営損失を受けた。私たちが利益を達成するために十分な収入を作ることができるかどうかは、私たちのOCS製品が商業化に成功するかどうかにかかっている。2022年12月31日、2021年12月31日、2020年12月31日までの年度の収入はそれぞれ9350万ドル、3030万ドル、2560万ドルだったが、これらの年度の純損失はそれぞれ3620万ドル、4420万ドル、2870万ドルだった。2022年12月31日までの累計赤字は4兆787億ドルだった。これまで、私たちの運営資金は主に株式売却の収益、ローンプロトコル下の借金及び臨床試験とOCS製品の商業販売収入から来ている。私たちの損失は主に私たちの研究開発、臨床試験、製造と商業化活動に関連するコストから来て、私たちの国家OCS計画の開発を含む。
予測可能な未来に、私たちがアメリカと一部の非アメリカ市場での私たちの製品の商業販売の増加に集中するにつれて、私たちは引き続き純損失が発生することを予想して、私たちの国のOCS計画を拡大し、私たちのビジネスチームを強化して、彼らは私たちのOCS製品の商業販売を増加させることに力を入れて、私たちの製造業務を拡大する;私たちの次世代OCS製品を研究開発し続ける;そしてアメリカと一部の非アメリカ市場で新しい製品と製品強化の規制許可を求めて、新しい適応を含む。私たちの経営と資本支出の時間と金額は多くの要素に依存するだろう
26
製品開発や商業化に関連する多くのリスクや不確実性のため、費用が増加した時間や金額、あるいはいつ、または利益を達成または維持できるかを正確に予測することはできません。
私たちの既存と未来のどんな債務も私たちの業務運営能力に悪影響を及ぼすかもしれない。
2022年12月31日現在、カナダ帝国商業銀行(CIBC)との信用協定によると、長期債務の未償還元金残高は6000万ドルであり、CIBC信用協定と呼んでいる。私たちは未来にもっと多くの借金を招くかもしれない。カナダ帝国商業銀行の信用協定によると、私たちの支払い義務は運営資本、資本支出、研究開発と一般会社の需要を支払うために使用できる現金を減少させた。また、カナダ帝国商業銀行信用協定項の下の債務は変動金利で利上げされ、市場金利上昇の影響を受けやすい。市場金利が大幅に上昇すれば、私たちはこの債務に追加の利息を支払わなければならなくなり、これは私たちの他の業務需要に利用できる現金をさらに減らすだろう。十分な資金がないかもしれませんし、カナダ帝国商業銀行信用協定によって満期になった金額を支払うために、追加の融資を手配できないかもしれません。あるいは2027年7月に満期になったカナダ帝国商業銀行信用協定によって私たちの債務を再融資することができません。
カナダ帝国商業銀行の信用協定によると、私たちの債務は私たちのすべての資産と私たちの完全所有の重要な付属会社の資産を抵当にします。私たちの資産に付与された保証権益は、私たちが追加債務融資を受ける能力を制限するかもしれない。また、カナダ帝国商業銀行信用協定は、(X)最低流動資金金額の維持を要求し、大きな者に準じて(I)過去4ヶ月間の総合調整EBITDA損失(または収益)(EBITDAがマイナスの場合のみ)および(Ii)1,000万ドル、および(Y)総純収入の維持を少なくともカナダ帝国商業銀行に提出する総収入計画の75%を含む、我々の活動を制約するいくつかの財務業績指標の契約を掲載している。財務契約を含むカナダ帝国商業銀行信用協定中の契約を遵守できなかったことは、私たちがカナダ帝国商業銀行信用協定下の義務の履行を加速させる可能性があり、特定の違約事件が発生した時、これらの義務も加速し、これらの事件は支払い違約、制御権変更、破産、資金不償還、その他の重大な債務下のいくつかの違約、規制承認に関連するいくつかの事件、そして私たちの業務、運営或いはその他の財務状況の重大な不利な変化を含む。違約事件(破産または債務不履行のある事件を除く)が発生しても継続している場合、カナダ帝国商業銀行は、借入金元金の全部または一部に応算と未払い利息を加えて満期と対応とすることを宣言することができる。ある破産または債務返済不能事件が発生すると、借金のすべての未返済元金に応算と未払い利息が自動的に満期になって支払うことになる。このような加速が発生すれば、私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼすだろう。
私たちの未返済債務や将来のいかなる債務にも、私たちの他の財務的義務に加えて、一般経済、業界、市場状況に不利に変化する私たちの脆弱性を増加させる可能性があり、業務や業界の変化に計画または対応する上での私たちの柔軟性を制限し、債務が少ないか債務超過がより良い競争相手を選択することに比べて競争劣勢を構成している。本年度報告のForm 10−Kにおける“項目7.経営陣の財務状況と経営成果の検討と分析−流動性と資本資源である長期債務”を参照。
私たちの財務業績は四半期ごとに変動する可能性があり、これは私たちの業績を予測しにくくし、私たちの業績が期待できないことを招く可能性があります。
多くの要因のため、我々の財務業績は、移植のために使用可能なドナー臓器の利用可能性を含む各四半期間で変動する可能性があり、これは予測不可能であり、OCSを使用して移植センターで行われる移植手術の数、および我が国OCS計画の需要に影響を与える可能性がある。私たちの販売収入は四半期ごとに大きく変動するかもしれません。私たちの今後の四半期と年間支出が収入に占める割合は、私たちが過去に記録したものとは大きく違うかもしれません。私たちの財政的業績は特定の四半期に予想を下回るかもしれない。異なる時期に私たちの財務業績を比較することは意味がないかもしれません。あなたは私たちの未来の業績の指標として私たちの過去の業績に依存してはいけません。臓器移植手術の時間は通常予測できないため、私たちの業務は四半期から四半期までの季節性を経験したことがない。
私たちは純営業損失と研究開発信用の繰り越しを使って将来の課税収入を相殺する能力が制限される可能性があります。
27
2022年12月31日現在、私たちは3.785億ドルの連邦純営業損失の繰り越しがあり、将来の課税収入を相殺することができ、その中で2.095億ドルの純営業損失は2023年からの異なる期日で満期になり、残りの1.69億ドルは満期になっていないが、その用途は年間課税収入の80%に相当する年間減額に限られている。2022年12月31日現在、私たちは3.212億ドルの州純営業損失が繰り越しており、これらの損失は将来の課税収入を相殺し、2030年に開始する異なる日に満期になる可能性がある。2022年12月31日現在、米国連邦と州の研究開発税収控除はそれぞれ900万ドルと550万ドルであり、これは将来の税収負担を相殺するために使用できる可能性がある。私たちのアメリカ連邦研究開発税収控除は2023年に満期になり、私たちの州研究開発税収控除は2024年に満期になり始めた。これらのNOLと税収控除の大部分は満期になって使用されない可能性があり、将来の所得税債務を相殺するためには使用できない。また、一般的に、改正された1986年の国内税法第382条及び383条又は同法典によると、会社は“所有権変更”を経験しており、通常、その持分は3年間で価値変化が50%を超えると定義されており、変更前の純資産、研究·開発信用繰越及び許可されていない利息支出繰越を利用して将来の課税収入を相殺する能力が制限されている。我々の既存のNOLと研究開発信用の繰越は以前の所有権変更による制限を受ける可能性がある。さらに、未来の私たちの株式所有権の変化、その中のいくつかは私たちのコントロール範囲を超えているかもしれません, “規則”第382条による所有権変更につながる可能性がある。州法によると、私たちのNOLと信用もまた被害を受ける可能性がある。これらの理由から、もし私たちが所有権の変更或いは制御権の変更が発生したと確定すれば、私たちはNOL、研究開発信用の繰越或いは2019年前に発生した利息支出の繰り越しを許可しない実質的な部分を利用できないかもしれません。
さらに、私たちがNOLや相殺能力を利用することは、私たちの収益力とアメリカ連邦と州の課税収入にかかっています。上述したように、私たちは設立以来すでに重大な純損失が発生しており、予測可能な未来に私たちは引き続き重大な損失を受けることが予想されている;したがって、私たちは私たちのNOLや信用を利用するために必要なアメリカ連邦や州課税収入が発生するかどうか分からない。減税·雇用法案によると、2017年12月31日以降の納税年度に発生する不良ローンは期限が切れない。また、いずれの課税年度においても、2018年以降に発生する純資産については、純資産の控除額は年間課税収入の80%を超えてはならない。TCJAはまた、企業所得税税率を以前の35%から21%に引き下げた。これは私たちのNOLと他の利用可能な繰延税金資産の潜在的な経済効果を減少させる可能性がある。
私たちは追加的な資金を集める必要があるかもしれないし、これらの資金は優遇的な条件で提供されないかもしれないし、全くできないかもしれない。追加資本を調達することは私たちの株主に希釈されるかもしれない。
私たちの運営資金の一部は当社のOCS製品およびサービスの販売収入から来ていますが、私たちは利益を達成するのに十分な収入が生まれるまで、株式発行、債務融資、戦略連合の組み合わせによって私たちの運営に資金を提供する必要があると予想しています。私たちはまた、市場状況が魅力的だと思うか、あるいはリスク緩和策として、より早くより多くの資金を集めることを選択するかもしれない。私たちが必要な時、追加的な資本がないかもしれないし、私たちの実際の現金需要は予想より大きいかもしれない。もし私たちの業界や市場全体の投資が限られている時、私たちは追加の資本が必要で、もしあれば、私たちは優遇条件で資金を調達できないかもしれない。もし私たちに有利な条項で融資を得ることができない場合、私たちは私たちの開発または商業化活動を大幅に延期、削減、または停止する必要があるかもしれません。私たちの資産の一部または全部を第三者に売却することができるかもしれませんか、または別のエンティティと合併することができますか、または私たちの業務を減少または終了させることができます。いずれもあなたの投資損失の全部または一部を招く可能性があります。
もし私たちが株式または転換可能な証券を発行することでより多くの資金を調達すれば、これらの証券の発行はわが社でのあなたの所有権のパーセンテージを希釈するかもしれません。さらに、新たに発行された証券は、普通株主よりも優先的な権利、特典、または特権を有することができる。もし私たちが追加債務融資を通じてより多くの資金を調達すれば、私たちはそのような債務の元金と利息を支払うために、任意の運営キャッシュフローからかなりの追加資金を出す必要があるかもしれない。どんな債務資金調達の条項もまた私たちの業務に重大な制限を加えるかもしれない。
製品の商業化と発展に関わるリスク
私たちの長期的な成長は私たちが国家OCS計画を通じてOCSに接触する能力を拡大することに依存する。
我々は、ドナーの臓器をOCSに調達するために、移植計画により有効なプロセスを提供する革新的な交鍵解決策である国家OCS計画を開発した。私たちは国家OCS計画がOCSのアクセスと使用を拡大し続けると信じている。しかし、私たちは、適切な外科医の募集および保持に依存し、移植センターおよび地域臓器調達組織との効率的な調整を確立し、維持することに依存する、我が国OCSプログラムを継続的に発展させることに成功しないかもしれない
28
臓器提供者とレシピエントの位置を決定するために。私たちは彼らの能力に対する需要と他の雇用者が提供する競争力のある報酬を含む外科医と他の合格者を募集して維持することができないかもしれない。このような素質の高い従業員を募集して維持するためには、私たちが彼らに支払う補償のレベルを増加させるか、補償の形式や構成を変える必要があるかもしれません。これは私たちの支出を増加させます。
私たち自身の外科と臨床人に加えて、私たちは限られた数のパートナーと構築されたネットワークを利用して、我が国OCS計画を介して臓器検索、臓器保存、および輸送サービスを提供する。これらの関係のいずれかが中断または終了された場合、または1つまたは複数のパートナーが任意の理由でその義務を履行することができないか、または履行したくない場合、国OCS計画による我々の顧客へのサービスは中断される可能性がある。私たちはまた他のパートナーを決定できないかもしれないし、他のパートナーと私たちにとって合理的な条項について交渉することができないかもしれない。私たちの国OCS計画のためにパートナーを中断または交換できなかったかどうかは、私たちの運営および財務業績に否定的な影響を与えるだろう。さらに、我が国OCS計画に参加する顧客にOCS製品を販売することによって生じる費用は、一般に、我が国OCS計画によってうちのOCS製品の販売を増加させることを求めるにつれて、我々の毛金利が低下する可能性がある。我が国OCS計画によって生成される追加費用は、輸送コストおよび燃料コストおよび他の輸送コストの増加を含み、これは、我が国OCS計画を運営することに関連する私たちの費用に影響を与え、これは、私たちの業務、財務状態、経営業績、キャッシュフロー、および将来性に悪影響を及ぼす可能性がある。
私たちは未来に私たちの製造と滅菌能力を向上させる必要があり、私たちの製造施設や他の面で問題に直面するかもしれない。
私たちが期待しているビジネス機会を満たすために十分な数のOCSを生産するためには、Andover工場で拡大したクリーンルームを運営し、第三者が私たちの製品を滅菌することを含む、私たちの製造能力を高め続ける必要があります。材料調達や品質管理や保証など、生産接点の規模を拡大する上で技術的課題に直面する可能性がある。生産量の増加は、現在FDAおよび他の規制機関によって実行されているか、または将来的に米国および他の国/地域に導入される可能性がある品質システム法規や他の適用要件を遵守することを困難にするかもしれない。持続的な商業規模生産も、必要な製造経験と技能を持つより多くの管理·技術者を雇用し、維持していく必要があるだろう。私たちは合格した人員をタイムリーに発見、採用、または維持することができないかもしれない。私たちのOCSの品質を維持するために、私たちの製品に対する顧客の需要を満たす速度で私たちのOCS製品を規模化して生産することができないかもしれません。私たちはOCSの製造規模を拡大することができず、私たちの収入を創出する能力を弱化させ、私たちの製品の市場受容度に悪影響を及ぼすかもしれない。
また、私たちのすべての製造業務はマサチューセッツ州アンドーバーの工場で行われています。この場所のどのような運営が中断されたり、私たちが拡大したクリーンルーム施設の運営遅延は、製品の需要を満たすことができない可能性があります。私たちは、商業的に合理的な条項で保険を購入し、環境健康と安全協定を採用し、コンピュータデータの遠隔地保存を利用することを含むこの施設を保護しようと努力していますが、多くの要素は、私たちの製造設備や私たちのコンポーネントの供給や完成品の在庫を破損したり破壊したりして、私たちの運営が大幅に遅延し、重要な情報が失われ、追加の費用が発生する可能性があります
どんな特定の場合でも、私たちの保険は私たちの損失を含まないかもしれないし、商業的に合理的な条項で保険を提供することができないかもしれません。また、保険加入水準にかかわらず、損失
29
私たちの施設の破壊或いは私たちの適時な製造オーナー立案法団の能力の中断を妨げるいかなることは、私たちの業務、財務状況、経営業績、キャッシュフローと将来性に重大な不利な影響を与える可能性があります。
私たちは第三者サプライヤーに依存して販売前に使い捨てテレビを消毒する。もしサプライヤーが私たちの製品を滅菌できない場合、容量、滅菌材料の利用可能性、監督或いはその他の制限によっても、連邦と州が滅菌過程でエチレンオキシドを使用する規定を含めて、私たちは代替サプライヤーが製品を滅菌することができるまで製品を販売することができないだろう。私たちは、タイムリーまたは費用対効果的な方法で、または代替不妊方法に移行できない可能性があり、これは、私たちの業務および運営結果を損なう可能性があります。
お客様の私たちの製品に対する需要を正確に予測し、私たちの在庫を管理できなければ、私たちの運営結果は実質的な損害を受ける可能性があります。
私たちは、供給中断の影響から私たち自身を保護し、顧客の需要をサポートするために、当社のOCS注入器を含む十分な在庫レベルを維持することを求めていますが、限られた部品、サブアセンブリ、材料、および完成品を手元に保持しています。十分な在庫供給を確保し、サプライヤーとの運営を管理するために、予想される材料需要と私たちの製品の需要を予測して、在庫需要を予測し、これらの予測に基づいてサプライヤーに注文します。私たちの製品に対する需要を正確に予測する能力は多くの要素の負の影響を受ける可能性があり、移植比率、製品のリコール、私たちの商業戦略を正確に管理できなかった、競争相手の製品の発売、顧客の私たちの製品に対する需要の増加或いは減少、私たちは顧客の新製品に対する受け入れ程度、病院容量、人員配置、プログラムと方案の変化、一般市場状況或いは監督事項の意外な変化、及び経済状況或いは消費者の未来の経済状況に対する自信が弱まることを正確に予測できなかった。私たちはまた私たちの国OCS計画を通じて分配するために地域場所で在庫備蓄を維持している。もし私たちがこれらの場所で十分な在庫を維持できない場合、またはOCS製品の地域需要を正確に予測できない場合、私たちは追加のコストを生成し、地域場所間の在庫の再バランスを含めて私たちの地域場所に在庫を輸送し、私たちは予想される商業販売増加を達成できないかもしれない。
お客様のニーズを超える在庫レベルは、一部の在庫が時代遅れや期限切れ、在庫減記やログアウトを招く可能性があります。逆に、私たちの製品に対する顧客の需要や私たち自身の部品、部品、材料に対する需要を過小評価した場合、私たちの製造パートナーとサプライヤーは、私たちの需要を満たすコンポーネント、コンポーネント、材料を提供できない可能性があり、私たちの製造は、新冠肺炎の影響、インフレの全体的な影響、およびサプライヤーの労働力不足の影響を受ける可能性があり、それによって、在庫レベルの不足や顧客への貨物の配送の中断、遅延、またはキャンセルを招く可能性があり、いずれも私たちの名声、顧客関係、業務を損なうことになります。さらに、私たちの製品に含まれるいくつかのコンポーネント、コンポーネント、および材料は、長い注文納期を必要とし、必要な場合、私たちまたは私たちの製造パートナーが受け入れられる条項で追加の供給または材料を得ることができない可能性があり、私たちの製造パートナーおよびサプライヤーは、私たちの増加した需要を満たすために十分な生産能力を割り当てることができない可能性があり、いずれも、私たちの製品および私たちの運営結果の需要を満たす能力に悪影響を及ぼす可能性があります。
我々の目標はOCS輸液器の戦略的リザーブを維持することであるが、もし私たちがこれらのストックを維持できるようにする速度でOCS輸液器を製造および組み立てることができない場合、私たちは私たちの費用および運営結果に影響を与える可能性がある代替戦略に依存してOCS輸液器をタイムリーに渡すことが要求されるであろう。
私たちは事業主立案法団の成功と、それが市場の受け入れを得ることができるかどうかに大きく依存している。もし私たちが事業主立案法団を商業化することに成功できなければ、私たちの業務は失敗するかもしれない。
私たちは私たちのすべての精力と財力をOCSの発展に投入し、教育外科医、移植センター、臓器調達組織、および個人および公共支払者はOCSの利点を理解し、OCSに関連するサービスを提供し、私たちの全国OCS計画を開始する。我々は3つのOCS製品に対するFDAのPMAを受けているにもかかわらず、私たちは、これらの承認された適応のOCSを商業化することに成功することができないかもしれないし、または私たちが計画した時間に、または他の適応または他の司法管轄区域の承認を得ることができないかもしれない。私たちが製品収入を作成し、利益を達成する能力は、主にOCS灌流器およびOCS解決策の販売に依存し、私たちは総称して使い捨てデバイスと呼ばれる。人口統計傾向,ドナー臓器獲得性および移植の終末期臓器不全治療法としての仮定は誤りである可能性が証明された。
われわれは外科医、移植センタープロジェクト主任、臓器調達組織、および個人および公共支払者に引き続き証明する必要があり、OCSは以下の部分またはすべての結果をもたらす可能性があると予想している
30
移植後の臨床結果の改善,臓器提供利用率の向上,潜在ドナー群の拡大,および既存の代替案と比較した看護総コストの低下である。
外科医師、移植センター及び私営と公共部門の支払人は新製品、新技術と新しい治療方法を採用する方面でよく行動が遅く、これらの新製品、新技術と治療方法は追加の前期コストと訓練を必要とするからである。OCSの費用は冷蔵保存の費用を大きく超える。さらに、我々の国際顧客および一部の米国顧客は、直接買収モードを使用し、このようなモードによれば、移植センターは、我が国OCSではなくOCSを使用して、回収および臓器管理のために自分のチームをトレーニングすることを計画している。外科医はOCSを使用したトレーニングを受けたくない可能性があり、OCSが複雑すぎて、適切なトレーニングなしに採用できないと考える可能性があり、OCSを使用しないことを選択する可能性があり、これは直接取得モードにおけるOCSの採用を制限する可能性がある。これらおよび他の要因に基づいて、移植センタープロジェクト主任、臓器調達組織、およびプライベートおよび公的支払者は、OCSの利点がそのコストを超えないことを決定する可能性がある。さらに、OCSを使用することは、OCSを使用してトレーニングされた外科医の数などの要因によって、個別の移植センターで移植する能力によって制限される可能性がある。そのため、所有者立件法団に対する需要は私たちの予想を大幅に下回る可能性があり、これは私たちの業務、財務状況、経営業績、キャッシュフローと将来性に重大な悪影響を与える。
外科医、移植センター、および個人および公共支払者を引き続き教育し、冷蔵または新しい競合技術と比較したOCSの利点を示しなければならない。
移植プロジェクトの担当者は臓器移植に新しい医療設備を採用する重要な意思決定者である。著者らの商業化努力の重要な部分は教育移植センタープロジェクト主任と他の外科医師のOCSに関する相対的な利点である。私たちの成功は効果的なマーケティングと教育プロジェクト主任と他の外科医に大きく依存して、OCSと私たちの国のOCS計画の利点を理解させる。OCSの受け入れはまた、OCSおよび我が国OCS計画の固有の特徴、予期される医療および経済的利益、安全性、使いやすさ、および費用便益を理解させるために、プロジェクト主任、他の外科医、およびプライベートおよび公的支払者をトレーニングすることに依存する。計画担当者、他の外科医、および個人および公的支払者が、私たちが発表した大量の臨床証拠およびデータが納得できると思わない場合、または他の研究を待つことを望む場合、彼らは、私たちの製品および国家OCS計画サービスを使用しないか、または私たちの製品および国家OCS計画サービスに保険および精算を提供することを選択することができる。現在,米国以外の汎用国家医療システムの多くはOCSを用いた費用を移植センターに精算していないが,国際市場の精算には追加の臨床研究が必要である可能性がある。
また,われわれのOCSの移植後の長期効果は不明である。いくつかの外科医、移植センター、および個人および公共支払者は、私たちが提供するより長期的な安全性および有効性データを見ることを望んでいるかもしれない。私たちまたは他の人が未来に生成する可能性のあるいかなるデータも、私たちの既存の臨床研究で観察されたデータと一致することは保証できない。さらに、国家OCS計画がOCSに接触することを拡大することに伴い、移植外科医はますます著者らの臨床専門家と外科医師が提供した臓器に関する臨床データに依存する可能性がある。我々は国家OCS計画に参加した移植外科医に提供された臓器に関する臨床データを担当している。
私たちの長期的な成長は、新しい適応への拡張と私たちの次世代製品の開発を含むOCSプラットフォームを改善する能力に依存する。
私たちのビジネス計画は、より多くの機関に拡張することによって、私たちの次世代製品を開発することを含むOCSプラットフォームを改善し続けることを想定している。このような新しい製品や改装された製品を開発するのは高価で時間がかかり、経営陣の注意を現在の運営からそらす。我々OCSプラットフォームの任意の新製品発表または製品強化機能の成功は、私たちが能力があるかどうかを含むいくつかの要素に依存する
31
もし私たちが私たちの適応を拡大し、私たちの次世代製品を開発することに成功できなければ、私たちの収入を増加させる能力が損なわれる可能性があり、これは私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼすかもしれない。
私たちは私たちの製品を直接マーケティングと販売する上で経験が限られています。もし私たちが私たちの販売インフラを拡大し、顧客の需要を十分に満たすことができなければ、これは私たちの製品の販売と市場受容度にマイナスの影響を与えるかもしれません。利益を達成したり維持したりするのに十分な収入が生じないかもしれません。
私たちはアメリカで私たちの製品を直接マーケティングして販売する経験が限られています。私たちの経営業績は私たちの販売とマーケティングの努力にかかっています。私たちの製品を十分に普及してマーケティングできなければ、私たちの売上は伸びないかもしれません。あるいは大幅に下がるかもしれません。
顧客ニーズを支援する製品経験を持つ販売代表と臨床専門家からなる専門グループからなる販売チームを利用する必要があると考えられる。販売代表とマーケティング人員に対する競争は非常に激しく、私たちは効果的な販売とマーケティングチームを維持するために十分な人員を誘致し、維持することができないかもしれない。もし私たちが顧客の需要を十分に満たすことができなければ、私たちの製品の販売と市場受容度にマイナス影響を与えるかもしれません。利益を達成したり維持したりするのに十分な収入を生むことができないかもしれません。
私たちの未来の成功は私たちが引き続き採用、訓練、維持と激励する能力があるかどうかにかかっており、熟練した外科医師、販売代表と臨床専門家を激励し、そして私たちの販売計画製品が顧客の需要を満たすことを確保する。新入社員は最高生産性を達成するために訓練が必要である。もし私たちが新入社員に対して十分な訓練をしていなければ、もし私たちの販売チームが未来に高い流動率を経験した場合、あるいは私たちの販売計画製品が私たちの顧客の需要を満たすことができなければ、新入社員の仕事効率は私たちの売上を維持または増加させるために必要なレベルに達しないかもしれません。
私たちの収入の大部分は限られた数の顧客に依存しており、これらの顧客の損失や需要の著しい不足は私たちの財務状況や経営業績に実質的な悪影響を及ぼす可能性がある。
私たちの収入の大部分は限られた数の顧客から来ている。2022年12月31日までの1年間、フェニックスメイオ診療所病院の収入は私たちの収入の14%を占めている。しかしながら、顧客または他の任意の顧客は、現在のレベル、価格設定、または私たちの製品を全く使用しない可能性があり、私たちの収入は、経済的条件の変化、他の臓器保存方法(例えば、冷蔵)の使用または損失、私たちの最大顧客とのトラフィックの減少、またはあまり有利ではない条項によって大幅に変動する可能性があります。私たちの将来の成功は、私たちの最大顧客の業務タイミングと業務量、そしてこれらの顧客の財務と運営成功にかかっているだろう。もし私たちが重要な顧客を失ったり、重要な顧客が私たちとの業務量を大幅に減少させれば、私たちの収入は大幅に減少する可能性があり、これは私たちの業務、財務状況、経営業績、キャッシュフロー、見通しに重大な悪影響を及ぼすだろう。
2022年12月31日までの1年間、我が国OCS計画に参加した顧客からの収入は、米国の顧客総収入の約89%を占めている。私たちの成功は私たちが国家OCS計画の機能と効率を維持しながら、容量と能力を増加させる能力に依存するだろう。もし私たちが顧客参加国家OCS計画を介してOCS製品を彼らに渡すことができない場合、私たちの収入は大幅に減少する可能性があり、これは私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼすだろう。
私たちは単一ソースの供給者に依存し、少数の場合、OCSで使用される多くの構成要素を独占的なプロバイダに提供することに依存する。
私たちは単一ソースの供給者に依存し、少数の場合、OCSで使用される多くの構成要素は唯一のソースの供給者に依存する。例えば、Fresenius Kabiオーストリア株式会社およびFresenius Kabi ABは、総称してFreseniusと呼ばれ、それぞれOCS肺およびOCS心臓のOCS解決策の単一ソース供給者である。私たちはいくつかのサプライヤーと製造と供給協定を持っていますが、ほとんどのサプライヤーについては、私たちは
32
必要によります。私たちの供給者たちはいつでもこのような部品の生産を停止したり供給したりすることができる。私たちはその中のいくつかの構成要素を大量に在庫していない。私たちのサプライヤーは自然な行為、私たちがこれらのメーカーと合意した性質、あるいは私たちの顧客としての彼らに対する相対的な重要性、そして私たちのメーカーは将来、彼らが私たちと行っている業務レベルを停止または減少させることを決定するかもしれません。また、これらのサプライヤーが私たちに部品を渡すことができない場合、労働力不足、減速、停止、その他のいかなる理由でも、代替サプライヤーを探すことを要求されます。私たちは、これらのコンポーネントの他のサプライヤーを迅速にまたは完全に決定することができないか、または重大な追加コストを発生させることなく、これらのプロバイダの資格を決定して決定することができない可能性がある。私たちは私たちが似たような条件で遅延なく、さらには完全に遅延なく代替関係を作ることができるという保証はない。
私たちはまた私たち自身のいくつかのコンポーネントの製造プロセスを作ることを選択するかもしれないが、私たちはそうすることは成功しないかもしれない。例えば、私たちが選択して製造したどのコンポーネント設計もFDAの承認を求める必要があり、これらの設計は合理的な時間で承認されないか、または全く承認されないかもしれない。また,我々が設計したコンポーネントは,第三者が製造した類似のコンポーネントと比較して成功しない場合や,機能や経済効果を提供できない可能性がある.もし私たちが自分のOCSコンポーネント製造プロセスを確立することを選択したら、私たちはこれらのプロセスのために追加の原材料を調達する必要があるかもしれないが、これらの原材料は得られないかもしれない。もし私たちがサプライヤーから得た製品の品質にいかなる遅延や欠陥が発生した場合、あるいはサプライヤーを交換しなければならない場合、私たちはまた規制の遅延に直面したり、追加の規制許可や承認を求められたりする可能性がある。さらに、OCSで使用される多くの構成要素は、OCSのために専用に設計されており、これは、既存の構成要素を代替品として提供できない可能性があることを意味する。
必要に応じて、これらの材料または構成要素のための追加または交換のサプライヤー、またはサプライヤーの任意の供給中断は、私たちの製品を生産する能力を制限し、生産遅延およびコスト増加を招き、タイムリーに顧客に製品を渡す能力に悪影響を与える可能性がある。接触網のために十分な数の部品を得ることができず,次世代接触網の発展に悪影響を及ぼす可能性もある。もし私たちがコンポーネントの代替供給源を決定できなければ、代替コンポーネントを使用するために私たちの製品を修正しなければならないかもしれません。これは追加の規制義務を招く可能性があります。これは私たちのマーケティング能力に影響を与え、出荷遅延を招き、設計と製造コストを増加させ、私たちの製品の価格を向上させる可能性があります。このような改装製品はいずれも従来の製品ほど有効ではないか,あるいは市場の受け入れを得られない可能性がある.これはお客様の不満を招き、私たちの名声を損なう可能性があり、私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼす可能性があります。
私たちは第三者が私たちの国のOCS計画のために臓器および医療従事者を輸送することに依存し、限られた獲得可能性または輸送コストの増加は、私たちの国のOCS計画を拡大または運営する能力を制限するかもしれない。
我々のNOPは,ドナー臓器を回収し,臓器を患者に搬送して移植するために,第三者プライベートジェットネットワークを用いて医療従事者を搬送することに依存する。自家用車への依存は,燃料価格の変化,操業停止,天候に関する運営危険に関するリスクを含む様々なリスクの影響を受ける。特に,プライベートジェットは需要量が大きい場合があり,市場状況に応じて価格変動の影響を受ける.しかも、供給はアメリカのプライベートジェットの数が限られていることと合格したパイロットの数が限られているという制限を受けている。したがって、第三者民間航空機提供者たちは私たちのサービスを優先的に使用できないかもしれない。
もし必要な時に私たちのNOPのためにフライトサービスを得ることができなければ、私たちのNOPを利用して需要を満たすことができないかもしれません。私たちはまた代替的で、もっと高いかもしれないフライトサービスを探すことを要求されるかもしれない。これらのフライトコストはNOPコスト構造の大きな部分を占めており、フライトコストはお客様が支払うが、燃料価格の長期的な上昇、飛行機の供給不足、あるいはその他の原因により、フライトサービスコストが大幅に増加し、代替フライトを探して獲得するための追加コストを生成する必要があるかもしれないし、あるいは製品をフライトコストの低い場所やフライトが入手しやすい場所に輸送することで、私たちの在庫を再バランスすることによって、お客様はより高いフライトコストを発生したくないかもしれないため、私たちのサービスと製品があるにもかかわらず、私たちのサービスと製品を使用して臓器を抽出することを放棄する。また、私たちのNOPの能力は私たちが使用できる飛行機とパイロットの数によって制限され、私たちがNOPを拡大し続けるにつれて、私たちはより多くの利用可能な飛行機とパイロットを得る必要があるだろう。
私たちは満足できる製品の価格と利益率を達成したり維持することができないかもしれない。
医療機器メーカーは価格競争の歴史があり、私たちの製品が満足できる価格に達することを保証することができません。あるいは価格を私たちの歴史的に達成したレベルに維持することはできません。支払者がOCS製品の金額のいかなる低下を私たちの顧客に精算することは、顧客が私たちの製品を使用し続けることを困難にし、追加の価格設定圧力をもたらす可能性がある。もし私たちが製品の価格を下げることを余儀なくされたら
33
私たちの毛金利は下がるだろうし、これは私たちの投資と事業を発展させる能力に悪影響を及ぼすだろう。もし私たちが私たちの価格を維持できないなら、あるいは私たちのコストが増加すれば、私たちは私たちの価格上昇でこの成長を相殺することができなくて、私たちの利益率は侵食されるかもしれない。私たちは巨大な価格設定の圧力を受け続けるつもりで、これは私たちの業務と運営結果を損なうかもしれない。
私どもの製品を製造するための部品価格の上昇と供給不足は私どもの業務や経営業績に悪影響を及ぼす可能性があります。
私たちの部品サプライヤーの原材料供給は供給と定価を含めて様々な理由で中断される可能性があります。インフレや労働力不足の普遍的な影響により、顧客への約束を果たす能力に悪影響を及ぼす可能性があるサプライチェーン中断を経験する可能性があります。価格の大幅な上昇は私どもの運営実績や営業利益率に悪影響を及ぼす可能性があります。特に、インフレ、貿易政策の変化、関税と関税の徴収、公衆衛生危機(例えば新冠肺炎の大流行)は、私たちの製品の原材料やコンポーネントの価格や可用性に悪影響を及ぼす可能性がある。私たちは値上げの形で上昇した部品価格を顧客に転嫁できないかもしれないし、私たちがそうする能力は延期されるかもしれない。したがって、私たちの経営業績と財政状況は不利な影響を受けるかもしれない。
もし私たちが効果的に競争できなければ、私たちの業務と経営業績を損なうだろう。
様々な医療機器,製薬,バイオテクノロジー会社が提供する製品,プログラム,療法は臓器移植の需要を制限する可能性がある。このグループの会社は臓器のタイプによって違います。肺気腫や慢性気管支炎を含むCOPDの新しい療法は肺移植への需要を制限する可能性がある。代替製品,プログラム,療法,心室補助装置,心拍管理製品,全人工心臓および心臓·外科手術を含む薬物療法は,心臓移植への需要を制限する可能性がある。肝臓に影響を及ぼす慢性疾患や状況の治療を改善し,人工肝臓を開発する努力は,肝臓移植への需要を制限する可能性がある。臓器移植需要が低下した場合、OCSおよびその構成要素の販売は影響を受けるであろう。
他の会社が開発する可能性のある技術および製品は、患者の予後を改善することができ、またはOCSよりも安全で、使用しやすく、より安価で、または受け入れやすいことができる。これらの製品または技術は、OCSを時代遅れまたは競争力に不足させ、我々OCS製品の需要を減少させる可能性がある。私たちと比べ、多くの代替製品、プログラムと療法の提供者はもっと高い知名度を持っており、研究開発、製造、臨床前テスト、臨床試験を行い、監督管理の許可と許可を獲得し、マーケティングと製品販売の面でより多くの財務資源と専門知識を持っている。規模の小さい会社や他のスタートアップ会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配されている。第三者はまた、合格した医療、工事および管理者を募集し、維持し、臨床試験場と臨床試験の患者登録を確立し、そして私たちの製品や開発計画または私たちの業務に有利な技術補充または必要な技術を獲得する上で私たちと競争する可能性がある。もし私たちが効果的に競争できなければ、私たちの業務と経営業績を損なうだろう。
未来の監督部門の承認を得るために必要な臨床試験過程は長くて高価であり、結果は不確定である。
臨床試験はPMA応用を支援するために必要であり,我々の上場設備製品の修正バージョンを支援する将来のPMA補充剤に必要である可能性もある。臨床試験は複雑で高価な過程であり、長年の時間を要する可能性があり、結果自体も確定していない。次世代OCS製品を開発するため、またはより多くの臓器のためのOCS製品を開発するために、我々は臨床試験に多くの費用および多くの時間を要する可能性があるが、試験製品が試験コストを支払うのに十分な収入を生じるかどうかを決定することはできない。われわれは臨床試験で大きな挫折を経験する可能性があり,早期の臨床試験が有望な結果を示した後でも,臨床試験中のいつでも失敗する可能性がある。私たちのいかなる製品も故障或いは不良影響を与える可能性があり、私たち或いは監督管理機関の中断、延期或いは臨床試験の停止を招く可能性がある。私たち、FDA、または他の規制機関は臨床試験を一時停止または中止することができる。
早期研究の成功結果はその後の臨床試験で積極的な結果を得ることが保証されていない。我々が前臨床研究および臨床試験から収集したデータは、FDAまたは他の規制部門の承認または承認を支持するのに十分ではないかもしれない。しかも、FDAは私たちの研究と実験データの説明に同意しないかもしれない。FDAは,臨床試験の設計,進行,あるいは結果が安全性や有効性を証明するのに不十分であると結論する可能性があり,FDAは高価で長い追加試験を要求する可能性があり,製品の承認や承認を遅らせる可能性がある。
34
臨床試験は通常大量の被験者を登録する必要があり、これらの被験者は臨床試験の参加者として確定、募集、維持することが困難かもしれない。我々PMAが承認した条件の1つとして,上場後の検討が求められている.例えば、OCS肺胸部臓器灌流登録(TOP)、OCS心臓灌流登録(OHP)、およびOCS肝臓灌流登録(OLP)を含む3つの臓器製品の承認後登録が行われている。
承認後の研究における不利な結果は、PMAの承認が撤回されるか、または承認が制限される可能性がある。私たちは新しい臓器におけるOCSの使用およびOCS製品の開発を支援し、より多くの外国司法管轄区域で私たちの製品を商業化することができるように、より多くの臨床研究を行う必要があるだろう。臓器移植の臨床試験は設計·実施が困難であり,多大な時間と高価な費用が必要である。臨床試験の結果は本質的に不確実である。どんな研究の開始と完了も様々な理由で阻止され、延期され、停止される可能性がある。以下の状況は、任意の臨床試験のコスト、時間、または成功達成に悪影響を及ぼす可能性がある
35
失敗は臨床試験のどの段階でも起こる可能性がある。例えば、私たちの臨床研究は否定的または不確実な結果をもたらす可能性があり、将来的には、私たちが計画しているテスト以外の臨床試験および非臨床試験を決定または監督機関に要求する可能性があるかもしれない。我々がOCS肺およびOCS心臓のPMA申請を提出した後、FDAは、この機関の正常な審査プロセスの一部として、いくつかの追加の臨床分析、技術情報、および明確化を要求する。FDAは最終的にこの2つのPMAを承認した。FDAは、将来のPMA出願を支援するために、より多くの臨床試験を行うか、またはより多くの証拠を提出することを要求することができる。私たちが将来開発する可能性のある任意の製品の安全性と有効性を十分に証明できなければ、規制部門の承認や承認を得て、最終的にその製品や使用指示の商業化を阻止するだろう。私たちの将来の製品がアメリカで承認されたり承認されたりしても、私たちの製品の外国での商業化は、これらの国家規制機関のマーケティング許可を得る必要があります。許可許可手続きは司法管轄区域によって異なり、追加の臨床前研究または臨床試験を含む米国とは異なるまたはそれ以上の要求および行政審査期間に関連する可能性がある。これらのすべての事件は、私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼす可能性がある。
私たちの運営や業務に関するリスク
道徳的で包容的な企業文化を維持できなかったり、私たちの名声を損なうことは、私たちの業務に実質的な悪影響を及ぼす可能性があります。
私たちは、私たちの従業員が誠実に行動し、お互いを尊重し、不当な疑いを通報する権利があると考える文化を作るために努力している。私たちが高素質の従業員を誘致し、維持する能力は、多元化と包容性環境に対する私たちの約束、そして私たちが感知する信頼性と道徳的操作にかかっている。職場での嫌がらせや差別、規制が規定されていない、データおよびシステムを正しく使用して保護できなかった、私たちの従業員政策に違反し、規制機関または他の人がそのような行為に対する行動など、雇用に関連する違法行為を含む問題が発生する可能性がある。不当な行為を解決する疑いは商業運営に対する人々の関心を分散させ、費用が高い。私たちは法律法規の遵守を促進する政策を制定し、すべての従業員に従業員を尊重する職場を作った。これらの政策には、商業行為と道徳的規則、インサイダー取引政策、FD政策、セクハラ政策、規制された博愛政策と告発者政策が含まれており、私たちは従業員の不正行為および常に不正行為疑惑を招く活動を最小限にしようと努力している努力の構成要素であるが、私たちの従業員はこれらの政策を遵守できないかもしれない。私たちの名声を損なう以外に、実際または告発された不正行為は、私たちの株主、監督機関、および他の当事者の信頼に影響を与え、私たちの業務、財務状況、経営業績に重大な悪影響を及ぼす可能性があります。
私たちの情報技術インフラをネットワークベースの攻撃、ネットワークセキュリティホール、データ破損から保護できなかったことは、私たちの運営を深刻に乱し、私たちの業務や運営業績に悪影響を及ぼす可能性があります。
私たちの業務が効果的に機能するかどうかは、私たちの情報技術システムにかかっている。私たちは私たちの情報技術システムによって販売とマーケティングデータ、会計と財務機能、在庫管理、製品開発任務、臨床データ、ドナーと患者データ、顧客サービスと技術支持機能を有効に管理する。私たちの情報技術システムは、地震、火災、洪水およびその他の自然災害、テロ、ネットワーク攻撃、コンピュータウイルスまたはハッカー攻撃、停電、コンピュータシステムまたはデータネットワークの故障、セキュリティホールおよびデータ破損の破壊または妨害を受けやすい。私たちまたは私たちのサービスプロバイダの情報技術の故障は、私たちの運営全体を混乱させたり、売上の低下、管理コストの増加、製品不足を招く可能性があります。これらはすべて、私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼす可能性があります。さらに、我々のソフトウェアシステムは、第三者サービスプロバイダによってホストされ、セキュリティおよび情報技術システムも同様のリスクに直面するクラウドベースのアプリケーションを含む。
ネットワーク脅威構造の変化に伴い、攻撃の頻度、複雑性、強度は増加しており、検出が困難になってきている。我々の情報システムは、コンピュータウイルス、恐喝ソフトウェアおよびネットワーク釣り攻撃、およびより複雑で的確なネットワーク関連攻撃、ならびに人為的エラーおよび技術エラーによるネットワークセキュリティ障害、私たちのシステムおよび私たちの顧客、業務パートナーおよびサプライヤーに対するシステムのセキュリティ、および私たちが処理するデータのセキュリティ、可用性および完全性がリスクを構成する新たで拡大された脅威に直面している。また他にも
36
ネットワークセキュリティが直面する多くと絶えず変化するリスクは、犯罪ハッカー、ハッカー活動家、国家支持の侵入、工業スパイ活動、従業員汚職及び人為或いは技術誤りを含む。
また、プライバシーおよびセキュリティ法律、法規、またはお客様の強要によって制御される敏感な、機密または個人データまたは情報にアクセスすることができます。我々は、我々のシステムおよび敏感な、機密または個人データまたは情報を保護するための制御措置を実施しているが、私たちは、敏感、機密または個人データまたは情報の漏洩を引き起こす可能性がある、重大なセキュリティホール、盗難、位置ずれ、紛失または破損したデータ、従業員のエラーおよび/または不正行為(離職従業員の流用を含む)の影響を受けやすい可能性がある。
従業員訓練や保護システムの維持を含むいくつかの措置をとることで、これらのリスクを低減しようとしているが、これらの措置はネットワーク攻撃を防止するのに十分ではない可能性があり、他の既知または未知の脅威の影響を受けやすい可能性があることが証明されている。このような脅威の影響は実質的かもしれない。重大なネットワークセキュリティ事件は、収入損失を含む一連の潜在的な実質的な負の結果をもたらす可能性がある;不正アクセス、開示、修正、誤用、紛失または会社システムまたはデータの破壊、個人識別情報または私たちの知的財産権のような敏感、規制されたまたは機密データの盗難、恐喝ソフトウェア、サービス拒否または他の攻撃によってキーシステムの機能を喪失させる;業務遅延、サービスまたはシステム中断、設備損傷および人員または財産傷害、および保険料の増加。事件の防止、準備、対応と救済のコストと業務結果は巨大である可能性がある。さらに、私たちは事件のために訴訟、規制法執行、または他の法的行動に直面する可能性があり、損害賠償、罰金、制裁または他の処罰、および費用の高いコンプライアンス措置を必要とする禁止救済をもたらす可能性がある。サイバーセキュリティ事件はまた私たちのブランドに影響を与え、私たちの名声を損なう可能性があり、私たちと顧客、従業員、株主との関係に悪影響を及ぼす可能性がある。
海外業務に関連する経済、政治、その他のリスクは、私たちの国際販売や私たちの業務結果に悪影響を及ぼす可能性があります。
私たちはヨーロッパ、アジア太平洋地域、中央アジア、カナダの国家でOCSをマーケティングし、他の国際市場でそれをマーケティングすることを計画しているため、私たちは国際業務の展開に関連するリスクに直面している。2022年、2021年、2020年12月31日までの年間で、それぞれ10%、28%、25%の収入が米国以外の顧客から来ています。私たちは国際販売が私たちの総売上の重要な部分を占め続けると予想している。しかも、私たちの何人かの従業員と供給者たちはアメリカの外に位置している。私たちの運営結果は様々な要素の影響を受けるかもしれません
37
私たちは輸送サプライヤーに依存して世界の顧客に製品を渡す。労働者、関税または世界貿易機関に関連する紛争、海賊行為、悪天候またはテロ事件が輸送施設や設備に与える有形損害、輸送施設の渋滞、積載、寄港、オフロード、私たちの製品の設備不足、エネルギー関連の協力、または他の要因は、国内および国際での私たちの製品の輸送またはアンロードを混乱または遅延させる可能性がある。このような中断や遅延は、私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しに実質的な悪影響を及ぼす可能性があります。
これらのリスクのうちの1つまたは複数が実現されれば、私たちの業務、財務状況、経営業績、キャッシュフロー、および見通しは実質的な悪影響を受ける可能性がある。
私たちの成功は私たちが創始者、総裁、最高経営責任者とその他の管理チームのメンバーを維持し、合格した人材を誘致、維持、激励する能力にかかっている。
私たちの成功は高い素質の臨床医師、外科医、科学者、エンジニア、マネージャーと販売員を持続的に吸引、維持、激励する能力にかかっている。私たちの創始者で最高経営責任者兼最高経営責任者のワリッド·H·カザニイン博士と私たちの管理チームの他のメンバーは私たちの業務の成功および私たちのOCSの開発と商業化の努力が非常に重要です。これらすべての重要な従業員は、Hassane in博士を含め、任意の従業員であり、いつでも私たちとの雇用関係を打ち切ることができる。私たちの管理チームの重要なメンバー、特にカザニアン博士を失ったことは、私たちの研究、開発、商業化目標の実現を阻害する可能性がある。私たちはHassane in博士の生命のために100万ドルの“キーパーソン”保険リストを維持していますが、私たちは他の従業員のためにこの保険を維持しません。
また、私たちの予想成長は、臨床開発、監督、販売、マーケティング、工学、科学、臨床支援、管理者を含む多くの合格者を雇用することを要求するだろう。私たちの活動分野では、他社や研究や学術機関から合格者の激しい競争があります。もし私たちが受け入れ可能な条件で業務の持続的な発展に必要な合格者を引き付け、維持することができなければ、私たちは私たちの運営を維持したり、利益を達成することができないかもしれない。
もし私たちの成長を効果的に管理できなければ、私たちの業務を損なうかもしれない。
私たちが期待している将来の成長を効果的に管理するためには、私たちの製造·消毒能力、情報技術インフラ、金融·会計システムと制御を強化しなければならない。私たちの成長は大量の資本支出を必要とし、例えば、より多くの適応または他の臓器に関連する移植のためのOCSの開発など、他のプロジェクトから財政資源を移転することができるだろう。私たちの国のOCS計画は革新的な鍵解決策であり、アウトソーシング臓器検索とOCS器官管理を提供し、追加の資本支出も必要となる。もし私たちが私たちの成長を効果的に管理できなければ、私たちの費用は予想よりも多くなるかもしれません。私たちの収入の増加は予想より遅くなるかもしれません。私たちは私たちの研究開発と商業化目標を達成できないかもしれません。これは逆に私たちの業務、財務状況、経営業績、キャッシュフロー、見通しに実質的な悪影響を及ぼす可能性があります。
もし私たちが買収、合弁、戦略投資を求めれば、このような取引は私たちを追加的なリスクに直面させるかもしれない。
私たちは、買収、合弁企業、戦略投資機会を検討して、私たちの現在の製品供給を拡大し、私たちの業務の規模と地理的範囲を拡大したり、他の方法で成長と運営効率の機会を提供したりすることができる。私たちが適切な候補者を見つけたり、有利な条件でこのような取引を終わらせることができるという保証はない。必要であれば、これらの取引の融資は私たちの債務増加を招き、私たちの株主の利益を希釈するか、または両方をもたらす可能性がある。いくつかの買収または合弁企業権益の買収価格には、将来現金で支払われる追加金額が含まれる可能性があり、その一部は、買収された事業の将来のいくつかの経営業績の実現状況に依存する可能性がある。このような買収された業務または合弁企業の業績がこのような経営結果を超える場合、追加料金が発生し、追加金額の支払いが要求される可能性があります。
38
私たちは、買収された業務の統合またはそのような業務の長期計画の達成に成功しなかったこと、および私たちの買収や投資活動に関連するいかなる他の不利な結果も、私たちの業務に悪影響を及ぼす可能性があります。 いかなる買収も私たちが行っている業務を混乱させ、資源を移転し、私たちの費用を増加させ、私たちの経営陣の私たちが行っている運営に対する関心を分散させる可能性がある。
持続的な新冠肺炎疫病は著者らの業務、財務状況、経営業績、キャッシュフローと将来性に影響を与える。
新型コロナウイルスの伝播を抑制する努力を含む新冠肺炎の大流行は、すでに著者らの業務、財務状況、経営業績とキャッシュフローに影響を与える可能性があり、新変種或いは感染率急増の影響を含む。新冠肺炎がすでにおよび将来私たちの業務に与える可能性のある影響は、移植手術の全体的な頻度の低下、私たちの製造運営とサプライチェーンの中断、労働力の不足、生産性の低下および材料またはコンポーネントの利用できないこと、私たちの従業員と顧客の旅行能力が制限されていること、および製品の設置、訓練、または出荷が他の影響を受けている国とアメリカ国内を往復する遅延を含む。
私たちは私たちのOCS製品が使用した完成品と原材料を在庫していますが、疫病がさらに延長されると、私たちの製品を製造するために必要な原材料が不足する可能性があります。新冠肺炎が私たちの第三者パートナーの運営に与える影響の程度は未来の発展に依存し、これらの発展は高度な不確定性を持っており、自信に満ちて予測できない。もし私たちの製造、サプライチェーン、または商業運営が長期的に中断されれば、私たちの業務、財務状況、運営結果、見通しに実質的な悪影響を及ぼすことが予想される。
私たちの知的財産権に関するリスクは
もし私たちが第三者の知的財産権を侵害したり、他の方法で私たちの知的財産権に関する訴訟や他の訴訟を受けたりすると、私たちの業務や競争地位は悪影響を受ける可能性がある。
私たちのビジネス成功は、他人の特許または他の知的財産権または独自の権利を侵害しない、流用するか、または他の方法で侵害するかにある程度依存するだろう。特許と他の知的財産権に関する重大な訴訟は医療機器産業で発生した。サードパーティは、OCSまたはOCSの態様を主張するか、または米国および海外でライセンスまたは他の権利を保有していない我々の知的財産権を侵害すると主張する可能性がある。米国および海外の第三者は、特許を出願または取得したか、または将来出願して特許を取得する可能性があり、これらの特許は、我々の製品を製造、使用、および販売する能力を阻止、制限、または他の方法で妨害するであろう。
私たちの技術分野に大量の特許があることを考慮して、私たちは私たちが既存の特許を侵害していないか、あるいは私たちが将来付与される可能性のある特許を侵害しないかを確認することができない。例えば、米国および他の場所の特許出願は、発表前に長年待つことができるか、または無意識に放棄された特許または出願が再起動される可能性があるため、承認または最近再起動を待っている他の特許出願が存在する可能性があり、これらの出願を知らない。これらの出願は、発行された特許、または以前に放棄された特許の復興をもたらす可能性があり、これは、私たちの製品を製造、使用、または販売する能力を阻止、制限、または他の方法で妨害するだろう。将来、第三者は、競争相手または非執行実体からのクレームを含む彼らの独自技術を不正に使用することを主張するかもしれませんが、これらのクレームは関連する製品収入がなく、私たち自身の特許の組み合わせは彼らに抑止力がないかもしれません。私たちが現在または更新された形で私たちの製品を商業化し、新製品を発売して新市場に進出するにつれて、競争相手は私たちの1つ以上の製品が彼らの知的財産権を侵害していると主張するかもしれません。これは、私たちの商業化と新市場への進出を阻害するためのビジネス戦略の一部です。特許数が多く,新特許出願や発行速度が速く,関連する技術が複雑であり,訴訟の不確実性が企業資源や管理層の関心が特許訴訟に移行するリスクを増加させる可能性がある。
我々に対していかなる第三者特許を主張すれば,このような主張に法的根拠がないと考えても,裁判所が侵害,有効性,実行可能性あるいは優先権の問題で我々に有利な裁決を下すことは保証されない.管轄権のある裁判所は、主張する第三者特許が有効で、強制的に実行可能であり、侵害されていると判断する可能性があり、これは私たちの製品商業化能力に実質的な悪影響を及ぼす可能性がある。連邦裁判所でいかなる米国特許の有効性にも挑戦することに成功するためには、有効性推定を克服する必要がある。この負担が重いため,このような米国特許主張の無効について明確で納得できる証拠を提出することが求められているため,管轄権のある裁判所がこのような米国特許の主張の無効を宣言する保証はない.私たちは選択することができます、あるいは、もし私たちが第三者の特許権を侵害していることが発見された場合、私たちはこのような特許が無効または強制的に実行できないことを成功的に証明できなかった場合、私たちは要求されるかもしれません
39
このような第三者の許可を得て、私たちの任意の製品を開発、製造、販売し続けます。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。私たちが許可を得ることができても、それは非排他的である可能性があり、私たちの競争相手や他の第三者が私たちに許可された同じ技術にアクセスできるようにするためには、大量の許可と印税を支払う必要があるかもしれない。私たちはまた、裁判所の命令によって、権利侵害技術や製品の開発、製造、商業化を中止することを余儀なくされる可能性がある。さらに、私たちが特許や他の知的財産権を故意に侵害していることが発見された場合、私たちは3倍の損害賠償と弁護士費を含む重大な金銭損害に責任があると判断される可能性がある。聴聞結果、動議、または他の一時的な事態が発表される可能性もある。もし証券アナリストや投資家がこれらの結果がマイナスだと思っていれば、私たち普通株の株価に実質的な悪影響を及ぼす可能性がある。第三者の機密情報や商業秘密を盗用したと主張することは、当社の業務、財務状況、運営結果、見通しに類似した重大な悪影響を及ぼす可能性があります。
私たちの業界は、特許および他の知的財産権に関連する大量の訴訟および他の訴訟を経験しており、私たちの特許および他の知的財産権を保護または実行する訴訟は、高価で、時間がかかり、成功しない可能性がある。
私たちに対する侵害クレームに加えて、私たちはまた、米国特許商標局(USPTO)が発表したライセンス後訴訟、およびOCS知的財産権に関する欧州特許庁の反対訴訟を含む他のタイプの特許訴訟および他の訴訟に参加することができる。例えば、私たちは、第3の方向の米国特許商標局が提出した既存技術の事前発行を受けたり、ライセンス後の審査手続き、異議、派生、再審に参加したりすることができる各方面間米国又は他の場所で我々の特許権又は他の者の特許権の審査又は介入手続に挑戦する。このような任意の挑戦において不利な裁決を下すことは、排他性喪失または特許主張の全部または部分的な縮小、無効または実行不能を招き、それにより、他人が類似または同じ技術および製品を使用することを阻止したり、それを商業化する能力を制限したり、私たちの技術および製品の特許保護期間を制限したりする可能性がある。私たちにとって、いかなる特許訴訟や他の手続きのコストも、解決が私たちに有利であっても、巨大である可能性がある。私たちのいくつかの競争相手は、彼らがより多くの財政資源を持っているので、私たちよりもこのような訴訟や訴訟の費用を効率的に負担するかもしれない。特許訴訟または他の訴訟の開始および継続によって生じる不確実性は、私たちの競争能力に重大な悪影響を及ぼす可能性がある。特許訴訟と他の訴訟もまた多くの管理時間を取るかもしれない。
さらに、競争相手および他の第三者は、私たちの特許および他の知的財産権を侵害、流用、または他の方法で侵害する可能性がある。権利侵害や不正使用に対抗するために、費用がかかり、時間がかかる可能性があり、私たちの経営陣の時間と注意力を分散させる権利侵害請求を要求される可能性があります。しかも、このような訴訟手続きで、私たちの多くの相手は私たちよりも多くの資源を投入してこのような法的行動を起訴する能力があるかもしれない。
裁判所は私たちの告発に同意しないかもしれないし、私たちの特許に問題のある第三者技術が含まれていないことを理由に、他方の論争のある技術の使用を阻止することを拒否するかもしれない。さらに、もう一方は、私たちが彼らの知的財産権を侵害したことを反訴したり、彼らが主張している特許に対して私たちが主張している特許を無効または実行できない、または両方を反訴することができる。米国の特許訴訟では,主張された特許の有効性,実行可能性,あるいは範囲を疑問視する反訴が日常的である。同様に、第三者は私たちのいくつかの知的財産権が侵害されていない、無効で、または強制的に執行できないことを宣言するために、私たちに法的訴訟を提起するかもしれない。このような訴訟の結果は一般的に予測できない。
どんな訴訟手続きの不利な結果も、私たちの1つ以上の特許を無効または狭義に解釈されるリスクに直面させる可能性がある。もし被告が勝訴した場合、私たちのある製品の特許は無効または強制執行できないと考え、私たちはその製品の少なくとも一部またはすべての特許保護を失うだろう。競合製品はまた、私たちの特許カバー範囲に存在しないか、または同様に強力な他の国/地域で販売される可能性がある。このような結果のいずれも私たちの業務に実質的な悪影響を及ぼすだろう。
知的財産権訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報は訴訟中の開示によって漏洩される可能性がある。聴聞結果、動議、または他の一時的な事態が発表される可能性もある。もし証券アナリストや投資家がこれらの結果がマイナスだと思っていれば、私たち普通株の株価に実質的な悪影響を及ぼす可能性がある。たとえ私たちが最終的に勝訴しても、裁判所はこれ以上の侵害活動に禁止令を発行せず、金銭賠償のみを決定する可能性があり、これは十分な救済措置ではないかもしれない。しかも、このような訴訟の金銭的コストと私たちの経営陣の注意力の移転は、私たちが訴訟から得たどんなメリットをも超えるかもしれない。特許訴訟または他の訴訟の開始と継続によって生じる不確実性は、私たちの業務に重大な悪影響を及ぼす可能性がある。
40
私たちが所有者立案法団に関する知的財産権を確立、維持または十分に保護できなければ、所有者立案法団の商業価値が影響を受け、私たちの競争地位も損なわれる。
私たちの成功と競争能力は、私たちが米国や他の国で所有者立案法委員会をカバーする知的財産権を設立し、維持する能力があるかどうかにある程度かかっている。我々は、米国において複数の特許及び特許出願の独占ライセンスを所有又は所有し、複数の外国司法管轄区において対応する特許及び特許出願を所有又は所有している。私たちが持っている特許および特許出願については、必要なすべての費用が支払われていると仮定して、私たちが現在発行または処理している特許出願ですでに発行されているか、または発行可能な任意の特許は、2025年から2036年の間に満了する予定である。
しかしながら、私たちは、私たちの任意の特許がすでに発行されているか、または私たちの任意の係属中の特許出願が発行された特許として成熟していることを保証することはできず、我々を保護するのに十分な範囲のOCS技術、我々のOCS技術のために開発された任意の追加機能、または任意の新製品を有するクレームを含むであろう。他の当事者は、私たちのシステムに関連しているか、または私たちのシステムと競合する可能性のある技術を開発している可能性があり、特許出願が提出されているか、または提出されている可能性があり、同じ方法または装置を要求することによっても、私たちの特許地位を支配する可能性のある標的を要求することによって、私たちの特許出願と重複または衝突した特許を受信している可能性がある。医療機器会社の特許地位は,我々の特許地位を含め,複雑な法律や事実問題に関与している可能性があるため,我々が獲得可能な任意の特許主張の範囲,有効性,実行可能性は確実に予測できない。私たちの未解決および未来の特許出願は、特許の形態で発表されないかもしれないし、または、発行されれば、私たちに有利な形で発表されないかもしれない。私たちの特許が発行されても、私たちの特許は、挑戦、縮小、実行不可能、無効または回避される可能性があり、または他の人は、私たちの特許および特許出願の発明権、所有権、または実行可能性に挑戦する可能性があり、いずれも、競合他社が同様の製品をマーケティングする能力を制限することを制限するか、または私たちの製品の特許保護期間を制限するか、またはOCS製品またはOCS製品コンポーネントを製造、マーケティング、および販売する権利を失う可能性がある。また,“ライシー·スミス米国発明法”や“ライシー·スミス法案”は米国特許法を多くの重大な改正を行っている。これらの条項は、特許出願起訴方式に影響を与える条項を含み、既存技術を再定義し、競争相手に特許の有効性に挑戦するために、より効果的かつ費用効果的な方法を提供する。また、, “ライシー·スミス法案”は米国の特許制度を先行出願制度に転換した。最初の届出の規定は2013年3月16日に施行された。Leahy-Smith法案が我々の業務運営にどのような影響を与えるかは不明である(もしあれば)。例えば、ライシー·スミス法案は、特許裁判及び控訴委員会(PTAB)という行政裁判所が特許の有効性を疑問視する場を提供し、費用が地域裁判所訴訟よりもはるかに低く、時間もはるかに速いと規定されている。我々の特許に挑戦する訴訟は、特許の損失または特許出願の拒絶、または特許または特許出願の1つまたは複数の特許請求の損失または範囲の縮小をもたらす可能性がある。また、介入手続きにおける不利な決定は、第三者が我々が求める特許権を取得することを招く可能性があり、逆に製品を商業化する能力に影響を与える可能性がある。
米国や他国の特許法または特許法解釈の変更は,我々の知的財産権の価値を低下させたり,我々の特許保護範囲を縮小したりする可能性があり,これは逆に所有者立案法団の商業価値を低下させる可能性がある。いくつかの外国の法律は私たちの固有の権利に対する保護の程度がアメリカの法律よりも悪く、私たちはこれらの国で私たちの固有の権利を保護することが重要な問題に直面するかもしれない。
未来の私たちの所有権の保護の程度は不確定で、私たちは保証できない
41
もし私たちがハッジ·ワックスマン法案に基づいて特許期間の延長を得ることができなければ、私たちの業務は実質的な損害を受ける可能性がある。
FDAが我々の製品の発売を承認した時間、期限、および詳細によると、私たちが所有または許可している1つ以上の米国特許は、1984年の“薬品価格競争および特許期限回復法”(Hatch-Waxman Actと略称する)に従って限られた特許期間を回復する資格がある可能性がある。ハッジ·ワックスマン法は、製品開発およびFDA規制審査中に失われた有効特許期間を補償するために、承認された製品の特許をカバーする最長5年間の特許回復期を可能にする。しかし、関連時間においても、私たちの製品をカバーする発行された特許を持っており、テスト段階や規制審査中に職務調査を行うことができず、適用された最終期限内または関連特許が満了する前に出願できなかったり、適用要件を満たしていなかったりすれば、延期されない可能性があります。さらに、延長された時間または提供された特許保護範囲は、私たちが要求したものよりも短いかもしれない。各承認された製品は1つの特許しか延長できず,展示期間は承認日から総特許期間を14年以上延長することはできず,承認された製品,その使用方法または製造方法に関する権利要件のみを延長することができる。もし私たちが特許期間の延長や回復を得ることができない場合、あるいはどのような延長の期限が私たちが要求したものよりも短い場合、私たちは適用製品に対して特許権を行使する期限が短縮され、私たちの競争相手は私たちの特許が満期になった後に競争製品の承認を得ることができるかもしれない。したがって、私たちの収益能力は実質的な悪影響を受けるかもしれない。またこのような状況が発生したら, 私たちの競争相手は私たちの臨床と臨床前データを参考にして、私たちの開発と試験への投資を利用して、他の場合よりも早く彼らの製品を発売するかもしれない。もし私たちの製品が十分な特許保護または他の独占権を持っていなければ、私たちの業務、財務状況、または経営結果は実質的な悪影響を受ける可能性がある。
私たちは世界各地で私たちの知的財産権を強制的に施行できないかもしれない。
いくつかの外国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。ある外国司法管轄区では、多くの会社が知的財産権の保護と保護に重大な問題に直面している。これは私たちの外国特許の侵害や、私たちの他の知的財産権の流用を阻止することを難しくするかもしれない。例えば、一部の外国国には強制許可法があり、これらの法律によると、特許権者は第三者に許可を付与しなければならない。また、一部の国は、政府機関または政府請負業者を含む第三者に対する特許の実行可能性を制限している。このような国では、特許は限られた利点を提供するかもしれないし、利益さえないかもしれない。特許保護は最終的には国ごとに求めなければならないが,これは高価で時間のかかるプロセスであり,結果は不確定である。したがって、私たちは特定の国で特許保護を求めないことを選択することができ、私たちはこれらの国で特許保護の利点を享受しないだろう。
外国の管轄区域で私たちの特許権を強制執行する訴訟は巨額のコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移すことができます。したがって、このような国で知的財産権を保護するための私たちの努力は十分ではないかもしれない。また、米国や外国の法律や裁判所の法的裁決の変化は、私たちの技術や知的財産権の執行のために十分に保護されている能力に影響を与える可能性がある。
もし私たちが私たちの商業秘密の機密性を保護できなければ、所有者立案法団の価値と私たちの商業と競争地位は損なわれるかもしれません。
特許保護に加えて、私たちは、私たちの機密および独自の情報を保護するために、ビジネス秘密保護と、私たちの従業員、コンサルタント、および第三者と締結された秘密協定および発明譲渡協定に依存します。契約措置に加えて、私たちは公認された物理的および技術的セキュリティ措置を使用して、私たちの固有の情報の機密性を保護しようと努力している。例えば、従業員またはアクセス許可権限を有する第三者が商業秘密を盗用する場合、このような措置は、私たちの独自の情報に十分な保護を提供しない可能性がある。私たちの安全対策は、従業員やコンサルタントが私たちのビジネス秘密を盗用して競争相手に提供することを阻止できないかもしれませんが、このような不正行為に対する追跡権は、私たちの利益を十分に保護するための十分な救済措置を提供できないかもしれません。許可されていない当事者たちはまた、複製や逆工事をしようとするかもしれないし、私たちは独自の製品のいくつかの側面だと思う。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかる可能性があり、結果は予測できない。一般的に受け入れられている安全措置を使用しているにもかかわらず、商業秘密の侵害は往々にして州法律の問題であり、司法管轄区によって商業秘密を保護する基準が異なる可能性がある。また,ビジネス秘密は,我々の法的追跡を阻止するように他の人によって独立して開発されている可能性がある.私たちは従業員、コンサルタント、第三者と協定を締結して、彼らは譲渡する義務があることを規定しました
42
しかしながら、彼らが私たちのために働いている間、これらの合意は自動的に実行されない可能性があり、すべての従業員またはコンサルタントがそのような合意に署名することができるわけではなく、または従業員またはコンサルタントがこれらの合意の条項に違反または違反する可能性があり、そのような違反または違反に対応するための十分な救済措置がない可能性がある。私たちのビジネス秘密のような知的財産権または機密または独自の情報が開示または流用されている場合、またはそのような情報が競合他社によって独立して開発されている場合、所有者立案法団の価値および私たちの業務および競争地位を損なう可能性がある。
私たちは、私たちまたは私たちの従業員が商業秘密やノウハウを含む第三者の知的財産権を盗用した、または私たちの競争相手との競争禁止または入札協定に違反し、第三者が私たち自身の知的財産権の所有権権益を要求する可能性があると告発されるかもしれません。
私たちの多くの従業員およびコンサルタントは、以前、私たちの競争相手または潜在的な競争相手、病院、または他の第三者を含む他の医療機器、バイオテクノロジーまたは製薬会社に雇われていた。これらの従業員、コンサルタント、および請負業者の一部は、以前の雇用に関する独占権、秘密、およびスポーツ禁止協定に署名した可能性がある。私たちの従業員およびコンサルタントが私たちのために働いているときに他人の知的財産権、独自情報、技術ノウハウ、または商業秘密を使用しないことを確実にするために努力しているにもかかわらず、私たちまたはこれらの個人は、これらの元雇用主、競争相手、または他の第三者の知的財産権を意図的にまたは他の方法で流用したとして告発されるか、またはいわゆる商業秘密または他の固有情報を開示している可能性がある。さらに、私たちは、従業員やコンサルタントと達成した知的財産権を私たちに譲渡する義務があるという合意が無効であるか、または別の雇用主、前の雇用主、または別の人または実体に発明を譲渡する以前または相互に競争する契約義務と衝突するため、私たちが自分の知的財産権の所有権または発明権と見なしていることに第三者のクレームを受ける可能性がある。訴訟は、そのようなクレームを解決するために許可証を取得することを望む可能性があるが、実際にライセンスを取得すれば、商業的に合理的な条項でライセンスを取得することができる保証はない。もし私たちがこれらのクレームの弁護に失敗したら、金銭損害賠償や和解支払いを支払う以外に、裁判所は私たちの製品に重要な技術、機能、あるいは他の知的財産権の使用を禁止することができます, このような技術または特徴が、元雇用主の商業秘密または他の固有情報を含むか、または由来することが発見された場合。私たちの製品に重要または必要不可欠な技術、機能、または他の知的財産権を統合できないことは、私たちの業務や競争地位に重大な悪影響を与え、製品の販売を阻止する可能性があります。しかも、私たちは貴重な知的財産権や人員を失うかもしれない。これらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。どんな訴訟やその脅威も、私たちが従業員を雇ったり、独立販売代表と契約を結ぶ能力に悪影響を及ぼす可能性があります。キーパーソンまたは彼らの作業製品の流失は、製品を商業化する能力を阻害または阻止する可能性があり、これは、私たちの業務、財務状況、経営業績、キャッシュフロー、および将来性に重大かつ不利な影響を与える可能性がある。
政府の規制に関連するリスク
所有者立件法団の設立が承認された後も、私たちは米国や他の国の規制機関や実体の持続的な規制を受けており、いずれの規定も遵守できなければ、私たちの業務は影響を受ける可能性がある。
OCSが特定の適応を承認した後であっても、私たちはFDAおよび他の規制機関およびエンティティによって広く持続的に規制されている。私たちは、私たちの製品が死亡または深刻な損傷をもたらす可能性があることを合理的に示す情報があること、または故障が発生したことを合理的に示す情報があることを認識し、故障が再び発生した場合、私たちが販売しているデバイスや同様のデバイスが死亡または深刻なダメージを引き起こす可能性が高いことを“医療機器報告条例”によって制約されており、FDAに報告しなければならない。我々は、健康構成に対するデバイスのリスクを低減し、健康にリスクを構成する可能性のあるデバイスのFDCA違反を修復し、他の修正または除去された記録を維持するために、修正または除去を開始したFDAに修正または除去を報告しなければならない。FDAは販売促進と広告、そして私たちがOCSに提出したすべての声明を厳格に規制する。FDAが、私たちの宣伝材料、トレーニング、または広告活動がOCSを使用することを許可されていない宣伝を構成していると判断した場合、それは、私たちのトレーニングまたは宣伝材料を停止または修正することを要求することができ、または規制された法執行行動を受け入れることを要求することができる。
FDAと州当局は広範囲な法執行権力を持っている。適用される規制要件を遵守しない場合、FDAまたは州政府機関が法執行行動をとる可能性があり、その中には以下のいずれかの制裁措置が含まれている可能性がある
43
任意の是正行動は、任意であっても非自発的であっても、訴訟において自己弁護する可能性があり、時間と資金を投入し、経営陣の業務運営への関心を分散させ、私たちの名声や財務業績を損なう可能性がある。
我々が現在発売しているOCS肺、OCS心臓、およびOCS肝臓については、承認条件の一部として、PMA承認後研究を完了しなければならない。例えば、OCS肺に対する3つの承認後の研究を完成しなければならず、OCS LONG INSPIRE継続PASを含み、これはOCS肺INSPIRE試験患者の長期結果を評価するための両腕観察研究である;OCS肺拡大持続PAS研究は、OCS肺拡大試験患者の長期結果を評価するための単一アーム研究である;およびわれわれのOCS肺TOP登録は、現在使用されていると使用されていない2つのドナー肺におけるOCS肺の短期および長期安全性および有効性を評価するための展望性、単一アーム、多中心、観察性研究である。私たちの最高登録所は定期報告書をFDAに提出しなければならない。承認条件を守らないことは承認を撤回することを含む重大な不利な行動につながる可能性がある。
われわれはまた,厳格な上場後義務の遵守が求められており,これらの義務はEUの医療機器にCEマークを貼り付けることに伴う。その中には,報告基準を満たした事故の報告義務が含まれており,安全最新報告とトレンド報告を定期的に提供している。また、EUの国家主管部門も設備会社が実施しているマーケティング計画を密接に監視している。会社が履行しなければならない販促材料の発売前の承認に関する義務はEU加盟国間で異なる。もし私たちがEUでOCSをマーケティングして普及させる義務を履行しなければ、私たちの業務と運営結果を損なうかもしれない。
また、我々のCIBC信用協定によると、規制承認に関連するいくつかの変化や他の事件は、違約事件を招く可能性があります。本年度報告表格10-Kにおける“項目7.経営陣の検討と分析--長期債務”を参照。
私たちの製品はすでに製品リコールの影響を受けている可能性があり、これは私たちの名声を損なう可能性があり、私たちの業務、財務状況、経営業績、キャッシュフロー、将来性に重大かつ不利な影響を与える可能性があります。
OCSは連邦および州の法規に従って製造されなければならず、もし私たちがこれらの法規に従わなければ、私たちまたは私たちの任意のサプライヤーまたは第三者製造業者は私たちが設置したシステムをリコールするか、または生産を一時停止または終了させることを余儀なくされるかもしれない。FDAと同様の外国政府当局は、設計、製造またはラベルに重大な欠陥または欠陥がある場合に商業化製品をリコールすることを要求する権利がある。FDAの場合、リコール命令は、FDAに基づいて、この装置が合理的な可能性があることを発見しなければならず、深刻な健康不良結果または死亡をもたらす。また、外国政府機関は、設計や製造に重大な欠陥や欠陥がある場合に、私たちの製品をリコールすることを要求する権利がある。設備に何か重大な欠陥が発見されれば、メーカーは自発的に製品をリコールすることができる。コンポーネント故障、セキュリティ故障、製造ミス、設計またはラベル欠陥または他の欠陥と問題のため、政府の強制または自発的なリコールが発生する可能性がある。リコールは、私たちのどの製品も管理と財務資源を移転し、私たちの財務状況と運営結果に悪影響を与えます。FDAは,機器の健康構成のリスクを減少させたり,機器による健康構成リスクに起因する可能性のあるFDCA違反を救済するためのリコールを要求し,リコール開始後10営業日以内にFDAに報告すべきである。会社はリコール記録の保留を要求されており、たとえこれらのリコールがFDAに報告する必要がなくても。将来的に私たちの製品に関する自発的なリコールを開始するかもしれませんが、これらのリコールはFDAに通知する必要はないと思います。FDAが私たちの決定に同意しなければ、私たちはこのような行動を報告することを要求されるかもしれない
44
呼び戻す。リコール声明はお客様の名声を損なう可能性があり、私たちの販売にマイナス影響を与える可能性があります。また、任意の是正行動は、任意であっても非自発的であっても、訴訟において自己弁護するにもかかわらず、時間と資金を投入し、経営陣の業務運営への関心を分散させ、私たちの名声や財務業績を損なう可能性がある。さらに、FDAは、警告状、無タイトル状、行政行動、刑事起訴、民事罰金、私たちの設備承認の撤回、私たちの製品の差し押さえ、または将来の製品の整理または承認の延期を含む、リコールが行われたときにリコールを報告しない法執行行動をとることができる。
私たちは過去に臨床現場で任意にいくつかのOCS製品をリコールしたことがあり、未来に類似の行動をとる必要があるかもしれないが、これは他の司法管轄区の監督機関に通知を出す可能性がある。我々が製品の商業化を拡大し、新しい顧客にOCS製品を販売することに伴い、将来的にはどの製品リコールの影響も増加し、将来のどの製品リコールにも歴史的製品リコールよりも大きな行政と応答努力が必要となる。
国際的に、製品の欠陥を解決する方法は違うだろう。製品は一つの国でリコールすることができるが、他の国でリコールすることはできない。しかしながら、欧州連合内では、主管当局は、遅延なく設備に対して是正行動(設備の撤回/リコールを含む)を行い、患者、ユーザまたは他の人の健康または安全または公衆衛生保護の他の態様に対して許容できないリスクを構成する任意の設備を、他の国の主管当局、欧州委員会、および通知機関に通知しなければならない(状況に応じて)。他にも“千年開発報告”を守らない場合は、是正行動をとって通知を出す可能性があり、規定を守らない場合は所定の時間内(主管当局が確定)が是正されていない。したがって、EU加盟国のリコールはEUの他の国のリコールを招く可能性がある。
OCSの必要なFDA承認を維持できない場合、またはOCSの将来の使用に対するFDAの必要な承認を得ることができない場合、われわれはOCSを商業的に販売およびマーケティングすることができないであろう。
OCS製品は医療デバイスであり、アメリカではFDAと他の連邦、州、地方当局によって広く規制されている。FDAはOCSの設計、開発、テスト、製造、ラベル、販売、普及、流通、輸入、輸出、および輸送を規制する。われわれはすでにDBDとDCDに適応したOCS肺,OCS肝,OCS心臓にそれぞれPMAを獲得した。我々は、2021年7月に肺のためのOCS肺液を冷間洗浄、貯蔵および輸送するための510(K)許可を取得し、2022年11月にOCS肺ドナー洗浄の510(K)許可を取得した。
上場後のデータが安全問題やパフォーマンスが良くないことを示した場合、PMAは承認を撤回したり、他の制限を加えたりする可能性がある。FDAはまた、セキュリティ問題が発生した場合に510(K)で承認された装置を市場から除去することを要求することができる。
もし私たちが所有者立案法団の必要な規制承認を維持できない場合、あるいは将来の製品のために必要な規制承認または許可を得ることができない場合、私たちの財務状況と運営結果は影響を受け、実質的である可能性があり、私たちの業務は倒産する可能性がある。
もし私たちがEU、北アイルランド、そしてイギリスでCEマークを維持できなかったら、私たちはEUでビジネス的にOCSを販売し、マーケティングすることができないだろう。
EUでは、我々は、肺、心臓、および肝臓移植のためのOCS肺、OCS心臓、およびOCS肝臓をそれぞれ販売するためにCEマーカーをキャップする権利がある。我々の通知機関BSIはオランダに本部を置き,OCS製品のCEタグ付けを許可する証明書を発行する.私たちのEUでの販売は私たちの各OCS製品のCEマーク認証を獲得して維持することに依存します。MDRの要求に応じて、我々は、OCSコンソール、OCS使い捨て用品、およびOCS肺システムのCEマーク再認証を2022年9月に取得し、OCSコンソール、OCS使い捨て用品、およびOCS溶液添加剤を含む。私たちはOCS肝臓のCEマーカーを申請し、今後12ヶ月以内にMDR項目の下で私たちの溶液添加剤を受け取る予定だ。CEフラグを継続して使用できるようにするためには,MDRで規定されている条件を満たす必要がある.
イギリスの離脱後、北アイルランド議定書によると、MDRは北アイルランドに適用されるが、大ブリテン(イングランド、ウェールズ、スコットランド)には適用されない。“2002年イギリス医療機器条例”(UK MDR 2002)は、この移行期間に基づいて、イギリスは2023年6月30日までにEU CEマーカーを認める移行期間を提供する。MHRAは、この期限を2024年6月30日まで延長することを確認した。この日以降にイギリス市場に市場を投入するためには,医療機器はイギリスMDR 2002基準に適合した合格評価を経て,イギリスKCAマークを貼らなければならない。しかしながら、過渡期から利益を得た装置であっても、イギリスMDR 2002の他の要件に適合しなければならない;例えば、医薬品および保健製品規制機関(MHRA)には、製造業者がイギリス以外に存在する場合、イギリスの担当者を任命しなければならない。
45
EUとイギリス市場に製品を投入し続けるためには、EU MDRまたはイギリスMDR 2022に規定されている条件を満たす必要がある。MDRに従って私たちの製品に対して現在使用されている認証を維持することができない場合、および/または必要に応じてイギリスMD 0 R 2002の認証を取得することができない場合、OCSの任意の現在の用途のためにEUおよび/または英国市場にデバイスを投入し続けることができないかもしれない。CE/UKCAマークを貼り付ける用途に何か変化があれば,CE/UKCAマークを貼り付けるために必要な技術文書をさらなる検討や修正を行う必要があり,我々の収入や経営結果が悪影響を受ける可能性があり,我々の名声が損なわれる可能性がある.
もし私たちが外国の管轄区域で規制承認を得ることができなければ、私たちの市場機会は制限されるだろう。
FDAの承認または承認またはCEマークは、他の国の規制機関の承認を得ることを確保することができず、外国規制機関の承認も他国の規制機関の承認を得ることを確保することができない。しかし、一つの管轄区域で承認または承認を得られなかったことは、私たちが他の場所で承認または承認を得る能力に悪影響を及ぼすかもしれない。私たちが必要な市場許可を得たり維持したりしなければ、私たちの製品をアメリカ以外の市場で商業化すれば、私たちの全体の市場浸透率にマイナスの影響を与えるだろう。例えば、製造ミスにより、私たちの製品の効果が添付された使用説明書で主張されている基準を満たしていなければ、規制機関は私たちの製品がEU、北アイルランド、イギリス、その他の場所の市場で発売されることを阻止することができる。
移植センターおよび病院が、OCSおよび追加の使い捨てセットを購入するために、政府または第三者支払者から十分な補償または資金を得ることができない場合、OCSおよび国家OCS計画を使用するプログラムに関連するコストは、収入を創出し、利益を達成する見通しが深刻な影響を受けるであろう。
私たちが収入を創出し、利益を達成する見通しは、米国および他の市場がOCSおよび国家OCS計画を使用する臓器移植プログラムが十分な精算または資金を有するかどうかに大きく依存する。
米国では,連邦医療保険は通常,予想される金額精算に基づいて移植手続きを行う施設である。入院治療の場合、連邦医療保険の予期される支払いは、通常、患者の病状および他の患者データ、ならびに患者の入院中に実行されるプログラムによって決定され、MS-DRGsと呼ばれる分類システムが使用される。その他の要因に加え,予想料率は地域差や病院が教育病院であるかどうかに応じて調整される。支払いは所定のレートに基づくことが予想され、病院が看護を提供する実際のコストよりも低い可能性があるので、病院は、製品、装置、および用品を利用することによって入院運営コストを低減する動力があり、これらの製品、装置および用品は、患者の入院時間を減少させ、労働力を減少させるか、または他の方法で彼らのコストを低減する。
これらのMS−DRGベースの支払いに加えて、Medicareは、適用可能なMS−DRGの支払いに基づくのではなく、予期される支払いシステムからの“伝達”コストとみなされる“合理的かつ必要な”臓器取得コストを移植センターに精算する。一般式臓器取得コストには、組織分類、臓器保存、臓器輸送、ドナー評価、その他の取得コストなど、臓器取得に必要なサービスが含まれる。これらの費用の単独支払いは,移植センターの医療保険コスト報告に基づいて確立された合理的なコストに基づいて決定される。移植センターが臓器専用OCSコンソール、OCS注入器、およびOCS解決策のために生成するコストは、臓器取得コストに分類され、連邦医療保険はこれらのコストに追加の精算を提供する。しかし,疾患や傷害の診断や治療が不合理で不必要と判断された項目については,連邦医療保険は精算されていない。全国範囲で連邦医療保険を管理するCMSと連邦医療保険請負者は、OCSがこのような状況で合理的で必要であるかどうかを決定する際に大きな裁量権を有する。CMSまたはMedicare請負者は、信頼できる臨床データ証明がOCSを使用して患者にもたらす利点がない場合、MedicareはOCSの費用を支払いおよび補償しないと決定する可能性がある。私たちが以前に行われており、計画されている臨床研究および患者登録から収集されたデータは、CMSまたはMedicare請負者がカバー範囲を決定する目的のために十分ではないかもしれない。したがって、連邦医療保険は移植センターのOCS費用の全部または一部を精算しないかもしれない。アメリカの民間保険会社や他の公共保険会社は通常連邦医療保険のカバー範囲と支払い政策に従うと信じています。
米国以外では、精算·助成制度は国や一部の国、地域によって大きく異なる。多くの外国市場には政府が管理する医療システムがあり,医療設備やプログラムの精算や資金調達を管理している。EU加盟国では、臓器移植手術に関連する費用は国家保険によって支払われる可能性があり、場合によっては、民間保険会社によって支払われるか、または国家保険会社と民間保険会社によって共同で支払われる可能性があり、具体的には個別項目によって決定される優先順位に依存する。これらの補償配置は国と地域レベルで複雑な規則と条例の制約を受けており、これらの規則と条例は欧州連合加盟国の間で異なる可能性がある
46
OCSが既存の保存方法より優れていることを証明するために、より多くの臨床研究を行う必要があるかもしれない。このような臨床データを収集する研究は現在のところ計画されておらず,いずれの研究も高価で長い可能性があり,最終的には補償を確保するのに十分な結果が生じない可能性がある。場合によっては、私たちは、移植手順において法団を使用する利点をサポートするために、法団のための十分な補償を得ることができないかもしれない、または追加の臨床データを収集するまで。病院または外科医が存在する国または地域に単独の追加補償または資金がない場合、病院または外科医は、独立医療保険のメリットが医療保険のコストを超えないか、または超えることはないと考える可能性がある。あるいは、私たちは支払人とリスク分担を達成することを要求されるかもしれない。
もし私たちの製品が私たちの顧客が指令2010/53/EU(元指令2010/45/EU)の要求を遵守することを妨げ、イギリスの2012年に移植に使用される臓器の品質と安全条例(法定文書(SI)2012年1501号)(この条例)が移植に使用される臓器の調達、保存、輸送に何らかの基準を加えた場合、EUでの私たちの製品の採用が阻害される可能性がある。一部の外国、特にEUでは、補償や資金を得ることができる場所であっても、医療機器の定価は政府によって制御されている。これらの国では,製品にCEマークを行った後,政府当局との補償や定価交渉にかなりの時間を要する可能性がある。例えば、いくつかの外国精算制度は、特定の期間内に限られたお金を支払うことを規定しているので、支払い期限の延長をもたらし、これは、移植のためにOCSを使用して販売を制限することを阻害する可能性がある。もし私たちの製品が精算を得ることができない場合、あるいは範囲や金額が制限されている場合、あるいは定価が満足できないレベルに設定されている場合、ある国で私たちの製品を販売することは利益がないかもしれません。これは私たちの業務の長期的な成長にマイナスの影響を与える可能性があります。
政府プロジェクトおよび他の第三者支払者の既存の精算および資金調達が十分な支払いを提供していても、病院が費用効果に適合した方法でOCSを購入することができるようにしても、これらの手配を管理する法律および法規は変化する可能性がある。政府、保険会社、および医療費の他の支払者は、これらの費用を制御または減少させるために努力し続け、米国または外国の精算および資金調達制度の立法または規制改革を招き、OCSまたは移植プログラムの精算を大幅に減少または廃止する可能性がある。
米国またはEUの病院が所有者立件法団および追加的な使い切り即時廃棄装置、または一般的な移植手続きを支払うために返済または支出を得ることができない場合、彼らは十分な経済的誘因なく所有者立件法団を購入する可能性がある。病院や外科医が確定した場合、所有者立件法団のメリットは、所有者立件法団の初期コストと持続費用を超えないか、または超えることはなく、顕著な販売を実現できない可能性があり、永遠に利益を上げない可能性がある。
国際市場で精算を行うには、追加の臨床研究を含む具体的な国に対する精算活動を展開する必要があるかもしれないが、これは時間も高価で、受け入れられる販売率が生じない可能性がある。
国際市場では,市場の我々の製品に対する受け入れ度は,主流医療支払いシステムの精算能力に大きく依存する可能性が高い。国際市場の精算や医療支払い制度は国や地域によって大きく異なり、政府が援助する医療や個人保険を含む。もしあれば、私たちは国際補償承認をタイムリーに得られないかもしれない。また、私たちが国際精算承認を得たとしても、私たちの業務が承認された司法管轄区域に拡張されていることを商業的に証明するのに十分ではないかもしれません。私たちまたは私たちの顧客が私たちの製品のマーケティングと販売を求めている主要な国際市場で製品の精算を得ることができなければ、私たちの国際収入の増加は損なわれ、私たちの業務と運営結果は不利な影響を受けるだろう。
私たちが私たちの製品を修正する場合、私たちは新しいPMAまたはPMAサプリメントの承認を得ることを要求される可能性があり、既存のCEフラグを変更し、必要な承認が得られるまで、マーケティングの停止または任意の修正された製品のリコールを要求される可能性があります。
PMAによって承認されたデバイスのいくつかの修正は、新しいPMAまたはPMA付録を承認する必要があり、他の修正は、年次報告で報告するか、または30日の通知によって報告することができる。FDAは新しいPMAまたはPMAサプリメントが必要かどうかに関する私たちの決定に同意しないかもしれない。私たちは将来的に承認された設備および製造プロセスを修正するかもしれませんが、これらの修正は新しいPMA申請やPMA補充を承認する必要はないと考え、または30日間の通知を提出します。FDAが私たちの決定に同意せず、新しいPMA、PMAサプリメント、または30日間の通知を提出して、以前に承認された製品や製造プロセスを修正することを要求した場合、私たちは30日の通知を承認または提出するまで、マーケティングの停止や修正された製品のリコールを要求される可能性があり、巨額の規制罰金または処罰を受ける可能性があります。さらに、FDAは、将来の商業化に適した任意の適応のために、私たちの製品を承認しないかもしれませんか、または臨床試験のための装置の支援を必要とする可能性があります
47
修正された適応や主張もあります必要な承認を得る上でのどんな遅延や失敗も、私たちが新製品を適時に発売したり、製品の能力を強化したりすることに悪影響を与え、逆に未来の成長を損なうことになる。
また,CEマーク機器に関連する品質システムや製品範囲の重大な変化は,その製品を認証する通知機構に通知する必要がある.通知された機関は提案された変更を評価するだろう。追加のステップを取らなければ、CEフラグを変更できないかもしれないし、全然できないかもしれません。例えば,より多くの臨床試験を行い,適切な通知機関により多くの技術情報を提供し,CEマークを変更された製品に貼り付ける必要があるかもしれない。
FDAのQSR、またはFDAまたはEUの臨床試験または調査に関する要求を遵守できない場合、FDAまたは関連EU主管当局は、私たちの生産運営を停止することを含む様々な法執行行動をとる可能性があり、私たちの業務は影響を受けるだろう。
米国では,医療機器メーカーとしてFDAのQSRの遵守を証明し維持することが求められている。QSRは複雑な規制方案であり、医療機器の設計、テスト、制御、製造、ラベル、品質保証、包装、貯蔵と輸送の方法と文書をカバーする。FDAは定期検査と抜き打ち検査によりQSRを実行している。
FDAの定期検査を受けて、QSRおよび生物研究モニタリング計画に適合しているかどうかを決定し、これは、臨床試験中を含むFDA発行表483を過去および将来にもたらす可能性がある。米国以外でも、我々の製品や運営は、国際標準化機関のような業界標準機関が制定した基準を遵守することが求められることが多い。例えば、EUでは、MDRは臨床研究の詳細な要件を含み、これらの要件は、国際標準ISO 14155:2020年の良好な臨床実践に関する要件、またはGCPに適合する。外国の監督管理機関はこれらの基準に基づいて私たちの製品または私たちの製品のテストを評価するかもしれない。外国規制機関の具体的な基準、評価タイプ、審査範囲はそれぞれ異なる。我々は、GCP要件およびQSR(米国)を含むFDAまたは現地の臨床試験/調査に関する要求を遵守できなかったか、または不利な検査に対して満足かつ迅速な是正措置をとることができず、警告状、不利な宣伝、私たちの製造業務の閉鎖または制限、私たちの製品の承認または承認の遅延、私たちの製品の輸出入の許可の拒否、私たちの製品の販売の禁止、私たちの製品のリコールまたは差し押さえ、罰金、禁止、民事または刑事罰、または他の制裁を引き起こす可能性があり、これらはいずれも私たちの業務および運営業績に影響を与える可能性がある。
私たちはアメリカ以外で規制資格を取得したり維持することができないかもしれないが、これは私たちの業務を損なうかもしれない。
OCSの米国以外での販売は、国によって異なる外国規制要求によって制約されている。外国の規制承認プロセスには、通常、FDAの承認または承認の取得に関連するすべてのリスク、およびその他のリスクが含まれる。国際規制要求を遵守することは高価で時間のかかる過程かもしれないし、承認も確実ではない。外国の承認または承認を得るのに要する時間は、FDAの承認または承認に要する時間を超える可能性があり、このような承認または承認の要求は、FDAの要求とは大きく異なる可能性がある。外国の規制機関は、FDAの承認または承認のための私たちの製品の同じ用途を承認または承認しないかもしれない。さらに、私たちは、新製品または改装製品にCEマークを貼ることができないかもしれないし、任意の追加の規制資格、許可または承認を得ることができないかもしれないし、EUの個別加盟国またはOCSを販売することを求める他の国によって要求される追加の法的義務を履行できないかもしれない。FDAは米国からの医療機器輸出も規制している。私たちが外国規制機関の承認を得ることに成功し、維持できない場合、あるいは米国の輸出規制を遵守しなければ、私たちの業務は損なわれるだろう。
外国の規制機関は米国と海外の製造施設を定期的に検査している。任意の検査意見に関する是正·予防措置を実施しているが,米国や他の国·地域に適用される規制機関や実体を介して将来の当施設の検査を通過できない可能性がある。米国国外で私たちの製品を販売するために必要な資格、許可または承認を遅延させたり、これらの資格、許可または承認を得ることができなかったり、他の外国の規制要求を遵守できなかったりすることは、国際市場で私たちの製品をマーケティングしたり、機能を強化したりすることを制限または阻止する可能性があります。また、新しい要求の実施は私たちの業務や製品に大きな影響を与える可能性があり、私たちはこれらの新しい要求に適応できないかもしれません。もし私たちが適用される外国法規を守らなければ、私たちは重大な処罰に直面するかもしれません。私たちの業務、財務状況、経営業績、キャッシュフロー、見通しは不利な影響を受ける可能性があります。
48
私たちは製品責任訴訟またはOCS欠陥による規制遅延に直面する可能性があり、これは高価で時間がかかる可能性があり、私たちが支払うべき大量の損害賠償と私たちの保険料率を増加させる可能性がある。
もし私たちの製品が設計、製造、またはラベルに欠陥があると考えられている場合、欠陥のあるコンポーネントを含み、セキュリティ障害を受けたり、ハッカーに攻撃されたり、または偽造された場合、私たちは、OCSの移植センターまたは彼らの患者、または彼らのクレームを代表する他の人に代わって購入または使用する他の人々が提起した巨額でコストの高い訴訟に直面する可能性がある。しかも、移植は複雑で内在的なリスクを持つ医療手続きである。現在、肺、心臓或いは肝臓移植を待っている多くの患者はすでに病状が深刻であり、その中の一部の人は集中治療を受けている。これらすべての患者が移植を受けなければ、大きな死亡リスクがある。そのため、所有者立件法団の表現が期待に達しず、そのため、患者が期待した移植を受けられなかった或いは成功しなかった移植を受けられなかった場合、著者らは重大な責任を負う可能性がある。死亡は臓器移植人口が発生すると予想される有害事象であるが、OCSを使用した死亡率または他の深刻な有害事象の比率が従来の移植プログラムを使用する予想よりも高い場合、移植外科医はOCSの使用をしばしばまたは根本的に停止する可能性があり、これは私たちの業務、財務状態、経営業績、キャッシュフローおよび将来性に重大かつ不利な影響を与える可能性がある。
OCSは新しい臓器移植方法を表すので、患者または移植センターは、OCSが患者の深刻な有害事象または死亡をもたらすかどうかにかかわらず、計画または完了した移植中にOCSを使用することに関連する訴訟の当事者として我々を選択することができる。どんなクレームも、私たちが最終的に成功したかどうかにかかわらず、私たちの核心業務に対する管理層の注意を移し、弁護費用が高く、私たちへの巨額の損害賠償を招く可能性がある。
現在、私たちは全世界の製品責任保険を維持し、人類の臨床と商業に私たちの製品を使用するために毎回1000万ドルに達する損害賠償を提供している。私たちはまた必要に応じて現地の保険証書を維持する。私たちの現在の保険範囲は未来のクレームを支払うのに十分ではなく、賠償免除額の制限を受けているかもしれません。さらに、将来的には、私たちは十分な潜在的責任保険を提供するのに十分な金額や範囲の保険を受けることができないかもしれない。私たちが提出したいかなる製品責任クレームに対しても、法的根拠があるか否かにかかわらず、私たちの製品責任保険料率を高めたり、持続的な保険を得ることを阻止したり、業界での私たちの名声を損なう可能性があり、私たちの現在または未来の臨床前研究または臨床試験を損害し、私たちの製品の市場での受容度を阻害し、製品販売を減少させる可能性がある。さらに、私たちは、私たちの保険カバー範囲または現金備蓄クレームに適用される保険リストに規定されている賠償免除額の範囲内の任意の製品責任損失を支払う必要があり、これは、私たちの業務、財務状況、経営業績、キャッシュフロー、および将来性に重大で不利な影響を与える可能性があります。
FDAは医療機器に対するサイバー攻撃の脅威はもはや理論的ではないと警告している。ハッカーおよび他の第三者は、OCS上の情報を取得し、トロイの木馬または他の他のシステムへの入口点として機能するOCSの動作方法を変更し、これらのシステムがネットワークセキュリティホールまたは攻撃を受けるか、または移植された臓器または個人にダメージを与える可能性があるOCSのセキュリティ制御をバイパスしようと試みる可能性がある。もし私たちのセキュリティコントロールが所有者立件法団とその上の情報を完全に保護できない場合、私たちは名声被害を受ける可能性があり、規制調査と法執行を受けることができ、あるいは起訴される可能性がある。
第三者は、私たちの製品の偽造バージョンを生産しようと試みるかもしれません。これは、OCSとその構成要素を販売する能力を損なう可能性があり、私たちの名声に負の影響を与え、または患者を損害し、製品の責任を負わせる可能性があります。
偽医療機器の市場での存在はますます多くなっている。第三者は、当社の独占権を侵害していると考えられるシステムを開発、製造、流通、および販売しようと試みる可能性があり、これはOCSと競合し、私たちの独占権が維持されない司法管轄地域でOCSを販売する能力を弱めるであろう。また、偽造品の販売促進方式は消費者をミスリードし、自分が私たちに関連していると信じるようにする可能性がある。偽OCSが市場に存在する場合、我々は、現在市場にあるすべてのOCS製品を検証し、検証中にすべてのOCS製品を市場からリコールする義務があると予想される。偽デバイスがそのような有害事象をもたらしたかどうか、または偽デバイスの存在を知っているかどうかにかかわらず、偽OCSの使用に関連する任意の副作用または死亡の訴訟で指名される可能性もある。
もし私たちがこれらの用途の普及に参加していると考えられている場合、私たちの製品をマーケティングしたり普及させたり、OCSを誤用またはタグ外に使用しないと、市場での私たちの名声を損なう可能性があり、製品責任訴訟のダメージを招き、または監督機関のコストの高い調査、罰金、または制裁をもたらす可能性があり、いずれも私たちの業務に高いコストをもたらす可能性がある。
私たちのOCS製品はすでにアメリカ、EUと他の司法管轄区で特定の適応のマーケティングを行うことが許可されており、私たちの宣伝材料と訓練方法は販売国の監督要求に符合しなければならない。所有者立件法団を承認以外の用途に使用しないように、私たちの商業チームを訓練します
49
用途/期待用途の指示を“非ラベル用途”と呼ぶ.しかし,外科医が独立した専門医学的判断が適切であると判断すれば,外科医がタグ外でOCSを使用することを阻止することはできない。外科医がタグの外でOCSを使用しようと試みる場合、患者の負傷のリスクを増加させる可能性がある。さらに、FDA/任意の外国規制機関によって許可された適応またはCEマーカー以外の適応のためにOCSを使用することは、そのような疾患を有効に治療できない可能性があり、これは、外科医および患者における私たちの市場的名声を損なう可能性がある。
FDAまたは任意の外国規制機関が、私たちの宣伝材料または訓練が非ラベル使用を普及させることを構成していると判断した場合、またはその材料または訓練が虚偽または誤解であると判断した場合、警告状、禁止、差し押さえ、民事または罰金または刑事罰を必要としない違反行為のための規制または法執行行動を要求することができる。EUではMDRはラベル外宣伝の形で誤った宣伝を行うことを明確に禁止し,MDRは国家主管当局に執行権を付与する。他の連邦、州、または外国の法執行機関が私たちの商業活動がラベル外使用の普及を構成していると考える場合、刑事、民事および行政処罰、損害賠償、罰金、返還、政府医療計画から除外され、私たちの業務を削減することを含むが、これらに限定されない重大な処罰を招く可能性があり、彼らはまた、虚偽申告法または消費者保護法のような他の規制機関に基づいて行動する可能性がある。
さらに、外科医が十分な訓練を受けていなければ、OCSまたは不適切な技術を乱用する可能性があり、患者の結果が満足できない、患者の負傷、負の宣伝と製品責任を増加させるリスクを招く可能性がある。もしOCSが誤用されたり、不適切な技術が使用された場合、私たちは私たちの顧客または彼らの患者に高価な訴訟になるかもしれない。同様に、コストを低減するために、外科医は、OCSの使い捨てコンポーネントおよびアクセサリを繰り返し使用することもでき、または製品の故障および責任をもたらす可能性があるOCSコンポーネントを私たちから購入するのではなく、第三者ポストプロセッサから再加工されたOCSコンポーネントを購入することができる。上述したように、製品責任クレームは、経営陣のコア業務に対する関心を分散させ、弁護コストが高く、私たちに対する巨額の損害賠償を招く可能性があり、これらの賠償は保険範囲内ではない可能性がある。
米国または他の司法管轄区域の立法または法規改革は、私たちの製品が規制許可や承認を得ることを難しくするか、または承認または承認を得た後に私たちの製品を製造、マーケティング、または流通させるかもしれない。
米国議会は時々立法を起草し、提出することは、医療機器の監督管理を管理する法定条項を著しく変える可能性がある。さらに、FDAは、我々の業務および製品に大きな影響を与える可能性がある方法で、FDAの法規およびガイドラインを修正または再解釈する可能性がある。任意の新しい規制、法規、または既存の法規の改正または再解釈は、任意の将来の製品のコストを増加させたり、審査時間を延長したり、私たちの製品が承認、製造、マーケティング、または流通を得にくくする可能性があります。私たちは法規、法規、法律解釈、あるいは政策の変化を確定することができず、公布、公布、採用すれば、私たちの未来の業務にどのような影響を与えるかもしれません。他の事項に加えて、このような変更は、承認または承認を得る前に追加試験を行う必要がある場合があり、製造方法の変更、当社製品のリコール、交換または生産停止、または記録を追加的に保存する必要がある場合があります。
欧州連合(EU)2017/745号条例,あるいはMDRは,医療機器指令(93/42/EEC)を廃止·代替し,2021年5月26日から施行された。MDRは現在適用されているため,市場に投入されたすべての新機器はMDRでCEとマークされなければならないが,MDRが付与した過渡期には,“医療機器指令”による医療機器通知機関が2021年5月26日まで発行された証明書は証明書に示された時間まで有効であるが,すべての証明書は2024年5月27日に失効する。イギリスの離脱後、北アイルランド議定書によると、MDRは北アイルランドに適用されるが、大ブリテン(イングランド、ウェールズ、スコットランド)には適用されない。イギリスの薬品と保健製品監督機関(MHRA)は1つの過渡期を提供し、この過渡期内に、イギリスは2024年6月30日までEU CE標識を認める。この日後にイギリス市場に市場を投入するためには,医療機器はイギリスの法律に適合した合格評価を経て,イギリスのKCAマークを貼らなければならない。
我々が以前に医療機器命令に従って認証したすべての製品は、OCS心臓、OCS肝臓コンソール(および使い捨て製品)およびOCS肺システムを含み、OCSコンソール、OCS使い捨て製品、およびOCS溶液添加剤を含み、現在MDRに従って認証が再取得されている。我々はまたMDRに基づいてOCS肝臓のCEマーカーを申請し、今後12ヶ月以内にCEマーカーと私たちの溶液添加剤を得る予定である。
また、2024年7月1日から、私たちの製品は認証を受けて、UKCAマークを貼って、イギリス市場で発売する必要があることを認識しました。しかし,MHRAがイギリスの将来の医療機器規制の相談に応じた後,イギリス政府は2023年に最新のイギリス医療機器立法を公表する予定である。これが
50
医療機器への規制枠組み/要求が大きく変化する可能性がある。これは私たちが必要な認証を得る能力を遅らせるかもしれないし、私たちはイギリスのKCAマークを得るまで、私たちの製品をイギリス市場から撤去しなければならないかもしれない。
私たちはいくつかの連邦、州、そして外国の詐欺と乱用法律、医療情報プライバシーと安全法律、透明性法律の制約を受けており、これらの法律に違反すれば、私たちは実質的な処罰を受けるかもしれない。しかも、このような法律による私たちの接近に対するどんな挑戦や調査も、否定的な宣伝と費用の高さをもたらす可能性がある。
アメリカには多くの医療詐欺と乱用に関連する連邦と州と外国の法律があり、反リベート、虚偽クレームと医師透明性法律を含む。私たちの商業行為と供給者との関係はこのような法律によって検討されている。私たちはまた、連邦政府および私たちが業務を展開している州と外国の司法管轄区域が、患者、顧客、従業員、その他の第三者情報に関連するプライバシーおよび安全法規によって制約される可能性がある。私たちの運営能力に影響を及ぼす可能性のある医療法規は含まれていますがこれらに限定されません
51
これらの法律および法規は、販売計画を含む顧客、医師、または他の潜在的購入者との間で達成可能な様々な財務計画を制限し、それによって、私たちの業務、マーケティング、および他の販売促進活動を制限します。特に、これらの法律は、割引と返却方法、顧客支援、教育と訓練計画、医師相談およびその他のサービス手配を含む、私たちの販売製品をどのように構築するかに影響を与えます。これらの法律の広範性のため、法定例外状況と利用可能な規制安全港の範囲は狭く、それらが受ける解釈範囲は広いため、私たちの現在または未来のいくつかの接近は、そのうちの1つまたは複数の法律の挑戦を受けるかもしれない。
医療規制法を強制的に遵守するために、ある法執行機関は最近、ヘルスケア会社とヘルスケア提供者との相互作用の審査を強化し、医療業界のいくつかの調査、起訴、有罪判決、和解を招いた。例えば、欧州連合加盟国は、処方を誘導し、ラベル外での装置の使用を奨励することを含む、会社が不法と考えられるマーケティング活動を密接に監視する。調査への対応に時間と資源がかかる可能性があり、経営陣の業務への関心を分散させる可能性がある。また,これらの調査の結果として,医療提供者や実体は,法令や会社の誠実な合意に同意する一部として,追加のコンプライアンスや報告要求に同意しなければならない可能性がある。このような調査や和解は、私たちのコストを増加させるか、または他の方法で私たちの業務に悪影響を及ぼす可能性がある。私たちのやり方に疑問を提起したり、調査が成功しなくても、否定的な宣伝をもたらし、対応する費用が高いかもしれない。もし私たちの運営が上記の任意の医療法律または法規または私たちに適用される任意の他の医療法規に違反していることが発見された場合、私たちは行政、民事と刑事罰、損害賠償、罰金、連邦医療保険や医療補助などの政府医療計画から除外され、監禁、契約損害、名声損害、回収、および私たちの業務を削減または再編することを含む処罰を受ける可能性があります。しかも、業界協会はそのメンバー会社の活動を密接に監視している。もしこれらの組織や国家当局が私たちが彼らの法律、法規、規則または標準規定の義務に違反していることを指摘したら、私たちの名声は損なわれ、私たちの業務、財務状況、そして経営結果は損害を受けるだろう, キャッシュフローと見通しは不利な影響を受けるかもしれない。
“海外腐敗防止法”や、輸出規制法、税関法、制裁法、その他の我々の業務を管理する法律を含む反賄賂、反腐敗、反マネーロンダリング法を遵守しないことは、民事や刑事罰、その他の救済措置、法的費用を招く可能性がある。
私たちが国際的存在を拡大するにつれて、私たちはますますアメリカ、EU、他の政府と組織によって加えられた貿易と経済制裁、その他の制限を受けている。米国司法省、商務省、国務院、米国財務省、その他の連邦機関や当局は、経済制裁法、輸出規制法、反海外腐敗法、その他の連邦法規(外国資産制御弁公室(OFAC)が制定した法律·法規に違反した会社や個人に広範な民事·刑事罰を加えることを求める可能性がある。また、反賄賂法は国内と国際賄賂、そして民間および公共部門の賄賂を禁止する。もし賄賂がイギリスで発生したり、贈賄または賄賂を受け取った人がイギリスと密接に関連している場合、個人は賄賂を提供または収賄する実質的な犯罪を犯す。イギリスに設立または英国で一部の業務を経営する組織を登録し、その組織と関連のある人(その組織にサービスを提供する人)が世界のどこでも贈賄を行い、その組織のために業務を取得または保留することを意図している場合、その組織は“反収賄法”に基づいて法的責任を負う。これは厳格な責任犯罪であり、唯一の抗弁理由は、その組織が賄賂を防止する“適切な手続き”を実施しているか、あるいはそのような手続きがないことが合理的であることである。これらの法律と法規、その他の反腐敗法、反マネーロンダリング法、輸出規制法、税関法、裁決法及びその他の我々の業務を管理する法律に基づいて、各政府機関
52
輸出許可証が必要となる可能性があり、制裁された国または制裁された個人または実体との業務活動の停止、およびコンプライアンス計画の修正を含む業務慣行の修正が求められる可能性があり、これはコンプライアンスコストを増加させ、罰金、処罰、および他の制裁を受ける可能性がある。このような法律や法規に違反することは私たちの業務、財務状況、そして経営結果に否定的な影響を及ぼすだろう。私たちの製品は政府や政府の付属実体に販売されているため、私たちは潜在的に“海外腐敗防止法”、“収賄法”または他の関連法律に違反する高いリスクに直面する可能性がある。
私たちは、私たちと私たちの役員、官僚、従業員、代表、コンサルタント、代理人が“海外腐敗防止法”、“海外腐敗防止法”、“反賄賂法”および他の輸出規制、反腐敗、反マネーロンダリング、テロ対策法律法規を遵守することを確保するための政策と手続きを実施した。しかし、私たちの政策と手続きが十分であるか、あるいは役員、高級管理者、従業員、代表、コンサルタント、代理人がなくても、私たちが責任を負う可能性のある行為に従事しないことを保証することはできません。私たちの業務パートナーがいないし、彼らが私たちの契約義務を履行する能力に大きな影響を与える可能性のある行為にも従事しないことは、私たちがこのような行為に対して責任を負うことを保証することもできません。“海外腐敗防止法”、“海外腐敗防止法”、“贈収賄法”または他の輸出規制、反腐敗、反マネーロンダリング、反テロ法律または法規に違反する行為は、厳しい刑事または民事制裁を招く可能性があり、他の責任を負う可能性もあり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちは個人情報を収集、保存、処理、または共有する方法を遵守しなければならず、将来的には他のアメリカ、州、外国の法律法規の制約を受ける可能性がある。私たちは実際にこのような義務を守らないと私たちの業務を損なう可能性があると思う。これらの法律を遵守することは、私たちの顧客基盤の維持と拡大の努力を損なう可能性もあり、私たちの収入を減らすことができる。
業務を展開する際には,健康に関する個人データを含む個人に関するデータを収集,処理,共有することが可能である.米国連邦政府と各州は、個人情報を収集、配布、使用、保存する法律、法規、ガイドライン、規則を採択または提出している。私たちはまた、FDAのガイドラインを含む、医療機器のネットワークセキュリティに関する米国連邦規則、法規、ガイドラインの制約を受ける可能性がある。各州のプライバシーやネットワークセキュリティ法律はそれぞれ異なり,場合によっては米国連邦法律よりも厳しい要求が加えられる可能性がある.例えば、CCPAは、違反行為に対する民事処罰と、データセキュリティ違反に対する個人訴権下の法定損害賠償とを含む、カリフォルニア州住民に拡大されたプライバシー権および保護を提供する。CPRAはこのような保護を拡大し、それは2023年1月1日にほとんどの重要な側面で作動するだろう。他の州は似たような立法提案を採択したり進めている。国家法がもっと保護されているところで、私たちはもっと厳格な規定を守らなければならない。州の法律を守らない人に罰金と罰を科すほか、一部の州では個人情報を悪用した個人に対して個人訴訟を起こす権利が規定されている。私たちが変化する法律と法規を遵守するための持続的な努力は費用がかかるかもしれないし、私たちの政策、手続き、そしてシステムを絶えず修正する必要がある。データ保護に関する法律を守らなければ、私たちは法執行行動のリスクに直面し、このような法律の罰を受ける。私たちが適用されたデータ法に違反していると判断されなくても、政府のこれらの問題の調査は費用が高く、時間が長く、不利な宣伝が生じる可能性があり、これは私たちの業務、財務状況、運営結果、または将来性を損なう可能性がある。
ヨーロッパ経済区やイギリス、その他の国際司法管轄区にも、そこに住んでいる個人データを収集、使用、処理する法律法規がある。このような法律はしばしばアメリカの法律よりもっと厳しい。例えば、私たちは、データ漏洩通知の制限時間の短縮、情報保持の制限、健康データおよび仮名(すなわち、鍵符号化)データに関するより多くの要件、サービスプロバイダと契約したときの追加義務、および個人データに対する個人のより強力な権利を含む、個人データの制御者および処理者に、より厳しい行政要件を適用するGDPRの要求を受ける。GDPRは、EU加盟国が遺伝子、生体認証、または健康データを処理することを制限する法律法規を含む独自のさらなる法律法規を制定することができ、これは、個人データを使用して共有する能力を制限したり、コストを増加させ、私たちの業務や財務状況を損なう可能性があります。もし私たちがGDPRに規定された義務を履行しなければ、私たちは巨額の罰金と訴訟を含むEU規制機関の法執行活動に直面するかもしれない。さらに、EUの法律は、特定の要求が満たされない限り、米国への個人データの移転を制限している。プライバシーとデータ保護の立法と規制構造は発展し続けており、プライバシーやデータ保護問題にますます注目されており、これは私たちの業務に影響を与える可能性がある。例えば、2020年7月、EU裁判所は米国-EUプライバシー保護枠組みの無効を宣言した, これにより、ヨーロッパ経済圏やイギリスから米国へのデータ転送がより厳しく審査され、データプライバシー立法を遵守するコストが増加する可能性がある。私たちは様々なメカニズムに依存して個人データを私たちのヨーロッパ業務からアメリカに移した。私たちはまた、指令2002/58/ECを含む、私たちの加工活動に適した任意のEU指令を実行する各EU加盟国の法律を遵守しなければならない。
53
私たちは時々改正されて代替されたイギリスのデータ保護法の要求を守らなければならない。英国データ保護法とは,(I)“2018年EU(撤回)法案”第3条により英国法の一部を構成する“GDPR”,(Ii)“2018年データ保護法”,(Iii)“2018年EU(撤回)法案”第2条により有効である“2003年プライバシー及び電子通信(EC指令)条例”,及び(Iv)イギリスで有効な任意の他のデータ保護分野の法律(全部又は一部)が時々我々に適用されることである。
私たちまたは私たちと協力している第三者が、データプライバシーやセキュリティ法律、政策、法律義務または業界基準を遵守できていないと判断されたり、消費者権益提唱団体を含めた不正配布や移転を招くいかなるセキュリティ事件も、欧州データ保護機関や米国連邦および州規制機関の法執行行動や調査、罰金および処罰、消費者権益提唱団体を含む政府の法執行行動および調査を引き起こす可能性があり、私たちの顧客、彼らの患者、および他の医療保健専門家の信頼を失う可能性があり、これは私たちの名声を損なう可能性があり、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
最近公布された、あるいは将来アメリカの医療システムを改革する可能性のある立法を含む医療政策の変化は、私たちの業務、財務状況、運営結果を損なう可能性がある。
私たちは高度に規制された産業で運営している。アメリカと各州政府は引き続き提出し、立法或いは行政行動をとることによって、医療保健の獲得性とコストに影響を与える可能性がある。医療改革措置は私たちの業務、財務状況、そして運営結果を損なうかもしれない。
アメリカでは、医療費用を統制するための多くの立法計画が続いているだろう。医療改革は進行されており、継続されるかもしれない。これらの改革努力は臓器調達と移植のカバー面と支払いに重点を置き続けている可能性がある。例えば,医療保険·医療補助サービスセンターは2020年と2021年に規定を発表し,臓器調達組織が連邦医療保険に加入する条件や,臓器調達組織,移植センター,ドナー病院の臓器獲得支払い政策を改正した。
私たちは将来、より多くの州および連邦医療政策および改革措置を取ることが予想され、いずれも医療製品およびサービスのカバー範囲または精算を制限するか、または他の方法でOCSの需要減少または追加の価格設定圧力をもたらし、私たちの業界全体および私たちの顧客に実質的な悪影響を及ぼす可能性がある。臓器調達組織、移植センター或いは病院が提供するサービスの保証範囲或いは精算範囲のいかなる変化或いは不確定性は、OCSの需要に影響を与える可能性があり、更に私たちの業務、財務状況と運営結果に重大な不利な影響を与える可能性がある。
また、他のより広範な立法改革も採択されており、これは私たちの製品の商業成功に悪影響を与え、私たちの製品の商業成功を阻止する可能性があります。改正2011年予算制御法または予算制御法には、2030年までに提供者に支払う医療保険の削減を含む連邦赤字削減のための条項が含まれている(2020年5月1日~2022年3月31日を除く)。Medicare、Medicaid、または他の公共援助または補助金に影響を与える医療計画の重大な支出削減、または任意のより広範な赤字削減努力または“予算制御法案”の立法代替として徴収される任意の重大な税金または費用、または他の態様は、私たちが予想する製品収入に悪影響を及ぼす可能性がある。
我々の業務活動は危険材料の使用に関するものであり,このような材料の使用を規制する環境や職業安全法の遵守が求められている。もし私たちがこのような法律に違反したら、私たちは巨額の罰金、責任、または他の不利な結果に直面するかもしれない。
私たちの研究と開発計画は危険材料の制御された使用に関するものだ。したがって、私たちはこのような材料の使用、処理、処理を管理する国際、連邦、州、そして地方法律の制約を受けている。私たちがこれらの材料を処理して処分する安全手続きはすべての重要な面で適用される法規に適合していると信じているが、これらの材料による意外な汚染や傷害のリスクを除去することはできない。事故が発生したり環境法を遵守できなかったりすれば,それによる被害に責任を負う可能性があり,どのような責任も我々の資産や資源を超える可能性がある。私たちの一般責任保険と傘形保険は、毎回の事故の年間総限度額は最高200万ドルに達すると規定されているが、汚染物質排出に関する責任は含まれていない。私たちが現在加入している保険は、汚染状況または他の特殊または予見不可能な事件による意外な汚染または傷害のすべての責任をカバーするのに十分ではないかもしれない。しかも、一度の事故は私たちの業務を閉鎖するように損害を与えるか、または強要するかもしれない。
54
私たちの普通株に関するリスクと一般リスク
私たち普通株の市場価格はずっと変動し続ける可能性があり、証券集団訴訟の影響を受けるかもしれません。
2022年12月31日までの1年間、私たちの普通株の1株当たりの価格は10.00ドルから64.36ドルまで様々だ。普通株市場の価格変動を引き起こす可能性があるいくつかの要素は
特に医療機器やバイオテクノロジー会社の市場は極端な価格と数量変動を経験しており,これらの変動はその株がこれらの価格や数量変動を経験した会社の経営業績の変化に関係なくあるいは比例しないことが多い。私たちの株価の潜在的な変動性のため、私たちは未来に証券訴訟の目標になるかもしれない。証券訴訟は巨額のコストを招き、経営陣の注意と資源を私たちの業務から移す可能性がある。
証券や業界アナリストが私たちの業務に不利な意見や誤った意見を発表したり、私たちの業務に関する研究報告や不利な研究報告を発表しなかったりすれば、私たちの株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は、業界や証券アナリストが発表した私たちまたは私たちの業務に関する研究と報告の影響を受けています。これらのアナリストのうちの1人以上がわが社への報道を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、金融市場で可視度を失う可能性があり、逆に私たちの株価や取引量を低下させる可能性がある。さらに、私たちのどのアナリストが私たち、私たちのビジネスモデル、または私たちの株式表現に否定的または誤った意見を発表したか、または私たちの経営業績が投資家グループの期待に達しなかった場合、以下の1つまたは複数の項目を追跡する
55
わが社のアナリストを追跡すると、わが社に対する彼らの提案を変えるかもしれません。私たちの株価は下落するかもしれません。
私たちは、再記述された組織規約の中で反買収条項を採択し、法律を改正し、再記述し、マサチューセッツ州法律の条項に制約されており、これらの条項は、当社の現在の取締役会を罷免したり、交換したり、わが社の支配権変更や他の業務合併に関連する試みを実施したりする可能性があります。
私たちが再記述した条項や組織、ならびに改正および再記述された法律およびマサチューセッツ州法律のいくつかの条項は、当社の実際または潜在的な支配権変更に関連し、私たちまたは私たちの証券保有者に有利かもしれないいくつかのタイプの取引を阻止するかもしれません。例えば、私たちが改正して再記載した定款は、任意の株主会議を主宰する議長休会の権利を付与する。私たちの取締役会はまた、株主の承認を必要とすることなく、将来的に任意のカテゴリまたはシリーズの優先株を発行することができ、取締役会が決定した条項に従って行うことができる。私たち普通株保有者の権利は、将来発行される可能性のある任意のカテゴリまたはシリーズ優先株保有者の権利によって制約され、損害を受ける可能性がある。マサチューセッツ州法律はまた、合併が承認されたか、または規定された方法で完了しない限り、特定の商業合併に従事することを禁止している。これらの条項は単独でまたは一緒に敵意の買収、わが社の統制権の変更、あるいは私たちの経営陣の変更を遅らせる可能性があります。
私たちの組織規約指定マサチューセッツ州サフォーク県高等裁判所の商業訴訟会議(または、マサチューセッツ州サフォーク県高等裁判所の商業訴訟会議のみが管轄権がなく、マサチューセッツ州連邦内に位置する別の州または連邦裁判所)が、私たちの株主が開始する可能性のあるタイプの訴訟および訴訟の唯一および独占フォーラムとして指定された場合、これは、私たちおよび私たちの役員および上級管理職に対する訴訟を阻止することができるかもしれない。
私たちの組織規約は、マサチューセッツ州サフォーク県高等裁判所の商業訴訟会議(または、マサチューセッツ州サフォーク県高等裁判所の商業訴訟会議にのみ管轄権がなく、マサチューセッツ州連邦内に位置する別の州または連邦裁判所)が、マサチューセッツ州成文法または一般法に従って提起された任意の訴訟の唯一および独占フォーラムとして指定されている場合:私たちを代表して派生し、私たちの取締役、上級管理職、または他の従業員が私たちまたは私たちの株主の受託責任に違反していると主張します。“マサチューセッツ州商業会社法”のいずれかの条項によるクレーム又は内部事務原則の管轄を主張するクレームは、すべての場合、裁判所は、被告に指定された不可欠な当事者に対して個人管轄権を有する。また、私たちが再記載した組織定款の規定は、任意の個人または実体が私たちの普通株のいかなる権益を購入または他の方法で買収するかは、上記の規定に同意したとみなされます。本条項は、“取引法”、“1933年証券法”(改正)又は“証券法”に基づいて提起された訴訟には適用されない。さらに、この排他的な裁判所条項は、司法フォーラムで私たちの株主が司法フォーラムでこのような株主が、私たちまたは私たちの役員や役員と紛争することに有利だと思うクレームを出す能力を制限する可能性があり、これは、私たちと私たちの役員や幹部に対するこのような訴訟を阻止する可能性があります。代替的に、マサチューセッツ州サフォーク県高級裁判所の商業訴訟会議またはマサチューセッツ州以外の裁判所が、この排他的フォーラム条項が上記の1つまたは複数の特定のタイプの訴訟または訴訟手続に適用されないことを発見した場合、またはそれを強制的に実行することができない, 私たちは、他の場所や管轄区域でこのような問題を解決するために追加コストが生じる可能性があり、これは、私たちの業務、財務状況、経営業績、キャッシュフロー、および将来性に重大な悪影響を及ぼす可能性があります。
財務報告の効率的な内部統制と効率的な開示制御プログラムを保持できなかった場合、財務結果をタイムリーに正確に報告したり、詐欺を防止したりすることができず、投資家がわが社の信頼に悪影響を及ぼす可能性がある。
2002年に改正されたサバンズ·オキシリー法第404条によると、我々の経営陣は、我々の独立公認会計士事務所の財務報告の内部統制の有効性を報告し、財務報告の内部統制に対する我々の独立公認会計士事務所の有効性を証明することを求めなければならない。この評価は財務報告書の内部統制で発見された私たちの経営陣の重大な弱点を開示することを含む。また、私たちは、経営陣が私たちの四半期および年間報告書で財務および他の情報を認証することを要求し、四半期ごとに内部制御プログラムの重大な変化を開示することを要求する米証券取引委員会がサバンズ-オキシリー法案第302条を実施する規則を遵守しなければならない。
もし私たちが財務報告書の内部統制に重大な欠陥があることを発見すれば、私たちは発見された重大な欠陥を適時に修復することができず、私たちの報告義務を遵守し続けるために必要なすべての統制を維持することができないかもしれない。もし私たちの財務報告の内部統制に重大な弱点があることが発見された場合、あるいは404条の要求を直ちに遵守できないか、または財務報告の内部統制が有効であると断言するか、または独立公認会計士事務所ができなければ
56
今後しばらくの間、財務報告に対する内部統制の有効性が低下すれば、投資家は私たちの財務報告の正確性と完全性に自信を失うかもしれない。したがって、私たちの普通株の市場価格は実質的な悪影響を受けるかもしれない。
会計基準の変更及び管理層が複雑な会計事項に関連する主観的な仮定、見積もりと判断は私たちの財務状況と経営業績に重大な影響を与える可能性がある。
私たちは、収入確認、リース、株式ベースの報酬を含むが、これらは複雑であり、私たちの経営陣の主観的な仮定、推定、判断に関連する、当社の業務に関連する広範な事項の会計原則および関連声明、実施ガイドライン、解釈に適用されます。会計声明またはその解釈の変化、または経営陣の基本的な仮定、推定または判断の変化は、我々の報告または予想される財務業績を著しく変化させる可能性がある。
57
項目1 B。未解決の従業員のコメント。
ない。
項目2.財産
私たちの会社本部と製造と臨床訓練施設はマサチューセッツ州アンドーバーにあり、私たちはそこで105,894平方フィートの空間、10,500平方フィートの実験室と訓練施設、7,900平方フィートの10,000級の再構成可能なクリーンルーム施設を借りました。これらの施設の賃貸契約は2027年12月31日に満期となり、レンタル期間を満期日に延長してから5年間延長することが選択できます。
私たちは、新しいレンタルの交渉や追加的または代替的な運営空間の評価を求める可能性があるにもかかわらず、私たちの現在の需要を満たすのに十分な施設を持っていると信じている。私たちは商業的に合理的な条件下で、いつでも適切な代替空間を得ることができると信じている。
項目3.法的訴訟
私たちは現在、実質的な法的手続きの影響を受けていない。私たちは時々法的訴訟や調査に巻き込まれる可能性があり、これは私たちの名声、業務、財務状況に悪影響を与え、私たちの経営陣の業務運営への注意をそらす可能性があります。
第4項鉱山安全情報開示
適用されません。
第II部
第五項登録者普通株式市場、関連株主事項及び発行者が株式証券を購入する。
普通株取引に関するいくつかの情報は
我々の普通株のナスダック世界市場での取引コードはTMDXであり、2019年5月2日から公開取引される。その前に、私たちの普通株は市場を公開しなかった。
58
株式表現グラフ(1)
次の図は、2019年5月2日(私たちの普通株の最初の公開取引日)から2022年12月31日までの比較を示しており、私たちの普通株、ナスダック総合指数、ナスダック医療指数に対する現金投資累計総リターンは100.00ドルとします。このような見返りは歴史的結果に基づいており,未来を示唆するための表現ではない.ナスダック総合指数とナスダックヘルスケア指数のデータは配当金の再投資を想定している。

(1)1934年に改正された証券取引法第18節について言えば、本業績グラフは“募集材料”とみなされてはならず、米国証券取引委員会に“保存”されているとみなされてはならないし、同節に規定された他の責任の制約を受けているとみなされてはならないし、引用によってTransMedics Group,Inc.が改正された1933年証券法によって提出されたいかなる文書にも組み入れられてはならない。
私たち普通株保有者
2023年2月15日現在、約27名の普通株式保有者が登録されている。これらの額には、“著名人”や“街”の名で株を持っている株主は含まれていない。
株式補償計画に基づいて発行された証券
私たちの株式報酬計画に関する情報は、私たちがアメリカ証券取引委員会に提出した2023年年次総会の株主に関する最終依頼書に含まれ、引用によって本明細書に組み込まれます。
最近売却された未登録持分証券
ない。
59
発行人が株式証券を購入する
2022年9月30日から2022年12月31日までの間、登録された株式証券は何も購入していません。
配当をする
私たちは私たちの配当金を発表したり支払ったりしたことがない。予測可能な未来に、私たちは私たちの株のいかなる現金配当金も発表したり支払わないと予想される。将来の現金配当金の発表と支払い(あれば)の任意の決定は、私たちの取締役会によって適宜決定され、適用される法律、私たちの財務状況、経営結果、契約制限、資本要求、業務見通し、一般業務または金融市場状況、および私たちの取締役会が関連すると考えられる他の要素を含む様々な要素に依存します。しかも、私たちの信用協定は私たちが現金配当金を支払う能力を制限する契約を含む。
第六項です。
保留されている
60
項目7.経営陣の以下の問題の議論と分析財務状況と経営実績。
以下、当社の財務状況と経営結果の検討と分析は、当社の連結財務諸表と本年度報告書10-K表の他の部分に関する付記と一緒に読まなければなりません。本議論および分析に含まれるいくつかの情報または本Form 10−K年次報告における他の情報は、リスクおよび不確実性に関する前向きな陳述を含む、我々の業務計画および戦略に関する情報を含む。多くの要因のため、“項目1 A”に列挙された要因が含まれる。本年度報告“Form 10−K”における“リスク要因”の節では,我々の実際の結果は,以下の議論や分析に含まれる前向き陳述に記述または示唆された結果とは大きく異なる可能性がある。
概要
我々は商業段階の医療技術会社であり,複数の疾患州にまたがる終末期臓器不全患者の臓器移植療法を転換している。われわれがOCSを開発したのは数十年来の看護基準に代わるためであり,この基準は世界数十万人の患者の救命を得る移植療法を大きく制限していると考えられる。著者らの革新したOCS技術は人体外器官の自然生活と機能環境の多くの方面を複製した。したがって、OCSは、移植臓器保存を静的から動的環境に変換し、それによって、臓器最適化と評価を含む新しい機能を実現する範式遷移を表す。我々はまた、アウトソーシング臓器検索およびOCS臓器管理を提供し、米国の移植計画により効率的なプロセスを提供し、OCSを介してドナー臓器を獲得する革新的な鍵解決策である我が国OCS計画、またはNOPを開発した。OCSとNOPの併用は,臓器移植の数を著しく増加させ,移植後の結果を改善する可能性があると信じている。
我々はOCSをプラットフォームとして設計し、複数の器官の製品にコア技術を利用することを可能にした。これまで、著者らは3種類のOCS製品を開発し、それぞれ心臓、肺と肝臓移植に使用し、OCSをFDAの許可を得た唯一の携帯型、多臓器、温血灌流技術プラットフォームとした。我々のすべての3つの製品、OCS心臓、OCS肺、およびOCS肝臓は、米国食品医薬品局(FDA)の発売前に承認された。さらに、我々の3つの製品OCS心、OCS肺、およびOCS肝は、脳死後ドナー臓器(DBD器官)および循環死後ドナー臓器(DCD器官)のために許可されている。
設立以来、私たちはすべての資源を私たちの独自のOCS技術プラットフォームと器官専用OCS製品を設計、開発、構築することに集中してきた;臨床試験を通じてOCS製品の安全性と有効性の臨床証拠を獲得し、監督部門の承認を得る;私たちの会社を組織し、配備する;事業を計画する;資金を調達する;私たちの製品を商業化する;国家OCS計画を開発と拡大する;私たちの市場と流通チェーンを発展させ、拡大し、これらの業務に一般的かつ行政的な支持を提供する。これまで、私たちの運営資金は主にローンプロトコルでの借入収益、私たちが公開発行した普通株を売却する収益、そして私たちOCS製品の臨床試験と商業販売収入から来ています。
設立以来、私たちは重大な運営損失を受けた。私たちが利益を達成するために十分な収入を創出できるかどうかは、私たちの製品のさらなる開発と商業化にかかっている。2022年12月31日までの1年間で、9350万ドルの総収入を創出し、純損失は3620万ドルだった。2022年12月31日までの累計赤字は4兆787億ドルだった。予測可能な未来に、私たちは私たちの製品のアメリカと一部の非アメリカ市場での商業販売の増加に集中しているので、私たちのビジネスチームを成長させることを含む、私たちのOCS製品の商業販売を追求する;私たちのNOPを拡大する;私たちの製造と消毒業務を拡大する;次世代OCSを開発する;研究、開発と臨床試験を継続する;アメリカと一部の非アメリカ市場で新しい製品と製品の強化(他の適応または他の臓器を含む)の規制承認を求め、上場企業として運営するために、純損失が続くと予想される。そのため,販売,一般,行政費用,研究,開発,臨床試験費用を含む我々の経営活動に関連する費用を支払うために多くの追加資金が必要となる。
61
製品開発や商業化に関連する多くのリスクや不確実性のため、費用が増加した時間や金額、あるいはいつ、または利益を達成または維持できるかを正確に予測することはできません。これまで、利益を達成するのに十分な収入を生み出すことができれば、株式発行、債務融資、戦略連合の組み合わせで私たちの運営に資金を提供する予定です。私たちは必要な時に割引条項や追加資金を調達できないか、そのような他の合意や手配を達成することができないかもしれない。もし私たちが必要な時に資金を調達したり、このような合意に到達できない場合、私たちは私たちの1つ以上の製品のさらなる開発と商業化努力を大幅に延期、削減、または停止させなければならないかもしれないし、私たちの業務を減少または終了させなければならないかもしれない。
2022年12月31日まで、私たちは2.012億ドルの現金を持っている。私たちはForm 10-K年次報告書を提出した後、私たちの現金は少なくとも12ヶ月の運営費用、資本支出要求、および債務超過支払いを支払うのに十分だと信じている。私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは予想よりも早く利用可能な資本資源を枯渇させるかもしれない。“流動性と資本資源”を見てください
経済的影響と新冠肺炎
インフレ、貿易政策の変化、および関税および関税の徴収は、原材料の価格または獲得性、私たちの製品の構成要素、ならびに輸送および輸送コストに悪影響を与え続ける可能性がある。例えば、世界経済は、大口商品、その他の材料と労働力コストの大幅な変動、消費者自信の低下、経済成長の減速、サプライチェーンの中断、経済安定性の不確定性、および世界的に記録的なインフレを含む極端な変動と破壊を経験している。不利な経済状況は、私たちの製品の需要と価格設定への影響と、私たちの製品の原材料と部品の定価と可用性を含む、私たちの業務に様々なリスクをもたらし続ける可能性があり、在庫需要と財務業績を予測することが困難になる可能性があります。
新型コロナウイルスの伝播を抑制する努力を含む新冠肺炎の大流行は、すでに著者らの業務、財務状況、経営業績とキャッシュフローに影響を与える可能性があり、新変種或いは感染率急増の影響を含む。新冠肺炎の私たちの業務に対する持続的な影響は、私たちの製造運営とサプライチェーンの中断、労働力の不足、生産性の低下、材料やコンポーネントが利用できないこと、私たちの従業員と顧客の旅行能力が制限されていること、および製品の設置、訓練、または出荷が他の影響を受けている国とアメリカ内を往復する遅延を含むかもしれない。
OCS製品で使用されている完成品と原材料の在庫を維持していますが、大流行に関するさらなる延長の中断は、私たちの製品を製造するために必要な原材料不足を招く可能性があります。新冠肺炎が私たちの第三者パートナーの運営に与える影響の程度は未来の発展に依存し、これらの発展は高度な不確定性を持っており、自信に満ちて予測できない。もし私たちの製造、サプライチェーン、または商業運営が長期的に中断されれば、私たちの業務、財務状況、運営結果、見通しに実質的な悪影響を及ぼすことが予想される。
私たちの運営結果の構成要素は
収入.収入
私たちの純製品収入は主に私たちの臓器専用OCSコンソールで使用される使い捨て臓器専用使い捨てセットの販売から来ています。より小さい程度では、我々はまた、OCSゲーム機をクライアントに販売し、顧客に無料で貸したOCSゲーム機を暗黙的にリースすることによって、製品収入を得る。各新しい移植プログラムについて、クライアントは、クライアントの既存の臓器専用OCSコンソールのためのOCS使い捨てデバイスのセットを追加的に購入する。我々はまた、米国のNOPの下でアウトソーシング臓器検索およびOCS臓器管理サービスを提供することによってサービス収入を創出する。
我々のすべての収入は,米国,ヨーロッパ,アジア太平洋地域の移植センターや臓器調達組織の販売から来ており,これらの組織は亡きドナーから臓器を回収して移植を行う非営利組織であり,場合によっては特定の国の移植センターに販売する流通業者からも来ている。我々のほとんどの顧客契約は、OCS灌流器およびOCS解決策からなるコミットメントを含み、我々のNOP項目における臓器回収およびOCS臓器管理サービスコミットメントと、クライアントに販売されても顧客に貸しても1つのOCSコンソールとを含むことができる。
62
顧客注文が使い捨てセットおよび臓器回収またはOCS臓器管理サービスを含む場合、私たちは、使い捨てスーツおよびサービスが別個の履行義務を構成することを決定し、収入が使い捨てスーツおよびサービスのためにそれぞれ顧客に渡されることを確認する。
私たちは顧客プロトコルを持っていて、このプロトコルに基づいて、私たちはプロトコル期限内にOCSコンソールをクライアントに貸します。この場合、私たちは、臓器専用のOCSコンソールを顧客現場に配置し、クライアントは、各移植中に使用されるOCS使い捨てデバイスを個別に購入する。OCSコンソールをクライアントに貸したとき、我々は、コンソールの所有権を常に保持し、任意のOCS製品に関連する最低購入コミットメントをクライアントに要求しない。この場合、我々は、受信した各新しい移植プログラムの顧客注文および顧客プロトコルに規定された価格に基づいて、OCS使い捨てデバイスの請求書をクライアントに発行する。時間が経つにつれて、私たちは、一般に、顧客が追加のOCS使い捨てセットを購入し、使用することによって、レンタルされたOCSコンソールのコストを回収する。これらの理由から、使い捨てスーツの一部の販売価格は、OCSコンソールを使用した暗黙的なレンタル料であることが決定された。
私たちのいくつかの顧客臨床試験プロトコルによると、私たちは顧客に臨床試験材料の精算と彼らのOCS製品の使用に関連する特定の臨床文書を支払った。その中のいくつかの支払いは私たちに単独で識別可能な収益を提供していないため、私たちはこのような支払いを顧客収入の減少に記録し、私たちの純製品収入報告をもたらした。
2022年12月31日現在,米国以外でのすべての販売は商業販売である(どの臨床試験にも関係ない)。私たちのEUでの販売は私たちの各OCS製品のCEマーク認証を獲得して維持することに依存します。EU医療機器法規(法規2017/745)またはMDRの要件に基づいて、我々は、OCSコンソール、OCS使い捨て用品、およびOCS溶液添加剤を含む各OCS心肺システムのCEマーク再認証を2022年9月に取得した。また、2022年9月にOCS肝臓コンソールおよび使い捨て製品のCEマークの再認証を取得した。私たちはOCS肝臓のCEマーカーを申請し、今後12ヶ月以内にMDR項目の下で私たちの溶液添加剤を受け取る予定だ。
米国でOCS肺,OCS心臓およびOCS肝臓を獲得したPMA,および米国におけるNOPの継続拡大により,我々の収入は長期的に増加すると予想される。また,国立ヘルスケアシステムがOCSを使用した費用の返済を開始した場合,移植センターがより多くの移植症例でOCSを使用すれば,より多くの移植センターがその計画にOCSを採用すれば,我々の収入は長期的に増加することが予想され,これは米国での販売増加が予想される結果である。
収入コスト、毛利、利回り
製品純収入コストは、OCSゲーム機および使い捨てデバイスのコンポーネントコスト、直接材料コスト、人工コスト、および製造を直接サポートする製造間接費用、および顧客に貸したOCSゲーム機の減価償却を含む。私たちがOCSコンソールを顧客に無料で貸して使用するとき、私たちはOCSコンソールのコストを財産およびデバイスとして資本化し、その使用寿命が予想される5年以内に減価償却する。OCS使い捨てセットのコストは、我々のOCS肺、OCS心臓、およびOCS肝臓解決策のコストを含む。サービスコスト収入は、主に臓器回収およびOCS臓器管理サービスを直接サポートする労働力および管理費用および輸送コストを含む。私たちは収入コストが主に私たちの収入の増加または減少に伴って増加または減少すると予想し、主に絶対ドルで計算される。
毛利は各報告期間内に私たちの収入が私たちの収入コストを超える金額を意味する。私たちは毛利を営収で割って毛利を計算した。私たちの毛金利はずっと各種の要素の影響を受け続けます。主に生産量、部品と直接材料のコスト、製造間接費用、直接人工、NOPによって提供されるサービスコスト及び私たちのOCS製品とNOPサービスの販売価格です。
私たちは私たちの販売量と生産量の増加、そして規模経済、私たちの製品の改善と製造効率の向上に伴い、私たちのOCS使い捨て設備の単位コストが低下し、純製品収入コストが純製品収入に占める割合は適度に低下し、毛金利と毛利益は適度に増加すると予想している。私たちは私たちの設計、工事と製造能力を利用して、私たちの製造技術の効率を更に推進し、高めるつもりです。これはコストを下げて、私たちの毛利率を高めると信じています。また、私たちがより多くのサービスを提供することと、規模と経験の向上により、これらのサービスの提供効率は将来的に私たちのサービス利回りが少し改善されることを見ることができると予想しています。私たちの毛金利は長期的に増加すると予想されていますが、それらは四半期の変化によって変動するかもしれません。
63
運営費
研究·開発·臨床試験費用
研究、開発および臨床試験費用は、主に、我々の研究活動、製品開発、ハードウェアおよびソフトウェア工学、臨床試験が、我々の製品の安全性および有効性を継続的に開発するための臨床証拠、規制費用、試験、コンサルティングサービス、および当社のOCS技術プラットフォームおよびOCS製品に関連する他のコストを含む
私たちは研究、開発、臨床試験の費用を負担する。長期的には,持続的な製品開発や承認作業により,研究,開発,臨床試験の費用が増加することが予想される。米国や他のサービス地域で適応を拡大し,より多くの規制承認を得ることに関する活動を継続し,我々の次世代OCS技術プラットフォームを開発する予定である。
販売、一般、行政費用
販売、一般および行政費用は、主に私たちのビジネスチームの人員と、株式ベースの給与を含む実行、マーケティング、財務、行政機能者の賃金および関連コストを含む。販売、一般および行政費用には、施設に関連する直接および分担費用、物流費用、販売促進活動、マーケティング、会議および貿易展示費用、ならびに法律、特許、コンサルティング、投資家および公共関係、会計および監査サービスの専門費用も含まれる。私たちのOCS製品のアメリカと一部の非アメリカ市場での商業販売が引き続き増加することに伴い、私たちは引き続き私たちのビジネスチームの従業員数を増加させ、マーケティングに力を入れることが予想されます。私たちは、私たちのOCS製品と国家OCS計画の予想される持続的な販売増加をサポートするために従業員数を増加させるにつれて、私たちの販売、一般、および管理費用は長期的に増加すると予想している。
その他の収入(費用)
利子支出
利息支出には、我々の融資協議下の未返済借入金に関する利息支出と、当該等の合意に関連する債務割引の償却とが含まれる。2022年7月、私たちはカナダ帝国商業銀行(Canada Imperial Bank of Commerce、略称CIBC)とクレジット合意に達し、合意に基づいて6000万ドルを借りました。その際,これまでOrbiMed Royalty Opportunities II,LPやOrbiMedと合意していたクレジット合意によって返済されていなかった残り3,500万ドルの元金を返済した。
その他の収入,純額
その他の収入(費用)、純額には、利息収入、実現されていない外貨取引損益、その他私たちの核心業務とは関係のない営業外収入と費用項目が含まれています。利息収入には私たちの投資現金残高から稼いだ利息が含まれています。外貨取引損益は会社間取引から次のようになる
64
及び顧客又は仕入先との取引は、取引を記録した法人実体の本位貨幣以外の貨幣建てで取引する。
所得税支給
私たちが設立して以来、私たちは毎年発生している純運営損失、あるいはアメリカで発生した研究開発税収控除記録のためにいかなるアメリカ連邦あるいは州所得税優遇も記録していません。既存の証拠の重みによって、私たちのすべての純運営損失の繰越と税金控除は実現できない可能性が高いと思います。私たちは私たちの外国子会社の運営に関する些細な外国所得税の支出を記録した。
2022年12月31日現在、私たちは3.785億ドルの連邦純営業損失の繰り越しがあり、将来の課税収入を相殺することができ、そのうち2.095億ドルの純営業損失は2023年からの異なる期日で満期になり、残りの1.69億ドルは満期になっていないが、その用途は年間課税収入の80%に相当する年間減額に限られている。2022年12月31日現在、私たちは3.212億ドルの州純営業損失が繰り越しており、これらの損失は将来の課税収入を相殺し、2030年に開始する異なる日に満期になる可能性がある。2022年12月31日まで、米国連邦と州の研究開発税収控除はそれぞれ900万ドルと550万ドルで、将来の税収負担を相殺し、それぞれ2023年と2024年に満期を始める可能性がある。2022年12月31日現在、海外純運営赤字を繰り越していません。私たちは資産負債表ごとに私たちの繰延税項目の純資産について全額推定値を記録しました。
2022年、2021年、2020年12月31日までの年間実績
次の表は、2022年、2021年、2020年12月31日までの年度の経営成果をまとめたものです
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
|
|
(単位:千) |
|
|||||||||
収入: |
|
|
|
|
|
|
|
|
|
|||
製品純収入 |
|
$ |
79,234 |
|
|
$ |
29,657 |
|
|
$ |
25,092 |
|
サービス収入 |
|
|
14,225 |
|
|
|
605 |
|
|
|
547 |
|
総収入 |
|
|
93,459 |
|
|
|
30,262 |
|
|
|
25,639 |
|
収入コスト: |
|
|
|
|
|
|
|
|
|
|||
製品純収入コスト |
|
|
16,970 |
|
|
|
9,031 |
|
|
|
8,961 |
|
サービスコスト収入 |
|
|
11,217 |
|
|
|
72 |
|
|
|
43 |
|
収入総コスト |
|
|
28,187 |
|
|
|
9,103 |
|
|
|
9,004 |
|
毛利 |
|
|
65,272 |
|
|
|
21,159 |
|
|
|
16,635 |
|
運営費用: |
|
|
|
|
|
|
|
|
|
|||
研究·開発·臨床試験 |
|
|
26,812 |
|
|
|
22,304 |
|
|
|
18,831 |
|
販売、一般、行政 |
|
|
69,897 |
|
|
|
38,283 |
|
|
|
24,188 |
|
総運営費 |
|
|
96,709 |
|
|
|
60,587 |
|
|
|
43,019 |
|
運営損失 |
|
|
(31,437 |
) |
|
|
(39,428 |
) |
|
|
(26,384 |
) |
その他の収入(支出): |
|
|
|
|
|
|
|
|
|
|||
利子支出 |
|
|
(3,726 |
) |
|
|
(3,874 |
) |
|
|
(3,985 |
) |
その他の収入,純額 |
|
|
(1,002 |
) |
|
|
(877 |
) |
|
|
1,653 |
|
その他の費用の合計 |
|
|
(4,728 |
) |
|
|
(4,751 |
) |
|
|
(2,332 |
) |
所得税前損失 |
|
|
(36,165 |
) |
|
|
(44,179 |
) |
|
|
(28,716 |
) |
所得税支給 |
|
|
(66 |
) |
|
|
(36 |
) |
|
|
(32 |
) |
純損失 |
|
$ |
(36,231 |
) |
|
$ |
(44,215 |
) |
|
$ |
(28,748 |
) |
65
2022年と2021年12月31日終了年度比較
収入.収入
|
|
十二月三十一日までの年度 |
|
|
|
|
||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||
国と機関別の収入: |
|
|
|
|
|
|
|
|
|
|||
アメリカです |
|
|
|
|
|
|
|
|
|
|||
肺総収入 |
|
$ |
7,967 |
|
|
$ |
9,843 |
|
|
$ |
(1,876 |
) |
ハート総収入 |
|
|
29,902 |
|
|
|
10,103 |
|
|
|
19,799 |
|
肝臓総収入 |
|
|
46,169 |
|
|
|
1,915 |
|
|
|
44,254 |
|
アメリカの総収入 |
|
|
84,038 |
|
|
|
21,861 |
|
|
|
62,177 |
|
他のすべての国/地域 |
|
|
|
|
|
|
|
|
|
|||
肺収入 |
|
|
880 |
|
|
822 |
|
|
|
58 |
|
|
心臓収入 |
|
|
8,451 |
|
|
|
7,579 |
|
|
|
872 |
|
肝臓収入 |
|
|
90 |
|
|
|
— |
|
|
|
90 |
|
他のすべての国·地域の総収入 |
|
|
9,421 |
|
|
|
8,401 |
|
|
|
1,020 |
|
総収入 |
|
$ |
93,459 |
|
|
$ |
30,262 |
|
|
$ |
63,197 |
|
2022年12月31日までの年間で、米国の顧客からの収入は8400万ドルであり、2021年12月31日までの年間と比較して6220万ドル増加したが、これは主に我々のOCS肝臓およびOCS心臓使い捨てセットの販売量が増加したが、我々のOCS肺使い捨てセットの販売量低下部分はこの影響を相殺したためである。上の表の各器官の収入には、使い捨てセットを販売する純製品収入と、“国家行動計画”に従って米国で提供される臓器検索およびOCS臓器管理サービスのサービス収入が含まれる。2022年12月31日までの1年間、NOPに参加している顧客からの収入は、米国の顧客総収入の約89%を占めている。OCS肝臓使い捨てセットおよび臓器回収およびOCS臓器管理サービスの米国での販売収入が4430万ドル増加したのは、主に、FDAがOCS肝臓製品および我が国OCS計画を承認し、2022年12月31日までの年間にOCS肝臓使い捨てセットの販売量を拡大したためである。OCS心臓使い捨てセットおよび臓器回収およびOCS臓器管理サービスの米国での販売収入が1980万ドル増加したのは、FDAが2021年第3四半期にOCS心臓を承認し、2022年4月に追加のDCD心臓PMA補充適応を承認し、2022年12月31日までの年間で全国OCS計画を拡大したためである。OCS肺使い捨てセットの販売量の減少により、OCS使い捨てセットおよび臓器回収およびOCS臓器管理サービスの米国における販売収入は190万ドル減少した。
2022年12月31日までの会計年度では、米国以外の顧客からの収入は940万ドルで、2021年12月31日現在の年度に比べて100万ドル増加した。2022年12月31日までの1年間、OCS肺、OCS心臓、およびOCS肝臓使い捨てセットの定価向上および販売量の増加により、米国以外の収入は2021年12月31日までの年より増加した。この増加は80万ドルの為替レートの悪影響によって部分的に相殺される。
66
収入コスト、毛利、利回り
純製品収入コストは790万ドル増加し,2021年12月31日までの年度の900万ドルから2022年12月31日までの年度の1700万ドルに増加した。国家OCS計画が2021年末に開始されるにつれて、サービスコスト収入は1110万ドル増加し、2021年12月31日までの年間10万ドルから2022年12月31日までの年間1120万ドルに増加した。2022年12月31日までの1年間で、毛利益は2021年12月31日までの年間より4410万ドル増加した。2022年12月31日までの1年間に、ある臨床試験は計算すべき項目の推定が変化したため、毛利益は140万ドルの有利な影響を含む。
2022年12月31日と2021年12月31日までの年度の純製品収入の毛金利はそれぞれ79%と70%である。純製品収入の毛金利の増加は主に米国の販売量の増加とより価格の高いOCS使い捨てデバイスの販売増加による規模経済である。2022年12月31日までの年間サービス収入の毛金利は21%であり、主に著者らのNOP下の臓器検索とOCS器官管理サービスから来ている。2021年12月31日までの年間のサービス収入には、主に、当社のNOP拡大前に提供される少量の臓器管理サービスと、直接調達顧客に提供されるトレーニングサービスが含まれています。
運営費
研究·開発·臨床試験費用
|
|
十二月三十一日までの年度 |
|
|
|
|
||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||
|
|
(単位:千) |
|
|||||||||
関係者(株ベースの報酬を含む) |
|
$ |
9,548 |
|
|
$ |
8,292 |
|
|
$ |
1,256 |
|
臨床試験コスト |
|
|
1,778 |
|
|
|
3,180 |
|
|
|
(1,402 |
) |
コンサルティングと第三者テスト |
|
|
5,104 |
|
|
|
4,212 |
|
|
|
892 |
|
実験室用品と研究材料 |
|
|
5,404 |
|
|
|
2,837 |
|
|
|
2,567 |
|
他にも |
|
|
4,978 |
|
|
|
3,783 |
|
|
|
1,195 |
|
総研究·開発·臨床試験 |
|
$ |
26,812 |
|
|
$ |
22,304 |
|
|
$ |
4,508 |
|
研究·開発·臨床試験総支出は450万ドル増加し,2021年12月31日までの年度の2230万ドルから2022年12月31日までの年度の2680万ドルに増加した。人事関連費用が130万ドル増加した要因は,株による報酬支出が40万ドル増加したことであり,新入社員や既存従業員への追加補助金の支給や従業員数の増加に関係している。コンサルティングと第三者テスト、実験室用品、研究材料、その他のコストはそれぞれ90万ドル、260万ドル、120万ドル増加しました。これは、私たちの次世代計画と現在行われている既存の研究活動が活動を増加させたためです。2021年9月にFDAがOCS心臓とOCS肝臓を承認した後に発売前に許可された臨床試験登録活動を完成したため、臨床試験コストは140万ドル減少した。
販売、一般、行政費用
|
|
十二月三十一日までの年度 |
|
|
|
|
||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||
|
|
(単位:千) |
|
|||||||||
関係者(株ベースの報酬を含む) |
|
$ |
39,350 |
|
|
$ |
21,202 |
|
|
$ |
18,148 |
|
プロおよび顧問料 |
|
|
7,991 |
|
|
|
7,032 |
|
|
|
959 |
|
商展と会議 |
|
|
4,347 |
|
|
|
1,445 |
|
|
|
2,902 |
|
物流やその他 |
|
|
18,209 |
|
|
|
8,604 |
|
|
|
9,605 |
|
販売、一般、行政費用の合計 |
|
$ |
69,897 |
|
|
$ |
38,283 |
|
|
$ |
31,614 |
|
販売·一般·行政費総額は3,160万ドル増加し,2021年12月31日現在の年度の3,830万ドルから2022年12月31日までの年度の6,990万ドルに増加したのは,人員関連のコスト,専門·コンサルタント費用,展示会や会議および物流その他のコストの増加によるものである。主に、私たちのチームが国家OCS計画をサポートするために拡大し続け、米国における当社のOCS心臓およびOCS肝臓製品の商業的増加、および株式ベースの報酬の増加のため、関係者に関連するコストが1,810万ドル増加した
67
300万ドルを支出した主な理由は、新入社員と既存従業員に追加補助金を提供することだ。我が国OCS計画拡張に関連する追加販売と管理コストのため、専門家と相談費は100万ドル増加しました。商展や会議費が290万ドル増加したのは,対面活動の増加が原因であり,新冠肺炎の大流行に対応するための規制が緩和されたためである。物流および他のコストは、我が国OCS計画拡張に関連する起動および物流コストが増加したため、960万ドル増加した。
その他の収入(費用)
利子支出
2022年12月31日と2021年12月31日までの年間の利息支出はそれぞれ370万ドルと390万ドル。減少は,カナダ帝国商業銀行信用協定では我々の債務金利が低いが,我々が以前OrbiMedと締結していたクレジット協定での未返済融資元金に比べて未返済融資元金が増加し,その影響を部分的に相殺したためである。
その他の費用、純額
2022年12月31日と2021年12月31日までの年度の他の費用純額には、それぞれ90万ドルと10万ドルの利息収入が含まれており、これは私たちの投資現金残高がより高い利息を稼いでいるためだ。その他の費用のほか、純額には実現済みと未実現の外貨取引損失がそれぞれ130万ドルと100万ドル含まれている。2022年12月31日までの年度、その他の費用純額には60万ドルの債務弁済損失も含まれている。
2021年12月31日までと2020年12月31日までの年度比較
我々の2021年12月31日までの年度と2020年12月31日までの年度の経営業績の比較については,項目7.経営陣の財務状況と経営成果の検討と分析−我々の経営業績の構成要素である2021年12月31日までの年次報告に含まれる2021年12月31日現在の年度と2020年の比較を参照されたい。
流動性と資本資源
2022年12月31日現在、私たちの主な流動性源は現金2.012億ドルだ。設立以来、私たちは重大な運営損失を受けた。これまで、私たちの運営資金は主にローンプロトコルでの借入収益、私たちが公開発行した普通株を売却する収益、そして私たちOCS製品の臨床試験と商業販売収入から来ています。
キャッシュフロー
次の表は、列挙された各期間の現金源と用途をまとめています
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
|
|
(単位:千) |
|
|||||||||
経営活動用の現金 |
|
$ |
(45,817 |
) |
|
$ |
(28,864 |
) |
|
$ |
(30,265 |
) |
投資活動によって提供される現金 |
|
|
54,513 |
|
|
|
29,267 |
|
|
|
(41,598 |
) |
融資活動で提供された現金 |
|
|
167,927 |
|
|
|
1,393 |
|
|
|
75,549 |
|
為替レート変動対現金·現金等価物と |
|
|
(1,021 |
) |
|
|
(797 |
) |
|
|
803 |
|
現金、現金等価物、および限定的な現金の純増加 |
|
$ |
175,602 |
|
|
$ |
999 |
|
|
$ |
4,489 |
|
経営活動
2022年12月31日までの1年間に、経営活動は4580万ドルの現金を使用したが、主な原因は、私たちの純損失3620万ドルと、私たちの運営資産と負債の変化に使用された現金純額2680万ドルだったが、1720万ドルの非現金費用純額によって部分的に相殺された。2022年12月31日までの1年間、我々の経営資産と負債の変化に使用された純現金には、主に2170万ドルの売掛金増加と800万ドルの在庫増加が含まれていたが、一部は前払い費用250万ドルの減少によって相殺された。
68
2021年12月31日までの1年間、経営活動は2890万ドルの現金を使用したが、主な原因は4420万ドルの純損失があったが、1230万ドルの非現金費用純額と300万ドルの運営資産と負債の変化によって提供された現金純額によって部分的に相殺されたからだ。2021年12月31日現在、私たちの経営資産と負債の変化が提供する現金純額は、主に売掛金と売掛金およびその他の流動負債の1,000万ドルの増加と売掛金の80万ドルの減少を含むが、在庫増加490万ドルと前払い費用およびその他の流動資産の増加320万ドルによって部分的に相殺される。
各報告期間の売掛金、在庫、売掛金、売掛金、その他の流動負債の変動は、一般に私たちの業務の増加および領収書と支払いのスケジュールによるものです。
投資活動
2022年12月31日までの年間で、投資活動が提供する現金純額は5450万ドルで、7690万ドルの有価証券販売と満期日収益を含み、一部は1050万ドルの有価証券購入と1190万ドルの不動産·設備購入によって相殺された。
2021年12月31日までの年間で、投資活動が提供する現金純額は2930万ドルで、有価証券の売却と満期の収益1.048億ドルを含み、一部は有価証券購入7200万ドルと不動産·設備購入350万ドルで相殺された。
融資活動
2022年12月31日までに、融資活動が提供する現金純額は1兆679億ドルで、当社が2022年8月に公開発売した純額1.399億ドル、長期債務発行による純額5850万ドル、購入権行使時に普通株を発行した際に得られた金470万ドル、2019年の従業員の株式購入計画に関する普通株発行に関する金50万ドルおよび株式承認証行使時に普通株を発行した場合の得られた金40万ドルを含み、一部は3,610万ドルの長期債務返済に相殺された。
融資活動が提供する現金純額は2021年12月31日までの1年間で140万ドルで、株式オプション行使時に普通株を発行する収益100万ドルと、従業員株式購入計画に関する普通株発行収益40万ドルを含む。
2020年12月31日までの年間キャッシュフローの検討については,2021年12月31日までの年次報告Form 10−Kに含まれる項目7.経営陣の財務状況と運営結果の検討と分析−流動性と資本資源−キャッシュフローを参照されたい。
長期債務
2022年7月、私たちはカナダ帝国商業銀行と信用協定を締結し、この協定に基づいて、私たちは6,000万ドルを借りて、ここではカナダ帝国商業銀行信用協定と呼ばれています。私たちはカナダ帝国商業銀行信用協定の収益を使用して、私たちがOrbiMedと2018年6月に締結した信用協定でのすべての満期金額を返済した。
カナダ帝国商業銀行信用協定項の下の借入金は年利で利上げされ、金利は(I)吾らが選択した担保付き隔夜融資金利であり、最低金利は1.5%、プラス2.0%、または(Ii)1.0%プラスa)最優遇金利、最低金利は4.0%、またはb)連邦基金有効金利を加え、0.5%である。カナダ帝国商業銀行信用協定項の下の借金は最初の24ヶ月に毎月利息のみで支払い、その後、カナダ帝国商業銀行信用協定が2027年7月に満期になるまで、等しい毎月元金プラス応利息で支払われる。最初の24ヶ月後にいくつかの収入マイルストーンに達した場合、私たちは利息だけの返済期間を1年延長するかもしれない。吾らはカナダ帝国商業銀行信用協定項の未返済借金を前払いし、締め切り後12ヶ月前に支払う場合、前払いは未返済借金の2.0%であり、締め切り後12ヶ月後から24ヶ月前に支払う場合は、1.0%の前払いを選択することができる。
カナダ帝国商業銀行信用協定の下のすべての債務は私たちと私たちのすべての主要な子会社によって保証されます。いくつかの例外を除いて、私たちとすべての保証人のすべての債務は、私たちと各保証人のほとんどの資産(彼らの知的財産を含む)を担保にしている。カナダ帝国商業銀行の信用協定によると、私たちはいつもの陳述と保証、違約事件及びいくつかの積極と消極的な契約に同意し、私たちは期限が切れるまでこれらの契約を守ります。他の条約を除いて、金融協約には(X)最低流動資金を維持する要求が含まれている
69
(I)過去4ヶ月間の総合調整EBITDA損失(または収益)(EBITDAが負の場合のみ)および(Ii)1,000万ドル、および(Y)純収入総額の少なくともカナダ帝国商業銀行総収入計画に提出されたレベルの75%の維持を要求し、両者は大きい者を基準とした。特定の違約事件が発生した場合、支払い違約、制御権変更、破産、資金不償還、その他の重大な債務項目の下のいくつかの違約、政府の承認に関連するある事件(もしこのような事件が私たちの業務に重大な不利な変化を引き起こす可能性がある場合)、特定の契約を遵守できなかったこと及び私たちの業務、運営或いは財務状況に重大な不利な変化が発生した場合、CIBC信用協定項下の義務は加速する可能性がある。2022年12月31日まで、私たちはカナダ帝国商業銀行信用協定のすべての条項を遵守した。
違約事件が継続している間、年利率は違約事件発生時に適用すべき金利に2.0%をプラスすることになる。違約事件(破産または債務不履行のある事件を除く)が発生しても継続している場合、カナダ帝国商業銀行は、借入金元金の全部または一部に応算と未払い利息を加えて満期と対応とすることを宣言することができる。ある破産または債務返済不能事件が発生すると、借金のすべての未返済元金に応算と未払い利息が自動的に満期になって支払うことになる。さらに、いくつかの例外を除いて、私たちは、いくつかの資産売却およびいくつかの死傷者および事件を非難する現金の純収益の一部で未返済借金を前払いすることを要求されるかもしれない。
資金需要
私たちがOCS製品の商業販売を追求し、増加するにつれて、私たちは将来、私たちのコストと支出が増加することを予想し、特に私たちのビジネスチームを拡大し、我が国のOCS計画を拡大し、私たちの製造と消毒業務を拡大し、研究、開発と臨床試験を継続し、アメリカと一部の非アメリカ市場で新製品と製品の強化(新適応を含む)の規制承認を求める。例えば、私たちの製品に対する需要が私たちの既存の製造と滅菌能力を超えたら、私たちがこのような業務を十分に拡大するまで、注文を履行する能力は制限されます。また、初公募が終了した後、上場企業の運営に関する追加コストが発生し続けると予想されている。私たちの経営と資本支出の時間と金額は多くの要素に依存するだろう
私たちは私たちの既存の現金がForm 10-K年度報告書を提出してから少なくとも12ヶ月以内に私たちの運営費用、資本支出要求、および債務超過支払いに資金を提供できると信じている。
私たちは追加的な資金を集める必要があるかもしれないし、これらの資金は優遇的な条件で提供されないかもしれないし、全くできないかもしれない。“第1 A項参照。リスク要因-私たちの財務状況と追加資本需要に関連するリスク“。
70
実質的契約義務
私たちの契約義務にはカナダ帝国商業銀行信用協定によって支払われるべき元金と利息が含まれています。2022年12月31日現在、私たちの未返済元金残高は6000万ドルで、2027年に満期になります。2023年に370万ドルの利息を支払うと思います。私たちの支払いの見積もりは、2022年12月31日の有効金利である6.1%の仮定金利に基づいています。
私たちはキャンセルできない運営レンタル方式で私たちの施設をレンタルします。2022年12月31日まで、レンタル期間は5年です。2022年12月31日まで、1050万ドルの固定レンタル支払い義務があり、そのうち200万ドルは2023年の間に支払います。
2021年1月には、2029年12月までに指定年度最低数量の商品を購入するという無条件950万ドルの調達約束を正常業務中に達成しました。罰金がなければ、契約はキャンセルできません。2022年12月31日まで、私たちの残りの購入約束は700万ドルだった。
著者らはまた正常な業務過程中にコンサルティング会社、材料サプライヤーとその他の第三者と臨床試験、テストと製造サービスについて他の契約を締結した。このような契約には最低購入約束は含まれておらず、私たちは事前に書面で契約をキャンセルすることを通知することができる。キャンセル時に支払うべき金額には、キャンセル日までに提供されるサービスの支払いまたは発生した費用のみが含まれており、当サービス提供者のキャンセル不可義務が含まれています。以上の議論には、これらの支払いの金額と時間が分からないため、これらの支払いは含まれていない。
重要な会計政策と重大な判断と見積もり
私たちの総合財務諸表はアメリカで認められている会計原則に基づいて作成されています。我々の総合財務諸表および関連開示を作成する際には、資産、負債、収入、コストおよび費用、および関連開示報告金額に影響を与える推定、仮説、判断を行う必要がある。私たちは持続的な基礎の上で私たちの推定を評価する。異なる仮定や条件の下で、私たちの実際の結果はこれらの推定とは異なる可能性がある。
我々の主な会計政策は、本年度報告10-K表の他の部分の総合財務諸表付記2により詳細に記載されているが、以下の会計政策は、我々の総合財務諸表の作成に使用される判断と推定に最も重要であると考えられる。
収入確認
私たちの純製品収入は主に私たちの臓器専用OCSコンソールで使用される使い捨て臓器専用使い捨てセットの販売から来ています。より小さい程度では、我々はまた、OCSゲーム機および顧客に無料で貸与されたOCSゲーム機の暗黙的リースをクライアントに販売することによって収入を得る。各新しい移植プログラムについて、クライアントは、クライアントの既存の臓器専用OCSコンソールのためのOCS使い捨てデバイスのセットを追加的に購入する。我々はまた、米国のNOPの下でアウトソーシング臓器検索およびOCS臓器管理サービスを提供することによってサービス収入を創出する。
我々は,(1)顧客との契約を決定する,(2)契約中の履行義務を決定する,(3)取引価格を決定する,(4)取引価格を契約に割り当てる履行義務,および(5)契約履行義務を履行する際に収入を確認する,の5つのステップで顧客に販売されている収入を確認する.
我々のほとんどの顧客契約は、OCS灌流器およびOCS解決策からなる配信可能な成果を含む複数の義務を有する。クライアント契約配信コンテンツはまた、顧客に販売するか、顧客に提供するかにかかわらず、我が国OCS計画またはOCS制御ステーション下の臓器検索およびOCS臓器管理サービスを含むことができる。私たちはそれが異なる履行義務を代表するかどうかを決定するために、多重履行義務手配のすべての約束を評価する。私たちの顧客スケジュールでは、私たちが収入を得る主な業績義務は、OCS灌流器、OCS解決策、OCSコンソール、臓器検索サービス、およびOCS臓器管理サービスである。
71
クライアント注文がOCSコンソールを含む場合、顧客トレーニングおよびOCSコンソールのデバイス設定は、個別に販売されていないので、当社のOCSコンソールの販売または貸し出しと共にのみ実行されることが決定された。さらに、トレーニングおよびデバイス設定が完了する前に、クライアントがOCSコンソールから利益を得ることができないので、OCSコンソール自体がユニークではないことが決定された。したがって、注文がOCSコンソールを含む場合、トレーニング、OCSコンソールデバイス設定、およびOCSコンソール自体は、単一の総合的な性能義務であると結論する。OCSコンソールがクライアント現場に到着し、トレーニングおよびデバイス設定を完了した後にのみ、単一の総合的な性能義務からの収入を確認します。
クライアント注文は、OCSコンソールおよび各グラフト中に使用されるOCS使い捨てセットを使用することを含むことができる。OCSコンソールをクライアントに貸したとき、我々は、コンソールの所有権を常に保持し、任意のOCS製品に関連する最低購入コミットメントをクライアントに要求しない。この場合、我々は、受信した各新しい移植プログラムの顧客注文および顧客プロトコルに規定された価格に基づいて、OCS使い捨てデバイスの請求書をクライアントに発行する。時間が経つにつれて、私たちは、一般に、顧客が追加のOCS使い捨てセットを購入し、使用することによって、レンタルされたOCSコンソールのコストを回収する。これらの理由から、使い捨てデバイスの部分的な配置考慮要素は、OCSコンソールを使用するレンタル料を暗黙的に支払うことであることが決定された。したがって、我々は、各異なる履行義務の相対的に独立した販売価格を推定することに基づいて、レンタル配信アイテム(すなわち、OCSコンソール)と非レンタル送達アイテム(すなわち、OCS使い捨てセット)との間にペア価格を割り当てる。今まで、レンタル交付成果に割り当てられた金額は取るに足らなかった。
OCS注入器、OCSソリューション、およびOCSゲーム機をクライアントに販売する収入は、我々の総合経営レポートにおいて製品純収入として分類される。顧客への臓器検索およびOCS臓器管理サービスの販売収入は、我々の総合ビジネスレポートにおいてサービス収入として分類される。
制御権が顧客に転送されると、収入が確認され、その金額は、製品やサービスを交換する権利があることが予想される対価格を反映している。顧客注文が使い捨てセットおよび臓器回収またはOCS臓器管理サービスを含む場合、私たちは、使い捨てスーツおよびサービスが別個の履行義務を構成することを決定し、収入が使い捨てスーツおよびサービスのためにそれぞれ顧客に渡されることを確認する。
取引先に支払う
私たちのいくつかの顧客臨床試験プロトコルによると、私たちは顧客に臨床試験材料の精算と彼らのOCS製品の使用に関連する特定の臨床文書を支払った。承認後の研究に参加したクライアントにも実行された移植プログラムに関する情報を支払う.私たちは支払いの性質とそれらが異なる商品かサービスに対して、これらの支払いに対する適切な会計処理を決定します。
他の収入考慮要素
レポートの収入は税金を差し引いた純額です。私たちは輸送が契約履行義務であるとは思わないので、発生して顧客に請求書を発行する輸送コストは収入と収入コストとして記録されている。
我々は取引価格に推定変動金額のみを計上しており,変動対価格に関する不確実性が解決されれば,確認された累積収入が大きく逆転しない可能性が高い.約束された貨物またはサービスが顧客との契約で重要ではないと考えられた場合、私たちはそれらが履行義務であるかどうかを評価しない。また、契約開始時の予想が顧客への支払いから顧客への移転約束された貨物またはサービスまでの期間が1年を超えない場合には、契約に重要な融資部分があるかどうかを評価しない。
株に基づく報酬
私たちは授与日奨励の公正価値に基づいて、従業員、非従業員と取締役に付与された株式奨励を計算した。オプション報酬の公正価値は、ブラック·スコアーズオプション定価モデルを用いて測定される。制限的普通株奨励の公正価値は、付与日の我々普通株の時価と購入価格(あれば)との差額に基づいて計量される。一般に,サービスの付与条件に基づく報酬のみを発行し,直線的な方法を用いてこれらの報酬の費用を記録する.これらの賠償金の補償費用は必要なサービス期間内に確認され、サービス期間は通常各賠償金の授権期間である。罰金が発生しなかった時に計算します
72
すべてのオプション所有者が必要なサービス期間を完了すると仮定すると,補償コストを記録する.もし奨励金が没収された場合、私たちは以前奨励が没収された間に確認された補償費用を販売します。
ブラック·スコアーズオプション定価モデルは、普通株式の公正価値と、私たちの普通株式変動性の仮定、私たちの普通株式オプションの期待期限、私たちの普通株式オプションの期待期限に近い一定期間の無リスク金利、および私たちの期待配当収益率を入力として使用します。
在庫品価格計算
我々はコストあるいは可変現純値の中の低い者で在庫を推定し、コスト計算は先進的な先出方法を採用した。私たちは定期的に既存の在庫数量を審査して、過剰と時代遅れの在庫を確定し、状況が許可された時、歴史販売、未来の需要、市場状況と予想製品のライフサイクルを評価した後、在庫をその推定可能な純価値に減記する費用を記録する。このような費用は私たちの総合経営報告書で収入コストに分類される。在庫を可変動純分に減記するには新たなコストベースが発生します。2022年12月31日と2021年12月31日までの過剰·陳腐在庫準備金は30万ドル。
各報告期間の終了時に、長期製造業調達約束が損失に対応すべきかどうかを“米国会計基準”330に基づいて評価した在庫品これは、将来の在庫購入の堅固さ、ログアウト不可、およびヘッジ不能の承諾による損失が予想され、これらの損失が決定された販売契約によって回収されることができない限り、または他の場合には、価格低下が生じることなく、在庫損失と同様に当期経営報告書で確認されなければならないことを要求する。本年度報告(Form 10−K)の他の部分に掲載されている総合財務諸表に記載されている各報告期間が終了した時点で、吾らは将来の余剰調達承諾によるいかなる潜在損失も確認していないため、製造業調達承諾期間の残り期間の推定将来顧客売上高と比較して、当社は将来期間の余剰調達承諾のいかなる損失を計上しているかを確認していない。
最近発表された会計公告
最近発表された我々の財務状況、経営結果又はキャッシュフローに影響を与える可能性のある会計声明の記述は、本年度報告における他の地方の連結財務諸表の付記2に開示される。
第七A項。数量化と高質市場リスクの開示について。
私たちは可変金利債務ツールを通じてある業務に融資し、様々な外貨建てで取引を行うため、金利と外貨為替レートの変化の影響を受けている。このような金利の変化は未来のキャッシュフローと収益に影響を及ぼすかもしれない。私たちは正常な運営と資金調達活動を通じてこのような危険を管理する。
外貨両替リスク
私たちの外貨取引リスクは主に会社間取引および顧客またはサプライヤーとの取引から来ており、これらの取引は私たちが取引を記録した法人実体の機能通貨以外の通貨で価格を計算します。このような取引で生じた資産と負債は、期末レートを用いて当該法人実体の機能通貨に換算される。外貨取引収益(損失)は他の収入(費用)の構成要素として連結経営報告書に登録されている。2022年12月31日までの1年間に、130万ドルの外貨取引損失を確認しました。
外貨換算リスクは、連結報告目的で機能通貨がドルでない子会社の財務諸表をドルに換算することに由来する。これらの子会社の資産と負債は期末レートをドルに換算し、収入と支出項目は期間ごとに有効な平均レートをドルに換算する。これらの外貨換算調整の影響を計上して累計他の全面赤字を計上することは、我々の総合貸借対照表における株主権益の単独構成要素である。2022年12月31日までの1年間に、外貨両替損失10万ドルを記録しました。
2022年12月31日までの年間で、我々の9%の収入と4%の運営コストと支出は、その機能通貨がドルの子会社ではないため、外貨リスクの影響を受けている。
73
現在、私たちの最大の外貨開放はユーロに対する開放だ。私たちはドルとユーロの間の10%の為替変動が私たちの経営業績や財務状況に実質的な影響を与えないと信じている。私たちは私たちの純損失の変動を経験し、継続するだろう。これは、私たちの資産と負債を再評価することによるものであり、これらの資産と負債は、資産や負債の実体を記録する機能通貨ではない。現在、私たちは私たちの外国為替リスクを攻撃しないだろう。
金利感度
2022年7月、私たちはカナダ帝国商業銀行とカナダ帝国商業銀行信用協定を締結した。カナダ帝国商業銀行信用協定項の下の借入金は年利で利上げされ、金利は(I)吾らが選択した担保付き隔夜融資金利であり、最低金利は1.5%、プラス2.0%、または(Ii)1.0%プラスa)最優遇金利、最低金利は4.0%、またはb)連邦基金有効金利を加え、0.5%である。12月31日現在、カナダ帝国商業銀行信用協定によると、2022年の未返済借入金総額は6,000万ドルであり、当該等借入金に適用される金利は6.1%である。連邦基金の有効金利が直ちに10%変化することは、私たちの債務関連義務、財務状況、あるいは運営結果に実質的な影響を与えない。
74
プロジェクト8.財務諸表Sと補足データ。
TransMedicsグループ会社
連結財務諸表索引
|
ページ |
独立公認会計士事務所レポート(PCAOB ID) |
75 |
合併貸借対照表 |
78 |
連結業務報告書 |
79 |
合併全面損失表 |
80 |
株主権益合併報告書 |
81 |
統合現金フロー表 |
82 |
連結財務諸表付記 |
83 |
独立公認会計士事務所報告
送られます TransMedics Group,Inc.取締役会と株主
財務諸表と財務報告の内部統制に関するいくつかの見方
TransMedics Group,Inc.とその子会社(“当社”)の2022年12月31日と2021年12月31日までの連結貸借対照表,および2022年12月31日までの3年度の関連総合経営表,全面損失表,株主権益表,キャッシュフロー表を監査した(総称して“総合財務諸表”と呼ぶ)。私たちはまた、会社が2022年12月31日までの財務報告の内部統制、根拠を監査しました内部制御--統合フレームワーク(2013)テレデビル委員会(COSO)協賛組織委員会によって発表されました。
上記の総合財務諸表は、米国公認の会計原則に従って、当社の2022年12月31日および2021年12月31日までの財務状況、および2022年12月31日までの3年度の経営実績およびキャッシュフローを各重大な面で公平に反映していると考えられる。また、2022年12月31日現在、当社はすべての実質的な面で財務報告に対する有効な内部統制を維持しており、その根拠は内部制御--統合フレームワーク(2013)COSOによって発表されます。
会計原則の変化
総合財務諸表付記2で述べたように、当社は2021年にリースに対する会計処理方式を変更した。
意見の基礎
当社経営陣は、このような総合財務諸表の作成、有効な財務報告内部統制の維持、財務報告内部統制の有効性の評価を担当しており、9 A項の経営陣の財務報告内部統制年次報告書に含まれている。私たちの責任は会社の合併について意見を述べることです 財務諸表と私たちの監査に基づく会社の財務報告書の内部統制。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は私たちが合併に関するものを得るために監査を計画し、実行することを要求する 財務諸表には、エラーによるものであっても詐欺であっても、すべての重要な点で財務報告の有効な内部統制が維持されているか否かにかかわらず、重大なエラー陳述はない。
75
私たちは合併後の 財務諸表には、合併後の重大な誤報のリスクを評価するためのプログラムが含まれている 財務諸表は、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行する。このような手続きには、総合財務諸表の金額および開示に関する証拠の検討が含まれています 財務諸表。私たちの監査には、経営陣が使用する会計原則の評価と重大な推定、合併報告書の全体的な報告状況の評価も含まれています 財務諸表。我々の財務報告の内部統制の監査には、財務報告の内部統制を理解すること、重大な弱点があるリスクを評価すること、評価されたリスクテストに基づいて内部統制の設計と運営有効性を評価することが含まれる。私たちの監査はまた、私たちがこのような状況で必要だと思う他の手続きを実行することを含む。私たちは私たちの監査が私たちの意見に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制は、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分の記録を維持することに関連している、(2)公認された会計原則に従って財務諸表を作成するために取引が必要とされている合理的な保証を提供し、会社の収入および支出は会社の経営陣および取締役の許可のみに基づいて行われる、という政策と手続きを含む。および(Iii)財務諸表に重大な影響を与える可能性のある不正買収、使用または処分会社の資産を防止またはタイムリーに発見することについて合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
重要な監査事項
以下に述べる重要な監査事項とは、当期に合併財務諸表を監査して生じた事項であり、当該事項は監査委員会に伝達又は要求され、かつ(I)は 連結財務諸表および(Ii)は、我々が特に挑戦的、主観的、または複雑な判断に関するものである。重要な監査事項のコミュニケーションは合併に対する私たちの意見を何の方法でも変えないだろう 財務諸表を全体として、次の重要監査事項を伝達することにより、重要監査事項又はそれに関連する勘定又は開示について個別の意見を提供することはない。
収入確認
総合財務諸表付記2に記載されているように、同社は2022年12月31日までの1年間に総収入9330万ドルを記録した。同社は、その臓器専用OCSコンソール上で使用される使い捨て臓器専用OCS輸液器(すなわち、その臓器専用OCS輸液器がその臓器専用OCS解決策と共に販売されている)(各OCSコンソールは、会社の臓器ケアシステム(OCS)製品の構成要素である)を販売することによって製品収入を取得し、会社の国家OCS計画に従って外部パッケージ臓器検索およびOCS臓器管理サービスを提供することによってサービス収入を生成する。その会社のほとんどの顧客契約はどれだけ義務を履行していますか。成果を提供することは、OCS輸液セットおよびOCSソリューションを含む。いくつかのクライアント契約では、配信コンテンツは、クライアントに販売するか、クライアントに貸すかにかかわらず、OCSコンソールをさらに含む。経営陣は、異なる履行義務を表すかどうかを決定するために、多重履行義務手配の各約束を評価する。管理層は、トレーニング、OCSコンソールデバイス設定、およびOCSコンソール自体が互いに高度に依存しており、単一の総合的な業績義務であると結論した。OCS製品の制御権が顧客に転送されるとき、収入を確認することは、会社が製品または製品の対価格を交換する権利があることを期待していることを反映する。OCS製品の制御権は、一般に、製品が顧客現場に到着した後にのみ渡され、さらに、OCSコンソールのためのトレーニングおよびデバイス設定は、会社によって行われている。さらに、国OCSスキームによれば、顧客に提供されるサービスは、サービス発生時にサービス収入として確認される異なる履行義務である臓器検索およびOCS臓器管理を含む。
収入確認に関連するプログラムを実行することが重要な監査事項であると判断する主な考慮事項は、監査人が、プログラムを実行し、管理層がOCS製品または製品の制御権を顧客またはサービスに転送し、収入を確認する時点に関連する監査証拠を決定することに関連する高い努力であることを決定することである。
76
この問題を処理することは、統合財務諸表に対する私たちの全体的な意見を形成するための実行手順および評価監査証拠に関するものである。これらのプログラムは、存在する制御および制御がクライアントに移行する時点の制御を含む収入確認プロセスに関連する制御措置の有効性をテストすることを含む。他にも、これらのプログラムは、取引サンプルに対して、収入として確認された取引が存在するかどうかを評価することと、顧客注文書を取得して検査することと、適用された場合に顧客の請求書、顧客プロトコル、輸送伝票、および現金受領書を取得して検査することによって、収入を確認する適切なタイミングを評価することとを含む。
/s/
2023年2月27日
2001年以来、当社の監査役を務めてきました。
77
TransMedicsグループ会社
統合されたインフラスプレー銃のシーツ
(単位は千で、シェアは含まれていない)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
有価証券 |
|
|
— |
|
|
|
|
|
売掛金 |
|
|
|
|
|
|
||
在庫品 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
制限現金 |
|
|
|
|
|
|
||
経営的リース使用権資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
費用とその他の流動負債を計算しなければならない |
|
|
|
|
|
|
||
収入を繰り越す |
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
— |
|
|
流動負債総額 |
|
|
|
|
|
|
||
長期債務、割引と現在の部分を差し引いた純額 |
|
|
|
|
|
|
||
賃貸負債を経営し,当期分を差し引く |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
(注13) |
|
|
|
|
|
|
||
株主権益: |
|
|
|
|
|
|
||
優先株額面価値 |
|
|
|
|
|
|
||
普通株額面価値 |
|
|
|
|
|
|
||
その他の総合損失を累計する |
|
|
( |
) |
|
|
( |
) |
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこれらの連結財務諸表の構成要素である。
78
TransMedicsグループ会社
合併状態運営部
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
収入: |
|
|
|
|
|
|
|
|
|
|||
製品純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
サービス収入 |
|
|
|
|
|
|
|
|
|
|||
総収入 |
|
|
|
|
|
|
|
|
|
|||
収入コスト: |
|
|
|
|
|
|
|
|
|
|||
製品純収入コスト |
|
|
|
|
|
|
|
|
|
|||
サービスコスト収入 |
|
|
|
|
|
|
|
|
|
|||
収入総コスト |
|
|
|
|
|
|
|
|
|
|||
毛利 |
|
|
|
|
|
|
|
|
|
|||
運営費用: |
|
|
|
|
|
|
|
|
|
|||
研究·開発·臨床試験 |
|
|
|
|
|
|
|
|
|
|||
販売、一般、行政 |
|
|
|
|
|
|
|
|
|
|||
総運営費 |
|
|
|
|
|
|
|
|
|
|||
運営損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
その他の収入(支出): |
|
|
|
|
|
|
|
|
|
|||
利子支出 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
その他の収入,純額 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
その他の費用の合計 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税前損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税支給 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
普通株主は1株当たり純損失を占めなければならない,基本的に |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
加重平均発行済み普通株式、基本普通株式、希釈後普通株 |
|
|
|
|
|
|
|
|
|
|||
付記はこれらの連結財務諸表の構成要素である。
79
TransMedicsグループ会社
合併報告書総合損失の
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
その他の全面的な損失: |
|
|
|
|
|
|
|
|
|
|||
外貨換算調整 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
取引可能証券の未実現収益(損失),税引き後純額は$ |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
その他総合損失合計 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
総合損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
付記はこれらの連結財務諸表の構成要素である。
80
TransMedicsグループ会社
連結報告書OF株主権益
(単位は千で、シェアは含まれていない)
|
|
普通株 |
|
|
積算 |
|
|
|
|
|
合計する |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
わかりました- |
|
|
積算 |
|
|
株主の |
|
|||||
2019年12月28日の残高 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|||
普通株の発行 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
年発行普通株 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
年発行普通株 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株に基づく報酬 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
外貨換算 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
未実現損失 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2020年12月31日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
|
|||
普通株発行 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
年発行普通株 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株に基づく報酬 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
外貨?外貨 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
未実現損失 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2021年12月31日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
|
|||
普通株を公開発行する |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株式を発行する場合、 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
年発行普通株 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
発行制限普通株 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
制限普通株没収 |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
年発行普通株 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株に基づく報酬費用 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
外貨換算 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
未実現有価証券収益 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年12月31日の残高 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|||
付記はこれらの連結財務諸表の構成要素である。
81
TransMedicsグループ会社
合併状態キャッシュストリームNTS
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
経営活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
|
|||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
|
|
|
|||
減価償却および償却費用 |
|
|
|
|
|
|
|
|
|
|||
株に基づく報酬費用 |
|
|
|
|
|
|
|
|
|
|||
債務返済損失 |
|
|
|
|
|
— |
|
|
|
— |
|
|
有価証券売却の損失 |
|
|
|
|
|
— |
|
|
|
— |
|
|
非現金利息と期末割増料金 |
|
|
|
|
|
|
|
|
|
|||
非現金レンタル費用 |
|
|
|
|
|
|
|
|
— |
|
||
有価証券の割増純償却 |
|
|
|
|
|
|
|
|
|
|||
未実現外貨取引損失 |
|
|
|
|
|
|
|
|
( |
) |
||
経営性資産と負債変動状況: |
|
|
|
|
|
|
|
|
|
|||
売掛金 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
在庫品 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
前払い費用と他の流動資産 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
売掛金 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
費用とその他の流動負債を計算しなければならない |
|
|
|
|
|
|
|
|
|
|||
収入を繰り越す |
|
|
— |
|
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
|
|
|
— |
|
||
賃料を繰延する |
|
|
— |
|
|
|
— |
|
|
|
|
|
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
|
|
|
|||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
有価証券を購入する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
有価証券の販売収益と満期日 |
|
|
|
|
|
|
|
|
|
|||
投資活動での純現金の提供 |
|
|
|
|
|
|
|
|
( |
) |
||
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
|
|||
長期債券を発行して得られる収益は,発行コストを差し引く |
|
|
|
|
|
— |
|
|
|
— |
|
|
長期債務を償還する |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
普通株で得た金を公開発行し,純額 |
|
|
|
|
|
— |
|
|
|
|
||
株式オプション行使時に普通株で得られた金を発行する |
|
|
|
|
|
|
|
|
|
|||
株式引受証を行使する際に普通株式を発行して得た金 |
|
|
|
|
|
— |
|
|
|
— |
|
|
従業員株に関する普通株を発行して得た金 |
|
|
|
|
|
|
|
|
|
|||
Paycheck保護計画ローンの収益 |
|
|
— |
|
|
|
— |
|
|
|
|
|
アリペイはローンの返済を保障しています |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
融資活動が提供する現金純額 |
|
|
|
|
|
|
|
|
|
|||
現金、現金等価物および限定現金に及ぼす為替レート変動の影響 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
現金、現金等価物、および限定的な現金の純増加 |
|
|
|
|
|
|
|
|
|
|||
期初現金、現金等価物、および限定現金 |
|
|
|
|
|
|
|
|
|
|||
現金、現金等価物、制限された現金、期末 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
キャッシュフロー情報の追加開示: |
|
|
|
|
|
|
|
|
|
|||
利子を支払う現金 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
非現金投資と融資活動を追加開示します |
|
|
|
|
|
|
|
|
|
|||
在庫を財産と設備に移す |
|
$ |
|
|
$ |
|
|
$ |
|
|||
支払すべき帳簿に掲げる財産と設備の購入と |
|
$ |
|
|
$ |
|
|
$ |
— |
|
||
現金、現金等価物、および制限現金の入金: |
|
|
|
|
|
|
|
|
|
|||
現金と現金等価物 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
制限現金 |
|
|
|
|
|
|
|
|
|
|||
現金レポートに表示されている現金、現金等価物、および限定的な現金総額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
付記はこれらの連結財務諸表の構成要素である。
82
TransMedicsグループ会社
連結財務諸表付記
TransMedics Group,Inc.(“TransMedics Group”およびその合併子会社“会社”)は2018年10月にマサチューセッツ州連邦に登録設立された。TransMedics,Inc.(“TransMedics”)はTransMedicsグループの運営会社と完全子会社であり,1998年8月にデラウェア州に登録設立された.同社は商業段階の医療技術会社であり,複数の疾患州の終末期臓器不全患者の臓器移植療法を転換している。同社は数十年来の看護標準の代わりに臓器看護システム(“OCS”)を開発した。OCSは、移植臓器保存を静的から動的環境に変換し、臓器最適化と評価を含む新しい機能を実現するファントム変換を表す。同社のOCS技術は人体外器官の自然生活と機能環境の多くの方面を複製した。同社はまた、外部委託臓器検索およびOCS臓器管理を提供し、OCSの臓器提供を得るために、米国の移植計画により有効なプロセスを提供する革新的な鍵解決策である国家OCS計画(“NOP”)を開発した。
付随する総合財務諸表は、業務の連続性、資産の現金化及び正常業務過程における負債と引受状況に基づいて作成されている。同社は設立以来、純損失#ドルを含む経常赤字が発生している
同社は現在の現金#ドルは
同社は、競争相手の新技術革新の開発、キーパーソンへの依存、ノウハウの保護、政府法規の遵守、市場の製品受容度の不確実性、および運営に資金を提供するために追加融資を得る必要があるが、医療機器業界や類似規模の会社と同じリスクと不確定要素に直面している。現在開発されている製品は、商業化前に追加の臨床試験や規制承認を含む追加の研究·開発努力が必要となる。このような努力は追加的な資本、十分な人員、インフラ、そして広範囲なコンプライアンス報告能力を必要とする。会社の研究·開発は成功できない可能性があり、会社の技術は十分に保護されていない可能性があり、会社は予想されたスケジュールで必要な政府規制の承認を得ることができないかもしれないし、承認された製品は商業可能性を持たない可能性がある。会社は技術と競争が日進月歩の環境で運営されている。
新冠肺炎の大流行はすでに社会の多くの方面に広範な影響を与え続ける可能性があり、すでに全世界経済及び世界各地の企業と資本市場に重大な破壊を与える可能性がある。新冠肺炎の会社の業務に対する持続的な影響は、会社の製造業務とサプライチェーンの中断、労働力の不足、生産性の低下と材料または部品が利用できないこと、従業員と顧客の旅行能力が制限されていること、および製品の設置、訓練または出荷が他の影響を受けている国とアメリカ国内を往復する遅延を含む可能性がある。同社はそのOCS製品に使用されている完成品と原材料を在庫しているが、疫病がさらに延長すると、その製品を製造するために必要な原材料不足を招く可能性がある。
会社の総合財務諸表は、米国公認の会計原則(“公認会計原則”)に従って作成されている。本付記内の適用指針に対するいかなる言及も財務会計基準委員会(“FASB”)の会計基準編纂(“ASC”)及び“会計基準更新”(“ASU”)に掲載されている権威公認会計原則を指す。添付されている総合財務諸表には、当社及びその完全子会社の勘定が含まれている。合併では、すべての会社間口座と取引がキャンセルされた。
83
予算の使用
公認会計基準に従って財務諸表を作成することは、報告期間中に報告された資産および負債額、または有資産および負債の開示および報告期間内の報告の収入および支出に影響を与えるために、管理層に推定および仮定を要求する。これらの連結財務諸表に反映される重大な推定および仮定には、収入確認、在庫推定値、株式ベースの奨励推定値が含まれているが、これらに限定されない。当社は過去の経験、既知の傾向、その他その当時の状況に属すると考えられる合理的な特定の市場要素あるいはその他の関連要素に基づいて推定します。継続的な基礎の上で、経営陣は状況、事実、経験の変化に基づいてその推定数を評価する。推定された変化は、それらが知られている期間に記録される 当該等の総合財務諸表の発行日まで、当社は、当社が任意の資産又は負債の帳簿価値を更新、判断、判断又は改訂する必要がある特定のイベントや状況を知ることができません。実際の結果は,これらの推定や仮定とは異なる可能性がある.
信用、重要な顧客、および重要なサプライヤー集中のリスク
会社を集中的な信用リスクに直面させる可能性のある金融商品は主に現金、現金等価物、有価証券、売掛金を含む。当社は、商業銀行関係に関連する正常信用リスクを除いて、異常信用リスクの影響を受けないと考えている。会社は2022年12月31日、2022年12月31日、2021年12月31日まで、信用損失準備金を計上しない。
重要な顧客は
同社製品に含まれるいくつかの部品および構成要素は、単一の供給源、単一の供給源、または限られた供給者から取得され、消毒サービスも同様である。会社はサプライヤー、メーカー、サービスプロバイダといった限られたソースへの依存を減らすことを求めているが、これらのソースの一部または全部を失うことは、会社の経営業績、財務状況、キャッシュフローに重大な悪影響を与え、その顧客関係を損なう可能性がある。
繰延融資コスト
債務負債に関する繰延融資コストを債務負債帳簿金額の減少額とし、債務返済期間内に実際の利息法を用いて利子支出に償却する。
現金等価物
当社は購入の日に原始期限が三ヶ月以下のすべての高流動性投資を現金等価物と見なしています。
制限現金
2022年12月31日と2021年12月31日まで、会社は維持
売掛金
勘定.勘定売掛金は信用損失準備金を差し引いて列記し、信用損失準備金は回収できない可能性のある金額の見積もりである。同社はその顧客に対して継続的な信用評価を行い、経済状況を監視し、その売掛金が回収リスクに直面している可能性がある事実と状況を確定する。当社は顧客の支払い不足による可能性のある推定信用損失(ある場合)に売掛金準備金を提供します
84
作文を書くその売掛金、現在の経済状況と歴史的信用損失活動。回収できないとされた金額は準備金から差し引かれたりログアウトしたりします。2022年12月31日と2021年12月31日まで、会社は
財産と設備
財産と設備はコストから減価償却累計と償却を差し引く。減価償却と償却費用は、資産ごとの推定耐用年数内に直線法で確認され、具体的には以下の通り
|
|
使用寿命を見込む |
製造設備 |
|
|
OCSコンソール |
|
|
コンピュータ装置及びソフトウェア |
|
|
実験室装置 |
|
|
事務·貿易展示設備 |
|
|
賃借権改善 |
|
OCSコンソールによって発生するコストは、会社がNOPのためにOCSコンソールを使用するか、またはクライアントに貸して使用するかを決定しない限り、会社は、OCSコンソールのコストを在庫から財産およびデバイスに再分類し、OCSコンソールの推定使用寿命内に減価償却を開始する。このような減価償却費用は収入コストに分類される。会社は顧客に貸したすべてのOCSゲーム機の所有権を保持している。
まだ投入されていない資本資産のコストは建設中工事として資本化し、投入後に減価償却に計上する。廃棄または販売時には、資産を処分するコスト及び関連する減価償却及び償却は勘定から差し引かれ、それによって生じる収益又は損失はいずれも運営損失に計上される。修理費と維持費は発生時に料金を記入します。
長期資産減価準備
長期資産には財産と設備と使用権資産が含まれている。保有·使用待ちの長期資産が,事件やビジネス環境の変化が発生して資産の帳簿価値が完全に回収できない可能性があることを示した場合には,回収可能テストを行う。当社がいつ減値審査を行うかを決定する際に考慮する要素は、予想に関連する業務パフォーマンスの顕著な不良、業界或いは経済傾向に重大なマイナス影響が出現すること、及び資産用途の重大な変化或いは計画変更を含む。長期資産グループの回収可能性を評価するために減値審査を行うと、当社は、長期資産グループの使用と最終処分による未割引キャッシュフローの予測をその帳簿価値と比較する。資産グループの使用予想による予想未割引将来のキャッシュフローがその帳簿金額よりも少ない場合、減価損失は運営損失で確認される。減価損失は、減価資産グループの帳簿価値がその公正価値を超えることに基づく。“会社”ができた
ソフトウェア開発コスト
♪the the the会社が会社のOCSコンソールおよびOCS灌流器のハードウェアコンポーネントに組み込まれたコンピュータソフトウェアを開発することは、コストを発生させる。資本化条件を満たす内部開発や外部からソフトウェアを購入するコストを除いて,本ソフトウェアに関する研究·開発コストは発生した費用に計上される.技術実行可能性を決定した後,製品全面発表前に発生したソフトウェア開発コストは資本化され,製品全面発表時にはこのような資産に関する経済的利益の実現モデルに基づいて償却が行われる。技術実現可能性と製品発表の間の時間が短いため,
85
金額この期間中に発生したコストの中で会社は
在庫品
在庫はコストまたは現金化可能な純価値の中の低いもので価格されます。コスト計算は先進的な先出し方法を採用している.過去の販売、将来の需要、市場状況、および予想される製品ライフサイクルを評価した後、会社は定期的に既存在庫数を審査して過剰かつ時代遅れの在庫を決定し、状況が許可された場合に在庫をその推定可能な純価値に減記する費用を記録する。このような費用は、連結業務報告書において収入コストに分類される。在庫を可変動純分に減記するには新たなコストベースが発生します。
各報告期間が終了したとき、当社は、会計基準に基づいて編纂されるべきかどうか(“ASC”)330を評価し、長期製造業調達承諾の損失を計上すべきである在庫品これは、将来の在庫購入の堅固さ、ログアウト不可、およびヘッジ不能の承諾による損失が予想され、これらの損失が決定された販売契約によって回収されることができない限り、または他の場合には、価格低下が生じることなく、在庫損失と同様に当期経営報告書で確認されなければならないことを要求する。添付されている総合財務諸表に記載されている各報告期間が終了した時点で、当社は将来の残りの調達承諾による潜在損失を確認していないため、製造業調達承諾期間の残り期間の予想将来顧客売上高と比較して、当社はいかなる潜在損失も確認していない
賃貸借証書
2021年1月1日までに、当社はASC 840レンタル(“ASC 840”)で入金されます。効き目がある
米国会計基準第842条によれば、会社が一定期間資産を統制しながら資産のほぼすべての経済的利益を得る権利がある場合、会社は契約をリースとみなす。当社は、開始時に賃貸契約であるか、埋め込み賃貸契約を含むか否かを決定する。リース定義に適合した手配については、当社は、リース開始日にその使用権資産とリース負債の初期分類及び計量を決定し、その後修正した場合、当該等資産及びリース負債の初期分類及び計量を決定する。レンタル期間には、当社が行使を合理的に保証する任意の継続選択権が含まれています。賃貸支払いの現在値は、レンタル中の暗黙的な金利(この金利が容易に決定されやすい場合)を使用することによって決定され、そうでなければ、当社は、レンタル期間の推定保証増分借入金利を使用する。当社の方針は、統合貸借対照表に元の期限が12ヶ月以下の賃貸を記録せず、レンタル期間内に直線ベースで損益表で当該等の賃貸支払いを確認することである。同社の既存の賃貸契約は事務、実験室、製造空間に使用されている。
レンタル料に加えて、レンタル契約は、一般に非レンタル構成要素と呼ばれる公共事業、メンテナンス、および他の運営コストのような追加コストを会社に要求する可能性がある。当社はレンタルと非レンタル構成要素を分離しないことを選択しました。賃貸組成物及びそれに関連する非レンタル構成要素の固定コストのみが単一賃貸構成要素として入金され、使用権資産及び賃貸負債の一部であることが確認される。運営リースの賃貸料支出は,合理的に保証された賃貸期間内にリース支払総額で直線的に確認され,総合運営報告書の運営費に計上される。
賃貸手配された収入は、顧客と契約を締結する収入基準の制約を受けず、ASC 842に従って個別に入金される。ASC 842によれば、レンタル者は、参照指数またはレートに依存しない可変リース支払いのリースを経営的賃貸として分類し、レンタルが販売型リースまたは直接融資リースに分類されることを前提とし、レンタル者は、他の方法で初日の損失を確認するであろう。同社のOCSコンソール隠れリースプロトコルは、特定の基準を満たすいくつかの可変支払いを有する販売タイプのレンタルプロトコルに適合し、したがって、初日の損失はASC 842に従って確認されるであろう。したがって、ASC 842によれば、この等リースは経営リースとみなされ、当社は販売時にリース資産(OCSコンソール)の確認を終了するわけではないが、資産の使用年数内にリース資産を減価償却する。
86
公正価値計量
公認会計原則に基づき、ある資産と負債は公正価値に基づいて帳簿に記入される。公正価値は、計量日市場参加者間の秩序ある取引において、資産または負債が元金または最も有利な市場で負債を移転するために徴収または支払いされる交換価格として定義される。公正価値を計量するための推定技術は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に減少させなければならない。公正価値別に列挙された金融資産および負債は、公正価値レベルの以下の3つのレベルのうちの1つで分類および開示されなければならず、そのうちの最初の2つのレベルは可視とみなされ、最後のレベルは見えないとみなされる
当社の現金等価物及び有価証券は公正価値に基づいて入金され、上記公正価値階層に基づいて決定される(付記4参照)。これらの資産と負債の短期的な性質により、会社の売掛金、売掛金、売掛金の帳簿価値はその公正価値に近い。変動金利が市場金利に近いため、会社の長期債務の帳簿価値は資産負債表ごとにその公正価値(二次計量)に近い。
有価証券
会社の有価証券(非持分ツール)は販売可能に分類され、公正価値に基づいて入金され、未実現収益と損失は他の全面収益(損失)株主権益を累積する構成部分として報告されている。実現した損益は具体的な確認方法をもとに,他の収入(費用)純額の構成要素として連結業務表に入れた。
公正価値が有価証券の超過コストより低い場合、予想される信用損失を推定する。信用に関する減価額は総合経営報告書で確認した。信用損失は、総合貸借対照表内の信用損失準備口座を使用して確認され、期待される信用損失の後続の改善は、口座内の一口の金額の引抜きとして確認される。当社がその証券を売却しようとしている場合、または当社がその余剰コスト基準を回収する前に証券を売却する必要がある可能性が高い場合、信用損失準備はログアウトされ、資産の残高コストベースがその公正な価値を超える部分が総合経営報告書に記録される。いくつありますか
市場情報を細分化する
会社はその運営を業績を評価し、運営決定を行うための細分化された市場。同社はすでに移植のための人体器官を近生理条件下で保存し、冷蔵器官保存の局限性を解決するための独自システムを開発し、商業化している。運営部門は、企業の構成要素として定義され、会社の首席運営意思決定者又は意思決定グループは、資源をどのように割り当てるか及び業績を評価するかを決定する際に、異なる財務情報を定期的に評価する。その会社はその運営意思決定者がその最高経営責任者であることを決定した。会社の首席運営決定者は、総合的な基礎の上で会社の財務情報を審査し、資源を分配し、財務業績を評価する。
製品保証
87
どれもその期間を報告し、必要に応じて調整する。2022年12月31日と2021年12月31日現在、保証対象金額は$未満です
収入確認
同社の純製品収入は、主に臓器専用OCSコンソールの使い捨てのための臓器専用使い捨てセットの販売から来ている。より小さい程度で、同社はまた、OCSゲーム機および顧客に無料で貸与されたOCSゲーム機の暗黙的リースをクライアントに販売することによって、製品収入を得る。各新しい移植プログラムについて、クライアントは、クライアントの既存の臓器専用OCSコンソールのためのOCS使い捨てデバイスのセットを追加的に購入する。同社はまた、米国の国家OCS計画に基づいて、サービス収入を生成するために、アウトソーシング臓器検索およびOCS臓器管理サービスを提供する。
会社は,(1)顧客との契約を決定する,(2)契約中の履行義務を決定する,(3)取引価格を決定する,(4)取引価格を契約に割り当てる履行義務,および(5)契約履行義務を履行する際に収入を確認する,の5つのステップで顧客に販売されている収入を確認する.
同社のほとんどの顧客契約は、OCS灌流器およびOCS解決策からなる配信可能な成果を含む複数の義務を履行する。クライアント契約配信コンテンツはまた、会社の国家OCS計画またはOCSコンソールに従って提供される臓器検索およびOCS臓器管理サービスを含むことができ、顧客への販売または顧客への貸し出しを含むことができる。同社は、それが異なる履行義務を代表するかどうかを決定するために、多重履行義務手配のすべての約束を評価した。同社が収入を得る顧客スケジュールにおける主な履行義務は、OCS灌流器、OCS解決策、OCSコンソール、臓器検索サービス、およびOCS臓器管理サービスである。
クライアント注文がOCSコンソールを含む場合、会社は、顧客トレーニングおよびOCSコンソールのデバイス設定の両方が会社によって実行されると判断しており、独立して販売されていないので、会社によってそのOCSコンソールの販売またはローンと共にのみ実行される。さらに、当社は、トレーニングおよびデバイス設定が完了する前に、クライアントがOCSコンソールから利益を得ることができないので、OCSコンソール自体がユニークではないと判断した。したがって、注文がOCSコンソールを含む場合、会社は、トレーニング、OCSコンソール装置設定、およびOCSコンソール自体が互いに高度に依存し、単一の総合性能義務であると結論する。会社は、OCSコンソールが顧客現場に到着し、会社がトレーニングおよびデバイス設定を完了した後にのみ、単一の総合的な性能義務からの収入を確認する。
クライアント注文は、OCSコンソールおよび各グラフト中に使用されるOCS使い捨てセットを使用することを含むことができる。会社がOCSコンソールをクライアントに貸したとき、それは常にコンソールの所有権を保持し、任意のOCS製品に関連する最低購入コミットメントをクライアントに要求しない。この場合、会社は、受信した各新しい移植プログラムの顧客注文および顧客プロトコルに規定された価格に基づいて、OCS使い捨てデバイスの請求書をクライアントに発行する。時間が経つにつれて、会社は通常、顧客が追加のOCS使い捨てセットを購入し、使用することによって、レンタルされたOCSコンソールのコストを回収する。これらの理由から、当社は、使い捨てスーツの部分的な配置コストが、OCSコンソールを使用した暗黙的なレンタル料支払いであることを決定した。したがって、当社は、各異なる履行責任の相対的に独立した販売価格を推定することに基づいて、レンタル交付項目(すなわち、OCSコンソール)と非レンタル交付項目(すなわち、OCS使い捨てセット)との間にペア価格を割り当てる。今まで、レンタル交付成果に割り当てられた金額は取るに足らなかった。
OCS注入器、OCSソリューション、およびOCSゲーム機をクライアントに販売する収入は、会社の総合経営レポートにおいて製品純収入として分類される。顧客への臓器検索およびOCS臓器管理サービスの販売収入は、会社の総合経営報告書においてサービス収入に分類される。
制御権が顧客に転送されると、収入が確認され、その金額は、企業が製品やサービスの対価格を交換する権利があることを反映している。お客様の注文が使い捨てスーツおよび臓器回収またはOCS臓器管理サービスを含む場合、当社は、使い捨てスーツおよびサービスが別個の履行義務を構成することを決定し、収入を使い捨てスーツおよびサービスの両方として顧客に提供することを確認した。
88
取引先に支払う
同社のいくつかの顧客臨床試験プロトコルによれば、同社は、その顧客に臨床試験材料および顧客がそのOCS製品を使用することに関連する特定の臨床文書の費用を支払う。同社は承認後の研究に参加した顧客にも実行された移植プログラムに関する情報を支払っている。会社は、支払いの性質およびこれらの支払いが異なる商品またはサービスに対して、適切な会計処理方法を決定する。
契約資産と負債
当社は無条件支払権利を持っている時点で売掛金を確認します。このような入金は契約資産ではありません。契約資産は、顧客手配中の未発行金額からであり、確認された収入が顧客に発行された金額を超えた場合、会社の支払い権利は時間の推移に限らない。その会社は所有している
契約責任とは、会社が顧客の対価格(又は支払うべき金額)を受け取った顧客に貨物又はサービスを譲渡する義務をいう。同社は、その唯一の契約負債が繰延収入であり、領収書が発行されたが収入として確認されていない金額を含むことを決定した。
余剰履行義務
会社は一般に以下の範囲で契約履行義務を履行する
他の収入考慮要素
レポートの収入は税金を差し引いた純額です。当社は輸送を契約履行義務とは考えていないため、発生して顧客に請求書を発行する輸送コストは収入と収入コストとして記録されている。
当社は取引価格にのみ推定可変金額を含めており,可変対価格に関する不確実性が解決された場合,確認された累積収入が大きく逆転しない可能性が高いことを前提としている。約束された貨物またはサービスが顧客との契約において重要でないとみなされた場合、会社はそれらが履行義務であるかどうかを評価しない。また、契約開始時の予想が顧客への支払いから顧客への移転承諾された貨物またはサービスまでの期間が1年を超えない場合、会社は、契約に重大な融資部分があるか否かを評価しない。
総代理店
同社は主にその直販チームを通じてその製品をマーケティングと販売し、このチームはその製品を世界の最終顧客に販売している。同社の収入のごく一部は、欧州やアジア太平洋地域の限られた数の流通業者の販売によるものだ。会社が流通業者と取引を行う場合、その契約スケジュールは、最終顧客ではなく流通業者と取引される。会社が流通業者と業務往来を行っても,最終顧客から直接注文を受信しても,その収入確認ポリシーと注文の収入確認モデルは同じである.
研究·開発·臨床試験コスト
研究、開発と臨床試験費用は、給料とボーナス、株式報酬、従業員福祉、施設コスト、実験室用品、減価償却、テスト、監督管理、データ管理とコンサルティングコストを含む研究活動、製品開発、ハードウェアとソフトウェア工学、臨床試験活動のコストを含む。
研究,開発,臨床試験コストは発生時に費用を計上した。将来的に受信された研究、開発および臨床試験活動のための貨物またはサービスの前払いは前払い費用として記録される。このような前払い費用は、関連貨物が交付されたか、または関連サービスが完了したときに費用として確認されるか、または貨物の配送またはサービスの提供がもはや予期されていない場合に費用として確認される。
89
特許費用
特許出願の提出及び起訴に関するすべての特許に関する費用は、支出回収状況が不確定であることによる費用に基づいて計上される。発生した金額は一般費用と行政費用に分類される。
外貨換算
当社の各海外子会社のビットコインは現地通貨です。会社海外子会社の資産と負債は期末レートを用いてドルに換算し、収入と支出項目は期間ごとの平均レートを用いてドルに換算する。これらの外貨換算調整の影響を計上して累計他の総合損失を計上することは、株主権益の単独構成要素である。
同社はまた、会社間取引や顧客やサプライヤーとの取引により取引収益や損失が生じており、これらの取引は、取引記録が存在する法人実体の機能通貨以外の通貨で価格を計算している。実現したと実現していない外貨取引収益(損失)は、他の収入(費用)の構成要素として連結業務報告書に入れられ、合計(#ドル)となる
株に基づく報酬
当社は授与日奨励の公正価値に基づいて、従業員、非従業員と取締役に付与された株式奨励に対して会計計算を行う。オプション報酬の公正価値は、ブラック·スコアーズオプション定価モデルを用いて測定される。制限的普通株奨励の公正価値は、付与された日の会社普通株の時価と買収価格(ある場合)との差額に基づいて計量される。一般的に、会社が発行する奨励はサービスに基づく帰属条件だけだ。これらの賠償金の補償費用は,各賠償金の授権期間内に直線法で確認される。すべてのオプション所有者が必要なサービス期間を完了すると仮定し、当社は没収発生時に会計処理を行い、補償コストを記録する。賠償の非帰属部分が没収された場合、会社は以前没収中に確認した補償費用を振り戻す。
同社がその総合経営報告書において株式による補償費用を分類する方式は,受賞者の賃金コストを分類したり,受賞者のサービス支払いを分類したりする方式と同様である。
総合損失と累積その他総合損失
総合損失には,純損失および株主との取引や経済事件以外の取引や経済事件による株主権益の他の変化がある。同社の他の全面赤字の唯一の要素は、外貨換算調整と有価証券の未実現収益(赤字)である。
総合貸借対照表の累計その他総合収益(赤字)には主に外貨換算調整が含まれる。その他の有価証券の未実現収益(損失)に起因する総合損失を累積することは顕著ではない。
1株当たり純収益
普通株1株あたりの基本純収益(損失)の計算方法は,純収益(損失)を当期発行普通株の加重平均株式数で割る。普通株式1株当たりの純利益(損失)の計算方法は、純収益(損失)を当期発行済み普通株の加重平均株式数で割ったものであり、その中には、発行済み株式奨励が希釈効果をもたらすと仮定した潜在希釈性普通株が含まれている。会社が純損失を報告している期間については,1株当たりの希釈純損失は普通株1株あたりの基本純損失と同様であり,希釈性普通株の影響が逆希薄であれば希釈性普通株が発行されているとは考えられないからである。同社は2022年、2021年、2020年12月31日までの年度普通株主が純損失を占めるべきだと報告した。
当社の潜在的希薄化証券は、1株当たり純損失を減らすため、1株当たりの純損失の計算から除外されている
90
基にする期末ごとの未返済額によると、上記期間の普通株株主が1株当たりの純損失を占めるべきであることから差し引かれ、これらの純損失を計上することで逆償却効果が生じるからである
|
|
12月31日まで |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
普通株購入引受権証 |
|
|
|
|
|
|
||
普通株購入オプション |
|
|
|
|
|
|
||
従業員株購入計画 |
|
|
|
|
|
|
||
制限株奨励 |
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
||
所得税
当社は貸借対照法に従って所得税を計算し、この方法は財務諸表または当社の納税申告書で確認された事件の予想将来の税務結果のために繰延税金資産と負債を確認することを要求する。繰延税項は、資産及び負債の財務諸表と課税基礎との差額に基づいて、予想差額を用いて返送される年度の現行税率を決定する。繰延税金資産と負債の変動を所得税に計上する準備。当社はその繰延税金資産の現金化の可能性を評価し、既存の証拠の量に基づいて、繰延税金資産のすべてまたは一部が現金化されない可能性が高いと考え、所得税の支出を計上することで推定支出を確立する。繰延税項資産の回収潜在力は、課税収入期間の繰越能力を分析し、現有課税の一時的な差異を振り戻し、将来の課税オーバー額を予想し、慎重かつ実行可能な税務計画策略を考慮して評価することである。
会社は財務諸表で確認された所得税の不確実性を計算し、確認すべき税収割引額を決定するために2ステップ法を採用した。まず、税務機関が外部審査後にこのような状況を維持する可能性を決定するために、税収状況を評価しなければならない。税務状況がより継続する可能性があると考えられる場合、税務状況は、財務諸表で確認される利益金額を決定するために評価される。確認可能な受益額は,最終和解時に実現される可能性が50%を超える最大額である。所得税の準備には、それによって生じる税収準備金または未確認の税収割引の影響が適切であると考えられ、関連する純利息および罰金が含まれる。
“会社”ができた
2021年12月31日現在、証券タイプ別取引可能証券には、以下のものが含まれている(千単位)
|
|
2021年12月31日 |
|
|||||||||||||||||
|
|
償却する |
|
|
毛収入 |
|
|
毛収入 |
|
|
信用損失 |
|
|
公正価値 |
|
|||||
米国債(1年以内満期) |
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
|
||
アメリカ政府機関債券( |
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
|
||
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
|
||
91
“会社”ができた
以下の表に、同社が2021年12月31日までに公正価値で恒常的に計量した資産の公正価値レベル(単位:千)を示す
|
|
2021年12月31日の公正価値計量使用: |
|
|||||||||||||
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
資産: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
有価証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ国債 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
アメリカ政府機関債券 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
当社は見積市場価格に基づいて貨幣市場基金を推定し、このオファーは公正価値システム中の一級計量を代表する。アメリカ国庫券とアメリカ政府機関債券は同社が活発な市場での類似証券のオファーを用いて評価を行い、これは公正価値レベル中の二次評価基準である。
在庫には以下の内容(千計)が含まれている
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
原料.原料 |
|
$ |
|
|
$ |
|
||
製品の中で |
|
|
|
|
|
|
||
完成品 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
財産と設備、純価値は以下の通り(千で計算)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
製造設備 |
|
$ |
|
|
$ |
|
||
OCSコンソール |
|
|
|
|
|
|
||
コンピュータ装置及びソフトウェア |
|
|
|
|
|
|
||
実験室装置 |
|
|
|
|
|
|
||
事務·貿易展示設備 |
|
|
|
|
|
|
||
賃借権改善 |
|
|
|
|
|
|
||
建設中の工事 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減算:減価償却累計と償却 |
|
|
( |
) |
|
|
( |
) |
|
|
$ |
|
|
$ |
|
||
2022年、2021年、2020年12月31日までの年間で、減価償却と償却費用の総額は#ドル
92
計算すべき費用および他の流動負債には、以下の項目が含まれる(千で計算)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
給料と関連費用を計算しなければならない |
|
$ |
|
|
$ |
|
||
物流コストを計算する |
|
|
|
|
|
— |
|
|
専門費用を計算する |
|
|
|
|
|
|
||
研究·開発·臨床試験費用を計算すべきである |
|
|
|
|
|
|
||
その他の措置を講じる |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
長期債務は以下の部分から構成される(千計)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
長期債務元金 |
|
$ |
|
|
$ |
|
||
差し引く:長期債務の現在部分 |
|
|
— |
|
|
|
— |
|
長期債務,当期分を差し引く |
|
|
|
|
|
|
||
債務割引は債務増額後の純額を差し引く |
|
|
( |
) |
|
|
( |
) |
期末払い |
|
|
— |
|
|
|
|
|
長期債務、割引と現在の部分を差し引いた純額 |
|
$ |
|
|
$ |
|
||
OrbiMed信用プロトコル
当社は2018年6月にOrbiMed Royalty Opportunities II,LPとクレジットプロトコル(“OrbiMedクレジットプロトコル”)を締結し,これによりTransMedicsが$を借入する
2022年7月、当社は#ドルを含むOrbiMed信用協定によって満期になったお金を返済しました
カナダ帝国商業銀行信用協定
当社は2022年7月にカナダ帝国商業銀行(“CIBC”)と信用協定を締結し、この合意に基づき、当社は$を借入する
カナダ帝国商業銀行信用協定項下の借入金は年利で利下げし、金利は当社が選択する:(I)当社が選定した1つの利子期間の担保付き隔夜融資金利、最低金利は
93
カナダ帝国商業銀行の信用協定を締結することについて、当社は前払い費用及びその他の費用#ドルを支払う
カナダ帝国商業銀行信用協定項の下のすべての債務は当社とその各主要な付属会社が保証します。一部の例外を除いて、当社および保証人1人あたりのすべての債務は、当社および保証人1人あたりのほとんどの資産(その知的財産権を含む)を担保としています。カナダ帝国商業銀行の信用協定によると、当社はすでに慣用陳述と保証、違約事件及びいくつかのプラスとマイナスの契約に同意し、期限まで同意した
違約事件が継続している間、年利率は違約事件発生時に適用される金利プラスに等しくなります
同社はカナダ帝国商業銀行信用協定のすべての条項と特徴を評価し、区別すべき可能性のある潜在的な埋め込み特徴を決定した。この分析の一部として、同社は債務の経済的特徴とリスクを評価した。当社は、カナダ帝国商業銀行信用協定のすべての特徴は債務主体と明確に密接に関連しているか、あるいは極めて低い公正価値を持っているため、派生負債として単独で計算する必要がないことを確定した。
2022年12月31日現在、カナダ帝国商業銀行信用協定により借入金に適用される金利は
優先株
2022年12月31日から,会社の組織定款認可会社が最も多く発行されている
普通株
2022年12月31日から,会社の組織定款認可会社が最も多く発行されている
94
株式承認証
2022年12月31日まで、同社は未償還株式証明書を購入することができます
2019年株式インセンティブ計画
“2019年株式インセンティブ計画”(“2019年計画”)は、会社及びその子会社の従業員、取締役、コンサルタントに奨励的株式オプション、不適格株式オプション、株式付加権、制限株、制限株式単位、非制限株式、非制限株式単位等の株式ベースの奨励を付与することを規定している。2019年計画によると、TransMedicsグループが最初に発行可能な普通株式数は
奨励の行使や購入価格を支払うため、または源泉徴収要求を満たすために差し押さえられた株式、および株式付加価値権がカバーする、その任意の部分を株式で決済する株式は、2019年計画下で発行可能な株式数を減らす。また、2019年計画に基づいて発行可能な株式数(I)は、2019年計画に基づいて交付されたいかなる株式によっても増加することはなく、その後、株式オプションの行使に直接帰属する収益を用いて買い戻し、(Ii)現金で決済または満期、行使不可能、終了、没収、または買い戻しの奨励によって減少することはなく、TransMedics Groupは2019年の計画に基づいて株式を発行していない。2022年12月31日までに
2019年従業員株購入計画
会社の2019年従業員株購入計画(“2019年従業員株購入計画”)によると、会社の一部の従業員は発売期間中に会社普通株を低い価格で購入する資格がある。2019年ESPPは、参加者が国内税法で規定されている制限を満たした場合、賃金控除により貢献した資金を用いて普通株を購入することを許可し、購入価格は
2021年インセンティブ計画
2021年8月、会社取締役会はTransMedics Group,Inc.のインセンティブ計画(以下、“インセンティブ計画”と略す)を承認した。インセンティブ計画の条項によると、当社は、当社の元従業員又は取締役でない個人又は当社が真に非雇用期間後に再雇用された個人に、非制限株式オプション、株式付加権、制限株式、非制限株式、制限株式単位奨励及び業績奨励を付与することができる。合計する
株式オプション推定値
株式オプション付与の公正価値は、ブラック·スコアーズオプション定価モデルを用いて推定される。会社が初公開するまで、会社の普通株は市場を公開していなかったため、会社特定の歴史や隠れた変動率データは限られていた。そこで,当社の予想変動率の推定は,当社自身の歴史変動率と,それに類似した特徴を持つ上場企業の履歴変動率の組を組み合わせたものである.サービスの帰属条件に基づくオプションを有する場合、会社の株式オプションの期待期限は、“通常”オプション資格に適合する報酬の“簡略化”方法を用いて決定される。無リスク金利は,時間賞付与時に有効な米国債収益率曲線を参照して決定される
95
期限は授権書の予想期限にほぼ等しい。予想配当収益率は、当社が現金配当金を支払ったことがないことに基づいており、予測可能な未来には現金配当金は一切支払われないと予想される。
次の表は、加重平均に基づいて、ブラック·スコアーズオプション定価モデルにおいて、従業員および取締役に付与された株式オプション付与日の公正価値を決定するための仮定を提案した
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
無リスク金利 |
|
|
% |
|
|
% |
|
|
% |
|||
予想期限(年単位) |
|
|
|
|
|
|
|
|
|
|||
予想変動率 |
|
|
% |
|
|
% |
|
|
% |
|||
期待配当収益率 |
|
|
% |
|
|
% |
|
|
% |
|||
次の表は、会社の2021年12月31日以来のオプション活動をまとめています
|
|
番号をつける |
|
|
重みをつける |
|
|
重みをつける |
|
|
骨材 |
|
||||
|
|
|
|
|
|
|
|
(単位:年) |
|
|
(単位:千) |
|
||||
2021年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
授与する |
|
|
|
|
|
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
没収される |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
期限が切れる |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
帰属しており、2022年12月31日に帰属する予定です |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2022年12月31日までに行使可能なオプション |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
株式オプションの内的価値総額は、会社普通株公正価値よりも低い価格を行使する株式オプションの行権価格と会社普通株公正価値との差額として計算される。2022年12月31日現在,2021年および2020年12月31日までに年度内に行使される株式オプションの内的価値の合計は
その会社は所有している
制限普通株
2022年12月31日までの年度内に、会社はいくつかの非従業員サービスサプライヤーに制限的普通株式を付与する。“会社”ができた
次の表は、2021年12月31日以来の制限された普通株式活動をまとめたものである
|
|
株 |
|
|
加重平均付与日公正価値 |
|
||
2021年12月31日現在の非帰属制限普通株式 |
|
|
— |
|
|
$ |
— |
|
発表されました |
|
|
|
|
|
|
||
既得 |
|
|
— |
|
|
|
— |
|
没収される |
|
|
( |
) |
|
|
|
|
2022年12月31日現在の非帰属制限普通株式 |
|
|
|
|
$ |
|
||
96
株に基づく報酬
同社は、その合併経営報告書の以下の費用種別に、株式ベースの報酬費用(千単位)を記録している
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
収入コスト |
|
$ |
|
|
$ |
|
|
$ |
|
|||
研究·開発·臨床試験費用 |
|
|
|
|
|
|
|
|
|
|||
販売、一般、行政費用 |
|
|
|
|
|
|
|
|
|
|||
|
|
$ |
|
|
$ |
|
|
$ |
|
|||
2022年12月31日現在、未帰属株式報酬に関する未確認報酬コスト総額は$
計税準備構成部分
2022年,2021年および2022年12月31日まで年度
所得税前損失
所得税前に赤字となった国内と海外の部分は以下の通り(千計)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
アメリカです |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
外国.外国 |
|
|
|
|
|
|
|
|
|
|||
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
米国連邦法定所得税率と会社の有効所得税率の入金は以下の通りである
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
連邦法定所得税率 |
|
|
( |
)% |
|
|
( |
)% |
|
|
( |
)% |
連邦福祉を差し引いた州税 |
|
|
( |
)% |
|
|
( |
)% |
|
|
( |
)% |
連邦と州研究開発税 |
|
|
( |
)% |
|
|
( |
)% |
|
|
( |
)% |
差し引かれない項目 |
|
|
( |
)% |
|
|
( |
)% |
|
|
( |
)% |
国の混合税率変化の繰延納税効果 |
|
|
% |
|
|
( |
)% |
|
|
% |
||
規定に戻る |
|
|
% |
|
|
% |
|
|
% |
|||
他にも |
|
|
% |
|
|
( |
)% |
|
|
% |
||
繰延税金資産推定値変動準備 |
|
|
% |
|
|
% |
|
|
% |
|||
有効所得税率 |
|
|
% |
|
|
% |
|
|
( |
)% |
||
97
繰延税金純資産は以下の部分からなる(千計)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
繰延税金資産: |
|
|
|
|
|
|
||
純営業損失が繰り越す |
|
$ |
|
|
$ |
|
||
資本化研究と開発費 |
|
|
|
|
|
|
||
研究と開発税収は繰越免除 |
|
|
|
|
|
|
||
費用を計算する |
|
|
|
|
|
|
||
株に基づく報酬費用 |
|
|
|
|
|
|
||
リース責任 |
|
|
|
|
|
|
||
第百三十三条権益 |
|
|
|
|
|
— |
|
|
他にも |
|
|
|
|
|
|
||
繰延税金資産総額 |
|
|
|
|
|
|
||
繰延税金負債: |
|
|
|
|
|
|
||
他にも |
|
|
( |
) |
|
|
( |
) |
使用権資産 |
|
|
( |
) |
|
|
( |
) |
繰延税金負債総額 |
|
|
( |
) |
|
|
( |
) |
推定免税額 |
|
|
( |
) |
|
|
( |
) |
繰延税項目純資産 |
|
$ |
— |
|
|
$ |
— |
|
2022年12月31日現在、会社が繰り越した連邦純営業損失は$
アメリカ連邦と州の営業純損失の繰越と研究開発税収の繰越免除の使用は1986年の“国税法”第382と383節及び州法律の相応条項の実質的な年間制限を受ける可能性があり、原因は以前に発生或いは未来に発生する可能性のある所有権変更である
会計基準第740号の要求によると、当社の経営陣は、繰延税金資産の現金化に影響を与えるプラスおよび負の証拠を評価しており、これらの証拠は主に繰越の純営業損失を含む。経営陣は、当社が連邦や州繰延税資産の利益を確認しない可能性があることを確認したため、推定手当を計上した。
その会社は所有している
98
同社は2001年12月31日までの納税年度に研究免除を獲得したが,条件に合った活動を記録する研究は行われていない。この研究は会社の研究や開発繰り越しの調整につながる可能性があるが、研究が完了し、どのような調整が完了しているかを知る前に、2022年12月31日までの年度には未確認の税収割引として記載されている金額はない。すでに当社の研究及び発展信用について全額評価を準備し、必要であれば調整を行い、この調整は信用繰越を研究するために設立された繰延税金項目の資産調整と推定値から相殺する。
会社は管轄区域の税法の規定に従って所得税申告書を提出します。通常業務の過程において、当社は連邦と州司法管轄区の審査を受けなければならない(適用されるように)。現在未解決の連邦や州税務審査はない。当社は財政年度から開放納税年度があるが,審査しなければならない
2022年12月31日までの年度における繰延税項資産推定準備の変化は、主に第174条に要求される研究開発コスト資本化および今年度発生した連邦と純営業損失に関係しているが、州有効税率の変化により、州営業純損失繰越に関する繰延税項資産減少部分はこの変化を相殺している。2021年および2020年12月31日までの繰延税金資産推定値準備変動は、主に2021年および2020年の経営損失純繰越増加と関係がある。推定免税額の変動状況は以下の通り(千で計算)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
年初の評価免税額 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
所得税引当利益の減額を計上する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
所得税計上の増加 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
年末までの推定免税額 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
2022年12月31日と2021年12月31日まで、会社は
同社はオフィス、実験室、製造スペースを借りている
賃貸契約により大家が$を貢献した
ASC 842項目の下で、会社のレンタル費用の構成要素は以下の通りである
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
リースコストを経営する |
|
$ |
|
|
$ |
|
||
短期賃貸コスト |
|
|
|
|
|
|
||
可変リースコスト |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
99
レンタルに関する補足キャッシュフロー情報開示状況は以下のとおりである(千計):
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
経営活動に計量した金額を計上するために支払われた現金 |
|
$ |
|
|
$ |
|
||
2022年12月31日までの加重平均残存期間は
十二月三十一日までの年度 |
|
|
|
|
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
将来の最低賃貸支払い総額 |
|
|
|
|
差し引く:推定利息 |
|
|
( |
) |
リース負債総額を経営する |
|
$ |
|
|
次の表は、総合貸借対照表の賃貸負債(千で計算)
|
|
2022年12月31日 |
|
|
流動経営賃貸負債 |
|
$ |
|
|
賃貸負債を経営し,当期分を差し引く |
|
|
|
|
リース負債総額を経営する |
|
$ |
|
|
401(K)貯蓄計画
国内所得法第401(K)条によると、同社には固定払込貯蓄計画がある。この計画は、基本的に最低年齢およびサービス要件に適合するすべての従業員をカバーし、参加者が税引前に年間給与の一部の支払いを延期することを可能にする。その計画に対する会社の貢献は取締役会が適宜決定することができる。当社は、2022年、2021年、2020年12月31日までの年間で、
100
賠償協定
通常の業務の過程で、会社は、特定の知的財産権(特許、著作権、商標または商業秘密を含む可能性がある)を侵害する第三者クレームについて、その顧客を弁護および賠償することに同意した。これらの賠償条項によると、当社のリスクは一般に最終顧客が合意に基づいて支払う総金額に限られています。しかし、いくつかの合意には賠償条項が含まれており、会社が合意に基づいて受け取った金額を超える損失を受ける可能性がある。通常の業務過程において、会社は、このような合意または第三者に違反する知的財産侵害クレームによる損失を含むが、これらに限定されない異なる範囲および条項の賠償をサプライヤー、レンタル者、業務パートナー、および他の当事者に提供することができる。また、当社は取締役会メンバーと合意を締結し、取締役または上級管理者としての身分やサービスとして生じる可能性のあるいくつかの責任について補償を行うことを当社に要求している。
これらの賠償協定によると、会社が将来支払う必要がある可能性のある最大潜在金額は多くの場合無制限である。当社はこれまで、当該等の賠償により重大なコストを発生させていません。同社は現在、どのような賠償要求があるかを知らず、2022年12月31日と2021年12月31日までの総合財務諸表に当該等の債務に関する負債を計上していない。
無条件購入承諾
2021年1月、当社は無条件の契約を締結しました
法律訴訟
その会社はその業務範囲を
国·地域別に記載された収入は付記15参照。地理的位置別の長期資産要約は以下のとおりである(千単位)
|
|
|
|
|||||
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
国·地域別の長期資産(1): |
|
|
|
|
|
|
||
アメリカです |
|
$ |
|
|
$ |
|
||
他のすべての国/地域 |
|
|
|
|
|
|
||
長期資産総額 |
|
$ |
|
|
$ |
|
||
101
当社は,臨床試験材料を補償するために顧客に支払う金と,当社のOCS製品に関する特定の臨床試験プロトコルを実行することによる顧客コストが,顧客が譲渡した独自の商品やサービスを当社に提供していないことが決定したため,同社の総合経営報告書に顧客収入の減少と記載している。同社がOCS使い捨てスーツの販売収入を確認した場合、このような精算費用の顧客への支払いに関連する収入の減少が確認される。
これらの特定支払の毛収入と純製品収入の入金は以下のとおりである(千単位)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
顧客に販売される総生産 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
差し引く:臨床試験費用 |
|
|
( |
) |
|
|
|
|
|
|
||
製品純収入総額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
2022年12月31日までの年間臨床試験支払いには、いくつかの臨床試験に計上すべき費用の見積もりの調整が含まれている。臨床試験の追跡期間終了に伴い,同社はその見積を更新した。臨床試験支払いに関するすべての情報を受け取った後、同社はその臨床試験の計算すべき費用推定を更新し続ける。
会社は、承認後の研究または既存の看護標準プロトコルに関連する情報を取得するために顧客に支払われるお金(すなわち、会社のOCS製品とは無関係)が、会社が顧客から転送された会社OCS製品のユニークな商品またはサービスとは独立して顧客から転送されたことを受け取り、顧客に支払われる対価格が、受信したユニークな商品またはサービスの公正な価値を表すので、コストとして分類された基準に適合すると認定している。そのため、顧客に支払われたこのようなお金は運営費用として記録される。同社は,顧客への支払いの承認後の研究に関する支払いと,既存の介護基準案に関する文書支払い#ドルを記録している
仕分け収入
同社は、当社の収入とキャッシュフローの性質、金額、時間、不確実性が経済的要因の影響をどのように受けるかを最もよく記述していると考えられるため、臓器タイプと地理地域別に顧客との契約収入を分類した
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
国と機関別の収入(1): |
|
|
|
|
|
|
|
|
|
|||
アメリカです |
|
|
|
|
|
|
|
|
|
|||
肺総収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
ハート総収入 |
|
|
|
|
|
|
|
|
|
|||
肝臓総収入 |
|
|
|
|
|
|
|
|
|
|||
アメリカの総収入 |
|
|
|
|
|
|
|
|
|
|||
他のすべての国/地域 |
|
|
|
|
|
|
|
|
|
|||
肺収入 |
|
|
|
|
|
|
|
|||||
心臓収入 |
|
|
|
|
|
|
|
|
|
|||
肝臓収入 |
|
|
|
|
|
— |
|
|
|
— |
|
|
他のすべての国·地域の総収入 |
|
|
|
|
|
|
|
|
|
|||
総収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
102
顧客注文が米国における使い捨てセットおよび臓器回収またはOCS臓器管理サービスを含む場合、会社は、使い捨てスーツおよびサービスが別個の履行義務を構成することを決定し、収入を使い捨てスーツおよびサービスの両方として顧客に提供することを確認した。
アミラ·ハサニン博士を雇って
アミラ·カザニイン博士は会社の最高経営責任者兼取締役会のワリッド·カザニイン博士の妹で、彼女は会社のOCS肺プロジェクトの製品役員である。同社はAmira Hassane博士に#ドルを支払った
103
項目9.Accouとの変更と分岐会計と財務情報開示の専門。
ありません
第9条。制御するプログラムがあります
情報開示制御とプログラムの評価
我々の経営陣は、総裁、最高経営責任者、最高財務責任者(それぞれ最高経営責任者、財務会計官)の参加の下、2022年12月31日までの開示制御および手続きの有効性を評価した。取引法規則13 a-15(E)および15 d-15(E)に定義されている用語“開示制御および手順”は、取引法に従って提出または提出された報告において開示を要求する会社の情報が米国証券取引委員会規則および表によって指定された期間内に記録、処理、集約および報告されることを保証するための会社の制御および他の手続きを意味する。開示制御及び手続は、会社が“取引法”に基づいて提出又は提出された報告書において開示を要求する情報が蓄積され、その主要幹部及び主要財務官を含む会社経営者に伝達されることを保証することに限定されるものではないが、必要な開示に関する決定をタイムリーに行うために、同様の機能を果たす者の制御及び手続を適宜行う。
経営陣は、どのような制御やプログラムが、どんなに設計や操作が良くても、その目標を実現するために合理的な保証を提供するしかないことを認識しており、管理部門は、可能な制御とプログラムのコスト-利益関係を評価する際にその判断を運用しなければならない。2022年12月31日現在の我々の開示制御及び手続の評価に基づいて、我々の総裁兼最高経営責任者及び我々の最高財務官は、この日までに、我々の開示制御及び手続が合理的な保証レベルで有効であると結論した。
財務報告の内部統制
経営陣財務報告内部統制年次報告書
経営陣は、取引法に基づいて公布された規則13 a−15(F)および15 d−15(F)に定義されている財務報告の十分な内部統制の確立および維持を担当する 我々の主要執行者および主要財務官によって設計または監督され、当社の取締役会、管理層、および他の人員によって実施されるプログラムとして、財務報告の信頼性およびGAAPに基づいて外部目的で財務諸表を作成する合理的な保証を提供する。
財務報告の内部統制は、(1)合理的で詳細かつ正確かつ公平に資産取引および処置を反映する記録を維持することに関連する、(2)公認会計基準に基づいて財務諸表を作成し、その管理層および取締役の許可のみに基づいて収支を行うために必要な取引を記録するための合理的な保証を提供する、および(3)その財務諸表に重大な影響を与える可能性のある不正な買収、使用または処分について合理的な保証を提供するための合理的な保証を提供する、という政策および手順を含む。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来の期間の有効性をどのように評価するかの予測には,条件の変化により制御措置が不十分になる可能性がある,あるいはそのような制御措置に含まれる政策やプログラムの遵守度が悪化する可能性がある.
我々の経営陣は、委員会が発表した“内部統制-総合枠組み”(2013)に記載されている基準に基づいて、2022年12月31日までの財務報告内部統制の有効性を評価した
104
トレデビル委員会は組織を後援している。この評価に基づき、経営陣は、2022年12月31日現在、財務報告の内部統制に有効であると結論した。
本稿で述べたように、2022年12月31日までの財務報告内部統制の有効性は、独立公認会計士事務所普華永道会計士事務所が監査している。
財務報告の内部統制の変化
2022年12月31日までの3ヶ月間、財務報告の内部統制(取引法第13 a-15(F)および15 d-15(F)条の定義による)に大きな影響を与えなかったか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化はなかった。
プロジェクト9 B。他にも情報です。
ありません
プロジェクト9 Cです。検査を阻害する外国司法管轄区域の開示に関する。
適用されません。
105
第三部
プロジェクト10.役員·役員職ICERSと会社管理。
本条項10に要求される情報は、2023年の株主総会に関する我々が米国証券取引委員会または米国証券取引委員会に提出した最終委託書に含まれ、引用によって本明細書に組み込まれる。
プロジェクト11.行政官イー補償します。
第11条に要求される情報は、2023年年次総会に関する我々が米国証券取引委員会または米国証券取引委員会に提出した最終委託書に含まれ、引用によって本明細書に組み込まれる。
プロジェクト12.特定の受益者の保証所有権従業員と経営陣と関連した株主問題。
第12条要求される情報は、2023年年次総会に関する我々が米国証券取引委員会又は米国証券取引委員会に提出した最終委託書に含まれ、引用により本明細書に組み込まれる。
第13条に要求される情報は、2023年年次総会に関する我々が米国証券取引委員会または米国証券取引委員会に提出した最終委託書に含まれ、引用によって本明細書に組み込まれる。
第14項.元金口座TING料金とサービスです。
第14条に要求される情報は、2023年年次総会に関する我々が米国証券取引委員会又は米国証券取引委員会に提出した最終委託書に含まれ、引用により本明細書に組み込まれる。
106
第4部
プロジェクト15.展示品、資金エーアールアイチェックリストです。
一財務諸表
以下のファイルは、本ファイルに添付されている76~105ページに含まれ、本年度報告の10-Kフォームの一部としてアーカイブされる。
|
ページ |
独立公認会計士事務所報告 |
75 |
合併貸借対照表 |
78 |
連結業務報告書 |
79 |
合併全面損失表 |
80 |
株主権益合併報告書 |
81 |
統合現金フロー表 |
82 |
連結財務諸表付記 |
83 |
(2)財務諸表付表:
これらは、適用されない、不要、または必要な資料が財務諸表またはその付記に列挙されているので、すべての財務諸表の添付表は省略される。
(3)展示品。
以下に本年度報告10-K表の一部として提出した証拠品リストを示す.
展示品 番号をつける |
|
説明する |
3.1 |
|
再記載された組織定款(登録者年次報告書の表格10−K添付ファイル3.1(アーカイブ号)参照:38891)2020年3月17日に米国証券取引委員会に提出) |
|
|
|
3.2 |
|
2回目の改訂及び再改訂附例(参照登録者により2022年11月4日に米国証券取引委員会に提出された現在の8−Kテーブル報告書(ファイル番号001−38891)の添付ファイル3.1編入) |
|
|
|
4.1 |
|
普通株式株式を証明する株式サンプル証明書(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル4.1を参照)。 |
|
|
|
4.3 |
|
登録者とHercules Technology Growth Capital,Inc.(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル4.3を統合した優先株購入権証明書を参照することにより、日付は2015年9月11日) |
|
|
|
4.4 |
|
登録者とHercules Technology Growth Capital,Inc.(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル4.4を統合した優先株購入権証明書を参照することにより、日付は2016年8月4日) |
|
|
|
4.5 |
|
登録証券説明(2020年3月17日に米国証券取引委員会に提出された登録者10−K年報(文書番号001−38891)添付ファイル4.5参照) |
|
|
|
10.1 |
|
第9の改正および再署名された投資家権利協定は、2019年5月6日であり、TransMedics Group,Inc.,TransMedics,Inc.およびその株主間で締結される(2019年5月1日に米国証券取引委員会に提出された登録者の現在の8-K報告書(文書番号001-38891)の添付ファイル10.1を参照して編入される) |
|
|
|
10.2 |
|
登録者とその役員及び上級管理者それぞれとの間の賠償協議表(2019年4月5日に米国証券取引委員会に提出された登録者S−1表登録説明書(第333−230736号文書)添付ファイル10.2を参照して編入) |
|
|
|
10.3# |
|
2004年株式インセンティブ計画の改訂と再作成(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.3参照) |
|
|
|
107
10.4# |
|
2004年株式インセンティブ計画下のインセンティブ株式オプション協定表(2019年4月5日に米国証券取引委員会に提出された登録者S−1フォーム登録説明書(第333-230736号ファイル)添付ファイル10.4参照) |
|
|
|
10.5# |
|
2014年株式インセンティブ計画の改訂と再開(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.5参照) |
|
|
|
10.6# |
|
2014年株式インセンティブ計画下のインセンティブ株式オプション協定表(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.6参照) |
|
|
|
10.7# |
|
2014年株式インセンティブ計画非限定株式オプション協定表(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.7参照) |
|
|
|
10.8# |
|
2014年株式インセンティブ計画下の限定株式契約表(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル10.8参照) |
|
|
|
10.9# |
|
2019年株式インセンティブ計画(2019年4月22日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号書類)添付ファイル10.9参照) |
|
|
|
10.10# |
|
2019年株式インセンティブ計画下のインセンティブ株式オプション契約表(2019年4月22日に米国証券取引委員会に提出された登録者S-1フォーム登録説明書(第333-230736号ファイル)添付ファイル10.10参照) |
|
|
|
10.11# |
|
2019年株式インセンティブ計画下非法定株式オプション協定表(2019年4月22日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号ファイル)添付ファイル10.11を参照して編入) |
|
|
|
10.12# |
|
2019年従業員株購入計画(2019年4月22日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル10.12参照) |
|
|
|
10.13# |
|
2019年現金奨励計画(2019年4月22日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号書類)添付ファイル10.13編入参照) |
|
|
|
10.14# |
|
TransMedics Group,Inc.誘導計画(登録者を参照して2021年8月9日に米国証券取引委員会に提出された8−Kフォーム現在報告書(ファイル番号001−38891)の添付ファイル10.1への編入) |
|
|
|
10.15# |
|
登録者とWaleed H.Hassanein,M.D.によって締結された2007年11月15日の日付の“行政者保留協定”(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録声明(第333-230736号文書)添付ファイル10.14を参照して編入) |
|
|
|
10.16# |
|
行政者保留協定は、登録者とTamer I.KhaYal,M.D.によって締結され、日付は2007年11月15日である(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録声明(第333-230736号文書)添付ファイル10.15を参照して編入) |
|
|
|
10.17# |
|
登録者とスティーヴン·ゴードンとの間の役員保留協定は、2015年3月23日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録声明(書類番号333-230736)添付ファイル10.16を引用して編入) |
|
|
|
10.18 |
|
登録者と200 Minuteman Limited Partnershipとの間のリース契約は、2004年6月25日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル10.17を参照して編入) |
|
|
|
10.19 |
|
登録者と200 Minuteman有限責任組合との間の賃貸借契約第1改正案は、2004年9月28日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.18を参照して編入) |
|
|
|
10.20 |
|
登録者と200 Minuteman有限責任組合との間の第二次リース改正案は、2005年11月29日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.19を参照して編入) |
108
|
|
|
10.21 |
|
登録者と200 Minuteman有限責任組合との間の第3次リース改正案は、2006年6月12日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.20を参照して編入) |
|
|
|
10.22 |
|
登録者と200 Minuteman有限責任組合との間の第4回リース改正案は、2007年2月1日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.21を参照して編入) |
|
|
|
10.23 |
|
登録者と200 Minuteman有限責任組合との間の第5回リース改正案は、2010年4月30日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.22を参照して編入) |
|
|
|
10.24 |
|
登録者と30 Minuteman Limited Partnershipが2004年6月25日に締結したリース契約(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル10.23を参照して編入) |
|
|
|
10.25 |
|
登録者と30 Minuteman有限責任組合との間の第二次リース改正案は、2005年11月29日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.24を参照して編入) |
|
|
|
10.26 |
|
登録者と30 Minuteman有限責任組合との間の第3次リース改正案は、2010年4月30日(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(第333-230736号文書)添付ファイル10.25を参照して編入) |
|
|
|
10.27 |
|
当社、Whetstone 200 Minuteman Park,LLCとWhetstone 30 Minuteman Park,LLCの間で締結された、2020年1月9日のリース契約を日付とする総合改正案1(登録者が2020年3月17日に米国証券取引委員会に提出した10−K表年次報告書(文書番号001−38891)の添付ファイル10.26を参照して編入) |
|
|
|
10.28 |
|
クレジット協定は、期日は2022年7月25日であり、TransMedics Group,Inc.,貸手TransMedics Group,Inc.およびカナダ帝国商業銀行によって行政代理および担保エージェントとして提出される(登録者を参照して2022年7月29日に米国証券取引委員会に提出された8-K表現在の報告(文書番号001-38891)の添付ファイル10.1が編入される) |
|
|
|
10.29 |
|
保証および担保協定は、TransMedics Group,Inc.,TransMedics,Inc.,TransMedics B.V.およびカナダ帝国商業銀行によって署名され、日付は2022年7月25日(添付ファイル10.2を参照して登録者が2022年7月29日に米国証券取引委員会に提出された8-K表現在報告書(文書番号001-38891)に組み込まれる) |
|
|
|
10.30+ |
|
登録者とFresenius Kabi ABとの間で2005年5月24日に署名された開発及び供給協定(添付ファイル10.32を参照して登録者が2019年4月5日に米国証券取引委員会に提出したS−1表登録説明書(第333−230736号文書)に組み込まれる) |
|
|
|
10.31+ |
|
登録者とフィゼンユス·カビーオーストリア株式会社との間で2015年4月1日に署名された契約製造協定(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録声明(第333-230736号文書)添付ファイル10.33を参照して編入) |
|
|
|
10.32+ |
|
BEとTransMedics,Inc.とStephen Gordonの間で2020年4月10日に署名された“役員留任協定改正案”(合併内容参照登録者は2020年4月13日に米国証券取引委員会に提出された最新8−K表報告(文書番号001−38891))。 |
|
|
|
10.33 |
|
2020年6月1日に当社がWhetstone 200 Minuteman Park,LLCおよびWhetstone 30 Minuteman Park,LLC(登録者が2020年8月7日に米国証券取引委員会に提出した10-Q表四半期報告(文書番号001-38891)と合併した)を参考にした総合リース改正案2。 |
|
|
|
21.1 |
|
子会社リスト(2019年4月5日に米国証券取引委員会に提出された登録者S-1表登録説明書(書類番号333-230736)添付ファイル21.1を参照して編入)。 |
|
|
|
23.1* |
|
独立公認会計士事務所の普華永道会計士事務所の同意を得た。 |
|
|
|
31.1* |
|
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
31.2* |
|
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
|
|
109
32.1** |
|
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条に規定されている最高経営責任者証明書。 |
|
|
|
32.2** |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による首席財務官の認証。 |
|
|
|
101.INS |
|
連結されたXBRLインスタンス文書-インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルには表示されない |
|
|
|
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
101.カール |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
|
101.def |
|
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
|
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
101.Pre |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
|
104 |
|
表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) |
*アーカイブをお送りします。
**関数で提供されます。
#管理または補償計画、契約、またはスケジュールを表示します。
+ いくつかの部分に機密待遇を与え、どの部分が省略され、単独で米国証券取引委員会に提出されたか。
項目16.表10-Kの概要
ない。
110
標札すきま
改正された1934年証券取引法第13又は15(D)節の要求に基づいて、登録者は、正式に許可された次の署名者がその代表を代表して本報告書に署名することを正式に手配した.
|
|
会社名 |
|
|
|
|
|
日付:2023年2月27日 |
|
差出人: |
/s/スティーブン·ゴードン |
|
|
|
スティーブン·ゴードン |
|
|
|
首席財務官·財務担当兼秘書 |
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
名前.名前 |
|
タイトル |
|
日取り |
|
|
|
|
|
ヴァリッド·H·ハサン医学博士 |
|
取締役最高経営責任者総裁 |
|
2023年2月27日 |
ヴァリッド·H·ハサニン |
|
|
|
|
|
|
|
|
|
/s/スティーブン·ゴードン |
|
首席財務官·財務担当兼秘書 |
|
2023年2月27日 |
スティーブン·ゴードン |
|
|
|
|
|
|
|
|
|
ジェームズ·R·トビン |
|
取締役会議長 |
|
2023年2月27日 |
ジェームズ·R·トビン |
|
|
|
|
|
|
|
|
|
/S/Edward M.Basile |
|
役員.取締役 |
|
2023年2月27日 |
エドワード·M·バシル |
|
|
|
|
|
|
|
|
|
トーマス·J·ガンダーソン |
|
役員.取締役 |
|
2023年2月27日 |
トーマス·ガンダーソン |
|
|
|
|
|
|
|
|
|
リトル·エドウィン·M·カニア |
|
役員.取締役 |
|
2023年2月27日 |
リトル·エドウィン·M·カニア |
|
|
|
|
|
|
|
|
|
デイビッド·ウィル医学博士 |
|
役員.取締役 |
|
2023年2月27日 |
デイビッド·ウィル医学博士 |
|
|
|
|
|
|
|
|
|
/s/メリリー·レインズ |
|
役員.取締役 |
|
2023年2月27日 |
メリリー·レインズ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
111