
2022年第4四半期と通年財務実績2023年2月23日

このプレゼンテーションには重大な危険と不確実性に関する前向きな陳述が含まれている。“1995年個人証券訴訟改革法”における展望性陳述の定義は、展望性陳述は歴史事実ではなく、多くのリスクと不確定要素に関連することである。ここでの語は、例えば、“可能”、“会”、“はず”、“可能”、“できる”、“期待”、“計画”、“予想”、“信じる”、“見積もり”、“計画”、“予測”、“計画”、“潜在”、“継続”および類似の表現(および未来のイベントを引用する他の言葉または表現
である。条件または状況)は、前向き陳述を識別する可能性がある。本プレゼンテーション中の展望性陳述は会社の現在の予想と信念に基づいており、既知と未知のリスク、不確定性とその他の要素に関連し、会社の実際の結果、業績と業績及びいくつかの事件の時間は任意の展望性陳述の中で予測、予想或いは表明した結果、業績、業績或いは時間と大きく異なる可能性がある。このようなリスク、不確実性、および他の要因は、米国、ヨーロッパまたは日本以外のArikayceまたは会社の米国、ヨーロッパ、日本または他の市場の候補製品が、各市場および各用途のLamiraネブライザーシステムの個別の規制承認を含む規制承認を得ることができなかったか、または遅延して規制されていない要素を含むが、これらに限定されない。会社が唯一承認した製品Arikayceはアメリカ、ヨーロッパ、または日本で商業化に成功しなかった(それぞれアミカ星リポソーム吸入懸濁剤、リポソーム590 mg霧化分散剤、アミカシン吸入薬物製品), Arikayceに対する米国、ヨーロッパ、または日本の承認を維持するか、災害または他の事件(自然災害または公衆衛生危機を含む)による業務または経済的中断、新冠肺炎の大流行の影響、および会社の業務、従業員(キーパーソン、患者、パートナー、およびサプライヤーを含む)へのそれの伝播を減少させる努力;BrusocatibまたはTPIPは、Brusocatib、Aspen研究、医師、患者、第三者支払者、および医療界の他の人のArikayceに対する市場受け入れの程度の不確実性を含む、進行中および将来の臨床研究において、患者に無効または安全でないことが証明されているリスクである。会社が患者報告結果を検証するツールの研究およびArikayceを完全に承認するために必要な確認性上場後の臨床試験のリスクを含む、米国食品·薬物管理局のArikayceの完全な承認を得ることができない;会社、Pariまたは会社の他の第三者メーカーがArikayceまたはLamiraシステムに関連する法規要件を遵守できない;会社は政府または第三者支払人から十分なArikayceまたはArikayceが受け入れられる価格の補償を得ることができない;Arikayce、Brusocatib、TPIPまたは当社の他の候補製品に関連する意外な安全または治療効果の問題;br}会社のArikayce、Brusocatib、TPIPまたは当社の他の候補製品の潜在的な市場規模の推定は正確ではないか、または会社は医師の識別のデータ、予想される患者受入率、予想される治療持続時間を決定するために使用される, または予想される患者コンプライアンス率または停止率;Pharmakonコンサルタント会社が管理するいくつかの基金の会社保証優先融資に関連するリスクおよび不確実性、ならびに会社とOrbiMed Royalty&Credit Opportunities IV、LPが管理する会社の特許権使用料融資の予想収益は、優先保証融資および特許権使用料融資プロトコルにおける契約を遵守する能力を維持すること、およびこれらの合意に基づいて会社の運営の制限に及ぼす影響を含む。当社は有効な直売やマーケティングインフラを作ることができず、このようなインフラを提供する第三者と協力してArikayceや会社が将来承認した任意の候補製品を流通させることもできません。規制部門の承認を得ることができず、Arikayceの適応をより広い患者集団に拡大することができません。会社のライバルbrは、会社が特定の適応について開発した製品と本質的に同じ製品の孤立薬物独占特許権を得ることができます。新型遺伝子治療製品の開発、監督管理許可と商業化の時間とコストの予測に成功できなかった;会社が監督許可を行うために必要な臨床前開発活動と臨床試験の経験が限られているため、試験を行い、完成する或いは監督管理承認に必要なデータを行うのに十分な患者を募集或いは維持できない可能性があるため、Arikayce、Brensocatib、TPIPと会社の他の候補製品の未来の臨床試験に成功しなかった, 他の事項に加えて、会社の臨床研究は延期されるか、または薬物開発中に深刻な副作用のリスクが発見される;会社が依存する第三者は、商業または臨床需要のための十分な数のArikayceまたは会社の候補製品を生産することができず、会社の臨床試験を行うことができなかったか、または会社の業務に影響を与える会社の合意または法律法規または会社との合意を遵守できなかった。会社は肝心な人を誘致し、維持することができない、あるいは会社の成長を効果的に管理することができない;会社は最近買収した会社をうまく統合することができず、管理層が統合活動に投入する時間と注意力を適切に管理することができない;会社が買収した技術、製品と候補製品が商業的に成功しないリスク;会社はその競争が激しく変化する環境に適応できない;会社はその重要な顧客のリスクを維持できない;政府の医療改革は会社のコストを大幅に増加させ、その財務状況を損害するリスク。米国、ヨーロッパ、日本、世界の全体的な経済状況は、長期インフレの影響を含み、会社及びそのサプライヤーに影響を及ぼす, 第三者サービス提供者および潜在的パートナー;会社は、その知的財産権を十分に保護することができない、またはその商業秘密および他の固有情報の開示を阻止すること、およびそのような事項に関連する訴訟または他の訴訟関連費用;Arikayceまたは会社の候補製品に関連する合意が、PariおよびアスリーカンABとのライセンス契約、および会社がこのような合意規定を遵守できない義務を含む、会社に適用される制限または他のbr義務;会社が当事者になる可能性のある訴訟によるコストと潜在的な名声損害、製品責任クレームを含む;会社の運営がネットワークセキュリティ攻撃または問題が発生したときに重大な妨害を受けるリスク;会社の企業資源計画システムのアップグレードに関連する業務中断または費用;会社の国際経営における限られた経験;会社の業務に適用される法律法規の変化、任意の価格改革、およびこのような法律法規を遵守できなかった;会社の運営損失の歴史, 会社は決して収益性を達成または維持できない可能性がある;営業権減価費用は会社の経営業績および財務状況に影響する;会社の既存の債務を返済できないこと、および会社が将来の資本を獲得する能力に関する不確実性、および適切な監督管理機関によって承認された追加の第三者製造施設の計画の実行を遅延させ、これらの計画に関連する意外な費用を遅延させる。会社は実際に会社の展望性陳述が表明した結果、計画、意図或いは期待を実現できないかもしれない。展望性陳述は本質的にリスクと不確定要素に関連するので、それらは事件と関係があり、未来に発生する可能性があるか不可能な状況に依存するからである。会社の業務に影響を及ぼす可能性のあるリスクおよび不確定要因に関するより多くの情報は、会社が2022年12月31日までの年間10-K表(Br)報告書および会社がその後米国証券取引委員会(米国証券取引委員会)に提出した任意の文書における“リスク要因”第1 A項“リスク要因”で議論されている要因を参照されたい。当社は読者にこのような前向きな陳述に過度に依存しないように注意しており、これらの陳述は本プレゼンテーションの発表日にのみ発表されます。法律および米国証券取引委員会規則が特に要求することに加えて、会社は、予想またはイベント、条件、または環境の任意の変化を反映するために、または実際の結果および前向き陳述に記載されている変化に影響を与える可能性があるために、そのような陳述を公開または修正する義務を負わない。前向きに陳述する

2023年上半期Aspen登録完了(1 Q)筋骨格臨床前データ(2 Q)CNS臨床前データ(2 Q)第1筋骨格IND(2 Q)2 H 2023 CRSsNP第2段階試験開始(2023年中)TOLINE結果(3 Q)TPIP仮用量滴定安全性と耐性レベル登録完了(YE)1 H
2024 PH-ILD TOPLINE結果(Aspen TOPLINE結果(2 Q)Insmedは、私たちの4つのカラムのそれぞれから変革性の臨床データを得ており、一流や一流を表す治療を意味する
Arikayce Brusocatib TPIP早期研究

成人患者のスクリーニングはすでに未来のマイルストーンの登録が完了し、Br}Toplinesの結果は24年第2四半期に完成する

保存日国際研究日日:2023年5月8日場所:ニューヨーク市とbr}仮想時間:東部時間午前8時

世界をリードする能力を打ち出して、私たちの次の成長の章を支持します

提出されたすべての8つの要約は、Arikayce有害事象緩和:実世界背景下のBrusocatib Willow研究:疾病の重症度別に分けて分析し、5月19日から24日までの提出を受け入れた

Brusocatib:鼻ポリープの潜在力のないCRSの第二段階研究
初発疾患治療~全世界400 K 1,2,3,4アドレス指定可能な患者(重症人群)約7000万アメリカCRSsNP 1患者を開始したが、多くの人はコルチコステロイド及び/或いは内視鏡副鼻腔手術(ESS)に対して最初に最も深刻な再発と潜在手術患者に対して反応しなかった。慢性副鼻腔炎無鼻ポリープJアレルギー反応性Clin免疫実践。2016;4(4):575-582。DOI:10.1016/j.jaip.2016.04.015;2 Benjamin et。Al、鼻ポリープのない慢性副鼻腔炎患者の臨床特徴学術環境下で、JアレルギーCLIN免疫実践巻7、第3期、2019年3月;3アメリカ患者レベル声明データ分析(Komodo Health)に限られ、患者病歴中にDxコードのない積極的なCRS患者の割合;ヨーロッパ5と日本に外挿;4患者レベル声明データ分析US(Komodo Health)のみ、能動的治療のCRSNP患者がESSを有する割合;ヨーロッパ5と日本Brusocatib 40 mg qdプラセボqdスクリーニングベースラインEOT(初歩分析)Brusocatib 10 mg qd 4週間治療コース24週間EOS R中止後に毎日副鼻腔主要終点総積分(STSS)約270名の患者1:1:1-2023年中にフォローアップした
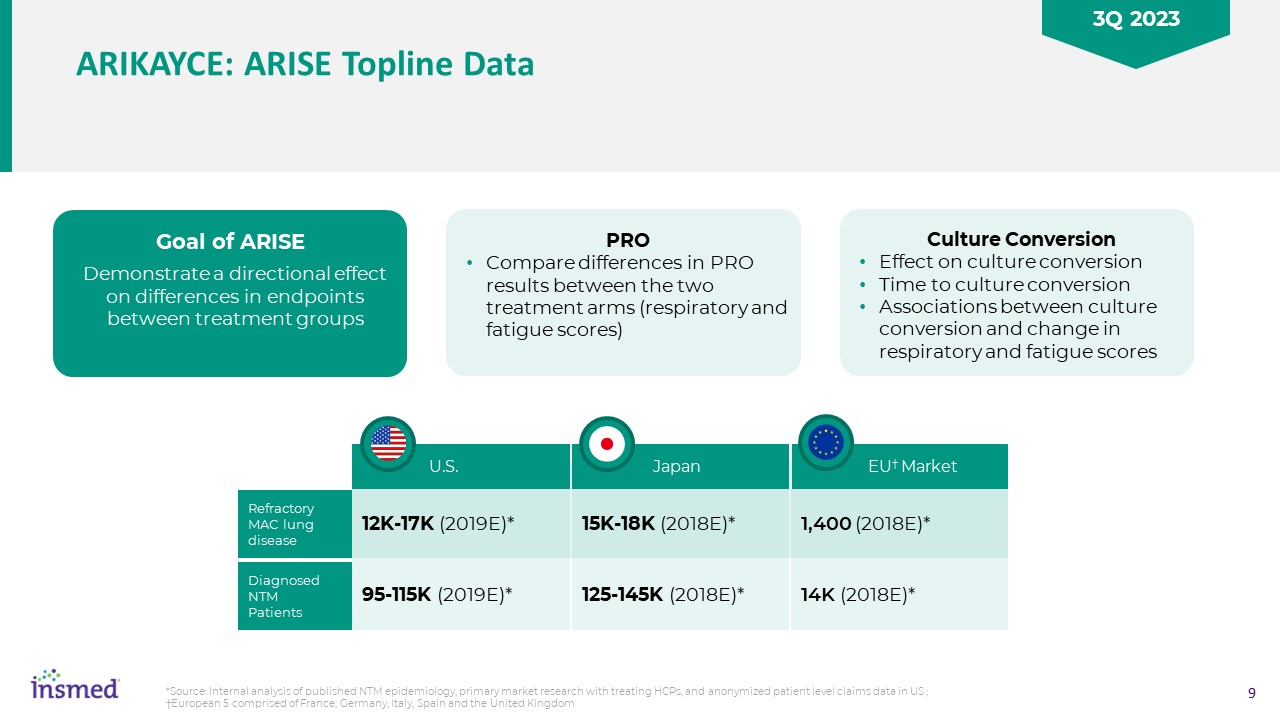
Arikayce:Rise ToplineデータPROは2つの治療群間のPRO結果の差異(呼吸と疲労採点)の目標を比較し、治療群間の終点差異に対する方向性影響培養転換が培養転換時間に与える影響
培養転換と呼吸と疲労採点変化との間の転換関連を示した*ソース:すでに発表されたNTM疫学の内部分析、HCP治療の一次市場研究、及び匿名のアメリカ患者レベルクレームデータ;ヨーロッパ5フランス、ドイツ、イタリア、スペインとイギリスからなる12 K-17 K(2019 E)*95-115 K(2019 E)*米国難治性MAC肺疾患診断NTMP患者15 K-18 K(2018 E)*125-145 K(2018 E)*日本1,400(2018 E)*14 K
(2018 E)*EU市場2023年第3四半期
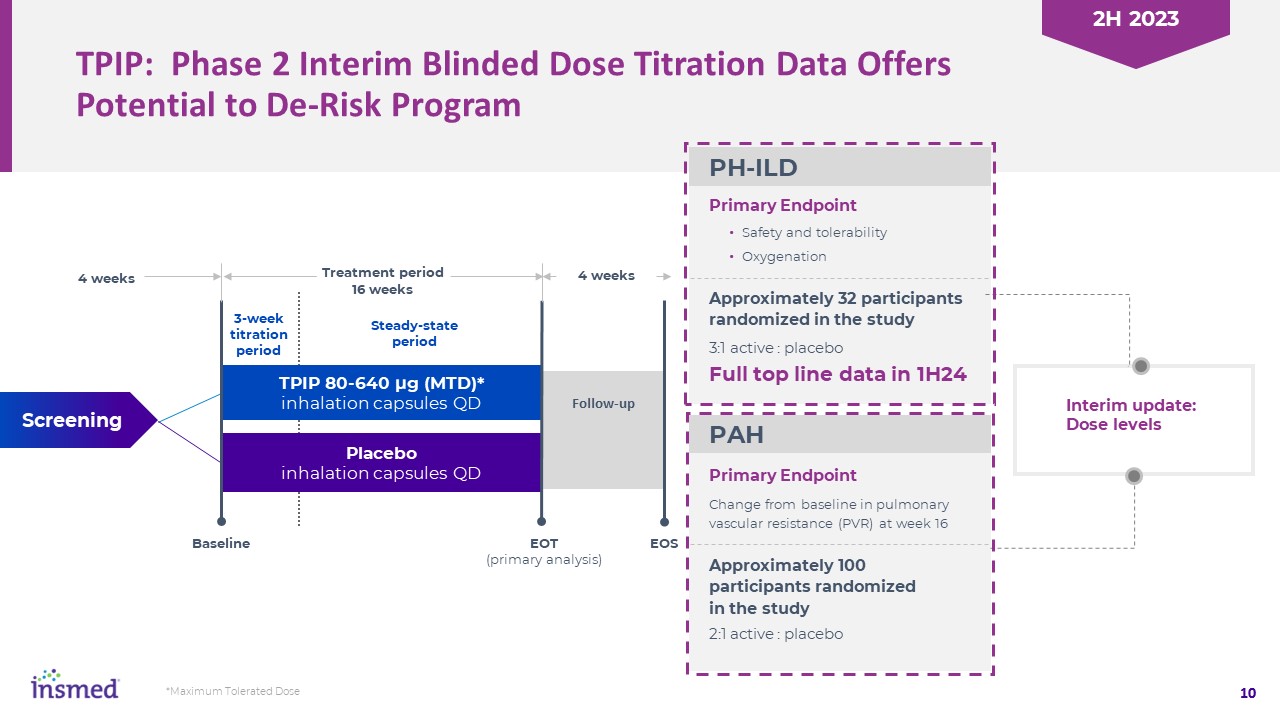
TPIP:第二段階仮盲法用量滴定データはリスクを下げる可能性を提供した
計画の主要な終点10 3:1有効:プラセボ安全性と耐性酸素化研究中に約32名の参加者をランダムに選択し、研究16週目に肺血管抵抗(PVR)の変化は主に
終点約100名の参加者が研究中にランダムに2:1積極:プラセボ1週間以内の完全なトップラインデータTP IP 80-640マイクログラム(MTD)*吸入カプセルQDプラセボ吸入治療期16週ベースラインEOT(初歩的分析)EOS 4週間安定期3週間フォローアップ定期中期更新:用量レベルPH-ILD PAH*最大耐容量2023
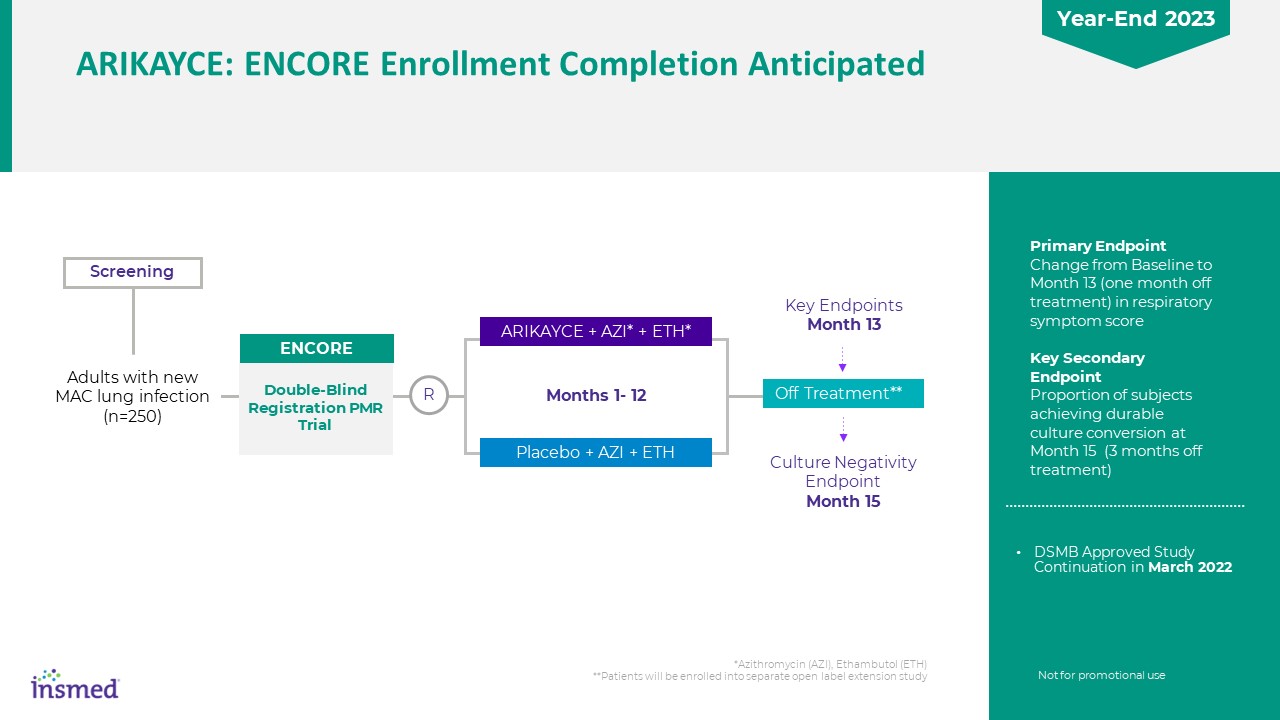
*アジスロマイシン(Azi)、エタンブトール(ETH)**患者は、ベースラインから13ヶ月目(治療停止1ヶ月)の個別の開放ラベル拡張研究の主な終点に組み込まれ、15ヶ月目(治療停止3ヶ月)に持続的培養変換を達成した被験者の割合は、15ヶ月目のスクリーニングキー終点13ヶ月目の培養陰性終点15 Arikayce+Azi*+ETH*プラセボ+Azi+ETH 1~12ヶ月で新しいMAC肺感染を有する成人(n=250)で治療を停止する**ダブル視覚障害者登録PMR試験Encore R非販売促進用途DSMBの承認2022年3月にArikayceの研究継続:Encore登録は2023年末に完了する予定です
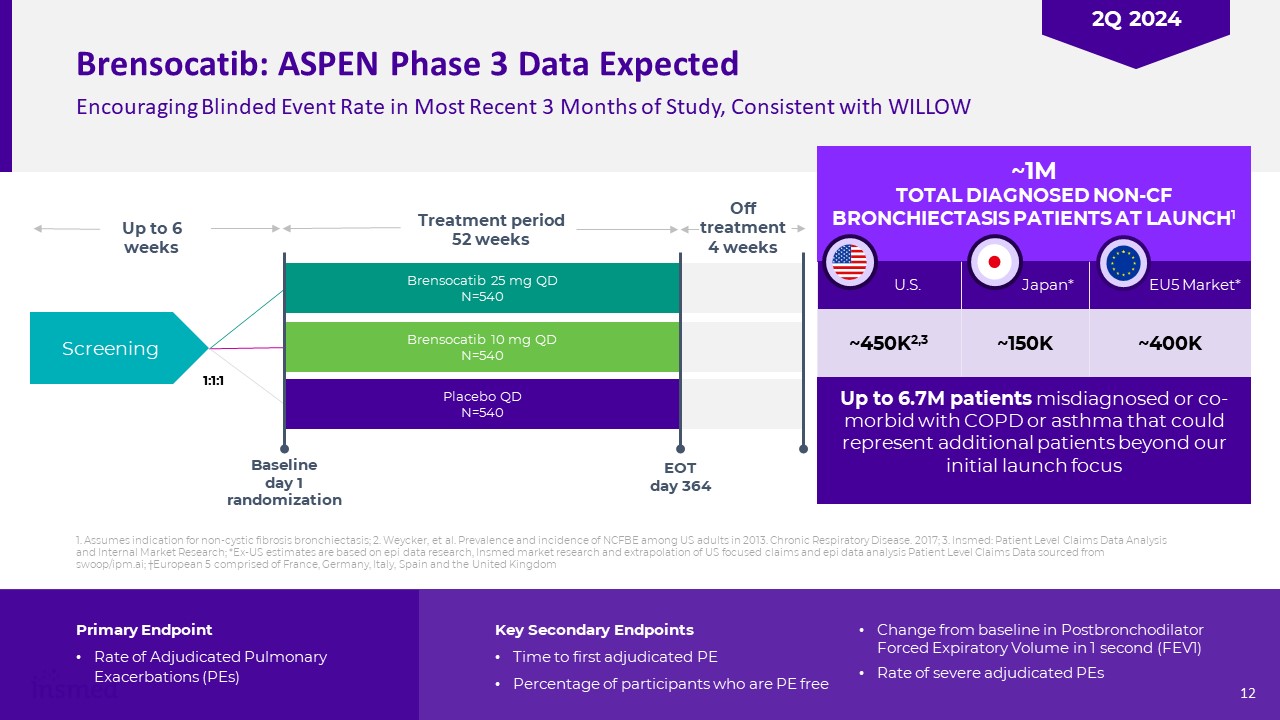
Brusocatib:最近3ヶ月の研究ではAspenステージ3データは心強い失明イベントの発生率が予想されていますLAUNCH 1~450 K 2,3アメリカ~150 K日本*~400 K EU 5市場*670万名の誤診或いはCOPD或いは喘息を合併した患者
は著者らが最初に発売した焦点Brusocatib 25 mg qd N=540 Brensocatib 10 mg qd N=540スクリーニング治療期間52週ベースライン1日目にランダムEOT 364から6週1:1:1治療を中止した4週間後、新規患者を代表した。肝心な副次的終点がPEを初めて判定した時間は、気管支拡張剤後1秒に力呼気容量(FEV 1)がベースラインよりPEの自由変化を有する参加者の割合(FEV 1)よりもPEの割合を強く判定する1。非嚢胞性線維性気管支拡張症の適応と仮定する。2.Weyckerら。2013年の米国成人におけるNCFBEの罹患率と発症率。慢性呼吸器疾患です。2017年;3.Insmed:患者レベルクレームデータ分析と内部市場研究;*アメリカ以外の推定はEPIデータ研究、Insmed市場研究及びアメリカ重点クレームとEPIデータ分析の外挿
患者レベルクレームデータはswoop/ipm.aiから来た;ヨーロッパ5はフランス、ドイツ、イタリア、スペインとイギリスの12 2 Q 2024から構成されている
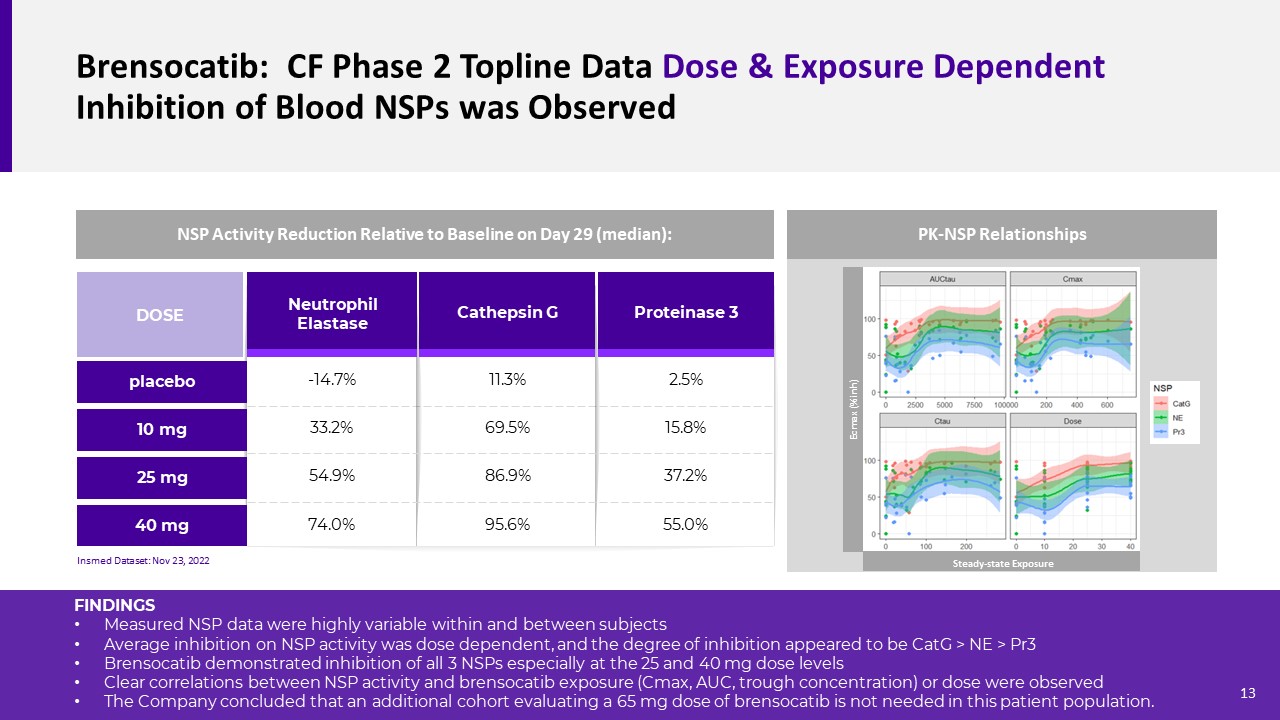
Brusocatib:CFステージ2 TOPLINEデータに観察されたカテプシンGタンパク質3好中球エラスターゼ10 mg 25 mg用量40 mgプラセボ-14.7%33.2%54.9%74.0%11.3%69.5%86.9%95.6%2.5%15.8%37.2%55.0%NSP活性は29日にベースラインと比較して29日間低下した
29日(中央値):Insmedデータセット:11月23日2022年のPK-NSP関係の結果測定されたNSPデータは、対象内と対象との間で高度に可変であり、NSP活性の平均阻害は用量依存性であり、阻害の程度は、CATG>NE>PR 3であるようである。Brusocatibは、すべての3種類のNSPの阻害を示し、特に25および40 mg用量レベルである。NSP活性とBrensocatib曝露(Cmax、AUC、谷濃度)または用量との間に有意な相関が認められた。br社は、患者集団において65 mg用量のBrensocatibを追加的に評価する必要はないと結論した。Ecmax(%inh)定常状態暴露13
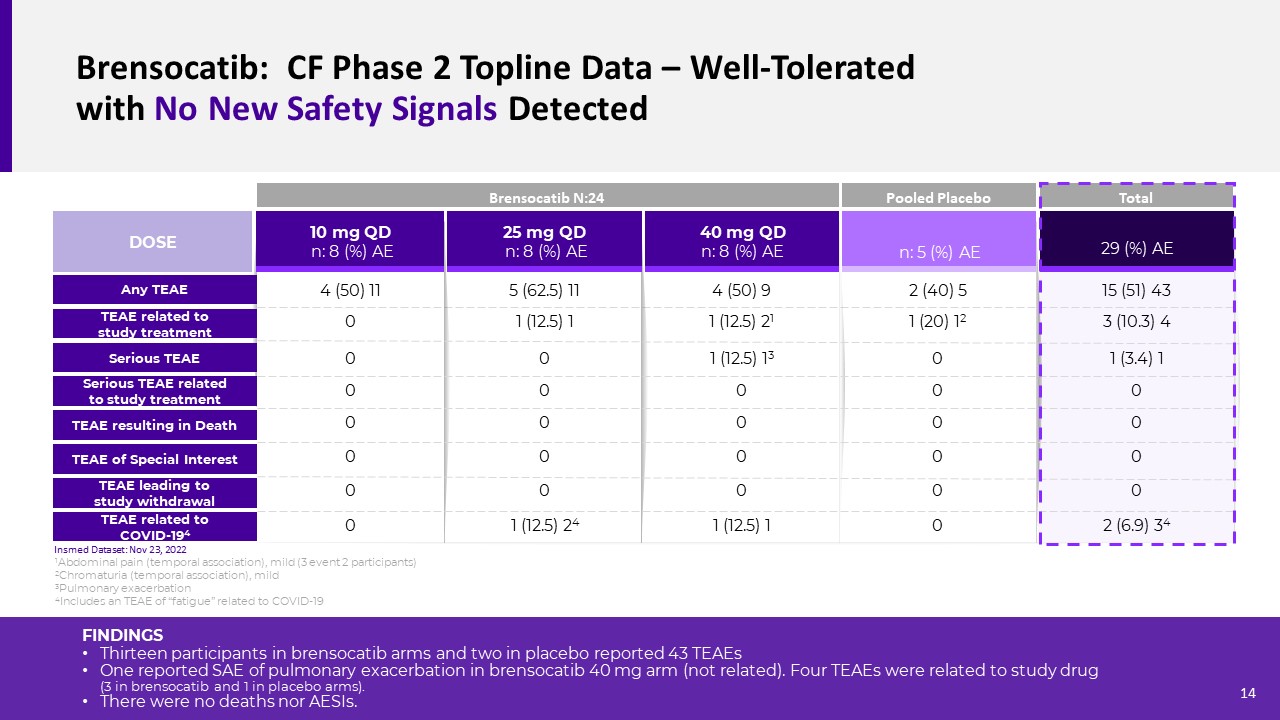
Brusocatib:cf第2段階トポロジー線データ−新たな安全信号のない良好な耐性
検出結果13名Brusocatib群と2名のプラセボ群の参加者は43個のTEAEを報告し,そのうちの1つはBrusocatib 40 mg群の肺増悪SAEを報告した(無関係)。TEAEsが研究薬に関与していたのは4例であった(ブレンキセチン服用3例,プラセボ1例)。死亡例もなく,AESIs症例もなかった。25 mg QD n:8(%)AE 40 mg QD n:8(%)AE 10 mg QD n:8(%)AE TEAEと研究治療関連重症TEAE用量重症TEAEと研究治療関連任意のTEAE n:5(%)
AE 29(%)AE 4(50)9 1(12.5)21 1(12.5)13 0 Bensocatib N:24 COVID-194 TEAEに関連する混合プラセボ総TEAEはCOVID-194 TEA Eに関連死0 1(12.5)1TEAEによる研究中止5(62.5)11 1(12.5)1 00 00 01(12.5)24 4(50)11 00 00 02(40)51(20)12 00 00 15(51)43 3(10.3)4 1(3.4)1 00 02(6.9)34 1腹痛(一過性連想),軽度(3事象2参加者)2色尿(一過性関連),軽度3肺増悪4新冠肺炎に関するTEAE“疲労”14 Insmedデータセット:2022年11月23日
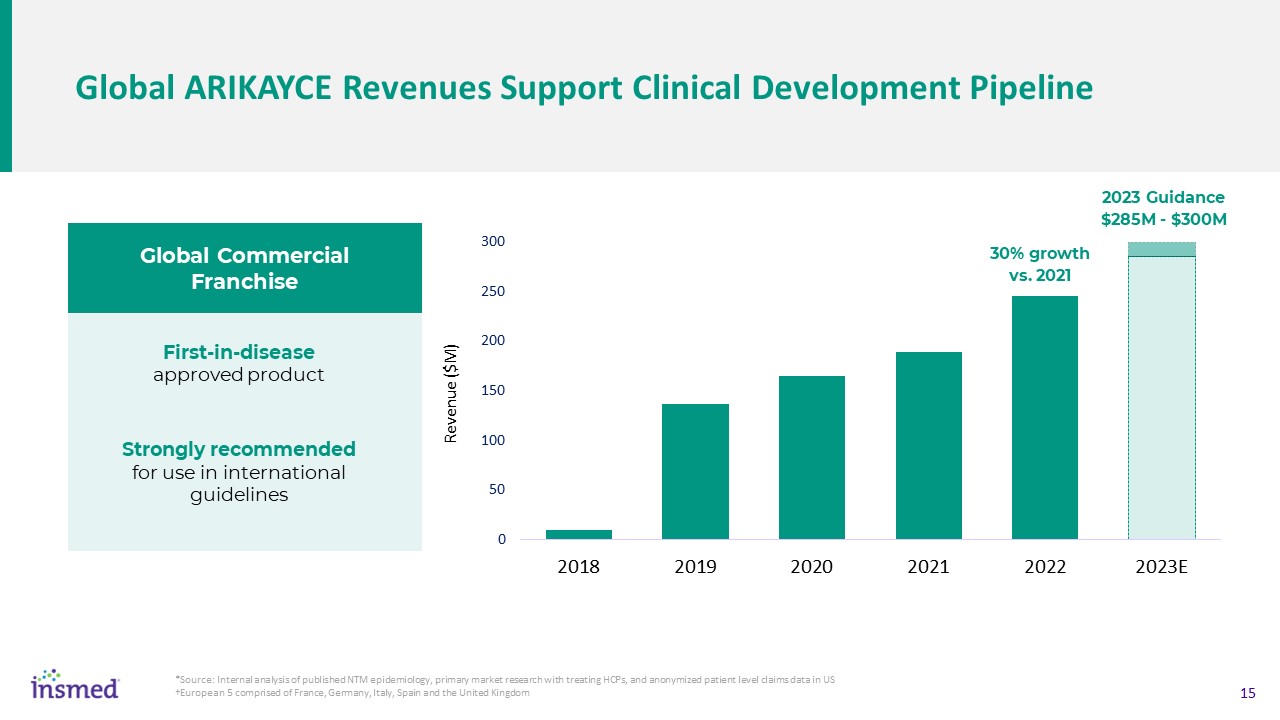
全世界のArikayce収入支持臨床開発ルート*ソース:すでに発表された非伝染性気管支炎疫学分析、HCPを治療する一次市場研究と匿名患者レベルのクレームデータの内部
アメリカヨーロッパ5フランス、ドイツ、イタリア、スペインとイギリスが初めて承認した製品br}国際ガイドライン2023年の全世界商業特許経営ガイドラインは2021年に比べて2.85億-3億ドル30%増加することを強く提案した

2025年までに持続可能な成長ビジネスを確立する1 2 3 4 Arikayce Brusocatib TPIP*難治性MAC前線MAClung疾患の早期研究次世代製造追加技術段階3支出の80%無鼻ポリープ(CRSsNP)嚢胞性線維性化膿性鼻炎(HS)アメリカ、日本、EU市場ヨーロッパ5フランス、ドイツ、イタリア、スペインとイギリス*Treprostinil Palmil吸入粉16

Arikayce商業特許経営権の信頼できる収入源2012年12月31日までの現金状況は、今後18ヶ月のすべての変曲点2022年収入が2021年度より30%増加する全世界収入-2.454億ドル-1.86億ドルJP-5650万EU+ROW-290万ドル2023年資本分配>中後期パイプラインと商業プロジェクト予想支出の80%

著者らの戦略重点実行に基づいて、著者らの信頼できる収入流を利用して同時に資本生産TOPLINE臨床データ読み取り値を慎重に配置し、最近と長期に商業準備活動を推進し、顕著に多くの深刻かつ稀な疾病制御支出の患者にサービスを提供する。最適なリターンをサポートするための慎重な展開資本の機会優先事項2023年の収入予想2.85億ドル~3億ドル>80%の支出は、中後期計画指導臨床マイルストーン今後18ヶ月1 H 2023 Aspen
登録完了(1 Q)筋骨格臨床前データ(2 Q)CNS臨床前データ(2 Q)第一筋骨格IND 2 H 2023 CRSNP段階2試験開始(2023年中)背線結果(3 Q)TPIP中期用量滴定安全性と耐性レベルを生成する登録完了(YE)第1回CNS IND(2023年末/2024年初め)2024年上半期PH-ILD TOPLINE結果筋骨格臨床データAspen TOPLINE結果(2 Q)