
ARV-471:2期VERITAC試験結果サンアントニオ乳癌シンポジウム,2022年12月8日

安全港と展望性陳述2本陳述は1995年の“個人証券訴訟改革法”の定義に符合する展望性陳述を含み、重大なリスクと不確定性に関連し、ARV-471が1種の同類の最適なエストロゲン受容体標的療法になる可能性に関する陳述、及び著者らのARV-471の未来の試験の時間を含み、任意の組み合わせ研究を含む。“予想”、“信じる”、“推定”、“予想”、“予定”、“可能”、“可能”、“計画”、“予測”、“プロジェクト”、“目標”、“潜在”、“将”、“可能”、“可能”、“べき”、“継続”および同様の表現は、これらの識別語を含むわけではないが、前向き表現を識別することを意図している。私たちは私たちの展望声明で開示された計画、意図、または予想を実際に達成できないかもしれません。あなたは私たちの展望的声明に過度に依存してはいけません。様々なリスクと不確実性要因のため、実際の結果や事件は、展望性声明で開示された計画、意図、および予想と実質的に異なる可能性があるが、これらのリスクおよび不確実性は、私たちとファイザーが予想されるスケジュール内でARV-471の臨床開発に成功し、臨床試験結果を得ることができるかどうか、あるいは全くできないこと、および他の重要な要素を含むが、これらの要素は、私たちの実際の結果が展望性声明で述べられた結果と大きく異なる可能性があり、これらの内容は、米国証券取引委員会の四半期および年度報告に提出された“リスク要因”の部分で議論されている。本プレゼンテーションに含まれる前向きな陳述は,本プレゼンテーションの発表日までの未来の出来事に対する我々の現在の見方を反映している, 法的要求を適用することを除いて、私たちはどんな前向きな陳述を更新する義務も負わない。このような展望的な陳述は、この陳述の日の後の私たちのいかなる日を代表する観点とみなされてはならない。Arvinasの名前と標識は私たちの商標だ。PROTACのサービス商標と登録アメリカ商標も持っています。本プレゼンテーションに登場する商標,商号,サービスマークは,それぞれの所有者の財産である.私たちは、本プレゼンテーションで命名された商標に適用される名称を省略する。本プレゼンテーションには、独立した当事者と市場規模に関する私たちの推定および他の統計データ、および私たちの業界に関する他のデータも含まれています。このようなデータは多くの仮定と制限を関連しており、このようなデータと推定を過度に重視しないことを想起させる。また、私たちの未来表現の予測、仮説と見積もり、そして私たちが経営する市場の未来表現は、必然的に高度な不確実性とリスクの影響を受ける。本プレゼンテーションでは,投資家グループのみを対象とした.これは、本明細書で言及した製品を普及させるため、または他の方法で医療処方決定に影響を与えるためではない。交差実験比較は対面による研究ではなく,直接比較することもできない.

3概要
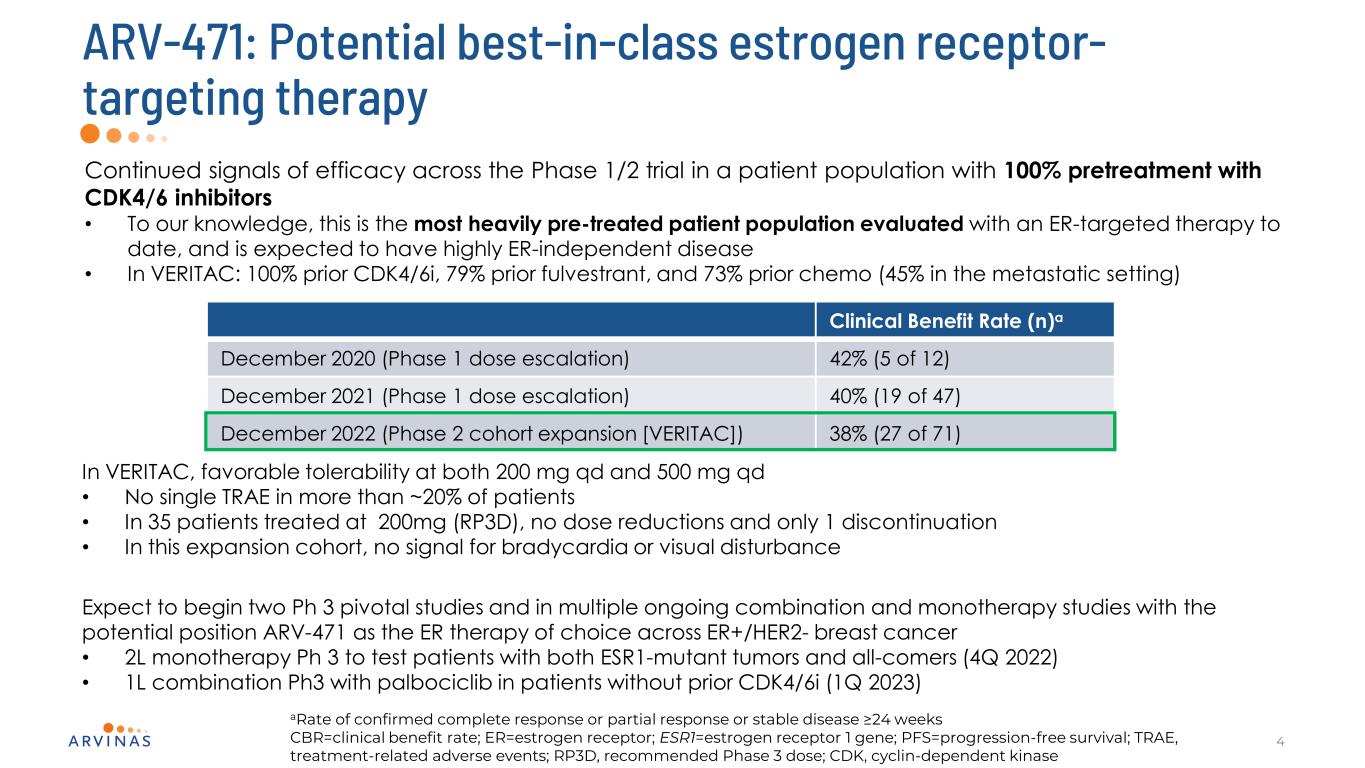
ARV−471:潜在的な同種最適エストロゲン受容体標的治療4 1/2期試験で持続的に有効なシグナルは,CDK 4/6阻害剤を用いた100%前治療患者集団における·我々の知る限り,これまでER標的治療評価を受けてきた最も深刻な前治療患者集団であり,高度ER非依存性疾患·VERITAC:100%前のCDK 4/6 i,79%前のfulvestrantが予想される。臨床受益率(N)2020年12月(第1段階用量増加)42%(5/12)2021年12月(第1段階投与量増加)40%(47/19)2022年12月(第2段階コホート拡大)[VERITAC])VERITACでは38%(27/71),200 mg/dおよび500 mg/dとも良好な耐性を示した·20%を超える患者では単一TRAEがなかった·この拡大行列で200 mg(RP 3 D)治療した35例中,用量減少はなく1例のみ中止した。徐脈や視覚障害のないシグナルは、ESR 1変異腫瘍とすべての患者を同時に有する患者(2022年4月)·1 LとPalbociclibとの併用Ph 3がCDK 4/6 i(2023年1月)のない患者で完全応答または部分応答または安定疾患を確認する比率24週CBR=臨床受益率をテストするためのPh 3キー研究と複数の共同治療研究が開始される予定である。ER=エストロゲン受容体;ESR 1=エストロゲン受容体1遺伝子;PFS=無進行生存期間;TRAE、治療に関連する有害事象;RP 3 D、推奨される3期用量;CDK、細胞周期蛋白依存性キナーゼ

ARV-471:ER+/HER 2-乳癌治療の内分泌バックボーン選択5潜在的な未来のアメリカER+/HER 2-乳癌治療例とARV-471アジュバント(手術後)乳癌(~160 K)*転移性乳癌(~50 K*)第二/第三線内分泌主幹アロマターゼ阻害剤(AI)Fulvestrantあるいはイシメタン付加療法CDK 4/6と他の標的阻害剤mTOR阻害剤あるいはPIK 3阻害剤Fulvestrant*SEERデータベースからのアメリカ人口毎年イベントCD K:細胞周期蛋白依存性キナーゼ、PI 3 K:リン酸イノシトール3-キナーゼ;MTOR:ラパマイシンの哺乳動物標的ARV-471拡張潜在力未来状態:ARV-471は経口、高効率のER分解剤として設計され、最近良好な安全性を持っている

SERDSまたはARV 471を有する研究は、一連の以前の治療法を含み、重要な研究において、VERITACは、ほとんどの以前の治療法Paloma-31期3研究Palbociclib+fulvestrantとプラセボ+fulvestrant(N=521)0 34%オスミウムacelERA 2段階2研究巨大消毒剤とSOC(N=303)42%*19%*32%SERENA-23両親誘導剤とFulvestrant(N=2 4 0)50%0 19%Ameera-32期オスミウム(N=2 90)79*、VI 10%*、11%VERONICA 4フルビストとフルビスターの併用11%VERONICA 4期研究(N=103)100%0 EMERALD 5 ELEACESTANT VS SOC≡(N=477)100%30%22%VERITAC 2期拡張行列の抗レトロウイルス-471(N=71)100%79%45%1 Lancet Onol 2016。2022年ESMO。3 2022年サンアントニオ乳癌シンポジウム。4臨床癌研究2022年.5 J臨床癌2022年。*高度/移行設定。フルオレン医師のフルビストまたはアロマターゼ阻害剤の選択;タモキシフェンはAMEERA-3においても許可されている。SOC=標準看護師が発表したデータは、総人口6期待薬剤耐性期待効果を手動で計算した

7 ARV-471:VERITAC第2段階の詳細
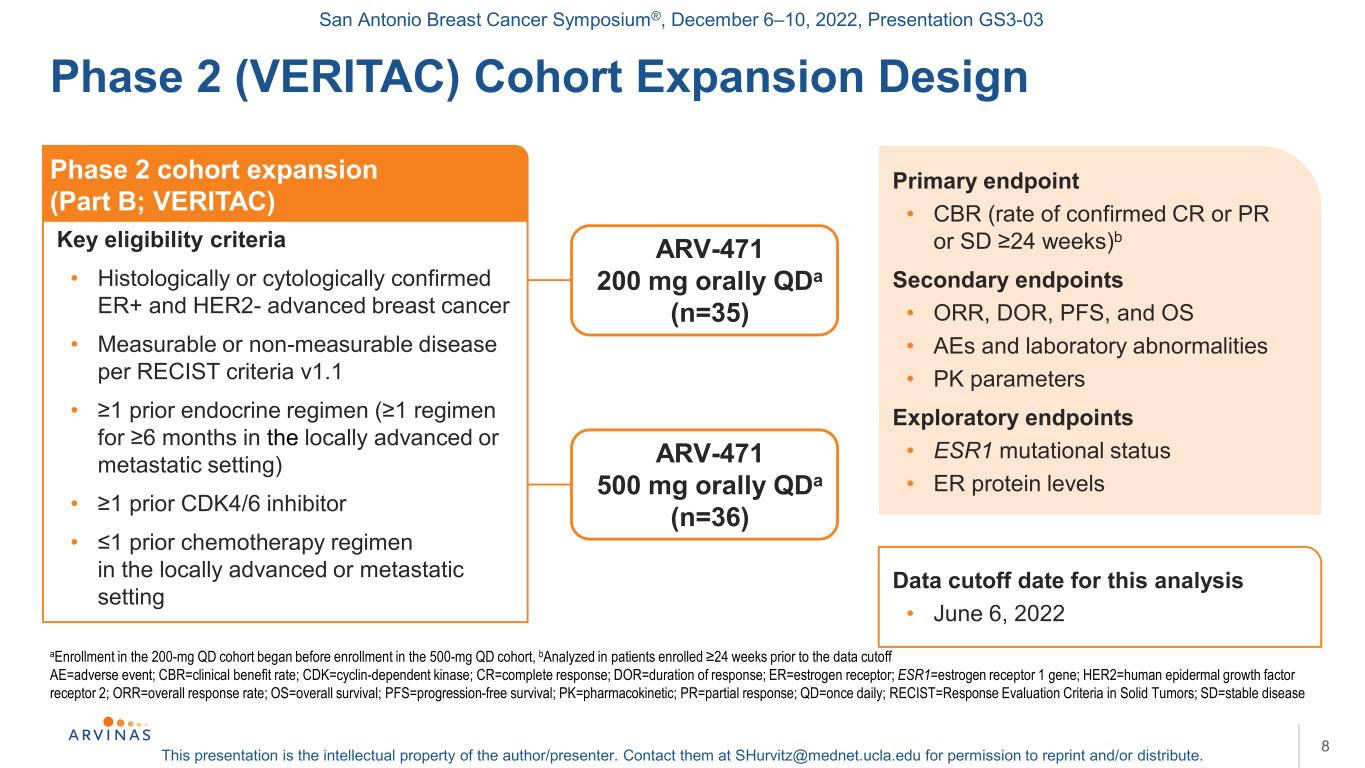
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。8 a 200 mgQDキュー中の登録は500 mgQDキューに格納する前に開始し、bはデータ締め切り24週間前に入選した患者において分析を行った:AE=有害事象;CBR=臨床受益率;CDK=細胞周期依存性キナーゼ;CR=完全応答;DOR=応答持続時間;ER=エストロゲン受容体;ESR 1=エストロゲン受容体1遺伝子;HER 2=ヒト表皮成長因子受容体2;OOR=総応答率;OS=総生存率;PFS=無進行生存率;PK=薬物動態;PR=部分応答;QD=1日1回;RECIST=実体腫瘍の治療効果評価基準;SD=安定期疾患2期(RAC)待ち行列設計拡大2期行列拡大(一部B;VERITAC)キー資格基準·組織学的または細胞学的に確認されたER+およびHER 2−進行乳癌·RECIST標準に従って測定可能または測定不可能な疾患v 1.1·1前の内分泌レジメン(局所進行または転移の場合、1レジメンは6カ月)·1前のCDK 4/6阻害剤·1前の化学療法レジメンの局所末期または転移の場合の主要終点·CBR(CRまたはPRまたはSD 24週の確定診断比率)b副次的終点·OOR、DOR、PFS、PFS、OS·AEsと実験室異常·PKパラメータ探索終点·ESR 1変異状態·ER蛋白レベルARV−471 200 mg経口QDA(n=35)ARV−471 500 mg経口QDA(n=36)今回分析したデータ締め切り·2022年6月6日
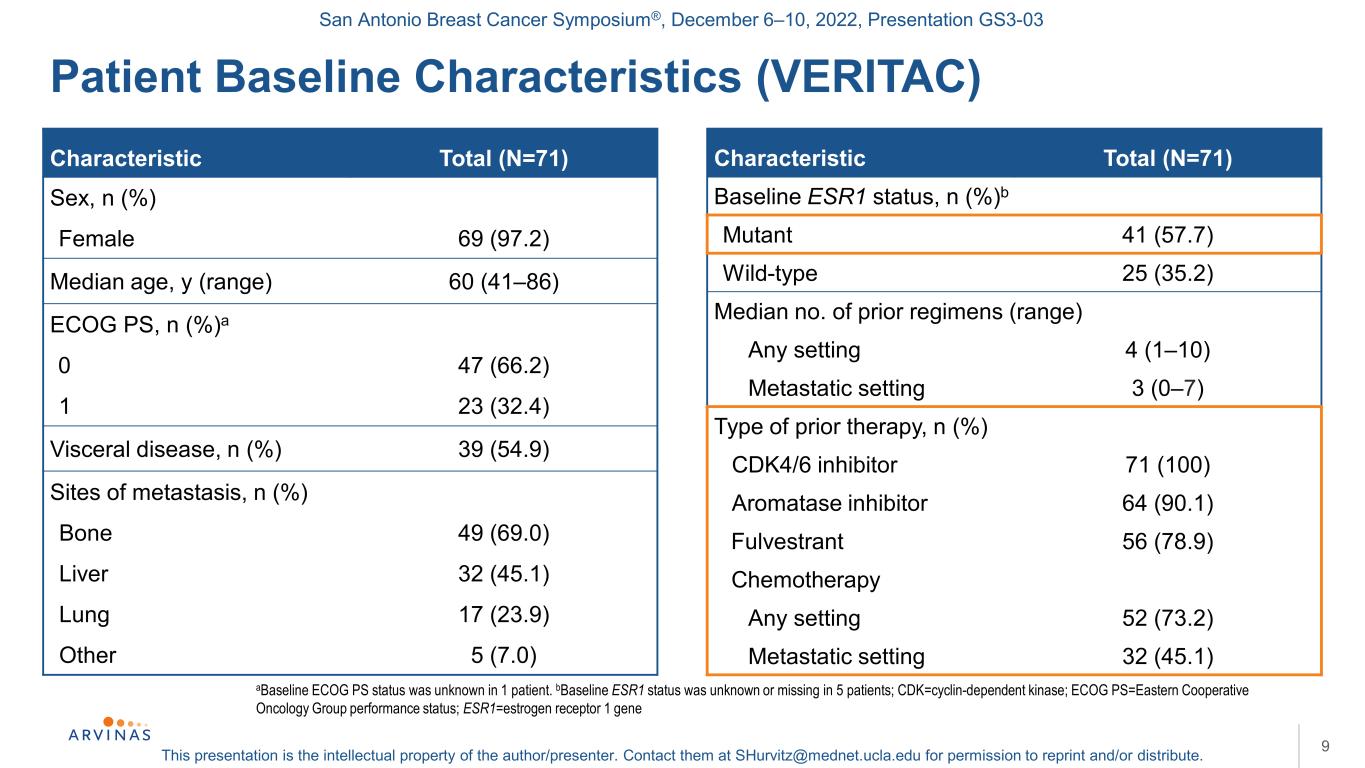
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。患者ベースライン特徴(VERITAC)9 aベースラインECOG PS状態未知1例。BベースラインESR 1状態未知或いは欠損5例;CDK=細胞周期蛋白依存キナーゼ;ECOG PS=東部協力腫瘍群表現状態;ESR 1=エストロゲン受容体1遺伝子特徴総数(N=71)性別、n(%)女性69(97.2)中位年齢、y(範囲)60(41-86)ECOG PS、n(%)a 0 47(66.2)1 23(32.4)内臓疾患、n(%)39(54.9)転移部位、n(%)骨49(69.0)肝32(45.1)肺17(23.9)その他5(7.0)特徴総(N=71)ベースラインESR 1状態、N(%)b変異体41(57.7)野生型25(35.2)中央値前のレジメン(範囲)任意のケース4(1-10)転移ケース3(0-7)既往治療タイプn(%)CDK 4/6インヒビター71(100)アロマターゼインヒビター64(90.1)Fulvestrant 56(78.9)化学療法任意のケース52(73.2)転移ケース32(45.1)
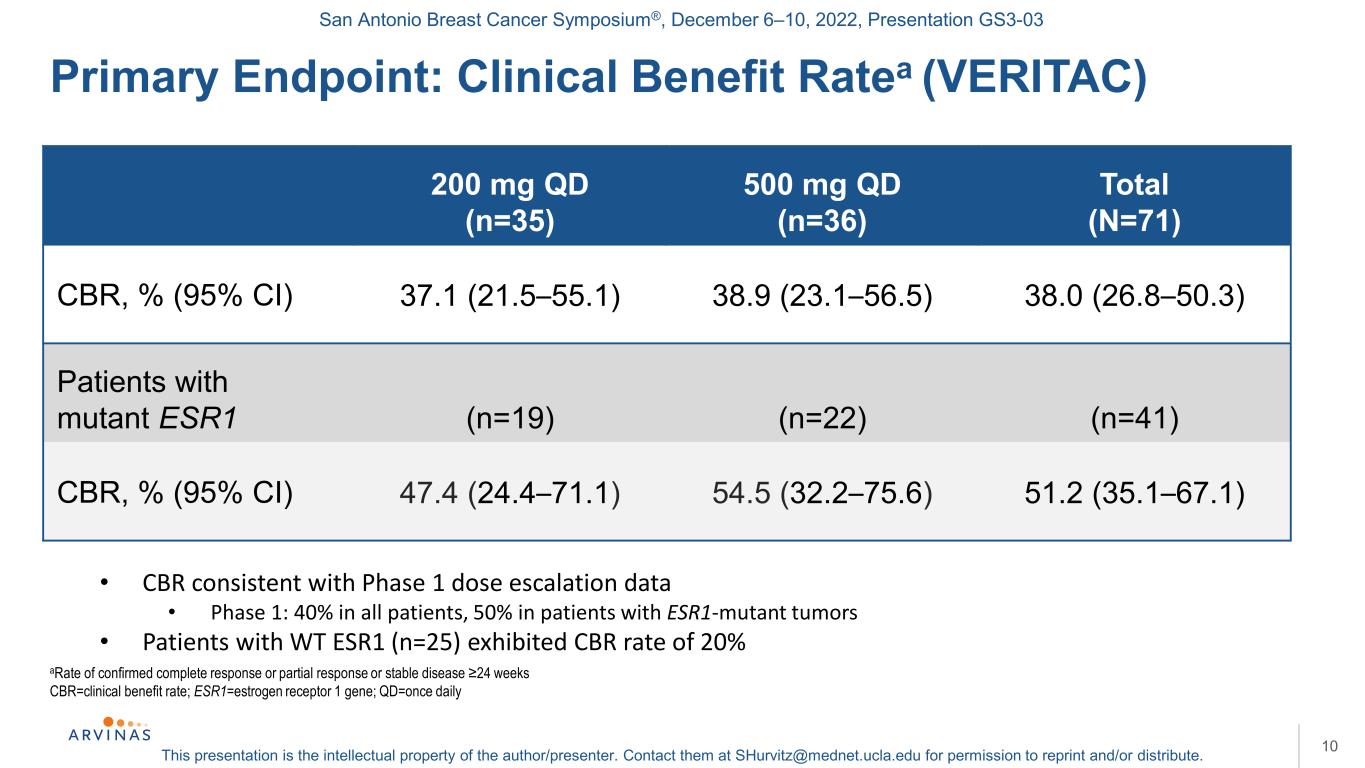
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。10完全寛解または部分寛解または病状安定と診断された比率24週CBR=臨床受益率;Qd=1日1回:臨床受益率(VERITAC)200 mg qd(n=35)500 mg qd(n=36)総CBR(N=71)CBR,%(95%CI)37.1(21.5-55.1)38.9(23.1-56.5)38.0(26.8-50.3)突然変異ESR 1患者(n=19)(n=22)(n=41)CBR、%(95%CI)47.4(24.4-71.1)54.5(32.2-75.6)51.2(35.1-67.1)·CBRは第1段階用量増加データと一致·第1段階:全患者40%、ESR 1変異腫瘍患者50%·WT ESR 1患者(n=25)CBR率20%
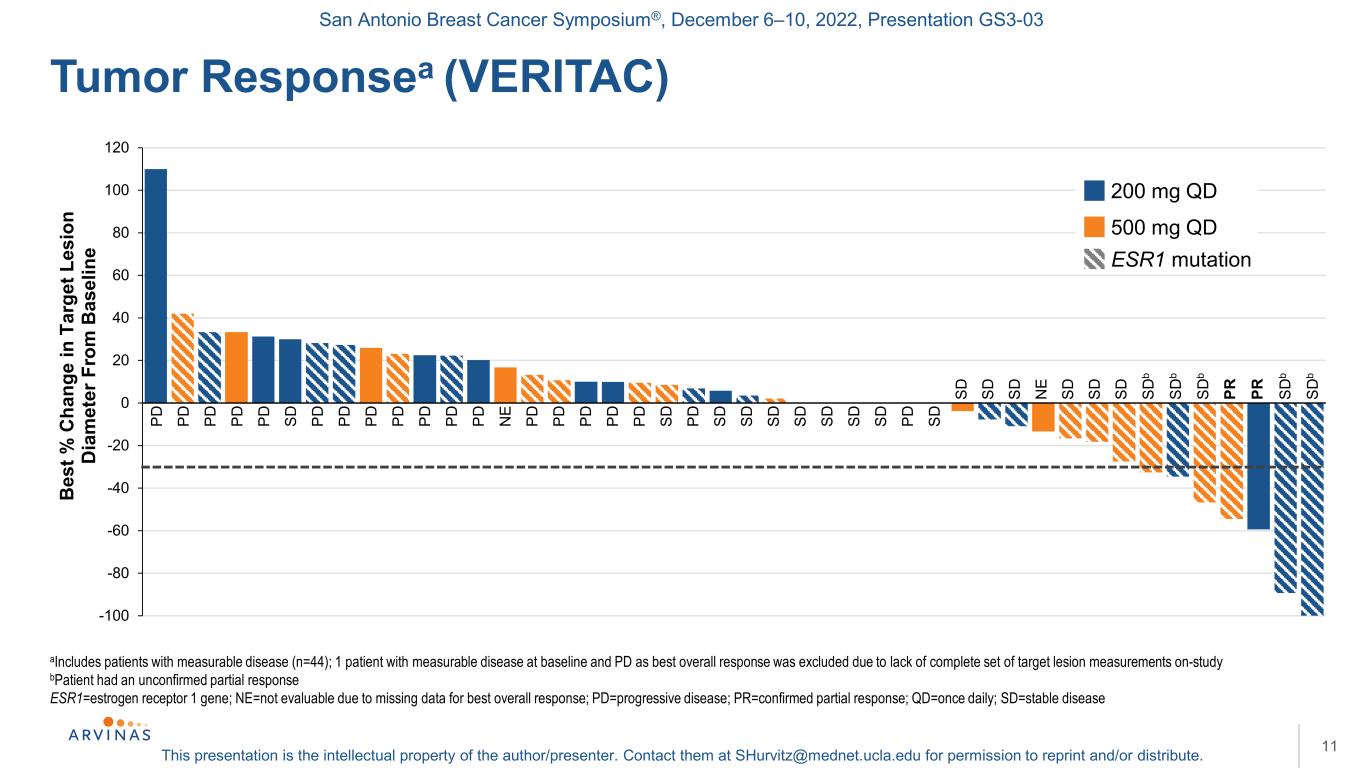
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。11 aは、測定可能な疾患を含む患者(n=44);ベースラインで測定可能な疾患およびPDが最適な全体的反応である1人の患者は、完全な標的病変測定のセットが乏しいために研究から除外された-b患者が未確認の部分反応ESR 1=エストロゲン受容体1遺伝子を有することを研究し、NE=最適な全体反応のデータが不足しているため評価できない;PD=進行性疾患;PR=確認された部分反応;QD=1日1回;SD=安定型疾患腫瘍反応(VERITAC)-100-80-60-40-20 20 40 60 80 100 120 BES%C HANGE E 200 mg QD 500 mg QD PD PDSD PDSD SDPD SD SDPD PD SD PD SD N E SD PR SD NE SD PR SD B PD SD b ESR 1変異
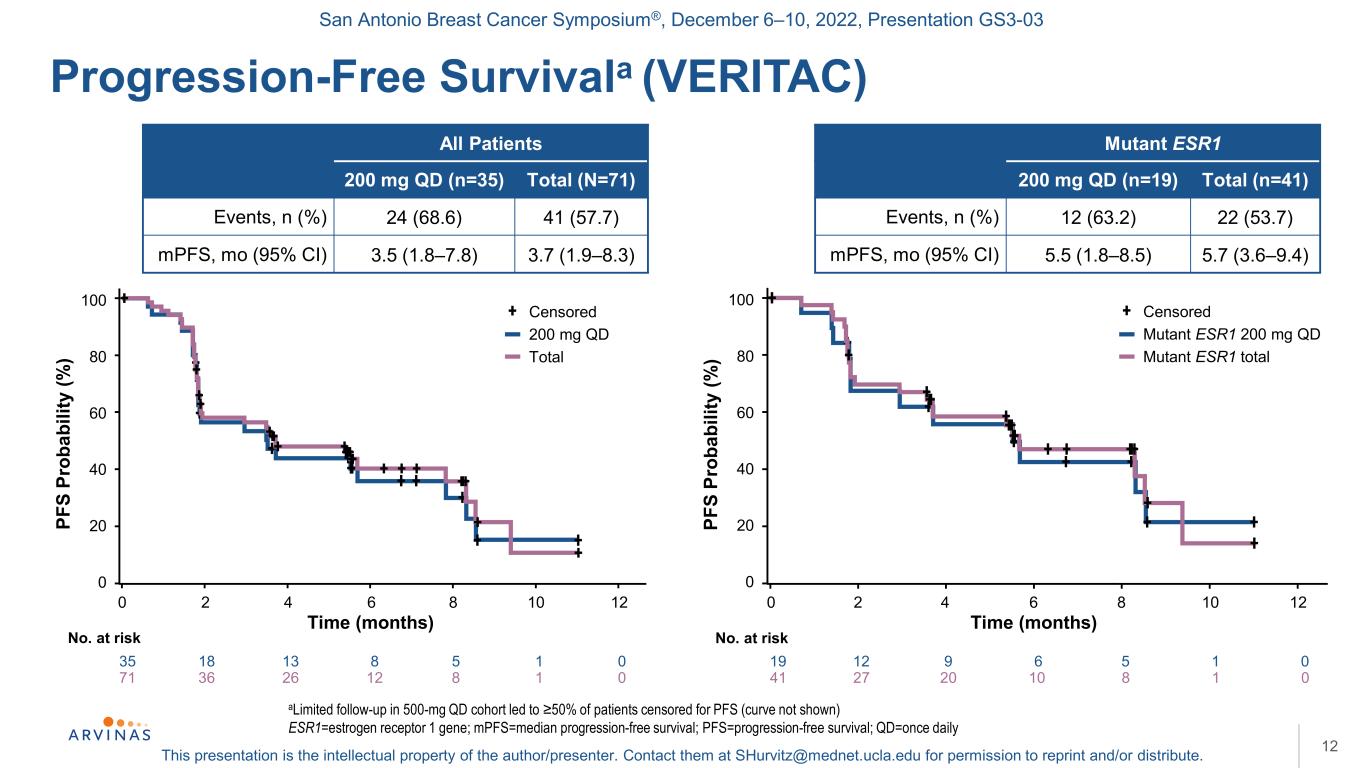
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。100 80 60 40 20 0無進行生存期間(VERITAC)12 500 mgQdキューで定義されたフォローアップにより、50%の患者がPFS(曲線では示されていない)ESR 1=エストロゲン受容体1遺伝子を検討された;MPFS=中央値無進行生存期間;PFS=無進行生存期間;Qd=1日1回すべての患者200 mg qd(n=35)合計(N=71)イベント,n(%)24(68.6)41(57.7)mpFS,mo(95%CI)3.5(1.8-7.8)3.7(1.9-8.3)変異型ES R 1 200 mg qd(n=19)合計(n=41)イベント,n(%)12(63.2)22(53.7)mpFS,モリブデン(95%CI)5.5(1.8-8.5)5.7(3.6-9.4)71 36 26 12 8 1 0 100 80 60 40 0 PF S PROAB(%)0 2 4 6 8 8 10 12回(月)Noリスク35 18 13 8 5 10合計200 mg qd変異体ESR 1 200 mg qd変異体ESR 1総Pf S pr abilty(%)0 2 4 6 8 10 12時間(月)No.リスク41 27 20 10 8 1 0 19 12 9 6 5 1 0
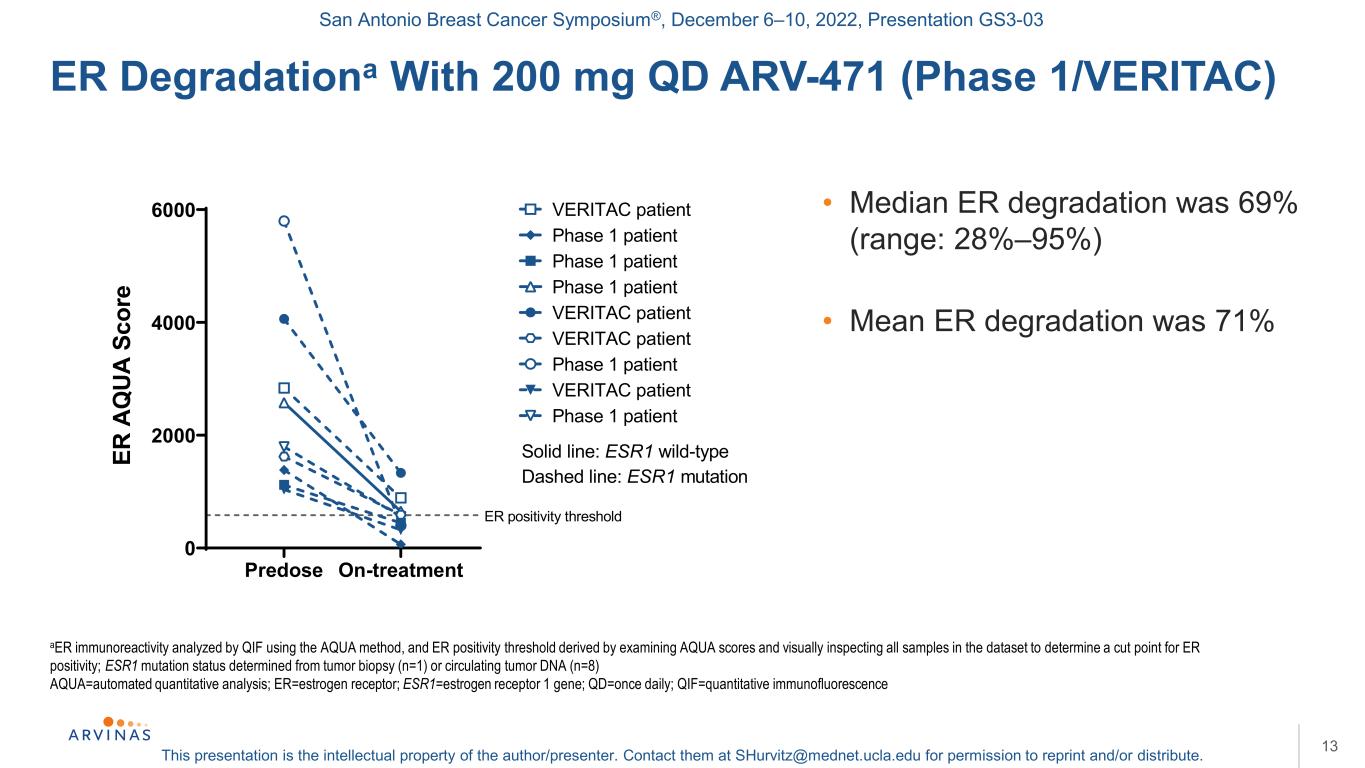
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。ER Degradationaは200 mgのQD ARV-471(1期/VERITAC)13 Aer免疫反応性をQIFを用いてAqua法を用いて分析し、ER陽性閾値はAquaスコアおよび肉眼検査データセットのすべてのサンプルを検査してER陽性の臨界点を決定することによって得られ、ESR 1変異状態は腫瘍生検(n=1)または循環腫瘍DNA(n=8)アクア=自動定量分析;ER=エストロゲン受容体;ESR 1=エストロゲン受容体1遺伝子;QD=1日1回;QIF=定量免疫蛍光·ER分解率中央値69%(範囲:28%-95%)·治療前平均ER分解率71%0 2000 4000 ER A Q UA S COR陽性閾値VERITAC患者1期患者VERITAC患者1期VERITAC患者1期患者実線:ESR 1野生型破線:ESR 1変異
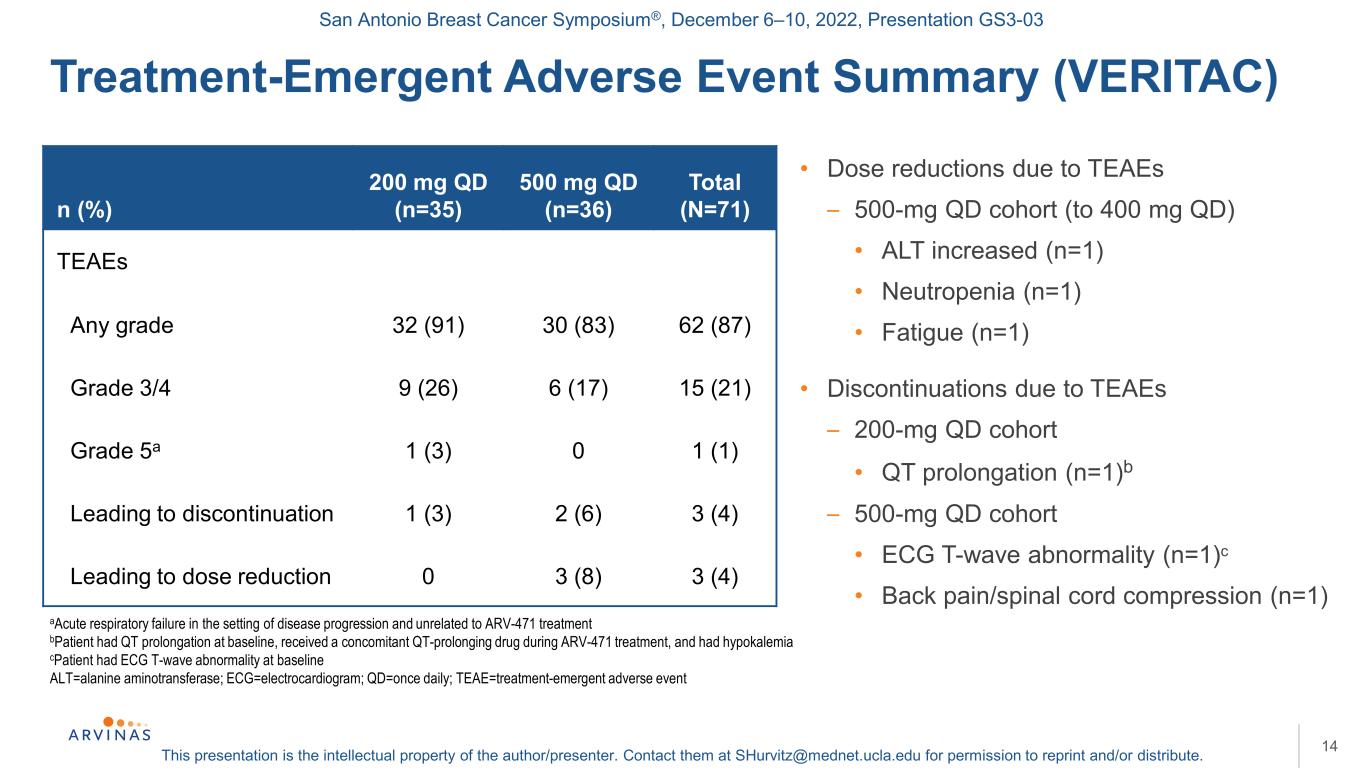
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。治療−緊急有害事象まとめ(VERITAC)14 ARV−471治療とは無関係な疾患進展背景下の急性呼吸不全患者はベースライン時QT延長,ARV−471治療期間に伴うQT延長薬を受け,低カリウム血症患者はベースライン時に心電図T波異常,ALT=アラニンアミノトランスフェラーゼ;ECG=心電図;QD=1日1回;TEAE=治療−緊急有害事象·TEAEによる用量減少−500 mg qd行列(400 Mg Qd)·ALT上昇(n=1)·好中球減少(n=1)·疲労(n=1)·TEAEs中断−200 mg qd行列·QT延長(n=1)b−500 mg qd行列·心電図T波異常(n=1)c·背部痛/脊髄圧迫(n=1)n(%)200 mg qd(n=35)合計500 mg qd(n=71)TEEs Any分級3(91)30(83)(87)ステージ3/4ステージ9(26)6(17)15(21)5 aステージ1(3)0 1(1)停止1(3)2(6)3(4)線量減少につながる0 3(8)3(4)
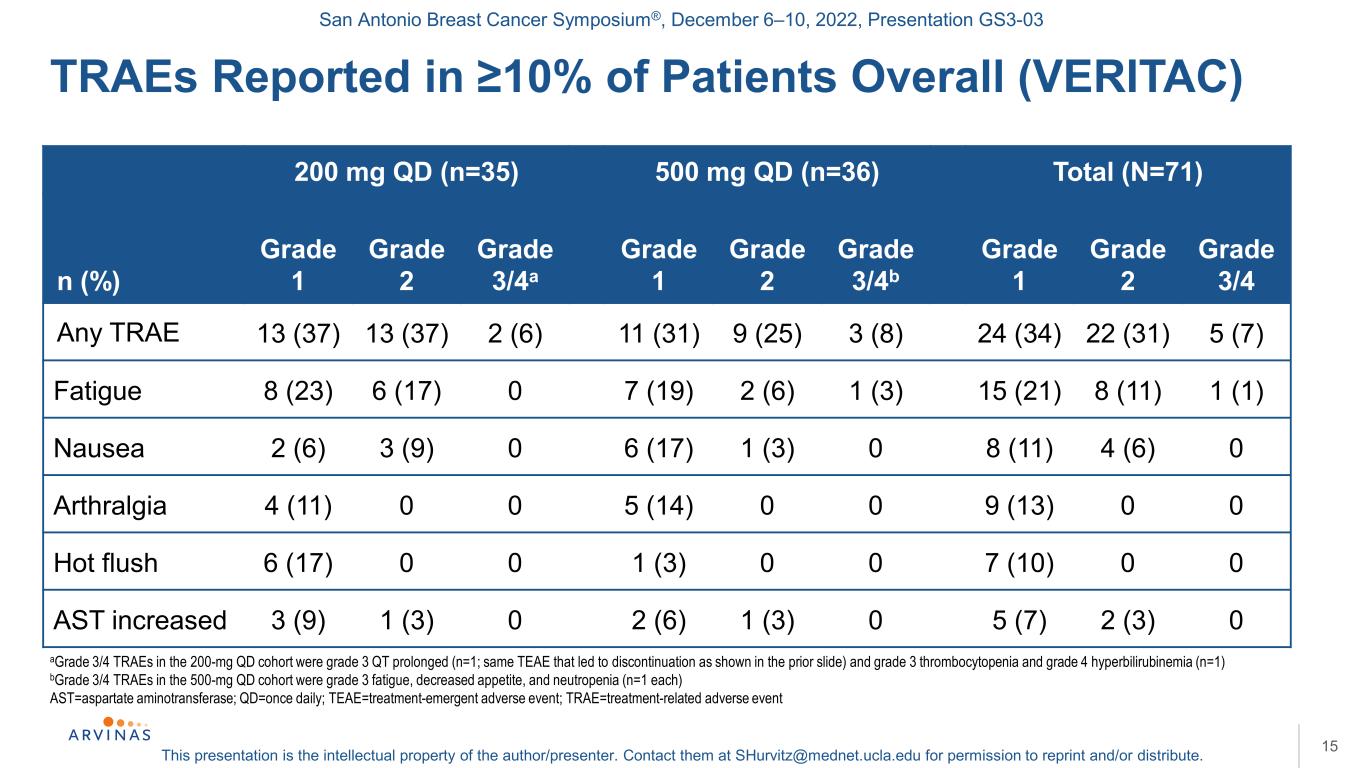
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。200 mg qd(n=35)500 mg qd(n=36)合計(N=71)n(%)1級2級3/4 a級1級2級3/4 b級1級3/4 b級1級3/4の任意の曲13(37)13(37)2(6)11(31)9(25)3(8)24(34)22(31)5(7)疲労8(23)6(17)07(19)2(6)1(3)15(21)8(11)1(1)気持ち悪い2(6)3(9)0 6(17)1(3)0 8(11)4(6)0関節痛4(11)0 5(14)0 0 9(13)0潮熱6(17)0 0 1(3)0 0 7(10)0 AST増加3(9)1(3)0 2(6)1(3)0 5(7)2(3)0 15 A級3/4 TRAE延長(n=1);B 500 mg qd列中の3/4級TRAEは3級疲労、食欲低下と好中球減少(n=1)、AST=アスパラギン酸アミノトランスフェラーゼ;Qd=1日1回;TEAE=治療-緊急有害事象;TRAE=治療関連有害事象で報告されたTRAEは患者総数の10%(VERITAC)を占めた
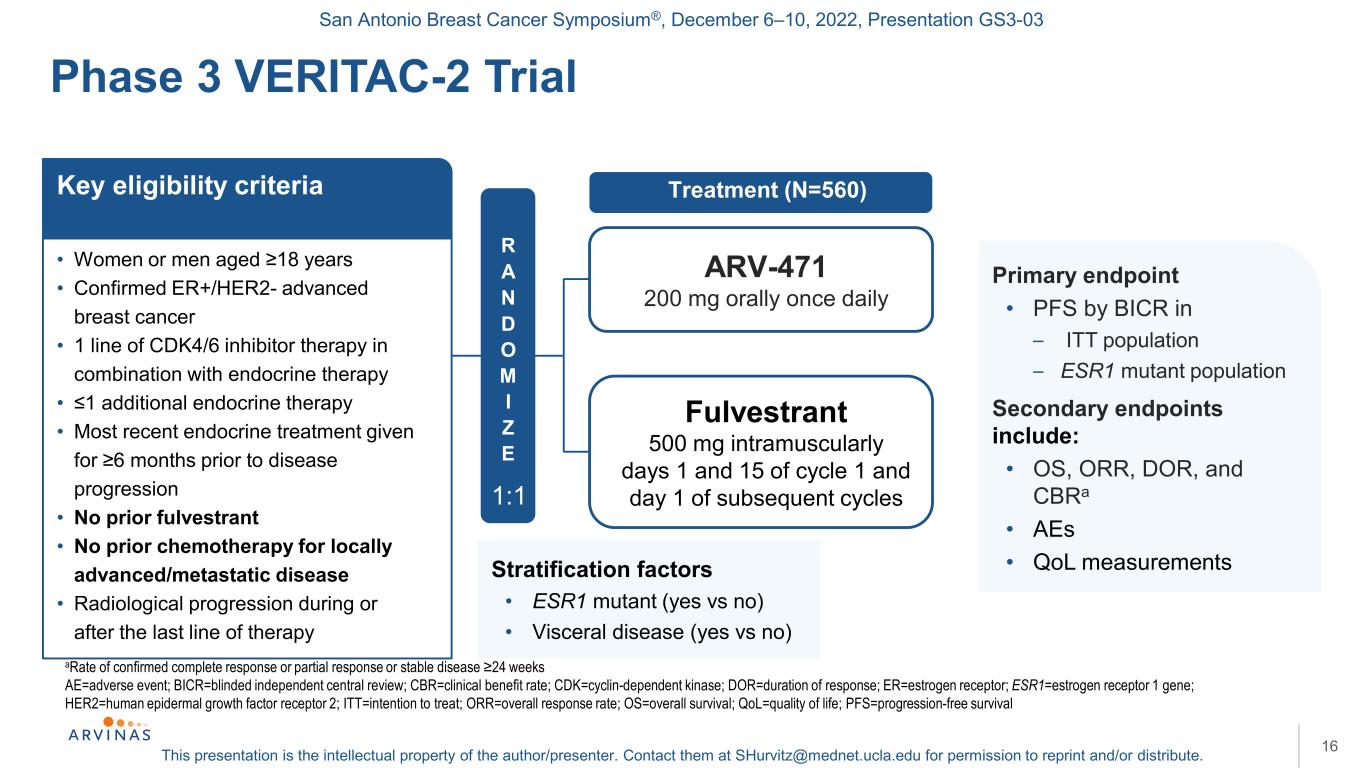
サンアントニオ乳癌シンポジウム,2022年12月6−10日,プレゼンテーションGS 3−03本プレゼンテーションは著者/講演者の知的財産権である。彼らに連絡する:shurvitz@mednet.ucla.eduは、転載および/または配布の許可を得る。16完全緩和または部分的緩和または病状安定と診断される比率24週AE=有害事象;BICR=盲法独立センター概要;CBR=臨床受益率;CDK=細胞周期蛋白依存性キナーゼ;DOR=反応持続時間;ER=エストロゲン受容体;ESR 1=エストロゲン受容体1遺伝子;HER 2=ヒト表皮増殖因子受容体2;ITT=治療意向;OOR=総応答率;OS=総生存期間;QOL=生活の質;PFS=無進展生存期間3 VERITAC−2試験·年齢18歳の女性や男性·確定診断されたER+/HER 2−進行乳癌·CDK 4/6阻害剤併用内分泌治療の1行·1付加内分泌治療·疾患進行前6カ月に最近の内分泌治療を受けたことがない·以前にホルヴェスターを受けたことがない·局所末期/転移性疾患の化学療法を受けていない·最終治療期間またはその後の放射線進展−4712万mg,Fulvestrantを1日1回筋肉注射し,1日500 mg,周期1と15日およびその後のキー資格基準の主な終点の1日目と15日目,その後のキー資格基準の主な終点の1日目と15日目·BICR In-ITT集団のPFS-ESR 1変異集団副次的端末は、·OS、OOR,DORとCBRa·AEs·QOL測定R A N D O M I Z E 1:1階層因子·ESR 1変異(そうか否)·内臓疾患(そうかどうか)治療(N=560)
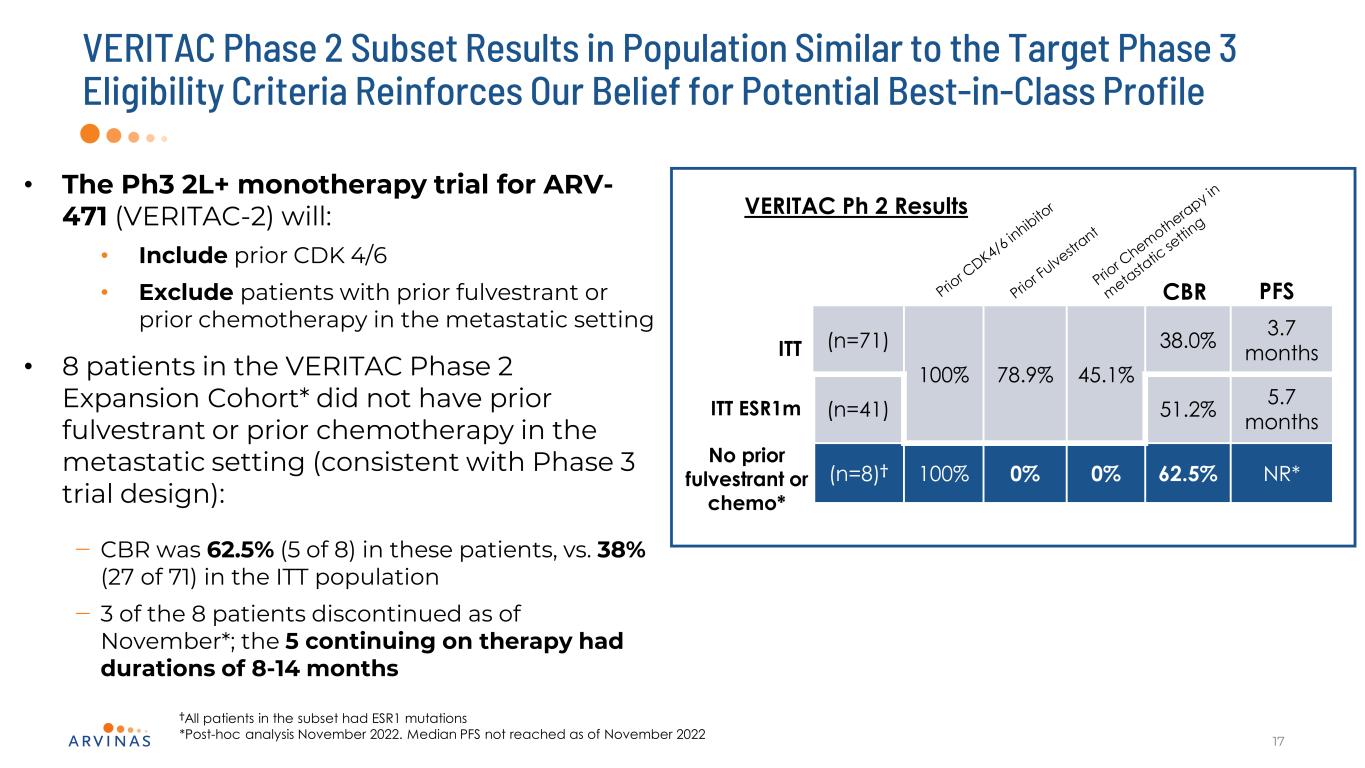
VERITAC 2期サブセットの結果は目標3期資格基準と類似しており,潜在的な同種の最適プロファイルに対する信念17·ARV−471に対するPh 3 2 L+単一療法試験(VERITAC−2)は:·先のCDK 4/6を含む·転移環境で全トランスまたは以前の化学療法を受けた患者を除外·VITAC第2期拡張キューの患者8名*転移環境に以前の全トランスまたは以前の化学療法がなかった(第3期試験設計と一致):−CBRはこれらの患者で62.5%(5/8),ITT群では38%(27/71)−11月現在,8名中3名が治療を中止している*.治療を継続した5名の患者の持続期間は8−14カ月であり,亜群のすべての患者にESR 1変異*2022年11月の事後分析があった。2022年11月現在達成されていない中央値PFS ITT(n=71)100%78.9%45.1%38.0%3.7カ月(n=41)51.2%5.7カ月(n=8)≡100%0%0%62.5%NR*VERITAC Ph 2結果CBR PFS前のフルビドンまたは化学療法*ITT ESR 1 Mなし

18の結論

持続的な治療効果と良好な耐性はARV-471を2つの重要な研究の道に進ませ、この2つの研究はすぐに19·良好な耐性を開始し、それぞれ200 mg qdと500 mg qd·200 mgの第3段階投与量である。無用量減少と一次中止·ARV−471の耐性は,疾患連続過程でPh 3試験を開発·開始するのに適している·治療経験の少ない患者への単一療法2 L Ph 3(2022年第4四半期)·ER依存腫瘍患者へのESR 1 mutとAll−comersの役割を解決するための試験·Palbo併用1 L Ph 3の応用(2023年第1四半期)·他の併用療法や早期乳癌とともに開始されたより広範な開発·ARV−471が重篤な薬剤耐性患者において強力なCBRとM PFS·この治療困難群における活性がPROTAC技術の耐性の潜在力を示している。その安全性と有効性はまだ確定されていない:確定診断の完全緩和或いは部分緩和或いは病状安定の比率は24週CBR=臨床受益率;ER=エストロゲン受容体;ESR 1=エストロゲン受容体1遺伝子;PFS=無進展生存期間

VERITACデータは、ARV 471が同種の中で最も良いER標的療法20 cc 2020:ステップ1 PoC 2021:ステップ1読み出し2022:ステップ2読み出し2022:TACTIVE−Uを起動する計画であることを確認した。TACTIVE−E 2022:日本患者においてTACTIVE−N 2022を開始する計画:日本患者において第1段階検証を開始するPROTACタンパク質分解器の持続的治療効果シグナルと良好な耐性特徴は、多標的治療を有するグローバル経路組合せ試験を実現するために、日本への第3段階登録研究の第1段階試験の推進を支持する−計画的により多くの薬剤を増加させ、ARM−471を骨幹治療の潜在力として確立し、早期乳癌の安全性および臨床活性(例えば、、例えば、早期乳癌の安全性および臨床活性を評価することを目的とする。新しいアジュバント)次のマイルストーン:第3段階登録研究(1 L)転移性乳癌2022年の潜在的治療法としてARV-471の評価を実証した:VERITAC-2 Ph 3試験(2 L+単一療法)第1地点の用量患者が開始した

ありがとう21歳