
が2022年11月17日に米国証券取引委員会に提出されたように。
登録番号333-
アメリカ アメリカ
証券取引委員会
ワシントンD.C.,20549
表
文を登録する
はい
1933年証券法
(登録者の正確な名称は、その定款に規定されている名称と同じ)
(State or other jurisdiction 会社や組織) |
(主に 標準業界 分類記号) | (I.R.S.雇用主 識別子) |
CEO
(サービスエージェントの名前、住所、郵便番号、電話番号、市外局番を含む)
を:にコピーする
Jeffery J. Fessler, Esq. シェパードムリンリチャード&Hampton LLP |
Brad L. Shiffman, Esq. 空白ローマ有限責任会社 アメリカ大通り1271
|
一般販売の約 開始日をお勧めします
本登録声明の発効日後、実際に実行可能な範囲内でできるだけ早く提出する。
1933年の証券法第415条の規則に基づいて、本表に登録されている任意の証券が遅延または連続的に発売される場合、以下の枠を選択してください。☐
証券法下のルール462(B)によれば、本テーブルは、発行された追加証券を登録するために提出された場合、 の下の枠を選択し、同じ製品の早い発効登録宣言の証券法登録宣言番号 を並べてください
この表が証券法下の規則462(C)に従って提出された後に改正された場合、以下の枠を選択し、同一製品のより早い有効登録宣言の証券法登録宣言番号をリストしてください
この表が証券法下の規則462(D)に従って提出された後に改正された場合、以下の枠を選択し、同一製品のより早い有効登録宣言の証券法登録宣言番号をリストしてください
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社, か新興成長型会社かを再選択マークで示した。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小報告会社”、“新興成長型会社”の定義を参照されたい。
| 大型 加速ファイルサーバ | ☐ | 加速した ファイルマネージャ | ☐ | |
| ☒ | 小さな報告会社 | |||
| 新興成長型会社 |
もし
が新興成長型会社である場合、登録者が延長された移行期間を使用しないことを選択したかどうかを再選択マークで示して、証券法第7(A)(2)(B)節に提供される任意の新しいまたは改正された財務会計基準を遵守してください
登録者は,本登録声明を修正し,その発効日を登録者に延期するために必要な1つ以上の日付を修正し,本登録声明をその後改正された1933年証券法第8(A)条に基づいて発効させるか,又は証券取引委員会が上記第8(A)条に基づいて決定された日に施行されるまで,本登録声明を明確に宣言する。
この予備入札説明書に含まれる 情報は不完全であり、変更される可能性があります。米国証券取引委員会に提出された登録声明が発効するまで、これらの証券は売却してはならない。本初歩募集説明書は、これらの証券を販売する要約 でもなく、いかなる要約や売却も許可されていない州でこれらの証券を購入する要約を募集するものでもない。
| 予備募集説明書 | テーマ 完成 | 日付:2022年11月17日 |
個の共有
普通株 株

AccuStem科学社は
私たち は1株 $の仮定公開発行価格で私たちの普通株を発売します。本入札明細書で用いられる仮想公開発行価格は説明目的にのみ用いられる.実際の発行価格は募集説明書で使用されている想定価格と大きく異なる可能性があり,吾らと引受業者代表との交渉によって決定され,実際の発行価格の価格を代表しない可能性がある.
私たちの普通株式はOTCQB創業ボード市場(“OTCQB”)で“ACUT”をコードオファーとしています。2022年11月16日、OTCQBでの我々の普通株式の最終報告価格は0.75ドルだった。私たちはすでに私たちの普通株をbr}ナスダック資本市場に上場することを申請しました。コードは“ACUT”で、上場は今回発行の条件です。私たちの申請が必ず承認されるという保証はない。
私たちの普通株に投資することは高い危険と関連がある。15ページ目からの“リスク要因”を参照してください。米国証券取引委員会およびどの州証券委員会もこれらの証券を承認または承認しておらず、本入札説明書が事実であるかどうか、または完全であるかどうかも決定されていません。どんな反対の陳述も刑事犯罪だ。
| 1株当たり | 合計する | |||||||
| 公開発行価格 | $ | $ | ||||||
| 保証割引と手数料(1) | $ | $ | ||||||
| 費用を差し引く前の収益は私たちに払います | $ | $ | ||||||
| (1) | 引受割引および手数料は、引受業者または株式承認証にbr}引受業者または株式承認証に支払われる公開発行価格0.4%に相当する非実報性費用手当を含まず、引受業者に発行された株式総数3.0%に相当する普通株を購入する。87ページから“保証”を参照して、引受業者の賠償に関する他のbr情報を知ることをお勧めします。 |
私たちはすでに引受業者に45日間の選択権を付与して、最大公開発行価格で私たちの普通株の追加株式を購入して、引受割引と手数料を差し引くことができます。
引受業者は2022年頃に株を受け渡しする予定だ。
ThinkEquity
本募集説明書の日付は2022年です。
| -2- |

| -3- |

| -4- |

| -5- |
カタログ表
| ページ | |
| 募集説明書の概要 | 7 |
| 歴史的財務データをまとめる | 13 |
| リスク要因 | 15 |
| 前向き陳述に関する特別説明 | 49 |
| 業界と市場データ | 50 |
| 収益の使用 | 50 |
| 配当政策 | 50 |
| 大文字である | 51 |
| 薄めにする | 52 |
| 経営陣の財務状況と経営成果の検討と分析 | 54 |
| 商売人 | 60 |
| 管理する | 75 |
| 役員報酬 | 79 |
| 特定の実益所有者と経営陣の保証所有権 | 80 |
| 特定の関係や関係者が取引する | 82 |
| 証券説明書 | 83 |
| 引受販売 | 87 |
| 法律事務 | 94 |
| 専門家 | 94 |
| そこでもっと多くの情報を見つけることができます | 95 |
| 財務諸表 | F-1 |
あなたは、本入札明細書に含まれる情報のみに依存しなければなりません。この製品に関連するbr}で使用することを許可している任意の無料で目論見書を作成することを許可しています。私たちと販売業者は誰もあなたに違う情報を提供することを許可していません。当社は、本募集説明書に含まれる証券の販売及び購入を求める要約及び要約のみを許可する司法管区においてのみ、本募集説明書に記載されている情報は、本募集説明書の日付のみが正確であり、本募集説明書の交付時間 又は本募集説明書に含まれる証券の任意の売却時間にかかわらず、当該募集説明書の発行日にのみ正確である。この日以来、私たちの業務、財務状況、運営結果、見通しは変化している可能性があります 私たちはできません。引受業者もいかなる申し出も許されない司法管轄区でこのような証券の要約を行うことはできません。本入札明細書は、本明細書に記載された部分文書に含まれるいくつかの条項の要約を含むが、完全な情報を取得するために実際の文書を参照する。すべての要約は、実際の文書によって完全に限定されている。 本明細書で言及された部分文書のコピーが提出されているか、または登録説明書の証拠物として提出されており、 本願明細書は、登録説明書の一部であり、以下に述べるように、“どこでより多くの情報を見つけることができるか”というタイトルでこれらの文書のコピーを取得することができる
米国以外の投資家に対して:私たちまたはいかなる引受業者も何の行動も取らず、米国以外のいかなる司法管轄区域での今回の発行または株式募集説明書の保有または配布を許可する。米国以外で本募集説明書を持っている人は、自分に知らせ、株式募集説明書を発行することに含まれる証券と、本募集説明書を米国国外に配布することに関するいかなる制限も守らなければならない。
別の説明がない限り、本募集説明書に含まれる私たちの業界および市場に関する情報は、私たちの一般的な期待および市場地位、市場機会および市場シェアを含み、いずれも、私たち自身の管理層の推定および研究、ならびに業界および一般出版物および第三者からの研究、調査および研究の情報に基づいている。業界出版物および第三者研究、調査および研究は、一般に、彼らの情報は、そのような情報の正確性または完全性を保証しないにもかかわらず、信頼できると考えられるソースから得られることを示している。これらの業界の出版物と第三者研究、調査、研究から得られたデータは信頼できると信じている。経営陣評価は 公開可能な情報,我々の本業への理解,およびこれらの情報や知識に基づく仮定に基づいており,これらの情報や知識は合理的であると考えられる.私たちの経営陣はいかなる独立したソースの確認も得られていないと推測し、私たちはいかなる第三者情報も独立して確認していない。また、様々な要素、“リスク要因”に記載されている要素を含むため、私たちと私たちの業界の未来の業績に対する仮説と推定は必ず高度な不確定性とリスクの影響を受ける。これらの と他の要素は、私たちの未来の業績が私たちの仮説と見積もりと大きく異なることをもたらすかもしれない。“展望的陳述に関する警告説明”を参照してください。私たちはこの目論見書のすべての開示に最終的な責任がある。
本募集説明書は、当社の商標及びサービスマーク、並びに他のエンティティに属する商標及びサービスマークへの参照を含む。便宜上、本明細書で言及された商標および商品名は、ラベルまたは記号を有しない可能性があるが、このような参照は、適用法に従って、私たちの権利または適用許可者がこれらの商標および商品名に対する権利を最大限に主張しないことをいかなる方法でも示すものではない。私たちは、他の会社との関係を示唆するために、または他の会社の任意の支援またはスポンサーを示唆するために、他の会社の商標、商標またはサービスマークを使用または展示するつもりはありません。
| -6- |
募集説明書 概要
以下の要約では、本募集説明書の他の部分に含まれる精選情報を重点的に紹介し、本募集説明書の他の部分に含まれるより詳細な情報および財務諸表によりその全体を限定した。それはあなたとあなたの投資決定に重要かもしれないすべての情報を含まない。“リスク要因”、“経営陣の財務状況と経営結果の討論と分析”、“br}及び本募集説明書の他の部分の財務諸表と関連説明に記載されている事項を含む株式募集説明書の全文をよく読まなければなりません。本募集説明書では,文意に加えて,“私たち”,“AccuStem”または“当社”に言及する場合は,AccuStem Sciences,Inc.を指す.
本募集説明書におけるbr株式及び1株当たりの資料反映は、我々の財務諸表及びその付記を除いて、予想比率1:1の承認普通株及び発行済み普通株を予想比率で行う逆株式分割は、 発効日直後であるが発売終了前に行う予定である。
使命(Br)宣言
我々の使命は,癌スクリーニングから治療とモニタリングまでの腫瘍学的看護連続体中のすべての患者の結果と生活の質を最適化する新しい診断ツールを提供することである。
概要
我々は臨床分期診断会社であり,全世界で年間1800万人以上の癌と診断された人の生活の質と予後の改善に取り組んでいる。著者らの計画は新しいゲノムテストを開発し、それを商業化し、腫瘍学的治療過程全体の決定を支持することである。私たちの重点は早期乳癌患者のために私たちの特許ゲノムテストStemPrintER を商業化することであり、この市場機会は13億ドルを超える年収を代表していると予想される。
著者らの主要な候補製品はStemPrintERであり、これは20個の遺伝子を含む予後分析であり、腔内(ER+/HER 2陰性)乳癌患者の遠隔再発リスクを予測することを目的としている。この測定方法を開発することは、腫瘍の“乾性”を測定し、あるいは腫瘍が幹細胞の行為をどの程度示すかを測定するためであり、癌の再発或いは標準治療に耐性を与える可能性があり、最終的にその多学科看護チームの患者に対する管理方式に影響を与える可能性がある。StemPrintERはすでに複数の臨床コホートと研究で検証されており,その中で最大のものはヨーロッパ腫瘍学研究所(“IEO”)からの約2400名の患者とTransATAC研究の約800名の患者の連続シリーズ研究である。IEOキューでは,StemPrintER高リスク患者(“SPRS High”) 遠隔再発の可能性は低リスク(“SPRS low”)患者の1.85倍であるが(図1),TransATACキューではSPRS高リスク患者が遠隔再発する可能性はSPRS低リスク患者の4.27倍 である(図2)。つまり,これらのデータはStemPrintERが乳癌患者の予後に対して高い予測作用を有することを明らかにし,腫瘍臨床における潜在的用途を示唆している。
| -7- |
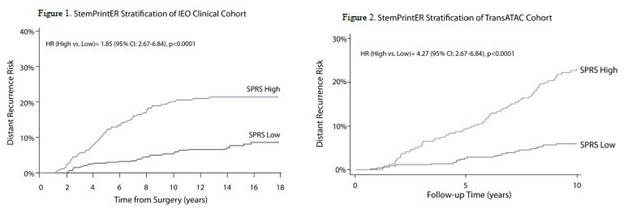
*SPRS- StemPrintER再発スコア;SPRSハイStemPrintERハイリスク;SPRS低StemPrintER低リスク
私たちが最初にStemPrintERを計画した以外に、私たちは私たちの製品の組み合わせを拡張するための大きな機会があると信じている。まず,腫瘍の“乾性”の広範な適用性を考慮すると,StemPrintプラットフォームは乳癌以外に重要な臨床実用価値を有すると信じられている。そこで,StemPrintを検証し,様々な異なる腫瘍タイプに適用するための商業化を図る。さらに、私たちは、私たちの独自の検出を強化し、患者の看護全体の過程で患者と医師により多くの情報と価値を提供するために、補助商品検出(例えば、遺伝子検出、体細胞変異検出)を提供する予定である。
我々は,いくつかの重要なマイルストーンを実現した後にStemPrintERを発売する予定である.まず、私たちはすべてのビジネスサンプルのStemPrintER結果を処理、テスト、報告するための実験室を決定または構築する予定です。また,StemPrintER 検出をそれらを開発した実験室から我々のビジネス実験室に移行する予定である.最後に、私たちの商業実験室でテスト能力を確立した後、1988年の米国臨床実験室改善修正案(“CLIA”)の認証 を得ることを求めて、臨床の結果を報告し、医療保険と医療補助サービスセンターに補償を求めることができます。私たちはこれらのマイルストーンを完成するのに少なくとも18ヶ月かかると予想されています。これらの任務が完了すると,我々はまず米国でStemPrintERを発売し,臨床需要や収入機会を評価する際に他の市場に拡張する予定である。
我々 は、低用量コンピュータ断層撮影(“LDCT”)スクリーニングによって決定された肺 結節が良性か悪性かの決定を助けることを目的としたmicroRNA署名分類器(“MSC”)試験の許可権を有する。今回発売された純収益 でこのテストをさらに開発または商業化するつもりはありません。
| -8- |
私たちの 戦略
我々の目標は,癌看護全体の過程で患者や彼らの医師を支援するための有力なツール提供者となることである。これを実現するために私たちは求めます
| ● | 人的資本を有効に採用し、発展させ、維持することで、優れた文化を実現し、一流の業績を提供することができる | |
| ● | 世界的にリードする癌看護機関と臨床パートナー関係を構築することを通じて、著者らの候補製品を厳格に検証する | |
| ● | 幅広い職能分野の思想指導者を参加させ、私たちの業務成功に重要な計画を効果的に策定する | |
| ● | 私たちの製品の組み合わせを拡張し、統合されたツール生態系を作って、私たちが多学科看護チームの第一選択のパートナーになるようにします | |
| ● | 規律が厳格なシステムの流れを応用して、予測可能と持続可能な収入増加を実現する。 |
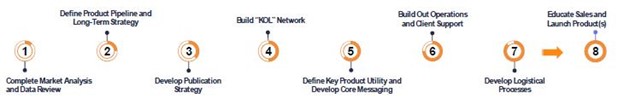
私たちの戦略は私たちの指導チームが診断業界で製品の発売と再発売に成功した成熟歴史を基礎としています。私たちは厳格な方法があります。まず市場と利用可能な製品データを深く分析して、それから重要な意見リーダーあるいはKOLで、バイヤーの行動を理解します。この方法は近未来と長期戦略を策定できるようになり、 戦略が到着すると、チーム計画は全社目標の成功実行を推進する運営要求に重点を置く。以下の図では,このようなシステム化の方法を説明する.
会社の歴史と買収
AccuStem Sciences LimitedはTiziana Life Science plc(“Tiziana”)から分割することにより設立され,AccuStem Sciences Limited(“Old AccuStem”)は2020年6月5日に有限責任民間会社としてイングランドとウェールズに登録設立された。その他の事項を除いて、分割の条件は裁判所がTizianaの減資を承認することであり、Tizianaの株主は2020年10月2日に特別決議を採択した。裁判所は2020年10月27日にTizianaに関する資本削減を承認し,分割は2020年10月30日に発効した。
| -9- |
分割プロトコルでは,TizianaはStemPrintER Sciences Limited(“StemPrintER Sciences”)のすべての発行済み株を我々に譲渡し,StemPrintER SciencesはTizianaのエンティティであり,TizianaはこのエンティティにStemPrint プロジェクトに関するすべての資産と知的財産権および1,167,700ドル(1,000,000 GB)の現金を提供することを規定している.
分割を行うために,TizianaはまずStemPrintプロジェクトに関連する資産(主にミラノIEO/大学から取得したライセンスと1つのアウトソーシング研究プロジェクトの利益)を別の会社StemPrinter Sciences,および1,167,700 (1,000,000 GB)現金に移した。このステップの結果として,StemPrinter Sciencesが1つの運営エンティティとなる.次のステップで、Tiziana は、Tizianaの株主に発行した普通株と引き換えに、StemPrinter Sciencesの株を私たちに譲渡し、 は1対1の方法で、Tizianaがそれらの株の株主に実物形式で配当することを株主に宣言する。
2021年1月1日に私たちと締結された共有サービス協定の条項によると、Tiziana は分割が完了した後、いくつかの限られた管理·行政サービスを提供し続けていく。共有サービス協定の条項によると、Tizianaは、双方が合意したコストに基づいて、様々な行政、財務、法律、税務、保険、施設、情報技術、その他のbrサービスを提供することに同意しています。共有サービスプロトコルの初期期限は2021年12月までであり,その後自動的に更新され,3カ月連続している.双方はいつでも相互に共有サービスプロトコル を終了することができる.しかも、私たちは30日前に共有サービス協定を終了することを書面で通知することができる。他方がそれぞれの実質的な義務を履行できなければ,双方は本プロトコルを終了することができる.
2021年12月1日、デラウェア州のAccuStem Sciences Inc.(“New AccuStem”)がOld AccuStemの後継者となった。 2021年12月30日、Old AccuStemの解散を完了した。
リスクファクターの概要
私たちの業務は多くのリスクに直面していて、私たちの普通株に投資することを決定する前に、あなたはこのようなリスクを認識しなければならない。これらの リスクは,本募集説明書の“リスク要因”の部分でより全面的に議論されている。これらのリスクには
| ● | 設立以来、私たち は毎年純損失を出しています。私たちは予測可能な未来に、私たちは赤字を続けて、永遠に実現したり、利益を維持したりすることができないと予想しています. | |
| ● | 今回の発行が成功したとしても、将来の機会を利用するために、より多くの資金を集める必要があるかもしれません. | |
| ● | 我々 は我々の候補製品の開発を完了するために大量の追加資金が必要であり,これらは受け入れ可能な 条項で提供できない可能性がある(あれば).必要なときに必要な資金を得ることができない場合、ある製品の開発、研究操作、または将来の商業化努力を延期、制限、または終了させることを迫られる可能性がある。 | |
| ● | 私たちの独立公認会計士事務所は、持続経営企業としての持続的な経営能力を大きく疑っており、この は私たちの将来の融資を受ける能力を阻害する可能性があります。 | |
| ● | 私たちの候補製品を開発して商業化する権利は、他の人が私たちに付与する許可の条項と条件に支配されています。もし私たちが私たちの既存と将来の第三者の任意の知的財産権の許可下の義務を履行できなければ、私たちの業務に非常に重要な許可権を失うかもしれません。 | |
| ● | もし私たちが候補製品や技術のために特許保護を獲得して維持することができない場合、または私たちの特許保護範囲が十分に広くなければ、私たちの競争相手は類似した製品および技術を開発し、それを商業化することができる。 | |
| ● | われわれ は効用研究を行う機関と連携しておらず, StemPrintERの期待臨床効用を示す保証もない。 |
| -10- |
| ● | 私たち は、リソースが限られているので、いくつかのリソースとサービスを提供する第三者に依存します。 | |
| ● | 我々は競争の激しい市場で運営し、多遺伝子予後分析領域からの競争相手の競争に直面し、腔内(ER+/HER 2-)乳癌患者の再発リスクを予測する。 | |
| ● | 私たちの経営陣、取締役会、br}科学コンサルタントの少数の重要な個人の専門知識と持続的なサービスに依存しています。 | |
| ● | 私たちがすべての臨床前研究と臨床試験を成功させても、私たちは私たちの1つ以上の候補製品を商業化することに成功できないかもしれない。 | |
| ● | 私たち は私たちの組織を拡張する必要があり、このような成長を管理する際に困難に直面する可能性があり、私たちの運営を中断する可能性があります。 | |
| ● | 私たちのbr従業員、独立請負業者、コンサルタント、商業パートナー、協力者とサプライヤーは、法規基準と要求を遵守しないことを含む不適切な行為または他の不当な活動に従事する可能性があります。 |
我々の資本構造を変更することを提案する
我々は,本目論見書 の日付までに我々の普通株式流通株を1対1の逆分割する予定である.逆株式分割に関連する断片的な株式は発行されず、このようなすべての断片的な資本は、最も近い普通株式整数に丸められる。私たちが発行したおよび/または発行された転換可能証券の転換および/または行使価格は、未償還株式オプションおよび引受権証を行使する際に発行可能な株と、私たちの発行された転換可能手形の転換価格を含む調整されます。本株式募集明細書で提供されるすべての情報は、本明細書に記載されているすべてのこのような金額および対応する株式交換価格および/または行使用価格データが、仮定された逆株式分割を実施するために、我々の普通株式流通株が1対1で逆分割されていると仮定している。
新興成長型会社としての影響
私たち は、2012年のJumpStart Our Business Startups ActやJOBS Actで定義されている新興成長型会社、またはEGCである。したがって,EGCではない他の上場取引エンティティに適した様々な報告要求の何らかの免除を利用することができる.これらの免除には
| ● | 本募集説明書の“経営層の財務状況と経営成果の討論と分析”と題する節では、2年間しか提出されていない監査財務諸表と関連討論を選択した | |
| ● | 2002年のサバンズ·オクスリ法案第404条またはサバンズ·オクスリー法案の監査人認証要件の遵守を要求していない | |
| ● | 上場企業会計監督委員会が通過する可能性のある強制ローテーション監査会社に関する任意の要求、または監査および財務諸表に関する追加情報を提供する監査師報告書の補足(すなわち、監査人の議論および分析)を遵守することは要求されていない | |
| ● | “報酬発言権”、“頻度発言権”、および“黄金パラシュート発言権”のようないくつかの役員報酬問題を株主諮問投票に提出する必要はない | |
| ● | 役員報酬と業績との相関、および最高経営責任者報酬と従業員報酬中央値との比較など、役員報酬に関連するいくつかの項目を開示する必要はない。 |
| -11- |
JOBS法案第107節では、EGCは、新たな又は改正された会計基準を遵守するために、“取引所法案”第13(A)節に規定された移行期間を延長することができることも規定されている。したがって、EGCは、これらの基準が民間会社に適用されるまで、いくつかの会計基準 の採用を延期することができる。EGCとしては,JOBS法案で許可されている新たなあるいは改訂された会計基準を遵守するために延長された過渡期 を利用する予定である。
私たち は、(1)年間総収入が10.7億ドルを超える最初の会計年度の最終日、 (2)2027年の最終日、(3)取引所 法案によると、ルール12 b-2で定義された“大型加速申告者”となる日までEGCとなり、これは任意の会計年度の最後の日に発生し、最近完成した第2四半期の最後の営業日まで、非付属会社が持っている私たちの普通株の世界総時価は7億ドルを超える。あるいは(Iv)私たちは任意の3年間に10億ドルを超える転換不可能債券を発行した日。
企業情報
私たちの法定名称はAccuStem Sciences,Inc.です。私たちの登録事務所はニューヨークペンシルベニア広場5号19階にあり、郵便番号:#1954、NY、電話:+44(0)20 7495 2379です。私たちは完全子会社を持っている:StemPrintER Sciences Limited、これはイングランドとウェールズに登録して設立された民間会社で、“会社法”に基づいて限られた責任を負う。私たちのサイトの住所はwww.AccuStem.comです。当サイトへの引用 は非アクティブテキスト参照のみであり、本登録声明で参照される当サイトまたは任意の他のサイト に含まれる情報またはそのサイトを介してアクセス可能な情報は、本登録宣言に属さない。
利用可能な情報
我々 は,改正された1934年の“証券取引法”(以下,“取引法”と略す)により,年度,四半期と現在の報告,依頼書,その他の文書を米国証券取引委員会(“米国証券取引委員会”)に提出した。私たちは、引用によって、このような届出書類または他の文書を、本募集説明書または本入札説明書に含まれる登録説明書に組み込むことはしない。アメリカ証券取引委員会は、報告、依頼書と情報声明、その他の発行者に関する情報を含む相互接続サイトwww.sec.govを維持しており、私たちbrはアメリカ証券取引委員会で電子的に記録している。
Form 10-K、Form 10-Q、およびForm 8-Kで米国証券取引委員会に提出された各文書およびこの報告書のすべての修正は、当社のウェブサイトwww.AccuStem.comで無料で閲覧およびダウンロードすることができ、報告および改訂が米国証券取引委員会に電子的にアーカイブまたは米国証券取引委員会に提供された後、合理的な可能な範囲でできるだけ早く確認してダウンロードすることができる。
製品
| 私たちが提供する普通株式 : | 普通株式 | |
| 今回の発行前に発行された普通株式 | 個の共有 | |
| 今回の発行後すぐに普通株式 を発行します | 株(引受業者が選択権を行使すれば、最大で 株を追加購入して超過配給を補う場合は株) | |
| 超過配給オプション | 私たちはすでに引受業者に45日間の選択権を付与し、本募集説明書の発表日から、公開発行価格で引受割引を引いて、最大で追加でbr株普通株を購入することができます |
| -12- |
| 収益を使用する : | 引受業者が引受割引と手数料および我々が支払うべき推定発売費用を差し引いた後,想定した公開発行価格で1株あたり$ が超過配給選択権を全面的に行使すれば,今回発行した純収益は約$または約$ となると予想される。私たちは今回発行された純収益を用いて研究実験室を決定または構築し、サンプルセットを取得して、私たちのbr候補製品をさらに検証し、StemPrintERテストの実用性を証明するために新しい臨床試験を開始する予定である。残り収益 は、ライセンスに従ってIEO/ミラノ大学に175,000ドル を支払うことを含む、運営資金および一般企業用途に使用される。今回の発行で得られた収益の期待用途のより完全な説明については,“収益の使用”を参照されたい | |
| リスク 要因: | 私たちの証券への投資は高度なリスクに関連しており、あなたのすべての投資損失を招く可能性があります。投資決定を下す前に、本入札明細書のすべての情報をよく考慮しなければなりません。特に15ページ目からの“リスク要因”というタイトルの次のリスク要因を評価しなければなりません | |
| ナスダック資本市場取引コード: | 当社の普通株をナスダック資本市場に看板で上場することを申請しました。コードは“ACUT” |
今回の発行直後に発行された普通株数は、2022年10月31日現在の11,346,535株発行済み普通株 に基づいており、含まれていない
| ● | 引受権証を行使する際に発行可能な普通株であり,行権価格は1株$; と | |
| ● | 2021年の総合持分インセンティブ計画によると、未償還オプションを行使する際に109,811株の普通株式(Br)加重平均使用価格は0.41ドルである | |
| ● | 今回の発行が完了したら、引受業者代表に普通株式標引受権証を発行します。 |
本募集説明書に別の説明がある以外に、本募集説明書のすべての情報は、以下のように反映されるか、または仮定される
| ● | 私たちの普通株の逆株分割は2022年に発効します | |
| ● | 引受業者は、超過配給の選択権を補うために、最大のbr株普通株を購入する権利を行使してはならない。 |
履歴連結財務データをまとめる
次の表に私たちが示した期間のまとめられた総合財務データを示します。2021年12月31日までの年度と2020年6月5日(成立日)から2021年12月31日までの経営データ総合報告書を、本募集説明書の他の部分に含まれる監査された総合財務諸表から導出しました。2022年9月30日と2021年9月30日までの9ヶ月間の未監査総合財務諸表データと、2022年9月30日現在の未監査総合貸借対照表データ は、本募集説明書の他の期間の未監査総合財務諸表からのものである。我々の過去の 結果は必ずしも未来のどの時期の予想結果を代表するとは限らない.以下の要約(Br)の連結財務データおよび本募集説明書の他の部分に含まれる監査された合併財務諸表、および“経営陣の財務状況および運営結果の議論および分析”というタイトルの章を読まなければなりません
米ドル単位で帳簿と記録を保存し、以下の規定に基づいて財務諸表を作成します一般的に受け入れられている会計原則(“米国公認会計原則”)。
| -13- |
統合された 運営報告書データ:
Nine Months Ended September 30, | 現在までの年度 | 2020年6月5日から | ||||||||||||||
2022 (未監査) | 2021 (未監査) | 2021年12月31日 | 2020年12月31日 | |||||||||||||
| 運営費 | ||||||||||||||||
| 研究開発費 | $ | 133,809 | $ | 46,869 | $ | 73,335 | $ | 5,748 | ||||||||
| 一般と行政費用 | 2,634,076 | 80,263 | 597,279 | 48,500 | ||||||||||||
| 総運営費 | 2,767,885 | 127,132 | 670,614 | 54,248 | ||||||||||||
| 運営損失 | (2,767,885 | ) | (127,132 | ) | (670,614 | ) | (54,248 | ) | ||||||||
| 所得税前損失 | (2,767,885 | ) | (127,132 | ) | (670,614 | ) | (54,248 | ) | ||||||||
| 所得税の割引 | - | - | — | — | ||||||||||||
| 純損失 | $ | (2,767,885 | ) | $ | (127,132 | ) | $ | (670,614 | ) | $ | (54,248 | ) | ||||
| 普通株主は1株当たり基本損失と希釈して1株当たり純損失を占めるべきである | $ | (0.25 | ) | $ | (0.01 | $ | (0.07 | ) | $ | (0.01 | ) | |||||
| 基本と希釈後の普通株株主の1株当たり純損失を計算するための加重平均既発行普通株 | 10,904,423 | 9,999,132 | 9,999,132 | 9,999,132 | ||||||||||||
| 翻訳調整 | — | (16,347 | ) | (11,553 | ) | 78,534 | ||||||||||
| 総合損失 | $ | (2,767,885 | ) | $ | (143,479 | ) | $ | (682,167 | ) | $ | 24,286 | |||||
統合された貸借対照表データ:
[固定 テーブル間距離[
| 2022年9月30日まで | ||||||||
| 実際 | 調整された(1) | |||||||
| 現金 | $ | 1,331,960 | $ | |||||
| 運営資本 | $ | 789,139 | $ | |||||
| 総資産 | $ | 1,622,658 | $ | |||||
| 株主権益総額 | $ | 797,724 | $ | |||||
(1) は、私が今回発売中に想定した1株当たり公開発行価格 で普通株を売却することに等しくするための調整であり、 は、2022年のOTCQB報告の最後に報告された売却価格1株当たり普通株$に反映され、推定引受割引およびマージンおよび吾などが今回の発売について支払うべき推定発売費用 を差し引く。
| -14- |
リスク要因
私たちの普通株に対するどんな投資も高い投機的で高い危険を持っている。我々の普通株を購入するか否かを決定する前に、投資家は以下のリスクを慎重に考慮すべきである。我々の業務、財務状況、経営業績と見通し には、以下のような重大なリスクと、引用によって組み込まれた重大なリスクが存在する。我々が現在予見できない他のリスクや不確実性 も我々の業務運営に影響を与える可能性がある.実際に以下のいずれかのリスクが発生した場合、我々の業務、財務状況または経営業績は実質的な悪影響を受ける可能性がある。この場合、私たちの普通株の取引価格は下落する可能性があり、私たちの株主は私たちの普通株への投資の全部または一部を損失するかもしれない。
リスクbrは私たちの財務状況と業務の将来融資と関係があります
設立以来、私たち は毎年純損失を出しています。私たちは予測可能な未来に、私たちは引き続き損失を被って、永遠に実現できない、あるいは利益を維持することができると予想しています。
著者らは臨床段階診断会社であり、運営歴史は限られている。2013年5月の設立以来、私たちは重大な純損失が発生した。2021年12月31日までの年度、2020年6月5日(成立日)から2020年12月31日までの期間および2022年9月30日までの9カ月間の純損失はそれぞれ670,614ドル、54,248ドル、2,767,885ドルだった。2022年9月30日現在、私たちの累計損失は3,492,747ドルです。商業化の候補品を持つには数年(あれば)かかると予想される。予想される未来には、巨額かつ増加していく運営費や損失が引き続き発生する見通しである。これらの純損失 は私たちの株主権益や純資産に悪影響を与え、四半期と年の間に大きく変動する可能性がある。私たちは次の場合、私たちの費用が大幅に増加すると予想している
| ● | 現在の良好な生産実践またはcGMPに基づいて、臨床試験または潜在的な商業販売のための候補製品を生産する; | |
| ● | 販売、マーケティング、流通インフラを構築し、市場の承認を得る可能性のある任意の候補製品を商業化する | |
| ● | 私たちの知的財産権の組み合わせを開発し、維持し、拡大し、保護する | |
| ● | 他の可能性のある候補製品および技術を決定、評価、取得すること | |
| ● | 安全、brの維持、または任意の許可内の技術および製品の操作自由を得る; | |
| ● | 競争し合う技術や市場の発展に対応し | |
| ● | アメリカとヨーロッパでの私たちの業務を拡大する。 |
私たち は決してこれらのすべての活動で成功しないかもしれません。たとえ私たちが成功しても、私たちは利益を達成するのに十分な収入や巨大な収入を生み出しないかもしれません。もし私たちが確実に利益を達成したら、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。私たちが達成できず利益を維持することは会社の価値を低下させ、資金を調達し、研究開発や研究開発を維持し、業務を拡大し、あるいは運営を継続する能力を弱める可能性がある。
| -15- |
我々 はその候補製品の開発を完了するために大量の追加資金が必要であり,これは受け入れ可能な条項で提供できない可能性があり, があれば.必要なときに必要な資金を得ることができなければ、いくつかの製品開発、研究、または将来の商業化努力を延期、制限、または終了させることを迫られる可能性がある(あれば)
設立以来、私たちの運営は大量の現金を消費し、私たちは持続活動に関連する費用が大幅に増加することを予想して、特に私たちが研究開発を続け、さらなる臨床試験を開始し、私たちの候補製品のためにマーケティング承認を求める場合。また、私たちの候補製品が市場で承認されれば、製品販売、マーケティング、製造、流通に関連した巨額の費用が発生すると予想される。
また, 我々は米国で公的報告会社として運営することに余分なコストが生じると予想している.
もし私たちが適時に十分な資金を得ることができなければ、私たちは私たちの候補製品研究開発計画や将来の商業化努力を大幅に削減、延期、停止することを要求される可能性があり、私たちの業務を拡大することができない、あるいは必要に応じて私たちのビジネスチャンスを利用することができず、これは私たちの業務を損なう可能性があり、業務中断を招く可能性がある。
私たちの財務状況と経営業績は過去に大きく変化し、様々な要素のため、損失は引き続き増加しており、その中の多くの要素は私たちがコントロールできない。
私たちの財務状況と経営業績は過去に大きく変化し、様々な要素のため、損失は引き続き増加しており、その中の多くの要素は私たちがコントロールできない。このような変動を引き起こす可能性のある私たちの業務に関連する要素は
| ● | 候補製品の臨床前と臨床研究を含む現在の研究と開発計画を継続する |
| ● | 候補製品の臨床試験 ; |
| ● | 私たちの臨床試験は臨床開発のすべての段階で成功しました |
| ● | 臨床試験の開始、登録と時間手配を延期する |
| ● | 私たちのbrは、将来の候補製品開発および/または商業化の協力、許可または他の手配の能力、およびこれらの計画の条項を確保し、維持する |
| ● | 私たちは候補製品を開発する能力と資金の即時性を得るための追加資金を得ています |
| ● | 我々の候補製品と競合する可能性のある候補製品の臨床試験または市場応用結果 |
| ● | 上場承認を得る可能性のある既存製品または新製品からの競争 ; |
| ● | 私たちの候補製品の潜在的な副作用は、承認または承認された製品の市場からの撤退を遅延または阻止する可能性がある |
| ● | 規制部門が私たちの候補製品を審査して承認することにはどんな遅延がありますか |
| ● | 他の候補製品を識別し開発する能力は |
| ● | 患者や医療提供者が私たちの製品のために保険を受けたり十分に精算する能力 |
| ● | 臨床研究組織(CRO)が臨床研究や他の法規要求を遵守する能力などの第三者の能力 |
| ● | 第三者メーカーは、私たちの候補製品と臨床試験を行うために必要な重要な成分を生産する能力 を生産し、承認されれば、私たちの製品の商業化に成功する |
| -16- |
| ● | 私たちは私たちの知的財産権のbrコストと、私たちと任意の第三者協力者の能力を獲得し、維持し、保護する |
| ● | 潜在的な知的財産権訴訟に関連する費用と結果 |
| ● | 私たちは未来の成長を十分に支援することができます |
| ● | 私たちは私たちの業務を効率的に管理するためにキーパーソンを引き付けて維持する能力がある |
| ● | 私たちは私たちの金融インフラを構築し、必要な程度に私たちの会計システムと制御を改善することができる。 |
新製品とサービスを開発することは投機的で高リスクな仕事だ。最初に,所望の製品やサービスが期待される結果を達成できない可能性があること,あるいは許容可能な分析精度や臨床実用レベルを達成できない可能性があることを示した。潜在的な成功製品またはサービスを決定する前に、私たちはbr開発において私たちの製品を変更し、臨床研究を繰り返す必要があるかもしれない。製品開発コストが高く, は完成まで数年かかる可能性があり,不確実な結果が生じる可能性がある。失敗は開発のどんな段階でも起こるかもしれない。もし開発後、br製品やサービスが成功した場合、私たちは依然としてアメリカ食品医薬品局(FDA)および他の規制許可、許可または承認を得る必要があるかもしれないが、それを発売することは、具体的には製品またはサービスの性質に依存する。FDAの承認、許可、または承認経路は、多くの時間、および追加の研究、開発および臨床研究の支出に関連する可能性がある。FDAは私たちが未来に開発したどんな製品やサービスも承認、許可、または承認しないかもしれない。私たちが規制部門の承認、許可、または承認を得た製品やサービスを開発したとしても、私たちは大量の資源を投入して商業化、販売、マーケティングして利益を得る必要があり、その製品やサービスは決して商業的に成功しないかもしれない。また, のいずれの製品やサービスの開発も,競合製品やサービスの開発により中断または実行可能性が低下する可能性がある.
新しい潜在的な製品やサービスは開発または商業化のどの段階でも失敗する可能性があり、もし私たちが現在または将来のどの製品やサービスも成功しないと判断すれば、私たちはそれらを放棄するかもしれませんが、私たちの投資は何の見返りもありません。もし私たちが他の製品やサービスの開発に失敗したら、私たちの成長潜在力は影響を受けるかもしれない。
私たちが規制部門の許可を得て私たちの1つ以上の候補製品の販売を許可することに成功した場合、私たちの収入は、私たちが規制部門の承認を得た地域の市場規模、製品の受け入れ可能な価格、保険と精算を得る能力、そして私たちがその地域の商業権を持っているかどうかにある程度依存するだろう。もし私たちの潜在的な患者数が私たちが推定したほど多くなければ、規制部門が承認した適応は私たちが予想していたより狭い、あるいは競争、医師の選択、または治療ガイドラインによって治療が縮小された場合、私たちは承認されても、販売されているこのような製品から相当な収入を得ないかもしれない。
私たちの研究開発費は、現在の候補製品と私たちが開発する可能性のある未来の候補製品に継続的に投資し続け、計画中の臨床試験を継続するため、私たちの研究開発費は引き続き大幅に増加することが予想される。また、私たちの候補製品が規制部門の承認を得たら、より多くの販売やマーケティング費用が発生することが予想されます。また、私たちが上場企業になると、上場企業の運営に関する追加コストが発生します。そのため、予測可能な未来には、重大かつ増加していく運営損失と負のキャッシュフローを受け続けることが予想される。これらの損失はすでに私たちの株主権益、財務状況、キャッシュフロー、運営資本に実質的な悪影響を与え続けるだろう。
今回の発行が成功したとしても、将来の機会を利用するために、より多くの資金を集める必要があるかもしれません
私たちは未来の機会を利用するために追加資金を集める必要があるかもしれない。このような追加資金は得られないかもしれない、または、利用可能であれば、 は私たちまたは私たちの株主に有利な条項ではないかもしれない。もし私たちが必要な追加資金を得ることができなければ、私たちは私たちの業務範囲や予想される拡張を縮小する必要があるかもしれない。
| -17- |
どんな追加的な資金調達活動も、私たちの経営陣を日常活動から気を取らせる可能性があり、これは私たちが候補製品を開発し、それを商業化する能力に悪影響を及ぼすかもしれない。さらに、私たちは未来の融資が十分な金額または私たちが受け入れられる条項で提供されることを保証できない。さらに、任意の融資条項は、株式または債務、またはそのような発行の可能性にかかわらず、私たちの株主の持株または権利に悪影響を及ぼす可能性があり、私たちの株式の市場価格の下落を招く可能性があります。追加の持分または転換可能な証券の販売は私たちの株主を希釈する可能性があります。brの債務の発生は固定支払義務の増加を招き、私たちはいくつかの配当金を支払う能力の制限、追加の債務の発生、私たちが取得することができるかもしれない知的財産権を販売する能力の制限、および私たちが業務を展開する能力に悪影響を及ぼす可能性のある他の運営制限に同意する必要があるかもしれません。私たちはまた、パートナーとの手配を通じて、または他の場合にはより早い段階で資金を求めることを要求される可能性があり、そうでなければ、私たちのいくつかの技術または候補製品の権利を放棄すること、または私たちに不利な条項に同意することが要求される可能性があり、これらの条項のいずれも、私たちの業務、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。
私たちの独立公認会計士事務所は、持続経営企業としての持続的な経営能力を大きく疑っており、この は私たちの将来の融資を受ける能力を阻害する可能性があります。
2021年12月31日現在の連結財務諸表は、今後12ヶ月以内に経営を継続すると仮定して作成されています。経常的な運営損失のため、財務諸表発表後、追加資本なしで1年間経営を継続する能力には大きな疑問があると結論しました。私たちの独立公認会計士事務所は、設立以来の運営赤字と2021年12月31日までの累計赤字724,862ドルについて言及し、必要な資金を得ることなく経営を継続する企業としての経営能力に深刻な疑いを抱いている監査意見を発表しました。私たちの持続的な経営企業としての持続的な経営能力は、関係者から追加の財務支援を受ける能力があるかどうか、あるいは追加の株式や債務融資によって、さらなる運営効率を実現し、支出を減らし、最終的に収入を生み出す能力があるかどうかにかかっている。財務諸表は、このような不確実性に起因する可能性のある任意の調整 を含まない。
知的財産権に関するリスク
私たちの候補製品の開発と商業化の権利は、他の人が私たちに付与する許可の条項と条件に支配されています。もし私たちが既存と未来の第三者の任意の知的財産権の許可下の義務を履行できなければ、私たちは私たちの業務に非常に重要な許可権を失うかもしれません。
我々 は,欧州腫瘍学研究所,Fondazione FIRC per l‘Oncolgia Molecolare,ミラノ大学(“IEO/ミラノ大学”)から付与された我々の技術や候補製品の開発に非常に重要であるか,あるいは に必要ないくつかの特許やノウハウの許可と再許可に依存しており,製造に関する特許やノウハウを含む。
Tizianaは2014年6月24日、ミラノIEO/大学と独占ライセンス契約(“ライセンス”)を締結し、Tizianaは、IEO/ミラノ大学のいくつかの特許下でのグローバル独占ライセンスと、IEO/ミラノ大学のいくつかの独自技術の下でのグローバル独占ライセンスをそれぞれ取得し、多遺伝子予測ツールに関連するライセンス製品を開発および商業化する。ライセンスは2020年10月30日に分割協定に含まれる予定の一部として割り当てられています。ライセンス条項によると、特定の職務遂行調査マイルストーンを含むライセンス製品の開発と商業化に合理的な努力をする義務があります。
もし私たちがライセンス規定の義務やライセンスを履行できず、任意の理由で終了した場合、私たちは、私たちの研究開発計画やStemPrintER候補製品の将来の任意の商業化努力を停止することを要求される可能性があり、私たちの業務を拡張することができない、あるいは必要に応じて私たちのビジネスチャンスを利用することができません。これは、私たちの業務を損なう可能性があり、私たちの業務中断を招く可能性があります。
| -18- |
ライセンスはまた、違約と資金不償還を含む他の理由で終了する可能性がある。
もし私たちが候補製品と技術のために特許保護を獲得して維持することができない場合、あるいは私たちの特許保護範囲が十分でなければ、私たちの競争相手は類似した製品と技術を開発して商業化することができる
私たちの成功は、アメリカ、イギリス、その他の国/地域で私たちの候補製品と技術について特許保護を求め、獲得し、維持する能力に大きく依存している。私たちの許可者たちは、私たちの業務に非常に重要ないくつかの技術と私たちの候補製品StemPrintERに関する特許出願をアメリカ、イギリス、および他の場所に提出することによって私たちの独自の地位を保護しようとしている。
我々の現在の特許組合せは、第三者から内部許可を得る限られた数の特許出願を含む。もし私たちが他人が私たちの技術および候補製品をコピーすることを防止するために、あるいは特許保護を得るのが遅い前に私たちの研究開発成果の可能な特許を決定することができない場合、そうでなければ、私たちの業務、運営結果、および財務状況に大きな悪影響を及ぼす可能性がある。
私たちの知的財産権は挑戦することができます
現在または将来の商標、設計権または特許出願が登録商標、設計権利または特許をもたらすことを保証することはできず、任意の特許、設計または商標保護の範囲または著作権またはデータベース権利、または機密違反訴訟を提起する権利は、競合他社を排除するか、または競合優位を提供することを保証することはできず、 は、私たちの任意の許可特許、設計権または商標が挑戦を受けたときに有効であることを保証することができず、または第三者が私たちが保有する特許、設計権、商標または他の知的財産権の権利または所有権を要求することはない。
もし私たちが私たちの知的財産権をうまく行使できなければ、これは私たちの業務、財務状況、そして見通しに実質的な悪影響を及ぼすかもしれない。私たちは、第三者が所有する特許、設計権、商標または他の知的財産権の侵害に関するクレームを受ける可能性がある。私たちに不利な判決は、重大な金銭的損失、法的費用、および/またはすべてのまたは特定の地域で製品を製造、販売、または販売できない責任をもたらす可能性がある。
私たちの戦略は商業的価値のある知的財産権の創造に関するもので、これらの知的財産権は保護されることができます
私たち は私たちの知的財産権の組み合わせを拡大するつもりだ。将来の任意の特許出願が特許付与をもたらすことは保証されず、いかなる特許保護の範囲も競争相手を排除したり、競争優位性を提供してくれる保証はなく、私たちのいかなる特許 も挑戦されたときに有効であることを保証することはできず、第三者が私たちが保有する特許および他の固有の権利に対する権利または所有権 を要求しない保証もない。もし私たちがその技術や製品の面で追加の特許保護を得ることに成功しなければ、私たちの業務、運営結果、財務状況に重大な悪影響を及ぼす可能性がある。
業務発展に関するリスク
われわれ は効用研究を行う機関と連携しておらず, StemPrintERの期待臨床効用を示す保証もない。
StemPrintERに関する初歩的な回顧検証研究が完了した後、私たちは精算申請を支援するために臨床効用研究 を行う可能性があり、これは商業化に成功するために必要であり、さらなる証拠を提供して マーケティング声明を支持する。我々は,どの機関が効用研究を行うかは決定されておらず,これらの機関との関連協定も締結されていない.これらの連携を確保できないリスクがあり,効用研究段階に入る能力に影響を与える.
| -19- |
また, は実環境でStemPrintERの臨床的効用を示すことができない可能性があり,精算能力 に影響する。このような精算が実現できなければ、StemPrinterの商業化をより挑戦的にし、brは私たちの創造能力に影響を与え、それに応じて私たちの業務、財務状況、運営結果に実質的な悪影響を与えるだろう
CLIA研究所を設立し、StemPrintERを提供する過程で、私たちがコントロールできないリスクがある。
StemPrintER は20個の遺伝子を含むテストであり、早期乳癌患者の再発リスクを指示することを目的とし、主にER+/HER 2-群に用いられる。CLIA認証の実験室ではStemPrinterをLDTとして動作させていない.
たとえ が最終的に我々の検査を行う実験室のCLIA認証を得て商業化すれば,StemPrintERをLDTとして提供しても固有の リスクが存在し,これらのリスクはテスト摂取を含めて我々の制御を超えており,これは我々が起こりうる収入に影響を与える である。また,StemPrintER をLDTとして提供することで意味のある収入を生み出すことはできないかもしれない.
私たちは、リソースが限られているので、第三者に依存して、いくつかのリソースとサービスを提供してくれます
我々のbr計画部分は,我々の実験室システムに関するテストを含む我々のStemPrintERテストの研究,開発,供給,臨床テストを外部資源に依存して行い,これらのシステムは外部メーカーが開発したソフトウェアに依存することが予想される.StemPrintERと他の製品の将来の発展はこれらの第三者の表現にある程度依存するだろう。私たちは 関連第三者が関連手配の義務を履行できるという保証はない。将来、私たちは製品のマーケティング、販売、流通の面で外部資源に依存するかもしれない。我々がこれらのタスクを実行するために適任なbrパートナーを割り当てることができる保証はなく,これらのタスクが我々に有利な条項に基づいて達成できることを保証することはできない.また、経営陣は私たちを代表して意思決定を行う責任がありますが、経営陣は外部専門顧問の提案にある程度依存します。私たちがそのようなコンサルタントから正しい提案を受けるという保証はない。
我々と任意の第三者との分岐 は、我々の研究開発計画および/または商業化計画の遅延を招く可能性がある。任意の第三者が私たちとの関係を終了した場合、私たちは、他の第三者から開発および/または商業化サービスを取得すること、または内部で関連機能を開発することを要求され、これは、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
我々は研究と製品開発のリスクに直面している
私たち は新製品を開発したり、私たちが開発したテストや解決策で満たすことができる特定の市場ニーズを決定できない可能性があります。 製品開発は私たちの重要な持続活動になります。しかし、より多くの製品が開発され、成功的に発売され、市場に受け入れられる保証はない。すべての新製品開発は固有のリスクレベルがあり、長い過程 である可能性があり、予測できない遅延、コスト超過と挫折を受け、例えば患者を臨床試験に参加することが困難である。Br医療機器業界の性質は,新製品が競争や法規によって変化する可能性があることを意味する可能性があり,これは我々の業務,運営結果,財務状況に実質的な悪影響を及ぼす可能性がある。
また、研究開発は様々な要求の制約を受ける可能性があり、例えば新製品の臨床評価に参与する個人の研究対象保護、機関審査委員会監督、監督許可と設計制御要求を受けることができる。要求を遵守できなかったことは、製品の商業化を処罰、遅延、または阻止する可能性がある。
私たちは医療や技術の変化や時代遅れに関するリスクに支配されています
私たちの製品に対する需要は代替技術と代替薬物の発展の悪影響を受ける可能性があります。私たちが現在開発している技術や製品が時代遅れにならないことは保証できません。したがって、新技術や新製品は、私たちが現在開発している技術や製品よりも優れているか、淘汰される可能性があります。私たちの製品が最新の進展と同期していることを確保できなければ、私たちの競争力や財務業績に大きな悪影響を及ぼす可能性があります。私たちの成功は、これらの技術の変化と業界の傾向を満たすために、私たちの製品を開発し、調整したり、新しい技術を獲得して統合したりする能力にある程度依存し、それができなければ、私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性があります。
| -20- |
市場 と競争リスク
我々は競争の激しい市場で運営し、競争相手の競争に直面し、これらの競争相手は多遺伝子予後分析に参加して腔性(ER+/HER 2-)乳癌患者の再発リスクを予測する
我々は競争相手からの競争に直面する可能性があり、これらの競争相手は腔内(ER+/HER 2-)乳癌患者の再発リスクを予測するための多遺伝子予後分析を開発している。私たちの多くの競争相手は、より多くの研究、開発、マーケティング、財務、人的資源を得る機会があり、これはこれらの競争相手に商業的優位性を提供するかもしれない。新製品はStemPrinterよりも効率的で安いか、または よりも効率的にマーケティングされる可能性があります。上記のいずれかの理由による競争の大幅な激化は、マーケティングまたは資本支出を増加させる必要があるか、または競争力を維持するためにビジネスモデルを変更することを要求する可能性があり、これは、当社の収益性および/または財務状況を含む、私たちのビジネスに悪影響を及ぼす可能性があります。
候補製品の市場機会は私たちが予想していたより小さいかもしれません
著者らは研究開発を1種の多遺伝子予後ツールに集中し、ある乳癌の再発を予測するために使用している。これらの疾患を有する人数と、私たちの予後分析から利益を得る可能性があるこれらの疾患患者のサブセットとの理解は、推定に基づいている。これらの推定は不正確であることが証明される可能性があり,新しい研究はこれらの疾患の推定発症率や流行率を低下させる可能性がある。米国、イギリス(“イギリス”)、欧州連合(“EU”)および他の地域の患者数は予想を下回る可能性があり、他の方法で私たちの製品候補や患者の評価を受け入れることができない可能性があり、これはますます識別と接触が困難になる可能性があり、これらはすべて私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼすだろう。
また、もし が承認された場合、いくつかの要素は、私たちの潜在製品を受け入れた実際の患者数が潜在的な潜在市場よりも少なく、例えば、多くの未発達市場は広範なbr新しい治療法が不足し、精算が限られている可能性がある。
私たちの候補製品の将来のビジネス成功は、各候補製品が医師、患者、第三者支払人、および医学界の他の人に受け入れられる程度に依存するだろう
私たちはマーケティングを許可していない製品;私たちの候補製品は開発の検証研究段階にあり、私たちは商業販売または商業成功を得るために使用できる製品が永遠にないかもしれません。私たちの候補製品の商業成功は、彼らが医師、患者、第三者支払人によって医療に必要で、経済的に効率的で安全な製品として受け入れられているかどうかにある程度かかっている。もし私たちの未来の製品が十分な受容度に達していなければ、私たちは著しい製品収入が生じないかもしれないし、利益が得られないかもしれない。いくつかの候補製品が市場に認められても、この市場は相当なbr収入を生成するのに十分ではないかもしれない。もし私たちの候補製品が商業販売のために承認された場合、その市場受容度はいくつかの要素に依存するが、これらに限定されない
| ● | 私たちの候補製品の臨床試験における有効性と安全性 | |
| ● | 他の予測ツールと比較して私たちの候補製品の潜在的な利点と知覚的利点 | |
| ● | 他の予後予測ツールと比較した利用可能性および使用コスト; | |
| ● | 任意の候補製品の目標適応を変更する看護基準 ; |
| -21- |
| ● | 医師が新しい予後ツールを使用する意思と、目標患者群が新しい予後ツールを試みる意欲 | |
| ● | 製品br}FDA、イギリス医薬品および保健製品規制機関、欧州医薬品管理局(“EMA”)または他の規制機関のラベルまたは製品挿入要件は、製品 承認ラベルに含まれる任意の制限または警告を含む; | |
| ● | 製品が市場に投入されるタイミングを競う | |
| ● | 販売、流通、マーケティング支援 | |
| ● | 私たちの候補製品や競争する製品や治療法を宣伝しています | |
| ● | 潜在的な製品責任クレーム; | |
| ● | 私たちの製品を他の薬と一緒に使用するための制限はありません | |
| ● | 有利な第三者支払者カバー範囲と十分な精算。 |
もし潜在製品が臨床前研究と臨床試験において良好な臨床特性と安全性を示しても、市場のこの製品に対する受容度は製品発売後にのみ完全に確定することができる。
新たに承認された製品の保険範囲と精算状態が不確定です。十分な保険を獲得したり維持できなかったり、私たちが認めた候補製品を清算することは、これらの製品を販売する能力を制限するかもしれません
我々brは,政府と個人支払者の保証範囲と十分な精算が,多くの患者が承認した候補製品を負担できる鍵となると予想している。したがって、私たちの候補製品の販売は、国内外の私たちの候補製品の費用がどの程度健康維持、管理医療、薬局福祉と類似の医療保健管理組織によって支払われるか、あるいは政府当局、個人健康保険会社、その他の第三者支払人によってどの程度精算されるかに大きく依存する。第三者支払者が製品の使用を決定することを含む第三者支払人の保証範囲と精算はいくつかの要素に依存する可能性がある
| ● | 私たちの健康計画がカバーしている福祉 | |
| ● | 安全で効果的で医学的に必要なものです | |
| ● | 特定の患者に適した ; | |
| ● | 費用対効果が高い | |
| ● | 実験的でも研究的でもない。 |
第三者支払人から製品の保険と精算を得ることは時間がかかり高価な過程であり、これは支払人に科学的、臨床的、費用効果的なデータを支援するbrを提供する必要があるかもしれない。私たちは保証と精算の承認を得るのに十分なデータを提供できないかもしれない。カバー範囲および精算範囲が利用または遅延できない場合、または限られたbrレベルでのみ提供される場合、候補製品の商業化に成功することができない可能性がある。保険を提供しても、承認された精算金額は十分な投資リターンを実現するのに十分ではない可能性があり、将来的にはあまり優遇されない保険政策や精算料率 が実施される可能性がある。
我々の製品に対する市場 の受け入れと販売は、第三者支払者が十分な保険と精算を提供するかどうかに大きく依存し、既存および将来の医療改革措置の影響を受ける可能性がある。
| -22- |
規制リスク
私たちの業務に関連する多くの法規を遵守することは高価で時間のかかる過程であり、いかなる守らない行為も巨額の罰金を招く可能性がある。
一旦CLIA認証の実験室があれば、著者らはCLIAの制約を受け、これは連邦法律であり、臨床実験室を監督して人類からのサンプルを測定し、目的は疾病の診断、予防或いは治療に情報を提供することである。CLIA法規 は人員資格、管理と参加能力テスト、患者テスト管理、品質管理、品質保証と検査などの領域で具体的な標準を規定した。私たちは2年ごとに検査と検査を受けるつもりだ。また,CLIA検査員はわれわれの臨床参考実験室に対してランダム検査を行うことができる。
CLIAによれば,高度なテストを行うために認証やコンプライアンス証明書を持つ必要があるが,我々 はCAPを介して認証証明書を持つ必要はない。CLIAプロジェクトを代表する検査員による検査を行い,他の認証組織からの認証証明書や適合性証明書を保存することも可能である.
CLIA要求を遵守できなかったことは、我々のCLIA認証証明書の取り消し、一時停止または制限、および是正計画の指導、州現場監督、民事罰金、民事強制訴訟および/または刑事罰を含む法執行行動を引き起こす可能性がある。私たちはCLIAコンプライアンスと認証を維持しなければなりません。Medicare 受益者に提供するテスト料金を支払う資格があります。もし私たちがCLIA計画の要求に違反して制裁を受けたことが発見されれば、私たちの業務と名声は損なわれる可能性がある。私たちの研究室を再コンプライアンスさせる可能性があっても、私たちは巨額の費用を発生させ、その過程で収入を損失する可能性がある。
私たちはアリゾナ州でテストする許可証を持っていなければならない。アリゾナ州の法律は著者らの臨床参考実験室の日常運営のために標準を制定し、人員と品質管理に必要な訓練と技能を含む。さらに、他のいくつかの州 は、これらの州の患者のサンプルをテストするための許可証を持つことを要求している。他の州は似たような要求を持っているかもしれないし、未来に似たような要求を採用するかもしれない。許可が必要だと思っている州から許可証を取得する予定ですが、他の州が州外実験室に許可証を取得してその州のサンプルを受け取ることを要求していることが分かるかもしれませんが、他の州にも現在このような要求がある可能性があり、将来的にもこのような要求があるかもしれません。
もし私たちが取り消し、一時停止、制限でCLIA認証証明書やアリゾナ州許可証を失ったら、私たちは私たちのテスト製品を販売することができなくなり、これは私たちの収入を制限し、私たちの業務を損なうことになります。
もし私たちが医療法律法規を遵守できなければ、私たちは巨額の処罰に直面する可能性があり、私たちの業務、運営、財務状況は不利な影響を受ける可能性がある。
私たちbrはまた、連邦政府と私たちが業務を展開している州の医療詐欺と規制の乱用、そして私たちが業務を展開している国の外国の法律や法規のような制約を受けています。これらの法律には、州および連邦反リベート、自己推薦、詐欺および乱用、虚偽声明、および医師および他の免許を有する医療専門家に支払われる他の価値移転に関する透明性法律および法規が含まれているが、これらに限定されない。
| -23- |
リベート地位、またはAKSは、他の事項に加えて、購入、レンタル、注文または購入を誘導または手配し、実験室サービスを含む任意の商品、施設、物品またはサービスを購入、レンタル、注文または手配、レンタルまたは注文するために、実験室サービスを含む任意の商品、施設、物品またはサービスを誘導または手配するために、連邦医療保険、医療補助または他の連邦によって援助された医療保健計画に従って、全部または部分的に精算することができる任意の報酬(任意のリベート、賄賂またはリベートを含む)を受け取ることを禁止する。用語“報酬” は価値のあるものを含むと広く解釈されている。AKSは、メーカー と処方者、購入者、および処方マネージャーとの間の配置に適用されると解釈される。いくつかの法定例外と規制避風港保護のいくつかの一般的な活動が起訴されないにもかかわらず、例外と避難港の範囲は狭い。私たちの接近はすべての場合、安全港が反リベート責任から保護されるすべての基準を満たしていないかもしれない。しかしながら、特定の適用された法定例外または安全港を規制するすべての要求を満たすことができなかったことは、AKSの下で違法であることを意味するものではない。逆に、すべての事実と状況を累積審査した上で、この手配の合法性を逐案的に評価する。いくつかの裁判所は、報酬の手配に関連する任意の目的が連邦医療保険がカバーする業務への移行を誘導することであれば、AKSは違反されていると法規の意図要求を解釈している。また、個人または実体は、法規や法規違反の特定の意図を実際に知る必要がなく、br}違反を実施することができる。
2014年6月25日、監察長室(OIG)は、血液サンプルを採取、処理、包装するために、紹介医と医師団体に実験室費用を支払うことを懸念する特別詐欺警報を発表した。具体的には、OIGは、連邦医療保険によってカバーされ、精算されたサービス、または商業合理性を有さない、または公平な市場価値を超えるサービスを実験室が医師に支払う場合、このような手配がAKSに関連する可能性があることを懸念しており、これらは、医師のbr}をこのような実験室に検査を発注させるためである。実験室の選択と実験室検査の注文の決定は医師によって行われるか、または医師の強い影響を受けるが、患者の意見は少ないか、あるいは全く影響がないため、このような支払いは、医師が医学に必要なよりも多くの実験室検査 を注文することを招く可能性があり、特に支払いが医師によって生成された業務量または価値と一緒にバンドルされているとき、または考慮されている場合である。医師や病理医学団体とサンプル採取,輸送,処理に関するサービスの手配が適用法と一致しないことが発見されれば,刑事罰brや米国連邦や州医療保健計画から除外されるなどの重罰を受ける可能性がある。
私たちbrはまた、連邦医師の自己推薦禁止によって制限されており、この禁止は、一般にスタック法と呼ばれ、br}と実体との経済関係(実体との投資、所有権または補償関係を含む)を禁止する医師が、例外が適用されない限り、臨床実験室サービスを含む指定された医療サービスを得ることを推奨するbr連邦医療保険患者。同様に、エンティティは、トラフィック禁止に従って提供されるサービスの料金をMedicareまたは任意の他の当事者に課金してはならない。また,虚偽請求法については,政府 は,“スタッカー法”違反による物品やサービスを含むクレームが虚偽または詐欺的クレーム を構成していると断言できる.
“虚偽請求法案”を含む連邦民事および刑事虚偽クレーム法律は、他の事項に加えて、誰もが知っている場合に連邦政府に虚偽クレームを提出するか、または連邦政府に虚偽クレームを提出させるか、または連邦政府が支払う虚偽または詐欺的クレームを得るために虚偽陳述を行うか、またはそれを引き起こすことを禁止する。クレームは、米国政府に提出された金銭または財産に対する“任意の要求または要求” を含む。また,虚偽クレーム法律については,政府はAKSやスターク法違反による物品やサービスへのクレームが虚偽または詐欺的クレームを構成していると断言することができる。民間(Br)はまた、政府の名義でこれらの虚偽クレーム法律に基づいて訴訟を提起し、政府に提出または支払いされた虚偽および詐欺的クレーム(または他の法規違反行為)を告発し、エンティティが罰金または和解において政府に支払う任意の金額を共有する能力がある。このような訴訟はQui Tam Actionsと呼ばれ,医療業界では非常に一般的である。
HIPAAはまた、br詐欺の任意の医療福祉計画(プライベート第三者支払者を含む)の計画を知りながら故意に実行または実行しようとする連邦刑法を制定し、brを故意に偽造、隠蔽し、または重大な事実を隠蔽し、または医療福祉、プロジェクトまたはサービスの提供に関連する任意の重大な虚偽、架空、または詐欺的な陳述を行うことを禁止している。AKSと同様に,個人や実体は法規や法規違反の具体的な意図を実際に知る必要がなく違反を実施することができる.
| -24- |
さらに、連邦民事罰金法規によれば、誰も、共同支払いの免除および控除可能な金額(またはその任意の部分)を含む任意の報酬を連邦医療保険または医療補助受益者に提供または移転してはならず、この人は、その報酬が、受益者の連邦医療保険または医療補助対応プロジェクトまたはサービスの特定の提供者、従事者またはサプライヤーの選択に影響を与える可能性があることを知っているべきである。また、場合によっては、AKSや民事虚偽請求法案によれば、MedicareとMedicaid受益者の共同支払いや免責額を放棄することが多い提供者も責任を問われる可能性がある。禁止の法定例外の1つは、財務需要の個人化決定に基づくか、または一般的な公事、宣伝されていない賠償免除額、または控除可能な金額ではなく、合理的な収集努力に基づく枯渇である。しかし、OIGは、この例外は、特定の患者の特殊な経済的需要を満たすためにたまにのみ使用されるべきであると強調している。この禁止は連邦医療計画の受益者にのみ適用されるが、商業支払者が患者に提供する共同支払いおよび無料額の定例免除は、不正な詐欺計画、高すぎるサービス費用、患者契約への侵害介入、および成文法または一般法詐欺に関連する適用州法 に関連する可能性がある。もし我々の患者援助計画が適用法と一致しないことが発見された場合,我々 はそのような計画の再構成や中止,あるいは他の重大な処罰を受けることが要求される可能性がある。
“医師支払い陽光法案”によると、2022年から、いくつかのデバイス、薬物、およびバイオ製品の製造業者は、(場合によっては、彼らの流通業者)医師(医師、歯科医、検眼師、足科医および脊椎マッサージ師を含むと定義される)、いくつかの他の医療提供者および教育病院によって支払われるいくつかのお金および移転の価値、ならびに医師(法規の定義に基づいて)およびその直系親族が所有する所有権およびbr投資権益をCMSに報告しなければならない。我々は我々自身の実験室で開発したテストやLDTを生産する予定であり,我々自身の実験室でのみ使用するか,我々自身の実験室で使用することを計画しているため,我々は現在brなどの報告要求を免除していると考えられる.しかし、私たちの規制機関(主に連邦政府)が私たちの決意に同意する保証はありません。私たちがこれらの法律法規に違反していると認定したり、可能な違反によって調査を受けていることを公開したりすることは、私たちの業務、見通し、運営結果、または財務状況に悪影響を及ぼすかもしれません。
私たちが運営を計画しているいくつかの州もまた、上述したような詐欺と乱用法を採用した。これらの法律の範囲と解釈は州によって異なり、州裁判所と監督機関によって実行され、各州は広範な自由裁量権を持っている。一部の州詐欺や乱用法律は、連邦が援助した医療計画によって精算されたプロジェクトやサービスだけではなく、患者や商業保険会社を含む任意の支払人の精算項目やサービスに適用される。
私たちのいくつかの業務活動は1つ以上のこのような法律の挑戦を受けるかもしれない。結果にかかわらず、このような挑戦は、私たちの業務、ビジネス関係、名声、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。有効なコンプライアンス計画は,これらのbr法違反により調査·起訴されるリスクを低減することができるにもかかわらず,これらのリスクを完全に解消することはできない。私たちのこれらの法律違反に対するいかなる行為も、私たちがそれを防御することに成功しても、私たちに巨額の法的費用を発生させ、私たちの経営陣の業務運営に対する関心を移す可能性があります。また、これらの法律の遵守を実現し、維持することはコストが高いことが証明される可能性があります。
私たちまたは私たちの業務が上記の任意の法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは、行政、民事および/または刑事罰、損害賠償、罰金、返還、br個人監禁、米国連邦または州医療計画(米国内のMedicareおよびMedicaidおよび米国以外の同様の計画のような)に参加することから除外され、これらの法律違反に関する疑惑を解決し、私たちの業務を削減または再構築することを含む重大な処罰を受ける可能性があります。いずれも我々の業務運営能力や財務業績に実質的な悪影響を及ぼす可能性がある。もし私たちの任意の検査製品が海外で販売されている場合、私たちは同様の外国の法律法規によって制限されるかもしれません。例えば、brの安全監視、詐欺防止、および法律の乱用、および会社のコンプライアンス計画の実施および医療保健専門家に価値支払いまたは移転を報告することを含む可能性があります。例えば、EUまたはEUの多くの加盟国は、特に医療専門家および組織のための医療機器(体外診断医療機器を含む)のビジネス実践をさらに制限する具体的な反贈与法規を採択している。
さらに、最近、医療専門家または実体に提供される支払いおよび価値移転の規制を強化する傾向がある。また、多くのEU加盟国は、米国の医療機器メーカーに対する要求と同様に、報告および透明性に (通常年1回)を要求する国“陽光法案”を採択している。
| -25- |
私たちの製品と運営はアメリカと海外で広範な政府の監督と監督を受けています。もし私たちが適用された要求を守らなければ、私たちの業務を損なうかもしれません。
私たちの候補製品は体外テストで、アメリカや他の管轄区域では医療機器として規制することができます。適用時、FDAと外国監督機関は他の事項以外に、医療機器を監督する:設計、開発と製造、テスト、ラベル、使用と貯蔵説明の内容と言語;臨床試験(適用範囲内で、臨床試験はEUの臨床調査の概念を含む);製品安全、機関登録と設備発売、マーケティング、販売と流通、発売前の整理、分類、承認と認証、記録保存プログラム、広告と販売促進、リコールと現場安全是正措置。発売後のモニタリングは、死亡或いは重傷と故障を報告することを含み、再び発生すれば、死亡或いは重傷を招く可能性がある;発売後の研究;及び製品の輸出入を含む。
私たちが守らなければならない規制は複雑で、時間が経つにつれてもっと厳しくなるかもしれない。法規の変化は私たちの業務を継続または拡大する能力が制限され、予想コストより高いか、あるいは予想売上を下回る可能性があります。FDA及びその外国の同業者は定期抜き打ち検査などの方式でその監督管理要求を実行した。私たちは、私たちまたは私たちが使用している任意の契約製造業者またはサプライヤーが、将来の任意のFDAまたは外国検査でコンプライアンスが発見されるかどうかを知りません。適用された法規を遵守しないことは、私たちの製品を販売する能力を危険にさらし、例えば、警告状、罰金、禁止、民事処罰、流通の終了、製品のリコールまたは差し押さえ、製品の市場への販売の遅延、生産の完全または部分的な一時停止、将来のマーケティング許可または認証の拒否、現在のマーケティング許可および認証の撤回または一時停止、私たちの製品の販売を禁止することを引き起こす可能性があり、最も深刻な場合、刑事罰を受けるだろう。
EU加盟国で私たちの製品を販売するためには、EU体外診断医療機器指令(指令98/79/EC)またはIVDDの基本的な要件に適合しなければならない。これらの要求を守ることは私たちの製品にヨーロッパ適合性やCEマークを貼り付けることができる前提条件であり、これらのマークがなければ、私たちの製品はEUで販売したりマーケティングすることができません。EU市場に市場に投入されたすべての医療機器はIVDD添付ファイルIに規定された基本的な要求に適合しなければならず、体外診断医療機器の設計と製造は患者の臨床状況或いは安全 或いは使用者と他の人の安全と健康を危害しない必要がある。さらに、装置は、製造業者が予期する性能を達成し、適切な方法で設計、製造、および包装を行わなければならない。欧州委員会は医療機器に適用される様々な基準を採用した。設計や製造に関する統一的な基準もある。強制的ではないが,これらの基準 を遵守することは,基本的な要求を満たす最も単純な方法とみなされ,機器がこの基本的な要求を満たすという覆す可能な推定を作成しているからである.基本的な要求に適合していることを証明するためには,医療機器のタイプとその分類によって評価プログラムが必要である。一般的なルールとしては,体外診断医療機器とそのメーカーが基本的な要求に適合していることの証明は,製品の正常使用条件下での安全性や性能を支援する臨床データの評価などに基づいていなければならない。特指, 製造業者は、デバイスが通常の使用条件下でその予期される性能を達成したことを証明しなければならず、その予期される性能の利点を考慮した場合、既知および予測可能なリスクおよび任意の有害事象が最小限に低下し、許容可能であり、デバイス性能およびセキュリティに関するいかなる宣言も適切な証拠支持を有する。
(一般的な)体外診断医療機器に加えて,メーカーはその製品がIVDDの基本的な要求に適合していることを自ら宣言することができ,合格評価プログラムは機関の介入を通知する必要がある。通知機関はEU加盟国が指定した独立組織であり、設備が市場に投入される前にその適合性を評価する責任がある。被通知機関 は通常,製品の技術文書やメーカーの品質体系を審査·検査する(被通知機関は 関連協調基準を実施すると仮定した品質体系がこれらの要求を満たしていると仮定しなければならない).関連製品が関連する基本的な要求に適合していることが確認された場合,通知機関は合格証明書を発行し,メーカーはそれ自身の合格宣言の根拠とする.次いで、製造業者は、CEマークを装置に適用して、装置がEU全体にわたって市場に投入されることを可能にすることができる。
| -26- |
もし私たちが適用されるヨーロッパの法律と指示を遵守できなければ、私たちは引き続き私たちの製品にCEマークを貼ることができなくなり、これはEUでこれらの製品を販売することを阻止します。EUでは、EUと欧州経済圏(EEA)で販売または販売されている機器の適合性評価を行う通知機関に通知しなければならない。もし、私たちの品質システムの重大な変更や体外診断医療機器の重大な変更が計画されている場合、これらの変更は、IVDD添付ファイルIに規定されている基本的な要求の適合性に影響を与える可能性があり、あるいは、デバイスがCEフラグを取得した予想用途に大きな変化をもたらす可能性がある。通知機関はその後、計画中の変更を評価し、製品がIVDDに持続的に適合するかどうかを検証する。評価が有利である場合、通知機関は、IVDD添付ファイルに規定されている基本的な要件および品質体系要件に適合することを証明するために、新しい合格証明書または既存の証明書の付録を発行する。
上記のEU規則は一般に欧州経済圏に適用される(EU加盟国27カ国にノルウェー、リヒテンシュタイン、アイスランドを加えて構成される)。上記の要求を守らなくても、私たちがこの三つの国で私たちの製品を販売することを阻止します。
EUの医療機器に関する規制構造は変化しており、体外診断医療機器を管理する新しい法規は2022年5月26日に発効しており、これらの改正は私たちがEUとヨーロッパ経済区で業務を展開することを計画している方式に影響を与える可能性がある。
FDAはリスクに基づく方法で実験室開発に関するテストまたはLDTの実行裁量政策を修正する可能性があり、私たちのbrは広範な規制要求を受ける可能性があり、追加の臨床試験を要求される可能性があり、その後、米国で私たちの既存のテストを販売し続けることができ、または私たちが開発する可能性のある任意の他のテストを開始することができ、これは実行コストを増加させ、 または他の方法で私たちの業務を損なう可能性がある。
LDT は臨床用の体外テストであり、単一の実験室内で設計、製造と使用されている。LDT は医療機器に分類され、FDAは医療機器がその予期される用途に対して安全かつ有効であることを確保する法的権限を有するが、FDAは従来、法執行自由裁量権を行使し、LDTに関連する 上場前審査を含むいくつかの適用可能なFDA要求を実行していない。また,HHSは2020年8月に,FDAが通知やレビュールールの作成なしにLDTの発売前審査を要求することを要求しないと発表した。バイデン政府はまだ前回政府が2020年8月に発表したこの公告を廃止する肯定的な措置を取っていないが、この2020年の政策声明は衛生·公衆サービス部のウェブサイトには発表されていない。
FDAのLDTに対する規制の改正を提案する立法と行政提案は近年発表されており,brは随時新たな立法と行政提案を提出し続けることが予想される。FDAは、立法 を法律または法規として制定するか、または指導意見を発表する可能性があり、これは、私たちのLDTを継続的に提供すること、または米国で新しいLDTテストを開発および導入することを要求する新しいまたはより多くの規制要件をもたらす可能性がある。
例えば、FDAは、米国でLDTSとして販売されているテスト が追加の規制要求によって強制的に実行されるように、LDTSの現在の方法を修正することができる。近年,FDAはLDTに関する裁量権政策を修正する予定であることを示している.具体的には、FDAは2014年7月31日、LDTに関する法執行自由裁量政策をリスクに基づく方法で修正する意向を国会に通知した。2014年10月3日、FDAは“実験室開発テスト(LDTS)規制フレームワーク”、または“フレームワークガイドライン”、および“FDA通知と実験室開発テスト(LDTS)医療機器報告”と題する2つの指導文書草案を発表した。FDAは2016年11月にガイドラインの定稿 を停止し、LDTの適切な監督方法をさらに公開し、国会許可委員会 に立法解決策を制定する機会を与え、FDAは2017年1月にLDT規制可能な方法に関する討論文書 を発表した。
| -27- |
さらに、FDAと議会は過去10年間、LDTに対するFDAの法執行裁量政策を終了し、LDTに対して追加的な規制要求を提出するためのいくつかの提案を考慮した。例えば、国会は最近立法に力を入れ、すべての体外臨床試験のためのLDTおよび体外診断規制枠組みを作成し、この枠組みは既存の医療機器規制枠組みとは独立する。2021年6月、米国の衆議院議員は正式に有効法案(2021年の正確な先端IVCT発展法案を検証)を提出し、米国上院で同バージョンを提出した。現在の形で可決されれば、“有効法案”は新しい医療製品カテゴリーを作成し、それを医療機器から分離し、体外臨床試験、あるいはIVCTと呼び、このようなすべての製品をFDAの監督範囲に入れる。“有効法案”は、従来のLDTはIVCTとしてFDAによって規制され、すべてのIVCTは高リスクまたは低リスクに分類され、FDAの既存の医療機器がI、IIまたはIIIに分類されることとは異なることを想定しているようである。提案されているように、IVCTのリスク分類は、不正確な結果が患者または公衆健康のリスク ,テストが十分に理解されている程度および/またはその特徴がどれだけ良いかを含むいくつかの要因に依存する。この検出を使用した臨床状況、および他の検出の利用可能性および任意の緩和措置。リスク分類により,新たなIVCTや既存のIVCTの何らかの改正が発売前に審査される可能性がある。この法案には現在、立法公布前に商業化されたいくつかのテストが廃止されるという条項が含まれていることに注意されたい, いくつかの要求によって制約されている。 この有効法案や他の立法提案が国会で可決されるかどうか、あるいは総裁が署名して法律になるかどうかは不明である。
FDAが裁量権を実行する政策を修正しない場合であっても、将来的に発売前審査およびその後のマーケティング許可を要求することを含む重大な規制要件を実施する可能性がある。私たちはまた、私たちが計画した製品発表を支援するために臨床研究を行う必要があるかもしれない。このような臨床試験を要求すれば,臨床試験の開始や完成を遅らせることは,われわれの試験開発コストを著しく増加させ,任意の製品の商業化を遅らせる可能性がある。
もし私たちの製品が必要な国際規制登録やマーケティング許可または認証を取得し、維持していない場合、私たちはアメリカ以外の地域でこのような製品をマーケティングして販売することができません。
私たちの製品のアメリカ以外での販売は引き続き外国の規制要求に制約されます。これらの要求は国/地域によって異なります。また,FDAは米国からの医療機器輸出を規制している。一部の国の法規は、私たちの製品のマーケティングや販売に大きな障害を設定しないか、または規制機関または第三者に通知することだけを要求する可能性がありますが、他の国/地域の法規は、指定された規制機関から肯定的なマーケティング許可を得ることを要求しています。登録、マーケティング許可、または認証を含む外国法規要件を遵守することは、高価で時間がかかる可能性があり、私たちが製品を販売することを計画しているすべての国/地域で必要なマーケティング許可を得ることができない可能性があり、またはそれをタイムリーに行うことができない可能性があります。 他の国/地域が要求する場合、登録およびマーケティング許可を取得するのに要する時間は、FDAのマーケティング許可に要する時間よりも長くなる可能性があり、このような登録または許可の要件はFDAの要求と大きく異なる可能性があります。私たちは追加のマーケティング許可を申請して、修正された製品 を販売する必要があるかもしれません。さらに、私たちは、私たちが獲得した許可を維持するために必要な品質と安全基準 を満たし続けることができないかもしれない。特定の国/地域でのマーケティング許可を維持できなければ、適用可能なbr製品をその国/地域で販売することはできません。
FDAからの米国におけるマーケティング許可の取得は、他の国/地域の規制機関または通知機関が同様のマーケティング許可または認証を得ることを保証するものではなく、1つまたは複数の外国規制機関または通知機関の登録、マーケティング許可または認証は、他の国/地域の監督機関または通知機関またはFDAによる登録、マーケティング許可または認証を保証することができない。しかしながら、1つの国/地域で登録、マーケティング許可、または認証を得ることができなかったか、または遅延することは、他の国/地域の規制プロセスに悪影響を及ぼす可能性がある。
| -28- |
米国またはEUの立法または法規改革は、マーケティング許可または任意の候補製品の認証を得ることを困難にするかもしれないし、またはそのような許可を得た後に任意の候補製品 を製造、マーケティング、または流通させることで、コストも高くなるかもしれない。
国会は時々立法を起草し、提出することは、医療機器の規制を管理する法定条項を著しく変えるかもしれない。さらに、FDAは、その政策を変更し、他の法規を採用したり、既存の法規を改正したり、 または他の行動をとることができ、これは、将来開発中の私たちが米国で開発している製品のマーケティング許可を阻止または延期するか、またはマーケティング許可を得た任意の製品をタイムリーに修正する能力に影響を与える可能性がある。過去数年間、FDAは、その510(K)承認プロセスを改革することを提案し、これらの提案は、臨床データに対する要求およびより長い審査期間を増加させること、または製造業者がその製品に対して510(K)承認プロセス を使用することをより困難にすることを含む可能性がある。例えば,2018年11月,FDA関係者はFDAが取りたい手順を発表し,FDCA第510(K)節により上場前通知経路を近代化した である.他の事項に加えて,FDAは提案を計画し, はメーカが510(K)経路で比較的新しい述語を使用するように推進することを発表した.これらの提案は、510(K)の経路下で述語として使用されるいくつかの古いデバイスを除去するために潜在的に日没 を計画し、除去されたデバイスリストを潜在的に公表することを含み、その基礎は、10年以上の述語デバイスと実質的に等価であることが証明されている。これらの提案 はまだ最終的に決定または採択されていないが,FDAは国会と協力し,立法によってこれらの提案を実施する可能性がある。したがって、任意の提案を採用すれば、どの程度私たちに追加の規制要求を適用し、将来510(K)の許可を得る能力を遅らせることができ、コンプライアンスコストを増加させる可能性があるかどうかは不明である, 私たちが入手可能な任意のマーケティング許可を維持する能力を制限したり、他の方法で私たちの業務に負の影響を与える可能性のある競争を製造したりします。
最近、FDAは、“いくつかの広く理解されているデバイスタイプ”のための任意の“セキュリティおよび性能に基づく” 販売前審査経路を記載した改訂された最終ガイドラインを2019年9月に発表し、510(K)の許可経路の下で、そのようなデバイスがFDAによって確立された客観的なセキュリティおよび性能基準を満たすことを証明することによって、製造業者が許可中にその医療デバイスの安全性および性能を特定の予測デバイスと比較する必要がないようにする。FDAは、“セキュリティおよび性能に基づく”経路に適したデバイスタイプリスト を維持し、各デバイスタイプの性能基準を決定し、実行可能な場合に推奨される試験方法を決定するために、製品固有のガイダンスファイルを作成し続ける。FDAは、私たちと同様のデバイスカテゴリのための性能基準を確立する可能性があり、このような性能基準が確立されると、マーケティング許可を得る能力にどの程度影響を与えるか、または他の方法で私たちのトラフィックに悪影響を及ぼす可能性のある競争をもたらすかどうかは不明である。
さらに、FDAは、FDAの法規およびガイドラインを改正または再解釈することが多く、その方法は、私たちの業務および製品に大きな影響を与える可能性がある。任意の新しい法規、法規、または既存の法規の改正または再解釈は、追加コストを増加させたり、任意の候補製品の審査時間を延長したり、または、私たちが開発している任意の候補製品がマーケティング許可、製造、マーケティング、または流通を得ることをより困難にする可能性がある。私たちは法規、法規、法律解釈、または政策の変化がいつ、そして公布、公布、または通過が私たちの未来の業務にどのような影響を与える可能性があるかを決定することができない。他の事項に加えて、このような変更は、マーケティング許可を求める前に追加のテストを行うこと、製造方法のリコールを変更すること、当社の製品を交換または停止すること、または追加的な記録保存を行う必要がある場合があります。
FDAおよび他の規制機関の政策は変わる可能性があり、私たちが開発した任意の候補製品のマーケティング許可を阻止、制限、または延期するための追加の政府法規が公布されるかもしれない。もし私たちが既存の要求の変化や新しい要求や政策の採用に緩やかに適応できない場合、または私たちがコンプライアンスを維持できない場合、私たちのbrは法執行行動の影響を受ける可能性があり、私たちは利益を達成したり維持することができないかもしれない。
医療機器に関する連合の規制構造が変化している。2017年4月5日、医療機器の体外診断に関する欧州議会と欧州理事会の2017/746号条例が採択され、国民の健康と患者の安全をより良く保護するための近代的かつより強力なEU立法枠組みを構築するために、欧州委員会第2010/227/EU号決定、またはIVDRが廃止された。指令と異なり,IVDRは国家法に変換される必要がないため,異なる欧州市場間で解釈が一致しないリスクが低下している。
IVDRはリリースから5年後(2022年5月26日)に発効する。適用されると、他の事項を除いて、IVDRは:
| ● | 設備を市場に投入するルールを強化し、設備が発売された後に監視を強化する | |
| ● | 市場に投入された設備の品質、性能、安全に対するメーカーのフォロー責任を明確に規定する | |
| ● | 輸入業者と流通業者の義務と責任に関する明確な規定を制定する |
| -29- |
| ● | 新条例要求を遵守するすべての方面に最終的な責任を有する者を決定する義務があると規定されている | |
| ● | 唯一の識別コードを導入することによって、医療機器のサプライチェーン全体におけるエンドユーザー或いは患者の追跡可能性を高め、メーカーと監督機関がサプライチェーンを通じて特定の機器を追跡する能力を高め、安全リスクが発見された医療機器を迅速かつ効果的にリコールすることを促進する | |
| ● | 中央データベース(Eudame)を構築し、患者、医療保健専門家と公衆にEUの既存製品に関する全面的な情報を提供する | |
| ● | いくつかの高リスクデバイスを評価するルールを強化し、これらのデバイスは、市場に投入される前に専門家の追加検査を受ける必要がある可能性がある |
これらの 修正は私たちがヨーロッパ経済圏で業務を展開する方式に影響を与える可能性がある。
FDAや他の政府機関の世界的な健康懸念に影響を与える資金の変化や中断は、彼らの主要な指導者および他の人員の能力の採用と保留を阻害する可能性があり、あるいは他の方法で新しい医療機器製品の適時な開発、許可または商業化を阻止する可能性があり、これは私たちの業務に負の影響を与える可能性がある。
FDA、外国監督機関と通知機関の新製品販売を審査、許可と認証する能力は、政府予算と資金レベルを含む様々な要素の影響を受ける可能性がある;その採用と保留キー人員およびユーザー費用支払いを受ける能力;法律、法規と政策変化;およびFDAが通常の機能を履行する能力に影響を与える可能性がある。したがって、FDAの平均審査時間は近年変動している。また,研究開発活動を援助する他の政府機関の政府資金 は政治過程に支配されており,この過程は本質的に不安定で予測不可能である。FDAおよび他の機関の中断は、必要な政府機関の審査および/または上場許可を受けるのに必要な設備(体外診断を含む)を遅らせる可能性もあり、これは私たちの業務に悪影響を及ぼすだろう。例えば、過去数年間、米国政府は2018年12月22日から35日間を含めて何度も閉鎖されており、FDAのようないくつかの規制機関は、FDAのキー従業員を休暇させ、キー活動を停止しなければならない。
また、brは新冠肺炎疫病に対応するため、アメリカ食品薬品監督管理局は2020年3月10日に外国製造施設と製品の検査を延期する意向を発表し、2020年3月18日に国内製造施設の定例監督検査を一時的に延期すると発表した。その後、FDAは2020年7月10日、国内製造施設のある現場検査を再開し、リスクに基づく優先順位制度に従う意向を発表した。FDAは、このリスクに基づく評価システムを使用して、特定の地理的地域内で発生する可能性のある規制活動種別を決定し、重要な任務検査からすべての規制活動を回復することを意図している。他の監督管理機関は類似の制限或いは他の政策措置を取って新冠肺炎の大流行 に対応する可能性がある。政府が長期的に停止している場合、または世界的な健康問題がFDA、他の規制機関または通知機関が通常通り業務を展開したり、検査、審査、または他の規制活動を行ったりすることを阻止し続ける場合、FDAが私たちの規制提出を適時に審査し、処理する能力に顕著な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。
例えば,EUでは,通知機関がIVDRに基づいて製品やサービスを認証することを正式に指定しなければならない.これまでいくつかの通知機関しか指定されていなかったが、新冠肺炎の流行はそれらの指定過程を著しく緩和してきた。 IVDRの指定がなければ、通知機関はまだ新法規による認証装置を開始しない可能性がある。通知された機関はいくつかしかIVDR機関に指定されていないため,重い仕事量に直面しており,その審査時間も延長されている。この状況はEUとヨーロッパ経済圏で業務を展開する方法に影響を与えるかもしれません
| -30- |
米国の医療改革に関連したり、影響を与えたりする法令の変化を含めて、医療業界の変化に効果的に適応できなければ、私たちの業務は損なわれる可能性があります。
連邦、州と地方立法機関はよく立法を通じて、医療改革或いは医療保健業界に影響する関連法規を公布する。私たちは今後も政府が医療業界の監督と規制を強化していくと予想している。私たちはいかなる新しい医療立法や法規の最終的な内容、時間あるいは効果を予測することができず、今のところ潜在的な新しい法規や法規が私たちの業務に与える影響を推定することはできません。将来的に国会や州立法機関によって制定された立法または連邦または州規制機関によって公布された法規は、私たちの業務に悪影響を及ぼす可能性がある。
私たちは未来の臨床実験室操作を適用された法律に適合させることができず、重大な民事或いは刑事処罰を招く可能性がある
私たちは高度に規範化された環境で臨床実験室を運営し、その中にはbrを維持することがCLIA認証と国家臨床実験室許可要求を遵守することを含む。これらの要求を遵守できなかったことは、証明書または免許が取り消され、制限または取り消し、br行動の指導計画、現場監視、民事罰金、刑事制裁を含む一連の法執行行動を招く可能性がある。このような故障はまた深刻な否定的な宣伝を招く可能性がある。これらの結果のいずれも、私たちの運営を制限または完全に阻止し、私たちの財務業績に影響を与える可能性がある。
私たちの情報技術、ストレージシステム或いは臨床実験室設備の故障、セキュリティホール或いはイベントは私たちの運営と研究開発を著しく中断する可能性があります。
私たちの業務戦略を実行する能力は、私たちの情報技術またはITシステムの持続的かつ断続的な性能にある程度依存し、これらのシステムは、私たちが構築した臨床実験室と私たちの研究開発作業を含む私たちの運営をサポートします。私たちの業務の多くの側面は、機密および独自のbr業務情報を保持し、保存し、保存する必要があり、テスト注文を受信し、処理し、患者の健康記録を安全に保存し、私たちのテスト結果を提供します。私たち自身および顧客と従業員のデータの完全性と保護、私たちの業務に重要です。情報,セキュリティ,プライバシー,データ保護法を管理する規制環境 の要求が高まっており,発展し続けている.ITシステムは、電気通信またはネットワーク障害、ネットワーク攻撃(恐喝ソフトウェアを含む)および犯罪ハッカー、ハッカー活動家、国家支援からの侵入および他の攻撃、工業スパイおよび従業員の汚職、従業員のミスまたは不注意による侵入および事件、ならびに自然災害からの他の悪意のある人間行為を含む様々なソースからの損傷を受けやすい。さらに、ネットワークセキュリティおよびバックアップ措置がとられているにもかかわらず、我々のいくつかのサーバは、物理的または電子的な侵入、コンピュータウイルス および他の破壊的な問題に類似した悪意のあるコードの攻撃を受けやすい可能性がある。
近年,他社や政府機関で注目されているセキュリティホールや事件が増加しており,セキュリティ業界の専門家や政府関係者はハッカーやネットワーク攻撃が我々のような企業に対するリスクについて警告している.サイバー攻撃はより複雑で頻繁になっており、場合によっては重大な被害をもたらしている。コンピュータハッカーおよび他の人は、しばしば、技術製品、サービス、およびシステムの安全性を破壊し、従業員、顧客、または他の人に情報を漏洩させるか、または無意識にシステムまたはデータへのアクセス権限を提供することを詐欺的に誘導しようと試みる。私たちのほとんどの従業員は現在、オフィスで働いているのではなく、遠隔作業をしていますので、私たちはセキュリティホールや事件の影響を受けやすいかもしれません。私たちのサービス提供者は更に安全ホールと他の安全事件の影響を受けやすいかもしれないが、社交距離措置は従業員のオフィスで働く能力を制限し、新冠肺炎疫病に対抗する。
私たち は将来、私たちのITシステムやネットワークに対する未遂または成功したネットワーク攻撃に出会うかもしれない。これまで,我々は何の実質的なサイバー攻撃も経験していない.しかしながら、任意のセキュリティホールまたはイベントの影響または中断は、私たちのネットワークに危険を及ぼす可能性があり、その中に格納された情報(私たちの製品に関連するアルゴリズムを含む)は、許可されていない当事者によってアクセスされ、公開され、開示され、失われ、アクセスできない、または利用できない、破損され、または盗まれる可能性がある。私たちのITシステムに影響を与える可能性のある意外な問題、私たちのシステムへの不正アクセス、私たちのITシステムの中断または他のセキュリティホールに影響を与えることを防止するための予防措置を取っているにもかかわらず、任意の不正アクセス、紛失、アクセス不能、利用不可能、破損、盗難、または開示を防止し、私たちのbr能力を含む私たちの運営を混乱させる可能性もあります
| ● | テスト結果、請求書支払人または患者を提供するbrテストを処理する; | |
| ● | クレームと控訴を処理する |
| -31- |
| ● | Br顧客支援サービスを提供する; | |
| ● | 研究と開発活動を展開し | |
| ● | 会社の財務情報を収集し、処理し、準備する | |
| ● | 私たちのウェブサイトを通じて私たちのテストや他の患者や医療提供者の教育や外展に関する情報を提供します | |
| ● | そして私たちの業務を管理する行政面は、私たちの名声を損なう |
ITシステムまたはデータの任意のこのような違反、事件または他の被害、またはそのいずれかが発生したと考えられる場合、1996年の“健康保険携帯性および責任法案”(HIPAA)、同様の米国州データ保護法規、“カリフォルニア消費者プライバシー法案”(CCPA)、EU一般データ保護法規(GDPR)および他の法規を含む“カリフォルニア消費者プライバシー法案”(CCPA)、EU一般データ保護法規(GDPR)および他の法規を含む米国州データ保護法規、違反は、クレーム、クレーム、規制調査、および他の訴訟を招き、巨額の罰金を科す可能性がある。処罰、そして他の責任。セキュリティホールや他のセキュリティ関連イベントを検出して防止するためには、大きなコストを負担する必要があるかもしれません。さらに、サードパーティが取得した過去または将来のネットワーク攻撃または他のセキュリティホールまたはイベントに関する情報 は、わが社または私たちの株主に悪影響を与える方法に使用される可能性がある。
さらに、我々の運営をサポートする第三者サービスプロバイダおよび我々の独立した請負業者(CROを含む)、コンサルタント、協力者、br}およびサービスプロバイダは、システム中断および中断、ならびにbrの他の違反、イベント、または他の被害を受ける可能性があり、またはそれらが私たちのために処理または維持してくれるITシステムまたはデータに影響を与える可能性があり、これは、上記のいずれかの状況をもたらす可能性がある。私たちおよび第三者サービスプロバイダは、すべてのネットワーク攻撃または他のソースのセキュリティホールまたはイベントを予測または阻止するためのリソースまたは技術的成熟を有さない可能性があり、私たちまたは彼らは、ネットワーク攻撃およびデータを識別および応答する上で困難または遅延セキュリティホールおよびイベントに直面する可能性がある。さらに、米国、ヨーロッパ、および他の場所では、消費者、健康関連およびセキュリティ、プライバシーおよびデータ保護法の解釈および適用は、個人データの国際移転分野のような不確実で、互いに矛盾し、変化していることが多い。これらの異なる法律を遵守し、医療提供者や患者のデータ保護の面で変化していく期待を満たし、巨額のコストを発生させたり、私たちの業務に不利な方法で私たちの業務のやり方やコンプライアンスを変更することが要求される可能性があります。
私たち はネットワークセキュリティに関する事項、データ処理、またはデータセキュリティ責任のための保険証を維持しません。私たちの1つ以上の大口クレームに対する成功クレームは、私たちの財務状況、経営業績、名声を含む、私たちの業務に重大な悪影響を及ぼす可能性があります
私たちの経営陣、取締役会、大株主とTizianaの間の潜在的な利益衝突は、経営陣と投資家の間の利益の相違を招く可能性があります。
Tizianaのある取締役、管理者、重要株主も私たちの取締役、高級管理者、重要株主です。また、本文書の発表日まで、取締役会の多くのメンバーはTizianaにも関連する個人で構成されています。Tizianaは、2021年12月31日までの年度と2022年9月30日までの9ヶ月間、管理および行政サービスを含む特定のサービスを提供するために、それぞれ約12,434ドルおよび0ドルの現金費用 を受け取りました。私たちの株主とTizianaの最適な利益の間に利益衝突が生じる可能性があり、これらの利益は、今回発売された条項やTizianaが提供するサービスに関連している。このような紛争が私たちに有利な方法で解決されるか、または私たちの業務、運営、または経営結果に悪影響を与えないという保証はない。
| -32- |
私たちの経営陣の一部のメンバーは私たちの会社のためにフルタイムで働いていません。私たちのいくつかの上級管理者と取締役は利益の衝突があるかもしれません。
我々の幹部は,彼らが合理的で必要であると考えて我々の業務に時間を投入するが,我々の幹部 は我々に関連する活動以外の様々な活動に専門的な興味を持ち,我々の業務に最小限の時間 を投入する必要はない.私たちの首席財務官Keeren ShahもTizianaの財務役員を務めている。したがって、わが社とこれらの活動のうちの1つまたは複数との間の時間配分が衝突する可能性がある。私たちの取締役会と経営陣は、私たちの会社に対して彼らの受託責任を果たすことが予想されていますが、起こりうるいかなる利益衝突も私たちに有利な方法で解決される保証はありません。
私たちの業務運営に関するリスク
管理成長、従業員事務に関するリスク、および私たちの業務に関連する他のリスク
本募集説明書の発表日までに、私たちは4人のフルタイム従業員がいます。私たちの成熟に伴い、私たちは私たちの全職従業員の基礎を拡大し、更に多くの科学者、技術者とその他の熟練と経験豊富な人員を招聘することを望んでいる。私たちの経営陣は、不比例な注意を日常活動から移し、これらの成長活動を管理するために多くの時間を使用する必要があるかもしれません。私たちは私たちの業務の拡張を効果的に管理できないかもしれません。これは、私たちのインフラが弱く、操作が間違っていること、ビジネス機会を失うこと、従業員の流失、残りの従業員の生産性の低下を招く可能性があります。私たちの予想成長は大量の資本支出を必要とする可能性があり、財務資源を他のプロジェクトから分流し、例えば他の 製品や技術を開発することが可能である。経営陣が私たちの成長を効果的に管理できなければ、私たちの支出は予想よりも増加する可能性があり、 創造および/または収入を増加させる能力が低下する可能性があり、私たちは私たちの業務戦略を実施できないかもしれない。私たちの将来の財務業績および製品商業化と効果的な競争の能力は、将来の任意の成長を効果的に管理する能力にある程度依存するだろう。
キーパーソン側の挑戦を決定し、維持することは、私たちが効果的に業務を展開し、発展させる能力を弱めるかもしれない
競争の激しい医療機器業界における競争力は私たちが高い素質のbr管理と販売チームを誘致し、維持できるかどうかにかかっている。私たちは私たち自身のビジネスチームを募集し、私たちの既存の中央インフラチームを拡大するつもりです。私たちと合格人材を競争する多くの他の製薬会社や学術機関は、それよりも多くの財務や他の資源、異なるリスク状況、より長い業界の歴史を持っています。私たちは経済的に許容できる条件でこのような重要な人たちを引き付けたり維持することができないかもしれない。私たちはこれらのキーパーソンを引き付け、維持することができず、私たちの業務、将来性、財務状況、運営結果に重大な悪影響を及ぼすかもしれない。
私たちの経営陣、取締役会、科学コンサルタントの少数の重要な個人の専門知識と持続的なサービスに依存しています
私たちは、私たちの経営陣、役員、科学コンサルタントの中の少数の重要な個人の専門知識と経験に依存して、私たちの業務を発展させ、管理しています。彼らのサービスは保証されません。したがって、これらのキーパーソンの離脱は、私たちの運営、財務状況、私たちの業務戦略を実行する能力、および将来の見通しに悪影響を及ぼす可能性がある。
我々は,業界内で高いレベルの科学と技術専門知識を持つ者を含む適切な合格者の採用にある程度依存する予定である.私たちは十分な数の訓練された人員を見つけてその成長速度を満たすことができないかもしれません。これは計画通りに製品を開発する能力に影響を与えるかもしれません。
また、私たちが臨床前や臨床研究で失敗すれば、適切な合格者の採用と保留がより挑戦的になる可能性がある。私たちはキーパーソンやコンサルタントを失ったサービスを募集することができず、私たちの研究開発目標の進展や私たちの先行製品や他の製品の商業化を阻害する可能性があり、これは私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性があります。私たちは私たちの役員brと雇用協定を締結していません。彼らはいつでも自発的に私たちとの雇用関係を終わらせることができます。
| -33- |
私たちは製品責任クレームの対象になる可能性があります
関連する監督管理機関の上場許可を得ると、私たちは製品責任と関連する負の宣伝の固有のリスクに直面し、これは私たちの製品の臨床テストと製品販売の結果である。
対象者、患者、関連規制機関、製薬会社、br、および私たちの製品を使用またはマーケティングする任意の他の第三者は、私たちに刑事または民事訴訟を提起する可能性があります。このような製品責任クレームは、製造または設計欠陥、不注意、厳格な責任、保証違反、および製品固有の危険を警告できなかった疑いを含む可能性がある。
もし私たちが製品責任クレームを自己弁護することに成功できなければ、承認されれば、私たちは巨額の責任を負うか、私たちの製品の商業化を制限することが要求されるかもしれません。私たちがこのような製品責任クレームを自己弁護することに成功しても、大量の財務と管理資源が必要になるかもしれない。是非曲直や最終結果にかかわらず、製品責任クレームは次のようになる可能性がある
| ● | 大衆の否定的な見方のせいで、私たちの製品に対する需要は減少した | |
| ● | 私たちの名声を損なう | |
| ● | 臨床研究参加者の脱退や新しい研究参加者の募集は困難である | |
| ● | 規制当局が調査を開始した | |
| ● | 関連訴訟の弁護や和解の費用 | |
| ● | 管理職を移転する時間と私たちの資源 | |
| ● | 患者や研究者や被験者に豊かな金銭的報酬を与えます | |
| ● | 製品 リコール、撤回またはラベル付け、マーケティングまたは販売促進制限; | |
| ● | 製品販売収入損失 | |
| ● | 承認されれば、 は私たちのどんな製品も商業化できません。 |
私たちは私たちの現在と未来の業務運営をカバーするために、当業界の慣例的な保険レベルを維持しようとしているが、私たちに対するいかなるクレームも、裁判所の判決や和解の金額が私たちの保険範囲内にない、あるいは私たちの保険範囲を超えている可能性がある。私たちの保険リストにも様々な例外があります。私たちは製品責任クレームの影響を受けるかもしれませんが、私たちは保険範囲を持っていません。この場合、私たちは、裁判所が裁決した任意の金額、または和解協定で協議された、私たちの保険範囲を超えているか、または私たちの保険カバー範囲内にない任意の金額を支払わなければなりません。私たちは、これらの金額を支払うために十分な資本を得ることができないかもしれません。どのような判断も、私たちの業務、財務状況、経営結果、商業名声に悪影響を与え、私たちの製品の市場に悪影響を及ぼす可能性があります。
もし私たちまたは私たちのパートナー、許可者、および下請け業者が受け入れ可能なコストで適切な保険範囲を得ることができない場合、または損害賠償訴訟から私たち自身をいかなる方法でも保護することができない場合、これは私たちの製品のマーケティング に深刻な影響を与え、より広く言えば、私たちの業務、将来性、運営結果、または財務状況に不利である。
| -34- |
持続的な新冠肺炎の疫病と対応措置は私たちの業務運営の中断を招く可能性があり、これは私たちの業務、財務状況、経営業績とキャッシュフローに実質的な不利な影響を与える。
2019年12月、新冠肺炎を引き起こすコロナウイルス株SARS-CoV-2が武漢で浮上し、中国であることが報告された。2020年3月、世界保健機関は新冠肺炎疫病を全世界大流行と発表した。発見以来,SARS−CoV−2の新しい変種が次々と出現している。
また,我々は我々の業務や開発活動に深刻な影響を与える可能性のある他の中断に遭遇する可能性があり,brに限定されないが,我々のサプライヤーや他の第三者に圧力を与え,我々の臨床前開発候補製品と我々が開始予定の潜在的な将来の臨床試験の供給中断を招く可能性があり,我々が開始する任意の臨床試験の臨床登録の減少, および必要に応じて受け入れ可能な条件で資金を調達する能力(あれば)を含む。新冠肺炎疫病は引き続き全世界のサプライチェーンに影響を与え、サービス提供者、物流及び供給と製品の流動と可用性に中断をもたらした。私たちのbrの運営或いはサプライチェーンの中断は、政府の介入、旅行制限、検疫要求或いはその他の原因によっても、 は私たちが引き続き臨床試験、臨床前開発とその他の活動を行う能力にマイナスの影響を与え、私たちの製品の承認と収入を創造する能力を延期する可能性がある。
また、新冠肺炎の持続的な蔓延は、世界の資本市場の深刻な混乱と変動を招く可能性があり、これは私たちの資金コストを増加させ、資本市場に参入する能力に悪影響を及ぼす可能性がある。新冠肺炎の持続的な伝播は経済の減速や衰退を招く可能性があり、あるいは他の予測不可能な事件を引き起こす可能性があり、すべての状況は私たちの業務、経営業績、財務状況に悪影響を及ぼす可能性がある。
新冠肺炎疫病の最終影響は高度に不確定であり、変化が発生する可能性がある。新冠肺炎の私たちの業績への影響の程度は未来の事態の発展に依存し、これらの事態の発展は高度に不確定であり、出現する可能性のある新冠肺炎の重症度、ウイルスのいかなる新しい突然変異や変種の出現、疫病の持続時間、アメリカ、カナダ、インド、その他の国で実施されている旅行制限、アメリカ、カナダ、インド、その他の国の企業閉鎖や商業中断、世界各地(私たちの市場を含む)が取った行動に関する新しい情報を含む予測もできない。新冠肺炎を抑制する或いはその影響を治療する。著者らはまだ著者らの業務、著者らの臨床試験、著者らの臨床前開発仕事、医療保健システム或いは全世界経済全体による可能性の遅延或いは影響のすべての程度を不明である。しかし,これらの影響はわれわれの運営に実質的な影響を与える可能性があり,新冠肺炎の状況を注視していきたい。
市場と経済状況は私たちの業務、財務状況、株価にマイナスの影響を及ぼすかもしれない。
医療流行病、エネルギーコスト、地政学的問題、米国担保ローン市場と悪化しつつある不動産市場、不安定なグローバル信用市場と金融状況及び原油価格変動に対する懸念は、一定期間の経済の深刻な不安定、流動性と信用供給の減少、消費者の自信と自由支配可能な支出の低下、世界経済への期待が弱まり、世界経済の成長が鈍化し、失業率が上昇した。我々の全体的な業務戦略は、このような経済低迷(現在のインフレに関連する低迷とロシア-ウクライナ紛争を含む)、動揺したビジネス環境、および持続的な不安定または予測不可能な経済および市場状況の悪影響を受ける可能性がある。 これらの条件が悪化し続けるか改善されていなければ、必要な債務や株式融資をより困難にし、 コストが高く、希釈度が高くなる可能性がある。有利な条件で任意の必要な融資をタイムリーに得ることができなければ、我々の成長戦略、財務業績、株価に重大な悪影響を及ぼす可能性があり、開発や商業化計画の延期または放棄を要求する可能性がある。
臨床試験は高価で時間がかかるし、成功しないかもしれない。
臨床試験は高価で時間がかかるし、成功しないかもしれない。それらは、承認された診断技術を得るために必要な診断試験の安全性および有効性を決定するための診断試験の評価に関する。人体臨床試験における多くのテストと製品 は必要な安全性と有効性特徴を証明できない。我々のテストと候補製品が初期または後続の人工テストで を行うことに成功しても,それらは以降の開発段階で失敗する可能性がある.私たちは他の人を招いて、臨床研究組織と政府が援助する機関を含む私たちの臨床試験を行うかもしれない。これらの実験は,我々が予測したように開始または完了しないかもしれないし,予想された結果に達しない可能性がある.
| -35- |
私たちのbrは、臨床試験中または臨床試験の結果において、多くの予見不可能なイベントに遭遇する可能性があり、これらのイベントは、マーケティング許可を得ることを遅延または阻止するか、または私たちの診断技術を商業化することを含む
| ● | 規制機関または機関審査委員会は、私たちまたは私たちの調査員が予想される試験場所で臨床試験を開始または実施することを許可してはならない | |
| ● | 私たちのbrは、予想される試験地点で受け入れられる臨床試験契約または臨床試験案との合意に遅れたり、合意に達しなかったりする可能性がある | |
| ● | 臨床試験は否定的または不確定な結果をもたらす可能性があり、私たちは決定または監督機関が追加の臨床試験を行うことを要求するか、または製品とテスト開発計画を放棄することを要求するかもしれない | |
| ● | 臨床試験に必要な患者数は私たちが予想していたより多いかもしれません。これらの臨床試験の登録人数は私たちが予想していたより遅いかもしれません。あるいは参加者がこれらの臨床試験から退出する速度は私たちが予想していたよりも高いかもしれません | |
| ● | 私たちの第三者請負業者は、法規の要求を適時に遵守することができないか、または私たちに対する契約義務を履行できないかもしれません | |
| ● | 我々brは、参加者が受け入れられない健康リスクに曝露されていることを発見することを含む、様々な理由で臨床試験を一時停止または終了しなければならない可能性がある | |
| ● | 規制機関または機関審査委員会は、規制要件に適合していないこと、または参加者が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で臨床研究を一時停止または終了することを私たちまたは私たちの調査者に要求する可能性がある | |
| ● | 臨床試験のコストは予想以上に高いかもしれません | |
| ● | 規制機関 は、私たちの診断技術を承認する要求を修正するかもしれません、あるいはこれらの要求は私たちが予想しているのとは違うかもしれません。 |
もし私たちが現在予想している以上の追加の臨床試験または他の試験を行うことを要求された場合、もし私たちが臨床試験または他の試験を成功させることができなければ、これらの試験または試験の結果が陽性でないか、または軽度陽性である場合、または安全問題がある場合、私たちは:
| ● | 上場承認を得たときに遅延される | |
| ● | 市場の承認を得られず、これは私たちの生存能力を深刻に損なうだろう | |
| ● | 一部の国/地域では市場承認を得ているが、他の国/地域では得られない | |
| ● | 適応や患者集団の承認を得ていますこれらの適応や患者集団は私たちが意図したり望んでいるほど広くはありません | |
| ● | 重大な使用または配布制限またはセキュリティ警告を含むラベルの承認を得ること; | |
| ● | 追加の上場後のテスト要求を受ける | |
| ● | 市場の承認を得た後、 は診断テストを市場に投入する。 |
もし私たちが臨床テストやマーケティング承認の面で遅延に遭遇したら、私たちの製品とテスト開発コストは増加します。われわれのいかなる臨床前研究や臨床試験が計画通りに開始されるかどうか,再構成が必要かどうか,計画通りに完了するかどうか,あるいは全く知られていない。重大な臨床前または臨床試験遅延は、診断技術を商業化する独占的な権利を持つ私たちの任意の期限を短縮したり、私たちの競争相手が私たちよりも先に診断テストを市場に出すことを可能にして、診断技術を商業化することに成功する能力を弱化させ、私たちの業務と運営結果を損なう可能性があります。
| -36- |
特定の診断試験または候補製品の試験に成功した結果が生じなかった場合、試験または候補製品を商業化することはできないであろう。
私たち は広範な臨床テストを通じて、私たちの候補診断テストと候補製品の人体における安全性と有効性を証明しなければならない。私たちの研究と開発計画はまだ初期の発展段階にある。テスト中またはテスト中に、私たちは多くの予見不可能なbrイベントに遭遇する可能性があり、 以下を含む任意のテストまたは製品の商業化を遅延または阻止する可能性がある:
| ● | 臨床前研究のbr結果は決定的ではないかもしれない、あるいはそれらはヒトの臨床試験で得られる結果を代表しないかもしれない | |
| ● | 早期ヒト臨床試験で得られた安全性と有効性結果は、後の臨床試験で得られた結果を代表しないかもしれない | |
| ● | テスト結果を審査した後、私たちは以前有望と思われていたプロジェクトを放棄するかもしれない | |
| ● | 私たちまたは私たちの規制機関は、試験に参加した対象または患者が受け入れられない健康リスクに直面しているので、臨床試験を一時停止または終了する可能性がある | |
| ● | 我々のbrテストまたは候補製品は、予期される効果がない可能性があるか、または副作用または他の特徴を含む可能性があり、承認された場合、規制部門の承認を得ることができないか、またはその商業用途を制限することができない。 |
たとえ私たちの診断テストや候補製品が市場の承認を得ても、それらはbr医師、患者、第三者支払人、医学界の他の人に必要な市場受容度を得ることができない可能性があり、これは商業成功に必要である。
たとえ私たちの製品が市場の承認を得ても、それらは医者、患者、第三者支払人と医学界の他の人の十分な市場受容度を得ることができないかもしれない。もし私たちが相当な製品収入を作ることができなければ、私たちは利益を上げないかもしれない。もし私たちの製品とテストが商業販売に使用されることが許可されれば、市場の受け入れの程度は多くの要素に依存する
| ● | 代替試験または製品と比較して、それらの有効性、安全性、および他の潜在的利点 | |
| ● | 私たちは競争力のある価格でこれらの製品を売ることができます | |
| ● | 他の診断や治療法と比較して、それらの利便性と管理が簡便である | |
| ● | 対象患者群が新しい診断テストを試みたいかどうか、医師がこれらのテストを手配したいかどうか | |
| ● | 対象患者群が新たな療法を試みる意欲と,医師がこれらの治療法を処方する意欲 | |
| ● | マーケティングと流通支援の実力 | |
| ● | 政府機関と第三者医療保険を提供し、私たちの診断テストや製品に十分な精算候補を提供します | |
| ● | 私たちの診断テストまたは候補製品を他の診断方法または治療方法と共に使用するための任意の制限; | |
| ● | 私たちの診断テストまたは候補製品が他の薬剤と一緒に使用される任意のbr制限; | |
| ● | 私たちの診断テストを使用する場合、いくつかのタイプの患者は分析のために十分なサンプルを提供できない | |
| ● | いくつかのタイプの患者は私たちの診断テストを使用することができない。 |
もし私たちがこれらと似たような問題を解決して克服できなければ、私たちの業務と運営結果は深刻な損害を受ける可能性がある。
| -37- |
効果的な販売、マーケティング、および流通能力を確立することができない場合、またはそのような能力を有する第三者と合意できない場合、私たちの診断テストまたは候補製品が承認された場合、私たちはそれを商業化することに成功できないかもしれない。
私たちのbrは販売やマーケティングインフラがなく、販売、マーケティング、流通、私たちの診断テストや候補製品の販売では経験が限られています。マーケティング承認を得た任意の診断テストまたは候補製品をビジネスに成功させるためには、販売およびマーケティング機能を履行するために、直接、第三者と関係を確立し、維持する必要がある。
診断テストまたは候補製品を自ら商業化することを阻害する可能性がある要因は、
| ● | 十分な数の効果的な販売、技術的支援、マーケティングスタッフを募集し、訓練し、維持することはできません | |
| ● | 販売員は、私たちの診断テストまたは候補製品の利益に触れたり、医師を訓練したりすることができません | |
| ● | 販売者は補充診断テストまたは製品が不足しており、これは、より広範な診断テストまたは製品ラインを持つ会社と比較して競争的に不利になる可能性がある | |
| ● | 独立した販売、技術的支援、およびマーケティング組織の作成に関連する予測不可能なコストおよび費用; | |
| ● | 第三者支払者と政府機関から十分な保険と補償を受けることができない。 |
もし私たちが販売、マーケティング、流通能力を確立することに成功できなければ、私たち自身も第三者と協力しても、私たちの診断テストや候補製品の商業化に成功しないだろう。
もし私たちが提案した診断テストや候補製品の利点を医者に信じさせられない場合、私たちは市場受容度を確立しようとする時に遅延または追加費用が発生するかもしれない。
著者らが提案した診断テストと製品を広く使用するためには、病理実験室と医者に著者らが提案した診断テストと製品及び期待のメリットを理解させる必要があるかもしれない。この医師研修の流れを実行できないことは、私たちが提案した診断テストや製品の市場受容度に悪影響を及ぼす可能性がある。私たちは私たちが提案した診断テストまたは製品について医師に十分な数の訓練を提供して、私たちのマーケティング計画を達成したり、私たちの診断テストまたは製品の受け入れを実現することができないかもしれません。医者の教育方面のいかなる遅延も深刻な遅延あるいは私たちの診断テストや製品に対する需要を減少させる可能性がある。また,我々が提案した診断テストや製品に何らかの受容や需要が生じる前に,医師教育に多くの資金を投入する可能性がある。
私たち は激しい競争に直面しており、これは、他の人が私たちよりも競争相手の診断テストや製品 を発見、開発、または商業化することに成功する可能性がある。
新診断技術の開発と商業化競争は非常に激しい。私たちは競争に直面し、将来開発或いは商業化を求める可能性のある任意の診断技術の面で競争に直面し、世界各地からの大型診断と製薬会社、LDT実験室、より小さい診断と製薬会社及び生物技術会社を競争する。潜在的な競争相手 はまた学術機構、政府機構とその他の公共と個人研究組織を含み、それらは研究を展開し、特許保護を求め、そして研究、開発、製造と商業化の面で協力手配を確立する。
| -38- |
私たちと比較して、私たちが競争しているか、あるいは将来それと競争する可能性のある多くの会社は、研究開発、製造、臨床前テスト、臨床試験、規制承認およびマーケティング承認を得る診断テストまたは製品を含むより多くの財務資源、市場地位、専門知識を持っているか、または持っている可能性がある。br診断、製薬とバイオテクノロジー業界の合併と買収は、少数の競争相手の間により多くの資源集中をもたらす可能性がある。
小さな や他の早期会社も重要な競争相手となる可能性があり,特に大型 や成熟会社との連携により手配されている.これらの第三者は合格した科学、販売、マーケティングと管理人員を募集と維持し、臨床試験のために臨床試験サイトと患者登録を確立し、著者らの計画と相補的或いは必要な技術を獲得する方面で著者らと競争を展開する。
もし私たちの競争相手が私たちが開発する可能性のある任意の診断テストまたは製品よりも正確、便利、またはより安価な診断テストまたは製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失する可能性がある。私たちの競争相手はまた私たちよりも早くFDAや他の規制機関のその診断テストや製品の承認を得ることができ、これは私たちの競争相手により強力な市場地位を確立させるかもしれない。また、私たちの競争能力は、多くの場合、保険会社や他の第三者支払人の影響を受ける可能性があります。
私たち は私たちの目標市場で競争できないかもしれません。これは私たちの創造能力を弱化させ、私たちの運営結果に実質的な悪影響を与える可能性があります。
もし私たちが提案した診断テストや製品のユーザーが第三者支払者や政府機関から十分な精算を受けることができない場合、あるいは新しい制限法規を採用すれば、市場の私たちが提案するテストや製品に対する受容度が制限される可能性があり、私たちは収入を実現できないかもしれない。
政府および保険会社、医療機関(“HMO”)および医療コストの他の支払いが人為的にコストをコントロールまたは低減するための持続的な努力は、私たちの将来の収入および収益性、ならびに私たちの潜在的な顧客、サプライヤー、およびパートナーの将来の収入および収益性、ならびに資金の利用可能性に影響を与える可能性がある。例えば、いくつかの国際市場では、診断テストおよび製品の価格設定や収益力は政府によって規制されている。米国では,最近連邦と州政府が医療総コストの低減を目指していることから,米国議会と州立法機関は医療改革,医療機器,検査·処方薬のコスト,連邦医療保険と医療補助br改革に注目し続けている可能性がある。このような立法や規制提案が採用されるかどうかは予測できませんが、そのような提案を発表したり採択したりすることは、私たちの業務、財務状況、運営結果に大きな被害を与える可能性があります。
私たちが提案する検査や製品を商業化する能力は、政府当局、個人健康保険会社、その他の組織(例えば、医療機関)が私たちの検査や製品費用の適切な精算レベルをどの程度獲得するかにある程度依存するだろう。政府機関と第三者支払者は、医療テスト、薬品、サービスの料金に対してますます多くの挑戦を提出している。また、米国の管理型医療保健の傾向、医療機関などの組織の同時増加(これらの組織は医療サービス、診断、薬品の購入に著しく影響する可能性がある)、医療保健を改革したり、政府の保険計画を減少させる立法提案は、私たちのテストや製品価格がより低くなったり、拒否されたりする可能性がある。
当社の従業員、独立請負業者、コンサルタント、ビジネスパートナー、およびサプライヤーは、規制基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります。
私たちの業務運営および調査者、医療専門家、コンサルタント、第三者支払人と顧客との現在および未来との関係は、連邦および州医療詐欺および乱用法律、虚偽クレーム法律、健康プライバシーおよび安全法律、および他の医療法律法規の制約を直接または間接的に受けるだろう。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。私たちは、従業員、独立請負業者、コンサルタント、ビジネスパートナー、サプライヤー、代理が私たちまたは私たちの付属会社を代表して従業員詐欺または他の不正活動を行うリスクに直面しています。これらの当事者の不正行為は、FDAまたは外国衛生当局の規定を遵守できなかった、FDAまたは外国衛生当局に真実、完全かつ正確な情報を提供すること、私たちが制定した製造基準を遵守すること、米国の医療詐欺および乱用法律および同様の外国詐欺的不正行為法律を遵守すること、または財務情報またはデータを正確に報告すること、または許可されていない活動を私たちに開示することができない故意、無謀、および/または不注意な行為を含む可能性がある。
| -39- |
私たちが提案するテストと製品の市場競争は激しく迅速で、他人によって開発される可能性のある新しい診断技術 は、私たちが業務を維持·発展させ、競争力を維持する能力を弱める可能性がある。
診断産業は迅速で実質的な技術変化の影響を受けている。他の人たちの発展は私たちが提案したテストや製品を競争力を失ったり時代遅れにしたり、あるいは私たちが技術発展や他の市場要素のペースについていけないかもしれない。診断,製薬,バイオテクノロジー会社,大学,政府実体,その他の多様化からこの分野に進出するbrの技術競争は非常に激しく,さらに増加することが予想される。
私たちの資源は限られており、私たちはこのような技術固有の技術的挑戦に直面するかもしれない。ライバルはすでに 競争基盤や将来競争基盤となる可能性のある技術を開発している.いくつかの技術は、我々が提案する試験または製品と比較して、同様の診断効果を達成するために、完全に異なる方法または方法を有する可能性がある。我々の競争相手は,我々が提案したテストや製品よりも効率的あるいはコストの低い診断技術を開発する可能性があるため, は深刻な競争脅威となる.
私たちの代替品である診断テストは広く受け入れられるかもしれませんが、これは私たちが提案したテストや製品に対する市場の受け入れ度を制限する可能性があり、商業化されていてもそうです。私たちの多くの標的疾患と状況はまた他のテストで発見されたり、他の薬物で治療されることができる。これらのテストと治療は医学界に広く受け入れられる可能性があり、より長い使用歴史がある。これらの競争技術の既定の使用は、私たちの技術、調合、テスト、製品が商業化後に広く受け入れられる可能性を制限するかもしれない。
我々の第三者への依存に関するリスク
私たちは依存し、引き続き第三者に依存して私たちの臨床前研究と臨床試験を行うことが予想される。これらの第三者 がその契約義務の履行に成功しなかった場合、または予期された期限内に完了できなかった場合、規制部門の候補製品の承認を得ることができないか、または商業化することができない可能性がある。
我々の臨床前研究と臨床試験を行い、私たちが行っている臨床前と臨床計画のモニタリングと管理データを含む独立した臨床研究者と第三者契約研究機関(“CRO”)を含む第三者に依存し、計画してきた。これらの第三者と接触する際には、通常、予算や契約について交渉しなければならず、予算や契約について交渉しなければならないことが予想され、開発スケジュールが遅延し、コストが増加する可能性がある。また,我々の業務目標を達成するために必要な専門知識を専門的に持っている適格第三者サービスプロバイダの数は限られているため,代替調査者やCROを見つけることが困難であったり,合理的なビジネス条項でそうすることは困難である可能性がある.著者らはこれらの方に依存して著者らの臨床前研究と臨床試験を実行し、そしてその活動のいくつかの方面のみを制御する。しかし,我々のすべての臨床前研究と臨床試験が適用されたbr案や法律,法規,科学基準に基づいて行われていることを確実にする責任があり,これらの第三者への依存は規制責任を解除しない。私たちと私たちの第三者請負業者およびCROは、FDA、欧州経済圏加盟国の主管当局および同様の外国規制機関によって、私たちの臨床開発におけるすべての候補製品に対して実行される法規およびガイドラインである良好な臨床実践(‘GCP’) 要件を遵守しなければならない。規制機関は、定期検査試験発起人によってこれらのGCP要求を実行する, 主な研究者と臨床試験地点。もし私たちの任意のCROを十分に監視できなかった場合、または私たちまたは私たちの任意のCROが適用されたGCP要求を遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDA、EMAまたは他の規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。私たちまたは私たちのCROまたは私たちの臨床試験に関連するサービスを提供する他の第三者に対して規制検査を行った後、監督機関は私たちの任意の臨床試験がGCP規定に適合していることを確認することは保証できません。また,われわれの臨床試験は適用されたcGMP法規により生産された製品を用いて行わなければならない。私たちがこれらの規定を守らないには、私たちが臨床試験を繰り返す必要があるかもしれません。これは規制承認過程を遅延させます。
| -40- |
また,これらの研究者やCROは我々の従業員ではなく,契約を除いて,我々の候補製品や臨床試験に投入される資源数を時間を含めて制御することはできない。もし独立調査者やCROが私たちの候補製品を開発するのに十分な資源を投入できなかった場合、あるいは彼らの表現が目標に達していない場合、私たちの候補製品の承認と商業化の将来性を延期または影響する可能性がある。これらの調査者やCROはまた,我々の競争相手を含む他の商業実体と関係がある可能性があり,彼らはまたこれらの実体のための臨床研究や他の製品開発活動を行っている可能性があり,これは我々を代表する表現に影響を与える可能性がある。さらに、第三者サービスプロバイダを使用して、当社の固有情報をこれらの当事者に開示することを要求し、これは、競合他社がこれらの情報を発見するか、または盗用または開示されるリスクを増加させる。
もし私たちがこれらの第三者CROとの任意の関係が終了すれば、私たちはCROまたは の代わりに商業的に合理的な条項で合意できないかもしれない。CROがその契約責任または義務を成功裏に履行できなかった場合、または予期された締め切り内に完了できなかった場合、CROがCROを交換する必要がある場合、またはCROによって得られた臨床データの品質または正確性が、我々の臨床方案、法規要件または他の理由を遵守できなかったために影響を受ける場合、私たちの臨床試験は延長、遅延または終了される可能性があり、私たちは規制部門の私たちの候補製品の承認を得ることができないか、または商業化に成功する可能性がある。したがって、私たちの運営結果とビジネスの見通しが損なわれ、私たちのコストが増加する可能性があり、私たちの収益能力が延期される可能性がある。
臨床試験を繰り返すか、あるいは他のCROを採用することは追加のコストに関連し、私たちの管理層の時間と労力を必要とする。また、臨床試験は繰り返したり、新しいCROが仕事を開始する時に自然な過渡期がなければならない。したがって,遅延が生じる可能性があり,必要な臨床開発スケジュールを満たす能力に大きな影響を与える可能性がある。
私たちは製品開発コストを協力または分担するための第三者パートナーを見つけることができず、私たちの業務、財務状況、運営結果に深刻な損害を与える可能性があります。
私たちの候補独自製品開発および商業化戦略には、第三者との連携手配 を実行することが含まれている場合があります。将来の協力者は、彼らが適用する仕事と資源を決定する上で大きな自由裁量があり、 は予想通りに彼らの義務を履行できないかもしれない。潜在的な第三者パートナーには、バイオ製薬、製薬、バイオテクノロジー会社、学術機関、および他の実体が含まれる。第三者協力者は以下のような点で私たちを助けてくれるかもしれない
| ● | 研究、臨床前開発、臨床試験、製造を援助する | |
| ● | 規制部門の承認を求めています | |
| ● | 任意の未来の候補製品を商業化することに成功した。 |
もし私たちが協力プロトコルを作ることができなければ、私たちは自費で製品開発と商業化を行う必要があるかもしれない。このような約束は、私たちが開発できる候補製品の数を制限し、私たちの資本要求を著しく増加させ、私たちの内部資源に追加的な圧力をもたらすかもしれない。私たちがこれ以上協力できなかったことは、私たちの業務、財務状況、運営結果に実質的な損害を与える可能性があります。
さらに、許可、協力、および第三者との他の合意への私たちの依存は、私たちを多くのリスクに直面させるかもしれない。これらの 合意の条項は私たちに不利かもしれませんし、候補製品のいくつかの権利を放棄することを要求するかもしれません。 もし私たちが特定の分野で1人の協力者だけと協力することに同意すれば、私たちが他のエンティティと協力する機会は を減少させるかもしれません。潜在的な新しいパートナーとの長い交渉は、候補製品の研究、開発または商業化の遅延 を招く可能性がある。もし私たちの協力者が代替技術を採用することを決定した場合、あるいは私たちの協力者が私たちから権利を獲得した任意の候補製品の開発に成功しなかった場合、またはそれを商業化することは、私たちの業務、財務状況、および運営結果に深刻な損害を与える可能性がある。
| -41- |
我々の候補製品の商業化に関するリスク
私たちがすべての臨床前研究と臨床試験を成功させたとしても、私たちは私たちの1つまたは複数の候補製品の商業化に成功できないかもしれない。
たとえ著者らが必要な臨床前研究と臨床試験を完成しても、マーケティング審査の流れは高価で、時間と不確定であり、私たちが一部或いはすべての候補製品の商業化審査を獲得することを阻止するかもしれない。もし私たちが必要な規制承認を得ることができない場合、あるいは必要な規制承認を遅延させると、私たちの製品br候補製品を商業化することができなくなり、私たちの収益能力は深刻な影響を受けるだろう。
私たちの候補製品とその開発と商業化に関連する活動は、設計、テスト、製造、安全性、有効性、記録保存、ラベル、貯蔵、承認、広告、販売促進、販売と流通、輸出と輸入を含み、すべてアメリカFDAと他の規制機関、およびアメリカ以外のEMAと類似の規制機関によって全面的に規制されている。 候補製品のマーケティング承認を得られなかったことは、この候補製品の商業化を阻止するだろう。私たちはまだアメリカや他の任意の司法管轄区で私たちの任意の候補製品の申請を提出したり、マーケティングの許可を得ていません。
我々 は,市場承認を得るために必要な申請の提出と支援に関する経験が限られており,第三者 臨床研究組織や他の第三者コンサルタントやサプライヤーに依存してこの過程を完成させることが予想される。上場承認を得るためには,候補製品の安全性と有効性を決定するために,広範な臨床前と臨床データおよび適応ごとの支持情報 を監督機関に提出する必要がある。上場承認を得るためには、薬品製造過程に関する情報を監督機関に提出し、監督管理機関が生産施設を検査する必要がある。
米国や海外でマーケティング承認を得るプロセス はコストが高く,承認されれば数年 を要する可能性があり,関連する候補製品のタイプ,複雑性,新規性 を含む様々な要因によって大きく変化する可能性がある.開発期間中の上場承認政策の変更、追加法規または法規の変更または公布、または各提出された薬品申請の監督審査の変更は、申請の承認または拒否の遅延を招く可能性がある。監督管理機関は審査過程中にかなりの自由裁量権を持っており、いかなる申請を受け入れることを拒否することができ、また私たちのデータが承認を得るのに十分ではないことを決定することができ、追加の臨床前、臨床或いはその他の研究を行う必要がある。また,臨床前研究と臨床試験から得られたデータを異なるbr解釈を行うと候補製品の上場承認が遅延,制限あるいは阻止される可能性がある。私たちが最終的に得たどの上場承認も限られているかもしれないし、制限されたり、承認された後に約束された制約を受けたりして、承認された薬物が商業的に不可能になる可能性がある。
私たちの普通株と今回の発行に関するリスク
しかも、普通株の発行は希釈効果をもたらす可能性がある。
私たちは融資や他の目的のために、将来的により多くの株を発行することを求めるかもしれない。このような要約に参加または参加する資格がない株主は、我々における彼らの比例所有権および投票権権益が減少することを発見するであろう。また、このような売却価格は、今回発行された株式の公開発行価格または当時の市場価格よりも低い可能性がある。したがって、増発は普通株の市場価格に重大な悪影響を及ぼす可能性がある。
| -42- |
今回の発行で私たちの普通株を購入すれば、あなたの株の帳簿価値はすぐに大幅に希釈されます。
今回の発行で売却された普通株の公開発行価格は、今回の発行後の私たちの普通株の調整後の1株当たりの有形帳簿純価値を大きく上回ることになる。今回の発行で普通株を購入した投資家は1株当たり価格を支払い、この価格は今回の発行後に調整された1株当たりの有形帳簿純価値を大きく上回る。したがって,今回の発行で普通株を購入した投資家はただちに1株あたり$,または%を希釈し,仮定に基づく1株あたり$公開発行価格, OTCQBで報告されている我々の普通株の2022年の最終販売価格は,今回の発売発効後の我々の調整後の1株当たり有形帳簿純値と仮想公開発行価格との差額を表す.
このbr希釈は,我々の投資家が今回の発行前に株を購入したためであり,彼らが株を購入する際に支払う価格は,今回の発行で公衆に提供された価格よりもはるかに低いためである.未償還オプションを行使すれば、新投資家の権益をさらに希釈することになる。今回の発行で株を購入した投資家の持分が希釈されるため、我々が清算すれば、投資家が獲得した収益は今回の発行で支払われた購入価格を大きく下回る可能性がある。今回の発行後すぐに体験される希釈の詳細については、“希釈”というタイトルの部分を参照してください。
私たちは現在私たちの普通株に現金配当金を支払うつもりはありません。
私たちは予測可能な未来に、普通株が現金配当金を発行しないと予想している。私たちの配当政策はbr業務の経営業績と資本需要に基づいていますが、すべての収益(あれば)が残り、将来の業務拡張に資金を提供することが予想されます。
私たちの主要株主は会社に大量の株式を保有しており、これは、場合によっては重大な会社取引を承認することを含む、株主の承認を必要とするいくつかの事項において大きな影響力を持つ可能性があります
本願明細書の日付まで、Gabriele CerroneとPlanise Group Limited(Cerroneさんは同社の唯一の実益所有者)が所有する実益所有権は、我々が発行した普通株式の約33.77%を占めています。したがって、切竜さんは、特定の場合において重要な会社取引を承認することを含む、特定の株主の承認を必要とする事項に重大な影響を与えることができます。このような所有権集中はまた、当社が将来行う予定の任意の制御権変更を遅延または阻止する可能性がある。潜在的な新しい投資家が私たちに投資したくない場合、大量の株式が単一株主の手に集中することは不利だと考えているので、普通株の取引価格は不利な影響を受ける可能性がある。
私たちは“新興成長型会社”で、新興成長型会社に適用される開示要求が低下しています
我々は,米国証券取引委員会規則で定義されている“新興成長型会社”であり,(1)2025年の最終日まで新興成長型会社とし,(2)財政年度総収入が少なくとも10.7億ドルの財政年度の最終日,(3)米国証券取引委員会の規則により,“大型加速申告会社”の財政年度の最終日とみなされる これは,前年6月30日現在,我々非関連会社が保有する株式証券の時価が7億ドル を超え,(4)前3年の間に10億ドルを超える転換不能債券 を発行したことを意味する.私たちがまだ新興成長型企業である限り、私たちは、他の非新興成長型企業に適用される上場企業の特定の開示要求の免除に依存することを許可され、意図されている。これらの免除には
“サバンズ-オキシリー法”第404節の監査役認証要件の遵守が要求されていない
上場企業会計監督委員会(PCAOB)がすでに採用されているか、または採用される可能性のある強制ローテーション監査会社または補充監査師報告書が監査および財務諸表に関する補足情報を提供することに関する任意の要件を遵守することが要求されていない
| -43- |
要求された任意の監査されていない中期財務諸表を除いて、 は、本初期登録報告書に2年間の監査済み財務諸表しか提供できず、それに応じて“経営層の財務状況および経営結果の議論および分析”の開示を減少させる
役員報酬に関する開示義務を減少させ、
役員報酬または黄金パラシュート配置について拘束力のない相談投票の要求を求めることを免除する。
我々 は利用部分(ただしすべてではない)が利用可能な免除を選択する可能性がある.我々は,この登録宣言に減少した報告負担 を利用した.特に、私たちが新興成長型企業でなければ必要なすべての役員報酬情報は含まれていません。
また、雇用法案は、新興成長型会社が延長された過渡期を利用して新たなまたは改正された会計基準を遵守することができると規定している。これにより、新興成長型企業は、これらの基準が民間企業に適用されるまで、何らかの会計基準の採用を延期することを可能にする。私たちは、延長された過渡期 を利用して新たな会計基準を遵守するかどうかを検討している。“国際財務報告基準”は、新規または改正された会計基準を遵守する上で上場企業と民間会社を区別していないため、民間企業としての要件と上場企業としてのコンプライアンス要件は同じである。
もし私たちが適切な内部財務報告制御プログラムと手続きを維持できない場合、私たちは報告義務を履行できなくなり、私たちの財務諸表の再説明を招き、私たちの経営業績を損害し、私たちは監督審査とbr制裁を受け、投資家は私たちが報告した財務情報に自信を失い、私たちの普通株の市場価格にマイナス影響を与えるかもしれない。
効果的な内部統制は私たちが信頼できる財務報告書を提供し、詐欺を効果的に防止するために必要だ。私たちは財務報告の内部統制制度を維持し、それは私たちの主要行政人員と主要財務官あるいは類似の機能を実行する人員が設計または監督し、私たちの取締役会、管理層、その他の人員によって実施されるプログラムであり、公認された会計原則に基づいて財務報告の信頼性と外部目的の財務報告書の作成に合理的な保証を提供する。
上場企業として、私たちは財務報告書と内部統制の強化に高い要求を持っている。内部制御プログラムを記録してテストする必要があります“2002年サバンズ·オクスリ法案 ,経営陣には,我々の財務報告内部統制の有効性を年次評価することが求められている.効果的な内部統制を設計·実施する過程は継続的な努力であり、業務および経済·規制環境の変化を予測し、対応し、上場企業としての報告義務を満たすために十分な内部制御システムを維持するために大量の資源を費やすことが求められる。
私たちはあなたに保証することはできません。私たちは将来、財務報告の内部統制を改善する必要がある分野を決定します。 私たちはあなたに保証することはできません。私たちが取る救済措置が成功するかどうか、あるいは私たちは未来に成長を続けると同時に、 は私たちの財務プロセスと報告書を実施して十分な制御を維持します。もし私たちのbrが適切な内部財務報告制御プログラムとプログラムを確立できなければ、私たちは報告義務 を履行できなくなり、私たちの財務諸表の再記述を招き、私たちの経営業績を損害し、私たちは監督機関の審査と 制裁を受け、投資家は私たちが報告した財務情報に対して自信を失い、そして私たちの普通株の市場価格にマイナスの影響を与えるかもしれない。
| -44- |
私たちは財務報告書の内部統制に重大な欠陥があることを発見した。もし私たちがこのような重大な欠陥に対する救済措置が無効である場合、あるいは私たちが未来により多くの重大な欠陥を発見した場合、あるいは財務報告に対する有効な内部統制を確立し、維持することができなかった場合、私たちは適時に正確な財務諸表を作成したり、適用された法律と法規を遵守する能力が損なわれる可能性がある。
効果的な財務報告内部統制は、信頼できる財務報告を提供するために必要であり、それに加えて、詐欺を防止するための十分な開示制御および手続きが必要である。必要な新しいまたは改善された制御措置を実施できなかったか、または実施中に困難に遭遇した場合、私たちは私たちの報告義務を履行できない可能性がある。さらに、第404条に基づいて行われた任意のテスト、または私たちの独立公認会計士事務所がその後に行った任意のテストは、財務報告の内部統制に重大な弱点とみなされる欠陥があることが発見されるか、または、財務諸表の前向きまたはトレーサビリティの変更、またはさらなる関心または改善が必要な他の分野を決定する必要がある可能性がある。悪い内部統制はまたあなたが私たちが報告した財務情報に自信を失う可能性があります。
私たちの経営陣はこのような統制の有効性を毎年評価するように要求されるだろう。しかし、私たちが新興成長型会社である限り、私たちの独立公認会計士事務所は、第404条による財務報告書に対する内部統制の有効性を証明する必要はありません。私たちは5年もの間に新興成長型会社になるかもしれない。財務報告の内部統制の有効性を独立して評価している は,我々の経営陣の評価が発見されていない可能性のある問題を発見することができる。財務報告書の内部統制に発見されていない重大な欠陥が財務諸表の再記述を招く可能性があり、救済費用が発生することを要求します。
我々の経営陣は、2021年12月31日現在の財務報告内部統制の有効性を評価し、我々の財務報告内部統制に重大な欠陥があるため、我々の開示制御プログラムおよびプログラムは2021年12月31日現在で無効であると結論した。実質的な疲弊は会計資源の不足によるものだ。もし私たちがこの重大な弱点を正すことができなければ、 もし私たちが未来に重大な弱点に遭遇した場合、あるいは未来に有効な内部制御システムを維持できなければ、 私たちの財務状況や運営結果を正確かつタイムリーに報告できない可能性があり、これは投資家 が私たちの自信に悪影響を与え、私たちの普通株の価値に影響を与えるかもしれない。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
我々のbr開示制御および手順は、取引法に基づいて提出または提出された報告書において開示を要求する我々の情報が蓄積され、米国証券取引委員会規則および表に指定されたbr期間内に管理層、記録、処理、まとめおよび報告に伝達されることを合理的に保証することを目的としている。任意の開示制御およびプログラムまたは内部制御およびプログラムは、どんなにアイデアおよび動作が良好であっても、制御システムの目標が達成されることを保証するために、絶対的な保証ではなく、合理的な保証しか提供できないと信じている。これらの固有の制約には,意思決定過程における判断が誤っている可能性と,簡単な誤りや誤りにより故障する可能性があることがある.さらに、ある人の個人的な行動、2つ以上の個人が結託しているか、または許可されていないカバー制御は、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤った陳述や開示不足が発見されることなく発生する可能性がある.
将来の税法の変化はわが社に実質的な悪影響を与え、株主の純利益を減少させる可能性があります
最近公布されたアメリカ税法はアメリカ企業の連邦所得税を著しく変更し、アメリカ企業の所得税税率を下げ、利息減額を制限し、多くの業務減額と相殺を修正或いは廃止し(br}特定の稀な疾病薬物或いは一般的に“孤児薬物”と呼ばれる薬物テストで発生したいくつかの臨床試験費用の営業税控除を減少させ、地域税制の要素を採用して、一度の過渡税或いは送金税を徴収する。ある米国が所有する外国会社のすべての未分配収益と利益に対して、純営業損失を管理する規則と外国税収控除を管理する規則を改訂し、新しい反基地侵食条項を導入する。その中の多くの変更 は直ちに発効し、いかなる過渡期も必要とせず、既存の取引にも影響を与えない。この立法は多くの点で明確ではなく、財政部および国税局の潜在的な改正および技術修正、および法規の解釈および実施の影響を受ける可能性があり、いずれも立法のいくつかの悪影響を減少または増加させる可能性がある。また,これらの米国連邦所得税の変化が州や地方税にどのように影響するかは不明であり,州と地方税は通常連邦課税所得額 を州と地方税負債を計算する起点として使用する。また、税改正立法に関する技術的修正や他の立法提案もある可能性があり、その影響は予測できず、私たちまたは私たちの株主に不利になる可能性がある。
| -45- |
税金規制によるいくつかの変更は、1つまたは複数の報告期間内に私たちに悪影響を及ぼす可能性があるが、他の変更は将来的に有益である可能性がある。私たちは、最近の税務立法が全体として私たちに全面的な影響を与えることを決定するために、私たちの税務コンサルタントや監査人と協力し続けるつもりだ。
気候変動計画は私たちの業務、財務状況、そして運営結果に実質的な悪影響を及ぼすかもしれない。
温室効果ガス排出削減と炭素価格の決定により気候変動に対応する国内と国際立法 はいずれもエネルギーコストの増加と価格変動を招く可能性がある。国際社会は今、気候変動に対応する国際政策の枠組みを作ることにかなりの関心を持っている。消費者と企業はまたこのような懸念のために自分の行動を自ら変えるかもしれない。私たちは新しい法律法規と気候変動懸念による消費者と企業の選好に対応する必要があるだろう。私たちはコスト増加、資産価値の低下、そして運営プロセスの変化に直面するかもしれない。私たちの業務への影響は、炭素密集型活動への依存またはその中で演じる役割を含む特定の属性によって異なる可能性がある。
私たちの株の価格は変動するかもしれません。あなたは投資の全部または一部を失うかもしれません。
今回の発行後、私たちの普通株の取引価格は大きく変動する可能性があり、様々な要素の影響を受ける可能性があり、その中のいくつかの要素は取引量が限られていることを含む制御できない。これらの要素には、本“リスク要因”の部分および本募集説明書の他の部分的に議論された要因に加えて、以下のような要因が含まれる
| ● | 私たちの候補製品または競争相手の臨床試験と臨床前研究の開始、登録または結果 |
| ● | 私たちの他の開発計画のための臨床候補案の決定と推進に関するいかなる遅延も |
| ● | 将来の臨床試験での不良結果や遅延 |
| ● | 私たちは臨床試験を開始したり、既存の臨床試験を中止するのではなく、臨床試験を開始することにした |
| ● | 私たちの候補製品に対する規制部門の承認を得られなかったことを含む不利な規制決定 |
| ● | 承認された臨床試験要件を含むが、これらに限定されない、我々の候補製品に適用される法律または法規の変化 |
| ● | 我々のメーカーの不利な発展について ; |
| ● | 私たちはどんな承認された製品にも十分な製品供給を得ることができないし、受け入れ可能な価格で供給することができない |
| ● | 必要であれば、私たちは協力を作ることができません |
| ● | 私たちのbrが承認されれば、私たちの候補製品は商業化できません |
| ● | 重要な科学や管理職の増任や退職 |
| ● | 予想外のbrは、私たちの候補製品の使用に関連する深刻な安全問題; |
| -46- |
| ● | 私たちや競争相手が提供する新製品を紹介します |
| ● | 私たちまたは私たちの競争相手の重大な買収、戦略的パートナーシップ、合弁企業、または資本約束を発表する |
| ● | 私たちの成長能力を効果的に管理しています |
| ● | 四半期の経営業績の実際の変化や予想の変化 |
| ● | 私たちの現金状況; |
| ● | 私たちは投資界の推定と予測を達成できなかったか、あるいは他の方法で大衆に提供する可能性のある推定および予測を達成できなかった |
| ● | 私たちまたは私たちの業界に関する研究報告、または特定の製品候補報告、または証券アナリストの正または負の推薦または研究報告の撤回; |
| ● | 会社のような市場推定値変化 ; |
| ● | 医療支払いシステムの構成を変更する ; |
| ● | 株式市場の全体像 |
| ● | 私たちまたは私たちの株主は未来に私たちの普通株を売却する |
| ● | 私たちの普通株の取引量 |
| ● | 会計実務における変化 ; |
| ● | 内部制御無効 ; |
| ● | 特許、訴訟事項、および私たちの技術のために特許保護を得る能力を含む紛争brまたは特許権に関連する他の発展; |
| ● | 特許または株主訴訟を含む重大な訴訟; |
| ● | 一般的な政治と経済状況 |
| ● | 他の イベントや要素の多くは私たちが制御できない。 |
また,株式市場,特に診断会社の市場は,極端な価格や取引量の変動 を経験しており,通常これらの会社の経営業績に関係なくあるいは比例せず,新冠肺炎流行の結果 を含む。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格にマイナス影響を与える可能性がある。もし今回の発行後、私たちの普通株の市場価格が公開発行価格を超えなければ、あなたは私たちの投資で何の見返りも実現できないかもしれません。一部あるいは全部の投資を損失する可能性があります。従来、証券集団訴訟は、会社証券の市場価格が変動した後に会社に提起されるのが一般的でした。このような訴訟を提起すると、巨額の費用を招き、経営陣の注意力や資源を分散させる可能性があります。
我々 は,今回発行された純収益を用いるうえで広範な裁量権を持ち,それらを有効に使用しない可能性がある.
我々のbr経営陣は,今回発行した純収益を我々に広く裁量権を持ち,得られた資金を我々の運営結果を改善したり,我々の普通株価値を向上させないbr方式に利用することができる.私たちの経営陣がこれらのbr資金を有効に使用できなければ、財務損失を招く可能性があり、これは私たちの業務に重大な悪影響を与え、私たちの普通株価格の下落を招き、候補製品の開発を延期する可能性があります。使用する前に、このbr製品の純収益に収入や切り下げが生じないように投資する可能性があります。
| -47- |
販売禁止期間や市場の行き詰まりが終わった時、私たちの大量の流通株は市場に売却されるかもしれない。もし私たちの普通株が大量に販売されていれば、私たちの普通株の価格は下がるかもしれない。
本募集説明書の“引受”の節で述べたように、我々役員と役員が保有するすべての 普通株流通株は転売時に契約販売禁止令によって制限されている。また、今回の発行終了時には、引受業者代表に株式承認証を発行し、私たちの普通株の株式を購入します。もしこれらの証券保有者が適用されたロック期間満了後に公開市場で私たちの普通株を大量に売却する意向を示した場合、私たちの普通株の取引価格は大幅に下落し、公開発行価格以下に下落する可能性がある。
証券や業界アナリストが我々の業務に関する研究報告書を発表したり、不正確または不利な研究報告を発表しなければ、我々の株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は、証券や業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存するだろう。証券や業界アナリストは今のところできないし、わが社の研究を決して発表しないかもしれない。証券や業界アナリストが私たちの会社を報道し始めなければ、私たちの株の取引価格はマイナス影響を受ける可能性があります。Br証券または業界アナリストが報道を開始した場合、1人以上の追跡アナリストが私たちの株式格付けを引き下げたり、不正確なbrや私たちの業務に不利な研究報告書を発表した場合、私たちの株価は下落する可能性がある。これらのアナリストのうちの1つ以上が私たちの会社の報告を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの株に対する需要が減少する可能性があり、これは私たちの株価や取引量の低下を招く可能性がある。
我々が改訂·再改訂した会社登録証明書(“会社登録証明書”)によると、デラウェア州衡平裁判所は、会社とその株主との間のほとんどの紛争の唯一かつ排他的な法廷となり、株主が会社またはその役員、幹部または従業員との紛争について有利な司法フォーラムを得る能力を制限する可能性がある。
私たちの会社登録証明書は、私たちが書面で代替裁判所を選択することに同意しない限り、デラウェア州は、以下の場合の唯一かつ独占裁判所である:(I)私たちが提起した任意の派生訴訟または訴訟を代表して、(Ii)当社の任意の役員、役員または他の従業員が、私たちまたは私たちの株主に対する信頼責任に違反すると主張する任意の訴訟、(Iii)デラウェア州会社法(DGCL)または当社の定款または定款の任意の規定に基づいてクレームを提起する任意の訴訟を規定する。(Iv)内務原則によって制限された任意の訴訟。この排他的裁判所条項は、証券法または取引法に規定されたいかなる責任または義務を強制的に執行するための訴訟にも適用されず、連邦裁判所が排他的管轄権を有する他のいかなるクレームにも適用されない。そのような任意の請求が連邦法律クレームに基づく可能性がある範囲内で、取引法第27条は、“取引法”またはその下の規則および法規を実行するために生じる任意の義務または責任に対して提起されたすべての訴訟に対して連邦排他的管轄権を付与する。
証券法第22節では、連邦裁判所及び州裁判所は、“証券法”又はその下の規則及び条例で規定されている任意の義務又は責任を執行するために提起されたすべての訴訟に対して同時管轄権を有すると規定している。しかし、私たちの会社登録証明書には、私たちが書面で代替裁判所を選択することに同意しない限り、アメリカ合衆国の連邦地域裁判所は、証券法によって提起された任意の訴因を解決する独占裁判所となる連邦裁判所条項が含まれている。
これらの裁判所条項の選択は、株主が司法裁判所において、私たちまたは私たちの役員、役員、または他の従業員とのトラブルに有利であると考えるクレームを提出する能力を制限し、私たちの株主のコスト増加を招く可能性があり、これは、私たちおよび私たちの役員、役員、および他の従業員に対するこのようなbr訴訟を阻止する可能性がある。あるいは、もし裁判所が、私たちが会社登録証明書に含まれる裁判所条項の選択が訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の管轄区域でこのような訴訟を解決することに関連する追加費用 を生成する可能性があり、これは、私たちの業務、運営結果、および財務状況を損なう可能性がある。
| -48- |
私たち は証券集団訴訟を受けるかもしれない。
従来、証券集団訴訟は、ある会社の証券市場価格が下落した後に提起されることが多かった。このリスクは特に我々に関連しており,製薬会社は近年著しい株価変動 を経験しているためである。もし私たちがこのような訴訟に直面すれば、巨額のコストを招き、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務を損なう可能性がある。
私たちの普通株がナスダックに上場する保証はありません。
私たちは私たちの普通株をナスダック資本市場に上場することを申請しました。今回の発行が完了したら、私たちは上場要求を満たすと信じて、私たちの普通株はナスダック資本市場に上場すると予想されています。しかし、そのようなリストは保証されていない。もし申請が承認されずにナスダック資本市場に上場した場合、私たちは今回の発行を継続しないだろう。このような上場が承認されても、どのブローカーも私たちの普通株を取引することに興味を持っている保証はない。したがって、今回の発行で購入した株を希望したり、販売したりする必要があれば、売るのは難しいかもしれません。我々の主引受業者ThinkEquity は我々の普通株を市にする義務がなく,市になった後もbr通知なしに市を停止することができる.私たちも引受業者も、私たちの普通株の活発さと流動性取引市場が発展することを保証することができません。あるいは、発展すれば、市場は継続します。
前向き陳述に関する特別説明
この目論見書にはリスクと不確実性に関する前向きな陳述が含まれている。あなたはこのような前向きなbr陳述に過度に依存してはいけない。本募集説明書には、歴史的事実に関する陳述を除いて、他のすべての陳述は前向き陳述である。本入札明細書における 前向き記述は、予測のみである。私たちのこれらの展望的な陳述は主に私たちの現在の未来の事件と財務傾向の予想と予測に基づいており、私たちはこれらの事件と財務傾向が私たちの業務、財務状況、およびbr}運営業績に影響を与える可能性があると考えている。場合によっては、これらの前向き陳述は、“予想”、“信じ”、“信頼”、“継続”、“可能”、“可能”、“依存”、“推定”、“予想”、“予定”、“br}”、“可能”、“進行中”、“計画”、“潜在”、“予測”、“プロジェクト”、“ ”、“将”、“将”、またはこれらの用語の否定または他の同様の表現によって識別することができる。 ではないが、すべての前向き陳述にはこれらの言葉が含まれている。私たちは、未来の事件と傾向の現在の予想と予測に基づいて、これらの展望的な陳述に基づいて、これらの事件と傾向は、私たちの財務状況、運営結果、戦略、短期および長期業務運営、および目標と財務需要に影響を与える可能性があると考えている。
これらの 前向き陳述は、“リスク要因”に記載されているものを含む多くのリスク、不確実性、および仮説の影響を受ける。しかも、私たちの運営環境は競争が激しく、変化が迅速だ。新しいリスクが時々発生する。私たちの経営陣はすべてのリスクを予測することができず、すべての要素が私たちの業務に与える影響を評価することもできません。あるいは任意の要素や要素の組み合わせは、実際の結果が私たちが行う可能性のある任意の前向き陳述に含まれる結果と大きく異なる程度をもたらす可能性があります。これらのリスク、不確実性、および仮定を考慮すると、本明細書で議論される展望的イベントおよび状況は発生しない可能性があり、実際の結果は、展望的陳述における予期または示唆の結果とは大きく異なる可能性がある。
あなたは未来の事件の予測として展望的な陳述に依存してはいけない。私たちは展望性表現に反映される予想は合理的であると考えているが、私たちは展望性表現に反映された未来の結果、活動レベル、業績或いはイベント と状況が実現或いは発生することを保証できない。さらに、法律に別段の規定があることを除き、当社または他の任意の者は、前向き陳述の正確性および完全性について一切責任を負いません。本募集説明書の発行日後に、これらの陳述が実際の 結果または私たちの予想される変化に適合するように、任意の理由で任意の前向き陳述を公開更新する義務はない。
あなたは本募集説明書を読んで、私たちが募集説明書で引用してアメリカ証券取引委員会に提出した登録説明書の一部としての文書 を読んで、私たちの未来の実績、活動レベル、業績、およびbr}事件と状況は私たちの予想と大きく異なるかもしれません。
| -49- |
業界と市場データ
本募集説明書には、独立した当事者と、市場規模および成長に対する当社の推定およびその他の統計データ、および当社の業界に関する他のデータが含まれています。本募集明細書中の業界および市場データは、私たち自身の研究および業界 および第三者による一般出版物、調査および研究から来ている。このデータは、複数の仮説および制限 に関連し、“リスク要因”で議論されているものを含む、我々の業界の将来の業績の予測および推定を含み、これらの業界は、“リスク要因”で議論されているものを含む不確実性の高いbrの影響を受ける。私たちはあなたにこのような予測、仮定、そして推定を過度に重視しないように想起させる。さらに、業界および一般的な出版物、研究、および調査は、一般に、そのような情報の正確性または完全性を保証しないにもかかわらず、信頼できると考えられるソースから得られることを指摘している。これらの出版物,研究,調査は信頼できると信じているが,我々はその中に含まれるデータを独立に確認していない.また, は我々の内部研究の結果と推定が信頼できると信じているが,これらの結果と推定は何の独立したソースの確認も得られていない.
収益を使用する
仮定した公開発行価格を1株$ ,すなわち我々の普通株が2022年に場外取引所で公表した最終販売価格から,引受割引とマージンおよび我々が支払うべき発売費用を差し引いたところ,今回の発行で我々が発行·売却した普通株の純収益は約$(または 引受業者が超過配給選択権を全面的に行使すれば約$)と見積もられる。
我々 は現在,今回発行した純収益を用いて研究実験室を決定あるいは構築し,サンプル集を取得してさらに に我々の候補製品を検証し,StemPrintERの実用性を証明するために新たな臨床試験を開始する予定である。残り収益 は、ライセンス によるIEO/ミラノ大学への175,000ドルの支払いを含む運営資金および一般企業用途に使用される。
本募集説明書の最初のページに記載されている普通株式数は一定のままであると仮定し、推定された引受割引とマージンおよび推定対応の発売費用を差し引いた後、本募集説明書の仮定公開募集株価は1株当たり1.00ドル増加または減少し、今回の発行で得られた純収益は約百万ドル増加または減少すると仮定する。仮定した公開発行価格は不変であると仮定し,推定引受割引と手数料および推定支払いすべき発売費用を差し引いた後,我々が発行する普通株式数を増加または減少させることは,我々の純収益を増加または約百万ドル減少させることになる.
変化する環境は私たちの現在の予想よりも資本消費の速度を大きく速めるかもしれない。私たちの実際の支出の金額と時間は、私たちのグローバルマーケティングと販売の進展、そして私たちの発展努力、新冠肺炎の経済と政治的影響、それに対する政府の対応、そして全体の経済環境を含む多くの要素に依存するだろう。したがって、私たちの経営陣は今回の発行で得られた資金の使用に対して広範な裁量権を保持するだろう。私たちは最終的に私たちの現在の計画とは違う用途 に収益を使うかもしれない。今回の発行で得られた報酬のいずれかの部分が最終的に使用される前に,期待収益 がすべての提案用途に資金を提供するために不足していれば,我々の管理層は,使用して得られた報酬の優先順位, および必要な他の資金の金額と出所を決定する.
私たちが今回発行した純収益を使用する前に、私たちは純収益を様々な保本投資に投資することができます。短期、投資レベル、利下げツール、アメリカ政府証券を含むことができます。
配当政策
私たちは普通株の配当を発表したことがなく、現在も予測可能な未来に普通株の配当を発表するつもりはない。私たちは私たちの将来の収益を維持したいです。もしあれば、私たちの業務運営と拡張に使います。上記の規定を除いて、未来に現金配当金(あれば)を派遣することは当社取締役会が適宜決定し、債務合意の制限、利益レベル、資本要求、当社全体の財務状況及び当社取締役会が関連すると考えている任意の他の要素に依存する。
| -50- |
大文字である
次の表は2022年9月30日までの現金と資本を示しています
| ● | 実際に基づいています | |
| ● | 調整した上で、引受割引と手数料および私たちが推定したbr発売費用を差し引いた後、今回発行中の私たちの普通株の株は、私たちの普通株が場外取引市場で2022年11月に最終報告された販売価格 に基づいて計算された仮想公開発行価格1株$で発行·販売されている |
この表中の 備考情報は監査されておらず,参考までに,今回の発行完了後に我々の資本は実際の公開発行価格と定価時に決定された他の条項に基づいて を調整する.この 表を、“収益の使用”および“経営陣の財務状況および経営成果の議論および分析”に含まれる情報および本 募集説明書の他の部分の財務諸表と注釈と共に読まなければなりません。
| 2022年9月30日まで | ||||||||
| 実際 | 調整された(1) | |||||||
| 現金 | $ | 1,331,960 | $ | |||||
| 株主権益: | ||||||||
| 普通株、額面.001ドル;認可株式150,000,000株;発行済み株式11,346,535株、実際の発行と発行済み株式を調整して_株とする | 11,346 | |||||||
| 追加実収資本 | 4,279,125 | |||||||
| 赤字を累計する | (3,492,747 | ) | ||||||
| 株主権益総額 | 797,724 | $ | ||||||
| 総時価 | $ | 797,724 | $ | |||||
| (1) | 本募集説明書の表紙で述べたように、当社が発行する株式数は増加(減少)し、1株当たりの公開発売価格が変わらないと仮定し、引受割引および手数料および当社が支払うべき推定発売費用を差し引くと、現金、株主権益総額および総資本の調整金額が増加(減少)$となる。 |
上の表には2022年9月30日までのデータは含まれていません
| ● | 引受権証を行使する際に発行可能な普通株は、行使価格は1株当たり1.06ドルである | |
| ● | 2021年の総合株式インセンティブ計画に従って加重平均行権価格0.41ドルで普通株を購入する未償還オプション行使時に発行可能な109,811株の普通株式 | |
| ● | 今回の発行完了後、引受業者代表に普通株式承認証株式 を発行します。 |
| -51- |
薄めにする
もしあなたが私たちの普通株に投資する場合、あなたの所有権権益は希釈され、希釈程度は今回発行後の普通株の1株当たり公開発行価格 と調整された普通株1株当たりの有形帳簿純値との差額です。
2022年9月30日まで、私たちの歴史的有形帳簿純価値は797,724ドル、あるいは1株当たり0.07ドルで、2022年9月30日に発行された11,346,535株普通株に基づいている。私たちの1株当たりの歴史的有形帳簿純資産は、2022年9月30日の総有形資産から私たちの総負債を引いて、2022年9月30日の普通株式流通株数で割ったものです。
今回発行した普通株を想定した1株当たり公開発行価格 で売却した後、この価格は、我々の普通株が2022年11月に場外取引市場で最後に報告した販売価格 に基づいて、引受割引と手数料および支払うべき発売費用を差し引いた後、2022年9月30日まで、私たちの調整後 の1株当たりの有形帳簿純値は$、または1株当たりの普通株$である。これは,既存株主に対する調整後,1株あたりの有形帳簿純価値がただちに増加し,今回発行された普通株を購入した新規投資家の1株当たり直ちに$を希釈することを意味する。
次の表は1株単位の屋台を説明している:
| 1株当たり公開発行価格を仮定する | $ | |||||||
| 1株当たりの歴史的有形帳簿純価値 | $ | 0.07 | ||||||
| 新しい投資家の1株当たりの有形帳簿純価値の増加に起因しています | ||||||||
| 今回の発行後の調整に続いて1株当たりの有形帳簿純価値 | $ | |||||||
| 今回の発行で新投資家に1株当たりの収益を希釈する | $ |
以上検討したbr情報は参考までに,今回発行後の希釈情報は定価時に決定された実際の公開発行価格と今回発行した他の条項に基づいて調整する.公開発行価格を1株あたり $(我々の普通株が2022年11月に場外取引市場(OTCQB)で報告した最終販売価格に基づいて)増加(減少)$とし、今回の発行後に調整した有形帳簿純価値を1株あたり$に増加(減少)させ、今回の発行で普通株を購入した新規投資家を1株$に希釈したものとする。本募集説明書の最初のページで述べたように、引受割引と手数料及び当社が支払うべき予想発売費用を差し引いた後、価格は変わらない。本募集説明書の表紙で述べたように、当社が発売した株式数はbr株を増加させ、当社が今回発売後に調整した有形帳簿純値を1株当たり ドルに増加させ、今回発売された普通株を購入した新投資家に対する売上を1株$br}まで減少させ、公開発売された1株当たりの価格は変わらないと仮定し、引受割引や手数料、吾等が支払うべき発売支出を差し引いた後であると仮定する。仮に1株あたりの公開発売価格は変わらないと仮定し,引受割引と手数料および推定されるbr発売費用を差し引いた後,当社が発売した株式数減少 は,今回発売後に調整された有形帳簿純値 を1株あたり$に低下させ,今回発売した普通株を購入した 新投資家に対する償却を1株$に増加させると仮定する。
引受業者が選択権を行使して全額追加株式を購入すると、 発行発効後の調整後の1株当たりの有形帳簿純価値は1株あたり$となる。これは,既存株主の調整後に1株あたりの有形帳簿純値が 増加し,新規投資家の調整後の1株当たり有形帳簿純値が希釈されることを意味する。
上の表には2022年9月30日までのデータは含まれていません
| ● | 引受権証を行使する際に発行可能な普通株は、行使価格は1株当たり1.06ドルである | |
| ● | 2021年の総合持分インセンティブ計画によると、未償還オプションを行使する際に109,811株の普通株式(Br)加重平均使用価格は0.41ドルである | |
| ● | 今回の発行が完了したら、引受業者代表に普通株式標引受権証を発行します。 |
| -52- |
下記表は、上記の調整に基づいて我々が発行·売却した普通株の総数、 我々が受信した総対価格と1株当たり平均価格(I)既存株主が我々に支払う、または(Ii)今回の発行で我々の普通株を購入した新投資家が支払う価格をまとめ、公開発行価格を1株$とし、我々の普通株が2022年にOTCQBで最後に報告した販売価格に基づく。引受割引と手数料および予定発行を差し引く前に、私たちが支払うべき費用と(Iii)今回発行された普通株を購入した既存株主と新投資家が支払う1株当たりの平均価格:
| 株を購入する | 合計 考慮事項 | 平均1株当たりの価格 | ||||||||||||||||||
| 番号をつける | パーセント | 金額 | パーセント | |||||||||||||||||
| 既存の 株主 | % | $ | % | $ | ||||||||||||||||
| 新投資家 | % | % | $ | |||||||||||||||||
| 合計する | 100.0 | % | $ | 100.0 | % | $ | ||||||||||||||
公開発行価格を1株あたり $$とすると、我々普通株の2022年の場外市場での最終報告販売価格の増加(減少)$に基づいて、新投資家が支払う総対価格を100万ドル増加(減少)させ、増加した場合には、新規投資家が支払う総対価格の パーセントを増加(減少)させる。新規投資家が支払う総対価格の割合を %に低下させ、本募集説明書の表紙 で我々が提供する株式数は一定のままであると仮定する。本募集説明書の表紙で述べたように、当社の発売株式数は増加(減少)し、新規投資家が支払う総コストを増加(減少)$とし、増加すれば、新投資家が支払う総代償率は%に増加(減少)し、br}株式が減少した場合、公開募集株価が変化しないと仮定すると、新投資家が支払う総代償率は %に減少すると仮定する。
以上の 表仮設定引受業者は,今回の発行では超過配給選択権を行使しない.引受業者の超過配給選択権を十分に行使すれば、今回発行した普通株を購入した新規投資家が保有する普通株数は、今回の発行後の発行済み普通株総数のパーセンテージまで増加し、既存株主が保有する普通株数は、今回発行後の発行済み普通株総数のパーセンテージに減少する。
株式オプションや株式承認証を行使する程度については,我々の持分インセンティブ計画に基づいて新たな株式オプションを発行するか,あるいは将来的に 普通株を追加発行し,今回の発行に参加した投資家はさらに希釈する.さらに、株式や転換可能な債務証券を売却することで追加資本を調達すれば、これらの証券の発行は私たちの株主 をさらに希釈する可能性がある。
| -53- |
経営陣の財務状況と経営結果の検討と分析
あなたは、当社の財務状況および運営結果に関する以下の議論、ならびに財務諸表および関連説明、ならびに本募集明細書の他の部分に含まれる“リスク要因”および“業務記述”の部分を読まなければなりません。以下の議論には,我々の計画,推定,および信念を反映した前向きな陳述が含まれている.我々の実際の結果 は前向き陳述で議論された結果とは大きく異なる可能性がある.これらの差異をもたらすか、または促進する可能性のある要因 は、以下および本入札明細書の他の部分で説明される要素、特に“リスク要因”に含まれる。
概要
我々は臨床分期診断会社であり,全世界で年間1800万人以上の癌と診断された人の生活の質と予後の改善に取り組んでいる。著者らの計画は新しいゲノムテストを開発し、それを商業化し、腫瘍学的治療過程全体の決定を支持することである。私たちの重点は早期乳癌患者のために私たちの特許ゲノムテストStemPrintER を商業化することであり、この市場機会は13億ドルを超える年収を代表していると予想される。
私たちが設立して以来、私たちはほとんどの資源を私たちの候補製品の研究と開発に投入した。私たちの収入は、標準的な個人第三者と政府医療保険カバー範囲 と精算モデルを含む異なる源から来ると予想される。分割完了後、TizianaはStemPrinter Sciencesに1,353,373ドルの現金を転送し、StemPrinter Sciencesのすべての発行済み株式を譲渡し、3,070,000株の私たちの普通株と交換し、2022年3月に2,706,746 ドルに投資し、1,337,970株の私たちの普通株を購入した。
臨床前や臨床計画に関する持続開発活動 であるため,われわれの費用は大幅に増加することが予想される。CLIA システムに基づいて規制審査を提出し,最終的に精算審査を行うために,さらなる検証と効用研究を行う予定である。ヨーロッパやアジアの規制当局と適切な規制審査を行う戦略も求められるかもしれません
私たちの製品の潜在市場を開拓します。
私たちの費用と資本需要は中短期的に大幅に増加すると予想されています
| ● | 私たちの研究室パートナーを作りました | |
| ● | 私たちの研究と開発を続けて | |
| ● | 我々の製品開発および将来可能な商業化声明を支援する者を含む、br臨床、科学、財務および管理情報システムおよび人員を増加させる。 |
したがって、私たちは私たちの持続的な運営を支援し、私たちの成長戦略を実施するために多くの追加資金が必要かもしれない。私たちが製品販売から相当な収入を得る前に(もしあれば)、私たちは、第三者との協力を含む可能性がある公的または私募株式または債務融資または他のソースの組み合わせによって、私たちの運営に融資する予定です。私たちは必要な時に割引条項や追加資金を調達できないか、そのような他の合意や手配を達成することができないかもしれない。資金を調達できない場合や必要に応じてこのような合意を締結することができなければ、候補製品の開発や商業化を大幅に延期、削減、停止しなければならないかもしれません。
財務 運営概要
私たち はまだ商業販売許可を得ていない製品であり、これまで何の収入も発生していません。私たちはこれまで利益を上げたことがなく、設立以来毎年純損失を出している。2022年9月30日と2021年9月30日までの3ヶ月間の純損失はそれぞれ899,125ドルと67,722ドルだった。2022年9月30日と2021年9月30日までの9ヶ月間の純損失はそれぞれ2,767,885ドルと127,132ドルです。2022年9月30日までの累計赤字は3,492,747ドルです。私たちのほとんどの純損失は、私たちの研究開発計画に関する費用と、私たちの運営に関する一般的かつ行政コストから来ています。
研究開発費
研究·開発コストは発生時に費用を計上する。これらのコストには,内部費用と外部費用と,我々の研究開発活動のための資産の減価償却費用 がある。内部費用には、賃金、福祉、その他の関連コストが含まれており、株式ベースの給与、私たちの研究開発機能にサービスを提供する人員が含まれています。外部費用には 研究開発、臨床試験、特許コスト、および研究機関、契約メーカー、 と他の第三者サプライヤーと発生するコンプライアンスコストが含まれる。ノウハウを得るために支払われる許可料は、この技術が将来代替用途が期待されることを決定しない限り、研究および開発のために使用されるであろう。特許出願の提出と起訴に関するすべての特許に関するコストは研究開発費として研究開発費に計上されており,支出の回収状況に不確実性があるためである。著者らは特定の任務を達成する進捗の評価に基づいて、ある開発活動のコスト、例えば臨床前研究と臨床試験を記録した。これらの活動の支払いは、発生したコストパターンとは異なる可能性があり、連結財務諸表に前払いまたは計算された研究および開発費用として反映される可能性がある個別手配に基づく条項である(場合によっては)。いくつかの開発活動のコストを記録するには見積り値を用いる必要がある.私たちは私たちの推定と仮定が現在の条件下で合理的だと信じている;しかし、実際の結果はこれらの推定とは異なるかもしれない。
| -54- |
研究開発費は私たちの運営費用の大きな部分を占めている。私たちは予測可能な未来に研究開発費 を発生させる予定です。私たちは引き続き私たちの候補製品を開発したいからです。CLIA認証の実験室を設立する準備に伴い、2022年度および後続期間の研究開発費は、本稿で述べた前の時期よりも高くなると予想される。
我々の研究開発費は現在計画通りに間接コストや管理費用を追跡していない。我々は,複数の研究開発計画で我々のbr人員とインフラ資源を用いて,候補製品を識別,開発, の商業化を目指している.
今回,臨床前および臨床開発自体の予測不可能性および規制部門の承認(または認可)および商業化のために,発生するコストや持続的な開発や商業化に必要なスケジュールを決定的に見積もることはできなかった。これらの不確実性のため、臨床試験の成功と完成および規制認可または承認と商業化は不確定であり、許可または承認されたbrおよび商業化製品が生成されない可能性がある。候補製品ごとに完了日と完了コストが大きく異なる可能性があり, を予測することは困難である.我々は、各候補製品について協力する能力、各候補製品の科学的および臨床的成功状況、および各候補製品の商業的潜在力を継続的に評価することに基づいて、どの候補製品を開発し、各候補製品にどれだけの資金を提供するかを継続的に決定する。
一般 と管理費用
一般費用と行政費用は主に人員費用を含み、執行、会計、商業化、人的資源、その他の行政機能における従業員の賃金、福祉、保険、株式報酬の費用を含む。一般および行政費用には、商業前活動に関する費用、会社施設コスト、保険料、会社事務に関する弁護士費、監査、会計、その他の相談サービスの費用も含まれる。
私たちのbrは、2022年度には、会計、法律、人的資源、コンサルティング、投資家関係、上場企業保険料を含む会社のインフラコストの上昇が原因で、本稿で挙げた前の時期よりも増加すると予想されています。
運営結果
2022年9月30日までの3ヶ月と9ヶ月、2021年9月30日までの3ヶ月と9ヶ月
以下、我々の運営結果の検討と分析は、2022年9月30日までの3ヶ月と9ヶ月を、それぞれ2021年9月30日までの3ヶ月と9ヶ月と比較することを含む
| 9月30日までの3ヶ月 | 9月30日までの9ヶ月 | |||||||||||||||||||||||||||||||
| 2022 | 2021 | $Change | 変更率 | 2022 | 2021 | $Change | 変更率 | |||||||||||||||||||||||||
| 研究開発費 | $ | 58,270 | $ | 14,125 | $ | 44,145 | 313 | % | $ | 133,809 | $ | 46,869 | $ | 86,940 | 185 | % | ||||||||||||||||
| 一般と行政費用 | 840,855 | 48,597 | 792,258 | 1630 | % | 2,634,076 | 80,263 | 2,553,813 | 3182 | % | ||||||||||||||||||||||
| 運営損失 | 899,125 | 62,722 | 836,403 | 1334 | % | 2,767,885 | 127,132 | 2,640,753 | 2077 | % | ||||||||||||||||||||||
| 所得税前損失 | (899,125 | ) | (62,722 | ) | (836,403 | ) | 1334 | % | (2,767,885 | ) | (127,132 | ) | (2,640,753 | ) | 2077 | % | ||||||||||||||||
| 所得税の割引 | - | - | - | 0 | % | - | - | - | 0 | % | ||||||||||||||||||||||
| 純損失 | $ | (899,125 | ) | $ | (62,722 | ) | $ | (836,403 | ) | 1334 | % | $ | (2,767,885 | ) | $ | (127,132 | ) | $ | (2,640,753 | ) | 2077 | % | ||||||||||
| -55- |
研究開発
2022年9月30日までの3ヶ月と9ヶ月の研究·開発費はそれぞれ58,270ドルと133,809ドルに増加したが、2021年9月30日までの3ヶ月と9ヶ月の研究·開発費はそれぞれ14,125ドルと46,869ドルであり、これは主に特許関連のbr費用および実験室勤務およびコンサルティング費用の増加によるものである。
通常 と管理
2022年9月30日までの3ヶ月と9ヶ月の一般および行政費用はそれぞれ840,855ドルと2,634,076ドルに増加したが、2021年9月30日までの3ヶ月と9ヶ月の一般および行政費用はそれぞれ48,597ドルと80,263ドルであり、これは主に新しい管理チーム構造による賃金 関連コストの増加、法律費用およびその他のコンプライアンス費用に関するコストである。
純損失
2021年9月30日までの3カ月と9カ月に比べ、2022年9月30日までの3カ月と9カ月の純損失はそれぞれ836,403ドルと2,640,753ドル増加した。増加の主な原因は特許費用、新管理チーム構造による給与関連コスト、および法律費用および他のコンプライアンス費用に関するコスト増加
2021年12月31日までの年度と2020年6月5日(設立日)から2020年12月31日までの期間との比較
以下、我々の運営結果の検討と分析は、2021年12月31日までの年度と2020年6月5日(設立日)から2020年12月31日までの比較を含む
| 2021年12月31日までの年度 | 2020年6月5日から2020年12月31日まで | $Change | ||||||||||
| 収入.収入 | $ | — | $ | — | $ | — | ||||||
| 研究開発費 | 73,335 | 5,748 | 67,587 | |||||||||
| 一般と行政費用 | 597,279 | 48,500 | 548,779 | |||||||||
| 運営損失 | 670,614 | 54,248 | 616,366 | |||||||||
| 所得税前損失 | (670,614 | ) | (54,248 | ) | (616,366 | ) | ||||||
| 所得税の割引 | — | — | — | |||||||||
| 純損失 | $ | (670,614 | ) | $ | (54,248 | ) | $ | (616,366 | ) | |||
| -56- |
研究開発
2020年に比べて2021年の研究開発費は67,587ドル増加した。この増加は主に年間の特許関連費用と関連がある。
通常 と管理
2020年と比較して、2021年の一般·管理費は548,779ドル増加した。この増加は主に年間運営に関係しており, は上場企業であるため,法的費用や他のコンプライアンス費用に関するコストが増加している。
純損失
2020年に比べ、2021年の純損失は616,366ドル増加した。この増加は主に通年運営に関連していることや,上場企業による法的費用や他のコンプライアンス費用に関するコスト増加に関係している。
流動性 と資本資源
流動資金源
私たちが設立されて以来、私たちは何の収入も生じず、重大な運営損失が発生した。私たちの潜在的な製品は違う開発段階にある。今後数年以内に、私たちは製品販売から相当な収入を得ないと予想しています。もしあれば。分割により,TizianaはStemPrintERに1,353,373ドル(1,000,000 GB)の現金を譲渡することを約束し,StemPrintERのすべての発行済み株式 を我々に譲渡した。この1,353,373ドルの現金は2022年1月に支払い、2022年3月、Tizianaはまた現金2,675,940ドル(GB 2,000,000) 追加投資1,337,970株を私たちの普通株に追加投資した。私たちのキャッシュフローは変動する可能性があり、予測が難しく、多くの要素に依存するだろう。
キャッシュフロー
次の表は私たちのキャッシュフローをまとめています
| 9月30日までの9ヶ月間 | ||||||||
| 2022 | 2021 | |||||||
| 経営活動に使われている現金流量 | $ | (1,315,325 | ) | $ | — | |||
| 投資活動のためのキャッシュフロー | (10,999 | ) | — | |||||
| 融資活動によるキャッシュフロー | 2,658,284 | — | ||||||
| 現金と現金等価物の純増加 | 1,331,960 | — | ||||||
| 期初現金及び現金等価物 | — | — | ||||||
| 期末現金および現金等価物 | $ | 1,331,960 | $ | — | ||||
私たち は、現金が関係者から資金を提供するため、2021年9月30日まで何のキャッシュフローも発生していません。
| -57- |
操作 活動
2022年9月30日までの9カ月間に,関連先から売掛金を受け取るため,経営活動からのキャッシュフローが増加した。2021年9月30日までの9カ月間、経営活動からのキャッシュフローはなかった。
投資 活動
コンピュータ機器を購入したため、2022年9月30日までの9ヶ月間、投資活動のためのキャッシュフローが増加しました。 は2021年9月30日までの9ヶ月間、投資活動にキャッシュフローはありません。
活動に資金を提供する
2022年9月30日までの9カ月間、Tizianaへの普通株発行収益により、上記の“流動資金源”部分で述べたように、融資活動のキャッシュフローが生じた。2021年9月30日までの9ヶ月間、融資投資活動では現金純額は何も受け取っていない。
操作 活動
2021年12月31日までの年度および2020年6月5日から2020年12月31日までの間,すべての現金活動は“何らかの関係や関連側取引”で述べたように関連側が資金を提供するため,経営活動からのキャッシュフローは存在しない
投資 活動
2021年12月31日までの年度または2020年12月31日までの2020年6月5日期間( 成立期間)、投資活動では現金純額の使用や提供はありません。
活動に資金を提供する
2021年12月31日までまたは2020年6月5日(成立日)から2020年12月31日までの間、融資投資活動で現金純額は受信されていない。Tizianaが分割と補充分割協定で発行した株式は1,558,252ドルの受取現金残高がある。
資金需要
私たちの費用は増加し、運営損失が発生すると予想されています。2022年9月30日までの累計赤字は3,492,747ドルです。私たちの現在の計画によると、私たちは私たちの既存の現金と現金等価物が、2022年12月まで私たちの運営と資本支出需要に資金を提供するのに十分だと信じている。私たちは最近私たちの活動の加速を支援するために多くの追加支出が発生すると予想している。私たちは予測可能な未来に純損失が出ると予想している。私たちの製品開発と臨床運営、製品候補製品の商業化に資金を提供する能力があるかどうかは、計画融資から得られた現金金額と時間に依存する。私たちの将来の資本需要は多くの要素に依存します
| ● | 私たちの候補製品に関連する臨床試験と規制審査のコスト、時間、結果 | |
| ● | 製品マーケティング、販売、流通を含む商業化活動のコスト | |
| ● | 特許出願および知的財産権に関連する権利要件の維持、実行および弁護のための費用の準備、提出、および起訴; |
| -58- |
| ● | 競争する技術と製品と他の不利なマーケティングの発展が現れた | |
| ● | FDA、EMA、または他の規制機関が取った行動が私たちの製品開発活動に及ぼす影響 | |
| ● | 承認されれば候補製品を商業化する上での成功度と | |
| ● | 私たちが開発して商業化する未来の製品の数量とタイプ |
我々の任意の候補製品の開発のために、これらまたは他の変数のいずれかの結果が変化することは、候補製品の開発に関連するコストおよびスケジュールを著しく変更する可能性がある。また、私たちの運営計画は将来的に変化する可能性があり、このような運営計画に関連する運営需要や資本要求を満たすための追加資金が必要になるかもしれません。
私たちは相当な製品収入を生み出すことができる前に、株式融資、債務融資、他社との協力、または他の戦略取引を通じて、私たちの運営に資金を提供したいと思っています。私たちは現在何の約束もない外部資金源を持っている。もし私たちが株式または転換可能な債務証券を売却することによって追加資本を調達する場合、あなたの所有権資本は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての権利に悪影響を及ぼす可能性がある。債務融資および優先持分融資(利用可能な場合)が関与する可能性のあるプロトコルは、追加債務を生成する、買収または資本支出を行う、または配当金を発表するなど、特定の行動をとる能力を制限または制限する契約を含む。もし私たちが協力、戦略連合またはマーケティング、流通、または第三者との許可手配によってより多くの資金を調達する場合、私たちは、私たちの技術、将来の収入フロー、研究計画、または候補製品に対する貴重な権利を放棄しなければならないか、または私たちに不利になる可能性のある条項でライセンスを付与しなければならないかもしれない。もし私たちが必要な時に株式や債務融資や他の手配を通じてより多くの資金を調達できない場合、私たちは私たちのbr研究、製品開発、または将来の商業化努力を延期、制限、減少または終了する必要があるかもしれません。あるいは権利開発とマーケティングを付与することは、私たちが自分で開発とマーケティングを望んでいた候補製品です。
また、私たちの運営計画は変わる可能性があり、臨床試験や他の研究開発活動の運営需要と資本要求を満たすために追加の資金が必要かもしれません。私たちは現在信用計画もなく、約束された資金源もない。私たちの候補製品の開発や商業化に関連する多くのリスクと不確実性のため、現在および予想されている製品開発計画に関連する資本支出や運営支出が増加したbr金額を見積もることができません。
キー会計政策
私たちの連結財務諸表はアメリカ公認会計基準に基づいて作成されました。我々の連結財務諸表および関連開示を作成する際には、資産、負債、コストおよび費用に影響を与える報告金額の推定および判断、および我々の連結財務諸表における開示または資産および負債が必要である。我々の見積りは,歴史的経験,既知の傾向,事件,および当時の状況では合理的であると考えられる様々な他の要因に基づいており,これらの要因は資産や負債の帳簿価値の判断の基礎を構成しており,これらの資産や負債の帳簿価値は他の源 からは容易に現れない.私たちは持続的な基礎の上で私たちの推定と仮定を評価する。異なる 仮定や条件では,我々の実際の結果はこれらの推定値とは異なる可能性がある.
私たちの重要な会計政策は、私たちの連結財務諸表により詳細に説明されていますが、以下の会計政策は、私たちが合併財務諸表を作成する際に使用する判断と推定に最も重要であると考えられます。
| -59- |
株式ベースの報酬
従業員および取締役会メンバーに支給される株式ベースの報酬を計算する方法は、付与日 で報酬の公正価値を測定し、必要なサービス期間(通常は帰属期間)内に直線ベースでこの公正価値を株式ベースの報酬として確認することである。
相関 方
当事者が直接または間接的に1つまたは複数の中間者によって制御され、私たちによって制御され、または私たちと共同制御の下にある場合、私たちに関連する。関連側はまた、私たちの主要所有者、私たちの管理層、私たちの主要所有者の直系親族メンバー、および私たちの管理層、および私たちがそれと付き合う可能性のある他の当事者を含み、一方が他方の管理または経営政策に著しく影響を与えることができれば、取引側がその単独の利益を完全に追求することを阻止される可能性がある。
最近の会計声明
最近の会計声明に関する情報は、我々の連結財務諸表-付記2と本募集説明書の他の場所に関する付記 を参照してください。
第 7 A項。市場リスクの定量的·定性的開示について
2021年12月31日現在、金利リスクと外貨為替リスクを含む重大な市場リスクは存在しません。しかも、私たちは重大な商品価格や株式価格の危険は存在しない。
外貨両替リスク
私たちは2種類の外貨両替リスクに直面する可能性があります:取引と両替損益。外国為替取引損益と換算損益の違いは以下のとおりである:(I)換算調整は現金の流れに触れず,それらは既存の本位貨幣を報告通貨に変換する会計換算計算であり,(Ii) 取引損益は将来のある時点で正式に支払う必要がある実際の取引に基づく。
私たち は、ある資産、負債、損益表の換算に関する外貨両替リスクに直面する可能性があります。 資産と負債の換算調整は、株主権益部分または私たちの合併貸借対照表に含まれる他の累積全面収益(損失)のタイトルに反映されます。私たちは私たちの機能通貨として現地通貨を使用する。私たちの資産と負債は期末に為替レートでドルに換算されます。収入と費用口座 はその期間の平均レートを用いて換算する.我々は通常,特定外貨の損益 換算,特に関連先の売掛金や売掛金に関する損益が生じ,これらの金額が重大な場合がある.これらの損益 は我々の総合運営報告書に反映されている.
私たちは現在通貨ヘッジ活動をしていません。私たちの通貨リスクを減らすために開放していますが、私たちは未来にそうするかもしれません。 将来のリスクをヘッジするためのツールには、外貨長期契約とスワップ契約が含まれているかもしれません。これらのツールはリスクを選択的に管理するために使用できるが、重大な外貨変動の影響から完全に保護される保証はない。
業務説明
概要
我々は臨床分期診断会社であり,全世界で年間1800万人以上の癌と診断された人の生活の質と予後の改善に取り組んでいる。著者らの計画は新しいゲノムテストを開発し、それを商業化し、腫瘍学的治療過程全体の決定を支持することである。私たちの重点は早期乳癌患者のために私たちの特許ゲノムテストStemPrintER を商業化することであり、この市場機会は13億ドルを超える年収を代表していると予想される。
| -60- |
著者らの主要な候補製品はStemPrintERであり、これは20個の遺伝子を含む予後分析であり、腔内(ER+/HER 2陰性)乳癌患者の遠隔再発リスクを予測することを目的としている。この測定方法を開発することは、腫瘍の“乾性”を測定し、あるいは腫瘍が幹細胞の行為をどの程度示すかを測定するためであり、癌の再発或いは標準治療に耐性を与える可能性があり、最終的にその多学科看護チームの患者に対する管理方式に影響を与える可能性がある。StemPrintERはすでに複数の臨床コホートと研究で検証されており,その中で最大のものはヨーロッパ腫瘍学研究所(“IEO”)からの約2400名の患者とTransATAC研究の約800名の患者の連続シリーズ研究である。IEOキューでは,StemPrintER高リスク患者(“SPRS High”) 遠隔再発の可能性は低リスク(“SPRS low”)患者の1.85倍であるが(図1),TransATACキューではSPRS高リスク患者が遠隔再発する可能性はSPRS低リスク患者の4.27倍 である(図2)。つまり,これらのデータはStemPrintERが乳癌患者の予後に対して高い予測作用を有することを明らかにし,腫瘍臨床における潜在的用途を示唆している。
私たちが最初にStemPrintERを計画した以外に、私たちは私たちの製品の組み合わせを拡張するための大きな機会があると信じている。まず,腫瘍の“乾性”の広範な適用性を考慮すると,StemPrintプラットフォームは乳癌以外に重要な臨床実用価値を有すると信じられている。そこで,StemPrintを検証し,様々な異なる腫瘍タイプに適用するための商業化を図る。さらに、私たちは、私たちの独自の検出を強化し、患者の看護全体の過程で患者と医師により多くの情報と価値を提供するために、補助商品検出(例えば、遺伝子検出、体細胞変異検出)を提供する予定である。
我々brは、LDCTスクリーニングによって決定された肺結節が良性か悪性かの決定を助けることを目的としたMSC試験の許可権を有する。私たちは今回発行された純収益を使ってこのテストをさらに開発または商業化するつもりはない。
会社の歴史と買収
AccuStem Sciences LimitedはTiziana Life Science plc(“Tiziana”)から分割することにより設立され,AccuStem Sciences Limited(“Old AccuStem”)は2020年6月5日に個人会社としてイングランドとウェールズに登録設立された。その他の事項を除いて、分割の条件は、裁判所がTizianaの減資を承認することであり、Tizianaの株主は2020年10月2日に特別決議によりTizianaの減資を承認した。裁判所は2020年10月27日にTizianaに関する資本削減を承認し, 分割は2020年10月30日に発効した。
分割プロトコルでは,TizianaはStemPrinter Sciencesのすべての発行済み株式を我々に譲渡し,StemPrinter SciencesはTizianaのエンティティであり,TizianaはこのエンティティにStemPrintプロジェクトに関連するすべての資産と知的財産権,および1,353,373ドル(GB 1,000,000) 現金を提供することを規定している.
分割の目的で,TizianaはまずStemPrintプロジェクトに関連する資産(主にミラノIEO/大学から取得したライセンスおよびアウトソーシング研究プロジェクトの利益)を別の会社StemPrintER Sciences,および1,353,373 ドル(1,000,000 GB)現金に移した。このステップの結果として,StemPrinter Sciencesが1つの運営エンティティとなる.次の段階で、TizianaはTizianaの株主の株と引き換えにStemPrinter Sciencesの株を1対1で私たちに譲渡し、Tizianaはこれらの株の株主に実物配当を発表した。
2021年1月1日に私たちと締結された共有サービス契約の条項によると、分割が完了した後、Tiziana は、いくつかの限られた管理·行政サービスを提供し続けていく予定です。共有サービス協定の条項によると、Tizianaは、双方が合意したコストに基づいて、様々な行政、財務、法律、税務、保険、施設、情報技術、その他のbrサービスを提供することに同意しています。共有サービスプロトコルの初期期限は2021年12月までで、その後3ヶ月連続で自動的に更新されている。双方はいつでも相互に共有サービスプロトコル を終了することができる.しかも、私たちは30日前に共有サービス協定を終了することを書面で通知することができる。他方がそれぞれの実質的な義務を履行できなければ,双方は本プロトコルを終了することができる.
| -61- |
2021年12月1日、デラウェア州のAccuStem Sciences Inc.(“新AccuStem”)は、改正された1934年証券取引法(“取引法”)第12 G-3(A)条により旧AccuStemの後継者となった。この継承は、(I)旧AccuStem普通株(“旧AccuStem普通株”)20株当たり1株普通株と交換され、1株当たり0.001ドルである英国裁判所が承認した手配案(“手配案”)が2021年12月1日(“発効時間”)の発効後に行われる。(Ii)(I)旧AccuStem普通株2株に相当する米国預託株式10株当たり新AccuStem普通株を交換し、新AccuStemは旧AccuStemの持ち株会社となる。2021年12月30日、私たちはOld AccuStemの解散を完了した。
StemPrintERと乳がんの市場機会
毎年、全世界で200万人以上の女性が乳癌と診断されている。内分泌受容体陽性(ER+)乳癌は乳癌症例の大多数(~75%)を占め、その臨床行為は明らかな差異性を示した。この異質性は腫瘍の標準臨床病理特徴を用いて予後と治療反応を予測することはよく挑戦的である。このグループの患者の全体予後は良好であるが、その中のかなりの部分の患者(~20%)は術後10年以内に遠隔再発を経験する。HER 2陰性状態(HER 2−)が同時に存在するER+患者では,治療基準は内分泌治療 であり,臨床病理パラメータから再発リスクがあると考えられる患者に補助化学療法を加えた。しかし,これらのパラメータは通常ER+/HER 2−乳癌患者の再発リスクを予測するのに不十分であることは明らかであり,したがって,これらの患者のかなりの部分は過剰治療か,治療不足である。StemPrintER は臨床評価と組み合わせて使用され,患者の再発リスクを決定し,医師が看護過程全体で治療計画を最適化するのを助けることが予想される。
著者らはStemPrintERは幹細胞生物学において新しい生物学的基礎を持っていると考え、原発腫瘍腫瘍幹細胞の内在含有量と侵襲性を疑問視している。この方法は信頼できるリアルタイム定量逆転写ポリメラーゼ連鎖反応(qRT-PCR)、ホルマリン固定、パラフィン包埋(FFPE)プラットフォームを用いて測定を行った。StemPrintERの開発と臨床検証は,IEO由来の約2400名の乳癌患者の連続シリーズを用いた回顧分析で行った。その後,StemPrintERは前向きランダムTransATAC試験で約800名のER+/HER 2−閉経後患者のキューを用いて独立した検証を行った。
私たちの計画はStemPrintERを商業化し、早期乳癌のすべての臨床亜型をカバーし、79.8万人の患者が推定され、13億ドルを超えるサービス可能な市場機会に転換することである。
StemPrinter(Br)科学的背景
十数年来、多遺伝子分析の発展と検証は絶えず拡大した研究領域を代表し、これらの分析は腫瘍の潜在生物学的特徴を尋ね、癌患者の個体を正確に予測することができる。すべての腫瘍は腫瘍幹細胞の理論から起源し、及び人々はそれらと腫瘍の異質性と病気経過の関連性に対する日々の認識により、乳癌の“幹の程度”を理解し、或いは腫瘍の行為はどの程度幹細胞に似ており、個性化の患者管理を大きく促進する可能性がある。研究により、癌中の“高幹”特徴は疾病再発の主要な原因であり、癌幹細胞は高度な適応性と無限成長能力を有するためである。StemPrintERは、20個の幹細胞遺伝子のグループに基づいて、癌再発リスクが非常に低い患者と癌再発リスクが増加する患者との2つのグループに患者を分けることができる新しい患者予後ゲノム予測因子として開発された。この情報 は、患者の看護過程全体における異なる時点の治療計画に情報を提供することを目的としている。
著者らの初歩的な研究は正常乳腺組織中の乳腺幹細胞と子孫細胞を区別できる遺伝子に集中している。乳腺幹細胞で子孫よりも発現レベルが高い遺伝子のみを選択します選択基準は,癌幹細胞が正常乳腺幹細胞と類似した特徴を示す可能性があり,癌幹細胞は非常にまれであるため,高発現遺伝子(乳腺幹細胞と後代)を選択する可能性が高く,低発現遺伝子の得点の差が大きいという前提に基づいている。
| -62- |
すでに発表された研究に基づいて、20個の幹細胞遺伝子のいくつかは基質分解、遷移、浸潤と移植における作用(例えば、MMP 1、SNF、MIEN 1、PHLDA 2、EPB 41 L 5)を通じて転移拡散との明らかな関連を示した。署名 中の他の遺伝子(RACGAP 1、H 2 AFZ、H 2 AFJ、APOBEC 3 B、CENPW、TOP 2 A CDK 1)については、癌幹細胞表現型の確立において重要な意味を有する可能性があると考えられ、ゲノム不安定性への関与に関与している可能性がある。最後の組の遺伝子の転移における作用はそれほど明らかではなく、(A)代謝再プログラミングとミトコンドリア生理学(MRPS 23,NDUFB 10, PHB);(B)mRNAリボソームの生物発生、mRNA転写、スプライシングと出力、およびRNA加工と分解事象(ALYREF, EXOSC 4);および(C)生存/アポトーシスから脱出し、これは抗ホルモンおよび/または化学療法に関連し、ハイジャックシグナル経路を通じて、例えば形質転換成長因子-βとPI 3 K-AKT-mTOR(NOL 3,LY 6 E,EIF 4 EBP 1)を通過する。この20個の遺伝子と癌幹細胞表現型との間に機序の関連がある証拠は,これらの遺伝子が乳癌でしばしば過剰発現し,場合によっては遺伝子増幅の結果であることが観察されたことに由来する。
StemPrintER 臨床研究の歴史
高品質のフォローアップを有する大型展望性ランダム乳癌患者行列に対する検証性研究、及び新鮮な腫瘍サンプルと他の乳癌患者の遺伝子発現スペクトルを用いた一連の回顧研究を通じて、 はすでにStemPrintER予測腔内(ER+/HER 2-)と三陰性乳癌が遠隔転移を発生する個体の可能性を確定した。我々のゲノム予測指標は、(1つの例外を除いて)任意の他のゲノムツールまたは分子分類器に属さない遺伝子のセットを含み、これらの遺伝子は、三陰性または管腔乳癌として記述されていることに留意されたい。したがって,われわれの研究の結果,乳癌の“茎乾度”を探索し,乳癌の臨床結果を検討する独自のツールが開発されたと考えられる。
StemPrintERの最大の検証研究はIEO臨床ネットワークを通じて収集した2400近くの乳腺腫瘍サンプルの回顧分析に関連している。この発表された研究において、StemPrintとStemPrintERは腔性乳癌患者(ER+/HER 2-)と三陰性(ER-/PR-/HER 2-)乳癌患者の早期と末期再発に対して非常に高い予後を有し、標準的な臨床特徴と関係がない。
ER+/HER 2−閉経後乳癌患者のTransATACキューでは,IEOの科学者のグループがロンドン王立マストン病院とメアリー女王大学と協力し,銀行研究サンプルを用いてStemPrintERを独立した 検証を行った。 は尤度比x 2(LRx 2)とKaplan−Meier生存分析を用いてStemPrintER とOncotypeDXが提供する予後情報を評価した。10年間にわたるフォローアップ期間および早期(0−5年)または晩期(5−10年)のDRリスクを比較分析した。我々の研究結果から,StemPrintERは再発リスクに対して高い予測作用(危険比(高リスクと低リスク)=4.27(95%CI:2.67−6.84),pを示している
StemPrintプラットフォームとStemPrintER商業化
臨床的には,将来の研究では20遺伝子検査の信頼性と適用性の臨床エビデンスレベルを向上させる必要があるが,最近TransATACキューを用いた独立した検証により,StemPrintER は乳癌患者の臨床管理に直接関連しており,特にER+/HER 2−疾患の患者であることが示唆された。これらの管腔患者は新診断症例の大多数(~75%)を占め、臨床行為に高度な分子異質性と変異性を示す。そのため、ER+/HER 2-乳癌患者は正確な再発リスク階層から利益を得ることができ、最適な治療方案を制定することができる。
歴史的に見ると,乳癌では,多遺伝子解析は術後システム治療の役割を知らせるために用いられている。StemPrintER は同じ能力を有する可能性があると信じているが,特に長期予後が良好で補助化学療法から有意な利益が得られない患者 を識別する際には,現在商業化されているbr製品では解決できない代替臨床問題への回答に専念する予定である。われわれの資源を確立した患者キューの獲得に用い,前向き臨床試験を行うことで,StemPrintERがより広範な効用を有することが証明される可能性がある。
| -63- |
独自のゲノム分類器を商業化するためには、検査は患者の臨床管理のために十分なデータが必要であり、CMSおよび他の支払人から精算を得るのに十分な同業者レビューの出版物が必要であるという2つの重要な基準を満たさなければならない。2022年2月までに、私たちは“ヨーロッパがん誌”で2番目の検証記事を発表し、StemPrintERは商業化の最低のハードルに達したと信じている。そこで、いくつかの重要なマイルストーンを実現した後にStemPrintERを発売する予定です。 まず、すべてのビジネスサンプルのStemPrintER結果の処理、テスト、報告を担当するラボ(“ビジネスラボ”)を決定または構築します。また,StemPrintERをそれらを開発した実験室 からビジネス実験室に移行する予定である.最後に,商業実験室でテストが確立されると,米国の1988年臨床実験室改善修正案(“CLIA”)認証を得て,臨床使用結果を報告し,医療保険と医療補助サービスセンターに精算を求めることができるようにする。私たちはこのようなマイルストーンを達成するために少なくとも18ヶ月が必要だと予想している。これらの任務が完了すると,我々はまず米国でStemPrintERを発売し,臨床需要や収入機会を評価する際に他の市場に拡張する予定である。我々の計画を実施する能力に影響を与える可能性のあるライセンス情報については,“-IEO/ミラノ大学ライセンスプロトコル” を参照されたい。
StemPrintERの価値主張を強化するために、追加の“商品”試験(例えば、IHC受容体試験、遺伝子試験)を提供する予定である。このような追加的なテストは私たちの顧客のために顕著な価値を作らなければならない。同時に既存の実験室設備と技術を利用して規模経済を実現し、会社に追加の収入機会を提供する。
腫瘍“幹細胞”の広範な適用性を考慮すると、StemPrintプラットフォームは乳癌以外に重要な臨床実用価値があると信じている。そこで,様々な腫瘍タイプでStemPrintを検証し,商業化することを求めている。適用される場合、各腫瘍タイプはまた、顧客に対する私たちの価値主張 を向上させるための補助試験を含むであろう。
精算戦略
私たちの収入は、標準的な個人第三者と政府医療保険カバー範囲 と精算モデルを含む異なる源から来ると予想される。全面的な商業拡張の前に、私たちは販売努力を少数の早期に採用されたサイトに集中して、支払人との注文履歴、有効な物流と他の臨床実用プログラムを構築し、CLIA認証下の成功した検証 試験と承認、あるいはテストされたCEマークに依存して、ヨーロッパの健康、安全、環境生産基準に符合する証明 とすることを望んでいる。
私たちの競争相手
遺伝学とゲノム検査は腫瘍学領域において重要かつ絶えず発展する役割を果たしている。乳癌では,いくつかの会社が提供するゲノム検出がStemPrintERと競合する可能性がある。
乳がんbr癌
乳癌指数(HOGIC)は末期乳癌の再発可能性を予測し、内分泌治療を延長する必要があるかどうか(標準の5年間の基礎の上で更に5年間の内分泌治療を行う)を確定するための分析方法である。このテストは閉経前と閉経後にER+/HER 2-病を有し、3つの陽性リンパ節を有する患者に適している。
EndoPredict (Myriad)はCEマーカーの検出方法であり、最初に乳癌と診断された10年以内に転移が発生する可能性を予測することを目的としている。このテストは閉経前と閉経後早期ER+/HER 2乳癌及び3つの陽性リンパ節に及ぶ患者に適用される。
MammaPrint (Agendia)はFDAによって承認されたCEマーカー検出であり、5年以内に遠隔再発のリスクおよび患者 が化学療法から利益を得るかどうかを評価することを目的としている。このテストは閉経前および閉経後の乳癌患者に適用され、これらの患者は1期または2期乳癌を有し、腫瘍の大きさは5 cm以下であり、LN陰性またはLN陽性疾患(最大3つの陽性結節)を有する。ER とHER 2の状態にかかわらず,このテストを用いることができる.
| -64- |
OncotypeDXはCEマーカーの測定方法であり、ER+/HER 2-乳癌患者の遠隔転移のリスクを評価し、化学療法が必要かどうかを予測することを目的としている。このテストは閉経前と閉経後リンパ節の最大3つの陽性患者に用いることができる。
Prosigna (Veracyte)はCE標識の測定方法であり、乳癌亜型の情報を提供し、そして10年後の無再発の長期生存率を予測することを目的としている。このテストは早期ER+/HER 2乳癌に対する閉経後患者であり,これらの乳癌はLN陰性あるいはLN陽性(3つまでの陽性結節)である。
汎癌
我々が提供する予定の“商品”検出(例えば,IHC受容体検出,体細胞変異検出,遺伝子検出) は業界(例えば,キャビネット,色彩健康,基礎医学,衛士,Invitae,米国実験室会社,Natera,新遺伝子,Quest Diagnostics,Tempus)および学術や病院機関に多くの競争相手を有している。
従業員
本募集説明書の発表日までに、私たちは4人のフルタイム従業員がいます。これらの従業員には労働組合代表もなく、団体交渉合意のカバー範囲もなく、従業員との関係は良いと思います。
政府の法規
アメリカの衛生規制の概要
以下は、米国内の実験室サービスおよび医療機器規制の主な態様について概説する。本概要は、連邦および州レベルの規制のすべての態様に関連するものではなく、本登録声明に一般的に記載されている活動に最も関連する態様のみに関連することに留意されたい。
連邦と州臨床実験室の許可要件は
CLIAは、米国内で運営されているすべての臨床実験室または結果を個人に戻すことを管理しています。CLIAは、医療保険と医療補助サービスセンター(CMS)が州衛生部門と協力して管理しています。臨床実験室 は、疾患の診断、予防または治療または健康評価のための情報を提供することを目的として、ヒトからのサンプルを検出する実験室として定義される。臨床実験室は必ずそれに適した実験室検査タイプの証明書を持っていなければならず、しかも関係者の資格、訓練、記録保存、品質管理と能力テストなどの方面の法規に符合することを証明しなければならず、これらはすべて臨床実験室テストサービスの適時性、信頼性、brと正確性を確保することを目的としている。CLIAは、彼らが行ったすべてのテストの分析有効性を実験室的に証明または検証することを要求する。もし臨床実験室が独自のテスト方法(即ち、実験室が開発したテスト、‘LDT’)に基づいてサンプルを分析する場合、実験室は必ずこのようなテストの正確性、精度、特異性、敏感性を記録し、そしてこのようなテストのために参考範囲を確立しなければならない。
CMS は、少なくとも連邦要求と同様に厳しい臨床実験室基準が制定された州に対して、CLIAを免除することが規定されている。 ニューヨーク州もワシントン州もCLIAを免除する。NYS臨床実験室評価計画は、NYSが運営するすべての独立臨床実験室またはNYS試験サンプルの実験室から操作を開始する前に実験室許可証を取得することを要求し、LDTSを行うすべての臨床実験室は、試験の分析および臨床有効性を証明するために試験検証文書を提出しなければならない。
CLIA認証と州臨床実験室許可証の要求を遵守できないことは、証明書或いは免許が取り消され、制限或いは取り消し、方向性行動計画、現場監視、民事罰金、刑事制裁の撤回、実験室のMedicareとMedicaidサービス支払いの承認の撤回、及び重大な負の宣伝を含む一連の法執行行動を招く可能性がある。
| -65- |
食品薬品監督管理局
FDAは、疾患の診断、予防、治癒、緩和または治療、または身体構造または機能に影響を与えることが意図されたいくつかの物品を含む医療機器、および他の医療製品を規制する。まず、製品 が医療機器として使用されることが意図されているかどうかは、一般に、製造業者の製品ラベルに基づいて決定され、製品に貼り付けられたラベル、製品に付随する材料、および製品に関する宣伝情報を含む。
I類(低リスク)に分類される設備 は一般にFDAの発売前審査を経ずに発売できるが、機関登録、設備上場、記録保存、医療設備報告と品質体系法規を含む“一般制御”を受けなければならない。クラスII(中リスク)に分類されるデバイスは、一般的な制御に加えて、“特殊な制御”(例えば、性能基準/製造基準、発売後監視、患者登録、特殊ラベル要件、発売前データ要件およびガイドライン)を受ける可能性があり、通常、FDAの510(K)発売前許可またはDeNovo許可 を取得しなければならない。一般的な制御に加えて、クラスIII(高リスク)デバイスは、十分かつ良好に制御された臨床研究からのデータを含む証拠を含む上場前承認申請を提出することによってFDAの上場前承認を得なければならず、装置がその期待用途に対して安全かつ有効であることを証明する。一般に、FDAの発売前の承認またはDeNovo許可を必要とする装置は、そのような許可を得る前に、FDAマーケティングアプリケーションを支援するために必要な臨床データを配布および開発する目的のために使用される可能性があるが、いくつかの制限を受けてはならない。上場後 は,変更の範囲と設備の安全性と有効性への潜在的な影響により,承認/許可または承認された設備の変更もFDAの事前審査を受ける可能性がある。
また、この上場前審査過程はFDA規制の一面に過ぎないことを強調しなければならない。例えば、FDA規制製品ラベルは、販売促進声明を含む;医療機器の製造は、その設計を含み、FDA品質システム の要求に適合する;新製品或いは改良製品の臨床試験;及び安全問題の発売後のモニタリング、報告と行動 である。適用された発売前と発売後の設備要求を守らなければ,FDAは設備 が米国連邦食品,薬物,化粧品法に違反していると判定し,“混合偽”(501節)や“ブランド誤り”と判定する可能性がある(502節)。この法規は、差し押さえ、禁止令、刑事、および民事罰金を含む、偽またはブランドの誤った設備の販売または流通に対するいくつかの処罰を規定する。一般に、FDAは、法執行行動をとる前に、“警告状”または“タイトルのないbr信”のような規制されたエンティティの違反または疑われる違反を通信によって通知する。FDAが製造業者の施設を検査する際に違反が発見された場合、機関は、識別された違反をリストし、必要な是正を行うように製造業者に指示するテーブル483を発行する。
FDAソフトウェア規制
商業上の 医療設備の定義に符合する分散ソフトウェアアプリケーションはFDAの発売前許可を必要とする可能性があり、具体的にはそれらの分類とソフトウェア機能に依存する。これらのアプリケーションは、ハードウェア医療機器コンポーネントのアプリケーションと、いくつかの“独立した”ソフトウェアとを含む。FDAは2017年、ソフトウェアを医療機器として臨床評価(SAMD)するための国際医療機器規制機関フォーラムで確立された国際原則を採用し、ハードウェア医療機器の一部ではなく、1つまたは複数の医療目的のためのソフトウェアを指す最終ガイドラインを発表した。FDAは2019年、FDAのデバイスソフトウェア機能(デバイス定義に適合したモバイル医療アプリケーションを含む)の監督管理についてガイドラインを発表した。このガイドラインはFDAまたは規制された業界に対して拘束力がないが、FDAはSAMDとデジタル健康技術のための規制方法を制定する際にこれらの原則を考慮するつもりである。
| -66- |
FDA LDTSの規制
FDA は体外診断医療設備、あるいはIVDと呼ばれる1種類の医療設備を管理し、人体サンプルを収集、調製と検査するために使用される。IVDは、疾患またはその後遺症を治癒、軽減、治療または予防するために、疾患または他の状況(健康状態を含む)を診断するための試薬、機器、およびシステムを含む。FDAは、従来、臨床実験室によって独自に開発され、患者サンプルを分析するための試験がIVDの定義に適合し、この機関の規制管轄範囲に属することを主張してきた。また,FDAは従来“裁量権の執行”を大きく行使してきた,すなわちLDTを行う臨床実験室にIVD装置の要求を遵守することは要求されていない。過去、FDAはLDT規制に関する法執行自由裁量政策を修正する意向を示し、2014年にLDTの規制枠組みを提案したが、2016年の施行までにこの枠組みを放棄した。アメリカ衛生·公衆サービス部(HHS)はLDTがFDAに発売前審査を行う必要がないことを確定したが、申請者は自発的にそのLDTに発売前通知または発売前承認を提出することができる(新冠肺炎検査であれば、緊急使用許可を提出する)。br}国会は立法を制定し、FDAにLDTの監督を指示する可能性がある。
2021年6月24日、米国議会は、革新を加速させ、テストの質を向上させるために、新たなリスクに基づくLDT審査·承認枠組みの構築に努め続け、改訂版の“検証正確先端IVCT開発(有効)法案”を再発売した。最初の建設において、有効法案は臨床実験室に重大な影響を与える可能性があり、それらのbrはいくつかの新しい要求を遵守する必要があるからである
| ● | を登録してFDAに上場し; |
| ● | 品質要求 ; |
| ● | 調査研究 ; |
| ● | 販売前の承認または承認; |
| ● | 不良事件報告;および |
| ● | と削除を訂正する |
“有効法案”はこれらの要素(および他の要素)の枠組みを概説しているが,この法律が可決されれば,次の数年間にFDAに法規の公布と指導文書の配布を指示し,臨床実験室や他の機関が新たなIVCT規制計画の策定に参加する機会を得ることになる。
アメリカ連邦貿易委員会と消費者保護法
アメリカ国内では、アメリカ連邦貿易委員会(“FTC”)は大多数の医療機器と実験室サービスの広告を規制する権利がある。また,様々な州消費者保護法が存在し,実体がその製品やサービスが消費者にどのような利益を提供できるかについてのクレームを類似して規範化することができる.場合によっては、連邦貿易委員会やアメリカ各州のbrは、医療製品の患者へのメリットなどのクレームに基づいて行動し、禁止令や巨額の罰金などの様々な処罰を求めている。これまで、医師が注文した処方薬ではなく、栄養補助食品のような消費者に直接販売される製品により多くの活動が集中してきたが、連邦貿易委員会または他の消費者保護機関は、静脈輸液障害またはLDTに関するクレームを規制する措置をとる可能性がある。
詐欺と乱用
アメリカの重要な詐欺と乱用法律は以下の通りです
| ● | 反リベート法規:アメリカ連邦“反リベート法規”(アメリカ連邦法典第42編第1320 a-7 b(B)節)は、個人およびエンティティを刑事罰に処し、直接または間接的に現金または実物の形態で要求、提供、受信、または報酬(任意のリベート、賄賂またはリベートを含む)を要求し、または個人を誘引または奨励するために、または個人の紹介または購入、レンタル、または良い施設を発注する見返りとして含む。政府医療計画(例えば、MedicareおよびMedicaid)に従って支払うことができるプロジェクトまたはサービス。 |
| -67- |
| ● | 虚偽請求法案:米国連邦虚偽請求と民事罰金法、連邦“米国虚偽請求民事法案”(南カリフォルニア大学)を含む§3729-3733)民事告発者または刑事訴訟によって個人または実体に対してインフォームドコンセントまたは虚偽クレーム法案を行うことを含む個人またはエンティティに刑事および民事罰を適用することを含む:米国連邦虚偽クレームおよび連邦民事アメリカ虚偽クレーム法案(31 US.C.C.§3729-3733)個人またはエンティティに刑事および民事処罰を適用することは、民事通報者または準訴訟に加えて、他の事項に加えて、虚偽または詐欺的な連邦医療保健計画請求の提出または提出を意図的にまたは誘導するか、または虚偽クレームを支払うための虚偽陳述または記録材料を作成するか、または連邦政府への資金支払い義務を回避、減少または隠蔽することを含み、その潜在的責任は、強制的3倍損害賠償、各クレーム重大処罰、br、および行政処罰を含む。 |
透明度 要求
“米国の医師支払い陽光法案”(すなわち、“平価医療法案”6002条:医師の所有権または投資権益の透明性報告および報告)は、いくつかの薬品、設備、生物製品および医療用品メーカーが、医師および教育病院への支払いまたは移転価値に関する情報、および医師およびその直系親族が所有する所有権および投資権益に関する情報を毎年CMSに報告することを要求する。不完全または誤った情報 を報告しないか、または提供することは、会社を処罰させる可能性がある。同じような州法です同様の州詐欺および乱用法律、例えば、米国州の反リベートおよび虚偽クレーム法律は、販売またはマーケティング手配、および政府または非政府第三者支払者によって精算される医療プロジェクトまたはサービスに関するクレームbrに適用することができる。これらの法律は一般的に広く、多くの異なるアメリカ連邦と州機関によって、そして個人的な行動によって実行される。いくつかの州の法律はアメリカ連邦政府が公布したコンプライアンスガイドラインを遵守することを要求し、設備と薬品製造業者に医者と他の医療保健提供者或いはマーケティング支出への支払いと他の価値移転に関する情報を報告することを要求する。
データ プライバシーとセキュリティ
私たちのbrは多くの連邦、州と外国の法律法規の制約を受けて、これらの法規は健康に関連する個人情報と他の個人情報の収集、使用、開示と保護を管理する。米国では、このような法律は、“連邦貿易委員会法”第5条のような健康情報プライバシー、brデータ保護およびセキュリティ法、データ漏洩通知法、および消費者保護法律法規を含む。例えば、HIPAAは、特定の医療保健 提供者、例えば、私たち、健康計画および医療情報交換所、およびそれらのそれぞれの“業務パートナー”を含む“保険エンティティ”に義務を課し、保証エンティティまたはそれを代表して作成、br}個人識別可能な健康情報を受信、維持または送信し、およびその保証されたbr}パケット事業者は、個別に識別可能な保護された健康情報のプライバシー、安全および送信の保護に関して、 またはPHIを保護する。HIPAA違反が発見されたエンティティは,安全でないPHI違反,プライバシー慣行への苦情,HHSの監査によりも,HHSとの解決合意や是正行動計画が必要であれば,HIPAA違反に対する告発を結び,重大な民事,刑事,行政罰金や処罰,および/または追加の 報告や監督義務を受ける可能性がある.
また、CCPA、CPRA、GDPR、イギリスGDPR、イギリス2018年データ保護法のようないくつかの州および非米国の法律は、個人情報のプライバシーやセキュリティを管理し、場合によっては健康に関する情報を含み、その中のいくつかはHIPAA よりも厳しく、多くの法律は互いに大きく異なり、同じ効果を生じず、コンプライアンス作業を複雑化させる可能性がある。
これらの法律を遵守しない場合、クレーム、訴訟、規制調査および他の訴訟を引き起こす可能性があり、 は重大な民事および/または刑事罰および個人訴訟を適用する可能性がある。プライバシー、データ保護およびセキュリティ法律、法規および他の義務は絶えず変化し、互いに衝突し、コンプライアンス作業を複雑化させる可能性があり、クレーム、br}調査、訴訟、または重大な民事および/または刑事罰、他の責任、およびデータ使用、記憶、および他の処理の制限を招く可能性がある。
| -68- |
健康 1996年“保険流通と責任法案”(HIPAA)
HIPAAは患者のプライバシーや患者のデータ安全などの行為を保護できなかったことに対して刑事と民事責任を加えた。さらに、“健康情報技術促進経済·臨床健康法案”及びその実施条例によれば、“健康情報技術促進経済及び臨床健康法案”は、強制契約条項を含む保護された健康情報の使用又は開示、及び保護された健康情報のプライバシー、安全及び伝送に関する合理的かつ適切な行政、物理及び技術保障の実施に関連する特定の機能又は活動を履行する保証実体及びその業務パートナーにも義務を課す。
連邦貿易委員会(“FTC”)
連邦貿易委員会は個人情報の保護に積極的な役割を果たしており,その広範な消費者保護権力に依存して,データを収集し保護することについて欺瞞的や誤った声明を発表している会社や,データ安全に関する声明と一致する情報を保護するための十分な保障措置がない場合には,実質的な罰を求めることができる.場合によっては、州法はまた、健康情報のプライバシーおよびセキュリティを管理しており、その中の多くの法律は、互いに大きく異なり、HIPAAによって先制されず、コンプライアンス作業を複雑化させることが多い。
政府と第三者支払人は臨床実験室サービスの精算と請求書を発行します
Medicare 保険範囲はMedicare福祉カテゴリの範囲内に限定され、疾患または傷害の診断または治療は合理的かつ必要な項目およびサービスである。
連邦医療保険によると,我々のテスト費用は臨床実験室料金明細書(CLFS)に基づいて支払い,支払金額を特定のbrプログラム課金コードに割り当てる。2014年4月,連邦医療保険による臨床実験室サービスの支払い方式の重大な改革を含む“保護獲得医療保険法案”(Protecting Access to Medicare Act,略称PAMA)が国会で可決された。PAMAによると、CLFSまたはMedicare医師費用表に基づいて支払われるMedicare収入の大部分は、2017年から始まり、その後3年ごと(または“高度診断実験室テスト”に対して毎年)にCMSにプライベート支払者支払率 およびそのテスト量を報告しなければならない。必要な支払い情報を報告していない実験室は巨額の民事罰金を受ける可能性がある。PAMAの要求によれば、CMSは、試験された個人支払者支払いレートの数の加重中央値に等しい実験室報告のレートおよび数を使用して、実験室 試験の連邦医療保険支払いレートを作成する。
PAMA はまた、FDAによって承認または承認されたテストおよび高度な診断ラボテストのために、新しい一時的な請求書コードおよび一意のテスト識別子を使用することを許可する。AMAのCPT編集グループは、AMAの既存の第1のクラスのCPTコードセットを補完し、PAMAの一部の実施を促進するための新しい課金コード部分を作成する。臨床実験室または製造業者は、その試験を具体的に識別するために、これらの独自の実験室分析コード( またはPLAコード)を要求する可能性がある。承認されれば、これらのコードはAMAによって四半期ごとに発行されるだろう。私たちのテスト製品には現在、中国人民解放軍コード表示は何もありませんが、私たちは私たちのいくつかのテスト製品を記述するために1つ以上の特定の中国人民解放軍コードを探すことを選択するかもしれません。
テストの請求書 は複雑です。請求書の手配と適用法律によると、保険会社、連邦医療保険、医療補助、医師、病院、雇用主団体と患者のような異なる支払人に支払わなければなりません。これらはすべて異なる請求書の要求があります。また, が適用される法律法規や内部コンプライアンス政策やプログラムを遵守することは, 課金プロセスの複雑さを増加させる.法律法規の変化は、お客様に請求書を発行したり、コストを増加させる能力に悪影響を及ぼす可能性があります。CMSはまた,新たなプログラムを構築し,政府計画請求書のカバー基準と精算プロセスの変更を評価·実施し続けている。テスト申請に関する情報の紛失や不正確さは、発行プロセスの複雑さや速度を増加させ、未開票テストの在庫を増加させたり、通常、売掛金や不良債権費用の帳簿年齢を増加させたりする可能性があります。 テストサービスのために適時かつ正確に請求書を発行できなければ、私たちのサービスが精算を得られない場合や、私たちの売掛金の帳簿年齢が増加する可能性があり、これは私たちの運営結果やキャッシュフローに悪影響を及ぼす可能性があります。
| -69- |
政府と第三者支払者からの収入 は、賠償過程で再審査後にさかのぼって調整することができ、あるいは は支払い後監査の結果として調整することができる。たとえば,医療提供者やサプライヤーからの医療保険精算申請 は,政府と第三者支払者とその代理人の不定期監査を受ける.Medicare、Medicaid、および の他の要件および法規に適合することを確実にするために、政府機関またはその代理(回復監査請負者、統一計画誠実請負者、およびMedicareおよびMedicaid計画の下で運営される他の請負者を含む)は、しばしば監査を行い、提供されたサービスを支払い、政府計画クレーム提出の要求に適合するために提出されたクレームをサポートするために、顧客記録および他の文書を要求する。個人支払者は、請求が保証要求に適合することを確実にし、言われている多額の支払いを取り戻すために法的行動をとる可能性がある類似の監査を行う。負の監査結果または詐欺または乱用疑惑は、超過支払い責任、以前に支払われたクレームの返金または払い戻し、支払いの一時停止、または政府医療計画における請求書または支払い特権の廃止、または第三者支払者との合意を終了することを含むが、これらに限定されない責任を負うかもしれない。連邦医療計画請求書に関連する適用法を遵守しないことも様々な処罰を招く可能性があるが、これらに限定されない
| ● | 多額の支払いと受取金の払い戻し; |
| ● | はMedicare/Medicaidプログラムへの参加から除外した; |
| ● | 資産 没収; |
| ● | 民事と刑事罰金と処罰;そして |
| ● | 私たちの業務運営に必要な様々なライセンス、証明書、そしてライセンスの紛失 |
これらの処罰または制裁のいずれも、私たちの運営結果またはキャッシュフローに重大な悪影響を及ぼす可能性がある。
医療改革
2010年3月、2010年の“医療·教育調整法案”により改正された“2010年患者保護·平価医療法案”は、米国で“平価医療法案”が公布され、ACAと略称された。ACAは、医療保健が政府や民間保険会社が資金を提供する方法をいくつか大きな変更を行った。ACAには他の事項のほかに、連邦や州医療計画の登録、精算事項、詐欺や乱用を管理する条項が含まれており、これらの条項は現在予測できない方法で私たちの業界と私たちのbr運営に影響を与えると予想されています。
ACAのいくつかの側面は公布以来、司法、行政、そして国会の挑戦を受けてきた。2021年6月17日、米国最高裁はACAに対する最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。最高裁が裁決を下す前に,総裁·バイデンはACA市場による医療保険の取得を目的とした2021年2月15日から2021年8月15日までの特殊保険期間を開始する行政命令を発表した。行政命令はまた、特定の政府機関に、医療の取得を制限する既存の政策および規則を検討し、再検討することを指示する。バイデン政府の他の医療改革措置または他の挑戦、ACAの廃止または代替の努力がACAまたは私たちの業務にどのように影響するかはまだ不明である。
“ACA”が公布されて以来、他の立法改正も提案され、採択された。これらの変化には、2013年4月1日に施行された2011年度“予算制御法案”によると、医療保険提供者への支払い総額が2%減少し、この法規の後続立法改正により、医療保険支払い総額は2030年まで続くが、2020年5月1日から2021年12月31日までの臨時停止brは、国会が追加的に行動しない限り除外される。“2012年米国納税者救済法” は他に加えて,病院や癌治療センターを含むいくつかの医療サービス提供者への医療保険支払いをさらに減少させ,政府が提供者に多額を取り戻す訴訟時効期間を3年から5年に延長した。将来的には追加の州と連邦医療保健改革措置も取られる可能性があり、そのいずれも臨床実験室業界に実質的な悪影響を与える可能性がある。
| -70- |
EU医療機器条例
EUは具体的な指令と法規を採択し,医療機器(体外診断医療機器を含む)の設計,製造,臨床調査,適合性評価,ラベルと有害事象報告を管理している。
Br EUでは,現在医療機器の販売前政府審査はない。しかし、EUがEU市場に市場に投入することを要求するすべての体外診断医療機器は、体外診断医療機器の設計および製造方法を含むEUの体外診断医療機器指令、指令98/79/ECまたはIVDDの基本的な要求を満たさなければならない。また、体外診断医療機器の設計および製造方法は、患者の臨床状況や安全、またはユーザおよび他の人の安全および健康を損なわない必要がある。また、この機器は、製造者の予想される性能を達成し、適切な方法で設計、製造、包装されなければならない。欧州委員会は医療機器に適用される様々な基準を採択した。また,設計や製造に関する協調基準もある.強制的ではないが、これらの基準を遵守することは、基本的な要求を満たす最も簡単な方法とみなされ、その基本的な要求を満たす装置である覆すことができる推定を作成するからである。
IVDD遵守の基本的な要求はヨーロッパ適合性マーカー(CE−Mark)の事前条件であり,このマーカーがなければ体外診断医療機器はEUで販売や販売できない。IVDD添付ファイル1に規定されている基本的な要求に適合することを証明するためには,医療機器メーカーは医療機器のタイプとその(リスク)分類によって異なる合格評価プログラムを受けなければならない。一般に,体外診断医療機器とそのメーカーが基本的な要求に適合していることの証明は,製品の正常使用条件下での安全性や性能を支援する臨床データの評価などに基づいていなければならない。特に、製造業者は、デバイスが通常の使用条件下でその予期される性能を達成し、既知および予測可能なリスクおよび任意の有害事象が最小限に低減され、その予期される性能の利益をトレードオフする際に許容可能であり、デバイス性能およびセキュリティに関するいかなる宣言も適切な証拠支持を有することを証明しなければならない。(一般的に)体外診断医療機器を除いて、メーカーは自分でその製品が基本的な要求に符合することを声明することができる, 適合性評価手続きは機関の介入を通知する必要がある。通知機関は,EU加盟国によって指定された独立組織であり,設備が市場に投入される前に設備の適合性 を評価するためのものである。通知された機関は、通常、製品の技術アーカイブやメーカーの品質システムを監査·検査する(通知された機関は、関連調整基準を実施する品質システムがこれらの要求に適合すると仮定しなければならない)。関連製品が関連する基本的な要求に適合していることが確認された場合,通知機関は合格証明書を発行し,メーカーはそれ自身の合格宣言の根拠とする.次いで、製造業者は、CEマークを装置に適用することができ、それにより、装置がEU市場全体で市場に投入されることを可能にすることができる。
合格証明書の全有効期間内に、メーカーは定期的な監督審査を受け、継続的に適用要件に適合していることを検証する。具体的には、通知機関は関連証明書を更新する前に新たな監査を行う。
EU市場に体外診断医療機器を投入するすべてのメーカーはEU医療機器警戒制度を守らなければならない。この制度によれば,事故はEU加盟国の関連当局に報告しなければならず,メーカーは市場に投入された体外診断医療機器の使用に関連する死亡や健康状態が深刻に悪化するリスクを低減するための現場安全是正措置(FSCA)を講じなければならない。事故は、デバイスの特性および/または性能の任意の故障または悪化、ならびにラベルまたは使用説明書における任意の不足として定義され、患者または使用者または他の人の死亡またはその健康状態の深刻な悪化を直接的または間接的にもたらす可能性がある。FSCAには、リコール、修正、交換、廃棄、またはリフォーム設備を含むことができます。FSCAは、現場セキュリティ通知を介してそのクライアントおよび/またはデバイスのエンドユーザに製造業者またはその法律によって代表されなければならない。
| -71- |
体外診断医療設備の広告と販売促進はEU指令で規定されているいくつかの一般原則を守らなければならない。IVDD規定によると、CEマークを有するデバイスのみが、その予想される用途に応じてEUでマーケティングおよび広告を行うことができる。誤解性および比較広告に関する指令 2006/114/ECおよび不公平な商業行為に関する指令2005/29/ECは、医療機器広告のための具体的なものではないが、その広告にも適用され、例えば、広告 が証拠、バランス、および非誤解性を有することが要求される一般的なルールを含む。具体的な要求は国家レベルで決定された。EU加盟国の医療機器広告や販売促進に関する法律は管轄区域によって異なり、一般大衆への宣伝や販売促進製品を制限または制限する可能性があり、医療保健専門家の販売促進活動に制限を加える可能性がある。
EUの多くの加盟国はすでに具体的な反贈与法規を通じて、医療機器(体外診断医療機器を含む)の商業行為、特に医療保健専門家と組織をさらに制限している。さらに、最近、医療専門家または実体に提供される支払いおよび価値移転の規制を強化する傾向がある。また、多くのEU加盟国は、米国の医療機器メーカーに対する要求と同様に、報告および透明性に (通常年1回)を要求する国“陽光法案”を採択している。特定の国/地域ではまた商業コンプライアンス計画が強制的に実施されている。
EUでは、規制機関は、会社、サプライヤー、および/または下請け業者に対して発表された検査および発表されていない検査を行い、必要に応じて専門ユーザの施設を検査する権利がある。監督管理要求 (状況に応じて)を遵守できなかった場合は、規制機関の意見に応えるために時間と資源が必要となる可能性があり、状況に応じて是正と予防措置を実施する。監督管理機関は広範なコンプライアンスと法執行権力を持っており、このような問題が満足できる解決が得られなければ、見出しや警告状、罰金、同意法令、禁止、br、あるいは民事或いは刑事罰を含む様々な行動をとることができる。
医療機器に関する連合の規制構造が変化している。2017年4月5日、欧州議会および欧州理事会は、医療機器の体外診断に関する(EU)2017/746条例および第98/79/EC号命令の廃止と欧州委員会第2010/227/EU号決定またはIVDRの採択を、公衆の健康と患者の安全をより良く保護するための近代的かつより強力なEU立法枠組みを構築することを目的とした。指令と異なり,IVDRは国家法に変換される必要がないため,異なる欧州市場間で解釈が一致しないリスクが低下している。
IVDRはリリースから5年後(2022年5月26日)に発効する。適用されると、他の事項を除いて、IVDRは:
| ● | 設備を市場に投入するルールを強化し、設備が発売された後に監視を強化する |
| ● | 市場に投入された設備の品質、性能、安全に対するメーカーのフォロー責任を明確に規定する |
| ● | 輸入業者と流通業者の義務と責任に関する明確な規定を制定する |
| ● | 新条例要求を遵守するすべての方面に最終的な責任を有する者を決定する義務があると規定されている |
| ● | 唯一の識別コードを導入することによって、医療機器のサプライチェーン全体におけるエンドユーザー或いは患者の追跡可能性を高め、メーカーと監督機関がサプライチェーンを通じて特定の機器を追跡する能力を高め、安全リスクが発見された医療機器を迅速かつ効果的にリコールすることを促進する |
| ● | 中央データベース(Eudame)を構築し、患者、医療保健専門家と公衆にEUの既存製品に関する全面的な情報を提供する |
| ● | いくつかの高リスクデバイスを評価するルールを強化し、これらのデバイスは、市場に投入される前に専門家の追加検査を受ける必要がある可能性がある。 |
| -72- |
EU臨床実験室に関する法規{br
EUには、臨床実験室運営を管理するための米国CLIAのような全体的な法律または法規がない。しかし、EU加盟国の法律は検査サービス提供者としての私たちの業務展開方式に影響を及ぼすかもしれない。
その他の臨床実験室の仕事に影響を与える法律とガイドラインは“生物学と医学応用における人権と人類の尊厳を保護する条約”、世界医学協会が採択した“ヘルシンキ宣言”及び関連研究倫理委員会が発表した関連行為準則とガイドラインを含む。
保証と精算
国際市場では,精算や医療支払いシステムは国/地域によって大きく異なり,多くの国/地域で特定製品ラインやプログラムに価格上限が設けられている。EUでは、加盟国が製品を国や地域の医療サービスプロバイダが精算できるかどうか、国が運営する医療計画に基づいて設備の価格を制御することができるかどうか。brはますます多くの地方特定製品精算法が医療機器規制に適用され、brの追加的な許可要求を提供している。
知的財産権
私たちの独自技術および製品を保護し、私たちが特許保護を維持する能力(私たちの候補製品の組成、それらの使用方法、および他の関連技術および発明を含む)は、私たちの業務成功の鍵となる要素だと思います。2022年11月16日現在、私たちの許可知的財産権は、ヨーロッパで発行された特許 ;米国での許可出願、カナダでの係属中の出願、および係属中の特許協力条約(すなわちPCT)出願を含む。
私たちのライセンス知的財産権の組み合わせは以下のものを含みます
| タイトル | 国 | アプリケーション No | 出版物 第 | 登録 No | 状態.状態 | |||||
| 乳癌患者の階層化方法及び遺伝子署名を含むキット | アメリカ アメリカ | 16308564 | US20190161809A1 | 許す | ||||||
| 乳癌患者の階層化方法及び遺伝子署名を含むキット | カナダ | 3025860 | 未定である | |||||||
| 乳癌患者の階層的遺伝子署名を含む方法 | ヨーロッパ.ヨーロッパ | 177320785 | 3472345 | 3472345 | EP が承認された | |||||
| 乳癌再発リスクの決定方法及びキット | % | PCTEP2021062176 | WO2021224466 | すでに出版された |
我々は、乳癌患者のリスク階層化方法およびキットを開示するライセンスに従ってミラノIEO/大学 から特許シリーズを取得した。この特許シリーズは、カナダで処理される出願、米国で許可された出願、およびヨーロッパで付与された特許を含む。この特許シリーズで発行される特許は2037年6月に満期となり、複数の管轄区域で取得可能ないかなる特許期間の延長も含まれない。
乳癌の再発リスクを決定するための方法およびキット が開示されたライセンスに従ってIEO/ミラノ大学から第2の特許シリーズの権利を取得した。この特許シリーズは、2022年11月に欧州で国家段階に入る出願中のPCTを含む。この特許シリーズで発行される特許は、複数の管轄区域で取得可能ないかなる特許期間の延長も含まれない2041年5月に満了する。
| -73- |
私たちは私たちの知的財産権の組み合わせに関連するいかなる第三者クレームや論争のある訴訟も知らない。
IEO/ミラノ大学ライセンス契約
Tizianaは2014年6月24日、ミラノIEO/大学と独占ライセンス契約(“ライセンス”)を締結し、Tizianaは、いくつかの特許下のグローバル独占ライセンスを取得し、IEO/ミラノ大学の特定の独自技術下でのグローバル独占ライセンスを取得して、多遺伝子予測ツールに関連するライセンス製品を開発し、商業化する。ライセンスは、2020年10月30日に分割協定に含まれる手配の一部として割り当てられています。ライセンス条項によると、指定された職務遂行調査マイルストーンを含むライセンス製品の開発と商業化に合理的な努力をする義務があります。
2022年11月9日,AccuStemとIEO/ミラノ大学はライセンスを改正し,StemPrintER商業化の規制経路とスケジュールを明らかにした。具体的には、規制要件言語は、(I)許可製品の法規の承認または承認の時間を改訂の日から36ヶ月に延長し、(Ii)試験室開発の試験を承認または承認することによって契約法規要件 を満たすことができることを明らかにすることができる(すなわち、承認または承認はFDAではなくCLIA規制経路によって達成されることができる)、および(Iii)商業的に発売される時間は、改正された日から60 ヶ月延長された。この改正規定では,当局は“淫行及び不雅物品規制条例”に別途175,000元の免許料を払わなければならない。
ライセンスはまた、2022年11月10日の1.0176ドルの為替レートに基づいて、最大300,000ユーロ(または305,280ドル、2022年11月10日の1.0176ドル)の開発マイルストーン支払いと、純売上高に1桁パーセント印税 を支払うことを可能にします。すべての国/地域のすべてのライセンス製品の印税期限が満了するまで、ライセンスはずっと有効です。重大な違約が発生した場合、どちらもライセンスを終了することができ、また、30日の通知後のいつでもライセンスを終了することができます。
属性
私たちの会社の本社は現在イギリスロンドンPark Lane 55号に位置しており、共有サービスプロトコルにより、Tizianaとこのアドレスを共有しています。私たちはこのような施設が私たちの現在と最近の未来の必要性を満たすのに十分だと信じている。
法的訴訟
私たちは時々通常の業務過程で発生する様々な法的行動と不満の側になるかもしれない。正常な業務過程における承諾と義務のほかに、様々なクレーム、未解決、潜在的な法的訴訟、政府の法律法規に関する調査、私たちの正常な経営業務に関する他の事項に直面しています。任意の特定の時期において、キャッシュフローまたは経営結果は、上述した1つまたは複数の事項の不利な解決によって大きな影響を受ける可能性がある。
| -74- |
管理する
次の表は、本募集説明書までの日まで、私たちのすべての役員と役員の名前と年齢を示しています。
| 名前.名前 | 年ごろ | ポスト | ||
| ウェンディ·ブロディ | 56 | 取締役CEO兼最高経営責任者 | ||
| ジェフ·フェンステル | 43 | 首席運営官 | ||
| ジョー·フラナガン | 48 | 首席商務官 | ||
| キレン·シャア | 46 | 首席財務官 | ||
| ガブリエル·チェロン | 50 | 役員.取締役 | ||
| ウィリー·サイモン | 70 | 役員.取締役 | ||
| ジョン·ブランカシオ | 74 | 役員.取締役 | ||
| ショーン·マクドナ | 62 | 役員.取締役 |
ウェンディ·ブロサー
ウェンディ·E·ブローサーは2022年3月から最高経営責任者を務めてきた。わが社に加入する前に、Blosserさんは各種の職務を担当し、診断、外科と資本領域で組織を再起動と創立し、主に腫瘍学と女性の健康に注目した。私たちに参加する前に、イブザーさんは個人的な理由で1年間休暇を取った。2019年5月から2021年3月まで、ブローサーさんはAgendia N.V.で首席商務官を務めた。2018年3月から2019年5月まで、BlosserさんはCaravelベンチャーポートフォリオ(アニメ動力学、Strand Diagnostics)で複数の幹部を務めた。2015年2月から2018年3月まで、ブロサーさんは販売副総裁(2015年2月から2017年3月)を務め、その後BiodeSix首席商務官(2017年3月~2018年3月)を務めた。これまで、Blosserさんは集積腫瘍学(LabCorp子会社)で販売副総裁を務めていた。ブロサーさんはCytyc Corporationで彼女の診断学生活を始め、同社の8年間、彼女はいくつかの指導職を務めた。ブロサーさんが診断分野で製品を発売し、再発売した背景、複数の会社にコンサルティング支援を提供した経験、企業リーダーの記録が彼女を取締役会のメンバーにする資格があると信じています。
ジェフ·フェンステル
Jeff フェンステルは2021年12月から会社の首席運営官を務めている。私たちに参加する前に、Fenstererさんは、Agendia N.V.で2019年7月から2021年12月まで、グローバルマーケティングおよびマーケティング戦略の副社長を務めました。この間、彼は製品戦略をリードして新技術を商業化し、マーケティング計画を制定し、強力な販売量と収入増加を実現した。Fenstererさんは、2018年3月から2019年6月まで、Caravel Venturesポートフォリオ(アニメーション·ダイナミクス、Strand Diagnostics)で複数のリーダーを務めています。Fenstererさんは、2015年2月から2018年3月まで、BiodeSixビジネス戦略上級取締役を含む様々なビジネスリーダーシップを担当しています。さんは、2015年5月にカーネギーメロン大学テッパービジネスマネジメント修士号を取得し、2001年5月にセントビンセント大学で理学療法士号を取得しました。
ジョー·フラナガン
Joe フラナガンは2022年1月から私たちの首席商務官を務めています。Flanaganさんは、初期診断から大手製薬会社の複数の製品の商業開発、成功への導入にリーダーシップを発揮した戦略的専門家である25年を超える優れた販売経験を持っています。我々に加入する前に、2021年4月から2022年1月まで、フラナガンさんはAmbry Geneticsの腫瘍学特許経営においてbrビジネスリーダーの職を務めていた。2019年7月から2021年3月まで、フラナガンさんはAgendia N.V.市場開発部副総裁 を務め、戦略販売計画をリードしています。2018年7月~2019年7月、彼はCirculogeneセールス副社長を務め、癌患者のための血液ベースのゲノムおよび遺伝子検出を販売する会社をリードしています。 2015年3月から2018年7月までの間、フラナガンさんはBiodeSixイーストセールス副社長を務め、米国東部の販売と収入を担当しています。
Keeren Shah
Keeren Shahは2021年8月以来私たちの首席財務官を務めてきました。Shahさんは2021年3月からOkyo Pharma Limitedの首席財務官を務め、2020年8月からTiziana生命科学有限会社とRasna Treateutics,Inc.の財務総監を務め、2016年6月から2020年7月までTizianaとその関連会社の財務総監を務めてきた。その前に、ShahさんはVisa、Inc.で財務チームの高級主管を10年間担当し、肝心な財務制御活動、財務計画と分析及び核心プロセスを担当し、そして肝心な転換計画とVisaの初公開株式(IPO)を指導と参与した。Visaに加入する前に、ShahさんはArthur AndersenやBBC Worldwideなど、他の大手会社で様々な財務職を務めていた。彼女は経済学の栄誉文学士の学位を持ち、特許管理会計士協会のメンバーだ。
| -75- |
ガブリエルチェロン
ガブリエル·マルコ·アントニオ·チェロンさんは2021年3月以来、当社の取締役の責任者を務めてきました。チェロンさんは、腫瘍学、感染症および分子診断学の分野で10社のバイオテクノロジー企業を設立し、うち7社はナスダック市場に上場し、ロンドン証券取引所マザーボード市場とロンドンAIM市場に2社上場しています。Cerroneさんは、Tiziana生命科学株式会社を設立し、2014年4月から同社の実行議長を務めています。チェロンさんは腫瘍会社カーディフ腫瘍学会社の共同創業者であり、同社の連合会長を務めた;Synergy PharmPharmticals,Inc.とカリスト製薬会社の共同創業者と会長であり、SIGA Technologies,Inc.の取締役メンバーであり、SIGA Technologies,Inc.の再編をリードしている。チェロンはまた、人と共同でFermaVir製薬会社を創立し、取締役会の会長を務め、2007年9月までInhibitex,Inc.とInhibitex,Inc.を買収した。チェロンさんはInhibitex,Inc.の取締役を務め、2012年9月まで25億ドルの価格で施美百宝に売却した。Cerroneさんは、白血病療法に集中した共同創業者であるRasna Treateutics Inc.の共同創業者であり、 Heion PharmPharmticals,Inc.の共同創業者;Gensignia Life Sciences,Inc.の共同創業者であり、Gensignia Life Sciences,Inc.はmicroRNA技術を使用した腫瘍学に専念した分子診断会社です;そしてBioVitas Capital Ltdの創始者です。Cerroneさんはニューヨーク大学ストーンビジネススクールを卒業し、工商管理修士号を取得しました。我々は、切竜さんのビジネスと金融の専門知識は彼が取締役会のメンバーになる資格があると信じています。
ウィリー·サイモン
2021年3月以来、サイモン·さんは同社の取締役を務めてきた。彼は銀行家で、Kredietbank N.V.とシティロンドン銀行で働いたことがあり、1997年から1999年までの間にGenerale Bank NL取締役会の執行メンバーを務め、1999年から2002年の間に富通投資管理会社(Fortis Investment Management)の最高経営責任者を務めた。2002年から2004年まで、彼はOyens&van Eeghen銀行の会長を務めた。2014年までAIM-TradedVelox 3 plc(前身は24/7全天候ゲームグループホールディングス)の会長を務め、取締役は場外取引上場会社Playlogic Entertainment Inc.の株主だった。ウィリー·サイモンは2006年からアムステルダム上場会社Bever Holdingsの会長を務め、2015年からDucat Seaの会長を務めてきた。彼は奥代製薬株式会社とTiziana生命科学株式会社の非執行役員でもあります。我々はサイモンさんのビジネスリーダーが彼を取締役会のメンバーにする資格があると信じています。
ジョン·ブランカシオ
ブランカシオさんは、2021年3月から当社の取締役を務める退職公認会計士です。2004年4月から2017年5月までの間に、Brancaccioさん は、医療機器会社インキュベーターAccelerated Technologies,Inc.の首席財務官を務めた。Brancaccioさんは、2004年4月から2013年1月にSynergy PharmPharmticals,Inc.と合併するまで、カリスト製薬会社の取締役マネージャーを務め、2004年4月からTamir Biotech,Inc.(前身はアルファ社)の取締役マネージャーを務め、2013年12月からヘピン製薬会社の取締役マネージャーを務め、2016年9月からRasna治療会社の取締役マネージャーを務め、2020年6月からOkyo Pharma Ltd.社の取締役を務め、2020年7月からTiziana生命科学社の取締役社長を担当する。2008年7月から2019年4月まで、ブランカシオが取締役の最高経営責任者を務めた。我々は、さんBrancaccioの金融経験によって、彼が取締役会のメンバーになる資格があると信じています。
ショーン·マクドナ
“br}マクドナさんは、2022年11月から当社の役員を务めます。マクドナは2015年1月以来、眼科疾患に専念するバイオテクノロジー会社Ocugenix,Inc.の最高経営責任者兼CEO総裁を務めてきた2015年から2016年まで、マクドナさんはアダムス資本管理会社のリスクパートナーであり、アダムス資本管理会社は初期応用技術投資を専門とするベンチャー企業である。これまで、2001年から2014年にかけて、マクドナさんは精密治療会社のCEOを務め、初めて癌生物学的ブレークスルーと機械学習の使用を組み合わせたバイオテクノロジー会社の1つであり,癌患者の最も有効な癌治療を支援できる製品の開発を目指している。我々は、マクドナさんの業務と管理経験によって、彼は取締役会のメンバーになる資格があると信じています。
| -76- |
家族関係
私たちのどの幹部や役員の間には他の家族関係はありません。
法律の手続きに関与しています
私たちの知る限り、過去10年間、私たちの役員または役員は、S-Kルール401(F)項 に記載されたいかなる法的手続きにも参加していない。
取締役 独立
私たちの取締役会は各役員の独立性を検討した。当社取締役会では、彼の背景、仕事、および従属関係に関する情報を提供することに基づき、サイモンさんとブランカシオさんを決定しました。取締役の責任履行を妨害する際に独立判断を行使する関係 は存在せず,これらの 取締役はいずれもナスダック資本市場上場基準で定義されている“独立”取締役である.私たちは今回の発行を完了する前に、独立した取締役を再任命する予定です。これらの決定を行う際に、我々の取締役会は、各非従業員取締役の現在と以前のわが社との関係と、各非従業員取締役が私たちの株式に対する実益所有権を含む、彼らの独立性の決定に関連するすべての他の事実および状況を考慮し、“いくつかの関係および関連する個人取引”という節で説明された彼らに関連する取引を含む
取締役会と委員会
私たちの取締役会は監査委員会、指名委員会、そして報酬委員会を設立した。この委員会のすべては正式に許可された義務の下で運営されている。
監査委員会
取締役会の監査委員会はJohn BrancaccioとWilly Simonで構成されている。委員会はJohn Brancaccioが議長を務め、担当している
| ● | 内部統制の質を監督し、私たちの財務業績が適切に測定され、報告されることを確実にする | |
| ● | 役員のリスク評価を審議し、取締役会全体で議論するための項目を提出する | |
| ● | 会計政策、会計処理、および財務報告書の開示の審査を含む、経営陣および監査役が提出した中期および年間勘定に関する報告書を受領し、審査する | |
| ● | 会社全体及びその子会社が使用する会計及び内部統制制度を考慮する | |
| ● | 非常勤監査人の任命や再任命について取締役会に提案し、その採用条項を審査し、非常勤監査師の独立性、客観性、有効性を監督することを含む、私たちと外部監査人との関係を監督する。 |
監査委員会は各財政年度に2回以上の会議を開催し、私たちの監査人に制限されることなく接触することができる。
我々の取締役会はJohn Brancaccioがナスダック上場規則第 5605(A)(2)節で定義された“監査委員会財務専門家”であることを決定した。
取引法第10 A-3条に規定する監査委員会メンバーの独立性基準を満たすために、上場企業監査委員会の各メンバーは、その監査委員会、取締役会又は任意の取締役会委員会のメンバーとしてでなければ、上場企業又はその任意の子会社の任意の相談、相談又はその他の補償費用を直接又は間接的に受け入れてはならない。私たちの監査委員会の構成は、現在の米国証券取引委員会規則の独立性に対する要求に適合すると信じている。
| -77- |
報酬委員会
取締役会の報酬委員会はWilly SimonとJohn Brancaccioで構成されている。この委員会はウィリー·サイモンが議長を務めています
| ● | 執行役員の業績を審査する |
| ● | 執行役員の報酬やサービス条件に関する事項について取締役会に提案し、 | |
| ● | 時々実施される任意の株式購入計画或いは株式激励計画に基づいて株式購入及びその他の持分激励を付与する提案について取締役会に提案を提出する。 |
給与委員会は提案する時、私たちの株主の利益と私たちの業績を適切に考慮するだろう。
取引法第10 C-1条に規定されている報酬委員会メンバーの独立性基準を満たすためには、取締役が当該会社に関係しているか否かを決定することに関連するすべての要因を考慮しなければならない。これは、報酬委員会メンバーの職責において管理層から独立した取締役の能力にとって重要であるが、これらに限定されない:(1)取締役の報酬源は、その会社が取締役に支払う任意の相談または他の補償料を含む。(2)取締役が会社またはその任意の子会社または関連会社に所属しているかどうか。私たちの報酬委員会の構成は、現在の米国証券取引委員会規則下の独立性要件に適合すると信じている。
私たちの給与委員会のメンバーの中には私たちの会社の高級職員や従業員だった人は一人もいません。
指名委員会
取締役会指名委員会はJohn BrancaccioとWilly Simonで構成されている。委員会はJohn Brancaccioが議長を務め、担当している
| ● | 役員選抜基準と招聘手続きを制定する | |
| ● | 私たちの取締役会とその対応する委員会に候補者を推薦します | |
| ● | 取締役会メンバーと役員の個人運営状況を評価し、評価結果を取締役会に報告する | |
| ● | 会社管理基準を制定する。 |
道徳基準
私たち はすべての取締役会のメンバー、高級管理者、従業員に適用される正式な商業行為と道徳基準を通過しました。私たちのビジネス規則は私たちのサイトwww.AccuStem.comで見つけることができます。AccuStem Sciences,Inc.秘書に書面で要求すれば,我々の“商業行為と道徳規範”のコピー ,住所は1954 New York,NY 10001,ペンシルバニア広場5号を無料で得ることができる.もし私たちの“商業行為と道徳基準”を実質的に修正したり、任意の幹部や取締役に“商業行為と道徳基準”の任意の免除を付与したりすれば、私たちは直ちに私たちのウェブサイトで修正または放棄の性質を開示します。 Www.AccuStem.comおよび/または私たちがアメリカ証券取引委員会に提出した公開文書で。
| -78- |
役員報酬
集計表 給与表
2020年6月5日から2020年12月31日までの期間および2021年12月31日までの1年間、私たちの役員には、年金、退職、同様の福祉のような現金報酬やbr福祉は支払われていません。
招待状 封
ウェンディ·ブロサー
私たちは2022年2月18日にBlosserさんと招聘書を締結し、この招聘書は2022年3月4日に発効した。この招聘書はブロサーさんが年間425,000ドルの初期年間基本給を得る権利があるようにする。Blosserさんは基本給の45%までの年間ボーナスを得る資格があり、ボーナス金額は私たちの取締役会が自ら決定し、2022年第1四半期にこのようなボーナスのうち47,813ドルを支払うことを保証することを前提としている。Blosserさんは株式オプションを受け取り、普通株490,000株を1株2.66ドルで購入し、オプションは2022年3月4日の第1、第2、第3周年にそれぞれ10%の株式を付与し、2022年3月4日の4周年に20%の株式を付与し、1回の株式融資を完了した後に25%の株式を付与し、2023年末までに米国でCLIA認証の実験室“br”を開始した際に30,000,000ドル以下の純収益と25%の株式を獲得する。この協定はブロサーさんが私たちに雇われたことを自発的に規定しているさらに、Blosserさんはまた1年間の非競争と非招待条項を守らなければならない。
ジェフ·フェンステル
我々は2021年11月25日にFenstererさんと招聘状を締結し、2021年12月13日に発効する。この招聘状はFenstererさんが年間300,000ドルの初期年間基本給を得る権利を与えた。Fenstererさんは、基本賃金の40%までの年間ボーナスを得る資格があり、そのボーナス額は我々の取締役会が自ら決定する資格があります。さんFenstererは、普通株式を1株2.66ドルで1株2.66ドルで購入するストックオプションを受け取り、そのうちのオプションは2022年3月4日の第1、第2、第3記念日に10%、2022年3月4日の4周年には20%の株式を付与し、1回の株式融資を終えて25%の株式を取得することで、2023年末までに米国でCLIA認証を開始する際に30,000,000ドル以上の純収益と25%の株式を得ることになる。合意によると、Fenstererさんは自由に私たちに雇われることができますまた、Fenstererさんは1年間のスポーツ禁止条約やeスポーツ禁止条約にも拘束されている。
ジョー·フラナガン
我々は、2021年12月6日にフラナガンさんと招聘状を締結し、2022年1月17日に発効します。フラナガン·さんは、初年度の基本賃金を年間300,000ドルで取得する権利を持っています。フラナガンさんは、基本賃金の40%までの年間ボーナスを得る資格があり、そのボーナス額は当社の取締役会が自ら決定します。Flanaganさんは、1株2.66ドルで普通株式を2.66ドルで購入するストックオプションを受け取り、オプションは2022年3月4日の第1、第2、第3記念日に10%の株式を付与し、2022年3月4日の4周年に20%の株式を付与し、1回の株式融資を完了した後に25%の株式を取得し、2023年末までに米国でCLIA認証を開始する際に30,000,000ドル以下の純収益および25%の株式を取得することになります。契約によると、フラナガンさんは任意に私たちに雇われることができます。また、フラナガン·さんは、1年間のスポーツ禁止条約やeスポーツ禁止条約も遵守しなければならない。
プロトコルにお問い合わせください
Keeren Shah
私たちは2021年3月1日にShahさんとコンサルティング契約を締結し、取締役金融サービスを提供します。この協定は、Shahさんが2022年11月10日までの1 GBから1.1677ドルのレート比率に基づく年間15,000 GB(17,516ドル)の基本費用を得る権利があるようにする。シャアさんもボーナスを得る資格があるかもしれません。ボーナスの額は私たちが自分で決めます。
| -79- |
Shahさんはどんな付随的な福祉も受ける権利がない。Shahさんの会社での相談が理由なく終了された場合、Shahさんは関連通知中の彼女のすべてまたは任意の残りの部分の基本費用に相当する代替費用の支払いを受ける権利があるだろう。
Shahさんはまた6ヶ月間の非招待状契約を守らなければならない。
ガブリエルチェロン
我々は、2022年1月1日にCerroneさんとコンサルティング契約を締結し、業務発展、戦略計画、会社財務助言を提供し、取締役会の執行議長としての役割を果たします。このプロトコルは、Cerroneさんが年間66,000ドルの基本料金を取得する権利を持っています。切竜さんもボーナスを得る資格があり、ボーナスの額は私たちが自分で決めることができる。
Cerroneさんはいかなる福祉も受ける権利がありません。Cerroneさんと会社からの諮問が理由なく終了した場合、Cerroneさんは、基本料金の代わりに、関連通知期間の全部または残りの部分について、その基本料金に相当する支払いを受ける権利を持っています。
Cerroneさんはまた、6ヶ月間の非招待状契約を遵守しなければなりません。
年間ボーナス
現在、私たちの上級指導者グループの毎年のボーナス機会はそれぞれの給料の40%~45%だ。ボーナス計画はキー企業のマイルストーンの成果に基づいており、取締役会の承認状況に応じて決定される。会社が従業員を増やすことに伴い、私たちはボーナス計画を拡大する予定です。
財政年度終了時に返済されなかった持分奨励
2021年12月31日まで未完成株式奨励
取締役と非従業員報酬政策
次の表には、2021年12月31日までの年度非従業員董事所が稼いだ給与の資料を示しています。2020年6月5日から2020年12月31日までの間に報酬を稼いでいません。
| 2021年12月31日までの年度 | ||||||||
| 名前.名前 | 稼いだ費用や 現金払い(ドル) | 合計(ドル) | ||||||
| クァンバル·シャルーバイ博士(1) | — | — | ||||||
| ガブリエル·チェロン | — | — | ||||||
| ウィリー·サイモン | 4,166 | 4,166 | ||||||
| ジョン·ブランカシオ | 4,166 | 4,166 | ||||||
(1) サルバイ博士は2022年6月20日に取締役を辞任する。
安全な利益を得る所有者と経営陣の所有権
次の表は2022年11月16日までの私たちの普通株の利益所有権を示しています。具体的には以下の通りです
| ● | 私たちが知っている実益は私たちの普通株式の5%以上のすべての人またはグループの関係者を持っています | |
| ● | 指名されたすべての執行官は | |
| ● | 私たちすべての役員は | |
| ● | チームとして、私たちのすべての現職幹部と役員。 |
| -80- |
私たち は米国証券取引委員会規則に基づいて利益所有権を決定したので、それは私たちの証券に対する単独または共有投票権または投資権 を代表する。以下で別途説明しない限り,表 で指名された個人と実体は,その実益が所有するすべての株式に対して独占投票権と独占投資権を持つが,適用されるコミュニティ財産法 を遵守しなければならない.この情報は、取引法第13(D)および13(G)条に基づく規定を含む、利益所有権が任意の他の目的のために使用されることを必ずしも示すものではない。
我々 は、2022年11月16日現在の発行済み普通株の株式から、今回の発行前の実益所有権パーセンテージを計算します。我々は,今回の発行完了後に発行された普通株の株式 から今回の発行後の利益所有権パーセンテージを計算し,引受業者が追加株式購入の選択権を行使していないと仮定し,仮定した初公募株価格1株$に基づいて,本募集説明書の表紙に規定されているbr推定発行価格区間の中点である.現在行使可能であるか、または2022年11月16日から60日以内に行使可能な普通株式を未弁済株式と見なし、当該株式購入権を保有する者が実益して、当該者の所有率を計算する。しかし、他の人の所有権率を計算するために、私たちはこれらのbr株を発行済み株と見なしていない。別の説明がない限り、次の表に列挙された各受益者の住所はc/o AccuStem Sciences,Inc.,5 Penn Plaza,19であるこれは…。ニューヨーク1954階、郵便番号:10001。
| 実益所有株 | 実益所有株 | |||||||||||||||
| 今回発売される前に | 今回の献祭の後 | |||||||||||||||
| 実益所有者の氏名または名称 | 株 | パーセント(1) | 株 | パーセント | ||||||||||||
| 任命された行政員と役員 | ||||||||||||||||
| ガブリエル·チェロン(2) (3) (4) | 3,872,264 | 34.00 | % | % | ||||||||||||
| ウィリー·サイモン | 9,789 | * | ||||||||||||||
| キレン·シャア(5) | 5,251 | * | ||||||||||||||
| ジョン·ブランカシオ(6) | 8,964 | * | ||||||||||||||
| ウェンディ·ブロディ | 2,000 | * | ||||||||||||||
| ショーン·マクドナ | - | - | - | - | ||||||||||||
| ジェフ·フェンステル | - | - | - | - | ||||||||||||
| ジョー·フラナガン | - | - | - | - | ||||||||||||
| 執行役員全員と役員(8人) | 3,898,268 | 34.19 | % | |||||||||||||
| 株主の5% | ||||||||||||||||
| プーランウィズグループ有限公司(1) (2) | 3,294,338 | 29.03 | % | % | ||||||||||||
| Tiziana生命科学有限公司 | 1,337,970 | 11.79 | % | |||||||||||||
| * | 受益所有権が1%未満であることを示す. |
| (1) | “実益保有株式率”は、2022年11月16日現在発行および発行された11,346,535株普通株に基づいて計算される。 |
| (2) | ガブリエル·チェロンは当社傘下取締役グループ有限公司の全発行株式の実益所有者です。Planwiseグループ有限公司は英領バージン諸島に登録設立され、登録住所はVG 1110、英領バージン諸島トルトラ路鎮Wickhams Cay IIビステラ企業サービスセンターです。 |
(3)
|
この には、Cerroneさんが保有する株式や、Planwise Group LimitedおよびPanetta Partners Limited(Cerroneさんが実益権益を所有しているとみなされるエンティティ)が株式を保有しています。 |
| (4) | 41,041個の株式オプションからなり、現在行使可能または2022年11月16日から60日以内に行使可能 |
| (5) | 現在行使可能または2022年11月16日から60日以内に行使可能な5,001件の株式オプションを含む |
| (6) | 8964個の株式オプションからなり、これらのオプションは現在 を行使することができ、または2022年11月16日から60日以内に行使することができる |
| -81- |
ある 関係と関連先取引
以下のbrは、2020年1月1日以来、私たちが参加している取引の概要を含み、関連金額がbrを超えるか、または12万ドルを超えるか、または2021年12月31日までの私たちの総資産平均値の1%を超え、これらの取引において、私たちの取締役、役員、または私たちの知っている限りでは、5%を超える当社株を有する実益所有者、または前述の者の直系親族のいずれかが、直接または間接的な重大な利益、持分およびその他の補償を有することを除いて、終了します。統制権及びその他の手配の変更は、本募集明細書の他の箇所に記載されている。以下では,我々の役員,役員,株主との他の取引についても紹介する.
企業再編
AccuStem Sciences LimitedはTiziana Life Science plc(“Tiziana”)から分割(分割)して設立され,AccuStem Sciences Limited(“Old AccuStem”)が2020年6月5日にイングランドとウェールズに登録設立され,会社法有限責任 によって設立された民間会社であり,会社番号は12647178である。その他の事項を除いて、分割の条件は、裁判所がTizianaの減資を承認することを含み、Tizianaの株主は2020年10月2日に特別決議によりTizianaの減資を承認した。裁判所は2020年10月27日にTizianaに関する資本削減を承認し,分割は2020年10月30日に発効した。
分割プロトコルでは,TizianaはStemPrintER Sciences Limited(“StemPrintER Sciences”)のすべての発行済み株式を我々に譲渡し,StemPrintER SciencesはTizianaのエンティティであり,TizianaはこのエンティティにStemPrint プロジェクトに関するすべての資産と知的財産権および1,353,373ドル(1,000,000 GB)の現金を提供することを規定している.
分割の目的で,TizianaはまずStemPrintプロジェクトに関連する資産(主にミラノIEO/大学から取得したライセンスおよびアウトソーシング研究プロジェクトの利益)を別の会社StemPrintER Sciences,および1,353,373 ドル(1,000,000 GB)現金に移した。このステップの結果として,StemPrinter Sciencesが1つの運営エンティティとなる.次の段階で、TizianaはTizianaの株主の株と引き換えにStemPrinter Sciencesの株を1対1で私たちに譲渡し、Tizianaはこれらの株の株主に実物配当を発表した。
2021年1月1日に私たちと締結された共有サービス契約の条項によると、分割が完了した後、Tiziana は、いくつかの限られた管理·行政サービスを提供し続けていく予定です。共有サービス協定の条項によると、Tizianaは、双方が合意したコストに基づいて、様々な行政、財務、法律、税務、保険、施設、情報技術、その他のbrサービスを提供することに同意しています。共有サービスプロトコルの初期期限は2021年12月までで、その後3ヶ月連続で自動的に更新されている。双方はいつでも相互に共有サービスプロトコル を終了することができる.しかも、私たちは30日前に共有サービス協定を終了することを書面で通知することができる。他方がそれぞれの実質的な義務を履行できなければ,双方は本プロトコルを終了することができる.
私たちの役員と取締役と協定を結びます
我々は2021年3月1日にシャアさんとコンサルティング契約を締結し、取締役金融サービスを提供した。この協定は、Shahさんが2022年11月10日までの1 GBから1.1677ドルのレート比率に基づく年間15,000 GB(17,516ドル)の基本費用を得る権利があるようにする。シャアさんもボーナスを得る資格があるかもしれません。ボーナスの額は私たちが自分で決めます。
| -82- |
Shahさんはどんな付随的な福祉も受ける権利がない。Shahさんの諮問プロトコルが理由なく終了した場合、Shahさんは、関連する通知期間の全部または任意の残りの部分において、その基本料金に相当する代通知金を得る権利がある。
Shahさんはまた6ヶ月間の非招待書契約を守らなければならない。
ガブリエルチェロン
我々は、2022年1月1日にCerroneさんとコンサルティング契約を締結し、業務発展、戦略計画、会社財務助言を提供し、取締役会の執行議長としての役割を果たします。このプロトコルは、Cerroneさんが年間66,000ドルの基本料金を取得する権利を持っています。切竜さんもボーナスを得る資格があり、ボーナスの額は私たちが自分で決めることができる。
Cerroneさんはいかなる福祉も受ける権利がありません。Cerroneさんと当社のコンサルティングが理由なく終了した場合、Cerroneさんは、基本料金の代わりに、 に関する通知期間の全部または残りの部分について、その基本料金に相当するお金を得る権利を有しています。
Cerroneさんはまた、6ヶ月間のeスポーツ禁止およびeスポーツ禁止条約を遵守しなければならない。
Gensignia IP Ltd.ライセンスプロトコル
2022年6月23日,吾らはGensigniaと譲渡·負担協定を締結し,これにより,GensigniaはBiomirna Holdings Ltd.とGensignia Inc.との間で改訂された許可協定(“MSC許可”)に基づき,2011年12月21日に発効したすべての 権利を譲渡した。ガブリエル·チェロン、私たちの会長はGensigniaの会長です。MSCライセンスは、マイルストーン支払いで最大400,000ドルの費用を支払い、純売上高に応じて低いビット数パーセントで印税を支払うことを規定しています。MSCライセンスは、すべての国/地域のすべてのライセンス製品の印税期限が満了するまで有効である。重大な違約イベントが発生した場合、いずれか一方がMSCライセンスを終了することができ、さらに、90日の通知後にいつでもMSCライセンスを終了することができる。
証券説明
以下、当社の株式の記述及び当社の登録証明書及び当社定款の規定を要約とし、当社登録証明書及び今回の発売終了後に発効する当社規約を参考に保留します。私たちは、私たちが登録した説明書の証拠物として、これらの書類のコピーをアメリカ証券取引委員会に提出しました。本募集説明書はその一部です。普通株と優先株の は,我々の資本構造が今回の発行終了前と後に変化することを反映していることを示している.
一般情報
今回の発行が完了したら、私たちの法定株式は以下のようになります
| ● | 150,000,000株の普通株式、1株当たり0.001ドル、および | |
| ● | 10,000,000株の優先株で、1株当たり0.001ドルの価値があります。 |
以下では、当社株の記述および当社が改訂·再記述した会社登録証明書と定款の規定を要約 とし、会社登録証明書と定款を参照して限定します。私たちの証明書と私たちの定款を読むことを促します。今回の発行終了後すぐに発効します。これらは登録説明書の証拠物として含まれています。本募集説明書はその一部です。
以下に概説する我々の証明書および我々の定款のいくつかのbr条項は、逆買収の効力を有するとみなされる可能性があり、株主がその最適な利益に適合すると考えられる可能性のある要約買収または買収の試みを遅延または阻止する可能性があり、一般株の割増を招く可能性のある試みを含む。
| -83- |
普通株 株
株主議決に提出されたすべての事項について、当社の普通株式の所有者は、記録された株式を保有する毎に投票する権利がある。brは、我々の改正及び再記載された会社登録証明書に別途規定又は法律が別途規定されているほか、選挙及び取締役罷免に関する事項を除いて、吾等の株主が議決した事項は、自ら又は代表を委任して会議に出席し、その事項について投票する権利のある株式brの過半数又は株主の書面決議案が当該事項を代表する会議に必要な賛成票の数を代表しなければならない。私たちの普通株の保有者は役員選挙で累計投票権を持っていません。
私たちの普通株の保有者 は、私たちの取締役会でその合法的に利用可能な資金から配当金を得る権利があると発表したが、任意の法定または契約によって制限されており、任意の発行された優先株条項が配当金支払いに制限されている。
私たちが私たちのすべてまたはほとんどの資産を解散または清算または売却した後、必要なすべての金額を債権者に全額支払い、優先株株主の任意の権利の制限の下で、私たちの普通株の株式所有者は、私たちが分配可能な余剰資産を比例的に獲得する権利があるだろう。
私たち普通株の保有者 は優先引受権、引受権、償還権または転換権を持っていません。普通株は償還または債務返済基金条項には適用されないだろう。
優先株
私たちの取締役会は、私たちの株主が行動しない場合、1つまたは複数のシリーズまたはカテゴリの最大10,000,000株の優先株 を指定して発行し、各シリーズまたはカテゴリの権利、優先および特権を指定する権利を有しており、これらの権利、優先および特権は、私たちの普通株式の権利よりも大きい可能性がある。優先株の指定や流通株はありません。我々の取締役会 が優先株保有者の具体的な権利を決定するまで、いかなる優先株株の発行が私たちの普通株式保有者の権利に与える実際の影響を説明することはできません。しかし影響には
| ● | 普通株の配当金を制限します | |
| ● | 私たちの普通株の投票権を希釈し | |
| ● | 私たちの普通株の清算権を損なう | |
| ● | 我々の株主がさらなる行動をとる必要はなく,我々の制御権変更を遅延させたり阻止したりする. |
取締役会が株主の承認を得ずに優先株を発行する権力は、第三者 がわが社に対する制御権を獲得しにくくなる可能性があり、このような試みを阻止する可能性がある。私たちは現在優先株を発行する計画を持っていない。
フォーラム ベスト
私たちの会社登録証明書は、私たちが書面で代替フォーラムを選択することに同意しない限り、デラウェア州衡平裁判所は、法律を適用して許容される最大範囲で、(I)私たちが提起した任意の派生訴訟または訴訟になることを規定しています;(Ii)私たちの取締役、役員、または他の従業員の私たちまたは私たちの株主に対する受託責任に違反すると主張する任意の唯一かつ独占的なフォーラム。(Iii)当社、当社の会社登録証明書または当社の付例のいずれかの条文に基づいて、当社、任意の取締役または当社の上級者または従業員に対して申索の任意の訴訟を提起する。または(Iv)任意の主張brは、私たち、任意の役員または私たちの上級職員または従業員に対して内部事務原則によって管轄されているクレームの訴訟を提起するが、上記(I)~(Iv)条のそれぞれについて、衡平裁判所が衡平裁判所の管轄を受けない不可欠な一方(かつ不可欠な一方は、衡平裁判所がこの裁決後10(10)日以内にそれを管轄することに同意しない)のいずれかのクレームが存在すると判断した場合を除く。衡平裁判所以外の裁判所又は裁判所の排他的管轄権に属する、又は衡平裁判所がそれに対して標的管轄権を持たない裁判所又は裁判所。会社登録証明書(Br)はさらに、衡平裁判所を会社を代表して提起された任意の派生訴訟又は法律手続の唯一及び独占裁判所として選択することは、証券法又は取引法に規定された責任又は責任を強制的に執行する訴訟には適用されない。
| -84- |
反買収条項
私たちの会社登録証明書と定款には、他方が私たちに対する制御権を獲得することを遅延、延期、または阻止する可能性がある条項 が含まれています。以下に概説するこれらの規定は、強制買収行為や不十分な買収入札を阻止すると予想される。これらの条項はまた、私たちの支配権を獲得することを求める人がまず私たちの取締役会と交渉することを奨励することを目的としており、このような買収の条項が改善され、株主に有利になる可能性があると考えられます。しかし、それらはまた私たちの取締役会に権限を与え、いくつかの株主が支持する可能性のある買収を阻止する。
デラウェア州一般会社法203節それは.私たちはデラウェア州会社法203条によって制限されている。特定のbrの例外を除いて、第203条は、デラウェア州上場企業が利益関連株主になった日から3年以内に任意の“利益関連株主”と“業務合併”を行うことを禁止し、利益関連株主が我々の取締役会の承認の下でこのような地位を得ない限り、または企業合併が所定の方法で承認されない限り。“業務合併”には、その他の事項のほか、当社と“利益関連株主”に関する合併または合併、10%以上の資産の売却が含まれています。一般に、“利害関係のある株主”とは、当社の15%以上の議決権を有する株式を発行した任意のエンティティまたは個人、およびそのようなエンティティまたは個人に関連または制御されているか、またはそのようなエンティティまたは個人によって制御される任意のエンティティまたは個人を意味する。
発行されていない株式を許可していますそれは.ナスダック株式市場の上場基準の制限を受けて、私たちの普通株の許可はありますが、発行されていない株は株主のbrの承認を必要とせずに未来に発行することができます。これらの追加株式は、様々な会社の融資取引、買収、および従業員福祉計画に使用することができる。許可されているが発行されていない普通株式およびbr}未保持普通株の存在は、代理競争、カプセル買収、合併、または他の方法で我々の制御権を獲得する試みをより困難にするか、または歓迎されない可能性がある。
株主は書面で行動に同意したそれは.私たちの証明書及び私たちの定款は、年次会議又は株主特別会議で要求又は許可された任意の行動は、会議を適切に提出する前にのみとることができ、書面同意による行動及び当該書面同意による行動が事前に取締役会の承認を得た場合にのみ、会議の代わりに書面同意によりとることができる。
株主特別会議 それは.私たちの定款はまた、法律が別途要求されない限り、株主特別会議 は私たちの取締役会でしか開催できません。
株主提案と取締役指名事前通知要求それは.また、我々の規約は、年次株主総会の株主提案を提出するための事前通知手順 を作成し、指名候補者の取締役会への参入を提案することを含む。任意の事項を会議前に適切に処理するためには,株主は事前通知と所有権期限要求を遵守し,何らかの情報を提供しなければならない.株主は年次 会議において会議通知で指定された提案又は指名のみを考慮することができ、又は当社取締役会又は当社取締役会又は会議記録日に届出された合格株主が会議前に提出した提案又は指名に基づいて、当該株主は 会議で投票する権利があり、適切な形で直ちに当社秘書に書面通知を行い、このような 業務を会議に提出することを意図していることを示す。これらの条項は、私たちの未補償と議決権証券の保有者が支持する株主行動の大部分を次の株主総会に延期するかもしれない。
会社登録証明書または別例改訂それは.デラウェア州一般会社法では、会社の会社登録証明書又は定款を修正するには、任意の事項について投票する権利のある株式の多数の賛成票を得る必要があり、会社の会社登録証明書又は定款(場合によって決まる)がより大きな割合を要求しない限り、多くの賛成票を得ることができる。今回の発行完了後、当社の定款は、当社取締役会の多数票またはすべての株主が取締役選挙に少なくとも662/3%の賛成票を投じる資格のある株主投票で改訂または廃止することができます。さらに、すべての株主が取締役選挙で投票する資格を有する少なくとも66.2/3%の賛成票の保有者は、私たちの証明書の前3段落に記載された任意の規定と一致しない任意の条項の修正または廃止を要求されるであろう。
| -85- |
上級職員と役員の責任と賠償制限
私たちの証明書と定款はデラウェア州会社法で許容される最大限に私たちの役員と上級管理者に保障を提供します。今回の発行が完了する前に、私たちは私たちのすべての取締役と賠償協定 を締結するつもりです。場合によっては、この協定はデラウェア州法律に含まれる具体的な賠償条項よりも広いかもしれません。また、デラウェア州の法律で許可されている場合、私たちの証明書には、取締役の何らかの受託責任違反による金銭損害の個人責任を免除する条項が含まれています。これらの規定の効果は,我々の権利と我々のbr株主がデリバティブ訴訟において取締役が取締役としての受託責任に違反して取締役に金銭損害賠償を求める権利を追及することであるが,取締役は以下のような場合に対して個人的な責任を負う
| ● | 私たちや株主への忠誠義務に違反する行為は | |
| ● | 善意でない行為やしないこと、または故意の不正行為に関連しているか、または違法であることを知っている | |
| ● | 取締役がいかなる不正な個人利益から利益を得るかの取引;または | |
| ● | 株主に不正な分配を行う。 |
これらの責任制限は、連邦または州証券法によって生じる責任にも適用されず、禁止救済または撤回のような公平な救済措置の利用可能性にも影響を与えない。
私たちの規約では、法律で許容されている最大限に私たちの役員と上級管理者を賠償し、従業員brと他の代理人を賠償することができます。私たちの定款はまた、任意の訴訟または訴訟の最終処分の前に取締役または上級職員が発生した費用を前借りする義務があると規定しています。
私たちは役員や上級管理者と単独の賠償協定を締結する予定です。その他の事項に加えて、これらの合意は、合理的な弁護士費、招聘費、法廷費用、br調書費用、専門家費用、証人費用、出張費用、コピー料、印刷および製本費用、電話代、郵便料金、br配達サービス料を含む私たちの取締役および上級管理者の任意のおよびすべての費用(合理的な弁護士費、招聘費、法廷費用、br調書費用、専門家費用、証人費用、出張費用、コピー料、電話代、郵便料金、およびその代表者またはその代表が、私たちの役員または高級管理者としてのサービスにおいて実際かつ合理的に発生した任意の訴訟または訴訟によって支払われた金額を賠償することを要求する。Brまたは私たちの任意の子会社またはその者は、賠償契約に規定されている決定に従う限り、賠償および立て替え費用の手続きを受ける権利がある限り、私たちの要求に応じてサービスを提供する任意の他の会社または企業である。これらの付例条項や賠償協定は,合格者を誘致·維持するために取締役や上級管理職を務めることが必要であると考えられる。
私どもの会社証明書や定款における責任制限や賠償条項は、株主 が取締役が受託責任に違反して提訴することを阻止する可能性があります。それらはまた、取締役や上級管理職に対するデリバティブ訴訟の可能性を減少させる可能性があり、訴訟が成功すれば、私たちと私たちの株主に利益をもたらす可能性がある。これらの賠償条項に基づいて役員や上級管理者に和解や損害賠償金の費用を支払うと、私たちの運営実績や財務状況が損なわれる可能性があります。
証券法による責任の賠償は,取締役,上級管理者,あるいは我々を制御する者を許可する可能性があるため, 我々は,米国証券取引委員会は,このような賠償は証券法で表現された公共政策 に違反するため,実行できないと考えていることを通知した.
| -86- |
現在、私たちの取締役や上級管理職に関連する未解決の訴訟や訴訟は、賠償が必要または許可されているbrに関連しておらず、クレームを引き起こす可能性のある訴訟や訴訟手続きが脅かされていることもわかりません。
エージェントとレジストリを接続する
私どもの普通株の譲渡代理と登録機関は太平洋株式譲渡会社です。
取引 記号と市場
私たちは私たちの普通株をナスダック資本市場に上場することを申請しました。コードは“ACUT”です
引受販売
ThinkEquity LLCは引受業者の代表である。吾らと代表との間の引受契約の条項及び条件によると、吾らは以下の各引受業者に販売することに同意し、各引受業者はそれぞれ公開募集価格で本募集説明書の表紙に記載されている引受割引を減算することに同意し、次の表にその名称の横に記載されている普通株式数を購入する
| 引受業者 | 番号をつける 個の共有 よくある 在庫 |
|||
| ThinkEquity LLC | ||||
| 合計する | ||||
引受契約は、引受業者が本募集説明書で提供された普通株式の交付を支払う義務は、その弁護士がある法律 事項及び引受協定に規定されている他の条件を含む様々な条件及び陳述及び担保の制約を受けることを規定している。普通株は引受業者から発行され,発行時,発行時,受付時にあらかじめ販売されている.引受業者は、公開発売を撤回、キャンセルまたは修正し、注文の全部または一部を拒否する権利を保持する。引受業者は、本募集説明書で提供されたすべての普通株を受け入れて支払う義務があるが、以下の超過配給選択権に含まれる普通株は含まれていない。
私たちbrは、証券法下の責任を含む引受業者の特定の責任を賠償し、引受業者がそのために支払う必要がある可能性のある金を支払うことに同意した。
超過配給オプション
我々brはすでに引受業者に45日間を代表する選択権を付与しており,1株$の公開発行価格で最大45日間の普通株を購入することができ,超過配給のみに用いることができる(あれば).引受業者は本募集説明書が公表された日から数日以内にこの選択権を行使することができ、引受業者は上表に記載した普通株式総数を超える普通株を売却することに限られる。これらの追加株式のいずれかを購入した場合、引受業者は、発行株と同じ条項で追加株式 を提供する。
割引と手数料
引受業者は当初、本募集説明書の表紙の公開発行価格で一般向けに普通株を発売することを提案し、その価格から1株当たりの普通株$を超えない割引で取引業者に普通株を発売することを提案した。もし私たちが発行した普通株 がすべて公開発行価格で販売されていなければ、引受業者は本募集説明書を補充することで発行価格と他のbr売却条項を変更することができる。
| -87- |
次の表に私たちの公開発行価格、引受割引と手数料および費用を差し引く前の収益を示します。情報 は,我々が引受業者代表に付与した超過配給選択権を行使または完全に行使していないと仮定する.
| 1株当たり | 未超過配給の合計 選択権 | 合計は 超過配給 選択権 | ||||||||||
| 公開発行価格 | $ | $ | $ | |||||||||
| 引受割引(7.5%) | $ | $ | $ | |||||||||
| 費用を差し引く前の収益は私たちに払います | $ | $ | $ | |||||||||
我々 は,発行終了時に受け取った総収益の0.4%に相当する非実売費用手当を引受業者代表に支払うことに同意した.私たちは代表に35,000ドルの費用保証金を支払いました。この保証金はbrに使用され、今回の発行に関する自己負担可能費用を引受業者に支払い、FINRAルール5110(F)(2)(C)に基づいて実際に発生していない費用を返済してくれます。
私たちは、引受業者が引受契約に規定している今回の発行に関連するいくつかの費用を清算することに同意しており、引受業者の法律顧問の費用と支出を含む。しかし、私たちは保証人に精算する最高金額が222,500ドルを超えないことに同意します。
我々のbr}今回発行された予定総費用には,登録,届出と上場費用,印刷費および法律と会計費用が含まれているが, は引受割引や手数料は含まれておらず,約$である。
代表 授権書
今回の発売完了後、吾らは代表権証や代表株式証への最大 株式普通株(今回の公開発売販売株式総数の3.0%)を発行することに同意した。代表の株式引受証は1株当たりの行使価格で行使され、価格は(I)今回発売された普通株の1株当たり公開発行価格の125%と(Ii)2.14ドルの中で大きい者に等しい。brに代表される引受権証は、今回発売された証券の販売開始日から4年半の間、随時および時々全部または部分的に行使することができる。
代表株式承認証はまた、代表株式証に関連する株式の登録権、代表株式承認証と慣例の逆希釈条項に関連する普通株登録の無限“搭載”登録権を規定している。FINRAルール5110(F)(2)(G)(Iv)によれば、提供される需要登録権は、今回の発行に関する引受合意の日から5年以下となる。FINRAルール5110(F)(2)(G)(V)によると,提供される 搭載登録権は,今回の発行に関する引受契約の日から7年を超えない.
代表株式証と代表株式承認証に関連する普通株式はすでに金融業界監督管理機関(FINRA)によって補償 とされているため、FINRA規則5110(G)(1) により、180日間の販売禁止期間を受けるべきである。代表又はこの規則によって許可された譲受人は、売却、譲渡、譲渡、質権又は質権代表の引受権証又は代表株式権証に関連する証券を代表してはならず、代表も、登録声明が発効した日から180日以内に経済的処置を有効に行うことができるように、いかなる対沖、空売り、br派生ツール、引受又は上昇取引に従事してはならない。また、代表の引受権証は、登録声明が発効した日から180日以内に売却、譲渡、質権又は質権を取得することができないが、発売に参加した任意の引受業者及び選定された取引業者及びその誠実な高級職員又はパートナーに売却、譲渡、質権又は質権を除く。代表株式承認証は、資本再編、合併、株式分割或いはその他の構造的取引或いは私たちが未来に融資を行う場合、代表株式承認証と代表株式承認証に関連する普通株の数量と価格を調整する。
| -88- |
ロックプロトコル
“ロック”協定によれば、我々、我々の幹部および取締役、ならびに5%以上の普通株式流通株を保有するいくつかの所有者は同意しており、事前に書面で同意されていない場合には、私たち普通株の任意の株式を直接または間接的に売却、売却、質権、または他の方法で譲渡または処分することはない(または将来任意の時点で私たち普通株の任意の取引または手配を譲渡または処分することを意図しているか、または可能性がある)。私たちの普通株式所有権の任意の経済的利益またはリスクをすべてまたは部分的に別の人の任意のスワップまたは他の派生商品取引に移し、任意の要求を提出したり、任意の権利を行使したり、任意の普通株式または行使可能な普通株式または証券への登録、 または私たちの普通株または任意の他の証券の登録に交換することができる、または上記の任意の事項を実行する意図を開示開示することをもたらすが、慣例的例外に適合する。当社の取締役、行政者、当社及び当社の任意の後継者は、本募集説明書の日付から六ヶ月後及びいくつかの株主が本募集説明書の日付から三ヶ月後です。
優先購入権
今回の発売締め切りから12ヶ月前に、代表者は撤回できない優先購入権を持ち、独占投資銀行家、独占帳簿管理人及び/或いは独占配給代理として参加することができ、そして代表者が自ら未来の毎回の公開及び私募株式及び債券発行に参加することを決定し、代表常常の条項 によるすべての株式リンク融資を含む。その代表は、任意の他のブローカーがこのような発売に参加する権利があるかどうか、およびそのような参加のための経済条項を決定する権利があるだろう。代表は、任意のお金または費用を支払うために、優先購入権を放棄または終了する機会を一度以上持たないだろう。
発行価格の確定
私たちの普通株の公開発行価格は私たちと引受業者との交渉によって決定されるだろう。これらの交渉で考慮される要因には,現在の市場状況,我々の財務情報,我々と引受業者が我々に相当すると考えている他社の市場評価 ,我々の業務潜在力の推定,我々の発展現状 およびその他関連と考えられる要因がある.
私たちの普通株の公開発行価格が今回の発行後の私たちの普通株の公開市場での取引価格に対応することは保証されませんし、私たちの普通株と引受権証の活発な取引市場が今回の発行後に発展し、br}が続くことも保証されません。
自由支配可能なbrアカウント
引受業者は、ここで発行された普通株を自由裁量権を持ついかなる口座にも売却することを確認するつもりはない。
取引?ナスダック資本市場
私たちは私たちの普通株をナスダック資本市場に上場することを申請しました。コードは“ACUT”です。私たちの申請が承認されたり、取引市場が発展するという保証はない。私たちの普通株がナスダック資本市場に上場することが今回の発行の条件です。我々の普通株式は現在OTCQBで取引されており、コードは“ACUT”である。2022年11月16日、私たちの普通株の最新販売価格は1株当たり0.75ドルです。
| -89- |
他にも
将来、いくつかの引受業者および/またはその関連会社は、通常の費用を徴収する可能性がある様々な投資銀行や他の金融サービスを提供してくれるかもしれない。その業務過程において、引受業者およびその関連会社は、自分の口座または顧客の口座のために私たちの証券またはローンを積極的に取引することができるので、引受業者およびその関連会社は、いつでもこのような証券またはローンの多頭または空手形を保有することができる。今回の発行に関連するサービスを除いて、本募集説明書の発行日前の180日以内に、いかなる引受業者も私たちにいかなる投資銀行または他の金融サービスを提供することはなく、私たちは本募集説明書の日付後少なくとも90日以内にいかなる引受業者がいかなる投資銀行または他の金融サービスに従事することを保留することを望まない。
価格安定、空振り、懲罰的入札
今回の発行に関する 引受業者は、安定、維持、または他の方法で私たちの普通株価格に影響を与える取引に参加する可能性があります。 具体的には、引受業者は、本募集説明書の表紙に規定されているよりも多くの株を売却することにより、今回の発行に関する株式を超過販売することができる。これは私たちの普通株式に自分の口座に使用するための空頭寸を作った。空頭寸 は回補空頭寸であってもよいし、裸空頭寸であってもよい。引当空頭寸では、引受業者が超過配給する普通株式数は、超過配給選択権で購入可能な普通株数を超えない。 裸頭頭寸では、関連する普通株式数は、超過配給 オプションにおける普通株式数よりも大きい。平倉のために、引受業者はすべてまたは部分的な超過配給選択権を行使することを選択することができる。引受業者は、私たちの普通株の価格を安定させるか、公開市場で普通株を競って購入することで、どんな空手形も減らすことができます。
引受業者も懲罰的オファーを実施することができる。これは,特定の引受業者または取引業者が今回の発行で普通株を割り当てることにより普通株の割当てを許可する売却許可権を償還する際に発生し,引受業者が安定したbrや空振り戻し取引時に普通株を買い戻したためである.
最後に、引受業者は、以下に述べる“受動”を含めて、市取引で私たちの普通株の株を入札して購入することができる。
これらの 活動は、私たちの普通株の市場価格を安定させるか、またはこれらの活動なしに存在する可能性のある価格よりも高く維持するかもしれない。引受業者は、これらの活動に従事する必要はなく、予告なく、いつでもこのような活動を終了することができる。これらの取引は、我々の普通株を取引する国家証券取引所、場外取引市場、または他の市場で行うことができる。
賠償する
我々brは、証券法及び取引所法による今回の発行に関する責任、及び引受契約に含まれる陳述及び保証の一部又は全部に違反することによる責任を賠償することに同意し、引受業者がこれらの責任のために支払うことを要求される可能性のある金を負担する。
電子配信
この電子フォーマットの入札説明書は、ウェブサイト上で、または1つまたは複数の引受業者またはその付属会社によって維持される他のオンラインサービスによって取得することができる。電子フォーマットの本募集説明書を除いて、任意の引受業者ウェブサイト上の情報と引受業者が維持する任意の他のサイトに含まれる任意の情報は、本募集説明書の一部でもなく、本募集説明書の一部でもなく、私たちまたは任意の引受業者によって引受業者として承認および/または裏書きされていないので、投資家は に依存してはならない。
販売制限
いかなる司法管轄区域(米国を除く)においても、私たちの普通株式の公開、またはそのための行動を必要とする任意の司法管轄区において、本募集説明書または私たちまたは私たちの普通株式に関連する任意の他の材料を所有、配布、または配布することを可能にする行動は行われていない。したがって、私たちの普通株式は、直接または間接的に発売または販売することができず、本募集説明書または私たちの普通株式に関連する任意の他の発売材料または広告は、そのような国または管轄区域の任意の適用規則および条例が遵守されない限り、任意の国または司法管轄区または任意の国または管轄区域から配布または発行することができる。
| -90- |
ヨーロッパ経済圏の潜在投資家への通知
欧州経済圏の各加盟国(それぞれ、“関連国”)については、証券に関連する目論見書を発行する前に、関連国の主管当局によって承認されたか、または適切な場合には、他の関連国で承認され、関連国の主管当局に通知された証券の公開発行がないか、または、EUの目論見説明書の規定に適合していることが通知された。しかし、EUの株式募集説明書に規定されている以下の免除によると、証券要約はいつでも関連国の公衆に発行することができる
| (a) | “EU株式募集説明書条例”第2(E)条に基づいて適格投資家の任意の法人実体と定義する | |
| (b) | 150人以下の自然人または法人(EU株式募集説明書に規定されている適格投資家は除く)であるが、事前に代表の同意を得なければならない | |
| (c) | EU株式募集説明書条例第1条第4項に規定する他のいずれかに属する場合 |
しかし、当該等の証券要約は、吾等又は任意の代表に“EU株式募集定款規則”第3条に基づいて株式募集定款を掲載することを要求してはならない、又は“EU株式募集規約規則”第23条に基づいて株式募集定款を補充することを要求してはならない。
本条項について言えば、任意の関連国の証券に関連する“公衆への要約”という言葉は、投資家が任意の証券の購入または承認を決定することができるように、任意の形式および任意の手段で契約条項と要約された任意の証券とのコミュニケーションを行うことを意味し、“EU株式募集説明書条例” は改正された(EU)2017/1129号条例を意味する。
イギリスの潜在投資家への通知
FCAが承認した証券の目論見書が公表される前に、イギリスは目論見書に基づいて一般に証券 を発売していないが、すべてイギリスの株式募集説明書の規定に適合しているが、イギリスの株式募集説明書に規定されている以下の免除により、いつでもイギリスで証券を発売することができる
| (a) | 英国株式募集説明書条例第2(E)条に基づいて適格投資家の任意の法人実体と定義される | |
| (b) | 150人以下の自然人または法人(イギリスの株式募集説明書に規定されている適格投資家を除く)は、事前に代表の同意を得なければならない | |
| (c) | FSMA第86条に規定される範囲内の任意の他の場合, |
ただし、このような証券要約は、私等又は任意の代表がFSMA第85条に基づいて目論見書を発表すること、又はイギリス株式募集説明書条例第23条に基づいて補充募集説明書を発行することを要求してはならない。この条項について言えば、イギリス国内の証券については、投資家が任意の証券の購入または承認を決定することができるように、任意の形態と任意の方法で契約条項と任意の擬要約証券との十分な情報のコミュニケーションを意味する。“イギリス株式募集説明書条例”という言葉は、改正された“2018年EU(離脱)法”に基づいて、英国国内の法律の一部であるため、(EU)2017/1129号法規を意味する。“FSMA”という言葉は、改正されたイギリスの“金融サービスと市場法”を意味する。
また、イギリスでは、本明細書では、以下の対象のみに配布され、その後に提出される任意の要約は、(I)“金融サービス及び市場法”(金融促進)令(改正)第19条(5)項の範囲内の投資に関する事項について専門的な経験を有する者、又は当該命令についてのみ対象とする。及び/又は(Ii)は、法令第49(2)(A)~(D)条に属する(これらのすべての者を総称して“関係者”と呼ぶ)又は その他の場合の高算入会社(又は他の方法で合法的に伝達可能な者) は、FSMAが指す証券をイギリス公衆に発売することを招くこともない。
いかなる非関係者のイギリス内の人も、行動を取ったり、本文書に含まれる情報に依存したりしてはならず、いかなる行動をとるための根拠としても使用されてはならない。イギリスでは,本文書に関連する任意の投資や投資活動は関係者が行ったり独占したりすることができる.
| -91- |
スイスの潜在投資家への通知
私たちの普通株はスイスで公開発売されないかもしれませんし、スイス証券取引所(“Six”) やスイスの他の証券取引所や規制された取引機関に上場しないかもしれません。本文書は,ART項で発行される目論見書の開示基準は作成時に考慮していない.652 aかArt“スイス債権法”の1156条又は上場目論見書の開示基準。27歳からです。六項の上場規則又はスイスの任意の他の証券取引所又は監督された取引機関の上場規則 。本稿の枠および私たちの普通株式または今回の発売に関連する任意の他の発売またはマーケティング材料は、スイスで公開配布されても、または他の方法で開示されてはならない。
本文書または今回の発行、当社、私たちの普通株式に関連する任意の他の発売またはマーケティング材料 は、スイスの監督管理機関に提出または提出されるか、または承認されるであろう。特に、本文書はスイス金融市場監督局(FINMA)に提出されず、私たち普通株の発売もスイス金融市場監督局(FINMA)の規制を受けることはなく、私たち普通株の発売 はなく、スイス連邦集団投資計画法案(CISA)によって許可されることもありません。中鋼協が集団投資計画で権益を取得した買収者のための投資家保障brによると、当社の普通株株式を買収する買収者には延びていない。
ドバイ国際金融センター潜在投資家心得
本募集説明書の補足資料は、ドバイ金融サービス管理局(DFSA)の発行済み証券規則に基づく免除要項に関する。本募集説明書付録は、DFSA“発行済み証券ルール”で指定されたタイプの方にのみ適用されます。それは他の誰にも渡すこともできないし、他の誰にも依存することはできない。DFSAは、免除特典に関連するファイルの審査または確認を担当していません。DFSAは本募集説明書の付録を承認しておらず、ここに列挙された情報を確認する措置も取られておらず、募集説明書の付録に対しては何の責任も負いません。本募集説明書の増刊に係る当社の普通株式は、流動性が不足している可能性があり、及び/又は転売制限を受けている可能性がある。当社の普通株式を購入する潜在的購入者は、当社の普通株式について自己の職務調査を行うべきである。本募集説明書の付録の内容を理解していない場合は、許可された財務コンサルタントに問い合わせなければなりません。
オーストラリアの潜在投資家への通知
今回の発行に関する配給書類、目論見書、製品開示声明又はその他の開示書類は、オーストラリア証券·投資委員会にまだ提出されていない。本募集説明書付録は、“2001年会社法”(“会社法”)下の目論見書、製品開示声明又はその他の開示文書を構成しておらず、“会社法”に規定されている目論見書、製品開示声明又は他の開示文書に必要な情報も含まれていない。
オーストラリアでは、会社法第708条に記載されている1つ以上の免除により、“老練な投資家”(会社法第708(8)条にいう)、“専門投資家”(会社法第708(11)条にいう専門投資家)又は他の者(“免除投資家”)にのみ自社普通株の発売の任意の要約を提出することができるので、会社法第6 D章の規定により、投資家に開示することなく自社普通株を発売することは合法である。
| -92- |
会社法第708条の免除又はその他の規定により会社法第6 D章に基づいて投資家に開示する必要がない場合を除き、又は要約が会社法第6 D章が会社法第6 D章の開示文書に適合することにより規定されている場合を除き、この場合、免除されたオーストラリア投資家が申請した普通株式は、発売後12ヶ月以内にオーストラリアで販売してはならない。私たちの普通株br株を購入する人はオーストラリアのこのような転売制限を守らなければならない。
本募集説明書の付録には一般情報のみが含まれており、特定の人の投資目標、財務状況、または 特定の需要は考慮されていません。それはどんな証券推薦や金融商品提案も含まれていない。投資決定を下す前に、投資家は、本募集説明書の付録の情報が彼らの需要、目標、状況に適しているかどうかを考慮し、必要に応じてこれらの事項について専門家の意見を求める必要がある。
香港の潜在投資家への通知
当社の普通株の株式は香港で発売または販売されていないし、香港でいかなる文書でも発売または販売されることはなく、(A)で“証券及び先物条例”(第章)で定義された“専門投資家”への発売や販売はない。及び当該条例に基づいて定められた任意の規則;又は(B)その他の場合において、その書類は“会社条例”ではない(第当社の普通株式に関する広告、招待状、書類は、香港や他の場所で発行された目的であっても、その内容がアクセスされたり読まれたりする可能性があり、誰かによって管理されている可能性があるか、または管理されている可能性がある。香港公衆(香港証券法で許可されているものを除く)であるが、我々の普通株株式は、香港以外の者にのみ売却または売却しようとしているか、又は“証券及び先物条例”及び同条例に基づいて定められた任意の規則により規定された“専門投資家”にのみ売却される普通株を除く。
日本の潜在投資家への通知
当社の普通株の株式はまだ日本の“金融商品·取引法”(1948年第25号法律改正)に基づいて登録されていないため、日本で直接または間接的に、いかなる日本人の利益のために、または他の人に直接または間接的に日本でまたは誰かの日本人に再発売または転売することはない。本項において、“日本人”とは、日本の法律に基づいて設立された任意の会社又は他の実体を含む日本に住む誰かを意味する。
シンガポールの潜在投資家への通知{br
本目論見書の付録はシンガポール金融管理局にはまだ目論見書として登録されていません。したがって、本募集説明書及び当社普通株の要約又は売却、引受又は購入招待に関する任意の他の書類又は材料は、配布又は配布することができず、シンガポール国内の者に当社普通株を直接又は間接的に提供又は売却したり、引受又は購入招待の対象としたりすることはできないが、以下の場合を除く:(I)シンガポール証券及び先物法第289章第274条に基づいて機関投資家に;(Ii)第275条(1)に従って関係者に、又は第275(1 A)条に基づいて、“SFA”第275条に規定する条件に従って、 を関係者に、又は(Iii)“SFA”の任意の他の適用条項に基づいて、“SFA”の任意の他の適用条項に従って、他の方法で支払う。
| -93- |
もし我々の普通株式の株式がSFA第275条に基づいて関係者によって引受または購入された場合、すなわち:
| (a) | その唯一のビジネスは、投資を保有することであり、そのすべての株式は、1つまたは複数の個人によって所有されており、すべての人は、投資家を認めている会社である(SFA第4 A条で定義されているように)認可された投資家ではない) | |
| (b) | 信託(受託者は認可投資家ではない)は、唯一の目的は投資を持つことであり、信託のすべての受益者 は投資家を認可する個人である |
当該会社の証券又は受益者が当該信託における権利及び利益(いずれにしても記載)を、当該会社又は当該信託が“証券取引条例”第275条に基づいて提出した要約に基づいて我々の普通株の株式を買収してから6ヶ月以内に譲渡してはならないが、以下の場合を除く
| (c) | 機関投資家又は国家外国為替管理局第275(2)条に規定されている関係者、又は国家外国為替管理局第275(1 A)条又は第276(4)(I)(B)条に記載されている要約により生成された者; | |
| (d) | 譲渡を考慮していないか、または譲渡を考慮しているもの; | |
| (e) | 譲渡は法律で実施されている | |
| (f) | SFA第276条(7)の規定に従って;又は | |
| (g) | シンガポール“2005年証券及び先物(投資要約)(株式及び債券)規程”第32条に述べたように。 |
カナダの潜在投資家への通知
私たちの普通株は、国家文書45-106に定義されている適格投資家である購入者または購入元金とみなされる購入者にしか販売できません株式募集規約の免除又はこの条例第七百三十三条第一項証券法(オンタリオ)および は、National Instrument 31-103に定義されているように許容されるクライアントである登録要件、免除、継続的な登録義務. 任意の普通株式の転売は、証券法を適用する目論見書の要求の免除に適合しなければならないか、または募集説明書の要求に拘束されない取引で行われなければならない。
証券 本募集説明書 付録(それに対する任意の改正を含む)に不実陳述が含まれている場合、カナダのある省または地域の法律は、買い手が買い手のいる省または地域の証券法に規定されている期限内に撤回または損害賠償を行使することを前提とした撤回または損害賠償を買い手に提供することができる。買い手 は、これらの権利の詳細を理解するために、買い手の所在する省または地域の証券法の任意の適用条項を参照して、法律顧問に相談しなければならない。
“国家文書33−105”第3 A.3節(非カナダ司法管区の政府から発行または担保された証券であれば、第3 A.4節)保証紛争(NI 33-105)、引受業者は、今回の発行に関連する引受業者の利益衝突に関するNI 33-105の開示要件を遵守する必要がない。
法務
シェパード, Mullin,Richter&Hampton LLP,ニューヨーク,ニューヨーク,今回発売で販売される我々の普通株の有効性を伝える.今回の発行に関連するいくつかの法的問題は、ニューヨークBlank Roman LLPから引受業者に渡される。
専門家
AccuStem Sciences,Inc.2021年12月31日と2020年12月31日までの財務諸表及び2021年12月31日までの年度と2020年6月5日(設立日)から2020年12月31日までの財務諸表は独立した公認会計士事務所マーゼ米国有限責任会社が監査を行い、その監査報告は本募集説明書の他の部分に掲載され、会計と監査専門家事務所の権威的な報告に基づいて登録されている。
| -94- |
ここで詳細な情報を見つけることができます
我々は証券法に基づいて米国証券取引委員会に 本募集説明書が提供する証券に関するS-1表登録声明を提出した。本出願明細書は、その構成要素である登録説明書中の全ての情報及び当該登録説明書の証拠物を含まない。本入札明細書に含まれる任意の契約または任意の他の文書内容に関する宣言は、必ずしも完全ではなく、いずれの場合も、参照によって本明細書の一部に組み込まれるか、または本入札明細書の一部の登録宣言の証拠物としての契約または他の文書のコピーを推薦する。これらの陳述の各々は、本参照文書のすべての態様によって制限される。
あなたは、米国証券取引委員会公共資料室で、本募集説明書に含まれる登録説明書および私たちの報告書、依頼書およびその他の情報を読むことができます。住所はワシントンD.C.20549です。公共資料室の運営に関する情報をもっと知りたいのですが、アメリカ証券取引委員会の電話番号1-800-アメリカ証券取引委員会-0330に電話してください。米国証券取引委員会には、AccuStem Sciences,Inc.米国証券取引委員会のウェブサイトがhttp://www.sec.gov上で見つけることができる報告、代理、および情報 声明、および米国証券取引委員会に電子文書を提出するための他の発行者に関する情報が含まれる相互接続ウェブサイトが設けられている。AccuStem Sciences,Inc.,5 Penn Plaza,19に手紙を書くことで、これらのファイルのコピーを無料で請求することもできますこれは…。 Floor #1954, New York, NY 10001, or calling us at 00 44 2074952379.
我々は,取引法の情報と報告要求を遵守し,本法に基づいて米国証券取引委員会に定期報告,br}依頼書その他の情報を提出する。これらの定期的な報告書、依頼書、および他の情報は、米国証券取引委員会の公共参照施設および上述した米国証券取引委員会のウェブサイト上で参照および複製することができる。ウェブサイトを維持していますWww.AccuStem.comそれは.米国証券取引委員会がこれらの材料を電子的にアーカイブまたは提供した後、合理的で実行可能な範囲内でこれらの材料をできるだけ早く無料で取得することができます。私たちのサイト上の情報は本募集説明書の一部ではありません。本募集説明書に含まれている私たちのサイトアドレスは、非能動的なテキスト参照にすぎません。
| -95- |
連結財務諸表インデックス
ACCUSTEM Science Inc.
| 2022年9月30日(未監査)及び2021年12月31日までの簡明総合貸借対照表 | F-2 | |
| 2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月間監査されていない合併経営報告書と全面赤字 | F-3 | |
| 2022年と2021年9月30日までの3ヶ月と9ヶ月間監査されていない株主権益変動表 | F-4 | |
| 2022年9月30日と2021年9月30日までの9ヶ月間監査されていないキャッシュフロー表簡明連結レポート | F-6 | |
| 2022年9月30日現在の未監査簡明合併財務諸表付記 | F-7 | |
| 独立公認会計士事務所報告(マーゼアメリカ有限責任会社、ニューヨーク、ニューヨーク、PCAOB ID 339) | F-16 | |
| 2021年12月31日現在と2020年12月31日現在の連結貸借対照表 | F-17 | |
| 2021年12月31日までの年度と2020年6月5日(設立日)から2020年12月31日までの総合経営と全面収益(赤字)表 | F-18 | |
| 2021年12月31日まで年度及び2020年6月5日(成立日)から2020年12月31日までの株主権益総合報告書 | F-19 | |
| 2021年12月31日までの年度と2020年6月5日(設立日)から2020年12月31日までの連結現金フロー表 | F-20 | |
| 連結財務諸表付記 | F-21 |
| F-1 |
ACCUSTEM Science Inc.そして付属会社
簡素化された合併貸借対照表
| (未監査) | ||||||||
| 2022年9月30日 | 2021年12月31日 | |||||||
| 資産 | ||||||||
| 流動資産 | ||||||||
| 現金 | $ | $ | ||||||
| 関係者の売掛金 | ||||||||
| 前払い費用 | ||||||||
| 流動資産総額 | $ | $ | ||||||
| 装置、ネットワーク | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 流動負債 | ||||||||
| 売掛金 | $ | $ | ||||||
| 関係者対応 | ||||||||
| 費用を計算する | ||||||||
| 支払手形 | ||||||||
| 流動負債総額 | ||||||||
| 総負債 | ||||||||
| 株主権益 | ||||||||
| 優先株$額面価値ライセンス株;発行済みと未償還 | $ | $ | ||||||
| 普通株$額面価値ライセンス株;そして2022年9月30日と2021年12月31日までにそれぞれ発行·発行された株 | ||||||||
| 追加実収資本 | ||||||||
| 関係者が受取金を引受する | ( | ) | ||||||
| その他の総合損失を累計する | ||||||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益総額 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
| F-2 |
ACCUSTEM Science Inc.そして付属会社
合併経営報告書と全面収益(損失)を簡素化する
(未監査)
| 9月30日までの3ヶ月 | 9か月で終わる 九月三十日 | |||||||||||||||
| 2022 | 2021 | 2022 | 2021 | |||||||||||||
| 運営費 | ||||||||||||||||
| 研究開発費 | $ | $ | $ | $ | ||||||||||||
| 一般と行政費用 | ||||||||||||||||
| 総運営費 | ||||||||||||||||
| 運営損失 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 税引き前損失 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 所得税の割引 | ||||||||||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 普通株主は1株当たり基本損失と希釈して1株当たり純損失を占めるべきである | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 基本と希釈後の普通株株主の1株当たり純損失を計算するための加重平均既発行普通株 | ||||||||||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 翻訳調整 | ( | ) | ( | ) | ||||||||||||
| 総合損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
| F-3 |
ACCUSTEM Science Inc.そして付属会社
簡素化された株主権益合併報告書
(未監査)
2022年9月30日までの3ヶ月
| 普通株 | その他の内容 | 関連先 | その他を累計する | |||||||||||||||||||||||||
| 株式数 | 金額 | 実収資本 | 注文すべきである | 総合損失 | 赤字を累計する | 株主権益 | ||||||||||||||||||||||
| 2022年6月30日の残高 | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||
| 株式ベースの報酬 | - | |||||||||||||||||||||||||||
| 普通株式オプションの行使 | ||||||||||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | |||||||||||||||||||||||
| 2022年9月30日の残高 | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||
2021年9月30日までの3ヶ月
| 普通株 | その他の内容 | 関連先 | その他を累計する | |||||||||||||||||||||||||
| 株式数 | 金額 | 実収資本 | 注文すべきである | 総合収益 | 赤字を累計する | 株主権益 | ||||||||||||||||||||||
残高は June 30, 2021 | $ | $ | $ | ( | ) | $ | $ | ( | ) | $ | ||||||||||||||||||
| 株式ベースの報酬 | ||||||||||||||||||||||||||||
| 外貨換算調整 | - | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | |||||||||||||||||||||||
| 2021年9月30日の残高 | $ | $ | $ | ( | ) | $ | $ | ( | ) | $ | ||||||||||||||||||
| F-4 |
2022年9月30日までの9ヶ月間
| 普通株 | その他の内容 | 関連先 | その他を累計する | |||||||||||||||||||||||||
| 株式数 | 金額 | 実収資本 | 注文すべきである | 総合収益 | 赤字を累計する | 株主の 権益 | ||||||||||||||||||||||
| 2021年12月31日の残高 | $ | $ | $ | ( | ) | $ | $ | ( | ) | $ | ||||||||||||||||||
| 株式ベースの報酬 | - | |||||||||||||||||||||||||||
| 普通株発行 | ||||||||||||||||||||||||||||
| 購読領収書を受け取るべきです | - | |||||||||||||||||||||||||||
| 普通株式オプションの行使 | ||||||||||||||||||||||||||||
| 外貨換算調整 | - | ( | ) | ( | ) | |||||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | |||||||||||||||||||||||
| 2022年9月30日の残高 | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||
2021年9月30日までの9ヶ月間
| 普通株 | その他の内容 | 関連先 | その他を累計する | |||||||||||||||||||||||||
| 株式数 | 金額 | 実収資本 | 注文すべきである | 総合収益 | 赤字を累計する | 株主の 権益 | ||||||||||||||||||||||
| 2020年12月31日残高 | $ | $ | $ | ( | ) | $ | $ | ( | ) | $ | ||||||||||||||||||
| 株式ベースの報酬 | ||||||||||||||||||||||||||||
| 外貨換算調整 | - | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | |||||||||||||||||||||||
| 2021年9月30日の残高 | $ | $ | $ | ( | ) | $ | $ | ( | ) | $ | ||||||||||||||||||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
| F-5 |
ACCUSTEM Science Inc.そして付属会社
簡明 統合キャッシュフロー表
(未監査)
現在までの9ヶ月間で 九月三十日 | ||||||||
| 2022 | 2021 | |||||||
| 経営活動 | ||||||||
| 純損失 | ( | ) | ( | ) | ||||
| 純収入と業務活動が提供する現金純額を調整する | ||||||||
| 外貨換算 | ( | ) | ( | ) | ||||
| 減価償却 | ||||||||
| 株式ベースの報酬 | ||||||||
| 営業資産と負債の変動: | ||||||||
| 関係者の売掛金 | ||||||||
| 前払い費用 | ||||||||
| 売掛金 | ( | ) | ||||||
| 関係者対応 | ( | ) | ||||||
| 費用を計算する | ( | ) | ||||||
| 経営活動のための現金純額 | ( | ) | ||||||
| 投資活動 | ||||||||
| 設備を購入する | ( | ) | ||||||
| 投資活動のための現金純額 | ( | ) | ||||||
| 融資活動 | ||||||||
| 受取引受金 | ||||||||
| 普通株式を発行して得た金 | ||||||||
| オプション行使で得られた収益 | ||||||||
| 支払手形払い | ( | ) | ||||||
| 融資活動が提供する現金純額 | ||||||||
| 現金が増える | ||||||||
| 現金、年明け | ||||||||
| 年末現金 | ||||||||
| 非現金投資·融資活動の追加開示 | ||||||||
| 支払手形を発行して前払い料金を払う | ||||||||
| キャッシュフロー情報を補充する | ||||||||
| 利子を支払う現金 | ||||||||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
| F-6 |
ACCUSTEM Science Inc.そして付属会社
簡明合併財務諸表付記
(未監査)
1. 業務的性質
AccuStem Sciences,Inc.は初期段階にある生命科学会社であり,多様な癌を治療する新製品の開発と商業化に取り組んでいる。同社の主な業務はゲノム学に基づく個人化薬物業務であり,特に乳癌や肺癌患者の業務に集中している。
新冠肺炎疫病の影響
2020年初め、新型コロナウイルス(新冠肺炎)は全世界的に突然発生した。したがって、連邦、州、そして地方当局の許可は経済活動の全体的な減少を招く。新冠肺炎は会社の2022年9月30日と2021年9月30日までの9カ月間の運営に実質的な影響はなかった。しかし、大流行は引き続き世界経済に大きな影響を与える可能性があり、会社の運営に悪影響を及ぼす可能性がある。現在、新冠肺炎が運営、流動性、財務状況と運営結果に与える影響程度はまだ確定されていない。
流動性 と持続経営
簡明総合財務諸表は持続経営原則に従って作成され、正常な業務過程で資産を現金化し、負債を返済することを考慮する。
社の活動資金は主に関連側の支援によるものである.設立以来、会社は各年度
期間に純損失を出している。2022年9月30日までの9ヶ月間、当社は純損失$を記録しました
経営陣 は、これらの簡明な連結財務諸表が発表された日から少なくとも12ヶ月以内に、会社がその運営を支援する十分な現金や流動資産がなく、その計画の研究開発活動を継続するために多くの追加の現金資源が必要になると考えている。
Br社は、新製品の普及と、研究開発活動の支援と、その製品による販売に必要な運営資金 を追加する必要があります。しかし、必要に応じて、または優遇された条項および条件の下で、このような融資を受けることができる保証はない。現在、資金需要の正確な金額と時間を正確に確定できないのは、製品開発仕事の品質、運営資金の管理及び購入サービスの正常な支払い条項と条件の継続を含む多くの要素に依存する。
| F-7 |
その資本需要を満たすために、その計画の研究開発活動やその他の支出を含むために、会社は個人投資と公共持分の形で追加の株式融資を積極的に求めている。当社は機関投資家や他の当事者とこのような可能な発行について継続的に検討してきた。必要であれば、受け入れ可能な条項または完全に十分な融資機会 を得ることができない。もし会社が十分な金額または受け入れ可能な条項で追加のbr融資を得ることができない場合、または会社が私募または公募株を完成できなかった場合、br社は研究開発計画および製品の組み合わせの一部または全部を延期、減少または廃止することを余儀なくされ、これはその経営業績または業務の将来性に悪影響を及ぼす可能性がある。経営陣がこれらの計画を推進し続けているにもかかわらず、会社が当社が受け入れられる十分な資金を獲得することに成功し、持続的な運営に資金を提供することは保証されない。不透明な要因を考慮して、経営陣は継続経営 基準を採用して簡明な総合財務諸表を作成することが適切であることを決定した。
2. 重要会計政策の概要
これらの簡明な総合財務諸表を作成する際に適用される主要な会計政策は以下のとおりである。
デモベース
添付されていない監査を経ない簡明総合財務諸表は、アメリカ公認会計原則(“アメリカ公認会計原則”)とアメリカ証券取引委員会(“アメリカ証券取引委員会”)の中期財務報告に関する適用規則と規定に基づいて作成された。米国公認会計原則に従って作成された財務諸表に通常含まれるいくつかの情報と付記開示は、このような規則と規定に基づいて簡素化または省略されている。したがって、これらの縮小合併財務諸表は、私たちが2022年4月18日にアメリカ証券取引委員会に提出した2021年12月31日までの10-K表年次報告書 に含まれる合併財務諸表と付記を組み合わせて読まなければならない。別の説明がない限り、すべての“$”への引用はドルを指し、すべての“GB”または“GBP”への引用はイギリスポンドへの引用である。 当社の報告通貨はドルである。
統合根拠
簡明な連結財務諸表には、当社及びその完全子会社の会社間取引及び残高償却後の勘定が含まれている。
見積もりを使った
公認会計原則に基づいて財務諸表を作成することは、会社の管理層に推定と仮定を要求する、すなわち、財務諸表の日付に影響を与える報告された資産と負債額及び報告された報告期間内の収入と費用である。実際の結果はこれらの推定とは異なる可能性がある。
全面損失
すべての期間の総合損失には主に純損失と外貨換算調整が含まれています。
リスク と不確実性
Br社は、その研究および開発活動の成功、運営損失を補うために追加資本(または融資)が必要であること、大企業の代替製品やサービスからの競争、ノウハウの保護、特許訴訟、キー個人への依存、および情報技術の変化に関連するリスクを含む、その業界の他の類似規模の会社と類似した多くのリスクに直面している。
現金
Br社は、購入日に購入された元の満期日が3ヶ月以下のすべての高流動性投資および通貨市場口座を現金等価物とみなしている。2022年9月30日及び2021年12月31日、当社
| F-8 |
信用リスク集中度
会社に重大な信用リスクを負担させる可能性のある金融商品には現金が含まれている。当社は定期的に金融機関で政府保険限度額を超える預金を保持しています。経営陣は、当社は重大な信用リスクに直面していないと信じている。当社の預金は経営陣が信用素の高いと考えている金融機関に保管されているが、当社は同社などの預金に何の損失もない。
設備、 純額
設備
はコストから減価償却累計を引いて計算します。財務報告の目的で、当社は直線減価償却方法
を用いて資産の推定耐用年数を減価償却する。この装置はコンピュータ装置で構成されており、その使用寿命は
会社はその従業員、取締役と顧問に株式オプション、業績オプションとその他の株式ツールを授与することができる。 株式ツールに関連する報酬コストは付与日のこのツールの公正価値を基礎とし、授権期間内に直線方式で必要なサービス期間内に確認することができるが、業績オプションは除外する。業績に基づく 株式オプションは業績目標の達成状況に応じて付与される.パフォーマンスに基づくオプション報酬に関する報酬コスト は、実現確率に基づいて必要なサービス期間内に確認される。業績に基づく株式オプション要求管理層 は,業績目標を実現する可能性を仮定する.
社は、Black-Scholesオプション定価モデルを使用して、株式オプション 報酬を修正することを含む、サービスおよび業績に基づく株式オプション報酬の公正価値を推定する。このモデルは、期待株価変動率、期待オプション寿命、無リスク金利および配当率に関するいくつかの仮定に基づいて株式オプションの公正価値を得る。
最新の会計基準
会計基準を採用した
ありません
標準 は採用されていない
ありません
| F-9 |
3. STEMPRINTER Science Limitedを買収し株式を募集する
当社の合併は分譲の結果であるTiziana生命科学社のStemPrinter Sciences Limited(“StemPrinter”)“Tiziana“)上2020年10月30日。
2020年10月5日、AccuStem Sciences Limited(“Limited”)はTizianaと、StemPrintERプロジェクト、予備プロジェクト、受取現金に関する所有権と知的財産権
$を含む子会社StemPrintERを買収することで合意した
すべての所有権と知的財産権の譲渡は資産譲渡とみなされる。この段階で単独の資産購入処理としては,譲渡前にTizianaがStemPrintERプロジェクトに対してのみ有限の保守型活動を行い,公開価値がStemPrintER知的財産権資産に集中しているという事実を反映している.
2022年3月、分割協定補充協定の条項に基づいて、Tizianaは$を投資した
4. 支払手形
当社は2022年5月20日に1年間の役員および上級管理職責任保険契約を締結し、金額は$とした
5. 装備
デバイス は以下のコンポーネントからなる:
| 2022年9月30日 | 2022年12月31日 | |||||||
| コンピュータ装置 | $ | |||||||
| 減算:減価償却累計 | ||||||||
| 装置、ネットワーク | $ | |||||||
減価償却費用は約$
減価償却費用は,付随する簡明総合経営報告書と 全面損失の一般·行政費用に含まれる。
6. 免許証
Tizianaは2014年6月24日、ミラノIEO/大学と独占ライセンス契約を締結し、Tizianaは、IEO/ミラノ大学のいくつかの特許下でのグローバル独占ライセンスと、特定の独自技術下でのグローバル非独占ライセンスとを取得して、多遺伝子予測ツールに関連するライセンス製品を開発して商業化する。付記3に記載されているように、Stemprint tERを買収する条項に基づいて会社に割り当てられる。
| F-10 |
ライセンスはライセンス製品の研究、開発と商業化の完全な制御と許可を規定し、許可製品の開発と商業化の面で商業的に合理的な努力を要求する。
ライセンス期限については、以下の記念碑的支払いが必要です( ユーロ1:1.0176ドルのレートでユーロからドルに変換)
| ● | € | |
| ● | € | |
| ● | € |
ライセンスが私たちに譲渡される前に、許可者としてTiziana
はユーロに資金を提供する必要があります
会社は、2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月以内に、本ライセンス契約に関するいかなる費用も確認していません。
普通株式1株当たりの純損失を計算する際には、オプション行使によって発行可能な普通株 を計上するため、基本 は普通株式1株当たりの純損失と同じである。
| 9月30日までの3ヶ月 | 9か月で終わる 九月三十日 | |||||||||||||||
| 2022 | 2021 | 2022 | 2021 | |||||||||||||
| 分子: | ||||||||||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 普通株主は1株当たり純損失を占めるべきである | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 分母: | ||||||||||||||||
| 加重平均発行済み普通株式、基本普通株式、希釈後普通株 | ||||||||||||||||
| 普通株主は1株当たり基本損失と希釈して1株当たり純損失を占めるべきである | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
株式オプションと引受権証を含む潜在的希薄化証券は、 希釈後の普通株1株当たりの純損失を計算することから除外されており、1株当たりの純損失が減少するからである。したがって、普通株株主が基本純損失と希釈後の1株当たり純損失を占めるべき加重平均既発行普通株数は同じである。
| F-11 |
| 9月30日までの3ヶ月 | 9か月で終わる 九月三十日 | |||||||||||||||
| 2022 | 2021 | 2022 | 2021 | |||||||||||||
| 株式オプション行使時に発行可能な株式 | ||||||||||||||||
| 合計する | ||||||||||||||||
2021年8月、株式会社は“2021年総合持分インセンティブ計画”(以下、“インセンティブ計画”と略す)を採択した。インセンティブ計画は、会社が選定した従業員、取締役及び独立請負者にオプション、株式付加価値権、制限株式、制限株式単位及びその他の株式ベースの奨励を付与することができると規定している。
各報酬は、インセンティブ計画に規定された時間または時間に行使され、インセンティブ計画に規定された条項および条件の制約を受けなければならず、これらの条項および条件は、適用される奨励協定において管理者によって決定されなければならない。この計画が許可した総株式は. 奨励計画下の奨励 最大行使可能発行日から数年。ここにあります 残りの 株はインセンティブ計画により2022年9月30日に発行される。奨励計画に基づいて保留及び発行可能な普通株式数は、各カレンダー年度の初日に毎年増加しなければならず、発効日後の最初の1月1日から奨励計画第4(A)節に定義された計画初期10年期間の最後の1月1日までとする。
オプション
2021年12月1日(“発効日”)に、当社はイギリスからデラウェア州への移転登録を完了しました(付記1参照)。発効日には、新AccuStemが新規株式購入権を授受する代償として、Limitedが付与した限られた普通株を購入する購入ツール(“旧購入持分”)が自動的に交換されたが、新AccuStem取締役会はこのような新購入株権は旧購入株式と同じであるが、新AccuStem普通株と関係があると考えている。発効日に、 New AccuStemは、その2021年の奨励計画及びその他の手配の下でLimitedの責任を負い、この等の手配に基づいて、移転発効日前に有限普通株に関する奨励に同意したが、当社は、有限計画によって付与されたすべての持分奨励の代わりに、新しいAccuStem普通株の等値持分奨励を行う。また,発効日から新AccuStemのbr}2021年株式インセンティブ計画(“2021年計画”)が発効した。新しいAccuStemまたはその子会社の任意の従業員、取締役またはコンサルタント、または任意のbrは、2021年計画に参加する資格がある。
再定住の結果としてオプションは2021年12月に発行され、株式交換の対価格となります。 発行されたオプションの発行権価格は$です1株につき,授出日10周年にすべて満期になる.これらのオプション は付与日にすべて帰属する.
また会社はBr激励計画によると、2022年第1四半期に従業員、取締役、非従業員に選択肢を提供する。
付与された オプションの発行価格は$から$まで与えられた日の10周年記念日に満期になりました
あります 付与または修正された2022年9月30日までの3ヶ月のオプション。その会社は授与した2021年9月30日までの3ヶ月間のオプション。
| F-12 |
量 時間に基づく 株式オプション | 重みをつける 平均値 行権価格 | 重みをつける 平均値 残り 契約書 寿命(年単位) | 骨材 固有の 価値がある | |||||||||||||
| 2022年1月1日に返済されていません | $ | $ | ||||||||||||||
| 発表されました | ||||||||||||||||
| 鍛えられた | ( | ) | — | |||||||||||||
| 期限切れ·没収 | — | |||||||||||||||
| 2022年9月30日に返済されていません | $ | $ | ||||||||||||||
| 2022年9月30日に付与され行使可能になりました | $ | $ | ||||||||||||||
量 パフォーマンス- 基台 株式オプション | 重みをつける 平均値 行権価格 | 重みをつける 平均値 残り 契約書 寿命(年単位) | 骨材 固有の 価値がある | |||||||||||||
| 2022年1月1日に返済されていません | $ | — | $ | |||||||||||||
| 発表されました | ||||||||||||||||
| 鍛えられた | — | |||||||||||||||
| 期限切れ·没収 | — | |||||||||||||||
| 2022年9月30日に返済されていません | $ | $ | ||||||||||||||
| 2022年9月30日に付与され行使可能になりました | — | |||||||||||||||
合計内在価値は、対象普通株の2022年9月30日までの推定公正価値とオプション行権価格との差額で計算される。
株式ベースの報酬総額は約$そして$それぞれ2022年9月30日と2021年9月30日までの3カ月 である。2022年9月30日および2021年9月30日までの9ヶ月間、株式ベースの給与は約$ と$それぞれ,である.
株式に基づく給与支出総額は、簡明総合経営報告書やその他の全面収益の一般·行政費用 に計上されている。
2022年9月30日までの9ヶ月以内に付与された株式オプションの加重平均授受日公正価値は$それは.業績に基づく と時間に基づく株式オプションは持分ごとに分類される.いくつありますか2022年9月30日までの3ヶ月以内に付与された株式オプション。
同社はブラック·スコアーズオプション定価モデルを使用してオプション報酬の公正価値を推定している。次の表は,2022年9月30日までの9カ月間のオプション付与の推定公正価値を計算するための加重平均投入をまとめたものである。
9人のために戦う 現在までの月 | ||||
| 2022年9月30日 | ||||
| 無リスク金利 | - | % | ||
| 期待配当収益率 | % | |||
| 所期期限 | – 年.年 | |||
| 予想変動率 | - | % |
| F-13 |
無リスク金利は、米国財務省のゼロ金利債券を使用した現在の利用可能な収益率で決定され、残りの期限は奨励の期待期限に見合っていると仮定する。同社は歴史的にずっと民間会社であり、会社に特定されたbr歴史と隠れた変動率情報が不足している。経営陣は似たような上場企業に基づいて予想される変動性を推定した。オプションの期待寿命 は,オプション予想が満了していない期間を表す.配当収益率の推定値は%brは当社の歴史上支払われたことがないので、予測可能な未来に普通配当金を支払うつもりもありません。
2022年9月30日までに$オプションに関連した未確認報酬支出。$この部分のコストは時間に基づく 条件によって制限され,約何年もです。残りの$未確認報酬支出 は、オプションに帰属していない業績ベースの条件に関連している。性能状況が発生または発生する可能性があると,必要なサービス期間内にこれらのコストを確認する予定である.業績株価オプションに関する報酬コストは報告期間ごとに評価 を行い,業績条件予想結果の変化に応じて調整した。
株式承認証
2022年3月に会社は
付与された普通株式証の行使価格は$である
当社の普通株式購入活動の株式引受証の概要は以下の通り
量 株 | 重みをつける 平均値 行権価格 | 重みをつける 平均値 残り 契約書 寿命(年単位) | 骨材 固有の 価値がある | |||||||||||||
| 2022年1月1日に返済されていません | $ | — | $ | |||||||||||||
| 発表されました | ||||||||||||||||
| 鍛えられた | — | |||||||||||||||
| 期限切れ·没収 | — | |||||||||||||||
| 2022年9月30日に返済されていません | $ | $ | ||||||||||||||
| 2022年9月30日に付与され行使可能になりました | — | |||||||||||||||
付与日これらの株式承認証の公正価値は$である株式承認証1部あたりの総公平価値は$それは.下表は,2022年9月30日までの9カ月間の一般権証オプションの推定公正価値を計算するための加重平均投入をまとめたものである。
9か月で終わる 2022年9月30日 | ||||
| 無リスク金利 | % | |||
| 期待配当収益率 | % | |||
| 所期期限 | 年.年 | |||
| 予想変動率 | % | |||
| F-14 |
あります 2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月以内に確認された引受権証は、株式の補償支出に基づく。
2022年9月30日までに$一般株式証に帰属していないことに関連する業績に基づく未確認補償コスト総額の百分率 。これらのコストは,性能状況が発生したり,発生する可能性がある場合に確認される予定である.
9. 関係者取引
Tiziana
は係り先であり,共通制御下にあるためである.当社はTizianaと取締役、役員、重要な株主を共有しています。Tizianaから子会社を買収したため、同社も設立された。2022年9月30日現在、Tizianaは約
2022年9月30日と2021年12月31日まで、$
分割協定が発効した後、会社は共有サービス協定を締結し、ある限られた管理と行政サービスをアウトソーシングした。当社は、費用には、当社のサービス提供にかかる時間に関する賃金コストが含まれており、実際にかかる時間と分配された賃金コストに基づいて算出されていることに注目している。また、会社はあるオフィススペースの使用をコストで料金を徴収している。これらのサービスの料金は追加されていません。当社は2022年、2022年、2021年9月30日までの3ヶ月間、約3ヶ月間発生しています
2022年9月30日と2021年12月31日まで、$
2022年1月、当社は取締役会長兼第一大株主のGabriele Cerroneと契約を締結し、月額を$とするコンサルティングサービスを当社に提供する
10. 所得税
列報のすべての期間において、当社が発生した税前損失は相応の税額割引を得ていません。当社は、それによって生じる繰延税金資産の価値を現金化することができない可能性が高いと結論しているからです。当社 は、将来的にその推定手当の一部を減少させるのに適しているかどうかを決定するために、今後の期間の状況を評価し続ける。2020年3月27日、新冠肺炎の大流行による一定の救済を提供するためのCARE法案が国会で可決された。その他の事項以外にも、“注目法”には、純営業損失の繰越期間、代替最低還付限度額、 および純利息控除制限改正に関する条項が含まれている。CARE法案は、会社が2022年9月30日までの9ヶ月間の総合財務諸表に実質的な影響を与えていない。当社はCARE法案がその財務諸表に及ぼす可能性のあるいかなる影響も監視し続けます。
2022年9月30日現在、会社はどの税務機関でも公開されていない税務監査を行っている。
11. 引受金とその他の事項
法的訴訟
会社は時々様々なクレーム、訴訟、そして訴訟に参加する。当社は、不利な結果が生じる可能性があり、損失金額が合理的に推定できると判断した場合、特定の法的手続きのための準備金を確立します。経営陣は、不利な結果が発生する可能性があると判断し、および/または可能な損失を推定することができる任意の法的事項を決定していません。
| F-15 |
独立公認会計士事務所報告{br
Accustem Science Inc.の取締役会と株主。
連結財務諸表に関する意見
Accustem Science Inc.(当社)2021年12月31日までと2020年12月31日までの連結貸借対照表,および2021年12月31日までの年度と2020年6月5日(設立日)から2020年12月31日までの関連経営報告書と全面収益(損失),株主権益とキャッシュフロー,および関連付記(総称して財務諸表と呼ぶ)を監査した。この等の財務諸表は,当社の二零二年十二月三十一日及び二零二年十二月三十一日の財務状況と,二零二一年十二月三十一日までの年度及び二零年六月五日(設立日)から二零二年十二月三十一日までの経営実績及びキャッシュフローを各重大な面で公平に反映しており、米国公認の会計原則に適合していると考えられる。
持続経営に関する解釈的 段落
添付されている総合財務諸表 は、当社が経営を継続すると仮定して作成されています。財務諸表付記1で述べたように、当社は設立以来経営損失を出している。同社の累計赤字は2021年12月31日現在724,862ドル。当社は機関投資家や他の人から必要な資金を得て、運営を継続することに依存しています。これらのことは、経営を続ける企業として存続する能力が大きく疑われている。付記1には、これらの事項に関する経営陣の計画も記載されています。合併財務諸表には、このような不確実性の結果による可能性のある調整は含まれていません。
意見を求める根拠
これらの財務諸表は会社経営陣が担当しています。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。
私たちのbrはアメリカ上場会社会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社から独立しなければならない。
私たち はPCAOBの基準に従って監査を行います。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、監査を計画し、実行することを要求しています。エラーによるものであっても詐欺であっても、当社はその財務報告の内部統制を監査する必要もありません。私たちの監査の一部として、財務報告の内部統制を知る必要がありますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって,我々 はこのような意見を表現しない.
我々のbr監査には、財務諸表の重大な誤報のリスクを評価するための実行プログラムが含まれており、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行する。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。私たちの監査には、経営陣が使用する会計原則の評価と重大な推定、財務諸表の全体的なレポートの評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
マザーズ·アメリカ法律事務所
/s/ マーゼアメリカ有限責任会社
私たち は2022年以来当社の監査役を務めています。
ニューヨーク、ニューヨーク州
2022年04月15日
| F-16 |
ACCUSTEM Science Inc.子会社と
合併貸借対照表
| 十二月三十一日 | 十二月三十一日 | |||||||
| 2021 | 2020 | |||||||
| 資産 | ||||||||
| 関係者の売掛金 | $ | $ | ||||||
| 流動資産総額 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 負債.負債 | ||||||||
| 売掛金 | $ | $ | ||||||
| 関係者対応 | ||||||||
| 費用を計算する | ||||||||
| 流動負債総額 | ||||||||
| 総負債 | ||||||||
| 株主権益 | ||||||||
| 優先株$額面価値ライセンス株;発行済みと未償還 | ||||||||
| 普通株$額面価値ライセンス株;発行済みおよび発行済み株式 | ||||||||
| 追加実収資本 | ||||||||
| 関係者が受取金を引受する | ( | ) | ( | ) | ||||
| その他の総合収益を累計する | ||||||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益総額 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
| F-17 |
ACCUSTEM Science Inc.子会社と
合併 経営報告書と全面収益(赤字)
現在までの年度 十二月三十一日 | 2020年6月5日から (開始から) 十二月三十一日 | |||||||
| 2021 | 2020 | |||||||
| 運営費用 | ||||||||
| 研究開発費 | $ | $ | ||||||
| 一般料金と管理費用 | ||||||||
| 運営費総額 | ||||||||
| 運営損失 | ( | ) | ( | ) | ||||
| 所得税前損失、 | ( | ) | ( | ) | ||||
| 収入 税収割引(費用) | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 普通株株主は1株当たり純損失を占め,基本損失と赤字を計上すべきである | $ | ( | ) | $ | ( | ) | ||
| 加重 は普通株株主が1株当たり純損失の平均既発行普通株を占めるべきであり、基本と希釈後の | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 翻訳 調整 | ( | ) | ||||||
| 総合 収入 | $ | ( | ) | $ | ||||
| F-18 |
ACCUSTEM Science Inc.子会社と
合併株主権益表
| 普通株 株 | その他の内容 | 関わる 会合 | 積算 他にも | |||||||||||||||||||||||||
番号をつける の株 | 金額 | 実収資本 | 定期購読 応募 | 総合収入 | 累積赤字 | 株主権益 | ||||||||||||||||||||||
| 2020年6月5日(成立日)の残高 | $ | $ | $ | $ | $ | $ | ||||||||||||||||||||||
| Stemprint tER分割プロトコルに関する普通株式の発行 | | |||||||||||||||||||||||||||
| Stemprint関連補完分割プロトコルに関する普通株式 の発行 | ( | ) | ||||||||||||||||||||||||||
| 外貨換算調整 | — | ( | ) | |||||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||||||
| 2020年12月31日の残高 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 株に基づく報酬 | — | |||||||||||||||||||||||||||
| 外貨換算調整 | — | ( | ) | ( | ) | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||||||
| 2021年12月31日の残高 | $ | $ | $ | ( | ) | $ | $ | ( | ) | $ | ||||||||||||||||||
| F-19 |
ACCUSTEM Science Inc.子会社と
統合現金フロー表
現在までの年度 十二月三十一日 | その期間内に 2020年6月5日から (成立日) 12月31日まで | |||||||
| 2021 | 2020 | |||||||
| 経営活動のキャッシュフロー | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| を調整し、純損失と経営活動で使用されている現金純額を照合する: | ||||||||
| 株に基づく報酬 | ||||||||
| 資産と負債の変化 : | ||||||||
| 売掛金 | ||||||||
| 関連 対応先 | ||||||||
| 課税費用 | ||||||||
| 経営活動キャッシュフロー純額 | ||||||||
| 現金純変化 | ||||||||
| 現金、 年明け | ||||||||
| 現金、年末 | $ | $ | ||||||
| 非現金プロジェクト投資と融資活動: | ||||||||
| Stemprint/関連先の分割プロトコルのために発行された株式 | $ | $ | ||||||
| Stemprint/関連側が売掛金を引受する関連補充分割プロトコルのために発行された株式 | $ | $ | ||||||
| F-20 |
ACCUSTEM Science Inc.子会社と
連結財務諸表付記
1. ビジネス記述
Accustem Science Inc.及びその子会社(“当社”)は2021年7月28日に米国デラウェア州に登録設立された。同社は早期生命科学会社であり、多様な癌の新製品の開発·商業化·管理に取り組んでいる。同社の主な活動はゲノム学に基づく個人化薬物業務であり,特に乳癌患者に集中している。
当社の合併地位はAccustem Sciences Limited(“Limited”)が2020年10月30日に法人StemPrinter Sciences Limited(“StemPrintER”) をTiziana Life Science plc(“Tiziana”)から分割したためである。Limited は2020年6月5日に登録が成立した。2021年3月12日、2021年5月7日と2021年6月1日にさらに改正され、Limitedは1934年の証券取引法に基づいて米国証券取引委員会に20-F表登録 声明を提出し、 分割取引を実施する。登録声明は2021年7月1日に施行されることが発表された。この取引の詳細な手順は以下のとおりである
2020年10月に達成された合意によると、TizianaはStemPrinterのすべての所有権と知的財産権
を譲渡し、$を支払うことを約束した
2020年10月5日、LimitedはTizianaと、StemPrintプロジェクトに関する所有権と知的財産権および#ドルの受取現金を含むStemPrintERの流通株を買収することで合意した
2021年11月1日、有限会社はイギリス“UK”法律の手配方案に基づいて新しい親会社(前身はAccustem Sciences Limited及びその子会社)を設立する予定であり、 はデラウェア州登録会社Accustem Sciences,Inc.であることを発表した。1934年証券法第12 G-3(A)条によると、2021年12月1日(“発効日”)、有限会社はイギリスから米国デラウェア州への移転を完了した。転籍を完了するために、当社はLimitedのすべての発行済み株式を買収し、当社の普通株の発行と引き換えに、Limitedの後任発行者となる。
当社とその付属会社は,移転後にLimitedが移転前に行う業務や運営と同じ業務や運営を行うが,当社の日常業務やその戦略は期待していない. このようなエンティティが共同制御されているため,買収事項は既存の帳簿金額に応じて入金される.移転前の総合財務諸表は、当社の前身である株式会社の総合財務諸表であり、会計·報告目的に用いられている。2021年12月30日、会社と取締役会は有限会社の解散を許可し、2021年12月30日から発効する。当社の全資附属会社StemPrinter Sciences Limitedの普通株はAccustem Sciences,Inc.に譲渡されており,今回の解散は当社の2021年12月31日までの年度業績に影響を与えなかった。
転入発効の日に当社はまだ完成した
これらの連結財務諸表および関連付記では、移転前期間に関するすべてのbr株式および1株当たりの金額は20:1交換割合の影響を反映するように追跡的に調整されている。
これらの 連結財務諸表は,2020年6月5日(創業期)から2020年12月31日までの間に作成されたものと,2021年12月31日までの連結財務諸表である。
関連取引所市場で発行された有限会社普通株株式は、株式記号が“ACMSY”である。2022年3月23日、会社の普通株は場外取引市場で取引を開始し、株式コードは“ACUT”となった。
| F-21 |
新冠肺炎疫病の影響
2020年初め、新型コロナウイルス(新冠肺炎)は全世界的に突然発生した。したがって、連邦、州、そして地方当局の許可は経済活動の全体的な減少を招く。新冠肺炎は2021年12月31日と2020年12月31日までの会社運営に実質的な影響はなかった。しかし,大流行は引き続きグローバル経済に大きな影響を与える可能性があり,会社の運営に悪影響を及ぼす可能性がある。現在、新冠肺炎が運営、流動性、財務状況と運営結果に与える影響程度はまだ確定されていない。
流動性 と持続経営
総合財務諸表は持続経営をもとに作成されており、正常業務過程で資産を現金化し、負債を返済することを考えている。
社の活動資金は主に関連側の支援によるものである.設立以来、会社は各年度
期間に純損失を出している。2021年12月31日まで、当社は純損失$を記録しました
経営陣 は、これらの連結財務諸表が発表された日から少なくとも12ヶ月以内に、会社はその運営を支援するのに十分な現金や流動資産を持っておらず、そのbr計画の研究開発活動を継続するために多くの追加の現金資源が必要になると考えている。
Br社は、新製品の普及と、研究開発活動の支援と、その製品による販売に必要な運営資金 を追加する必要があります。しかし、必要に応じて、または優遇された条項および条件の下で、このような融資を受けることができる保証はない。現在、資金需要の正確な金額と時間を正確に確定できないのは、製品開発仕事の品質、運営資金の管理及び購入サービスの正常な支払い条項と条件の継続を含む多くの要素に依存する。
年末に続き,経営陣は会社が関連先の受取/支払純額を受け取っていることに気づいた$
その資本需要を満たすために、計画中の研究開発活動やその他の支出を含むため、当社は私募方式で追加株式融資を行うことを積極的に求めている。当社は機関投資家や他の当事者とこのような可能な発行について交渉してきました。会社には十分な融資機会がないかもしれません。 必要であれば、受け入れ可能な条項によって、あるいは融資機会が全くありません。当社が十分な金額または受け入れ可能な条項で追加融資を受けることができない場合、または当社が私募または公募株を完成できなかった場合、当社は、研究開発計画および製品の組み合わせの一部または全部の拡張を延期、キャンセル、または廃止することを余儀なくされ、その経営業績または業務の将来性に悪影響を及ぼす可能性がある。経営陣はこれらの計画を継続して実行しているにもかかわらず,会社 が会社が受け入れられる十分な資金を獲得し,継続的な運営に資金を提供することに成功する保証はない。不確実性を考慮して、経営陣は継続的な経営基盤を採用して総合財務諸表を作成するのが適切だと考えている。
| F-22 |
2. 重要会計政策の概要
これらの総合財務諸表を作成する際に採用される主な会計政策は以下のとおりである。
デモベース
添付された財務諸表はすでに米国公認会計原則(“公認会計原則”)に従って作成され、ドル建てで計算されている。他に説明がない限り、すべての“$”はドルを指し、すべての“ポンド”はイギリスポンドを指す。その会社の報告通貨はドルです。
統合根拠
添付されている監査された総合財務諸表はAccustem Science Inc.とその完全子会社の勘定を含む。当社は当社が財務と経営政策を管理し、そのため制御するすべての実体を合併し、当社はこれらの実体に対して持株権を持っている。エンティティ に対して制御権を行使するか否かを評価する際には、現在の投票権 および現在行使可能または両替可能な潜在的投票権の存在および効力が考慮される。子会社は当社が支配権を取得した日から合併し、支配権が終了した日から合併を解除する。
会社間取引と会社間の残高は合併時に打ち消されます。子会社の会計政策は、会社がとっている政策と一致することを確実にするために、必要に応じて変更されている。
転入前に、有限会社は国際財務報告基準(“IFRS”)に基づいてその総合財務諸表を報告した。移転後、会社は公認会計原則に移行し、これまでのすべての 期間に適用された。経営陣は、2021年12月31日と2020年12月31日までの財務状況と、2021年と2020年12月31日までの経営結果と現金流量とを公平に反映するために、必要なすべての調整(通常の経常的調整、会社間調整、再分類、非日常的調整を含む)が記録されていると考えている。当社とその子会社は従来共同統制下にありました。遷移および関連する内部再構成は、共通制御されたエンティティに対するASC 805による再構成と一致する企業合併それは.したがって,資産と負債および株式を交換する譲渡 は,譲渡日に譲渡エンティティから額面ごとに新しいエンティティに計上される.再編前に提出された財務諸表中のすべての期間の財務情報 は合併に基づいて記載されており,各エンティティはこれらの期間は共同制御下にある.
総合 収益(損失)
全期間の総合収益(赤字)は主に純損失と外貨換算調整からなる。
見積もりを使った
公認会計原則に基づいて財務諸表を作成することは、会社の管理層に推定と仮定を要求する、すなわち、財務諸表の日付に影響を与える報告された資産と負債額及び報告された報告期間内の収入と費用である。実際の結果はこれらの推定とは異なる可能性がある。
リスク と不確実性
Br社は、その研究および開発活動の成功、運営損失を補うために追加資本(または融資)が必要であること、大企業の代替製品やサービスからの競争、ノウハウの保護、特許訴訟、キー個人への依存、および情報技術の変化に関連するリスクを含む、その業界の他の類似規模の会社と類似した多くのリスクに直面している。
| F-23 |
長期資産減価
会社は、財務会計基準委員会(FASB)会計基準編纂(ASC)360(“ASC 360”)に従って、その長期資産(または資産群)の回収可能性を検討する財産·工場·設備 イベントや状況変化が長期資産(グループ)の帳簿価値が回収できない可能性があることを示す場合, の潜在的減値の評価は、主に当社が将来期待しているキャッシュフローから長期資産の帳簿価値を回収する能力に基づいている。将来未割引キャッシュフロー総額が資産の帳票金額よりも少ないことが予想される場合、公正価値(予想未来割引キャッシュフローから計算)と資産帳簿価値との差額について損失を確認する。
所得税 税
社はASC 740-所得税それは.連邦および州所得税については、繰延税金資産および負債は、財務諸表と資産および負債の課税基礎との差に基づいて確認される。また、繰延税項資産も営業純損失やその他の税項属性に基づいて入金される。繰延所得税は規定税率に基づいており、予想差が逆転した時期に適用する法律が公布されている。繰延税金資産の税金利益が実現不可能な場合には、推定準備を計上する。
当社は、その繰延税金資産の全額推定免税額を、すべてまたは一部の免税額をサポートするのに十分な証拠があるまで維持していきたいと考えています。完全な推定手当を確立する際、会社はすべての潜在的な課税収入源、課税臨時差の将来の輸出、課税収入の予測、税収計画戦略の収入、および任意の他の利用可能かつ関連する情報を含むすべての利用可能な証拠を考慮した。既存の推定免税額 は期間ごとに再審査される。繰延税金資産の現金化が決定される可能性が高い場合には、この決定が下された間に適切な推定免税額(ある場合)が割り当てられる。
税収 は、より達成可能な敷居に適合するとはみなされない職が今年度の税費として記録される。2021年12月31日と2020年12月31日まで、不確定なbr税務頭寸は財務諸表に計算または開示する必要があります。会社納税申告書を作成する過程で採用または予想される税務立場を評価し、 税務立場が“より可能性が高い”かどうかを確定し、税務機関の支援を受ける必要がある。
研究と開発費
研究と製品開発コストはASC 730−項で発生した費用に計上されている。研究と開発それは.研究と開発費用 は主に会社の候補製品の組み合わせの臨床前と臨床開発に関するコストを含み、臨床研究組織(CRO)に支払う費用、臨床試験材料の製造、臨床前研究活動、研究と開発活動の実行に必要なコンサルタントと人員、知的財産権、および知的財産権を許可するコストを含むが、知的財産権は進行中の研究と開発資産であり、将来は他の用途はない。
細分化市場 情報
ASC 280を採用しています細分化市場報告報告可能な部門が、その財務諸表開示のために決定される。運営部門は実体の構成要素として定義され、単独の財務情報を得ることができ、首席運営決定者(“CODM”)によって定期的に審査され、個別部門にどのように資源を割り当て、業績を評価するかを決定することができる。当社の最高経営責任者はその最高経営責任者(“CEO”)。当社は を単独の運営部門として運営することを決定し、報告可能な部門があります。
| F-24 |
金融商品の公正価値
契約手配の実質内容及び金融負債、金融資産及び権益ツールの定義に基づいて、会社は金融商品又はその構成要素を金融負債、金融資産又は権益ツールに分類する。
会社は、資産、負債、または資本構成要素を含むかどうかを決定するために、金融商品の条項を評価する。このような構成要素は、金融資産、金融負債、または権益ツールに個別に分類されなければならない。
Br社の財務負債には貿易と他の支払いが含まれている。項目の短期的な性質により,当該等金額の帳簿価値は公正価値に近い。当社は公正な価値で損益によっていかなる金融資産や負債を保有していないか、あるいは他の全面的な収益を通じて公正な価値で保有している
Br社はASC 718の規定により、付与日の公正価値に基づいて、従業員と非従業員に株式ツールを付与する株式ベースの報酬支出を確認する-株補償。報酬の付与日公正価値は、必要なサービス期間内に補償費用として比例して確認され、このサービス期間は、通常、報酬の帰属期限に等しい。会社は没収が発生した期間の実際の没収を計算する。
会社の株式支払いには株式オプションが含まれています。株式報酬費用は、営業報告書の一般費用と行政費用および研究開発費に計上される。
会社はASC 260に基づいて1株当たり損失を計算しています1株当たりの収益それは.普通株1株あたりの基本純損失の計算方法は, 純損失を期内に発行された普通株の加重平均株式数を除く。普通株希釈1株当たり純損失 計算方法は、オプション、制限性株式単位 (“RSU”)と業績奨励を含むすべての潜在的な普通株希釈株式を考慮する。普通株の基本と希釈後の1株当たり純損失は列報のすべての期間で同じである すべての潜在的に薄くなった既発行証券の影響は逆に薄くなっているからである。
外貨
合併財務諸表はドルで報告され、ドルは会社の報告と機能通貨であり、会社の運営と資本コストはドルで取引されるからである。当社が完全に合併した子会社であるbr機能通貨は依然としてポンドであり,これは実体運営が置かれている主要な経済環境の通貨である。
本位貨幣と会社が報告した貨幣種の異なる海外業務の財務結果と頭寸を以下のように換算する
| ● | 資産と負債は、この報告日の年末レートで換算される | |
| ● | 収入および支出は、その期間の平均レートに換算される | |
| ● | 権益 留保収益/累積損失を含む取引は,取引当日の為替レートに換算する. |
外貨建て取引や残高の換算や決済による収益と損失計上収入の決定 総合全面損失表における“その他全面損失”には、2021年12月31日と2020年12月31日までの外貨換算調整が含まれている。
| F-25 |
最近 が発表され会計基準が採用された
Br社は2012年のJumpStart Our Business Startups Act(“JOBS Act”)で定義されている新興成長型会社である。“雇用法案”によると、新興成長型企業は、これらの基準が民間企業に適用されるまで、“雇用法案”公布後に発表された新会計基準または改正会計基準の採用を延期することができる。
企業は、新しいまたは改正された会計基準を遵守するためにこの延長された移行期間を使用することを選択し、新しいまたは改正された会計基準は、それ(I)がもはや新興成長型企業または (Ii)が“雇用法案”に規定されている移行期間を延長する日(より早い日を基準とする)から脱退することを明確かつ撤回できないまで、上場企業および民間企業に対して異なる発効日を有する。そのため、合併後の財務諸表は、上場企業 の発効日までに新たなまたは改訂された会計声明を遵守している会社と比較できない可能性がある。
雇用法案は、新興成長型会社が新たな会計基準や改正された会計基準を早期に採用することを排除しない。以下に述べるように、 社は新興成長型会社の満期日までに何らかの会計声明を事前に採用している。当社がまだ新興成長型会社である間、当社は延長された移行期間を任意の他の新たなまたは改正された会計基準に適用する予定です。
会社はすべての会計基準更新(“ASUS”)の適用性と影響を考慮している。以下で議論されていないASUSは、当社の財務諸表への適用または予想の影響はわずかであると評価および決定した。
2020年6月5日から施行され、アリゾナ州2018-07年“報酬--株式報酬-ASC 718。この更新は、コストおよび複雑性を低減し、サービス提供者、コンサルタント、外部法律顧問、およびサプライヤーのような非従業員に発行される在庫ベースの支払いの財務報告を改善することを目的としている。ASUはテーマ718の範囲を拡張しました報酬--株式報酬現在、従業員に発行される株式ベースの支払いのみが含まれており、非従業員に発行された商品やサービスの株式ベースの支払いも含まれている。したがって、非従業員と従業員の株式ベースの支払いに対する会計処理はほぼ一致する。本指針は、2018年12月15日から上場企業が発表した年度および中期財務諸表に適用されます。この基準の早期採用を許可しています。この基準は提出されたすべての期間に遡及的な方法で適用されるだろう。2020年6月5日現在、ASU 2018-07を採用して会社の総合財務諸表に実質的な影響がないため、調整を記録していません。
2020年7月1日より、ASU 2019-12“所得税-ASC 740:所得税の会計計算を簡素化するこれは、ASC 740における一般原則のいくつかの例外を削除することによって、所得税の会計処理を簡略化する。修正案はまた、既存のガイドラインを明確におよび修正することによって、ASC 740の他の分野におけるGAAPの一貫した適用を改善し、GAAPを簡略化する。本指導 は2020年12月15日以降から始まる財政年度とこれらの財政年度内の過渡期が有効である。ASU 2019-12 の採用は当社の総合財務諸表に大きな影響を与えていません。
まだ採用されていない会計基準が発表された
2016年2月、FASBは改訂されたASU第2016-02号を発表した賃貸借証書ASC 842は、テナントに貸借対照表上のほとんどのリースによって生成された権利および義務の資産および負債を確認することを要求する。本ガイドラインは、2021年12月15日以降の事業年度に適用され、これらの事業年度内の移行期間を含む。ASU 2016-02は、最初の申請の日または後に締結されたすべてのレンタル契約を修正して遡及採用することを要求し、いくつかの移行減免を使用することを選択することができます。当社はすでにテーマ842を評価しており、2022年1月1日からこの基準を採用すると、当社の財務諸表や関連開示に非実質的な影響が生じると考えられている。当社には未払いのレンタル契約はありません。
2020年8月にFASBはASU 2020-06を発表しました債務--転換やその他のオプションを持つ債務(トピック470-20)およびデリバティブとヘッジ−実体自己資本の契約(小主題815-40)(ASU 2020-06)は、変換可能なツールおよびエンティティの自己持分の契約を含む、負債および持分の特徴を有するいくつかの金融商品の会計処理を簡略化する。ASU 2020−06は、(1)現金変換機能を有する変換可能債券(“CCF”) および(2)有益な変換機能を有する変換可能ツール(“BCF”)の分離モードを米国GAAPから削除した。
したがって,ASUの指導を取り入れた後,エンティティはこのような債務に変換機能を埋め込む権益 を単独で提示することはない.逆に、彼らは、変換可能債務ツールを完全に債務として入金し、変換可能優先株を完全に優先株 として入金する(すなわち、単一課金単位として)、(1)変換可能債券がASC 815派生ツールとして必要な特徴 を含むか、または(2)変換可能債務ツールがかなり高いプレミアムで発行されなければならない。ASU 2020-06は、米国証券取引委員会の届出手続き定義に適合する公共業務エンティティに対して有効であり、米国証券取引委員会の定義に適合する比較的小さい報告会社の実体は含まれておらず、 2021年12月15日以降の財政年度は、これらの財政年度内の移行期間を含む。当社はASU 2020-06の条項を採用し、2024年1月1日から発効し、現在潜在的な影響を評価しています。
| F-26 |
2021年5月、FASBはASU 2021-04を発表した発行者は独立株式のいくつかの修正または交換の会計処理 分類書面コールオプション(“ASU 2021-04”)は、権利証を株式補償またはデリバティブとして会計処理する新たな方式を会社に導入している である。新しいガイドラインの下で、変更されていない手形の株式分類 を修正すれば、会社は修正された会計を元のチケットで新しいチケットを交換するように処理する。一般に、“新しい”手形の公正価値が“元の”手形の公正価値よりも大きい場合、発行者が現金を支払ったように、取引実質によって超過された部分が確認される。本基準の発効日は,すべてのエンティティが2021年12月15日以降に開始する中期·年度報告期間であり,早期採用を許可している。当社は現在、新しい指針の影響を評価しており、この指針を採択することはその総合財務諸表や開示に大きな影響を与えないと予想される。
3. STEMPRINTER Science Limitedを買収
会社の合併はStemPrinterが2020年10月30日にTizianaから分割した結果である。取引については、以下の手順で詳細に説明し、注1で説明する。
2020年10月5日、LimitedはTizianaと、StemPrintプロジェクトに関連する所有権と知的財産権および#ドルの受取現金を含む子会社StemPrintERを買収することで合意した
同社はASC 805-企業合併ASC 730-研究と開発取引をどのように会計処理するかを決定する際 取引は最終的に同一側によって制御されるエンティティ間で行われるため,ASC 805-50により,今回の買収は共通制御グループとみなされている企業合併そのため、払込資産の帳簿価値は変わらず、歴史的コストで入金される。付記1で述べたように、上記株式組合せは、株式合併後株式組合せである。
すべての所有権と知的財産権の譲渡は資産譲渡とみなされる。この段階で単独の資産購入処理としては,譲渡前にTizianaがStemPrintERプロジェクトに対してのみ有限の保守型活動を行い,公開価値がStemPrintER知的財産権資産に集中しているという事実を反映している.
また、Tizianaは、分割協定の追加合意条項に基づいて、#ドルで投資することに同意した
4. 免許証
Tizianaは2014年6月24日、ミラノIEO/大学と独占ライセンス契約を締結し、Tizianaは、IEO/ミラノ大学のいくつかの特許下でのグローバル独占ライセンスと、特定の独自技術下でのグローバル非独占ライセンスとを取得して、多遺伝子予測ツールに関連するライセンス製品を開発して商業化する。付記3に記載されているように、Stemprint tERを買収する条項に基づいて会社に割り当てられる。
ライセンスはライセンス製品の研究、開発と商業化の完全な制御と許可を規定し、許可製品の開発と商業化の面で商業的に合理的な努力を要求する。研究計画が完成した後、以下の各種職務遂行調査要求を満たさなければならない
| F-27 |
ライセンス期限については、以下の記念碑的な支払いが必要です( ユーロ1の為替レートを使用してユーロをドルに換算:1.1324ドル)
| ● | € | |
| ● | € | |
| ● | € |
ライセンスが私たちに譲渡される前に、許可者としてTiziana
はユーロに資金を提供する必要があります
会社は,2021年12月31日までの期間と2021年12月31日までの年度において,本ライセンス契約に関する0ドルと0ドルの費用 を確認した。
普通株式1株当たりの純損失を計算する際には、オプション行使によって発行可能な普通株 を計上するため、基本 は普通株式1株当たりの純損失と同じである。
For the Year 一段落した December 31, | For the Period from June 5, 2020 (date of inception) to December 31, | |||||||
| 2021 | 2020 | |||||||
| 分子: | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 普通株主は純損失を占めるべきだ | $ | ( | ) | $ | ( | ) | ||
| 分母: | ||||||||
| 加重平均 発行済み普通株式、基本普通株、希釈後普通株 | ||||||||
| 普通株1株当たり純損失,基本損失と赤字 | $ | ( | ) | $ | ( | ) | ||
Br社の潜在的希薄化証券は、株式オプションを含め、1株当たり純損失を減少させるため、普通株希釈純損失の計算から除外されている。したがって,普通株株主が基本純損失を占めるべきであることと希釈後の1株当たり純損失を計算するための加重平均発行済み普通株数 は同じである。
| F-28 |
For
the Year 十二月三十一日 | 2020年6月5日から発効 (成立日) 12月31日まで | |||||||
| 2021 | 2020 | |||||||
| 株式 発行済み普通株のオプションを購入する | ||||||||
| 合計する | ||||||||
2021年8月、株式会社は2021年総合持分インセンティブ計画(“インセンティブ計画”)を採択した。インセンティブ計画は、会社が選定したbr従業員、取締役、独立請負者にオプション、株式付加価値権、制限株、制限株式単位、その他の株式ベースの奨励を付与することができることを規定している。
各 オプションは、インセンティブ計画に規定された時間または時間に行使され、インセンティブ計画に規定された条項および条件の制約を受けなければならず、これらの条項および条件は、適用される報酬プロトコルにおいて管理者によって決定されなければならない。この計画が許可した総株式はそれは. 奨励計画下のオプションは最大行使可能発行日から数年。ここにあります残りの利用可能株は2021年12月31日にインセンティブ計画に従って発行される。奨励計画の下で保留及び発行可能な普通株式数は、各カレンダー年度の初日に毎年増加しなければならず、発効日後の最初の1月1日から奨励計画第 4(A)節で定義された計画初期10年期間の最後の1月1日までである。
2021年12月1日(“発効日”)に、当社はイギリスからデラウェア州への移転登録を完了しました(付記1参照)。発効日に、Limitedが授与した有限普通株の購入株式購入ツール(“旧購入株権”)はすでに自動交換され、新Accustemとして新購入株権を授受する代償として、このなどの新購入株権はLimited取締役会を通じて旧購入株権と同等であると考えられたが、新Accustem普通株と関係がある。発効日に、新会社はその2021年奨励計画及びその他の手配下の責任を負い、この手配により、当社は移転発効日前に有限普通株に関する奨励に同意し、当社は有限計画によって与えられたすべての持分奨励の代わりに、新会社の普通株の同値持分奨励を代替する。また、発効日から、新マクロベースの“2021年株式インセンティブ計画”(略称“2021年計画”)が正式に発効した。新マクロベースの任意の従業員、取締役またはコンサルタント、またはその子会社の任意のbrは2021年計画に参加する資格がある。
Number of 共有 オプション | 重みをつける 平均値 トレーニングをする 値段 | 重みをつける 平均値 残り 契約書 life (in years) | 骨材 固有の 価値がある | ||||||||||||||
| 2021年1月1日現在の未返済債務 | $ | $ | |||||||||||||||
| 発表されました | years | ||||||||||||||||
| 鍛えられた | — | ||||||||||||||||
| 期限切れ·没収 | — | ||||||||||||||||
| 2021年12月31日までの未返済債務 | years | ||||||||||||||||
| Brが付与され、2021年12月31日に行使可能です | $ | years | $ | ||||||||||||||
| F-29 |
合計内的価値は、対象普通株の2021年12月31日までの推定公正価値とオプション行権価格との差額で計算される。
2021年12月31日までのすべてのbrオプションは、2021年8月1日発行日にすべて帰属します。
| 年度まで | ||||
| 十二月三十一日 | ||||
| 2021 | ||||
| 研究開発 | $ | |||
| 通常 と管理 | ||||
| 株に基づく報酬総支出 | $ | |||
2021年12月31日まで年度内に付与された株式オプションの加重平均授受日公正価値は$それぞれ,である. 社はBlack-Scholesオプション定価モデルを用いて、2021年12月31日までの年間オプション報酬の公正価値を以下の加重平均 により推定すると仮定する
| 年度まで | ||||
| 十二月三十一日 | ||||
| 2021 | ||||
| 無リスク金利 | % | |||
| 期待配当収益率 | % | |||
| 所期の 期限 | years | |||
| 期待変動 | % | |||
無リスク金利は、イギリス財務省のゼロ金利債券を使用して現在利用可能な収益率を用いて決定され、残りの期間は奨励の期待期限に見合っていると仮定する。同社は歴史的にずっと民間会社であり、会社に特定されたbr歴史と隠れた変動率情報が不足している。経営陣は似たような上場企業に基づいて予想される変動性を推定した。オプションの期待寿命 は,オプション予想が満了していない期間を表す.配当収益率の推定値は%は、当社の歴史的にはないので、予測可能な未来に普通配当金を支払うつもりもありません。
2021年12月31日にはオプションに関連した未確認報酬支出。
7. 関係者取引
Tiziana は係り先であり,共通制御下にあるためである.当社はTizianaと取締役、上級管理者、大株主を共有しています。Tizianaから子会社を買収したため、br社も設立されており、詳細は付記1と3を参照されたい。
2021年12月31日と2020年12月31日までに$
分割協定が発効した後、会社は共有サービス協定を締結し、ある限られた管理と行政サービスをアウトソーシングした。当社は、費用には、当社のサービス提供にかかる時間に関する賃金コストが含まれており、実際にかかる時間と分配された賃金コストに基づいて算出されていることに注目している。また,会社はコストに応じて何らかのオフィス空間の使用料
を徴収している.これらのサービスの料金は追加されていません。当社は、2021年12月31日までの年度と2020年6月5日から2020年12月31日までの創業期間で約
| F-30 |
2021年12月31日と2020年12月31日に$
8. 所得税
所得税前損失の国内と国外の構成要素は以下の通りである
For the Year Ended December 31, | For the Period from June 5, 2020 (date of inception) to December 31, | |||||||
| 国内では | $ | $ | ||||||
| 外国.外国 | ||||||||
| $ | $ | |||||||
A
所得税準備金と#年法定所得税率の適用により計算された金額との照合
| 12月31日までの年間 | For the Period from June 5, 2020 (成立日)から 十二月三十一日 | |||||||
| 2021 | 2020 | |||||||
| 法定税率の連邦所得税 | % | % | ||||||
| 州税と地方税、連邦福祉を差し引く | % | % | ||||||
| イギリスの収入率の違い | % | % | ||||||
| 評価免税額の変更 | ( | )% | ( | )% | ||||
| % | % | |||||||
2021年12月31日まで及び2020年12月31日まで2020年6月5日(成立日)までに、当社には当期税項はなく、損失及び全額推定手当による繰延所得税の支出や利益も記録されていない。
繰延所得税は、財務報告目的のための資産および負債の帳簿価値と所得税目的のための金額との差額の純税収影響を反映する。次の表は2021年12月31日と2020年12月31日までの会社繰延税金純資産の重要な構成部分を示している。
| 2021年12月31日 | 2020年12月31日 | |||||||
| 純営業損失繰越 | $ | $ | ||||||
| 繰延税金資産合計 | ||||||||
| 減算: 推定免税額 | ( | ) | ( | ) | ||||
| 純繰延税金資産 | $ | $ | ||||||
| F-31 |
2021年12月31日現在、同社の利用可能な純営業損失は$に転換している
国税法第382条によると、所有権変更時には、会社純営業損失繰越の使用が制限される可能性があります。 第382条の完全な分析は作成されておらず、NOLは第382条の制限を受ける可能性がある。
その会社はアメリカ、連邦、州、そしてイギリスで所得税を払わなければならない。各司法管区内の税収法規は関連税収法律法規の解釈を受け、適用するには重大な判断が必要である。設立以来、当社の納税年限はすべての税務機関の審査に開放されています。
9. 引受金とその他の事項
法的訴訟
会社は時々様々なクレーム、訴訟、そして訴訟に参加する。当社は、不利な結果が生じる可能性があり、損失金額が合理的に推定できると判断した場合、特定の法的手続きのための準備金を確立します。経営陣は、不利な結果が発生する可能性があると判断し、および/または可能な損失を推定することができる任意の法的事項を決定していません。
10. 後続事件
新オプション賞を授与する
2022年1月、会社は従業員、コンサルタント、執行取締役会を授与した奨励計画下のオプションは、
会社株を購入する数量です。オプションごとの権利価格は1ドルから1ドルまで様々だ
株式承認証を発行する
2022年1月に会社は令状を取る。
Tizianaの会社への投資
2022年3月31日会社発表2020年10月に作ったドル購入の約束に基づいて、会社株をTiziana生命科学有限会社に売却します
実行指導チームを任命する
2022年3月3日、会社はウェンディ·ブローサー最高経営責任者の任命を発表した。リーダーチームに参加したのは、最高運営官のジェフ·フェンステルとチーフ商務官のJoe·フラナガン。
| F-32 |
普通株式

AccuStem科学社は
予備募集説明書
ThinkEquity
, 2022
2022年(今回の発売日から25日を含む)には、これらの証券を取引するすべての取引業者が、今回の発売に参加するか否かにかかわらず、目論見書の提出を要求される可能性がある。これは,トレーダーが引受業者としての場合と,その売れ残りの配給または引受について目論見書を提出する義務以外の義務である.
第(Br)II部分−目論見に不要な情報
第 項13.発行および発行の他の費用。
次の表に当社が本契約項に登録した証券の発行と流通により対応するコストと費用を示す。米国証券取引委員会登録料を除いて、すべての金額が見積もりとなっている。
| アメリカ証券取引委員会登録料 | $ | 1,144 | ||
| FINRA届出費用 | $ | 2,000 | ||
| ナスダック上市費 | $ | * | ||
| 移籍代行費と登録料 | $ | * | ||
| 印刷と彫刻費 | $ | * | ||
| 会計費用と費用 | $ | * | ||
| 弁護士費と支出 | $ | * | ||
| 雑類 | $ | * | ||
| 合計する | $ | * |
* 修正案で提出
第br項14.役員と上級職員への賠償
“取締役条例”第102節は、会社役員が取締役としての受託責任に違反して会社又はその株主に対して負う個人責任を免除することを許可するが、取締役は忠実な義務に違反し、誠実に行動することができず、故意の不当行為又は故意違法行為に従事し、配当金の支払いを許可する場合又は株式買い戻しを許可することがデラウェア州会社法に違反し、又は不正な個人利益を得ることができない場合を除く。我々が改正し再確認した会社登録証明書の規定は、取締役が取締役の信頼された責任に違反する行為によって、会社又はその株主に対して個人責任を負うことはない。法律条文で取締役がこのような責任を負うべきであることが規定されていない限り、会社取締役会は、取締役が信頼された責任に違反する責任を廃止または制限することを禁止している。
DGCL第145節では、会社は、取締役、会社の高級管理者、従業員または代理人を賠償する権利があり、または会社の請求に応じて、別の会社、共同企業、合弁企業、信託または他の企業の身分サービスである者は、一方であったか、または一方または脅威となり、終了または完了した可能性のある訴訟の一方の訴訟、訴訟または訴訟において実際かつ合理的に招いた費用(弁護士費を含む)、判決、罰金および支払いの和解金額を賠償する権利があると規定されている。いかなる刑事訴訟や法的手続きにおいても,その行為が違法であると信じる合理的な理由はないが,会社が提起したり,会社の権利に基づいて提起された訴訟では,いかなるクレームについても賠償してはならない.その人は、会社に責任がある問題または事項brを判決され、衡平裁判所または他の判決裁判所の裁定に限定されない限り、責任判決が下されたにもかかわらず、事件のすべての状況を考慮して、当該人は、公平かつ合理的に当該裁判所または他の裁判所が適切と思う費用を賠償する権利がある。
登録説明書(目論見書は登録説明書の一部である)が発効する前に発効し、当社の改訂及び再改訂された“会社登録証明書”及び改訂及び再改訂された定款は、DGCLが許容する最大限に当社の役員及び高級社員に保障を提供する。私たちは、彼または彼女が取締役になったか、または同意した役員であるか、または取締役になることに同意した役員であるか、または取締役になることに同意した役員であるか、または取締役であることに応じた役員、パートナー、従業員または受託者、または同様の身分で別の会社、共同企業においてサービスまたは同意サービスを行うため、かつてまたは現在脅威になっている任意の脅威、br未決または完了した訴訟、訴訟または法的手続きのいずれかの当事者に賠償する。合弁企業、信託または他のbr企業(これらのすべての人々は“賠償者”と呼ばれる)、またはこのような身分で取られたまたは漏れたと言われている任意の行動のために、そのような訴訟、訴訟または訴訟に関連する実際および合理的に生じたすべての費用(弁護士費を含む)、判決、罰金、および支払いの金額brについて、もしその補償者が善意に基づいて行動し、私たちの最大の利益に適合または反対しないと合理的に信じている方法で行動する場合、どんな刑事訴訟や訴訟についても、彼や彼女は彼や彼女の行為が不法だと信じる合理的な理由がない。当社の改正·再改訂された会社登録証明書および改正·再改訂された定款は、かつて取締役または高級職員として、または取締役高級職員として、私たちの要請に応じて取締役、高級職員、brパートナーとして同意した任意の当事者、または当方に有利な判決を促進する権利のある損害者を賠償することが規定されます, 別の会社、共同企業、合弁企業、信託会社または他の企業の従業員または受託者、または同様の身分で、またはその身分で取られたまたは取られていないと言われるいかなる行動によって支払われたと言われるすべての費用(弁護士費を含む) と、法律によって許容される範囲内で、和解のために実際かつ合理的に引き起こされる、そのような訴訟、訴訟または法律手続きに関連する金額、およびそのような訴訟、訴訟または法律手続きからの任意の控訴は、賠償者が善意に基づいて行動し、進行中であることを合理的に信じて行動する場合、私たちの最大の利益に反対しないか、または私たちの最大の利益に反対しないが、裁判所がこのような判決があるにもかかわらず、すべての状況を考慮して、彼または彼女がそのような費用の賠償を受ける権利がある限り、その人が私たちに責任があると判決された任意のクレーム、問題または事項について賠償を行ってはならない。上述したように、任意の賠償者が成功した範囲内で、是非曲直にかかわらず、私たちは、彼または彼女が実際かつ合理的に生成したすべてのこれに関連する費用(弁護士費を含む)を賠償する。場合によっては,費用を賠償対象に立て替えなければならない.
| -96- |
今回の発行が完了する前に、私たちの各役員と役員 と単独の賠償協定を締結する予定です。その他の事項を除いて、各賠償協定は、任意およびすべての費用、判決、罰金、罰金、および任意のクレームを解決するために支払われた任意およびすべての費用、判決、罰金、罰金および金額について、法律 および私たちが改正し、再修正した会社登録証明書が許容する最大限に賠償を提供しなければなりません。賠償協定は、被賠償者のすべての費用を立て替えまたは支払うことを規定し、被賠償者がこのような賠償を受ける権利がないことが発見された場合はこちらに精算しなければならない。
また、私たちは、これらの上級社員や役員の身分下での役割または非作為のために上級社員や役員保険に加入しています。
ここに登録された普通株の売却に関連する任意の引受契約では、引受業者は、特定の条件下で私たち、私たちの役員、私たちの上級管理者、および証券法が指す私たちを統制する人のいくつかの責任を賠償することに同意するだろう。
第 項15.近く販売される未登録証券
以下に2019年1月1日以降に販売されているすべての未登録証券の情報を示す。別の説明がない限り、証券法第4(A)(2)又は3(A)(9)条又は証券法第4(A)(2)又は3(A)(9)(Br)条又は証券法第3(B)条に基づいて公布された第701条の規則により、以下の証券の発行 は、発行者が公開発行の取引に関与していないとみなすか、又は規則701に規定される補償に関する利益計画及び契約に基づいて証券法による登録を免除するものとみなす。
2022年3月30日、AccuStem Sciences Inc.(“当社”)はTiziana生命科学有限公司(“Tiziana”) と普通株購入協定(“合意”)を締結し、これによりTizianaは1株2.00ドルの買収価格で当社1,337,970株普通株を買収し、総収益は2,675,940ドルであった。普通株の購入は、Tizianaと当社が2021年10月5日に締結した分割補充協定に適合し、この合意に基づき、Tizianaは普通株上場時に2,000,000株自社普通株株式を購入することに同意する。普通株は改正された“1933年証券法”(以下、“証券法”と略す)に基づいて登録されておらず、証券法の下S規則で規定されている免除に基づいて発行されている。購入プロトコルと普通株の上記の要約は完全ではなく,最終取引文書を参照して全体的に限定されている.購入プロトコル表 は添付ファイル10.1として2022年4月5日に米国証券取引委員会に提出された8-K表報告に添付されています。
会社はAccuStem Sciences Limitedの後続発行者であり,AccuStem Sciences Limitedはイングランドとウェールズに登録設立された公共有限会社(“Old AccuStem”)である。この相続は、英国裁判所が承認した手配案(“手配案”)が2021年12月1日(“発効時期”)の発効後に発生したもので、(I)旧AccuStem普通株20株(“旧AccuStem普通株”)ごとに普通株を交換し、1株当たり額面0.001ドルである。および(Ii)AccuStem米国預託証券(“米国預託株式”)10株ごとに旧AccuStem普通株2株を代表して1株会社普通株を交換し、当社を旧AccuStemの持ち株会社とした。手配計画については、発効時期に、証券法第3(A)(10)条免除により登録された取引中の全発行株式と引き換えに、合計9,999,132株の会社普通株を発行した。これらの 株は現金を支払っていません。
プロジェクト 16.証拠物と財務諸表の添付表
(a) 展示品です以下の展示品はここに含まれていますか、または引用によってここに統合されています
| 1.1 | 引受契約の書式 |
| 3.1 | AccuStem Science Inc.社登録証明書の改訂と再署名(添付ファイル3.1を参照して2021年12月3日に提出されたForm 8-Kへの統合) |
| 3.2* | AccuStem Science Inc.改正および再登録された登録証明書修正案 |
| 3.3 | AccuStem Science Inc.の規約(添付ファイル3.2を引用して2021年12月2日に提出されたForm 8-Kに統合) |
| -97- |
| 4.1 | 普通株の書式 |
| 4.2 | Tiziana Life Sciences PLCとAccuStem Sciences Limitedが2020年10月5日に署名した分割協定(統合内容は添付ファイル4.3からForm 20-Fを参照し、2021年3月12日に提出) |
| 4.3 | Tiziana Life Science PLCとAccuStem Sciences Limitedが2020年10月30日に署名した補足分割協定(添付ファイル4.4を参照して2021年3月12日に提出されたForm 20-Fに統合することにより) |
| 5.1 * | シェパード、ムリン、リヒト、ハンプトン法律事務所の意見 |
| 10.1 | TTFactor SrlとFondazione FIRCの間で2014年6月24日に署名されたライセンス契約(添付ファイル4.5を参照して2021年5月7日に提出されたForm 20-Fに統合) |
| 10.2 | 賠償協議表(添付ファイル10.1~2021年12月3日に提出された8−K表参照) |
| 10.3 | AccuStem Sciences Inc.2021年総合持分インセンティブ計画(添付ファイル10.2を参照して2021年12月3日に提出された8-K表に統合) |
| 10.4 | Accustem Sciences Ltd.とTiziana Life Science plc間の共有サービスプロトコルは,2021年1月1日である。 |
| 10.5 | Accustein Sciences,Inc.とWendy Blosserの間の招待状日は2022年2月18日である. |
| 10.6 | Accustem Science,Inc.とジェフ·フェンステルが2021年11月25日に出した招待状 |
| 10.7 | Accustem Science,Inc.とJoe·フラナガンが2021年12月6日に出した招待状 |
| 10.8 | Keeren ShahとAccustem Science,Inc.は2021年3月21日に署名したコンサルティング協定である。 |
| 10.9 | 2022年1月1日Gabriele CerroneとAccustem Science,Inc.の間のコンサルティングプロトコル。 |
| 10.10 | AccuStem Sciences,Inc.,Istituto Europe o di Oncolgia SrlとUniversity degli Studi di Milanoの間のライセンスプロトコル第1修正案は,2022年11月9日である. |
| 10.11 | Keeren ShahとAccustem Science,Inc.は2021年7月22日に署名したコンサルティング協定修正案である。 |
| 21.1 | 子会社リスト(添付ファイル8.1~2021年5月7日提出の20-F表合併参照) |
| 23.1 | マーゼ法律事務所は同意しました |
| 23.2* | シェパード、ムリン、リヒートとハンプトン法律事務所の同意書 (添付ファイル5.1参照) |
| 24.1 | 授権書(署名ページに含まれる) |
| 107 | 届出費用表 |
* は改訂方式で提出されます。
# S-K条例第601(B)(2)項により、付表および証拠品は省略されています。PalTalk,Inc.米国証券取引委員会の要求に応じて、漏れたスケジュールおよび証拠品の補足コピーを提供することを約束します。
契約または補償計画スケジュールを管理します。
| -98- |
第 項17.承諾
(A) 以下に署名された登録者は、ここで約束した:
(1) 要約や売却を提出している任意の期間,本登録宣言に対して発効後の修正:
(I) 証券法第10(A)(3)節に要求される任意の目論見書;
(Ii) 登録説明書の有効日(または最近発効された改訂)の後に発生した、個別に、または全体的に、登録説明書に記載されている情報が根本的に変化することを表す任意の事実またはイベント を入札説明書に反映させる。上記の規定にもかかわらず、証券発行量の増加または減少(発行証券の総ドル価値が登録証券を超えない場合)、および推定最高発売範囲のローエンドまたはハイエンドからのいかなる逸脱も、取引量と価格の変化の合計が有効登録説明書“登録費用の計算”表に規定された最高発行価格の20%を超えないことを前提として、第424(B)条に基づいて委員会に提出された目論見書に反映されることができる
(3) 登録説明に以前開示されていなかった割当て計画に関する任意の重大な情報に登録するか、または が登録説明においてそのような情報を実質的に変更する;
(2) 証券法に規定されている任意の責任を決定するために、各発効後の改正は、その中で提供される証券に関する新たな登録声明とみなされ、その際に発行されたこのような証券は 初期とみなされるべきである善意のその供え物です。
(3) 修正案を事後発効させることで,発行終了時にまだ販売されていない登録中の証券を登録から削除する.
(4) 証券法に基づいて任意の買い手に対する責任を決定するために、ルール424(B) に基づいて発売に関する登録声明の一部として提出された各入札説明書は、ルール430 Bに基づいて提出された登録宣言またはルール430 Aに基づいて提出された入札説明書を除いて、登録声明の一部とみなされ、発効後初めて使用された日から に計上されるべきである。しかしながら、登録声明または募集説明書が登録宣言の一部であるか、または登録声明または目論見書において参照的に組み込まれているか、または登録声明または目論見書に組み込まれた文書になされた宣言が登録声明または目論見書の一部である場合、最初の使用前に販売契約を締結した買い手にとっては、登録声明または募集説明書において行われた最初の使用日の直前に登録声明または募集説明書の一部として、またはそのような文書に記載された任意の声明を置換または修正することはない。
(5) 1933年“証券法”による証券初回流通における任意の買い手に対する任意の責任を決定するために、以下に署名された登録者は、本登録声明に基づいて以下に署名した登録者に証券を提供する一次発売において、買い手への証券売却の引受方式にかかわらず、証券が次のいずれかの通信方式で買い手に提供または販売されている場合、以下に署名した登録者は買い手の売り手であり、買い手にそのような証券を提供または売却するとみなされる
(1) 規則424に従って提出しなければならない要約に関連する任意の予備募集説明書または以下に署名する登録者の募集説明書;
(Ii) 以下に署名された登録者またはその代表によって作成された、または署名された登録者によって使用または言及された発売に関連する任意の無料書面募集説明書
(Iii) 以下に署名された登録者に関する重要な情報または以下に署名された登録者またはその代表によって提供される私たちの証券を含む他の任意の無料で書かれた目論見書の発売に関連する部分;
(Iv) 以下に署名した登録者が買手に提出した要約中の任意の他の通知.
(B) 証券法の規定によると、登録者の役員、上級管理者、制御者は、上記条項又はその他の規定により賠償を受けることができるが、登録者は、証券及び取引委員会が、このような賠償が証券法に規定する公共政策に違反していると考えているため、強制的に実行することができないと通知されている。登録者の弁護士が前例をコントロールすることによって解決されたと思わない限り、登録者、上級職員または制御者が登録されている証券について賠償要求を提出し、賠償を要求する責任(登録者がいかなる訴訟、訴訟または法的手続きに成功して招いたり、支払う費用を除く)に成功した場合、適切な管轄権を持つ裁判所に, 当該裁判所のこのような賠償がその法案が表現した公共政策に違反しているかどうか,その問題の最終裁決に準ずるかどうかを質問する.
| -99- |
サイン
改正された1933年証券法の要求によると、登録者は2022年11月17日にニューヨーク州ニューヨーク市で以下の署名者が登録者を代表して本S-1表登録声明 に署名することを正式に許可した。
| ACCUSTEM Science,Inc. | ||
| 差出人: | /s/ ウェンディ·ブロディ | |
| ウェンディ·ブロサー | ||
| CEOと役員(最高経営責任者) | ||
授権書
以下に署名されたAccuStem Sciences,Inc.の各上級管理者および取締役は、ここで構成され、Wendy BlosserおよびKeeren Shahを任命することができ、 彼らのいずれかは、他の人、個人の真実および合法的な事実弁護士および代理人なしに行動することができ、すべての人は、その名前、場所およびエージェントの完全な代替および再置換を任意のおよびすべての身分で行う権利があり、br}署名AccuStem Sciences,Inc.のS-1表登録声明および同一製品に関連する任意の他の登録声明(任意の登録声明、任意の登録声明、Inc.のS-1表登録声明を含む)又はその修正案は、1933年の証券法規則462(B)(br})及びその任意及びすべての修正案(登録声明の発効後の修正案を含む)が提出された後に発効され、すべての証拠物及びこれに関連するすべての他の書類と共に証券取引委員会に提出され、上記事実代理人及び代理人並びにそれら1人当たりの 及びこれに関連するすべての必要かつ必要な行為及び事項の全ての権限及び許可を付与される。すべての上述した事実弁護士および代理人またはそれらのうちのいずれか、またはそれらの代替者またはbrまたは代替者を承認および確認するために、彼または彼女自身が可能であるか、または行うことができるすべての意図および目的のために、本合意による行動を合法的に行うことができるか、または結果として生じることができる。
改正された“1933年証券法”の要求に基づき、本登録声明は、指定された日に以下の者が所持する身分で署名された。
| サイン | タイトル | 日取り | ||
| /s/ ウェンディ·ブロディ | ||||
| ウェンディ·ブロサー | 最高経営責任者兼取締役 | 2022年11月17日 | ||
| (CEO ) | ||||
/s/ Keeren Shah |
||||
| Keeren Shah | 最高財務官 | 2022年11月17日 | ||
| (担当者 財務官) | ||||
| /s/ ガブリエル·チェロン | ||||
| ガブリエルチェロン | 役員.取締役 | 2022年11月17日 | ||
| /s/ ウィリー·サイモン | ||||
| ウィリー·サイモン | 役員.取締役 | 2022年11月17日 | ||
| /s/ John Brancaccio | ||||
| ジョン·ブランカシオ | 役員.取締役 | 2022年11月17日 | ||
/s/ Sean McDonald |
||||
| ショーン·マクドナ | 役員.取締役 |
November 17, 2022 |
| -100- |