
2022年9月12日臨床と企業の最新状況

2展望的陳述本プレゼンテーションのいくつかの陳述は、1995年の“個人証券訴訟改革法”によって指摘された前向き陳述に属する。これらの陳述は、“予想”、“信じる”、“予測”、“推定”および“意図”または我々の予想、戦略、計画または意図に関連する他の同様の用語または表現を使用することによって識別することができる。このような展望的な陳述は私たちの現在の予想に基づいており、実際の結果は大きく異なるかもしれない。多くの要素が実際の事件をこのような前向きな陳述によって示された状況と大きく異なることをもたらす可能性がある。これらの要素は、これらに限定されない:追加資金の需要;私たちの持続的な経営能力;臨床試験は長く高価なプロセスに関連し、結果は不確定であり、早期研究および試験の結果は将来の試験結果を予測できない可能性がある;私たちの臨床試験は、予期しない副作用または他の安全リスクのために一時停止または停止する可能性があり、これらのリスクは、候補製品の承認を阻止する可能性があり、私たちの臨床試験は、開始または登録において試験読み取りに影響を与えるコストおよび時間の遅延に遭遇する可能性がある。展望性表現は、新冠肺炎コロナウイルスの爆発が私たちの財務状況を深刻に損害し、私たちのコスト支出を増加させる可能性があること、政府または第三者支払者の支払いの不確実性、キーパーソンへの依存、マーケティングと販売経験の限られたこと、激しい競争、特許保護と訴訟の不確実性、第三者への依存、規制リスク、およびFDAの許可または承認を得られなかったこと、およびFDAの規制を遵守しないことによるリスクを含む業務中断に関連するリスクを含む。私たちのどんな技術や製品も利用されたり、商業的な成功であることが証明される保証はありません。また…, 将来の臨床試験の完成や成功は保証されず,いかなる正確な薬物療法のいかなる適応も規制部門の承認を得ることが保証されない,あるいは商業的成功であることが証明されている。投資家は、2021年12月31日までの10-K表に記載されているリスク要因と、米国証券取引委員会に提出された他の定期報告書とを読まなければならない。ここで提案された要素リストは代表的であると考えられるが、このようなリストは、すべての潜在的リスクおよび不確定要素の完全な陳述とみなされるべきではない。リストに入っていない要素は展望性陳述の実現にもっと多くの重大な障害を構成するかもしれない。本明細書に含まれる前向きな陳述は、本明細書の発表日までに行われ、後続のイベントまたは状況を反映するために、そのような陳述を公開更新する義務を負わない。
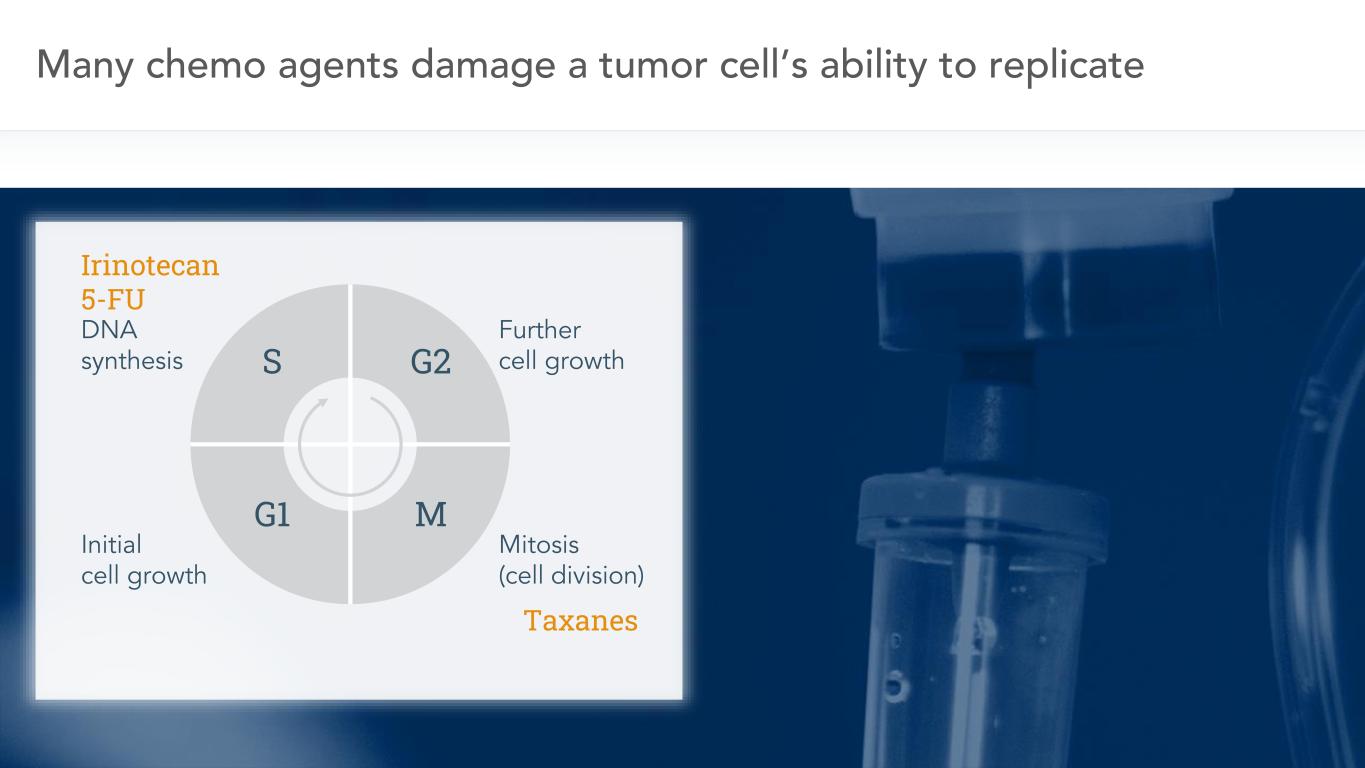
3多くの化学療法薬は腫瘍細胞のDNA合成を複製する能力を破壊し、初期細胞成長はさらに細胞成長有糸分裂(細胞分裂)

4つの癌がすくすくと成長しているのはDNA複製と細胞分裂を優先しているからです
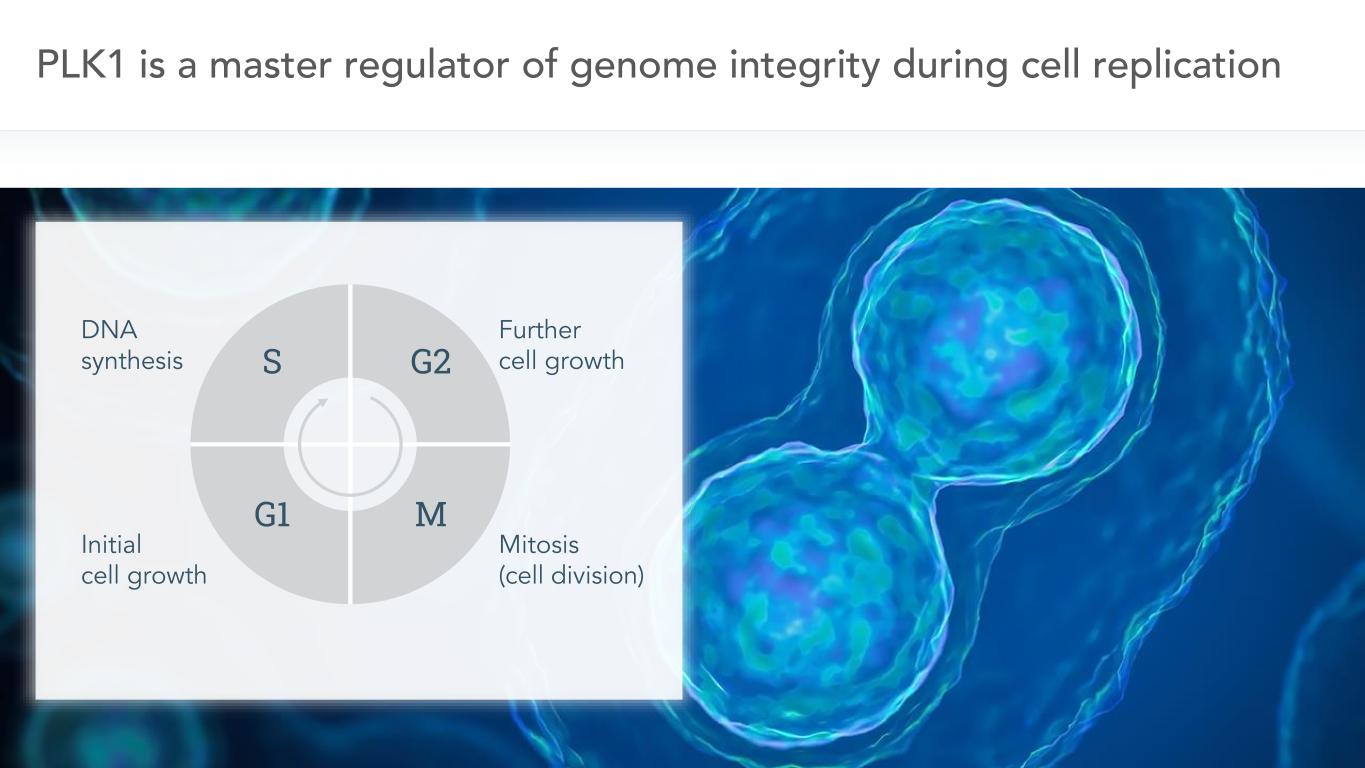
5 PLK 1は細胞複製過程におけるゲノム完全性の主要な調節者DNA合成初期細胞成長さらに細胞成長有糸分裂(細胞分裂)S G 2 G 1 Mである
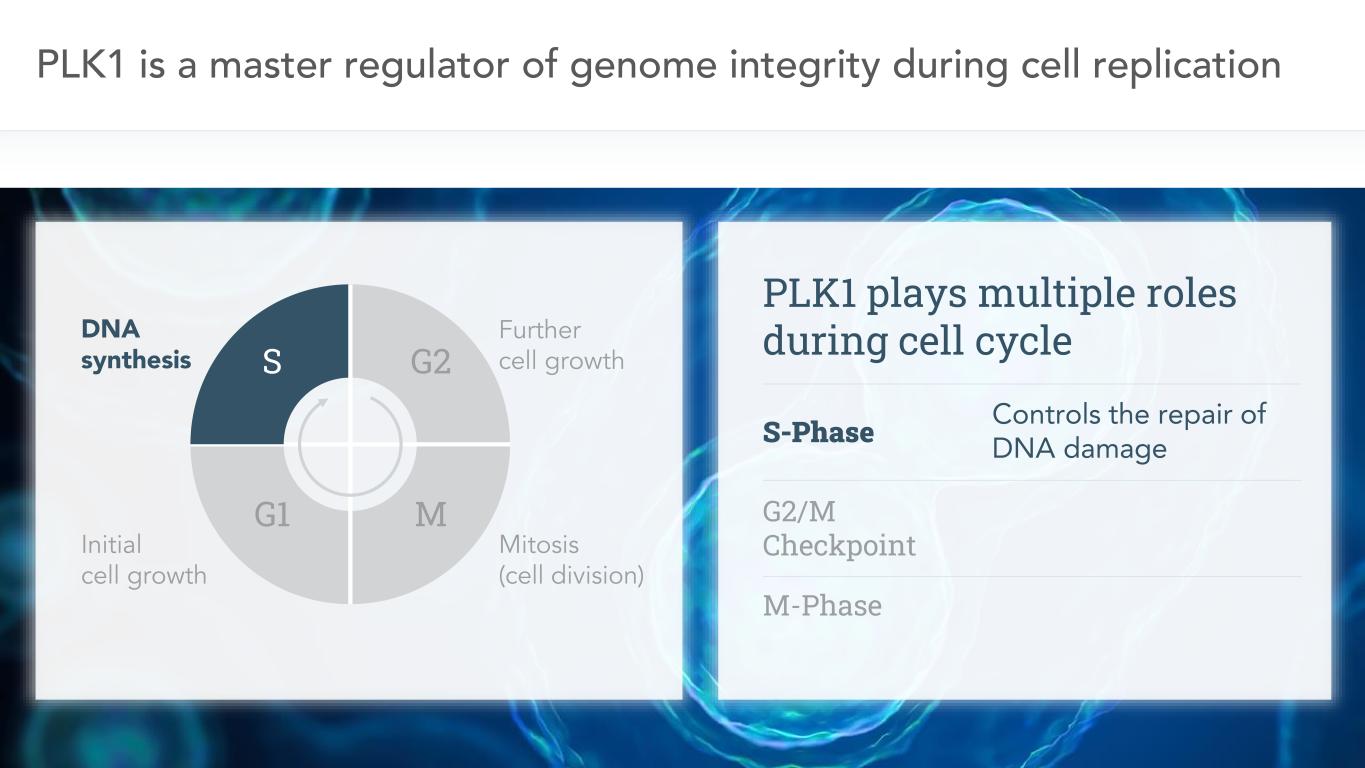
6 PLK 1は細胞複製、DNA合成、初期細胞成長、細胞の更なる成長、有糸分裂(細胞分裂)過程におけるゲノム完全性の主要な調節者である。G 2、G 1、M、S、PLK 1は細胞周期において多重作用を発揮し、S期はDNA損傷の修復を制御し、G 2/M期検査点M期
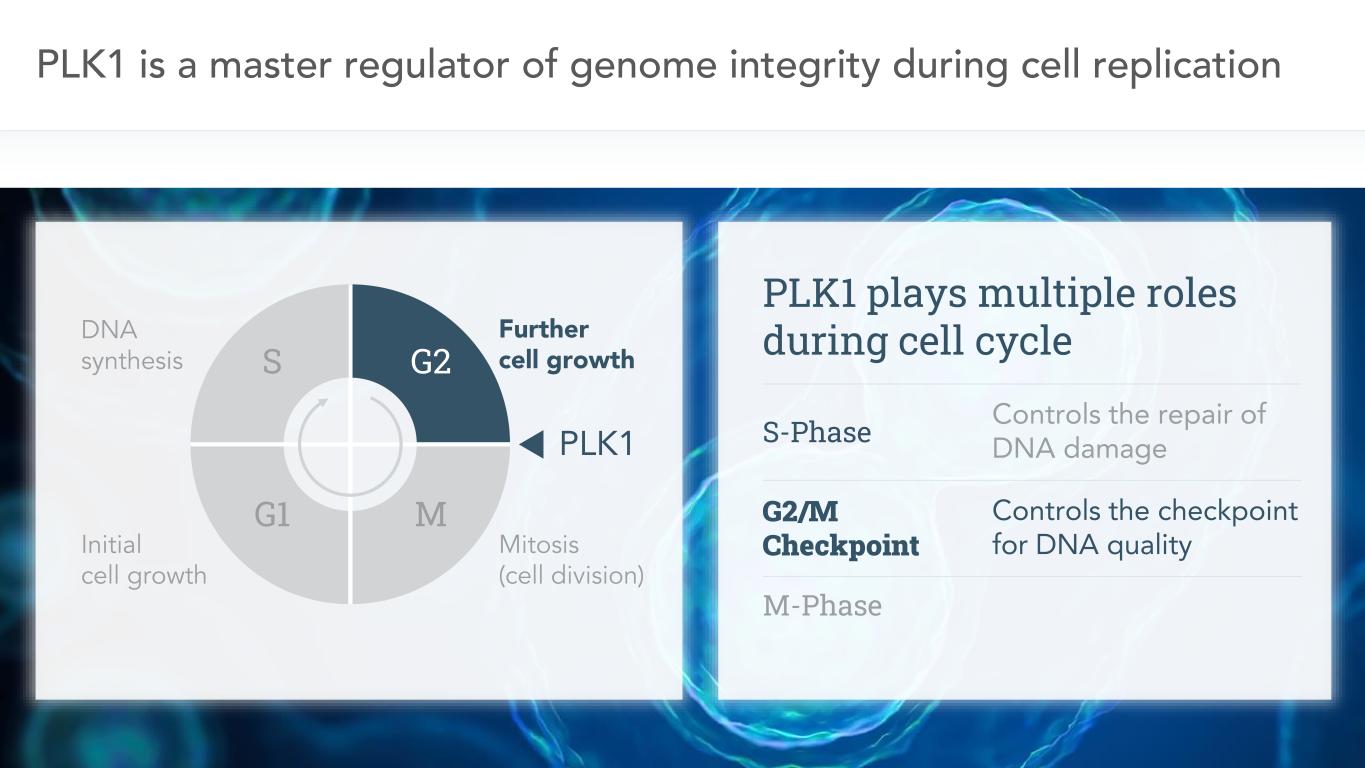
7 PLK 1は細胞複製、DNA合成、初期細胞成長、細胞の更なる成長、有糸分裂(細胞分裂)過程におけるゲノム完全性の主要な調節者である。細胞周期において、PLK 1は多重作用を発揮し、DNA損傷の修復を制御する;G 2/M検査点はDNA品質の検査点を制御する;M期

8、PLK 1は細胞複製、DNA合成、細胞初期成長、細胞の更なる成長、有糸分裂(細胞分裂)過程中のゲノム完全性の主要な調節者である。G 2、G 1、S、M、PLK 1は細胞周期において多重作用を発揮し、DNA損傷の修復を制御し、G 2/M検査点はDNA品質の検査点を制御し、M期は染色体の分離を制御する
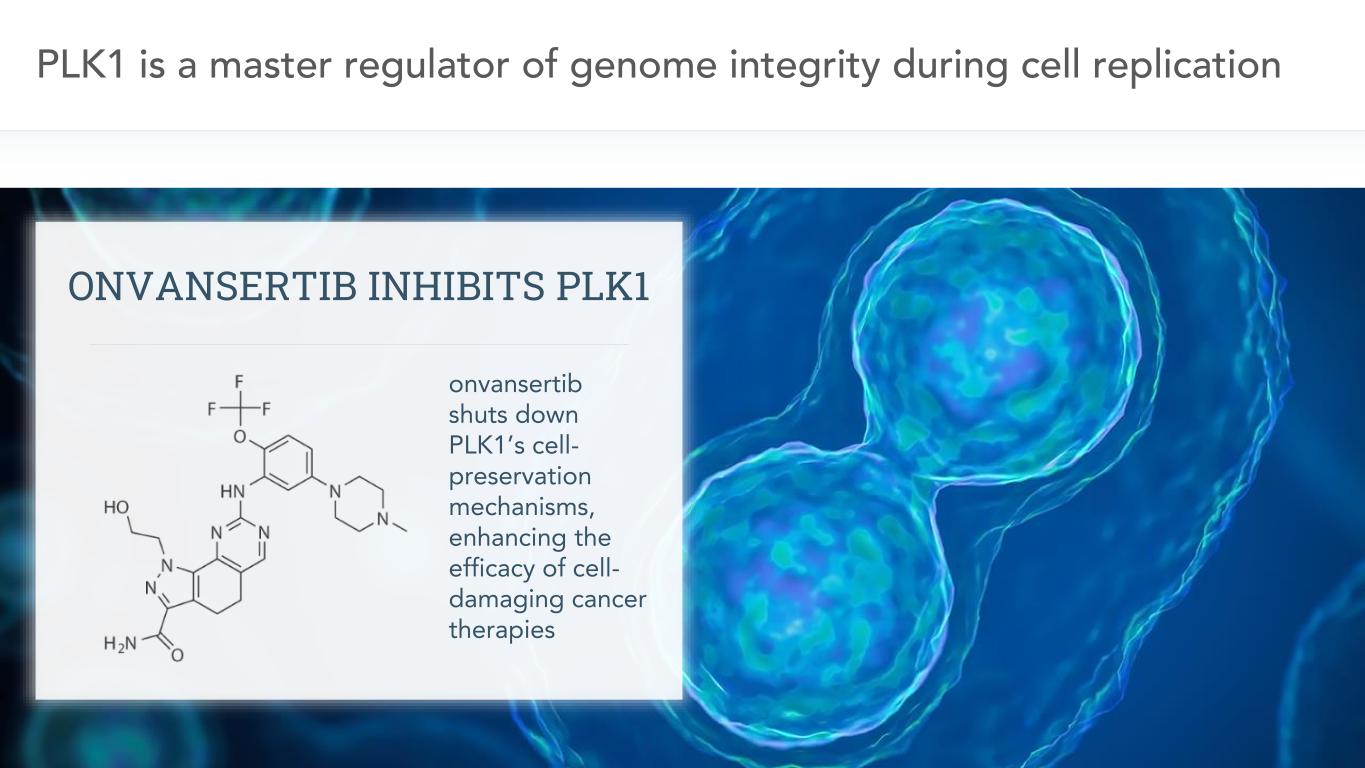
9細胞複製過程において、PLK 1はゲノム完全性の主要な調節者であり、VansertibはPLK 1の細胞保存機序を閉鎖し、細胞破壊性癌治療の治療効果を増強する

10 Onvansertib局在カーディフ腫瘍学的に有効な標的PLK 1·小分子·経口投与·24時間半減酵素IC 50(ミクロン)PLK 1 0.002 PLK 2>10.000 PLK 3>10.000 CK 2 0.400 Flt 3 0.400 CDK 1/CycB>10.000 42他のキナーゼおよび>10.000マイクロプレート>10.000 PLK 1に特異的

11 2つの目標推進我々の最近の臨床開発計画1無作為試験による以前のmCRCデータの検証2付加適応を示す臨床POC 2022 2023 2024第1四半期第2四半期第3四半期第4四半期の目標
12今日私たちはどこにいるのか、私たちはどこで私たちのmCRC計画の追加的なonvansertib計画の予備実験を加速します:ステップ1 b/2次の実験

13今日、私たちは私たちの位置を見て、私たちのmCRC計画の追加的な治療膵臓癌(MPDAC)三陰性乳癌(TNBC)小細胞肺癌(SCLC)前立腺癌(MCRPC)をどこに加速させるかを見ます

14予備試験:1 b/2段階次の試験は、mCRC計画の追加的なonvansertib計画を加速します
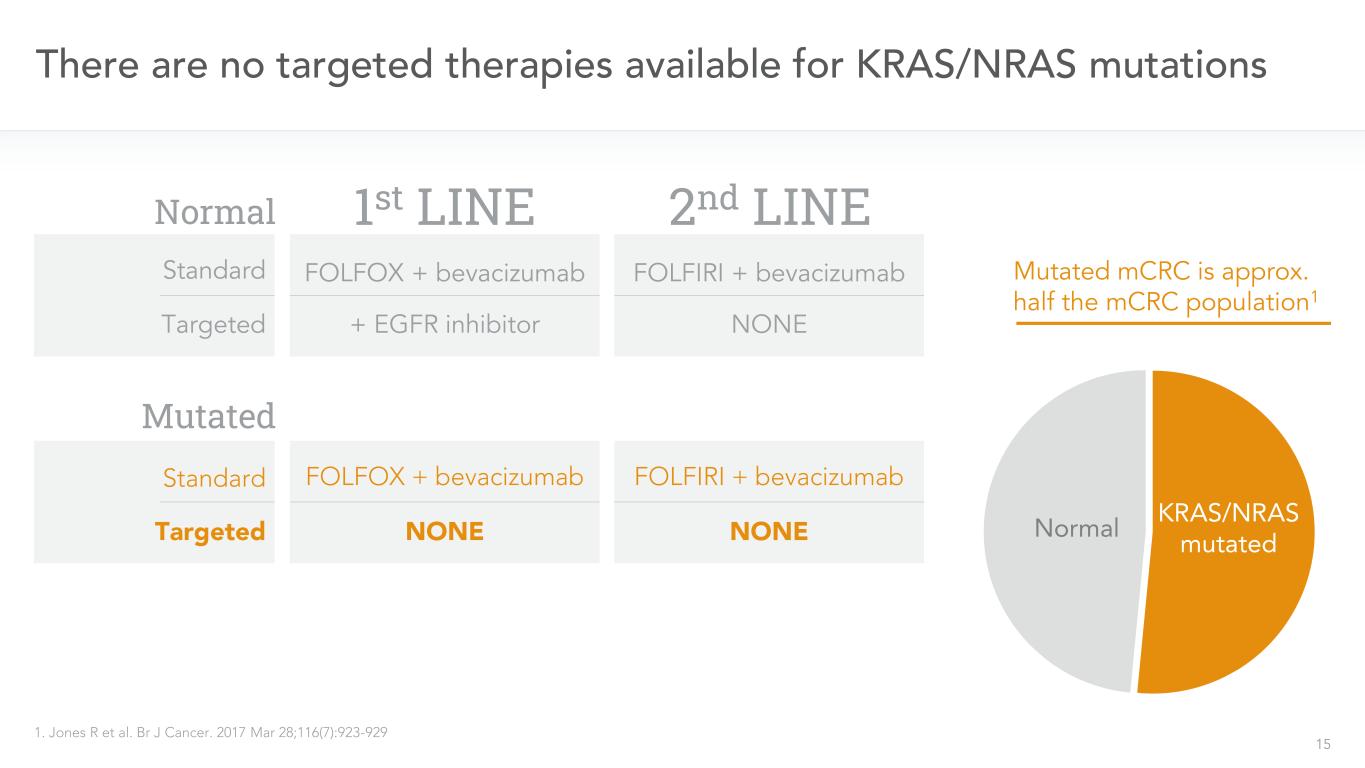
15 KRAS/NRAS変異に対する標的治療なし1.Jones Rら。BR J癌。2017年3月28日;116(7):923-929一線二線標的FOLFIRI+ベバシズマブFOLFOX+ベバシズマブFOLFOX+ベバシズマブ+EGFR阻害剤KRAS/NRAS変異正常無標準標的FOLFOX+ベバシズマブFOLFIRI+ベバシズマブ無突然変異mCRCは約MCRC人口の半分1

16二線mCRC患者の予後は悪い*Bennounaら,“柳葉刀”2013;14:29−37;Giessenら,“腫瘍学報”,2015,54:187−193;Cremoliniら,“柳葉刀”2020,21:497−507;Antoniottiら,“通信柳葉刀”,2020年6月。MCRC:転移性結腸直腸癌二線FOLFIRI+ベバシズマブ過去OOR 5%11.4%13%2006-2008 2000-2013-2015-2017*一線正常変異標準標的FOLFOX+ベバシズマブ+EGFR阻害剤標準標的非FOLFOX+ベバシズマブFOLFIRI+ベバシズマブ標的
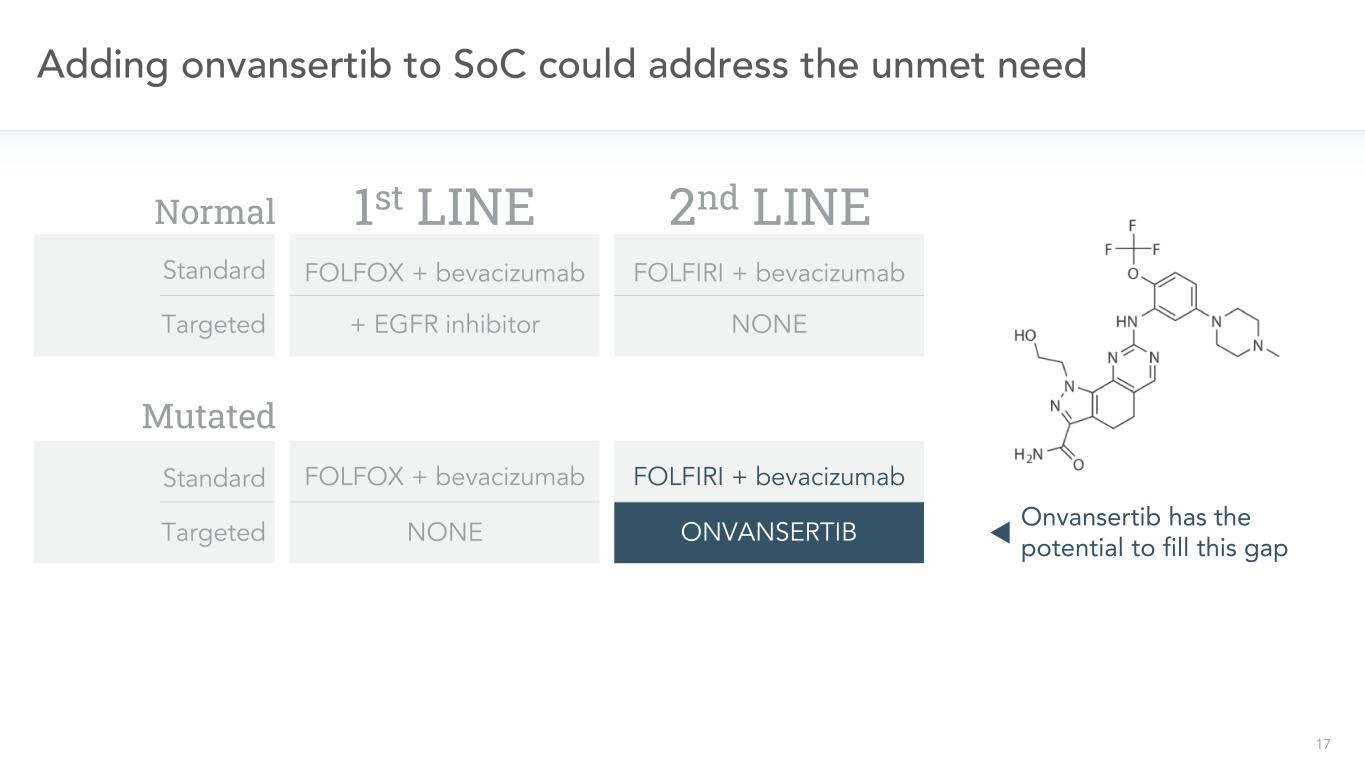
17 SoCへのonvansertibの添加は、未満足の需要を解決することができ、二線FOLFIRI+ベバシズマブ非FOLFIRI+ベバシズマブ一線標的FOLFOX+ベバシズマブ+EGFR阻害剤標準標的FOLFOX+ベバシズマブOnvansertibを標的とすることは、この空白を埋める可能性を有する
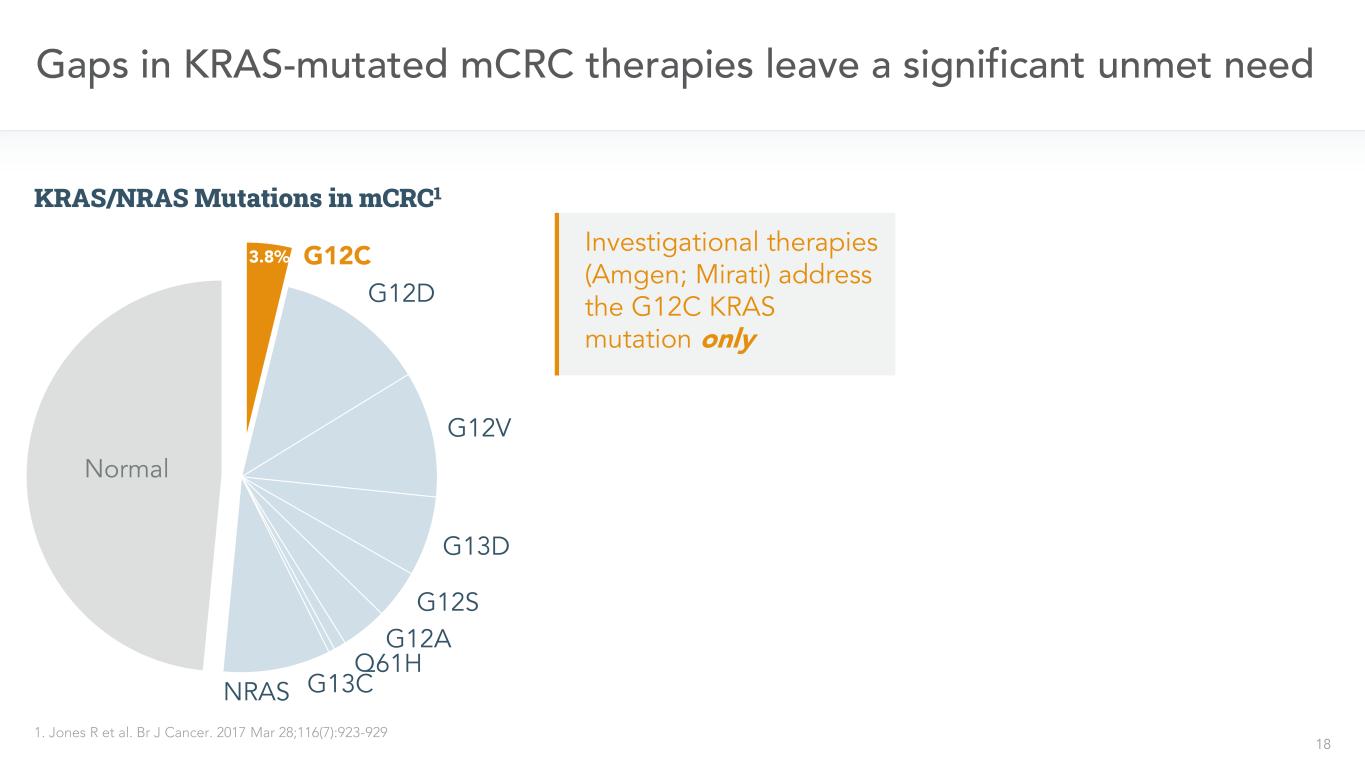
18 G 12 C G 12 D G 12 V G 13 D G 12 S G 12 A Q 61 H G 13 CNRAS KRAS変異mCRC治療における正常なノッチは、満たされていない有意な需要1を残している。BR J癌。2017年3月28日;116(7):923-929 3.8%研究療法(安進;ミラティ)mCRC 1中のG 12 C KRAS変異とKRAS/NRAS変異のみ
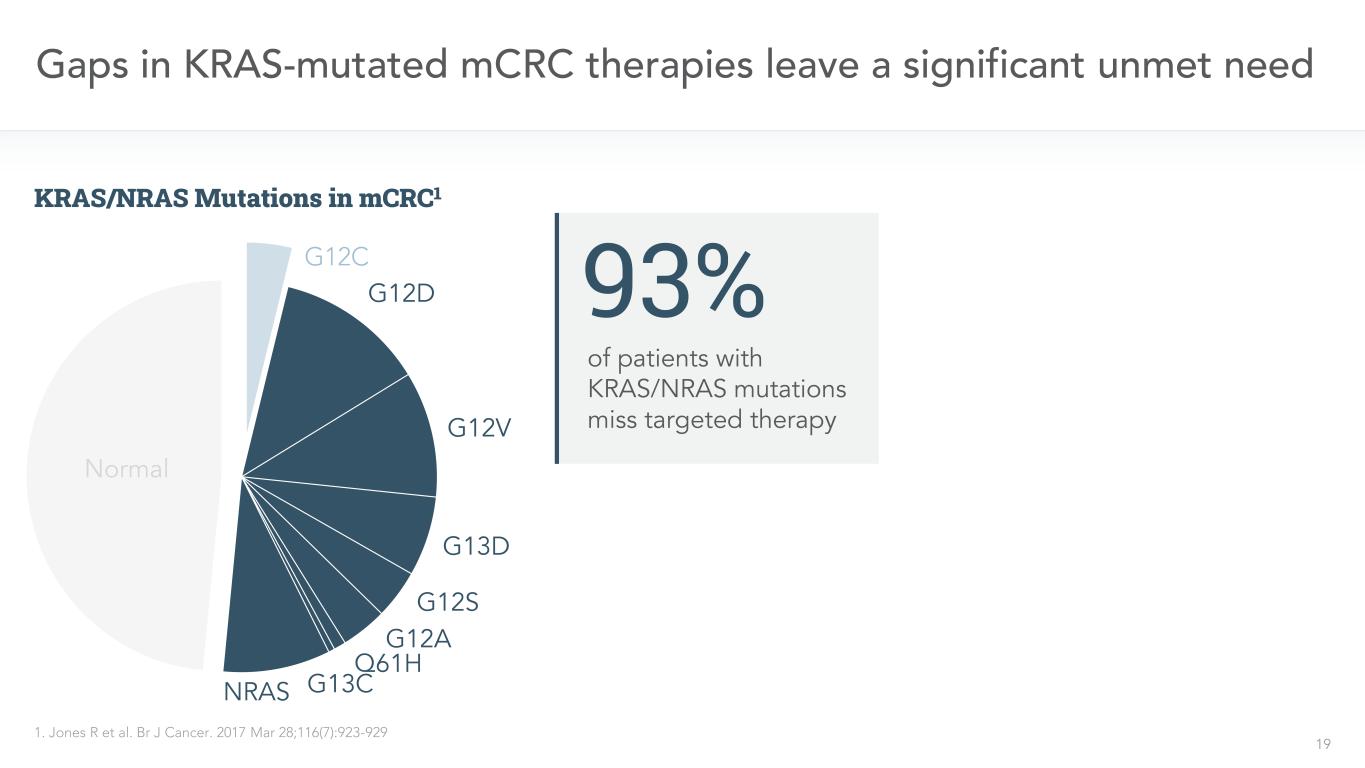
KRAS突然変異のmCRC治療中の19個の欠損は1つの重大な満たされていない需要1を残した。BR J癌。2017年3月28日;116(7):923-929例のKRAS/NRAS変異患者は予想される標的治療93%G 12 C G 12 D G 12 V G 12 D G 12 S G 12 A Q 61 H G 13 CNRAS正常mCRC 1中のKRAS/NRAS変異に達しなかった
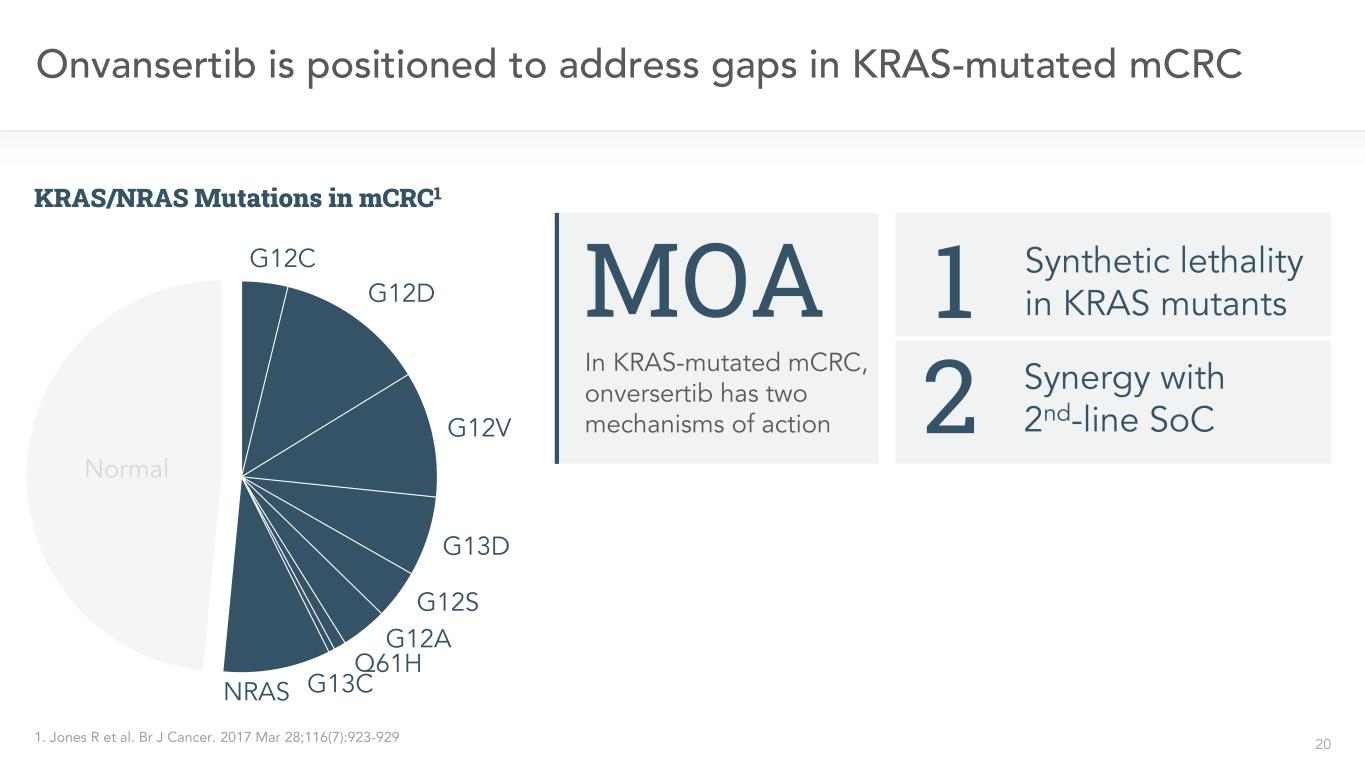
20 Onvansertibは、KRAS変異を解決するmCRCにおけるKRAS変異のmCRC MOAの空白に位置し、onversertibは2つの作用機序1を有する。BR J癌。2017年3月28日;116(7):923-929と二線SOC 2の協同作用KRAS変異体1 G 12 C G 12 D G 12 V G 13 D G 12 A Q 61 H G 13 CNRAS正常なKRAS/NRAS変異
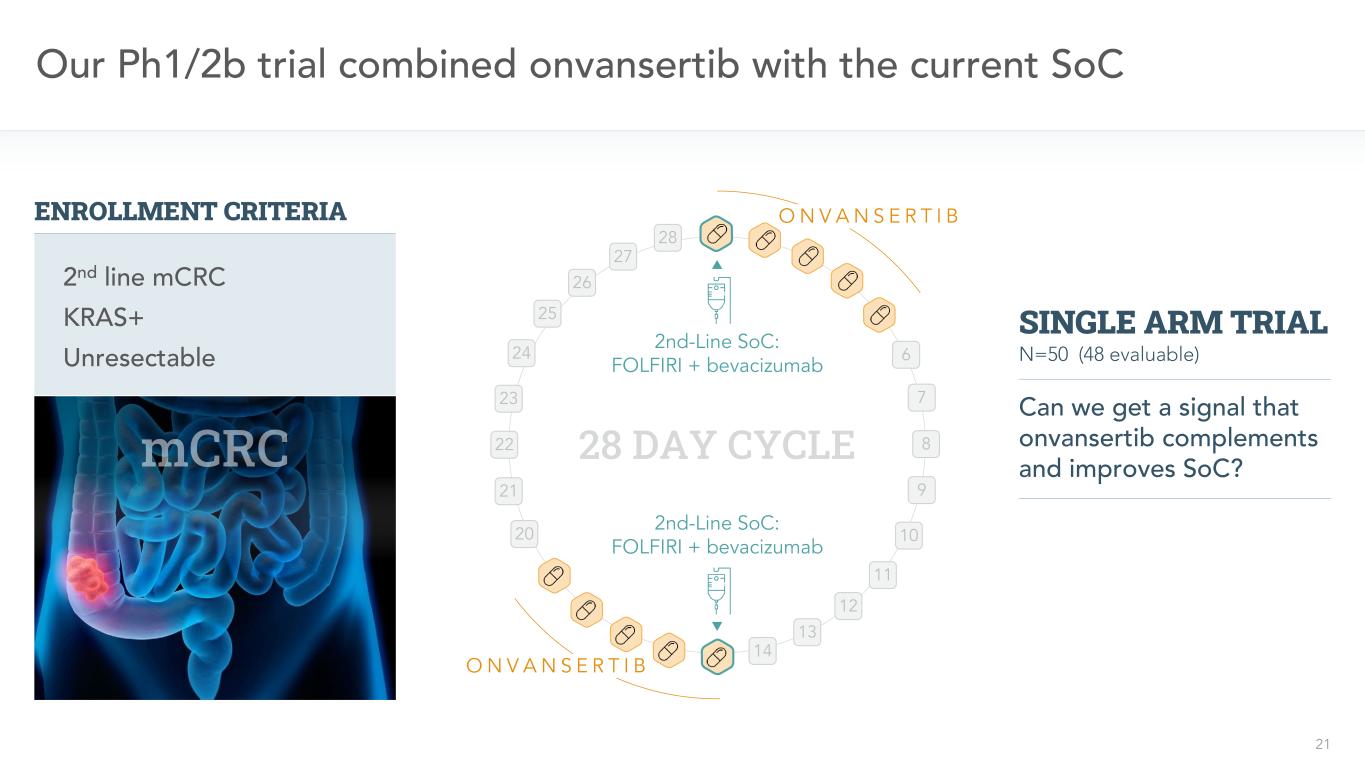
21二線SoC:FOLFIRI+ベバシズマブ二線SoC:FOLFIRI+ベバシズマブ28日間我々のPH 1/2 b試験onvansertibと現在のSoC 6 7 8 9 11 11 13 13 14 21 22 22 23 24 25 26 27 28 ONVANSRTIB ONVNSR TB KRAS+切除不可能な二線mCRC登録基準N=50(48評価可能)私たちはonvansertib補充とSoCを改善する信号を得ることができますか?片腕試験

22二線SoC:FOLFIRI+ベバシズマブ二線SoC:FOLFIRI+ベバシズマブ28日周期6 7 8 9 10 11 12 13 14 21 22 23 24 25 26 26 27 28 ONVANS I B O VNSRIB KRAS+切除不可能な二線mCRC登録基準N=50(48評価可能)onvansertibがSoCを補完し改善したことを示す信号を得ることができますか?単一腕試験著者らのPH 1/2 b試験は安全性、有効性と応答バイオマーカーの治療効果の終点を評価した:主に≧1周期治療を受けた患者のRECIST V 1.1の客観応答率(OOR)1次級:無進展生存期間(PFS)と応答持続時間(DOR)2探索性:KRAS突然変異負担の減少と治療に対する応答3 22
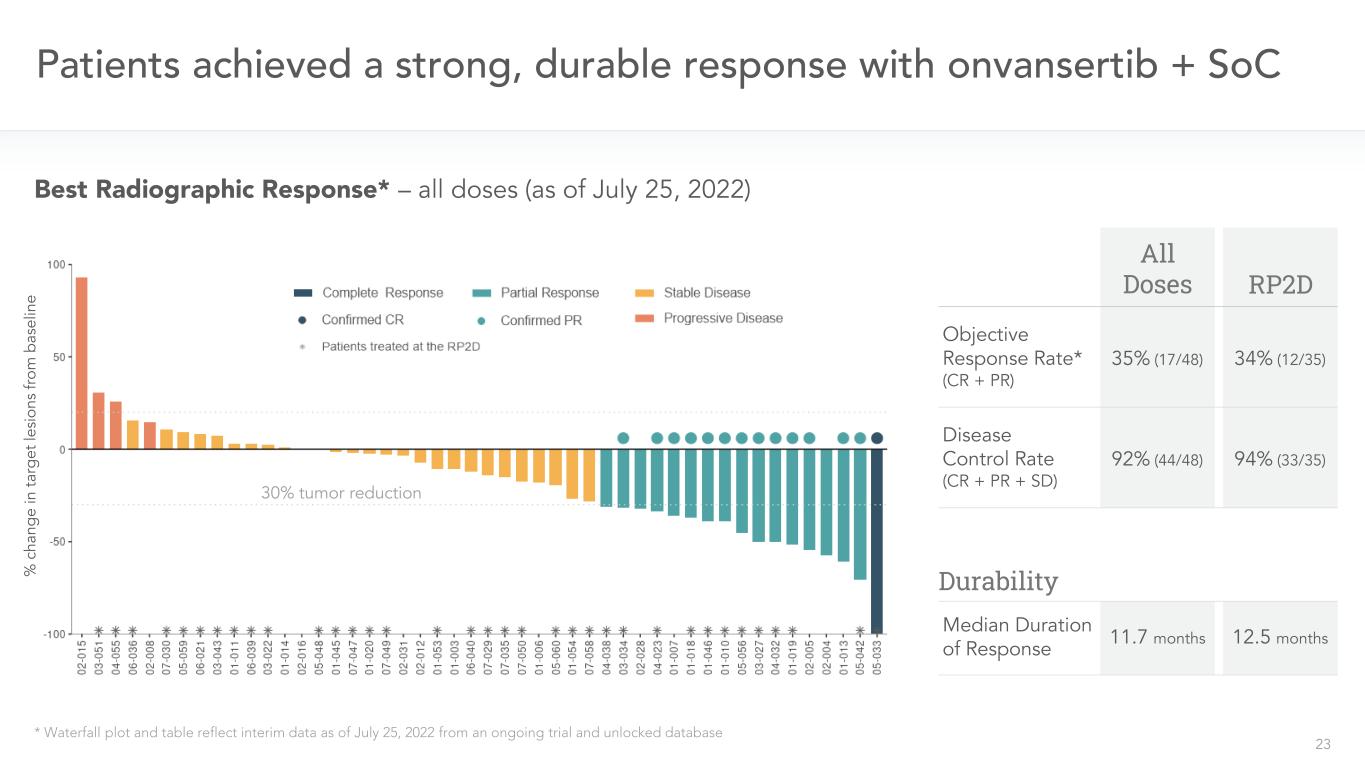
23人の患者がonvansertib+SoC*図面および表を使用して、2022年7月25日までに行われている試験の中期データおよびアンロックデータベースの最適放射反応*-すべての用量を反映している(7月25日現在、2022年)すべての用量のRP 2 D目標緩解率*(CR+PR)34%(12/35)35%(17/48)疾患コントロール率(CR+PR+SD)92%(44/48)中位緩解期12.5カ月11.7カ月94%(33/35)腫瘍耐性30%減少
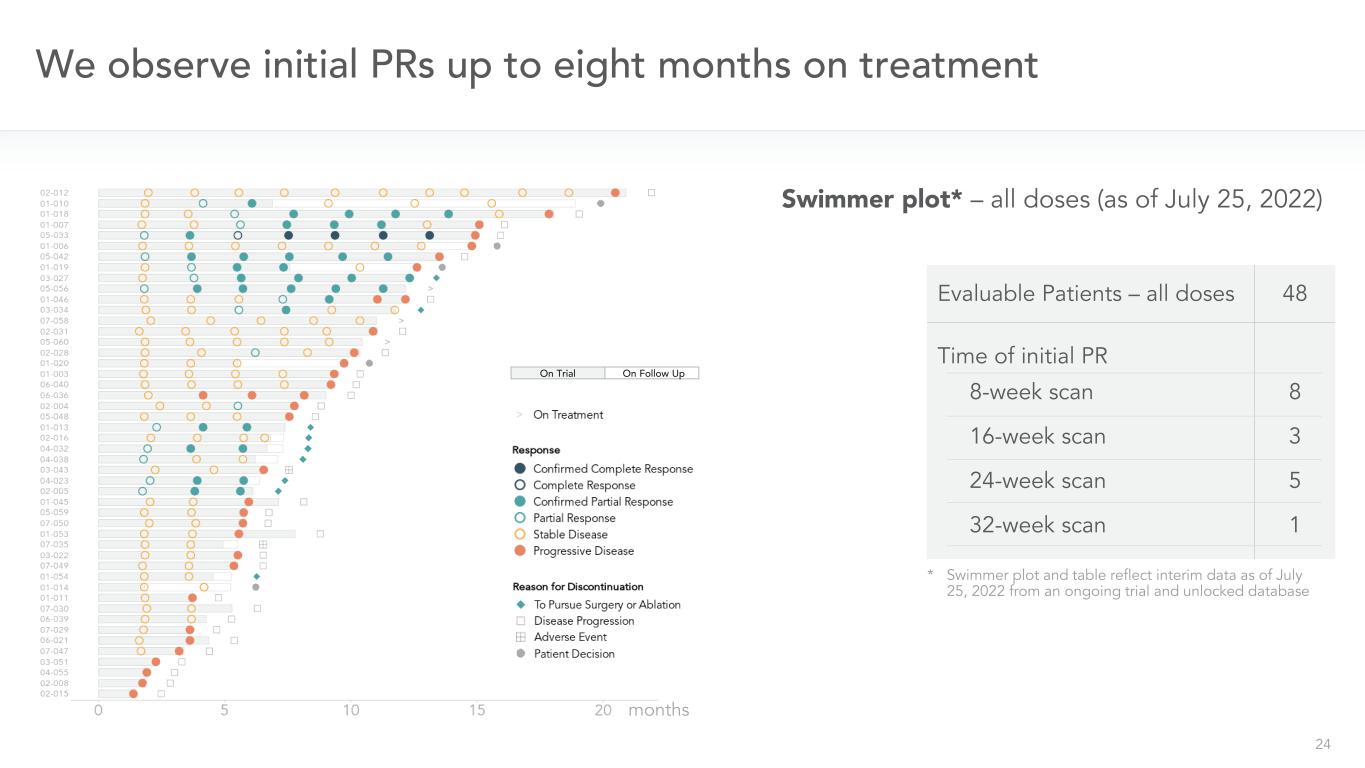
24我々は治療中に8ヶ月に及ぶ初期PRを観察した*水泳者グラフおよび表は、2022年7月25日までの中間データを反映しており、実施中の試験およびロックされていないデータベースから患者を評価することができる-すべての用量48回の初期PR 8週スキャン16週スキャン24週スキャン32週スキャン8 3 5 1スイマーグラフ*-すべての用量(2022年7月25日現在)のフォローアップ月で試験した
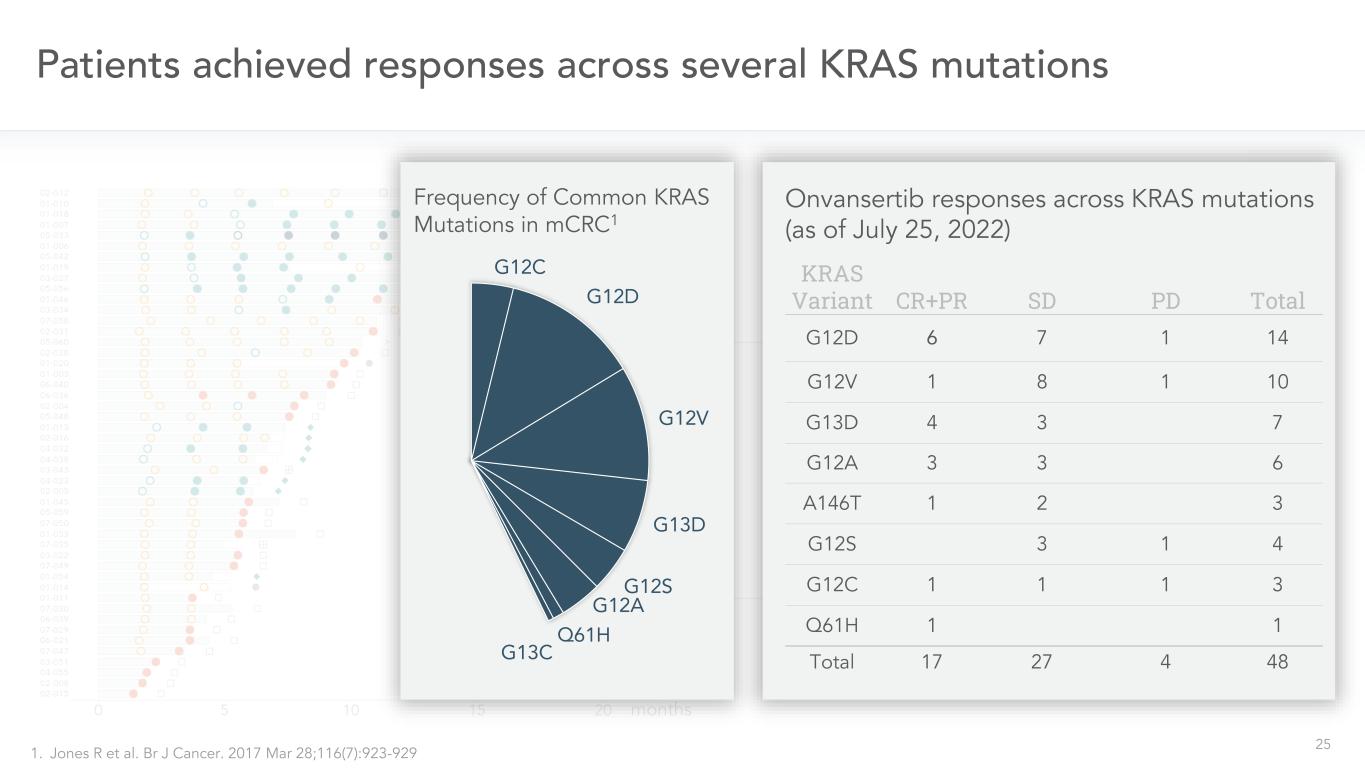
25人の患者は、いくつかの評価可能なKRAS変異患者において、応答-すべての用量48回の初期PR 8週スキャン16週スキャン24週スキャン32週スキャン8 3 5 1水泳マップ*-すべての用量(2022年7月25日現在)月KRAS変異体CR+PR SD Total G 12 D 6 7 1 14 G 12 V 1 8 1 10 G 13 D 4 3 7 G 12 A 3 3 6 A 1466 T 1 2 3 G 12 S 3 1 4 G 12 C 1 1 1 3 Q 61 H 1合計17 27 4 48 OnvansertibのKRAS変異における反応(2022年7月25日現在)mCRC 1.R Jonesらのよく見られるKRAS変異周波数KRAS変異を達成した。BR J癌。2017年3月28日;116(7):923-929 G 12 C G 12 D G 12 V G 13 D G 12 S G 12 A Q 61 H G 13 C
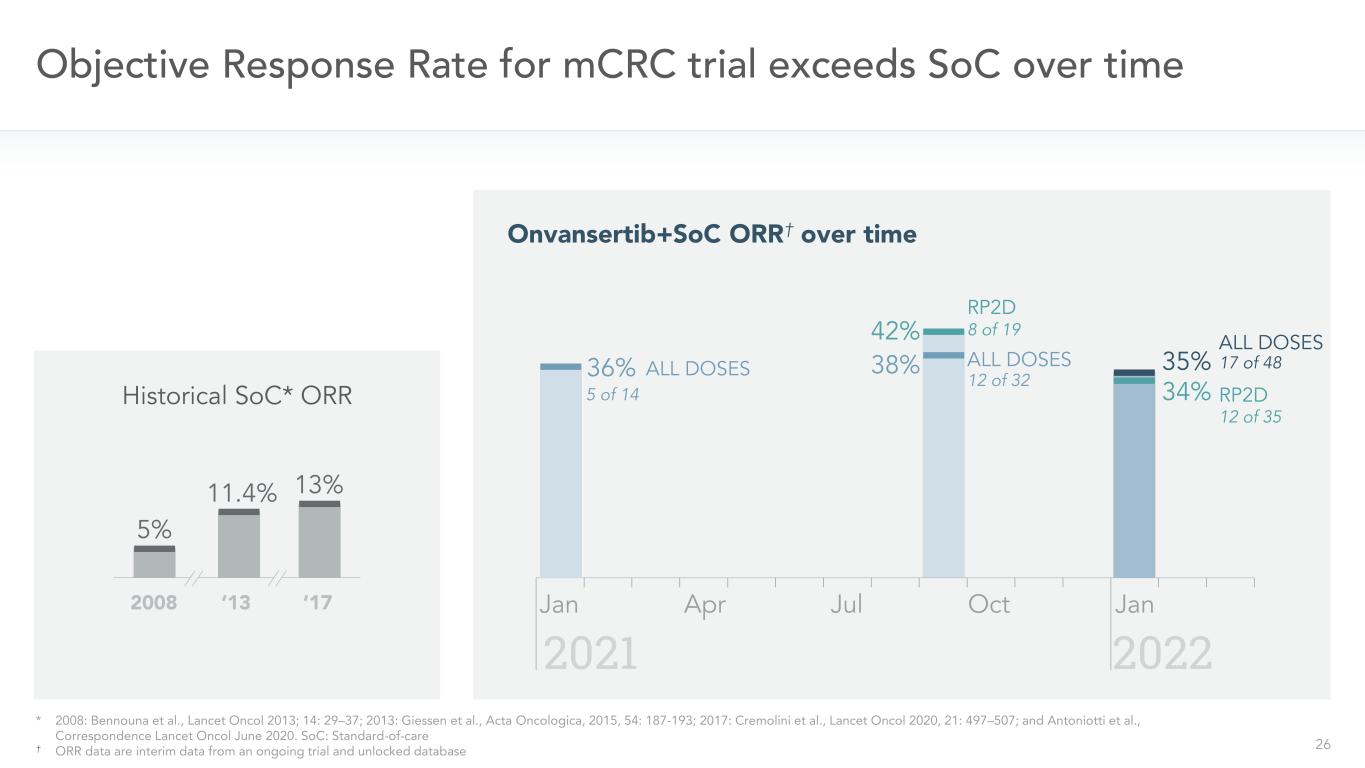
26 2008年‘13’17年mCRC試験の客観的応答率はSOC 42%RP 2 D Onvansertib+SOC ORRを超え、時間とともに38%すべての用量履歴SOC*OOR 8/19 5%11.4%13%20222021 1/35 17/4836%1/14用量*2008年:ベンヌナら、“柳葉刀”2013年;14:29-37;2013年:吉森ら、腫瘍学報、2015年、54:187-193;2017年:クリモーリニら、“柳葉刀”、2020年、21:497-507;Antoniottiら,“通信柳葉刀”,2020年6月。SOC:標準看護師ORRデータは,行われている実験とロック解除データベースからの一時データである

27時間の経過とともに,mCRC試験の無進展生存期間はSOC*2008年:Bennounaら,“柳葉刀”2013;14:29−37;2013:Giessenら,“腫瘍学報”,2015,54:187−193,2017:Cremoliniら,“柳葉刀”2020,21:497−507;Antoniottiら,“通信柳葉刀”2020年6月を上回った。SOC:標準看護≡MPFSは,行われている実験とロック解除データベースからの一時データである.無進行生存期間-すべての用量(2022年7月25日現在)9.3歴史SOC*MPFS(Mo)2008 2013 5.7 2017 4.5.6.00 0.25 0.50 0.75 1.00 Pr ob abtity of S ur vi va l 0 5 10 15 20ヶ月中間位PFS:
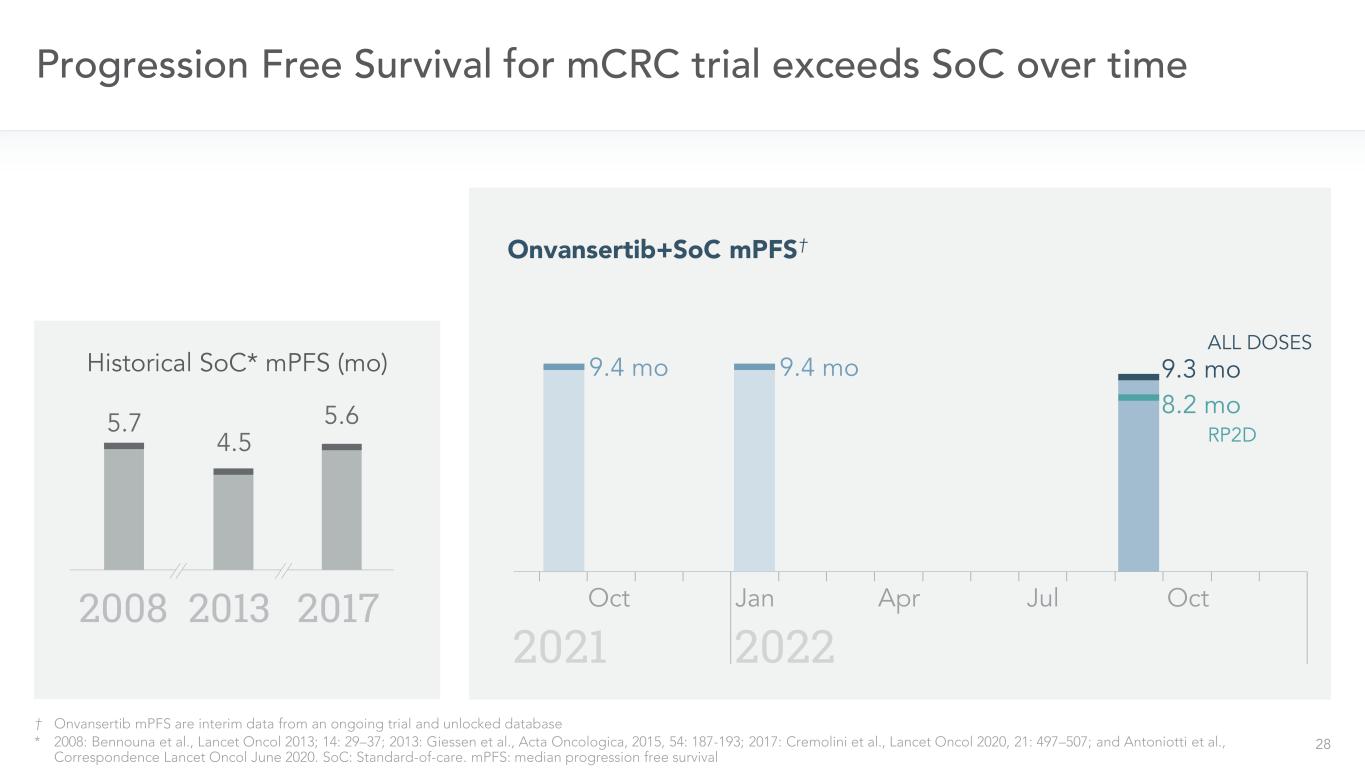
28インチOnvansertib MPFは,実験·アンロックデータベースからの一時データ*2008年:ベンヌナら,“柳葉刀”2013年,14:29−37,2013年:吉森ら,“腫瘍学報”,2015,54:187−193,2017年:クリモリニら,“柳葉刀”2020,21:497−507,Antoniottiら,“通信柳葉刀”2020年6月である。SOC:看護標準。MPFS:≡9.4 mo 20222021 10月9.4 mo 4月9.3 mo履歴SOC*MPFS(Mo)20082013年20175.55.6 RP 2 D 8.2 mo全用量

29 OnvansertibとFOLFIRI-BEVの併用耐性は良好である*2022年7月25日までの一時的なデータは、実施中の試験およびアンロックデータベースからのものである。N:患者数(総数N=50);表示されたイベントが≧中で発生した患者は10%であり、数字は、そのイベントを経験した患者数(因果関係にかかわらず)を表し、各患者は1回のみ計算され、所与のイベントに対する最高レベルのみである。−:突発的な不良事象を治療する筋肉骨格疼痛、感染と出血が集まって重大/予期しない毒副作用レベルTEAE*1 2 3 4すべて好中球減少症1 13 15 6 35疲労15 15 3 0 33吐き気24 7 2 0 33下痢15 7 2 0 24腹痛13 7 1 0 21粘膜炎11 6 2 0 19脱毛17 2 0 19血小板減少10 4 1 0 15高血圧2 8 5 0 15·すべてのTEAEにおいて、11%(84/788)G 3/G 4·7患者のみ11個のG 4·7患者に11個のG 4不良事象が発生した:TEAEs好中球減少(n=7);白血球減少(n=2);好中球減少(n=1);高リン血症(n=1)·5−FU中止+増殖因子の使用により好中球減少の重症度が改善した*1 2 3 4全貧血9 4 1 0 14嘔吐9 3 1 0 14嘔吐9 3 1 0 13筋骨格疼痛11 1 0 12感染症3 4 4 0 11出血顎8 0 1 09頭痛7 0 07神経障害5 2 0 7 GERD 7 0 7 ALT増加4 0 0 5

30試験の患者人口統計データは、二線mCRC人口*データが2022年7月25日までの一時的なデータであり、実施中の試験およびアンロックされたデータベースから、上位50人の被験者に適用されることを反映している。患者数(N)1 b期、用量レベル0 Onvansertib 12 mg/m 2段階1 b、用量レベル+1 Onvansertib 15 mg/m 2段階1 b、用量レベル+2 Onvansertib 18 mg/m 2段階2 RP 2 D Onvansertib 15 mg/m 2総患者治療6 6 32 50現在治療0 03総患者N=50中央値[日程を測る]またはn(%)年齢(年)61[35-83]性別男性28(56%)女性22(44%)ECOG 0.33(66%)1 17(34%)原発結腸癌27(54%)直腸18(36%)その他5(10%)総患者N=50中央値n(%)肝転移13(26%)肝臓と他の27(54%)肝臓10(20%)転移器官数116(32%)≧234(68%)ベバシズマブ治療5は35(70%)No 15(30%)登録者数*
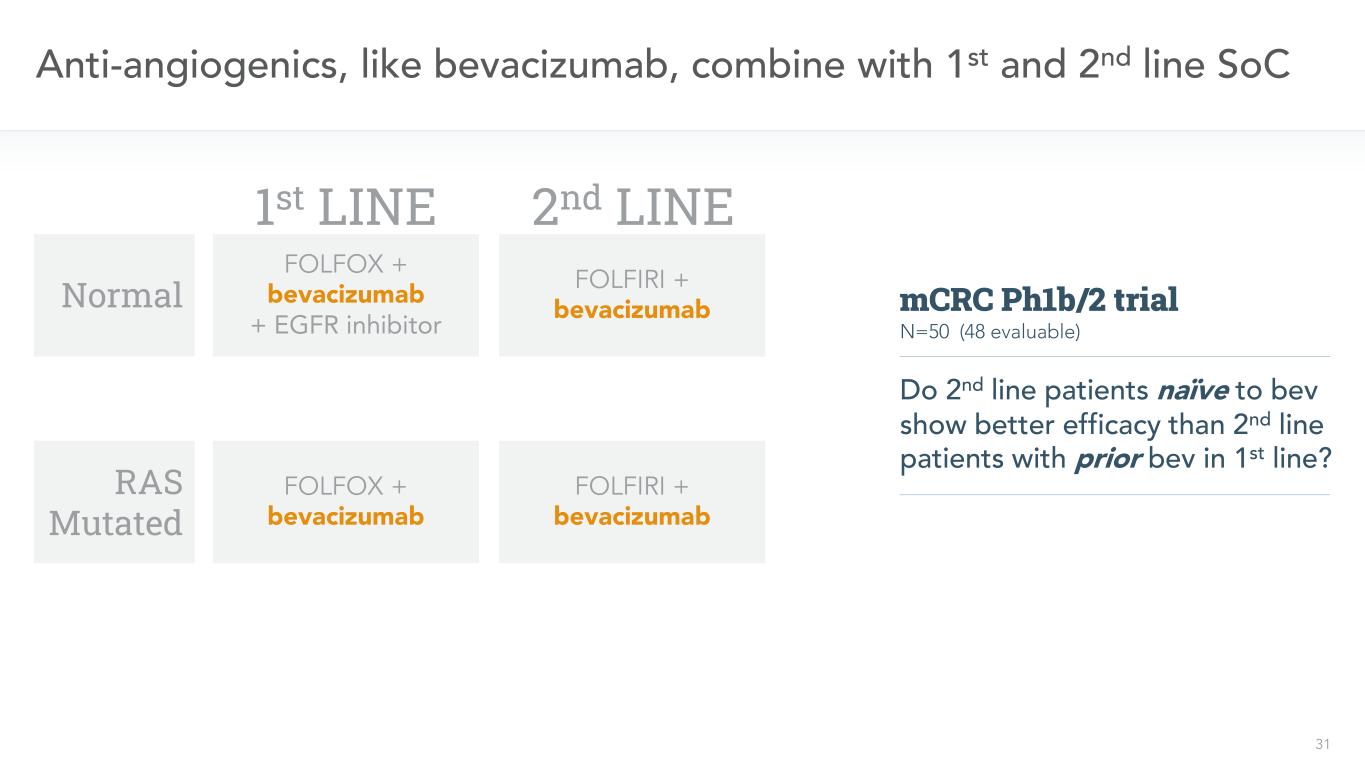
31種類の抗血管新生薬物、例えばベバシズマブ、一線と二線SoC正常RAS突然変異一線FOLFOX+ベバシズマブ+EGFR阻害剤FOLFOX+ベバシズマブ二線FOLFIRI+ベバシズマブFOLFIRI+ベバシズマブN=50(48評価可能)単純からBEVまでの二線患者は一線BBV治療を受けた二線患者よりもっと良い治療効果を示したか?MCRC PH 1 b/2試験
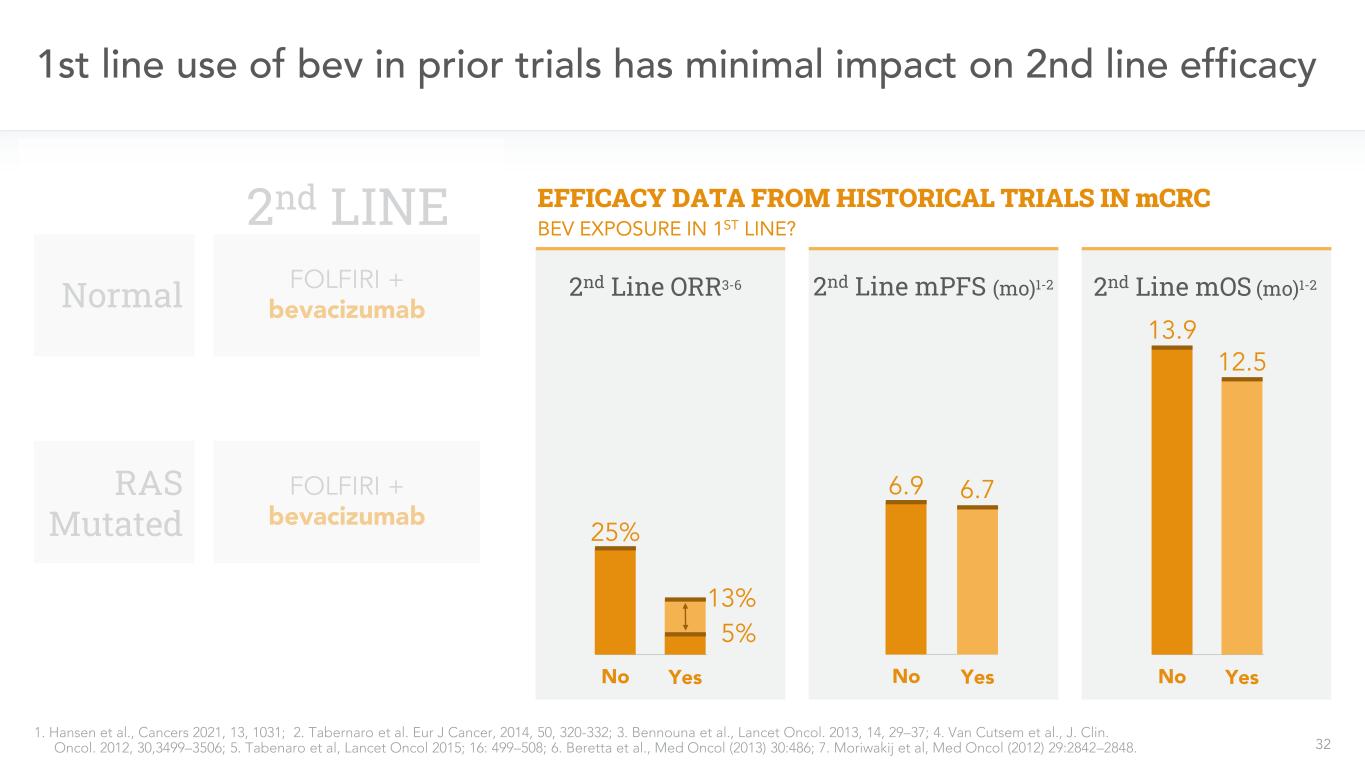
32先行試験では、2線治療に対するBevの使用の影響はわずかであり、1.Hansenら、癌2021,13,1031;2.Tabernaroら。ヨーロッパがん雑誌、2014,50,320-332;3.ベンヌナら、“柳葉刀”。2013,14,29-37;4.Van Cutsemら、J.Clin。オコール。2012,30,3499-3506;5.Tabenaroら、“柳葉刀”2015;16:499-508;6.Berettaら、Med Onol(2013)30:486;7.Moriwakijら、Med Onol(2012)29:2842-2848。MCRC第2線MOS(Mo)1-2 13.9 12.5歴史試験における正常RAS変異の治療効果データ1-2 13.9 12.5 Noは第2線MPFS(Mo)1-2 6.9 6.7 Noは第2線FOLFIRI+ベバシズマブFOLFIRI+ベバシズマブ第2線OOR 3-6 25%13%は第1線5%Bev暴露であるか
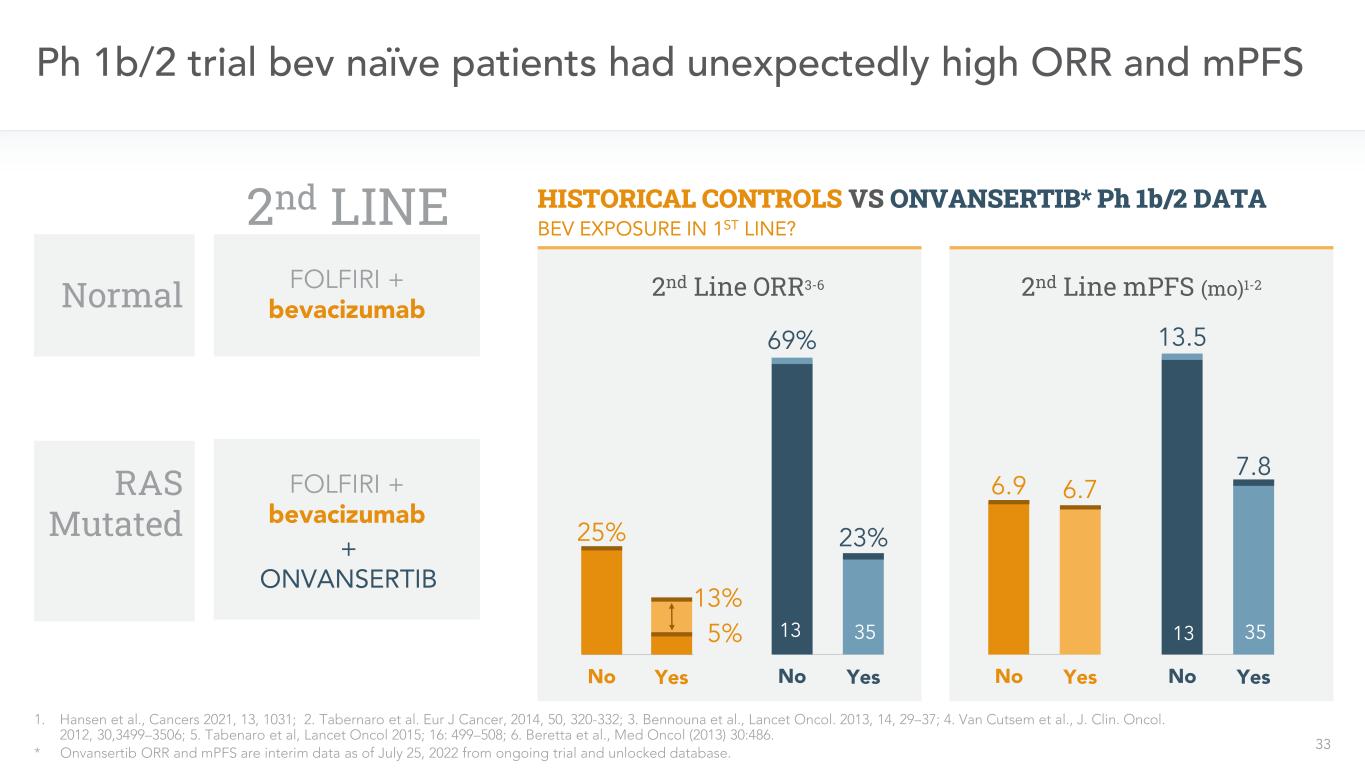
Ph 1 b/2試験のナイーブ患者33名は,意外な高OORやMPFS 1.Hansenら,癌2021,13,1031,2.Tabernaroらであった。ヨーロッパがん雑誌、2014,50,320-332;3.ベンヌナら、“柳葉刀”。2013,14,29-37;4.Van Cutsemら、J.Clin。オコール。2012,30,3499-3506;5.Tabenaroら、“柳葉刀”2015;16:499-508;6.Berettaら、Med Onol(2013)30:486。*Onvansertib OORおよびMPFSは、試験およびアンロックが行われているデータベースから、2022年7月25日までの一時的なデータです。正常履歴対照とONVANSERTIB*Ph 1 b/2データ2行目MPFS(Mo)1-2 6.9 6.7 No Yes 2行目FOLFIRI+ベバシズマブ第2行OOR 3-6 25%13%No 5%13.5 7.8 No 69%23%No 23%13 FOLFIRI+ベバズマブ+ONVANSERTIB Bev暴露1行目?RAS突然変異35 3513
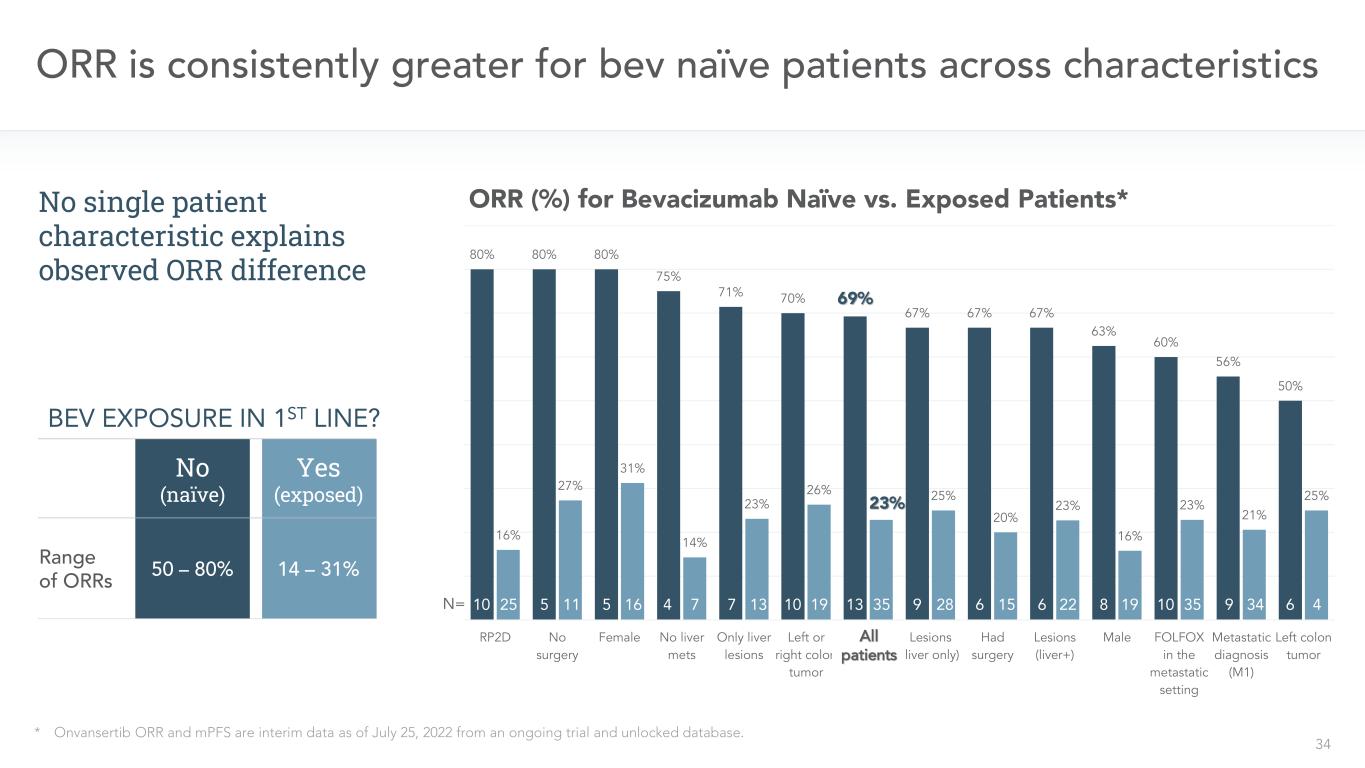
34 80%80%80%75%71%70%69%67%67%63%60%56%50%16%27%14%23%26%23%23%23%23%23%23%21%25%RP 2 D無手術女性肝臓病変なし左または右結腸癌全患者(肝臓のみ)手術病変(肝臓+)男性FOLFOX転移環境で診断(M 1)左半結腸癌N=ORR横断特徴*Onvansertib ORRおよびMPFSは2022年7月25日までの間のデータであり、試験およびアンロックを行っているデータベースから。10 25 5 11 5 16 4 7 13 10 19 13 35 9 28 6 15 6 22 8 19 10 35 9 34 64ベバシズマブと暴露患者のOOR(%)*いいえ(幼稚)は(暴露)OOR範囲14-31%50-80%単一患者の特徴解釈で観察されなかったORR差異l p-ts Bevは第一線にありますか

35潜在的onvansertib beacizumab協同作用は、新しい機会である*Onvansertib OORおよびMPFSは、実施されている試験およびアンロックデータベースからの2022年7月25日までの中間データである。10 5 11 5 16 4 7 7 13 10 19 13 35 9 28 6 15 6 22 8 19 10 35 9 34 6 4 No(幼稚)はすべての患者23%またはR 69%またはRであり、私たちはこの観察結果にどのように応答すればいいですか?操作機会A。これは統計異常(小数n)ですか?これはONV/BEVの相乗効果によるのでしょうか?仮定1.次のmCRC試験のランダム化範囲内で以前のBev暴露を階層化する2.臨床前研究で明らかなonv/Bev協同作用を探索する3.Ph 1 b/2患者のベースラインctDNAのBev幼稚とBev暴露のゲノム変化を分析して一線探索性mCRC試験onvansertib+FOLFIRI+Bev RP 2 D 80%あるいはR 16%ORBev Bevを第一線に暴露する

36初期のKRAS MAF ctDNA低下と放射線反応との関連性KRAS MAFは、実施中の試験およびアンロックデータベースからの2022年7月25日までの中間データである。K RA S M A F−96−73−63の0−50−100 CR+PR SD PD%C HAはベースライン(周期1日,投与前)と治療(周期2の1日目,投与前)で滴状デジタルポリメラーゼ連鎖反応(DdPCR)を用いてKRAS MAFを測定した。1例のPRと2例のSD患者のベースライン時にKRAS MAFは検出されなかった。反応バイオマーカー·48名の評価可能患者のうち45名がKRAS MAFの変化·87.5%(14/16)を評価したCR/PR患者が第1周期後にKRAS MAFが90%·32%(8/25)低下したSD患者と4名のPD患者(n=4)が28日間の治療周期(2022年7月25日までの平均値±SD)後にこのような低下%KRAS変異対立遺伝子頻度(MAF)*の低下はなかったと予測した。平均点-90

37 KRAS MAFの早期変化予測臨床反応Onvansertib ORRおよびMPFSは、試験およびアンロックが行われているデータベースからの2022年7月25日までの一時的データである。または(%)9%2 23人のKRAS非応答者のうち64%14 22人のKRAS応答者中14 12.6カ月MPFS(Mo)6.0個のKRAS非応答者KRAS非応答者P=0.0190.00 0.50 0.75 1.00 KRAS非応答者0 5 10 15 20カ月KRAS非応答者KRAS非応答者12.66.0

38予備試験:1 b/2段階次の試験は、mCRC計画の追加的なonvansertib計画を加速します
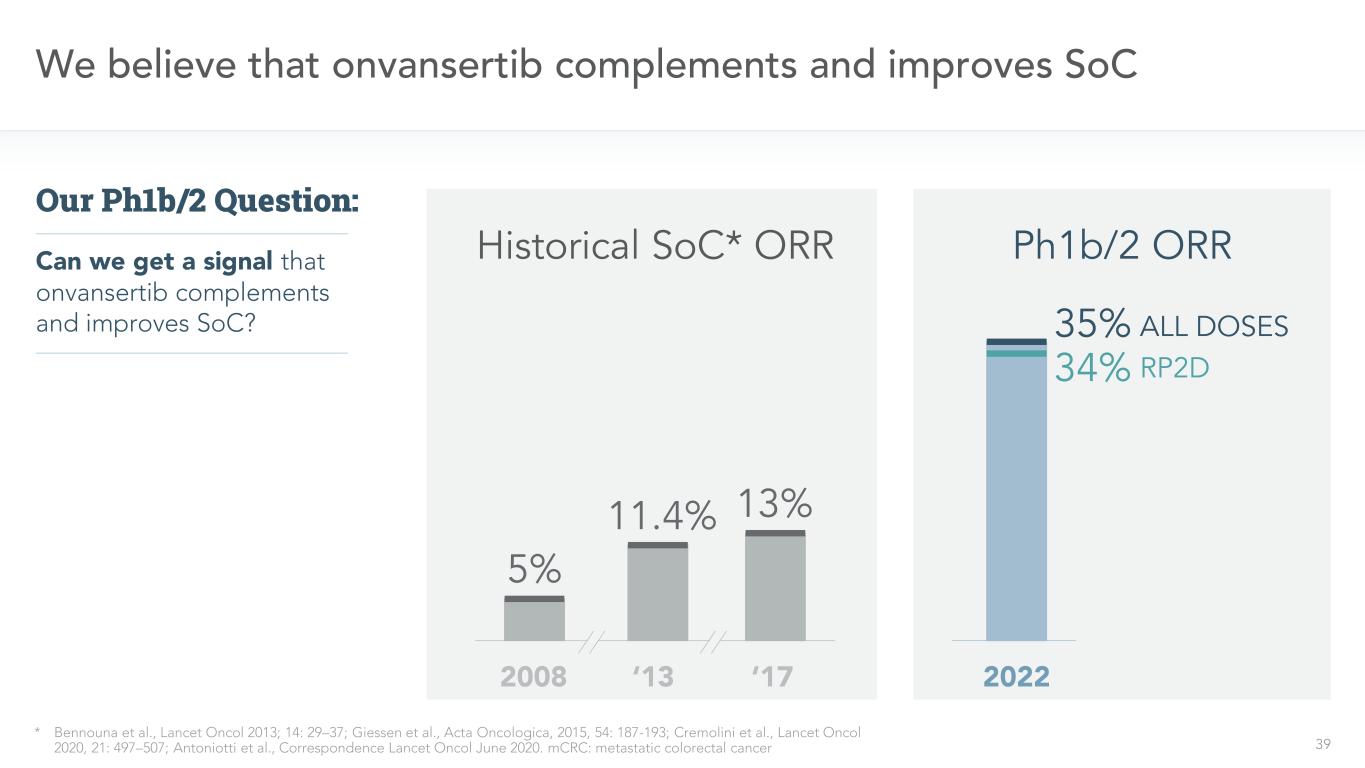
39 onvansertibはSoC*Bennounaら,“柳葉刀”2013;14:29−37;Giessenら,“腫瘍学報”,2015,54:187−193;Cremoliniら,“柳葉刀”2020,21:497−507;Antoniottiら,“通信柳葉刀”2020年6月を補完·改善したと考えられている。MCRC:転移性結腸直腸癌はonvansertib SoCの補充と改善のシグナルを得ることができますか?我々のPH 1 b/2問題:2008‘13’17歴史SoC*OOR 5%11.4%13%35%RP 2 D 34%全用量2022 PH 1 b/2 ORR

40我々は4つの明確な目標を持って次の実験を行い、SoCに対するonvansertibの貢献を示し、最適な投与位置を確認し、可能な加速承認機会で資本効率的に運営することを示す
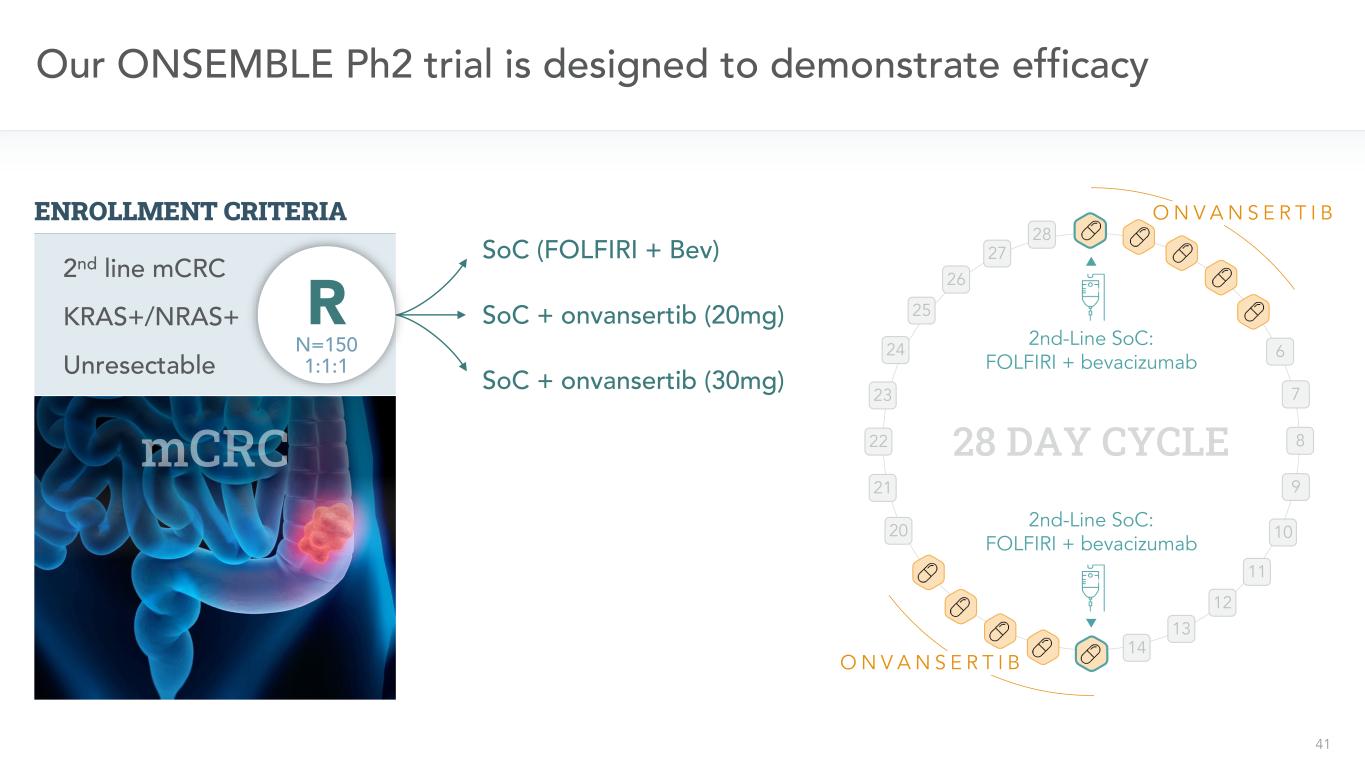
41二線SoC:FOLFIRI+ベバシズマブ二線SOC:FOLFIRI+ベバシズマブ28日間我々の唯一のPH 2試験は、SOC(FOLFIRI+BEV)SoC+onvansertib(20 Mg)SoC+onvansertib(30 Mg)6 7 8 9 9 10 11 12 13 14 20 21 22 23 24 25 26 27 28 ONVANSRIB ONVANSRTIB KRAS+/NRAS+切除不可能な第2ラインCRC mN=150 1:1:1 R登録標準を示すことを目的としている

42我々の唯一のPH 2試験は治療効果の終点を示すことを目的とした主要な肝心な副次的他の副次的目標応答率:CR+PR無進展生存率疾患制御率:CR+PR+SD反応持続時間:DOR全体生存期間:OS低下MAFとOOR、PFS、DCR、DOR、OS登録標準KRAS+/NRAS+切除不可能二線mCRC N=150 1:1:1 R

43我々の単一PH 2試験は、統計的に信頼できる登録基準KRAS+/NRAS+切除不可能な二線mCRC N=150 1:1:1 R·対照群と独占的にSoCを行う·両剤onvansertibの安全性/有効性を検査する·BEV-NAIVEとBEV曝露のランダム層·効率的かつ経済的に効率的な設計STAT·ORRにおける有意差を検出する最低電力·顕性レベルの最適使用(各治療群と対照群のアルファ0.045)·PFSのための治療武器を集約する能力である

44我々は楽観的に考えて、ランダムデータは実質的な価値2022 2023 2024 Q 1 Q 2 Q 3 Q 4 mCRCランダムデータ読み出し機会創造価値を創出する·mCRCとSoC単独使用との治療効果の向上におけるonvansertibの役割を厳密に証明する·mCRCにおいて承認機会を加速する可能性のある位置·可能な応答者(MAF)·強力な兆候は、onvansertibが他の適応試験活性化において潜在力を有することを示している

45膵臓癌(MPDAC)前立腺癌(MCRPC)三陰性乳癌(TNBC)小細胞肺癌(SCLC)我々のmCRC計画を加速させる追加のonvansertib計画

46我々のmPDAC PH 2試験はonvansertibと標準看護10 9 8 7 6二線SoC:NAL-IRI+亜葉酸カルシウム+5-FU 14日間周期11 12 13 14 ON V A NSRTI Bは第一線のゲムシタビン/アブラサニ登録基準を通過できなかった43名の患者は43名の患者を計画し、私たちはonvansertibのSoCの補充と改善の信号を得ることができますか?片腕試験
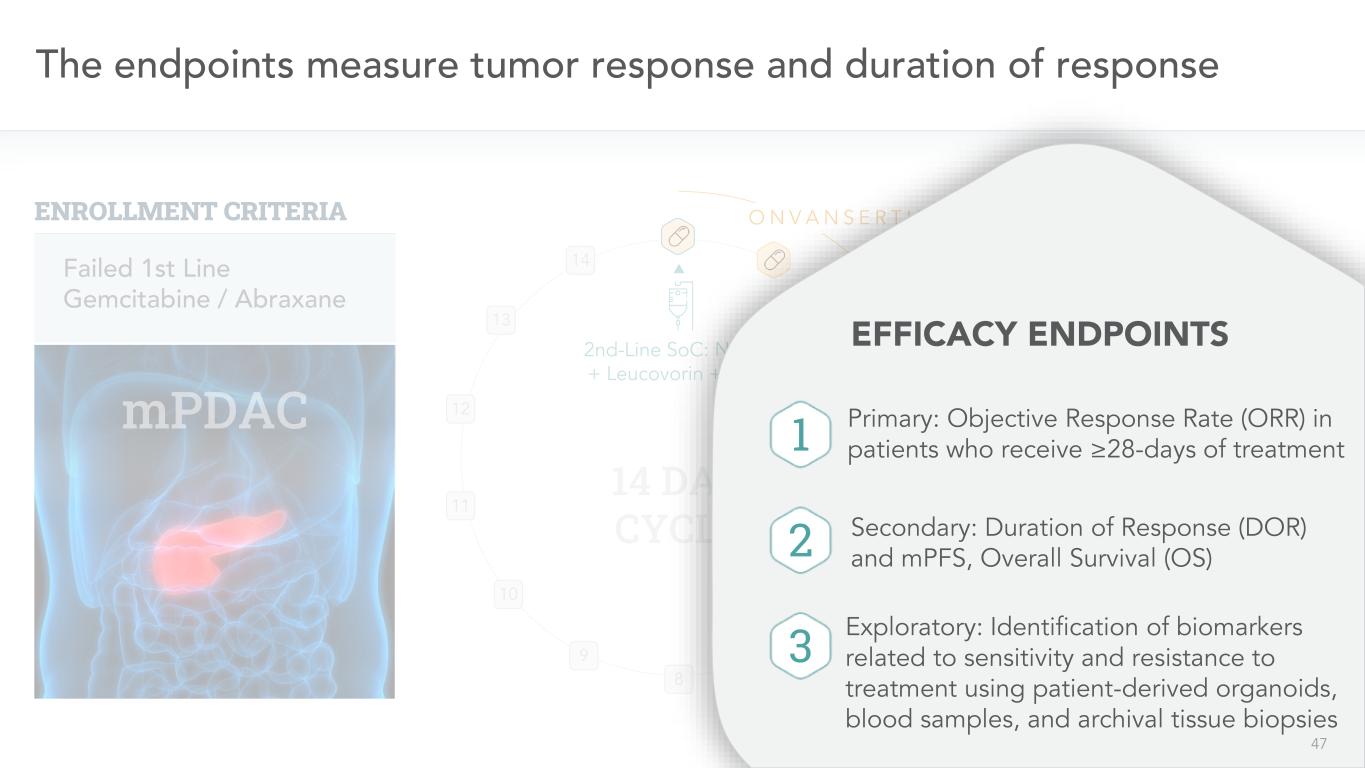
47終点腫瘍反応および反応持続時間10 9 8 7 6二線SoC:NAL-IRI+亜葉酸カルシウム+5-FU 14日周期11 12 13 14 O N V A NSER TIB失敗1線ゲムシタビン/アブラサルタン登録基準N=6/43以下は、この試験から得られた単一腕三連FICACY終点を試みた:主に≧治療28日を受けた患者の客観的応答率(OOR)副次的:応答持続時間(DOR)とMPFS、総生存期間(OS)探索性:患者由来器官、血液試料治療の感受性と薬剤耐性に関連する生物マーカーの識別アーカイブ組織生検1 2 3 47
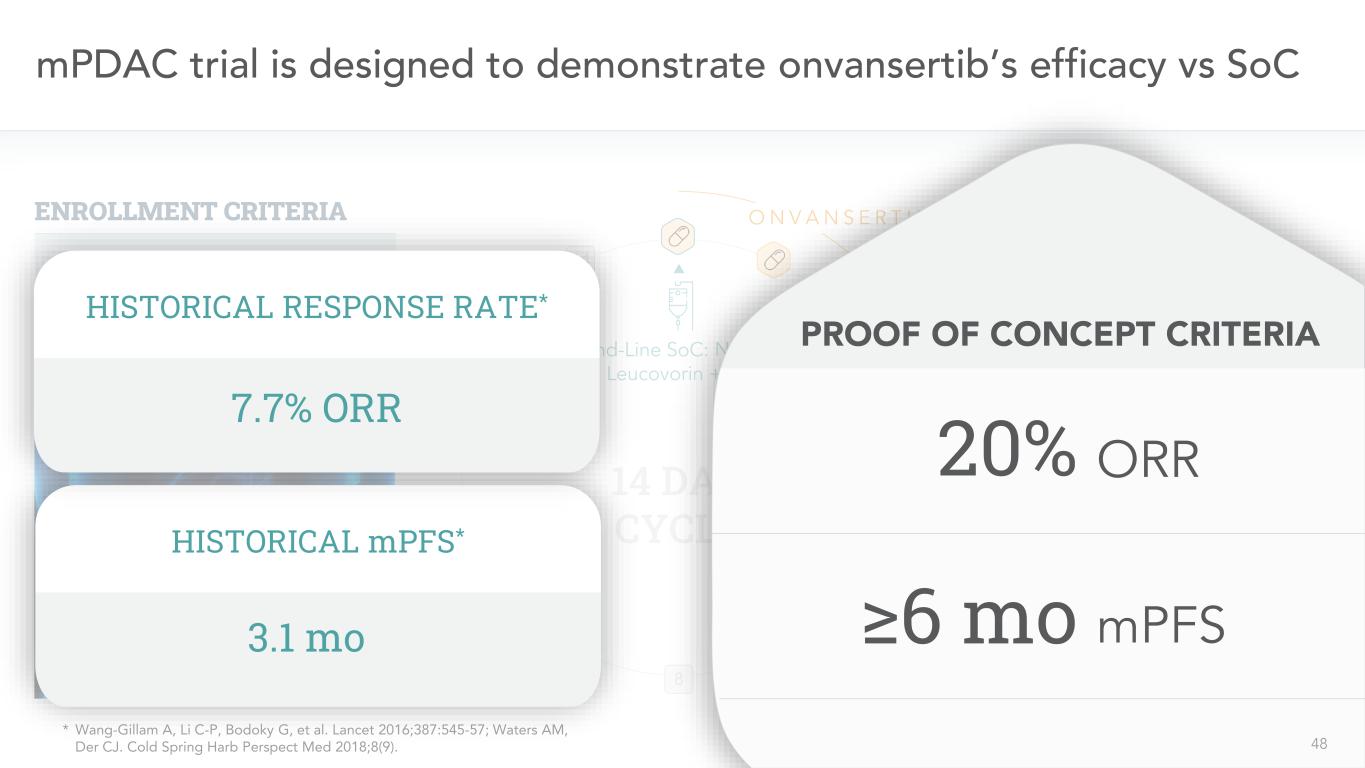
48 mPDAC試験は、onvansertibとSoC 10 8 8 7 6二線SoCの治療効果を証明することを目的とした:NAL-IRI+亜葉酸カルシウム+5-FU 14日間周期11 12 13 14 ONV A NSR TRB失敗した1線ゲムシタビン/アブラサニ登録基準N=6/43以下は、この実験から得られた単一アーム試験履歴MPFS*3.1 mo履歴応答率*7.7%ORR概念検証基準20%≧6 mo ORMPFS 4 8*Wang-Gillam A、理想自動車C-P、Bodoky Gなどである。“柳葉刀”2016;387:545-57;Waters AM,Der CJ。“冷泉ハッブル透視医学”2018;8(9)
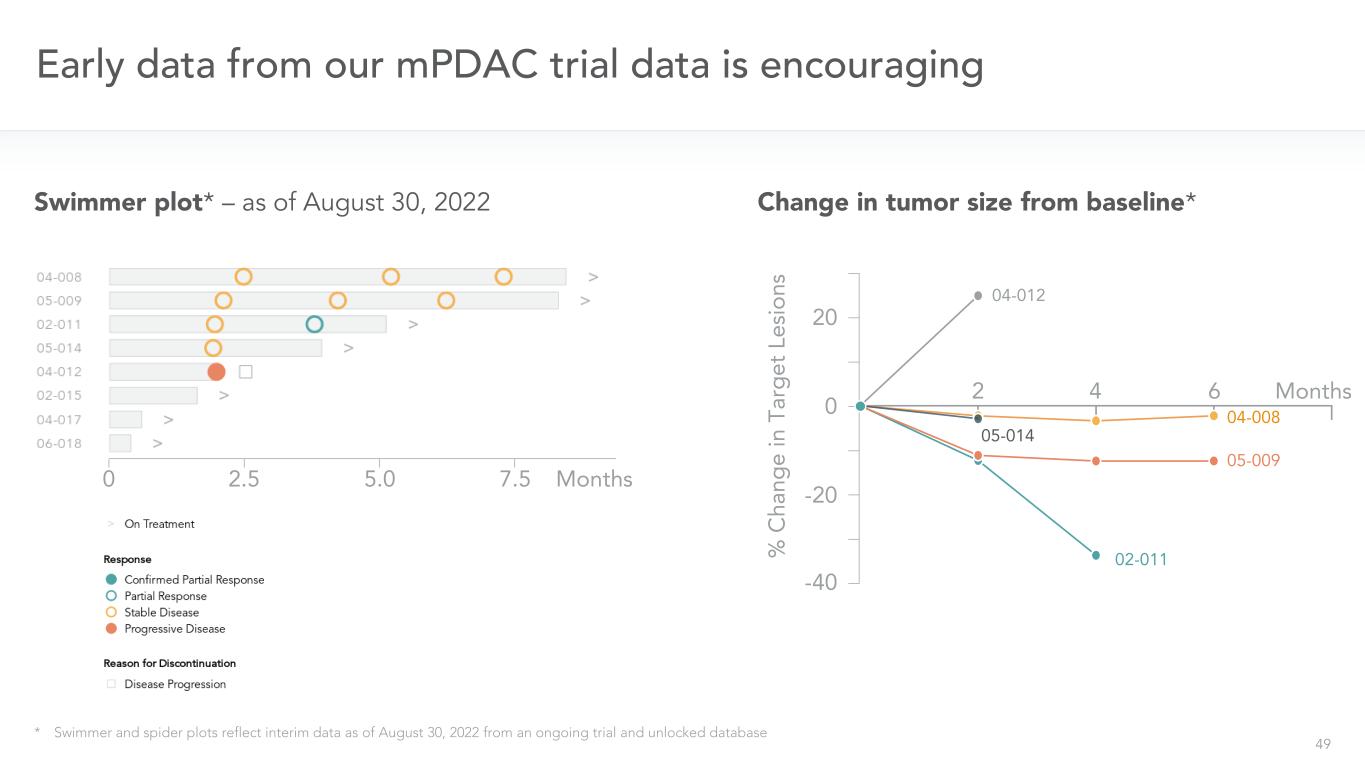
49我々のmPDAC試験データの初期データは鼓舞された*水泳者およびクモ図は、2022年8月30日までに行われている試験およびロックされていないデータベース水泳者図の中間データを反映している*-2022年8月30日まで02.5.0.5.5月の腫瘍サイズはベースラインと比較して変化*04-008 05-009 02-012 20 0-20-40 02-011 05-009 04-008 05-014 04-012

50膵臓癌(MPDAC)前立腺癌(MCRPC)三陰性乳癌(TNBC)小細胞肺癌(SCLC)我々のmCRC計画を加速させる追加のonvansertib計画

2022年4月の51 AACRデータによると、アビットロンに対する初期薬剤耐性を示すmCRPC患者では、評価された用量密度の増加とともに疾患制御率が増加した。PSAを増加させることにより、onvansertib用量密度の増加に伴い疾患制御率が増加·PSA安定を達成した患者の疾患制御率は29%から45%に増加したが、放射線学的に安定した患者では、ctDNA分析はPI 3 Kシグナル経路がonvansertib/アビットロンに対する感受性に関連していることを示した

52私たちは、将来のmCRPC開発活動を支援するつもりはありません。この試験は登録が完了し(n=72)、重要な臨床データを生成しました:·onvansertibの毒性が無視できるため·疾患制御は用量密度の増加に伴いカーディフ腫瘍学会社はmCRPC研究結果の進路でどの会社も後援する未来のステップを取ることを計画していません

53膵臓癌(MPDAC)前立腺癌(MCRPC)三陰性乳癌(TNBC)小細胞肺癌(SCLC)我々のmCRC計画を加速させる追加のonvansertib計画
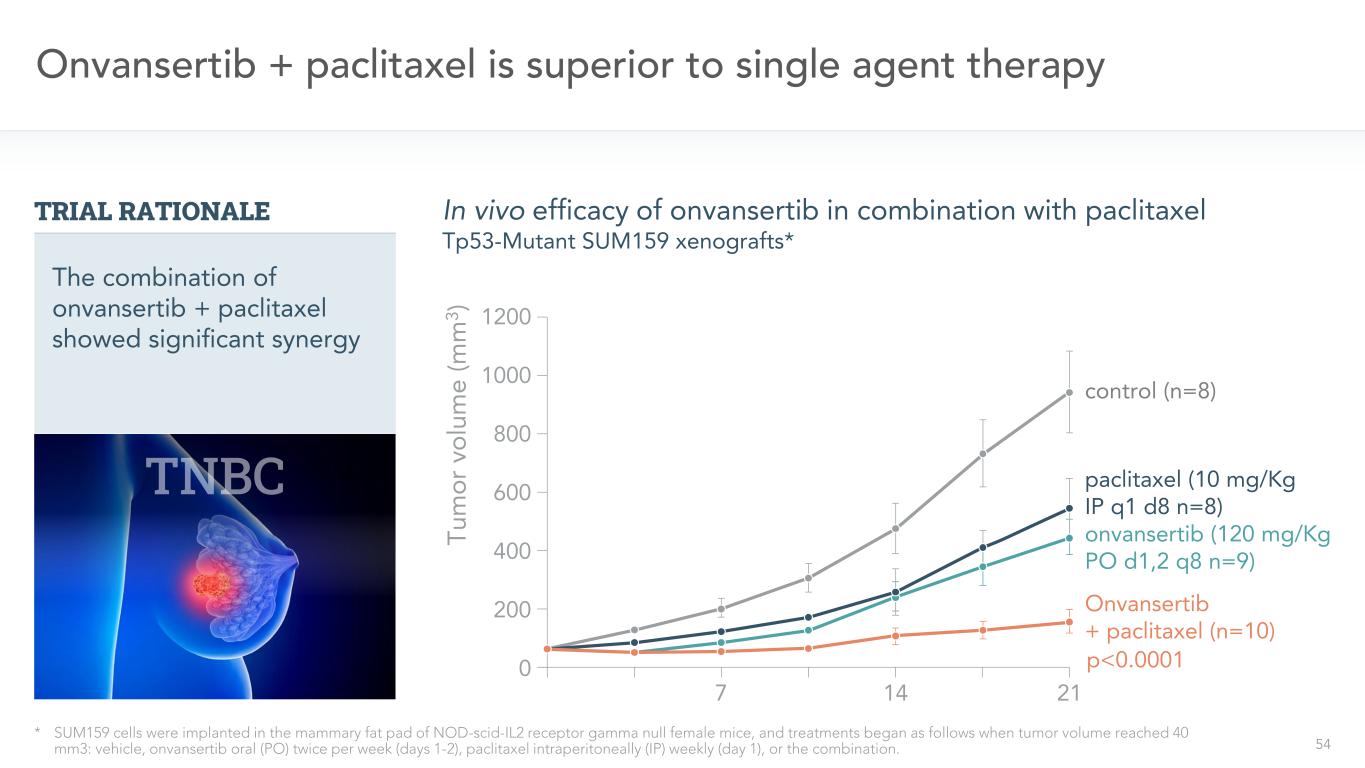
54アヴァンサーチブ+パクリタキセル治療は単剤治療より優れている*SUM 159細胞をNOD-SCID-IL 2受容体γ欠損雌マウスの乳房脂肪パッドに接種し、腫瘍体積が40 mm 3に達したとき、治療を開始した:賦形剤、アバンザチブ経口投与(PO)は週2回(1~2日目)、パクリタキセルは毎週腹腔注射(IP)週(1日目)、または両方を併用した。対照群(n=8)パクリタキセル(10 mg/kg ip q 1 d 8 n=8)onvansertib(12 0 mg/kg PO d 1,2 q 8 n=9)onvansertib+パクリタキセル(n=10)onvansertib併用パクリタキセルTP 53-変異株SUM異種移植の体内治療効果
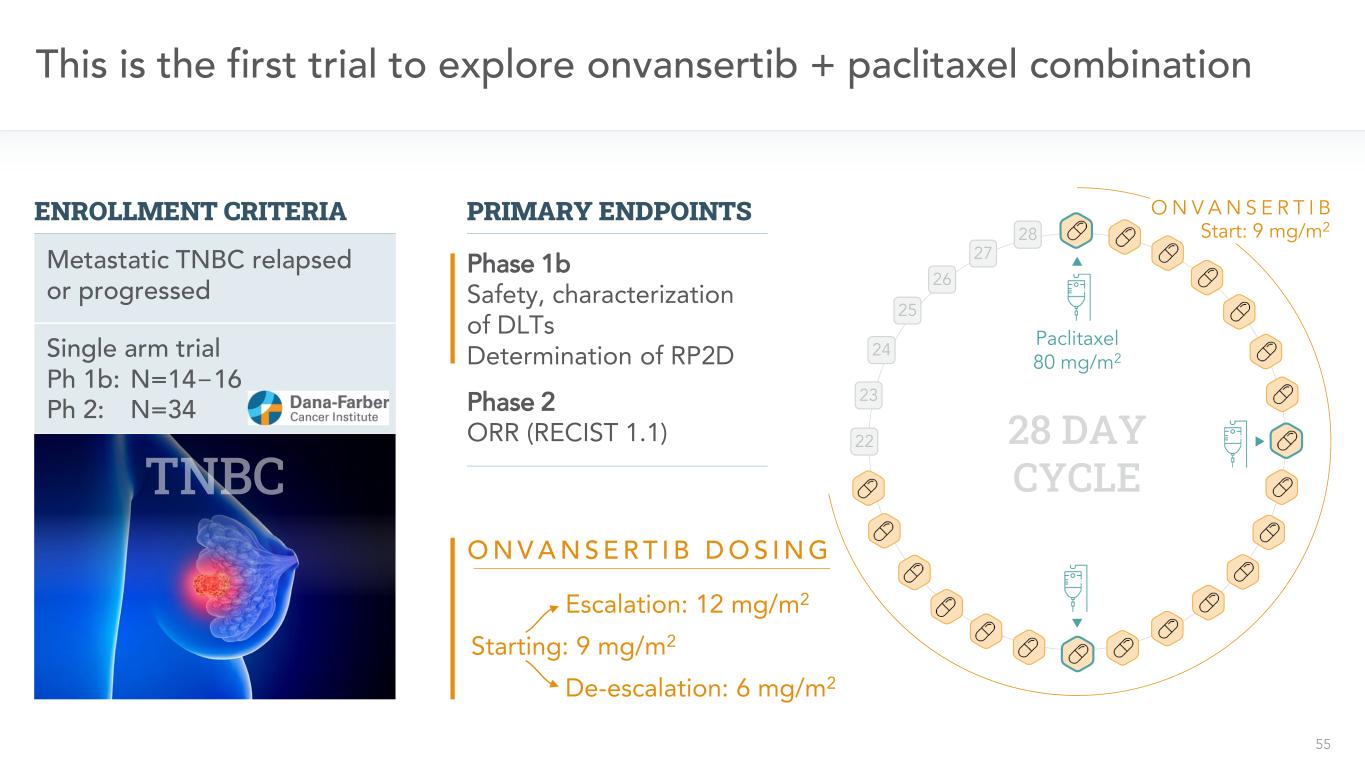
55単腕試験Ph 1 b:n=14−16 Ph 2:n=34これは、onvansertib+パクリタキセル連合転移性臨床試験の再発または進展を探索する初めての登録標準の主要終点1 b期安全性、DLTS測定RP 2 Dパクリタキセル80 mg/m 2 28日間期間22 23 24 25 26 27 28 ONVANSRIBONVNANRTRIBD ORING開始:9 mg/m 2アップグレード:12 mg/m 2降格:6 mg/m 2起動:9 mg/m 2または2期ORR(RECIST 1.1)

56これは初めて万色テブ+パクリタキセル連合入選標準パクリタキセル80 mg/m 2 28日周期22 23 24 25 26 27 28 ON V A NSRTB RP 2 D主要終点1 b期安全性、DLTSの特徴RP 2 D 2期またはR(RECIST 1.1)二次終点2期無進展生存(PFS)単一アーム試験Ph 1 b:N=14−16 Ph 2:N=34転移性TNBC再発または進展

57膵臓癌(MPDAC)前立腺癌(MCRPC)三陰性乳癌(TNBC)小細胞肺癌(SCLC)我々のmCRC計画を加速させる追加のonvansertib計画
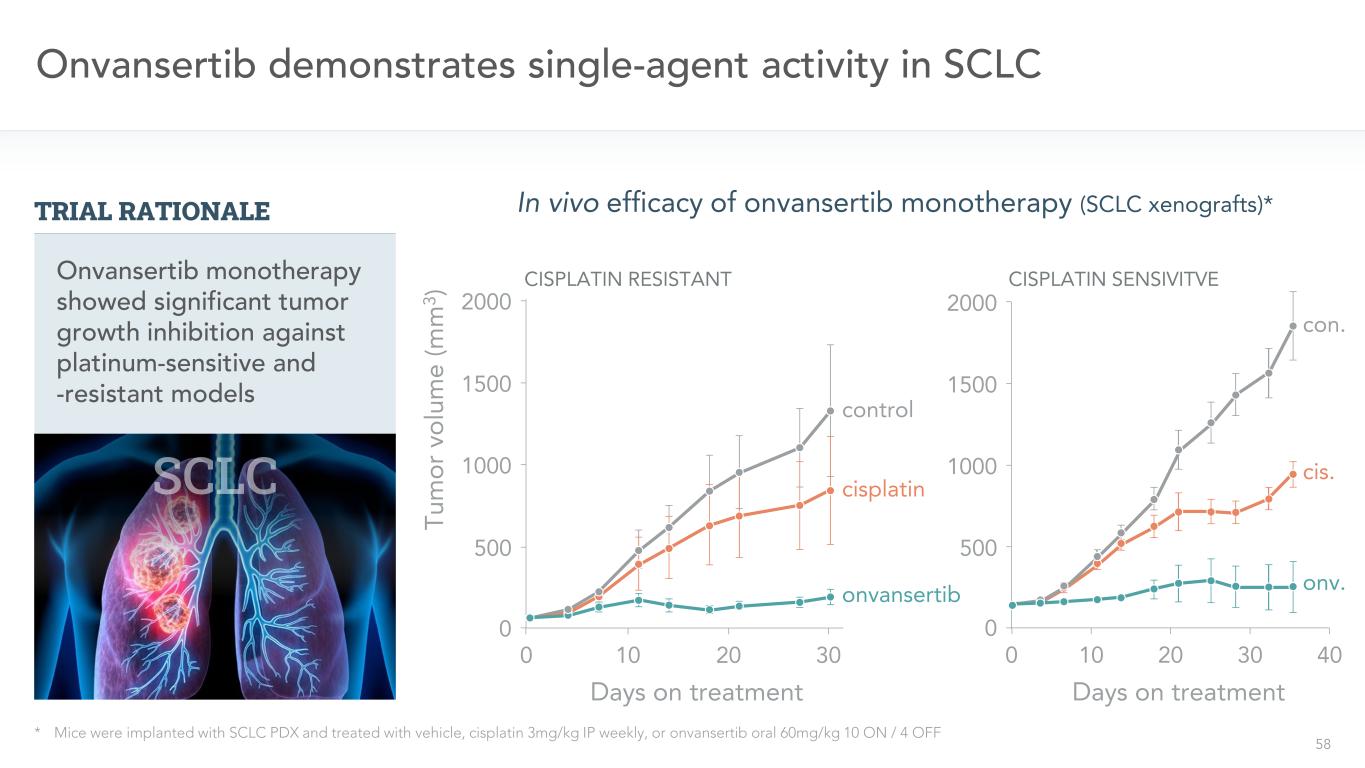
58 Onvansertibは、SCLC*マウスにおいて単剤活性を示した。マウスはSCLC PDXを移植した後、毎週ipシスプラチン3 mg/kg、またはOnvansertib 60 mg/kg 10 on/4 onvansertib対照2000 1500 1000 500 0 TuまたはVol e(M 3)10 20 300 2000 1500 1000 500 0 10 1930 40 Onvansertib単一治療の経口投与は白金感受性および薬剤耐性モデルに対して有意な腫瘍増殖阻害作用を示した。順位をつける。コーエン。Onvansertib単一治療(SCLC異種移植)の体内治療効果
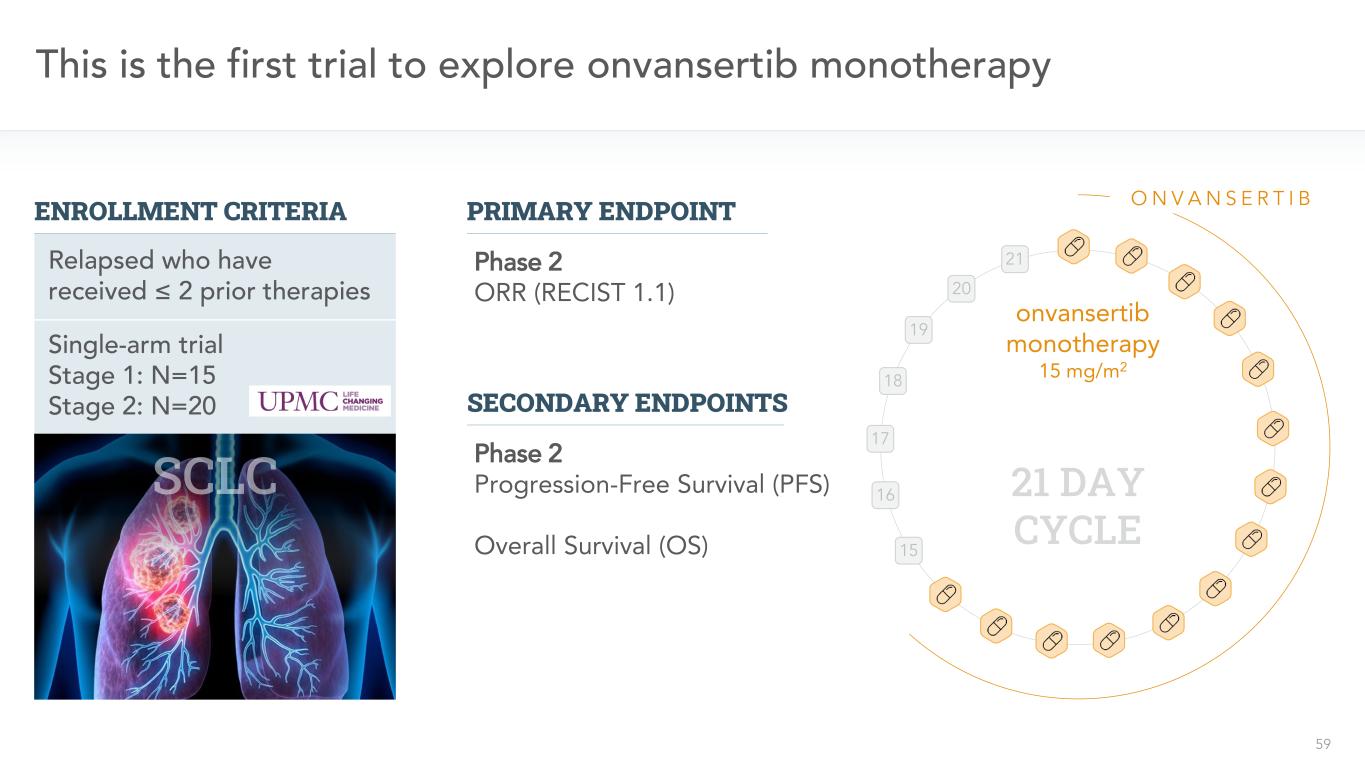
59単一腕試験段階1:N=15段階2:N=20これは、≦2以前の治療を受けた再発者がVansertib単一治療を受けた最初の探索である第1の試験15 16 17 18 19 20 21 ONV ANSRTB 21日周期onvansertib単一治療15 mg/m 2 2期またはR(RECIST 1.1)主要二次終点2期無進展生存(PFS)総生存率(OS)

60我々が準備中のonvansertib臨床前PH 1/2 PH 2/3 mPDAC TNBC SCLC卵巣mCRC Onivyde/5-FUパクリタキセルNone(単一療法)PARP阻害剤FOLFIRI/BEV Investigatorによる試験組み合わせ:登録状態登録評価活性化mCRC FOLFIRI/BEV登録ランダム単一アーム試験
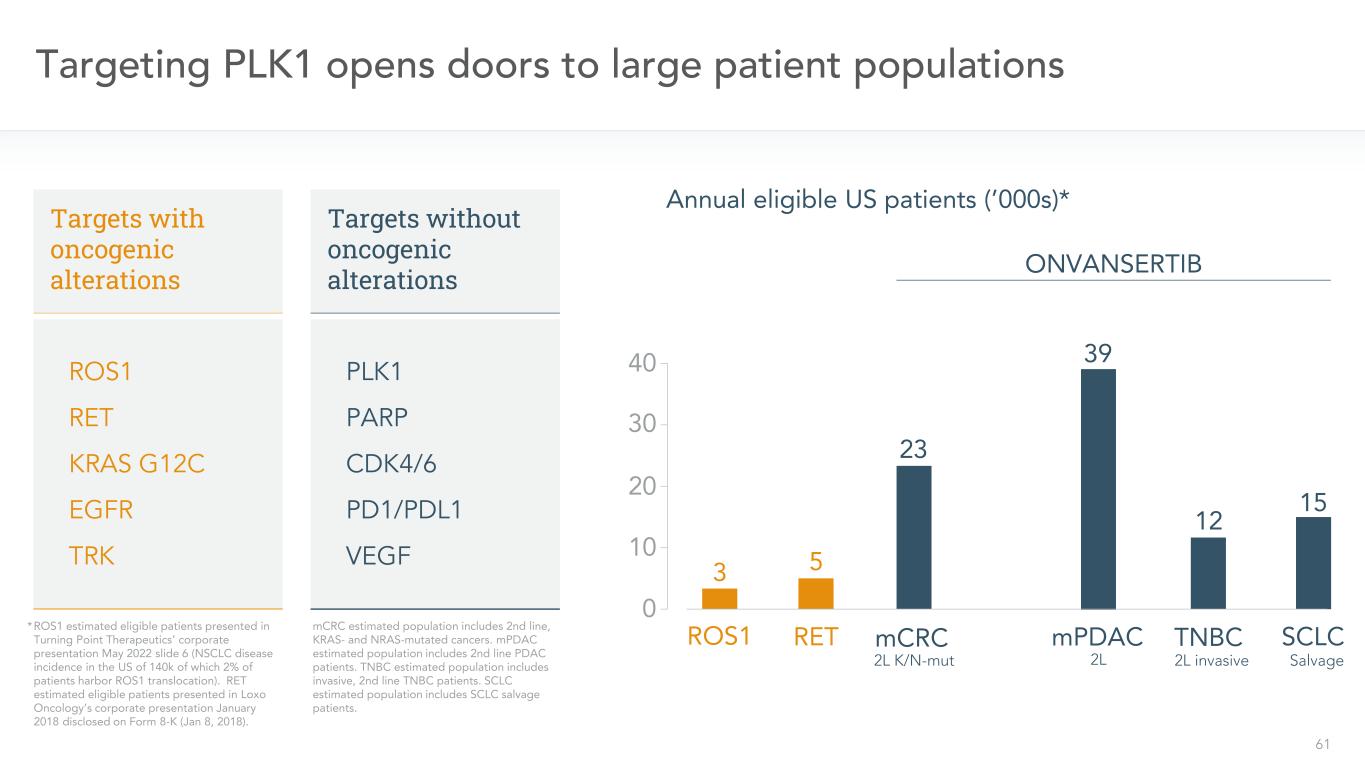
61 PLK 1が大量の患者集団のためにゲートを開いた53 RETROS 1年度条件に適合した米国患者(2000年代)*ONVANSERTIB 15 SCLCTNBC 12 mPDAC 39 23 mCRC標的ROS 1 RET KRAS G 12 C EGFR TRK標的無癌遺伝子改変PLK 1 PARP CDK 4/6 PD 1 VEGF*ROS 1 Turning Point Treateuticsの会社プレゼンテーションで公表された推定合格患者2022年5月スライド6(米国のNSCLC疾患発症率は140 kであり、その中の2%の患者はROS 1転座が存在する)。RET推定該当患者は,Loxo Oncology 2018年1月にForm 8−K(2018年1月8日)で開示された会社プレゼンテーションに登場した。MCRCが推定した人口は二線、KRASとNRAS突然変異の癌を含む。MPDAC推定群は二線PDAC患者を含む。TNBC推定群は侵襲性、二線TNBC患者を含む。小細胞肺癌推定群は小細胞肺癌引き上げ患者を含む。2 L K/N-MUT 2 L 2 L侵襲的救急30 20 10 040
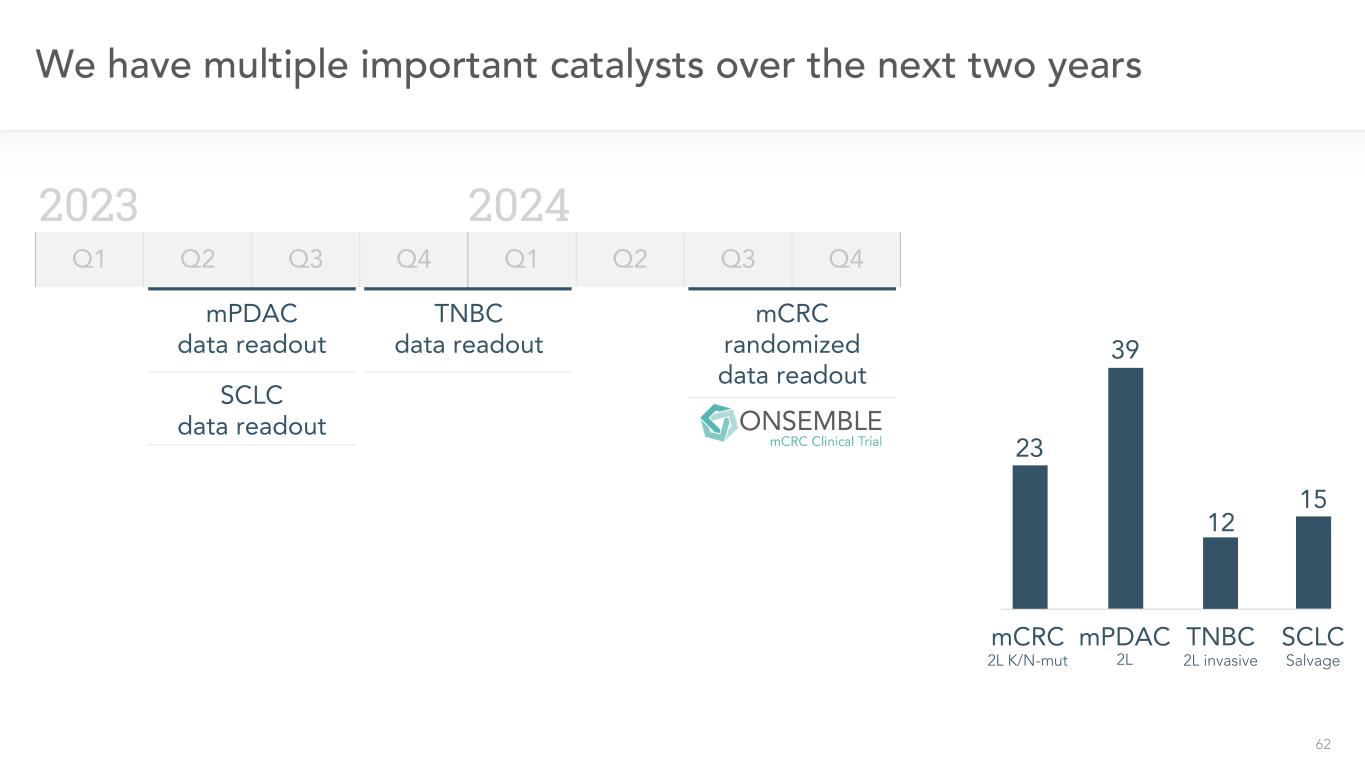
62私たちは今後2年間に複数の重要な触媒を持っています2023年2024年Q 1 Q 2 Q 3 Q 4 Q 2 Q 3 Q 4 mPDACデータ読み出しSCLCデータ読み出しTNBCデータ読み出し15 SCLCTNBC 12 mPDAC 39 23 mCRC mCRCランダムデータ読み出し2 L K/N-MUT 2 L創造的救急

63 2025第1四半期第2四半期2022年6月30日現在、財務状況は堅調*以上の財務情報は、8/4/22年8月4日に提出された10 Q表の未監査財務情報から来ています。2022年6月30日現金および投資*経営活動で使用される現金正味額*(2022年6月30日までの2四半期スクロール)1690万ドル2023年第1四半期第2四半期第3四半期第4四半期第1四半期第3四半期第4四半期第4四半期第2四半期ランダムデータ読み取りmPDACデータ読み取り値SCLCデータ読み取り値TNBCデータ読み取り

64我々の臨床開発計画は、我々の主な目標1無作為試験による以前のmCRCデータ2を検証し、他の適応における臨床POCの応用目標2025 Q 1 Q 2 2023 2024 Q 1 Q 2 Q 3 Q 4 Q 1 Q 2 Q 3 Q 4を証明する

65我々の臨床開発計画は、我々の主要な目標段階1 b/2単一アーム段階2ランダム強ORR+DOR+PFS MAFバイオマーカー機会有効な設計確認用量を支持した;階層BEV 1ランダム試験による以前のmCRCデータ2を検証臨床POCが他の適応目標信号発見2025 Q 1 Q 2 2023 2024 Q 1 Q 2 Q 3 Q 4 Q 1 Q 2 Q 3 Q 4我々の戦略を示す
66付録

67時間経過したonvansertib mCRC PH 1 b/2試験データダイジェスト*データは、いくつかの後続データを含み、実施中の試験およびアンロックデータベースの一時データを反映する。ASCO GI 2021年1月KOL活動2021年9月投資家ネットワーク中継2022年1月投資家ネットワーク放送2022年9月データ締め切り2020年11月2日*2021年12月3日*7月25日2022*全用量RP 2 D評価可能患者(CR+PR)36%(5)38%(12)42%(8)35%(17)34%(12)35%(17)34%(12)確定診断CR/PR 29%(4)31%(10)37%(7)27%(13)29%(10)29%(14)31%(11)有効時間11.7疾病コントロール率(CR+PR+SD)86%(12)94%(30)100%(19)92%(44)94%(33)92%(44)94%(33)