添付ファイル99.1
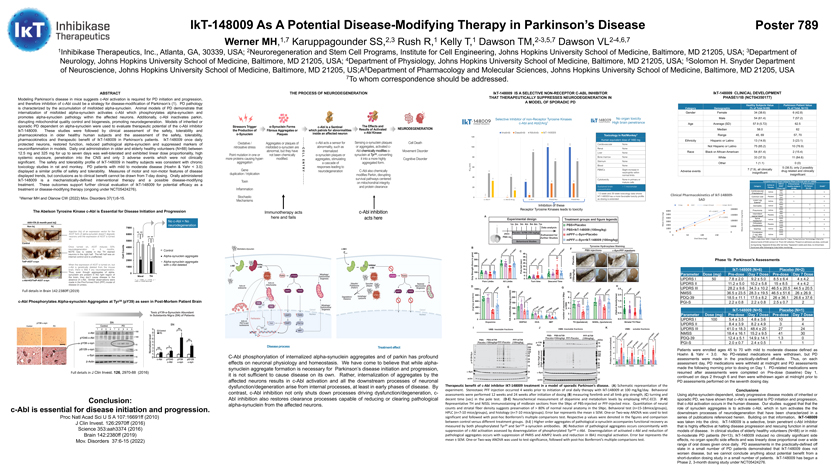
789 Werner MH,1,7 Karuppagounder SS,2,3 Rush R,1 Kelly T,1 Dawson TM,2-3,5,7 Dawson VL 2-4,6,71 1阻害酵素治療会社,アトランタ,GA,30339,米国;2神経再生と幹細胞計画,ジョンホプキンス大学医学院細胞工学研究所,ボルチモア,MD 21205;3米国ジョンホプキンス大学医学院神経疾患系,ボルチモア,メリーランド州21205;4ジョンホプキンス大学医学院生理科、アメリカメリーランド州ボルチモア21205;5ソロモン·H·スナイダー神経科学科、ジョンホプキンス大学医学院、アメリカボルチモア、メリーランド州21205;A 6ジョンホプキンス大学医学院薬理学と分子科学科、ボルチモア、MD 21205、アメリカ7通信受信者。パーキンソン病マウスモデルを要約すると,c−Ablの活性化はパーキンソン病の発生と発展に必要であることが示唆されたため,c−Ablの抑制はパーキンソン病の疾患修飾戦略(1)となる可能性がある。パーキンソン病の病理特徴は誤って折り畳まれたα−シヌクレイン蓄積である。パーキンソン病の動物モデルは,誤って折り畳まれたα−シヌクレイン内化がc−Abl,c−Ablがα−シヌクレインをリン酸化し,影響を受けるニューロン内のα−シヌクレイン病理を促進することを示している。また,c−AblはParkinを不活化し,ミトコンドリアの品質制御や生物発生を撹乱し,神経変性を促進する。α-シヌクレインに依存する遺伝性或いは散発性パーキンソン病モデルを用いて、c-Abl阻害剤IKT-148009の治療潜在力を評価した。これらの研究の後、老年健康被験者の安全性、耐性と薬物動態を臨床評価し、安全性、耐性を評価した, パーキンソン病患者におけるIKT-148009の薬物動態学と治療効果。IKT-148009は毎日1回、モデル中で神経細胞を保護し、機能を回復し、病理性α-シヌクレインを減少させ、そして神経炎症マーカーを抑制する。老年と老年健康ボランティア(N=88)は毎日12.5 mgから325 mgの間の薬物を経口投与し、最大7日間の耐性は良好であり、線形用量の割合を示し、高い全身暴露を示し、中枢系に浸透し、3つの有害事象だけは臨床意義がない。健康被験者におけるIKT-148009の安全性と耐性はラットとサルの慢性毒理学研究と一致した。軽、中度PD患者(Hoehn&Yahr 1マイクロモル、14濃度、113週と39週の毒理学データを示した。6 0 1 Ikt-148009は、用量の延長に伴い、これらの受容体チロシンキナーゼによる毒性6000(Ng)5000 Cmax 4000 3000平均値2000 1000 0 c-Abl阻害剤Ikt-148009の治療効果を阻害するより有利な毒性曲線0 c-abl 1 c-abl/arg c-Kit PDGFRA PDGFRbを有する。(A)実験概略図。イカト−148009 1日100 mg/kg経口治療開始4週間前から立体配向パーフルオロ鉄注射を開始した。投与後12週と24週に行動学的評価(B)前肢brとすべての肢体握力,(C)回転と低下時間(米国証券取引委員会)を測定した。(D-E)ドーパミンおよび代謝レベルの神経化学を、高速液体クロマトグラフィー-電子捕捉検出器を用いて測定した。(F-H)PBSまたはPFFマウスにおける脳SNPC切片の代表的なTHおよびNissl免疫染色を注射した。神経計数と線条体繊維密度の定量はSNPCが>80%の正常神経解剖を保持していることを表明した。行動学テスト(n=15-18匹/グループ), 高速液体クロマトグラフィー(n=7−10匹のマウス/群)と組織学的(n=7−10匹のマウス/群)。誤差ストリップは平均値±走査電子顕微鏡を表す。単因子分散分析または二元分散分析を用いて顕性検定を行い,Bonferroni後の多重比較検定を用いた。図にそれぞれp値および対照群と異なる処理群との比較を示す。(i-J))病的a-シヌクレインの高次凝集は、リン酸化Tyr 39およびSer 129 a-シヌクレイン抗体の測定により機能回復を伴う。(K)病的凝集の減少は、c-Abl活性の阻害に伴い、リン酸化Tyr 245 c-Ablを下方制御することによって評価される。PARISとAIMP 2レベルの抑制及びIBA 1ミクログリア細胞活性化の減少に伴い、活性化c-Abl低下と病理性凝集物は減少した。誤差ストリップは平均値±走査電子顕微鏡を表す。単因子分散分析または二元分散分析を用いて有意検定を行い,その後Bonferroni‘s多重比較検定を行った。Ikt-148009臨床発展段階1/1 B(NCT 04350177)健康被験者がパーキンソン患者の価値を評価する分類:人口学(総数に占める割合N=88)(総数に占める割合、N=13)性別女性34(38.6)6(42.8)男性54(61.4)7(57.2)平均年齢(SD)57.9(5.72)62.5中央値58.0 62 範囲45,69 57,70人種スペイン系またはラテン系13(14.8)3(23.1)非スペイン系またはラテン系75(85.2)10(76.9)黒人またはアフリカ系アメリカ人54(61.4)2(15.4)白人33(37.5)11(84.6)その他1(1.1)0(0)7(7.9),臨床すべて5(38.5), IKT-148009活性薬物或いはSADを使用した1/1 b期試験において、2 のみが薬物に関連し、臨床的意義が大きくない完全な有害事象リスト或いは発生回数別MAD(1)健康被験者PD患者レベル(2) プラセボ(用量mg)(N=88)(N=14)心血管SAD活性1(動悸)(6)(75)MAD普通風邪プラセボ1(25)下腿MAD 1水腫症(5)(25)MAD 1皮膚炎1(50)MAD 1肺炎1(50)間欠性1(50)間欠性1(50)悲しみプラセボ1 1膣出血(4)(175)脊髄MAD 1活動0頭痛(3)(50)起立性MAD 1プラセボ1低血圧(100)SAD下痢活動(325)2 1便秘MAD 1(活動後1日(100)1日7用量)(1)SAD=単剤。MAD=1日単剤、7日間連続服用。(2)有害事象汎用用語基準(CTCAE)5.0版の使用,(3)脳脊髄液収集から,(4)入院時に服薬前に出現し,服薬中に継続した,(5)最終服薬後28日に出現した,(6)服薬後2週間で出現した, 3日間の動態心電図モニタリングを経ても臨床的根拠は認められなかった。パーキンソン病1 b期評価IKT-148009(N=6)プラセボ(N=2)パラメータ用量(Mg)用量前7日目用量前7日目用量UPDRS I 50 7.8±2.0 9.2±5.0 8.5±4.4±4.4 UPDRS II 11.2±5.0 10.2±5.8 15±8.5 4±4.2 UPDRS III 28.2±9.6 34.3±10.2 42.5±20.5 5 44.5±20.5 NMSS36.5±23.5 28.3±19.5 46.5±51.6 26(Br)±26.9 PDQ-39 18.5±11.1 17.5±8.2 26±36.1 26.6±37.6 PGI-S 2.2±0.8±0.8±0.7 2 IKT-148009(N=5)プラセボ(N=1)用量前用量(Mg)投与前7日前7剤UPDR I 100 5.4±5.4±3.5 4.8±3.6 109 UPDRS II 8.4±3.9 8.2±4.9 3 4 UPDRS III 41.0±18.3 48.4±20 27 24 NMS 18.4±16.1 15.2±9.5 41 30 PDQ-39 12.4±5.1.9±14.1.1.3 0 PGI-S 2.0±0.7 2.4±0.5 11例45歳から70歳までの年齢の患者11例をHoehn&Yahr と定義した